Zelfmanagement, educatie en informatie
Uitgangsvraag
Welke adviezen en informatie (patiënteneducatie en -informatie) moeten aan patiënten met artrose aan heup of knie worden verstrekt (onder andere met betrekking tot leefstijl, werk- en sportbelasting)?
Deelvragen
- Wat is de effectiviteit van zelfmanagementprogramma’s bij het verminderen van artroseklachten?
- Wat is de effectiviteit van bewust gewichtsverlies bij patiënten met overgewicht/obesitas bij het verminderen van artroseklachten?
- Waaruit moet informatie en educatie over knie- en heupartrose bestaan?
Aanbeveling
Geef informatie en educatie over artrose bij patiënten met symptomatische knie- en/of heupartrose, en besteed hierbij aandacht aan tenminste de volgende onderwerpen:
- aard van artrose;
- oorzaken van artrose;
- consequenties van artrose (met betrekking tot leefstijl, werk- en sportbelasting, balans tussen belasting en belastbaarheid);
- prognose van artrose;
- voor- en nadelen van de relevante behandelopties;
- goed en veilig medicatiegebruik;
- mogelijkheden en belang van zelfmanagement;
- voordelen van een gezond gewicht en voldoende bewegen;
- loophulpmiddelen, indien geïndiceerd (zoals wandelstok, rollator).
Houd bij het geven van informatie en educatie rekening met het opleidingsniveau en de ziektepercepties van de patiënt.
Betrek bij de voorlichting indien geïndiceerd familieleden of mantelzorgers.
Bied naast mondeling informatie ook informatie via een andere routes aan, afgestemd op de informatiebehoefte van de patiënt (bijvoorbeeld een brochure, website of groepsbijeenkomst).
Betrouwbare patiënteninformatie over artrose is te vinden op:
- Handboek voor mensen met artrose: https://www.poly-artrose.nl/wat-is-artrose
- Patiëntinformatie van ReumaNederland: https://reumanederland.nl/reuma/vormen-van-reuma/artrose/;
- Thuisarts: https://www.thuisarts.nl/artrose; Patiëntinformatie van het KNGF: https://www.defysiotherapeut.com/aandoeningen-en-klachten/artrose/.
Adviseer niet routinematig een speciaal programma ter bevordering van zelfmanagement voor pijnvermindering en verbetering van fysiek functioneren bij symptomatische patiënten met heup- of knieartrose.
Adviseer in het kader van algemene gezondheidsadviezen bij alle patiënten met heup- of knieartrose om op gezond gewicht te komen en om voldoende te bewegen.
Adviseer patiënten met symptomatische knieartrose en overgewicht of obesitas minstens 10% van hun gewicht te verliezen en fysieke trainingen te volgen.
Overwegingen
De uitgangsvraag omvat drie deelvragen die betrekking hebben op respectievelijk de effectiviteit van speciale zelfmanagementprogramma's, de effectiviteit van bewust gewichtsverlies bij personen met overgewicht, en de rol van informatieverstrekking en educatie. In onderstaande tekst worden de overwegingen bij de drie deelvragen gecombineerd om zo de hoofdvraag te kunnen beantwoorden: Welke adviezen en informatie (patiënteneducatie en -informatie) moeten aan patiënten met artrose worden verstrekt (onder andere met betrekking tot leefstijl, werk- en sportbelasting)?
Voor en nadelen van de interventie en kwaliteit van het bewijs
Zelfmanagementprogramma’s zijn complex en omvatten vele verschillende interventies. Ze zijn bedoeld om de patiënt te ondersteunen en hen een actieve attitude ten aanzien van hun ziekte aan te leren. Een belangrijk onderdeel is informatie, om kennis over artrose te verbeteren, en educatie. Daarnaast bestaan ze meestal uit interventies gericht op gedragsverandering. Er worden vele verschillende zelfmanagementprogramma’s aangeboden. En de onderzoeken betreffen derhalve ook vele verschillende programma’s, waarvan de meeste zich richten op patiënten met knieartrose. Uit de literatuuranalyse komt naar voren dat er redelijk bewijs is (GRADE gradering: redelijk) dat zelfmanagementprogramma’s op middellange termijn niet of nauwelijks resulteren in pijnreductie in vergelijking tot gebruikelijke zorg, geen interventie of wachtlijst, of alternatieve interventies niet gericht op zelfmanagement. Er is wel sprake van enige verbetering van patiëntgerapporteerd fysiek functioneren, maar het gaat om een klein, klinisch niet relevant, verschil ten opzichte van gebruikelijke zorg. Er zijn geen klinisch relevante voordelen aangetoond op kwaliteit van leven en in de algemene verbetering van de patiënt (patient global assessment). Andere belangrijke uitkomsten zijn niet onderzocht, zoals patiënttevredenheid en participatie. Over bijwerkingen is er in de studies niet tot onvoldoende gerapporteerd. Belangrijk zijn verder de resultaten uit de vergelijking van zelfmanagementprogramma’s met informatieverstrekking, omdat informatieverstrekking onderdeel is van optimale zorg voor artrose patiënten. Juist deze klinische studies laten geen voordeel zien van zelfmanagementprogramma’s boven informatieverstrekking (GRADE gradering: redelijk).
Uit de literatuuranalyse komt naar voren dat er zwak bewijs is (GRADE gradering: laag) dat de combinatie van bewust gewichtsverlies met fysieke training bij patiënten met symptomatische knieartrose leidt tot pijnreductie en verbetering van patiëntgerapporteerd fysiek functioneren, in vergelijking met alleen fysieke training (beweegprogramma) of leefstijladviezen. Het aantal studies waarin dieet-interventies gericht op gewichtsverlies worden vergeleken met alternatieve interventies niet gericht op gewichtsverlies is beperkt en de studies kennen methodologische beperkingen, die inherent zijn aan dit type non-farmacologisch onderzoek. Bij personen met heupartrose ontbreekt dit type gerandomiseerd onderzoek geheel en is derhalve geen uitspraak mogelijk.
De effectiviteit van gewichtsverlies bij patiënten met symptomatische knieartrose wordt ondersteund door de dosis-respons relatie die wordt gezien in de klinische trials. In de studie door Christensen (Christensen 2005) wordt een groter effect gezien indien er een grotere gewichtsreductie wordt bereikt, en de klinische trials van Messier (2013) en Miller (2006) waarin een grotere gewichtsreductie wordt bereikt dan in de klinische trial van Messier (2004) laten een gunstiger effect op pijn en fysiek functioneren zien. Hiermee in overeenstemming zijn de resultaten van observationeel onderzoek (Atukorala 2016; Riddle 2013). Atukorala (2016) onderzocht 1383 patiënten met knieartrose (gemiddelde leeftijd 64 jaar en BMI 34,4 kg/m2) gedurende een gewichtsverliesprogramma van achttien weken en vond een statistisch significante dosis-respons relatie waarbij een gewichtsreductie van 7,7% (95% betrouwbaarheidsinterval van 5,2% tot 13,3%) nodig bleek om een minimale klinisch belangrijke verbetering in fysiek functioneren (9,1 punten op de WOMAC functie subschaal) te bereiken.
Er zijn geen klinische trials gedaan die hebben onderzocht of er ook een effect van gewichtsreductie is op structurele schade aan het gewricht, maar observationele studies suggereren dat overgewicht en obesitas geassocieerd zijn met radiologische achteruitgang, zowel incidentie als progressie van knieartrose (Reijman 2007; Yusuf 2011). In observationele studies wordt een verhoogd risico van overgewicht op symptomatische heupartrose gerapporteerd, echter minder duidelijk en minder sterk dan voor knieartrose (Jiang 2011; Lievense 2002). Verder is er bewijs vanuit observationele studies dat gewichtsreductie het risico op symptomatische knieartrose kan verkleinen. Een preventieve interventiestudie liet zien dat diegenen die het lukte om aan de hand van een lifestyle programma na een jaar 5kg of 5% van hun lichaamsgewicht te reduceren ook een aanmerkelijke reductie hadden in het ontstaan van een klinische knieartrose na 6 jaar follow-up (de Vos 2017) . Dit is relevant omdat patiënten met symptomatische knieartrose een verhoogd risico hebben om ook symptomatische knieartrose in de contralaterale knie te ontwikkelen (Jones 2013; Felson 1992). Tot slot heeft gewichtsverlies naast een potentieel gunstig effect op symptoom reductie bij knieartrose ook andere gunstige gezondheidseffecten, onder andere op het ontstaan en verloop van diabetes mellitus en hart- en vaatziekten. Patiënten met knieartrose zijn overwegend ouderen, waarbij vaak multimorbiditeit aanwezig is.
Werk- en sportbelasting
Artrose is meestal het gevolg van een samenspel van systemische en lokale factoren. Systemische factoren (genetische factoren, leeftijd en geslacht) bepalen de individuele gevoeligheid van het gewricht voor de inwerking van lokale biomechanische factoren, met als resultaat artrose. Lokale biomechanische risicofactoren hebben betrekking op een abnormale biomechanische belasting van het gewricht bijvoorbeeld als gevolg van een afwijkende gewrichtsvorm, standafwijkingen, overgewicht, en/of abnormale belasting van het gewricht bij sport of arbeid. De meeste studies over sport in het algemeen laten een matig verhoogd risico (ongeveer verdubbeld) zien voor het ontstaan van heupartrose. Als specifieke sport kan alleen langeafstandhardlopen als een risicofactor worden aangemerkt voor het ontstaan van heupartrose. Voor andere sporten zijn geen studies voorhanden, of is het bewijs minder overtuigend zoals bij ballet en voetbal (Lievense 2003). Ook voor knieartrose is een matig verhoogd risico gevonden door sport, vooral bij hoge intensiteit en lange duur (Bierma-Zeinstra 2007). De kans op knieartrose door overgewicht of door een knietrauma zoals voorste kruisbandruptuur of meniscusletsel is echter veel groter dan de kans op knieartrose door sport. Werkzaamheden waarbij sprake is van repeterende bewegingen en overbelasting van de gewrichten, kunnen eveneens een verhoogd risico vormen voor het ontstaan van artrose (Verbeek 2017; Seidler 2018). Voorbeelden van beroepsactiviteiten waarbij dit kan optreden zijn: knielen, tillen (vooral vanuit een stand met gebogen knieën), hurken, trappen beklimmen en over oneffen ondergrond lopen. Naar schatting dragen de beroepswerkzaamheden bij mannen voor 15 tot 30 procent bij aan het ontstaan van knieartrose. Werknemers in de agrarische sector hebben een duidelijk hogere kans op artrose van de heupen (Lievense 2001). Vloerenleggers en bouwvakkers hebben meer kans op knieartrose. Vrouwelijke schoonmakers hebben een verhoogde kans op zowel heup- als knieartrose (Schouten 2002; Maetzel 1997; McMillan 2005). De risicofactoren die een rol spelen bij de progressie van artrose zijn niet noodzakelijkerwijs dezelfde als voor het ontstaan van artrose. Van veel factoren is niet bekend of en in hoeverre ze invloed hebben op het ontstaan en/of verergeren van artrose. Overgewicht, varus- en valgusstandafwijking in de knie en tekenen van ontsteking versnellen de progressie van knieartrose (Belo 2007; Bastick 2015), terwijl supero/laterale migratie van de heupkop en een atrofische botrespons de progressie van heupartrose lijkt te versnellen (Lievense 2002).
Waarden en voorkeuren van patiënten
Patiënten geven aan dat zij goede informatieverstrekking en educatie over de ziekte artrose cruciaal vinden (zie Samenvatting focusgroepen onder aanverwant). Patiënten geven zelf aan dat zij graag informatie willen over wat ze kunnen doen om de klachten te verminderen, of in ieder geval verergering te voorkomen. Daarbij worden pijn en gewrichtsstijfheid als grootste belemmeringen ervaren, die zich niet alleen afspelen op het gebied van mobiliteit, maar ook in het sociaal leven, werk en hobby’s. Patiënten hebben daarbij erg de behoefte om zelf iets te kunnen doen, om zo nog enige controle over hun situatie te hebben.
Echter nu is informatievertrekking en educatie in de Nederlandse klinische praktijk onvolledig, in zowel eerste lijn als tweede lijn. Patiënten geven aan dat de informatie vooral is gericht op (de beslissing tot) operatieve behandeling. Informatieverstrekking en educatie omtrent lifestyle interventies, waaronder gewichtsreductie, worden niet gegeven, onvoldoende onderbouwd of niet aangeboden in een voor patiënt als haalbaar ervaren vorm. Patiënten worden bijvoorbeeld niet geïnformeerd over het feit dat 10% gewichtsreductie evidente verbetering in de symptomen kan geven (zie voorgaande paragraaf), en dat dus geen normaal gewicht hoeft te worden bereikt. Ook is de informatieverstrekking en educatie niet gestandaardiseerd. Dit resulteert in grote verschillen in de informatieverstrekking en educatie tussen individuele zorgverleners vanuit de verschillende disciplines en tussen zorgverleners onderling zelfs vanuit dezelfde disciplines. Soms ervaren patiënten de informatie vanuit verschillende zorgverleners als tegenstrijdig; dit geeft verwarring en onzekerheid.
Welke informatie en kennis aan een patiënt moet worden overgedragen, wanneer en hoe vaak en op welke wijze de overdracht aan de patiënt optimaal kan verlopen is echter onvoldoende onderzocht en op dit moment onduidelijk. Wel zijn er initiatieven waarbij zorgverleners vanuit verschillende disciplines tezamen met patiënten tot aanbevelingen zijn gekomen (Fernandes 2013). Centraal hierbij staat dat de informatie en educatie op de individuele patiënt moet zijn toegepast, bijvoorbeeld advies over afvallen aan een patiënt met overgewicht of obesitas, en informatie die past bij de ziekte percepties van de patiënt en zijn opleidingsniveau. Ook moet in ogenschouw worden genomen wat een patiënt zelf wil weten (Ndosi 2014). Belangrijke elementen van de informatie en educatie betreffen: uitleg over de aard en oorzaken van artrose, de consequenties en prognose van artrose, onderhouden en aanpassen van activiteiten (balans tussen belasting en belastbaarheid bij de individuele patiënt), adviezen ten aanzien van verminderen van ongunstige mechanische belasting, en adviseren omtrent loophulpmiddelen en ondersteunende middelen. Mondelinge informatie moet worden ondersteund door een andere vorm van informatie, bijvoorbeeld een folder of groepsbijeenkomst. Informatieverstrekking is erg belangrijk om zo samen met de patiënt tot geïnformeerde “shared decision making” te kunnen komen. Tot slot kunnen familieleden of mantelzorgers bij de informatieverstrekking worden betrokken.
Hoe de precieze inhoud van informatie en educatie eruit kan zien is verder uitgewerkt in een onderzoek waarin artrose experts en gebruikers gevraagd zijn om aanbevelingen te selecteren uit de verschillende artrose richtlijnen via een Delphi-procedure (French 2015). Op basis daarvan is men gekomen tot een lijst van uitspraken met hoge prioriteit om overgedragen te worden aan artrose patiënten tijdens de informatieverstrekking. Hieronder vallen statements over kennis, principes van management, fysieke activiteit en gewichtsreductie, medicatiegebruik en operatie (zie French 2015). De huidige richtlijnwerkgroep heeft zich in haar aanbeveling met betrekking tot informatie en educatie over artrose bij patiënten met symptomatische knie- en/of heupartrose op hoofdlijnen hoofdzakelijk gebaseerd op bovengenoemde lijst.
In het algemeen waren zelfmanagementprogramma niet of weinig effectief. In hoeverre er patiëntengroepen zijn (artrosepatiënten met chronische pijn, hoogopgeleiden, vrouwen, artrosepatiënten waarbij psychologische factoren een rol spelen bij de ervaren symptomen, etc.), die toch een gunstig effect van zelfmanagementprogramma’s zouden kunnen ervaren is op dit moment niet duidelijk. De resultaten van de klinische studies en de systematische review sluiten niet de mogelijkheid uit dat er patiënten zijn die een klinisch relevant effect ervaren van een zelfmanagementprogramma.
De klinische studies naar de effectiviteit van zelfmanagementprogramma’s lieten nogal wat uitval zien 10 tot 40%, vergelijkbaar tussen interventie- en controlegroepen (Kroon 2014). Dat suggereert dat voor patiënten een zelfmanagementprogramma niet vanzelfsprekend is. Uiteindelijk is voor een patiënt heel belangrijk hoe hij/zij elke dag met “zijn/haar” artrose moet omgaan. Daarbij speelt zelfeffectiviteit (‘self-efficacy’) een belangrijke rol: het vertrouwen in de eigen bekwaamheid om met succes invloed uit te oefenen op zijn of haar omgeving, bijvoorbeeld door een bepaalde taak te volbrengen of een probleem op te lossen. In de meeste klinische studies wordt dit niet geëvalueerd. In toekomstige studies naar zelfmanagementprogramma’s en bij toekomstige revisie van de huidige richtlijnmodule moet ook zelfeffectiviteit als uitkomstmaat worden meegenomen.
Aanvaardbaarheid overige stakeholders
Het verstrekken van informatie en educatie kost tijd. De huidige praktijkvoering is hierop vaak niet ingericht. Met name is van belang dat er tijd is voor informatieverstrekking en educatie beschikbaar is. Nader onderzoek is nodig hoe dit het beste in de klinische praktijk kan worden georganiseerd: zoals door wie (de behandelend (huis)arts, zorgverlener of een zorgondersteuner), en in welke vorm (groepsbijeenkomst, één-op-één, etc.). Voor patiënten is bewust gewichtsverlies nog al eens een lastig onderwerp. Wanneer er over bewust gewichtsverlies wordt gesproken voelt een aantal patiënten zich aangevallen of niet serieus genomen door hun arts. Ook voelen zij zich in de steek gelaten. Daarbij komt ook dat een aantal patiënten met overgewicht of obesitas niet gelooft dat zij in staat zullen zijn om gewicht te verliezen. Daarom zou het wenselijk zijn om patiënten die aangeven dat zij gewichtsreductie als problematisch zien, extra ondersteuning aan te bieden, zoals begeleiding door een diëtist en fysio- of oefentherapeut. Daarbij is het dan van belang dat daarvoor ook financiële steun beschikbaar is voor de patiënten.
Kosten (middelen beslag)
Er is onvoldoende onderzoek gedaan om overwegingen te geven ten aanzien van de kosteneffectiviteit van zelfmanagementprogramma’s. Echter gezien de afwezige tot lage effectiviteit van deze programma’s voor knie- en heupartrose patiënten in het algemeen is het erg onwaarschijnlijk dat dergelijk programma’s kosteneffectief zijn. Er is onvoldoende onderzoek om een uitspraak te doen over de kosteneffectiviteit van bewust gewichtsverlies. In toekomstig onderzoek moet de waarde van gewichtsverlies bij symptomatische knieartrose worden beoordeeld vanuit een breed perspectief, dus ook rekening houdend met algemene gezondheidswinst voor de patiënt, het verlichten en voorkomen van comorbiditeiten en andere ziekten, zoals hart- en vaatziekten en diabetes mellitus. Volledige gestandaardiseerde informatieverstrekking en educatie, toegespitst op de patiënt, zal extra tijd vragen, dit zal extra middelen vragen. Ook zullen zorgverleners moeten worden opgeleid/nageschoold om optimale informatie en educatie te geven, waarmee kosten zijn gemoeid.
Haalbaarheid
Om tot implementatie van gewichtsreducerende behandeling te komen zullen strategieën moeten worden ontwikkeld om gewichtsverlies voor patiënten haalbaar te maken. Daarbij gaat het dan niet alleen om de gewichtsreductie op zich, maar ook om het verlaagde gewicht te handhaven. Een recente RCT (Christensen 2017) laat zien dat blijvend gewichtsverlies met een adequate onderhoudsbehandeling zeer wel mogelijk is, maar hoe zo’n onderhoudsbehandeling in de praktijk moet worden georganiseerd zal verder moeten worden onderzocht. Dit is niet alleen van belang bij knieartrose, maar ook bij andere ziekten waarbij overgewicht en obesitas een ongunstige risicofactor is. Blijvend gewichtsverlies en handhaven van een gezond lichaamsgewicht is een belangrijk onderwerp voor primaire en secundaire preventie in public health.
Voor het verstrekken van volledige en gestandaardiseerde informatie en educatie is het wenselijk dat er overeenstemming is tussen de verschillende zorgverleners. Zoals in deze overwegingen opgenomen zijn er door diverse zorgverleners in overleg met patiënten al voorstellen tot meer gestandaardiseerde informatie verstrekking gedaan. Echter voor de Nederlandse situatie, waar vele disciplines betrokken zijn, met ieder hun eigen zienswijze, is nadere uitwerking daarvan wellicht bevorderlijk voor de implementatie.
Rationale (balans tussen voor- en nadelen van de interventie)
Zelfmanagementprogramma’s zijn complexe interventies gericht op educatie en gedragsverandering, het opdoen van kennis en verbeteren van zelfmanagementvaardigheden. Zelfmanagementprogramma’s onderscheiden zich door hun complexiteit duidelijk van standaard informatieverstrekking. Gegeven de afwezige tot lage effectiviteit van zelfmanagementprogramma’s bij patiënten met artrose van knie of heup, met name in vergelijking tot informatieverstrekking die onderdeel moet zijn van de standaardzorg, is er onvoldoende onderbouwing om deze interventie routinematig in te zetten, ook al lijkt deze interventie weinig bijwerkingen te hebben. Er is daarentegen voldoende bewijs voor de effectiviteit van bewust gewichtsverlies voor pijnreductie en verbetering van fysiek functioneren wanneer het wordt gecombineerd met fysieke training bij patiënten met symptomatische knieartrose die overgewicht of obesitas hebben. Daarbij moet er gestreefd worden naar een gewichtsreductie van tenminste 10%. Daarnaast geeft het additionele gezondheidswinst en past in een gezonde en actieve leefstijl. Tot slot zijn er weinig bijwerkingen. Gegeven het gebrek aan bewijs voor de effectiviteit van bewust gewichtsverlies bij patiënten met overgewicht of obesitas op symptomen bij heupartrose, en daarnaast beperkter onderbouwing voor overgewicht of obesitas als risicofactor voor heupartrose dan voor knieartrose, lijkt deze behandeling (afvaldieet in combinatie met fysieke training) niet zinvol ter vermindering van klachten bij symptomatische heupartrose. Op zich past een gezond gewicht en meer bewegen natuurlijk wel in een gezonde levensstijl.
Er is geen direct bewijs betreffende informatieverstrekking en educatie, echter deze wordt beschouwd als de noodzakelijk eerste stap van de behandeling. Volledige en gestandaardiseerde informatieverstrekking en educatie is een belangrijke wens van patiënten. Zelfmanagementprogramma zijn weliswaar nauwelijks effectief en worden door de werkgroep niet aanbevolen, maar bevatten wel onderdelen die belangrijk bijdragen aan de informatie en educatie van patiënten over hun ziekte knie- of heupartrose. Daarnaast is er onderbouwing voor de optimale inhoud en optimale vorm van informatie/ educatie op basis van expert opinion en patiëntraadpleging (French 2015).
Aanbevelingen
In de aanbevelingen worden de adviezen die voortkomen uit de drie deelvragen gecombineerd om een antwoord te geven op de hoofdvraag ‘Welke adviezen en informatie (patiënteneducatie en -informatie) moeten aan patiënten met artrose worden verstrekt (onder anderen met betrekking tot leefstijl, werk- en sportbelasting)?’
Onderbouwing
Achtergrond
Patiënten met knie-of heupartrose ervaren vaak klachten zoals pijn, functiebeperking, en verminderde kwaliteit van leven. Ook maken zij zich vaak zorgen over hun toekomst betreffende de prognose ten aanzien van het te verwachten beloop van hun klachten. Er bestaat vaak onduidelijkheid over de aard van de ziekte artrose en hoe deze zich ontwikkelt. Patiënten vragen om duidelijkheid over de aard en te verwachten beloop van de ziekte en wat zij daar zelf aan kunnen bijdragen in positieve en negatieve zin. Artsen en health professionals geven echter nogal eens beperkt en verschillend advies, en dat geeft verwarring en onzekerheid bij de patiënt. Meer duidelijkheid omtrent gebruik van adviezen betreffende gebruik van zelfmanagementprogramma’s, gewichtsverlies, en lifestyle factoren is daarom belangrijk. Educatie en informatie over de ziekte waaraan een patiënt lijdt is een conditio sine qua non in de behandeling (overkoepelend principe). Derhalve is dit voor elke patiënt met knie- en heupartrose een van de eerste stappen in de behandeling. In deze module zal in worden gegaan op de meerwaarde van een zelfmanagementprogramma en lifestyle advies ten aanzien van gewichtsverlies. Lifestyle advies ten aanzien van bewegen is besproken in de module Oefentherapie bij heup- of knieartrose.
Conclusies / Summary of Findings
Deelvraag 1. Wat is de effectiviteit van zelfmanagementprogramma’s bij het verminderen van artroseklachten?
Laag GRADE |
Zelfmanagementprogramma’s zouden mogelijk op middellange termijn kunnen resulteren in een kleine (maar waarschijnlijk niet klinisch-relevante) pijnreductie bij patiënten met heup- of knieartrose, in vergelijking met aandacht-controle. |
|
Redelijk GRADE |
Zelfmanagementprogramma’s lijken op middellange termijn niet of nauwelijks te resulteren in pijnreductie, in vergelijking tot gebruikelijke zorg, geen interventie of wachtlijst, of informatie, of alternatieve interventies niet gericht op zelfmanagement. |
|
Zeer Laag GRADE |
We zijn onzeker over de lange-termijn effecten van zelfmanagement-programma’s op pijn. Bronnen: (Allen, 2016; Broderick, 2014; Coleman, 2012; Farr, 2010; Helminen, 2015; Hurley, 2012; Kao, 2012; Kroon, 2014; Murphy, 2016; Rini, 2015; Somers 2012) |
|
Redelijk GRADE |
Zelfmanagementprogramma’s resulteren op middellange termijn waarschijnlijk in een kleine (maar niet klinisch-relevante) verbetering van patiëntgerapporteerd fysiek functioneren bij patiënten met heup- of knieartrose, in vergelijking met gebruikelijke zorg, geen interventie of wachtlijst. |
|
Laag tot Redelijk GRADE |
Zelfmanagementprogramma’s lijken op middellange termijn niet effectiever dan andere interventies die niet zijn gericht op zelfmanagement, ten aanzien van fysiek functioneren. |
|
Zeer Laag GRADE |
We zijn onzeker over de lange-termijn effecten van zelfmanagementprogramma’s op fysiek functioneren. Bronnen: (Allen, 2016; Broderick, 2014; Coleman, 2012; Helminen, 2015; Hurley, 2012; Kao, 2012; Kroon, 2014; Rini, 2015; Schlenk, 2011) |
|
Redelijk GRADE |
Zelfmanagementprogramma’s resulteren op middellange termijn waarschijnlijk in een kleine (maar niet klinisch-relevante) algehele verbetering (patient’s global assessment) bij patiënten met heup- of knieartrose, in vergelijking met gebruikelijke zorg, geen interventie of wachtlijst. |
|
Laag tot Redelijk GRADE |
Zelfmanagementprogramma’s lijken op middellange termijn niet effectiever dan andere interventies die niet zijn gericht op zelfmanagement, ten aanzien van patient’s global assessment. Bronnen: (Allen, 2016; Broderick, 2014; Coleman, 2012; Helminen, 2015; Hurley, 2012; Kao, 2012; Kroon, 2014; Rini, 2015; Schlenk, 2011) |
|
Laag GRADE |
Zelfmanagementprogramma’s lijken op middellange termijn geen meerwaarde te hebben op de kwaliteit van leven van patiënten met heup- of knieartrose, in vergelijking met alternatieve interventies die niet zijn gericht op zelfmanagement. |
|
Zeer laag GRADE |
We zijn onzeker over de lange-termijn effecten van zelfmanagementprogramma’s op kwaliteit van leven. Bronnen: (Helminen, 2015; Hurley 2012; Kroon, 2014, Somers 2012) |
|
Laag tot Redelijk GRADE |
Zelfmanagementprogramma’s lijken op middellange termijn geen effect te hebben op sociale activiteiten (waaronder participatie) van patiënten met heup- of knieartrose, in vergelijking met gebruikelijke zorg, geen interventie of wachtlijst, of informatieverstrekking. Bronnen: (Broderick, 2014; Helminen, 2015; Kroon, 2014) |
|
Laag GRADE |
Zelfmanagementprogramma’s lijken op middellange termijn geen effect te hebben op zorggebruik van patiënten met heup- of knieartrose, in vergelijking met gebruikelijke zorg, geen interventie of wachtlijst, of informatieverstrekking. Bronnen: (Broderick, 2014; Helminen, 2015; Kroon, 2014) |
|
Zeer Laag GRADE |
We zijn onzeker over de kosten van zelfmanagementprogramma’s voor patiënten met heup- of knieartrose, in vergelijking met gebruikelijke zorg, geen interventie of wachtlijst. Bronnen: (Hurley, 2012) |
|
Geen GRADE |
Zelfmanagementprogramma’s leiden vermoedelijk tot weinig bijwerkingen of complicaties bij patiënten met heup- of knieartrose. Bronnen: (Kroon, 2014) |
|
Geen GRADE |
Het is onbekend wat de kosteneffectiviteit is van zelfmanagementprogramma’s voor patiënten met heup- of knieartrose. |
|
Geen GRADE |
Het is onbekend of zelfmanagementprogramma’s de tijd tot chirurgische interventie kunnen verlengen voor patiënten met heup- of knieartrose. |
Deelvraag 2. Wat is de effectiviteit van bewust gewichtsverlies bij patiënten met overgewicht/obesitas bij het verminderen van artroseklachten?
|
Laag GRADE |
De combinatie van bewust gewichtsverlies door middel van diëten (5-10% gewichtsreductie) met fysieke training (beweegprogramma) bij patiënten met symptomatische knieartrose lijkt te resulteren in pijnreductie en verbetering van patiëntgerapporteerd fysiek functioneren, in vergelijking met alleen fysieke training (beweegprogramma) of leefstijladviezen. Bronnen: (Messier 2004, 2013; Miller 2006) |
|
Laag GRADE |
Bewust gewichtsverlies door middel van diëten (5-10% gewichtsreductie) bij patiënten met symptomatische knieartrose lijkt niet te resulteren in meer pijnreductie of verbetering van patiëntgerapporteerd fysiek functioneren dan fysieke training (beweegprogramma) of leefstijladviezen. Bronnen: (Messier 2004, 2013; Miller 2006) |
|
Laag GRADE |
Een streng dieet (dagelijkse energie-inname van 3,4 MJ/dag) bij patiënten met symptomatische knieartrose lijkt mogelijk te resulteren in een grotere pijnreductie en grotere verbetering van patiëntgerapporteerd fysiek functioneren dan een conventioneel afvaldieet (5 MJ/dag). Bron: (Christensen 2005) |
|
Geen GRADE |
De effectiviteit van bewust gewichtsverlies bij patiënten met overgewicht/obesitas bij het verminderen van artroseklachten bij patiënten met heupartrose is onbekend. |
Samenvatting literatuur
Deelvraag 1. Wat is de effectiviteit van zelfmanagementprogramma’s bij het verminderen van artroseklachten?
Beschrijving van de zelf-managementprogramma’s
Zelfmanagementprogramma’s omvatten meer dan eenvoudige vormen van patiënteneducatie. Het doel van de zelfmanagementprogramma’s was om mensen met een chronische aandoening aan te moedigen actief om te gaan met hun aandoening en zelf de regie te nemen. De zelfmanagementprogramma’s zijn bedoeld om patiënten te ondersteunen en dienen niet als vervanging van medische zorg.
De meeste studies beschreven zelfmanagementprogramma’s als complexe interventies die een breed pakket van onderwerpen (interventies) omvatten. Educatie en gedragsverandering zijn belangrijke pijlers. De exacte inhoud van de programma’s verschilde. Sommige programma’s richtten zich specifiek op het omgaan met de chronische aandoening, terwijl andere programma’s een holistische aanpak hanteerden waarbij welzijn in bredere zin centraal stond. Het opdoen van kennis en zelfmanagementvaardigheden kwam in vrijwel alle programma’s aan bod (> 90% van de studies). In slechts weinig studies (< 15%) was er aandacht voor sociale integratie en het verbeteren van sociale ondersteuning.
Behalve de inhoud, varieerde ook de wijze waarop zelfmanagementprogramma’s werden aangeboden. Mede afhankelijk van de inhoud van het zelfmanagementprogramma werd dit aangeboden aan de patiënt door een verpleegkundige, psycholoog, een getrainde vrijwilliger, een facilitator, fysiotherapeut, ergotherapeut, oefentherapeut, docent gezondheidswetenschappen, of specialist in patiënteducatie. Programma’s werden één-op-één aan patiënten aangeboden, maar ook als groepsinterventie of eHealth interventie. De duur van de contactmomenten varieerde van een enkele sessie tot een programma van meerdere maanden en frequenties lopen uiteen van eens per week tot eens per twee maanden.
Meer details over de zelfmanagementprogramma’s zijn te vinden in Kroon (2014) en in de evidence-tabellen.
Beschrijving studies
Kroon (2014) analyseerde het effect van zelfmanagementprogramma’s onder andere ten opzichte van:
- Interventies waarbij de controlegroep vergelijkbare aandacht krijgt (educatie), maar zonder specifieke aandacht of instructies voor zelfmanagement of gedragsverandering (aandacht-controle);
- Geen behandeling, gebruikelijke zorg, of plaatsing op een wachtlijst;
- Alleen informatieverstrekking;
- Een alternatieve interventie niet gericht op zelfmanagement (beweegprogramma/ fysiotherapie of dieet).
Kroon (2014) includeert daarnaast nog de vergelijking tussen zelfmanagementprogramma’s en acupunctuur, in de huidige literatuuranalyse is deze vergelijking niet meegenomen omdat deze controle interventie geen deel uitmaakt van de uitgangsvraag. De 13 relevante RCT’s die tijdens de aanvullende zoekactie zijn gevonden werden ingedeeld in één van bovenstaande categorieën. Er werden geen nieuwe studies gevonden waarin men een zelfmanagementprogramma vergeleek met een aandacht controlegroep. Met uitzondering van De Rezende (2016) werden alle studies (39) toegevoegd aan de meta-analyses.
De Rezende (2016) rapporteerde resultaten van een RCT met acht verschillende groepen waarin men een zelfmanagementprogramma vergeleek met het verstrekken van alleen informatie. In de groepen werden verschillende interventiestrategieën ingezet: de duur tussen de educatieve lezingen verschilde en er was wel of geen sprake van telefonische follow-up. De auteurs beschreven alleen resultaten van de afzonderlijke groepen en de vergelijkingen tussen deze afzonderlijke groepen. Een vergelijking tussen zelfmanagement versus informatieverstrekking op basis van de gehele studiepopulatie was niet mogelijk. Geen van de afzonderlijke groepen werd aan de meta-analyse toegevoegd.
Een overzicht van de kenmerken op basis van alle geïncludeerde studies in deze literatuursamenvatting is per vergelijking weergegeven in tabel 1
Tabel 1 Overzicht van kenmerken voor de verschillende vergelijkingen
|
|
Zelfmanagement versus aandacht-controle |
Zelfmanagement versus gebruikelijke zorg, geen interventie of wachtlijst |
Zelfmanagement versus alleen informatie |
Zelfmanagement versus een alternatieve interventie |
|
Aantal studies |
4 |
21 |
5 |
8 |
|
Aantal deelnemers |
897 |
4950 |
1277 |
1112 |
Resultaten
In Tabel 2 en 3 zijn alle resultaten per uitkomstmaat en per vergelijking weergegeven, inclusief de mate van vertrouwen in de bewijskracht (GRADE-beoordeling) voor de betreffende uitkomstmaat.
Zelfmanagement versus aandacht-controle
Middellange termijn effecten
Gewrichtspijn en fysiek functioneren (cruciale uitkomstmaten)
Op basis van een meta-analyse van 3 studies (577 deelnemers) bleken deelnemers 6 tot 12 maanden na deelname aan een zelfmanagementprogramma statistisch significant minder pijn te ervaren dan de deelnemers in de aandacht controlegroep (SMD -0,26; 95% BI -0,44 tot -0,09) (Figuur 1). Het geschatte effect (puntschatter) van het zelfmanagementprogramma op pijnreductie was relatief gering, en kleiner dan het door de werkgroep benoemde minimaal klinisch relevant verschil (MCID van 0,37; zie het onderdeel Relevante uitkomstmaten onder Zoeken en selecteren). Wel overlapt de effectschatting met de MCID. Gegevens over ervaren pijn langer dan een jaar na de interventie werden niet gevonden.
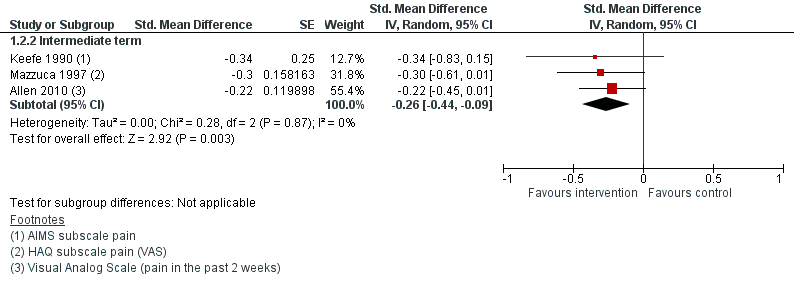 Figuur 1. Vergelijking zelfmanagementprogramma (intervention) versus een aandacht-controlegroep (control). Uitkomstmaat: pijn (middellange termijn)
Figuur 1. Vergelijking zelfmanagementprogramma (intervention) versus een aandacht-controlegroep (control). Uitkomstmaat: pijn (middellange termijn)
Ten opzichte van de aandacht-controle groep resulteerden zelfmanagementprogramma’s niet in statistisch significante verschillen in patiëntgerapporteerd fysiek functioneren (SMD -0,19; 95% BI -0,50 tot 0,11) (Figuur 2 Twee studies vonden geen statistisch significant effect (Mazzuca, 1997; Allen, 2010) tegenover één kleine studie met 68 patiënten Keefe (1990) waarin wél een statistisch significant en klinisch relevant verschil werd gevonden. De effectschatting (95%BI) na pooling overlapt met het door de werkgroep benoemde minimaal klinisch relevant verschil, maar het gemiddelde groepsverschil (puntschatter) ligt duidelijk onder de MCID.
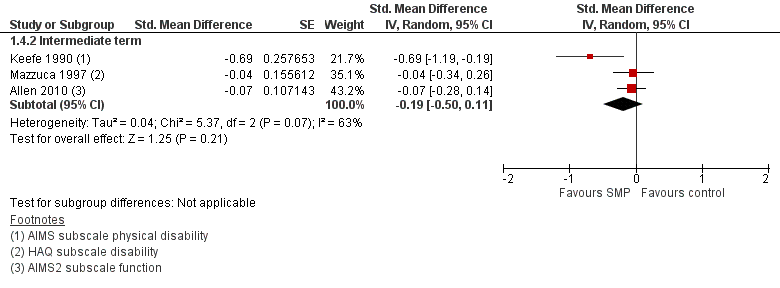 Figuur 2. Vergelijking zelfmanagementprogramma (SMP) versus een aandacht-controlegroep (control). Uitkomstmaat: zelfgerapporteerd fysiek functioneren (middellange termijn)
Figuur 2. Vergelijking zelfmanagementprogramma (SMP) versus een aandacht-controlegroep (control). Uitkomstmaat: zelfgerapporteerd fysiek functioneren (middellange termijn)
Overige uitkomstmaten (belangrijke uitkomstmaten)
Zelfmanagementprogramma’s resulteerden niet in statistisch significante effecten ten opzichte van de aandacht-controle groep in algehele verbetering (patient’s global assessment) of kwaliteit van leven. Beide uitkomstmaten werden gerapporteerd in één studie en de gemiddelde verschillen bedroegen -0,14 (95%BI -0,54 tot 0,26) en -0,01 (95%BI -0,03 tot 0,01), respectievelijk. De mate waarin deelnemers zich terugtrokken uit de studies was niet verschillend tussen de groepen (RR 1,10; 95% BI 0,70 tot 1,74).
Voor de volgende uitkomstmaten waren geen gegevens beschikbaar: responders, bijwerkingen en complicaties, de tijd tot chirurgische interventie, patiënttevredenheid, participatie (betaald werk, sport, vrijetijdsbesteding), kosten (kosteneffectiviteit) en zorggebruik.
Langetermijn effecten
In geen van de studies werden patiënten langer dan een jaar gevolgd.
Bewijskracht van de literatuur
De bewijskracht is gebaseerd op resultaten uit RCT’s en start derhalve hoog. Voor de uitkomstmaten pijn, patient’s global assessment en kwaliteit van leven werd de bewijskracht van afgewaardeerd tot ‘laag’. De redenen om de bewijskracht twee niveaus af te waarderen waren methodologische beperkingen van de studies (zoals het ontbreken van blindering van de patiënten, inadequate randomisatie methode, of gebreken in het maskeren van de randomisatie) en imprecisie (het betrouwbaarheidsinterval omsluit de MCID).
Voor de uitkomstmaat patiëntgerapporteerd fysiek functioneren werd de bewijskracht van de RCT’s afgewaardeerd tot ‘laag’. De redenen om de bewijskracht twee niveaus af te waarderen waren methodologische beperkingen van de studies en substantiële inconsistentie in studieresultaten.
Zelfmanagement versus (gebruikelijke zorg, geen interventie of wachtlijst)
Middellange termijn effecten
Gewrichtspijn en fysiek functioneren (cruciale uitkomstmaten)
De gepoolde resultaten van 18 studies (3.467 deelnemers) lieten een gering en statistisch niet significant verschil in pijnreductie zien na deelname aan zelfmanagementprogramma’s ten opzichte van controle (SMD -0,12, 95% BI -0,25; 0,00) (Figuur 3 Wel bleek op basis van een meta-analyse van deze 18 studies dat patiënten 6-12 maanden na deelname aan een zelfmanagementprogramma een statistisch significante verbetering in fysiek functioneren rapporteerden in vergelijking met de patiënten in de controlegroep. De effectschatting na pooling (SMD -0,15; 95% BI -0,23 tot -0,06) ligt echter in zijn geheel onder het door de werkgroep benoemde minimaal klinisch relevant verschil (MCID van 0,37 SD) (Figuur 4).
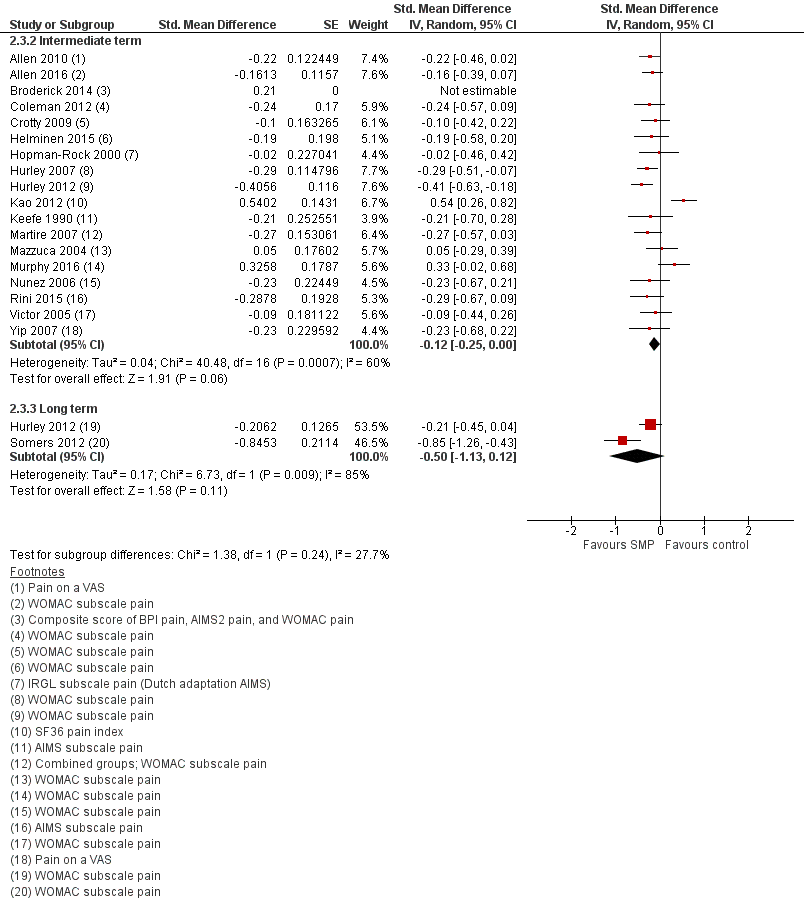 Figuur 3. Vergelijking zelfmanagementprogramma (SMP) versus gebruikelijke zorg, geen interventie of wachtlijst. Uitkomstmaat: pijn (middellange en lange termijn)
Figuur 3. Vergelijking zelfmanagementprogramma (SMP) versus gebruikelijke zorg, geen interventie of wachtlijst. Uitkomstmaat: pijn (middellange en lange termijn)
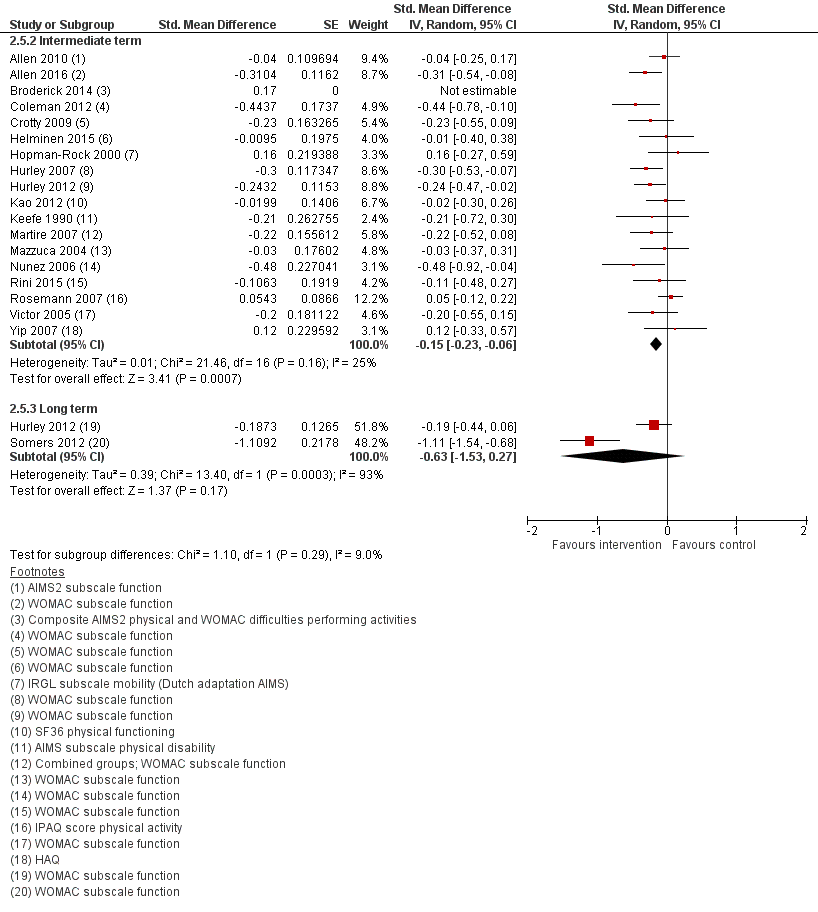 Figuur 4. Vergelijking zelfmanagementprogramma (intervention) versus gebruikelijke zorg, geen interventie of wachtlijst. Uitkomstmaat: patiëntgerapporteerd fysiek functioneren (middellange en lange termijn).
Figuur 4. Vergelijking zelfmanagementprogramma (intervention) versus gebruikelijke zorg, geen interventie of wachtlijst. Uitkomstmaat: patiëntgerapporteerd fysiek functioneren (middellange en lange termijn).
Overige uitkomstmaten (belangrijke uitkomstmaten)
Vergelijkbare resultaten werden gevonden voor patient’s global assessment: de meta-analyse op basis van 8 studies (1.390 deelnemers) wees uit dat zelfmanagementprogramma’s resulteerden in een statistisch significante, maar kleine algehele verbetering ten opzichte van de controlegroep. De effectschatting na pooling (SMD -0,25; 95% BI: -0,41 tot -0,08) ligt in zijn geheel onder het minimaal klinisch relevant verschil (MCID van 0,5 SD) (Figuur 5).
Opvallend zijn de resultaten van de studie van Kao (2012): men vond in deze studie na 8 weken een hogere (‘slechtere’) WOMAC score in de zelfmanagementgroep vergeleken met de controlegroep. De auteurs geven hier diverse redenen voor, waaronder bias door (selectieve) clusterrandomisatie. Ondanks randomisatie was er een groot verschil in gemiddelde WOMAC score op baseline: de WOMAC score in de zelfmanagementgroep vóór aanvang van de interventie was 38,5 (SD 31,3) versus 30,9 (SD 24,3) in de controlegroep.
 Figuur 5. Vergelijking zelfmanagementprogramma (intervention) versus gebruikelijke zorg, geen interventie of wachtlijst. Uitkomstmaat: patient’s global assessment (middellange termijn)
Figuur 5. Vergelijking zelfmanagementprogramma (intervention) versus gebruikelijke zorg, geen interventie of wachtlijst. Uitkomstmaat: patient’s global assessment (middellange termijn)
Eén studie in Groot-Brittannië (Hurley 2012) met 283 deelnemers bracht de kosten gerelateerd aan gezondheid en sociale kosten betaald uit gemeenschapsgeld en de eventuele extra kosten voor het uitvoeren van de interventies in kaart over een periode van 30 maanden. Het verschil tussen interventie- en controlegroep bedroeg gemiddeld £ -1.118 per deelnemer (95% BI £-2.566 tot £-221) (2003/2004 prijsniveau): het zelfmanagementprogramma bleek in deze situatie in termen van kosten statistisch significant voordeliger. Deze gegevens berustten echter op weinig recente (periode 2003-2004) studieresultaten verkregen in het buitenland en het is onduidelijk hoe deze resultaten zich verhouden tot de huidige Nederlandse situatie.
Zelfmanagementprogramma’s resulteerden niet in statistisch significante verbetering van kwaliteit van leven, participatie of zorggebruik ten opzichte van de controle-interventie (gebruikelijke zorg, geen interventie of wachtlijst). De geschatte effectmaten (puntschattingen) waren bovendien klein (klinisch niet relevant), en varieerden van SMD --0,14 tot 0,12.
De mate waarin deelnemers zich terugtrokken uit de studie was niet verschillend in beide groepen (RR: 0,88; 95% BI 0,72 tot 1,08). Uit de resultaten van één studie (Coleman, 2012) bleek er geen statistisch significant verschil tussen het aantal responders (op basis van de OARSI criteria) in de zelfmanagementgroep (22 responders) en de controlegroep (14 responders) (33% versus 20%, p=0,12).
Voor de volgende uitkomstmaten waren geen gegevens beschikbaar: bijwerkingen en complicaties, de tijd tot chirurgische interventie, patiënttevredenheid en kosteneffectiviteit.
Langetermijn effecten
In weinig studies werden patiënten langer dan een jaar gevolgd. Men rapporteerde alleen lange-termijn effecten ten aanzien van pijn, patiëntgerapporteerd fysiek functioneren en kwaliteit van leven.
Gewrichtspijn en fysiek functioneren (cruciale uitkomstmaten)
Twee studies (381 deelnemers) rapporteerden het effect op gewrichtspijn op lange termijn (Figuur 3). Hurley (2012) vond een statistisch niet significante pijnreductie, waarvan het betrouwbaarheidsinterval de grens voor klinische relevantie overschreed (SMD -0,21; 95% BI -0,45 tot 0,04). Somers (2012) vond een statistisch significante pijnreductie. De schatting van het effect ligt in zijn geheel boven de grens voor klinische relevantie (SMD -0,85; 95% BI -1,26 tot -0,43). Na pooling bedraagt de effectschatting SMD -0,50 (95% BI -1,13 tot 0,12).
Vergelijkbare resultaten rapporteerden deze studies met betrekking tot patiëntgerapporteerd fysiek functioneren (Figuur 4). Hurley (2012) vond geen statistisch significant effect (SMD -0,19, 95% BI -0,44 tot 0,06) en Somers (2012) daarentegen wel (SMD -1,11, 95% BI -1,54 tot -0,68). Na pooling bedraagt de effectschatting SMD -0,63 (95% BI -1,53 tot 0,27).
Overige uitkomstmaten (belangrijke uitkomstmaten)
Er werden geen verschillen tussen de groepen gevonden ten aanzien van kwaliteit van leven (één studie Cronan, (1997), SMD 0,01, 95% BI -0,29 tot 0,31). Voor andere uitkomstmaten waren geen resultaten beschikbaar op langere termijn.
Bewijskracht van de literatuur
Middellange termijn. De bewijskracht is gebaseerd op resultaten uit RCT’s en start derhalve hoog. Voor de uitkomstmaten patiëntgerapporteerd fysiek functioneren, pijn, kwaliteit van leven en participatie op middellange termijn werd de bewijskracht afgewaardeerd tot ‘redelijk’. De reden om de bewijskracht één niveau af te waarderen waren methodologische beperkingen van de studies, zoals het ontbreken van blindering van de patiënten, inadequate randomisatie methode of gebreken in het maskeren van de randomisatie (Kroon 2015).
Voor de uitkomstmaat patient’s global assessment werd de bewijskracht van de RCT’s afgewaardeerd tot ‘laag’. De reden om de bewijskracht twee niveaus af te waarderen waren methodologische beperkingen van de studies en imprecisie (het betrouwbaarheidsinterval omsluit de MCID).
Voor de uitkomstmaat zorggebruik werd de bewijskracht van de RCT’s afgewaardeerd tot ‘laag’. De redenen om de bewijskracht twee niveaus af te waarderen waren methodologische beperkingen van de studies en imprecisie (betrouwbaarheidsinterval omsluit de MCID).
Voor de uitkomstmaat kosten werd de bewijskracht van de RCT’s afgewaardeerd tot ‘zeer laag’. De redenen om de bewijskracht af te waarderen waren methodologische beperkingen van de studie, en zeer ernstige indirectheid.
Lange termijn. De bewijskracht is gebaseerd op resultaten uit RCT’s en start derhalve hoog. De resultaten voor de uitkomstmaten op langere termijn werden afgewaardeerd tot het laagste niveau vanwege ernstige methodologische beperkingen van de studies, een hoge mate van inconsistentie (niet-overlappende betrouwbaarheidsintervallen) en imprecisie (het betrouwbaarheidsinterval omsluit de MCID).
Zelfmanagement versus alleen informatieverstrekking
Middellange termijn effecten
Gewrichtspijn en fysiek functioneren (cruciale uitkomstmaten)
Geen van de meta-analyses toonden een klinisch relevant of statistisch significant verschil in gewrichtspijn of fysiek functioneren aan tussen de deelnemers van een zelfmanagementprogramma of deelnemers die alleen informatie kregen verstrekt (SMD’s -0,07 en -0,09, respectievelijk) (Figuur 6 en 7).
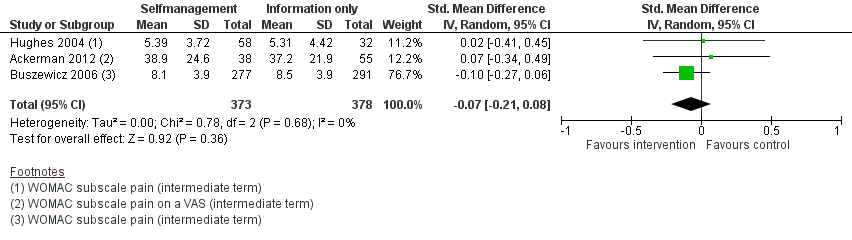 Figuur 6. Vergelijking zelfmanagementprogramma (intervention) versus alleen informatie (control). Uitkomstmaat: pijn (middellange en lange termijn)
Figuur 6. Vergelijking zelfmanagementprogramma (intervention) versus alleen informatie (control). Uitkomstmaat: pijn (middellange en lange termijn)
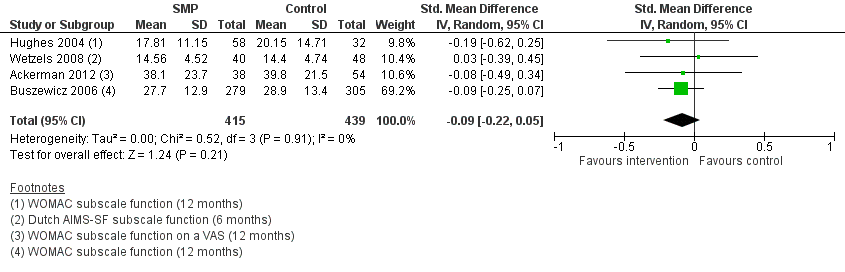
Figuur 7. Vergelijking zelfmanagementprogramma (intervention) versus alleen informatie (control). Uitkomstmaat: patiëntgerapporteerd fysiek functioneren (middellange en lange termijn)
Overige uitkomstmaten (belangrijke uitkomstmaten)
Voor geen van de overige uitkomstmaten werd een statistisch significant verschil gevonden tussen beide groepen en de geschatte effectmaten waren klein (klinisch niet relevant) en varieerden van SMD -0,06 tot 0,14. Er waren geen gegevens beschikbaar over het aantal responders (op basis van de OARSI criteria) in beide groepen.
Langetermijn effecten
In geen van de studies werden patiënten langer dan een jaar gevolgd.
Bewijskracht van de literatuur
De bewijskracht is gebaseerd op resultaten uit RCT’s en start derhalve hoog. Voor uitkomstmaten pijn, fysiek functioneren, patient’s global assessment en kwaliteit van leven werd de bewijskracht van de RCT’s afgewaardeerd tot ‘redelijk’. De reden om de bewijskracht af te waarderen waren methodologische beperkingen van de studies (zoals het ontbreken van blindering van de patiënten, inadequate randomisatie methode, of gebreken in het maskeren van de randomisatie).
Voor de uitkomstmaten participatie en zorggebruik werd de bewijskracht van de RCT’s afgewaardeerd tot ‘laag’. De reden om de bewijskracht twee niveaus af te waarderen waren methodologische beperkingen van de studies en imprecisie (betrouwbaarheidsintervallen omsluiten de MCID).
Voor de uitkomstmaat withdrawal from trial werd de bewijskracht van de RCT’s afgewaardeerd tot ‘laag’: één niveau vanwege methodologische beperkingen van de studies en één niveau vanwege substantiële inconsistentie (I2 = 86%; niet-overlappende betrouwbaarheidsintervallen en zowel significant positieve als negatieve verschillen).
Zelfmanagement versus een alternatieve interventie niet gericht op zelfmanagement
Middellange termijn effecten
Gewrichtspijn en fysiek functioneren (cruciale uitkomstmaten)
Zelfmanagementprogramma’s resulteerden in kleine en statistisch niet significante effecten ten opzichte van een alternatieve interventie zonder zelfmanagement component (beweegprogramma/ fysiotherapie) wat betreft pijn en patiëntgerapporteerd fysiek functioneren (Figuur 8 en 9). De geschatte SMD’s bedroegen -0,07 en -0,18, respectievelijk en de betrouwbaarheidsintervallen omsluiten de MCID.
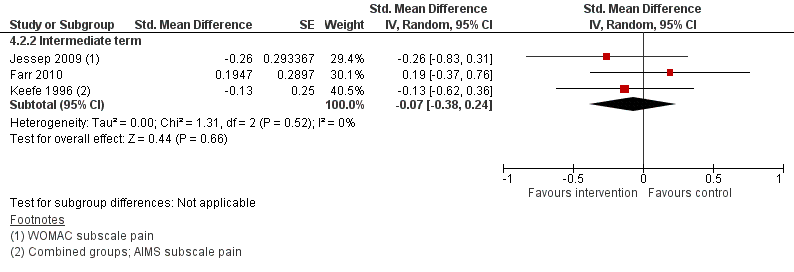 Figuur 8. Vergelijking zelfmanagementprogramma (intervention) versus een alternatieve interventie (control). Uitkomstmaat: pijn (middellange en lange termijn)
Figuur 8. Vergelijking zelfmanagementprogramma (intervention) versus een alternatieve interventie (control). Uitkomstmaat: pijn (middellange en lange termijn)
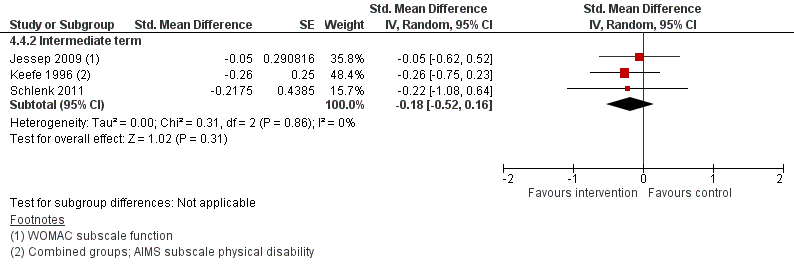 Figuur 9. Vergelijking zelfmanagementprogramma (intervention) versus een alternatieve interventie (control). Uitkomstmaat: patiëntgerapporteerd fysiek functioneren (middellange en lange termijn)
Figuur 9. Vergelijking zelfmanagementprogramma (intervention) versus een alternatieve interventie (control). Uitkomstmaat: patiëntgerapporteerd fysiek functioneren (middellange en lange termijn)
Overige uitkomstmaten (belangrijke uitkomstmaten)
Zelfmanagementprogramma’s resulteerden niet in een statistisch significant effect op de kwaliteit van leven ten opzichte van een alternatieve interventie zonder zelfmanagement component. De geschatte effectmaat was bovendien klein (SMD 0,01, 95% BI -0,28 tot 0,26). De mate waarin deelnemers zich terugtrokken uit de studies verschilde niet tussen beide groepen (RR 0,90; 95% BI 0,73 tot 1,10). Voor de volgende uitkomstmaten waren geen gegevens beschikbaar: patient’s global assessment, responders, bijwerkingen en complicaties, de tijd tot chirurgische interventie, patiënttevredenheid, participatie (betaald werk, sport, vrijetijdsbesteding), kosten (kosteneffectiviteit) en zorggebruik.
Langetermijn effecten
Gewrichtspijn en fysiek functioneren (cruciale uitkomstmaten)
Er waren geen resultaten ten aanzien van gewrichtspijn of gewrichtspijn op lange termijn beschikbaar.
Overige uitkomstmaten (belangrijke uitkomstmaten)
Cronan (1997) volgde 122 deelnemers drie jaar lang, vergelijkt een zelfmanagementprogramma met een programma voor sociale ondersteuning, en analyseerde de kwaliteit van leven van de deelnemers. Er bleek geen statistisch significant klinisch relevant verschil tussen beide groepen (SMD: -0,23, 95% BI -0,55 tot 0,10). Voor de overige uitkomstmaten waren geen resultaten beschikbaar.
Bewijskracht van de literatuur
Middellange termijn. De bewijskracht is gebaseerd op resultaten uit RCT’s en start derhalve hoog. Voor alle uitkomstmaten werd de bewijskracht van de RCT’s afgewaardeerd tot ‘laag’. De reden om de bewijskracht twee niveaus af te waarderen waren methodologische beperkingen van de studies en imprecisie (betrouwbaarheidsintervallen omsluiten de MCID).
Lange termijn. De bewijskracht voor de uitkomstmaat Kwaliteit van leven werd afgewaardeerd tot ‘zeer laag’ vanwege methodologische beperkingen (een niveau) en ernstige imprecisie (enkele studie, betrouwbaarheidsinterval omsluit de MCID en het nuleffect; verlaging met twee niveaus).
Alle vergelijkingen
Kanttekening met betrekking tot de bewijskracht van de literatuur over zelfmanagementprogramma’s
Er is weinig bewijs voor een klinisch relevant effect van zelfmanagementprogramma’s. Kroon (2014) zette uiteen dat, ondanks het afwaarderen van de bewijskracht, het onduidelijk is of aanvullende, goed opgezette studies deze conclusie ten aanzien van zelfmanagementprogramma’s in belangrijke mate zouden veranderen. Door de afwezigheid van blindering van de interventie en de waarschijnlijk ontoereikende aandacht-controle in de nu beschikbare studies (de huidige literatuursamenvatting), bestaat er een grote kans dat deelnemers aan de zelfmanagementprogramma’s gunstiger rapporteerden over de effecten op onder andere gewrichtspijn en fysiek functioneren, dan deelnemers in de controlegroepen. De bias in de huidige literatuuranalyse is hoogstwaarschijnlijk ten gunste van het effect van de zelfmanagementprogramma’s, en de kleine effecten die zijn gevonden verdwijnen mogelijk geheel wanneer bias zou worden weggenomen. Voor de uitkomstmaten waar op dit moment sprake is van een klein effect, is er mogelijk in werkelijkheid sprake van ‘geen effect’.
Echter hierbij moet worden opgemerkt dat afwezigheid van blindering inherent is aan dit type niet-farmacologische onderzoek waarbij het niet mogelijk is om de health professionals die de zorg verlenen te blinderen als ook de patiënten die de zorg ontvangen. Er zijn klinische studies die hebben geprobeerd dit te ondervangen door de uitkomsten te laten beoordelen door effectbeoordelaars die geblindeerd zijn.
Tot slot over ontoereikende aandacht-controle. Aandacht kan ook worden beschouwd als een onderdeel van de behandeling, en kan bijdragen aan het therapeutisch effect van zelfmanagementprogramma’s. Echter de vergelijkingen met andere interventies waarin ook extra aandacht wordt gegeven, zoals informatieverstrekking, laten zien dat het zelfmanagementprogramma geen aanvullend voordeel lijkt te geven (GRADE: redelijk op de cruciale uitkomstmaten pijn en patiëntgerapporteerd fysiek functioneren).
Duiding effect op cruciale uitkomstmaten op middellange termijn
Zelfmanagementtraining resulteerde in een verbetering op de cruciale uitkomstmaat ‘patiëntgerapporteerde gewrichtspijn’ in vergelijking met het effect van vergelijkbare aandacht en gebruikelijke zorg, geen interventie of wachtlijst. Ten opzichte van gebruikelijke zorg, geen interventie of wachtlijst, resulteerde zelfmanagementtraining eveneens in een kleine verbetering van ‘patiëntgerapporteerd fysiek functioneren’. De klinische relevantie van bovengenoemde kleine verschillen is twijfelachtig: in het gunstigste geval overlapt de effectschatting (95% BI) met het door de werkgroep benoemde minimaal klinisch relevant verschil (MCID), maar in alle gevallen ligt het gemiddelde effect (puntschatter) duidelijk onder de MCID. Daarnaast lijken zelfmanagementprogramma’s niet of nauwelijks te resulteren in pijnreductie of verbetering van fysiek functioneren in vergelijking tot bijvoorbeeld informatieverstrekking.
Enerzijds bestaat er dus op basis van wetenschappelijke literatuur een aanzienlijke mate van onzekerheid over de effecten van zelfmanagementtraining en zijn er niet meer dan aanwijzingen voor een mogelijke (kleine) meerwaarde. Anderzijds kan wel worden opgemerkt dat zelfmanagementtraining vrijwel zeker niet tot relevante bijwerkingen of complicaties leidt bij patiënten met heup- of knieartrose (Kroon 2014). Bij het bepalen van de aanbeveling moet de kans op een (klein) positief effect van zelfmanagementtraining worden gewogen in relatie tot eventuele risico’s, kosten, de mogelijke impact op sociaaleconomische gezondheidsverschillen en aanvullende overwegingen zoals de noodzaak van het verstrekken van patiënteninformatie en het bevorderen van patient empowerment (zie het tabblad Overwegingen).
Tabel 2. Gestandaardiseerde effectmaten (95% BI) met minimaal een ‘lage’ GRADE beoordeling voor middellange termijn (6 tot en met 12 maanden na de interventie) effecten van zelfmanagementprogramma’s voor patiënten met heup en/of knieartrose (per uitkomstmaat en voor verschillende vergelijkingen)
* Alternatieve interventies, bijvoorbeeld een beweegprogramma en dieet. Statistisch significante resultaten (p < 0,05) zijn vet gedrukt
Tabel 3. Gestandaardiseerde effectmaten (95% BI) en GRADE beoordeling voor lange termijn effecten van zelfmanagementprogramma’s voor patiënten met heup en/of knieartrose (per uitkomstmaat en voor verschillende vergelijkingen)
|
Uitkomstmaat |
Zelfmanagement versus aandacht-controle |
Zelfmanagement versus gebruikelijke zorg, geen interventie of wachtlijst |
Zelfmanagement versus alleen informatie |
Zelfmanagement versus een alternatieve interventie niet gericht op zelfmanagement* |
|
Pijn (SMD) (lager is beter) |
Geen resultaten |
-0,50 (-1,13; 0,12) (ZEER LAAG) |
Geen resultaten |
Geen resultaten |
|
Patiëntgerapporteerd fysiek functioneren (SMD) (lager is beter) |
Geen resultaten |
-0,63 (-1,53; 0,27) (ZEER LAAG) |
Geen resultaten |
Geen resultaten |
|
Patient’s global assessment (SMD) (lager is beter) |
Geen resultaten |
Geen resultaten |
Geen resultaten |
Geen resultaten |
|
Kwaliteit van leven (SMD) (hoger is beter) |
Geen resultaten |
0,01 (-0,29; 0,31) (ZEER LAAG) |
Geen resultaten |
-0,23 (-0,55; 0,10) (ZEER LAAG) |
|
Participatie (betaald werk, sport, vrijetijdsbesteding) (SMD) (lager is beter) |
Geen resultaten |
Geen resultaten |
Geen resultaten |
Geen resultaten |
* Alternatieve interventies, bijvoorbeeld een beweegprogramma en dieet. Statistisch significante resultaten (p < 0,05) zijn vet gedrukt
Deelvraag 2. Wat is de effectiviteit van bewust gewichtsverlies bij patiënten met overgewicht/obesitas bij het verminderen van artroseklachten?
Beschrijving studies
Er werden geen studies gevonden naar de effecten van een dieetinterventie op klachten als gevolg van symptomatische heupartrose. Vier studies analyseren de effecten van een dieetinterventie bij personen met symptomatische knieartrose (Messier 2004, 2013; Miller 2006; Christensen 2005). Twee studies (Messier 2004; Miller 2006) vergelijken een dieetinterventie (al dan niet gecombineerd met een beweegprogramma) met leefstijladviezen. De studie van Messier (2013) vergelijkt een dieetinterventie (al dan niet gecombineerd met een beweegprogramma) met een beweegprogramma. Christensen (2005) vergelijkt tenslotte een streng afvaldieet met een minder streng (‘conventioneel’) afvaldieet. Er werden geen gerandomiseerde studies gevonden naar het effect van bariatrische chirurgie op verminderen van artroseklachten. De lengte van follow-up varieert van 2 maanden (Christensen 2005) tot 6 maanden (Miller 2006) of 18 maanden (Messier 2004, 2013). De studies zijn van redelijke methodologische kwaliteit, maar door het ontbreken van blindering bestaat er een aanzienlijk risico op bias.
De dieetinterventies verschillen tussen de studies. In Messier (2004) is de milde dieetinterventie gericht op het veranderen van eetgewoonten en daardoor verminderen van calorie-inname door middel van leefstijladviezen en intensieve begeleiding, met als doel 5% gewichtsverlies in 18 maanden. Miller (2006) maakt gebruik van een afvaldieet waarbij de calorie-inname van de deelnemers werd beperkt op basis van een individuele schatting van het energieverbruik, zodat een energietekort van ongeveer 1000 kcal/dag (4,2 MJ/dag) optrad, met als doel 10% gewichtsverlies in 6 maanden. De minimum dagelijkse energie-inname bedroeg 1100 kcal bij vrouwen en 1200 kcal bij mannen (respectievelijk 4,2 MJ en 5 MJ per dag). Messier (2013) hanteert een startdieet vergelijkbaar met Miller (2006) met initieel energietekort van ongeveer 1000 kcal/dag, waarbij het doel was om 10% gewichtsverlies te bereiken in 18 maanden. Tenslotte vergelijkt Christensen (2005) een streng afvaldieet met een energie-inname van slechts 810 kcal/dag (3,4 MJ/dag) met een conventioneel afvaldieet met een energie-inname van 1200 kcal/dag (controlegroep; 5 MJ/dag). Dit laatste afvaldieet in de controlegroep komt min of meer overeen met het afvaldieet in de interventiegroepen bij Miller (2006) en Messier (2013).
Vanwege de grote klinische heterogeniteit (verschillende interventies, controles, lengte van follow-up) is pooling van de onderzoeksresultaten niet verantwoord. Daarom worden hieronder kort de belangrijkste karakteristieken en resultaten besproken per individuele studie.
Resultaten
Gewrichtspijn en fysiek functioneren (cruciale uitkomstmaten)
Messier (2004) randomiseert 316 deelnemers (72% vrouw) met overgewicht of obesitas (gemiddeld lichaamsgewicht 96 kg, gemiddelde BMI 34,4 kg/m2 en leeftijd 69 jaar) en symptomatische knieartrose naar een mild afvaldieet met als doel 5% gewichtsverlies (n=82), het milde afvaldieet in combinatie met een beweegprogramma (trainingssessies van één uur, drie dagen per week; n=76), alleen het beweegprogramma (n=80), of leefstijladviezen (controlegroep; n=78). Tijdens 18 maanden follow-up bedroeg het gewichtsverlies gemiddeld respectievelijk 4,9% (mild afvaldieet), 5,7% (mild afvaldieet en bewegen), 3,7% (alleen bewegen), en 1,2% (controlegroep). Er werd een vergelijkbaar gewichtsverlies bereikt in de afvaldieetgroep en de afvaldieet/bewegen-groep maar alleen de combinatie van (mild) afvaldieet met een beweegprogramma resulteert in een gemiddeld grotere pijnreductie dan de controle-interventie (Figuur 5a): gestandaardiseerd gemiddeld groepsverschil (Standardized Mean Difference, SMD) -0,27 (95%BI= (-0,62; 0,08)). De effectgrootte overlapt met de grens voor klinische relevantie (0,37 SD) maar is na correctie voor verschillen op baseline statistisch niet significant. Eenzelfde resultaat werd bereikt bij analyse van patiëntgerapporteerd fysiek functioneren (WOMAC functie; Figuur 5b): SMD= -0,19 (95%BI= (-0,55; 0,16)), eveneens statistisch niet significant.
Miller (2006) randomiseert 87 personen (62% vrouw) met overgewicht of obesitas (gemiddeld lichaamsgewicht 98 kg, gemiddelde BMI 34,6 kg/m2 en leeftijd 69,5 jaar) en symptomatische knieartrose naar een interventiegroep waarin een afvaldieet met als doel 10% gewichtsverlies wordt gecombineerd met een beweegprogramma (n=44), en een controlegroep waarin leefstijladviezen worden gegeven gericht op gewichtsbehoud (controlegroep; n=45). Tijdens 6 maanden follow-up bedroeg het gewichtsverlies gemiddeld 8,7% in de interventiegroep (afvaldieet en bewegen) en 0% in de controlegroep (leefstijladviezen). Het afvaldieet in combinatie met een beweegprogramma resulteert in een statistisch significant grotere pijnreductie, en een statistisch significant grotere verbetering in fysiek functioneren: respectievelijk SMD = -0,78 (95%BI= (-1,25; -0,31)), en -0,64 (95%BI= (-1,11; -0,18)). Voor beide uitkomstmaten liggen de puntschattingen duidelijk boven de grens voor klinische relevantie (0,37 SD), maar overlapt de effectschatting (betrouwbaarheidsinterval) wel met de grens voor klinische relevantie.
Messier (2013) randomiseert 454 deelnemers (72% vrouw) met overgewicht of obesitas (gemiddeld lichaamsgewicht 93 kg, gemiddelde BMI 33,6 kg/m2 en leeftijd 66 jaar) en symptomatische knieartrose naar een afvaldieet met als doel tenminste 10% gewichtsverlies (n=152), het afvaldieet in combinatie met een beweegprogramma (n=152), of alleen het beweegprogramma (controlegroep; n=150). Tijdens 18 maanden follow-up bedroeg het gewichtsverlies gemiddeld respectievelijk 9,6% (afvaldieet), 11,4% (afvaldieet en bewegen), en 2,0% (alleen bewegen). Het afvaldieet leidt niet tot een klinisch relevant grotere pijnreductie of verbetering in fysiek functioneren dan de bewegingsinterventie, en de kleine verschillen in effectiviteit zijn statistisch niet significant (Figuur 5a en 5b). Ondanks dat er een vergelijkbaar gewichtsverlies werd bereikt in de afvaldieetgroep en de afvaldieet/bewegen-groep resulteert de combinatie van een afvaldieet met een beweegprogramma wel in een statistisch significant grotere pijnreductie, en een statistisch significant grotere verbetering in fysiek functioneren, in vergelijking met alleen bewegen: respectievelijk SMD = -0,39 (95%BI= (-0,64; -0,13)), en -0,52 (95%BI= (-0,78; -0,26)). Voor beide uitkomstmaten liggen de puntschattingen boven de grens voor klinische relevantie (0,37 SD), maar overlapt de effectschatting (betrouwbaarheidsinterval) wel met de grens voor klinische relevantie.
Christensen (2005) randomiseert 80 deelnemers (89% vrouw) met overgewicht of obesitas (gemiddeld lichaamsgewicht 96,8 kg, gemiddelde BMI 35,9 kg/m2 en leeftijd 63 jaar) en symptomatische knieartrose naar een streng afvaldieet (3,4 MJ/dag; n=40), en een ‘conventioneel’ afvaldieet (5 MJ/dag; controlegroep; n=40). Tijdens een relatief korte follow-up van 2 maanden bedroeg het gewichtsverlies gemiddeld 11,1% (streng afvaldieet) en 4,3% (conventioneel afvaldieet), en daarmee was er sprake van een aanzienlijk grotere gewichtsreductie in de interventiegroep. Het strenge afvaldieet resulteert in een gemiddeld grotere pijnreductie dan de controle-interventie (Figuur 10): SMD= -0,32 (95%BI= (-0,76; 0,12)). De effectgrootte overlapt met de grens voor klinische relevantie (0,37 SD) maar is statistisch niet significant. De effecten op fysiek functioneren zijn klinische relevant en statistisch significant in het voordeel van de strenge dieetinterventie: SMD= -0,67 (95%BI= (-1,12; -0,21)). De puntschatting ligt duidelijk boven de grens voor klinische relevantie (0,37 SD) maar de effectschatting (betrouwbaarheidsinterval) overlapt met de grens voor klinische relevantie. Bij de interpretatie van deze resultaten moet rekening worden gehouden met het feit dat alleen personen die hoog gemotiveerd waren voor deelname aan het afvalprogramma werden geïncludeerd, dat het strenge afvaldieet een dieet met bijzonder lage energie-inhoud betreft (3,4 MJ/dag) en dat de lengte van de follow-up beperkt was tot slechts twee maanden.
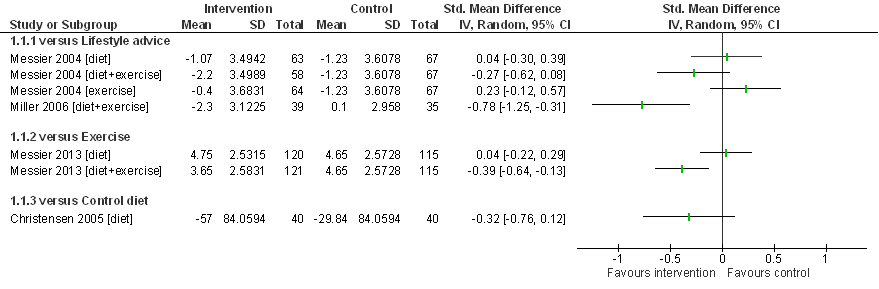 Figuur 10. Forest plot van het effect van gewichtsinterventies bij knieartrose op gewrichtspijn in vergelijking met een controle-interventie. Gewichtsinterventies bestonden uit dieet of dieet in combinatie met bewegen, in een RCT (Messier 2004) kreeg een deel van de patiënten alleen een bewegingsinterventie. De controle-interventie bestond uit leefstijladvies (Miller 2006; Messier 2004), een beweegprogramma (Messier 2013) of een minder streng dieet (Christensen 2005). Uitkomstmaat: reductie in WOMAC pijn ten opzichte van baseline, gemeten na zes maanden (Miller 2006), achttien maanden (Messier 2004, 2013) of twee maanden (Christensen 2005). Gestandaardiseerd gemiddeld groepsverschil (Standardized Mean Difference, SMD).
Figuur 10. Forest plot van het effect van gewichtsinterventies bij knieartrose op gewrichtspijn in vergelijking met een controle-interventie. Gewichtsinterventies bestonden uit dieet of dieet in combinatie met bewegen, in een RCT (Messier 2004) kreeg een deel van de patiënten alleen een bewegingsinterventie. De controle-interventie bestond uit leefstijladvies (Miller 2006; Messier 2004), een beweegprogramma (Messier 2013) of een minder streng dieet (Christensen 2005). Uitkomstmaat: reductie in WOMAC pijn ten opzichte van baseline, gemeten na zes maanden (Miller 2006), achttien maanden (Messier 2004, 2013) of twee maanden (Christensen 2005). Gestandaardiseerd gemiddeld groepsverschil (Standardized Mean Difference, SMD).
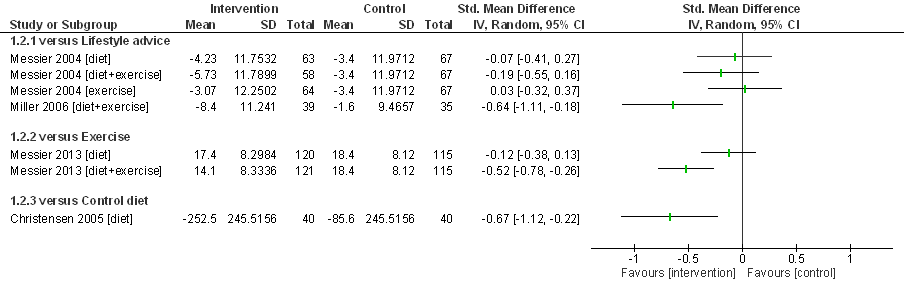 Figuur 11. Forest plot van het effect van gewichtsinterventies bij knieartrose op patiëntgerapporteerd fysiek functioneren in vergelijking met een controle-interventie. Gewichtsinterventies bestonden uit dieet of dieet in combinatie met bewegen, in een RCT (Messier 2004) kreeg een deel van de patiënten alleen een bewegingsinterventie. De controle-interventie bestond uit leefstijladvies (Miller 2006; Messier 2004), een beweegprogramma (Messier 2013) of een minder streng dieet (Christensen 2005). Uitkomstmaat: WOMAC functie, gemeten na zes maanden (Miller 2006), achttien maanden (Messier 2004, 2013) of twee maanden (Christensen 2005). Gestandaardiseerd gemiddeld groepsverschil (Standardized Mean Difference, SMD).
Figuur 11. Forest plot van het effect van gewichtsinterventies bij knieartrose op patiëntgerapporteerd fysiek functioneren in vergelijking met een controle-interventie. Gewichtsinterventies bestonden uit dieet of dieet in combinatie met bewegen, in een RCT (Messier 2004) kreeg een deel van de patiënten alleen een bewegingsinterventie. De controle-interventie bestond uit leefstijladvies (Miller 2006; Messier 2004), een beweegprogramma (Messier 2013) of een minder streng dieet (Christensen 2005). Uitkomstmaat: WOMAC functie, gemeten na zes maanden (Miller 2006), achttien maanden (Messier 2004, 2013) of twee maanden (Christensen 2005). Gestandaardiseerd gemiddeld groepsverschil (Standardized Mean Difference, SMD).
Overige uitkomstmaten (belangrijke uitkomstmaten)
Messier (2004; 2013) rapporteert de compliantie van de deelnemers: 73% (leefstijladviezen), 72% (dieet), 60% (beweegprogramma), en 64% (dieet en beweegprogramma; gemiddeld over beide interventies) in Messier (2004), en 73% (leefstijladviezen), 61% (dieet), 54% (beweegprogramma), en 63%/58% (dieet/ beweegprogramma) in Messier (2013). Messier (2013) rapporteert ook effecten op gezondheidsgerelateerde kwaliteit van leven (SF-36) en vindt alleen voor de combinatie van een afvaldieet met een beweegprogramma een klein maar wel statistisch significant voordeel op de fysieke subschaal van de SF-36 ten opzichte van de controle-interventie (alleen beweegprogramma): gemiddeld groepsverschil (mean difference, MD) -2,8 (95%BI= (-4,8; -0,9)). Er worden kleine en niet statistisch significante verschillen waargenomen op de mentale subschaal van de SF-36. Miller (2006) en Christensen (2005) rapporteren de effecten op gewrichtsstijfheid (WOMAC stijfheid) en beide vinden een gering en statistisch niet significant verschil in het voordeel van de dieetinterventie.
Adverse events (bijwerkingen en complicaties) worden gemeld in drie studies: een ernstige adverse event in de vorm van een schedelfractuur (Messier 2004) en een drietal niet ernstige adverse events (kneuzingen; Messier 2013) door struikelen van deelnemers tijdens oefentherapie, terwijl Miller (2006) rapporteert dat er geen ernstige adverse events waren. Geen van de studies rapporteerde over andere belangrijke uitkomstmaten (patiënttevredenheid, participatie, tijd tot chirurgische interventie, kosten of zorggebruik).
Samenvattend zijn er aanwijzingen dat de afzonderlijke interventies, een afvaldieet of beweegprogramma of leefstijladviezen, vergelijkbare effecten hebben op pijn en fysiek functioneren bij symptomatische knieartrose. De combinatie van een afvaldieet met een beweegprogramma lijkt daarentegen een klinisch relevant voordeel te bieden op pijn en fysiek functioneren in vergelijking met de afzonderlijke interventies. Tenslotte is er een aanwijzing, op basis van een enkele studie met korte follow-up (Christensen 2005), dat een streng dieet (dagelijkse energie-inname van 3,4 MJ/dag) mogelijk tot een grotere pijnreductie en grotere verbetering van fysiek functioneren leidt dan een conventioneel afvaldieet (5 MJ/dag).
Bewijskracht van de literatuur
De bewijskracht is gebaseerd op resultaten uit RCT’s en start derhalve hoog. Voor vrijwel alle vergelijkingen (dieet versus leefstijladvies, dieet versus beweegprogramma, dieet/beweegprogramma versus beweegprogramma, streng dieet versus minder streng dieet) is een enkele studie beschikbaar, alleen voor de vergelijking tussen dieet/beweegprogramma en leefstijladvies zijn twee studies geïncludeerd. De bewijskracht voor de cruciale uitkomstmaten gewrichtspijn en patiëntgerapporteerd fysiek functioneren is overal verlaagd met twee niveaus naar laag vanwege imprecisie en methodologische beperkingen. Naast het geringe aantal studies per vergelijking, overlappen in alle gevallen de effectschattingen met de grens voor klinische relevantie, en kennen alle studies methodologische beperkingen met name door het ontbreken van blindering.
Zoeken en selecteren
Om de deelvragen 1 en 2 te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvragen:
- Wat zijn de gunstige en ongunstige effecten van een zelfmanagementprogramma in vergelijking met standaard zorg of interventies zonder zelfmanagement component bij volwassen patiënten met klachten als gevolg van artrose aan heup en/of knie in de eerste of tweede lijn?
- Wat zijn de gunstige en ongunstige effecten van bewust afvallen alléén in vergelijking met standaard zorg of andere interventies (waarbij afvallen geen primair doel is) bij volwassen patiënten met klachten als gevolg van artrose aan heup en/of knie in de eerste of tweede lijn?
Voor deelvraag-3 is geen systematische literatuuranalyse uitgevoerd, deze deelvraag wordt beantwoord op basis van de literatuuranalyse bij deelvragen 1 en 2, en aanvullende overwegingen.
Relevante uitkomstmaten
De werkgroep achtte patiëntgerapporteerde gewrichtspijn (NRS, VAS; pijnsubschaal van WOMAC, KOOS, HOOS) en patiëntgerapporteerd fysiek functioneren (beperkingen bij het uitvoeren van algemeen dagelijkse activiteiten; relevante subschalen van IKS, WOMAC kneescore, WOMAC hip score, KOOS, HOOS, Oxford Knee Score, en Oxford Hip Score) cruciale uitkomstmaten. Percentage responders (op basis van patiëntgerapporteerde uitkomstmaten) werd benoemd als een belangrijke uitkomstmaat. Responderanalyses worden bij voorkeur uitgevoerd op basis van de OMERACT-OARSI set van respondercriteria (Pham 2003) die zijn gebaseerd op veranderingen in pijn, functie en algemene verbetering (patient’s global assessment). De volgende uitkomstmaten werden eveneens als belangrijk benoemd: patiëntgerapporteerde gewrichtsstijfheid, kwaliteit van leven (QoL), patiënttevredenheid, participatie (betaald werk, sport, vrijetijdsbesteding), adverse events (bijwerkingen en complicaties), therapietrouw (compliantie; withdrawal from trial), tijd tot chirurgische interventie (elke vorm van chirurgie gerelateerd aan de klachten als gevolg van artrose), kosten (kosteneffectiviteit; ook lange termijn (vijf jaar)), en zorggebruik.
De werkgroep definieerde voor deelvraag 1 niet a priori de genoemde uitkomstmaten, maar hanteerde, waar mogelijk, de in de Cochrane Review van Kroon (2014) gebruikte definities.
Klinische relevantie en grenzen voor klinische besluitvorming
Op basis van een analyse van de minimaal klinisch relevante verschillen (zie module 'Oefentherapie bij heup- of knieartrose') heeft de werkgroep besloten een MCID (minimal clinically important difference) te hanteren van 0,37 SD (standaarddeviaties) voor gewrichtspijn en fysiek functioneren, overeenkomend met 7 tot 8 punten op een 0 tot 100 meetschaal. Voor de overige uitkomstmaten werden de door de internationale GRADE working group voorgestelde default grenzen gehanteerd voor klinische relevantie: een verschil in relatief risico van 25% bij dichotome uitkomstmaten, en een verschil van een halve standaarddeviatie voor continue uitkomstmaten.
Zoeken en selecteren (Methode)
Bij aanvang van de richtlijnontwikkeling is een oriënterende zoekactie uitgevoerd naar systematische reviews en richtlijnen met betrekking tot conservatieve behandeling van artrose aan heup of knie (zie werkwijze onder het tabblad verantwoording). Deze oriënterende zoekactie leverde een recente Cochrane systematische review op, die de effecten van zelfmanagementprogramma's voor behandeling van artrose analyseerde en de literatuur dekte tot begin 2013 (Kroon 2014). Voor deelvraag 1 is derhalve in de databases Medline (via OVID) en Cinahl (via) op 13 juli 2016 met relevante zoektermen aanvullend gezocht vanaf het jaar 2013 naar (systematische reviews van) gerandomiseerd onderzoek naar de waarde van zelfmanagementprogramma's bij behandeling van mensen met heup- of knieartrose. Kroon (2014) includeerde studies waarin de patiëntenpopulatie bestond uit ‘mensen gediagnosticeerd met artrose’ (osteoartritis) en niet enkel uit ‘mensen gediagnosticeerd met knie- of heupartrose’. De aanvullende zoekactie werd beperkt tot mensen gediagnosticeerd met knie- of heupartrose.
Voor deelvraag-2 is een aparte zoekactie uitgevoerd op 24 augustus 2017 waarin zonder beperking op publicatiedatum is gezocht naar (systematische reviews van) origineel onderzoek naar de waarde van bewust gewichtsverlies ter vermindering van artroseklachten bij patiënten met overgewicht/obesitas en heup- of knieartrose. De zoekverantwoordingen zijn weergegeven onder het tabblad Verantwoording.
Voor deelvraag-1 (zelfmanagement) werden studies geselecteerd op grond van de volgende selectiecriteria:
Inclusiecriteria:
- De patiëntenpopulatie bestaat volledig uit volwassen patiënten die zich melden met klachten als gevolg van artrose aan heup en/of knie in de eerste of tweede lijn;
- De interventie is een zelfmanagementprogramma, gedefinieerd als volgt in analogie met Kroon (2014): “a package of interventions specifically targeted at patient education and behaviour modification, designed to encourage people with chronic disease to take an active self-management role to supplement medical care and improve outcomes.” Studies die zelfmanagement interventies beschrijven, maar waarbij de interventies niet werden aangeboden volgens een gestructureerd format, werden geëxcludeerd;
- De controlegroep ontvangt alleen informatie, gebruikelijke zorg of een andere interventie (geen zelfmanagementprogramma), staat op een wachtlijst, of ontvangt geen enkele interventie in analogie met Kroon (2014);
- De studie betreft een systematisch literatuuronderzoek of RCT.
Exclusiecriteria:
- De interventie focust enkel op fysieke training (in analogie met Kroon 2014).
Van de volgende studies die Kroon (2014) includeerde was het onduidelijk of de studiepopulatie knie- of heupartrose had of was het duidelijk dat er ook patiënten met andere artrose diagnoses geïncludeerd waren: Blixen (2004), Calfas (1992), Hansson (2010), Heuts (2005) en Lorig (2008). Deze studies werden geëxcludeerd omdat zij niet voldeden aan de selectiecriteria.
Kroon (2014) vond na de afronding van hun meta-analyses nog acht studies die in aanmerking kwamen voor selectie in hun review. Vijf van deze studies voldeden aan de selectiecriteria van de werkgroep en deze werden geïncludeerd (Coleman, 2012; Hurley, 2012; Schlenk, 2011; Somers, 2012; Kao, 2012). De literatuurzoekactie om de review van Kroon (2014) aan te vullen, leverde 177 treffers op. Op basis van titel en abstract werden in eerste instantie 15 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 8 primaire studies definitief geselecteerd (zie exclusietabel onder het tabblad Verantwoording).
Samengevat: de literatuuranalyse voor deelvraag-1 is gebaseerd op de studies in de meta-analyse van Kroon (2014) waarin de studiepopulatie voldeed aan de selectiecriteria van de werkgroep, aangevuld met 13 recente studies. Voor de studiekarakteristieken en resultaten, en beoordeling van de individuele studieopzet (risk of bias) van de studies geïncludeerd in de SR van Kroon (2014) wordt verwezen naar het bewuste systematische review. De belangrijkste studiekarakteristieken en resultaten van de 13 aanvullende studies zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
In analogie met Kroon (2014) zijn de uitkomsten als volgt ingedeeld:
- Directe effecten (‘immediate effects’, gemeten tot zes weken na de start van de interventie);
- Middellange termijn effecten (‘intermediate effects’, gemeten tot en met één jaar na de interventie);
- Langetermijn effecten (‘longer-term effects’, gemeten na langer dan één jaar na de interventie).
In onderstaande literatuursamenvatting worden de effecten op middellange en lange termijn beschreven. Effecten tot zes weken na de interventie (directe effecten) werden door de werkgroep als minder relevant beoordeeld en daarom hier buiten beschouwing gelaten.
De zoekactie voor deelvraag 2 leverde in totaal 389 referenties op: 80 SR’s en 309 RCT’s. Voor deze deelvraag werden studies geselecteerd op grond van de volgende inclusiecriteria:
- De patiëntenpopulatie bestaat volledig uit volwassen patiënten die zich melden met klachten als gevolg van artrose aan heup en/of knie in de eerste of tweede lijn;
- De interventie heeft als primair doel gewichtsverlies;
- De controlegroep ontvangt geen interventie (standaard zorg, wachtlijst) of een andere interventie die niet (of minder) is gericht op gewichtsverlies;
- De studie betreft een systematisch literatuuronderzoek of RCT.
Na een voorselectie op titel en abstract werd van 19 studies de volledige tekst bekeken. Uiteindelijk bleken 4 studies te voldoen aan de inclusiecriteria en deze zijn geïncludeerd in de literatuuranalyse.
Referenties
- Allen KD, Oddone EZ, Coffman CJ, et al. Telephone-based self-management of osteoarthritis: A randomized trial. Ann Intern Med. 2010 Nov 2;153(9):570-9. doi: 10.7326/0003-4819-153-9-201011020-00006. PubMed PMID: 21041576.
- Allen KD, Yancy WS Jr, Bosworth HB, et al. A Combined Patient and Provider Intervention for Management of Osteoarthritis in Veterans: A Randomized Clinical Trial. Ann Intern Med. 2016 Jan 19;164(2):73-83. doi: 10.7326/M15-0378. Epub 2015 Dec 22. PubMed PMID: 26720751.
- Atukorala I, Makovey J, Lawler L, et al. Is There a Dose-Response Relationship Between Weight Loss and Symptom Improvement in Persons With Knee Osteoarthritis? Arthritis Care Res (Hoboken). 2016 ;68(8):1106-14. doi: 10.1002/acr.22805. PubMed PMID: 26784732.
- Bastick AN, Runhaar J, Belo JN, Bierma-Zeinstra SM. Prognostic factors for progression of clinical osteoarthritis of the knee: a systematic review of observational studies. Arthritis Res Ther. 2015 Jun 8;17:152. doi: 10.1186/s13075-015-0670-x. Review. PubMed PMID: 26050740; PubMed Central PMCID: PMC4483213.
- Belo JN, Berger MY, Reijman M, et al. Bierma-Zeinstra SM. Prognostic factors of progression of osteoarthritis of the knee: a systematic review of observational studies. Arthritis Rheum. 2007 Feb 15;57(1):13-26. Review. PubMed PMID: 17266080.
- Bierma-Zeinstra SM, Koes BW. Risk factors and prognostic factors of hip and knee osteoarthritis. Nat Clin Pract Rheumatol. 2007 ;3(2):78-85. Review. PubMed PMID: 17299445.
- Blixen CE, Bramstedt KA, Hammel JP, et al. A pilot study of health education via a nurse-run telephone self-management programme for elderly people with osteoarthritis. J Telemed Telecare. 2004;10(1):44-9. PubMed PMID: 15006216.
- Broderick JE, Keefe FJ, Bruckenthal P, et al. Nurse practitioners can effectively deliver pain coping skills training to osteoarthritis patients with chronic pain: A randomized, controlled trial. Pain. 2014 ;155(9):1743-54. doi: 10.1016/j.pain.2014.05.024. Epub 2014 May 24. PubMed PMID: 24865795.
- Calfas KJ, Kaplan RM, Ingram RE. One-year evaluation of cognitive-behavioral intervention in osteoarthritis. Arthritis Care Res. 1992 ;5(4):202-9. PubMed PMID: 1489766.
- Christensen P, Henriksen M, Bartels EM, et al. Long-term weight-loss maintenance in obese patients with knee osteoarthritis: a randomized trial. Am J Clin Nutr. 2017;106(3):755-763. doi: 10.3945/ajcn.117.158543. Epub 2017 Jul 26. PubMed PMID: 28747328.
- Christensen R, Astrup A, Bliddal H. Weight loss: the treatment of choice for knee osteoarthritis? A randomized trial. Osteoarthritis Cartilage. 2005 ;13(1):20-7. PubMed PMID: 15639633.
- Coleman S, Briffa NK, Carroll G, et al. A randomised controlled trial of a selfmanagement education program for osteoarthritis of the knee delivered by health care professionals. Arthritis Research and Therapy 2012;14(1):R21.
- Cronan TA, Groessl E, Kaplan RM. The effects of social support and education interventions on health care costs. Arthritis and Research 1997;10(2):99110. (DOI: Cn-00255687; PUBMED: 9313398).
- de Rezende MU, Hissadomi MI, de Campos GC, et al. One-Year Results of an Educational Program on Osteoarthritis: A Prospective Randomized Controlled Trial in Brazil. Geriatr Orthop Surg Rehabil. 2016 ;7(2):86-94. doi: 10.1177/2151458516645634. Epub 2016 May 11. PubMed PMID: 27239382.
- de Vos BC, Landsmeer MLA, van Middelkoop M, et al. Long-term effects of a lifestyle intervention and oral glucosamine sulphate in primary care on incident knee OA in overweight women. Rheumatology (Oxford). 2017 Aug 1;56(8):1326-1334. doi: 10.1093/rheumatology/kex145. PubMed PMID: 28431145.
- Farr JN, Going SB, McKnight PE, et al. Progressive resistance training improves overall physical activity levels in patients with early osteoarthritis of the knee: a randomized controlled trial. Phys Ther 2010;90:35666.
- Felson DT, Zhang Y, Anthony JM, et al. Weight loss reduces the risk for symptomatic knee osteoarthritis in women. The Framingham Study. Ann Intern Med. 1992 Apr 1;116(7):535-9. PubMed PMID: 1543306.
- Fernandes L, Hagen KB, Bijlsma JW, et al. European League Against Rheumatism (EULAR). EULAR recommendations for the non-pharmacological core management of hip and knee osteoarthritis. Ann Rheum Dis. 2013 ;72(7):1125-35. doi: 10.1136/annrheumdis-2012-202745. Epub 2013 Apr 17. PubMed PMID: 23595142.
- French SD, Bennell KL, Nicolson PJ, et al. What do people with knee or hip osteoarthritis need to know? An international consensus list of essential statements for osteoarthritis. Arthritis Care Res (Hoboken). 2015 ;67(6):809-16. doi: 10.1002/acr.22518. PubMed PMID: 25418120.
- Hansson EE, Jönsson-Lundgren M, Ronnheden AM et al. Effect of an education programme for patients with osteoarthritis in primary care--a randomized controlled trial. BMC Musculoskelet Disord. 2010 Oct 25;11:244. doi: 10.1186/1471-2474-11-244. PubMed PMID: 20969809; PubMed Central PMCID: PMC2987970.
- Helminen EE, Sinikallio SH, Valjakka AL, et al. Effectiveness of a cognitive-behavioural group intervention for knee osteoarthritis pain: a randomized controlled trial. Clin Rehabil. 2015 ;29(9):868-81. doi: 10.1177/0269215514558567. Epub 2014 Nov 20. PubMed PMID: 25413168.
- Heuts PH, de Bie R, Drietelaar M, Aretz K, Hopman-Rock M, Bastiaenen CH, Metsemakers JF, van Weel C, van Schayck O. Self-management in osteoarthritis of hip or knee: a randomized clinical trial in a primary healthcare setting. J Rheumatol. 2005 Mar;32(3):543-9. PubMed PMID: 15742451.
- Higgins JPT, Green S (editors). Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0 (updated March 2011). The Cochrane Collaboration, 2011. Available from www.handbook.cochrane.org.
- Hurley MV, Walsh NE, Mitchell H, et al. Long-term outcomes and costs of an integrated rehabilitation program for chronic knee pain: a pragmatic, cluster randomized, controlled trial. Arthritis Care and Research 2012;64(2):23847.
- Jiang L, Rong J, Wang Y, et al. The relationship between body mass index and hip osteoarthritis: a systematic review and meta-analysis. Joint Bone Spine. 2011 ;78(2):150-5. doi: 10.1016/j.jbspin.2010.04.011. Epub 2010 Jun 30. Review. PubMed PMID: 20580591.
- Jones RK, Chapman GJ, Findlow AH, et al. A new approach to prevention of knee osteoarthritis: reducing medial load in the contralateral knee. J Rheumatol. 2013 ;40(3):309-15. doi: 10.3899/jrheum.120589. Epub 2013 Jan 15. PubMed PMID: 23322462.
- Kao MJ, Wu MP, Tsai MW, et al. The effectiveness of a self-management program on quality of life for knee osteoarthritis (OA) patients. Archives of Gerontology and Geriatrics 2012;54(2):31724.
- Keefe FJ, Caldwell DS, Williams DA, et al. Pain coping skills training in the management of osteoarthritic knee pain: II. Followup results. Behavior Therapy 1990;21(4):43547. (DOI: Cn-00364121).
- Kroon FP, van der Burg LR, Buchbinder R, et al. Self-management education programmes for osteoarthritis. Cochrane Database Syst Rev. 2014 Jan 15;(1):CD008963. doi: 10.1002/14651858.CD008963.pub2. Review. PubMed PMID: 24425500.
- Lievense A, Bierma-Zeinstra S, Verhagen A, et al. Influence of work on the development of osteoarthritis of the hip: a systematic review. J Rheumatol. 2001 ;28(11):2520-8. Review. PubMed PMID: 11708427.
- Lievense AM, Bierma-Zeinstra SM, Verhagen AP, et al. Influence of sporting activities on the development of osteoarthritis of the hip: a systematic review. Arthritis Rheum. 2003 Apr 15;49(2):228-36. Review. PubMed PMID: 12687515.
- Lievense AM, Bierma-Zeinstra SM, Verhagen AP, et al. Influence of obesity on the development of osteoarthritis of the hip: a systematic review. Rheumatology (Oxford). 2002;41(10):1155-62. Review. PubMed PMID: 12364636.
- Lievense AM, Bierma-Zeinstra SM, Verhagen AP, et al. Prognostic factors of progress of hip osteoarthritis: a systematic review. Arthritis Rheum. 2002 Oct 15;47(5):556-62. Review. PubMed PMID: 12382307.
- Lorig KR, Ritter PL, Laurent DD, et al. The internet-based arthritis self-management program: a one-year randomized trial for patients with arthritis or fibromyalgia. Arthritis Rheum. 2008 Jul 15;59(7):1009-17. doi: 10.1002/art.23817. PubMed PMID: 18576310.
- Maetzel A, Mäkelä M, Hawker G, et al. Osteoarthritis of the hip and knee and mechanical occupational exposure--a systematic overview of the evidence. J Rheumatol. 1997 ;24(8):1599-607. PubMed PMID: 9263158.
- Mazzuca SA, Brandt KD, Katz BP, et al. Effects of self-care education on the health status of inner-city patients with osteoarthritis of the knee. Arthritis and Rheumatism 1997;40(8):146674. (DOI: Cn-00142539; PUBMED: 9259427).
- McMillan G, Nichols L. Osteoarthritis and meniscus disorders of the knee as occupational diseases of miners. Occup Environ Med. 2005;62(8):567-75. Review. PubMed PMID: 16046610; PubMed Central PMCID: PMC1741064.
- Messier SP, Loeser RF, Miller GD, et al. Exercise and dietary weight loss in overweight and obese older adults with knee osteoarthritis: the arthritis, diet, and activity promotion trial. Arthritis Rheum. 2004;50(5):150110.
- Messier SP, Mihalko SL, Legault C, et al. Effects of intensive diet and exercise on knee joint loads, inflammation, and clinical outcomes among overweight and obese adults with knee osteoarthritis: the IDEA randomized clinical trial. Jama. 2013 Sep 25;310(12):1263-73. doi: 10.1001/jama.2013.277669. PMID: 24065013.
- Miller GD, Nicklas BJ, Davis C, et al. Intensive weight loss program improves physical function in older obese adults with knee osteoarthritis. Obesity (Silver Spring). 2006 ;14(7): 1219-30. doi: 10.1038/oby.2006.139. PMID: 16899803.
- Murphy SL, Kratz AL, Kidwell K, et al. Brief time-based activity pacing instruction as a singular behavioral intervention was not effective in participants with symptomatic osteoarthritis. Pain. 2016;157(7):1563-73. doi: 10.1097/j.pain.0000000000000549. PubMed PMID: 26963847; PubMed Central PMCID: PMC4912409.
- Ndosi M, Bremander A, Hamnes B, et al. Validation of the educational needs assessment tool as a generic instrument for rheumatic diseases in seven European countries. Ann Rheum Dis. 2014 Dec;73(12):2122-9. doi: 10.1136/annrheumdis-2013-203461. Epub 2013 Aug 6. PubMed PMID: 23921996.
- Pham T, Van Der Heijde D, Lassere M, et al. OMERACT-OARSI. Outcome variables for osteoarthritis clinical trials: The OMERACT-OARSI set of responder criteria. J Rheumatol. 2003 ;30(7):1648-54. Review. PubMed PMID: 12858473.
- Reijman M, Pols HA, Bergink AP, et al. Body mass index associated with onset and progression of osteoarthritis of the knee but not of the hip: the Rotterdam Study. Ann Rheum Dis. 2007 ;66(2):158-62. Epub 2006 Jul 12. PubMed PMID: 16837490; PubMed Central PMCID: PMC1798486.
- Riddle DL, Stratford PW. Body weight changes and corresponding changes in pain and function in persons with symptomatic knee osteoarthritis: a cohort study. Arthritis Care Res (Hoboken). 2013 ;65(1):15-22. doi: 10.1002/acr.21692. PubMed PMID: 22505346; PubMed Central PMCID: PMC3401342.
- Rini C, Porter LS, Somers TJ, et al. Automated Internet-based pain coping skills training to manage osteoarthritis pain: a randomized controlled trial. Pain. 2015 ;156(5):837-48. doi: 10.1097/j.pain.0000000000000121. PubMed PMID: 25734997.
- Rosemann T, Joos S, Laux G, et al. Case management of arthritis patients in primary care: a cluster-randomized controlled trial. Arthritis Rheum 2007;57:13907.
- Schlenk EA, Lias JL, Sereika SM, et al. Improving physical activity and function in overweight and obese older adults with osteoarthritis of the knee: a feasibility study. Rehabil Nurs. 2011 Jan-;36(1):32-42. PubMed PMID: 21290963; PubMed Central PMCID: PMC3052988.
- Schouten JS, de Bie RA, Swaen G. An update on the relationship between occupational factors and osteoarthritis of the hip and knee. Curr Opin Rheumatol. 2002;14(2):89-92. Review. PubMed PMID: 11845010.
- Seidler A, Lüben L, Hegewald J, Bolm-Audorff U, Bergmann A, Liebers F, Ramdohr C, Romero Starke K, Freiberg A, Unverzagt S. Dose-response relationship between cumulative physical workload and osteoarthritis of the hip - a meta-analysis applying an external reference population for exposure assignment. BMC Musculoskelet Disord. 2018 Jun 1;19(1):182. doi: 10.1186/s12891-018-2085-8. PubMed PMID: 29859083; PubMed Central PMCID: PMC5984732.
- Somers TJ, Blumenthal JA, Guilak F, et al. Pain coping skills training and lifestyle behavioral weight management in patients with knee osteoarthritis: a randomized controlled study. Pain 2012;153(6):1199209.
- Verbeek J, Mischke C, Robinson R, Ijaz S, Kuijer P, Kievit A, Ojajärvi A, Neuvonen K. Occupational Exposure to Knee Loading and the Risk of Osteoarthritis of the Knee: A Systematic Review and a Dose-Response Meta-Analysis. Saf Health Work. 2017 Jun;8(2):130-142. doi: 10.1016/j.shaw.2017.02.001. Epub 2017 Feb 22. Review. PubMed PMID: 28593068; PubMed Central PMCID: PMC5447410.
- Yusuf E, Bijsterbosch J, Slagboom PE, et al. Body mass index and alignment and their interaction as risk factors for progression of knees with radiographic signs of osteoarthritis. Osteoarthritis Cartilage. 2011 ;19(9):1117-22. doi: 10.1016/j.joca.2011.06.001. Epub 2011 Jun 16. PubMed PMID: 21722745.
Evidence tabellen
Deelvraag 1
Risk of bias table for intervention studies (deelvraag-1)
Research question: What is the value of selfmanagement programs for adults with osteoarthritis of hip or knee?
|
Study reference (first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Allen, 2016 |
computer-generated, stratified based on providers’ volume of female patients (< 15% versus ≥15%). |
Unlikely, study team members involved in screening and consent were blinded to randomization. |
Likely (But: potential patient participants were blinded to their PCP’s randomization until after baseline assessments.) |
Likely |
Likely for patient-reported outcomes; outcomes assessors were blind to randomization. |
Unlikely |
Unlikely |
Unlikely, analyses involved all randomly assigned participants using all data collected |
|
Broderick, 2014 |
permuted blocking procedure using 2 block sizes (6 and 8) |
Unlikely |
Likely |
Likely |
Likely for patient-reported outcomes; The research team maintained assessor blinding, but patients sometimes revealed their experimental condition. |
Unlikely |
Likely |
Unlikely; analyses were conducted in accordance with the intention-to-treat principle. |
|
Coleman, 2012 |
Simple randomisation: a sealed envelope was drawn from a box by an independent person to determine group allocation. |
Unlikely |
Likely; blinding of participants was not possible, owing to the nature of the intervention. |
Likely; blinding of care providers was not possible. |
Likely for patient-reported outcomes; the physiotherapists performing the assessments did not participate in the facilitation of the OAK program and thus were blind to group allocation. |
Unlikely |
Unlikely |
Unlikely; the main comparisons between groups were performed using an intention-to-treat analysis. |
|
De Rezende 2016 |
Randomization was performed by a computer-generated program |
Unclear |
Likely; although there was no difference in the information presented between groups. |
Likely |
Likely for patient-reported outcomes; evaluators did not know the group to which each patient belonged. |
Unlikely |
|
Unclear |
|
Helminen 2015 |
computer-generated code for randomization, administered via sequentially numbered sealed opaque envelopes |
Unlikely |
Likely; blinding not possible. |
Unlikely |
Likely for patient-reported outcomes |
Unlikely |
|
Unlikely; all analyses adhered to the intent-to-treat principle. |
|
Hurley 2012 |
A randomization list was generated and held at a central site away from the research center by personnel not involved in the trial. |
Unlikely |
Likely; blinding of participants not possible, owing to the nature of the intervention. |
Likely; blinding of care providers was not possible. |
Likely for patient-reported outcomes; the assessors were blinded to a participant’s allocation. |
Unlikely |
Likely, as indicated by missing values analysis. |
Unlikely |
|
Murphy 2016 |
Randomization scheme was block stratified by age group (cut off was 62 years) and male/female sex with blocks of 3; randomization scheme developed by study statistician and implemented in statistical software |
Unclear |
Likely, blinding of participants not possible |
Likely |
Likely for patient-reported outcomes; assessors were blinded. |
Unlikely |
Unlikely |
Unlikley, analyses used an Intent to Treat approach |
|
Rini 2015 |
computer-generated permuted block randomization (with random block sizes varying from 2 to 12) stratified by sex and site; sequentially-numbered opaque envelopes used to conceal allocation |
Unlikely |
Unlikely |
|
Likely for patient-reported outcomes |
|
|
|
|
Schlenk 2011 |
adaptive randomization procedure of minimization to ensure groups were balanced in age (50–64 years, 65–74 years, and ≥ 75 years), gender, race (White and non-White), and recruitment site. |
Unlikely |
Unclear |
Unclear |
Likely for patient-reported outcomes |
Unclear |
Likely/unclear |
Unclear |
|
Somers, 2012 |
random allocation computer software program to assign participants in blocks |
Unlikely |
Unclear |
Unclear |
Likely for patient-reported outcomes |
Unlikely |
Likely |
Unlikely; all randomized participants were included in the data analysis following the intent-to-treat principle. |
|
Kao 2012 |
Participants living in two of four districts were assigned to an intervention group by ballot; while participants lived in the other two districts were assigned to a control group. |
Likely |
Likely |
Likely |
Likely for patient-reported outcomes; investigators remained blind to treatment groups |
Unclear |
Unclear |
Unlikely |
|
Farr 2010 |
Eligible participants were stratified by sex and randomly assigned via a random number table to 1 of the 3 treatment groups.
|
Unlikely; concealed allocation was accomplished using envelopes to conceal computer-generated values. |
Likely; manifest transparency of the treatments rendered blinding unfeasible |
Likely |
Likely for patient-reported outcomes |
Unlikely |
Unclear |
Unclear |
|
Rosemann 2007 |
Of 115 practices, 75 were randomly selected, stratified into rural or urban, and randomly assigned to either the control group or 1 of the 2 intervention groups |
Unclear |
Unclear |
Likely |
Likely for patient-reported outcomes |
Unclear |
Likely |
Unlikely; all analyses were performed based on intent-to-treat, regardless of whether patients really received the intended treatment. |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules..
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
Evidence table for intervention studies (deelvraag-1)
Research question: What is the value of selfmanagement programs for adults with osteoarthritis of hip or knee?
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Self-management programmes versus attention control |
|||||||
|
None found after Kroon (2014) |
|||||||
|
Self-management programmes versus usual care / no treatment |
|||||||
|
Allen, 2016 |
Type of study: cluster RCT
Setting: Ambulatory care service
Country: U.S.A.
Source of funding: National Institute of Arthritis and Musculoskeletal and Skin Disorders
|
Inclusion criteria: - hip OA and / or knee OA (based on radiographic evidence - patient-reported joint symptoms that was present or for which patient used pain medications on most days during the last month - overweight - not currently meeting Department of Health and Human Services physical activity recommendations
Exclusion criteria: See article Appendix A
N total at baseline: 300 Intervention: 151 Control: 149
Important prognostic factors2: Age (SD): I: 60 (9) C: 62 (9)
Sex (n, % male) I: 131 (87%) C: 141 (95%) |
Describe intervention (treatment/procedure/test):
A twelve-month intervention focusing on physical activity, weight management and cognitive behavioral pain management strategies. Telephone calls were scheduled twice per month for the first six months, then monthly for the last six months, and were delivered by one counselor with training in OA and behavior change. Participants were given written patient educational materials corresponding to intervention topics, an exercise video for patients with OA, and an audio CD of relaxation exercises. |
Describe control (treatment/procedure/test):
Usual care |
Length of follow-up: 12 months (intermediate term)
Loss-to-follow-up: Intervention: N= 12 (8%) Reasons for withdrawal: excluded, missed assessment, lost to follow-up.
Control: N= 15 (10%) Reasons: excluded, missed assessment, lost to follow-up.
Incomplete outcome data: Intervention: N (%) Not reported
Control: N (%) Not reported
(Missing data were imputed) |
Outcome measures and effect size (include 95%CI and p-value if available):
N in analysis: I: 151 C:149
WOMAC subscale pain (treatment diff (95%CI)): -0.5 (-1.2, 0.2) SMD (SE): -0.16 (0.12), p=0.16
WOMAC subscale function: Mean diff (95%CI): -3.3 (1.0; 5.7) SMD (SE): -0.31 (0.12), p=0.008
WOMAC total: I: -4.0 (-6.2, -1.8) C: 0.1 (-2.1, 2.3) SMD (SE): -0.30 (0.12), p<0.01
Function performance (SPPB) Mean diff (95%CI): 0.3 (-0.3, 0.9) SMD (SE): 0.09 (0.12), p=0.43
Activities (hours per week) 3.6 (1.3, 5.9)
Adverse events 4, none associated with the OA intervention.
Health services utilization (N) Physical therapy: I: 1; C: 2 Knee brace: I: 5; C: 3 MOVE! Program: I: 8; C: 2 Orthopedic visit: I: 4; C: 6 Joint injection: I: 8; C: 7 |
A patient and provider OA intervention improved total WOMAC and WOMAC function score at 12-months. No statistically significant or clinically relevant differences between arms for other secondary and process outcomes. |
|
Broderick, 2014 |
Type of study: RCT
Setting: Primary care and rheumatology practices
Country: U.S.A.
Source of funding: National Institute of Arthritis and Musculoskeletal and Skin Diseases of the National Institutes of Health |
Inclusion criteria: - physician-confirmed diagnosis of hip or knee OA; - 21 years of age or older; - usual pain ≥4 on a 10-point scale for a duration of at least 6 months; - no cognitive/ mental impairment that would interfere with participation; - no expected joint replacement surgery in the next 2 years.
Exclusion criteria: none reported
N total at baseline: 256 Intervention: 129 Control: 127
Important prognostic factors2: Age (SD): I: 68 (8.7) C: 66 (10)
Sex (F) I: 78.9 C: 74.4
No significant group differences were found on demographic or clinical variables, except for employment (p = .001), with control group participants more likely to be employed. |
Describe intervention (treatment/procedure/test):
Pain coping skills training interventions teach patients cognitive and behavioral skills to manage their pain and enhance their perception of pain control. Four broad coping skills were taught across ten 30- to 45-minute sessions: |
Describe control (treatment/procedure/test):
Usual care: patients in both conditions were provided with an OA informational brochure from the Arthritis Foundation and information on programs (support groups, arthritis education, and aquatic exercise classes) offered in the community. |
Length of follow-up: 12 months (intermediate term)
Loss-to-follow-up: Intervention: N= 38 (29%) Reasons for withdrawal: not reported
Control: N= 36 (28%) Reasons for withdrawal: not reported
Retention rates did not differ between treatment and control groups.
Incomplete outcome data: Intervention: N (%) Not reported
Control: N (%) Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
N total in analysis: 256 Intervention: 129 Control: 127
Pain intensity (composite of BPI pain, AIMS2 pain, and WOMAC pain) mean diff (SE): -0.21 (0.11), p=0.047 SMD (SE): 0.21 (unknown)
Physical functioning (composite AIMS2 physical and WOMAC difficulties performing activities) mean diff (SE): -0.17 (0.08) p=0.036 SMD (SE): 0.17 (unknown)
AIMS2 social activities mean diff (SE): 0.12 (0.21), p=0.557 SMD (SE): -0.07 (unknown)
Daily pain medication mean diff (SE): −0.10 (0.05), p<0.05
|
This NP-delivered PCST protocol produced significant improvements in a range of pain-related variables including pain intensity, coping with pain, self-efficacy for controlling pain, activity interference due to pain, and the use of pain medication when compared with usual care. |
|
Coleman, 2012 |
Type of study: RCT
Setting: primary care
Country: Australia
Source of funding: Arthritis Western Australia. The research undertaken was independent from the funding body. |
Inclusion criteria: - Diagnosis of OA (X-ray or clinical diagnosis) - Referral from general practitioner or specialist - Able to meet program requirements
Exclusion criteria: - Coexisting inflammatory arthritis - Serious comorbidity - Knee replacement scheduled in < 6 months
N total at baseline: 146 Intervention: 71 Control: 75
Important prognostic factors2: Age ± SD: I: 65 ± 7.9 C: 65 ± 8.7
Sex, M:F I: 14:57 C: 23:52
Despite randomisation, there were between group differences in severity at baseline. Therefore, baseline values were used as covariates in the analyses |
Describe intervention (treatment/procedure/test):
Disease-specific SM program for people with osteoarthritis of the knee (OAK) for delivery by health care professionals.
Six weekly sessions of 2.5 hours each |
Describe control (treatment/procedure/test):
Waiting list |
Length of follow-up: 6 months (intermediate term)
Loss-to-follow-up: Intervention: N=3 (4%) Control: N=7 (9%) Reasons for withdrawal (describe): overseas relocation; work, family and time commitments; and not having been randomised to the OAK group
Incomplete outcome data: Intervention: not reported N (%) Reasons (describe)
Control: not reported N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
N total in analysis:136 Intervention: 68 Control: 68
WOMAC subscale Pain (mean (SE)): I: 6.1 (0.3) C: 6.7 (0.3) SMD (SE)= -0.24 (0.17), p=0.16 mean diff in change: -0.49 (-1.26 to 0.28)
WOMAC total (mean (SE)): I: 29.2 (1.2) C: 33.3 (1.2) SMD (SE): -0.41 (0.17), p=0.02) mean diff in change: -4.08 (-7.47 to –0.68)
WOMAC subscale function (mean (SE)): I: 19.9 (1) C: 23.4 (0.9), p<0.05 SMD (SE): -0.44 (0.17), p=0.01 mean diff in change: -4.35 (-6.20 to -0.91
OARSI Responder index I: 22 (33%) C: 14 (20%), p=0.123
Function performance: Timed Up and Go test (mean (SE)): I: 10 (0.2) C: 11 (0.2), p<0.05 SMD (SE): -0.60 (0.18, p<0.001) mean diff in change: -0.72 (-1.35 to -0.08)
Withdrawal (proportion): I: 3/71 C: 7/75 |
In the OAK group, a significantly greater proportion of responders* were observed at 8 weeks compared with the control group, though by 6 months this proportion did not differ significantly between groups.
(* responders defined as: an improvement of ≥ 50% and an absolute change of ≥ 20 points on a 100-point scale in pain or function or an improvement in at least two of the following: an improvement of ≥ 20% and an absolute change of ≥ 10 points in two of the three parameters pain, function and global health) |
|
Helminen, 2015 |
Type of study: cluster RCT
Setting: primary healthcare
Country: Finland
Source of funding: an EVO and a VTR grant from Kuopio University Hospital
|
Inclusion criteria: - aged between 35 and 75 years with clinical symptoms and radiographic grading of knee osteoarthritis
Exclusion criteria: - Severe psychiatric or psychological disorders that had led to hospitalization or an inability to work; - previous or planned lower extremity joint surgery; - other back or lower limb pain symptoms that had been more aggravating than the knee pain.
N total at baseline: 111 Intervention: 55 Control: 56
Important prognostic factors2: Age (min-max): I: 65 (7) C: 63 (7)
Sex (female) I: 39 (71%) C: 38 (68%)
No statistical differences were noted in the baseline characteristics between the two groups |
Describe intervention (treatment/procedure/test):
Cognitive– behavioural intervention on knee osteoarthritis pain. Six weekly sessions supervised by an experienced psychologist and a physiotherapist. The sessions took place in a group of 7−13 persons according to the model presented by Linton. Each session lasted for two hours. |
Describe control (treatment/procedure/test):
Care as usual: both the intervention and the control group continued side by side with the usual GP care that patients might have received in primary care throughout the study |
Length of follow-up: 12 months (intermediate term)
N at follow-up analyses: Intervention: 55 Control: 48
Loss-to-follow-up: Intervention: N= 2 (3%) Reasons for withdrawal: no response.
Control: N= 11 (20%) Reasons: Reasons for withdrawal: dead, dropped out, no response.
Incomplete outcome data: Intervention: 2 (3%)
Control: 11 (20%)
|
Outcome measures and effect size (include 95%CI and p-value if available):
N total at follow-up: 103 Intervention: 55 Control: 48
Age, gender, and disease severity were included in all models based on their associations with the study outcomes in prior research.
No adverse events were recorded in either of the study groups.
WOMAC subscale Pain Mean diff (95% CI): -3.9 (-11.8 to 4.0) Mean (95% CI): I: 35.6 (30.0 tot 41.1) C: 39.5 (33.7 tot 45.2) SMD (SE): -0.19 (0.20), P=0.34
WOMAC subscale function mean diff (95% CI): -0.3 (-8.3, 7.8) I: 36.5 (30.6 tot 42.3) C: 36.7 (31.0 tot 42.4) SMD (SE): -0.010 (0.20), p=0.96
HRQoL, 15D Mean diff (95% CI): −0.03 (−0.06, 0.00) I: 0.82 (0.80 tot 0.85) C: 0.85 (0.83 tot 0.88) SMD (SE): -0.42 (0.20), p =0.04
RAND-36 Social Functioning Mean diff (95% CI): −7.8 (−16.4, 0.81), p=0.08 I: 75.0 (68.2−81.8) C: 82.8 (77.6−88.0) SMD (95%CI): -0.35 (-0.74-0.04)
No significant differences between the groups at any assessment point in the use of pain medication, the number of doctor appointments, physiotherapist appointments, or sick-leave days owing to osteoarthritis. |
This single-blinded RCT could not confirm the hypothesized advantage of a group-based cognitive–behavioural training programme over ordinary GP care in knee osteoarthritis pain patients. On the contrary, our findings indicated a negative impact of the intervention on pain self-efficacy in knee osteoarthritis patients. |
|
Hurley, 2012 |
Type of study: cluster RCT
Setting: primary care surgeries
Country: Great Britain
Source of funding:
|
Inclusion criteria: - 50 years or over - mild, moderate, or severe knee pain of more than 6 months’ duration
Exclusion criteria: Leg arthroplasty, physiotherapy for knee pain in the preceding 12 months, intraarticular injections in the preceding 6 months, unstable medical conditions, inability/unwillingness to exercise, severe lack of mobility,
N total at baseline: 418 Intervention:
Control: 178
Important prognostic factors2: Age (min-max): I: 67 (50-91) C: 67 (51-89)
Sex, M:F I: 80:198 C: 44:96 All of the participants in the trial received interventions their primary care physicians considered appropriate. For the majority, this consisted of prolonged medication (analgesia and nonsteroidal anti-inflammatory drugs). There were no between-group differences in the interventions received.
|
Describe intervention (treatment/procedure/test):
ESCAPE-knee pain program: In addition to care as usual, the intervention group participated in an exercise-based rehabilitation program designed to improve function by integrating exercise, education, and self-management strategies to dispel inappropriate health beliefs, alter behavior, and encourage regular physical activity.
12 supervised sessions twice weekly for 6 weeks. |
Describe control (treatment/procedure/test):
Care as usual: whatever services or interventions their physicians considered appropriate |
Length of follow-up: 6 months (intermediate term); 18 and 30 months (long term)
Loss-to-follow-up @ 30 months: Intervention: N= 89 (32%) Reasons for withdrawal: not reported
Control: N= 46 (33%) Reasons: not reported
Incomplete outcome data: Intervention: N (%) Not reported
Control: N (%) Not reported
The decline in WOMAC function for usual care participants may, in part, be due to loss to followup rather than improvements in functioning for individual participants. Participants who were lost to followup had poorer functioning at baseline than those who were assessed on at least 1 followup occasion (WOMAC function score 29.0 versus 26.9; P = 0.41). In particular, participants who were lost to followup from the usual care arm had poorer baseline functioning than participants lost to followup from the ESCAPE-knee pain arm (mean WOMAC function score 32.2 versus 28.0; P = 0.49).
|
Outcome measures and effect size (include 95%CI and p-value if available):
N at 6 months: I: 229 C: 113 N at 30 months: I: 189 C: 94
WOMAC subscale Pain Mean (SD): 6 months I: 5.7 (1.9) C: 6.5 (2.1), p=0.18 SMD (SE): -0.41 (0.12), p<0.001
30 months I: 5.9 (2.6) C: 6.4 (2.0), p=0.46 SMD (SE): -0.21 (0.13), p=0.10
WOMAC subscale function (mean (SD)): 6 months I: 21.7 (6.7) C: 23.4 (7.5), p=0.42 NNT: 7.3 (4.1 to 42.0) Adjusted for missings: mean diff: -4.44 (-6.54 to -2.33), p<0.0001 SMD (SE): -0.24 (0.12), p=0.04
30 months I: 22.3 (8.7) C: 23.8 (6.3), p=0.53 NNT: 6.7 (3.8 to 39.5) Adjusted for missings: mean diff: -2.78 (-5.32 to -0.23), p=0.032 SMD (SE): -0.19 (0.13), p=0.14
Costs Over 30 months there were no differences in discounted total health and social costs (£-1,177; 95% CI £-3,609 to £313)
Imputing missing data did suggest that ESCAPE-knee pain participants had lower costs: £ -1,118; 95% CI £-2,566 to £-221.
Adjusting for baseline differences in functioning had little impact on the treatment effects. Overall, physical functioning of usual care participants did not change during the 30-month followup |
The unadjusted data analysis, which ignores baseline values and missing data, suggests little or no between-group differences. However, this was greatly influenced by the differential withdrawal from usual care of participants with the highest health and social care costs and poorest function. This differential attrition reduced betweengroup treatment differences and masked the program’s greater and sustained clinical and cost benefits compared to usual primary care.
|
|
Kao, 2012 |
Type of study: RCT
Setting: Hospital
Country: Taiwan
Source of funding: Department of Health, Taipei City Government
|
Inclusion criteria: - 50 years or older - Knee pain complaints or muscle weakness in lower extremity confirmed by a clinical examination as having OA affecting their knees.
Exclusion criteria: Had knee replacement or surgery; unable to maintain balance while standing independently; having medical conditions that could be exacerbated by the protocol.
N total at baseline: 259 Intervention: 134 Control: 125
Important prognostic factors2: Age (SD): I: 67.3 (10.1 C: 68.2 (11.2)
Sex (Male) I: 22 (19%) C: 26 (29%) |
Describe intervention (treatment/procedure/test):
Taipei Osteoarthritis Program: Four 80-min classes held once a week, each with 10–15 participants led by a physical therapist trained in leading small groups and in self-management basic principles.; |
Describe control (treatment/procedure/test):
Standard care |
Length of follow-up: 8 weeks (intermediate term)
Loss-to-follow-up: Intervention: N= 20 (15%) Reasons for withdrawal: no contact, busy, withdraw, much better.
Control: N= 31 (27%) Reasons: no contact, busy, withdraw,
There was no statistically significant difference between non-completers and completers in terms of demographics and outcome measures at baseline.
Incomplete outcome data: Intervention: N (%) Not reported
Control: N (%) Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
N total at follow-up: Intervention: 114 Control: 91
WOMAC total Mean (SD) I: 41.2 (31.2) C: 33.4 (27.2) SMD (95% CI): 0.26 (-0.01; 0.54), p=0.06
SF36 pain index Mean (SD) I: 70.0 (16.7) C: 60.5 (18.5) SMD (95% CI): 0.54 (0.26; 0.82), p<0.001
SF36 physical functioning Mean (SD) I: 65.1 (10.0) C: 65.3 (10.0) mean diff: -0.02 (-0.30;0.26), p=0.89
|
The study showed at an 8-week follow-up an impact on the psychological well being of participants, in particular the participants’ GH perception and mental subscales of the SF-36. Other outcomes, including disability level by WOMAC showed no significant effect. |
|
Murphy, 2016
|
Type of study: RCT
Setting: Occupational therapy
Country: U.S.A.
Source of funding: Rehabilitation and Research Branch of the Veterans Affairs Office of Research Development
|
Inclusion criteria: - age 50 and older; - pain for at least 3 months duration; - at least mild to moderate pain severity overall; - radiographic evidence of osteoarthritis in a corresponding knee or hip joint.
Exclusion criteria: - non-ambulatory; - changed any medications within the past 2 weeks; - medical conditions that could interfere with symptom ratings or accelerometer data - knee joint injection within the previous 3 months or knee arthroscopic procedure within the previous 2 months, or knee replacement within the previous 6 months; - in the last 12 months physical or occupational therapy for OA symptoms for knee or hip problems or participated in a cognitive behavioral program or other self-management program.
N total at baseline: 193 Intervention-1: n=64 Intervention-2: n=66 Control: n=63
Important prognostic factors2: Age (years (SD)): I-1: 64 (8) I-2: 64 (8) C: 66 (9)
Sex (Female I-1: 39 (61%) I-2: 41 (62%) C: 39 (62%) |
Describe intervention (treatment/procedure/test):
Intervention 1:Tailored activity pacing Interverntion 2: General activity pacing
|
Describe control (treatment/procedure/test):
Care as usual. |
Length of follow-up: 6 months (intermediate term)
Loss-to-follow-up: I-1: 18 (28%) I-2: 17 (26%) Reasons for withdrawal: unable to follow instructions, started new treatment, lost to follow-up, medical conditions.
Control: N=8 (13%) Reasons: lost to follow-up
Incomplete outcome data: Intervention: N (%) Not reported
Control: N (%) Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
I-2 (N=64) vs C (N=63)
WOMAC pain Mean (SE) I: 7.93 (0.45) C: 6.78 (0.43) Mean diff (95%CI): 0.13 (-0.21, 0.48) SMD (SE): 0.33 (0.18), p=0.07
Physical function Six minute walk (feet) Mean (SE) I: 1223.39 (32.93) C: 1208.63 (32.54) SMD (95%CI): 0.06 (-0.29, 0.41)
|
We did not find that activity pacing as a singular behavioral strategy was sufficient for improving pain, fatigue, or physical function for participants in this sample. |
|
Rini, 2015
|
Type of study: RCT
Setting: Recruitment through medical and surgical clinics
Country: U.S.A.
Source of funding: National Institute of Arthritis and Musculoskeletal and Skin Diseases
|
Inclusion criteria: - ≥18 years old with knee or hip OA, confirmed radiographically or by physician; - frequent OA pain
Exclusion criteria: - significant cognitive impairment; - less than 7th grade reading proficiency; - medical comorbidities that interfered with their ability to complete the intervention or that indicated they had a pain-related condition in addition to OA
N total at baseline: 113 Intervention: n=58 Control: n=55
Important prognostic factors2: Age (years (SD)): I: 68 (8) C: 67 (11)
Sex (Female I: 46 (79%) C: 45 (82%)
Participants in the two treatment conditions did not differ at baseline in terms of sociodemographic, medical, or study outcome variables |
Describe intervention (treatment/procedure/test):
PainCOACH, an in-person Pain Coping Skills Training (PCST) protocol for delivery via the Internet. Eight modules, to be completed in a self-directed manner (i.e., without therapist contact) at the rate of one per week. Each module took 35-45 minutes to complete and provided interactive training in a cognitive or behavioral pain coping skill
|
Describe control (treatment/procedure/test):
Care as usual. |
Length of follow-up: 11 weeks (intermediate term)
Loss-to-follow-up: I: 1/58 (2%) Reasons for withdrawal: not reported
Control: N=3/55 (5%) Reasons for withdrawal: not reported
Incomplete outcome data: Intervention: N (%) Not reported
Control: N (%) Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
N total at follow-up: 109 Intervention: 57 Control: 52
AIMS2 Pain subscale Mean (SD): I: 4.07 (1.99) C: 4.62 (1.79) SMD (SE): -0.29 (0.19), p=0.14
AIMS2 Functioning subscale Mean (SD) I: 1.62 (1.19) C: 1.75 (1.24) SMD (SE): -0.11 (0.19)
|
Results showed a significant sex by treatment interaction, F(1,107)=12.96; p<.001. Women in the PainCOACH condition had significant reductions in pain from baseline (M=4.02; Tukey adjusted p=.036). There were no corresponding significant reductions in pain for women in the control condition. |
|
Rosemann, 2007 |
Type of study: cluster-RCT
Setting: General Practice
Country: Germany
Source of funding: not reported
|
Inclusion criteria: - ≥18 years; - diagnosed with OA in the knee or the hip according to the American College of Rheumatology criteria.
Exclusion criteria: None reported
N total at baseline: 1,021 Intervention-1: n=345 Intervention-2: n=344 Control: n=332
Important prognostic factors2: Age (years (SD)): I-1: 66 (15) I-2: 66 (15) C: 66 (15)
Sex (Female I-1: 214 (62%) I-2: 231 (67%) C: 229 (69%)
No significant differences between the control group versus intervention group 1 and intervention group 2. |
Describe intervention (treatment/procedure/test):
Intervention 1: only GPs providing information on arthritis self-management. Intervention 2: additional case management conducted via telephone by a practice nurse. (used for comparison in meta-analysis)
GPs in intervention group 1 and 2 participated in 2 interactive peer group meetings of 8 hours each. In addition to the meetings, GPs received a written summary of evidence-based treatments for OA in a primary care setting. Furthermore, GPs received written material for patients: a leaflet providing information about the cause and the treatment possibilities as well as coping strategies. GPs also received booklets and audio CDs with a detailed exercise program, similar to some ASMPs, and were asked to provide these materials to every included patient.
Practice nurses from intervention group II also participated in a course. Telephone calls with the patients were conducted at least every 4 weeks. |
Describe control (treatment/procedure/test):
Not described – Assumption: care as usual. |
Length of follow-up: 9 months (intermediate term)
Loss-to-follow-up: I-1: 84 (24%) I-2: 68 (20%) Reasons for withdrawal: did not return questionnaires
Control: N=74 (22%) Reasons: did not return questionnaires
No statistically significant differences were found between the dropouts and the remaining subjects on baseline factors.
Incomplete outcome data: Intervention: N (%) Not reported
Control: N (%) Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
N total at follow-up: I-1: 261 I-2: 276 C: 258
IPAQ score physical activity Mean (95% CI): I-1: 131.5 (104.3, 157.2), p=0.78 I-2: 133.4 (118.6, 148.2), p=0.67 C: 125.2 (103.8, 146.6) SMD (SE) I-2 vs C: 0.05 (0.09), p=0.53
Health services utilization Mean (95% CI) GP contacts I-1: 0.12 (-0.24, 0.36), p=0.34 I-2: 0.11 (-0.23, 0.34), p=0.82 C: 0.22 (-0.21, 0.45) SMD (SE) I-2 vs C: -0.03 (-0.09)
Referrals to orthopaedics Mean (95% CI) I-1: 0.09 (0.02, 0.15), p=0.15 I-2: 0.24 (-0.16, 0.31), p=0.04 C: 0.01 (-0.05, 0.06)
Radiographs Mean (95% CI)I -1: 0.07 (-0.01, 0.15), p=0.05 I-2: 0.09 (0.02, 0.16), p=0.03 C: -0.06 (-0.13, 0.01)
Physiotherapy Mean (95% CI)I -1: 0.07 (-.04, 0.18), p=0.24 I-2: 0.14 (0.02, 0.23), p=0.13 C: 0.04 (-0.05, 0.12)
Prescriptions (Mean (95% CI)) Paracetamol: I-1: 7.43 (3.33, 11.53), p<0.001 I-2: 6.89 (2.93, 10.70), p<0.001) C: 1.31 (-3.01, 0.39)
Opioids I-1: 4.33 (3.32, 5.34), p<0.08 I-2: 8.80 (5.02, 12.58), p<0.001) C: 0.98 (-1.32, 3.28)
NSAID I-1: 4.30 (2.82, 5.78)<0.08 I-2: 6.54 (4.54, 8.54), p<0.02) C: 2.31 (0.91, 3.71) |
Multifaceted educational interventions with GPs provided through quality circles had no impact on patients’ QOL or physical activity. However, the interventions seemed to reduce certain aspects of health service utilization, such as radiographs, and to change prescription patterns |
|
Somers, 2012 |
Type of study: RCT
Setting: outpatient section of Clinic at a university medical center
Country: U.S.A.
Source of funding: National Institutes of Health
|
Inclusion criteria: 1) Knee pain on most days of the month for at least the prior 6 months; 2) over the age of 18; 3) overweight or obese; 4) met the American College of Rheumatology criteria for OA and had radiographic evidence of OA affecting one or both knees (knee x-rays were graded by an experienced reader) on the basis of the Kellgren-Lawrence grading system; 5) no other major weight bearing joint affected by OA; 6) OA of the knee(s) was considered the medical condition that contributed most to limitations in their daily function as assessed by the healthcare provider.
Exclusion criteria: 1) medical condition that increased risk of a significant adverse health event during physical activity; 2) another known organic disease that would contraindicate safe participation in the study; 3) a non-OA inflammatory arthropathy or another arthritic disorder; 4) used oral corticosteroids regularly; or 5) were participating in a regular exercise or weight loss program
N total at baseline: 232 Intervention: n=62 Control: PCST only: n=60 BWM only: n=59 Standard care: n=51
Important prognostic factors2: Age (years) (SD): Intervention: 57 (9) Control: PCST only: 58 (11) BWM only: 58 (11) Standard care: 58 (10)
Sex (Male) Intervention: 5 (8%) Control: PCST only: 20 (33%)) BWM only: 12 (20%) Standard care: 11 (22%) |
Describe intervention (treatment/procedure/test):
Combined pain coping skills training (PCST) and lifestyle behavioral weight management BWM intervention.
Program of 24 weeks. PCST: During the first 12 weeks, 60-minute group sessions were held weekly. For the last 12 weeks, 60-minute group sessions were held every other week. PCST was delivered by clinical psychologists with prior PCST experience.
BMW: During the first 12 weeks, 60 minute group sessions were held weekly. Additionally, three 90-minute supervised exercises sessions were held each week of the first 12 weeks. During the last 12 weeks, 60-minute group sessions were held every other week; there were no supervised exercise sessions. BWM was delivered by psychologists with a specialty in behavioral medicine and prior experience in behavioral weight management protocols.
Participants in all treatment conditions received six monthly maintenance calls focused on reinforcing the use of skills learned during the program.
|
Describe control (treatment/procedure/test):
- PCST-only; - BWM-only; - standard care |
Length of follow-up: 24 months (long term)
N at Follow-up: Intervention: n=47 (76%) Control: PCST only: n=39 (65%) BWM only: n=40 (68% Standard care: n=51 (37 (73%) Reasons for withdrawal: no time, lost to contact, health concerns, moved, family reasons, dissatisfied.
Dropout rates did not vary significantly across treatment conditions (chi-square = 2.0; p = 0.57). Participants who dropped out had higher baseline pain scores (p = 0.02) and weight (p = 0.03).
Incomplete outcome data: Intervention: N (%) Not reported
Control: N (%) Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
WOMAC subscale pain: I: 27.2 (23.9 tot 30.4) PCST only: 34.5 (30.8 tot 38.2) mean diff: 7.3(1.3 tot 13.3) BWM only: 35.5 (31.9 tot 39.0) mean diff: 8.3(2.5 tot 14.1) standard care: 38.0 (34.1 tot 41.8) mean diff: 10.8 (4.6 tot 16.9)
WOMAC subscale function: I: 25.1 (22.1 tot 28.3) PCST only: 35.2 (31.8 tot 38.6) mean diff: 10.0 (4.4 tot 15.6) BWM only: 36.0 (32.6 tot 39.3) mean diff: 10.8 (5.3 tot 16.2) standard care: 37.5 (33.9 tot 41.2) mean diff: 12.4 (6.5 tot 18.2)
Function performance Normal gait velocity I: 1.2 (1.1–1.2) PCST only: 1.1 (1.1 to 1.2) mean diff: −.04 (−.10 to .01) BWM only: 1.2 (1.1 to 1.2) mean diff: −.01 (−.06 to .03) standard care: 1.2 (1.1 to 1.2) mean diff: −.01(−.05 to .04)
|
A behavioral intervention that simultaneously addresses pain and weight is more effective in improving pain and other outcomes than behavioral interventions that address pain or weight alone.
|
|
Self-management programmes versus information only |
|||||||
|
De Rezende, 2016 |
Type of study: RCT
Setting: Department of Orthopedics and Traumatology in a tertiary hospital
Country: Brazil
Source of funding: The author(s) received no financial support for the research, authorship, and/or publication of this article.
|
Inclusion criteria: - outpatient aged 45 years or older with knee OA according to the American College of Rheumatology clinical and radiological definition; - had received standard care for OA in the past 6 months; - no other rheumatologic disease; - knee pain rated above 30 mm on a numerical scale and necessitating drug treatment.
Exclusion criteria: - Participating in another program with nutritional education, engaging in another clinical trial, or undergoing surgery during the study not related to knee OA that would prevent daily regular exercises.
N total at baseline: 228 Intervention: 150, divided in 6 groups Control: 48
All groups were similar in gender, race, age, affected side, and OA severity. |
Describe intervention (treatment/procedure/test):
3 groups: according to the intervals of 1, 2, and 3 months between the 2 days of lectures and 2 subgroups (A and B, according to the use of bimonthly telephone calls or no telephone calls, respectively) of 28 or 29 participants. All groups received a booklet on OA and a video with all of the lectures. Patients in groups 1 to 3 were asked to come to the hospital on 2 specific Saturdays according to the intervals of each group. |
Describe control (treatment/procedure/test):
Control group watched the video once at the hospital and only then received the take-home material. |
Length of follow-up: 12 months (intermediate term)
Loss-to-follow-up: Intervention: N=
Control: N= (%) Reasons: not reported
Reasons for withdrawal: weather conditions that prevented access to the hospital, being unable to attend classes when they were scheduled, not interested, living too far away.
Incomplete outcome data: Intervention: N (%) Not reported
Control: N (%) Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
Outcomes not reported for interventions vs control, but across 8 different groups.
|
- Interval between classes (1, 2, or 3 months) is not an important issue. - Telephone calls did not significantly improve the results |
|
Schlenk, 2011 |
Type of study: RCT (feasibility)
Setting: outpatient section of Clinical Research Center at a university medical center
Country: U.S.A.
Source of funding: not reported
|
Inclusion criteria: - age 50 years or older - a physician-confirmed diagnosis of OA of the knee - overweight or obese
Exclusion criteria: Currently doing lower-extremity exercise ≥ 2 times per week; currently fitness walking ≥ 90 minutes per week; having current knee conditions such as meniscus tears, knee ligament ruptures, or previous unilateral knee replacement surgery; scheduled to undergo a major surgical procedure in the next 6 months; currently participating in a drug or psychoeducational trial.
N total at baseline: 26 Intervention: 13 Control: 13
Important prognostic factors2: Age (SD): 63.2 (9.8)
Sex, M:F 1:25 |
Describe intervention (treatment/procedure/test):
The first session consisted of a standardized educational program on sedentary lifestyles and obesity as risk factors for cardiovascular disease, and OA of the knee and its treatment plus distribution of educational brochures followed by a physical therapy evaluation. Subjects then completed five weekly sessions of lower-extremity flexibility and strengthening exercise guided by a physical therapist. Subjects also received a lower extremity exercise videotape (Schlenk et al., 1999; University of Pittsburgh Medical Center Health System, 1999), written exercise guide, and diagrams of the exercise for a modelling strategy based on self-efficacy. During weeks 8–24, subjects received nine biweekly telephone calls by a registered nurse to monitor progress |
Describe control (treatment/procedure/test):
Usual care initially, and at the end of the 6-month intervention period controls met with the physical therapist for a physical therapy evaluation, brief one-time instruction on lower-extremity exercise, and educational materials. The group received no self-efficacy-based adherence counseling. |
Length of follow-up: 6 months (intermediate term)
Loss-to-follow-up: Intervention: N= 2 (15%) Reasons for withdrawal: not reported
Control: N= 3 (23%) Reasons: not reported
No statistically significant differences were found between the dropouts and the remaining subjects on baseline factors.
Incomplete outcome data: Intervention: N (%) Not reported
Control: N (%) Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
N in analysis: I: 11 C: 10
WOMAC subscale function Mean (SD): I: 18.9 (13.2) C: 21.6 (10.3), n.s. SMD (SE): -0.22 (0.44), p=0.62
Function performance 6-minute walk (yards): Mean (SD): I: 480.0 (94.9) C: 502.3 (104.3), n.s. SMD (SE): -22.3 (43.7), p=0.61
SPPB: Mean (SD): I: 11.6 (1.4) C: 11.5 (2.2), n.s.
|
|
|
Self-management programmes versus alternate interventions |
|||||||
|
Farr, 2010 |
Type of study: RCT
Setting: university campus Country: U.S.A.
Source of funding: National Institutes of Health/National Institute of Arthritis and Musculoskeletal and Skin Diseases |
Inclusion criteria: 1) age between 35 and 68 years; 2) pain on 4 or more days of the week in one or both knees for at least 4 months during the previous year; 3) less than 5 years' symptom duration; 4) radiographic status of grade II OA (and no higher) in at least one knee; 5) disability due to knee OA
Exclusion criteria: None reported
N total at baseline: 293 Intervention: n=98 Control: RT only: n=95 RT + SM: n=100
Important prognostic factors2: Age (years) (SD): 55 (7)
Sex (M:F): 26:74
No significant (p>.05) difference among groups or between completers (n=171) and noncompleters (n=83) at baseline for any variables. |
Describe intervention (treatment/procedure/test):
The 9-month program began with 12 weekly, 90-minute classroom sessions in which participants completed SM education modules. Classroom sessions were followed by 24 weeks of a structured telephone intervention program that reinforced SM skills
|
Describe control (treatment/procedure/test):
Alternative interventions: RT only (used for comparison in meta-analysis) RT + SM
Resistance training (RT): participants met with certified physical trainers 3 times per week for 9 months, with a minimum of 1 day of rest between training sessions, to complete a 1-hour exercise regimen that emphasized RT.
The RT groups were combined because both groups of participants engaged in the RT intervention and no significant (p>.05) group differences using independent t tests were observed for any variables at any time point. |
Length of follow-up: 9 months (intermediate term)
Loss-to-follow-up: Intervention: n=25 (26%) Control: RT only: n=23 (24%) RT + SM: n=24 (24%) Reasons for withdrawal: not interested, lost to follow-up, health problems, time commitment, personal, leaving local area, did not receive allocated intervention.
Incomplete outcome data: Intervention: Intervention: n=16/73 (22%) Control: RT only: n=20/72 (28%) RT + SM: n=14/76 (18%)
|
Outcome measures and effect size (include 95%CI and p-value if available):
WOMAC Pain (mean (SD)): I: 62.9 (81.0) RT only: 48.6 (61.3) RT + SM: 56.2 (75.3) SMD (SE): 0.19 (0.29), p=0.50
Level of moderate- and vigorous-intensity physical activity (min/day (SD)): I: 24.8 (18.7) Control: RT only: 27.7 (20.0) RT + SM: 31.8 (16.8) SMD (SE): -0.15 (0.29) |
No significant (p>.05) differences in VPA among the intervention groups at any time interval. The SM group participants increased their MVPA by 22% at 3 months (P=.023, effect size (d)=0.25) and by 2% at 9 months (P=.80, effect size (d)=0.03) compared with baseline levels.
|
|
Self-management programmes versus acupuncture |
|||||||
|
Excluded from the literature review in the guideline |
|||||||
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors ((potential) confounders)
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Deelvraag 2
Risk of bias table for intervention studies (deelvraag-2)
Research question: What is the value of dietary weight loss in overweight or obese adults with osteoarthritis of hip or knee?
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Messier 2004 |
random assignments computer-generated with blocks |
Unlikely |
Likely, it was not possible to blind participants |
Likely, not possible to blind care providers |
Likely for patient-reported outcomes |
Unlikely |
Unclear |
Unlikely |
|
Miller 2006 |
no details available ‘participants were randomized’ |
Unclear |
Likely, it was not possible to blind participants |
Likely, not possible to blind care providers |
Likely for patient-reported outcomes |
Unlikely |
Unlikely |
Likely, ‘’the number of participants tested for each dependent variable, varies’’; not all randomized participants were included in the analysis |
|
Messier 2013 |
A stratified-block randomization method, stratified by BMI and sex |
Unlikely |
Likely, it was not possible to blind participants |
Likely, not possible to blind care providers |
Likely for patient-reported outcomes |
Unlikely |
Unclear |
Unlikely |
|
Christensen 2005 |
randomization was done in a stratified way, according to gender, BMI and age |
Unlikely |
Likely, it was not possible to blind participants |
Likely, not possible to blind care providers |
Likely for patient-reported outcomes |
Unlikely |
Unclear, based on completers only (~10% drop-outs in both groups) |
Unclear, no ITT but based on completers |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules..
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Evidence table for intervention studies (deelvraag-2)
Research question: What is the value of dietary weight loss in overweight or obese adults with osteoarthritis of hip or knee?
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Miller, 2006 |
Type of study: RCT
Setting: ‘Treatment center’
Country: USA
Source of funding: This project was funded by SlimFast Nutrition Institute, the Wake Forest University, Claude D. Pepper Older American Independence Center, and the Wake Forest University General Clinical Research Center |
Inclusion criteria: -BMI ≥30.0 kg/m2 -≥60 years of age -symptomatic knee OA -self-reported difficulty, attributed to knee pain, in performing at least one of the following activities: lifting and carrying groceries, walking one-quarter mile, getting in and out of a chair, or going up and down stairs. Exclusion criteria: -unstable medical condition -condition where rapid weight loss or exercise is contraindicated (e.g., unstable angina, frailty, advanced osteoporosis). -individuals who were unwilling to modify diet or physical activity patterns or would not be able to comply with the intervention because of food allergies or reactions to the meal replacements, - individuals living>50 miles from the treatment center, - individuals with known excessive alcohol consumption
N total at baseline: Intervention: 44 Control: 43
Important prognostic factors2: Age ± SD: I:69.3 (0.9) C: 69.7 (0.9)
Sex: I: 36.4% M C: 39.5% M
|
Weight Loss group (WL)
The weight loss goal was 10% loss during 6 months of trial: partial meal replacements, nutrition education, and lifestyle behaviour modifications; providing daily energy deficit of 1000 kcal of dietary intake predicted energy expenditure (predicted resting metabolism X 1.2 activity factor); lowest levels 1100 kcal for women and 1200 kcal for men. The calorie distribution goal for each individual was~20% from protein, ~25% from fat, and ~55% from carbohydrates. A maximum of two meal replacements per day (shakes and bars; SlimFast Foods Co., Englewood, NJ) were provided based on the participant’s tolerance for the product. For the third meal, a weekly menu plan with recipes was given for participants to follow. They were free to choose the meal they preferred that allowed them to stay within the daily calorie goals. This meal of traditional foods was typically consumed in the evening, contained 500 to 750 kcal, and was low in fat and high in vegetables. Recommended snacks included fruits or vegetables providing ~100 to 120 kcal. The food plan was tailored to allow for individual preferences for various food items.
Behavioral and educational sessions were held on a weekly basis for those in the WL group. These sessions were conducted for 60 minutes in a group (n = 6 to 12 per group) and individual format and were led by a registered dietitian and exercise physiologist with expertise in behavior therapy with older adults. All participants were instructed in behavior modification with advice on food selection, meal portion, dietary fat control, relapse prevention, and self-monitoring techniques. Throughout the duration of the study, body weight was monitored and recorded in these weekly sessions. If an individual was not meeting weight loss goals, energy intake was individually modified accordingly to produce the desired rate of weight loss. All participants in the WL group were taught self-monitoring techniques for diet and body weight. |
Weight Stable group (WS)
Participants randomized to this arm of the study were the attention control group and met bimonthly in a group format that included presentations on general health, including OA and exercise. Individuals were weighed at these meetings and encouraged to maintain their weight throughout the 6-month study. Bimonthly newsletters were sent to participants in months 1, 3, and 5 describing other health facts on topics such as nutrition, pertinent disease topics, aging, and other health issues in older adults. At the close of the study, individuals in the WS control group were provided with weight loss information on diet and exercise, a 2-month supply of meal replacements and snack food provisions, a personalized exercise consultation, and 1 month of the facility-based exercise program as an incentive and reward for participation in the study |
Length of follow-up: 6 months
Loss-to-follow-up: Total: 8 (9%) Intervention: 2/43 Reasons: moving from area, medical condition unrelated to study intervention, transportation issues, and undisclosed personal reasons.
Control: N (%): 6/44 Most common reason: participants wanted to be randomized to the WL group.
Incomplete outcome data: Intervention: 10/43
Control: 2/44
|
Outcome measures and effect size (include 95%CI and p-value if available):
N in analysis: I: 33; C: 41
Baseline vs follow-up WOMAC subscale pain (lower score is better) I: 6.5 (0.5) vs 4.1 (0.4) C: 6.3 (0.5) vs 6.1 (0.5); p<0.05
WOMAC function (lower score is better) I: 24.0 (1.5) vs 15.2 (1.5) C: 26.7 (1.9) vs 23.8 (2.0); p<0.05
WOMAC total (lower score is better) I: 33.9 (2.0) vs 22.3 (1.9) C: 36.6 (2.5) vs 33.0 (2.6); p<0.05
Physical performance Stair-climb time I: 10.7 (0.8) vs 11.2 (1.2) C: 9.2 (0.5) vs 9.37 (0.76)
6-min walk (m) I: 426 (11) vs 430 (13) C: 435 (11) vs 430 (13)
|
Authors’ conclusions: the WL group obtained a mean weight loss of 8.5% and showed higher physical function assessed by self-reported and performance tasks compared with WS controls. Correlation analysis showed that greater weight loss was associated with better improvements in function (r~0.3-0.5) |
|
Messier, 2004 |
Type of study: RCT (ADAPT)
Setting: Claude D. Pepper Older Americans Independence Center of Wake Forest University
Country: U.S.A.
Source of funding: NIH |
Inclusion criteria: 1) age ≥60 years; 2) body mass index ≥28 kg/m2; 3) knee pain on most days of the month; 4) sedentary activity pattern with 20 minutes of formal exercise once weekly for the past 6 months; 5) selfreported difficulty in at least one of the g activities ascribed to knee pain; 6) radiographic evidence of grade I–III tibiofemoral or patellofemoral OA based on weight-bearing anteroposterior and sunrise view radiographs
Exclusion criteria: 1) serious medical condition that prevented safe participation in an exercise program; 2) a Mini-Mental State Examination score of ≥24; 3) inability to finish the 18-month study or unlikely to be compliant; 4) inability to walk without a cane or other assistive device; 5) participation in another research study; 6) reported alcohol consumption of>14 drinks per week; 7) ST segment depression of at least 2 mm at an exercise level of 4 METS or less, hypotension, or complex arrhythmias during a graded exercise test; 8) inability to complete the protocol, in the opinion of the clinical staff, because of frailty, illness, or other reasons.
N total at baseline: Intervention: 82 Control: 78
Important prognostic factors2: Age ± SD: I: 68 (0.7) C: 69 (0.1)
Sex: I: 28% M C: 32% M |
Dietary intervention with the aim to produce and maintain an average weight loss of 5% during the 18-month intervention period. Based on principles from the group dynamics literature and social cognitive theory and was divided into 3 phases: intensive (months 1–4), transition (months 5–6), and maintenance (months 7–18). |
Healthy lifestyle control group (‘a usual-care comparison group). Designed to provide attention, social interaction, and health education. |
Length of follow-up: 18 months
Loss-to-follow-up: Intervention: 19/82 Reasons not reported
Control: 11/78 Reasons not reported
Incomplete outcome data: Intervention: not reported
Control: not reported
Retention of participants was not significantly different between the groups (for healthy lifestyle, 86%; for diet only, 77%.
|
Outcome measures and effect size (include 95%CI and p-value if available):
N in analysis: I: 63; C: 67
Baseline vs follow-up WOMAC subscale pain (lower score is better) I: 6.58 (0.40) vs 5.51 (0.45) C: 7.25 (0.39) vs 6.02 (0.45)
Physical performance Stair-climb time I: 9.74 (0.65) vs 8.43 (0.78) C: 9.59 (0.64) vs 9.37 (0.76)
6-min walk (m) I: 426 (11) vs 430 (13) C: 435 (11) vs 430 (13)
Adherence I: 72% (defined as attendance at nutrition classes) C: 77% for the first 3 months (defined as attendance at the 3 healthy lifestyle classes) and 73% for months 4–18 (defined as the percentage of follow-up calls that were successfully completed). |
|
|
Messier, 2013 |
Type of study: RCT
Setting: University
Country: U.S.A.
Source of funding: National Institutes of Health, National Institute of Arthritis and Musculoskeletal and Skin Diseases, National Institute on Aging, National Center for Research Resources—and by General Nutrition Centers |
Inclusion criteria: Kellgren-Lawrence14 grade 2 or 3 (mild or moderate) radiographic tibiofemoral OA or tibiofemoral plus patellofemoral OA of one or both knees, pain on most days due to knee OA, a body mass index (BMI) from 27 through 41 (calculated as weight in kilograms divided by height in meters squared), and a sedentary lifestyle (< 30 minutes per week of formal exercise for the past 6 months)
Exclusion criteria: Reported elsewhere, see article for details.
N total at baseline: Intervention: 152 Control: 150
Important prognostic factors2: Age ± SD: I: 66 (6) C: 66 (6)
Sex: I: 29% M C: 28% M
|
Weight loss intervention A mean group loss of at least 10% of baseline weight, with a desired range between 10% and 15%. The diet was based on partial meal replacements, including up to 2 meal-replacement shakes per day (Lean Shake; General Nutrition Centers). For the third meal, participants followed a weekly menu plan and recipes that were 500 to 750 kcal, low in fat, and high in vegetables. As follow-up progressed, fewer meal replacements were consumed. |
Exercise intervention 1 hour on 3 days/ week for 18 months.
|
Length of follow-up: 18 months
Loss-to-follow-up: Intervention: N= 23/152 Reasons: cancellations, no contact, unhappy with group, personal or health issues, moved, no longer interested
Control: N= 22/150 Reasons: cancellations, no contact, unhappy with group, personal or health issues, moved, no longer interested
Incomplete outcome data: Intervention: 5/129
Control: 6/134
Retention did not differ significantly among the groups and noncompleters did not differ significantly from completers in terms of age, sex, race, number of comorbidities, initial radiographic score, knee pain, or physical function.
|
Outcome measures and effect size (include 95%CI and p-value if available):
N in analysis: I: 124; C: 128
Baseline vs follow-up WOMAC subscale pain (lower score is better) I: 6.6 vs 4.8 C: 6.1 vs 4.4
WOMAC function (lower score is better) I: 24.8 vs 17.7 C: 23.1 vs 17.6
Physical performance 6-min walk (m) I: 475 vs 502 C: 480 vs 525
Adherence I: (number of individual and class sessions attended/number scheduled) was 61%. C: (number of sessions I: completed/ number scheduled) was 66% for the first 6 months and 54% for 18months. |
|
|
Christensen 2005
|
RCT
Outpatient clinic Dept Rheumatology; Denmark |
Inclusion: Overweight, age>18 age, primary knee OA (ACR criteria), KL-grade 2 or 3, BMI>28; clear, unequivocal motivation for weight loss
Exclusion: history or active presence of other rheumatic diseases that might be responsible for secondary OA; diabetes mellitus; other endocrine disorders or substantial abnormalities in hematological, hepatic, renal or cardiac functions
N total at baseline: 96 patients Intervention: 44 Control: 45 9 dropouts: 4/5 in intervention and control
Analytic sample: 96 patients Intervention: 40 Control: 40
Important prognostic factors2: Age ± SD: I: 60.5 (11.6) C: 64.6 (10.4) Sex: I: 12% M C: 10% M BMI I: 36.3 C: 35.5 Weight (kg) I: 96.4 C: 97.1 |
LED (low-energy diet) 3.4 MJ/day n=40
LED: nutrition powder in water, taken as six daily meals, meeting all recommendations for daily intake of high quality protein; 37 energy percent from protein, 47% from carbohydrate, 16% from vegetable fat, and fibers from oat-bran (15 g/day); nutritional instruction and behavioral therapy by experienced dietician at weekly sessions (1.5 h/week)
|
conventional diet 5 MJ/day n=40
conventional diet: nutritional advice 2-h session at baseline, recommending ordinary foods in amounts, which would provide patients with approximately 5 MJ/day; patients received ideas for diet plans in a booklet; no contact with the dietician after the dietary consultation at baseline |
Length of follow-up: 2 months (8 weeks)
Loss-to-follow-up: Intervention: N= 4/44 Control: N= 5/45
analyses based on completers |
Outcome measures and effect size (include 95%CI and p-value if available):
N in analysis: I: 40; C: 40
WOMAC pain (lower = better) change from baseline (SD) Diff (95%CI) I/C: -57.0 (16.9) vs -29.8 (17.7) Diff= -27.2 (-64.0; 9.7) p= 0.15 (NS)
WOMAC funct (lower = better) change from baseline (SD) Diff (95%CI) I/C: -252.5 (49.6) vs -85.6 (51.9) Diff= -166.9 (-274.5; -59.3) p=0.003
WOMAC stiffn (lower = better) change from baseline (SD) Diff (95%CI) I/C: -22.6 (7.2) vs -10.2 (7.4) Diff= -12.4 (-27.7; 2.8) p= 0.11 (NS)
|
|
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors ((potential) confounders)
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 19-11-2018
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep in stand gehouden. Uiterlijk in 2024 bepaalt het bestuur van de Nederlandse Orthopaedische Vereniging (NOV) of deze richtlijn (module) nog actueel is. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NOV is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Diagnostiek heup- of knieartrose |
NOV |
2019 |
2021 |
eens in twee jaar |
NOV |
beschikbaarheid nieuwe criteria voor vroeg diagnostiek |
|
Zelfmanagement educatie en informatie |
NOV |
2019 |
2024 |
eens in de vijf jaar |
NOV, NHG, NVR, VRA, KNGF |
Lopend onderzoek, beschikbaarheid nieuwe interventies |
|
submodule Gewichtsverlies |
NOV |
2019 |
2024 |
Eens in de vijf jaar |
NOV, NHG |
Onderzoek naar effectiviteit van gewichtsverlies |
|
Oefentherapie bij heup- of knieartrose |
NOV |
2019 |
2024 |
eens in vijf jaar |
(NOV en KNGF of de werkgroep) |
lopend onderzoek |
|
Pijnmedicatie |
NOV |
2019 |
2024 |
eens in de vijf jaar |
NOV |
Lopend onderzoek, beschikbaarheid nieuwe middelen |
|
Intra-articulaire injecties |
NOV |
2019 |
2024 |
eens in de vijf jaar |
NOV |
Lopend onderzoek, beschikbaarheid nieuwe middelen |
|
Knie kniebraces en orheses |
NOV |
2019 |
2024 |
eens in de vijf jaar |
NOV |
Lopend onderzoek, beschikbaarheid nieuwe middelen |
|
Beleid bij specifieke subgroepen |
NOV |
2019 |
2024 |
eens in de vijf jaar |
NOV |
Lopend onderzoek |
|
Geïntegreerd beleid |
NOV |
2019 |
2024 |
eens in de vjif jaar |
NOV |
Lopend onderzoek, transmuraal overleg |
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
*De KNMP geeft de richtlijn 'bestuurlijke ondersteuning'
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). Patiëntenparticipatie bij deze richtlijn werd mede gefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
Doel en doelgroep
Doel
Doel is een multidisciplinaire richtlijn voor de conservatieve behandeling van heup- en knieartrose. De richtlijn beoogt een leidraad te geven voor de dagelijkse zorgpraktijk bij patiënten met artrose aan heup of knie, in eerste en tweede lijn. In de conclusies wordt aangegeven wat de wetenschappelijke stand van zaken is. De aanbevelingen zijn gericht op optimaal medisch handelen en zijn gebaseerd op de resultaten van wetenschappelijk onderzoek en overwegingen van de werkgroep, waarbij voor zover mogelijk de inbreng door patiënten is meegenomen (patiënten perspectief). Het doel is een hogere kwaliteit en meer uniformiteit in behandelingsstrategie, en het verminderen van praktijkvariatie. Daarvoor zijn duidelijke verwijscriteria van eerste naar tweede lijn noodzakelijk. Doel van de richtlijn is met name ook het verminderen van pijn en verbeteren van de gewrichtsfunctie door optimalisatie van de zorg. Het identificeren van kennislacunes zal richting kunnen geven aan nieuw wetenschappelijk onderzoek en nieuwe ontwikkelingen. Tot slot is naar aanleiding van de noodzaak tot beheersing van de verdere groei van kosten in de gezondheidzorg aandacht besteed aan kosten en kosteneffectiviteit.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg en patiëntvoorlichting voor patiënten met (verdenking op) artrose aan heup of knie: orthopedisch chirurgen, reumatologen, radiologen, revalidatieartsen, apothekers, fysiotherapeuten, oefentherapeuten Cesar of Mensendieck*, ergotherapeuten, huisartsen, klinisch geriaters, specialisten ouderengeneeskunde, anesthesiologen, sportartsen, arbo-artsen en bedrijfsartsen, en bijvoorbeeld ook alle artsen (niet) in opleiding voor huisarts en genoemde specialisten, en verpleegkundig specialisten en de physician assistants op dit gebied.
*waar oefentherapeut staat in de rest van het document wordt bedoeld oefentherapeut Cesar of Mensendieck
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2015 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van relevante specialismen die betrokken zijn bij de zorg voor personen met artrose aan heup of knie.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende drie jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- A.A. Polak, orthopedisch chirurg, Sint Franciscus Gasthuis, Rotterdam (voorzitter); Nederlandse Orthopaedische Vereniging;
- Prof. dr. S.M.A. Bierma-Zeinstra, hoogleraar Artrose, afdeling Huisartsgeneeskunde en Orthopedie, Erasmus MC, Universitair Medisch Centrum, Rotterdam; Nederlandse Orthopaedische Vereniging;
- J. Hoogmoed, klinisch geriater, SJG Weert, Weert; Nederlandse Vereniging voor Klinische Geriatrie;
- H. Jessen, NVA, anesthesioloog/ pijnspecialist, Kliniek ViaSana, Mill; Nederlandse Vereniging voor Anesthesiologie (mandaat tot 1 november 2017);
- J.W. Kallewaard, anesthesioloog/ pijnspecialist, Rijnstate Arnhem, AMC Amsterdam; Nederlandse Vereniging voor Anesthesiologie (mandaat vanaf 1 augustus 2018);
- L. Elzinga, anesthesioloog/ pijnspecialist, Bravis Ziekenhuis Roosendaal, Roosendaal; Nederlandse Vereniging voor Anesthesiologie (mandaat vanaf 1 augustus 2018);
- Prof. dr. G. Kloppenburg, reumatoloog, Leids Universitair Medisch Centrum LUMC, Leiden; Nederlandse Vereniging van Reumatologie;
- J.S. van der Kraan, patiëntvertegenwoordiger, beleidsmedewerker Patiëntenfederatie Nederland, Utrecht; Patiëntenfederatie Nederland;
- Dr. E.H.G. Oei, radioloog, Erasmus MC, Universitair Medisch Centrum, Rotterdam; Nederlandse Vereniging voor Radiologie;
- S. Spruijt, orthopedisch chirurg, HagaZiekenhuis, Den Haag; Nederlandse Orthopaedische Vereniging;
- Prof. dr. T.P.M. Vliet Vlieland, Leids Universitair Medisch Centrum LUMC, Leiden; Koninklijk Nederlands Genootschap voor Fysiotherapie;
- C.M.J. Wildervanck-Dekker, huisarts en kaderarts bewegingsapparaat, Julius Gezondheidscentrum Leidsche Rijn, De Meern; Nederlands Huisartsen Genootschap (mandaat tot 1 juni 2018);
- Dr. T. Kuijpers, epidemioloog, senior wetenschappelijk medewerker Nederlands Huisartsen Genootschap, Utrecht; Nederlands Huisartsen Genootschap (mandaat vanaf 1 juni 2018).
Klankbordgroep
- R. Hebing, poliklinisch apotheker, Apotheek Reade, Amsterdam; Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie; Nederlandse Vereniging van ZiekenhuisApothekers;
- T. Mesman, ergotherapeut, Revalidatie Centrum Reade, Amsterdam; Ergotherapie Nederland;
- Dr. L.A.M. Elders, bedrijfsarts, ConsuloBV, Rotterdam; Nederlandse Vereniging voor Arbeids- en Bedrijfsgeneeskunde;
- Dr. A.M. Boonstra, revalidatiearts, Revalidatie Friesland, Beetsterzwaag; Nederlandse Vereniging van Revalidatieartsen;
- M. Post, beleidsmedewerker Ontwikkeling & Wetenschap VvOCM, Utrecht; Vereniging van Oefentherapeuten Cesar en Mensendieck.
Met ondersteuning van
- Dr. K.N.J. Burger, epidemioloog, senior adviseur Kennisinstituut Federatie van Medisch Specialisten;
- Dr. J.S. Boschman, adviseur Kennisinstituut Federatie van Medisch Specialisten;
- Dr. M.L. Molag, adviseur Kennisinstituut Federatie van Medisch Specialisten;
- E.A. Rake (MSc), junior adviseur Kennisinstituut Federatie van Medisch Specialisten;
- M.S. Oerbekke, adviseur Kennisinstituut Federatie van Medisch Specialisten;
- M. Wessels (MSc), medisch informatiespecialist, Kennisinstituut Federatie van Medisch Specialisten;
- N.F. Bullock, secretaresse, Kennisinstituut Federatie van Medisch Specialisten.
Met dank aan
- Dr A.P. Verhagen, fysiotherapeut en klinisch epidemioloog, Erasmus MC, Universitair Medisch Centrum, Rotterdam (voor het ter beschikking stellen van meta-analystische data).
Belangenverklaringen
De KNMG-Code “Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling” is gevolgd (KNAW 2016). Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventueel belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Polak (voorzitter) |
orthopedisch chirurg |
geen |
werkzaam in SFG ziekenhuis, lid v/d coöperatie met de persoonlijke BV Polak Beheer BV |
geen |
|
Bierma-Zeinstra |
Hoogleraar aan het Erasmus MC (onderzoek) |
geen |
lid van de internationale OARSI richtlijn commissie voor behandeling van artrose, lid van ARUK klinische studies commissie en van de wetenschappelijke commissie van het Annafonds, associate editor van Osteoarthritis & Cartilage, lid van de editorial board van Maturitas, en lid van de scientific advisory board van het Arthritis UK Pain Centre in Nottingham. Mede verantwoordelijk voor organisatie en inhoud van de tweejarige NHG erkende kaderopleiding voor huisartsen "Kaderhuisarts bewegingsapparaat". Op mijn onderzoeksafdeling ontvingen wij voor artrose onderzoek gedurende de ontwikkeling van de richtlijn (2015-2018) subsidies van het reumafonds (Dutch Arthritis Foundation), ZonMW, EU FP 7, het fonds NutsOhra, CZ, en ZonMW. Het betreft de volgende studies: Intramuscular corticosteroid injections in hip OA: a randomized controlled trial. Dutch Arthritis Foundation; Optimizing the management of osteoarthritis and other chronic musculoskeletal pain disorders in primary care. Dutch Arthritis Foundation, Long-term Program; Cost-effectiveness of viscosupplementation therapy for patients with osteoarthritis of the knee: a randomized clinical trial. ZonMW; Health Care Efficiency Research Programme: sub-programme Effects & Costs; D-board (Novel Diagnostics and Biomarkers for Early Identification of Chronic Inflammatory Joint Diseases) EU-FP7 Health; Dutch consortium ARGON. Optimal timing for osteoarthritis surgery. NOV/Dutch Arthritis Foundation; Duloxetine for chronic osteoarthritis pain; an important alternative? ZonMW; Rational Pharmacotherapy programme; Diagnostic criteria for early osteoarthritis of hip and knee. Dutch Arthritis Foundation; Joint implementation of guidelines for osteoarthritis in Western Europe: JIGSAW-E (first applicant Krysia Diedzics, UK). EIT Health (European Union); IFEROA- Identification of the female specific etiology and risk groups for osteoarthritis; Intramuscular corticosteroid injections in hip OA: a randomized controlled trial. Nuts Ohra; Is MRI of the knee cost-effective in patients with traumatic knee complaints in primary care? (first applicant P. Luijsterburg) ZonMW; Health Care Efficiency Research Programme: sub-programme Effects & Costs (K€ 616); Cost-effectiveness of two treatment strategies of an anterior cruciate ligament rupture. A randomized clinical study. ZonMW; Health Care Efficiency Research Programme: sub-programme Effects & Costs; Should a traumatic meniscal tear be resected? (first applicant M. Reijman) ZonMW; sub-programme Effects & Costs (K€ 400); Shock wave therapy for ankle arthrodesis (first applicant D. Meuffels). Dutch Arthritis Foundation; Like-2-Run (first applicant M. van Middelkoop) ZonMw Sport en Bewegen (K€ 157); Growing up: the influence of lifestyle on joint health (first applicant M. Van Middelkoop). EUR-fellowship; Effectiveness in knee osteoarthritis of an intra-articular corticosteroid injection versus an intra-muscular gluteal corticosteroid injection versus no injection in general practice: a multicenter randomized, 24 weeks comparative parallel-group trial. ZonMW Programme Primary Focus; PaTIO study: PhysiotherApeutic Treat-to-target Intervention after Orthopaedic surgery; A cost-effectiveness study. ZonMW/NOV Zorgevaluatie Leading the Change; Evaluation of care for patients with hip and knee osteoarthritis on the cross-road of primary and secondary care. CZ Health Insurance; The OA Trial Bank. Dutch Arthritis Foundation. Consultant op uurbasis (betaald aan mijn werkgever Erasmus MC) voor Infirst Healthcare ltd in de UK. Binnen dit consultancy chief investigator voor de "Flare study", a Three Arm Double blind, Randomised Multicentre Study to Investigate the Non-Inferiority of a Soft Gel Capsule of Ibuprofen Lipid Formulation (total daily dose 1200 mg) versus a Standard Soft Gel Ibuprofen Capsule (total daily dose 1200 mg and 2400 mg) in the Treatment of Patients with Episodic Knee Arthralgia/Flaring Knee Pain; eenmalig consultant geweest voor Regeneron met betrekking tot welke baseline variablelen in studies bepaald moeten worden voor het vaststellen van responsieve subgroepen bij gebruik van anti-NGF. |
was beoogd als voorzitter maar in overleg is besloten om een andere voorzitter te benoemen om zo elke schijn van belangenverstrengeling te voorkomen; om dezelfde reden geen voortrekker of meelezer op de pijnmedicatie vraag. Omdat de nieuwe pijnstiller (Soft Gel Capsule of Ibuprofen) niet verkrijgbaar is op de Nederlandse markt en geen onderdeel vormt van de richtlijnmodule, was deelname aan de besluitvorming wel mogelijk. |
|
Spruijt |
Orthopaedisch chirurg, Maartenskliniek Woerden/Nijmegen (tot 1 septemeber 2017). Orthopaedisch chirurg HagaZiekenhuis Den Haag (per 1 september 2017). |
geen |
Met Spruijt Praktijk o.a. lid Medisch Specialisten Coöperatief Haga; Consultant Zimmer Biomet (presentaties, cursussen, scholing); In de afgelopen jaren zijn er 2 RCTs in ons ziekenhuis gedaan waarbij kniedistractie vergeleken werd met tibiakop-osteotomie en kniedistractie met knieprothesiologie (financiering door ZonMw) |
geen |
|
Oei |
Musculoskeletaal radioloog, Erasmus MC Rotterdam; Unviversitair docent musculoskeletale beeldvorming, Erasmus MC Rotterdam/ Erasmus Universiteit Rotterdam |
geen |
geen |
geen |
|
Wildervanck-Dekker |
huisarts, kaderarts bewegings-apparaat/ intern consulent beweging-sapparaat Leidsche Rijn Julius Gezondheidscentra |
geen |
geen |
geen |
|
Kuijpers |
Epidemioloog, senior wetenschappelijk medewerker Nederlands Huisartsen Genootschap |
geen |
geen |
geen |
|
Vliet Vlieland |
Hoogleraar Doelmatigheid Revalidatie-processen/ Fysiotherapie, LUMC; Adviseur en Coordinator Wetenschappelijk Onderzoek Sophia Revalidatie Den Haag en Rijnlands Revalidatie Centrum Leiden |
geen |
Bijzonder Hoogleraar vanwege het KNGF bij LUMC; Betrokkenheid bij relevante, lopende onderzoeken: Zorgnetwerken voor mensen met reumatische aandoeningen in Nederland, Vliet Vlieland (hoofdaanvrager/penvoerder) van den Ende (mede-aanvrager), Dekker (Mede-aanvrager), Subsidiegever: ReumaNederland; De-implementation of blood saving maesures in hip and knee arthroplasties, aanvrager: L. van Bodegom-Vos, P. Marang-van de Mheen, T. Vliet Vlieland, R. Nelissen, Subsidiegever: ZonMw |
geen |
|
Jessen |
Anesthesioloog/ pijnbehandelaar |
geen neven-werkzaamheden; extramurale tandheelkundige behandeling onder narcose als onderdeel van anesthesioloog |
Aandeel in kliniek SanaVisie betreft ZBC voor plastische en cosmetische chirurgie; werkzaam in kliniek VraSana betreft ZBC voor orthopedische, neurochirurgische behandelingen |
geen |
|
Elzinga |
Anesthesioloog-Pijnspecialist Bravis Ziekenhuis Roosendaal |
lid Bestuur Sectie Pijn en Palliatieve geneeskunde NVA (reiskostenbasis) |
geen |
geen |
|
Kallewaard |
Anesthesioloog pijnbestrijder Rijnstate (70%) en AMC (30%) |
voorzitter Sectie Pijn- en Palliatieve geneeskunde NVA; voorzitter BBC NVA (onbetaald) |
geen |
geen |
|
Kloppenburg |
hoogleraar medisch specialist, reumatoloog |
Lid Commissie Medische Ethiek (2011-2016); vergoeding wordt betaald aan de afd. Reumatologie, LUMC; Associate editor "Arthritis Rheumatism" (2010-2015); Associate editor "Arthritis Rheumatism" (2010-2015) |
Alle financiële vergoedingen zijn betaald aan het Leids Universitair Medisch Centrum: Consultancy EMD Serono Research & Development Institute (10-2016–2-2017) betreffende "DMOAD development in osteoarthritis"; Lid Advisory boards voor Abbvie (2016), GlaxoSmithKline (2016, 2017, 2018), Levicept (2016) betreffende artrose. Lid advisory board voor Pfizer (2018) "Tanezumab osteoarthritis global panel meeting". Author UptoDate "Management of hand osteoarthritis"(2017); Medevoorzitter van werkgroep voor Revisie van Clinical Trial richtlijnen voor handartrose op initiatief van OARS) (2013-2015); Voorzitter Programma Commissie voor jaarlijks congres OARSI (2015); Lid Task Force EULAR "EULAR Recommendations for the use of imaging in OA clinical practice" (2014-2015); Concilium Rheumatologicum voor Nederlandse Vereniging Reumatologie (NVR) (2013-heden); Lid Centrale Visitatiecommissie, NVR (2013-heden); Programma Commissie EULAR (2014-2017); Werkgroep Handartrose OMERACT; Lid Abstract Review Commissie "American College of Rheumatology" (2014, 2015); Lezing ter nascholing van Nederlandse Reumatologen (ACR Review 2015), gesponsord door Pfizer (vergoeding betaald aan LUMC); Lid Advisory Board "Nature Review Rheumatology" (start 2015); Lid Board of Directors OARSI (2017-heden); Lid werkgroep "Kennisagenda Reumatologie" voor NVR; Lid Health Care Professionals Working Party van de European Medicines Agency (EMA) namens de EULAR (start 2018); Alle grants zijn uit betaald aan het LUMC: Grant van European League Against Rheumatism (EULAR) voor "Development of Classifiction Criteria for Hand Osteoarthritis"; Grant van EULAR voor "2018 Update of the EULAR Recommendations for the Management of Hand Osteoarthritis"; Grant van Reumafonds voor "Randomized placebo-controlled trail with prednisolone in hand Osteoarthritis: a proof-of-concept study" (2015-2018); Langlopende ondersteuning van ReumaNederland voor artroseonderzoek (2013-2023); Grant van Europese Unie (IMI-EFPIA project Approach, start 2015); Grants van Pfizer voor onderzoek naar etanercept in handartrose (2008-2015); Principal Investigator Nederland van industrie geinitieerde klinische trials (Abbvie) naar effectiviteit en veiligheid van Lutikizumab bij knie- en handartrose |
nevenfuncties en belangen zijn besproken in de werkgroep in het licht van de geprioriteerde uitgangsvragen en besloten is dat er geen actie hoeft te worden ondernomen (adviezen zijn niet beperkt tot een bedrijf maar verstrekt aan een aantal elkaar beconcurrerende bedrijven; richtlijn bevat geen uitgangsvragen m.b.t. LEVI, tanezumab, lutikizumab of prednisolon); geen trekker op medicamenteuze uitgangsvragen. |
|
Hoogmoed |
klinisch geriater |
geen |
geen |
geen |
|
v/d Kraan |
beleidsmedewerker Patiëntenfederatie Nederland |
geen |
geen |
geen |
|
Hebing |
poliklinisch apotheker Apotheek Reade en onderzoeker Reade Research, reumatologie |
klankbord specialisme Vereniging van Jonge Apothekers (belangenbehartiging jonge apothekers in opleiding tot openbaar apotheker specialist, aanspreekpunt vervolgopleiding, kwaliteitsmonitoring vervolgopleiding; onbetaald); Lid Centraal College KNMP (lid namens Apothekers in opleiding tot specialist; betaald), SIG biotechnologie NVZA, OMERACT werkgroep (onbetaald) |
geen |
geen |
|
Mesman |
ergotherapeut/ handtherapeut Reade binnen artrose team Reumarevalidatie |
geen |
geen |
geen |
|
Elders |
Bedrijfsarts Ministerie van Binnenlandse Zaken en Koninkrijkrelaties/ P-Direkt Klinische Arbeids-geneeskundige Rijndam Revalidatie-centrum/ Arbeidsrevalidatie |
Functie bedrijfsarts: beoordelen en begeleiden van werknemers bij het Ministerie afdeling P-Direkt, tevens werkzaam als arts-gemachtigde voor vele Ministeries en Departementen van de Rijksoverheid |
voorzitter van de Nederlandse Vereniging voor Klinische arbeidsgeneeskunde |
|
|
Boonstra |
Revalidatiearts Revalidatie Friesland OCA |
voorzitter cie. Kwaliteit VRA |
geen |
geen |
|
Post |
Beleidsmedewerker ontwikkeling & wetenschap VvOCM |
geen |
afgevaardigde namens VvOCM in het PON (Partnerschap Overgewicht Nederland) |
geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afvaardiging van Patiëntenfederatie Nederland in de werkgroep en een tweetal focusgroepen georganiseerd door Patiëntenfederatie Nederland (aanverwant ‘Samenvatting focusgroepen artrose’). Daarnaast is er in de oriënterende fase gezocht naar literatuur vanuit patiëntenperspectief, hierbij is gebruik gemaakt van een gestandaardiseerd zoekfilter (Wessels 2016). ReumaNederland, de Poly-Artrose Lotgenoten Vereniging en de Nationale Vereniging ReumaZorg Nederland zijn gevraagd om knelpunten aan te leveren, en de conceptrichtlijn is voor commentaar voorgelegd aan genoemde patiëntenverenigingen.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Voor deze richtlijn zijn geen interne kwaliteitsindicatoren ontwikkeld (zie Indicatorontwikkeling onder Werkwijze).
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen via een invitational conference door:
Ergotherapie Nederland (EN), Bijwerkingencentrum Lareb, Nefemed, Nederlands Huisartsen Genootschap (NHG), Patiëntenfederatie Nederland, Nederlandse Vereniging voor Arbeids- en Bedrijfsgeneeskunde (NVAB), Nederlandse Vereniging van Reumatologie (NVR), Nederlandse Vereniging van ZiekenhuisApothekers (NVZA), Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie (KNMP), ReumaNederland, Poly-Artrose Lotgenoten Vereniging, Nationale Vereniging ReumaZorg Nederland, Zorginstituut Nederland (ZIN), Zelfstandige Klinieken Nederland (ZKN), Nederlandse Orthopaedische Vereniging (NOV), Zorgverzekeraars Nederland (ZN). Daarnaast is de Nederlandse Vereniging van Revalidatieartsen (VRA) benaderd voor een schriftelijke knelpuntanalyse op basis van het conceptraamwerk en de conceptnotulen van de invitational conference. Een verslag van de invitational conference met toelichting van de richtlijnwerkgroep is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen (Guideline International Network), systematische reviews (Medline (OVID), Cochrane Library), en literatuur over patiëntenvoorkeuren en patiëntrelevante uitkomstmaten (patiëntenperspectief; Medline (OVID)). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of bias (ROB) tabellen.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is i.p.v. ‘matig’
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz 2017).
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Bij de richtlijnontwikkeling is ervoor gekozen om organisatie van zorg aspecten expliciet bij de afzonderlijke modules/ uitgangsvragen te behandelen, met name in de module ‘Zelfmanagement, educatie en informatie’, de module ‘Beleid bij specifieke subgroepen’, en de module ‘Geïntegreerd beleid’; daarom is geen aparte module Randvoorwaarden (organisatie van zorg) opgenomen.
Indicatorontwikkeling
Voor deze richtlijn zijn geen interne kwaliteitsindicatoren ontwikkeld omdat naar inschatting van de werkgroep, het meten van relevante indicatoren (percentage patiënten dat terecht door huisarts naar orthopeed wordt verwezen, percentage patiënten dat terecht een gewrichtsvervanging ondergaat, percentage patiënten waarvoor de huisarts terecht röntgenonderzoek laat doen bij het stellen van de diagnose artrose) op grote praktische problemen zal stuiten. In alle gevallen zou moeten worden bepaald of er sprake is van een terechte of onterechte verwijzing en dit veronderstelt een strikte definitie van de onderliggende criteria en een adequate verslaglegging in EPD of patiëntendossier. Een strikte definitie voor het volledig doorlopen van een conservatieve (stepped-care) behandeling is niet mogelijk omdat de stepped-care behandeling op de individuele patiënt moet worden afgestemd. Beoordeling of er sprake is van een terechte afwijking van een strikte stepped-care behandeling vereist een uitvoerige en systematische verslaglegging van behandeling en onderliggende argumenten in het patiëntendossier die momenteel niet haalbaar is in de klinische praktijk. Door het ontbreken van eenduidige criteria zou zo'n beoordeling ook willekeurig zijn en weinig transparant. De werkgroep is van mening dat andere maatregelen ter bevordering van implementatie zinvoller zijn, en onderstreept de noodzaak om landelijke transmurale afspraken te maken in een apart traject met een brede werkgroep waarin alle stakeholders zijn vertegenwoordigd. Daarnaast is de werkgroep van mening dat er methodes moeten worden ontwikkeld om het conservatieve zorgtraject (stepped-care) goed en efficiënt in het EPD van de huisarts te registreren zoals de Joint Implementation of Guidelines for Osteroarthritis in Western Europe (JIGSAW-E) e-template (link: https://www.eithealth.eu/jigsaw-e). Wellicht kan aan zo'n registratie-template een diagnostische component worden toegevoegd zodat op eenvoudige en efficiënte wijze inzichtelijk kan worden gemaakt waarom röntgenfoto’s worden aangevraagd door de huisarts. Een analyse van de kwaliteit van de verslaglegging met behulp van registratie-templates in de klinische praktijk biedt in de toekomst mogelijk wel aanknopingspunten voor indicatoren.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk onderzoek van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder Aanverwante items).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. Daarnaast werden de volgende verenigingen en organisaties benaderd voor commentaar: Vereniging voor Sportgeneeskunde (VSG), Bijwerkingencentrum Lareb, ReumaNederland, Poly-Artrose Lotgenoten Vereniging (P-AL), Nationale Vereniging ReumaZorg Nederland, Zorginstituut Nederland (ZIN), Zelfstandige Klinieken Nederland (ZKN), Nederlandse Federatie van Universitair Medische Centra (NFU), Nederlandse Vereniging van Ziekenhuizen (NVZ), Samenwerkende Topklinische opleidingsZiekenhuizen (STZ), Zorgverzekeraars Nederland (ZN), Inspectie Gezondheidszorg en Jeugd (IGJ), Nederlandse Zorgautoriteit (NZa), Vereniging Innovatieve Geneesmiddelen (Nefarma), en Nefemed. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al.; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Hultcrantz M, Rind D, Akl EA, et al. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184.
KNAW, KNMG, GR, NHG, FMS (2016). Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling. Link: https://storage.knaw.nl/2022-08/Gedragscode-belangenverstrengeling-januari-2017.pdf
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. Link: http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al, editors. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008 17;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 ;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
Zoekverantwoording
Deelvraag 1
|
Database |
Zoektermen Aanvullende zoekactie op: Kroon FPB, van derBurg LRA,BuchbinderR,OsborneRH, JohnstonRV, PittV. Self-management education programmes for osteoarthritis.CochraneDatabase of SystematicReviews 2014, Issue 1.Art.No.:CD008963.DOI: 10.1002/14651858.CD008963.pub2. NB Search is specifieker dan in deze review |
Totaal |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Medline (OVID)
2013-juli 2016
zoekdatum: 13 juli 2016 |
1 exp osteoarthritis/ (51349) 2 (osteoarthriti* or osteo-arthriti* or osteoarthrotic or osteoarthros*).ti,ab. (51289) 3 (degenerative adj2 arthritis).ti,ab. (1322) 4 coxarthro*.ti,ab. (1560) 5 gonarthro*.ti,ab. (1000) 6 1 or 2 or 3 or 4 or 5 (71704) 16 exp Self Care/ or exp Behavior Therapy/ or exp Adaptation, Psychological/ or (self adj (care or help or manag$ or directed or monitor$ or efficacy or admin$)).tw. or empower$.tw. or (cope or copes or coping).tw. or (adapt$ adj behav$).tw. or (behav$ adj (therap$ or intervention$)).tw. (333286) 17 11 and 16 (409) 18 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (291462) 19 17 and 18 (41) 20 (randomized controlled trial or controlled clinical trial).pt. or randomized.ab. or placebo.ab. or randomly.ab. or trial.ab. or groups.ab. (2341238) 21 17 and 20 (161) 22 21 not 19 (137) |
177 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Cinahl |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Deelvraag 2
|
Database |
Zoektermen |
Totaal |
|
Medline
Engels
1946-aug. 2017
zoekdatum: 24-08-2017 |
1 exp osteoarthritis/ (55385) 2 (osteoarthriti* or osteo-arthriti* or osteoarthrotic or osteoarthros*).ti,ab. (57045) 3 (degenerative adj2 arthritis).ti,ab. (1322) 4 coxarthro*.ti,ab. (1631) 5 gonarthro*.ti,ab. (1052) 6 1 or 2 or 3 or 4 or 5 (78204) 7 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (339406) 8 (randomized controlled trial or controlled clinical trial).pt. or randomized.ab. or placebo.ab. or randomly.ab. or trial.ab. or groups.ab. (2587965) 13 Dietetics/ or Weight Loss/ or dh.fs. or exp Obesity/dh, pc, th (Diet Therapy, Prevention & Control, Therapy) (107336) 14 (Dietet* or "diet therap*" or dietary or ((weight or overweight or "waist circumference*") adj3 (reduction* or loss or loos*)) or ((BMI or "body mass index") adj3 (reduc* or lower*))).ti,ab,kf. (317429) 15 13 or 14 (375915) 16 6 and 15 (1230) 17 limit 16 to english language (1150) 18 12 and 17 (4) 19 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (339406) 20 17 and 19 (77)> 73 uniek 21 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1766549) 22 17 and 21 (323) 23 22 not 20 (281)> 255 uniek |
389 |
|
Embase (Elsevier) |
((('knee osteoarthritis'/exp/mj OR 'knee osteoarthritis':ab,ti OR 'hip osteoarthritis'/exp/mj OR 'hip osteoarthritis':ab,ti OR (('osteoarthritis'/exp/mj OR osteoarthritis:ab,ti OR osteoarthrosis:ab,ti OR 'degenerative joint disease':ab,ti OR 'osteo arthritis':ab,ti OR 'osteo arthrosis':ab,ti OR 'degenerative arthritis':ab,ti) AND ('hip'/exp/mj OR hip*:ab,ti)) OR gonart*:ab,ti OR coxart*:ab,ti) AND (('dietetics'/exp/mj OR 'weight reduction'/exp/mj) OR 'obesity'/exp/mj/dm_th OR (dietet*:ti,ab OR 'diet therap*':ti,ab OR dietary:ti,ab OR (((weight OR overweight OR 'waist circumference*') NEAR/3 (reduction* OR loss OR loos*)):ti,ab) OR (((bmi OR 'body mass index') NEAR/3 (reduc* OR lower*)):ti,ab))) NOT 'conference abstract':it AND (english)/lim AND (embase)/lim) AND (('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp))) (36)> 7 uniek AND (('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it)) (154)> 54 uniek |
Exclusietabel
Tabel Exclusie na het lezen van het volledige artikel
Deelvraag-1
|
Auteur en jaartal |
Redenen van exclusie |
|
Allen, 2011 |
geen SR of RCT (conference paper) |
|
Patel, 2016 |
geen SR of RCT (feasibility study) |
|
SRs |
|
|
Pietrzak, 2013 |
Beschrijft 1 studie die ook is geïncludeerd in Kroon (2014), de andere twee studies voldoen niet aan selectiecriteria |
|
Williamson, 2015 |
Twee studies voldoen aan selectiecriteria, andere niet of zijn al geïncludeerd in Kroon (2014) |
|
RCTs |
|
|
Stukstette, 2011 |
Patiëntenpopulatie voldoet niet aan selectiecriteria |
|
Von Korff, 2012 |
Patiëntenpopulatie voldoet niet aan selectiecriteria |
|
Wu, 2011 |
Rapporteert over dezelfde RCT als Kao, 2012 en beschrijft geen relevante uitkomstmaten |
|
Brosseau, 2012 |
Interventie voldoet niet aan selectiecriteria |
|
Ettinger, 1997 |
Interventie voldoet niet aan selectiecriteria |
|
Svege, 2013 |
Controle voldoet niet aan selectiecriteria |
|
Talbot, 2013 |
Interventie voldoet niet aan selectiecriteria |
|
Thorstensson, 2005 |
Interventie voldoet niet aan selectiecriteria |
|
Bennell, 2014 |
Interventie voldoet niet aan selectiecriteria |
|
Kawi, 2015 |
Uitkomtmaten voldoen niet aan selectiecriteria |
|
McDonald, 2013 |
Interventie voldoet niet aan selectiecriteria |
|
Smith, 2015 |
Patiëntenpopulatie voldoet niet aan selectiecriteria |
|
Umapathy, 2015 |
Geen SR of RCT |
|
Vitiello, 2013 |
Patiëntenpopulatie voldoet niet aan selectiecriteria |


