Pijnmedicatie (oraal, dermaal)

Einddatum 01-2020
Project nr: 836041007
Einddatum 07-2023

Artrose in de knie
Keuzekaart-in-beeld Artrose in de heup
Keuzekaart-in-beeld Artrose in de knie

Artrose in mijn heup en ga naar het ziekenhuis
Artrose in mijn knie en ga naar het ziekenhuis
Uitgangsvraag
Wat is de optimale strategie voor medicamenteuze pijnstilling bij patiënten met artrose van heup of knie?
Deelvragen
- Wat is de optimale strategie voor pijnstilling bij patiënten met artrose van de knie?
- Wat is de optimale strategie voor pijnstilling bij patiënten met artrose van de heup?
Aanbeveling
Pijnmedicatie bij knie- of heupartrose
Bepreek met de patiënt met symptomatische knie- of heupartrose:
- de voor- en nadelen van de pijnmedicatie inclusief de mogelijke risico’s van gebruik van pijnmedicatie;
- de te verwachten werkzaamheid van pijnmedicatie;
- de overige mogelijkheden om pijn te verlichten (gezond bewegen, oefentherapie, gewichtsverlies bij overgewicht; zie de modules ‘Oefentherapie’, ‘Educatie en informatie’ en ‘Geïntegreerd beleid’).
Beslis samen met de patiënt wat de best passende pijnmedicatie is, volg hierbij onderstaande stappen. Ga bij onvoldoende pijnstilling, contra-indicaties of een specifieke indicatie over naar de volgende stap.
- start bij heupartrose met paracetamol, en bij knieartrose met paracetamol of een dermale NSAID (eventueel in combinatie met paracetamol);
- wissel naar een orale NSAID en bij risicogroepen naar een orale NSAID in combinatie met een maagbeschermer*1,2;
- overweeg bij onvoldoende effect om te wisselen naar een alternatieve NSAID;
- bouw de pijnmedicatie af bij het (grotendeels) verdwijnen van symptomen, bij voorkeur binnen tien dagen na start van de behandeling.
Overweeg behandeling met een zwakwerkend opioïd (tramadol) bij patiënten met heup- of knieartrose waarbij NSAID’s onvoldoende effectief of gecontra-indiceerd zijn*3.
Overweeg bij patiënten met ernstige en chronische pijn van heup- of knieartrose die refractair zijn voor reguliere pijnmedicatie, een proefbehandeling met duloxetine.
Verwijs de patiënt met ernstige en chronische pijn van heup- of knieartrose bij onvoldoende resultaat van conservatieve behandeling:
- bij (waarschijnlijkheids)indicatie voor gewrichtsvervanging: naar de orthopedisch chirurg.
- bij ontbreken van een (waarschijnlijkheids)indicatie voor gewrichtsvervanging: naar een pijnbehandelcentrum met specifieke expertise op het gebied van de behandeling van mensen met chronische pijnklachten van het bewegingsapparaat.
Evalueer periodiek de behoefte van de patiënt aan symptomatische pijnverlichting en de respons op de behandeling.
Begeleid de patiënt in zijn medicatiegebruik met aandacht voor polyfarmacie, (angst voor) bijwerkingen, praktische gebruiksproblemen en therapietrouw, en zorg voor een goede verslaglegging en overdracht van medicatiegegevens.
*1 Schrijf bij een niet-selectief NSAID een maagbeschermer voor bij:
- alle patiënten van 70 jaar of ouder; of
- patiënten met een ulcus of maagcomplicaties in de voorgeschiedenis (ongeacht de leeftijd); of
- bij 2 of meer van de volgende risicofactoren:
- leeftijd tussen 60 en 70 jaar;
- ernstige invaliderende reumatoïde artritis, hartfalen of diabetes;
- hoge dosering van een niet-selectief NSAID;
- gebruik van comedicatie met een hoger risico op maagcomplicaties.
Zie voor verdere informatie de NHG-Standaard Maagklachten (NHG 2013).
*2 Wees terughoudend met orale NSAID's bij kwetsbare ouderen vanwege de verhoogde gevoeligheid voor bijwerkingen. Houd rekening met het gastro-intestinale en cardiovasculaire risicoprofiel van de patiënt. Schrijf de orale NSAID zo kort mogelijk en in zo laag mogelijke effectieve dosering voor, zorg voor een adequate follow-up en monitor bijwerkingen zorgvuldig.
*3 Wees terughoudend met tramadol bij kwetsbare ouderen vanwege bijwerkingen. Zie voor verdere informatie de Multidisciplinaire richtlijn Pijn bij kwetsbare ouderen (Verenso 2016).
Overwegingen
De hoofdvraag luidt ‘Wat is de optimale strategie voor medicamenteuze pijnstilling bij patiënten met artrose van heup of knie?’, en om deze vraag te beantwoorden is een systematische literatuuranalyse gedaan op basis van twee deelvragen die zich specifiek richtten op respectievelijk knieartrose en heupartrose. Omdat het overgrote deel van de onderzoeken (RCT’s) is uitgevoerd bij patiënten met knieartrose is de onderbouwing (evidence) voor een pijnmedicatiestrategie bij symptomatische knieartrose beter dan bij heupartrose. De werkgroep constateert dat meer onderzoek bij heupartrose gewenst is (zie Kennislacunes), maar is ook van mening dat er voldoende overeenkomsten (mechanistisch, symptomatisch) zijn tussen heup- en knieartrose om ook aanbevelingen te kunnen doen voor medicamenteuze pijnstilling bij patiënten met heupartrose.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Paracetamol versus placebo, NSAID’s versus placebo en onderling. Met betrekking tot de cruciale uitkomstmaten, pijn en fysiek functioneren, kan uit de literatuuranalyse met hoge zekerheid (GRADE bewijskracht bij knieartrose: hoog) worden geconcludeerd dat paracetamol weliswaar pijn reduceert en fysiek functioneren verbetert, maar dat deze effecten van paracetamol ook in de maximaal toegestane dagdosering gering zijn in vergelijking met placebo, en een algemeen aanvaarde grens voor klinische relevantie niet overtreffen (bij een behandelduur tussen 1 en 26 weken; zie Samenvatting literatuur en Conclusies op het tabblad Onderbouwing). Er is ook hoge zekerheid dat NSAID’s in de maximaal toegestane dagdosering wel in een klinisch relevante pijnreductie en verbetering van fysiek functioneren kunnen resulteren ten opzichte van placebobehandeling. De bewijskracht voor een klinisch relevante pijnreductie bij knieartrose is hoog voor etoricoxib (60 mg) en diclofenac (150 mg), en redelijk voor celecoxib (400 mg), naproxen (1000 mg) en ibuprofen (2400 mg). De bewijskracht voor een klinisch relevante verbetering in fysiek functioneren bij knieartrose is hoog voor diclofenac, redelijk voor etoricoxib, naproxen en ibuprofen, en laag voor celecoxib. De overall bewijskracht op de cruciale uitkomstmaten is daarmee het hoogst voor diclofenac (bij de maximale dagdosering van 150 mg). Op basis van gemiddeld effect bij de maximale dagdosering lijken diclofenac en etoricoxib effectiever dan celecoxib, naproxen en ibuprofen, maar harde conclusies lijken voorbarig omdat de betrouwbaarheidsintervallen overlappen en er nauwelijks directe (head-to-head) trials zijn uitgevoerd (zie Kennislacunes).
Antidepressiva versus placebo. Er is redelijke zekerheid dat de serotonine-noradrenaline-heropnameremmer (SNRI) duloxetine resulteert in een klinisch relevante pijnreductie bij patiënten met knieartrose (GRADE bewijskracht: redelijk), en mogelijk verbetert duloxetine ook het fysiek functioneren (GRADE bewijskracht: laag). De resultaten van een recente grote Chinese RCT (Uchio 2018; 354 patiënten met knieartrose gerandomiseerd naar placebo of duloxetine) verschenen na de zoekdatum in de huidige richtlijnmodule sluiten hier goed bij aan: behandeling met duloxetine resulteerde in een statistisch significant grotere pijnreductie dan behandeling met placebo, het gemiddelde verschil op de BPI pijnschaal (Brief Pain Inventory-Severity, gemiddelde pijn op schaal van 0 tot 10) na drie maanden behandeling bedroeg -0,77. Dit komt overeen met een klinisch relevante effectgrootte (Standardized Mean Difference) van -0,47, maar het betrouwbaarheidsinterval (95%BI= (-0,68; -0,25)) overlapt met de grens voor klinische relevantie; vergelijk met Figuur 5 in Samenvatting literatuur). De effecten van andere antidepressiva dan duloxetine (tricyclische antidepressiva, specifieke serotonine-heropnameremmers, andere serotonine-noradrenaline-heropnameremmers dan duloxetine) bij patiënten met knieartrose zijn onbekend, en er werden ook geen studies gevonden naar de effecten van antidepressiva bij patiënten met heupartrose. Een recente systematische review onderzoekt de effectiviteit van het tricyclische antidepressivum amitriptyline bij musculoskeletale pijn en includeert 7 RCT's (van den Driest 2017). Bij 2 RCT's wordt een positief effect van amitriptyline op pijn en functie waargenomen in vergelijking met pregabaline of placebo. Deze SR vindt echter geen relevante RCT's uitgevoerd bij patiënten met heup- of knieartrose. Verder onderzoek is nodig om de waarde van amitriptyline en andere antidepressiva bij patiënten met heup- of knieartrose te kunnen bepalen.
Dermale NSAID’s versus placebo (drager) en orale NSAID’s (alleen bij knie). Dermale NSAID’s en placebo resulteren beide in een aanzienlijke pijnreductie ten opzichte van baseline waarbij de effectiviteit van de actieve interventie gering (statistisch significant) groter is dan die van placebo (dermale toepassing van alleen de drager). Er is hoge zekerheid (GRADE bewijskracht: hoog) dat dermale NSAID’s (diclofenac, ketoprofen) niet in een klinisch relevante pijnreductie resulteren bij patiënten met knieartrose, in vergelijking met een dermale placebo. Daarnaast is er enig bewijs dat dermale NSAID’s (diclofenac, ketoprofen) resulteren in een vergelijkbare pijnreductie als orale NSAID’s (GRADE bewijskracht: laag), en dat het succes van behandeling (percentage patiënten met tenminste 50% reductie in pijn) vergelijkbaar is (GRADE bewijskracht: redelijk). Bij het bepalen van de positie van dermale NSAID's ten opzichte van orale NSAID's is van belang is dat het placebo-effect bij dermale toepassing van NSAID’s aanzienlijk groter is dan bij oraal gebruik van NSAID’s (zie Bannuru 2015; Zou 2016). Er is meer onderzoek nodig naar de optimale dosering en formulering van dermale NSAID’s. In RCT’s van goede kwaliteit en voldoende omvang moeten verschillende dermale NSAID’s zowel onderling worden vergeleken als met orale NSAID’s (zie Kennislacunes). Een recent verschenen meta-analyse (Zeng 2018) suggereert dat sommige preparaten (zoals diclofenac pleisters) wellicht een grotere effectiviteit bezitten en mogelijk wel een klinisch relevant effect geven in vergelijking met een dermale placebo (dermale toepassing van alleen de drager). In Nederland zijn op dit moment twee dermale NSAID's verkrijgbaar, dermaal diclofenac en dermaal ibuprofen, beide in de vorm van een gel.
Bijwerkingen
Paracetamol. Paracetamol is een relatief veilig medicament, met een beter veiligheidsprofiel dan bijvoorbeeld NSAID’s. Toch brengen hogere doseringen dan aanbevolen het risico van zeer ernstige leverbeschadiging met zich mee, 6 gram kan al leverbeschadiging geven, na chronisch gebruik is bij 3 tot 4 gram per dag al leverschade gemeld (FK 2018). Klinische klachten en symptomen van leverbeschadiging worden doorgaans pas 2 dagen (max. 4 tot 6 dagen) na toediening waargenomen. Uit onderzoek van het Instituut voor Verantwoord Medicijngebruik (IVM 2017) blijkt dat consumenten de risico’s van pijnstillers zoals paracetamol onderschatten, de helft van de respondenten denkt meer paracetamol te kunnen slikken dan veilig voor hen is. Bij gebruik langer dan 3 maanden kan geneesmiddelafhankelijke hoofdpijn ontstaan.
NSAID’s. Celecoxib en etoricoxib zijn selectieve cyclo-oxygenase-2 (COX-2) remmers, de overige middelen worden als niet-selectieve NSAID’s beschouwd. Gebruik van NSAID's kan gepaard gaan met een aantal, soms ernstige, bijwerkingen: gastro-intestinale bloedingen, cardiovasculaire complicaties, en nierfunctiestoornissen (FK 2018; EPHOR 2014; Trelle 2011; CNT 2013; Zweers 2014). Bij het voorschrijven van NSAID's moet rekening worden gehouden met individuele patiëntkarakteristieken (comorbiditeit, leeftijd) en mogelijke bijwerkingen, contra-indicaties en interacties van de NSAID's. Het veiligheidsprofiel van NSAID's varieert. Celecoxib heeft het minst ongunstige gastro-intestinale risicoprofiel, maar is gecontra-indiceerd bij arteriële trombo-embolische complicaties (myocardinfarct, CVA, perifeer arterieel vaatlijden). Naproxen heeft een relatief gunstig cardiovasculair risicoprofiel, maar heeft een relatief hoog risico op gastro-intestinale complicaties. Etoricoxib en diclofenac zijn gecontra-indiceerd bij arteriële trombo-embolische complicaties in de anamnese. Naproxen heeft een bloedingsrisico vergelijkbaar met acetylsalicylzuur. Ibuprofen heeft een interactie met acetylsalicylzuur. Voor verdere informatie wordt de lezer verwezen naar het Farmacotherapeutisch kompas (FK 2018; EPHOR 2014) en de NHG-Standaard Pijn (NHG 2018), officiële productinformatie (Summary of Product Characteristics, SmPC) van de betreffende geneesmiddelen is te raadplegen via http://www.cbg-meb.nl. Indien een niet-selectief NSAID wordt voorgeschreven, is een maagbeschermer geïndiceerd bij alle patiënten van 70 jaar of ouder, alsmede bij patiënten met een ulcus of maagcomplicaties in de voorgeschiedenis (ongeacht de leeftijd). Daarnaast is maagbescherming met een protonpompremmer (PPI) geïndiceerd bij 2 of meer van de volgende risicofactoren: leeftijd tussen 60 en 70 jaar; ernstige invaliderende reumatoïde artritis, hartfalen of diabetes; hoge dosering van een niet-selectief NSAID; gebruik van comedicatie met een hoger risico op maagcomplicaties. Voor verdere informatie wordt de lezer verwezen naar de NHG-Standaard Maagklachten (NHG 2013; zie ook Tsoi 2014).
Dermale NSAID’s. De veiligheid van dermale NSAID’s is matig onderzocht, maar er zijn aanwijzingen dat dermale NSAID’s een lager risico hebben op gastro-intestinale en systemische bijwerkingen dan orale NSAID’s (GRADE bewijskracht: zeer laag tot laag). Dermale NSAID’s hebben een hoger risico op lokale bijwerkingen, maar die zijn doorgaans mild en van voorbijgaande aard. In de eerder genoemde recente meta-analyse (Zeng 2018) zijn bovendien nadelige effecten van deze interventies uitgebreid bestudeerd, waarbij tevens gebruik werd gemaakt van observationele gegevens van meer dan 200.000 patiënten. Met uitzondering van topicale salicylzuur (acetylsalicylzuur verschilt van de andere NSAID's omdat het COX-1 en COX-2 irreversibel remt) werden voor de dermale producten geen serieuze renale of gastrointestinale bijwerkingen gezien. Een beter veiligheidsprofiel van dermale NSAID’s ten opzichte van orale NSAID’s is ook te verwachten op basis van de geringere systemische absorptie: de maximale concentratie NSAID in bloedplasma is bij dermale toepassing van een NSAID in het algemeen minder dan 15% van de concentratie die wordt bereikt bij oraal gebruik van een equivalente dosis van dezelfde NSAID (Heyneman 2000).
Antidepressiva (duloxetine). Uit de literatuuranalyse komt naar voren dat gebruik van duloxetine gepaard kan gaan met een aantal bijwerkingen zoals misselijkheid, constipatie, droge mond, diarree, vermoeidheid, duizeligheid, slaperigheid en slapeloosheid. Misselijkheid, droge mond, slaperigheid en hoofdpijn komen zeer vaak voor (FK 2018).
Voor alle pijnmedicatie geldt dat het belangrijk is om patiënten te informeren over een juiste toepassing van de pijnmedicatie en goed voor te lichten over (het risico op) bijwerkingen en het belang om de maximale dagdosis niet te overschrijden, rekening houdend met eventuele zelfmedicatie met vrij verkrijgbare pijnstillers. Voor een effectief en veilig gebruik van pijnmedicatie bij artrose is begeleiding van de patiënt nodig door behandelaar en apotheker. Patiënten met artrose gebruiken naast pijnmedicatie veelal ook medicatie voor andere aandoeningen, en daarom dient er aandacht te zijn voor o.a. polyfarmacie, (angst voor) bijwerkingen, praktische gebruiksproblemen zoals het openen van verpakkingen, tijdcongruente inname van pijnmedicatie, therapietrouw, en goede overdracht van medicatiegegevens.
Monotherapie en combinatietherapie. Bij het ontstaan van pijn bij artrose aan heup of knie zijn zowel nociceptieve als non-nociceptieve mechanismen betrokken, inclusief neuropathische en centrale mechanismen. Paracetamol grijpt in op (deels) andere pijnmechanismen dan NSAID’s en duloxetine. Een optimale behandeling, met name van ernstige pijn bij heup- of knieartrose, vereist daarom mogelijk combinatietherapie (van Laar 2012). Zo is monotherapie met paracetamol weinig effectief, maar zou paracetamol mogelijk van toegevoegde waarde kunnen zijn als onderdeel van een combinatietherapie. Overtuigende evidence voor een meerwaarde van combinaties van paracetamol met NSAID's ontbreekt echter. Doherty (2011) randomiseerde patiënten met symptomatische knieartrose (892 personen met gemiddelde leeftijd 61 jaar) naar driemaal daags ibuprofen (400 mg), paracetamol (1000 mg), een combinatietablet van ibuprofen/paracetamol (200/500 mg), of een combinatietablet ibuprofen/paracetamol (400/1000 mg). Geen van beide combinatietabletten bleek superieur ten opzichte van monotherapie met ibuprofen, terwijl er wel duidelijke aanwijzingen waren voor meer bijwerkingen bij gebruik van de combinatietabletten. In een retrospectieve cohortstudie (Rahme 2008) bij personen van 65 jaar of ouder bleek het risico op ziekenhuisopname vanwege gastro-intestinale bijwerkingen tweemaal hoger bij gebruik van paracetamol in combinatie met een NSAID (en maagbeschermer) dan bij monotherapie met paracetamol of een NSAID (en maagbeschermer). Ondanks dat combinatietherapie vaak wordt toegepast in de klinische praktijk is er vooralsnog onvoldoende onderbouwing voor en is meer onderzoek nodig (Thybo 2017). De werkgroep is daarom van mening dat de voorkeur uitgaat naar monotherapie en dat combinaties van paracetamol met NSAID's vooralsnog niet kunnen worden aanbevolen.
Effecten en bijwerkingen in bepaalde subgroepen
NSAID’s dienen bij kwetsbare ouderen met grote terughoudendheid te worden toegepast vanwege de verhoogde gevoeligheid voor bijwerkingen (EPHOR 2014; Verenso 2016). Ook hier geldt het advies om NSAID’s zo kort mogelijk en in zo laag mogelijke effectieve dosering voor te schrijven. Indien een NSAID geïndiceerd is bij kwetsbare ouderen, is het van extra groot belang om het gastro-intestinale en cardiovasculaire risicoprofiel van de patiënt mee te nemen in de overweging. Bijwerkingen dienen te worden gemonitord. Indien een niet-selectief NSAID wordt voorgeschreven, is bij kwetsbare ouderen altijd een maagbeschermer geïndiceerd. Minder terughoudendheid is nodig bij gebruik van dermale NSAID’s die minder bijwerkingen geven mits de huid intact is, belangrijk is dat de behandelaar alert blijft op ongewenste veranderingen in nier- en hartfunctie en bloeddruk. Voor verdere informatie wordt de lezer verwezen naar de Multidisciplinaire richtlijn pijn bij kwetsbare ouderen (Verenso 2016) en de NHG-Standaard Maagklachten (NHG 2013).
In theorie zou de aanwezigheid van neuropathische of centrale pijnmechanismes de medicatiekeuze kunnen beïnvloeden. Hierover zijn momenteel nog geen studies voorhanden, en hebben we bovendien een op het spreekuur haalbare manier nodig om deze mechanismes te herkennen (zie Kennislacunes)
Invloed van dosering en wijze van toediening
Belangrijk is om vanwege de mogelijke (ernstige) bijwerkingen van NSAID's bij de dosering te streven naar de laagst mogelijke effectieve dosering en het gebruik zo kort mogelijk te houden. Hierbij moet een afweging worden gemaakt tussen de voor- en nadelen van een hogere dosering: grotere effectiviteit maar ook meer (kans op) bijwerkingen. Als leidraad voor de duur van de behandeling bij een tijdelijke verergering van de klachten stelt de werkgroep een periode van vijf tot tien dagen voor omdat deze opvlamming in de meerderheid van de gevallen weer onder controle is na een dergelijke periode (Bierma-Zeinstra 2017). Met betrekking tot de eventuele voordelen van continu gedoseerde NSAID’s in vergelijking met gebruik naar behoefte (‘on demand’) concludeert de NHG-Standaard Niet-traumatische knieklachten (NHG 2016) dat er zeer veel onzekerheid is over een voordeel van continu gebruik van NSAID’s boven gebruik van NSAID’s on demand, zowel wat betreft effectiviteit als wat betreft veiligheid. De huidige werkgroep onderschrijft deze conclusie. Gezien de mogelijke bijwerkingen van NSAID’s dient het voorschrijven van NSAID’s bij voorkeur te worden beperkt tot situaties waarin tijdelijke verergering van de knieartrose optreedt, en waarin paracetamol of dermale NSAID’s niet voldoende zijn voor het onderdrukken van de pijn.
Waarden en voorkeuren van de patiënt
De meerderheid van patiënten met artrose geeft aan dat pijn hun grootste probleem is, en veel patiënten hebben chronische pijn (NICE 2014). Afhankelijk van de pijnintensiteit kan pijn een grote invloed hebben op ADL activiteiten, mobiliteit en participatie en algehele kwaliteit van leven. De meeste patiënten prefereren NSAID’s boven paracetamol, maar blijven desondanks vaak paracetamol slikken (Pincus 2000). Uit de focusgroepbijeenkomsten komt naar voren dat alle deelnemers pijnmedicatie en ontstekingsremmers hebben gehad, en dat de meesten dit nog steeds slikken (zie Samenvatting focusgroepen onder aanverwant). De medicatie is voorgeschreven door de huisarts, orthopeed, reumatoloog of door pijnpoli. Er wordt veel paracetamol gebruikt (1000 mg), eventueel in combinatie met diclofenac, ibuprofen, tramadol, opradol (niet verkrijgbaar op de Nederlandse markt) of morfine. Ook smeert een enkele deelnemer diclofenac en ibuprofen op de gewrichten. De pijnmedicatie vermindert de pijn, maar neemt de pijn niet weg. Bovendien hebben sommige deelnemers nare bijwerkingen zoals concentratieproblemen en duizeligheid. Het inzetten van pijnmedicatie en/of antidepressiva vergt een goede afweging tussen de mogelijke voordelen en de te verwachten bijwerkingen. Dit zal voor iedere patiënt anders uitpakken. Waar de ene patiënt bepaalde bijwerkingen over heeft voor een mogelijk gunstig effect vindt een ander de bijwerkingen erger dan de kwaal. Goede voorlichting en de mogelijkheid om als zorgverlener en patiënt hier samen over te kunnen beslissen is heel belangrijk. Ook reële verwachtingen (bijvoorbeeld kan de pijn verdwijnen of enkel verminderen) is belangrijk voor patiënten. Tenslotte is het belangrijk is om de patiënt voor te lichten over het belang om pijnmedicatie op regelmatige momenten in te nemen zodat een gelijkmatige bloedspiegel ontstaat en de pijnstilling gedurende de dag optimaal is.
Aanvaardbaarheid overige stakeholders, kosten, haalbaarheid
De aanvaardbaarheid van de interventies (stapsgewijze medicamenteuze pijnbehandeling) bij zorgverleners en andere stakeholders vormt naar inschatting van de werkgroep geen probleem. De aanbeveling sluit breed aan bij de huidige medische praktijk en lijkt haalbaar. De kosten van de pijnmedicatie zijn laag, aan gebruik van dermale NSAID’s en de comedicatie met een maagbeschermer zijn enigszins hogere kosten verbonden maar dit zou implementatie van de aanbeveling niet in de weg moeten staan. Wel is bij de inzet van de pijnmedicatie belangrijk dat vergoeding door de zorgverzekeraar (of het ontbreken daarvan) incidenteel een rol kan spelen bij de therapietrouw, bijvoorbeeld maagbeschermers worden niet vergoed bij korter dan zes maanden gebruik.
Overige pijnmedicatie: opiaten
Tramadol. In de systematische literatuuranalyse is tramadol buiten beschouwing gelaten omdat de werkgroep geen nieuwe evidence verwachtte die aanleiding zou kunnen zijn om het beleid ten aanzien van opiaten bij artrose aan heup of knie te wijzigen. Het zwakwerkende opioïd tramadol kan worden overwogen als paracetamol of NSAID onvoldoende effect hebben. De meta-analyse van Cepeda (2007) concludeerde dat (op grond van 11 RCT’s) tramadol of tramadol/paracetamol preparaten weliswaar effecten lieten zien op pijn en functie, maar dat deze effecten nauwelijks klinisch relevant waren. Daarnaast stopte een op de acht patiënten in de RCT’s met tramadol vanwege bijwerkingen. Frequente bijwerkingen zijn: duizeligheid, misselijkheid, braken, hoofdpijn, droge mond, obstipatie, zweten, vermoeidheid en slaperigheid. Belangrijk is om bij signalen van obstipatieklachten direct te starten met een laxans. Bij start van de behandeling beïnvloedt tramadol sterk de rijvaardigheid. Na twee weken stabiel dagelijks gebruik is tramadol rijveilig. Bij chronisch gebruik is er een risico op afhankelijkheid en onthoudingsverschijnselen bij staken van tramadol. Opioïden worden door kwetsbare ouderen vaak minder goed verdragen en voor tramadol is slechts een beperkte plaats: tramadol wordt alleen geadviseerd bij ouderen met matige chronische pijn waarbij paracetamol onvoldoende pijnstilling geeft en NSAID’s ongeschikt zijn (Verenso 2016; EPHOR 2011). Het is hierbij belangrijk om tramadol langzaam te titreren om de kans op bijwerkingen te verminderen.
Non-tramadol opiaten. Bij meer dan helft van de patiënten waarbij in de huisartspraktijk een sterkwerkend opioïd wordt voorgeschreven betreft het patiënten met klachten van het bewegingsapparaat. Een recent rapport van het NIVEL (NIVEL 2016) zag hierin tevens een stijging gedurende de periode van 2005 tot en met 2015; het betrof vooral de oudere patiënten (> 76 jaar), en het product oxycodon. Toch is er voor artrose op grond van de evidence vrijwel geen plaats voor deze sterkwerkende opiaten. Een recente Cochrane meta-analyse (da Costa 2014) op grond van 22 studies liet slechts een geringe en geen klinisch relevante meerwaarde zien ten opzichte van placebo (effectgrootte van 0,28 voor pijn, en 0,26 voor functie), terwijl er wel aanzienlijke bijwerkingen waren (een op de 20 viel uit in de RCT’s vanwege bijwerkingen van deze sterkwerkende opiaten). Ophogen van dosis leek geen grotere effecten te bewerkstelligen, en langere termijn gebruik verminderde zelfs de effecten. In een recente pragmatische treat-to-target RCT (Krebs 2018) vergeleek men over een periode van 12 maanden sterkwerkende opiaten (morfine, oxycodon, of hydrocodon/ paracetamol) met niet-opiaten (paracetamol of orale NSAID’s) in patiënten met chronische rugpijn of pijn als gevolg van knie- of heupartrose. Men zag in deze studie significant betere effecten op pijn van de non-opiaten, en significante meer bijwerkingen van de opiaten. Al met al beperken de bijwerkingen, de geringe effecten, en het risico op verslaving het gebruik van deze opiaten bij artrose patiënten.
Rationale
Paracetamol heeft een gering effect op pijn en fysiek functioneren ten opzichte van placebo maar ten opzichte van geen behandeling zou het effect van paracetamol vrijwel zeker klinisch relevant zijn. De kosten zijn laag, en gebruik van paracetamol is relatief veilig, zeker in vergelijking met orale NSAID’s. Dermale NSAID’s hebben bij knieartrose mogelijk een vergelijkbare effectiviteit als orale NSAID’s maar met een (veel) kleiner risico op ernstige bijwerkingen. Het niet onaanzienlijke placebo-effect van orale en (met name) dermale pijnmedicatie kan in het voordeel van de patiënt uitvallen. Orale NSAID’s resulteren in een aanzienlijke, klinisch relevante, pijnreductie en verbetering van fysiek functioneren maar kunnen ernstige bijwerkingen met zich meebrengen. Wanneer bij patiënten met heup- of knieartrose NSAID’s onvoldoende pijnstilling of functieverbetering geven of wanneer NSAID’s gecontra-indiceerd zijn, kan overwogen worden om tramadol voor te schrijven. Vanwege bijwerkingen, de geringe effecten en het risico op verslaving is er vrijwel geen plaats voor sterkwerkende opiaten bij de behandeling van patiënten met knie- of heupartrose. Terughoudendheid bij het voorschrijven van (orale) NSAID’s en opiaten (inclusief tramadol) bij kwetsbare oudere patiënten is noodzakelijk vanwege een verhoogde gevoeligheid voor bijwerkingen. Duloxetine kan leiden tot een klinisch relevante pijnreductie maar is primair een antidepressivum, en kent ook veel bijwerkingen. Bij patiënten met ernstige symptomen van heup- of knieartrose die refractair zijn voor reguliere pijnmedicatie kan een proefbehandeling met duloxetine worden overwogen. Verwijs de patiënt met ernstige en chronische pijn van heup- of knieartrose bij onvoldoende resultaat van de behandeling naar een pijnbehandelcentrum met specifieke expertise op het gebied van de behandeling van mensen met chronische pijnklachten van het bewegingsapparaat (: conservatieve en invasieve behandelopties; zie NHG-Standaard Pijn, NHG 2018). Pijnmedicatie is slechts een van de onderdelen van het behandelplan voor patiënten met artrose aan heup- of knie: gezond bewegen, oefentherapie en gewichtsverlies bij overgewicht moeten de basis vormen van het behandelplan.
Onderbouwing
Achtergrond
Pijn is één van de belangrijkste klachten van patiënten met artrose. Aanvankelijk hebben deze klachten vooral een periodisch karakter, maar na verloop van tijd kunnen de pijnklachten chronisch en meer belemmerend worden. Behalve het kraakbeen zijn alle structuren van een gewricht geïnnerveerd door nociceptoren. Vooral de mate van synovitis en de subchondrale beenmerg laesies lijken gerelateerd te zijn aan de aanwezigheid van pijn (Yusuf 2011), en de tijdelijke verergering bij pijn (Zhang 2011) bij artrose. Bij artrose kunnen behalve de nociceptieve pijn ook neuropathische en centrale pijnmechanismes een rol spelen. Structurele veranderingen in gewrichtsinnervatie zoals verlies en/of sprouting van zenuwvezels wordt hierbij gezien. Daarnaast kunnen centrale pijnmechanismes ontstaan bij artrose door bijvoorbeeld centrale sensitisatie, verminderde inhibitie van de dalende banen, en temporale summatie (Eitner 2017). Bij een aanzienlijk deel (19-49%) van de artrose patiënten zijn naast de nociceptieve mechanismes ook deze andere pijnmechanismes aanwezig (French 2017), en spelen een belangrijke rol bij de mate van pijnklachten van de patiënt (Lluch 2014). Wanneer conservatieve behandelingen zoals oefentherapie en hulpmiddelen niet het gewenste (pijnreducerende) effect hebben, moeten patiënten optimaal worden geadviseerd over pijnstilling. Farmacologische analgetica zijn een manier om de pijn bij patiënten met artrose te verlichten. De vraag is welke pijnmedicatie optimaal is bij het bestrijden van klachten (pijn, functionele beperkingen) bij patiënten met artrose van heup of knie.
Conclusies / Summary of Findings
Zoekvraag-1 gecombineerd met zoekvraag-2 (Paracetamol en NSAID’s in vergelijking met placebo)
|
Hoog1 GRADE |
Paracetamol resulteert, ook in de maximaal toegestane dagdosering, niet in een klinisch relevante pijnreductie bij patiënten met knieartrose, in vergelijking met placebo, bij een behandelduur tussen 1 en 26 weken.
|
|
Redelijk1 GRADE |
Paracetamol resulteert, ook in de maximaal toegestane dagdosering, waarschijnlijk niet in een klinisch relevante pijnreductie bij patiënten met heupartrose, in vergelijking met placebo, bij een behandelduur tussen 1 en 26 weken.
Bron: (da Costa 2017) |
|
Hoog2 GRADE |
Etoricoxib en diclofenac resulteren bij de maximaal toegestane dagdosering in een klinisch relevante pijnreductie bij patiënten met knieartrose, in vergelijking met placebo, bij een behandelduur tussen 1 en 26 weken.
|
|
Redelijk2 GRADE |
Etoricoxib en diclofenac resulteren bij de maximaal toegestane dagdosering waarschijnlijk in een klinisch relevante pijnreductie bij patiënten met heupartrose, in vergelijking met placebo, bij een behandelduur tussen 1 en 26 weken.
Bron: (da Costa 2017) |
|
Redelijk3 GRADE |
Celecoxib, naproxen en ibuprofen resulteren bij optimale dosering waarschijnlijk in een klinisch relevante pijnreductie bij patiënten met knieartrose, in vergelijking met placebo, bij een behandelduur tussen 1 en 26 weken.
|
|
Laag3 GRADE |
Celecoxib, naproxen en ibuprofen zouden bij optimale dosering mogelijk kunnen resulteren in een klinisch relevante pijnreductie bij patiënten met heupartrose, in vergelijking met placebo, bij een behandelduur tussen 1 en 26 weken.
Bron: (da Costa 2017) |
|
Hoog4 GRADE |
Paracetamol resulteert, ook in de maximaal toegestane dagdosering, niet in een klinisch relevante verbetering van fysiek functioneren bij patiënten met knieartrose, in vergelijking met placebo, bij een behandelduur tussen 1 en 26 weken.
|
|
Redelijk4 GRADE |
Paracetamol resulteert, ook in de maximaal toegestane dagdosering, waarschijnlijk niet in een klinisch relevante verbetering van fysiek functioneren bij patiënten met heupartrose, in vergelijking met placebo, bij een behandelduur tussen 1 en 26 weken.
Bron: (da Costa 2017) |
|
Hoog5 GRADE |
Diclofenac resulteert bij de maximaal toegestane dagdosering in een klinisch relevante verbetering van fysiek functioneren bij patiënten met knieartrose, in vergelijking met placebo, bij een behandelduur tussen 1 en 26 weken.
|
|
Redelijk5 GRADE |
Diclofenac resulteert bij de maximaal toegestane dagdosering waarschijnlijk in een klinisch relevante verbetering van fysiek functioneren bij patiënten met heupartrose, in vergelijking met placebo, bij een behandelduur tussen 1 en 26 weken.
Bron: da Costa 2017 |
|
Redelijk6 GRADE |
Etoricoxib, naproxen en ibuprofen resulteren bij de maximaal toegestane dagdosering waarschijnlijk in een klinisch relevante verbetering van fysiek functioneren bij patiënten met knieartrose, in vergelijking met placebo, bij een behandelduur tussen 1 en 26 weken.
|
|
Laag6 GRADE |
Etoricoxib, naproxen en ibuprofen zouden bij optimale dosering mogelijk kunnen resulteren in een klinisch relevante verbetering van fysiek functioneren bij patiënten met heupartrose, in vergelijking met placebo, bij een behandelduur tussen 1 en 26 weken.
Bron: da Costa 2017) |
|
Laag7 GRADE |
Celecoxib zou bij de maximaal toegestane dagdosering mogelijk kunnen resulteren in een klinisch relevante verbetering van fysiek functioneren bij patiënten met knieartrose, in vergelijking met placebo, bij een behandelduur tussen 1 en 26 weken.
|
|
Zeer laag7 GRADE |
We zijn onzeker over het effect van celecoxib op verbetering van fysiek functioneren bij patiënten met heupartrose, in vergelijking met placebo, bij een behandelduur tussen 1 en 26 weken.
Bron: (da Costa 2017) |
|
Geen GRADE |
Percentage responders, patiëntgerapporteerde gewrichtsstijfheid, kwaliteit van leven, patiënttevredenheid, participatie, adverse events (bijwerkingen en complicaties), therapietrouw, tijd tot chirurgische interventie, kosten (kosteneffectiviteit), en zorggebruik worden niet gerapporteerd.
Bron: (da Costa 2017) |
Zoekvraag-3 (antidepressiva in vergelijking met placebo)
|
Redelijk1 GRADE |
De SNRI duloxetine resulteert waarschijnlijk in een klinisch relevante pijnreductie bij patiënten met knieartrose, in vergelijking met placebo, bij een behandelduur van tien tot zestien weken.
Bronnen: (Chappel 2009; Chappel 2011; Frakes 2012; Wang 2017; Abou-Raya 2012) |
|
Laag2 GRADE |
De SNRI duloxetine zou mogelijk kunnen resulteren in een klinisch relevante verbetering van fysiek functioneren bij patiënten met knieartrose, in vergelijking met placebo, bij een behandelduur van tien tot zestien weken.
Bronnen: (Chappel 2009; Chappel 2011; Frakes 2012; Wang 2017; Abou-Raya 2012) |
|
Redelijk3 GRADE |
De SNRI duloxetine resulteert waarschijnlijk in een klinisch relevante hogere behandelrespons* bij patiënten met knieartrose, in vergelijking met placebo, bij een behandelduur van tien tot dertien weken.
*percentage patiënten met behandelsucces waarbij behandelsucces is gedefinieerd als tenminste 50% reductie in pijn ten opzichte van baseline.
Bronnen: (Chappel 2009; Chappel 2011; Frakes 2012; Wang 2017) |
|
Hoog4 GRADE |
De SNRI duloxetine resulteert niet in een klinisch relevante verbetering van gewrichtsstijfheid bij patiënten met artrose van de knie, in vergelijking met placebo, bij een behandelduur van tien tot zestien weken.
Bronnen: (Chappel 2009; Frakes 2012; Wang 2017; Abou-Raya 2012) |
|
Redelijk5 GRADE |
De SNRI duloxetine resulteert waarschijnlijk niet in een betere kwaliteit van leven bij patiënten met artrose van de knie, in vergelijking met placebo.
Bronnen: (Chappel 2009, 2011) |
|
Redelijk6 GRADE |
De SNRI duloxetine resulteert waarschijnlijk in meer (milde) bijwerkingen bij patiënten met artrose van de knie, in vergelijking met placebo, bij een behandelduur van tien tot dertien weken.
Een uitspraak over zeldzame (ernstige) bijwerkingen is niet mogelijk.
Bronnen: (Chappel 2009; Chappel 2011; Frakes 2012; Wang 2015, 2017) |
|
Geen GRADE |
De effecten van andere antidepressiva dan duloxetine (tricyclische antidepressiva, specifieke serotonine-heropnameremmers, andere serotonine-noradrenaline-heropnameremmers dan duloxetine) bij patiënten met knieartrose zijn onbekend.
Bronnen: niet van toepassing |
Zoekvraag-4 (vergelijking-1: dermale NSAID’s in vergelijking met placebo)
|
Laag1 GRADE |
Dermale NSAID’s (diclofenac) zouden mogelijk op de korte termijn (twee tot zes weken behandeling) kunnen resulteren in pijnreductie bij patiënten met knieartrose en opvlammende pijn (flare), in vergelijking met placebo (dermale toepassing van alleen de drager).
|
|
Hoog1 GRADE |
Dermale NSAID’s (diclofenac, ketoprofen) resulteren op de langere termijn (zes tot twaalf weken behandeling) niet in een klinisch relevante pijnreductie bij patiënten met knieartrose en opvlammende pijn (flare), in vergelijking met placebo (drager).
Dermale NSAID’s en placebo (dermale toepassing van alleen de drager) resulteren beide in een aanzienlijke pijnreductie ten opzichte van baseline maar de effectiviteit van de actieve interventie is slechts gering groter dan die van placebo.
Bronnen: (Derry 2016; Wadsworth 2016; Yataba 2017) |
|
Laag2 GRADE |
Dermaal diclofenac zou mogelijk op de korte termijn (twee tot zes weken behandeling) kunnen resulteren in een hogere behandelrespons* bij patiënten met knieartrose en opvlammende pijn (flare), in vergelijking met placebo (dermale toepassing van alleen de drager).
|
|
Redelijk2 GRADE |
Dermale NSAID’s (diclofenac, ketoprofen) resulteren op de langere termijn (zes tot twaalf weken behandeling) waarschijnlijk niet in een klinisch relevante hogere behandelrespons* bij patiënten met knieartrose en opvlammende pijn (flare), in vergelijking met placebo (drager).
Dermale NSAID’s en placebo (dermale toepassing van alleen de drager) resulteren beide in een aanzienlijke behandelrespons* ten opzichte van baseline maar de effectiviteit van de actieve interventie is slechts gering groter dan die van placebo.
*percentage patiënten met behandelsucces waarbij behandelsucces is gedefinieerd als tenminste 50% reductie in pijn ten opzichte van baseline, of een vergelijkbare definitie (zeer goed of excellent behandelresultaat, of geen of geringe pijn tijdens rust of activiteit).
Bronnen: (Derry 2016; Wadsworth 2016; Yataba 2017) |
|
Redelijk3 GRADE |
Dermaal diclofenac resulteert waarschijnlijk in een hoger risico op (milde) lokale bijwerkingen bij patiënten met knieartrose en opvlammende pijn (flare), in vergelijking met placebo (drager).
|
|
Redelijk3 GRADE |
Dermaal ketoprofen resulteert waarschijnlijk niet in een hoger risico op (milde) lokale bijwerkingen bij patiënten met knieartrose en opvlammende pijn (flare), in vergelijking met placebo (drager).
Bronnen: (Derry 2016; Wadsworth 2016; Yataba 2017) |
|
Laag4 GRADE |
Dermale NSAID’s lijken niet te resulteren in een hoger risico op (milde) systemische bijwerkingen bij patiënten met knieartrose en opvlammende pijn (flare), in vergelijking met placebo (drager).
Bronnen: (Derry 2016; Wadsworth 2016; Yataba 2017) |
|
Zeer laag5 GRADE |
We zijn onzeker over het effect van dermale NSAID’s op het risico op ernstige bijwerkingen bij patiënten met knieartrose en opvlammende pijn (flare), in vergelijking met placebo (drager).
Bronnen: (Derry 2016; Wadsworth 2016; Yataba 2017) |
Zoekvraag-4 (vergelijking-2: dermale NSAID’s in vergelijking met dezelfde of andere orale NSAID’s)
|
Laag6 GRADE |
Dermale NSAID’s (diclofenac, ketoprofen) lijken te resulteren in een vergelijkbare pijnreductie als orale NSAID’s bij patiënten met symptomatische knieartrose.
Bronnen: (Derry 2016; Mu 2016) |
|
Redelijk7 GRADE |
Dermale NSAID’s (diclofenac, ketoprofen) resulteren waarschijnlijk in een vergelijkbare behandelrespons* als orale NSAID’s bij patiënten met symptomatische knieartrose.
*percentage patiënten met behandelsucces waarbij behandelsucces is gedefinieerd als tenminste 50% reductie in pijn ten opzichte van baseline, of een vergelijkbare definitie (zeer goed of excellent behandelresultaat, of geen of geringe pijn tijdens rust of activiteit).
Bronnen: (Derry 2016; Mu 2016) |
|
Laag8 GRADE |
Dermale NSAID’s lijken te resulteren in een hoger risico op (milde) lokale bijwerkingen bij patiënten met symptomatische knieartrose dan orale NSAID’s.
Bronnen: (Derry 2016; Mu 2016) |
|
Laag9 GRADE |
Dermale NSAID’s lijken te resulteren in een lager risico op (milde) gastrointestinale bijwerkingen dan orale NSAID’s bij patiënten met symptomatische knieartrose.
|
|
Zeer laag9 GRADE |
We zijn onzeker over het effect van dermale NSAID’s op het risico op andere systemische bijwerkingen bij patiënten met symptomatische knieartrose, in vergelijking met orale NSAID’s.
Bronnen: (Derry 2016; Mu 2016) |
|
Zeer laag10 GRADE |
We zijn onzeker over het effect van dermale NSAID’s op het risico op ernstige bijwerkingen bij patiënten met symptomatische knieartrose, in vergelijking met orale NSAID’s.
Bronnen: (Derry 2016; Mu 2016) |
Samenvatting literatuur
De uitgangsvraag omvat twee deelvragen, een deelvraag gericht op behandeling van knieartrose, en een deelvraag gericht op behandeling van heupartrose. Omdat de behandelopties grotendeels vergelijkbaar zijn is in onderstaande literatuuranalyse een indeling gekozen op basis van de relevante (vergelijkingen van) behandelopties, conform de gehanteerde zoekvragen (zie onderdeel Zoeken en selecteren). Daarnaast zijn de eerste twee zoekvragen met betrekking tot paracetamol en NSAID’s gecombineerd.
Zoekvraag-1 Wat zijn de gunstige en ongunstige effecten van orale behandeling met paracetamol in vergelijking met placebo bij volwassen patiënten met klachten als gevolg van artrose aan heup of knie?
Zoekvraag-2 Wat zijn de gunstige en ongunstige effecten van orale behandeling met NSAID’s in vergelijking met placebo bij volwassen patiënten met klachten als gevolg van artrose aan heup of knie?
De zoekvragen zijn gecombineerd. De literatuuranalyse is gebaseerd op een recente systematische review (da Costa 2017) van zeer goede kwaliteit (zie evidence-tabellen onder het tabblad Onderbouwing). Da Costa (2017) analyseert de effectiviteit van NSAID’s en paracetamol, onderling en in vergelijking met placebo, en dekt de literatuur tot 24 februari 2015. Alleen RCT’s met tenminste 100 patiënten per groep, waarvan tenminste 80% met heup- of knieartrose werden geïncludeerd. De analyse werd beperkt tot de NSAID’s die in een eerdere cardiovasculaire veiligheidsanalyse (Trelle 2011) waren opgenomen: rofecoxib, lumiracoxib, etoricoxib, diclofenac, celecoxib, naproxen en ibuprofen.
Voor de studiekarakteristieken en resultaten van de SR en beoordeling van de individuele studieopzet (risk of bias) van de geïncludeerde studies wordt verwezen naar de publicatie van da Costa (2017), een beknopt overzicht is opgenomen in de evidencetabel. De geïncludeerde RCT’s hadden overwegend een laag risico op bias met betrekking tot blindering van patiënten en behandelaars, maar een meerderheid (76%) excludeert tenminste een patiënt van de statistische analyses, en vaak worden suboptimale imputatiemethodes gehanteerd (68% van de RCT’s gebruikt LOCF, last-observation-carried-forward). Vrijwel alle RCT’s werden commercieel gefinancierd, bij 8% van de RCT’s werd de bekostiging onvoldoende beschreven. De SR van da Costa (2017) werd niet commercieel gesponsord. De invloed van methodologische beperkingen op de effectschattingen (pijn) werd uitgebreid onderzocht in sensitiviteitsanalyses: statistische correctie voor blindering van groepstoekenning, blindering van behandelaar, incomplete uitkomstdata, en imputatiemethode (LOCF) had geen noemenswaardig effect op de effectschatters. Een statistische analyse met behulp van ‘comparison adjusted funnel plots’ (zie appendix bij da Costa 2017) leverde geen aanwijzingen voor publicatiebias.
Da Costa (2017) includeert 76 RCT's (totaal 58.451 patiënten): 6 RCT’s bestudeerden patiënten met heupartrose (7% van het patiëntentotaal in de meta-analyse) en 41 RCT’s patiënten met knieartrose (51% van het patiëntentotaal). De overige 29 RCT’s analyseerden pijnstilling in een gemengde studiepopulatie bestaande uit patiënten met heupartrose en/of knieartrose. Omdat de effectiviteit van pijnmedicatie mede afhangt van de gebruikte dosering werden paracetamol en NSAID’s geanalyseerd bij verschillende dagdoseringen (tabel bij Figuur 1): samen met placebo bevat de meta-analyse van da Costa (2017) 23 verschillende interventies. Celecoxib (200 mg/d) was de meest onderzochte actieve interventie (40 RCT’s; 11.507 patiënten kregen celecoxib 200 mg/d) gevolgd door naproxen (1000 mg/d; 7.997 patiënten), bij 4 interventies was er slechts een RCT beschikbaar (paracetamol < 2000mg; etoricoxib 90 mg; diclofenac 70 mg; naproxen 750 mg). Alle RCT’s includeerden tenminste 100 patiënten per groep en alle RCT’s bevatten een placebogroep. De gemiddelde leeftijd in de RCT's varieerde tussen 58 en 71 jaar, en de mediane follow-up bedroeg 12 weken (range tussen 1 en 56 weken; studieduur ≤2 weken: 4 studies; >2-≤6 weken: 25 studies; >6-≤12 weken: 21 studies; >12-≤24 weken: 17 studies; >24 weken: 9 studies).
|
Toelichting bij Figuur |
|||
|
Interventie |
Dagdosering |
Aantal RCT’s |
Positie (Figuur) |
|
placebo |
niet van toepassing |
76 |
01 |
|
paracetamol |
< 2000mg |
1 |
02 |
|
3000mg |
3 |
03 |
|
|
3900–4000mg* |
7 |
04 |
|
|
rofecoxib |
12,5mg |
12 |
05 |
|
25mg* |
14 |
06 |
|
|
50mg |
2 |
07 |
|
|
lumiracoxib |
100mg |
6 |
08 |
|
200mg* |
11 |
09 |
|
|
400mg |
5 |
10 |
|
|
etoricoxib |
30mg |
6 |
11 |
|
60mg* |
4 |
12 |
|
|
90mg |
1 |
13 |
|
|
diclofenac |
70mg |
1 |
14 |
|
100mg |
3 |
15 |
|
|
150mg* |
6 |
16 |
|
|
celecoxib |
100mg |
2 |
17 |
|
200mg |
40 |
18 |
|
|
400mg* |
4 |
19 |
|
|
naproxen |
750mg |
1 |
20 |
|
1000mg* |
15 |
21 |
|
|
ibuprofen |
1200mg |
2 |
22 |
|
2400mg* |
5 |
23 |
|
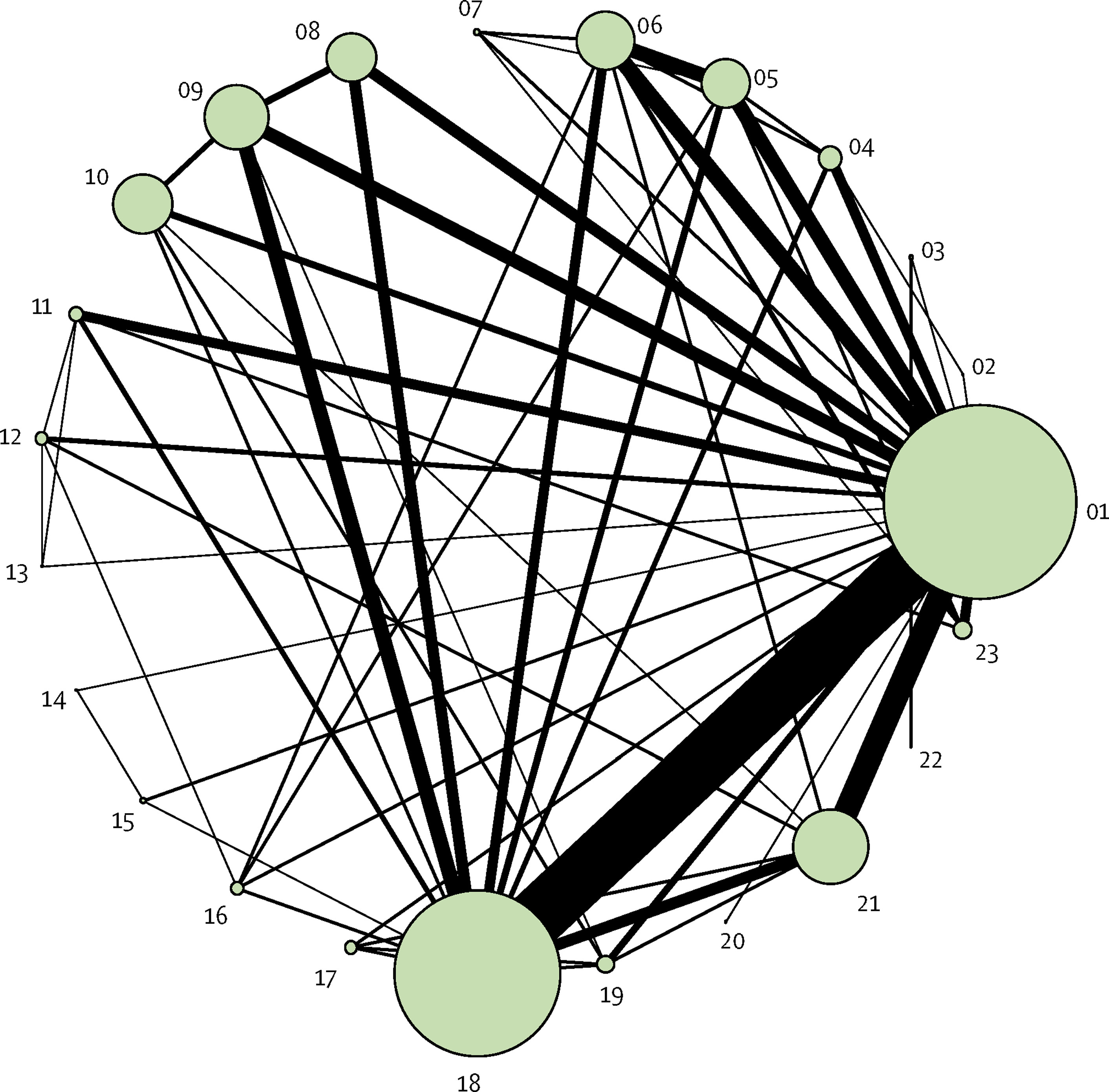
Figuur 1. Overzicht netwerk meta-analyse (da Costa 2017). Het netwerk bevat 23 interventies (cirkels in de figuur) en 76 RCT’s. Het aantal RCT’s beschikbaar per interventie varieert sterk (zie tabel). De grootte van de cirkels is representatief voor de gepoolde groepsgrootte, en de lijndikte voor het aantal RCT’s beschikbaar per (directe) vergelijking. Alle 76 RCT’s in het netwerk bevatten een placebogroep (positie 01 in het netwerk). *maximale toegestane dagdosering. Noot: rofecoxib is in 2004 wereldwijd van de markt gehaald en lumiracoxib is in Nederland niet verkrijgbaar (zie hoofdtekst voor verdere toelichting).
Vanwege het grote aantal relevante behandelopties en het gebrek aan directe (head-to-head) vergelijking tussen deze behandelopties, werd een netwerk meta-analyse uitgevoerd. Een netwerk meta-analyse maakt ook gebruik van informatie afkomstig uit indirecte vergelijkingen tussen interventies, en geeft een completer beeld van de relatieve effectiviteit van de behandelopties. Hierbij moet wel rekening worden gehouden met een eventueel verminderde betrouwbaarheid van effectschattingen die geheel of gedeeltelijk zijn gebaseerd op indirecte data. Een analyse van incoherentie, verschillen tussen directe en indirecte effectschatters, laat echter geen klinisch relevante verschillen zien (appendix bij da Costa 2017). Da Costa (2017) hanteert een Bayesiaans random effects model waarbij informatie van alle beschikbare tijdspunten wordt geïntegreerd (random walk model) en onderscheidt zich hiermee van eerdere netwerk meta-analyses en van klassieke pairwise meta-analyses van pijnmedicatie bij knie- of heupartrose die zich beperken tot een specifieke behandelduur van bijvoorbeeld 6 of 12 weken. De effectschattingen die worden gerapporteerd in da Costa (2017) zijn berekend bij een behandelduur van 6 weken, maar sensitiviteitsanalyses uitgevoerd bij andere tijdspunten geven vergelijkbare effectschattingen, er wordt geen bewijs gevonden voor een invloed van behandelduur op de effectschattingen (appendix bij da Costa 2017). De effectschattingen in da Costa (2017) lijken daarmee geldig voor korte termijn en middellange termijn, behandeling tussen 1 en 26 weken. Da Costa (2017) analyseert pijn en fysiek functioneren. Hierbij werd een hiërarchie van meetinstrumenten gehanteerd waarbij de uitkomstmaat pijn werd gebaseerd op gegevens afkomstig van het hoogst genoteerde meetinstrument, met een hogere notering voor globale pijnscore en pijn bij lopen dan voor de WOMAC pijnschaal (zie evidence tabel op tabblad Onderbouwing voor meer details). De netwerkmodellen voor zowel pijn als fysiek functioneren hebben een goede overall model fit. Er werd geen bewijs gevonden voor een verband tussen pijnreductie en behandelduur (appendix bij da Costa 2017). Effectschattingen worden weergegeven samen met een 95% geloofwaardigheidsinterval (credibility interval, CrI), de Bayesiaanse tegenhanger van het 95% betrouwbaarheidsinterval: er is 95% kans dat het ware effect in het geloofwaardigheidsinterval ligt.
Onderstaande literatuuranalyse is gebaseerd op de netwerk meta-analyses uit da Costa (2017) maar beperkt tot de in Nederland geregistreerde pijnmedicatie. Rofecoxib is in 2004 wereldwijd van de markt gehaald vanwege ernstige cardiovasculaire bijwerkingen, en de registratie van lumiracoxib in Australië, Nieuw-Zeeland en Canada is teruggetrokken vanwege een mogelijk verhoogd risico op leverbeschadiging en dit middel is in Nederland niet verkrijgbaar. Een van de doseringen voor diclofenac (70 mg) is niet verkrijgbaar in Nederland maar kan gelijkwaardig worden beschouwd aan een dosering van 75 mg die wel verkrijgbaar is.
Knieartrose en heupartrose
De studiepopulatie in de netwerk meta-analyse bestaat vooral uit patiënten met knieartrose. De geldigheid van de resultaten van de netwerk meta-analyse voor patiënten met knieartrose wordt ondersteund door het feit dat een statistische correctie voor verschillen tussen de studiepopulaties in de RCT’s (alleen heupartrose, alleen knieartrose, gemengd heup- of knieartrose) geen effect had op de effectschatters (appendix bij da Costa 2017). Omdat slechts 7% van de patiënten in de netwerk meta-analyse afkomstig zijn uit RCT’s met alleen patiënten met heupartrose, kan echter niet worden geconcludeerd dat de effectschatters ook volledig van toepassing zijn op patiënten met heupartrose. De bewijskracht van de resultaten van deze netwerk meta-analyse voor patiënten met heupartrose wordt hierdoor enigszins verlaagd (zie later onder Bewijskracht van de literatuur).
Gewrichtspijn (cruciale uitkomstmaat)
In zowel interventiegroep als placebogroep neemt de pijnintensiteit af ten opzichte van baseline. Alle actieve interventies (paracetamol, NSAID's) resulteren in een grotere gemiddelde pijnreductie (puntschatter) dan behandeling met placebo, onafhankelijk van de gebruikte dosering (Figuur 2). Bij lagere doseringen van paracetamol (< 2000 mg/d, 3000 mg/d), diclofenac (70 mg/d), celecoxib (100mg/d), naproxen (750 mg/d) en ibuprofen (1200 mg/d) is het voordeel in pijnreductie ten opzichte van placebo statistisch niet significant. Bij alle doseringen van etoricoxib (30 mg/d, 60 mg/d, 90 mg/d) en de hogere doseringen van diclofenac (100 mg/d, 150 mg/d), naproxen (1000 mg/d) en ibuprofen (2400 mg/d) overtreft de effectgrootte (puntschatter) het door de werkgroep benoemde minimaal klinisch relevant verschil (MCID) van 0,37 (stippellijn in Figuur 2). Bij etoricoxib (alle doseringen) en de hoogste doseringen van diclofenac (maximale dagdosering van 150 mg/d) overtreft de effectschatting (95% geloofwaardigheidsinterval, CrI) geheel de MCID: er is tenminste 95% kans dat deze interventies pijn reduceren ten opzichte van placebo met de MCID of meer. Omgekeerd ligt de effectschatting (95% CrI) bij de hoogste dosering paracetamol (maximale dagdosering van 3900 tot 4000 mg/d; voor deze dosering zijn de meeste data beschikbaar in zowel directe als indirecte vergelijkingen) geheel onder de MCID (dichter bij het nuleffect) en is er grote zekerheid dat paracetamol niet resulteert in een klinische relevante pijnreductie. Da Costa bepaalde de rangvolgorde van de interventies aan de hand van de mediane rangvolgorde, kans op het bereiken van de MCID, en SUCRA waarde (Figuur 3). De SUCRA waarde (surface under the cumulative ranking curve) is gebaseerd op zowel locatie (relatieve effectgrootte) als onzekerheid (variantie) van alle interventies in de netwerk meta-analyse. Als rofecoxib buiten beschouwing wordt gelaten (wereldwijd van de markt gehaald vanwege ernstige cardiovasculaire bijwerkingen) dan zijn de top-3 interventies met hoogste SUCRA waardes en daarmee grootste kans om de meest effectieve interventie te zijn: etoricoxib 60 mg/d, etoricoxib 90 mg/d en diclofenac 150 mg/d. De kans op het bereiken van een klinisch relevant effect (MCID) werd geschat op 100% bij de maximaal toegestane dagdosering van zowel etoricoxib (60 mg/d) als diclofenac (diclofenac 150 mg/d).
Samenvattend is er sterk bewijs dat paracetamol ook bij de maximaal toegestane dagdosering niet leidt tot een klinisch relevante pijnreductie ten opzichte van placebo. Bij optimale dosering leiden de NSAID's celecoxib, naproxen en ibuprofen waarschijnlijk wel tot een klinisch relevante pijnreductie, terwijl etoricoxib en diclofenac bij de maximaal toegestane dagdosering vrijwel zeker leiden tot een klinisch relevante pijnreductie. Deze conclusies gelden voor korte termijn tot middellange termijn, een behandelduur tussen 1 en 26 weken. De effectschattingen bij vergelijkingen tussen de actieve interventies (paracetamol, NSAID’s) en placebo zijn zeer betrouwbaar mede door de grote hoeveelheid directe evidence, alle RCT’s bevatten een placebogroep. Voor onderlinge vergelijkingen tussen actieve interventies is veel minder directe evidence beschikbaar, zo is er bijvoorbeeld slechts een RCT in de netwerk meta-analyse die etoricoxib rechtstreeks vergelijkt met diclofenac bij de maximale toegestane dagdosering.
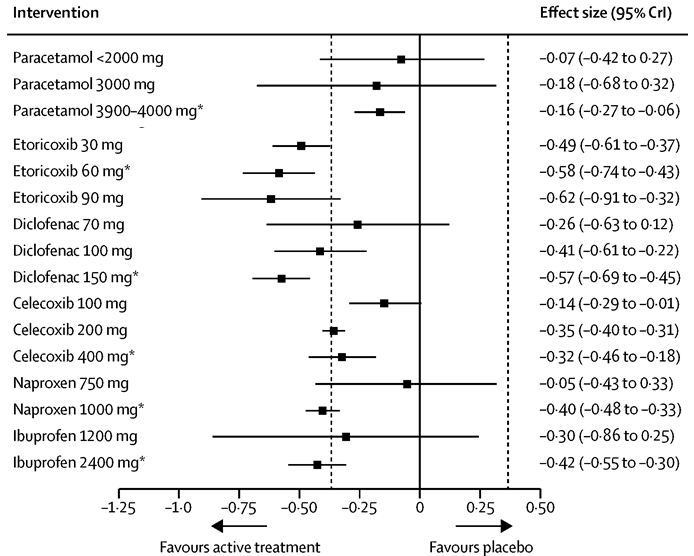
Figuur 2. Forest plot van het effect van verschillende dagdoseringen paracetamol en NSAID’s op gewrichtspijn bij patiënten met heup- of knieartrose, in vergelijking met placebo (da Costa 2017). Uitkomstmaat: reductie in pijn ten opzichte van baseline. Bayesiaanse netwerk meta-analyse (random effects model) gebaseerd op alle beschikbare tijdspunten (random walk model); gestandaardiseerde netwerk effectgrootte (mediaan groepsverschil met 95% geloofwaardigheidsinterval). De stippellijnen geven de MCID weer (0,37 SD). *maximale toegestane dagdosering. Alleen resultaten voor de in Nederland geregistreerde NSAID’s zijn weergegeven.
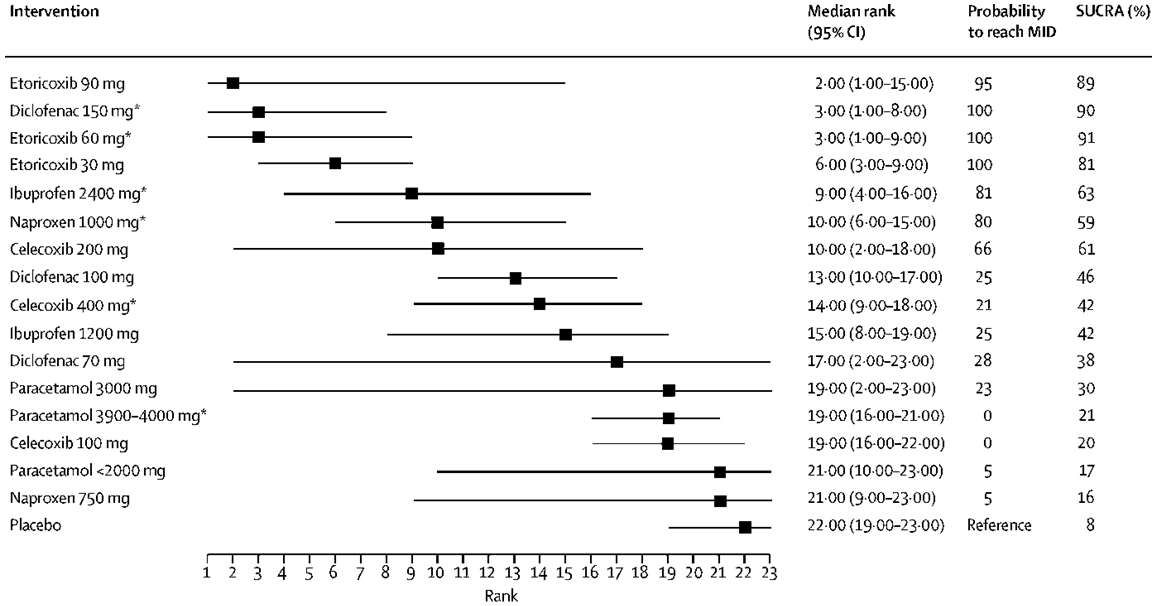
Figuur 3. Hiërarchie van interventies voor pijnreductie: mediane rangvolgorde, kans op het bereiken van de MCID, en SUCRA (da Costa 2017). De SUCRA waarde (surface under the cumulative ranking curve) is gebaseerd op zowel locatie (relatieve effectgrootte) als onzekerheid (variantie) van alle interventies (hoger is beter). *maximale toegestane dagdosering. Alleen resultaten voor de in Nederland geregistreerde NSAID’s zijn weergegeven.
Fysiek functioneren (cruciale uitkomstmaat)
Alle actieve interventies resulteren in een grotere verbetering van fysiek functioneren dan placebo, met uitzondering van paracetamol in laagste dagdosering (Figuur 4). Bij paracetamol (< 2000 mg/d, 3000 mg/d), diclofenac (70 mg/d), naproxen (750 mg/d) en ibuprofen (1200 mg/d) is het verschil ten opzichte van placebo statistisch niet significant. Bij etoricoxib (30 mg/d, 60 mg/d; geen data beschikbaar voor 90 mg/d), de hogere doseringen van diclofenac (100 mg/d, 150 mg/d), naproxen (1000 mg/d) en ibuprofen (1200 mg/d, 2400 mg/d) overtreft de effectgrootte (puntschatter) het door de werkgroep benoemde minimaal klinisch relevant verschil (MCID) van 0,37 (stippellijn in Figuur Z). Alleen bij de hoogste dosering van diclofenac (maximale dagdosering van 150 mg/d) overtreft de effectschatting (95% geloofwaardigheidsinterval, CrI) geheel de MCID en is er tenminste 95% kans dat fysiek functioneren verbetert ten opzichte van placebo met de MCID of meer. De effectschatting (95% CrI) bij de hoogste dosering paracetamol (maximale dagdosering van 3900 tot 4000 mg/d) ligt daarentegen geheel onder de MCID en is er grote zekerheid dat paracetamol niet resulteert in een klinische relevante verbetering in fysiek functioneren.
Samenvattend is er sterk bewijs dat paracetamol ook bij de maximaal toegestane dagdosering niet leidt tot een klinisch relevante verbetering in fysiek functioneren ten opzichte van placebo. De NSAID’s etoricoxib, naproxen en ibuprofen resulteren bij maximale toegestane dosering waarschijnlijk wel in een klinisch relevante verbetering van fysiek functioneren, voor celecoxib is dit onzekerder. Tenslotte resulteert diclofenac bij de maximaal toegestane dagdosering vrijwel zeker in een klinisch relevante verbetering van fysiek functioneren. Deze conclusies gelden voor korte termijn tot middellange termijn, een behandelduur tussen 1 en 26 weken.
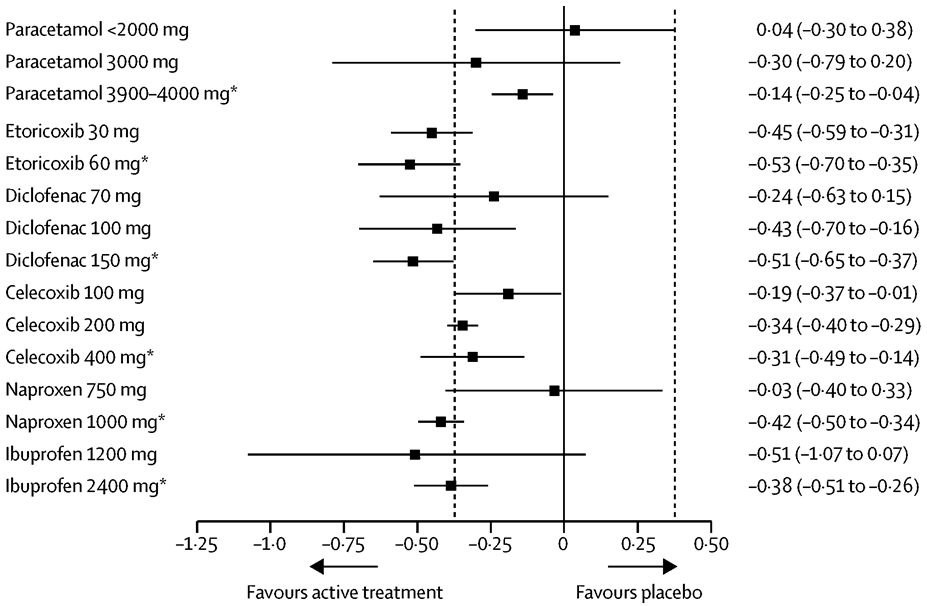
Figuur 4. Forest plot van het effect van verschillende dagdoseringen paracetamol en NSAID’s op fysiek functioneren bij patiënten met heup- of knieartrose, in vergelijking met placebo (da Costa 2017). Uitkomstmaat: verbetering in fysiek functioneren ten opzichte van baseline. Bayesiaanse netwerk meta-analyse (random effects model) gebaseerd op meerdere tijdspunten (random walk model); gestandaardiseerde effectgrootte (mediaan groepsverschil met 95% geloofwaardigheidsinterval). De stippellijnen geven de MCID weer (0,37 SD). *maximale toegestane dagdosering. Alleen resultaten voor de in Nederland geregistreerde NSAID’s zijn weergegeven.
Overige uitkomstmaten (belangrijke uitkomstmaten)
Overige uitkomstmaten (zie Relevante uitkomstmaten onder Zoeken en selecteren) zoals gewrichtsstijfheid, kwaliteit van leven, responderanalyses, en kosten werden niet als uitkomstmaat beschreven in da Costa 2017). Bijwerkingen en complicaties (adverse events; belangrijke uitkomstmaat) worden niet beschreven in da Costa (2017). In een eerdere publicatie van dezelfde auteurs (Trelle 2011) wordt de cardiovasculaire veiligheid van de NSAID’s geanalyseerd bij een brede studiepopulatie, niet beperkt tot patiënten met heup- of knieartrose (zie Overwegingen).
Zoekvraag-3 Wat zijn de gunstige en ongunstige effecten van orale behandeling met antidepressiva (tricyclische antidepressiva, specifieke serotonine-heropnameremmers en serotonine-noradrenaline-heropnameremmers) in vergelijking met placebo bij volwassen patiënten met klachten als gevolg van artrose aan heup of knie?
De literatuuranalyse is gebaseerd op een systematische review (Wang 2015) en twee aanvullende RCT’s (Wang 2017; Abou-Raya 2012). Wang (2015) is van goede kwaliteit en dekt de literatuur tot en met oktober 2013 en includeert drie RCT’s (Chappel, 2009 & 2011; Frakes 2011). De RCT’s werden ook in volledige tekst geraadpleegd voor ontbrekende uitkomstmaten. Alle geïncludeerde studies betreffen de serotonine-noradrenaline-heropnameremmer (SNRI) duloxetine, er werden geen relevante studies gevonden naar andere antidepressiva. De NICE-richtlijn (NICE 2014) en NHG-standaard (NHG 2016) beschrijven een kleine RCT (24 deelnemers) naar het tricyclisch antidepressivum imipramine Scott (1969), maar deze includeert slechts 7 patiënten met artrose en is daarom hier buiten beschouwing gelaten.
Beschrijving studies
Wang (2015) includeerde 3 RCT’s (Chappel, 2009 & 2011; Frakes 2011), samen met de 2 aanvullende RCT’s (Abou-Raya 2012 en Wang 2017) zijn daarmee ín totaal 5 RCT’s geselecteerd voor de beantwoording van deze vraag. Opvallend is dat ze alle gesponsord werden door de fabrikant (Eli Lilly) van het antidepressivum (duloxetine). Alle RCT’s beschreven patiënten met kniepijn door artrose aan de knie, waarbij de veiligheid en effectiviteit van duloxetine vergeleken werd met placebo. In deze RCT’s kregen de patiënten 60-120 mg duloxetine dan wel placebo gedurende 10 tot 16 weken (10 weken in Frakes 2011, 13 weken in Chappel 2009 & 2011, en 16 weken in Abou-Raya 2012). De gemiddelde leeftijd van deelnemers varieerde tussen de 60 en 69 jaar. De tijdsduur gedurende welke ze aan pijnklachten leden als gevolg van artrose aan de knie varieerde van 5,6 tot 9,8 jaar. Het design van Frakes (2011) week af van de overige RCT’s: in Frakes (2011) kregen de patiënten eerst een optimale pijnbehandeling met NSAID’s, voordat ze werden gerandomiseerd naar duloxetine dan wel placebo.
Voor de studiekarakteristieken en resultaten van Wang (2015) en beoordeling van de individuele studieopzet (risk of bias) van de geïncludeerde studies wordt verwezen naar de publicatie van Wang (2015), een beknopt overzicht is opgenomen in de evidencetabel. De belangrijkste studiekarakteristieken en resultaten van de aanvullende studies zijn eveneens opgenomen in de evidencetabel, de beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen. De studiekwaliteit was redelijk tot hoog. De belangrijkste tekortkoming betreft uitval van patiënten, die groter is in de duloxetinegroepen (15 tot 31% uitval in vergelijking met 9-23% in de controlegroepen), met name vanwege bijwerkingen van de medicatie. Pijnbeleving is cultuur gebonden, en belangrijk is om te vermelden dat twee van de geïncludeerde RCT’s niet-westerse patiëntengroepen betreffen, uit Egypte (Abou-Raya 2012) en China (Wang 2017). Tenslotte zijn er recent twijfels gerezen over publicaties van Abou-Raya en is een studie teruggetrokken naar de effecten van methotrexaat op symptomatische knieartrose vanwege ernstige verdenking op fraude (Abou-Raya 2014). Daarom wordt in onderstaande analyses telkens het effect van exclusie van de RCT van Abou-Raya (Abou-Raya 2012) besproken.
Gewrichtspijn (cruciale uitkomstmaat)
De meta-analyse van Wang (2015) is aangevuld met Abou-Raya (2012) en Wang (2017; zie Figuur 5). In zowel duloxetinegroep als placebogroep nam de gewrichtspijn bij patiënten met artrose aan de knie af (gemeten met WOMAC, Brief Pain Inventory of Numeric Rating Scale) ten opzichte van baseline. Behandeling met duloxetine resulteert in een statistisch significant grotere pijnreductie dan behandeling met placebo: gestandaardiseerd gemiddeld groepsverschil (Standardized Mean Difference, SMD), SMD= -0,40 (95%BI= (-0,50; -0,28)). Na exclusie van Abou-Raya (2012) bedraagt het groepsverschil, SMD= -0,35 (-0,49; -0,22). Er is nauwelijks sprake van statistische heterogeniteit. Bij patiënten die eerst een optimale pijnbehandeling met een NSAID kregen werd een vergelijkbaar effect gezien voor duloxetine in vergelijking met placebo: SMD= -0,52 (95% BI= (-0,69; -0,34)). In beide gevallen overtreft het gemiddelde effect het door de werkgroep benoemde minimaal klinisch relevant verschil (MCID) van 0,37, maar de effectschatting (betrouwbaarheidsinterval) overlapt wel met de MCID. Exclusie van Abou-Raya (2012) beïnvloedt de effectschatting slechts in gering mate.
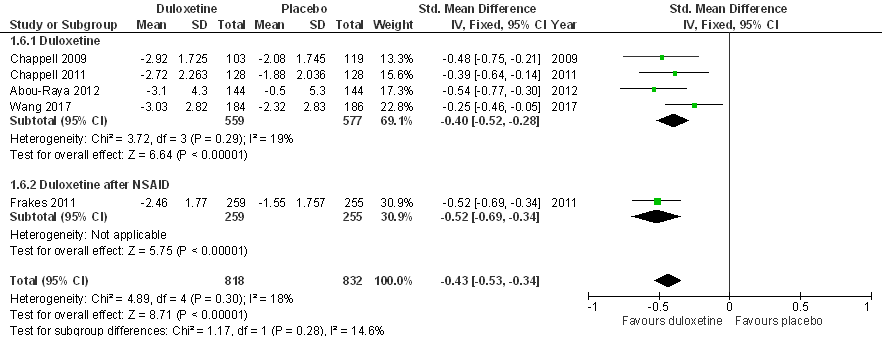
Figuur 5. Forest plot van het effect van duloxetine op gewichtspijn bij knieartrose in vergelijking met placebo. Uitkomstmaat: reductie in pijn ten opzichte van baseline, gemeten na 10-16 weken behandeling (1,650 deelnemers); Gestandaardiseerd gemiddeld groepsverschil (Standardized Mean Difference, SMD)
Fysiek functioneren (cruciale uitkomstmaat)
De meta-analyse van Wang (2015) is aangevuld met Abou-Raya (2012) en Wang (2017; zie Figuur 6). Het gemiddelde groepsverschil (mean difference, MD) op de WOMAC subschaal fysiek functioneren (schaal van 0-68, lager is beter) was: MD= -3,8 (95% BI (-5,39; -2,21)), statistisch significant in het voordeel van duloxetine. Er is sprake van matige statistische heterogeniteit (I2= 44%), maar in alle RCT’s is de verbetering in fysiek functioneren het grootst in de interventiegroep. Na exclusie van Abou-Raya (2012) bedraagt het groepsverschil, SMD= -2,9 (-4.3; -1.5) (statististiche heterogeniteit, I2= 0%). Bij patiënten die eerst een optimale pijnbehandeling met een NSAID kregen (Frakes 2011), was een iets groter voordeel te zien voor duloxetine in vergelijking met placebo: MD= -4,84 (95% BI (-7,11; -2,57)). In alle gevallen ligt het gemiddelde effect onder het door de werkgroep benoemde minimaal klinisch relevant verschil (een verschil in SMD van 0,37 vertaalt zich in ongeveer 5 punten op een 0-68 meetschaal), maar de effectschatting (betrouwbaarheidsinterval) overlapt wel met de MCID.
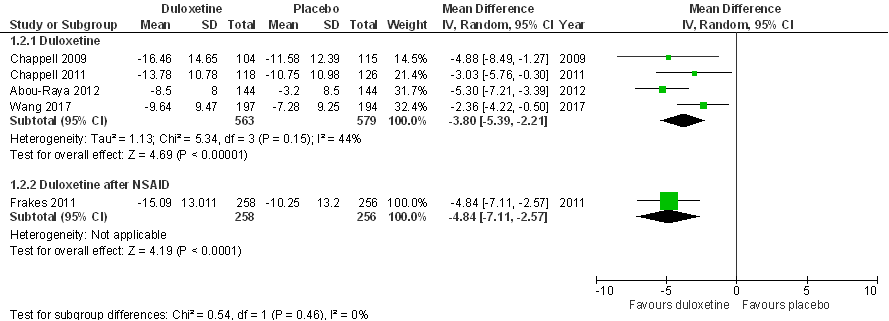
Figuur 6. Forest plot van het effect van duloxetine op fysiek functioneren bij knieartrose in vergelijking met placebo. Uitkomstmaat: verbetering in fysiek functioneren (WOMAC subschaal fysiek functioneren, 0-68) ten opzichte van baseline, gemeten na 10-16 weken behandeling (1,656 deelnemers); gemiddeld groepsverschil (Mean Difference, MD).
Percentage responders (belangrijke uitkomstmaat)
Wang (2015) definieert responders als patiënten met tenminste 50% reductie in pijn ten opzichte van baseline (bepaalt op basis van de primaire uitkomstvariabele voor pijn). De meta-analyse (Figuur 7) is aangevuld met Wang (2017) en Frakes (2011), Abou-Raya (2012) rapporteert deze uitkomstmaat niet. De resultaten voor Frakes worden in een subgroep gepresenteerd aangezien deze patiënten eerst optimale pijnbestrijding kregen met NSAID’s. Behandeling met duloxetine gedurende 13 weken resulteert in behandelsucces bij gemiddeld 44% (range 43-47%) van de patiënten in vergelijking met 33% (range 29-35%) van de patiënten behandeld met placebo: relatief risico (Risk Ratio, RR), RR= 1,36 (95%BI= (1,14; 1,61); 866 deelnemers). Dit vertaalt zich naar NNT= 8,6 (5,0; 22,0). Er is geen sprake van statistische heterogeniteit. Bij Frakes (2011) bedraagt het behandelsucces in interventie- en controlegroep respectievelijk 36% en 16%: RR= 2,21 (1,60; 3,06), NNT= 5,1 (3,0; 10,4). In beide gevallen overtreft het gemiddelde effect de default grens voor een klinisch relevant effect (25% verschil in relatief risico), maar overlapt de gepoolde effectschatting (betrouwbaarheidsinterval) wel met deze grens.
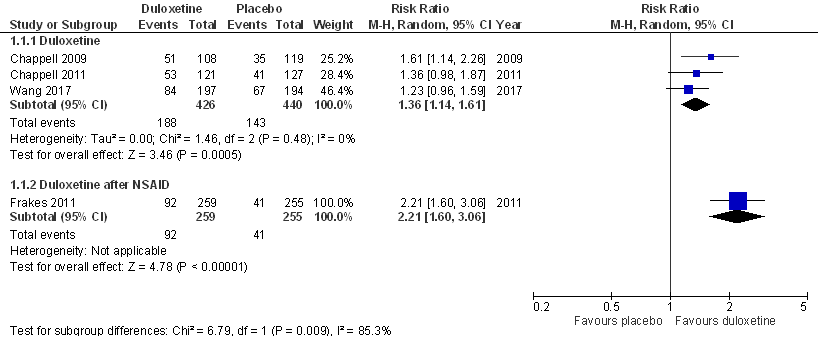
Figuur 7. Forest plot van het effect van duloxetine bij knieartrose op de kans op behandelsucces in vergelijking met placebo. Uitkomstmaat: relatieve kans op behandelsucces gemeten na 10-13 weken behandeling (1.380 deelnemers). Relatief risico (Risk Ratio, RR)
Gewrichtsstijfheid (belangrijke uitkomstmaat)
De SR van Wang (2015) analyseert deze uitkomstmaat niet en daarom zijn de originele publicaties van de geïncludeerde RCT’s geraadpleegd. Chappel (2011) geeft aan dat er geen statistisch significant verschil bestaat tussen interventie- en controlegroep, maar geeft geen verdere details. De overige RCT’s rapporteren de uitkomstmaat wel (Figuur 8). Behandeling met duloxetine resulteert in een statistisch significant grotere verbetering in patiëntgerapporteerde gewrichtsstijfheid dan behandeling met placebo (WOMAC subschaal stijfheid; 0-8 meetschaal): gemiddeld groepsverschil (Mean Difference, MD), MD= -0,43 (95%BI (-0,65; -0,20)). Dit vertaalt zich in een gestandaardiseerd gemiddeld verschil, SMD= -0,24 (-0,40; -0,07). Na exclusie van Abou-Raya (2012) bedraagt het groepsverschil, SMD= -0,32 (-0,48; -0,15). Bij patiënten die eerst een optimale pijnbehandeling met een NSAID kregen (Frakes 2011), was een iets groter voordeel te zien voor duloxetine in vergelijking met placebo (WOMAC subschaal stijfheid; 0-8 meetschaal): MD= -0,50 (-0,81; -0,19)), SMD= -0,28 (-0,45; -0,10). In alle gevallen ligt het gemiddelde effect onder de default grens voor een klinisch relevant effect (0,5 standaarddeviatie), en overlapt de effectschatting (betrouwbaarheidsinterval) niet met deze grens.
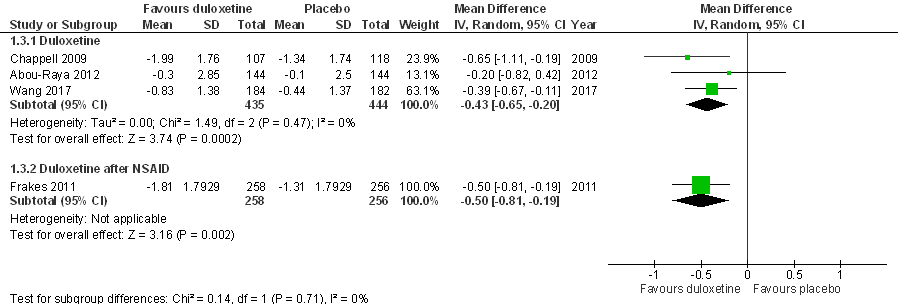
Figuur 8. Forest plot van het effect van duloxetine bij knieartrose op gewrichtsstijfheid in vergelijking met placebo. Uitkomstmaat: verbetering in gewrichtsstijfheid (WOMAC subschaal stijfheid, 0-8 meetschaal) ten opzichte van baseline, gemeten na 10-16 weken behandeling (1,393 deelnemers); gemiddeld groepsverschil (Mean Difference, MD).
Kwaliteit van leven (belangrijke uitkomstmaat)
In twee van de onderzoeken zijn uitkomstmaten die gerelateerd zijn aan kwaliteit van leven gerapporteerd (SF-36 in Chappell 2009, 2011; EQ-5D in Chappell 2009). Deze uitkomsten werden gerapporteerd voor verschillende domeinen van deze vragenlijsten. Op enkele domeinen werden statistisch significante verschillen tussen de duloxetine en placebogroep gezien, maar deze verschillen waren gering (< 0,5 standaarddeviatie) en niet klinisch relevant.
Adverse events (bijwerkingen, complicaties; belangrijke uitkomstmaat)
Wang (2015) analyseert TEAE’s (treatment emergent adverse events). Met name misselijkheid, constipatie, droge mond, diarree, vermoeidheid, duizeligheid, slaperigheid en slapeloosheid kwamen statistisch significant vaker voor bij patiënten behandeld met duloxetine: misselijkheid (bij 6 tot 15% van de patiënten in de duloxetinegroep versus 2 tot 5% van de patiënten in de placebogroep), vermoeidheid (2 tot 7% versus 0,8 tot 1,5%), constipatie (4 tot 9% versus 2 tot 3%), overmatig transpireren (1 tot 5% versus 0,5 tot 1%), slaperigheid (4 tot 5% versus 1 tot 3%), duizeligheid (4 tot 6% versus 1,5 tot 3%), diarree (4 tot 7% versus 2 tot 4%), slapeloosheid (3 tot 5% versus 1 tot 2%) en droge mond (2 tot 10% versus 1 tot 3%). Het risico op TEAE’s is statistisch significant hoger bij duloxetinebehandeling in vergelijking met placebo (Figuur 9): relatief risico RR= 1,41 (95% BI (1,22-1,63)). Het gemiddelde effect overtreft de default grens voor een klinisch relevant effect (25% verschil in relatief risico), maar de gepoolde effectschatting (betrouwbaarheidsinterval) overlapt wel met deze grens. De resultaten voor Frakes worden in een subgroep gepresenteerd aangezien deze patiënten eerst optimale pijnbestrijding kregen met NSAID’s: RR= 1,27 (95% BI (1,09; 1,47)). Patiënten behandeld met duloxetine blijken statistisch significant, en klinisch relevant, vaker hun deelname aan de studie te beëindigen: relatief risico RR= 2,32 (95%BI (1,52; 3,54)).
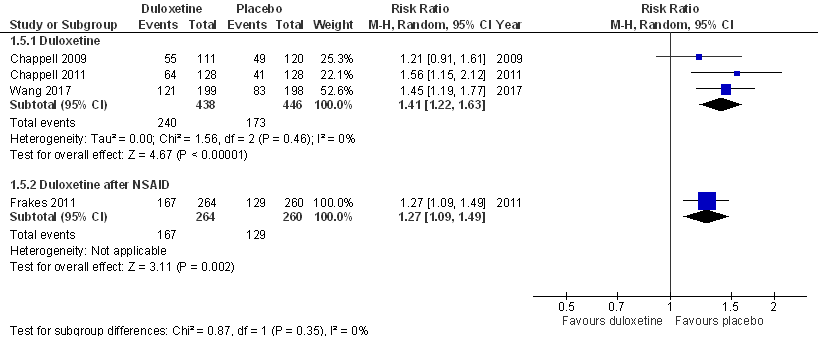
Figuur 9. Forest plot van het effect van duloxetine bij knieartrose op de kans op (milde) bijwerkingen (treatment emergent adverse events, TEAE’s) in vergelijking met placebo. Uitkomstmaat: TEAE’s tijdens 10 tot 13 weken behandeling (1.408 deelnemers). Relatief risico (Risk Ratio, RR).
Er deden zich geen sterfgevallen voor in de geïncludeerde RCT’s. Ernstige adverse events waren zeldzaam, en hun aantal vergelijkbaar tussen duloxetine- en placebogroepen. Hierbij moet wel worden opgemerkt dat de studieomvang ook na pooling ontoereikend is voor een betrouwbare analyse van zeldzame (ernstige) adverse events.
Overige uitkomstmaten (belangrijke uitkomstmaten)
Overige uitkomstmaten werden niet beschreven in Wang (2015, en geïncludeerde RCT’s) of aanvullende RCT’s.
Heupartrose
Deze behandeloptie/ vergelijking ontbreekt in de NICE richtlijn (NICE 2014), en de NHG-standaard heeft betrekking op patiënten met knieartrose. De literatuurzoekactie in de huidige richtlijn (vanaf het jaar 2008) leverde geen relevante SR’s of RCT’s op met betrekking tot behandeling van patiënten met heupartrose.
Zoekvraag-4. Wat zijn de gunstige en ongunstige effecten van behandeling met dermale NSAID’s in vergelijking met orale NSAID’s of placebo bij volwassen patiënten met klachten als gevolg van artrose aan de knie?
Behandeling van heupartrose met dermale NSAID’s is vanwege het dieperliggende gewricht weinig zinvol (alhoewel trials ontbreken), en daarom is de literatuuranalyse beperkt tot behandeling van klachten als gevolg van knieartrose.
Knieartrose
De literatuuranalyse is gebaseerd op een recente Cochrane SR (Derry 2016) van zeer goede kwaliteit (zie evidence-tabellen onder het tabblad Onderbouwing) die de literatuur dekt tot februari 2016, aangevuld met drie recente RCT’s (Mu 2016; Wadsworth 2016; Yataba 2017). Voor de studiekarakteristieken en resultaten van de Cochrane SR en beoordeling van de individuele studieopzet (risk of bias) van de geïncludeerde studies wordt verwezen naar de publicatie van Derry (2016), een beknopt overzicht is opgenomen in de evidencetabel. De belangrijkste studiekarakteristieken en resultaten van de aanvullende studies zijn eveneens opgenomen in de evidencetabel, de beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Derry (2016) includeert RCT's met een studieduur van tenminste twee weken die behandeling met dermale NSAID's (tenminste eenmaal daags) vergelijken met orale NSAID's of placebo (drager) bij volwassenen met chronische musculoskeletale pijn. Alleen RCT’s waarin behandelaars en patiënten waren geblindeerd voor de gerandomiseerde interventies werden geïncludeerd. Duur van de pijn diende tenminste drie maanden te zijn en de pijnintensiteit tenminste matig. De SR analyseert vier vergelijkingen (dermaal NSAID versus dermaal drager; dermaal NSAID versus (zelfde of andere) orale NSAID; dermale NSAID versus andere dermale NSAID; dermale NSAID versus andere dermale behandeloptie) waarvan alleen de vergelijking dermaal NSAID versus dermaal drager (placebo), en dermaal NSAID versus (zelfde of andere) orale NSAID relevant zijn voor de huidige uitgangsvraag. Primaire uitkomstmaat was de behandelrespons (klinisch succes) gedefinieerd als tenminste 50% reductie in pijn ten opzichte van baseline, of een vergelijkbare definitie van behandelsucces zoals een zeer goed of excellent behandelresultaat, of geen of geringe pijn tijdens rust of activiteit, gemeten op een ordinale schaal. Derry (2016) includeert in totaal 39 studies, het merendeel betreft vergelijking van een dermale NSAID met placebo (drager) bij patiënten met (radiologisch bevestigde) primaire knieartrose. De gemiddelde leeftijd van deelnemers varieert tussen 59 en 65 jaar en de studieduur tussen 2 en 12 weken.
De studiekwaliteit beoordeeld met de Cochrane Risk of Bias tool, is overwegend matig tot hoog (zie RoB tabel in Derry 2016). De belangrijkste tekortkomingen betreffen de geringe studiegrootte en studieduur van met name de oudere RCT’s die kan leiden tot een overschatting van het behandeleffect (zie Figuur 10). In de analyses wordt daarom waar mogelijk onderscheid gemaakt tussen studies met een studieduur van 2-6 weken en 6-12 weken, waarbij de resultaten verkregen op basis van de langer lopende RCT’s betrouwbaarder zijn (lagere kans op bias).
Onderstaande literatuuranalyse is gebaseerd op de meta-analyses uit Derry (2016) maar de analyses zijn beperkt tot RCT’s bij patiënten met knieartrose, en waar relevant aangevuld met de drie recente RCT’s (Wadsworth 2016; Mu 2016; Yataba 2017). De studiekwaliteit van de aanvullende studies is matig tot hoog. Vrijwel alle RCT’s opgenomen in Derry (2016) alsook de drie aanvullende studies zijn gesponsord door de fabrikant van de dermale formuleringen.
Dermaal NSAID versus dermaal drager (placebo)
Analyses zijn gebaseerd op de Cochrane review van Derry (2016) en aanvullende studies (Wadsworth 2016; Yatabe 2017). Het merendeel van de RCT's betreft expliciet patiënten met opvlammende pijn (ook wel flares genoemd; Baraf 2011, Baer 2005, Roth 2004, Grace 1999, Wadsworth 2016, Yatabe 2017), in alle gevallen is er sprake van tenminste een matige pijnintensiteit op baseline. Pooling van onderzoeksresultaten was mogelijk voor diclofenac (Derry 2016; Wadsworth 2016) en ketoprofen (Derry 2016). Wadsworth (2016) is een Noord-Amerikaanse RCT die diclofenac dermaal (2% oplossing) vergelijkt met placebo (drager) bij volwassenen met knieartrose en een behandelduur van 4 weken. De Japanse RCT van Yataba (2017) daarentegen betreft als enige S-flurbiprofen (pleisters). S-flurbiprofen is een enantiomeer van flurbiprofen. Flurbiprofen (zuigtablet) is geregistreerd in Nederland voor kortdurende behandeling van keelpijn. Omdat flurbiprofen pleisters niet zijn geregistreerd in Nederland en flurbiprofen zuigtabletten alleen geregistreerd voor kortdurende behandeling van keelpijn, worden de resultaten van deze studie alleen kort vermeld.
Gewrichtspijn (cruciale uitkomstmaat)
Omdat Derry (2016) gewrichtspijn niet analyseert als een afzonderlijke continue uitkomstmaat, maar alleen als onderdeel van de uitkomstmaat behandelrespons, zijn de originele publicaties geraadpleegd (zie evidencetabel).
Diclofenac
In zowel interventiegroep als placebogroep neemt de pijnintensiteit (WOMAC pijnscore) af ten opzichte van baseline. Behandeling met diclofenac dermaal resulteert in een statistisch significant grotere pijnreductie dan behandeling met placebo: gestandaardiseerd gemiddeld groepsverschil (Standardized Mean Difference, SMD), SMD=-0,21 (95%BI=(-0,30; -0,13); 2.342 deelnemers) bij een behandelduur van 6 tot 12 weken, en -0,43 (95%BI=(-0,56; -0,30); 991 deelnemers) bij een behandelduur van 2-6 weken (Figuur 10). Er is sprake van een matige statistische heterogeniteit maar in alle RCT's is de pijnreductie het grootst in de interventiegroep. Bij de kortlopende studies (2-6 weken; matige studiekwaliteit) overtreft het gemiddelde effect het door de werkgroep benoemde minimaal klinisch relevant verschil (MCID) van 0,37, maar overlapt de effectschatting (betrouwbaarheidsinterval) wel met de MCID. Bij de langer lopende studies (6 tot 12 weken behandeling; hoge studiekwaliteit) ligt de effectschatting na pooling geheel onder de MCID en lijkt geen sprake van een klinisch relevant verschil in vergelijking met placebobehandeling. Bij de interpretatie van de resultaten moet rekening worden gehouden met mogelijke vertekening van de resultaten in het voordeel van de dermale NSAID's als gevolg van publicatiebias. Vrijwel alle RCT's zijn gesponsord door de fabrikant van de dermale NSAID, de forest plot (Figuur 10) suggereert een overschatting van de effectiviteit van dermaal diclofenac in de vroege RCT's, en de asymmetrische funnel plot (Figuur 11) is eveneens een aanwijzing voor publicatiebias.
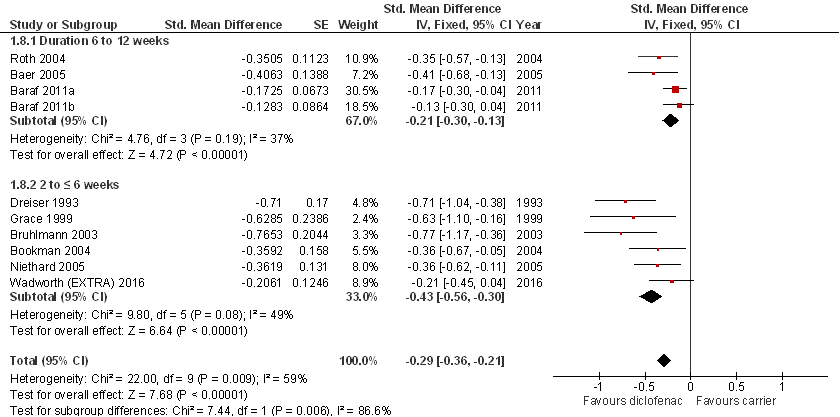
Figuur 10. Forest plot van het effect van dermale toepassing van diclofenac bij knieartrose op gewrichtspijn in vergelijking met dermale toepassing van de drager (placebo). Baraf (2011) onderscheidt bij analyse van WOMAC pijn 2 subgroepen: 25 tot 64 jaar (in forest plot aangeduid als Baraf 2011a) en 65 jaar en ouder (aangeduid met Baraf 2011b). Uitkomstmaat: reductie in WOMAC pijn ten opzichte van baseline, gemeten na 6 tot 12 weken behandeling (2.342 deelnemers), of na 2 tot 6 weken behandeling (991 deelnemers). Gestandaardiseerd gemiddeld groepsverschil (Standardized Mean Difference, SMD).
Figuur 11. Funnel plot ter beoordeling van mogelijke publicatiebias. Dermale toepassing van diclofenac bij knieartrose op gewrichtspijn in vergelijking met dermale toepassing van de drager (placebo). Uitkomstmaat: reductie in WOMAC pijn ten opzichte van baseline, gemeten na 6 tot 12 weken behandeling (2.342 deelnemers), of na 2 tot 6 weken behandeling (991 deelnemers). Gestandaardiseerd gemiddeld groepsverschil (Standardized Mean Difference, SMD).
Ketoprofen
Behandeling met ketoprofen dermaal resulteert niet in een statistisch significant grotere pijnreductie dan behandeling met placebo: gestandaardiseerd gemiddeld groepsverschil, SMD=-0,05 (95%BI=(-0,15; 0,04); 2.573 deelnemers) bij een behandelduur van 6 tot 12 weken (Figuur 12). Er is sprake van een zeer hoge statistische heterogeniteit (I2= 78%) met RCT's die nauwelijks een effect laten zien (Conaghan 2013; Kneer 2013), een effect in het voordeel van dermaal ketoprofen (Rother 2007), of juist een effect in het voordeel van de placebobehandeling (Rother 2013). In alle gevallen ligt het gemiddelde effect echter onder de MCID, en alleen in Rother (2007) overlapt de effectschatting met de MCID. Daarmee lijkt er geen sprake van een klinisch relevant verschil in vergelijking met placebobehandeling.
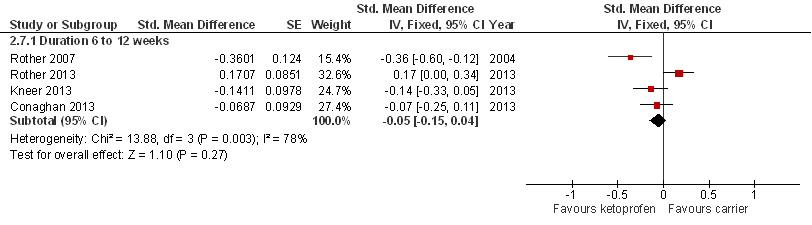
Figuur 12. Forest plot van het effect van dermale toepassing van ketoprofen bij knieartrose op gewrichtspijn in vergelijking met dermale toepassing van de drager (placebo). Uitkomstmaat: reductie in WOMAC pijn ten opzichte van baseline, gemeten na 6 tot12 weken behandeling (2.573 deelnemers). Gestandaardiseerd gemiddeld groepsverschil (Standardized Mean Difference, SMD).
Andere NSAID’s
Yataba (2017) randomiseert 509 patiënten met symptomatische knieartrose naar S-flurbiprofen-pleisters (3 groepen met doseringen van 10, 20 en 40 mg) of placebo-pleister en meet pijn bij opstaan uit een stoel (100-mm VAS). Na twee weken behandeling is in alle groepen, inclusief de placebogroep, sprake van een statistisch significante en klinisch relevante daling in pijnintensiteit ten opzichte van baseline: gemiddeld verschil (Mean Difference, MD), MD=-35,6 (-38.4;-32.9) bij behandeling met S-flurbiprofen-pleisters (40 mg), en -29,5 (-32,4;-26,7) bij gebruik van placebo-pleisters. Behandeling met S-flurbiprofen-pleisters in hoogste dosering resulteert daarmee in een statistisch significant grotere pijnreductie dan behandeling met placebo: MD=-6.1 (−10.1;-2.1). Het gemiddelde effect ligt onder de MCID (gedefinieerd als 7 tot 8 punten op een 0-100 meetschaal; zie Klinische relevantie onder Zoeken en selecteren) maar de effectschatting (betrouwbaarheidsinterval) overlapt wel met de MCID.
Fysiek functioneren (cruciale uitkomstmaat)
Deze uitkomstmaat wordt niet gerapporteerd in Derry (2016) of Yataba (2017). In Wadsworth (2016) resulteert behandeling gedurende vier weken met diclofenac dermaal in een gering grotere verbetering in fysiek functioneren dan een placebobehandeling (WOMAC functieschaal 0-68): MD= -2,8. Dit verschil is echter niet statistisch significant (p=0,06), en daarnaast gering en daarmee niet klinisch relevant.
Percentage responders (belangrijke uitkomstmaat)
Primaire uitkomstmaat in Derry (2016) gedefinieerd als tenminste 50% reductie in pijn ten opzichte van baseline, of een vergelijkbare definitie van behandelsucces zoals een zeer goed of excellent behandelresultaat, of geen of geringe pijn tijdens rust of activiteit, gemeten op een ordinale schaal.
Diclofenac
Na 6 tot 12 weken is er sprake van behandelsucces in gemiddeld 59% (range 44% tot 64%) van de patiënten behandeld met diclofenac dermaal, in vergelijking met 49% (range 25% tot 56%) van de patiënten behandeld met placebo (Figuur 13): relatief risico (Risk Ratio, RR), RR= 1,21 (95%BI= (1,12; 1,31); 1.958 deelnemers; hoge studiekwaliteit). Dit vertaalt zich naar een NNT (number needed to treat), NNT= 9,7 (6,6; 17,0). Bij analyse van de kortlopende RCT's (991 deelnemers; matige studiekwaliteit) bedraagt het percentage responders gemiddeld respectievelijk 42% (range 24-70%) en 25% (range 8-33%) in de interventiegroep en placebogroep: RR= 1,71 (1,42; 2,05), NNT= 5,7 (3,9; 9,7). Er is sprake van een matige tot hoge statistische heterogeniteit maar in alle RCT's is de behandelrespons het grootst in de interventiegroep. Opvallend is het hoge percentage responders in de placebogroepen (gemiddeld ongeveer 50% na 6 tot 12 weken behandeling), mogelijk mede veroorzaakt doordat de RCT's overwegend patiënten met opvlammende pijn includeren (‘flare design’) en/of effecten van de drager gebruikt voor dermaal diclofenac.
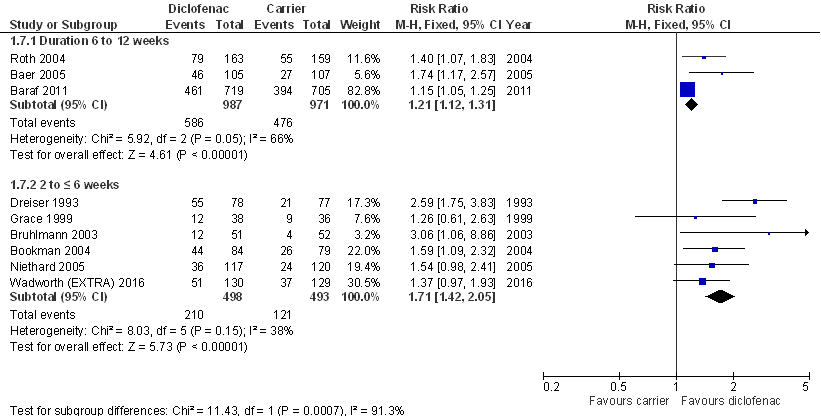
Figuur 13. Forest plot van het effect van dermale toepassing van diclofenac bij knieartrose op de kans op behandelsucces in vergelijking met dermale toepassing van de drager (placebo). Uitkomstmaat: relatieve kans op behandelsucces gemeten na 6 tot 12 weken behandeling (1.958 deelnemers), of na 2 tot 6 weken behandeling (991 deelnemers). Relatief risico (Risk Ratio, RR)
Ketoprofen
Behandeling met ketoprofen dermaal gedurende 6 tot 12 weken resulteert in behandelsucces bij gemiddeld 63% (range 41-88%) van de patiënten in vergelijking met 48% (range 27 tot 77%) van de patiënten behandeld met placebo (Figuur 14): relatief risico (Risk Ratio, RR), RR= 1,09 (95%BI= (1,01; 1,17); 2.573 deelnemers). Dit vertaalt zich naar NNT= 23 (12; 207). Opvallend is ook hier het hoge percentage responders in de placebogroepen van bijna 50%. Er is sprake van een zeer hoge statistische heterogeniteit (I2= 83%) waarbij alleen de kleinste RCT (Rother 2007; 265 deelnemers) een duidelijk effect in het voordeel van dermaal ketoprofen laat zien. Daarmee lijkt er geen bewijs voor een klinisch relevant verschil in behandelrespons tussen ketoprofen dermaal en placebo.
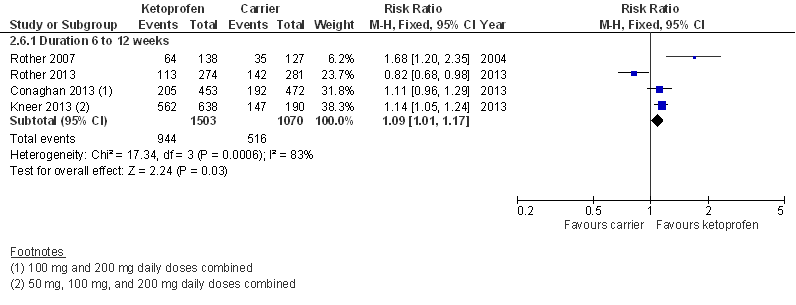
Figuur 14. Forest plot van het effect van dermale toepassing van ketoprofen bij knieartrose op de kans op behandelsucces in vergelijking met dermale toepassing van de drager (placebo). Uitkomstmaat: relatieve kans op behandelsucces gemeten na 6 tot 12 weken behandeling (2.573 deelnemers). Relatief risico (Risk Ratio, RR).
Andere NSAID
Yataba (2017) definieert behandelsucces als een pijnreductie met meer dan 50% ten opzichte van baseline (100-mm VAS pijnschaal). Na twee weken behandeling is er sprake van behandelsucces bij 72% van de patiënten behandeld met S-flurbiprofen-pleisters (40 mg) en 51% van de patiënten behandeld met placebopleisters: NNT= 4,7 (p < 0,01).
Gewrichtsstijfheid (belangrijke uitkomstmaat)
Niet gerapporteerd in Derry (2016) of Yataba (2017). In Wadsworth (2016) resulteert behandeling gedurende vier weken met diclofenac dermaal in een gering grotere reductie van de patiëntgerapporteerde gewrichtsstijfheid (WOMAC stijfheidsscore 0-8): MD= -0.3, niet statistisch significant (p=0,10) en gering en daarmee niet klinisch relevant.
Kwaliteit van leven (belangrijke uitkomstmaat)
Niet gerapporteerd in Derry (2016), Yataba (2017) en Wadsworth (2016).
Adverse events (bijwerkingen, complicaties; belangrijke uitkomstmaat)
Alle NSAID’s
Lokale bijwerkingen (Adverse Events, AE's) waren mild en meestal van voorbijgaande aard en betroffen irritaties in het applicatiegebied zoals droge huid, roodheid, erythema, en jeuk. De incidentie van lokale bijwerkingen varieerde sterk in zowel de interventiegroepen (0% tot 51%) als placebogroepen (0% tot 43%): na pooling RR= 1,84 (95%BI= (1,54; 2,21); I2= 76%; 13 studies, 3.658 deelnemers) voor diclofenac dermaal, en RR= 1,04 (95%BI= (0,85; 1,27); I2= 0%; 4 studies, 2.621 deelnemers) voor ketoprofen (Derry 2016). Wadsworth (2016) rapporteert lokale AE's: droge huid (respectievelijk bij 20% in interventiegroep en 22% in placebogroep), huidschilfering (resp. 6% en 8%), erythema (resoectievelijk 3% en 12%), jeuk (resoectievelijk 2% en 14%) en pijn (resoectievelijk 1,5% en 3,1%). Yataba (2017) meldt lokale AE's bij 10% en 5% van de deelnemers in respectievelijk interventiegroep (S-flurbiprofen pleisters) en placebogroep.
Systemische AE's waren over het algemeen mild en betroffen hoofdpijn, diarree, slaperigheid en dyspepsie. In de meeste studies was de incidentie onder de 10%, en vergelijkbaar in interventiegroep en placebogroep: na pooling RR= 0,89 (0,59; 1,3) voor diclofenac dermaal (I2= 0%; 7 studies, 1.266 deelnemers) en RR= 1,2 (0,77; 1,8) voor alle overige dermale NSAID's (971 deelnemers); beide statistisch niet significant. Yataba (2017) meldt systemische AE's in respectievelijk 4% en 2% van de deelnemers in interventiegroep en placebogroep. Bij de interpretatie van deze resultaten moet rekening worden gehouden met het feit dat systemische AE's in minder dan de helft van de studies werd gerapporteerd, dat de rapportage inconsistent was, en het aantal events gering (hoog risico op bias, en imprecisie door te geringe studieomvang).
Ernstige AE's waren nog zeldzamer en werden in enkele studies gerapporteerd. Baraf (2011; 1.426 deelnemers) meldt 17 ernstige AE's waarvan 12 in de interventiegroep, in een geval (diepe veneuze trombose en longembolie bij tachtigjarige vrouw met hoog risico op perifeer arterieel vaatlijden) beoordeeld als gerelateerd aan de interventie (diclofenac dermaal). Conaghan (2013; 1.395 deelnemers) rapporteert 10 AE's waarvan 3 in de interventiegroep, geen van alle beschouwd als gerelateerd aan de interventie. Rother (2013; 555 deelnemers) meldt 7 ernstige AE's waarvan 3 in de interventiegroep, in een geval (hoofdpijn) mogelijk gerelateerd aan de interventie (ketoprofen dermaal). Simon (2009; 755 deelnemers) rapporteert 5 ernstige AE's, alle in de placebogroepen. De overige studies melden een nog geringer aantal ernstige AE's of rapporteren deze uitkomstmaat niet. Wadsworth (2016) en Yataba (2017) rapporteren dat er geen ernstige AE’s werden waargenomen. Bij de interpretatie van deze resultaten moet rekening worden gehouden met het feit dat slechts een derde van de studies de uitkomstmaat rapporteert, en het aantal events zeer gering is (hoog risico op bias, en ernstige imprecisie door te geringe studieomvang/ te laag aantal events).
Samenvattend is er bewijs dat lokale AE’s vaker kunnen voorkomen bij een lokale behandeling met een NSAID (in vergelijking met placebobehandeling met alleen de drager), maar geen bewijs voor een hoger risico op systemische AE's. Er zijn geen aanwijzingen voor ernstige bijwerkingen, maar er is eveneens onvoldoende bewijs om zeldzame ernstige bijwerkingen te kunnen uitsluiten.
Overige uitkomstmaten (belangrijke uitkomstmaten)
Wadsworth (2016) rapporteert therapietrouw zowel op basis van het restgewicht van de medicatieflessen als op basis van zelfrapportage (259 deelnemers, behandelduur vier weken). Meer dan 96% van de deelnemers in de interventiegroep en placebogroep geeft aan de medicatie te gebruiken maar op basis van het restgewicht van de medicatieflessen bedraagt de therapietrouw respectievelijk 77% en 73%. Overige uitkomstmaten (zie Relevante uitkomstmaten onder Zoeken en selecteren) zoals kosten werden niet als uitkomstmaat beschreven.
Dermaal NSAID versus (dezelfde of andere) orale NSAID
Analyses zijn gebaseerd op Derry (2016; vier RCT’s) en een aanvullende studie Mu (2016). Twee van de RCT's betreft expliciet patiënten met opvlammende pijn (flares; Rother 2007, Simon 2009), in alle gevallen is er sprake van tenminste een matige pijnintensiteit op baseline. Rother (2007) vergelijkt ketoprofen dermaal met celecoxib oraal, Simon (2009) en Tugwell (2004) vergelijken diclofenac dermaal met diclofenac oraal, en Dickson (1991) vergelijkt piroxicam dermaal met ibuprofen oraal. De aanvullende studie (Mu 2016) is een Chinese RCT die loxoprofen dermaal (hydrogel patch) vergelijkt met loxoprofen oraal bij een behandelduur van vier weken. Ketoprofen, diclofenac, piroxicam, ibuprofen en loxoprofen zijn klassieke (niet COX-selectieve) NSAID's, terwijl celecoxib een COX-2 selectieve NSAID is. Loxoprofen is een NSAID uit dezelfde groep als ibuprofen, ketoprofen en naproxen, maar niet geregistreerd in Nederland. Omdat loxoprofen (beide toedieningsvormen) niet is geregistreerd in Nederland worden de resultaten van deze studie alleen kort vermeld. Vanwege het kleine aantal studies zijn de resultaten niet afzonderlijk geanalyseerd per NSAID of vergelijkende NSAID, maar zijn alle studies samengenomen.
Gewrichtspijn (cruciale uitkomstmaat)
Omdat Derry (2016) gewrichtspijn niet analyseert als een afzonderlijke continue uitkomstmaat maar alleen als onderdeel van de uitkomstmaat behandelrespons, zijn de originele publicaties geraadpleegd (zie evidencetabel). Drie RCT’s rapporteren gewrichtspijn (WOMAC pijnscore), de aanvullende studie (Mu 2016) niet. In zowel interventiegroep als placebogroep neemt de pijnintensiteit (WOMAC pijnscore) af ten opzichte van baseline. Er is sprake van een hoge statistische heterogeniteit (Figuur 15); 3 studies, 1.184 deelnemers; hoge studiekwaliteit): Simon (2009; vergelijkt diclofenac dermaal met oraal) laat een statistisch significant voordeel zien voor dermale toepassing, terwijl Tugwell (2004; vergelijkt diclofenac dermaal met oraal) en Rother (2007; vergelijkt ketoprofen dermaal met celecoxib oraal) een statistisch niet significant voordeel laten zien voor orale toepassing. Vanwege de hoge statistische en klinische heterogeniteit is pooling nauwelijks verantwoord en ligt een beoordeling van de individuele onderzoeksresultaten meer voor de hand: in alle gevallen ligt het gemiddelde effect onder de MCID (0,37), en alleen in Simon (2009) overtreft de effectschatting (betrouwbaarheidsinterval) de MCID. Deze resultaten suggereren dat er geen klinisch relevant verschil is in pijnreductie tussen behandeling met NSAID dermaal en behandeling met NSAID oraal bij een behandelduur van 6 tot 12 weken. Bij de interpretatie van deze resultaten moet rekening worden gehouden met het beperkte aantal studies en de grote klinische en statistische heterogeniteit (verschillende dermale NSAID’s en controle-interventies en deels tegenstrijdige resultaten).
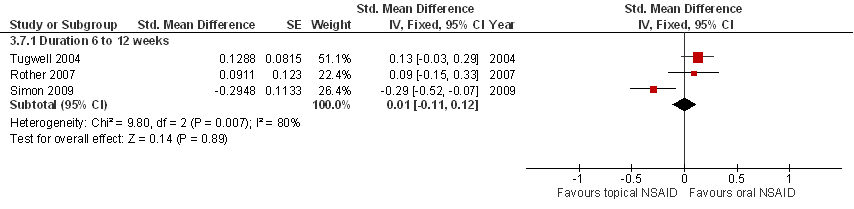
Figuur 15. Forest plot van het effect van dermale toepassing van NSAID’s bij knieartrose op gewrichtspijn in vergelijking met (dezelfde of andere) orale NSAID’s. Rother (2007) vergelijkt ketoprofen dermaal met celecoxib oraal, Simon (2009) en Tugwell (2004) vergelijken diclofenac dermaal met diclofenac oraal. Uitkomstmaat: reductie in WOMAC pijn ten opzichte van baseline, gemeten na 6 tot 12 weken behandeling (1.184 deelnemers deelnemers). Gestandaardiseerd gemiddeld groepsverschil (Standardized Mean Difference, SMD).
Fysiek functioneren (cruciale uitkomstmaat)
Niet gerapporteerd in Derry (2016) of Mu (2016).
Percentage responders (belangrijke uitkomstmaat)
Primaire uitkomstmaat in Derry (2016) gedefinieerd als tenminste 50% reductie in pijn ten opzichte van baseline, of een vergelijkbare definitie van behandelsucces zoals een zeer goed of excellent behandelresultaat, of geen of geringe pijn tijdens rust of activiteit, gemeten op een ordinale schaal.
Na 6 tot 12 weken is er sprake van behandelsucces in gemiddeld 57% (range 47 tot 66%) van de patiënten behandeld met NSAID dermaal, in vergelijking met 58% (range 39 tot 70%) van de patiënten behandeld met orale NSAID’s (Figuur 16): RR= 1,00 (95%BI= (0,90; 1,10), statistisch niet significant; 1.179 deelnemers; hoge studiekwaliteit). Bij analyse van de twee kortlopende RCT's (399 deelnemers; Dickson 1999 met matige studiekwaliteit, Mu 2016 met hoge studiekwaliteit) bedraagt het percentage responders gemiddeld respectievelijk 68% (range 64-73%) en 60% (gelijk in beide RCT’s) in de interventiegroep en controlegroep: RR= 1,12 (0,97; 1,30) (statistisch niet significant). Er is sprake van een matige statistische heterogeniteit: overall suggereren twee studies een klinisch relevant voordeel voor dermale toepassing van NSAID’s (Rother 2007; Mu 2016) terwijl in de overige drie studies geen klinisch relevant verschil tussen interventie en controle wordt waargenomen. In geen van de RCT’s is echter sprake van een statistisch significant verschil in behandelrespons tussen dermale en orale NSAID. Deze resultaten suggereren dat dermale toepassingen van NSAID’s niet minder effectief zijn dan orale toepassingen. Bij de interpretatie van deze resultaten moet rekening worden gehouden met het beperkte aantal studies en de grote klinische heterogeniteit (pooling nauwelijks verantwoord door verschillen tussen de dermale NSAID’s en controle-interventies).
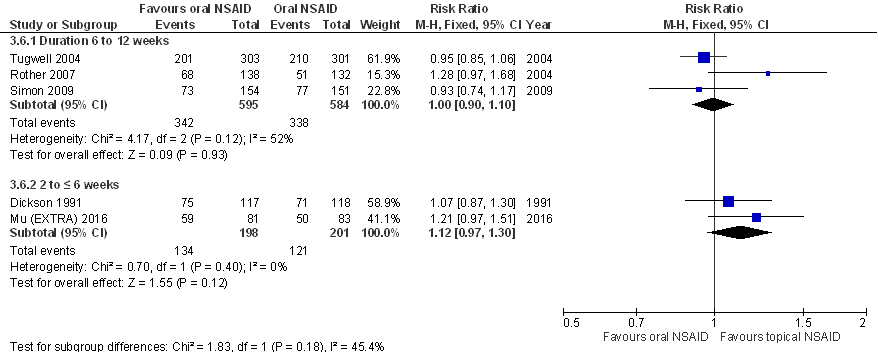
Figuur 16. Forest plot van het effect van dermale toepassing van NSAID’s bij knieartrose op de kans op behandelsucces in vergelijking met orale toepassing van (dezelfde of andere) NSAID’s. Tugwell (2004) en Simon (2009) vergelijken diclofenac dermaal met diclofenac oraal, Rother (2007) vergelijkt ketoprofen dermaal met celecoxib oraal. Dickson (1991) vergelijkt piroxicam dermaal met ibuprofen oraal, en Mu (2016) vergelijkt loxoprofen dermaal met loxoprofen oraal. Uitkomstmaat: relatieve kans op behandelsucces gemeten na 6-12 weken behandeling (1.179 deelnemers), of na 2-6 weken behandeling (399 deelnemers). Relatief risico (Risk Ratio, RR).
Gewrichtsstijfheid (belangrijke uitkomstmaat)
Niet gerapporteerd in Derry (2016) of Mu (2016).
Kwaliteit van leven (belangrijke uitkomstmaat)
Niet gerapporteerd in Derry (2016) of Mu (2016).
Adverse events (bijwerkingen, complicaties; belangrijke uitkomstmaat)
Alle NSAID’s
De incidentie van (milde) lokale bijwerkingen was gemiddeld 20% (range 3% tot 28%; 929 deelnemers) bij dermale toepassing en 6% (range 1% tot 7%; 890 deelnemers) bij oraal gebruik van NSAID’s: na pooling RR= 3,5 (95%BI= (2,6; 4,7); (Figuur 17). Dit vertaalt zich in een NNH (number needed to harm) van 6,4 (95%BI= (5,3; 8,0)). De statistische heterogeniteit is zeer groot, maar in het merendeel van de RCT’s is het risico op lokale bijwerkingen aanzienlijk groter bij dermale toepassing van NSAID’s dan bij orale toepassing. Bij de interpretatie van deze resultaten moet rekening worden gehouden met het beperkte aantal studies en de grote klinische heterogeniteit (pooling nauwelijks verantwoord door verschillen tussen de dermale NSAID’s en controle-interventies, verschillen in incidentie van lokale bijwerkingen).
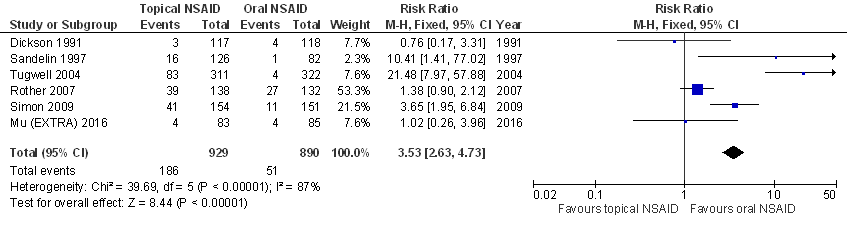
Figuur 17. Forest plot van het effect van dermale toepassing van NSAID’s bij knieartrose op de kans op lokale bijwerkingen in vergelijking met orale toepassing van (dezelfde of andere) NSAID’s. Dickson (1991) vergelijkt piroxicam dermaal met ibuprofen oraal, Sandelin (1997) vergelijkt eltenac dermaal met diclofenac oraal, Tugwell (2004) en Simon (2009) vergelijken diclofenac dermaal met diclofenac oraal, Rother (2007) vergelijkt ketoprofen dermaal met celecoxib oraal, en Mu (2016) vergelijkt loxoprofen dermaal met loxoprofen oraal. Uitkomstmaat: relatieve kans op lokale bijwerkingen (lokale adverse events). Relatief risico (Risk Ratio, RR).
Gastrointestinale bijwerkingen worden gemeld in zes studies (1.808 deelnemers): de incidentie was gemiddeld 17% (range 5% tot 35%; 929 deelnemers) bij dermale toepassing en 27% (range 9% tot 48%; 879 deelnemers) bij oraal gebruik van NSAID’s: na pooling RR= 0,66 (95%BI= (0,56; 0,78); (Figuur 18). Deze resultaten suggereren een lagere incidentie van gastrointestinale bijwerkingen bij dermaal gebruik van NSAID’s: als 100 personen behandeld worden met dermaal NSAID in plaats van oraal, neemt naar verwachting het aantal personen waarbij gastrointestinale bijwerkingen optreden gemiddeld met 9 af (95%BI= (-12; -6)). De statistische heterogeniteit is zeer groot, maar in vrijwel alle RCT’s is het risico (puntschatter) op gastrointestinale bijwerkingen klinisch relevant kleiner bij dermale toepassing van NSAID’s dan bij orale toepassing. Bij de interpretatie van deze resultaten moet rekening worden gehouden met het beperkte aantal studies en de grote klinische heterogeniteit (pooling nauwelijks verantwoord door verschillen tussen de dermale NSAID’s en controle-interventies, verschillen in incidentie van gastrointestinale bijwerkingen).
Alleen Mu (2016) rapporteert naast gastrointestinale bijwerkingen ook andere systemische AE’s maar met zeer lage incidentie (< 3%), vergelijkbaar in interventiegroep en controlegroep.
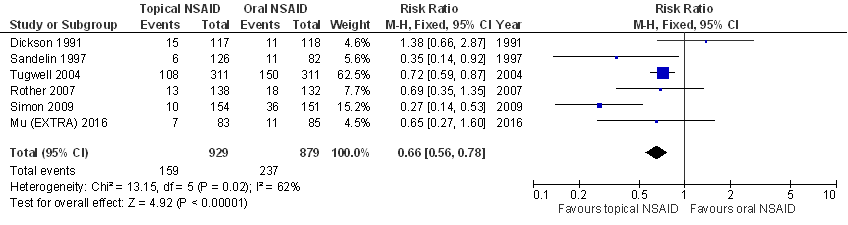
Figuur 18. Forest plot van het effect van dermale toepassing van NSAID’s bij knieartrose op de kans op gastrointestinale bijwerkingen in vergelijking met orale toepassing van (dezelfde of andere) NSAID’s. Uitkomstmaat: relatieve kans op lokale bijwerkingen (lokale adverse events). Relatief risico (Risk Ratio, RR).
Ernstige AE's waren nog zeldzamer en werden in enkele studies gerapporteerd. Rother (2007; 397 deelnemers) rapporteert een ernstige AE in de orale NSAID groep (myocardinfarct), Simon (2009; 755 deelnemers) meldt drie ernstige AE's in de orale NSAID groep (cellulitis aan het been, instabiele angina pectoris, TIA), en Mu (2016; 168 deelnemers) meldt een ernstige AE in de orale NSAID groep (ernstig meniscusletsel als gevolg van een knieverstuiking). Geen van deze studies rapporteert een ernstige AE bij personen behandeld met NSAID dermaal. Studieomvang en aantal events zijn echter te gering en laten geen conclusie toe over het risico op ernstige AE's bij gebruik van dermale (of orale) NSAID's (ernstige imprecisie door te geringe studieomvang).
Samenvattend lijkt het risico op lokale bijwerkingen aanzienlijk groter bij dermale toepassing van NSAID’s maar het risico op gastrointestinale bijwerkingen aanzienlijk kleiner dan bij orale toepassing. Er zijn geen aanwijzingen voor ernstige bijwerkingen bij lokale toepassing van NSAID's maar er is onvoldoende bewijs om zeldzame ernstige bijwerkingen te kunnen uitsluiten of een uitspraak te doen over het relatieve risico op ernstige bijwerkingen in vergelijking met orale NSAID's.
Overige uitkomstmaten (belangrijke uitkomstmaten)
Overige uitkomstmaten (zie Relevante uitkomstmaten onder Zoeken en selecteren) zoals kosten werden niet als uitkomstmaat beschreven.
Bewijskracht van de literatuur
De bewijskracht (GRADE-methodiek) is bepaald per vergelijking en uitkomstmaat, en is in alle gevallen gebaseerd op resultaten uit gerandomiseerd onderzoek en start derhalve hoog. Vervolgens is de bewijskracht verlaagd als er sprake was van relevante tekortkomingen op een of meerdere GRADE domeinen: risk of bias, inconsistentie, indirectheid, imprecisie, publicatiebias (zie Werkwijze op het tabblad Verantwoording).
Zoekvraag-1 gecombineerd met zoekvraag-2 (paracetamol en NSAID’s). Literatuurconclusies zijn gebaseerd op een netwerk meta-analyse van RCT’s. Vrijwel alle RCT’s zijn gesponsord door de fabrikant van de NSAID’s, maar een statistische analyse met behulp van ‘comparison adjusted funnel plots’ (zie appendix bij da Costa 2017) leverde geen aanwijzingen voor publicatiebias, de bewijskracht is niet afgewaardeerd voor publicatiebias. Voor alle vergelijkingen met placebo is de studieomvang toereikend en zijn er geen aanwijzingen voor klinisch relevante inconsistentie (statische heterogeniteit) of incoherentie (verschillen tussen directe en indirecte effectschattingen; zie da Costa 2017).
De nummering verwijst naar de opeenvolgende literatuurconclusies:
- Gewrichtspijn/ paracetamol. Knieartrose: de bewijskracht is niet verlaagd (effectschatting overlapt niet met MCID); de bewijskracht is HOOG. Heupartrose: de bewijskracht is met 1 niveau verlaagd vanwege indirectheid (studiepopulatie bestaat vooral uit patiënten met knieartrose); de bewijskracht is REDELIJK.
- Gewrichtspijn/ etoricoxib en diclofenac. Knieartrose: de bewijskracht is niet verlaagd (effectschatting overlapt niet met MCID); de bewijskracht is HOOG. Heupartrose: de bewijskracht is met 1 niveau verlaagd vanwege indirectheid (studiepopulatie bestaat vooral uit patiënten met knieartrose); de bewijskracht is REDELIJK.
- Gewrichtspijn/ Celecoxib, naproxen en ibuprofen. Knieartrose: de bewijskracht is met 1 niveau verlaagd vanwege imprecisie (effectschatting overlapt met MCID); de bewijskracht is REDELIJK. Heupartrose: de bewijskracht is met 1 niveau verlaagd vanwege indirectheid (studiepopulatie bestaat vooral uit patiënten met knieartrose) en met 1 niveau vanwege imprecisie (effectschatting overlapt met MCID); de bewijskracht is LAAG.
- Fysiek functioneren/ paracetamol. Knieartrose: de bewijskracht is niet verlaagd (effectschatting overlapt niet met MCID); de bewijskracht is HOOG. Heupartrose: de bewijskracht is met 1 niveau verlaagd vanwege indirectheid (studiepopulatie bestaat vooral uit patiënten met knieartrose); de bewijskracht is REDELIJK.
- Fysiek functioneren/ diclofenac. Knieartrose: de bewijskracht is niet verlaagd (effectschatting overlapt niet met MCID); de bewijskracht is HOOG. Heupartrose: de bewijskracht is met 1 niveau verlaagd vanwege indirectheid (studiepopulatie bestaat vooral uit patiënten met knieartrose); de bewijskracht is REDELIJK.
- Fysiek functioneren/ etoricoxib, naproxen en ibuprofen. Knieartrose: de bewijskracht is met 1 niveau verlaagd vanwege imprecisie (effectschatting overlapt met MCID); de bewijskracht is REDELIJK. Heupartrose: de bewijskracht is met 1 niveau verlaagd vanwege indirectheid (studiepopulatie bestaat vooral uit patiënten met knieartrose) en met 1 niveau vanwege imprecisie (effectschatting overlapt met MCID); de bewijskracht is LAAG.
- Fysiek functioneren/ celecoxib. Knieartrose: de bewijskracht is met 2 niveaus verlaagd vanwege ernstige imprecisie (puntschatter ligt onder de MCID maar effectschatting overlapt met MCID); de bewijskracht is LAAG. Heupartrose: de bewijskracht is met 1 niveau verlaagd vanwege indirectheid (studiepopulatie bestaat vooral uit patiënten met knieartrose) en met 2 niveaus vanwege imprecisie ((puntschatter onder ligt onder de MCID maar effectschatting overlapt met MCID); de bewijskracht is ZEER LAAG.
Zoekvraag-3 (antidepressiva)
Alle RCT’s zijn gesponsord door de fabrikant van het antidepressivum duloxetine, maar een statistische beoordeling van mogelijke publicatiebias was niet mogelijk door het te geringe aantal beschikbare RCT’s (n=5), de bewijskracht is niet afgewaardeerd voor publicatiebias.
De nummering verwijst naar de opeenvolgende literatuurconclusies:
- Gewrichtspijn. De bewijskracht is met 1 niveau verlaagd vanwege imprecisie (effectschatting overlapt met MCID); de bewijskracht is REDELIJK.
- Fysiek functioneren. De bewijskracht is met 2 niveaus verlaagd vanwege ernstige imprecisie (puntschatter ligt onder de MCID maar effectschatting overlapt met MCID); de bewijskracht is LAAG.
- Behandelrespons. Bewijskracht is met 1 niveau verlaagd vanwege imprecisie (effectschatting overlapt met MCID); de bewijskracht is REDELIJK.
- Gewrichtsstijfheid. De bewijskracht is niet verlaagd; de bewijskracht is HOOG.
- Kwaliteit van leven. De bewijskracht is met 1 niveau verlaagd vanwege Risk of Bias (multiple testing); de bewijskracht is REDELIJK.
- Bijwerkingen (adverse events). De bewijskracht is met 1 niveau verlaagd vanwege imprecisie (effectschatting overlapt met MCID); de bewijskracht is REDELIJK.
Zoekvraag-4 (dermale NSAID’s). Vrijwel alle RCT’s zijn gesponsord door de fabrikant van de dermale formuleringen, maar alleen voor de vergelijking tussen diclofenac en placebo was het aantal relevante RCT’s voldoende voor een statistische analyse van (potentiële) publicatiebias (funnel plot; zie Figuur 11) en is de bewijskracht (voor de uitkomstmaten gewrichtspijn en behandelrespons) afgewaardeerd voor publicatiebias (zie hieronder). De nummering verwijst naar de opeenvolgende literatuurconclusies:
Vergelijking-1: Dermale NSAID’s in vergelijking met placebo
- Gewrichtspijn. Korte termijn (twee tot zes weken behandeling): de bewijskracht is met 1 niveau verlaagd vanwege risk of bias (RoB) en met 1 niveau vanwege mogelijke publicatiebias; de bewijskracht is LAAG. Langere termijn (zes tot twaalf weken): geen afwaardering noodzakelijk (effectschatting overlapt niet met MCID); de bewijskracht is HOOG.
- Behandelrespons. Korte termijn (twee tot zes weken behandeling): de bewijskracht is met 1 niveau verlaagd vanwege RoB en met 1 niveau vanwege mogelijke publicatiebias; geen afwaardering nodig voor imprecisie (effectschatter overlapt niet met MCID bij RR=1,25 of NNT=10); de bewijskracht is LAAG. Langere termijn (zes tot twaalf weken): bewijskracht met betrekking tot diclofenac is met 1 niveau verlaagd vanwege imprecisie (effectschatter overlapt met MCID bij RR=1,25 en NNT=10), en bewijskracht met betrekking tot ketoprofen is met 1 niveau verlaagd vanwege inconsistentie (grote en onverklaarbare heterogeniteit in resultaten tussen de individuele RCT’s); de bewijskracht is REDELIJK.
- Lokale bijwerkingen. Diclofenac: de bewijskracht is met 1 niveau verlaagd vanwege inconsistentie (grote en onverklaarbare heterogeniteit in resultaten tussen de individuele RCT’s); de bewijskracht is REDELIJK. Ketoprofen: de bewijskracht is met 1 niveau verlaagd vanwege imprecisie (effectschatter overlapt met MCID bij RR=1,25); de bewijskracht is REDELIJK.
- Systemische bijwerkingen. De bewijskracht is met 1 niveau verlaagd vanwege RoB (minder dan de helft van de RCT’s rapporteert deze uitkomstmaat, rapportage is inconsistent) en 1 niveau vanwege imprecisie (effectschatter overlapt met MCID bij RR=1,25); de bewijskracht is LAAG.
- Ernstige bijwerkingen. De bewijskracht is met 1 niveau verlaagd vanwege RoB (slechts een derde deel van de RCT’s rapporteert deze uitkomstmaat) en 2 niveaus vanwege ernstige imprecisie (zeer gering aantal events); de bewijskracht is ZEER LAAG.
Vergelijking-2: Dermale NSAID’s in vergelijking met orale NSAID’s
- Gewrichtspijn. De bewijskracht is met 1 niveau verlaagd vanwege imprecisie (pooling nauwelijks verantwoord, grote klinische heterogeniteit in combinatie met gering aantal studies) en 1 niveau vanwege inconsistentie (grote en onverklaarbare heterogeniteit in resultaten tussen de individuele RCT’s); de bewijskracht is LAAG.
- Behandelrespons. De bewijskracht is met 1 niveau verlaagd vanwege imprecisie (pooling nauwelijks verantwoord, grote klinische heterogeniteit in combinatie met gering aantal studies); de bewijskracht is REDELIJK.
- Lokale bijwerkingen. De bewijskracht is verlaagd met 1 niveau vanwege inconsistentie (grote en onverklaarbare heterogeniteit in resultaten tussen de individuele RCT’s), en met 1 niveau vanwege imprecisie (pooling nauwelijks verantwoord, grote klinische heterogeniteit in combinatie met gering aantal studies); de bewijskracht is LAAG.
- Systemische bijwerkingen. Gastrointestinale bijwerkingen: de bewijskracht is met 2 niveaus verlaagd vanwege ernstige imprecisie (pooling nauwelijks verantwoord, grote klinische heterogeniteit in combinatie met gering aantal studies; effectschatters overlappen met MCID); de bewijskracht is LAAG. Andere systemische bijwerkingen: de bewijskracht is met 1 niveau verlaagd vanwege indirectheid (enige RCT betreft de niet in Nederland geregistreerde NSAID loxoprofen) en 2 niveaus vanwege ernstige imprecisie (uitkomstmaat wordt in slechts een RCT gerapporteerd); de bewijskracht is ZEER LAAG.
- Ernstige bijwerkingen. De bewijskracht is met 1 niveau verlaagd vanwege RoB (slechts enkele RCT’s rapporteren deze uitkomstmaat) en 2 niveaus vanwege ernstige imprecisie (zeer gering aantal events); de bewijskracht is ZEER LAAG.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag (vragen):
- Wat zijn de gunstige en ongunstige effecten van orale behandeling met paracetamol in vergelijking met placebo bij volwassen patiënten met klachten als gevolg van artrose aan heup of knie?
- Wat zijn de gunstige en ongunstige effecten van orale behandeling met NSAID’s in vergelijking met placebo bij volwassen patiënten met klachten als gevolg van artrose aan heup of knie?
- Wat zijn de gunstige en ongunstige effecten van orale behandeling met antidepressiva (tricyclische antidepressiva, specifieke serotonine-heropnameremmers en serotonine-noradrenaline-heropnameremmers) in vergelijking met placebo bij volwassen patiënten met klachten als gevolg van artrose aan heup of knie?
- Wat zijn de gunstige en ongunstige effecten van behandeling met dermale NSAID’s in vergelijking met orale NSAID’s of placebo bij volwassen patiënten met klachten als gevolg van artrose aan de knie?
Tramadol is buiten beschouwing gelaten, omdat de werkgroep geen nieuwe evidence verwachtte die aanleiding zou kunnen zijn om het beleid ten aanzien van opiaten bij artrose aan heup of knie te wijzigen. Behandeling van heupartrose met dermale NSAID’s lijkt vanwege het dieperliggende gewricht weinig zinvol (alhoewel trials ontbreken), en daarom is de literatuuranalyse voor dermale NSAID’s beperkt tot behandeling van klachten als gevolg van knieartrose.
Relevante uitkomstmaten
De werkgroep achtte patiëntgerapporteerd gewrichtspijn (NRS, VAS; pijnsubschaal van WOMAC, KOOS, HOOS) en patiëntgerapporteerd fysiek functioneren (beperkingen bij het uitvoeren van algemeen dagelijkse activiteiten; relevante subschalen van IKS, WOMAC kneescore, WOMAC hip score, KOOS, HOOS, Oxford Knee Score, en Oxford Hip Score) cruciale uitkomstmaten. Percentage responders (op basis van patiënt gerapporteerde uitkomstmaten) werd benoemd als een belangrijke uitkomstmaat. Responderanalyses worden bij voorkeur uitgevoerd op basis van de OMERACT-OARSI set van responder criteria (Pham 2003) die zijn gebaseerd op veranderingen in pijn, fysiek functioneren en algemene verbetering (patient’s global assessment). De volgende uitkomstmaten werden eveneens als belangrijk benoemd: patiëntgerapporteerde gewrichtsstijfheid, kwaliteit van leven (QoL), patiënttevredenheid, participatie (betaald werk, sport, vrijetijdsbesteding), adverse events (bijwerkingen en complicaties), therapietrouw (compliantie; withdrawal from trial), tijd tot chirurgische interventie (elke vorm van chirurgie gerelateerd aan de klachten als gevolg van artrose), kosten (kosteneffectiviteit; ook lange termijn (vijf jaar)), en zorggebruik.
Klinische relevantie en grenzen voor klinische besluitvorming
Op basis van een analyse van de minimaal klinisch relevante verschillen (zie module 'Oefentherapie bij heup- of knieartrose') heeft de werkgroep besloten een MCID (minimal clinically important difference) te hanteren van 0,37 SD (standaarddeviaties) voor gewrichtspijn en fysiek functioneren, overeenkomend met 7 tot 8 punten op een 0-100 meetschaal. Voor de overige uitkomstmaten werden de door de internationale GRADE working group voorgestelde default grenzen gehanteerd voor klinische relevantie: een verschil in relatief risico van 25% bij dichotome uitkomstmaten, en een verschil van een halve standaarddeviatie voor continue uitkomstmaten.
Zoeken en selecteren (Methode)
Bij aanvang van de richtlijnontwikkeling is een oriënterende zoekactie uitgevoerd naar systematische reviews en richtlijnen met betrekking tot conservatieve behandeling van artrose aan heup of knie (zie werkwijze onder het tabblad verantwoording). Deze oriënterende zoekactie leverde een valide richtlijn op van The National Institute for Health and Care Excellence (NICE 2014). In de voorbereidingsfase kwam de herziene NHG-Standaard Niet-traumatische knieklachten (NHG 2016) beschikbaar. De NHG-standaard Niet-traumatische knieklachten (NHG 2016) beperkt zich tot artrose van de knie terwijl in de NICE-richtlijn Osteoarthritis (NICE 2014) verschillende vormen van artrose worden besproken, waaronder ook artrose van de heup. Deze richtlijnen zijn gekozen als uitgangspunt, en de literatuuranalyses zijn gebaseerd op zoekacties die aansluiten op genoemde richtlijnen. Opiaten zijn buiten beschouwing gelaten, omdat de werkgroep geen nieuwe evidence verwachtte die aanleiding zou kunnen zijn om het beleid ten aanzien van opiaten bij artrose aan heup of knie te wijzigen.
Vanwege de twee patiëntgroepen, patiënten met knieartrose en patiënten met heupartrose, het grote aantal behandelopties en nog groter aantal mogelijke vergelijkingen, heeft de werkgroep besloten om twee specifieke vergelijkingen voor een uitgebreide literatuuranalyse te prioriteren (vanwege het belang van recente onderzoeksresultaten), en de overige relevante behandelopties/ vergelijkingen te analyseren op basis van de meest recente relevante en valide systematische review(s). Bij de geprioriteerde vergelijkingen zijn ook aanvullende RCT’s meegenomen in de literatuuranalyse (evidence synthese). De geprioriteerde behandelopties/ vergelijkingen zijn (i) antidepressiva (tricyclische antidepressiva, specifieke serotonine-heropnameremmers en serotonine-noradrenaline-heropnameremmers) versus placebo bij artrose aan knie of heup (zoekvraag-3), en (ii) dermale NSAID’s versus orale NSAID’s of placebo bij artrose aan de knie (zoekvraag-4).
Zoekvraag-1 gecombineerd met zoekvraag-2 (paracetamol en NSAID’s in vergelijking met placebo) bij knie- of heupartrose. De zoekactie uitgevoerd op 11 augustus 2017 leverde 290 treffers op. Op basis van titel en abstract werden in eerste instantie 11 (mogelijke) systematische reviews voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 10 studies uitgesloten (zie exclusietabel onder het tabblad Verantwoording) en 1 systematische review definitief geselecteerd (da Costa 2017).
Zoekvraag-3 orale antidepressiva in vergelijking met placebo bij knie- of heupartrose.
De zoekactie uitgevoerd op 2 november 2017 leverde 93 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: RCT’s; interventiegroep ontving antidepressiva als pijnbestrijding; de controlegroep ontving een placebo. Op basis van titel en abstract werden in eerste instantie negen studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens zes studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en drie studies definitief geselecteerd (Wang 2015, 2017; Abou-Raya 2012). De geselecteerde studies betreffen knieartrose, er werden geen relevante studies gevonden voor heupartrose.
Zoekvraag-4 dermale NSAID’s in vergelijking met orale NSAID’s of placebo bij knieartrose. Voor de vergelijking met betrekking tot dermale NSAID’s bij knieartrose leverde de zoekactie uitgevoerd op 2 november 2017 een recente Cochrane SR op van zeer goede kwaliteit (Derry 2016) die de literatuur dekt tot februari 2016. Analyse van het zoekresultaat vanaf februari 2016 leverde 40 hits op. Op basis van titel en abstract werden in eerste instantie 7 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 3 studies uitgesloten (zie exclusietabel onder het tabblad Verantwoording) en 4 studies (RCT’s) definitief geselecteerd (Derry 2016; Mu 2016; Wadsworth 2016; Yataba 2017).
Referenties
- Abou-Raya S, Abou-Raya A, Helmii M. Duloxetine for the management of pain in older adults with knee osteoarthritis: randomised placebo-controlled trial. Age & Ageing. 2012;41(5):646-52. PMID 22743149
- Baer PA, Thomas LM, Shainhouse Z. Treatment of osteoarthritis of the knee with a topical diclofenac solution: a randomised controlled, 6-week trial (ISRCTN53366886). BMC Musculoskelet Disord. 2005 Aug 8;6:44. PubMed PMID: 16086839.
- Bannuru RR, McAlindon TE, Sullivan MC, et al. Effectiveness and Implications of Alternative Placebo Treatments: A Systematic Review and Network Meta-analysis of Osteoarthritis Trials. Ann Intern Med. 2015 Sep 1;163(5):365-72. doi: 10.7326/M15-0623. Review. PubMed PMID: 26215539.
- Baraf HS, Gloth FM, Barthel HR, et al. Safety and efficacy of topical diclofenac sodium gel for knee osteoarthritis in elderly and younger patients: pooled data from three randomized, double-blind, parallel-group, placebo-controlled, multicentre trials. Drugs Aging. 2011 Jan 1;28(1):27-40. doi: 10.2165/11584880-000000000-00000. PubMed PMID: 21174485.
- Bierma-Zeinstra SMA, Brew J, Stoner K, et al. A new lipid formulation of low dose ibuprofen shows non-inferiority to high dose standard ibuprofen: the FLARE study (flaring arthralgia relief evaluation in episodic flaring knee pain) - a randomised double-blind study. Osteoarthritis Cartilage. 2017 ;25(12):1942-1951. doi: 10.1016/j.joca.2017.09.002. Epub 2017 Sep 9. PubMed PMID: 28899844.
- Cepeda MS, Camargo F, Zea C, et al. Tramadol for osteoarthritis: a systematic review and metaanalysis. J Rheumatol. 2007;34(3):543-55. Review. PubMed PMID: 17343302.
- Chappell AS, Desaiah D, Liu-Seifert H, et al. A double-blind, randomized, placebo-controlled study of the efficacy and safety of duloxetine for the treatment of chronic pain due to osteoarthritis of the knee. Pain Practice. 2011;11(1):33-41. PMID 20602715.
- Chappell AS, Ossanna MJ, Liu-Seifert H, et al. Duloxetine, a centrally acting analgesic, in the treatment of patients with osteoarthritis knee pain: a 13-week, randomized, placebo-controlled trial. Pain. 2009;146(3):253-60. PMID 19625125.
- CNT (2013). Coxib and traditional NSAID Trialists' (CNT) Collaboration, Bhala N, Emberson J, Merhi A, et al. Vascular and upper gastrointestinal effects of non-steroidal anti-inflammatory drugs: meta-analyses of individual participant data from randomised trials. Lancet. 2013 Aug 31;382(9894):769-79. doi: 10.1016/S0140-6736(13)60900-9. Epub 2013 May 30. PubMed PMID: 23726390.
- Conaghan PG, Dickson J, Bolten W, et al. multicentre, randomized, placebo- and active-controlled trial comparing the efficacy and safety of topical ketoprofen in Transfersome gel (IDEA-033) with ketoprofen-free vehicle (TDT 064) and oral celecoxib for knee pain associated with osteoarthritis. Rheumatology (Oxford). 2013 ;52(7):1303-12. doi: 10.1093/rheumatology/ket133. Epub 2013 Mar 28. PubMed PMID: 23542612.
- da Costa BR, Nüesch E, Kasteler R, et al. Oral or transdermal opioids for osteoarthritis of the knee or hip. Cochrane Database Syst Rev. 2014 Sep 17;(9):CD003115. doi: 10.1002/14651858.CD003115.pub4. Review. PubMed PMID: 25229835.
- da Costa BR, Reichenbach S, Keller N, et al. Effectiveness of non-steroidal anti-inflammatory drugs for the treatment of pain in knee and hip osteoarthritis: a network meta-analysis. Lancet. 2017 Jul 8;390(10090):e21-e33. doi: 10.1016/S0140-6736(17)31744-0. PubMed PMID: 28699595.
- Derry S, Conaghan P, Da Silva JA, et al. Topical NSAIDs for chronic musculoskeletal pain in adults. Cochrane Database Syst Rev. 2016 Apr 22;4:CD007400. doi: 10.1002/14651858.CD007400.pub3. Review. PubMed PMID: 27103611.
- Doherty M, Hawkey C, Goulder M, et al. A randomised controlled trial of ibuprofen, paracetamol or a combination tablet of ibuprofen/paracetamol in community-derived people with knee pain. Ann Rheum Dis. 2011 ;70(9):1534-41. doi: 10.1136/ard.2011.154047. PubMed PMID: 21804100.
- Eitner A, Hofmann GO, Schaible HG. Mechanisms of Osteoarthritic Pain. Studies in Humans and Experimental Models. Front Mol Neurosci. 2017 Nov 3;10:349. doi: 10.3389/fnmol.2017.00349. eCollection 2017. Review. PubMed PMID: 29163027.
- EPHOR (2011). A.L. van Ojik, P.A.F. Jansen, J.R.B.J. Brouwers, et al. Opioïden (Geneesmiddelbeoordeling voor de kwetsbare oude patiënt in het Farmacotherapeutisch Kompas) (versie 4.0; 10/08/2011). Link: http://www.ephor.nl/media/1072/opio%C3%AFden-compleet-aug-2011.pdf (geraadpleegd 11-06-2018).
- EPHOR (2014). I. Oldenkamp, J.R.B.J. Brouwers, G. van Valkenhoef, et al. NSAID's (Geneesmiddelbeoordeling voor de kwetsbare oude patiënt in het Farmacotherapeutisch Kompas) (herziene versie 2.1; 28/01/2014). Link: http://www.ephor.nl/media/1062/nsaid_rapport_herziene_versie_280114bde0.pdf (geraadpleegd 25-05-2018).
- FK 2018. Farmacotherapeutisch Kompas. Link: https://www.farmacotherapeutischkompas.nl (geraadpleegd op 25-05-2018).
- Frakes EP, Risser RC, Ball TD, et al. Duloxetine added to oral nonsteroidal anti-inflammatory drugs for treatment of knee pain due to osteoarthritis: results of a randomized, double-blind, placebo-controlled trial. Curr Med Res Opin. 2011 Dec;27(12):2361-72. doi: 10.1185/03007995.2011.633502. Epub 2011 Nov 9. Erratum in: Curr Med Res Opin. 2012 May;28(5):822. PubMed PMID: 22017192.
- French HP, Smart KM, Doyle F. Prevalence of neuropathic pain in knee or hip osteoarthritis: A systematic review and meta-analysis. Semin Arthritis Rheum. 2017 ;47(1):1-8. doi: 10.1016/j.semarthrit.2017.02.008. Epub 2017 Feb 20. Review. PubMed PMID: 28320529.
- Grace D, Rogers J, Skeith K, et al. Topical diclofenac versus placebo: a double blind, randomized clinical trial in patients with osteoarthritis of the knee. J Rheumatol. 1999 ;26(12):2659-63. PubMed PMID: 10606379.
- Heyneman CA, Lawless-Liday C, Wall GC. Oral versus topical NSAIDs in rheumatic diseases: a comparison. Drugs. 2000 ;60(3):555-74. Review. PubMed PMID: 11030467.
- IVM (2017). Instituut voor Verantwoord Medicijngebruik. Consumenten onderschat risico's pijnstillers (7 november 2017). Link: https://www.medicijngebruik.nl/ivm/ivm-in-de-pers (geraadpleegd 25 mei 2018).
- Kneer W, Rother M, Mazgareanu S, et al. European IDEA-033 study group. A 12-week randomized study of topical therapy with three dosages of ketoprofen in Transfersome® gel (IDEA-033) compared with the ketoprofen-free vehicle (TDT 064), in patients with osteoarthritis of the knee. J Pain Res. 2013 Oct 25;6:743-53. doi: 10.2147/JPR.S51054. eCollection 2013. PubMed PMID: 24187510.
- Krebs EE, Gravely A, Nugent S, et al. Effect of Opioid vs Nonopioid Medications on Pain-Related Function in Patients With Chronic Back Pain or Hip or Knee Osteoarthritis Pain: The SPACE Randomized Clinical Trial. JAMA. 2018 Mar 6;319(9):872-882. doi: 10.1001/jama.2018.0899. PubMed PMID: 29509867.
- Lluch E, Torres R, Nijs J, et al. Evidence for central sensitization in patients with osteoarthritis pain: a systematic literature review. Eur J Pain. 2014 ;18(10):1367-75. doi: 10.1002/j.1532-2149.2014.499.x. Epub 2014 Apr 3. Review. PubMed PMID: 24700605.
- Mu R, Bao CD, Chen ZW, et al. Efficacy and safety of loxoprofen hydrogel patch versus loxoprofen tablet in patients with knee osteoarthritis: a randomized controlled non-inferiority trial. Clin Rheumatol. 2016 Jan;35(1):165-73. doi: 10.1007/s10067-014-2701-4. Epub 2014 Jun 14. PubMed PMID: 24924603.
- NHG (2013). NHG-Standaard Maagklachten (derde herziening). Link: https://www.nhg.org/standaarden/volledig/nhg-standaard-maagklachten (geraadpleegd 1 juni 2018).
- NHG (2016). NHG-Standaard Niet-traumatische knieklachten (M107). Link: https://www.nhg.org/standaarden/volledig/nhg-standaard-niet-traumatische-knieklachten (geraadpleegd 18 februari 2018).
- NHG (2018). NHG-Standaard Pijn (actualisering juni 2018). Link: https://www.nhg.org/standaarden/volledig/nhg-standaard-pijn (geraadpleegd 13 juli 2018).
- NICE (2014). Osteoarthritis: care and management in adults. Clinical guideline CG177. Link: https://www.nice.org.uk/guidance/cg177 (geraadpleegd op 18 februari 2018).
- NIVEL 2016. Weesie, Y., Dijk, L. van, Nielen, M., Flinterman, L., Hek, K. Voorschrijven van opioïden in de huisartsenpraktijk. Link:https://www.nivel.nl/pdf/Rapport_voorschrijven_opioiden.pdf? (geraadpleegd 10 juli 2018)
- Pham T, Van Der Heijde D, Lassere M, et al. ; OMERACT-OARSI. Outcome variables for osteoarthritis clinical trials: The OMERACT-OARSI set of responder criteria. J Rheumatol. 2003 ;30(7):1648-54. Review. PubMed PMID: 12858473.
- Pincus T, Swearingen C, Cummins P, et al. Preference for nonsteroidal antiinflammatory drugs versus acetaminophen and concomitant use of both types of drugs in patients with osteoarthritis. J Rheumatol. 2000 ;27(4):1020-7. PubMed PMID: 10782831.
- Rahme E, Barkun A, Nedjar H, et al. Hospitalizations for upper and lower GI events associated with traditional NSAIDs and acetaminophen among the elderly in Quebec, Canada. Am J Gastroenterol. 2008 ;103(4):872-82. doi: 10.1111/j.1572-0241.2008.01811.x. Epub 2008 Mar 26. PubMed PMID: 18371130.
- Roth SH, Shainhouse JZ. Efficacy and safety of a topical diclofenac solution (pennsaid) in the treatment of primary osteoarthritis of the knee: a randomized, double-blind, vehicle-controlled clinical trial. Arch Intern Med. 2004 Oct 11;164(18):2017-23. PubMed PMID: 15477437.
- Rother M, Conaghan PG. A randomized, double-blind, phase III trial in moderate osteoarthritis knee pain comparing topical ketoprofen gel with ketoprofen-free gel. J Rheumatol. 2013 ;40(10):1742-8. doi: 10.3899/jrheum.130192. Epub 2013 Sep 1. PubMed PMID: 23996292.
- Rother M, Lavins BJ, Kneer W, et al. Efficacy and safety of epicutaneous ketoprofen in Transfersome (IDEA-033) versus oral celecoxib and placebo in osteoarthritis of the knee: multicentre randomised controlled trial. Ann Rheum Dis. 2007 ;66(9):1178-83. Epub 2007 Mar 15. PubMed PMID: 17363401.
- Scott WA. The relief of pain with an antidepressant in arthritis. Practitioner. 1969 ;202(212):802-7. PubMed PMID: 4894317.
- Simon LS, Grierson LM, Naseer Z, et al. Efficacy and safety of topical diclofenac containing dimethyl sulfoxide (DMSO) compared with those of topical placebo, DMSO vehicle and oral diclofenac for knee osteoarthritis. Pain. 2009 ;143(3):238-45. doi: 10.1016/j.pain.2009.03.008. Epub 2009 Apr 19. PubMed PMID: 19380203.
- Thybo KH, Hägi-Pedersen D, Wetterslev J, et al. PANSAID - PAracetamol and NSAID in combination: study protocol for a randomised trial. Trials. 2017 Jan 10;18(1):11. doi: 10.1186/s13063-016-1749-7. PubMed PMID: 28069072.
- Trelle S, Reichenbach S, Wandel S, et al. Cardiovascular safety of non-steroidal anti-inflammatory drugs: network meta-analysis. BMJ. 2011 Jan 11;342:c7086. doi: 10.1136/bmj.c7086. Review. PubMed PMID: 21224324.
- Tsoi K, Eimermann VM, Borgsteede SD (2014).Preventieve medicatie ter voorkoming van gastro-intestinale bloedingen bij gebruik van NSAIDs en acetylsalicylzuur. Commentaar op de NHG-Standaard Maagklachten. Pharmaceutisch Weekblad Wetenschappelijk Platform. 2014;8:a1411. Link: https://www.pw.nl/archief/wp/2014wp02/a1411 (geraadpleegd op 1 juni 2018).
- Tugwell PS, Wells GA, Shainhouse JZ. Equivalence study of a topical diclofenac solution (pennsaid) compared with oral diclofenac in symptomatic treatment of osteoarthritis of the knee: a randomized controlled trial. J Rheumatol. 2004 ;31(10):2002-12. PubMed PMID: 15468367.
- Uchio Y, Enomoto H, Alev L, et al. A randomized, double-blind, placebo-controlled Phase III trial of duloxetine in Japanese patients with knee pain due to osteoarthritis. J Pain Res. 2018 Apr 18;11:809-821. doi: 10.2147/JPR.S164128. eCollection 2018. PubMed PMID: 29713194.
- van den Driest JJ, Bierma-Zeinstra SMA, Bindels PJE, et al. Amitriptyline for musculoskeletal complaints: a systematic review. Fam Pract. 2017 Apr 1;34(2):138-146. doi: 10.1093/fampra/cmw134. Review. PubMed PMID: 28334783.
- van Laar M, Pergolizzi JV Jr, Mellinghoff HU, et al. Pain treatment in arthritis-related pain: beyond NSAIDs. Open Rheumatol J. 2012;6:320-30. doi: 10.2174/1874312901206010320. Epub 2012 Dec 13. PubMed PMID: 23264838.
- Verenso (2016). Multidisciplinaire Richtlijn Pijn, Herkenning en behandeling van pijn bij kwetsbare ouderen. Utrecht: Verenso 2011 (met herziene tekst 2016). Link: https://www.verenso.nl/kwaliteit-en-richtlijnen/richtlijnendatabase/pijn (geraadpleegd 25-05-2018).
- Wadsworth LT, Kent JD, Holt RJ. Efficacy and safety of diclofenac sodium 2% topical solution for osteoarthritis of the knee: a randomized, double-blind, vehicle-controlled, 4 week study. Curr Med Res Opin. 2016;32(2):241-50. doi: 10.1185/03007995.2015.1113400. Epub 2015 Nov 17. PubMed PMID: 26506138.
- Wang G, Bi L, Li X, et al. Efficacy and safety of duloxetine in Chinese patients with chronic pain due to osteoarthritis: a randomized, double-blind, placebo-controlled study. Osteoarthritis and Cartilage. 2017;25(6):832-8. PMID 28043937.
- Wang ZY, Shi SY, Li SJ, et al. Efficacy and Safety of Duloxetine on Osteoarthritis Knee Pain: A Meta-Analysis of Randomized Controlled Trials. Pain Medicine. 2015;16(7):1373-85. PMID 26176791.
- Yataba I, Otsuka N, Matsushita I, et al. The efficacy and safety of S-flurbiprofen plaster in the treatment of knee osteoarthritis: a phase II, randomized, double-blind, placebo-controlled, dose-finding study. J Pain Res. 2017 Apr 11;10:867-880. doi: 10.2147/JPR.S131779. eCollection 2017. PubMed PMID: 28442928.
- Yusuf E, Kortekaas MC, Watt I, eta l. Do knee abnormalities visualised on MRI explain knee pain in knee osteoarthritis? A systematic review. Ann Rheum Dis. 2011 ;70(1):60-7. doi: 10.1136/ard.2010.131904. Epub 2010 Sep 9. Review. PubMed PMID: 20829200.
- Zeng C, Wei J, Persson MSM, et al. Relative efficacy and safety of topical non-steroidal anti-inflammatory drugs for osteoarthritis: a systematic review and network meta-analysis of randomised controlled trials and observational studies. Br J Sports Med. 2018 ;52(10):642-650. doi: 10.1136/bjsports-2017-098043. Epub 2018 Feb 7. Review. PubMed PMID: 29436380.
- Zhang Y, Nevitt M, Niu J, et al. Fluctuation of knee pain and changes in bone marrow lesions, effusions, and synovitis on magnetic resonance imaging. Arthritis Rheum. 2011 ;63(3):691-9. doi: 10.1002/art.30148. PubMed PMID: 21360498.
- Zou K, Wong J, Abdullah N, et al. Examination of overall treatment effect and the proportion attributable to contextual effect in osteoarthritis: meta-analysis of randomised controlled trials. Ann Rheum Dis. 2016 ;75(11):1964-1970. doi: 10.1136/annrheumdis-2015-208387. Epub 2016 Feb16. PubMed PMID: 26882927.
- Zweers P, van Hunsel F (2014). Ook bij lage dosis nsaids ernstige reacties mogelijk. Pharm weekbl 17 oktober 2014;14942. Link: https://databankws.lareb.nl/Downloads/2014_4_lage_dosis_nsaids_PW.pdf (geraadpleegd 25-05-2018).
Evidence tabellen
Zoekvraag-1 gecombineerd met zoekvraag-2 (paracetamol en NSAID’s)
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
Research question: what is the value of paracetamol and NSAIDs in comparison to placebo in treatment of knee or hip OA?
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
da Costa 2017 |
Yes |
Yes |
Yes |
Yes*1 |
Not applicable |
Yes |
Yes |
Yes |
Yes |
*1 Network meta-analysis of high methodological quality but only reporting effects on pain and physical function, and only presenting network estimates of effects i.e. pairwise analyses are not provided (elaborate statistical methods are used to assess heterogeneity and inconsistency/ incoherence (differences in effect estimates based on direct and indirect comparisons))
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: what is the value of paracetamol and NSAIDs in comparison to placebo in treatment of knee or hip OA?
Zoekvraag-3 (antidepressiva)
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
Research question: what is the value of antidepressants in comparison to placebo in treatment of knee OA??
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Wang 2015 |
Yes |
Yes |
Yes*1 |
Yes*1 |
Not applicable |
Yes |
Yes |
Yes |
Yes |
*1 SR has high methodological quality but uses clinical success (responder analyses) as the only efficacy outcome (e.g. WOMAC or other continuous outcome measures for pain or function are not reported); Not completely clear why Abou-Raya 2012 was excluded (reason mentioned is: ‘insufficient outcome data’)
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Risk of bias table for intervention studies (randomized controlled trials)
Research question: what is the value of antidepressants in comparison to placebo in treatment of knee OA?
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Abou-Raya, 2012 |
computerised random number list and sealed envelopes |
unlikely |
unlikely |
unlikely |
unlikely |
likely*1 |
unlikely |
unlikely |
|
Chappel, 2009 |
computer-generated random sequence using an Interactive Voice Response System |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
Unclear*2 |
unlikely |
|
Chappel 2011 |
computer-generated random sequence using an interactive voice response system to assure blinding |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
Unclear*3 |
unlikely |
|
Frakes, 2011 |
Not described |
unclear |
unlikely |
unlikely |
unlikely |
unlikely |
Unclear*4 |
unlikely |
|
Wang 2017 |
computer-generated random sequence using an interactive web-response system |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
likely*5 |
*1 Egypt; relatively high completion % (85% versus 91% in control)
*2 USA, LOCF, 69 versus 80% completion in control, reasons discontinuation similar in intervention and control except for AEs: 13.5 vs 5.8%
*3 USA/ Europe, 73% versus 87% completion in control, reasons discontinuation similar except AE's: 18.8% versus 5.5%
*4 USA, 72 vs 77% completion in control, discontinuation for AEs 15% versus 9% in control; modified ITT (patients with baseline and at least one post-baseline observation)
*5 China, 81 vs 87% completion in control, discontinuation for AEs 10% versus 5% in control
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules..
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: What is the value of antidepressants in comparison to placebo in treatment of knee OA?
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Wang, 2017
Clinical trial register nr: NCT01931475
|
RCT (parallel) that included 5 study periods: a 1 week screening phase (study period I), a 13-week double-blind treatment phase (study period II), a 1-week titration phase (study period III), a 12-week open-label treatment phase (study period IV) and a 1-week taper phase. This paper presents results from phase II
Setting: prim/secondary care (outpatients); multi-centre
Country: China
Source of funding: Eli Lilly and/or one of its subsidiaries
|
Inclusion criteria: male and female outpatients of at least 40 years of age who met clinical and radiographic criteria for the diagnosis of OA of the knee or hip, had pain for>14 days of each month for 3 months prior to study entry, and had a rating>4 on the BPI 24-h Average Pain item (Question 3 of the BPI-modified shortform) during screening, prior to treatment.
Exclusion criteria: if they had any diagnosis of psychosis, bipolar disorder, schizoaffective disorder, current major depressive disorder, anxiety disorders (excluding phobias), alcohol or eating disorders, or suicidal risk. Also excluded were patients who were taking any excluded medications (analgesic agents including but not limited to NSAIDs, acetaminophen/paracetamol, and opioids) that could not be discontinued at the first study visit and patients who were anticipated by the investigator to require use of excluded medications during the study.
N total at baseline: 407 randomized 2 groups
Important prognostic factors2: age ± SD: I: 61 C: 60 Sex: I: 78% M C: 75% M BMI I: 25.4 C: 25.4 Duration of OA pain (years) I: 8.2 C: 7.8
Groups comparable at baseline? yes |
Duloxetine 60 mg N=205
|
placebo N=202 |
Length of follow-up: 13 weeks
Loss-to-follow-up: Intervention:39 (19%) Reasons: Adverse Events (20), consent withdrawal (16), lack of efficacy (2), loss to follow-up (1)
Control: 26 (13%) Reasons: Adverse Events (10), withdrawal (12), lack of efficacy (3), physician decision (1)
Incomplete outcome data: not specified
|
Responders: >50% reduction from baseline BPI: I: 42.8% C: 34.5% This difference was not statistically significant (group difference (95% CI) = 8.3% (-1.3%, 17.9%)).
WOMAC (subscale scores) Pain 0-20 scale Physical function 0-68 Stifness 0-8 LS mean change difference
Pain (change from baseline): I: -3.03 (-3.44; -2.62) C: -2.32 (-2.73; -1.91) Diff. -0.71 (-1.21; -0.21) Physical function: I: -9.64 (-10.97; -8.31) C: -7.28 (-8.59; -5.97) Diff.-2.36 (-3.95; -0.78) Stiffness: I: -0.83 (-1.03;-0.63) C: -0.44 (-0.64; -0.24) Diff -0.39 (-0.62; -0.16) Change in pain score is not clinically relevant (at least 0.5 SD)
Adverse events (AEs) treatment-emergent (TEAEs) I: 121 (60.8%) C: 83 (41.9%) I/C (%): 1,45
Serious adverse events: I: 0 C: 3 (1.5%)
|
Note: authors used pain reduction measured by brief pain inventory as primary outcome measure
Note: commercial funding of study and writing support
|
|
Abou-Raya, 2012
Clinical trial register NCT01425827 |
RCT single centre double-blind
Setting: prim/secondary care (outpatients); multi-centre
Country: Egypt
Source of funding: Eli Lilly and/or one of its subsidiaries |
Inclusion criteria: Patients aged 65 years and above attending the outpatient clinic, with American College of Rheumatology clinical and radiographic criteria of primary knee OA with knee pain, (>40 on the 24-h average pain severity scale (0-100) using mean of daily ratings from week preceding randomisation) for>14 days/month during three consecutive months preceding enrolment. Radiographic criteria included Kellgren-Lawrence grade I-III tibiofemoral or patellofemoral OA found on weight-bearing anteroposterior and sunrise view radiographs.
Exclusion criteria: Morbid obesity (BMI>32), joint inflammatory diseases and or crystal-induced arthroplasties, or any other concomitant disease (such as neuropsychiatric disease including cognitive impairment, Alzheimer’s disease, Parkinson’s disease, cerebrovascular disease, cardiovascular disease, liver and renal disease) or were taking any other antidepressants that could interfere with the evaluation of the intervention .
N total at baseline: 288 randomized 2 groups
Important prognostic factors2: age ± SD: I: 68.9 ± 6.2 C: 68.5 ± 5.8
Sex: I: 23/144= 16% M C: 24/144=17 % M
BMI I: 27.6 C: 27.5 Duration of OA pain (years) I: 5.7 C: 5.6
Groups comparable at baseline? yes |
Duloxetine 60 mg/dag |
Placebo |
Length of follow-up: 16 weeks
Loss-to-follow-up: Intervention: 20 (14%) Control: 15 (10%)
Reasons: Lost to follow-up Intervention: 6 (4%) Control: 5 (3%)
Discontinued intervention due to adverse events: I: 9 (6%) P: 6 (4%)
Discontinued intervention due to lack of efficacy: I: 5 (3%) P:2 (1%)
|
VAS: there was a significant reduction in pain on the VAS, P<0,001
Pain (WOMAC) (0-20): I: -3,1 (SD 4,3) C: -0,5 (SD 5,3)
Function (WOMAC) (0-68): I: -8,5 (SD 8.0) C: 3,2 (SD 8.5)
WOMAC stiffness (0-8): I: -0.3 (SD 2,8) C: -0.1
Adverse events: I: C: |
Commercial funding of study by providing medicines, no role in approval or preparation of the published manuscript.
Note: no data presented for VAS score |
Zoekvraag-4 (dermale NSAID’s)
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
Research question: what is the value of topical NSAIDs in comparison to oral NSAIDs or placebo (vehicle) in treatment of knee OA?
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Derry 2016 |
Yes |
Yes |
Yes |
Yes*1 |
Not applicable |
Yes |
Yes |
Yes |
Yes |
*1 SR has high methodological quality but uses clinical success (responder analyses) as the only efficacy outcome (e.g. WOMAC or other continuous outcome measures for pain or function are not reported)
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Risk of bias table for intervention studies (randomized controlled trials)
Research question: what is the value of topical NSAIDs in comparison to oral NSAIDs or placebo (vehicle) in treatment of knee OA?
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Wadsworth 2016 |
balanced randomized block assignment using interactive Webbased system |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unclear*1 |
Unlikely |
Unclear*1 |
|
Mu 2016
|
computer generated block randomization list stratified according to trial center |
Unlikely*2 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Yataba 2017 |
permuted block method, blinded, randomization codes concealed |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
*1 statistical corrections in results reported are unclear; completion rates were 91-94% but inadequate imputation methods used (LOCF/ BOCF)
*2 Chinese study, randomization procedure is unclear due to issues with English language
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules..
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: what is the value of topical NSAIDs in comparison to oral NSAIDs or placebo (vehicle) in treatment of knee OA?
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Derry 2016 |
Cochrane SR
multiple databases upto 3 Feb 2016 |
Inclusion criteria: adults (≥16 yrs) with chronic musculoskeletal pain ≥3 months duration and at least moderate intensity; double-blind RCTs comparing topical NSAIDs with inert carrier (placebo) or other active treatment for; ≥10 participants per treatment arm; duration ≥2 weeks
Exclusion criteria: participants with neuropathic pain or fibromyalgia; studies using a cross-over design only considered if data from the first treatment period were reported separately
Detailed information See orignal publication for details on individual study characteristics and results, and data systhesis; also see analyses/ forest plots in guideline text
All studies examined topical NSAIDs for treatment of osteoarthritis, mostly primary osteoarthritis of the knee or (occasionally) hand (excluded in supplementary analyses; see Results) |
Topical NSAID
|
Topical placebo (vehicle), or (any) oral NSAID, or other topical NSAID, or other topical treatment
Relevant comparisons for current research question; studies reporting the primary outcome:
(1) Topical NSAID versus topical placebo (vehicle)
Diclofenac: 9 publications 6 tot 12 weeks duration (4) Altman 2009 Baraf 2011 Baer 2005 Roth 2004 2-6 weeks duration (5) Bruhlmann 2003 Dreiser 1993 Grace 1999 Niethard 2005 Bookman 2004 All knee OA except Altman 2009 (hand arthritis); restricting analysis to knee arthritis (1958 participants) made no difference to results
Ketoprofen: 4 studies, all 6-12 weeks duration (4) Conaghan 2013 Kneer 2013 Rother 2007 Rother 2013 All knee OA
(2) Topical NSAID versus (any) oral NSAID 5 studies; 6-12 weeks (3) Rother 2007 Simon 2009 Tugwell 2004 2-6 weeks (2) Dickson 1991 Zacher 2001 several comparisons: piroxicam gel/ oral ibuprofen, ketoprofen gel/ oral celecoxib, diclofenac solution/ slow-release oral diclofenac, diclofenac solution/ oral diclofenac, diclofenac Emulgel/ oral ibuprofen
|
≥2 weeks (preferrably ≥6 weeks); range follow-up 2 tot 12 weeks
Primary outcome ’clinical success’: ≥ 50% reduction in pain, or an equivalent measure such as a ’very good’ or ’excellent’ global assessment of treatment, or ’none’ or ’slight’ pain on rest or movement, measured on a categorical scale. Hierarchy of outcomes, in order of preference, to extract data for the primary outcome: Participant-reported reduction in pain ≥50%, Participant-reported global assessment of treatment, Pain on movement, Pain at rest or spontaneous pain
Secondary outcomes: Numbers of participants with adverse events: local and systemic, and particularly serious gastrointestinal problems; Numbers of withdrawals: all cause, lack of efficacy, and adverse events
Supplementary data on pain reduction (see Comments) (1) Topical NSAID versus topical placebo (vehicle/ carrier) Diclofenac: 9 publications 6 tot 12 weeks duration (4) Altman 2009 (hand OA; excluded from analyses) Baraf 2011 (3 RCTs pooled) change from baseline (ITT), 2 subgroups (25-64 yrs />65 yrs) = Baraf 2011a/ Baraf 2011b WOMACpain 0-20 scale: Baraf 2011a>> -5.24 (SE 0.22; n 446) vs -4.44 (SE 0.22; n 441) Baraf 2011b>> -4.80 (SE 0.28; n 273) vs -4.20 (SE 0.29; n 264) Baer 2005 WOMAC pain 0-20, change from baseline: -5.2 (SD 5.0) vs -3.3 (4.3)>> Diff= 1.9 (95% CI= 0.7 to 3.2) Roth 2004 WOMAC pain 0-20, change from baseline: −5.9 (SD 4.7) −4.3 (4.4) 2-6 weeks duration (5) Bruhlmann 2003 NRS pain 0-10, baseline/week-2: 5.7 (SD 1.5; n 51)/2.1 (1.8)>> -3.6 (SD 2.34) vs 5.6 (1.5; n 52)/3.9 (2.1)>> -1.7 (2.58) (SD calculated as the square root of the sum of squares of SDs) Dreiser 1993 Pain relief from baseline: group difference (n 78/ 77)>> effect size -0.71 (SE 0.17) (taken from SR) Grace 1999 WOMACpain 0-100, change from baseline: -16.49 (SD 15.16) vs -4.35 (22.55) Niethard 2005 WOMACpain 0-100, change from baseline: -22 (SD 21) vs -14 (23)>> Diff= 9 (p=0.0002) Bookman 2004 WOMACpain 0-20, change from baseline: –3.9 (95%CI= –4.8 to –2.9; n 84) vs –2.5 (–3.3 to –1.7; n 79) All knee OA except Altman 2009 (hand arthritis); restricting analysis to knee arthritis (1958 participants) made no difference to results
Ketoprofen: 4 studies 6-12 weeks duration (all 4) Conaghan 2013 WOMACpain NRS 0-10, change from baseline (highest dose ketoprofen; n 230/ 234): −1.92 (SD 1.75) vs −1.80 (1.74) Kneer 2013 WOMACpain VAS 0-100, baseline/ week-12 (highest dose ketoprofen; n 221/ 199): 65.67 ± SD 13.38/ 28.39 ± 21.00>> -37.28 (SD 24.90) vs 65.6 ± 13.2 / 32.57 ± 32.33>> -33.03 (34.92) Rother 2007 WOMACpain VAS 0-100, change from baseline (n 138/ 127): -18.2 (95%CI= −22.1 to −14.3) vs -9.9 (−13.9 to −5.8) Rother 2013 WOMACpain NRS 0-10, change from baseline (n 274/ 281): −1.98 (SD 1.97) vs −2.33 (2.12) All knee OA
(2) Topical NSAID versus (any) oral NSAID 5 studies; 6-12 weeks (3) Rother 2007 WOMACpain VAS 0-100, change from baseline (n 138/ 127): -18.2 (95%CI= −22.1 to −14.3) vs -20.3 (-24.3 to -16.2) Simon 2009 WOMACpain 0-20, change from baseline (n 154/161): -6.0 (SD 4.5) vs -4.7 (4.3) Tugwell 2004 WOMACpain 0-500, change from baseline (n 303/301 ITT): –118 (SD 121) vs –134 (127)>> Diff= 16.4 (95%CI= –3.4 to 36.1) 2-6 weeks (2) NOT INCLUDED IN ANALYSES Dickson 1991 Zacher 2001 (osteoarthritis of the finger joints) All knee OA except Zacher 2001 (OA of finger joints) |
See orignal publication for details on individual study characteristics and results, and data systhesis; also see analyses/ forest plots in guideline text
RoB: All studies included were both randomised and double-blind and generally of moderate or high methodological quality; main deficiencies were in study duration and trial size particularly in the older studies; short study duration to test intervention for a chronic condition, and small study size, both tend to overestimate treatment effect
Note: authors do not analyze or report pain or function measures on a continuous scale (WOMAC, VAS), only responders analyses are provided (defined as primary outcome)
Therefore, in a supplementary analysis we assessed the effects on pain reduction (WOMAC, VAS or NRS) for the studies that are part of the quantitative responder analyses in Derry 2016: see supplementary data on pain reduction in the Table (also see analyses/ forest plots in guideline text)
|
|
|
Wadsworth 2016
ClinicalTrials.gov identifier NCT01119898 |
RCT (parallel) phase II
Setting: primary care? 23 sites
Country: USA
Source of funding: commercial (Horizon Pharma USA Inc, Mallinckrodt Pharmaceuticals); co-author employee of sponsor
|
Inclusion criteria: 40-85 yrs; radiographically confirmed primary knee OA <1 year prior to screening; KL-Grade 2-3; receiving stable analgesic therapy (>= 3 d/w oral or topical NSAID or acetaminophen); with a ‘moderate flare’ after washout (3-14 d medication washout period) defined as at least 2 unit worsening in NRS pain from>= 5 at baseline
Exclusion criteria: sec OA or symptomatic chondrocalcinosis; known sens to diclofenac or other NSAIDs; other severe medical condition; uncontrolled diabetes; alcohol or drug abuse <1 year prior to screening; breastfeeding females; surgery to the study knee; IA corticosteroid injection <90 days of screening or topical corticosteroid use; referral to orthopedic surgeon for (consideration of) knee replacement or knee reconstruction surgery; regular headaches requiring acetaminophen
N total at baseline: 260 randomized 259 treated (mITT) Intervention: 130 Control:129
Important prognostic factors2: age ± SD: I: 60 ± 9 C: 62 ± 9 Sex: I: 35% M C: 30% M Weight I: 93.3 (22.8) C: 89.8 (21.1) BMI I: 32.5 (7.7) C: 31.8 (6.8) KL % grade 2/3 I: 48/52 C: 54/46 WOMAC-pain I: 12.4 (3.1) C: 12.6 (3.4) NRS-pain (11-p) screening/day-1 I: 4.6/7.6 C: 4.6/7.6 Note: study uses ‘flare design’
Groups comparable at baseline? Yes |
Topical diclofenac BID total dose ~80 mg n=130
Diclofenac sodium 2% topical solution (Pennsaid, IL, USA) approved in January 2014 for knee OA; 40.4 mg/2 mL BID
Rescue medication acetaminophen (paracetamol) as on an as-needed basis (up to 1950 mg/day), except for the 3 days prior to each clinic visit |
Placebo (vehicle only) BID
n=129
Rescue medication acetaminophen (paracetamol) as on an as-needed basis (up to 1950 mg/day), except for the 3 days prior to each clinic visit |
Length of follow-up: 4 weeks
Loss-to-follow-up: Intervention:8 Control: 12 Reasons: AEs, withdrawal of consent, lack of efficacy, protocol noncompliance, withdrawal of patient by sponsor (1 patient), and 'other'; not specified separately for I/C
Incomplete outcome data: not specified
Study used inadequate imputation methods (LOCF, BOCF, and combined LOCF/BOCF) |
At final fup; WOMAC (pain 0-20, function 0 tot 68, stiffness 0-8; lower is better); patient global assessment (PGA); knee pain intensity (midday, evening, previous 24 h) NRS (11-p); cumulative (!) proportion of responders (>50% pain relief; LOCF/BOCF imputation!); compliance; use of rescue analgesia; AEs
WOMAC pain 0-20 change from baseline (SD) I: -4.5 (4.5) C: -3.6 (4.2) Diff= -0.9 (p=0.04)
WOMAC function 0-68 change from baseline (SD) I: -14.3 (14.7) C: -11.5 (13.8) Diff= -2.8 (p=0.06)
WOMAC stiffness 0-8 change from baseline (SD) I: - 1.7 (1.8) C: -1.4 (2.0) Diff= -0.3 (p=0.1)
Responders cumulative (!) proportion (%) with ≥ 50% NRS pain? reduction I: 51/130= 39.2% C: 37/129= 28.7% Diff= +10.5%
Adverse events (AEs) treament-emergent (TEAEs) I/C (%) Dryness 20.0/21.7 Exfoliation 6.2/7.8 Erythema 3.1/11.6 Pruritus 2.3/14.0 Pain 1.5/3.1 Total TEAEs 33/58 i.e. more TEAEs in control; no serious AEs reported
Compliance (%) based on drug bottle weights I: 77% C: 73% note:>96% compliance based on self-reporting
|
Authors conclude that topical diclofenac (BID) results in significantly greater improvement in pain reduction compared with control (vehicle); physical function, stiffness, and overall status (of knee OA) also demonstrated statistically significant improvements; generally well tolerated
Note: high placebo response, higher than ‘usual’ possibly due to flare design of the study; effects smaller than MID i.e. appear not clinically relevant (also see meta-analysis in guideline text: SMD= -0.21 (-0.45; 0.04) i.e. not statistically significant and less than MID of 0.37; although 95%CI does cross MID)
Note: commercial funding of study and study authors, and writing support; power calculation and statistical tests use α=0.10
Note: Topical NSAIDs reduce systemic exposure compared with oral NSAIDS, thus generally reducing incidence of GI and other associated AEs; important for patients with comorbidities, or those with difficulty swallowing oral medications; also minimizing toxicity in patients taking anticoagulants, and in those with renal and/or hepatic dysfunction |
|
Mu 2016
ISRCTN trial ID: ISRCTN40097939
|
RCT (parallel) double dummy non-inferiority
Setting: secondary care; multi-centre
Country: China
Source of funding: commercial (Daiichi Sankyo Co., Ltd)
|
Inclusion criteria: ≥40 years old; meet OCR criteria knee OA; washout (analgesics at least 1 w; no joint injection>4 w; no physical and/or occupational therapy>1 month)
Exclusion criteria: history of peptic ulcer, asthma, unstable cardiac diseases, abnormal hepatic function or renal function, hematologic disorders, psychosis, and other rheumatic diseases
N total at baseline: 169 randomized 164 treated (ITT) Intervention: 81 Control:83 (PP 71 vs 73)
Important prognostic factors2: age ± SD: I: 57 ± 10 C: 57 ± 9 Sex: I: 24% M C: 19% M BMI I: 24.7 ± 3.2 C: 25.0 ± 3.3 Radiogr grade Sharp score I: 1.6 ± 0.7 C: 1.5±0.6
Groups comparable at baseline? Yes |
Loxoprofen patch (OD) Tablet placebo (TID) n= 81 (ITT)/ 71 (PP)
LXP (Lead Chemical Co., Ltd.) with 100 mg of LX per patch (OD)
No statement on rescue medication |
Loxoprofen tablet (TID) Patch placebo (OD) n= 83 (ITT)/ 73 (PP)
LXT (Daiichi Sankyo Co., Ltd.) with 60 mg of LX per tablet (TID)
No statement on rescue medication |
Length of follow-up: 4 weeks
Loss-to-follow-up: Intervention:10 (12%) Reasons: lost to fup (4), prohibited medication (4), lack of compliance (2)
Control: 10 (12%) Reasons:lost to fup (3), prohibited medication (5), lack of compliance (1), meeting exclusion criteria (1)
Incomplete outcome data: not specified |
At final fup; proportion of responders (>50% overall improvement)
Overall improvement (definition) = % change in total symptoms score with respect to baseline (Clinical joint symptoms, including pain at rest, pain on motion, tenderness, swelling, effusion, burning pain, and disability in daily activities rated on 0 tot 3 scale and scores added together; lower is better); patient reported global assessment; AEs
Non-inferiority margin= -10%
Responders proportion; see definition I: 59/81 (72.8 %) C: 50/83 (60.2 %) Diff= 12.6% (−1.7;–26.9) ITT Diff= 13.0% (−1.8;–27.9) PP Meets the non-inferiority margin i.e. LXP is non-inferior to LXT
Adverse events (AEs) treament-emergent (TEAEs) I/C (%) GI disorders 16.9/ 28.2 Skin disorders 4.8/ 4.7 Infections 1.2/ 7.2 Total TEAEs 14.5/ 15.3
Note: similar total TEAEs, and ~17% GI disorders in patients treated with topical loxoprofen
|
Authors conclude that topical loxoprofen patch is at least equivalent to oral loxoprofen in efficacy for patients with knee OA; topical loxoprofen was not associated with significantly fewer adverse events than oral loxoprofen (further study on the safety of topical NSAIDs is warranted)
Note: high response in placebo group
Note: Loxoprofen (patch and tablets) is not registered in the Netherlands
Note: uses a composite symptomatic score (not validated?)
Note: commercial funding of study and writing support
|
|
Yataba 2017
|
RCT (parallel)
Setting: prim/secondary care; multi-centre (59 sites)
Country: Japan
Source of funding: commercial (Taisho Pharmaceutical); co-authors advisor or employee of sponsor
|
Inclusion criteria: ≥20 years; knee OA KL grade 2/3; using oral and/or topical NSAIDs continuously>3 weeks prior to screening visit; pain on rising from chair (100-mm VAS) before wash-out <80 mm, after wash-out ≥40 mm with ≥15 mm worsening of pain
Exclusion criteria: Complication of rheumatoid arthritis; history of knee surgery; malignant tumor, neuropsychiatric disease etc; taking oral or IA steroid, IA hyaluronic acid or local anesthetics
N total at baseline: 509 randomized 4 groups
Only data highest dose (40 mg) shown here
Important prognostic factors2: age ± SD: I: 66 C: 67 Sex: I: 15% M C: 16% M Weight I: 60.6 C: 59.7 BMI I: 25.4 C: 24.9 KL grade 2/3 (%) I: 74/26 C: 63/37
Groups comparable at baseline? No, more grade 3 knee OA in control group |
S-flurbiprofen plaster 3 groups: 10/20/40 mg n= 121/127/134
Only result for highest dose (40 mg) shown here
No rescue medication allowed
|
placebo plaster
n= 127
No rescue medication allowed
|
Length of follow-up: 2 weeks
Loss-to-follow-up: Intervention:5 (4%) Reasons:AE (1), consent withdrawal (3), complication (1)
Control: 3 (2%) Reasons: AE (2), lack of efficacy (1)
Incomplete outcome data: not specified
statistics: LOCF used |
At final fup; knee pain on rising from chair (standardised; 100 mm VAS), change from baseline; total clinical symptoms score; global assessment; AEs
Only result for highest dose (40 mg) shown here
Knee pain (100-mm VAS) from baseline I: -35.6 (-38.4;-32.9) C: -29.5 (-32.4;-26.7) Diff= -6.1 (−10.1;-2.1) p=0.001
Responders proportion>50% pain relief I: 97/134 (72.4 %) C: 65/127 (51.2 %) Diff= 21.2% p<0.001
Adverse events (AEs) treament-emergent (TEAEs) I/C (%) local 10.4/ 5.5 systemic 3.7/ 2.4 Total TEAEs 14.2/ 7.9 no severe AEs reported
|
Authors conclude that S-flurbiprofen plaster (especially 40 mg) showed remarkable pain relief with significant advantage over placebo but similar safety profile
Note: clinically relevant pain relief (compared to baseline) was observed in all groups including placebo (authors speculate that the peppermint oil present in all preparations may have contributed to pain relief)
Note: group difference in reduction of knee pain does not meet MID i.e. is probably not clinically relevant (95%CI does cross MID)
Note: S-flurbiprofen is not registered in the Netherlands for OA (tablets are registered for mild throat pain)
Note: very short follow-up of only 2 weeks
Note: commercial funding of study and writing support
|
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 12-03-2019
Beoordeeld op geldigheid : 19-11-2018
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep in stand gehouden. Uiterlijk in 2024 bepaalt het bestuur van de Nederlandse Orthopaedische Vereniging (NOV) of deze richtlijn (module) nog actueel is. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NOV is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Diagnostiek heup- of knieartrose |
NOV |
2019 |
2021 |
eens in twee jaar |
NOV |
beschikbaarheid nieuwe criteria voor vroeg diagnostiek |
|
Zelfmanagement educatie en informatie |
NOV |
2019 |
2024 |
eens in de vijf jaar |
NOV, NHG, NVR, VRA, KNGF |
Lopend onderzoek, beschikbaarheid nieuwe interventies |
|
submodule Gewichtsverlies |
NOV |
2019 |
2024 |
Eens in de vijf jaar |
NOV, NHG |
Onderzoek naar effectiviteit van gewichtsverlies |
|
Oefentherapie bij heup- of knieartrose |
NOV |
2019 |
2024 |
eens in vijf jaar |
(NOV en KNGF of de werkgroep) |
lopend onderzoek |
|
Pijnmedicatie |
NOV |
2019 |
2024 |
eens in de vijf jaar |
NOV |
Lopend onderzoek, beschikbaarheid nieuwe middelen |
|
Intra-articulaire injecties |
NOV |
2019 |
2024 |
eens in de vijf jaar |
NOV |
Lopend onderzoek, beschikbaarheid nieuwe middelen |
|
Knie kniebraces en orheses |
NOV |
2019 |
2024 |
eens in de vijf jaar |
NOV |
Lopend onderzoek, beschikbaarheid nieuwe middelen |
|
Beleid bij specifieke subgroepen |
NOV |
2019 |
2024 |
eens in de vijf jaar |
NOV |
Lopend onderzoek |
|
Geïntegreerd beleid |
NOV |
2019 |
2024 |
eens in de vjif jaar |
NOV |
Lopend onderzoek, transmuraal overleg |
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
*De KNMP geeft de richtlijn 'bestuurlijke ondersteuning'
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). Patiëntenparticipatie bij deze richtlijn werd mede gefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
Doel en doelgroep
Doel
Doel is een multidisciplinaire richtlijn voor de conservatieve behandeling van heup- en knieartrose. De richtlijn beoogt een leidraad te geven voor de dagelijkse zorgpraktijk bij patiënten met artrose aan heup of knie, in eerste en tweede lijn. In de conclusies wordt aangegeven wat de wetenschappelijke stand van zaken is. De aanbevelingen zijn gericht op optimaal medisch handelen en zijn gebaseerd op de resultaten van wetenschappelijk onderzoek en overwegingen van de werkgroep, waarbij voor zover mogelijk de inbreng door patiënten is meegenomen (patiënten perspectief). Het doel is een hogere kwaliteit en meer uniformiteit in behandelingsstrategie, en het verminderen van praktijkvariatie. Daarvoor zijn duidelijke verwijscriteria van eerste naar tweede lijn noodzakelijk. Doel van de richtlijn is met name ook het verminderen van pijn en verbeteren van de gewrichtsfunctie door optimalisatie van de zorg. Het identificeren van kennislacunes zal richting kunnen geven aan nieuw wetenschappelijk onderzoek en nieuwe ontwikkelingen. Tot slot is naar aanleiding van de noodzaak tot beheersing van de verdere groei van kosten in de gezondheidzorg aandacht besteed aan kosten en kosteneffectiviteit.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg en patiëntvoorlichting voor patiënten met (verdenking op) artrose aan heup of knie: orthopedisch chirurgen, reumatologen, radiologen, revalidatieartsen, apothekers, fysiotherapeuten, oefentherapeuten Cesar of Mensendieck*, ergotherapeuten, huisartsen, klinisch geriaters, specialisten ouderengeneeskunde, anesthesiologen, sportartsen, arbo-artsen en bedrijfsartsen, en bijvoorbeeld ook alle artsen (niet) in opleiding voor huisarts en genoemde specialisten, en verpleegkundig specialisten en de physician assistants op dit gebied.
*waar oefentherapeut staat in de rest van het document wordt bedoeld oefentherapeut Cesar of Mensendieck
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2015 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van relevante specialismen die betrokken zijn bij de zorg voor personen met artrose aan heup of knie.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende drie jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- A.A. Polak, orthopedisch chirurg, Sint Franciscus Gasthuis, Rotterdam (voorzitter); Nederlandse Orthopaedische Vereniging;
- Prof. dr. S.M.A. Bierma-Zeinstra, hoogleraar Artrose, afdeling Huisartsgeneeskunde en Orthopedie, Erasmus MC, Universitair Medisch Centrum, Rotterdam; Nederlandse Orthopaedische Vereniging;
- J. Hoogmoed, klinisch geriater, SJG Weert, Weert; Nederlandse Vereniging voor Klinische Geriatrie;
- H. Jessen, NVA, anesthesioloog/ pijnspecialist, Kliniek ViaSana, Mill; Nederlandse Vereniging voor Anesthesiologie (mandaat tot 1 november 2017);
- J.W. Kallewaard, anesthesioloog/ pijnspecialist, Rijnstate Arnhem, AMC Amsterdam; Nederlandse Vereniging voor Anesthesiologie (mandaat vanaf 1 augustus 2018);
- L. Elzinga, anesthesioloog/ pijnspecialist, Bravis Ziekenhuis Roosendaal, Roosendaal; Nederlandse Vereniging voor Anesthesiologie (mandaat vanaf 1 augustus 2018);
- Prof. dr. G. Kloppenburg, reumatoloog, Leids Universitair Medisch Centrum LUMC, Leiden; Nederlandse Vereniging van Reumatologie;
- J.S. van der Kraan, patiëntvertegenwoordiger, beleidsmedewerker Patiëntenfederatie Nederland, Utrecht; Patiëntenfederatie Nederland;
- Dr. E.H.G. Oei, radioloog, Erasmus MC, Universitair Medisch Centrum, Rotterdam; Nederlandse Vereniging voor Radiologie;
- S. Spruijt, orthopedisch chirurg, HagaZiekenhuis, Den Haag; Nederlandse Orthopaedische Vereniging;
- Prof. dr. T.P.M. Vliet Vlieland, Leids Universitair Medisch Centrum LUMC, Leiden; Koninklijk Nederlands Genootschap voor Fysiotherapie;
- C.M.J. Wildervanck-Dekker, huisarts en kaderarts bewegingsapparaat, Julius Gezondheidscentrum Leidsche Rijn, De Meern; Nederlands Huisartsen Genootschap (mandaat tot 1 juni 2018);
- Dr. T. Kuijpers, epidemioloog, senior wetenschappelijk medewerker Nederlands Huisartsen Genootschap, Utrecht; Nederlands Huisartsen Genootschap (mandaat vanaf 1 juni 2018).
Klankbordgroep
- R. Hebing, poliklinisch apotheker, Apotheek Reade, Amsterdam; Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie; Nederlandse Vereniging van ZiekenhuisApothekers;
- T. Mesman, ergotherapeut, Revalidatie Centrum Reade, Amsterdam; Ergotherapie Nederland;
- Dr. L.A.M. Elders, bedrijfsarts, ConsuloBV, Rotterdam; Nederlandse Vereniging voor Arbeids- en Bedrijfsgeneeskunde;
- Dr. A.M. Boonstra, revalidatiearts, Revalidatie Friesland, Beetsterzwaag; Nederlandse Vereniging van Revalidatieartsen;
- M. Post, beleidsmedewerker Ontwikkeling & Wetenschap VvOCM, Utrecht; Vereniging van Oefentherapeuten Cesar en Mensendieck.
Met ondersteuning van
- Dr. K.N.J. Burger, epidemioloog, senior adviseur Kennisinstituut Federatie van Medisch Specialisten;
- Dr. J.S. Boschman, adviseur Kennisinstituut Federatie van Medisch Specialisten;
- Dr. M.L. Molag, adviseur Kennisinstituut Federatie van Medisch Specialisten;
- E.A. Rake (MSc), junior adviseur Kennisinstituut Federatie van Medisch Specialisten;
- M.S. Oerbekke, adviseur Kennisinstituut Federatie van Medisch Specialisten;
- M. Wessels (MSc), medisch informatiespecialist, Kennisinstituut Federatie van Medisch Specialisten;
- N.F. Bullock, secretaresse, Kennisinstituut Federatie van Medisch Specialisten.
Met dank aan
- Dr A.P. Verhagen, fysiotherapeut en klinisch epidemioloog, Erasmus MC, Universitair Medisch Centrum, Rotterdam (voor het ter beschikking stellen van meta-analystische data).
Belangenverklaringen
De KNMG-Code “Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling” is gevolgd (KNAW 2016). Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventueel belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Polak (voorzitter) |
orthopedisch chirurg |
geen |
werkzaam in SFG ziekenhuis, lid v/d coöperatie met de persoonlijke BV Polak Beheer BV |
geen |
|
Bierma-Zeinstra |
Hoogleraar aan het Erasmus MC (onderzoek) |
geen |
lid van de internationale OARSI richtlijn commissie voor behandeling van artrose, lid van ARUK klinische studies commissie en van de wetenschappelijke commissie van het Annafonds, associate editor van Osteoarthritis & Cartilage, lid van de editorial board van Maturitas, en lid van de scientific advisory board van het Arthritis UK Pain Centre in Nottingham. Mede verantwoordelijk voor organisatie en inhoud van de tweejarige NHG erkende kaderopleiding voor huisartsen "Kaderhuisarts bewegingsapparaat". Op mijn onderzoeksafdeling ontvingen wij voor artrose onderzoek gedurende de ontwikkeling van de richtlijn (2015-2018) subsidies van het reumafonds (Dutch Arthritis Foundation), ZonMW, EU FP 7, het fonds NutsOhra, CZ, en ZonMW. Het betreft de volgende studies: Intramuscular corticosteroid injections in hip OA: a randomized controlled trial. Dutch Arthritis Foundation; Optimizing the management of osteoarthritis and other chronic musculoskeletal pain disorders in primary care. Dutch Arthritis Foundation, Long-term Program; Cost-effectiveness of viscosupplementation therapy for patients with osteoarthritis of the knee: a randomized clinical trial. ZonMW; Health Care Efficiency Research Programme: sub-programme Effects & Costs; D-board (Novel Diagnostics and Biomarkers for Early Identification of Chronic Inflammatory Joint Diseases) EU-FP7 Health; Dutch consortium ARGON. Optimal timing for osteoarthritis surgery. NOV/Dutch Arthritis Foundation; Duloxetine for chronic osteoarthritis pain; an important alternative? ZonMW; Rational Pharmacotherapy programme; Diagnostic criteria for early osteoarthritis of hip and knee. Dutch Arthritis Foundation; Joint implementation of guidelines for osteoarthritis in Western Europe: JIGSAW-E (first applicant Krysia Diedzics, UK). EIT Health (European Union); IFEROA- Identification of the female specific etiology and risk groups for osteoarthritis; Intramuscular corticosteroid injections in hip OA: a randomized controlled trial. Nuts Ohra; Is MRI of the knee cost-effective in patients with traumatic knee complaints in primary care? (first applicant P. Luijsterburg) ZonMW; Health Care Efficiency Research Programme: sub-programme Effects & Costs (K€ 616); Cost-effectiveness of two treatment strategies of an anterior cruciate ligament rupture. A randomized clinical study. ZonMW; Health Care Efficiency Research Programme: sub-programme Effects & Costs; Should a traumatic meniscal tear be resected? (first applicant M. Reijman) ZonMW; sub-programme Effects & Costs (K€ 400); Shock wave therapy for ankle arthrodesis (first applicant D. Meuffels). Dutch Arthritis Foundation; Like-2-Run (first applicant M. van Middelkoop) ZonMw Sport en Bewegen (K€ 157); Growing up: the influence of lifestyle on joint health (first applicant M. Van Middelkoop). EUR-fellowship; Effectiveness in knee osteoarthritis of an intra-articular corticosteroid injection versus an intra-muscular gluteal corticosteroid injection versus no injection in general practice: a multicenter randomized, 24 weeks comparative parallel-group trial. ZonMW Programme Primary Focus; PaTIO study: PhysiotherApeutic Treat-to-target Intervention after Orthopaedic surgery; A cost-effectiveness study. ZonMW/NOV Zorgevaluatie Leading the Change; Evaluation of care for patients with hip and knee osteoarthritis on the cross-road of primary and secondary care. CZ Health Insurance; The OA Trial Bank. Dutch Arthritis Foundation. Consultant op uurbasis (betaald aan mijn werkgever Erasmus MC) voor Infirst Healthcare ltd in de UK. Binnen dit consultancy chief investigator voor de "Flare study", a Three Arm Double blind, Randomised Multicentre Study to Investigate the Non-Inferiority of a Soft Gel Capsule of Ibuprofen Lipid Formulation (total daily dose 1200 mg) versus a Standard Soft Gel Ibuprofen Capsule (total daily dose 1200 mg and 2400 mg) in the Treatment of Patients with Episodic Knee Arthralgia/Flaring Knee Pain; eenmalig consultant geweest voor Regeneron met betrekking tot welke baseline variablelen in studies bepaald moeten worden voor het vaststellen van responsieve subgroepen bij gebruik van anti-NGF. |
was beoogd als voorzitter maar in overleg is besloten om een andere voorzitter te benoemen om zo elke schijn van belangenverstrengeling te voorkomen; om dezelfde reden geen voortrekker of meelezer op de pijnmedicatie vraag. Omdat de nieuwe pijnstiller (Soft Gel Capsule of Ibuprofen) niet verkrijgbaar is op de Nederlandse markt en geen onderdeel vormt van de richtlijnmodule, was deelname aan de besluitvorming wel mogelijk. |
|
Spruijt |
Orthopaedisch chirurg, Maartenskliniek Woerden/Nijmegen (tot 1 septemeber 2017). Orthopaedisch chirurg HagaZiekenhuis Den Haag (per 1 september 2017). |
geen |
Met Spruijt Praktijk o.a. lid Medisch Specialisten Coöperatief Haga; Consultant Zimmer Biomet (presentaties, cursussen, scholing); In de afgelopen jaren zijn er 2 RCTs in ons ziekenhuis gedaan waarbij kniedistractie vergeleken werd met tibiakop-osteotomie en kniedistractie met knieprothesiologie (financiering door ZonMw) |
geen |
|
Oei |
Musculoskeletaal radioloog, Erasmus MC Rotterdam; Unviversitair docent musculoskeletale beeldvorming, Erasmus MC Rotterdam/ Erasmus Universiteit Rotterdam |
geen |
geen |
geen |
|
Wildervanck-Dekker |
huisarts, kaderarts bewegings-apparaat/ intern consulent beweging-sapparaat Leidsche Rijn Julius Gezondheidscentra |
geen |
geen |
geen |
|
Kuijpers |
Epidemioloog, senior wetenschappelijk medewerker Nederlands Huisartsen Genootschap |
geen |
geen |
geen |
|
Vliet Vlieland |
Hoogleraar Doelmatigheid Revalidatie-processen/ Fysiotherapie, LUMC; Adviseur en Coordinator Wetenschappelijk Onderzoek Sophia Revalidatie Den Haag en Rijnlands Revalidatie Centrum Leiden |
geen |
Bijzonder Hoogleraar vanwege het KNGF bij LUMC; Betrokkenheid bij relevante, lopende onderzoeken: Zorgnetwerken voor mensen met reumatische aandoeningen in Nederland, Vliet Vlieland (hoofdaanvrager/penvoerder) van den Ende (mede-aanvrager), Dekker (Mede-aanvrager), Subsidiegever: ReumaNederland; De-implementation of blood saving maesures in hip and knee arthroplasties, aanvrager: L. van Bodegom-Vos, P. Marang-van de Mheen, T. Vliet Vlieland, R. Nelissen, Subsidiegever: ZonMw |
geen |
|
Jessen |
Anesthesioloog/ pijnbehandelaar |
geen neven-werkzaamheden; extramurale tandheelkundige behandeling onder narcose als onderdeel van anesthesioloog |
Aandeel in kliniek SanaVisie betreft ZBC voor plastische en cosmetische chirurgie; werkzaam in kliniek VraSana betreft ZBC voor orthopedische, neurochirurgische behandelingen |
geen |
|
Elzinga |
Anesthesioloog-Pijnspecialist Bravis Ziekenhuis Roosendaal |
lid Bestuur Sectie Pijn en Palliatieve geneeskunde NVA (reiskostenbasis) |
geen |
geen |
|
Kallewaard |
Anesthesioloog pijnbestrijder Rijnstate (70%) en AMC (30%) |
voorzitter Sectie Pijn- en Palliatieve geneeskunde NVA; voorzitter BBC NVA (onbetaald) |
geen |
geen |
|
Kloppenburg |
hoogleraar medisch specialist, reumatoloog |
Lid Commissie Medische Ethiek (2011-2016); vergoeding wordt betaald aan de afd. Reumatologie, LUMC; Associate editor "Arthritis Rheumatism" (2010-2015); Associate editor "Arthritis Rheumatism" (2010-2015) |
Alle financiële vergoedingen zijn betaald aan het Leids Universitair Medisch Centrum: Consultancy EMD Serono Research & Development Institute (10-2016–2-2017) betreffende "DMOAD development in osteoarthritis"; Lid Advisory boards voor Abbvie (2016), GlaxoSmithKline (2016, 2017, 2018), Levicept (2016) betreffende artrose. Lid advisory board voor Pfizer (2018) "Tanezumab osteoarthritis global panel meeting". Author UptoDate "Management of hand osteoarthritis"(2017); Medevoorzitter van werkgroep voor Revisie van Clinical Trial richtlijnen voor handartrose op initiatief van OARS) (2013-2015); Voorzitter Programma Commissie voor jaarlijks congres OARSI (2015); Lid Task Force EULAR "EULAR Recommendations for the use of imaging in OA clinical practice" (2014-2015); Concilium Rheumatologicum voor Nederlandse Vereniging Reumatologie (NVR) (2013-heden); Lid Centrale Visitatiecommissie, NVR (2013-heden); Programma Commissie EULAR (2014-2017); Werkgroep Handartrose OMERACT; Lid Abstract Review Commissie "American College of Rheumatology" (2014, 2015); Lezing ter nascholing van Nederlandse Reumatologen (ACR Review 2015), gesponsord door Pfizer (vergoeding betaald aan LUMC); Lid Advisory Board "Nature Review Rheumatology" (start 2015); Lid Board of Directors OARSI (2017-heden); Lid werkgroep "Kennisagenda Reumatologie" voor NVR; Lid Health Care Professionals Working Party van de European Medicines Agency (EMA) namens de EULAR (start 2018); Alle grants zijn uit betaald aan het LUMC: Grant van European League Against Rheumatism (EULAR) voor "Development of Classifiction Criteria for Hand Osteoarthritis"; Grant van EULAR voor "2018 Update of the EULAR Recommendations for the Management of Hand Osteoarthritis"; Grant van Reumafonds voor "Randomized placebo-controlled trail with prednisolone in hand Osteoarthritis: a proof-of-concept study" (2015-2018); Langlopende ondersteuning van ReumaNederland voor artroseonderzoek (2013-2023); Grant van Europese Unie (IMI-EFPIA project Approach, start 2015); Grants van Pfizer voor onderzoek naar etanercept in handartrose (2008-2015); Principal Investigator Nederland van industrie geinitieerde klinische trials (Abbvie) naar effectiviteit en veiligheid van Lutikizumab bij knie- en handartrose |
nevenfuncties en belangen zijn besproken in de werkgroep in het licht van de geprioriteerde uitgangsvragen en besloten is dat er geen actie hoeft te worden ondernomen (adviezen zijn niet beperkt tot een bedrijf maar verstrekt aan een aantal elkaar beconcurrerende bedrijven; richtlijn bevat geen uitgangsvragen m.b.t. LEVI, tanezumab, lutikizumab of prednisolon); geen trekker op medicamenteuze uitgangsvragen. |
|
Hoogmoed |
klinisch geriater |
geen |
geen |
geen |
|
v/d Kraan |
beleidsmedewerker Patiëntenfederatie Nederland |
geen |
geen |
geen |
|
Hebing |
poliklinisch apotheker Apotheek Reade en onderzoeker Reade Research, reumatologie |
klankbord specialisme Vereniging van Jonge Apothekers (belangenbehartiging jonge apothekers in opleiding tot openbaar apotheker specialist, aanspreekpunt vervolgopleiding, kwaliteitsmonitoring vervolgopleiding; onbetaald); Lid Centraal College KNMP (lid namens Apothekers in opleiding tot specialist; betaald), SIG biotechnologie NVZA, OMERACT werkgroep (onbetaald) |
geen |
geen |
|
Mesman |
ergotherapeut/ handtherapeut Reade binnen artrose team Reumarevalidatie |
geen |
geen |
geen |
|
Elders |
Bedrijfsarts Ministerie van Binnenlandse Zaken en Koninkrijkrelaties/ P-Direkt Klinische Arbeids-geneeskundige Rijndam Revalidatie-centrum/ Arbeidsrevalidatie |
Functie bedrijfsarts: beoordelen en begeleiden van werknemers bij het Ministerie afdeling P-Direkt, tevens werkzaam als arts-gemachtigde voor vele Ministeries en Departementen van de Rijksoverheid |
voorzitter van de Nederlandse Vereniging voor Klinische arbeidsgeneeskunde |
|
|
Boonstra |
Revalidatiearts Revalidatie Friesland OCA |
voorzitter cie. Kwaliteit VRA |
geen |
geen |
|
Post |
Beleidsmedewerker ontwikkeling & wetenschap VvOCM |
geen |
afgevaardigde namens VvOCM in het PON (Partnerschap Overgewicht Nederland) |
geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afvaardiging van Patiëntenfederatie Nederland in de werkgroep en een tweetal focusgroepen georganiseerd door Patiëntenfederatie Nederland (aanverwant ‘Samenvatting focusgroepen artrose’). Daarnaast is er in de oriënterende fase gezocht naar literatuur vanuit patiëntenperspectief, hierbij is gebruik gemaakt van een gestandaardiseerd zoekfilter (Wessels 2016). ReumaNederland, de Poly-Artrose Lotgenoten Vereniging en de Nationale Vereniging ReumaZorg Nederland zijn gevraagd om knelpunten aan te leveren, en de conceptrichtlijn is voor commentaar voorgelegd aan genoemde patiëntenverenigingen.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Voor deze richtlijn zijn geen interne kwaliteitsindicatoren ontwikkeld (zie Indicatorontwikkeling onder Werkwijze).
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen via een invitational conference door:
Ergotherapie Nederland (EN), Bijwerkingencentrum Lareb, Nefemed, Nederlands Huisartsen Genootschap (NHG), Patiëntenfederatie Nederland, Nederlandse Vereniging voor Arbeids- en Bedrijfsgeneeskunde (NVAB), Nederlandse Vereniging van Reumatologie (NVR), Nederlandse Vereniging van ZiekenhuisApothekers (NVZA), Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie (KNMP), ReumaNederland, Poly-Artrose Lotgenoten Vereniging, Nationale Vereniging ReumaZorg Nederland, Zorginstituut Nederland (ZIN), Zelfstandige Klinieken Nederland (ZKN), Nederlandse Orthopaedische Vereniging (NOV), Zorgverzekeraars Nederland (ZN). Daarnaast is de Nederlandse Vereniging van Revalidatieartsen (VRA) benaderd voor een schriftelijke knelpuntanalyse op basis van het conceptraamwerk en de conceptnotulen van de invitational conference. Een verslag van de invitational conference met toelichting van de richtlijnwerkgroep is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen (Guideline International Network), systematische reviews (Medline (OVID), Cochrane Library), en literatuur over patiëntenvoorkeuren en patiëntrelevante uitkomstmaten (patiëntenperspectief; Medline (OVID)). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of bias (ROB) tabellen.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is i.p.v. ‘matig’
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz 2017).
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Bij de richtlijnontwikkeling is ervoor gekozen om organisatie van zorg aspecten expliciet bij de afzonderlijke modules/ uitgangsvragen te behandelen, met name in de module ‘Zelfmanagement, educatie en informatie’, de module ‘Beleid bij specifieke subgroepen’, en de module ‘Geïntegreerd beleid’; daarom is geen aparte module Randvoorwaarden (organisatie van zorg) opgenomen.
Indicatorontwikkeling
Voor deze richtlijn zijn geen interne kwaliteitsindicatoren ontwikkeld omdat naar inschatting van de werkgroep, het meten van relevante indicatoren (percentage patiënten dat terecht door huisarts naar orthopeed wordt verwezen, percentage patiënten dat terecht een gewrichtsvervanging ondergaat, percentage patiënten waarvoor de huisarts terecht röntgenonderzoek laat doen bij het stellen van de diagnose artrose) op grote praktische problemen zal stuiten. In alle gevallen zou moeten worden bepaald of er sprake is van een terechte of onterechte verwijzing en dit veronderstelt een strikte definitie van de onderliggende criteria en een adequate verslaglegging in EPD of patiëntendossier. Een strikte definitie voor het volledig doorlopen van een conservatieve (stepped-care) behandeling is niet mogelijk omdat de stepped-care behandeling op de individuele patiënt moet worden afgestemd. Beoordeling of er sprake is van een terechte afwijking van een strikte stepped-care behandeling vereist een uitvoerige en systematische verslaglegging van behandeling en onderliggende argumenten in het patiëntendossier die momenteel niet haalbaar is in de klinische praktijk. Door het ontbreken van eenduidige criteria zou zo'n beoordeling ook willekeurig zijn en weinig transparant. De werkgroep is van mening dat andere maatregelen ter bevordering van implementatie zinvoller zijn, en onderstreept de noodzaak om landelijke transmurale afspraken te maken in een apart traject met een brede werkgroep waarin alle stakeholders zijn vertegenwoordigd. Daarnaast is de werkgroep van mening dat er methodes moeten worden ontwikkeld om het conservatieve zorgtraject (stepped-care) goed en efficiënt in het EPD van de huisarts te registreren zoals de Joint Implementation of Guidelines for Osteroarthritis in Western Europe (JIGSAW-E) e-template (link: https://www.eithealth.eu/jigsaw-e). Wellicht kan aan zo'n registratie-template een diagnostische component worden toegevoegd zodat op eenvoudige en efficiënte wijze inzichtelijk kan worden gemaakt waarom röntgenfoto’s worden aangevraagd door de huisarts. Een analyse van de kwaliteit van de verslaglegging met behulp van registratie-templates in de klinische praktijk biedt in de toekomst mogelijk wel aanknopingspunten voor indicatoren.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk onderzoek van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder Aanverwante items).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. Daarnaast werden de volgende verenigingen en organisaties benaderd voor commentaar: Vereniging voor Sportgeneeskunde (VSG), Bijwerkingencentrum Lareb, ReumaNederland, Poly-Artrose Lotgenoten Vereniging (P-AL), Nationale Vereniging ReumaZorg Nederland, Zorginstituut Nederland (ZIN), Zelfstandige Klinieken Nederland (ZKN), Nederlandse Federatie van Universitair Medische Centra (NFU), Nederlandse Vereniging van Ziekenhuizen (NVZ), Samenwerkende Topklinische opleidingsZiekenhuizen (STZ), Zorgverzekeraars Nederland (ZN), Inspectie Gezondheidszorg en Jeugd (IGJ), Nederlandse Zorgautoriteit (NZa), Vereniging Innovatieve Geneesmiddelen (Nefarma), en Nefemed. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al.; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Hultcrantz M, Rind D, Akl EA, et al. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184.
KNAW, KNMG, GR, NHG, FMS (2016). Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling. Link: https://storage.knaw.nl/2022-08/Gedragscode-belangenverstrengeling-januari-2017.pdf
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. Link: http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al, editors. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008 17;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 ;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
Zoekverantwoording
Zoekvraag-1 gecombineerd met zoekvraag-2: Paracetamol en NSAID’s in vergelijking met placebo bij volwassen patiënten met klachten als gevolg van artrose aan heup of knie.
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
zoekdatum: 11-9-2017
|
1 exp osteoarthritis/ or (osteoarthriti* or osteo-arthriti* or osteoarthrotic or osteoarthros*).ti,ab,kf. or (degenerative adj3 arthritis).ti,ab,kf. or coxarthro*.ti,ab,kf. or gonarthro*.ti,ab,kf. (80253) 2 exp Anti-Inflammatory Agents, Non-Steroidal/ or Acetaminophen/ or exp Serotonin Uptake Inhibitors/ or exp "Serotonin and Noradrenaline Reuptake Inhibitors"/ or exp Antidepressive Agents, Tricyclic/ or (("non-steroidal" adj3 "anti-inflammatory agent*") or NSAID* or ibuprofen or SSRI* or TCA* or antidepressant* or antidepressive or SNRI* or acetaminophen or paracetamol or "Serotonin Uptake Inhibitor*" or "noradrenaline uptake inhibitor*" or "Serotonin Reuptake Inhibitor*" or "noradrenaline Reuptake inhibitor*" or "norepinephrine uptake inhibitor*" or "norepinephrine Reuptake inhibitor*").ti,ab,kf. (334767) 3 1 and 2 (5915) 4 limit 3 to (english language and yr="2015 -Current") (514) 5 limit 3 to ed=20150101-20170906 (552) 6 4 or 5 (648) 7 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (347213) 8 6 and 7 (75) – 67 uniek 9 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1792292) 10 6 and 9 (264) 11 10 not 8 (212) – 160 uniek
|
290 |
|
Embase |
('knee osteoarthritis'/exp/mj OR 'knee osteoarthritis':ab,ti OR 'hip osteoarthritis'/exp/mj OR 'hip osteoarthritis':ab,ti OR (('osteoarthritis'/exp/mj OR osteoarthritis:ab,ti OR osteoarthrosis:ab,ti OR 'degenerative joint disease':ab,ti OR 'osteo arthritis':ab,ti OR 'osteo arthrosis':ab,ti OR 'degenerative arthritis':ab,ti) AND ('hip'/exp/mj OR hip*:ab,ti OR 'knee'/exp/mj OR knee*:ab,ti)) OR gonart*:ab,ti OR coxart*:ab,ti) AND ('nonsteroid antiinflammatory agent'/exp/mj OR 'paracetamol'/exp/mj OR 'antidepressant agent'/exp/mj OR (('non-steroidal' NEAR/3 'anti-inflammatory agent*'):ti,ab) OR nsaid*:ti,ab OR ibuprofen:ti,ab OR ssri*:ti,ab OR tca*:ti,ab OR antidepressant*:ti,ab OR antidepressive:ti,ab OR snri*:ti,ab OR acetaminophen:ti,ab OR paracetamol:ti,ab OR 'serotonin uptake inhibitor*':ti,ab OR 'noradrenaline uptake inhibitor*':ti,ab OR 'serotonin reuptake inhibitor*':ti,ab OR 'noradrenaline reuptake inhibitor*':ti,ab) NOT 'conference abstract':it AND (english)/lim AND (2015-2017)/py
AND ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) (29) 8 uniek
('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it) (96) – 57 uniek |
Zoekvraag-3: Antidepressiva in vergelijking met placebo bij volwassen patiënten met klachten als gevolg van artrose aan heup of knie.
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
zoekdatum: 2-11-2017 |
1 exp osteoarthritis/ or (osteoarthriti* or osteo-arthriti* or osteoarthrotic or osteoarthros*).ti,ab,kf. or (degenerative adj3 arthritis).ti,ab,kf. or coxarthro*.ti,ab,kf. or gonarthro*.ti,ab,kf. (82913) 2 exp Serotonin Uptake Inhibitors/ or exp "Serotonin and Noradrenaline Reuptake Inhibitors"/ or exp Antidepressive Agents, Tricyclic/ or (SSRI* or TCA* or antidepressant* or antidepressive or SNRI* or "Serotonin Uptake Inhibitor*" or "noradrenaline uptake inhibitor*" or "Serotonin Reuptake Inhibitor*" or "noradrenaline Reuptake inhibitor*" or "norepinephrine uptake inhibitor*" or "norepinephrine Reuptake inhibitor*").ti,ab,kf. (120267) 3 1 and 2 (194) 4 limit 3 to (english language and yr="2008 -Current") (132) 5 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (359486) 6 4 and 5 (22) – 22 uniek 7 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1844722) 8 4 and 7 (58) 9 8 not 6 (45) – 40 uniek
|
93 |
|
|
((('knee osteoarthritis'/exp/mj OR 'knee osteoarthritis':ab,ti OR 'hip osteoarthritis'/exp/mj OR 'hip osteoarthritis':ab,ti OR (('osteoarthritis'/exp/mj OR osteoarthritis:ab,ti OR osteoarthrosis:ab,ti OR 'degenerative joint disease':ab,ti OR 'osteo arthritis':ab,ti OR 'osteo arthrosis':ab,ti OR 'degenerative arthritis':ab,ti) AND ('hip'/exp/mj OR hip*:ab,ti OR 'knee'/exp/mj OR knee*:ab,ti)))
AND ('antidepressant agent'/exp/mj OR ssri*:ti,ab OR tca*:ti,ab OR antidepressant*:ti,ab OR antidepressive:ti,ab OR snri*:ti,ab OR 'serotonin uptake inhibitor*':ti,ab OR 'noradrenaline uptake inhibitor*':ti,ab OR 'serotonin reuptake inhibitor*':ti,ab OR 'noradrenaline reuptake inhibitor*':ti,ab)
AND (embase)/lim AND (2008-2017)/py AND (english)/lim)
AND (('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp))) (22) – 6 uniek
AND (('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it)) – 43 – 25 uniek |
Zoekvraag-4: Dermale NSAID’s in vergelijking met orale NSAID’s of placebo bij volwassen patiënten met klachten als gevolg van artrose aan de knie.
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
zoekdatum: 2-11-2017
|
1 exp Osteoarthritis, Knee/ (17032) 2 exp osteoarthritis/ or (osteoarthriti* or osteo-arthriti* or osteoarthrotic or osteoarthros*).ti,ab,kf. or (degenerative adj3 arthritis).ti,ab,kf. (82139) 3 Knee/ or Knee Joint/ or knee.ti,ab,kf. (143526) 4 2 and 3 (30486) 5 exp Osteoarthritis, Knee/ or gonarthro.ti,ab,kf. (17032) 6 4 or 5 (32176) 7 exp Anti-Inflammatory Agents, Non-Steroidal/ or Acetaminophen/ or exp Serotonin Uptake Inhibitors/ or exp "Serotonin and Noradrenaline Reuptake Inhibitors"/ or (("non-steroidal" adj3 "anti-inflammatory agent*") or NSAID* or ibuprofen or acetaminophen or paracetamol).ti,ab,kf. (262335) 8 6 and 7 (1869) 9 limit 8 to (english language and yr="2016 -Current") (153) 10 limit 8 to ed=20160201-20171102 (186) 11 9 or 10 (222) 12 exp Administration, Topical/ (83958) 13 (topical* or cutaneous or dermal or transcutaneous or transdermal or percutaneous or skin or massage or embrocation or gel or ointment or aerosol or cream or creme or lotion or mousse or foam or liniment or spray or rub or balm or salve or emulsion or oil or patch or plaster).ti,ab,kf. (1374599) 14 12 or 13 (1407091) 15 11 and 14 (45) 16 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (359486) 17 15 and 16 (11) 18 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1844722) 19 15 and 18 (33) 20 17 or 19 (36) – 27 uniek |
40 |
|
Embase (Elsevier) |
(((('knee osteoarthritis'/exp/mj OR 'knee osteoarthritis':ab,ti OR gonart*:ab,ti) OR (('osteoarthritis'/exp/mj OR osteoarthritis:ab,ti OR osteoarthrosis:ab,ti OR 'degenerative joint disease':ab,ti OR 'osteo arthritis':ab,ti OR 'osteo arthrosis':ab,ti OR 'degenerative arthritis':ab,ti) AND ('knee'/exp/mj OR knee*:ab,ti)))
AND ('nonsteroid antiinflammatory agent'/exp/mj OR 'paracetamol'/exp/mj OR (('non-steroidal' NEAR/3 'anti-inflammatory agent*'):ti,ab) OR nsaid*:ti,ab OR ibuprofen:ti,ab OR acetaminophen:ti,ab OR paracetamol:ti,ab) NOT 'conference abstracts':it
AND (embase)/lim AND (1-2-2016)/sd NOT (16-11-2017)/sd)
AND ('topical drug administration'/exp OR (topical*:ti,ab OR cutaneous:ti,ab OR dermal:ti,ab OR transcutaneous:ti,ab OR transdermal:ti,ab OR percutaneous:ti,ab OR skin:ti,ab OR massage:ti,ab OR embrocation:ti,ab OR gel:ti,ab OR ointment:ti,ab OR aerosol:ti,ab OR cream:ti,ab OR creme:ti,ab OR lotion:ti,ab OR mousse:ti,ab OR foam:ti,ab OR liniment:ti,ab OR spray:ti,ab OR rub:ti,ab OR balm:ti,ab OR salve:ti,ab OR emulsion:ti,ab OR oil:ti,ab OR patch:ti,ab OR plaster:ti,ab))))
((('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp))
OR ((('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it) (23)>13 uniek |
Exclusietabel
Zoekvraag-1 gecombineerd met zoekvraag-2: Paracetamol en NSAID’s in vergelijking met placebo bij volwassen patiënten met klachten als gevolg van artrose aan heup of knie.
Tabel Exclusie na het lezen van het volledige artikel:
|
Auteur en jaartal |
Redenen van exclusie |
|
Puljak 2017 |
SR met betrekking tot celecoxib, overlapt vrijwel geheel met bredere SR van da Costa (2017) |
|
Patel 2017 |
SR met betrekking tot aceclofenac, vergelijking met placebo ontbreekt |
|
Guyot 2017 |
SR met betrekking tot diclofenac; includeert beperkt aantal specifieke RCT’s uitgevoerd door/ in opdracht van Novartis (SR gesponsord door Novartis) |
|
Xu 2016 |
SR met betrekking tot celecoxib, overlapt volledig met de bredere SR van da Costa (2017) |
|
Song 2016 |
SR met betrekking tot etoricoxib, celecoxib en naproxen, overlapt vrijwel volledig met de bredere SR van da Costa (2017) |
|
Roberts 2016 |
SR van observationeel onderzoek met betrekking tot veiligheid van paracetamol; geen studiepopulaties met knie- of heupartrose |
|
Ennis 2016 |
SR met betrekking tot effectiviteit van paracetamol, geen meta-analyses; geen toegevoegde waarde t.o.v. da Costa (2017) |
|
van Walsem 2015 |
SR met betrekking tot NSAID’s en paracetamol; includeert ook patiëntpopulaties met reumatische artritis; recente NSAID’s (rofecoxib, lumiracoxib) ontbreken; oudere SR zonder toegevoegde waarde ten opzichte van da Costa (2017) |
|
Richette 2015 |
narrative review |
|
Bannuru 2015a |
SR van farmacologische interventies bij knieartrose; recente NSAID’s (rofecoxib, lumiracoxib) ontbreken; oudere SR zonder toegevoegde waarde ten opzichte van da Costa (2017) |
Zoekvraag-3: Antidepressiva in vergelijking met placebo bij volwassen patiënten met klachten als gevolg van artrose aan heup of knie.
Tabel Exclusie na het lezen van het volledige artikel:
|
Auteur en jaartal |
Redenen van exclusie |
|
Citrome 2012 |
SR overlapt met Wang 2015; geen toegevoegde waarde. |
|
Moore, 2013 |
Patiëntengroep veel breder dan artrose en trials al in NHG standaard beschreven. |
|
Myers, 2014 |
Niet conform PICO |
|
Pergolizzi, 2013 |
Patiëntengroep veel breder dan osteoartitis |
|
Teran-Estrada, 2011 |
Abstract congres |
|
Wielage 2013 |
Gaat over kosten, artikel uit 2013 en VS, is niet van toepassing op NL situatie. |
Zoekvraag-4: Dermale NSAID’s in vergelijking met orale NSAID’s of placebo bij volwassen patiënten met klachten als gevolg van artrose aan de knie.
Tabel Exclusie na het lezen van het volledige artikel:
|
Auteur en jaartal |
Redenen van exclusie |
|
Baraf 2010 |
RCT maakt deel uit van basis SR Derry (2016) |
|
Derry 2017 |
verkeerde PICO (brede overview van Cochrane SR’s met betrekking tot lokale analgetica bij acute en chronische pijn) |
|
Rannou 2016 |
narrative review |
