Oefentherapie bij heup- of knieartrose
Uitgangsvraag
Wat is de waarde van oefentherapie bij behandeling van artrose van heup of knie?
Deelvragen
- Wat is de waarde van oefentherapie (op het droge) op pijn, dagelijks functioneren en kwaliteit van leven van mensen met heup- of knieartrose?
- Wat is de kosteneffectiviteit van gesuperviseerde oefentherapie (op het droge) bij mensen met heup- of knieartrose op lange termijn?
Aanbeveling
Bied volwassenen met symptomatische artrose aan heup en/of knie gesuperviseerde oefentherapie aan indien voorlichting en praktische adviezen over de zelfstandige uitvoering van een oefen- en beweegprogramma om de klachten te verminderen niet volstaan.
Verwijs voor gesuperviseerde oefentherapie naar een fysiotherapeut of oefentherapeut Cesar of oefentherapeut Mensendieck.
Gesuperviseerde oefentherapie dient qua frequentie, intensiteit, type, en tijdsduur (FITT factoren) te voldoen aan de minimale eisen om een effect op de gezondheid te kunnen bewerkstelligen en mede met het oog op de beoogde ongesuperviseerde voortzetting aan te sluiten bij adviezen voor gezond beweeggedrag voor de algemene bevolking (zie KNGF richtlijn Atrose heup-knie, KNGF 2018; link: https://www.kngf.nl/kennisplatform/richtlijnen/artrose-heup-knie).
Overwegingen
Voor- en nadelen van de interventie
Bij mensen met artrose van heup of knie leidt gesuperviseerde oefentherapie, mogelijk op korte termijn en waarschijnlijk op langere termijn, tot een duidelijke verbetering van pijn en fysiek functioneren, hoewel de algehele kwaliteit van leven niet of nauwelijks wordt beïnvloed (met uitzondering van een gunstig effect op de kwaliteit van leven bij mensen met knieartrose op de korte termijn). Afgezien van de gunstige effecten specifiek op de heup- of kniefunctie (fysiek functioneren) draagt oefentherapie bij aan het behoud en verbeteren van het dagelijks functioneren en de hoeveelheid lichaamsbeweging, waarmee gezondheidsproblemen samenhangend met lichamelijke inactiviteit kunnen worden voorkomen of verminderd. Dit betreft bijvoorbeeld valproblematiek of klachten samenhangend met artrose in andere gewrichten.
Er worden niet of nauwelijks bijwerkingen van gesuperviseerde oefentherapie gerapporteerd. Gedurende de weken waarin een oefenprogramma wordt uitgevoerd is de afname van de ervaren gewrichtspijn lineair, terwijl de (spier)pijn die kan optreden direct in aansluiting op elke oefensessie afneemt met de tijd (Sandal 2016).
Mensen met artrose van heup of knie vormen een zeer heterogene groep, met name wat betreft de aanwezigheid van klinisch significante comorbiditeit. Dit kan zowel het voorkomen van artrose in meerdere gewrichten betreffen (polyartrose), alsook non-musculoskeletale comorbiditeit. Dergelijke patiënten zijn in de studies die zijn opgenomen in de bij deze richtlijn betrokken reviews veelal geëxcludeerd, terwijl comorditeit in de totale groep veel voorkomt. Bij knieartrose is aangetoond dat het in deze groep aanbieden van oefentherapie volgens een gestandaardiseerd protocol om te bepalen of er absolute contra-indicaties zijn en, in het geval van relatieve contra-indicaties, een systematische aanpak voor het aanpassen van de oefeningen, praktisch haalbaar en veilig is en effectiever dan reguliere zorg (zie module Beleid bij specifieke subgroepen; de Rooij 2017).
Kwaliteit van het bewijs
Voor de effecten van gesuperviseerde oefentherapie bij patiënten met symptomatische heupartrose of symptomatische knieartrose geldt een redelijke kwaliteit van bewijs (‘bewijskracht’) voor zowel vermindering van pijn als verbetering van fysiek functioneren op de langere termijn. Daarmee is de overall kwaliteit van bewijs voor de effecten van gesuperviseerde oefentherapie op de cruciale uitkomstmaten (pijn en fysiek functioneren) eveneens redelijk (de op een na hoogste gradering in de GRADE methodiek). Het aangetoonde effect van oefentherapie bij artrose van heup of knie is klinisch relevant, en ligt in de orde van grootte van het effect van pijnstillende medicatie. De geobserveerde verschillen in de kwaliteit van het bewijs voor de effectiviteit van oefentherapie tussen heup- en knieartrose, met name op korte termijn (direct na de interventie; zie Conclusies op tabblad Onderbouwing) hangen deels samen met het gegeven dat er veel meer studies zijn verricht bij knieartrose dan bij heupartrose. Het kwaliteitsoordeel werd in de meeste studies nadelig beïnvloed door de mogelijke risk op bias door het niet (kunnen) blinderen van patiënten en onderzoekers en de uitkomstmetingen. Deze beperking is deels inherent aan het uitvoeren van gerandomiseerd, gecontroleerd onderzoek met non-farmacologische interventies.
Waarden en voorkeuren van patiënten
De keuze om wel of niet aan een programma deel te nemen moet met de patiënt samen gemaakt zijn, op basis van de doelen en mogelijkheden. Het is belangrijk om voor aanvang van het programma met de patiënt de doelen samen te bespreken, en realistische verwachtingen te scheppen. Voor patiënten is vaak niet duidelijk of oefentherapie bedoeld is om de klachten te verhelpen, of om het huidige niveau te behouden en verergering van de klachten te voorkomen (zie Samenvatting focusgroepen onder aanverwant). Sommige patiënten zien oefentherapie als ‘wachtkamer voor een operatie’, en als tijdverspilling. Dat komt de therapietrouw niet ten goede. Relevante aspecten voor de uitvoering van het programma zijn onder andere voorkeuren van patiënten voor individuele of groepsbehandeling, en het al dan niet gebruik wensen te maken van aanvullende begeleiding in de vorm van telefonische contacten en/of eHealth (e-mail, Apps, interactieve websites). De tijd en de middelen die mensen met artrose ter beschikking hebben kunnen ook een rol spelen bij de keuze en uitvoering van het oefenprogramma, evenals eerdere ervaringen met oefentherapie. Belangrijk is dat de inhoud en vorm van het oefenprogramma goed aansluiten bij individuele voorkeuren voor bepaalde vormen van sport of lichaamsbeweging, inclusief de lichamelijke activiteit in het kader van dagelijkse activiteiten, om de kans op bestendiging na afloop van het gesuperviseerde gedeelte van het oefenprogramma te vergroten.
Aanvaardbaarheid voor overige relevante stakeholders
Oefentherapie is bij artrose van heup en knie een gangbare behandeling en wordt, gezien de bewezen effectiviteit, aanbevolen in verschillende internationale richtlijnen (zie Fernandes 2013). Desondanks laten het gebruik en de toepassing ervan ruimte voor verbetering. Onderzoek heeft laten zien dat kennis en attitude van zorgverleners ten aanzien van oefentherapie bij artrose van heup of knie een rol spelen bij het ondergebruik ervan (Smink 2013; Hofstede 2015, 2016; Selten 2017). Bij de behandeling van heup- en knieartrose zijn vaak meerdere zorgverleners betrokken, zoals de huisarts, fysiotherapeut of oefentherapeut Mensendieck of Cesar en eventueel praktijkondersteuner, diëtist, ergotherapeut, revalidatiearts en orthopedisch chirurg. Het is van groot belang dat alle zorgverleners dezelfde informatie en adviezen met betrekking tot het gebruik en de te verwachten effecten van oefentherapie verstrekken. Parallel aan de ontwikkeling van de huidige richtlijn is de KNGF richtlijn Artrose heup-knie herzien. In deze herziene richtlijn die tot stand is gekomen in samenwerking met de VvOCM wordt extra aandacht besteed aan de praktische uitvoering van de oefentherapie, teneinde de kwaliteit ervan te verbeteren en te borgen. Zo worden onder andere uitgewerkte voorbeelden van in onderzoek bewezen effectieve oefentherapeutische interventies aangeboden.
Kosten (middelenbeslag)
Oefentherapie reduceert de gewrichtspijn en verbetert het fysiek functioneren, heeft geen belangrijke nadelen en mogelijk een gunstige kosteneffectiviteit. Hiermee lijken de netto gunstige effecten de middelen zeker waard. In de kosteneffectiviteitsstudies betrokken in de systematische review (Vijgen 2017; zie Samenvatting literatuur) is oefentherapie vergeleken met standaard zorg. Er zijn daarnaast een aantal studies verricht waarin oefentherapie bij patiënten met een indicatie voor een totale gewrichtsprothese werd vergeleken met gewrichtsvervangende chirurgie. Hieruit bleek dat in een substantieel deel van de patiënten de operatie, al dan niet tijdelijk, kon worden uitgesteld (Skou 2015; Svege 2015). Omdat de indicatiestelling voor gewrichtsvervangende operaties gebaseerd is op relatieve criteria, zijn de bevindingen ook relevant voor patiënten bij wie deze indicatie (nog) niet is gesteld. De Nederlandse Orthopaedische Vereniging stelt dat voordat chirurgische therapie wordt overwogen oefentherapie, met een adequate inhoud en dosering, moet worden toegepast (document ‘Verstandige keuzes binnen de orthopedie’; NOV 2017). Zorginstituut Nederland heeft een budget impact analyse (BIA) uitgevoerd naar het financieel effect dat het opnemen van oefentherapie bij heup- en knieartrose in het basispakket zal hebben op het Budgettair Kader Zorg (BKZ), met een tijdshorizon van vier jaar (ZiN 2017). Er wordt een drietal scenario’s onderzocht: 8 zittingen oefentherapie in groep van 5-10 personen (laagste kostenscenario), 10 zittingen oefentherapie in groep van 3 personen (middelmatige kosten scenario) en 12 individuele zittingen oefentherapie (maximale kosten scenario). In het maximale kosten scenario wordt de totale budget impact van het vergoeden van oefentherapie bij heup- en knieartrose vanuit de basisverzekering over de jaren 2017-2020 geschat op een besparing van €1,1 miljoen in het eerste jaar tot €1,2 miljoen in het vierde jaar. In het laagste kostenscenario en middelmatige kostenscenario worden naar verwachting grotere besparingen gerealiseerd van €5 miljoen tot €11 miljoen per jaar. Deze budget impact analyses zijn opgesteld door bepaalde aannames te maken, die (momenteel) in de praktijk niet of zeer moeilijk te controleren of te kwantificeren zijn. Het Zorginstituut Nederland geeft in haar budget impact analyse aan dat de daadwerkelijke financiële gevolgen van het vergoeden van oefentherapie bij heup- en knieartrose vanuit de basisverzekering de komende jaren middels een evaluatie zullen worden onderzocht.
Haalbaarheid
Belemmeringen voor de implementatie van oefentherapie bij artrose van heup en knie zijn in eerder onderzoek in kaart gebracht. Naast de hierboven genoemde aspecten van kennis en attitude van de zorgverleners (Smink 2013; Hofstede 2015, 2016; Selten 2017) en de beperkte beschikbaarheid van bewezen effectieve (groeps)oefentherapie programma’s voor deze specifieke doelgroep speelt ook de attitude van patiënten ten aanzien van conservatieve behandeling en zelfmanagement een rol (Selten 2017). Een belangrijk aspect vormt ook de financiering van oefentherapie; tot voor kort was fysio- en oefentherapie voor mensen met heup- of knieartrose uitsluitend opgenomen in het aanvullende pakket. Hoewel in 2017 het besluit is genomen tot opname van fysio- en oefentherapie in het basispakket voor deze doelgroep (Staatsblad 2017) is er sprake van een beperkt aantal zittingen (n=12) en gaat het gebruik ten koste van het eigen risico. Hiermee zal er nog steeds een drempel voor optimaal gebruik blijven bestaan.
Rationale (balans tussen voor- en nadelen van de interventie)
Bij mensen met artrose van heup of knie leidt gesuperviseerde oefentherapie, mogelijk op korte termijn en waarschijnlijk op langere termijn, tot een duidelijke verbetering van pijn en fysiek functioneren, terwijl kwaliteit van leven niet of nauwelijks wordt beïnvloed (met uitzondering van een gunstig effect op de kwaliteit van leven bij mensen met knieartrose op de korte termijn). Er worden niet of nauwelijks bijwerkingen van gesuperviseerde oefentherapie gerapporteerd. Oefentherapie leidt bij heup- en knieartrose hoogst waarschijnlijk tot kostenbesparingen, voornamelijk doordat gewrichtsvervangende chirurgie hiermee kan worden uitgesteld of zelfs voorkomen. Gezien de gunstige uitkomsten van oefentherapie is het belangrijk dat alle betrokken zorgverleners het belang en de te verwachten effectiviteit van oefentherapie tijdig, actief en eenduidig inbrengen in de gezamenlijke besluitvorming over de behandeling. De uitvoering van de oefentherapie moet voldoen aan de minimale eisen om gezondheidseffecten op korte en lange termijn te bewerkstelligen en te behouden, waarbij rekening gehouden moet worden met eventueel aanwezige comorbiditeit en met de wensen, voorkeuren en mogelijkheden van de patiënt. Voor de behandeling van patiënten met artrose van heup- en/of knie en comorbiditeiten die van invloed zijn op het functioneren, dient de fysio- of oefentherapeut over specifieke kennis en vaardigheden betreffende het aanbieden van oefentherapie aan patiënten met deze comorbiditeiten te beschikken. Hierbij geldt de algemene stelregel ‘onbekwaam is onbevoegd'..
Optimale samenstelling van de interventie
De onderzochte oefentherapeutische interventies in de studies in de systematische review (Verhagen 2016; zie Samenvatting literatuur) varieerden met betrekking tot de zogenaamde FITT factoren (Frequentie, Intensiteit, Type en Tijdsduur). Er werden echter alleen studies in betrokken waarin oefentherapie met geen of een andere dan oefentherapeutische interventie werd vergeleken. Het aantal studies waarin verschillende oefentherapeutische interventies bij heup- en knierartrose wel direct met elkaar worden vergeleken is gering. Daarom kan niet op grond van vergelijkend onderzoek worden vastgesteld welke kenmerken van het oefenprogramma tot het grootste effect leiden. Wanneer echter wordt gekeken naar overeenkomstige kenmerken van de interventies in de studies in de systematische review (Verhagen 2016), dan blijken spierkrachttraining, training van het uithoudingsvermogen (aerobe training), oefeningen gericht op gewrichtsmobiliteit en lenigheid en functionele training (bv. trainen van lopen en traplopen, balans en stabiliteit) deel uit te maken van de meeste programma’s. Daarom mag verondersteld worden dat oefentherapie die dit type oefeningen omvat, en waarbij de uitvoering voldoet aan de minimale fysiologische eisen die aan dergelijke oefeningen worden gesteld om effect te kunnen sorteren, in de praktijk toegepast dient te worden. Dit laatste veronderstelt dat de gesuperviseerde oefentherapie wordt gecombineerd met een oefenprogramma voor thuis. Bij voorkeur voldoet de combinatie van de gesuperviseerde oefeningen en de oefeningen voor thuis aan de normen voor gezond beweeggedrag voor de algehele bevolking, bijvoorbeeld zoals gedefinieerd door de American College of Sports Medicine (ACSM; Garber 2011), inclusief de bij het type oefening behorende minimale intensiteit, duur, aantal herhalingen en frequentie (ACSM 2013; Bartholdy 2017). Het starten en volhouden van een bij de aandoening en de overig gezondheidstoestand passend beweegprogramma impliceert in veel gevallen een gedragsverandering. Om een blijvende verandering van het beweeggedrag te bewerkstelligen dient het oefenprogramma bewezen werkzame elementen op het gebied van het beïnvloeden van motivatie en zelfregulatie te bevatten, zoals bijvoorbeeld het stellen van doelen, zelf-monitoring, regelmatige evaluatie en betrokkenheid van de omgeving (Dobson 2016; Knittle 2012). Rekening houdend met de minimale eisen waaraan de inhoud en de dosering van het oefenprogramma moet voldoen, alsmede de gedragsmatige componenten en de wensen, voorkeuren en mogelijkheden van de patiënt, kan er variatie zijn in de wijze waarop het programma wordt aangeboden, dat wil zeggen in individueel of groepsverband, of al dan niet gebruik makend van blended therapy, dat wil zeggen combinaties van face-to-face behandeling en bijvoorbeeld telefonische of e-mail contacten of Apps. Voor patiënten met ernstige beperkingen in dagelijks leven en/of met een combinatie van ernstige fysieke en psychosociale problematiek waarbij de inzet van meerdere professionals gelijktijdig nodig is, is verwijzing naar de medisch-specialistische revalidatiebehandeling een optie.
Onderbouwing
Achtergrond
Oefentherapie richt zich bij mensen met artrose van de heup en/of knie op het verminderen of stabiliseren van de gevolgen ervan, die worden onderscheiden in stoornissen in lichaamsstructuur of -functies (bijvoorbeeld pijn, zwelling, verminderde spierkracht, of beweeglijkheid of stabiliteit van het gewricht) of beperkingen in activiteiten en participatie (bijvoorbeeld lopen of traplopen, werk, sport en hobby’s). Gesuperviseerde oefentherapie is geïndiceerd wanneer mensen met artrose van heup- en/of knie niet zelfstandig een bij de aandoening en hun overige gezondheidstoestand passend beweeg- en oefenprogramma kunnen uitvoeren. In de praktijk maken niet alle mensen met artrose van de heup en/of knie die ervoor in aanmerking komen gebruik van oefentherapie, en niet alle oefentherapie voldoet aan de minimale eisen om gezondheidseffecten te kunnen bereiken. In de volgende paragrafen wordt de beschikbare evidentie voor oefentherapie bij artrose van de heup en/of knie beschreven. Het op het goede moment inzetten van adequate oefentherapie in de eerste lijn leidt bij mensen met artrose van heup en/of knie mogelijk tot substitutie van tweedelijns zorg naar de eerste lijn en besparing van overige zorgkosten.
Conclusies / Summary of Findings
Deelvraag-1: wat is de waarde van oefentherapie (op het droge) op pijn, dagelijks functioneren en kwaliteit van leven van mensen met heup- of knieartrose?
Heupartrose
|
Laag GRADE |
Oefentherapie onder supervisie van een fysio- of oefentherapeut zou mogelijk op korte termijn (direct na de interventie) kunnen resulteren in pijnreductie bij patiënten met heupartrose, in vergelijking met standaard zorg.
Bronnen: (Verhagen 2016) |
|
Redelijk GRADE |
Oefentherapie onder supervisie van een fysio- of oefentherapeut resulteert waarschijnlijk op de langere termijn (zes maanden na de interventie) in enige pijnreductie bij patiënten met heupartrose, in vergelijking met standaard zorg.
Bronnen: (Verhagen 2016) |
|
Laag GRADE |
Oefentherapie onder supervisie van een fysio- of oefentherapeut zou mogelijk op korte termijn (direct na de interventie) kunnen resulteren in enige verbetering van het fysiek functioneren bij patiënten met heupartrose, in vergelijking met standaard zorg.
Bronnen: (Verhagen 2016) |
|
Redelijk GRADE |
Oefentherapie onder supervisie van een fysio- of oefentherapeut resulteert waarschijnlijk op de langere termijn (zes maanden na de interventie) in enige verbetering van het fysiek functioneren bij patiënten met heupartrose, in vergelijking met standaard zorg.
Bronnen: (Verhagen 2016) |
|
Redelijk GRADE |
Oefentherapie onder supervisie van een fysio- of oefentherapeut resulteert waarschijnlijk in een hogere behandelrespons* bij patiënten met heupartrose, in vergelijking met standaard zorg, zowel op korte termijn (direct na de interventie) als langere termijn (zes maanden na de interventie).
*er worden diverse definities voor behandelrespons gehanteerd: zie hoofdtekst voor details
Bronnen: (Verhagen 2016) |
|
Redelijk GRADE |
Oefentherapie onder supervisie van een fysio- of oefentherapeut heeft waarschijnlijk op korte termijn (direct na de interventie) niet of nauwelijks effect op de kwaliteit van leven bij patiënten met heupartrose, in vergelijking met standaard zorg.
Bronnen: (Verhagen 2016) |
|
Laag GRADE |
Oefentherapie onder supervisie van een fysio- of oefentherapeut lijkt op de langere termijn (zes maanden na de interventie) de kwaliteit van leven bij patiënten met heupartrose niet of nauwelijks te beïnvloeden, in vergelijking met standaard zorg.
Bronnen: (Verhagen 2016) |
Knieartrose
|
Hoog GRADE |
Oefentherapie onder supervisie van een fysio- of oefentherapeut resulteert op korte termijn (direct na de interventie) in pijnreductie bij patiënten met knieartrose, in vergelijking met standaard zorg.
Bronnen: (Verhagen 2016) |
|
Redelijk GRADE |
Oefentherapie onder supervisie van een fysio- of oefentherapeut resulteert waarschijnlijk op de langere termijn (zes maanden na de interventie) in enige pijnreductie bij patiënten met knieartrose, in vergelijking met standaard zorg.
Bronnen: (Verhagen 2016) |
|
Laag GRADE |
Oefentherapie onder supervisie van een fysio- of oefentherapeut zou mogelijk op korte termijn (direct na de interventie) kunnen resulteren in verbetering van fysiek functioneren bij patiënten met knieartrose, in vergelijking met standaard zorg.
Bronnen: (Verhagen 2016) |
|
Redelijk GRADE |
Oefentherapie onder supervisie van een fysio- of oefentherapeut resulteert waarschijnlijk op de langere termijn (zes maanden na de interventie) in verbetering van fysiek functioneren bij patiënten met knieartrose, in vergelijking met standaard zorg.
Bronnen: (Verhagen 2016) |
|
Laag GRADE |
Oefentherapie onder supervisie van een fysio- of oefentherapeut zou mogelijk op korte termijn (direct na de interventie) kunnen resulteren in een hogere behandelrespons* bij patiënten met knieartrose, in vergelijking met standaard zorg.
Bronnen: (Verhagen 2016) |
|
Redelijk GRADE |
Oefentherapie onder supervisie van een fysio- of oefentherapeut resulteert waarschijnlijk op de langere termijn (zes maanden na de interventie) niet of nauwelijks in een hogere behandelrespons* bij patiënten met knieartrose, in vergelijking met standaard zorg.
*er worden diverse definities voor behandelrespons gehanteerd: zie hoofdtekst voor details
Bronnen: (Verhagen 2016) |
|
Redelijk GRADE |
Oefentherapie onder supervisie van een fysio- of oefentherapeut resulteert waarschijnlijk op korte termijn (direct na de interventie) in enige verbetering van kwaliteit van leven bij patiënten met knieartrose, in vergelijking met standaard zorg.
Bronnen: (Verhagen 2016) |
|
Hoog GRADE |
Oefentherapie onder supervisie van een fysio- of oefentherapeut resulteert op de langere termijn (zes maanden na de interventie) niet of nauwelijks in verbetering van de kwaliteit van leven bij patiënten met knieartrose, in vergelijking met standaard zorg.
Bronnen: (Verhagen 2016) |
Deelvraag-2: wat is de kosteneffectiviteit van gesuperviseerde oefentherapie bij mensen met heup- of knieartrose op lange termijn?
|
Laag GRADE |
Oefentherapie onder supervisie van een fysio- of oefentherapeut bij patiënten met artrose van heup of knie resulteert mogelijk op korte termijn (een jaar) in een gunstige kosteneffectiviteit, in vergelijking met standaard zorg.
Bronnen: (Vijgen 2017) |
|
Zeer Laag GRADE |
We zijn onzeker over de kosteneffectiviteit op lange termijn (vijf jaar) van oefentherapie onder supervisie van een fysio- of oefentherapeut bij de behandeling van patiënten met artrose van heup of knie, in vergelijking met standaard zorg.
Bronnen: (Vijgen 2017) |
Samenvatting literatuur
Deelvraag-1: wat is de waarde van oefentherapie (op het droge) op pijn, dagelijks functioneren en kwaliteit van leven van mensen met heup- of knieartrose?
Verhagen (2016) is een SR van goede kwaliteit (zie kwaliteitsbeoordeling onder het tabblad Verantwoording). Verhagen (2016) analyseert of gesuperviseerde oefentherapie (land-based & water-based) bij volwassen patiënten met heup- of knieartrose een effectieve behandeling is in vergelijking met geen interventie (of bijvoorbeeld voorlichting door de huisarts), en bevat een update van twee recente Cochrane systematische reviews naar oefentherapie bij artrose aan heup of knie (Fransen 2014, 2015). De interventie wordt gedefinieerd als actieve oefentherapie onder supervisie van een fysio– of oefentherapeut ter bevordering of behoud van spierkracht en/of aerobe capaciteit en/of gewrichtsmobiliteit en/of balans en/of het uitvoeren van dagelijkse activiteiten en verbeteren kwaliteit van leven. De controle interventie bestaat uit: ‘usual care’ (medicatie en/of (beweeg) advies), geen behandeling (bv wachtlijst), een andere niet actieve interventie (bv medicatie), of niet gesuperviseerde oefentherapie (bv home-based oefentherapie). De SR analyseert de uitkomstmaten: responders (aantal patiënten dat aangeeft baat te hebben gehad bij de behandeling), zelf gerapporteerd fysiek functioneren, kwaliteit van leven en pijn, uitstel van operatie, compliantie, medicatie en bijwerkingen (adverse events). Deze uitkomstmaten worden primair geanalyseerd op zeer korte termijn (direct na beëindigen van de oefentherapie) en 6 maanden na stoppen van de oefentherapie. Een aantal subgroepanalyses wordt a priori gedefinieerd: duur van interventie (tot 12 weken versus langer dan 12 weken); type interventie (land-based en water-based; individueel en groepsverband); ernst van de aandoening (klinische diagnose, klinische en radiologische diagnose, patiënten die op een wachtlijst staan voor een nieuwe knie of heup); mate van supervisie (volledig gesuperviseerd en niet-volledige supervisie). Met uitzondering van de subgroepanalyses met betrekking tot land-based oefentherapie maken deze subgroepanalyses geen deel uit van de huidige uitgangsvraag.
De uitgangsvraag in Verhagen (2016) komt daarmee goed overeen met de uitgangsvraag in de richtlijn (deelvraag-1). Verhagen (2016) includeert in de primaire analyse ook studies naar water-based oefentherapie, maar door hun geringe aantal, dragen deze studies nauwelijks bij aan de effectschattingen na pooling, en daarnaast worden ook de resultaten afzonderlijk geanalyseerd (subgroepanalyses) voor land-based en water-based oefentherapie.
Hieronder volgt een analyse van de belangrijkste resultaten op basis van de SR van Verhagen (2015), uitgesplitst naar heupartrose en knieartrose.
Heupartrose
Verhagen (2016) includeert 15 RCT’s met in totaal 1402 patiënten. Alle geïncludeerde patiënten waren gediagnosticeerd met heupartrose met behulp van de ACR criteria; op alleen klinische criteria (n=6), gebaseerd op zowel klinische als radiologische criteria (n=8) of onduidelijk (n=1). In drie studies waren er patiënten geïncludeerd die op de wachtlijst stonden voor een nieuwe heup. De aantallen patiënten per interventiegroep varieerde tussen 6 en 102; vier studies worden gezien als klein (minder dan 25 patiënten in de kleinste studie-arm). In een studie kregen de patiënten water-based oefentherapie, in alle andere studies was de interventie ‘land-based’ oefentherapie onder begeleiding van een fysiotherapeut. De sessies varieerden van 30 tot 90 minuten (mediaan 60 min), de frequentie varieerde van 1 tot 3 keer per week (mediaan 1x per week), en de duur varieerde van 6 tot 12 weken (mediaan 8 weken). In drie studies zijn na de interventie tevens boostersessies toegevoegd. In negen studies is aangegeven dat het een groeps-interventie was en in vijf studies dat de interventie individueel werd gegeven. In acht studies waren alle sessies gesuperviseerd door de fysiotherapeut (volledige supervisie). De controle interventie bestond uit educatie (n=6 studies), geen behandeling (wachtlijst; n=2), gebruikelijke huisartszorg (n=5), of advies tot zelf thuis oefenen (n=1). In een studie werd de inhoud van de controle interventie (‘geen interventie’) niet gerapporteerd. Risk of bias werd beoordeeld aan de hand van de Cochrane RoB tool: 12 studies hadden een laag risico op bias en 3 studies een hoog risico op bias vanwege onduidelijkheden rondom randomisatiemethode en/of maskering van de groepstoekenning. Bij geen van de RCT's was de interventie geblindeerd, maar Verhagen (2016) gaat er bij beoordeling van de risk of bias vanuit dat dit vanwege het pragmatische design van de studies niet duidelijk heeft geleid tot een vertekening van de resultaten: patiënten geven toestemming voor randomisatie en daarom is het onwaarschijnlijk dat zij a priori een voorkeur hebben voor een van de interventies. Tabel 1 geeft een overzicht van de effecten van gesuperviseerde oefentherapie bij heupartrose voor de in Verhagen (2016) gerapporteerde uitkomstmaten.
Tabel 1. Effecten van gesuperviseerde oefentherapie bij heupartrose in vergelijking met controle (n=15 studies; Verhagen 2017)
Een positief effect (groepsverschil) is in het voordeel van oefentherapie (statistisch significante verschillen zijn dikgedrukt). De controle interventie bestond uit educatie (n=6 studies), geen behandeling (wachtlijst; n=2), gebruikelijke huisartszorg (n=5), advies tot zelf thuis oefenen (n=1); in een studie werd de inhoud van de controle interventie (‘geen interventie’) niet gerapporteerd.
|
Uitkomstmaat |
Parameter* |
direct na interventie#
(95%BI) (n studies/ n deelnemers) |
6 mnd na interventie#
(95%BI) (n studies/ n deelnemers) |
GRADE-I@
direct/ 6mnd |
GRADE-II@
direct/ 6mnd
|
|
Fysiek functioneren |
SMD*1 |
0.32 (0.13; 0.52) (12/1043) |
0.28 (0.10; 0.45) (5/501) |
REDELIJK/ HOOG |
LAAG/ REDELIJK |
|
MD*2 |
6.25 (3.12;9.37) (8/803) |
5.66 (1.93;9.39) (3/385) |
REDELIJK/ REDELIJK |
LAAG/ REDELIJK** |
|
|
Pijn
|
SMD*1 |
0.38 (0.20; 0.56) (11/978) |
0.21 (0.02; 0.39) (5/445) |
REDELIJK/ HOOG |
LAAG/ REDELIJK |
|
MD*3 |
6.00 (2.73; 9.27) (10/954) |
4.20 (0.41; 7.99) (5/445) |
REDELIJK/ REDELIJK |
LAAG/ LAAG |
|
|
Responders$ |
RD |
0.29 (0.03; 0.55) (3/375) |
0.17 (0.08; 0.26) (2/248) |
REDELIJK/ REDELIJK |
REDELIJK/ REDELIJK |
|
Kwaliteit van leven |
SMD |
0.00 (-0.22; 0.22) (7/739) |
0.02 (-0.40; 0.44) (3/258) |
REDELIJK/ LAAG |
REDELIJK/ LAAG |
*SMD: standardized mean difference (gestandaardiseerd verschil van gemiddelden); RD: risk difference (risicoverschil); MD: mean difference (gemiddeld verschil); *1alle meetinstrumenten (SMD); *2WOMAC en HOOS (MD; effecten komen overeen met respectievelijk SMD 0.41 en 0.27); *3WOMAC, HOOS, VAS (MD); #Effectschatter met 95%-betrouwbaarheidsinterval (95%BI); $Verschillende definities: ja/nee vraag; > 15% verbetering op HOOS; herstel op 7-punts schaal (responder= ‘geheel hersteld’ of ‘veel verbeterd’). @GRADE-beoordeling van bewijskracht volgens Verhagen (2016; GRADE-I), en de uiteindelijke GRADE beoordeling in de huidige richtlijn die rekening houdt met eventuele overlap van de effectschatting met MCID (GRADE-II); **al afgewaardeerd voor gering patiënten aantal (niet verder afgewaardeerd voor overlap met MCID). Noot: in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is i.p.v. ‘matig’.
Gewrichtspijn (cruciale uitkomstmaat)
Alle 15 studies hebben pijn gemeten; 10 studies presenteerden data direct na de interventie, en slechts enkele studies presenteerden lange termijn resultaten (6 tot 12 maanden na de interventie; Figuur 1). Zeven studies evalueerden pijn middels de WOMAC, vier studies op de VAS, drie studies op de HOOS en een op de IRGL (Invloed van Reuma op Gezondheid en Leefwijze; Nederlandstalige zelfbeoordelingslijst gebaseerd op de AIMS, Arthritis Impact Measurement Scales). De gepoolde effectschattingen waren op alle meetmomenten statistisch significant in het voordeel van oefentherapie: gestandaardiseerd gemiddeld groepsverschil, SMD=0,38 (95%BI=(0,20; 0,56)) direct na de interventie, en 0,21 (0,02; 0,39) zes maanden na interventie (Figuur 2). Op beide tijdspunten bevat de effectschatting (betrouwbaarheidsinterval) het door de werkgroep benoemde minimaal klinisch relevant verschil (MCID) van 0,37, en direct na de interventie overtreft het gemiddelde effect de MCID. Nagenoeg alle studies hebben een laag risico op bias. Slechts een kleine studie (n= 14 patiënten) betreft water-based oefentherapie (Stener-Victorin 2004) en exclusie van deze studie heeft geen noemenswaardige invloed op de effectschattingen.
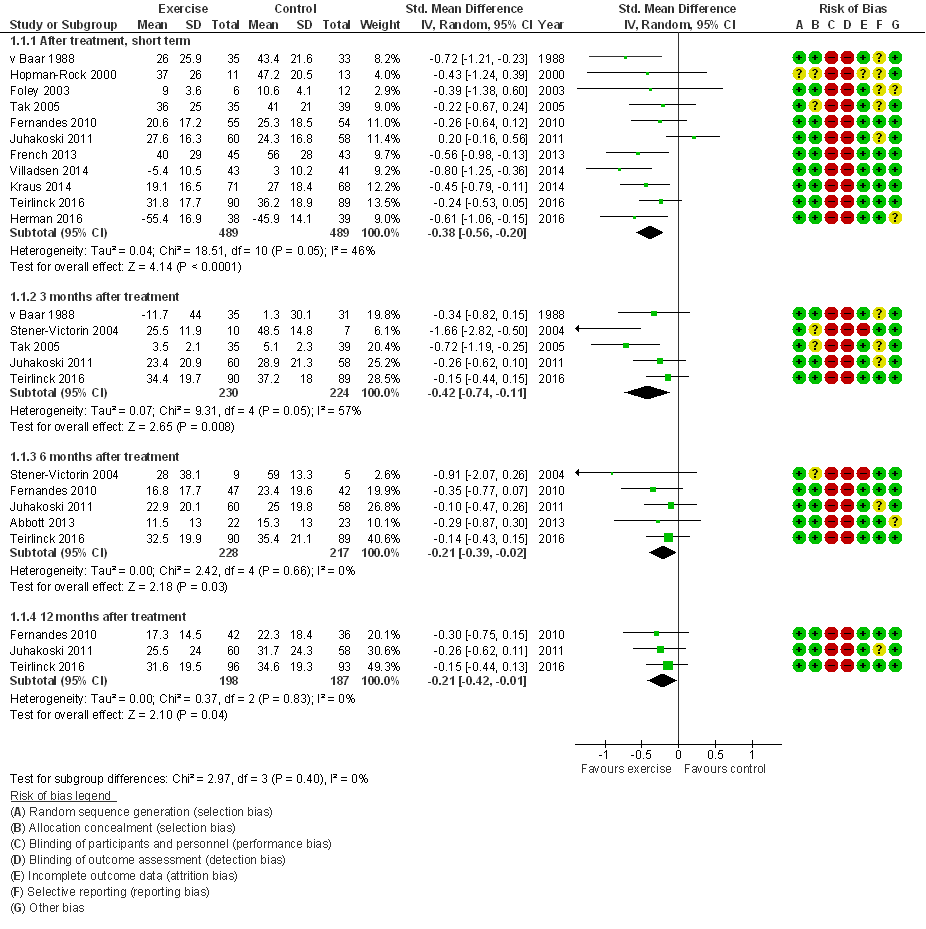
Figuur 1 Meta-analyse en forest plot van het effect van gesuperviseerde oefentherapie bij heupartrose op gewrichtspijn (Verhagen 2016)
Fysiek functioneren (cruciale uitkomstmaat)
Alle 15 studies hebben fysiek functioneren gemeten; 12 studies presenteerden data direct na de interventie, en vijf studies presenteerden lange termijn resultaten (6 tot 12 maanden na de interventie). Zeven studies presenteerden functioneren middels de WOMAC, drie middels de HOOS, twee middels de IRGL, en de overige drie studies gebruikten de DRI, HHS of de 6-minuten wandeltest. De gepoolde effectschattingen waren op alle meetmomenten statistisch significant in het voordeel van oefentherapie: gestandaardiseerd gemiddeld groepsverschil, SMD=0,32 (95%BI=(0,13; 0,52)) direct na de interventie, en 0,28 (0,10; 0,45) zes maanden na interventie (Figuur 2). Op beide tijdspunten bevat de effectschatting (95% betrouwbaarheidsinterval) het door de werkgroep benoemde minimaal klinisch relevant verschil (MCID) van 0,37, maar is het gemiddelde effect lager dan de MCID. Nagenoeg alle studies hebben een laag risico op bias. Slechts een kleine studie (n= 14 patiënten) betreft water-based oefentherapie (Stener-Victorin 2004) en exclusie van deze studie heeft geen noemenswaardige invloed op de effectschattingen.
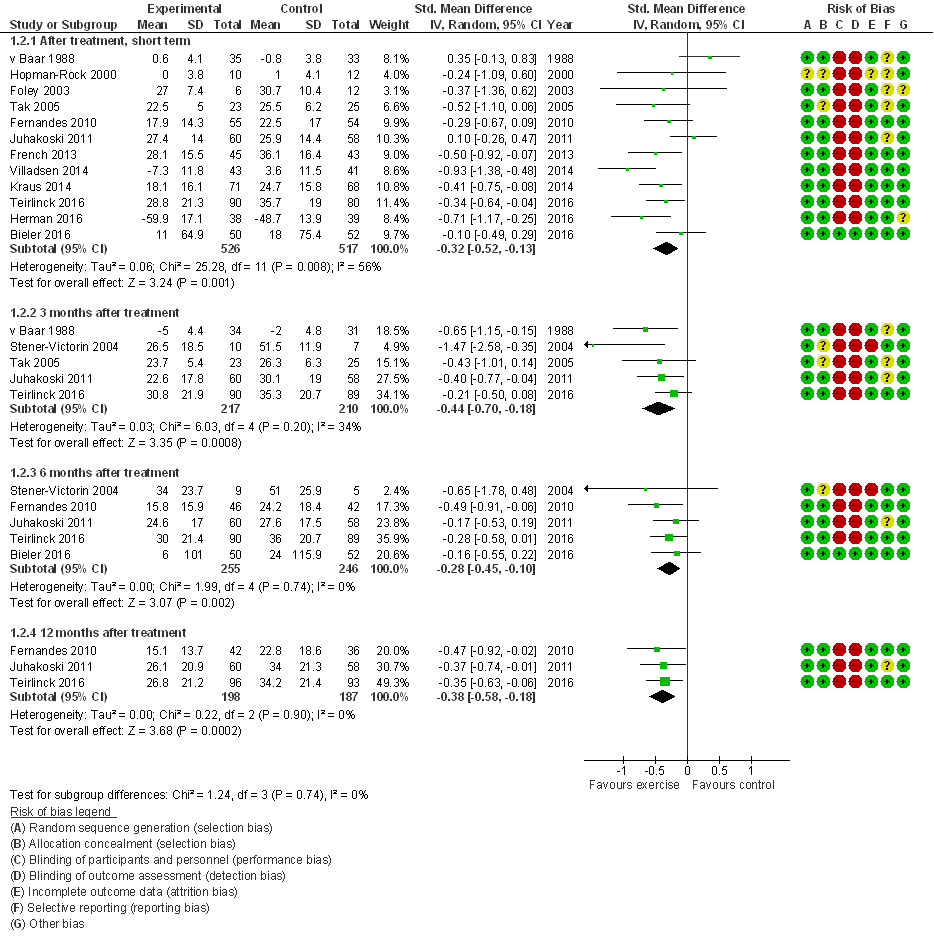
Figuur 2 Meta-analyse en forest plot van het effect van gesuperviseerde oefentherapie bij heupartrose op fysiek functioneren (Verhagen 2016)
Responders (belangrijke uitkomstmaat)
Vier studies rapporteerden het aantal mensen dat baat had bij de behandeling (responder). Responders werden gemeten met een ja/nee vraag (> 15% verbetering op de HOOS), percentage herstel op een 7-punt schaal (patiënten die ‘geheel herstelt’ of ‘veel verbeterd’ waren werden gezien als responder), of op basis van de OMERACT-OARSI criteria. Daarmee werd in slechts een van de vier studies het percentage responders optimaal gerapporteerd op basis van de OMERACT-OARSI set van responder criteria (Pham 2003). Zowel direct post-interventie als zes maanden na de interventie was er sprake van statistisch significant meer mensen die baat hadden van de oefentherapie. Direct na de interventie varieerde het percentage responders tussen 16-64% in de interventiegroep, in vergelijking met 4 tot 17% in de controlegroep (gemiddeld risicoverschil, RD=0,29 (95%BI= (0,03; 0,55)), en zes maanden na de interventie was dit 25-41% in vergelijking met 8-22% (RD=0,17 (0,08; 0,26)). Op beide tijdspunten ligt de effectschatting (95% betrouwbaarheidsinterval) ruim boven de door de GRADE working group voorgestelde default grens (de relatieve risico’s liggen ver boven 1,25). Alle studies hebben een laag risico op bias, en geen van de studies betreft water-based oefentherapie.
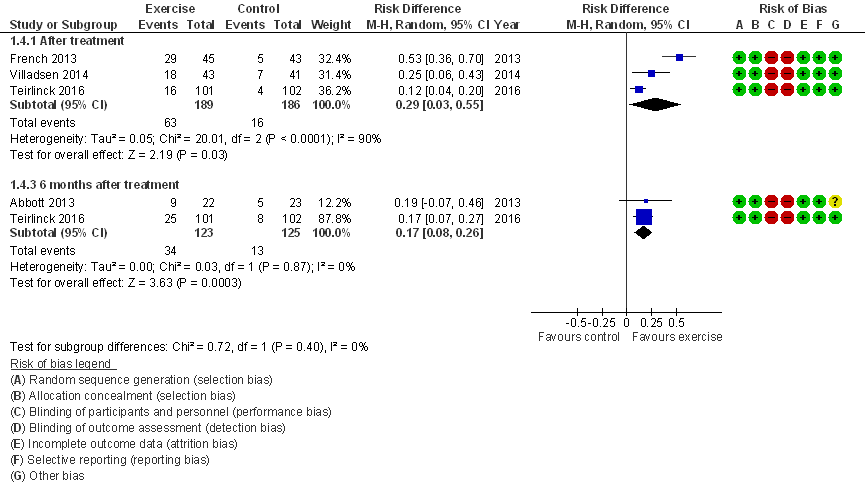
Figuur 3 Meta-analyse en forest plot van het effect van gesuperviseerde oefentherapie bij heupartrose op percentage responders (Verhagen 2016)
Kwaliteit van leven (belangrijke uitkomstmaat)
Kwaliteit van leven is gemeten in negen studies: met de SF-36 (drie studies), HOOS (drie studies), EQ-5D (een studie), 0-10 schaal (NRS; een studie), en GRI (Global self Rating Index; een studie). De gepoolde effectschattingen zijn gering en laten op geen enkel meetmoment een statistisch significant resultaat zien: SMD=0,00 (95%BI=(-0,22; 0,22)) direct na de interventie, en 0,02 (-0,40; 0,44) zes maanden na de interventie. Nagenoeg alle studies hebben een laag risico op bias. Slechts een kleine studie (n= 14 patiënten) betreft water-based oefentherapie (Stener-Victorin 2004) en exclusie van deze studie heeft geen noemenswaardige invloed op de effectschattingen.
Adverse events (bijwerkingen, complicaties; belangrijke uitkomstmaat)
Acht studies meldden dat bijwerkingen werden gemeten: in twee studies zijn geen bijwerkingen gevonden, in de andere studies zijn 1 tot 2 patiënten uitgevallen, veelal vanwege bijkomende pijnklachten of verergering van de pijn.
Therapietrouw (compliantie; belangrijke uitkomstmaat)
Drie studies rapporteren een percentage compliantie (adherence) variërend tussen 80 tot 93%.
Tijd tot chirurgische interventie
In drie studies is geëvalueerd hoeveel mensen gedurende het onderzoek in aanmerking kwamen voor een nieuwe heup (Svege 2015; Bieler 2016; Teirlinck 2016). Svege (2015) rapporteert hoeveel mensen binnen 6,5 jaar na inclusie een nieuwe heup heeft gekregen: 40% van de patiënten in de interventiegroep vergeleken met 57% in de controle groep (alleen educatie), een statistisch significant en klinisch relevant verschil in het voordeel van de interventiegroep. De tijd tot het krijgen van een nieuwe heup in de oefentherapie groep is beduidend langer dan in de controle groep (mediane tijdsduur respectievelijk 5,4 jaar en 3,5 jaar na inclusie). In de beide andere studies was de follow-up 12 maanden en bleek 6 tot 10% van de patiënten in de oefentherapie groep een nieuwe heup te krijgen en 9 tot 17% van de patiënten in de controle groep (Teirlinck 2016; Bieler 2016). Deze verschillen zijn in het voordeel van de oefentherapie, maar gering en niet klinisch relevant, mogelijk vanwege de relatieve korte follow-up.
Overige uitkomstmaten (belangrijke uitkomstmaten)
Overige uitkomstmaten (zie Relevante uitkomstmaten onder Zoeken en selecteren) zoals gewrichtsstijfheid, kosten en zorggebruik werden niet als uitkomstmaat beschreven in de systematische review van Verhagen (2016).
Knieartrose
Verhagen (2016) includeert 52 RCT’s met in totaal 6863 patiënten. Alle geïncludeerde patiënten waren gediagnosticeerd met knieartrose met behulp van de ACR criteria: op alleen klinische criteria (n=10), gebaseerd op zowel klinische als radiologische criteria (n=32) of onduidelijk (n=10). De radiologische ernst van knieartrose varieerde tussen Kellgren & Lawrence (K&L) graad I (mild) en IV (ernstig). In twee studies waren er patiënten geïncludeerd die op de wachtlijst stonden voor een nieuwe knie. De aantallen patiënten per interventiegroep varieerde tussen 6 en 467; 17 studies worden gezien als klein (minder dan 25 patiënten in de kleinste studie-arm). In vier studies kregen de patiënten water-based oefentherapie, in alle andere studies was de interventie ‘land-based’ oefentherapie onder begeleiding van een fysiotherapeut. De sessies varieerden van 30 tot 90 minuten (mediaan 60 min), de frequentie varieerde van 1 tot 3 keer per week (mediaan 1x per week), en de duur varieerde van 2 tot 52 weken (mediaan 12 weken). In vijf studies werden adviezen voor zelf thuis oefenen verstrekt ter bevordering van het lange termijn effect. In 22 studies is aangegeven dat oefentherapie in groepsverband was en in 23 studies dat de interventie individueel werd gegeven. In 38 studies waren alle sessies gesuperviseerd door de fysiotherapeut (volledige supervisie). De controle interventie bestond uit educatie (n=14 studies), geen behandeling (wachtlijst; n=8), gebruikelijke huisartszorg (n=9), advies tot zelf thuis oefenen (n=4), pijnmedicatie of een dieet (n=3). In 17 studies werd de inhoud van de controle interventie (‘geen interventie’) niet gerapporteerd. Risk of bias werd beoordeeld aan de hand van de Cochrane RoB tool: 22 studies hadden een laag risico op bias, bij 14 studies was het risico op bias onduidelijk (‘unclear’), en bij 16 studies was sprake van een hoog risico op bias, veelal vanwege onduidelijkheden rondom randomisatiemethode en/of maskering van de groepstoekenning. Bij geen van de RCT's was de interventie geblindeerd, maar Verhagen (2016) gaat er bij beoordeling van de risk of bias vanuit dat dit vanwege het pragmatische design van de studies niet duidelijk heeft geleid tot een vertekening van de resultaten: patiënten geven toestemming voor randomisatie en daarom is het onwaarschijnlijk dat zij a priori een voorkeur hebben voor een van de interventies. Tabel 2 geeft een overzicht van de effecten van gesuperviseerde oefentherapie bij knieartrose voor de in Verhagen (2016) gerapporteerde uitkomstmaten.
Tabel 2. Effecten van gesuperviseerde oefentherapie bij knieartrose (n=52 studies; Verhagen 2017).
Een positief effect (groepsverschil) is in het voordeel van oefentherapie (statistisch significante verschillen (p < 0,05) zijn dikgedrukt). De controle interventie bestond uit educatie (n=14 studies), geen behandeling (wachtlijst; n=8), gebruikelijke (huisarts)zorg (n=9), advies tot zelf thuis oefenen (n=4), pijnmedicatie of dieet (n=3); in 17 studies werd de inhoud van de controle interventie (‘geen interventie’) niet gerapporteerd.
|
Uitkomstmaat |
Parameter* |
direct na interventie#
(95%BI) (n studies/ n deelnemers) |
6 mnd na interventie#
(95%BI) (n studies/ n deelnemers) |
GRADE-I@
direct/ 6mnd |
GRADE-II@
direct/ 6mnd |
|
Fysiek functioneren |
SMD*1 |
0.48 (0.35;0.61) (42/3445) |
0.27 (0.14;0.41) (7/894) |
LAAG/ REDELIJK/ |
ZEER LAAG LAAG |
|
SMD*2 |
0.54 (0.36;0.72) (11/1129) |
0.30 (0.13;0.47) (3/580) |
REDELIJK/ HOOG |
LAAG/ REDELIJK |
|
|
Pijn
|
SMD*1 |
0.50 (0.37;0.63) (42/2709) |
0.26 (0.12;0.40) (7/889) |
LAAG/ REDELIJK/ |
LAAG/ LAAG |
|
SMD*2 |
0.55 (0.41;0.68) (11/1129) |
0.21 (0.04;0.38) (3/580) |
HOOG/ HOOG |
HOOG/ REDELIJK |
|
|
Responders$ |
RD |
0.28 (0.15;0.41) (7/861) |
0.05 (-0.05;0.15) (3/363) |
LAAG/ REDELIJK |
LAAG/ REDELIJK |
|
Kwaliteit van leven |
SMD |
0.25 (0.11;0.38) (17/1613) |
0.01 (-0.18;0.16) (3/584) |
REDELIJK/ REDELIJK |
REDELIJK/ REDELIJK |
|
SMD*2 |
0.32 (0.12;0.51) (7/709) |
0.04 (-0.14;0.23) (2/523) |
HOOG/ HOOG |
REDELIJK/ HOOG |
*SMD: standardized mean difference (gestandaardiseerd verschil van gemiddelden); RD: risk difference (risicoverschil); MD: mean difference (gemiddeld verschil); *1alle meetinstrumenten (SMD); *2Laag RoB studies met > 25 deelnemers per arm (SMD); #Effectschatter met 95%-betrouwbaarheidsinterval (95%BI); $Verschillende definities: OMERACT-OARSI criteria; 4,5 of 11-punts schaal; > MICD; > 6 punten verbetering WOMAC; > 15% verbetering op HOOS; 0 of 1 op pijn (‘geen pijn’). @GRADE-beoordeling van bewijskracht volgens Verhagen (2016; GRADE-I), en de uiteindelijke GRADE beoordeling in de huidige richtlijn die rekening houdt met eventuele overlap van de effectschatting met MCID (GRADE-II). Noot: in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is i.p.v. ‘matig’.
Gewrichtspijn (cruciale uitkomstmaat)
Alle 52 studies hebben pijn gemeten; 42 studies presenteerden data direct na de interventie, en slechts enkele studies presenteerden lange termijn resultaten (6 tot 12 maanden na de interventie). Pijn werd geëvalueerd met de WOMAC (n=31), VAS (n=10), of een alternatief meetinstrument (n=7). De gepoolde effectschattingen waren op alle meetmomenten statistisch significant in het voordeel van oefentherapie: gestandaardiseerd gemiddeld groepsverschil, SMD= 0,50 (95%BI=(0,37;0,63)) direct na de interventie, en 0,26 (0,12; 0,40) zes maanden na interventie (Figuur 4). Op beide tijdspunten bevat de effectschatting (95% betrouwbaarheidsinterval) het door de werkgroep benoemde minimaal klinisch relevant verschil (MCID) van 0,37, en direct na de interventie overtreft het gemiddelde effect de MCID. Een vergelijkbaar beeld ontstaat wanneer alleen de studies worden gepoold die voldoende groot zijn (> 25 patiënten in de kleinste studiegroep) en een laag RoB hebben: SMD= 0,55 (95%BI=(0,41;0,68)) direct na de interventie, en 0,21 (0,04; 0,38) zes maanden na interventie (tabel 2) Direct na de interventie overtreft de effectschatting, het hele betrouwbaarheidsinterval, de MCID. Vier studies evalueerden ‘water-based’ oefentherapie en exclusie van deze studies heeft geen noemenswaardige invloed op de effectschattingen: direct na de interventie bedraagt de effectschatting, SMD= 0,51 (95%BI=(0,37; 0,65)).
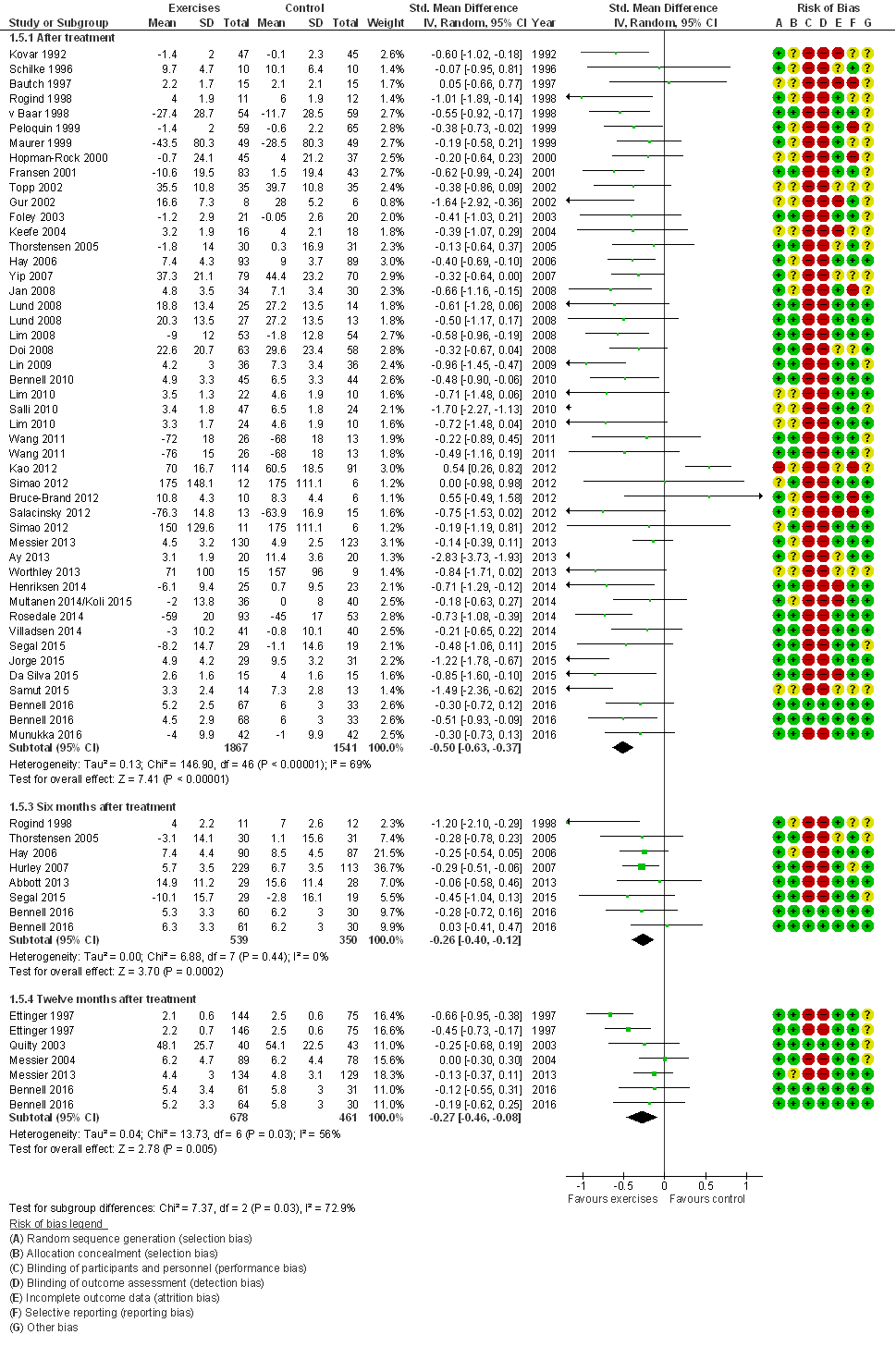
Figuur 4 Meta-analyse en forest plot van het effect van gesuperviseerde oefentherapie bij knieartrose op gewrichtspijn (Verhagen 2016)
Fysiek functioneren (cruciale uitkomstmaat)
Alle 52 studies hebben functioneren gemeten; 42 studies presenteerden data direct na de interventie, en 11 studies presenteerden lange termijn resultaten (6 tot 12 maanden na de interventie). Pijn werd meestal geëvalueerd met de WOMAC of KOOS, in 14 studies werd een alternatief meetinstrument gebruikt. De gepoolde effectschattingen waren op alle meetmomenten statistisch significant in het voordeel van oefentherapie: gestandaardiseerd gemiddeld groepsverschil, SMD= 0,48 (95%BI=(0,35;0,61)) direct na de interventie, en 0,27 (0,14; 0,41) zes maanden na interventie (Figuur 5). Een vergelijkbaar beeld ontstaat wanneer alleen de studies worden gepoold die voldoende groot zijn (> 25 patiënten in de kleinste studiegroep) en een laag RoB hebben: SMD= 0,54 (95%BI=(0,36;0,72)) direct na de interventie, en 0,30 (0,13; 0,47) zes maanden na interventie (tabel 2). In alle gevallen bevat de effectschatting (95% betrouwbaarheidsinterval) het door de werkgroep benoemde minimaal klinisch relevant verschil (MCID) van 0,37, en direct na de interventie overtreft het gemiddelde effect de MCID. Vier studies evalueerden ‘water-based’ oefentherapie en exclusie van deze studies heeft geen noemenswaardige invloed op de effectschattingen: direct na de interventie bedraagt de effectschatting, SMD= 0,50 (95%BI=(0,36; 0,64)).
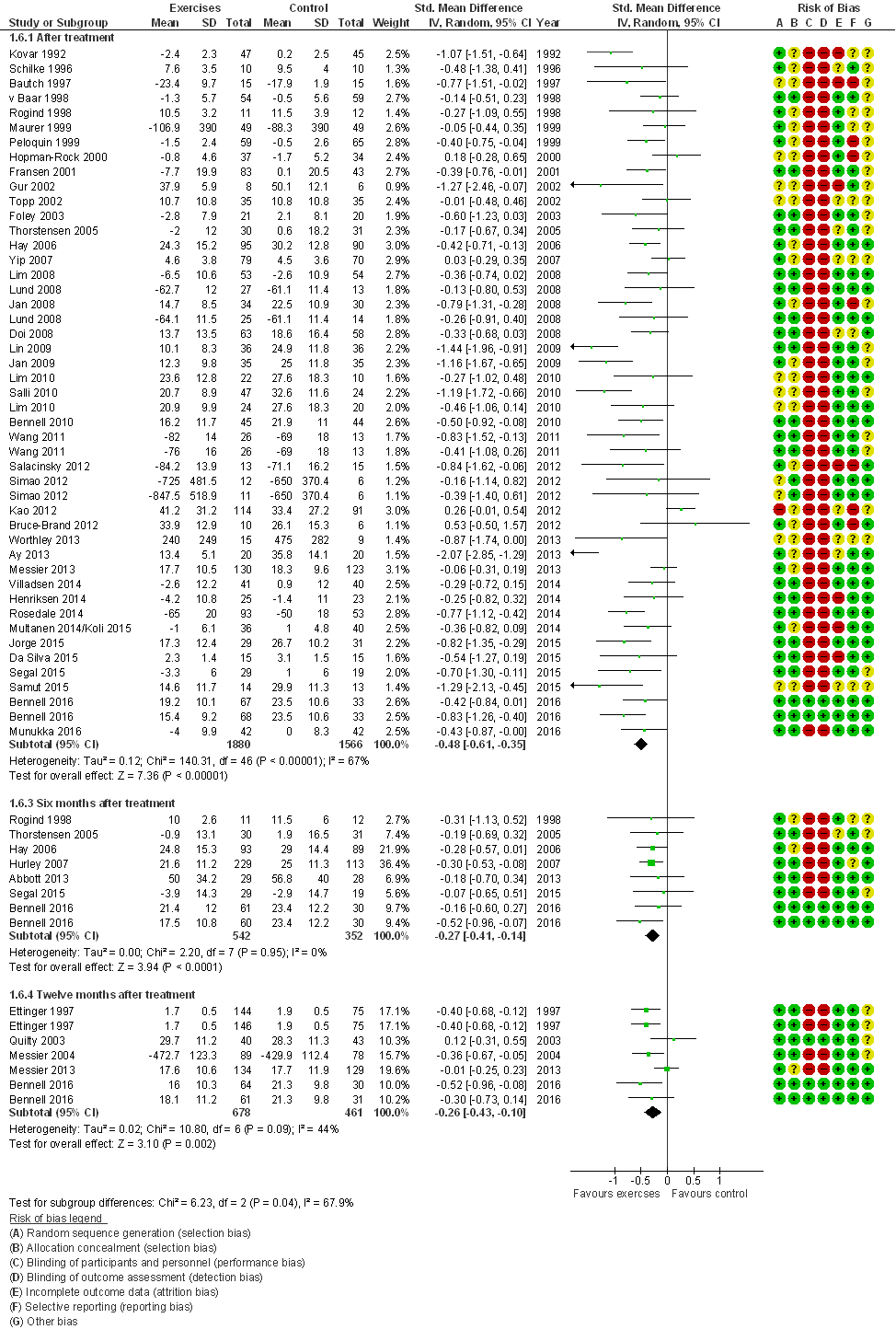 Figuur 5 Meta-analyse en forest plot van het effect van gesuperviseerde oefentherapie bij knieartrose op fysiek functioneren (Verhagen 2016)
Figuur 5 Meta-analyse en forest plot van het effect van gesuperviseerde oefentherapie bij knieartrose op fysiek functioneren (Verhagen 2016)
Responders (belangrijke uitkomstmaat)
Elf studies rapporteerden het aantal mensen dat baat had bij de behandeling (responder). Responders werden meestal gemeten met behulp van een 4, 5 of 11-punt schaal (global improvement), de overige studies bepaalden de responders op basis van de OMERACT-OARSI criteria, verbetering op de KOOS of WOMAC, of op basis van afwezigheid van pijn. In slechts twee van de elf studies werd het percentage responders optimaal gerapporteerd op basis van de OMERACT-OARSI set van responder criteria (Pham 2003). Direct post-interventie was er sprake van statistisch significant meer mensen die baat hadden van de oefentherapie: het percentage responders varieerde van 24 tot 79% in de interventiegroep, en 16-34% in de controlegroep (gemiddeld risicoverschil, RD=0,28 (95%BI= (0,15; 0,41); Figuur 6). De effectschatting (95% betrouwbaarheidsinterval) overtreft de door de GRADE working group voorgestelde default grens voor een klinisch relevant effect (de relatieve risico’s liggen ver boven 1,25). Zes maanden na de interventie was er slechts sprake van een klein en niet statistisch significant verschil in het percentage responders, het percentage responders varieerde van 30-67% in de interventiegroep en 25 tot 57% in de controlegroep (RD=0,05; 95%BI=(-0,05; 0,15)). Het merendeel van de studies (70%) heeft een laag risico op bias, en het beperken van de meta-analyse tot deze studies heeft geen noemenswaardige invloed op de effectschatting. Geen van de studies betreft water-based oefentherapie.
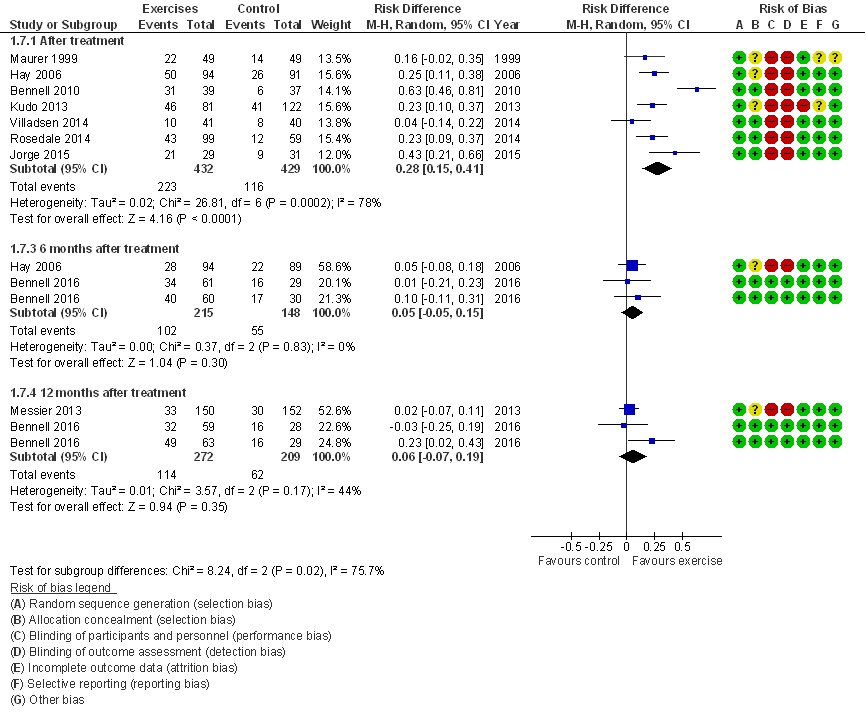
Figuur 6 Meta-analyse en forest plot van het effect van gesuperviseerde oefentherapie bij knieartrose op percentage responders (Verhagen 2016).
Kwaliteit van leven (belangrijke uitkomstmaat)
Kwaliteit van leven is gemeten in 21 studies: met de KOOS (10 studies), SF-36 (9 studies), of alternatief instrument (3 studies). De gepoolde effectschatting laat alleen direct post interventie een gering, maar statistisch significant resultaat zien in het voordeel van oefentherapie (SMD= 0,25; 95%BI=(0,11; 0,38)). Op alle andere meetmomenten wordt er geen effect van oefentherapie op kwaliteit van leven gevonden (op 6 maanden bedraagt SMD= 0,01; 95%BI= (-0,16; 0,18)). Een vergelijkbaar beeld ontstaat wanneer alleen de studies worden gepoold die voldoende groot zijn (> 25 patiënten in de kleinste studiegroep) en een laag RoB hebben: de effectschatting direct post-interventie is gering maar wel statistisch significant en in het voordeel van oefentherapie (SMD= 0,32; 95%BI= (0,12; 0,51)), terwijl 6 maanden na de interventie geen statistisch significant effect wordt gevonden (SMD= -0,04; 95%BI= (-0,23; 0,14)). Slechts vier studies evalueerden ‘water-based’ oefentherapie, en als de analyse wordt beperkt tot ‘land-based’ oefentherapie levert dit vergelijkbare effectschattingen op: SMD= 0,26 (95%BI= (0,11; 0,42)) direct post interventie en 0.01 (95%BI= (-0,16; 0,18)) op 6 maanden na de interventie.
Adverse events (bijwerkingen, complicaties; belangrijke uitkomstmaat)
Zes studies meldden dat bijwerkingen werden gemeten: In een studie zijn geen bijwerkingen gevonden, in de andere studies zijn 1 á 2 patiënten uitgevallen, veelal vanwege bijkomende en tijdelijke verergering van de pijn.
Therapietrouw (compliantie; belangrijke uitkomstmaat)
Vijf studies rapporteren een percentage compliantie (adherence) variërend tussen 66 tot 90%.
Tijd tot chirurgische interventie
In twee studies is geëvalueerd hoeveel mensen gedurende het onderzoek in aanmerking kwamen voor een nieuwe knie (Christensen 2015; Bennel 2016). In beide studies was de follow-up 12 maanden. In de oefentherapie groep kreeg 0%-1.5% van de patiënten een nieuwe knie, vergeleken met 1.6%-3.1% van de patiënten in de controle groep. Deze verschillen zijn in het voordeel van de oefentherapie, maar zijn niet klinisch relevant mogelijk vanwege de relatieve korte follow-up.
Overige uitkomstmaten (belangrijke uitkomstmaten)
Overige uitkomstmaten (zie Relevante uitkomstmaten onder Zoeken en selecteren) zoals gewrichtsstijfheid, kosten en zorggebruik werden niet als uitkomstmaat beschreven in de systematische review van Verhagen (2016).
Deelvraag-2: wat is de kosteneffectiviteit van gesuperviseerde oefentherapie bij mensen met heup- of knieartrose op lange termijn?
Vijgen (2017) includeert zeven studies naar de kosteneffectiviteit van oefentherapie bij knie- en heupartrose. Twee studies zijn uitgevoerd in Nederland, drie in de UK, één in Canada en één in Nieuw-Zeeland. Eén studie keek alleen naar patiënten met heupartrose, twee studies betroffen patiënten met knie- of heupartrose en vier studies betroffen patiënten met knieartrose. Alle studies zijn trialbased economische evaluaties zonder modellering. De tijdshorizon is bij alle studies kort en varieert van 6 maanden tot 30 maanden. Hieronder worden de opzet en resultaten per studie kort besproken. Voor meer details, evidencetabellen en kwaliteitsbeoordelingen van de geïncludeerde studies wordt verwezen naar de SR van Vijgen (2017; zie aanverwante producten).
Nederlandse economische studies
De meest recente kosteneffectiviteitstudie betreft behandeling van Nederlandse patiënten van 45 jaar of ouder met heupartrose vanwege non-traumatische heupklachten en die voldeden aan de ACR criteria voor heupartrose (Tan 2016). Oefentherapie gesuperviseerd door een fysiotherapeut (12 sessies gedurende de eerste 3 maanden gevolgd door 3 booster sessies op 5, 7 en 9 maanden follow-up) en gecombineerd met standaard huisartsenzorg (n= 101 patiënten) wordt vergeleken met alleen standaard huisartsenzorg (n=102). De studie is uitgevoerd vanuit een maatschappelijk perspectief over een tijdsduur van 1 jaar. Bij beoordeling op basis van de kwaliteitscriteria van Drummond (zie Vijgen 2017) blijkt de studie te voldoen aan 26 van de 35 criteria en is daarmee van goede kwaliteit. Zowel de interventie die onderzocht wordt (oefentherapie als aanvulling op standaard huisartsenzorg) als de vergelijkende behandeling komen goed overeen met de Nederlandse zorgverlening aan deze patiëntengroep. De incrementele totale kosten worden geschat op €607 (95% BI= (-2403; 993); statistisch niet significant) in het voordeel van oefentherapie: €98 lagere zorgkosten en €508 lagere productiviteitskosten per patiënt. Het minimale verschil in zorgkosten wordt vooral veroorzaakt door meer operaties in de controlegroep (n=9) dan in de interventiegroep (n=6) en dit heft de meerkosten van de oefentherapie op. Omdat er nauwelijks een verschil is in kwaliteit van leven tussen beide groepen (-0,006 QALY), lijkt er sprake van een gunstige kosteneffectiviteit. Uit onzekerheidsanalyses blijkt een kans van 33% dat oefentherapie tot positieve gezondheidseffecten leidt en een kans van 76% dat er kosten bespaard worden. Vanuit maatschappelijk perspectief en een willingness to pay (WTP) van €20.000 per QALY is de kans 68% dat oefentherapie kosteneffectief is ten opzichte van standaard huisartsenzorg, vanuit gezondheidszorgperspectief is de kans 47%.
Coupé (2007) is een minder recente Nederlandse kosteneffectiviteitstudie, en betreft patiënten die voldeden aan de ACR criteria en werden doorverwezen naar de fysiotherapeut voor hun heup- of knieartrose. Een combinatie van gedragstherapie en oefentherapie (12 weken combinatietherapie met 5 booster sessies) wordt vergeleken met de standaardzorg volgens de Nederlandse richtlijn van fysiotherapeuten (standaardfysiotherapie: advies, voorlichting en therapie, 12 weken behandeling). De studie is uitgevoerd vanuit zowel maatschappelijk als gezondheidszorg perspectief over een tijdsduur van 1 jaar. Omdat niet wordt vergeleken met standaard huisartsenzorg voldoet de studie strikt genomen niet aan de uitgangsvraag, maar Coupé (2007) geeft wel inzicht in de kosten en effecten (in QALY’s) van oefentherapie. De studie voldoet aan 26 van de 35 kwaliteitsitems en is daarmee van goede methodologische kwaliteit. De incrementele totale kosten werden geschat op €773 (95% BI= (-2360; 772); statistisch niet significant) in het voordeel van de combinatietherapie: €500 lagere zorgkosten en €600 lagere productiviteitskosten per patiënt, maar €330 hogere informele zorgkosten. De totale effecten bedroegen 0,73 QALY in de combinatietherapie groep en 0,71 QALY in de standaard fysiotherapie groep, en verschillen daarmee nauwelijks tussen beide groepen (-0,02 QALY).
Buitenlandse economische studies
Marra (2014) is een Canadese studie bij patiënten van 50 jaar of ouder, met pijn of stijfheid aan de knie en met overgewicht (BMI≥25kg/m2). Een multidisciplinaire interventie met oefentherapie wordt vergeleken met een begeleidingsprogramma georganiseerd vanuit de apotheek. De interventie bestond uit een vragenlijst, voorlichting, pijn medicatie, oefentherapie door een fysiotherapeut (2 keer per week a 6 weken deelname in een groep) en communicatie met huisarts. De standaardzorg betrof slechts voorlichting door middel van een voorlichtingsfolder. De studie voldoet aan 22 van de 35 kwaliteitscriteria is daarmee van voldoende methodologische kwaliteit. De kosteneffectiviteitsanalyse is gedaan vanuit maatschappelijk perspectief met een tijdshorizon van 6 maanden. De gemiddelde kosten per patiënt waren $755 in de interventiegroep, en $441 in de standaardzorg groep. In de interventiegroep werden 0,39 QALY’s per patiënt gewonnen en in de standaardzorg groep 0,36 QALY’s. Deze resultaten leiden tot een incrementele kosteneffectiviteitsratio van $14.903 per QALY. Uit de onzekerheidsanalyses bleek de kans 90% te zijn dat de multidisciplinaire interventie kosteneffectief is, bij een referentiewaarde van $20.000 per QALY.
Pinto (2013) is een Nieuw-Zeelandse studie bij patiënten die met heup- of knieartrose (ACR criteria) bij de huisarts komen of die zijn doorverwezen naar een orthopedische polikliniek ter overweging van een operatie. Oefentherapie wordt vergeleken met standaardzorg (door huisarts en andere zorgverleners). De studie voldoet aan 27 van de 35 kwaliteitscriteria is daarmee van goede methodologische kwaliteit. De analyse is uitgevoerd vanuit een maatschappelijk perspectief met een tijdshorizon van 1 jaar. De gemiddelde kosten per patiënt zijn $6.286 in de standaardzorg groep en $6.837 in de oefentherapie groep (verschil: $552). De patiënt die standaard zorg krijgt wint 0,65 QALY’s en de patiënt met oefentherapie 0,69 QALY’s (verschil: 0,04). Er resulteert een deterministische kosteneffectiviteitsratio van $23.365 per QALY van oefentherapie versus standaardzorg. Uit de onzekerheidsanalyses blijkt de kans 80% dat oefentherapie kosteneffectief, uitgaande van een referentiewaarde van $20.000 per QALY. De subgroepanalyse waarbij de patiënten die een operatie ondergingen buiten beschouwing werden gelaten, resulteert in een gunstiger kosteneffectiviteit ($163 per QALY).
Hurley (2007, 2012) is een UK studie bij patiënten van 50 jaar of ouder met milde, matige of ernstige kniepijn gedurende 6 maanden of langer. Gesuperviseerde oefentherapie op individuele basis of in groepsverband (twee keer per week gedurende 6 weken) wordt vergeleken met standaardzorg (zorg die de artsen in de UK het meest aangewezen achten). De studie uit 2007 betrof kosteneffectiviteit op de korte termijn (6 maanden) en de studie uit 2012 kosteneffectiviteit op de langere termijn (30 maanden). De korte termijn studie hanteert een maatschappelijk perspectief en voldoet aan 28 van de 35 kwaliteitscriteria en is daarmee van goede kwaliteit. De auteurs concluderen dat geïntegreerde oefentherapie met zelfmanagement (individueel of in groepsverband) een kosteneffectieve strategie lijkt ten opzichte van standaard huisartsenzorg. Als de maatschappij bereid is £1.900 (of meer) te betalen voor deze therapie dan is de kans op kosteneffectiviteit 90% (of meer). Bij £800 is die kans 50% en bij £0 is die kans slechts 5%. Groepstherapie reduceert de kosten en lijkt net zo effectief als individuele therapie. De lange termijn studie Hurley (2012) is van mindere methodologisch kwaliteit, onder andere door het ontbreken van algemeen toepasbare kosteneffectiviteitsresultaten met kosten per QALY, en doordat productiviteitskosten buiten beschouwing zijn gelaten. Deze studie hanteert een gezondheidszorg perspectief. De auteurs concluderen dat het oefentherapie programma leidt tot een beter fysiek functioneren in vergelijking met de standaard zorg (beoordeeld met behulp van de WOMAC), en dat dit voordeel van oefentherapie afneemt in de tijd maar wel stand houdt na 30 maanden. Na exclusie van een patiënt in de standaardzorg groep die na een knieoperatie ernstige complicaties kreeg, blijken de gemiddelde zorgkosten van beide groepen vrijwel gelijk, £982 bij standaardzorg en £1.018 bij oefentherapie.
Richardson (2006) is een UK studie bij patiënten met knieartrose die voldeden aan de ACR criteria en waren doorverwezen door de eerste of tweede lijn. Een oefenprogramma thuis in combinatie met oefentherapie wordt vergeleken met alleen een oefenprogramma thuis. De groepsgerichte oefentherapie vindt tweewekelijks plaats gedurende acht weken en wordt gesuperviseerd door een fysiotherapeut. De analyse is uitgevoerd vanuit gezondheidzorg (NHS) perspectief met een tijdshorizon van 12 maanden. De totale gemiddelde kosten per patiënt waren £440 voor de groepstherapie en £446 voor het thuisprogramma. Het verschil in effectiviteit is gering (0,023 QALY’s) en niet statistisch significant. Geconcludeerd wordt dat als de maatschappij bereid is £0 te betalen voor extra gezondheidswinst bij knieartrose, de kans 50% is dat groepsgerichte oefentherapie een kosteneffectieve interventie is ten opzichte van alleen oefentherapie thuis.
Samenvattend
De werkgroep beschouwt kosteneffectiviteit, met name kosteneffectiviteit op de lange termijn (vijf jaar) als een belangrijke uitkomstmaat, maar er werden geen studies gevonden naar kosteneffectiviteit met een voldoende lange tijdshorizon. De twee Nederlandse studies hebben een tijdshorizon van slechts een jaar. De buitenlandse studies zijn niet direct toepasbaar op de Nederlandse situatie met name vanwege verschillen in gezondheidszorgsystemen. Alleen de UK studie van Hurley (2012) heeft een tijdshorizon van meer dan een jaar, maar deze studie hanteert geen maatschappelijk maar een gezondheidszorg perspectief en is van mindere methodologische kwaliteit. De meest betrouwbare inzichten in de kosteneffectiviteit van oefentherapie kunnen worden ontleend aan de recente Nederlandse kosteneffectiviteit studie van Tan (2016) bij patiënten met heupartrose, die een statistisch niet significant verschil in incrementele totale kosten laat zien in het voordeel van oefentherapie in vergelijking met standaard huisartsenzorg, en een verwaarloosbaar verschil in kwaliteit van leven, bij een tijdshorizon van een jaar. In de overige geïncludeerde studies ontstaat een zelfde beeld van mogelijk (gering) lagere kosten van oefentherapie bij een vergelijkbare of (gering) hogere effectiviteit. Op basis van de beschikbare literatuur kan derhalve alleen voorzichtig worden geconcludeerd dat oefentherapie voor de behandeling van knie- en heupartrose op de korte termijn mogelijk tot een gunstige kosteneffectiviteit zal leiden. Lange termijn modelstudies zijn noodzakelijk om een uitspraak te kunnen doen over de lange termijn kosteneffectiviteit van oefentherapie. In deze modelstudies zullen ook de kenmerken van de patiënten (artrose in één of meerdere gewrichten, comorbiditeit, leeftijd en tussentijdse chirurgische en niet-chirurgische behandelingen) moeten worden betrokken, omdat deze grote invloed hebben op de patiëntrelevante uitkomsten en daarmee mogelijk ook op de kosteneffectiviteit van oefentherapie.
Bewijskracht van de literatuur
Deelvraag-1: beoordeling van de bewijskracht (GRADE systematiek) is gebaseerd op Verhagen (2016; kolom ‘GRADE-I’ in tabel 1 en 2). De bewijskracht is bepaald per uitkomstmaat en is in alle gevallen gebaseerd op resultaten uit gerandomiseerd onderzoek en start derhalve hoog. Vervolgens is de bewijskracht verlaagd als er sprake was van relevante tekortkomingen op een of meerdere GRADE domeinen: risk of bias, inconsistentie, indirectheid, imprecisie, publicatiebias (zie Werkwijze op het tabblad Verantwoording). Verhagen (2016) gaat er bij beoordeling van de risk of bias vanuit dat vanwege het pragmatische design van de studies het ontbreken van blindering (in geen van de RCT’s is de interventie geblindeerd) niet heeft geleid tot een relevante vertekening van de resultaten. De werkgroep volgt deze redenering met de kanttekening dat enige vertekening (al dan niet in het voordeel van oefentherapie) als gevolg van het ontbreken van blindering niet geheel kan worden uitgesloten. Verhagen (2016) hanteert strikte regels bij de beoordeling van de GRADE domeinen risk of bias (> 25% van de patiënten uit studies met een hoog RoB), inconsistentie (statistische heterogeniteit I2 > 40%, of < 75% van de patiënten rapporteert resultaten in dezelfde richting), en imprecisie (dichotome uitkomstmaat in < 300 patiënten of continue uitkomstmaat in < 400 patiënten). Idealiter vindt GRADE beoordeling plaats in relatie tot grenzen voor klinische besluitvorming, en wordt met name het domein imprecisie (mede) beoordeeld op basis van een eventuele overlap tussen de effectschatting (betrouwbaarheidsinterval) en de grens voor klinische besluitvorming (zie Klinische relevantie en grenzen voor klinische besluitvorming onder Zoeken en selecteren; Hultcrantz 2017). Verhagen (2016) classificeert weliswaar de grootte van effecten als gering (SMD < 0,3), matig (SMD tussen 0,3 en 0,5) of groot (SMD > 0,5), maar hanteert deze grenzen niet bij de beoordeling van imprecisie. De richtlijnwerkgroep heeft besloten een MCID te hanteren van 0,37 (SMD) voor pijn en fysiek functioneren, en de door de internationale GRADE working group voorgestelde default grenzen voor de overige uitkomstmaten. Als deze grenzen worden gehanteerd bij het beoordelen van imprecisie, is er in veel gevallen sprake van overlap van de effectschattingen met de MCID, en moet in de meeste gevallen de bewijskracht met een niveau (verder) worden verlaagd (vergelijk kolommen ‘GRADE-I’ en ‘GRADE-II’ in tabel 1 en 2).
Deelvraag-2: de bewijskracht is beoordeeld met behulp van de generieke GRADE methode (zie Werkwijze op het tabblad Verantwoording), het startpunt was hoog. Voor de uitkomstmaat kosteneffectiviteit op de korte termijn is de bewijskracht laag: er is afgewaardeerd met twee niveaus vanwege ernstige imprecisie (een enkele Nederlandse studie; effectschatting overlapt met het nuleffect). Voor kosteneffectiviteit op de lange termijn (vijf jaar) is de bewijskracht zeer laag: er is met een extra niveau afgewaardeerd vanwege indirectheid (buitenlandse studie).
Zoeken en selecteren
Om de uitgangsvraag (beide deelvragen) te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag: wat zijn de gunstige en ongunstige effecten van oefentherapie in vergelijking met geen oefentherapie bij volwassen patiënten met klachten als gevolg van artrose aan heup en/of knie in de eerste of tweede lijn?
Relevante uitkomstmaten
De werkgroep achtte patiëntgerapporteerde gewrichtspijn (NRS, VAS; pijn subschaal van WOMAC, KOOS, HOOS) en patiëntgerapporteerd fysiek functioneren (beperkingen bij het uitvoeren van algemeen dagelijkse activiteiten; relevante subschalen van IKS, WOMAC knee score, WOMAC hip score, KOOS, HOOS, Oxford Knee Score, en Oxford Hip Score) cruciale uitkomstmaten. Percentage responders (zelfrapportage, percentage patiënten dat aangeeft baat te hebben gehad bij de behandeling) werd benoemd als een belangrijke uitkomstmaat. Responderanalyses worden bij voorkeur uitgevoerd op basis van de OMERACT-OARSI set van responder criteria (Pham 2003) die zijn gebaseerd op veranderingen in pijn, fysiek functioneren en algemene verbetering (patient’s global assessment). De volgende uitkomstmaten werden eveneens als belangrijk benoemd: patiëntgerapporteerde gewrichtsstijfheid, kwaliteit van leven (QoL), patiënttevredenheid, participatie (betaald werk, sport, vrijetijdsbesteding), adverse events (bijwerkingen en complicaties), therapietrouw (compliantie; withdrawal from trial), tijd tot chirurgische interventie (elke vorm van chirurgie gerelateerd aan de klachten als gevolg van artrose), kosten (kosteneffectiviteit; ook lange termijn (vijf jaar)), en zorggebruik.
In afwijking van de NICE richtlijn Osteoarhritis (NICE 2014) wordt gewrichtsstijfheid niet als een cruciale maar als een belangrijke (niet-cruciale) uitkomstmaat benoemd, en bij de uitkomstmaat ‘tijd tot chirurgische interventie’ hanteert de werkgroep een bredere definitie die niet zoals bij NICE beperkt is tot alleen gewrichtsvervangende chirurgie.
Klinische relevantie en grenzen voor klinische besluitvorming
In toonaangevende systematische reviews van pijnmedicatie bij heup- en knieartrose wordt voor pijnreductie een minimaal klinisch relevant verschil (MCID, minimal clinically important difference) gehanteerd van 0,37 standaarddeviaties (da Costa 2017; Wandel 2010). Deze MCID is gebaseerd op de mediane MCID (improvement) uit vier studies (Tabel 3; Salaffi 2004; Angst 2001, 2002; Eberle 1999) voor de uitkomstmaat pijn. Andere deels recentere studies geven een vergelijkbaar beeld, alhoewel er sprake is van een aanzienlijke spreiding (Tubach 2012; Bellamy 2015; Mills 2016; Angst 2017). Tabel 3 geeft een overzicht van MCID-waarden voor gewrichtspijn en fysiek functioneren, en suggereert vergelijkbare MCID’s voor pijn en fysiek functioneren.
Tabel 3
|
|
Pijn |
Fysiek functioneren |
|||
|
Auteur |
Score |
MCID |
Effect size |
MCID |
Effect size |
|
Eberle 1999 |
VAS (0-100) |
8.4* |
? |
- |
- |
|
Angst 2001 |
WOMAC (0-10) |
0.75* |
0.33 |
0.67 |
0.31 |
|
Angst 2002 |
WOMAC (0-10) |
0.83* |
0.39 |
0.80 |
0.37 |
|
Salaffi 2004 |
VAS (0-10) |
1^ |
0.59 |
- |
- |
|
Tubach 2012 |
General Pain and Function (NRS 0-10) Normalized to 0-100 |
17* |
0.94 |
12 |
0.6 |
|
Bellamy 2015 |
WOMAC (NRS 0-10) Normalized to 0-100 |
9* |
0.43 |
6 |
0.43 |
|
Mills 2016 |
KOOS (100-0) 4 different methods for determining MCID used |
4± |
0.21 |
2.5 8.17 |
0.13 |
|
Angst 2017 |
WOMAC (0-100) 5 different methods for determining MCID used |
15± 8.74ⱡ 8.74* |
0.69 0.63 0.41 |
- |
- |
± Youden method (AUC optimal cutoff) method, ¥ 80% specific (AUC) method, ⱡ bivariate linear regression, ⅎ covariate linear regression, ^ mean change method Jaeschke, * mean change method Redelmeier = most common method and recommended (Angst 2017; Revicki 2008).
Wanneer de analyse wordt beperkt tot WOMAC en KOOS (de meest gebruikte en geadviseerde primaire uitkomstmaten bij artrose) en MCID’s vastgesteld met de Redelmeier methode, zijn de minimale klinisch relevante effect sizes voor pijn (0,33; 0,39; 0,43; 0,21; 0,41) gemiddeld 0,35, en voor fysiek functioneren (0,31; 0,37; 0,43; 0,37) gemiddeld 0,37. De werkgroep heeft besloten aan te sluiten bij genoemde toonaangevende systematische reviews van pijnmedicatie bij heup- en knieartrose, en een MCID te hanteren van 0,37 voor gewrichtspijn. Op basis van de aanvullende analyse (tabel 3) is besloten voor fysiek functioneren eveneens een MCID van 0,37 te hanteren. Deze MCID’s komen overeen met 7 tot 8 punten op een 0-100 meetschaal (subschaal van WOMAC, KOOS/ HOOS; genormaliseerd naar 0 tot 100) voor pijn of fysiek functioneren. Voor de overige uitkomstmaten werden de door de internationale GRADE working group voorgestelde default grenzen gehanteerd voor klinische relevantie: een verschil in relatief risico van 25% bij dichotome uitkomstmaten, en een verschil van een halve standaarddeviatie voor continue uitkomstmaten.
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz 2017).
Zoeken en selecteren (Methode)
Bij aanvang van de richtlijnontwikkeling is een oriënterende zoekactie uitgevoerd naar systematische reviews en richtlijnen met betrekking tot conservatieve behandeling van artrose aan heup of knie (zie werkwijze onder het tabblad verantwoording). Deze oriënterende zoekactie leverde twee recente Cochrane systematische reviews op, die de effecten van oefentherapie voor behandeling van artrose aan heup (Fransen 2014) en knie (Fransen 2015) analyseren en de literatuur dekken tot begin 2013. Voor deelvraag-1 is derhalve in de databases Medline (via OVID) en Cinahl (via Ebsco) op 3 maart 2016 met relevante zoektermen gezocht vanaf het jaar 2013 naar (systematische reviews van) gerandomiseerd onderzoek naar de waarde van oefentherapie bij behandeling van mensen met heup- of knieartrose. Omdat de literatuuranalyse uiteindelijk is gebaseerd op een systematische review uitgevoerd in opdracht van het Zorginstituut Nederland (zie later in de tekst), is de zoekverantwoording (tabblad Verantwoording) van de eigen zoekactie alleen vermeld ten behoeve van een toekomstige revisie van de richtlijnmodule. Voor deelvraag-2 is een aparte zoekactie uitgevoerd waarin op 30 september 2016 vanaf 2010 is gezocht naar (systematische reviews van) origineel onderzoek naar de kosteneffectiviteit van oefentherapie bij behandeling van mensen met heup- of knieartrose. Deze analyse van de kosteneffectiviteit van oefentherapie (Vijgen 2017) maakte deel uit van een parallel project naar de plaats van kosteneffectiviteit in Nederlandse richtlijnen.
Tijdens de richtlijnontwikkeling is in opdracht van het Zorginstituut Nederland in het kader van een beoordeling van ‘stand van de wetenschap en praktijk’ een systematische review uitgevoerd naar de waarde van oefentherapie onder supervisie van een fysiotherapeut of oefentherapeut bij artrose van heup of knie in vergelijking met gebruikelijke zorg. Deze SR (Verhagen 2016) betreft onder andere een update van de twee Cochrane systematische reviews naar oefentherapie bij artrose aan heup of knie (Fransen 2014, 2015) die de literatuur dekt tot 1 augustus 2016.
Beantwoording van deelvraag-1 is gebaseerd op de SR van Verhagen (2016), en beantwoording van deelvraag-2 op de SR (Vijgen 2017; zie aanverwante producten) uitgevoerd in het parallelle project naar de plaats van kosteneffectiviteit in Nederlandse richtlijnen. Voor de beoordeling van de individuele studieopzet (risk of bias) van de studies geïncludeerd in deze SR’s en de studiekarakteristieken en resultaten wordt verwezen naar de respectievelijke systematische reviews.
Referenties
- ACSM's Guidelines for Exercise Testing and Prescription. American College of Sports Medicine. Lippincott Williams & Wilkins, 9th revised North American ed 2013.
- Angst F, Aeschlimann A, Angst J. The minimal clinically important difference raised the significance of outcome effects above the statistical level, with methodological implications for future studies. J Clin Epidemiol. 2017 ;82:128-136. doi: 10.1016/j.jclinepi.2016.11.016. Epub 2016 Dec 14. PubMed PMID: 27986610.
- Angst F, Aeschlimann A, Michel BA, et al. Minimal clinically important rehabilitation effects in patients with osteoarthritis of the lower extremities. J Rheumatol. 2002 Jan;29(1):131-8. PubMed PMID: 11824949.
- Angst F, Aeschlimann A, Stucki G. Smallest detectable and minimal clinically important differences of rehabilitation intervention with their implications for required sample sizes using WOMAC and SF-36 quality of life measurement instruments in patients with osteoarthritis of the lower extremities. Arthritis Rheum. 2001 ;45(4):384-91. PubMed PMID: 11501727.
- Bartholdy C, Juhl C, Christensen R, et al. The role of muscle strengthening in exercise therapy for knee osteoarthritis: A systematic review and meta-regression analysis of randomized trials. Semin Arthritis Rheum. 2017 ;47(1):9-21. doi: 10.1016/j.semarthrit.2017.03.007. Epub 2017 Mar 18. Review. PubMed PMID: 28438380.
- Bellamy N, Hochberg M, Tubach F, et al. Development of multinational definitions of minimal clinically important improvement and patient acceptable symptomatic state in osteoarthritis. Arthritis Care Res (Hoboken). 2015 ;67(7):972-80. doi: 10.1002/acr.22538. PubMed PMID: 25581339.
- Bieler T, Siersma V, Magnusson SP, et al. In hip osteoarthritis, Nordic Walking is superior to strength training and home-based exercise for improving function. Scand J Med Sci Sports. 2017 ;27(8):873-886. doi: 10.1111/sms.12694. Epub 2016 Apr 30. PubMed PMID: 27129607.
- Coupé VM, Veenhof C, van Tulder MW, et al. The cost effectiveness of behavioural graded activity in patients with osteoarthritis of hip and/or knee. Ann Rheum Dis. 2007 ;66(2):215-21. Epub 2006 Jul 31. PubMed PMID: 16880195.
- da Costa BR, Reichenbach S, Keller N, et al. Effectiveness of non-steroidal anti-inflammatory drugs for the treatment of pain in knee and hip osteoarthritis: a network meta-analysis. Lancet. 2017 Jul 8;390(10090):e21-e33. doi: 10.1016/S0140-6736(17)31744-0. PubMed PMID: 28699595.
- de Rooij M, van der Leeden M, Cheung J, et al. Efficacy of Tailored Exercise Therapy on Physical Functioning in Patients With Knee Osteoarthritis and Comorbidity: A Randomized Controlled Trial. Arthritis Care Res (Hoboken). 2017 ;69(6):807-816. doi: 10.1002/acr.23013. Epub 2017 Apr 24. PubMed PMID: 27563831.
- Dobson F, Bennell KL, French SD, et al. Barriers and Facilitators to Exercise Participation in People with Hip and/or Knee Osteoarthritis: Synthesis of the Literature Using Behavior Change Theory. Am J Phys Med Rehabil. 2016 ;95(5):372-89. doi: 10.1097/PHM.0000000000000448. Review. PubMed PMID: 26945211.
- Eberle E, Ottillinger B. Clinically relevant change and clinically relevant difference in knee osteoarthritis. Osteoarthritis Cartilage. 1999;7(5):502-3. PubMed PMID: 10489324.
- Fernandes L, Hagen KB, Bijlsma JW, et al. European League Against Rheumatism (EULAR). EULAR recommendations for the non-pharmacological core management of hip and knee osteoarthritis. Ann Rheum Dis. 2013 ;72(7):1125-35. doi: 10.1136/annrheumdis-2012-202745. Epub 2013 Apr 17. PubMed PMID: 23595142.
- Fransen M, McConnell S, Harmer AR, et al. Exercise for osteoarthritis of the knee. Cochrane Database Syst Rev. 2015 Jan 9;1:CD004376. doi: 10.1002/14651858.CD004376.pub3. Review. PubMed PMID: 25569281.
- Fransen M, McConnell S, Hernandez-Molina G, et al. Exercise for osteoarthritis of the hip. Cochrane Database Syst Rev. 2014 Apr 22;(4):CD007912. doi: 10.1002/14651858.CD007912.pub2. Review. PubMed PMID: 24756895.
- Garber CE, Blissmer B, Deschenes MR, et al. American College of Sports Medicine. American College of Sports Medicine position stand. Quantity and quality of exercise for developing and maintaining cardiorespiratory, musculoskeletal, and neuromotor fitness in apparently healthy adults: guidance for prescribing exercise. Med Sci Sports Exerc. 2011 ;43(7):1334-59. doi: 10.1249/MSS.0b013e318213fefb. PubMed PMID: 21694556.
- Hofstede SN, Marang-van de Mheen PJ, Vliet Vlieland TP, et al. Barriers and Facilitators Associated with Non-Surgical Treatment Use for Osteoarthritis Patients in Orthopaedic Practice. PLoS One. 2016 Jan 22;11(1):e0147406. doi: 10.1371/journal.pone.0147406. eCollection 2016. PubMed PMID: 26799974; PubMed Central PMCID: PMC4723077.
- Hofstede SN, Vliet Vlieland TP, van den Ende CH, et al. Variation in use of non-surgical treatments among osteoarthritis patients in orthopaedic practice in the Netherlands. BMJ Open. 2015 Sep 9;5(9):e009117. doi: 10.1136/bmjopen-2015-009117. PubMed PMID: 26353874; PubMed Central PMCID: PMC4567674.
- Hultcrantz M, Rind D, Akl EA, et al. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184.
- Hurley MV, Walsh NE, Mitchell H, et al. Long-term outcomes and costs of an integrated rehabilitation program for chronic knee pain: a pragmatic, cluster randomized, controlled trial. Arthritis Care Res (Hoboken). 2012 ;64(2):238-47. doi: 10.1002/acr.20642. PubMed PMID: 21954131.
- Hurley MV, Walsh NE, Mitchell HL, et al. Economic evaluation of a rehabilitation program integrating exercise, self-management, and active coping strategies for chronic knee pain. Arthritis Rheum. 2007 Oct 15;57(7):1220-9. PubMed PMID: 17907207.
- KNGF (2018). Koninklijk Nederlands Genootschap voor Fysiotherapie. Richtlijn Artrose Heup-Knie. Herziene versie. Link: https://www.kngf.nl/kennisplatform/richtlijnen/artrose-heup-knie
- Knittle K, De Gucht V, Maes S. Lifestyle- and behaviour-change interventions in musculoskeletal conditions. Best Pract Res Clin Rheumatol. 2012 ;26(3):293-304. doi: 10.1016/j.berh.2012.05.002. Review. PubMed PMID: 22867927.
- Marra CA, Grubisic M, Cibere J, et al. Cost-utility analysis of a multidisciplinary strategy to manage osteoarthritis of the knee: economic evaluation of a cluster randomized controlled trial study. Arthritis Care Res (Hoboken). 2014 ;66(6):810-6. doi: 10.1002/acr.22232. PubMed PMID: 24249680.
- Mills KA, Naylor JM, Eyles JP, et al. Examining the Minimal Important Difference of Patient-reported Outcome Measures for Individuals with Knee Osteoarthritis: A Model Using the Knee Injury and Osteoarthritis Outcome Score. J Rheumatol. 2016 ;43(2):395-404. doi: 10.3899/jrheum.150398. Epub 2016 Jan 15. PubMed PMID: 26773118.
- NICE (2014). Osteoarthritis: care and management. Clinical guideline (CG177). February 2014. Link: https://www.nice.org.uk/guidance/cg177 (geraadpleegd op 10 augustus 2017)
- NOV (2017). Verstandige keuzes binnen de orthopedie. Link: https://www.demedischspecialist.nl/sites/default/files/Verstandige%20Keuzes%20NOV_definitief.pdf (Accessed December 8, 2017)
- Pham T, Van Der Heijde D, Lassere M, et al. OMERACT-OARSI. Outcome variables for osteoarthritis clinical trials: The OMERACT-OARSI set of responder criteria. J Rheumatol. 2003 Jul;30(7):1648-54. Review. PubMed PMID: 12858473.
- Pinto D, Robertson MC, Abbott JH, etal .MOA Trial Team. Manual therapy, exercise therapy, or both, in addition to usual care, for osteoarthritis of the hip or knee. 2: economic evaluation alongside a randomized controlled trial. Osteoarthritis Cartilage. 2013 Oct;21(10):1504-13. doi: 10.1016/j.joca.2013.06.014. Epub 2013 Jun 27. PubMed PMID: 23811491.
- Revicki D, Hays RD, Cella D, et al. Recommended methods for determining responsiveness and minimally important differences for patient-reported outcomes. J Clin Epidemiol. 2008 ;61(2):102-9. doi: 10.1016/j.jclinepi.2007.03.012. Epub 2007 Aug 3. Review. PubMed PMID: 18177782.
- Richardson G, Hawkins N, McCarthy CJ, et al. Cost-effectiveness of a supplementary class-based exercise program in the treatment of knee osteoarthritis. Int J Technol Assess Health Care. 2006 Winter;22(1):84-9. PubMed PMID: 16673684.
- Salaffi F, Stancati A, Silvestri CA, et al. Minimal clinically important changes in chronic musculoskeletal pain intensity measured on a numerical rating scale. Eur J Pain. 2004 ;8(4):283-91. PubMed PMID: 15207508.
- Sandal LF, Roos EM, Bøgesvang SJ, et al. Pain trajectory and exercise-induced pain flares during 8 weeks of neuromuscular exercise in individuals with knee and hip pain. Osteoarthritis Cartilage. 2016 Apr;24(4):589-92. doi: 10.1016/j.joca.2015.11.002. Epub 2015 Nov 10. PubMed PMID: 26564575.
- Selten EMH, Vriezekolk JE, Nijhof MW, et al. Barriers Impeding the Use of Non-pharmacological, Non-surgical Care in Hip and Knee Osteoarthritis: The Views of General Practitioners, Physical Therapists, and Medical Specialists. J Clin Rheumatol. 2017 ;23(8):405-410. doi: 10.1097/RHU.0000000000000562. PubMed PMID: 28926466.
- Skou ST, Roos EM, Laursen MB, et al. A Randomized, Controlled Trial of Total Knee Replacement. N Engl J Med. 2015 Oct 22;373(17):1597-606. doi: 10.1056/NEJMoa1505467. PubMed PMID: 26488691.
- Smink AJ, Bierma-Zeinstra SM, Dekker J, et al. Agreement of general practitioners with the guideline-based stepped-care strategy for patients with osteoarthritis of the hip or knee: a cross-sectional study. BMC Fam Pract. 2013 Mar 11;14:33. doi: 10.1186/1471-2296-14-33. PubMed PMID: 23497253; PubMed Central PMCID: PMC3602050.
- Staatsblad (2017). Besluit van 14 september 2017, houdende wijziging van het Besluit zorgverzekering in verband met het zorgpakket Zvw 2018. Link: https://zoek.officielebekendmakingen.nl/stb-2017-349.html (geraadpleegd 8 dec 2017)
- Stener-Victorin E, Kruse-Smidje C, Jung K. Comparison between electro-acupuncture and hydrotherapy, both in combination with patient education and patient education alone, on the symptomatic treatment of osteoarthritis of the hip. Clin J Pain. 2004 May-;20(3):179-85. PubMed PMID: 15100594.
- Svege I, Nordsletten L, Fernandes L, et al. Exercise therapy may postpone total hip replacement surgery in patients with hip osteoarthritis: a long-term follow-up of a randomised trial. Ann Rheum Dis. 2015 ;74(1):164-9. Doi: 10.1136/annrheumdis-2013-203628. Epub 2013 Nov 19. PubMed PMID: 24255546.
- Tan SS, Teirlinck CH, Dekker J, et al. Cost-utility of exercise therapy in patients with hip osteoarthritis in primary care. Osteoarthritis Cartilage. 2016 ;24(4):581-8. doi: 10.1016/j.joca.2015.11.010. Epub 2015 Nov 24. PubMed PMID: 26620092.
- Teirlinck CH, Luijsterburg PA, Dekker J, et al. Effectiveness of exercise therapy added to general practitioner care in patients with hip osteoarthritis: a pragmatic randomized controlled trial. Osteoarthritis Cartilage. 2016 ;24(1):82-90. doi: 10.1016/j.joca.2015.07.023. Epub 2015 Aug 5. PubMed PMID: 26254237.
- Tubach F, Ravaud P, Martin-Mola E, et al. Minimum clinically important improvement and patient acceptable symptom state in pain and function in rheumatoid arthritis, ankylosing spondylitis, chronic back pain, hand osteoarthritis, and hip and knee osteoarthritis: Results from a prospective multinational study. Arthritis Care Res (Hoboken). 2012 ;64(11):1699-707. doi: 10.1002/acr.21747. PubMed PMID: 22674853.
- Verhagen AP, Reijneveld-van de Vendel E, Teirlinck CH., et al. Bierma-Zeinstra SMA (2016). Effectiviteit oefentherapie voor patiënten met heup- of knieartrose. Eindrapport voor het Zorginstituut Nederland. In: 'Fysio- en oefentherapie bij artrose aan heup en knie, reumatoïde artritis en spondyloartritis en radiculair syndroom (hernia) met motorische uitval' (pagina 91-258). Zorginstituut Nederland. Link: https://www.zorginstituutnederland.nl/publicaties/adviezen/2017/03/13/fysio--en-oefentherapie-bij-artrose-aan-heup-en-knie-reumatoide-artritis-en-spondyloartritis-en-radiculair-syndroom-hernia-met-motorische-uitval (geraadpleegd 31 mei 2018).
- Vijgen SMC, et al. (2017). Systematische review van economische evaluaties van oefentherapie bij knie en heupartrose. Ten behoeve van de herziening van de klinische richtlijn. (zie bijlage-1)
- Wandel S, Jüni P, Tendal B, et al. Effects of glucosamine, chondroitin, or placebo in patients with osteoarthritis of hip or knee: network meta-analysis. BMJ. 2010 Sep 16;341:c4675. doi: 10.1136/bmj.c4675. Review. PubMed PMID: 20847017
- ZiN (2017). Budget Impact Analyse: oefentherapie bij heup- en knieartrose. In: 'Fysio- en oefentherapie bij artrose aan heup en knie, reumatoïde artritis en spondyloartritis en radiculair syndroom (hernia) met motorische uitval' (pagina 512-522). Zorginstituut Nederland. Link: https://www.zorginstituutnederland.nl/publicaties/adviezen/2017/03/13/fysio--en-oefentherapie-bij-artrose-aan-heup-en-knie-reumatoide-artritis-en-spondyloartritis-en-radiculair-syndroom-hernia-met-motorische-uitval (geraadpleegd 31 mei 2018).
Evidence tabellen
Voor evidencetabellen en risk-of-biastabellen zie de systematische reviews van Verhagen (2016) en Vijgen (2017; zie aanverwante producten).
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 19-11-2018
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep in stand gehouden. Uiterlijk in 2024 bepaalt het bestuur van de Nederlandse Orthopaedische Vereniging (NOV) of deze richtlijn (module) nog actueel is. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NOV is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Diagnostiek heup- of knieartrose |
NOV |
2019 |
2021 |
eens in twee jaar |
NOV |
beschikbaarheid nieuwe criteria voor vroeg diagnostiek |
|
Zelfmanagement educatie en informatie |
NOV |
2019 |
2024 |
eens in de vijf jaar |
NOV, NHG, NVR, VRA, KNGF |
Lopend onderzoek, beschikbaarheid nieuwe interventies |
|
submodule Gewichtsverlies |
NOV |
2019 |
2024 |
Eens in de vijf jaar |
NOV, NHG |
Onderzoek naar effectiviteit van gewichtsverlies |
|
Oefentherapie bij heup- of knieartrose |
NOV |
2019 |
2024 |
eens in vijf jaar |
(NOV en KNGF of de werkgroep) |
lopend onderzoek |
|
Pijnmedicatie |
NOV |
2019 |
2024 |
eens in de vijf jaar |
NOV |
Lopend onderzoek, beschikbaarheid nieuwe middelen |
|
Intra-articulaire injecties |
NOV |
2019 |
2024 |
eens in de vijf jaar |
NOV |
Lopend onderzoek, beschikbaarheid nieuwe middelen |
|
Knie kniebraces en orheses |
NOV |
2019 |
2024 |
eens in de vijf jaar |
NOV |
Lopend onderzoek, beschikbaarheid nieuwe middelen |
|
Beleid bij specifieke subgroepen |
NOV |
2019 |
2024 |
eens in de vijf jaar |
NOV |
Lopend onderzoek |
|
Geïntegreerd beleid |
NOV |
2019 |
2024 |
eens in de vjif jaar |
NOV |
Lopend onderzoek, transmuraal overleg |
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
*De KNMP geeft de richtlijn 'bestuurlijke ondersteuning'
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). Patiëntenparticipatie bij deze richtlijn werd mede gefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
Doel en doelgroep
Doel
Doel is een multidisciplinaire richtlijn voor de conservatieve behandeling van heup- en knieartrose. De richtlijn beoogt een leidraad te geven voor de dagelijkse zorgpraktijk bij patiënten met artrose aan heup of knie, in eerste en tweede lijn. In de conclusies wordt aangegeven wat de wetenschappelijke stand van zaken is. De aanbevelingen zijn gericht op optimaal medisch handelen en zijn gebaseerd op de resultaten van wetenschappelijk onderzoek en overwegingen van de werkgroep, waarbij voor zover mogelijk de inbreng door patiënten is meegenomen (patiënten perspectief). Het doel is een hogere kwaliteit en meer uniformiteit in behandelingsstrategie, en het verminderen van praktijkvariatie. Daarvoor zijn duidelijke verwijscriteria van eerste naar tweede lijn noodzakelijk. Doel van de richtlijn is met name ook het verminderen van pijn en verbeteren van de gewrichtsfunctie door optimalisatie van de zorg. Het identificeren van kennislacunes zal richting kunnen geven aan nieuw wetenschappelijk onderzoek en nieuwe ontwikkelingen. Tot slot is naar aanleiding van de noodzaak tot beheersing van de verdere groei van kosten in de gezondheidzorg aandacht besteed aan kosten en kosteneffectiviteit.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg en patiëntvoorlichting voor patiënten met (verdenking op) artrose aan heup of knie: orthopedisch chirurgen, reumatologen, radiologen, revalidatieartsen, apothekers, fysiotherapeuten, oefentherapeuten Cesar of Mensendieck*, ergotherapeuten, huisartsen, klinisch geriaters, specialisten ouderengeneeskunde, anesthesiologen, sportartsen, arbo-artsen en bedrijfsartsen, en bijvoorbeeld ook alle artsen (niet) in opleiding voor huisarts en genoemde specialisten, en verpleegkundig specialisten en de physician assistants op dit gebied.
*waar oefentherapeut staat in de rest van het document wordt bedoeld oefentherapeut Cesar of Mensendieck
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2015 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van relevante specialismen die betrokken zijn bij de zorg voor personen met artrose aan heup of knie.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende drie jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- A.A. Polak, orthopedisch chirurg, Sint Franciscus Gasthuis, Rotterdam (voorzitter); Nederlandse Orthopaedische Vereniging;
- Prof. dr. S.M.A. Bierma-Zeinstra, hoogleraar Artrose, afdeling Huisartsgeneeskunde en Orthopedie, Erasmus MC, Universitair Medisch Centrum, Rotterdam; Nederlandse Orthopaedische Vereniging;
- J. Hoogmoed, klinisch geriater, SJG Weert, Weert; Nederlandse Vereniging voor Klinische Geriatrie;
- H. Jessen, NVA, anesthesioloog/ pijnspecialist, Kliniek ViaSana, Mill; Nederlandse Vereniging voor Anesthesiologie (mandaat tot 1 november 2017);
- J.W. Kallewaard, anesthesioloog/ pijnspecialist, Rijnstate Arnhem, AMC Amsterdam; Nederlandse Vereniging voor Anesthesiologie (mandaat vanaf 1 augustus 2018);
- L. Elzinga, anesthesioloog/ pijnspecialist, Bravis Ziekenhuis Roosendaal, Roosendaal; Nederlandse Vereniging voor Anesthesiologie (mandaat vanaf 1 augustus 2018);
- Prof. dr. G. Kloppenburg, reumatoloog, Leids Universitair Medisch Centrum LUMC, Leiden; Nederlandse Vereniging van Reumatologie;
- J.S. van der Kraan, patiëntvertegenwoordiger, beleidsmedewerker Patiëntenfederatie Nederland, Utrecht; Patiëntenfederatie Nederland;
- Dr. E.H.G. Oei, radioloog, Erasmus MC, Universitair Medisch Centrum, Rotterdam; Nederlandse Vereniging voor Radiologie;
- S. Spruijt, orthopedisch chirurg, HagaZiekenhuis, Den Haag; Nederlandse Orthopaedische Vereniging;
- Prof. dr. T.P.M. Vliet Vlieland, Leids Universitair Medisch Centrum LUMC, Leiden; Koninklijk Nederlands Genootschap voor Fysiotherapie;
- C.M.J. Wildervanck-Dekker, huisarts en kaderarts bewegingsapparaat, Julius Gezondheidscentrum Leidsche Rijn, De Meern; Nederlands Huisartsen Genootschap (mandaat tot 1 juni 2018);
- Dr. T. Kuijpers, epidemioloog, senior wetenschappelijk medewerker Nederlands Huisartsen Genootschap, Utrecht; Nederlands Huisartsen Genootschap (mandaat vanaf 1 juni 2018).
Klankbordgroep
- R. Hebing, poliklinisch apotheker, Apotheek Reade, Amsterdam; Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie; Nederlandse Vereniging van ZiekenhuisApothekers;
- T. Mesman, ergotherapeut, Revalidatie Centrum Reade, Amsterdam; Ergotherapie Nederland;
- Dr. L.A.M. Elders, bedrijfsarts, ConsuloBV, Rotterdam; Nederlandse Vereniging voor Arbeids- en Bedrijfsgeneeskunde;
- Dr. A.M. Boonstra, revalidatiearts, Revalidatie Friesland, Beetsterzwaag; Nederlandse Vereniging van Revalidatieartsen;
- M. Post, beleidsmedewerker Ontwikkeling & Wetenschap VvOCM, Utrecht; Vereniging van Oefentherapeuten Cesar en Mensendieck.
Met ondersteuning van
- Dr. K.N.J. Burger, epidemioloog, senior adviseur Kennisinstituut Federatie van Medisch Specialisten;
- Dr. J.S. Boschman, adviseur Kennisinstituut Federatie van Medisch Specialisten;
- Dr. M.L. Molag, adviseur Kennisinstituut Federatie van Medisch Specialisten;
- E.A. Rake (MSc), junior adviseur Kennisinstituut Federatie van Medisch Specialisten;
- M.S. Oerbekke, adviseur Kennisinstituut Federatie van Medisch Specialisten;
- M. Wessels (MSc), medisch informatiespecialist, Kennisinstituut Federatie van Medisch Specialisten;
- N.F. Bullock, secretaresse, Kennisinstituut Federatie van Medisch Specialisten.
Met dank aan
- Dr A.P. Verhagen, fysiotherapeut en klinisch epidemioloog, Erasmus MC, Universitair Medisch Centrum, Rotterdam (voor het ter beschikking stellen van meta-analystische data).
Belangenverklaringen
De KNMG-Code “Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling” is gevolgd (KNAW 2016). Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventueel belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Polak (voorzitter) |
orthopedisch chirurg |
geen |
werkzaam in SFG ziekenhuis, lid v/d coöperatie met de persoonlijke BV Polak Beheer BV |
geen |
|
Bierma-Zeinstra |
Hoogleraar aan het Erasmus MC (onderzoek) |
geen |
lid van de internationale OARSI richtlijn commissie voor behandeling van artrose, lid van ARUK klinische studies commissie en van de wetenschappelijke commissie van het Annafonds, associate editor van Osteoarthritis & Cartilage, lid van de editorial board van Maturitas, en lid van de scientific advisory board van het Arthritis UK Pain Centre in Nottingham. Mede verantwoordelijk voor organisatie en inhoud van de tweejarige NHG erkende kaderopleiding voor huisartsen "Kaderhuisarts bewegingsapparaat". Op mijn onderzoeksafdeling ontvingen wij voor artrose onderzoek gedurende de ontwikkeling van de richtlijn (2015-2018) subsidies van het reumafonds (Dutch Arthritis Foundation), ZonMW, EU FP 7, het fonds NutsOhra, CZ, en ZonMW. Het betreft de volgende studies: Intramuscular corticosteroid injections in hip OA: a randomized controlled trial. Dutch Arthritis Foundation; Optimizing the management of osteoarthritis and other chronic musculoskeletal pain disorders in primary care. Dutch Arthritis Foundation, Long-term Program; Cost-effectiveness of viscosupplementation therapy for patients with osteoarthritis of the knee: a randomized clinical trial. ZonMW; Health Care Efficiency Research Programme: sub-programme Effects & Costs; D-board (Novel Diagnostics and Biomarkers for Early Identification of Chronic Inflammatory Joint Diseases) EU-FP7 Health; Dutch consortium ARGON. Optimal timing for osteoarthritis surgery. NOV/Dutch Arthritis Foundation; Duloxetine for chronic osteoarthritis pain; an important alternative? ZonMW; Rational Pharmacotherapy programme; Diagnostic criteria for early osteoarthritis of hip and knee. Dutch Arthritis Foundation; Joint implementation of guidelines for osteoarthritis in Western Europe: JIGSAW-E (first applicant Krysia Diedzics, UK). EIT Health (European Union); IFEROA- Identification of the female specific etiology and risk groups for osteoarthritis; Intramuscular corticosteroid injections in hip OA: a randomized controlled trial. Nuts Ohra; Is MRI of the knee cost-effective in patients with traumatic knee complaints in primary care? (first applicant P. Luijsterburg) ZonMW; Health Care Efficiency Research Programme: sub-programme Effects & Costs (K€ 616); Cost-effectiveness of two treatment strategies of an anterior cruciate ligament rupture. A randomized clinical study. ZonMW; Health Care Efficiency Research Programme: sub-programme Effects & Costs; Should a traumatic meniscal tear be resected? (first applicant M. Reijman) ZonMW; sub-programme Effects & Costs (K€ 400); Shock wave therapy for ankle arthrodesis (first applicant D. Meuffels). Dutch Arthritis Foundation; Like-2-Run (first applicant M. van Middelkoop) ZonMw Sport en Bewegen (K€ 157); Growing up: the influence of lifestyle on joint health (first applicant M. Van Middelkoop). EUR-fellowship; Effectiveness in knee osteoarthritis of an intra-articular corticosteroid injection versus an intra-muscular gluteal corticosteroid injection versus no injection in general practice: a multicenter randomized, 24 weeks comparative parallel-group trial. ZonMW Programme Primary Focus; PaTIO study: PhysiotherApeutic Treat-to-target Intervention after Orthopaedic surgery; A cost-effectiveness study. ZonMW/NOV Zorgevaluatie Leading the Change; Evaluation of care for patients with hip and knee osteoarthritis on the cross-road of primary and secondary care. CZ Health Insurance; The OA Trial Bank. Dutch Arthritis Foundation. Consultant op uurbasis (betaald aan mijn werkgever Erasmus MC) voor Infirst Healthcare ltd in de UK. Binnen dit consultancy chief investigator voor de "Flare study", a Three Arm Double blind, Randomised Multicentre Study to Investigate the Non-Inferiority of a Soft Gel Capsule of Ibuprofen Lipid Formulation (total daily dose 1200 mg) versus a Standard Soft Gel Ibuprofen Capsule (total daily dose 1200 mg and 2400 mg) in the Treatment of Patients with Episodic Knee Arthralgia/Flaring Knee Pain; eenmalig consultant geweest voor Regeneron met betrekking tot welke baseline variablelen in studies bepaald moeten worden voor het vaststellen van responsieve subgroepen bij gebruik van anti-NGF. |
was beoogd als voorzitter maar in overleg is besloten om een andere voorzitter te benoemen om zo elke schijn van belangenverstrengeling te voorkomen; om dezelfde reden geen voortrekker of meelezer op de pijnmedicatie vraag. Omdat de nieuwe pijnstiller (Soft Gel Capsule of Ibuprofen) niet verkrijgbaar is op de Nederlandse markt en geen onderdeel vormt van de richtlijnmodule, was deelname aan de besluitvorming wel mogelijk. |
|
Spruijt |
Orthopaedisch chirurg, Maartenskliniek Woerden/Nijmegen (tot 1 septemeber 2017). Orthopaedisch chirurg HagaZiekenhuis Den Haag (per 1 september 2017). |
geen |
Met Spruijt Praktijk o.a. lid Medisch Specialisten Coöperatief Haga; Consultant Zimmer Biomet (presentaties, cursussen, scholing); In de afgelopen jaren zijn er 2 RCTs in ons ziekenhuis gedaan waarbij kniedistractie vergeleken werd met tibiakop-osteotomie en kniedistractie met knieprothesiologie (financiering door ZonMw) |
geen |
|
Oei |
Musculoskeletaal radioloog, Erasmus MC Rotterdam; Unviversitair docent musculoskeletale beeldvorming, Erasmus MC Rotterdam/ Erasmus Universiteit Rotterdam |
geen |
geen |
geen |
|
Wildervanck-Dekker |
huisarts, kaderarts bewegings-apparaat/ intern consulent beweging-sapparaat Leidsche Rijn Julius Gezondheidscentra |
geen |
geen |
geen |
|
Kuijpers |
Epidemioloog, senior wetenschappelijk medewerker Nederlands Huisartsen Genootschap |
geen |
geen |
geen |
|
Vliet Vlieland |
Hoogleraar Doelmatigheid Revalidatie-processen/ Fysiotherapie, LUMC; Adviseur en Coordinator Wetenschappelijk Onderzoek Sophia Revalidatie Den Haag en Rijnlands Revalidatie Centrum Leiden |
geen |
Bijzonder Hoogleraar vanwege het KNGF bij LUMC; Betrokkenheid bij relevante, lopende onderzoeken: Zorgnetwerken voor mensen met reumatische aandoeningen in Nederland, Vliet Vlieland (hoofdaanvrager/penvoerder) van den Ende (mede-aanvrager), Dekker (Mede-aanvrager), Subsidiegever: ReumaNederland; De-implementation of blood saving maesures in hip and knee arthroplasties, aanvrager: L. van Bodegom-Vos, P. Marang-van de Mheen, T. Vliet Vlieland, R. Nelissen, Subsidiegever: ZonMw |
geen |
|
Jessen |
Anesthesioloog/ pijnbehandelaar |
geen neven-werkzaamheden; extramurale tandheelkundige behandeling onder narcose als onderdeel van anesthesioloog |
Aandeel in kliniek SanaVisie betreft ZBC voor plastische en cosmetische chirurgie; werkzaam in kliniek VraSana betreft ZBC voor orthopedische, neurochirurgische behandelingen |
geen |
|
Elzinga |
Anesthesioloog-Pijnspecialist Bravis Ziekenhuis Roosendaal |
lid Bestuur Sectie Pijn en Palliatieve geneeskunde NVA (reiskostenbasis) |
geen |
geen |
|
Kallewaard |
Anesthesioloog pijnbestrijder Rijnstate (70%) en AMC (30%) |
voorzitter Sectie Pijn- en Palliatieve geneeskunde NVA; voorzitter BBC NVA (onbetaald) |
geen |
geen |
|
Kloppenburg |
hoogleraar medisch specialist, reumatoloog |
Lid Commissie Medische Ethiek (2011-2016); vergoeding wordt betaald aan de afd. Reumatologie, LUMC; Associate editor "Arthritis Rheumatism" (2010-2015); Associate editor "Arthritis Rheumatism" (2010-2015) |
Alle financiële vergoedingen zijn betaald aan het Leids Universitair Medisch Centrum: Consultancy EMD Serono Research & Development Institute (10-2016–2-2017) betreffende "DMOAD development in osteoarthritis"; Lid Advisory boards voor Abbvie (2016), GlaxoSmithKline (2016, 2017, 2018), Levicept (2016) betreffende artrose. Lid advisory board voor Pfizer (2018) "Tanezumab osteoarthritis global panel meeting". Author UptoDate "Management of hand osteoarthritis"(2017); Medevoorzitter van werkgroep voor Revisie van Clinical Trial richtlijnen voor handartrose op initiatief van OARS) (2013-2015); Voorzitter Programma Commissie voor jaarlijks congres OARSI (2015); Lid Task Force EULAR "EULAR Recommendations for the use of imaging in OA clinical practice" (2014-2015); Concilium Rheumatologicum voor Nederlandse Vereniging Reumatologie (NVR) (2013-heden); Lid Centrale Visitatiecommissie, NVR (2013-heden); Programma Commissie EULAR (2014-2017); Werkgroep Handartrose OMERACT; Lid Abstract Review Commissie "American College of Rheumatology" (2014, 2015); Lezing ter nascholing van Nederlandse Reumatologen (ACR Review 2015), gesponsord door Pfizer (vergoeding betaald aan LUMC); Lid Advisory Board "Nature Review Rheumatology" (start 2015); Lid Board of Directors OARSI (2017-heden); Lid werkgroep "Kennisagenda Reumatologie" voor NVR; Lid Health Care Professionals Working Party van de European Medicines Agency (EMA) namens de EULAR (start 2018); Alle grants zijn uit betaald aan het LUMC: Grant van European League Against Rheumatism (EULAR) voor "Development of Classifiction Criteria for Hand Osteoarthritis"; Grant van EULAR voor "2018 Update of the EULAR Recommendations for the Management of Hand Osteoarthritis"; Grant van Reumafonds voor "Randomized placebo-controlled trail with prednisolone in hand Osteoarthritis: a proof-of-concept study" (2015-2018); Langlopende ondersteuning van ReumaNederland voor artroseonderzoek (2013-2023); Grant van Europese Unie (IMI-EFPIA project Approach, start 2015); Grants van Pfizer voor onderzoek naar etanercept in handartrose (2008-2015); Principal Investigator Nederland van industrie geinitieerde klinische trials (Abbvie) naar effectiviteit en veiligheid van Lutikizumab bij knie- en handartrose |
nevenfuncties en belangen zijn besproken in de werkgroep in het licht van de geprioriteerde uitgangsvragen en besloten is dat er geen actie hoeft te worden ondernomen (adviezen zijn niet beperkt tot een bedrijf maar verstrekt aan een aantal elkaar beconcurrerende bedrijven; richtlijn bevat geen uitgangsvragen m.b.t. LEVI, tanezumab, lutikizumab of prednisolon); geen trekker op medicamenteuze uitgangsvragen. |
|
Hoogmoed |
klinisch geriater |
geen |
geen |
geen |
|
v/d Kraan |
beleidsmedewerker Patiëntenfederatie Nederland |
geen |
geen |
geen |
|
Hebing |
poliklinisch apotheker Apotheek Reade en onderzoeker Reade Research, reumatologie |
klankbord specialisme Vereniging van Jonge Apothekers (belangenbehartiging jonge apothekers in opleiding tot openbaar apotheker specialist, aanspreekpunt vervolgopleiding, kwaliteitsmonitoring vervolgopleiding; onbetaald); Lid Centraal College KNMP (lid namens Apothekers in opleiding tot specialist; betaald), SIG biotechnologie NVZA, OMERACT werkgroep (onbetaald) |
geen |
geen |
|
Mesman |
ergotherapeut/ handtherapeut Reade binnen artrose team Reumarevalidatie |
geen |
geen |
geen |
|
Elders |
Bedrijfsarts Ministerie van Binnenlandse Zaken en Koninkrijkrelaties/ P-Direkt Klinische Arbeids-geneeskundige Rijndam Revalidatie-centrum/ Arbeidsrevalidatie |
Functie bedrijfsarts: beoordelen en begeleiden van werknemers bij het Ministerie afdeling P-Direkt, tevens werkzaam als arts-gemachtigde voor vele Ministeries en Departementen van de Rijksoverheid |
voorzitter van de Nederlandse Vereniging voor Klinische arbeidsgeneeskunde |
|
|
Boonstra |
Revalidatiearts Revalidatie Friesland OCA |
voorzitter cie. Kwaliteit VRA |
geen |
geen |
|
Post |
Beleidsmedewerker ontwikkeling & wetenschap VvOCM |
geen |
afgevaardigde namens VvOCM in het PON (Partnerschap Overgewicht Nederland) |
geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afvaardiging van Patiëntenfederatie Nederland in de werkgroep en een tweetal focusgroepen georganiseerd door Patiëntenfederatie Nederland (aanverwant ‘Samenvatting focusgroepen artrose’). Daarnaast is er in de oriënterende fase gezocht naar literatuur vanuit patiëntenperspectief, hierbij is gebruik gemaakt van een gestandaardiseerd zoekfilter (Wessels 2016). ReumaNederland, de Poly-Artrose Lotgenoten Vereniging en de Nationale Vereniging ReumaZorg Nederland zijn gevraagd om knelpunten aan te leveren, en de conceptrichtlijn is voor commentaar voorgelegd aan genoemde patiëntenverenigingen.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Voor deze richtlijn zijn geen interne kwaliteitsindicatoren ontwikkeld (zie Indicatorontwikkeling onder Werkwijze).
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen via een invitational conference door:
Ergotherapie Nederland (EN), Bijwerkingencentrum Lareb, Nefemed, Nederlands Huisartsen Genootschap (NHG), Patiëntenfederatie Nederland, Nederlandse Vereniging voor Arbeids- en Bedrijfsgeneeskunde (NVAB), Nederlandse Vereniging van Reumatologie (NVR), Nederlandse Vereniging van ZiekenhuisApothekers (NVZA), Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie (KNMP), ReumaNederland, Poly-Artrose Lotgenoten Vereniging, Nationale Vereniging ReumaZorg Nederland, Zorginstituut Nederland (ZIN), Zelfstandige Klinieken Nederland (ZKN), Nederlandse Orthopaedische Vereniging (NOV), Zorgverzekeraars Nederland (ZN). Daarnaast is de Nederlandse Vereniging van Revalidatieartsen (VRA) benaderd voor een schriftelijke knelpuntanalyse op basis van het conceptraamwerk en de conceptnotulen van de invitational conference. Een verslag van de invitational conference met toelichting van de richtlijnwerkgroep is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen (Guideline International Network), systematische reviews (Medline (OVID), Cochrane Library), en literatuur over patiëntenvoorkeuren en patiëntrelevante uitkomstmaten (patiëntenperspectief; Medline (OVID)). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of bias (ROB) tabellen.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is i.p.v. ‘matig’
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz 2017).
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Bij de richtlijnontwikkeling is ervoor gekozen om organisatie van zorg aspecten expliciet bij de afzonderlijke modules/ uitgangsvragen te behandelen, met name in de module ‘Zelfmanagement, educatie en informatie’, de module ‘Beleid bij specifieke subgroepen’, en de module ‘Geïntegreerd beleid’; daarom is geen aparte module Randvoorwaarden (organisatie van zorg) opgenomen.
Indicatorontwikkeling
Voor deze richtlijn zijn geen interne kwaliteitsindicatoren ontwikkeld omdat naar inschatting van de werkgroep, het meten van relevante indicatoren (percentage patiënten dat terecht door huisarts naar orthopeed wordt verwezen, percentage patiënten dat terecht een gewrichtsvervanging ondergaat, percentage patiënten waarvoor de huisarts terecht röntgenonderzoek laat doen bij het stellen van de diagnose artrose) op grote praktische problemen zal stuiten. In alle gevallen zou moeten worden bepaald of er sprake is van een terechte of onterechte verwijzing en dit veronderstelt een strikte definitie van de onderliggende criteria en een adequate verslaglegging in EPD of patiëntendossier. Een strikte definitie voor het volledig doorlopen van een conservatieve (stepped-care) behandeling is niet mogelijk omdat de stepped-care behandeling op de individuele patiënt moet worden afgestemd. Beoordeling of er sprake is van een terechte afwijking van een strikte stepped-care behandeling vereist een uitvoerige en systematische verslaglegging van behandeling en onderliggende argumenten in het patiëntendossier die momenteel niet haalbaar is in de klinische praktijk. Door het ontbreken van eenduidige criteria zou zo'n beoordeling ook willekeurig zijn en weinig transparant. De werkgroep is van mening dat andere maatregelen ter bevordering van implementatie zinvoller zijn, en onderstreept de noodzaak om landelijke transmurale afspraken te maken in een apart traject met een brede werkgroep waarin alle stakeholders zijn vertegenwoordigd. Daarnaast is de werkgroep van mening dat er methodes moeten worden ontwikkeld om het conservatieve zorgtraject (stepped-care) goed en efficiënt in het EPD van de huisarts te registreren zoals de Joint Implementation of Guidelines for Osteroarthritis in Western Europe (JIGSAW-E) e-template (link: https://www.eithealth.eu/jigsaw-e). Wellicht kan aan zo'n registratie-template een diagnostische component worden toegevoegd zodat op eenvoudige en efficiënte wijze inzichtelijk kan worden gemaakt waarom röntgenfoto’s worden aangevraagd door de huisarts. Een analyse van de kwaliteit van de verslaglegging met behulp van registratie-templates in de klinische praktijk biedt in de toekomst mogelijk wel aanknopingspunten voor indicatoren.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk onderzoek van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder Aanverwante items).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. Daarnaast werden de volgende verenigingen en organisaties benaderd voor commentaar: Vereniging voor Sportgeneeskunde (VSG), Bijwerkingencentrum Lareb, ReumaNederland, Poly-Artrose Lotgenoten Vereniging (P-AL), Nationale Vereniging ReumaZorg Nederland, Zorginstituut Nederland (ZIN), Zelfstandige Klinieken Nederland (ZKN), Nederlandse Federatie van Universitair Medische Centra (NFU), Nederlandse Vereniging van Ziekenhuizen (NVZ), Samenwerkende Topklinische opleidingsZiekenhuizen (STZ), Zorgverzekeraars Nederland (ZN), Inspectie Gezondheidszorg en Jeugd (IGJ), Nederlandse Zorgautoriteit (NZa), Vereniging Innovatieve Geneesmiddelen (Nefarma), en Nefemed. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al.; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Hultcrantz M, Rind D, Akl EA, et al. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184.
KNAW, KNMG, GR, NHG, FMS (2016). Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling. Link: https://storage.knaw.nl/2022-08/Gedragscode-belangenverstrengeling-januari-2017.pdf
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. Link: http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al, editors. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008 17;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 ;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
Zoekverantwoording
Deelvraag-1 (opmerking: de literatuuranalyse is niet gebaseerd op deze zoekactie, maar heeft gebruik gemaakt van een systematische review uitgevoerd in opdracht van het Zorginstituut [Verhagen 2016] die een eigen zoekstrategie heeft gehanteerd).
|
Database |
Zoektermen Zoekstrategie gebaseerd op Cochrane Reviews Fransen (CD007912 en CD004376, 2013) |
Totaal |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Medline (OVID)
2013-mrt 2016
zoekdatum: 3 maart 2016
Engels |
1 exp osteoarthritis/ (48327) 2 (osteoarthriti* or osteo-arthriti* or osteoarthrotic or osteoarthros*).ti,ab. (46861) 3 (degenerative adj2 arthritis).ti,ab. (1221) 4 coxarthro*.ti,ab. (1530) 5 gonarthro*.ti,ab. (960) 6 1 or 2 or 3 or 4 or 5 (66260) 13 Knee/ or exp Knee Joint/ or knee$.tw. or Hip/ or exp Hip Joint/ or hip$.tw. (364547) 14 6 and 13 (33865) 15 (exertion* or exercis* or sport* or ((physical or motion) adj5 (fitness or therap*)) or (physical* adj2 endur*) or ((strength* or isometric* or isotonic* or isokinetic* or aerobic* or endurance or weight*) adj5 (exercis* or train*))).tw. (298932) 16 physical therapy modalities/ or exp animal assisted therapy/ or exp electric stimulation therapy/ or exp exercise movement techniques/ or exp exercise therapy/ (exp physical therapy modalities lijkt me te breed) (131170) 17 (physiotherap* or kinesiotherap* or (skate* or skating) or run* or jog* or treadmill* or swim* or bicycl* or (cycle* or cycling) or walk* or (row or rows or rowing) or muscle strength*).tw. (771928) 18 15 or 16 or 17 (1084506) 19 14 and 18 (5406) 20 limit 19 to (english language and yr="2013 -Current") (1507) 21 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (259980) 22 20 and 21 (126) – 125 uniek 23 (randomized controlled trial/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or randomized controlled trial.pt. or random*.ti,ab. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (956201) 24 20 and 23 (445) 25 24 not 22 (382) – 374 uniek |
566 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Cinahl |
|
|
Deelvraag-2 kosteneffectiviteit (Vijgen 2017)
|
Database |
Zoektermen |
Totaal |
|
Medline
2010-sept 2016
zoekdatum: 30 sept 2016
Engels |
1 exp osteoarthritis/ (49432) 2 (osteoarthriti* or osteo-arthriti* or osteoarthrotic or osteoarthros*).ti,ab. (48276) 3 (degenerative adj2 arthritis).ti,ab. (1231) 4 coxarthro*.ti,ab. (1535) 5 gonarthro*.ti,ab. (966) 6 1 or 2 or 3 or 4 or 5 (67911) 7 Exercise for osteoarthritis of the knee: a Cochrane systematic review.m_titl. (1) 8 Physiotherapy management of hip osteoarthritis.m_titl. (2) 9 Exercise for osteoarthritis of the hip.m_titl. (4) 10 "High-intensity versus low-intensity physical activity or exercise in people with hip or knee osteoarthritis".m_titl. (1) 11 "Effectiveness of exercise therapy added to general practitioner care in patients with hip osteoarthritis: a pragmatic randomized controlled trial.".m_titl. (1) 12 7 or 8 or 9 or 10 or 11 (9) 13 Knee/ or exp Knee Joint/ or knee$.tw. or Hip/ or exp Hip Joint/ or hip$.tw. (372573) 14 6 and 13 (34907) 15 (exertion* or exercis* or sport* or ((physical or motion) adj5 (fitness or therap*)) or (physical* adj2 endur*) or ((strength* or isometric* or isotonic* or isokinetic* or aerobic* or endurance or weight*) adj5 (exercis* or train*))).tw. (305119) 16 physical therapy modalities/ or exp animal assisted therapy/ or exp electric stimulation therapy/ or exp exercise movement techniques/ or exp exercise therapy/ (exp physical therapy modalities lijkt me te breed) (133648) 17 (physiotherap* or kinesiotherap* or (skate* or skating) or run* or jog* or treadmill* or swim* or bicycl* or (cycle* or cycling) or walk* or (row or rows or rowing) or muscle strength*).tw. (789351) 18 15 or 16 or 17 (1107944) 19 14 and 18 (5609) 20 limit 19 to (english language and yr="2010 -Current") (2807) 26 ((exp Economics/ or Economics.fs. or Quality-Adjusted Life Years/ or Markov Chains/ or Decision Trees/ or (economic* or pharmacoeconomic* or cost or costs or costly or costing or price or prices or pricing or budget* or (expenditure* not energy) or (value adj3 money) or ((benefit* or financ*) adj3 (control* or analy* or minim* or illness* or evaluation* or effectiv* or efficac* or efficien* or impact* or model* or aspect*)) or (decision* adj3 (support* or model* or tree*)) or (cost* adj3 (benefit* or utilit* or medical* or nation* or internation* or hospital* or patient* or saving* or allocat*)) or (health* adj3 (cost* or econom* or expend* or budget*)) or ((health technology or medical technology) adj3 assessment*) or pharmacoeconomic* or qaly* or (quality adjusted adj3 (life year or life years))).ab,ti.) and english.la.) not (letter or news or comment or editorial or congresses or abstracts).pt. (873184) 27 20 and 26 (156) 28 remove duplicates from 27 (154) |
154 |
|
Cochrane HTA en EE |
ID Search #1 (physiotherap* or kinesiotherap* or skate* or skating or run* or jog* or treadmill* or swim* or bicycl* or cycle* or cycling or walk* or row or rowing or muscle strength* or strength* or isometric* or isotonic* or isokinetic*or aerobic* or endurance or weight* or (physical* near/2 endur*) or ((motion or movement) near/5 therap*) or (physical near/5 therap*) or (physical near/5 fitness)):ti,ab #2 (arthrosis or (degenerative near/2 arthritis) or osteoarthr*):ti,ab #3 (hip or knee):ti,ab #4 #2 and #3 #5 (coxarthro* or gonarthro*):ti,ab #6 (#4 or #5) and #1 Publication Year from 2010 to 2016 HTA $, EE 2 (0 uniek) |
0 |
|
Cinahl |
# Query S45 S27 AND S42 S44 S27 AND S42 S43 S27 AND S42 S42 S36 OR S37 OR S38 OR S39 OR S40 OR S41 S41 TI ((economic* OR pharmacoeconomic* OR cost OR costs OR costly OR costing OR price OR prices OR pricing OR budget* OR (expenditure* NOT energy) OR (value N/3 money) OR ((benefit* OR financ*) N/3 (control* OR analy* OR minim* OR illness* OR evaluation* OR effectiv* OR efficac* OR efficien* OR impact* OR model* OR aspect*)) OR (decision* N/3 (support* OR model* OR tree*)) OR (cost* N/3 (benefit* OR utilit* OR medical* OR nation* OR internation* OR hospital* OR patient* OR saving* OR allocat*)) OR (health* N/3 (cost* OR econom* OR expend* OR budget*)) OR (('health technology' OR 'medical technology') N/3 assessment*) OR pharmacoeconomic* OR qaly* OR ('quality adjusted' N/3 ('life year' OR 'life years')))) OR AB ((economic* OR pharmacoeconomic* OR cost OR costs OR costly OR costing OR price OR prices OR pricing OR budget* OR (expenditure* NOT energy) OR (value N/3 money) OR ((benefit* OR financ*) N/3 (control* OR analy* OR minim* OR illness* OR evaluation* OR effectiv* OR efficac* OR efficien* OR impact* OR model* OR aspect*)) OR (decision* N/3 (support* OR model* OR tree*)) OR (cost* N/3 (benefit* OR utilit* OR medical* OR nation* OR internation* OR hospital* OR patient* OR saving* OR allocat*)) OR (health* N/3 (cost* OR econom* OR expend* OR budget*)) OR (('health technology' OR 'medical technology') N/3 assessment*) OR pharmacoeconomic* OR qaly* OR ('quality adjusted' N/3 ('life year' OR 'life years')))) S40 MH "Decision Support Systems, Management") S39 (MH "Quality-Adjusted Life Years") S38 (MH "Cost Benefit Analysis") OR (MH "Cost Control") OR (MH "Health Care Costs") OR (MH "Costs and Cost Analysis") OR (MH "Health Facility Costs") OR (MH "Cost Savings") S37 (MH "Economics") S36 (MH "Economic Aspects of Illness") S35 S27 AND S34 S27 S13 AND S23 S23 S14 OR S15 OR S16 OR S17 OR S18 OR S19 OR S20 OR S21 OR S22 S22 TI ((physiotherap* or kinesiotherap* or (skate* or skating) or run* or jog* or treadmill* or swim* or bicycl* or (cycle* or cycling) or walk* or (row or rows or rowing) or muscle strength*)) OR AB ((physiotherap* or kinesiotherap* or (skate* or skating) or run* or jog* or treadmill* or swim* or bicycl* or (cycle* or cycling) or walk* or (row or rows or rowing) or muscle strength*)) S21 (MH "Physical Therapy") OR (MH "Gait Training+") OR (MH "Therapeutic Exercise") OR (MH "Lower Extremity Exercises") OR (MH "Motion Therapy, Continuous Passive") OR (MH "Muscle Strengthening+") OR (MH "Group Exercise") OR (MH "Closed Kinetic Chain Exercises") OR (MH "Aerobic Exercises+") S20 TI (strength* or isometric* or isotonic* or isokinetic*or aerobic* or endurance or weight*)) OR AB (strength* or isometric* or isotonic* or isokinetic*or aerobic* or endurance or weight*)) S19 TI physical* n2 endur* OR AB physical* n2 endur* S18 TI ((motion or movement) N5 therap*) OR AB ((motion or movement) N5 therap*) S17 TI physical N5 therap* OR AB physical N5 therap* S16 TI physical N5 fitness OR AB physical N5 fitness S15 MH "Exercise Tolerance+") or (MH "Exercise Test+") or (MH "Physical Fitness") or (MH "Sports+") or (MH "Pliability) or (MH "Physical Endurance+") S14 (MH "Exercise+") OR (MH "Exertion+") S13 (S11 OR S12) S12 (MH "Osteoarthritis, Hip") OR (MH "Osteoarthritis, Knee") S11 (S5 AND S10) S10 (S6 OR S7 OR S8 OR S9) S9 TI knee OR AB knee S8 TI hip OR AB hip S7 (MH "Knee") OR (MH "Knee joint") S6 (MH "Hip") OR (MH "Hip Joint) S5 S1 OR S2 OR S3 OR S4 S4 TI arthrosis OR AB arthrosis S3 TI degenerative N2 arthritis OR AB degenerative N2 arthritis S2 TI osteoarthr* OR AB osteoarthr* S1 (MH "Osteoarthritis+") |
68 |
Exclusietabel
zie de systematische reviews van Verhagen (2016) en Vijgen (2017)


