Intra-articulaire injecties
Uitgangsvraag
Wat is de waarde van intra-articulaire injecties bij behandeling van artrose van heup of knie?
Deelvragen
- Wat is de waarde van intra-articulaire corticosteroïdinjecties bij behandeling van artrose van de knie?
- Wat is de waarde van intra-articulaire corticosteroïdinjecties bij behandeling van artrose van de heup?
- Wat is de waarde van intra-articulaire bloedplaatjesinjecties bij de behandeling van artrose van de knie?
- Wat is de waarde van intra-articulaire bloedplaatjesinjecties bij de behandeling van artrose van de heup?
Aanbeveling
Intra-articulaire corticosteroïdinjecties bij knie- en heupartrose
Overweeg intra-articulaire corticosteroïdinjecties voor tijdelijke pijnvermindering bij volwassen personen met symptomatische knie- of heupartrose indien reguliere orale of dermale pijnmedicatie (zie module Pijnmedicatie) niet wenselijk, gecontra-indiceerd of onvoldoende effectief is. De patiënt met veel pijn zal de meeste baat hebben van de intra-articulaire corticosteroïdinjectie.
Let hierbij op de volgende aspecten:
- Beperk het aantal herhaalde intra-articulaire corticosteroïdinjecties tot het hoogstnoodzakelijke en tot maximaal één injectie in de drie maanden.
- Informeer de patiënt over het risico (ongeveer 1/10.000) op een septische gewrichtsinfectie (artritis) en het mogelijke nadelige effect van de corticosteroïdinjectie op het kraakbeen.
- Intra-articulaire injecties in het heupgewricht kunnen alleen uitgevoerd worden onder röntgen- of echogeleiding.
- Houd rekening met contra-indicaties en interacties met andere geneesmiddelen.
- Wijs personen met insulineafhankelijke diabetes op het glucose-verhogende effect van corticosteroïdinjecties.
Geef geen intra-articulaire corticosteroïdinjecties bij patiënten die op de wachtlijst staan voor een gewrichtsvervangende operatie aan het bewuste gewricht.
Geef bij voorkeur geen intra-articulaire corticosteroïdinjecties in de zes maanden voorafgaande aan een gewrichtsvervangende operatie aan het bewuste gewricht.
Intra-articulaire bloedplaatjes (PRP) injecties bij knie- en heupartrose
Geef geen intra-articulaire bloedplaatjes (PRP) injecties bij volwassen personen met symptomatische knie- of heupartrose, tenzij in onderzoeksverband.
Overwegingen
Deelvragen-1 en -2: intra-articulaire corticosteroïdinjecties bij knie-en heupartrose
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De 26 gerandomiseerde studies van de Cochrane review gebruikt in deze richtlijn rapporteerden gemiddeld gunstige effecten 4 tot 6 weken na de interventie van een intra-articulaire (IA) corticosteroïdinjectie ten opzichte van placebo bij artrose van de knie op de uitkomsten pijn en fysiek functioneren; voor pijn zijn deze effecten ook klinisch relevant (Jüni 2015). Kort na de injectie (enkele weken) zijn de effecten het grootst, maar na zes maanden zijn ze verdwenen. De enkele studies die voor de heup aanwezig zijn rapporteerden over het algemeen ook gunstige resultaten op de korte termijn (3 tot 8 weken) voor pijn en fysiek functioneren (McCabe 2016). Er werden niet meer bijwerkingen in de intra-articulaire corticosteroïd groep gevonden in de enkele studies die dit, meestal slechts kwalitatief, rapporteerden. Ook ernstige bijwerkingen werden slechts in enkele studies gerapporteerd en kwamen zeer weinig voor (Jüni 2015; McCabe 2016).
Hoewel er, vooral voor knieartrose, een redelijk aantal gerandomiseerde studies aanwezig is om het effect op pijn en fysiek functioneren van IA-injectie met corticosteroïden te evalueren ten opzichte van placebo injecties, is de kwaliteit van de bewijskracht laag. Dit komt door de nogal variërende resultaten tussen de verschillende studies en de meestal lage kwaliteit van de studies. Voor het betrouwbaar evalueren van bijwerkingen binnen de studies is de bewijskracht zeer laag vanwege de onduidelijke rapportage en het geringe aantal ernstige bijwerkingen (lage statistische power).
In een systematische review en netwerk meta-analyse die verschillende interventies voor behandeling van knieartrose met elkaar vergeleek, zag men dat de meest gerapporteerde bijwerking bij IA injectie therapieën een lokale reactie met pijn en zwelling was die doorgaans verdween na een paar dagen; in studies die deze interventies vergeleken met placebo, waren deze percentages ongeveer gelijk voor de IA corticosteroïdinjecties (7%) en IA-injecties met hyaluronzuur (8%; Bannuru 2015).
De meest gevreesde bijwerking is een septische artritis als gevolg van de IA-injectie; de frequentie van deze bijwerking is echter zo laag dat deze in afzonderlijke kleine studies niet wordt opgepikt. In dezelfde netwerk meta-analyse werd in 29 studies met IA-injectie therapie (3152 patiënten, 9500 IA injecties) specifiek over septische artritis gerapporteerd en vond men slechts 1 septische artritis (in de IA placebogroep; Bannuru 2015). In een eerdere retrospectieve studie werd dit risico op 4,6/100.000 IA injecties geschat Pal (1999).
Er is nog steeds onduidelijkheid over de vraag of het geven van een IA corticosteroïdinjectie in de periode voor een gewrichtsvervanging de kans op een prothese infectie vergroot. Systematische reviews rapporteerden dat de studies tot dusver meestal retrospectief waren met weinig informatie over mogelijke confounders en/of te klein voor voldoende zeggingskracht (Marsland, 2014; Charalambous, 2014, Pereira 2016). Recent zijn er echter grote retrospectieve studies beschikbaar gekomen. In een retrospectieve studie van bijna 38.000 totale heupoperaties waar men corrigeerde voor diverse confounders was de kans op een postoperatieve infectie bij een IA-injectie binnen één jaar voor de heupvervangende operatie 1,37 keer zo groot (statistisch significant) dan wanneer deze niet had plaatsgevonden (95%BI= (1,01-1,86); Ravi 2015). Het was in deze studie niet te achterhalen welk medicament was gebruikt bij de IA injectie. De andere grote retrospectieve studie van meer dan 80.000 totale knieoperaties rapporteerde een hogere kans op een postoperatieve infectie wanneer er een injectie in de ipsilaterale knie het jaar voorafgaand aan de gewrichtsvervanging had plaatsgevonden dan wanneer dit niet had plaatsgevonden (OR 1.23 (95%CI 1,15-1,33)). Men corrigeerde niet voor confounders en ook hier was het gebruikte medicament tijdens de IA injectie onbekend. Wanneer men de periode tussen de injectie en de gewrichtsvervanging in aanmerking nam, bleek de kans op infectie door een IA injectie in een periode meer dan 6 tot 7 maanden voor de operatie niet meer significant verhoogd (Bedard 2017). Vooralsnog adviseert de werkgroep daarom in ieder geval een tijdsperiode van een half jaar tussen de laatste IA injectie en de gewrichtsvervanging.
Er is tevens onduidelijkheid over de invloed van een IA-injectie met corticosteroïden op het kraakbeen en de maximaal toelaatbare frequentie van dergelijke injecties. Recent werd in een gerandomiseerde studie in patiënten met knieartrose (en echografische tekenen van synovitis bij aanvang van de studie; n=140 patiënten) na een interventie van twee jaar met driemaandelijkse IA corticosteroïdinjecties een groter op de MRI gemeten kraakbeenverlies gerapporteerd dan in de placebo injectie groep (McAlindon 2017). De keuze van de uitkomstmaat en de geringe grootte van de effecten trekken de klinische relevantie van deze uitkomsten echter nog in twijfel (Luijsterburg 2017), mede omdat men geen invloed op de klachten zag na de twee jaar, en de herhaalde injecties niet werden gegeven op grond van indicatie maar onafhankelijk van de mate van pijn en synovitis. Eerder was in een kleinere studie (68 patiënten) geen verschil gevonden in de röntgenologische gewrichtsspleetversmalling na twee jaar, tussen personen die waren gerandomiseerd naar IA-corticosteroïdinjecties elke drie maanden gedurende twee jaar, en personen gerandomiseerd naar placebo injecties (Raynauld 2003). Op basis van laatstgenoemde studie werd tot nu toe een maximale frequentie van IA corticosteroïdinjecties aanbevolen van eens in de 3 tot 4 maanden. De werkgroep is van mening dat vooralsnog een maximale frequentie van IA injecties met corticosteroïden moet worden gehanteerd van eens in de drie maanden; echter alleen wanneer er op dat moment voldoende indicatie is voor een dergelijke injectie.
Effecten en bijwerkingen in bepaalde subgroepen
Een subgroep die meer dan gemiddeld baat lijkt te hebben van een IA injectie met corticosteroïden zijn artrosepatiënten met ernstige pijn. In een meta-analyse met individuele patiëntgegevens vanuit vier beschikbare gerandomiseerde studies zag men bij heup- en knieartrosepatiënten met een pijnscore van 70 of meer op een 0 tot 100 schaal bij aanvang van de studie, een duidelijk groter effect van de corticosteroïdinjectie na vier tot zes weken vergeleken met placebo dan in de groep die bij aanvang minder dan 70 punten op deze pijnschaal scoorden (gemiddelde pijnreductie respectievelijk 28,5 en 15,0; van Middelkoop 2016). Met individuele patiëntgegevens vanuit drie beschikbare gerandomiseerde studies werd er in de subgroep met echografische inflammatoire tekenen bij aanvang van de studie net geen statistisch significant groter effect van de IA corticosteroïdinjectie ten opzichte van placebo gevonden dan in de groep zonder echografische tekenen van inflammatie (van Middelkoop 2016). Hierbij moet wel aangetekend worden dat de statistische power van deze laatste analyse klein was.
Corticosteroïdinjecties hebben de potentie de glucosespiegel te verhogen. Vanwege dit feit zijn er zorgen geuit over het toedienen van corticosteroïdinjecties bij patiënten met diabetes mellitus (DM). Een recente systematische review onderzocht de effecten van lokale corticosteroïdinjecties op de glucosespiegel bij DM-patiënten (Waterbrook 2017). De tien geïncludeerde studies waren klein, variërend van 6 tot 40 patiënten per studie, en betroffen meestal IA-injecties. Er was een merkbare stijging van de glucosespiegel na de corticosteroïdinjectie variërend tussen de studies van gemiddeld 125 mg/dL (7 mmol/L) tot 320 mg/dL (18 mmol/L). De maximale stijging werd bereikt tussen de eerste en de vijfde dag en de glucosespiegel normaliseerde naar de uitgangswaarde na 24 uur tot 10 dagen. Bij patiënten met type 1 DM of insulineafhankelijke DM (onderzocht in twee studies; zie Waterbrook 2017) werden grotere stijgingen in de glucosespiegel waargenomen dan bij patiënten met DM die niet afhankelijk waren van insuline. Bij patiënten met een HbA1c hoger dan 7% duurde normalisatie van de glucosespiegel langer dan bij patiënten met een HbA1c lager dan 7% (onderzocht in een studie; zie Waterbrook 2017). Geen van deze studies onderzocht echt de complicaties door deze glucosestijgingen, maar ze werden ook niet gerapporteerd. Men concludeerde dat een corticosteroïdinjectie resulteert in een duidelijke maar slechts kortdurende stijging van de glucosespiegel in patiënten met een goed ingestelde DM en dat de injecties waarschijnlijk veilig zijn, maar dat in patiënten met type 1 DM, insulineafhankelijke DM en/of ongecontroleerde DM (HbA1c groter dan 7%) deze stijging hoger is en langer aanhoudt. Bij patiënten die bijvoorbeeld al een bloedsuikerspiegel hebben van meer dan 250 mg/dL (14 mmol/L) zou een relatief hoge stijging mogelijk wel tot complicaties kunnen leiden.
Invloed van dosering en wijze van toediening
In de beschikbare placebogecontroleerde studies wordt triamcinolon (variërend van 20 tot 80 mg) het meest gebruikt en meestal met een dosis van 40 mg. Daarna volgt methylprednisolon (variërend van 25 tot 50 mg, en zelfs tot 120 mg in de heup; Jüni 2015; McCabe 2016). Er zijn twee gerandomiseerde studies beschikbaar die bij patiënten met artrose verschillende corticosteroïdproducten vergelijken. Beide studies betreffen patiënten met knieartrose. In de studie van Yavuz (2012) werd methylprednisolonacetaat (40 mg) vergeleken met triamcinolonacetaat (40 mg) en met betamethasondinatriumfosfaat (3 mg), waarbij de methylprednisolonacetaat een kleine maar statistisch significante meerwaarde had ten opzichte van de andere producten een tot zes weken na injectie. Op twaalf weken is het verschil in pijnreductie kleiner en niet statistisch significant. De studie van Lomonte (2015) vergeleek methylprednisolonacetaat (40 mg) met triamcinolonhexacetonide (40 mg) en vond geen verschil in pijnreductie tussen beide producten gemeten 4 tot 24 weken na injectie. Gerandomiseerde studies in artrosepatiënten die verschillende doseringen vergelijken, ontbreken.
De injectie moet onder steriele condities worden toegediend, waarbij in ieder geval de huid wordt schoongemaakt met alcohol. Er is echter geen bewijs voorhanden dat desinfectie met betadine of chlorhexidine het infectierisico vermindert ten opzichte van het gebruik van alcohol; bewijs ontbreekt eveneens voor het gebruik van steriele handschoenen ten opzichte van niet-steriele handschoenen of geen handschoenen, en voor het verwisselen van de naald tussen de aspiratie en het toedienen van het corticosteroid (Charalambous 2003).
Er zijn geen studies beschikbaar die de plaatsing van de IA-injectie (bij knie bijvoorbeeld superolateraal, lateraal-midpatellair, anterolateraal en anteromediaal) hebben vergeleken op effectiviteit. Wel vindt een systematische review naar de accuraatheid van de plaatsing (IA) op grond van 9 studies dat bij de knie de superolaterale plaatsing de hoogste IA accuraatheid (91%) oplevert (Hermans 2011). Een IA corticosteroïdinjectie in de knie onder echogeleiding om IA plaatsing te bereiken ten opzichte van een plaatsing zonder echogeleiding is wel onderzocht op (kosten-)effectiviteit in een studie (Sibbit 2009, 2011, 2012); maar de meerderheid van de studiepopulatie betrof patiënten met reumatoïde artritis.
Op grond van studies bij patiënten met een arthritis van de knie door reumatoïde arthritis heeft men eerder wel geadviseerd om 24 uur rust te houden na de intra-articulaire injectie (Neustadt 1985; Chakravarty 1994); deze studies lieten namelijk langer aanhoudende effecten zien in de groep die minimaal 72 respectievelijk 24 uur bedrust nam na de injectie. De theoretische basis hierbij is dat er snellere uptake in de circulatie is van het IA ingespoten stoffen wanneer de gewichtsdragende gewrichten actief zijn (Willliams 1981; Winfield 1979). Vanwege het ontbreken van direct bewijs adviseert de werkgroep geen bedrust post injectie, maar wel de instructie naar de patiënt toe om de eerstvolgende 24 uur de belasting van de onderste extremiteiten te beperken en niet te sporten.
Waarden en voorkeuren van de patiënt
Duidelijke voorlichting rondom injecties is erg belangrijk. Patiënten dienen realistische verwachtingen te hebben van het effect. Voorlichting over de duur van het effect, en de bijwerkingen wordt nog regelmatig gemist, of pas gegeven nadat de injectie reeds is gegeven. Er moet de tijd en ruimte zijn voor patiënten om samen met hun arts de voor- en nadelen in hun specifieke situatie te wegen.
Aanvaardbaarheid overige stakeholders, kosten, haalbaarheid
Dat de effecten, zoals de studies laten zien, slechts tijdelijk zijn is bij clinici en wellicht ook bij patiënten goed bekend. Het (tijdelijk) verlichten van de pijn bij artrose die niet genoeg reageert op de orale pijnstilling, eventueel in samenhang met (tijdelijke) inflammatoire tekenen van betreffend gewricht, is in de praktijk meestal het doel van de corticosteroïdinjectie. Het wordt vaak gezien als een manier om de patiënt over een pijnlijke periode heen te helpen, of om de patiënt tijdelijke vermindering van pijn te bieden bij een voor de patiënt belangrijke gebeurtenis. De IA corticosteroïdinjectie van de knie is een relatief makkelijke en algemeen aanvaarde interventie in zowel de eerstelijns- als de tweedelijns gezondheidzorg. Bij het toedienen van de IA corticosteroïdinjectie in de heup is echter een doorlichting van het heupgewricht geïndiceerd vanwege het diepliggende gewricht en kwetsbare structuren dicht bij de injectieplek. Hierdoor is een dergelijke interventie meer complex, vindt veel minder plaats en vrijwel alleen in de tweedelijns gezondheidzorg. Vanwege dit feit is recent een studie gedaan naar de effecten van een placebogecontroleerde corticosteroïdinjectie in de bilspier bij patiënten met heupartrose. Deze injectie gaf klinisch relevante effecten op pijn 2 tot 12 weken, en op fysiek functioneren 4 tot 12 weken na de injectie (Dorleijn 2018). Of deze effecten gelijkwaardig zijn aan een IA corticosteoroidinjectie is onbekend. De kosteneffectiviteit van een corticosteroïdinjectie bij artrose is op dit moment niet bekend. Een IA-corticosteroïdinjectie wordt momenteel vergoed binnen het basispakket door de zorgverzekeraars en het te injecteren product is niet erg duur.
Rationale
Voorgaande afwegend kan men zeggen dat de IA corticosteroïdinjectie vooral op de korte termijn mogelijk verlichting van de pijn kan bieden voor de patiënt met artrose. De ernst van de klachten, contra-indicaties voor reguliere pijnmedicatie of onvoldoende effectiviteit van de pijnmedicatie, kunnen hierbij leidend zijn. Daarnaast zal men vanwege de betere toegankelijkheid van het gewricht, bij de knie eerder tot deze beslissing overgaan dan bij de heup. Vanwege de onzekerheid over de eventueel nadelige invloed op kraakbeen zal men de frequentie van deze injecties beperken tot het hoogstnoodzakelijke en zeker niet vaker dan eens in de drie maanden. Vanwege de onzekerheid over het mogelijk verhoogde risico op een prothese infectie wanneer de corticosteroïdinjecties binnen een jaar voor het plaatsen van de prothese plaatsvinden, zullen deze injecties bij patiënten die op een wachtlijst staan voor een dergelijke operatie achterwege moeten worden gelaten, en er bij voorkeur een periode van tenminste een jaar in acht worden genomen tussen de laatste IA injectie en de gewrichtsvervanging. Patiënten moeten in alle gevallen goed op de hoogte worden gebracht van het uiterst kleine risico op een septische infectie direct na de injectie, en worden geïnstrueerd om direct contact op te nemen met de behandelaar bij verdenking op een infectie: dat wil zeggen het acuut ontstaan van een pijnlijke zwelling van het gewricht binnen een tot enkele dagen na de injectie (Shemesh 2011). De pijnlijke zwelling voelt vaak ook warm aan, en in de helft van de gevallen gaat een dergelijke septische arthritis gepaard met koorts (Hassan 2017).
Deelvragen-3 en -4: intra-articulaire bloedplaatjes (PRP) injecties bij knie- en heupartrose
Voor- en nadelen van de interventie en kwaliteit van het bewijs
De twee placebo gecontroleerde en gerandomiseerde, maar kleine, studies rapporteerden gunstige effecten van een IA leukocyten-arme PRP injectie ten opzichte van placebo bij artrose van de knie op de uitkomsten pijn en fysiek functioneren; de effecten zijn al klinisch relevant op de korte termijn en houden over een periode van minstens zes maanden aan (Kanchanatawan 2016). De enige gerandomiseerde en kleine studie met leukocyten-rijk PRP vertoonde geen effecten op pijn en fysiek functioneren ten opzichte van placebo (Kanchanatawan 2016). Er zijn geen gerandomiseerde effectiviteitstudies beschikbaar ten aanzien van IA PRP injecties bij heupartrose.
De bewijskracht voor effectiviteit van de interventie met leukocyten-arm PRP bij knieartrose is echter laag vanwege de disbalans tussen de groepen bij aanvang van de studies en het geringe totale aantal patiënten in de studies (15 tot 25 patiënten per studiearm). Bovendien is er in de grootste studie, hoewel als blind aangeduid, onduidelijkheid over de blindering omdat de blinderingsprocedure niet is beschreven en de placebogroep zelfs een toename van pijn vertoont (Patel 2013). Gewoonlijk is in dergelijke geblindeerde studies met injecties in artrosepatiënten dat de placebogroep een afname van de pijn vertoont (placebo-effect; Zhang 2008).
De IA PRP injectie is nog maar in drie gerandomiseerde studies met placebo vergeleken, maar in een groter aantal studies met andere IA-injecties, vooral met hyaluronzuur. In de meest recente en grootste systematische review vond men 11 gerandomiseerde studies die IA PRP injecties hadden vergeleken met IA hyaluronzuur injecties (Shen 2017). Acht van deze studies hadden een hoge risk of bias, de andere een matige risk op bias. Shen rapporteerde vergelijkbare effecten in twee studies, en betere effecten op pijn en fysiek functioneren na de IA PRP injecties dan na de HA-injecties in de 9 andere studies. Er was echter een grote variatie in de resultaten tussen de individuele studies (Shen 2017). Op basis van de eigen literatuuranalyse (zie Samenvatting literatuur) zijn we onzeker over het effect van intra-articulaire bloedplaatjes (PRP) injecties op het aantal patiënten met artrose van de heup dat (ernstige) adverse events ervaart, in vergelijking met geen interventie of placebo. De vijf gerandomiseerde die IA PRP vergeleken met IA hyaluronzuur en bijwerkingen rapporteerden, lieten geen verschil in bijwerkingen zien tussen de twee groepen (Kanchanatawan 2016). Voor meer zeldzame en ernstige bijwerkingen zijn de aantallen in de beschikbare studies sowieso veel te klein, maar waarschijnlijk is er bij IA PRP injecties hetzelfde kleine risico op een ernstige septische artritis na de injectie als bij IA injecties met andere producten (corticosteroïd of hyaluronzuur).
Effecten en bijwerkingen in bepaalde subgroepen
Twee studies, een ten opzichte van placebo en een ten opzichte van hyaluronzuur hebben gesuggereerd dat de subgroep van artrose patiënten die nog maar matige structurele veranderingen hebben, meer baat bij de PRP-injecties dan patiënten met meer ernstige structurele veranderingen (Montañez-Heredia 2016; Smith 2016). Deze suggestie berust echter slechts op zijdelings genoemde en slecht gerapporteerde post-hoc subgroep analyses in zeer kleine studies met alle risico’s op bias van dien (Bennell 2017). Er zijn geen subgroepen gerapporteerd die mogelijk meer bijwerkingen van IA PRP injecties hebben.
Invloed van dosering en toedieningsvorm
Vooralsnog zijn er naast de effectiviteit en de bijwerkingen nog veel andere onduidelijkheden over de IA interventie met PRP bij artrose. Zo is er bijvoorbeeld geen standaardisatie van dit product met betrekking tot de concentratie van de bloedplaatjes en groeifactoren in het product, het toelaten van de leukocyten bij de bereiding, het gebruik van vers of ingevroren PRP, het gebruik van een anticoagulans bij de bereiding, het gebruik van vers of ingevroren PRP, en het aantal en de frequentie van de injecties. Binnen de beschikbare gerandomiseerde studies verschillen al deze factoren. Er zijn momenteel veel te weinig studies beschikbaar om te evalueren of al deze verschillende bereidingen en toedieningsvormen invloed hebben op het mogelijke effect (Kanchanatawan 2016). In een recente review over PRP injecties bij de management van artrose (Bennell 2017) werd op grond van de positieve studies met IA PRP (zowel ten opzichte van placebo als ten opzichte IA hyaluronzuur) overigens wel aanbevolen om in toekomstige studies in ieder geval verse PRP te gebruiken, leukocyten arme PRP (die wordt vervaardigt met een enkele langzame en korte centrifugatie van ongeveer 1500 rpm gedurende 5 tot 8 minuten), mogelijk met drie opeenvolgende injecties die wekelijks worden toegediend.
Waarden en voorkeuren van de patiënt
Het feit dat er met lichaamseigen en door centrifugatie meer met bloedplaatjes geconcentreerd bloed wordt behandeld is voor menig patiënt een goed aanvaardbare therapie. De werkgroep beveelt deze behandeloptie echter niet aan, tenzij in onderzoeksverband: voorlichting over het feit dat deze behandeling (nog) alleen in onderzoeksverband wordt aanbevolen is heel belangrijk.
Aanvaardbaarheid overige stakeholders, kosten, haalbaarheid
Hoewel deze therapie door diverse privéklinieken op grote schaal wordt aangeboden, vindt deze behandeling ook al op kleinere schaal binnen de reguliere zorg plaats, inclusief in huisartspraktijken. Voor het uitvoeren van een dergelijke behandeling heeft de behandelaar centrifuge apparatuur nodig, zal steriel gewerkt moeten worden, en gegarandeerd kunnen worden dat alleen patiënt eigen materiaal wordt gebruikt; de behandeling is hierdoor momenteel niet op elke kliniek of praktijk mogelijk. De meeste zorgverzekeraars vergoeden deze behandeling niet, tenzij hier speciale afspraken over zijn.
Rationale
Voorgaande afwegend kan men stellen dat er onvoldoende onderzoek is gedaan naar de effectiviteit van deze interventies bij knieartrose, en dat onderzoek bij heup-artrose geheel ontbreekt. Kwalitatief betere studies zullen nodig zijn om uitspraken te doen over effectiviteit. Er worden weinig bijwerkingen van deze interventie gerapporteerd, maar de beschikbare studies zijn vaak te klein en niet opgezet om dit goed te bestuderen. De werkgroep is derhalve van mening dat intra-articulaire injecties met PRP voor de behandeling van artrose aan heup of knie niet kunnen worden aanbevolen, tenzij dit gebeurt in het kader van goed opgezet wetenschappelijk onderzoek.
Onderbouwing
Achtergrond
Intra-articulaire (IA) injecties met corticosteroïden bij patiënten met artrose horen al een geruime tijd tot het behandelingsarsenaal van de arts. Recent zijn intra-articulaire injecties met bloedplaatjes (autoloog bloedplaatjes rijk plasma) geïntroduceerd met een toename van deze therapie bij artrose als gevolg. De bewijskracht voor zowel de positieve als negatieve effecten (bijwerkingen) van deze IA therapieën is echter onduidelijk. Voor de behandeling met intra-articulaire injecties met hyaluronzuur heeft de NOV recentelijk een standpunt ingenomen (NOV 2013). Men kwam hierin tot de conclusie dat op basis van de stand van de wetenschap tot augustus 2013 voor hyaluronzuur injecties in het kniegewricht geen tot een beperkt positief effect kon worden aangetoond op vermindering van klachten bij de behandeling van artrose van de knie, en het effect op de lange termijn onbekend is. Daarnaast waren hyaluronzuur injecties in het kniegewricht bij artrose tot dan toe nog niet kosteneffectief gebleken. Op basis van het bovenstaande werden intraarticulaire hyaluronzuurinjecties niet aanbevolen als standaard primaire behandeling van artrose van de knie. Vanwege dit recente standpunt zal de waarde van hyaluronzuurinjecties bij behandeling van artrose aan heup of knie pas bij een volgende herziening van de richtlijnmodule opnieuw worden beoordeeld.
Conclusies
deelvraag 1: corticosteroïdinjecties in de knie
|
Laag GRADE |
Intra-articulaire corticosteroïdinjecties zouden mogelijk op korte termijn kunnen resulteren in pijnreductie bij patiënten met artrose van de knie, in vergelijking met geen interventie of placebo.
Dit effect lijkt af te nemen in de tijd, en na zes maanden is er geen verschil in pijnreductie tussen interventiegroep en controlegroep.
Bron (Jüni 2015) |
|
Laag GRADE |
Intra-articulaire corticosteroïdinjecties zouden mogelijk op korte termijn kunnen resulteren in verbetering van fysiek functioneren bij patiënten met artrose van de knie, in vergelijking met geen interventie of placebo.
Dit effect lijkt af te nemen in de tijd, en na zes maanden is er geen verschil in verbetering van fysiek functioneren tussen interventiegroep en controlegroep.
Bron (Jüni 2015) |
|
Laag GRADE |
Intra-articulaire corticosteroïdinjecties lijken niet te resulteren in een verbetering van de kwaliteit van leven bij patiënten met artrose van de knie, in vergelijking met geen interventie of placebo.
Bron (Jüni 2015) |
|
Zeer Laag GRADE |
We zijn onzeker over het effect van intra-articulaire corticosteroïdinjecties op het aantal patiënten met artrose van de knie dat adverse events (bijwerkingen en complicaties) ervaart, in vergelijking met geen interventie of placebo.
Bron (Jüni 2015) |
|
Zeer laag GRADE |
We zijn onzeker over het effect van intra-articulaire corticosteroïdinjecties op withdrawal from trial vanwege adverse events bij patiënten met artrose van de knie, in vergelijking met geen interventie of placebo.
Bron (Jüni 2015) |
|
Zeer Laag GRADE |
We zijn onzeker over het effect van intra-articulaire corticosteroïdinjecties op het aantal patiënten met artrose van de knie dat ernstige adverse events ervaart, in vergelijking met geen interventie of placebo.
Bron (Jüni 2015) |
deelvraag-2: corticosteroïdinjecties in de heup
|
Laag GRADE |
Intra-articulaire corticosteroïdinjecties zouden mogelijk op korte termijn kunnen resulteren in pijnreductie bij patiënten met (ernstige) artrose van de heup, in vergelijking met placebo.
Bron (McCabe 2016) |
|
Laag GRADE |
Intra-articulaire corticosteroïdinjecties zouden mogelijk kunnen resulteren in een hogere behandelrespons, gemeten op basis van de OARSI responder criteria acht weken na behandeling, bij patiënten met (ernstige) artrose van de heup, in vergelijking met placebo.
Bron (McCabe 2016) |
|
Redelijk GRADE |
Intra-articulaire corticosteroïdinjecties verbeteren waarschijnlijk op korte termijn (3-8 weken) fysiek functioneren bij patiënten met artrose van de heup, in vergelijking met placebo.
Bron (McCabe 2016) |
|
Zeer Laag GRADE |
We zijn onzeker over het effect van intra-articulaire corticosteroïdinjecties op het aantal patiënten met artrose van de heup dat (ernstige) adverse events ervaart, in vergelijking met geen interventie of placebo.
Bron (McCabe 2016) |
deelvraag 3: bloedplaatjes (PRP) injecties in de knie
|
Laag GRADE |
Intra-articulaire leukocytenarme bloedplaatjes (PRP) injecties zouden mogelijk kunnen resulteren in pijnreductie bij patiënten met artrose van de knie, in vergelijking met placebo, zowel op korte als langere termijn (een week tot 12 maanden).
Een uitspraak over de effectiviteit van leukocytenrijk PRP is niet mogelijk.
Bronnen (Kanchanatawan 2016 (Patel 2013; Rayegani 2014); Smith 2016) |
|
Laag GRADE |
Intra-articulaire leukocytenarme bloedplaatjes (PRP) injecties zouden mogelijk kunnen resulteren in verbeterd fysiek functioneren bij patiënten met artrose van de knie, in vergelijking met placebo, zowel op korte als langere termijn (een week tot 12 maanden).
Een uitspraak over de effectiviteit van leukocytenrijk PRP is niet mogelijk.
Bronnen (Kanchanatawan 2016 (Patel 2013; Rayegani 2014); Smith 2016) |
|
Zeer Laag GRADE |
We zijn onzeker over het effect van intra-articulaire bloedplaatjes (PRP) injecties op het aantal patiënten met artrose van de knie dat (ernstige) adverse events ervaart, in vergelijking met geen interventie of placebo.
Bronnen (Kanchanatawan 2016 (Patel 2013; Rayegani 2014); Smith 2016 |
|
Laag GRADE |
Intra-articulaire leukocytenarme bloedplaatjes (PRP) injecties zouden mogelijk kunnen resulteren in verminderde gewrichtsstijfheid bij patiënten met artrose van de knie, in vergelijking met placebo, zowel op korte als langere termijn (een week tot 12 maanden).
Bronnen (Kanchanatawan 2016 (Patel 2013; Rayegani 2014); Smith 2016) |
deelvraag 4: bloedplaatjes (PRP) injecties in de heup
|
Geen GRADE |
De waarde van bloedplaatjes (PRP) injecties bij het bestrijden van klachten als gevolg van artrose van de heup is onbekend.
Er werd geen literatuur gevonden waarbij bloedplaatjes (PRP) injecties werden vergeleken met placebo bij patiënten met artrose van de heup.
Bronnen (niet van toepassing) |
Samenvatting literatuur
deelvraag 1: corticosteroïdinjecties in de knie
Beschrijving studies
De systematische literatuuranalyse van Jüni (2015) is van goede kwaliteit (zie Risk-of-biastabellen). Jüni (2015) voerde een search uit tot 3 februari 2015 en includeerde 27 studies (26 studies voor de hoofduitkomstmaten pijn en fysiek functioneren, één studie rapporteerde alleen veiligheidsdata van de injectie). Minstens 75% van de patiënten in de geïncludeerde studies moest klinisch of radiologisch bewezen artrose hebben (om te differentiëren tussen reumatoïde artritis en artrose). De risk of bias van de studies was over het algemeen hoog of onduidelijk (geen adequate beschrijving van randomisatie en/of blindering, of het niet volgen van een intention-to-treat analyse). In tien studies werd een add-on therapie toegepast: zowel in de interventie als de controlegroep werd naast corticosteroïdinjecties of placebo/geen injecties een extra elektrotherapie, oefentherapie of intra-articulaire injectie met hylan GF-20 toegepast. Deze studies zijn in een sensitiviteitsanalyse geëxcludeerd. Twee studies waren cross-over studies met een wash-out periode van respectievelijk één en acht weken.
Resultaten
Gewrichtspijn (cruciale uitkomstmaat)
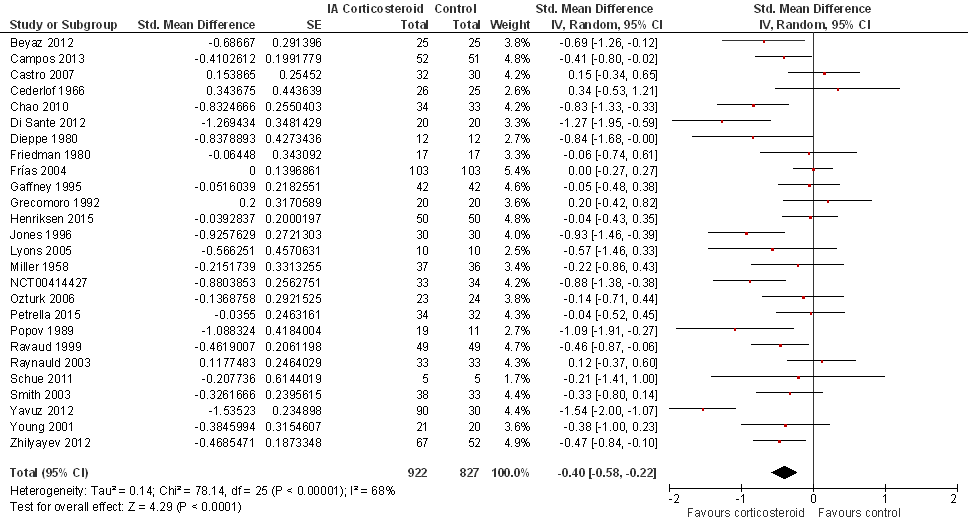
Vier tot zes weken na de injectie (hoofdanalyse; 26 studies):
Figuur 1
Extra sensitiviteitsanalyse door exclusie van add-on studies (zie Beschrijving studies): na het excluderen van tien studies was het gestandaardiseerde gemiddelde verschil (SMD, standardized mean difference) -0,54 (95%BI van -0,80 tot -0,28; 16 studies gepoold), met een I2 van 67% (heterogeniteit tussen de studies matig-hoog), in het voordeel van de corticosteroïdinjectie (statistische significant).
Een tot twee weken na de injectie (16 studies): het gepoold effect was SMD -0,48 (95%BI van -0,70 tot -0,27) in het voordeel van de corticosteroïdinjectie (statistisch significant), met een I2 van 63% (heterogeniteit tussen de studies matig-hoog).
Zes maanden na de injectie (7 studies):
Zeven studies rapporteerden pijnuitkomsten na zes maanden: SMD -0,07 (95%BI van -0,25 tot 0,11) in het voordeel van de corticosteroïdinjectie (niet statistisch significant), met een I2 van 0% (heterogeniteit tussen de studies laag).
In de Cochrane review (Jüni 2015) zijn ook uitkomsten te raadplegen drie maanden na de interventies, en de uitkomsten suggereren een trend in het afnemen van het effect over de tijd.
Fysiek functioneren (cruciale uitkomstmaat)
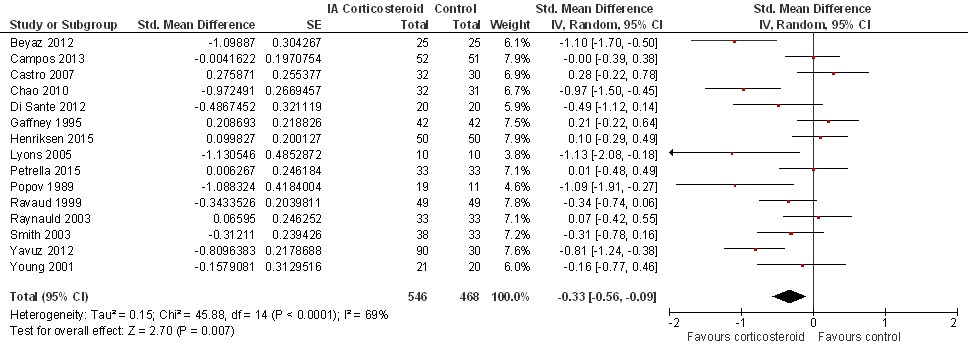
Vier tot zes weken na de injectie (15 studies):
Figuur 2
Extra sensitiviteitsanalyse door exclusie van add-on studies (zie Beschrijving studies): na het excluderen van zeven studies was SMD -0,58 (95%BI van -0,99 tot -0,17; 8 studies gepoold), met een I2 van 76% (heterogeniteit tussen de studies hoog), in het voordeel van de corticosteroïdinjectie (statistisch significant).
Zes maanden na de injectie: vier studies rapporteerden uitkomsten voor fysiek functioneren na zes maanden: SMD 0,06 (95%BI van -0,16 tot 0,28) in het voordeel van de controlegroep (niet statistisch significant), met een I2 van 0% (heterogeniteit tussen de studies laag).
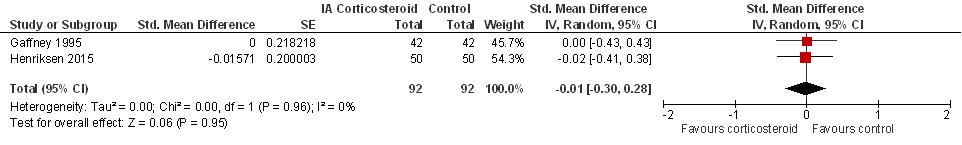
Kwaliteit van leven (belangrijke uitkomstmaat)
Figuur 3
Twee studies rapporteerden kwaliteit van leven, en laten geen verschil zien tussen de groepen. Er werd geen aparte sensitiviteitsanalyse gedaan, bij exclusie van add-on studies (zie Beschrijving studies) zou alleen de studie van Gaffney (1995) resteren.
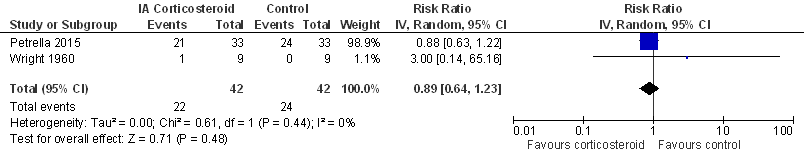
Adverse events (bijwerkingen, complicaties; belangrijke uitkomstmaat)
Dit werd gedefinieerd als: het aantal participanten die adverse events (elk soort) ondervonden.
Figuur 4
Het verschil tussen de groepen was niet statistisch significant.
Er werd geen aparte sensitiviteitsanalyse gedaan, bij exclusie van add-on studies (zie Beschrijving studies) zou alleen de studie van Wright (1960) resteren.
Aantal participanten die zich terug hebben getrokken uit de studie vanwege adverse events:
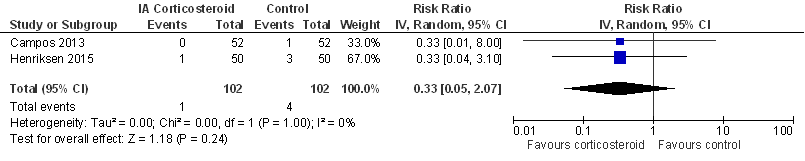
Figuur 5
Er werd geen aparte sensitiviteitsanalyse gedaan, beide studies zijn add-on studies.
Ernstige adverse events
Dit werd gedefinieerd als gebeurtenissen die het resultaat zijn van ziekenhuisopnames, verlengde duur van ziekenhuisopname, ernstige invaliditeit, verworven abnormaliteit, geboortedefect, levensbedreigende gebeurtenissen of dood.
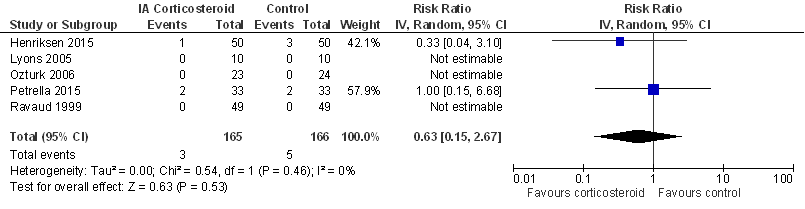
Figuur 6
Er werd geen aparte sensitiviteitsanalyse gedaan, bij exclusie van add-on studies (zie Beschrijving studies) zou alleen de studie van Lyons (2005) resteren.
Overige uitkomstmaten (belangrijke uitkomstmaten)
Overige uitkomstmaten (zie Relevante uitkomstmaten onder Zoeken en selecteren) zoals responderanalyses, gewrichtsstijfheid, tijd tot chirurgische interventie, en kosten werden niet als uitkomstmaat beschreven in de systematische review van Jüni (2015).
Bewijskracht van de literatuur
De bewijskracht is bepaald per uitkomstmaat en is in alle gevallen gebaseerd op resultaten uit gerandomiseerd onderzoek en start derhalve hoog. De bewijskracht voor de uitkomstmaat gewrichtspijn is met twee niveaus verlaagd naar lage bewijskracht vanwege beperkingen in de onderzoeksopzet (hoge risk of bias: onduidelijkheid over randomisatie, allocatie en blindering in bijna alle studies) en inconsistentie (hoge statistische heterogeniteit, de richting van effect is niet eenduidig). De bewijskracht voor de uitkomstmaat fysiek functioneren is met twee niveaus verlaagd naar lage bewijskracht vanwege beperkingen in de onderzoeksopzet (hoge risk of bias: onduidelijkheid over randomisatie, allocatie en blindering in bijna alle studies) en inconsistentie (hoge statistische heterogeniteit, de richting van effect is niet eenduidig). De bewijskracht voor de uitkomstmaat kwaliteit van leven is met twee niveaus verlaagd naar lage bewijskracht vanwege beperkingen in de onderzoeksopzet (hoge risk of bias: onduidelijkheid over randomisatie, allocatie en blindering) en het te geringe aantal patiënten (onvoldoende statistische power; imprecisie). De bewijskracht voor de uitkomstmaten adverse events en ernstige adverse events is met drie niveaus verlaagd naar zeer lage bewijskracht vanwege beperkingen in de onderzoeksopzet (hoge risk of bias); inconsistentie (de richting van effect is niet eenduidig) en het te geringe aantal patiënten (imprecisie gezien lage event rate). De bewijskracht voor de uitkomstmaat withdrawal from trial is met drie niveaus verlaagd naar zeer lage bewijskracht vanwege beperkingen in de onderzoeksopzet (hoge risk of bias: onduidelijkheid over allocatie en blindering) en het te geringe aantal patiënten (ernstige imprecisie gezien zeer lage event rate, twee niveaus verlaagd).
deelvraag-2: corticosteroïdinjecties in de heup
Beschrijving studies
De SR van McCabe is van goede kwaliteit (zie risk-of-biastabellen). In McCabe (2016) werd in zes databases gezocht naar relevante artikelen tot mei 2015. Vervolgens werden er vijf RCT’s geïncludeerd met patiënten met heupartrose (in totaal 346 patiënten). De meerderheid van de patiënten in de studie-populaties was in afwachting van een heupoperatie, wat suggereert dat de patiënten in deze studies ernstige heupartrose-klachten ondervonden. . Alle RCT’s vergeleken corticosteroïd-injecties (onder geleide van fluoroscopie of echo) met een placebo injectie (fysiologisch zout in vier studies; Mepivacaïne in één studie). De studies hadden een korte follow-up: 3-4 weken (Flanagan 1988; Kullenberg 2004; alle controle-patiënten stopten na drie weken vanwege het uitblijven van een effect), 8 weken (Atchia 2011; Lambert 2007) en 12 weken (Qvistgaard 2006). De uitkomstmaat gewrichtspijn werd gerapporteerd op een VAS-pijnschaal tijdens lopen en in rust (Kullenberg 2004; Qvistgaard 2006), WOMAC pijnschaal, of numerieke pijnschaal (Atchia 2011; Lambert 2007). De behandelrespons werd in twee studies (Atchia 2011; Lambert 2007) bepaald 8 weken na injectie op basis van de OARSI responder criteria, een samengestelde maat voor pijn, fysiek functioneren en global assesment. De studies geven slechts een kwalitatieve beschrijving van adverse events (bijwerkingen en complicaties). In de studie van Flanagan (1998) kregen patiënten die ernstige pijn hadden voorrang op inclusie in de studie; in de studie van Lambert (2007) werd aan de patiënten in de controlegroep gevraagd om een constante dosis NSAID’s te gebruiken gedurende de studie.
Resultaten
Gewrichtspijn (cruciale uitkomstmaat)
Forest plot van gemiddelde pijnverandering na injecties, random effect model (studieomvang respectievelijk 80, 52 en 101 patiënten, met respectievelijk 40, 31 en 32 patiënten die corticosteroïdinjecties ontvingen) .

Figuur 7
Omdat de follow-up duur varieert, is er geen gepoold resultaat weergegeven. De resultaten suggereren dat het effect van de corticosteroïdinjectie afneemt in de tijd (groter effect bij een kortere follow-up) maar enige voorzichtigheid is op zijn plaats omdat Lambert (2007) en Kullenberg (2004) geen standaarddeviaties rapporteerden en deze derhalve moesten worden geïmputeerd.
In de studie van Flanagan (1998) werd in de corticosteroïd groep door 9 van de 12 (75%) en in de controlegroep door 14 van de 24 (58%) patiënten pijnverbetering gerapporteerd (niet verder gespecificeerd). Atchia (2011) rapporteerde niet de gemiddelde pijnverandering op een continue schaal in de interventie- en controlegroep.
OMERACT-OARSI-responder criteria na 8 weken.
Twee studies rapporteerden de kans op een adequate behandelrespons op basis van de OMERACT OARSI responder criteria.
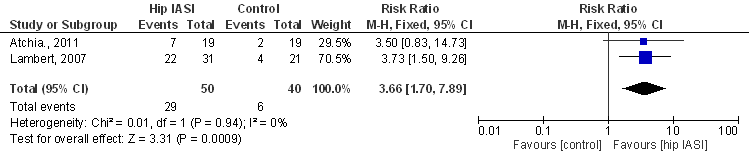
Forest plot van de kans op een adequate behandelrespons op basis van de OARSI responder criteria 8 weken na de injectie. IASI: intra-articular steroid injection.
Figuur 8
Beide studies hebben betrekking op patiënten met chronische artrose klachten: Lambert (2007) includeerde patiënten met symptomen van artrose gedurende > 6 maanden en Atchia (2011) patiënten die op de wachtlijst stonden voor een heupoperatie. De studie van Atchia (2011) laat een risk ratio (RR) van 3,50 zien (niet statistisch significant), de studie van Lambert een risk ratio van 3,73 (statistisch significant), en na pooling bedraagt de gemiddelde risk ratio, RR 3,7 (95%BI van 1,7 tot 7,9), statistisch significant in het voordeel van corticosteroïdinjectie.
Fysiek functioneren (cruciale uitkomstmaat)
Effect op functioneren werd in de geïncludeerde studies op verschillende momenten en met verschillende meetinstrumenten gemeten. McCabe (2016) rapporteerde geen specifieke uitkomsten (getallen) voor deze uitkomstmaat, en daarom zijn de originele publicaties geraadpleegd.
Tabel 1
|
Studie |
Meetinstrument |
Follow-up |
Uitkomst |
|
Kullenberg 2004 |
Gemodificeerde Katz ADL index (0-5 schaal) |
3 weken na injectie |
baseline 2.0 ± 0.3 placebo 2.2 ± 0.2 steroïd 3.6 ± 0.6 groepsverschil 1,4 (stat. significant) |
|
Lambert 2007; Atchia 2011 |
WOMAC fysieke functie subschaal |
8 weken na injectie |
Lambert 2007: baseline ~970 placebo 949 ± 350 steroïd 538 ± 402 groepsverschil 411 (stat. significant) Atchia 2011: groepsverschil SMD 0,4 na 8 weken (1,3 na 1 week en 0,9 na 4 weken) |
|
Lambert 2007 |
SF-36 fysieke en sociaal functioneren subschaal |
8 weken na injectie |
SF-36 Fysiek: baseline 20-23 placebo 22.6 ± 19.3 steroïd 32.6 ± 19.3 groepsverschil 13 (stat. significant) SF-36 Sociaal: baseline ~55 placebo 53.6 ± 24.7 steroïd 66.9 ± 27.9 groepsverschil 13 (stat. significant) |
Adverse events (bijwerkingen, complicaties; belangrijke uitkomstmaat)
De uitkomstmaat complicaties en bijwerkingen werd alleen kwalitatief gerapporteerd. De studie van Qvistgaard (2006) beschreef dat 3 van de 101 patiënten pijn ervaarden bij de injectie, maar er werd niet gespecificeerd welke patiëntengroep dit betrof. Vier studies rapporteerden dat de injectie procedure goed getolereerd werd. De studie van Lambert (2007) rapporteerde dat 52% van de patiënten in de placebogroep tenminste een adverse event had binnen twee maanden na injectie, in vergelijking met 51% van de patiënten in de corticosteroïdgroep. Adverse events werden hierbij gedefinieerd als ‘alles dat door de patiënt als anders of ongewoon wordt gerapporteerd’. Lambert (2007) geeft aan dat dat de meeste adverse events mild waren en/of niet gerelateerd aan de behandeling (kwantificering ontbreekt). Eén patiënt in de corticosteroïdgroep kreeg een DVT (diepe veneuze trombose) drie maanden na de injectie. Geen van de deelnemers trok zich terug uit de trial vanwege adverse events.
Overige uitkomstmaten (belangrijke uitkomstmaten)
Overige uitkomstmaten (zie Relevante uitkomstmaten onder Zoeken en selecteren) zoals gewrichtsstijfheid, kwaliteit van leven, withdrawal from trial, tijd tot chirurgische interventie, en kosten werden niet als uitkomstmaat gerapporteerd in de systematische review van McCabe (2016).
Bewijskracht van de literatuur
De bewijskracht is in alle gevallen gebaseerd op resultaten uit gerandomiseerd onderzoek en start derhalve hoog. De bewijskracht voor de uitkomstmaat gewrichtspijn is met twee niveaus verlaagd naar laag vanwege ernstige imprecisie (een enkele kleine studie per follow-up-duur). De bewijskracht voor de uitkomstmaat fysiek functioneren is met een niveau verlaagd naar redelijk vanwege het geringe aantal patiënten (imprecisie). De bewijskracht voor behandelrespons (op basis van OMERACT OARSI responder criteria) is met twee niveaus verlaagd naar laag vanwege ernstige imprecisie (gering aantal patiënten). De bewijskracht voor de uitkomstmaat (ernstige) adverse events werd verlaagd met drie niveaus naar zeer laag, vanwege een hoge risk of bias (onduidelijke en onvolledige rapportage; verlaging met twee niveaus) en (ernstige) imprecisie (onvoldoende studieomvang, zeker voor ernstige adverse events; verlaging met een tot twee niveaus).
deelvraag 3: bloedplaatjes (PRP) injecties in de knie
Beschrijving studies
De SR van Kanchanatawan (2016) is van goede kwaliteit (zie Risk-of-biastabellen) en vergelijkt intra-articulaire PRP injecties met injecties van hyaluronzuur en placebo-injecties. In totaal worden negen RCT’s geïncludeerd waarvan twee RCT’s een vergelijking van PRP met placebo bevatten (Patel 2013; Rayegani 2014). Deze laatstgenoemde RCT’s en de aanvullende recente RCT van Smith (2016) voldoen aan de selectiecriteria en zijn opgenomen in de huidige literatuuranalyse. De RCT’s zijn uitgevoerd in India (Patel 2013), Iran (Rayegani 2014) en de Verenigde Staten (Smith 2016).
Kanchanatawan (2016) beoordeelde de studiekwaliteit (risk of bias) op zes domeinen (randomisatie, blindering van groepstoekenning, blindering van deelnemers/ zorgverleners en uitkomstbeoordelaars, incomplete data, selectieve rapportage, en ‘andere vormen van bias’). Rayegani (2014) is van lage kwaliteit (hoog risico op bias) met name door het ontbreken van adequate blindering van de groepstoekenning, en ontbreken van blindering van patiënt en zorgverlener. De RCT van Patel (2013) is van redelijke kwaliteit (matig risico op bias), er is wel sprake van adequate blindering, maar drie patiënten worden na randomisatie geëxcludeerd en een intention-to-treat analyse ontbreekt. De RCT van Smith (2016) is van hoge kwaliteit (laag risico op bias; zie Risk-of-biastabellen). De studieomvang varieert tussen 30 en 78 patiënten, met 15 tot 31 patiënten per studie-arm. In de RCT van Smith (2016) is er sprake van onbalans in de groepstoekenning waarschijnlijk veroorzaakt door de geringe studieomvang met slechts 15 patiënten per studie-arm: patiënten in de placebogroep zijn gemiddeld jonger en hebben minder overgewicht, maar de WOMAC (sub)scores komen wel overeen op baseline. Dit laatste is niet het geval in de RCT’s van Patel (2013) en Rayegani (2014), in deze studies is er ernstige onbalans tussen interventie- en controlegroepen, met aanzienlijke lagere (betere) WOMAC (sub)scores in de controlegroepen op baseline (zie evidence-tabellen). Deze onbalans tussen interventie- en controlegroepen wordt niet verklaard en verlaagt het vertrouwen in de methodologische kwaliteit van genoemde RCT’s.
Van de drie geïncludeerde studies vergeleken twee studies (Patel 2013; Smith 2016) leukocyten-arm PRP (leukocyte poor PRP, LP-PRP) injecties met placebo injecties, en een studie (Rayegani 2014) vergeleek leukocyten-rijk PRP (leukocyte rich PRP, LR-PRP) injecties met placebo. PRP wordt in verschillende concentraties gebruikt, en aantal en frequentie van de injecties varieert. De concentratie bloedplaatjes bedraagt 310.140 per ml bloed in de RCT van Patel (2013), en > 150.000 bloedplaatjes per ml bloed in de overige twee RCT’s (Rayegani 2014; Smith 2016). Het aantal injecties varieert tussen 2 injecties met een tussenpoze van 3-4 weken (Patel 2013; Rayegani 2014), en 3 injecties met tussenpozen van een week (Smith 2016). Smith (2016) gebruikt, in tegenstelling tot Patel (2013) en Rayegani (2014), geen anticoagulans bij de bereiding van PRP.
Kanchanatawan (2016) analyseert de WOMAC (Western Ontario and McMaster Universities Osteoarthritis Index; Likert Scale version) totaalscore en subscores (gewrichtspijn, gewrichtsstijfheid en fysiek functioneren; patiënt gerapporteerde uitkomstscores) zes maanden na de injecties. Een lagere score geeft betere gezondheidsuitkomsten op de domeinen aan. Daarnaast worden adverse events geanalyseerd, waarbij adverse events breed zijn gedefinieerd als negatieve gebeurtenissen zoals pijn gerelateerd aan de injectie.
Resultaten
Gewrichtspijn (cruciale uitkomstmaat)
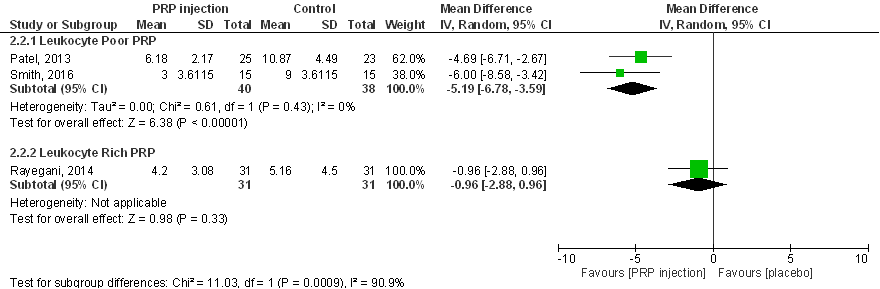
WOMAC subscore pijn (score tussen 0 tot 20) 6 maanden post-injectie:
Figuur 9
Pooling van alle drie de studies is onverantwoord vanwege onacceptabel grote statistische heterogeniteit (I2 83%). Deze heterogeniteit wordt mogelijk verklaard door verschillen tussen de PRP-preparaten, leukocyten-arm PRP (Patel 2013; Smith 2016) en leukocyten-rijk PRP (Rayegani 2014), maar harde conclusies zijn niet mogelijk door het kleine aantal studies. Interpretatie van de resultaten wordt ook bemoeilijkt door onbalans tussen interventie- en controlegroepen op baseline (zie eerder in de tekst onder Beschrijving studies). In Patel (2013) en Rayegani (2014) zijn de WOMAC (sub)scores op baseline aanzienlijke lager in de controlegroep dan in de interventiegroep: patiënten in de controlegroepen hebben voorafgaand aan de behandeling beduidend minder klachten dan de patiënten in de interventiegroepen. Als in de meta-analyses zou zijn gecorrigeerd voor verschillen in baseline scores dan zou dit het verschil tussen PRP en placebo hebben doen toenemen. Opmerkelijk is ook dat in Patel (2013) sprake is van een statistisch significante toename van pijn in de placebogroep, terwijl gewoonlijk een afname van pijn wordt gevonden in placebogroepen van geblindeerde studies naar intra-articulaire injecties bij personen met artrose (placebo-effect; Zhang 2008). Patel (2013) rapporteert ook de effecten op kortere termijn en constateert een grotere effectiviteit van PRP in het verminderen van pijn zes weken en drie maanden na injectie. Smith (2016) analyseert meerdere tijdpunten vanaf een week tot twaalf maanden na PRP-injectie, en vindt pijnreductie vanaf een week na injectie, en maximale pijnreductie na drie maanden, die aanhoudt tot het laatste meetmoment van twaalf maanden. Samenvattend zijn er aanwijzingen dat (leukocyten-arm) PRP-injecties in de knie mogelijk de pijn als gevolg van artrose aan de knie aanzienlijk (statistisch significant, en klinisch en patiënt relevant) kunnen verminderen, ook op de langere termijn. Een uitspraak over de effectiviteit van leukocyten-rijk PRP is niet mogelijk.
Fysiek functioneren (cruciale uitkomstmaat)
WOMAC-subscore fysiek functioneren (score tussen 0 tot 68) 6 maanden post-injectie:
Figuur 10
Een vergelijkbaar beeld ontstaat bij de analyse van de effecten van PRP injecties op fysiek functioneren, ook hier is pooling van alle drie de studies niet verantwoord vanwege onacceptabel grote statistische heterogeniteit (I2 93%), en lijkt er sprake van een aanzienlijke (klinisch en patiënt relevante) verbetering van fysiek functioneren na injectie van leukocytenarm PRP, gemeten zes maanden na behandeling (zie bovenstaande forest plot), maar ook op kortere en langere termijn (Patel 2013; Smith 2016). Samenvattend zijn er aanwijzingen dat (leukocytenarm) PRP-injecties in de knie mogelijk fysiek functioneren aanzienlijk (statistisch significant, en klinisch en patiënt relevant) kunnen verbeteren, ook op de langere termijn. Een uitspraak over de effectiviteit van leukocytenrijk PRP is niet mogelijk.
Adverse events (bijwerkingen, complicaties; belangrijke uitkomstmaat)
De definities die de drie studies hanteren voor adverse events zijn breed en onduidelijk, en de wijze waarop adverse events worden vastgesteld en beoordeeld wordt niet beschreven. Patel (2013) rapporteert adverse events ‘voor zo ver gerelateerd aan de behandeling’ bij elf patiënten (44% van totaal) in de PRP-groep en bij geen enkele patiënt in de controlegroep. De adverse events waren flauwvallen, duizeligheid, hoofdpijn, misselijkheid, maagslijmvliesontsteking (gastritis), zweten, en tachycardie. De adverse events waren overwegend injectie-gerelateerd. Drie patiënten (12%) meldde pijn en stijfheid gedurende twee dagen volgend op de PRP-injectie. Smith (2016) is een haalbaarheidsstudie uitgevoerd op last van de FDA (US Food and Drug Administration) primair om inzicht te krijgen in de veiligheid van (leukocytenarm) PRP bij behandeling van knieartrose. Er worden geen klinische adverse events (ziekten, klinische tekenen en symptomen gerelateerd aan de behandeling) geconstateerd in interventie- of controlegroep. Rayegani (2014) definieert adverse events niet als uitkomstmaat en geeft geen inzicht in de veiligheid van de behandeling. Samenvattend zijn er aanwijzingen dat (leukocytenarm) PRP-injecties in de knie mogelijk (milde, korte termijn) adverse events kunnen veroorzaken. Een uitspraak over minder frequente (ernstige) adverse events is niet mogelijk vanwege de geringe omvang van de studies. Ook is geen uitspraak mogelijk over eventuele adverse events bij gebruik van leukocytenrijk PRP.
Overige uitkomstmaten (belangrijke uitkomstmaten)
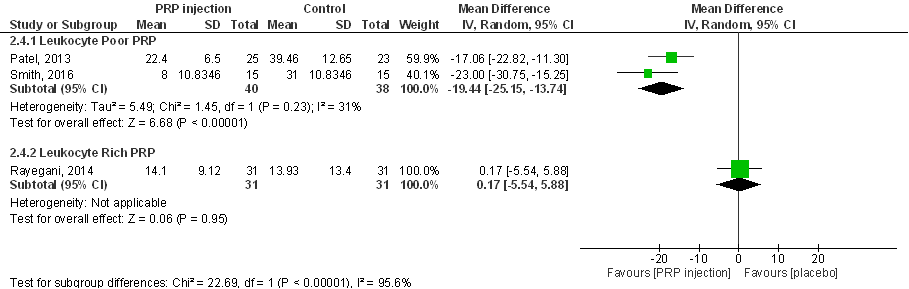
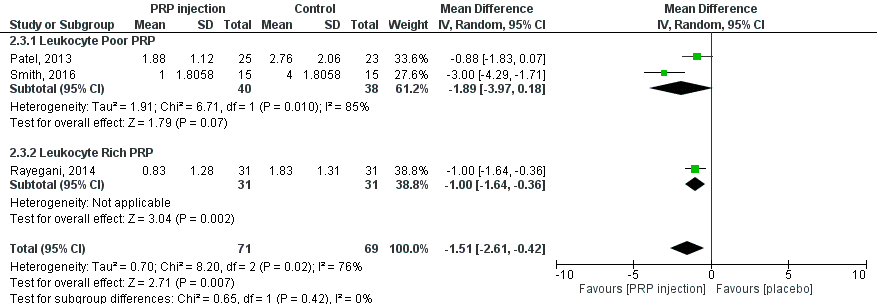
WOMAC-subscore gewrichtsstijfheid (score tussen 0 tot 8) 6 maanden post-injectie:
Figuur 11
De drie RCT’s laten een verbetering in gewrichtsstijfheid zien na behandeling met PRP in vergelijking met placebo, bij twee RCT’s (Smith 2016; Rayegani 2014) is sprake van een statistisch significant verschil. Na pooling is het gemiddelde verschil MD 1,51 (95%BI tussen 0,42 en 2,61), statistisch significant en klinisch (patiënt) relevant in het voordeel van injectie met PRP. Interpretatie van de resultaten wordt bemoeilijkt door onbalans tussen interventie- en controlegroepen op baseline (zie eerder in de tekst, en onder Beschrijving studies). Samenvattend zijn er aanwijzingen dat PRP-injecties in de knie mogelijk de gewrichtsstijfheid als gevolg van artrose aan de knie aanzienlijk (statistisch significant, en klinisch en patiënt relevant) kunnen verminderen, ook op de langere termijn.
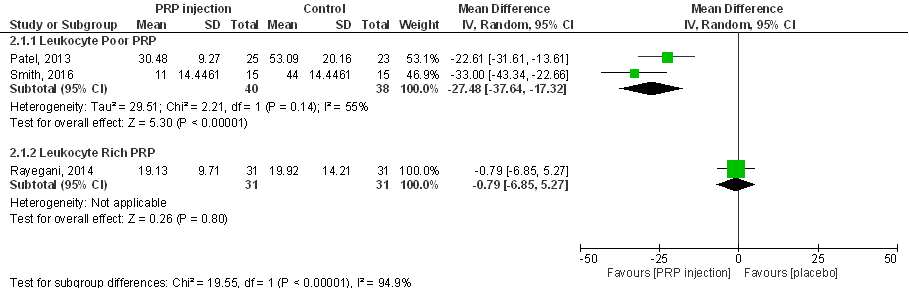
WOMAC-totaalscore (score tussen 0-96) 6 maanden post-injectie:
Figuur 12
De WOMAC-totaal score is opgebouwd uit de subscores voor gewrichtspijn (0 tot 20 punten), fysiek functioneren (0 tot 68 punten), en gewrichtsstijfheid (0 tot 8) punten, en een analyse van de effecten van PRP op de totaal score geeft dan ook een beeld dat vergelijkbaar is met de analyse van gewrichtspijn en fysiek functioneren. Pooling van alle drie de studies is niet verantwoord vanwege onacceptabel grote statistische heterogeniteit (I2 94%), en er lijkt sprake van een aanzienlijke (klinisch en patiënt relevante) verbetering van de WOMAC-totaal score na injectie van leukocytenarm PRP, gemeten zes maanden na behandeling (zie bovenstaande forest plot), maar ook op kortere en langere termijn (Patel 2013; Smith 2016). Samenvattend zijn er aanwijzingen dat (leukocytenarm) PRP-injecties in de knie mogelijk de klachten als gevolg van artrose aanzienlijk (statistisch significant, en klinisch en patiënt relevant) kunnen verminderen (resulterend in lagere WOMAC-totaal scores), ook op de langere termijn. Een uitspraak over de effectiviteit van leukocyten-rijk PRP is niet mogelijk.
Overige uitkomstmaten (zie Relevante uitkomstmaten onder Zoeken en selecteren) zoals kwaliteit van leven, withdrawal from trial, tijd tot chirurgische interventie, en kosten werden niet als uitkomstmaat gerapporteerd in de systematische review van Kanchanatawan (2016).
Bewijskracht van de literatuur
De bewijskracht is in alle gevallen gebaseerd op resultaten uit gerandomiseerd onderzoek en start derhalve hoog. De bewijskracht voor de uitkomstmaten gewrichtspijn en fysiek functioneren bij behandeling met leukocyten-arm PRP is met twee niveaus verlaagd naar laag vanwege risk of bias (met name onbalans tussen interventie- en controlegroep op baseline; een niveau verlaagd), en imprecisie (onvoldoende studieomvang; een niveau verlaagd). De bewijskracht voor de uitkomstmaten gewrichtspijn en fysiek functioneren bij behandeling met leukocyten-rijk PRP is verder verlaagd naar zeer laag vanwege ernstige risk of bias (niet gemaskeerde groepstoekenning, onbalans tussen interventie- en controlegroep op baseline; twee niveaus verlaagd), en imprecisie (enkele studie van onvoldoende studieomvang; twee niveaus verlaagd). De bewijskracht voor de uitkomstmaat (ernstige) adverse events werd verlaagd naar zeer laag, vanwege een hoge risk of bias (onduidelijke definitie en rapportage; verlaging met twee niveaus), inconsistentie (tegenstrijdige resultaten tussen individuele studies; verlaging met een niveau) en (ernstige) imprecisie (onvoldoende studieomvang, zeker voor ernstige adverse events; verlaging met een tot twee niveaus). De bewijskracht voor de uitkomstmaat gewrichtsstijfheid is met twee niveaus verlaagd naar laag vanwege risk of bias (met name onbalans tussen interventie- en controlegroep op baseline; een niveau verlaagd), en imprecisie (onvoldoende studieomvang; een niveau verlaagd).
deelvraag 4: bloedplaatjes (PRP) injecties in de heup
Beschrijving studies
Er werden geen relevante studies gevonden naar de waarde van PRP-injecties ter vermindering van klachten bij patiënten met artrose aan de heup.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag (vragen):
- Wat zijn de gunstige en ongunstige effecten van intra-articulaire corticosteroïd-injecties in vergelijking met geen behandeling of placebo bij volwassen patiënten met klachten als gevolg van artrose aan de knie?
- Wat zijn de gunstige en ongunstige effecten van intra-articulaire corticosteroïd-injecties in vergelijking met geen behandeling of placebo bij volwassen patiënten met klachten als gevolg van artrose aan de heup?
- Wat zijn de gunstige en ongunstige effecten van intra-articulaire platelet-injecties in vergelijking met geen behandeling of placebo bij volwassen patiënten met klachten als gevolg van artrose aan de knie?
- Wat zijn de gunstige en ongunstige effecten van intra-articulaire platelet-injecties in vergelijking met geen behandeling of placebo bij volwassen patiënten met klachten als gevolg van artrose aan de heup?
Relevante uitkomstmaten
De werkgroep achtte patiënt-gerapporteerde gewrichtspijn (NRS, VAS; pijnsubschaal van WOMAC, KOOS, HOOS) en patiëntgerapporteerd fysiek functioneren (beperkingen bij het uitvoeren van algemeen dagelijkse activiteiten; relevante subschalen van IKS, WOMAC kneescore, WOMAC hip score, KOOS, HOOS, Oxford Knee Score, en Oxford Hip Score) cruciale uitkomstmaten. Percentage responders (op basis van patiënt gerapporteerde uitkomstmaten) werd benoemd als een belangrijke uitkomstmaat. Responderanalyses worden bij voorkeur uitgevoerd op basis van de OMERACT-OARSI set van responder criteria (Pham 2003) die zijn gebaseerd op veranderingen in pijn, fysiek functioneren en algemene verbetering (patient’s global assessment). De volgende uitkomstmaten werden eveneens als belangrijk benoemd: patiëntgerapporteerde gewrichtsstijfheid, kwaliteit van leven (QoL), patiënttevredenheid, participatie (betaald werk, sport, vrijetijdsbesteding), adverse events (bijwerkingen en complicaties), therapietrouw (compliantie; withdrawal from trial), tijd tot chirurgische interventie (elke vorm van chirurgie gerelateerd aan de klachten als gevolg van artrose), kosten (kosteneffectiviteit; ook lange termijn (vijf jaar)), en zorggebruik.
Klinische relevantie en grenzen voor klinische besluitvorming
Op basis van een analyse van de minimaal klinisch relevante verschillen (zie module 'Oefentherapie bij heup- of knieartrose') heeft de werkgroep besloten een MCID (minimal clinically important difference) te hanteren van 0,37 SD (standaarddeviaties) voor gewrichtspijn en fysiek functioneren, overeenkomend met 7 tot 8 punten op een 0-100 meetschaal. Voor de overige uitkomstmaten werden de door de internationale GRADE working group voorgestelde default grenzen gehanteerd voor klinische relevantie: een verschil in relatief risico van 25% bij dichotome uitkomstmaten, en een verschil van een halve standaarddeviatie voor continue uitkomstmaten.
Deelvraag 1: zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Elsevier) is voor de periode van 1 februari 2015 tot 8 september 2016 met relevante zoektermen gezocht naar studies (Engelstalig) die corticosteroïd-injecties vergeleken met placebo of geen behandeling bij patiënten met knieartrose. De zoekactie leverde een recente systematische review op van zeer goede kwaliteit. Deze Cochrane review (Jüni 2015) dekt de literatuur tot 3 februari 2015, en is aangevuld met relevante recentere studies. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 88 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria (zelfde criteria als de review van Jüni, 2015): (quasi-) gerandomiseerd vergelijkend onderzoek; interventiegroep ontving corticosteroïdinjectie (niet gespecificeerd); de controlegroep ontving een placebo of geen interventie; de patiëntengroepen waarvan minstens 75% aangetoonde artrose van de knie had. Op basis van titel en abstract werden in eerste instantie 20 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 19 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 1 studie definitief geselecteerd.
Eén onderzoek werd opgenomen in de literatuuranalyse, namelijk de Cochrane review van Jüni, 2015. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Deelvraag 2: zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Elsevier) is op 8 september 2016 met relevante zoektermen gezocht naar studies (Engelstalig) die corticosteroïdinjecties vergeleken met placebo of geen behandeling bij patiënten met heupartrose. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 95 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: (quasi-) gerandomiseerd vergelijkend onderzoek; interventie-groep ontving corticosteroïd-injectie (niet gespecificeerd); de controlegroep ontving een placebo of geen interventie. Op basis van titel en abstract werden in eerste instantie 15 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 14 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 1 studie definitief geselecteerd.
Eén onderzoek werd opgenomen in de literatuuranalyse, namelijk de systematische review van McCabe (2016). De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Deelvraag 3 en 4: zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Elsevier) is op 14 september 2016 met relevante zoektermen gezocht naar studies (alle talen) die bloedplaatjes (platelet-rich plasma, PRP)-injecties vergeleken met placebo of geen behandeling bij patiënten met knie- of heupartrose. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 98 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: (quasi-) gerandomiseerd vergelijkend onderzoek; interventiegroep ontving een bloedplaatjes-injectie (niet gespecificeerd); de controlegroep ontving een placebo of geen interventie. Op basis van titel en abstract werden in eerste instantie 44 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 42 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en twee studies definitief geselecteerd. De geselecteerde studies betreffen knieartrose, er werden geen relevante studies gevonden voor heupartrose.
Er werden geen relevante studies gevonden voor heupartrose (deelvraag-4). Voor de toepassing van PRP bij knieartrose (deelvraag-3) werden twee onderzoeken opgenomen in de literatuuranalyse, namelijk de systematische review (SR) van Kanchanatawan (2016) die de literatuur dekt tot augustus 2015, en een aanvullende recente RCT (Smith 2016). De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Atchia I, Kane D, Reed MR, et al. Efficacy of a single ultrasound-guided injection for the treatment of hip osteoarthritis. Ann Rheum Dis. 2011 ;70(1):110-6. doi: 10.1136/ard.2009.127183. Epub 2010 Nov 10. PubMed PMID: 21068096.
- Bannuru RR, Schmid CH, Kent DM, et al. Comparative effectiveness of pharmacologic interventions for knee osteoarthritis: a systematic review and network meta-analysis. Ann Intern Med. 2015 Jan 6;162(1):46-54. doi: 10.7326/M14-1231. Review. PubMed PMID: 25560713.
- Bedard NA, Pugely AJ, Elkins JM, et al. Insall Award: Do Intraarticular Injections Increase the Risk of Infection After TKA? Clin Orthop Relat Res. 2017 ;475(1):45-52. doi: 10.1007/s11999-016-4757-8. PubMed PMID: 26970991; PubMed Central PMCID: PMC5174022.
- Bennell KL, Hunter DJ, Paterson KL. Platelet-Rich Plasma for the Management of Hip and Knee Osteoarthritis. Curr Rheumatol Rep. 2017 ;19(5):24. doi: 10.1007/s11926-017-0652-x. Review. PubMed PMID: 28386761.
- Bierma-Zeinstra SM, Verhagen AP. Osteoarthritis subpopulations and implications for clinical trial design. Arthritis Res Ther. 2011 Apr 5;13(2):213. doi: 10.1186/ar3299. Review. PubMed PMID: 21470393
- Chakravarty K, Pharoah PD, Scott DG. A randomized controlled study of post-injection rest following intra-articular steroid therapy for knee synovitis. Br J Rheumatol. 1994 ;33(5):464-8. PubMed PMID: 8173852.
- Charalambous CP, Prodromidis AD, Kwaees TA. Do intra-articular steroid injections increase infection rates in subsequent arthroplasty? A systematic review and meta-analysis of comparative studies. J Arthroplasty. 2014 ;29(11):2175-80. doi: 10.1016/j.arth.2014.07.013. Epub 2014 Aug 2. Review. PubMed PMID: 25201257.
- Charalambous CP, Tryfonidis M, Sadiq S, et al. Septic arthritis following intra-articular steroid injection of the knee--a survey of current practice regarding antiseptic technique used during intra-articular steroid injection of the knee. Clin Rheumatol. 2003 ;22(6):386-90. Epub 2003 Oct 15. PubMed PMID: 14677011.
- Dorleijn DMJ, Luijsterburg PAJ, Reijman M, et al. Intramuscular glucocorticoid injection versus placebo injection in hip osteoarthritis: a 12-week blinded randomised controlled trial. Ann Rheum Dis. 2018 Mar 7. pii: annrheumdis-2017-212628. doi: 10.1136/annrheumdis-2017-212628. (Epub ahead of print) PubMed PMID: 29514801.
- Flanagan J, Casale FF, Thomas TL, et al. Intra-articular injection for pain relief in patients awaiting hip replacement. Ann R Coll Surg Engl. 1988 ;70(3):156-7. PubMed PMID: 2457352.
- Gaffney K, Ledingham J, Perry JD. Intra-articular triamcinolone hexacetonide in knee osteoarthritis: factors influencing the clinical response. Ann Rheum Dis. 1995 ;54(5):379-81. PubMed PMID: 7794044.
- Hassan AS, Rao A, Manadan AM, et al. Peripheral Bacterial Septic Arthritis: Review of Diagnosis and Management. J Clin Rheumatol. 2017 ;23(8):435-442. doi: 10.1097/RHU.0000000000000588. PubMed PMID: 28926460.
- Hermans J, Bierma-Zeinstra SM, Bos PK, et al. The most accurate approach for intra-articular needle placement in the knee joint: a systematic review. Semin Arthritis Rheum. 2011 ;41(2):106-15. doi: 10.1016/j.semarthrit.2011.02.007. Review. PubMed PMID: 22036252.
- Jüni P, Hari R, Rutjes AW, et al. Intra-articular corticosteroid for knee osteoarthritis. Cochrane Database Syst Rev. 2015 Oct 22;(10):CD005328. doi: 10.1002/14651858.CD005328.pub3. Review. PubMed PMID: 26490760.
- Kanchanatawan W, Arirachakaran A, Chaijenkij K, et al. Short-term outcomes of platelet-rich plasma injection for treatment of osteoarthritis of the knee. Knee Surg Sports Traumatol Arthrosc. 2016 ;24(5):1665-77. doi: 10.1007/s00167-015-3784-4. Epub 2015 Sep 19. Review. PubMed PMID: 26387122.
- Kullenberg B, Runesson R, Tuvhag R, et al. Intraarticular corticosteroid injection: pain relief in osteoarthritis of the hip? J Rheumatol. 2004 ;31(11):2265-8. PubMed PMID: 15517641.
- Lambert RG, Hutchings EJ, Grace MG, et al. Steroid injection for osteoarthritis of the hip: a randomized, double-blind, placebo-controlled trial. Arthritis Rheum. 2007 ;56(7):2278-87. PubMed PMID: 17599747.
- Lomonte AB, de Morais MG, de Carvalho LO, et al. Efficacy of Triamcinolone Hexacetonide versus Methylprednisolone Acetate Intraarticular Injections in Knee Osteoarthritis: A Randomized, Double-blinded, 24-week Study. J Rheumatol. 2015 ;42(9):1677-84. doi: 10.3899/jrheum.150297. Epub 2015 Jul 1. PubMed PMID: 26136485.
- Luijsterburg PAJ, Bos PK, Bierma-Zeinstra SMA. Long-term Intra-articular Steroid Injections and Knee Cartilage. JAMA. 2017 Sep 26;318(12):1184. doi: 10.1001/jama.2017.11331. PubMed PMID: 28973606.
- Lyons C, Majeed A, Banarsee R. Effectiveness of high volume intra-articular injection of cortisone and lignocaine in osteoarthritis of the knee. Pilot study. North & West London journal of general practice: NWLJGP 2005;11(1): 238.
- Marsland D, Mumith A, Barlow IW. Systematic review: the safety of intra-articular corticosteroid injection prior to total knee arthroplasty. Knee. 2014 Jan;21(1):6-11. doi: 10.1016/j.knee.2013.07.003. Epub 2013 Aug 12. Review. PubMed PMID: 23948421.
- McAlindon TE, LaValley MP, Harvey WF, et al. Effect of Intra-articular Triamcinolone vs Saline on Knee Cartilage Volume and Pain in Patients With Knee Osteoarthritis: A Randomized Clinical Trial. JAMA. 2017 May 16;317(19):1967-1975. doi: 10.1001/jama.2017.5283. PubMed PMID: 28510679.
- McCabe PS, Maricar N, Parkes MJ et al. The efficacy of intra-articular steroids in hip osteoarthritis: a systematic review. Osteoarthritis Cartilage. 2016 ;24(9):1509-17. doi: 10.1016/j.joca.2016.04.018. Epub 2016 Apr 30. Review. PubMed PMID: 27143362.
- Montañez-Heredia E, Irízar S, Huertas PJ, et al. Intra-Articular Injections of Platelet-Rich Plasma versus Hyaluronic Acid in the Treatment of Osteoarthritic Knee Pain: A Randomized Clinical Trial in the Context of the Spanish National Health Care System. Int J Mol Sci. 2016 Jul 2;17(7). pii: E1064. doi: 10.3390/ijms17071064. PubMed PMID: 27384560
- Neustadt DH (1985). Intraarticular therapy for rheumatoid synovitis of the knee: Effects of the post-injection rest regimen. Clin Rheum Prac 3:65-68.
- NOV (2013). Hyaluronzuur injecties bij artrose van de knie. Richtlijnendatabase. Link: richtlijnendatabase.nl/richtlijn/hyaluronzuur_injecties_bij_artose_van_de_knie (geraadpleegd op 22 jan 2018).
- Pal B, Morris J. Perceived risks of joint infection following intra-articular corticosteroid injections: a survey of rheumatologists. Clin Rheumatol. 1999;18(3):264-5. PubMed PMID: 11206357.
- Patel S, Dhillon MS, Aggarwal S, et al. Treatment with platelet-rich plasma is more effective than placebo for knee osteoarthritis: a prospective, double-blind, randomized trial. Am J Sports Med. 2013 ;41(2):356-64. doi: 10.1177/0363546512471299. Epub 2013 Jan 8. PubMed PMID: 23299850.
- Pereira LC, Kerr J, Jolles BM. Intra-articular steroid injection for osteoarthritis of the hip prior to total hip arthroplasty : is it safe? A systematic review. Bone Joint J. 2016 Aug;98-B(8):1027-35. doi: 10.1302/0301-620X.98B8.37420. Review. PubMed PMID: 27482013.
- Pham T, Van Der Heijde D, Lassere M, et al. ; OMERACT-OARSI. Outcome variables for osteoarthritis clinical trials: The OMERACT-OARSI set of responder criteria. J Rheumatol. 2003 ;30(7):1648-54. Review. PubMed PMID: 12858473.
- Qvistgaard E, Christensen R, Torp-Pedersen S, et al. Intra-articular treatment of hip osteoarthritis: a randomized trial of hyaluronic acid, corticosteroid, and isotonic saline. Osteoarthritis Cartilage. 2006 ;14(2):163-70. Epub 2005 Nov 14. PubMed PMID: 16290043.
- Ravi B, Escott BG, Wasserstein D, et al. Intraarticular hip injection and early revision surgery following total hip arthroplasty: a retrospective cohort study. Arthritis Rheumatol. 2015 ;67(1):162-8. doi: 10.1002/art.38886. PubMed PMID: 25250699.
- Rayegani SM, Raeissadat SA, Taheri MS, et al. Does intra articular platelet rich plasma injection improve function, pain and quality of life in patients with osteoarthritis of the knee? A randomized clinical trial. Orthop Rev (Pavia). 2014 Sep 18;6(3):5405. doi:10.4081/or.2014.5405. eCollection 2014 Aug 8. PubMed PMID: 25317308.
- Raynauld JP, Buckland-Wright C, Ward R, et al., Pelletier JP. Safety and efficacy of long-term intraarticular steroid injections in osteoarthritis of the knee: a randomized, double-blind, placebo-controlled trial. Arthritis Rheum. 2003 ;48(2):370-7. Erratum in: Arthritis Rheum. 2003 ;48(11):3300. PubMed PMID: 12571845.
- Shemesh S, Heller S, Salai M, et al. Septic arthritis of the knee following intraarticular injections in elderly patients: report of six patients. Isr Med Assoc J. 2011 ;13(12):757-60. PubMed PMID: 22332447.
- Shen L, Yuan T, Chen S, et al. The temporal effect of platelet-rich plasma on pain and physical function in the treatment of knee osteoarthritis: systematic review and meta-analysis of randomized controlled trials. J Orthop Surg Res. 2017 Jan 23;12(1):16. doi: 10.1186/s13018-017-0521-3. Review. PubMed PMID: 28115016.
- Sibbitt WL Jr, Band PA, Kettwich LG, et al. A randomized controlled trial evaluating the cost-effectiveness of sonographic guidance for intra-articular injection of the osteoarthritic knee. J Clin Rheumatol. 2011 ;17(8):409-15. doi: 10.1097/RHU.0b013e31823a49a4. PubMed PMID: 22089991.
- Sibbitt WL Jr, Kettwich LG, Band PA, et al. Does ultrasound guidance improve the outcomes of arthrocentesis and corticosteroid injection of the knee? Scand J Rheumatol. 2012 ;41(1):66-72. doi: 10.3109/03009742.2011.599071. Epub 2011 Nov 21. PubMed PMID: 22103390.
- Sibbitt WL Jr, Peisajovich A, Michael AA, et al. AD. Does sonographic needle guidance affect the clinical outcome of intraarticular injections? J Rheumatol. 2009 ;36(9):1892-902. doi: 10.3899/jrheum.090013. Epub 2009 Jul 31. PubMed PMID: 19648304.
- Smith PA. Intra-articular Autologous Conditioned Plasma Injections Provide Safe and Efficacious Treatment for Knee Osteoarthritis: An FDA-Sanctioned, Randomized, Double-blind, Placebo-controlled Clinical Trial. Am J Sports Med. 2016 ;44(4):884-91. doi: 10.1177/0363546515624678. Epub 2016 Feb 1. PubMed PMID: 26831629.
- van Middelkoop M, Arden NK, Atchia I, et al. The OA Trial Bank: meta-analysis of individual patient data from knee and hip osteoarthritis trials show that patients with severe pain exhibit greater benefit from intra-articular glucocorticoids. Osteoarthritis Cartilage. 2016 ;24(7):1143-52. doi: 10.1016/j.joca.2016.01.983. Epub 2016 Feb 2. PubMed PMID: 26836288.
- Waterbrook AL, Balcik BJ, Goshinska AJ. Blood Glucose Levels After Local Musculoskeletal Steroid Injections in Patients With Diabetes Mellitus: A Clinical Review. Sports Health. 2017 ;9(4):372-374. doi: 10.1177/1941738117702585. Epub 2017 Apr 10. Review. PubMed PMID: 28394710.
- Williams PL, Crawley JC, Freeman AM, et al. Feasibility of outpatient management after intra-articular yttrium-90: comparison of two regimens. Br Med J (Clin Res Ed). 1981 Jan 3;282(6257):13-4. PubMed PMID: 6778548; PubMed Central PMCID: PMC1503778.
- Winfield J, Crawley JC, Hudson EA, et al. Evaluation of two regimens to immobilise the knee after injections of yttrium-90. Br Med J. 1979 Apr 14;1(6169):986-7. PubMed PMID: 435953; PubMed Central PMCID: PMC1598646.
- Wright V, Chandler GN, Morison RA, et al. Intra-articular therapy in osteo-arthritis; comparison of hydrocortisone acetate and hydrocortisone tertiary-butylacetate. Ann Rheum Dis. 1960 ;19:257-61. PubMed PMID: 13786828.
- Yavuz U, Sökücü S, Albayrak A, et al. Efficacy comparisons of the intraarticular steroidal agents in the patients with knee osteoarthritis. Rheumatol Int. 2012 ;32(11):3391-6. doi: 10.1007/s00296-011-2188-0. Epub 2011 Nov 5. PubMed PMID: 22057944.
- Zhang W, Robertson J, Jones AC, et al. The placebo effect and its determinants in osteoarthritis: meta-analysis of randomised controlled trials. Ann Rheum Dis. 2008 ;67(12):1716-23. doi: 10.1136/ard.2008.092015. Epub 2008 Jun 9. Review. PubMed PMID: 18541604.
Evidence tabellen
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
Research question: what is the value of intra-articular injection of corticosteroid or platelet-rich plasma (PRP) in the treatment of patients with knee or hip osteoarthritis?
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Corticosteroids and knee osteoarthritis (subquestion-1) |
|||||||||
|
Jüni 2015 |
Yes |
Yes, 3 databases were searched, from inception up to 3 February, 2015 |
Yes |
Yes |
Not applicable |
Yes (risk of bias table) |
Yes |
Yes, funnel plots were presented |
Yes, reported for the systematic review and the included studies |
|
Corticosteroids and hip osteoarthritis (subquestion-2) |
|||||||||
|
McCabe 2016 |
Ye |
Yes, 6 databases were searched from inception to May, 2015 |
Yes |
Yes |
Not applicable |
Yes, Jadad score (two studies scored 3, two studies scored 4, one study scored 5) |
No, not enough studies to allow pooling |
Yes (Quote: ‘’we cannot exclude publication bias in which trials that failed to show a treatment effect for IASI may have been less likely to have been published’’) |
Yes, reported for included studies (some risk for potential conflicts of interest) and for the systematic review (no conflicts of interest) |
|
Platetlet-rich-plasma and knee osteoarthritis (subquestion-3) |
|||||||||
|
Kanchanatwan 2016 |
Yes |
Yes, 2 databases were searched from inception up to 13 August, 2015 |
Yes |
Yes |
Not applicable |
Yes (risk of bias table) |
No, not enough studies to allow pooling |
Yes, contour-enhanced funnel plots and Egger tests were performed |
No, only reported for systematic review itself. |
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Risk of bias table for intervention studies (randomized controlled trials)
Research question: what is the value of intra-articular injection of platelet-rich plasma (PRP) in the treatment of patients with knee osteoarthritis?
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Smith 2016 |
Automated internet-based randomization system |
Unlikely*1
|
Unlikely |
Unlikley
|
Unlikely |
Unlikely |
Unclear |
Unclear |
*1 Despite proper randomisation and concealment of allocation, considerable differences exist between intervention and control groups at baseline, most likely due to the small study size (total 30 patients): age 53.5 vs 46.6, and BMI 29.5 vs 27.5 in intervention vs control groups
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules..
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: what is the value of intra-articular injection of corticosteroid or platelet-rich plasma (PRP) in the treatment of patients with knee or hip osteoarthritis?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Corticosteroids and knee osteoarthritis (subquestion-1) |
|||||||
|
Jüni 2015 |
SR and meta-analysis of RCTs
Literature search up to 3 February 2015
A: Beyaz, 2012 B: Campos, 2013 C: Castro, 2007 D: Cederlof, 1966 E: Chao, 2010 F: Dieppe, 1980 G: Di Sante, 2012 H: Frias, 2004 I: Friedman, 1980 J: Gaffney, 1995 K: Grecomoro, 1992 L: Henriksen, 2015 M: Jones, 1996 N: Lyons, 2005 O: Miller, 1958 P: NTC00414427 Q: Ozturk, 2006 R: Petrella, 2015 S: Popov, 1989 T: Ravaud, 1999 U: Raynauld, 2003 V: Schue, 2011 W: Smith, 2003 X: Wright, 1960 Y: Yavuz, 2012 Z: Young, 2001 AA: Zhilyayev, 2012
Study design: See Cochrane review (characteristics of studies) Add on studies: B, C, G, H, K, L, Q, R, T, W.
Setting and Country: See Cochrane review (characteristics of studies)
Source of funding: See Cochrane review (characteristics of studies) ‘’ Eleven trials received financial support from a non-profit organisation and no trial was explicitly supported by a commercial organisation.’’
|
Inclusion criteria SR: -randomised or quasi -randomised controlled trials with a control group receiving sham or no intervention - at least 75% of participants with clinically or radiologically confirmed osteoarthritis of the knee -any type of intra-articular corticosteroid injection
Exclusion criteria SR: -patients with only inflammatory arthritis, such as rheumatoid arthritis
27 studies included (26 studies for the main outcome measure, 1 study only reported safety data (X))
Important patient characteristics at baseline: See Cochrane review (characteristics of studies)
|
Describe intervention: See Cochrane review (characteristics of studies) |
Describe control: See Cochrane review (characteristics of studies) |
End-point of follow-up: See Cochrane review (characteristics of studies)
For how many participants were no complete outcome data available? (intervention/control) See Cochrane review (characteristics of studies)
|
Outcome measure-1 Defined as pain main: pain 4-6 weeks after injection:
Effect measure: standardized mean difference (95% CI): See Cochrane review;
26 studies included Pooled effect (random effects model): (total: 922 participants in the intervention group; 827 participants in the control group)
-0.4 (95% CI -0.58 to -0.22) favoring corticosteroid injection Heterogeneity (I2): 68% Eggert’s test: p=0.3
Outcome measure-2 Defined as function main: function 4-6 weeks after injection: Effect measure: standardized mean difference (95% CI): See Cochrane review;
15 studies included Pooled effect (random effects model): (total: 546 participants in the intervention group; 468 participants in the control group)
-0.33 (95% CI -0.56 to -0.09) favoring corticosteroid injection Heterogeneity (I2): 69% Eggert’s test: p=0.047
Outcome measure-3 Defined as quality of life – main Effect measure: standardized mean difference (95% CI): J: 0.00 (-0.3 to 0.43) L: -0.02 (-0.41 to 0.38)
Pooled effect (random effects model): (total: 92 participants in the intervention group; 92 participants in the control group)
-0.01 (95% CI -0.3 to 0.28) favoring corticosteroid injection Heterogeneity (I2): 0%
Outcome measure-4 Defined as number of participants experiencing any adverse events – main
Effect measure: risk ratio (95% CI): R: 0.88 (0.63 to 1.22) X: 3.00 (0.14 to 65.16)
Pooled effect (random effects model): (total: 42 participants in the intervention group; 42 participants in the control group) 0.89 (95% CI 0.64 to 1.23) favoring corticosteroid injection Heterogeneity (I2): 0%
Outcome measure-5 Number of participants who withdraw because of adverse events – main
Effect measure: risk ratio (95% CI):
B: 0.33 (0.01 to 8.00) L: 0.33 (0.04 to 3.10)
Pooled effect (random effects model): (total: 102 participants in the intervention group; 102 participants in the control group) 0.33 (95% CI 0.05 to 2.07) favoring corticosteroid injection Heterogeneity (I2): 0%
Outcome measure-6 Number of participants experiencing any serious adverse events - main
Effect measure: risk ratio (95% CI): L: 0.33 (0.04 to 3.10) N: not estimable (no events) Q: not estimable (no events) R: 1.00 (0.15 to 6.68) T: not estimable (no events)
Pooled effect (random effects model): (total: 165 participants in the intervention group; 166 participants in the control group)
0.63 (95% CI 0.15 to 2.67) favoring corticosteroid injection Heterogeneity (I2): 0% |
Brief description of author’s conclusion ‘’We found most of the identified trials that compared intra-articular corticosteroids with sham or non-intervention control to be small and hampered by low methodological quality, and graded the quality of evidence for the major outcomes (function and pain red.) as ‘low’.’’ ‘’An analysis of multiple time points suggested that effects decrease over time (p≤0.011), and our analysis provided no evidence that an effect remains six months after a corticosteroid injection.’’
Personal remarks on study quality, conclusions, and other issues (potentially) relevant to the research question: Outcome measure 7 (joint space narrowing) was not included in our literature review since it was not selected as outcome measure.
The systematic review itself was supported by a grant from the NIHR, UK (NIHR Cochrane Direct Commmission Incentive Award)
Sensitivity analyses (excluding add-on studies: studies that added hylan/elektro therapy/exercise in the intervention and control group).
Pain main: (4-6 weeks after injection) Excluded studies (n=10): B, C, G, H, K, L, Q, R, T, W.
Effect measure: standardized mean difference (95%C). A: -0.69 (-1.26 to -0.12) D: 0.34 (-0.53, 1.21) E: -0.83 (-1.33, -0.33) F: -0.84 (-1.68, -0.00) I: -0.06 (-0.74, 0.61) J: -0.05 (-0.48, 0.38) M: -0.93 (-1.46, -0.39) N: -0.57 (-1.46, 0.33) O: -0.22 (-0.86, 0.43) P: -0.88 (-1.38, -0.38) S: -1.09 (-1.91, -0.27) U: 0.12 (-0.37, 0.60) V: -0.21 (-1.41, 1.00) Y: -1.54 (-2.00, -1.07) Z: -0.38 (-1.00, 0.23) AA: -0.47 (-0.84, -0.10)
Pooled effect (random effects model): (total: 501 participants in the intervention group; 415 participants in the control group)
-0.54 (95% CI -0.8 to -0.28) favoring corticosteroid injection Heterogeneity (I2): 67%
Function main: (4-6 weeks after injection) Excluded studies (n=7): B, C, G, L, R, T, W.
Effect measure: standardized mean difference. A: -1.10 (-1.70, -0.50) E: -0.97 (-1.50, -0.45) J: 0.21 (-0.22, 0.64) N: -1.13 (-2.08, -0.18) S: -1.09 (-1.91, -0.27) U: 0.07 (-0.42, 0.55) Y: -0.81 (-1.24, -0.38) Z: -0.16 (-0.77, 0.46) Pooled effect (random effects model): (total: 272 participants in the intervention group; 202 participants in the control group) -0.58 (95% CI -0.99 to -0.17) favoring corticosteroid injection Heterogeneity (I2): 76%
For the other outcomes, no sensitivity analyses was done since only one study would remain after exclusion.
Heterogeneity: clinical and statistical heterogeneity; explained versus unexplained (subgroup analysis) |
|
Corticosteroids and hip osteoarthritis (subquestion-2) |
|||||||
|
McCabe 2016
Study characteristics and results are extracted from the SR (unless stated with *) |
SR and meta-analysis of RCTs
Literature search up to May, 2015
A: Flanagan, 1988 B: Kullenberg, 2004 C: Qvistgaard, 2006 D: Lambert, 2007 E: Atchia, 2011
Study design: A: RCT, 3 arms, parallel B: RCT, parallel C: RCT, 3 arms, parallel D: RCT, parallel E: RCT, parallel
Setting and Country: A: single center, UK B: single center, Sweden C: single center, Denmark D: single center, Canada E: UK Source of funding: A: Not stated B: Not stated C: Oak Foundation, Erna Hamilton Foundation; the hyaluronic acid was donated by Fidia Inc, Italy. D: CHAR/NycoMed, MSI Foundation, Arthritis Society of Canada, University of Alberta Foundation E:National Institute of Health Research and National Health Service; Durolane for injection was supplied by Q-med* |
Inclusion criteria SR: -use of hip intra-articular steroid injection (IASI) -diagnosis of hip OA must have been based on the presence of hip pain and radiological evidence of OA -all trials must have included an intervention group which received a IASI and a control group who received a placebo (sham injection, normal saline or local anesthetic intra-articular injection)
Exclusion criteria SR: -trials comparing IASI with another active treatment without a control group
5 studies included
Important patient characteristics at baseline:
N, mean age A: 36 patients, range in yrs: 46tot 79 yrs B: 80 patients, 70 yrs C: 101 patients, 66 yrs D: 52 patients, 62 yrs E: 77 patients, 69 yrs
Sex: A: 25% Male B: not reported C: 36% male D: 40% male E: 44% male
Injection guidance A: fluoroscopy B: fluoroscopy C: ultrasound D: fluoroscopy E: ultrasound
Severity of OA A: awaiting total hip replacement B*: 100% had Ahlback grade 2 or worse; Join spac narrowing with cartilage destruction ≥50%; Pain at rest and on weigh bearing ≥3 VAS C*: Kellgren grade I-II: 57%; Kellgren grade III-IV: 43 % D*: Kellgren grade I-II: 35%; Kellgren grade III-IV: 65%; symptoms for ≥ 6 months E: Pain> 1 months; Listed for total hip replacement or NZ priority score ≥ 20
Groups comparable at baseline? Not reported |
Describe intervention:
A: group 1: 20 mg Triamcinolone (salt not specified) + 0.5% Bupivacaine 10mL; Group 2: 0.5% Bupivacaine 10 mL B: 80 mg triamcinolone acetonide C: group 1: 1 injection with 1mL methylprednisolone corticosteroid followed by 2 sham injections + 1mL 1% lidocaine; group 2: 3 injections of 2 ML Hyaluronic acid + 1mL 1% lidocaine Repeated injection after 14 days D: 40 mg trriamcinoline hexacetonide + 0,5% bupivacaine E: group 1: 120 mg methylprednisolone acetate + 1% lidocaine; group 2: Durolane + 1% lidocaine
|
Describe control:
A: 10 mL normal saline ; patients in I and C group received active and passive physiotherapy and hydrotherapy at 3 hours post-injection and on the following 2 mornings B: 1% mepivacaine C: 3 injections with 2mL saline water+ 1mL 1% lidocaine Repeated injection after 14 days D: normal saline + 0,5% bupivacaine E: group 1: normal saline + 1% lidocaine; group 2: standard care, no injection
|
End-point of follow-up:
A: 4, 8,. 12, 26 weeks B: 2, 12 weeks C: 2, 4, 12 weeks D: 4, 8 weeks E: 1, 4, 8 weeks
For how many participants were no complete outcome data available? (intervention/control) A: 1 patient B: 13 patients C: 0 D: after 6 months: 33 patients (63%) without complete outcome data E: 5 patients
|
Outcome measure-1 Defined as change on pain outcomes on a continuous scale. Effect measure: standardized mean difference (95%CI): B: 3 weeks post-injection: -4.27 (-5.08 to -3.46) C: 3 months post injection: -0.19 (-0.7 to 0.33) D: 2 months post injection: -1.31 (-1.92 to -0.7) All favoring corticosteroid injection.
Outcome measure-2 OMERACT-OARSI responder after 8 weeks; fixed effects model; no pooled effects D: RR: 3.73 (95%CI: 1.5 to 9.26) favoring Hip IASI E: RR: 3.5 (95%CI: 0.83 to 14.73) favoring Hip IASI
Outcome measure-3 Defined as effect on function B: significant improvement on the Katz ADL index 3 weeks post-injection for the steroid group, not further specified D, E: SF-36 physical and social functioning subscales 8 weeks post-injection, significant improvement for steroid group, not further specified
Outcome measure-4 Defined as safety of hip IASI (adverse events) Injection procedure itself was noted to be well tolerated (B, C, D, E)
C: 3 patients experienced a flare in pain post-injection but the authors did not allocate this to a specific treatment group.
D: at least one adverse event ‘’most mild and/or considered unrelated to treatment’’) in the 2 month-period: I: 51% C: 52%, not sign.
D: 1 serious adverse event (deep venous thrombosis 3 months post-injection in the intervention group;
|
Author’s conclusion: Hip IAISs, when performed with image guidance, appear to be well tolerated and may be effective in reducing pain and improving function in the short term in those with severe hip OA.
Personal remarks on study quality, conclusions, and other issues (potentially) relevant to the research question:
The majority of participants were awaiting, or eligible for, a total hip replacement, which suggests that these participants had severe OA and so caution is needed in generalising these findings to those with less severe disease.
A: patients were given priority to the rct if their pain was worse B: all patients (in the intervention group) withdrew from the study before 12 weeks due to a lack of effect; McCabe states: only results up to the 3 weeks post-injection have been included in the review D: ‘’patients were asked to maintain a constant NSAID dosage throughout the trial’’; high loss-to-follow-up |
|
Platetlet-rich-plasma and knee osteoarthritis (subquestion-3) |
|||||||
|
Kanchanatwan 2016
PS., study characteristics and results are extracted from the SR (unless stated with *)
The systematic review was updated with Smith, 2016 (study C, see references) |
SR and meta-analysis of RCTs
Literature search up to 13th of August, 2015
A: Patel, 2013 B: Rayegani, 2014 C: Smith, 2016
Study design: A: RCT, parallel B: RCT, parallel C: RCT, parallel
Setting and Country: A: India, single center* B: Iran, multi-center* C:US, single center
Source of funding: A: Not reported * B: ‘’ the authors would thank Hakim Pharmaceutical Company for providing acetaminophen to patients free of charge for this clinical trial’’; ‘’ the authors declare no potential conflicts of interest’’ * C: Industrial authorship: the author (the only author!) is consultant for Arthrex Inc; Arthrex Inc provided support for the study
|
Inclusion criteria SR: -rct’s or quasi experimental designs with primary OA knee patients - compared clinical outcomes between platelet-rich plasma (PRP) with hyaluronic acid, normal saline solution or placebo (no treatment). -compared at least one of the following outcomes: range of motion, adverse events, function score, osteoarthritis indices including WOMAC total score, WOMAC sub-scores, Lequesne algofunctional index, IKDC subjective score, EQ-VAS -had sufficient data to extract and pool, i.e. reported mean, SD and numbers of subjects according to treatments for continuous outcomes; number of patients according to treatment for dichotomous outcomes.
Exclusion criteria SR: Not applicable
2 studies included
Important patient characteristics at baseline:
N, mean age A: 51 patients (group B and C were used in this analysis; group A received a single injection and these data were not used in the systematic review)* 52.7 yrs B: 62 patients, 56.4 yrs C: 30 patients, 50 yrs
Sex: A: 22.9% Male B: 6.5% Male C: 37% Male
BMI: mean, SD A: 26.0, nr B: 27.8, nr C: 28.5, 5,91
Platelet concentration per mL A: 310.149 B:>150.000 C: not reported
OA grade (Kellgren-Lawrence, KL) A: 89.6% KL I-II B: 64.5% KL I-II C: 60% KL II; 40% KL III
Injection (times) A: 2 injections, 3 weeks in between B: 2 injection, 4 weeks in between C: 3 injections, 1 week in between
Groups comparable at baseline? A: no** B: no** C: no** ** see Note |
Describe intervention:
A 2 injections of Leukocyte-poor PRP (1500 rpm for 15 minutes, single spinning), 100 mL bag with CPD-A1 (citrate phosphate dextrose and adenine) B: 2 injections of Leukocyte Rich PRP (1600 rpm for 15 minutes and 2800 rpm for 7 minutes, double spinning), 35-40 mL blood; exercise and acetaminophen 500 mg according to patients needs up to 2 g a day C: 3 injection, single spin, 1500 rpm for 5 minutes, single spinning, at least 3 to maximum 8mL autologous conditioned plasma, Leukocyte poor-PRP
WOMAC scores at baseline Total (0-96) A: 53.20 B: 43.29 C: 47 Pain (0-20) A: 10.62 B: 9.13 C: 10 Function (0-68) A: 39.1 B: 31.86 C: 32 Stiffness (0-8) A: 3.50 B: 2.3 C: 4
|
Describe control:
A: normal saline solution B: exercise and acetaminophen 500 mg according to patients needs up to 2 g a day C: normal saline solution
WOMAC scores at baseline Total (0-96) A: 45.54 B: 33.82 C: 46 Pain (0-20) A: 9.04 B: 7.12 C: 11 Function (0-68) A: 33.80 B: 25.03 C: 31 Stiffness (0-8) A: 2.70 B: 1.67 C: 4 |
End-point of follow-up:
A: 6 months B: 6 months C: 12 months (however, outcomes after 6 months were used in the analysis)
For how many participants were no complete outcome data available? (intervention/control) A: I: 0; C: 3 (did not receive allocated intervention)* B: I: n=1; C: n=1 (and another person excluded from analysis)* C: Not reported
|
Outcome measure-1 Defined as WOMAC- score 6 months post-injection; Effect measure: mean difference (95% CI):
WOMAC total (0-96) Leukocyte poor PRP A: -22.61 (-31.61 to -13.61) C:-33 (-43.34 to -22.66) Subtotal: -27.48 (-37.64 to -17.32) Heterogeneity (I2): 55%
Leukocyte rich PRP B: -0.79 (-6.85 to 5.27)
Pooled effect (random effects model): -18.47 (95% CI -38.41 to 1.47) favoring PRP injections Heterogeneity (I2): 94%
WOMAC pain (0-20) Leukocyte poor PRP A: -4.69 (-6.71 to -2.67) C: -6 (-8.58 to -3.42) Subtotal: -5.19 (-6.78 to -3.59) Heterogeneity (I2): 0%
Leukocyte rich PRP B: -0.96 (-2.88 to 0.96)
Pooled effect (random effects model): -3.8 (95% CI -6.81 to -0.8) favoring PRP injections Heterogeneity (I2): 83%
WOMAC stiffness (0-8) Leukocyte poor PRP A: -0.88 (-1.83 to 0.07) C: -3.00 (-4.29 to -1.71) Subtotal: -1.89 (-3.97 to 0.18) Heterogeneity (I2): 85%
Leukocyte rich PRP B: -1.00 (-1.64 to -0.36)
Pooled effect (random effects model): -1.51 (95% CI -2.61 to -0.42) favoring PRP injections Heterogeneity (I2): 76%
WOMAC function (0-68) Leukocyte poor PRP A: -17.06 (-22.82 to -11.3) C: -23.00 (-30.75 to -15.25) Subtotal: -19.44 (-25.15 to -13.74) Heterogeneity (I2): 31%
Leukocyte rich PRP B: 0.17 (-5.54 to 5.88)
Pooled effect (random effects model): -13.14 (95% CI -26.85 to 0.57) favoring PRP injections Heterogeneity (I2): 95.6%
Outcome measure-2 Adverse events Risk ratio (95% CI) Leukocyte poor PRP A: 21.23 (1.32 to 341.04) C: 0.33 (0.01 to 7.58) Leukocyte rich PRP B: not estimable (outcome measure was not reported)
|
Authors suggest that PRP injection is more efficacious than HA injection and placebo in reducing symptoms and improving function and quality of life
Subgroup analysis on leukocyte poor PRP versus leukocyte rich PRP
Smith 2016: written by one author, who was consultant at Arthrex Inc. during the study. Arthrex Inc sponsored the study (the blood centrifuge).*
**Note: in A and B there were considerable differences in WOMAC (sub)scores between intervention and control groups at baseline, with higher (better) (sub)scores in the control groups; in C patients in the intervention group were on average older (54 vs 47) and had higher BMI (29.5 vs 27.5). Also note that the meta-analyses were not corrected for baseline differences, which in this case (with relatively lower WOMAC scores in the control groups at baseline) reduces bias on the effect estimates at follow-up (i.e. the effect estimates in favour of PRP would increase if baseline corrections had been carried out).
|
NR: not reported
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 19-11-2018
Laatst geautoriseerd : 19-11-2018
Geplande herbeoordeling : 01-01-2025
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep in stand gehouden. Uiterlijk in 2024 bepaalt het bestuur van de Nederlandse Orthopaedische Vereniging (NOV) of deze richtlijn (module) nog actueel is. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NOV is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Diagnostiek heup- of knieartrose |
NOV |
2019 |
2021 |
eens in twee jaar |
NOV |
beschikbaarheid nieuwe criteria voor vroeg diagnostiek |
|
Zelfmanagement educatie en informatie |
NOV |
2019 |
2024 |
eens in de vijf jaar |
NOV, NHG, NVR, VRA, KNGF |
Lopend onderzoek, beschikbaarheid nieuwe interventies |
|
submodule Gewichtsverlies |
NOV |
2019 |
2024 |
Eens in de vijf jaar |
NOV, NHG |
Onderzoek naar effectiviteit van gewichtsverlies |
|
Oefentherapie bij heup- of knieartrose |
NOV |
2019 |
2024 |
eens in vijf jaar |
(NOV en KNGF of de werkgroep) |
lopend onderzoek |
|
Pijnmedicatie |
NOV |
2019 |
2024 |
eens in de vijf jaar |
NOV |
Lopend onderzoek, beschikbaarheid nieuwe middelen |
|
Intra-articulaire injecties |
NOV |
2019 |
2024 |
eens in de vijf jaar |
NOV |
Lopend onderzoek, beschikbaarheid nieuwe middelen |
|
Knie kniebraces en orheses |
NOV |
2019 |
2024 |
eens in de vijf jaar |
NOV |
Lopend onderzoek, beschikbaarheid nieuwe middelen |
|
Beleid bij specifieke subgroepen |
NOV |
2019 |
2024 |
eens in de vijf jaar |
NOV |
Lopend onderzoek |
|
Geïntegreerd beleid |
NOV |
2019 |
2024 |
eens in de vjif jaar |
NOV |
Lopend onderzoek, transmuraal overleg |
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
*De KNMP geeft de richtlijn 'bestuurlijke ondersteuning'
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). Patiëntenparticipatie bij deze richtlijn werd mede gefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
Doel en doelgroep
Doel
Doel is een multidisciplinaire richtlijn voor de conservatieve behandeling van heup- en knieartrose. De richtlijn beoogt een leidraad te geven voor de dagelijkse zorgpraktijk bij patiënten met artrose aan heup of knie, in eerste en tweede lijn. In de conclusies wordt aangegeven wat de wetenschappelijke stand van zaken is. De aanbevelingen zijn gericht op optimaal medisch handelen en zijn gebaseerd op de resultaten van wetenschappelijk onderzoek en overwegingen van de werkgroep, waarbij voor zover mogelijk de inbreng door patiënten is meegenomen (patiënten perspectief). Het doel is een hogere kwaliteit en meer uniformiteit in behandelingsstrategie, en het verminderen van praktijkvariatie. Daarvoor zijn duidelijke verwijscriteria van eerste naar tweede lijn noodzakelijk. Doel van de richtlijn is met name ook het verminderen van pijn en verbeteren van de gewrichtsfunctie door optimalisatie van de zorg. Het identificeren van kennislacunes zal richting kunnen geven aan nieuw wetenschappelijk onderzoek en nieuwe ontwikkelingen. Tot slot is naar aanleiding van de noodzaak tot beheersing van de verdere groei van kosten in de gezondheidzorg aandacht besteed aan kosten en kosteneffectiviteit.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg en patiëntvoorlichting voor patiënten met (verdenking op) artrose aan heup of knie: orthopedisch chirurgen, reumatologen, radiologen, revalidatieartsen, apothekers, fysiotherapeuten, oefentherapeuten Cesar of Mensendieck*, ergotherapeuten, huisartsen, klinisch geriaters, specialisten ouderengeneeskunde, anesthesiologen, sportartsen, arbo-artsen en bedrijfsartsen, en bijvoorbeeld ook alle artsen (niet) in opleiding voor huisarts en genoemde specialisten, en verpleegkundig specialisten en de physician assistants op dit gebied.
*waar oefentherapeut staat in de rest van het document wordt bedoeld oefentherapeut Cesar of Mensendieck
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2015 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van relevante specialismen die betrokken zijn bij de zorg voor personen met artrose aan heup of knie.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende drie jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- A.A. Polak, orthopedisch chirurg, Sint Franciscus Gasthuis, Rotterdam (voorzitter); Nederlandse Orthopaedische Vereniging;
- Prof. dr. S.M.A. Bierma-Zeinstra, hoogleraar Artrose, afdeling Huisartsgeneeskunde en Orthopedie, Erasmus MC, Universitair Medisch Centrum, Rotterdam; Nederlandse Orthopaedische Vereniging;
- J. Hoogmoed, klinisch geriater, SJG Weert, Weert; Nederlandse Vereniging voor Klinische Geriatrie;
- H. Jessen, NVA, anesthesioloog/ pijnspecialist, Kliniek ViaSana, Mill; Nederlandse Vereniging voor Anesthesiologie (mandaat tot 1 november 2017);
- J.W. Kallewaard, anesthesioloog/ pijnspecialist, Rijnstate Arnhem, AMC Amsterdam; Nederlandse Vereniging voor Anesthesiologie (mandaat vanaf 1 augustus 2018);
- L. Elzinga, anesthesioloog/ pijnspecialist, Bravis Ziekenhuis Roosendaal, Roosendaal; Nederlandse Vereniging voor Anesthesiologie (mandaat vanaf 1 augustus 2018);
- Prof. dr. G. Kloppenburg, reumatoloog, Leids Universitair Medisch Centrum LUMC, Leiden; Nederlandse Vereniging van Reumatologie;
- J.S. van der Kraan, patiëntvertegenwoordiger, beleidsmedewerker Patiëntenfederatie Nederland, Utrecht; Patiëntenfederatie Nederland;
- Dr. E.H.G. Oei, radioloog, Erasmus MC, Universitair Medisch Centrum, Rotterdam; Nederlandse Vereniging voor Radiologie;
- S. Spruijt, orthopedisch chirurg, HagaZiekenhuis, Den Haag; Nederlandse Orthopaedische Vereniging;
- Prof. dr. T.P.M. Vliet Vlieland, Leids Universitair Medisch Centrum LUMC, Leiden; Koninklijk Nederlands Genootschap voor Fysiotherapie;
- C.M.J. Wildervanck-Dekker, huisarts en kaderarts bewegingsapparaat, Julius Gezondheidscentrum Leidsche Rijn, De Meern; Nederlands Huisartsen Genootschap (mandaat tot 1 juni 2018);
- Dr. T. Kuijpers, epidemioloog, senior wetenschappelijk medewerker Nederlands Huisartsen Genootschap, Utrecht; Nederlands Huisartsen Genootschap (mandaat vanaf 1 juni 2018).
Klankbordgroep
- R. Hebing, poliklinisch apotheker, Apotheek Reade, Amsterdam; Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie; Nederlandse Vereniging van ZiekenhuisApothekers;
- T. Mesman, ergotherapeut, Revalidatie Centrum Reade, Amsterdam; Ergotherapie Nederland;
- Dr. L.A.M. Elders, bedrijfsarts, ConsuloBV, Rotterdam; Nederlandse Vereniging voor Arbeids- en Bedrijfsgeneeskunde;
- Dr. A.M. Boonstra, revalidatiearts, Revalidatie Friesland, Beetsterzwaag; Nederlandse Vereniging van Revalidatieartsen;
- M. Post, beleidsmedewerker Ontwikkeling & Wetenschap VvOCM, Utrecht; Vereniging van Oefentherapeuten Cesar en Mensendieck.
Met ondersteuning van
- Dr. K.N.J. Burger, epidemioloog, senior adviseur Kennisinstituut Federatie van Medisch Specialisten;
- Dr. J.S. Boschman, adviseur Kennisinstituut Federatie van Medisch Specialisten;
- Dr. M.L. Molag, adviseur Kennisinstituut Federatie van Medisch Specialisten;
- E.A. Rake (MSc), junior adviseur Kennisinstituut Federatie van Medisch Specialisten;
- M.S. Oerbekke, adviseur Kennisinstituut Federatie van Medisch Specialisten;
- M. Wessels (MSc), medisch informatiespecialist, Kennisinstituut Federatie van Medisch Specialisten;
- N.F. Bullock, secretaresse, Kennisinstituut Federatie van Medisch Specialisten.
Met dank aan
- Dr A.P. Verhagen, fysiotherapeut en klinisch epidemioloog, Erasmus MC, Universitair Medisch Centrum, Rotterdam (voor het ter beschikking stellen van meta-analystische data).
Belangenverklaringen
De KNMG-Code “Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling” is gevolgd (KNAW 2016). Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventueel belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Polak (voorzitter) |
orthopedisch chirurg |
geen |
werkzaam in SFG ziekenhuis, lid v/d coöperatie met de persoonlijke BV Polak Beheer BV |
geen |
|
Bierma-Zeinstra |
Hoogleraar aan het Erasmus MC (onderzoek) |
geen |
lid van de internationale OARSI richtlijn commissie voor behandeling van artrose, lid van ARUK klinische studies commissie en van de wetenschappelijke commissie van het Annafonds, associate editor van Osteoarthritis & Cartilage, lid van de editorial board van Maturitas, en lid van de scientific advisory board van het Arthritis UK Pain Centre in Nottingham. Mede verantwoordelijk voor organisatie en inhoud van de tweejarige NHG erkende kaderopleiding voor huisartsen "Kaderhuisarts bewegingsapparaat". Op mijn onderzoeksafdeling ontvingen wij voor artrose onderzoek gedurende de ontwikkeling van de richtlijn (2015-2018) subsidies van het reumafonds (Dutch Arthritis Foundation), ZonMW, EU FP 7, het fonds NutsOhra, CZ, en ZonMW. Het betreft de volgende studies: Intramuscular corticosteroid injections in hip OA: a randomized controlled trial. Dutch Arthritis Foundation; Optimizing the management of osteoarthritis and other chronic musculoskeletal pain disorders in primary care. Dutch Arthritis Foundation, Long-term Program; Cost-effectiveness of viscosupplementation therapy for patients with osteoarthritis of the knee: a randomized clinical trial. ZonMW; Health Care Efficiency Research Programme: sub-programme Effects & Costs; D-board (Novel Diagnostics and Biomarkers for Early Identification of Chronic Inflammatory Joint Diseases) EU-FP7 Health; Dutch consortium ARGON. Optimal timing for osteoarthritis surgery. NOV/Dutch Arthritis Foundation; Duloxetine for chronic osteoarthritis pain; an important alternative? ZonMW; Rational Pharmacotherapy programme; Diagnostic criteria for early osteoarthritis of hip and knee. Dutch Arthritis Foundation; Joint implementation of guidelines for osteoarthritis in Western Europe: JIGSAW-E (first applicant Krysia Diedzics, UK). EIT Health (European Union); IFEROA- Identification of the female specific etiology and risk groups for osteoarthritis; Intramuscular corticosteroid injections in hip OA: a randomized controlled trial. Nuts Ohra; Is MRI of the knee cost-effective in patients with traumatic knee complaints in primary care? (first applicant P. Luijsterburg) ZonMW; Health Care Efficiency Research Programme: sub-programme Effects & Costs (K€ 616); Cost-effectiveness of two treatment strategies of an anterior cruciate ligament rupture. A randomized clinical study. ZonMW; Health Care Efficiency Research Programme: sub-programme Effects & Costs; Should a traumatic meniscal tear be resected? (first applicant M. Reijman) ZonMW; sub-programme Effects & Costs (K€ 400); Shock wave therapy for ankle arthrodesis (first applicant D. Meuffels). Dutch Arthritis Foundation; Like-2-Run (first applicant M. van Middelkoop) ZonMw Sport en Bewegen (K€ 157); Growing up: the influence of lifestyle on joint health (first applicant M. Van Middelkoop). EUR-fellowship; Effectiveness in knee osteoarthritis of an intra-articular corticosteroid injection versus an intra-muscular gluteal corticosteroid injection versus no injection in general practice: a multicenter randomized, 24 weeks comparative parallel-group trial. ZonMW Programme Primary Focus; PaTIO study: PhysiotherApeutic Treat-to-target Intervention after Orthopaedic surgery; A cost-effectiveness study. ZonMW/NOV Zorgevaluatie Leading the Change; Evaluation of care for patients with hip and knee osteoarthritis on the cross-road of primary and secondary care. CZ Health Insurance; The OA Trial Bank. Dutch Arthritis Foundation. Consultant op uurbasis (betaald aan mijn werkgever Erasmus MC) voor Infirst Healthcare ltd in de UK. Binnen dit consultancy chief investigator voor de "Flare study", a Three Arm Double blind, Randomised Multicentre Study to Investigate the Non-Inferiority of a Soft Gel Capsule of Ibuprofen Lipid Formulation (total daily dose 1200 mg) versus a Standard Soft Gel Ibuprofen Capsule (total daily dose 1200 mg and 2400 mg) in the Treatment of Patients with Episodic Knee Arthralgia/Flaring Knee Pain; eenmalig consultant geweest voor Regeneron met betrekking tot welke baseline variablelen in studies bepaald moeten worden voor het vaststellen van responsieve subgroepen bij gebruik van anti-NGF. |
was beoogd als voorzitter maar in overleg is besloten om een andere voorzitter te benoemen om zo elke schijn van belangenverstrengeling te voorkomen; om dezelfde reden geen voortrekker of meelezer op de pijnmedicatie vraag. Omdat de nieuwe pijnstiller (Soft Gel Capsule of Ibuprofen) niet verkrijgbaar is op de Nederlandse markt en geen onderdeel vormt van de richtlijnmodule, was deelname aan de besluitvorming wel mogelijk. |
|
Spruijt |
Orthopaedisch chirurg, Maartenskliniek Woerden/Nijmegen (tot 1 septemeber 2017). Orthopaedisch chirurg HagaZiekenhuis Den Haag (per 1 september 2017). |
geen |
Met Spruijt Praktijk o.a. lid Medisch Specialisten Coöperatief Haga; Consultant Zimmer Biomet (presentaties, cursussen, scholing); In de afgelopen jaren zijn er 2 RCTs in ons ziekenhuis gedaan waarbij kniedistractie vergeleken werd met tibiakop-osteotomie en kniedistractie met knieprothesiologie (financiering door ZonMw) |
geen |
|
Oei |
Musculoskeletaal radioloog, Erasmus MC Rotterdam; Unviversitair docent musculoskeletale beeldvorming, Erasmus MC Rotterdam/ Erasmus Universiteit Rotterdam |
geen |
geen |
geen |
|
Wildervanck-Dekker |
huisarts, kaderarts bewegings-apparaat/ intern consulent beweging-sapparaat Leidsche Rijn Julius Gezondheidscentra |
geen |
geen |
geen |
|
Kuijpers |
Epidemioloog, senior wetenschappelijk medewerker Nederlands Huisartsen Genootschap |
geen |
geen |
geen |
|
Vliet Vlieland |
Hoogleraar Doelmatigheid Revalidatie-processen/ Fysiotherapie, LUMC; Adviseur en Coordinator Wetenschappelijk Onderzoek Sophia Revalidatie Den Haag en Rijnlands Revalidatie Centrum Leiden |
geen |
Bijzonder Hoogleraar vanwege het KNGF bij LUMC; Betrokkenheid bij relevante, lopende onderzoeken: Zorgnetwerken voor mensen met reumatische aandoeningen in Nederland, Vliet Vlieland (hoofdaanvrager/penvoerder) van den Ende (mede-aanvrager), Dekker (Mede-aanvrager), Subsidiegever: ReumaNederland; De-implementation of blood saving maesures in hip and knee arthroplasties, aanvrager: L. van Bodegom-Vos, P. Marang-van de Mheen, T. Vliet Vlieland, R. Nelissen, Subsidiegever: ZonMw |
geen |
|
Jessen |
Anesthesioloog/ pijnbehandelaar |
geen neven-werkzaamheden; extramurale tandheelkundige behandeling onder narcose als onderdeel van anesthesioloog |
Aandeel in kliniek SanaVisie betreft ZBC voor plastische en cosmetische chirurgie; werkzaam in kliniek VraSana betreft ZBC voor orthopedische, neurochirurgische behandelingen |
geen |
|
Elzinga |
Anesthesioloog-Pijnspecialist Bravis Ziekenhuis Roosendaal |
lid Bestuur Sectie Pijn en Palliatieve geneeskunde NVA (reiskostenbasis) |
geen |
geen |
|
Kallewaard |
Anesthesioloog pijnbestrijder Rijnstate (70%) en AMC (30%) |
voorzitter Sectie Pijn- en Palliatieve geneeskunde NVA; voorzitter BBC NVA (onbetaald) |
geen |
geen |
|
Kloppenburg |
hoogleraar medisch specialist, reumatoloog |
Lid Commissie Medische Ethiek (2011-2016); vergoeding wordt betaald aan de afd. Reumatologie, LUMC; Associate editor "Arthritis Rheumatism" (2010-2015); Associate editor "Arthritis Rheumatism" (2010-2015) |
Alle financiële vergoedingen zijn betaald aan het Leids Universitair Medisch Centrum: Consultancy EMD Serono Research & Development Institute (10-2016–2-2017) betreffende "DMOAD development in osteoarthritis"; Lid Advisory boards voor Abbvie (2016), GlaxoSmithKline (2016, 2017, 2018), Levicept (2016) betreffende artrose. Lid advisory board voor Pfizer (2018) "Tanezumab osteoarthritis global panel meeting". Author UptoDate "Management of hand osteoarthritis"(2017); Medevoorzitter van werkgroep voor Revisie van Clinical Trial richtlijnen voor handartrose op initiatief van OARS) (2013-2015); Voorzitter Programma Commissie voor jaarlijks congres OARSI (2015); Lid Task Force EULAR "EULAR Recommendations for the use of imaging in OA clinical practice" (2014-2015); Concilium Rheumatologicum voor Nederlandse Vereniging Reumatologie (NVR) (2013-heden); Lid Centrale Visitatiecommissie, NVR (2013-heden); Programma Commissie EULAR (2014-2017); Werkgroep Handartrose OMERACT; Lid Abstract Review Commissie "American College of Rheumatology" (2014, 2015); Lezing ter nascholing van Nederlandse Reumatologen (ACR Review 2015), gesponsord door Pfizer (vergoeding betaald aan LUMC); Lid Advisory Board "Nature Review Rheumatology" (start 2015); Lid Board of Directors OARSI (2017-heden); Lid werkgroep "Kennisagenda Reumatologie" voor NVR; Lid Health Care Professionals Working Party van de European Medicines Agency (EMA) namens de EULAR (start 2018); Alle grants zijn uit betaald aan het LUMC: Grant van European League Against Rheumatism (EULAR) voor "Development of Classifiction Criteria for Hand Osteoarthritis"; Grant van EULAR voor "2018 Update of the EULAR Recommendations for the Management of Hand Osteoarthritis"; Grant van Reumafonds voor "Randomized placebo-controlled trail with prednisolone in hand Osteoarthritis: a proof-of-concept study" (2015-2018); Langlopende ondersteuning van ReumaNederland voor artroseonderzoek (2013-2023); Grant van Europese Unie (IMI-EFPIA project Approach, start 2015); Grants van Pfizer voor onderzoek naar etanercept in handartrose (2008-2015); Principal Investigator Nederland van industrie geinitieerde klinische trials (Abbvie) naar effectiviteit en veiligheid van Lutikizumab bij knie- en handartrose |
nevenfuncties en belangen zijn besproken in de werkgroep in het licht van de geprioriteerde uitgangsvragen en besloten is dat er geen actie hoeft te worden ondernomen (adviezen zijn niet beperkt tot een bedrijf maar verstrekt aan een aantal elkaar beconcurrerende bedrijven; richtlijn bevat geen uitgangsvragen m.b.t. LEVI, tanezumab, lutikizumab of prednisolon); geen trekker op medicamenteuze uitgangsvragen. |
|
Hoogmoed |
klinisch geriater |
geen |
geen |
geen |
|
v/d Kraan |
beleidsmedewerker Patiëntenfederatie Nederland |
geen |
geen |
geen |
|
Hebing |
poliklinisch apotheker Apotheek Reade en onderzoeker Reade Research, reumatologie |
klankbord specialisme Vereniging van Jonge Apothekers (belangenbehartiging jonge apothekers in opleiding tot openbaar apotheker specialist, aanspreekpunt vervolgopleiding, kwaliteitsmonitoring vervolgopleiding; onbetaald); Lid Centraal College KNMP (lid namens Apothekers in opleiding tot specialist; betaald), SIG biotechnologie NVZA, OMERACT werkgroep (onbetaald) |
geen |
geen |
|
Mesman |
ergotherapeut/ handtherapeut Reade binnen artrose team Reumarevalidatie |
geen |
geen |
geen |
|
Elders |
Bedrijfsarts Ministerie van Binnenlandse Zaken en Koninkrijkrelaties/ P-Direkt Klinische Arbeids-geneeskundige Rijndam Revalidatie-centrum/ Arbeidsrevalidatie |
Functie bedrijfsarts: beoordelen en begeleiden van werknemers bij het Ministerie afdeling P-Direkt, tevens werkzaam als arts-gemachtigde voor vele Ministeries en Departementen van de Rijksoverheid |
voorzitter van de Nederlandse Vereniging voor Klinische arbeidsgeneeskunde |
|
|
Boonstra |
Revalidatiearts Revalidatie Friesland OCA |
voorzitter cie. Kwaliteit VRA |
geen |
geen |
|
Post |
Beleidsmedewerker ontwikkeling & wetenschap VvOCM |
geen |
afgevaardigde namens VvOCM in het PON (Partnerschap Overgewicht Nederland) |
geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afvaardiging van Patiëntenfederatie Nederland in de werkgroep en een tweetal focusgroepen georganiseerd door Patiëntenfederatie Nederland (aanverwant ‘Samenvatting focusgroepen artrose’). Daarnaast is er in de oriënterende fase gezocht naar literatuur vanuit patiëntenperspectief, hierbij is gebruik gemaakt van een gestandaardiseerd zoekfilter (Wessels 2016). ReumaNederland, de Poly-Artrose Lotgenoten Vereniging en de Nationale Vereniging ReumaZorg Nederland zijn gevraagd om knelpunten aan te leveren, en de conceptrichtlijn is voor commentaar voorgelegd aan genoemde patiëntenverenigingen.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Voor deze richtlijn zijn geen interne kwaliteitsindicatoren ontwikkeld (zie Indicatorontwikkeling onder Werkwijze).
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen via een invitational conference door:
Ergotherapie Nederland (EN), Bijwerkingencentrum Lareb, Nefemed, Nederlands Huisartsen Genootschap (NHG), Patiëntenfederatie Nederland, Nederlandse Vereniging voor Arbeids- en Bedrijfsgeneeskunde (NVAB), Nederlandse Vereniging van Reumatologie (NVR), Nederlandse Vereniging van ZiekenhuisApothekers (NVZA), Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie (KNMP), ReumaNederland, Poly-Artrose Lotgenoten Vereniging, Nationale Vereniging ReumaZorg Nederland, Zorginstituut Nederland (ZIN), Zelfstandige Klinieken Nederland (ZKN), Nederlandse Orthopaedische Vereniging (NOV), Zorgverzekeraars Nederland (ZN). Daarnaast is de Nederlandse Vereniging van Revalidatieartsen (VRA) benaderd voor een schriftelijke knelpuntanalyse op basis van het conceptraamwerk en de conceptnotulen van de invitational conference. Een verslag van de invitational conference met toelichting van de richtlijnwerkgroep is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen (Guideline International Network), systematische reviews (Medline (OVID), Cochrane Library), en literatuur over patiëntenvoorkeuren en patiëntrelevante uitkomstmaten (patiëntenperspectief; Medline (OVID)). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of bias (ROB) tabellen.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is i.p.v. ‘matig’
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz 2017).
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Bij de richtlijnontwikkeling is ervoor gekozen om organisatie van zorg aspecten expliciet bij de afzonderlijke modules/ uitgangsvragen te behandelen, met name in de module ‘Zelfmanagement, educatie en informatie’, de module ‘Beleid bij specifieke subgroepen’, en de module ‘Geïntegreerd beleid’; daarom is geen aparte module Randvoorwaarden (organisatie van zorg) opgenomen.
Indicatorontwikkeling
Voor deze richtlijn zijn geen interne kwaliteitsindicatoren ontwikkeld omdat naar inschatting van de werkgroep, het meten van relevante indicatoren (percentage patiënten dat terecht door huisarts naar orthopeed wordt verwezen, percentage patiënten dat terecht een gewrichtsvervanging ondergaat, percentage patiënten waarvoor de huisarts terecht röntgenonderzoek laat doen bij het stellen van de diagnose artrose) op grote praktische problemen zal stuiten. In alle gevallen zou moeten worden bepaald of er sprake is van een terechte of onterechte verwijzing en dit veronderstelt een strikte definitie van de onderliggende criteria en een adequate verslaglegging in EPD of patiëntendossier. Een strikte definitie voor het volledig doorlopen van een conservatieve (stepped-care) behandeling is niet mogelijk omdat de stepped-care behandeling op de individuele patiënt moet worden afgestemd. Beoordeling of er sprake is van een terechte afwijking van een strikte stepped-care behandeling vereist een uitvoerige en systematische verslaglegging van behandeling en onderliggende argumenten in het patiëntendossier die momenteel niet haalbaar is in de klinische praktijk. Door het ontbreken van eenduidige criteria zou zo'n beoordeling ook willekeurig zijn en weinig transparant. De werkgroep is van mening dat andere maatregelen ter bevordering van implementatie zinvoller zijn, en onderstreept de noodzaak om landelijke transmurale afspraken te maken in een apart traject met een brede werkgroep waarin alle stakeholders zijn vertegenwoordigd. Daarnaast is de werkgroep van mening dat er methodes moeten worden ontwikkeld om het conservatieve zorgtraject (stepped-care) goed en efficiënt in het EPD van de huisarts te registreren zoals de Joint Implementation of Guidelines for Osteroarthritis in Western Europe (JIGSAW-E) e-template (link: https://www.eithealth.eu/jigsaw-e). Wellicht kan aan zo'n registratie-template een diagnostische component worden toegevoegd zodat op eenvoudige en efficiënte wijze inzichtelijk kan worden gemaakt waarom röntgenfoto’s worden aangevraagd door de huisarts. Een analyse van de kwaliteit van de verslaglegging met behulp van registratie-templates in de klinische praktijk biedt in de toekomst mogelijk wel aanknopingspunten voor indicatoren.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk onderzoek van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder Aanverwante items).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. Daarnaast werden de volgende verenigingen en organisaties benaderd voor commentaar: Vereniging voor Sportgeneeskunde (VSG), Bijwerkingencentrum Lareb, ReumaNederland, Poly-Artrose Lotgenoten Vereniging (P-AL), Nationale Vereniging ReumaZorg Nederland, Zorginstituut Nederland (ZIN), Zelfstandige Klinieken Nederland (ZKN), Nederlandse Federatie van Universitair Medische Centra (NFU), Nederlandse Vereniging van Ziekenhuizen (NVZ), Samenwerkende Topklinische opleidingsZiekenhuizen (STZ), Zorgverzekeraars Nederland (ZN), Inspectie Gezondheidszorg en Jeugd (IGJ), Nederlandse Zorgautoriteit (NZa), Vereniging Innovatieve Geneesmiddelen (Nefarma), en Nefemed. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al.; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Hultcrantz M, Rind D, Akl EA, et al. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184.
KNAW, KNMG, GR, NHG, FMS (2016). Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling. Link: https://storage.knaw.nl/2022-08/Gedragscode-belangenverstrengeling-januari-2017.pdf
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. Link: http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al, editors. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008 17;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 ;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.


