Compressie therapie DVT van het been
Uitgangsvraag
- Wat is het effect van een therapeutische elastische kous bij patiënten met een proximale diepe veneuze trombose (DVT) van het been met betrekking tot het voorkomen/optreden van het post trombotisch syndroom (PTS) en recidief trombose?
- Wat is de gewenste duur van het dragen van een therapeutische elastische kous bij patiënten met een proximale diepe veneuze trombose (DVT) van het been met betrekking tot het voorkomen/optreden van het post trombotisch syndroom (PTS) en recidief trombose?
- Wat is het effect van compressie in de acute fase (binnen 48-uur na diagnose) met betrekking tot het verminderen van klachten en symptomen en het voorkomen/optreden van het PTS?
Aanbeveling
Schrijf een therapeutische elastische kous voor aan een patiënt met een DVT van het been.
Motiveer de patiënt de kous te dragen gedurende tenminste 6 maanden. Het is daarna een overweging om in geselecteerde patiënten met opeenvolgende lage Villalta scores (< 5, op 3 en 6 maanden) het dragen van de kous te staken. Bij patiënten met Villalta scores > 4, is het mogelijk beter de kous te blijven dragen.
Overweeg compressietherapie in de acute fase (binnen 48-uur) om pijn en/of oedeem te verminderen.
Overwegingen
Therapeutische elastische kousen na de acute fase
Het dragen van een therapeutische elastische kous lijkt te resulteren in een lagere incidentie van PTS ten opzichte van het dragen van geen kous of een placebo kous na de acute fase (Brandjes, 1997; Ginsberg, 2001; Kahn, 2014; Prandoni, 2004). Drie studies hebben gekeken naar de duur van de behandelingen waarbij er geen duidelijke relatie wordt aangetoond tussen behandelduur en het voorkomen van PTS (Aschwanden, 2008; Mol, 2016; ten Cate-Hoek, 2018). Een geïndividualiseerde duur kan een goed alternatief zijn ten opzichte van de standaard 2 jaar dragen van de kous. Temeer daar dit een aanzienlijke kostenbesparing met zich meebrengt. Een kosteneffectiviteit onderzoek van de studie van ten Cate-Hoek trial (Amin, 2018) liet een kostenbesparing van € 305,99 per patiënt per behandelperiode zien, met een netto monetair voordeel van €3205 (range 502 tot 5741). Dit betekent concreet dat door het individualiseren van de draagduur van de elastische compressiekous er in Nederland met 25.000 nieuwe gevallen van DVT per jaar, €88 miljoen (31 tot 144 miljoen) bespaard kan worden (gemeten over 2 jaar). In de studies is een kous tot de knie voorgeschreven, welke is aangemeten, vlakbrei, klasse III (enkeldruk 30-40 mm Hg).
Er zijn verschillende scoringssystemen beschikbaar voor PTS. Over de Villalta score is verreweg de meeste literatuur beschikbaar, maar een nadeel van de Villalta score is dat deze grotendeels berust op subjectieve klachten (van patiënten) en dit zou de betrouwbaarheid kunnen verminderen (Soosainathan, 2013). Het is belangrijk dat de zorgverlener die de Villalta score berekent geschoold is in het gebruik van deze score en de eerste tekenen van een PTS bij lichamelijk onderzoek kan herkennen. Op dit moment wordt in Nederland de Villalta score alleen door experts gebruikt en wordt hij niet standaard onderwezen in de geneeskunde opleiding. Instructie voor het uitvoeren van de Villalta score is bijgevoegd in Bijlage 1.
Compressietherapie in de acute fase
Compressie in de acute fase zou kunnen worden overwogen voor alle patiënten omdat dit pijn en oedeem vermindert en een betere trombusresolutie tot gevolg heeft (Amin 2018; Arpaie, 2007). Dit moet bij voorkeur gestart worden direct na de diagnose van een DVT, binnen 24- of 48-uur. Resolutie van de trombus is weer gerelateerd aan een lagere incidentie van PTS. Het gebruik van elastische compressiekousen geeft mogelijk een betere kwaliteit van leven. In het acute stadium kan er gekozen worden voor een zwachtel of een confectiekous. Voor het aanbrengen van een zwachtel is adequate scholing nodig.
Residuele obstructie van de venen (RVO) is niet als uitkomstmaat meegenomen in de analyse voor de herziening van deze richtlijn. Amin (2018) heeft laten zien dat compressietherapie in de acute fase resulteert in minder RVO dan geen compressietherapie (46,3% versus 66,7% met OR 0,46; 95% BI: 0,27 tot 0,80). Op de lange termijn hadden patiënten zonder RVO minder PTS dan patiënten met RVO (142/309 (46%) versus 167/309 (54%), OR 0,65; 95% BI: 0,46 tot 0,92) (Amin, 2018).
Therapietrouw bij het dragen van elastische kousen en mobiliseren
In het algemeen is het belangrijk de patiënt te (blijven) motiveren de kous te dragen. Wanneer het aantrekken of uittrekken een belemmering is kan er gekeken worden of aantrek-hulpmiddelen een oplossing zijn bijvoorbeeld via de ergotherapie of kan de thuiszorg eventueel worden ingeschakeld. Op dit moment wordt er geen standaard controle afspraak gemaakt door zorgverleners om te evalueren of een kous aan- en/of uitgetrokken kan worden en of er problemen zijn bij therapietrouw. Veel studies gebruiken verschillende definities van therapietrouw en rapporteren een therapietrouw welke varieerden tussen 50 en 92%. De studie van ten Cate-Hoek (2018) rapporteert de therapietrouw afzonderlijk voor de twee interventiegroepen bij 3, 6, 12 en 24 maanden. De groepen vertonen op geen enkel moment een duidelijk verschil in therapietrouw. Daarnaast is het belangrijk patiënten te stimuleren om te mobiliseren, om daarmee het effect van de compressietherapie te ondersteunen. Een patiënt kan gaan mobiliseren, bijvoorbeeld wandelen, na het starten van de antistolling en van compressietherapie.
De module ‘Communicatie met patiënten’ gaat uitgebreider in op wat patiënten belangrijk vinden in de informatievoorziening en besluitvorming.
Onderbouwing
Achtergrond
Patiënten met een proximale DVT worden behandeld met antistolling in combinatie met compressietherapie. Daarvoor kan gebruik gemaakt worden van een zwachtel of een tijdelijke/confectie elastische kous met een voldoende mate van druk (30 tot 40 mmHg). Er dient een therapeutische elastische kous op maat gemaakt te worden. Bij de aanwezigheid van zwelling van het been dient gewacht te worden met opmeten van de kous tot de zwelling verdwenen is. Het doel van de compressietherapie met de therapeutisch elastische kous is het voorkómen of verminderen in ernst van het PTS.
Het advies in de laatste Nederlandse richtlijn was deze kous minimaal 2 jaar te dragen. Het gaat in Nederland met name om de vraag of de duur van de kous bij patiënten met een DVT niet korter zou kunnen. Ook leeft de vraag of een aanpak zoals onderzocht in de IDEAL DVT-trial mogelijk is, waarbij na een standaard draagduur van 6 maanden, verdere behandeling wordt geïndividualiseerd op basis van de Villalta score. De Villalta score geeft weer welke patiënten een hoog risico hebben op PTS middels een vragenlijst. Daarnaast is het de vraag of vroegtijdige compressie (binnen 48-uur na diagnose) voordelen biedt boven compressie opgestart nadat de zwelling is verdwenen.
Conclusies / Summary of Findings
Na de acute fase
|
Laag GRADE |
PTS Het dragen van een therapeutische elastische kous lijkt te resulteren in een lagere incidentie van PTS ten opzichte van het dragen van geen kous of een placebo kous na de acute fase.
Bronnen: (Brandjes, 1997; Ginsberg, 2001; Kahn, 2014; Prandoni, 2004) |
|
Laag GRADE |
Ernstige PTS De incidentie van ernstige PTS lijkt mogelijk niet verlaagd te worden bij het dragen van een kous ten opzichte van geen kous of een placebo kous na de acute fase.
Bronnen: (Brandjes, 1997; Ginsberg, 2001; Kahn, 2014; Prandoni, 2004) |
|
Laag GRADE |
Recidiverende VTE Het dragen van een therapeutische elastische kous na de acute fase lijkt de kans op recidiverende VTE (DVT of longembolie) niet te verlagen ten opzichte van het dragen van geen kous of een placebo kous.
Bronnen: (Brandjes, 1997; Kahn, 2014; Partsch, 2004; Prandoni, 2004) |
|
Laag GRADE |
Bijwerkingen Het dragen van een therapeutische elastische kous tot de knie in de niet-acute fase van DVT lijkt niet tot ernstige bijwerkingen te leiden in vergelijking met een placebo kous of geen kous.
Bronnen: (Kahn, 2014; Prandoni, 2004) |
|
Redelijk GRADE |
Patiënttevredenheid/ kwaliteit van leven Het dragen van een therapeutische elastische kous na de acute fase lijkt geen of nauwelijks effect te hebben op de kwaliteit van leven ten opzichte van het dragen van geen kous of een placebo kous.
Bronnen: (Kahn, 2014) |
Acute fase
|
Zeer laag GRADE |
Optreden PTS Er zijn onvoldoende gegevens van voldoende kwaliteit om een conclusie te kunnen trekken over de effecten van compressietherapie (elastische compressie kous of zwachteltherapie) in vergelijking met geen compressietherapie op het optreden van PTS.
Bronnen: (Partsch, 2004; Roumen-Klappe, 2009) |
|
Zeer laag GRADE |
Recidiverende VTE Er zijn onvoldoende gegevens van voldoende kwaliteit om een conclusie te kunnen trekken over de effecten van compressietherapie (elastische compressie kous of zwachteltherapie) in vergelijking geen compressietherapie op het optreden van een recidief VTE.
Bronnen: (Partsch, 2004) |
|
Laag GRADE |
Bijwerkingen en symptoomverlichting Het is mogelijk dat het gebruiken van compressietherapie (elastische compressie kous of zwachteltherapie) in de acute fase de symptomen (oedeem, pijn) op korte termijn vermindert in vergelijking met geen compressietherapie.
Bronnen: (Partsch 2000; Roumen-Klappe, 2009; Amin, 2018) |
|
Laag GRADE |
Patiënttevredenheid/ kwaliteit van leven Het gebruiken van compressietherapie (elastische compressie kous of zwachteltherapie) in de acute fase heeft mogelijk een gunstig effect op het welbevinden en DVT-gerelateerde kwaliteit van leven op korte termijn in vergelijking met geen compressietherapie.
Bronnen: (Partsch, 2000; Roumen-Klappe, 2009; Amin, 2018) |
Elastische kous gedurende 2 jaar versus elastische kous voor een kortere tijd
|
Redelijk GRADE |
Optreden PTS Het korter dragen van een therapeutische elastische kous na een initiële behandelperiode van 6 maanden resulteert mogelijk niet tot een hogere incidentie PTS bij geselecteerde patiënten zonder PTS klachten en tekenen in vergelijking met het dragen gedurende twee jaar.
Gepersonaliseerde draagduur op basis van de Villalta score leidt daarbij waarschijnlijk tot het laagste risico.
Bronnen: (Aschwanden, 2008; Mol, 2016; ten Cate-Hoek, 2018) |
|
Redelijk GRADE |
Recidiverende VTE Het dragen van een therapeutische elastische kous gedurende twee jaar leidt waarschijnlijk niet tot een lagere kans op recidiverende DVT ten opzichte van het dragen van een therapeutische elastische kous gedurende één jaar of voor een gepersonaliseerde tijdsduur.
Bronnen: (Mol, 2016; ten Cate-Hoek, 2018) |
|
Laag GRADE |
Bijwerkingen Het dragen van een therapeutische elastische kous gedurende twee jaar lijkt niet tot ernstige bijwerkingen te leiden ten opzichte van het dragen van een therapeutische elastische kous gedurende één jaar of voor een gepersonaliseerde tijdsduur.
Bronnen: (ten Cate-Hoek, 2018) |
|
Redelijk GRADE |
Patiënttevredenheid/ kwaliteit van leven Het dragen van een therapeutische elastische kous gedurende twee jaar lijkt geen effect te hebben op de kwaliteit van leven ten opzichte van het dragen van een therapeutische elastische kous gedurende één jaar of voor een gepersonaliseerde tijdsduur.
Bronnen: (Mol, 2016; Ten Cate-Hoek, 2018) |
Samenvatting literatuur
Deze vraag is uitgewerkt met drie analyses:
- Wel versus geen compressietherapie na de acute fase.
- Wel versus geen compressietherapie in de acute fase.
- Langere versus kortere duur compressietherapie.
Er werd een Cochrane review (Appelen, 2017) geïncludeerd waarin verschillende vergelijkingen zijn uitgewerkt. In de Cochrane review zijn vergelijkende studies geïncludeerd die het effect van compressietherapie evalueren op de incidentie van PTS bij patiënten met DVT. Hierbij is iedere definitie voor PTS geaccepteerd, zo lang deze gebaseerd is op een systematische klinische geschiedenis en score van het lichamelijk onderzoek.
In totaal werden tien RCT’s met 2369 deelnemers in deze review beschreven:
- Één studie vergelijkt het dragen van een therapeutisch elastische kous tot de dij met het dragen van een therapeutisch elastische kous tot onder de knie (n=267) (Prandoni, 2012). Deze studie wordt voor de beantwoording van deze uitgangsvraag daarom buiten beschouwing gelaten.
- Vijf studies onderzoeken het effect van het dragen van een therapeutische kous in vergelijking met het dragen van een placebo kous of niet dragen van een kous na de acute fase. In deze studies variëren de druk en de lengte van de kous, evenals het moment van starten en de duur van de therapie (Brandjes, 1997; Ginsberg, 2001; Jayaray, 2015; Kahn, 2014; Prandoni, 2004).
- Twee studies onderzoeken het effect van compressietherapie in de acute fase van DVT (Roumen-Klappe, 2009; Partsch, 2000).
- Twee studies vergelijken een kortere duur met een langere duur beiden in een geselecteerde populatie van patiënten zonder klachten en in één studie met tevens goede kous compliantie (≥ 6 dagen per week) (Mol, 2016; Aschwanden 2008).
Ten opzichte van de Cochrane review werden twee additionele studies geïncludeerd:
- Wel versus geen compressietherapie na de acute fase: geen nieuwere studies.
- Wel versus geen compressietherapie in acute fase: een additionele studie (Amin, 2018).
- Langere versus kortere duur compressietherapie: een additionele studie (ten Cate-Hoek, 2018).
Tabel 1 Overzicht geïncludeerde studies
|
Studie |
Druk kous |
Lengte kous |
Start therapie |
Duur therapie |
Controlegroep |
Meetmethode PTS (afkapwaarde PTS) |
|
Wel versus geen kous na de acute fase |
||||||
|
Brandjes, 1997* |
40 mmHg |
Onder de knie |
2 tot 3 weken na diagnose DVT (proximaal) |
≥ 2 jaar |
Geen kous |
Brandjes schaal (≥ 3) FU: 5 jaar |
|
Ginsberg, 2001* |
20 tot 30 mmHg |
Zowel onder de knie als tot de dij |
1 jaar na diagnose DVT bij geselecteerde patiënten zonder klachten en zonder reflux (deel van een studie in 3 delen). |
onduidelijk |
Placebo kous |
Ginsberg’s criteria (been-pijn en zwelling) FU: 6 maanden tot 2 jaar |
|
Jayaraj, 2015* |
30 tot 40 mmHg |
Onder de knie |
< 48 uur na diagnose DVT (proximaal) |
2 jaar |
Geen kous |
Venous Clinical Severity Score (VCSS) en Villalta score (afkapwaarde onbekend) FU: 3 maanden tot 2 jaar |
|
Kahn, 2014* |
30 tot 40 mmHg |
Tot de knie |
< 2 weken na diagnose DVT (proximaal) |
2 jaar |
Placebo kous (<5 mmHg) |
Ginsberg criteria (been-pijn en zwelling voor minimaal 1 maand) en Villalta score (≥ 5) FU: 6 maand- 2 jaar |
|
Prandoni, 2004* |
30 tot 40 mmHg |
Onder de knie |
Bij ontslag (± 1 week na opname/ diagnose) bij DVT (proximaal) |
> 2 jaar |
Geen kous |
Villalta score (≥ 5) FU: 3 tot 5 jaar |
|
Wel versus geen kous in acute fase |
||||||
|
Roumen-Klappe, 2009* |
- |
multi-layer bandaging |
Meteen na diagnose DVT (proximaal en distaal) |
Tot reductie oedeem. Hierna ontvingen alle patiënten ECSs op maat |
Geen kous |
CEAP (≥ C3) en villalta score (≥ 5) FU: 1 jaar |
|
Partsch, 2000*
Partsch 2004 (uitkomsten PTS)
|
30 mmHg |
Tot de dij bandage of compressie kous |
Meteen na diagnose DVT (proximaal) |
Initiële studie 9 dagen, later follow-up na 2 jaar |
1. Niet elastische bandages (n=18) 2. Bedrust zonder compressietherapie (n=17) 3. elastische kous (n=18)
alle drie de groepen gedurende 9 dagen (daarna krijgen alle patiënten advies compressiekous te dragen). |
Villalta score (≥ 5) FU: 2 jaar |
|
Amin, 2018 |
35 mmHg |
7 centra: zwachteltherapie (tot en met dij) 30-40mmgh)
2 centra: compressie kous |
Meteen na diagnose DVT (proximaal) |
5 maanden |
Een centrum: geen initiële compressie. Na initiële fase kregen alle patiënten een therapeutische elastische kous voor 5 maanden.
|
Villalta score (≥ 5) FU: 6 maanden tot 2 jaar |
|
Lange versus korte duur |
||||||
|
Mol, 2016*
|
34 tot 36 mmHg |
Tot de knie |
Na 1 jaar compressietherapie werden compliante patiënten met Villalta < 5 gerandomiseerd tussen geen compressietherapie en doorgaan met compressietherapie, na proximale DVT.
|
1 jaar |
Identieke kous gedurende 2 jaar |
Villalta score (≥ 5) FU: 1 jaar |
|
Aschwanden, 2008*
|
26 tot 36 mmHg |
Onder de knie |
Na 6 maanden standaard compressietherapie werd gerandomiseerd naar stoppen of doorgaan voor nog eens 18 maanden, na proximale DVT. |
>2 jaar |
Geen kous na 6 maanden standaard compressietherapie. |
CEAP (≥ C4) FU: 3 jaar |
|
ten Cate Hoek, 2018 |
30 tot 40 mm Hg |
Therapeutische elastische kous (tot de knie) klasse III. |
Na 6 maanden standaard compressietherapie werd gerandomiseerd voor geïndividualiseerde duur of standaard duur 24 maanden |
2 jaar |
standaard therapie 24 maanden |
Villalta score (≥ 5) (tweemaal gemeten met 3 maanden er tussen) FU: 2 jaar |
|
* in Appelen (2017), FU = follow up |
|
|||||
Wel versus geen compressietherapie na de acute fase
Incidentie PTS
Vier studies die het dragen van een therapeutische elastische kous vergelijken met het niet dragen van een kous of het dragen van een placebo kous (n=1393) werden meegenomen in de analyse (Brandjes, 1997; Ginsberg, 2001; Kahn, 2014; Prandoni, 2004). De studie van Jayaraj (2015) werd niet meegenomen omdat specifieke aantallen in deze studie ontbreken, waardoor er geen risico verhouding berekend kan worden.
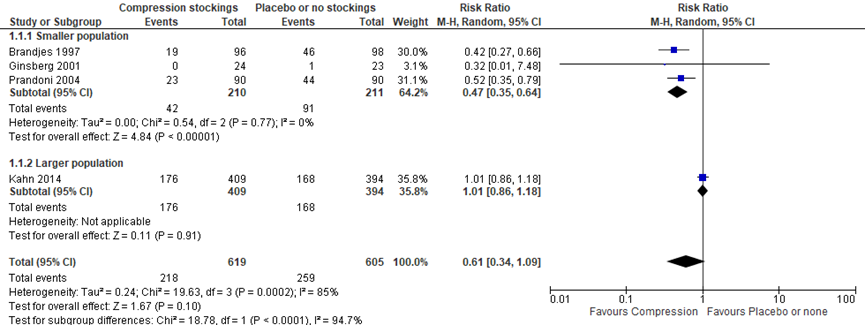
In de interventiegroep werden in totaal 218/619 (35,2%) gevallen van PTS gerapporteerd in vergelijking met 259/605 (42,8%) gevallen in de controlegroep. Het dragen van een elastische kous resulteerde volgens de gepoolde resultaten in een afname in incidentie van PTS (RR 0,61 (95% BI: 0,34 tot 1,09)).
Vanwege heterogeniteit (I2 = 94,7%; P = 0,0005), die grotendeels veroorzaakt werd door de studie van Kahn (2014), werd tevens een subgroep analyse uitgevoerd zonder deze Sox-trial (Brandjes, 1997; Ginsberg, 2001; Prandoni, 2004). De in de studie van Kahn gebruikte definitie van therapietrouw (bij minimaal 3 van de 5 telefonische interviews aangeven kous ten minste 3 dagen per week te dragen) maakt dat meer patiënten als “trouw” werden geclassificeerd ten opzichte van andere studies met strengere eisen. Dit zal invloed hebben gehad op de resultaten en deels een verklaring zijn voor de heterogeniteit.
Het aantal gevallen van PTS betrof 42/210 (20,0%) in de interventiegroep en 91/211 (43,1%) in de controlegroep (figuur 1) Hierbij werd voor de interventiegroep een afname in incidentie van PTS gevonden (RR 0,47 (95% BI: 0,35 tot 0,64)).
Figuur 1 Incidentie PTS bij elastische kous versus geen kous of placebo kous
Ernstige PTS
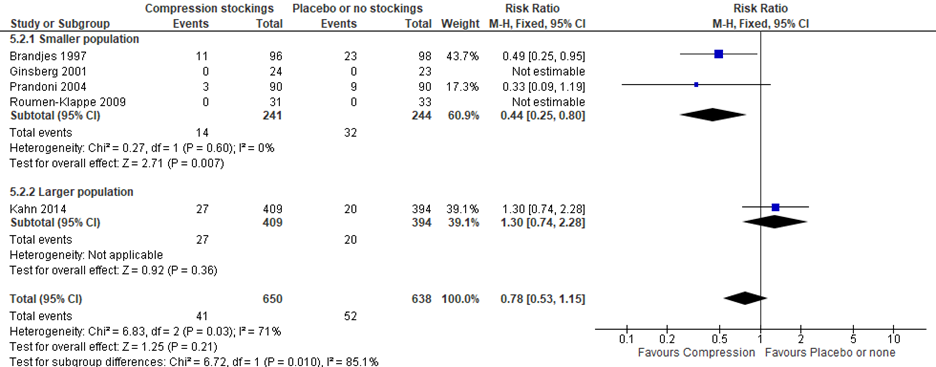
Vier studies rapporteerden tevens de incidentie van ernstige PTS (Brandjes, 1997; Ginsberg, 2001; Kahn, 2014; Prandoni, 2004) in een follow-up periode van 2 tot 6,3 jaar. Het aantal gevallen van ernstige PTS betrof 41/619 (6,6%) in de interventiegroep en 52/605 (8,6%) in de controlegroep (RR 0,78 (95% BI: 0,53 tot 1,15). Subgroep analyse waarin de studie van Kahn niet meegenomen wordt toont een lager risico op ernstige PTS bij elastische kous (RR: 0,44 (95% BI: 0,25 tot 0,80).
Figuur 2 Incidentie ernstige PTS bij elastische kous versus geen kous of placebo kous
Recidiverende VTE
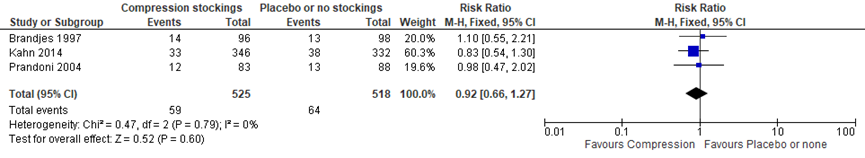
Drie studies konden in de meta-analyse voor de uitkomstmaat recidief VTE worden meegenomen (Brandjes, 1997; Kahn, 2014; Prandoni, 2004). In de interventiegroep werden in totaal 59/525 (11,2%) gevallen van recidief DVT gerapporteerd in vergelijking met 64/518 (12,3%) gevallen in de controlegroep. Het dragen van een elastische kous is niet geassocieerd met een afname van recidief DVT (RR 0,92 (95% BI: 0,66 tot 1,27).
Figuur 3 Recidiverende DVT bij elastische kous versus geen kous of placebo kous
In de studies die keken naar recidief longembolie waren over het algemeen de aantallen laag en was het moment waarop de longembolie optrad onduidelijk. Kahn (2014) rapporteerde 9/410 (2,2%) gevallen in de interventiegroep en 12/396 (3,0%) in de placebogroep.
Bijwerkingen
Twee studies onderzochten de bijwerkingen van compressietherapie (Kahn, 2014; Prandoni, 2004). In geen van deze studies werden ernstige bijwerkingen gevonden. Kahn (2014) vond dat voor zowel het dragen van een elastische kous als voor het dragen van een placebo kous bij 2% van de gevallen jeuk optreedt. Prandoni (2004) vond dat bij het dragen van een elastische kous in 6% van de gevallen jeuk optreedt. De controlegroep had geen kous.
Patiënttevredenheid/kwaliteit van leven
Kahn (2014) vond geen significant verschil tussen patiënten die een elastische kous droegen en patiënten die een placebo kous droegen met de generieke kwaliteit van leven metingen (SF36) en de ziekte specifieke kwaliteit van leven metingen (VEINES-QOL score).
Wel versus geen compressietherapie in de acute fase
Op basis van het werkingsmechanisme van compressie bij DVT kan worden verwacht dat het raadzaam is te beginnen met compressie in de acute fase van DVT: externe compressie kan de trombusresolutie bevorderen en zo waarschijnlijk nadelige symptomen vroegtijdig voorkomen. De gevolgen van het vroegtijdig starten met compressie therapie werd onderzocht in 4 studies.
In de studie van Partsch (2004) werden patiënten gerandomiseerd voor zwachtels (n=15) of compressiekous (n=15) met lopen of bedrust zonder compressie (n=15). Dit werd gevolgd door een knie hoge elastische kous voor iedereen (n=37). De follow-up duur was 2 jaar.
De studie van Roumen-Klappe (2011) evalueerde compressie in de acute fase van eerste proximale en distale DVT. Er werden 69 patiënten geïncludeerd. Alle patiënten ontvingen standaard anticoagulantia gedurende drie maanden en werden gerandomiseerd voor onmiddellijke start van zwachteltherapie of geen zwachteltherapie in de acute fase. Patiënten werden gestimuleerd om zo veel mogelijk te lopen. Na reductie van oedeem kregen alle participanten na 7 tot 14 dagen confectie kousen die ze 2 jaar moesten dragen. De follow-up duur was 1 jaar.
In een sub-studie van de IDEAL-DVT-trial (Amin, 2018) werden patiënten die binnen 24-uur na de diagnose DVT compressietherapie kregen in 9 centra (n=520) vergeleken met patiënten in 1 centrum (n=72), die compressietherapie kregen nadat het initiële oedeem geresorbeerd was. Zwachteltherapie werd toegepast in 369 patiënten (62,3%) en een compressiekous in 151 patiënten (25,5%). Compressietherapie in de acute fase van een DVT in een absolute vermindering van de kans op echografisch resterende veneuze obstructie na gemiddeld 5,3 maanden (46% versus 67% zonder compressie OR 0,46 (95% BI: 0,27 tot 0,80)). Tevens werd er een significant lagere incidentie van PTS gezien na 6 en 24 maanden bij de patiënten bij wie echografisch geen resterende obstructie meer geobserveerd werd (46% versus 54%, OR 0,65 (95% BI: 0,46 tot 0,92)). Er kan geen directe vergelijking worden gemaakt met wel versus geen compressietherapie en het optreden van PTS in de acute fase en daarom is deze studie niet meegenomen in de onderstaande resultaten.
Post trombotisch syndroom (PTS);
In de studie van Partsch kregen 14 van de 26 (54%) patiënten in de interventiegroep (zwachtels of compressiekous) in vergelijking met 9 van de 11 patiënten (82%) in de (bedrust) groep zonder kous een PTS (p>0,05) na 2 jaar. Er werden geen gevallen van ernstige PTS gerapporteerd.
In de studie van Roumen werd PTS tot aan een jaar op twee manieren gemeten:
- CEAP classificatie (PTS gedefinieerd als C3 of hoger): 39% in de groep met kous en 42% in de groep zonder kous (RR 0,92 (95%BI: 0,55 tot 1,56).
- Villalta score ≥ 5: 29% met kous in vergelijking met 33% zonder kous (RR 0,87 (95%BI: 0,41 tot 1,80). De ernst van PTS verschilde niet tussen de groepen. Er werden geen gevallen van ernstige PTS gerapporteerd.
Recidief VTE
In de studie van Roumen-Klappe (2009) werd optreden van recidief VTE niet gerapporteerd. In de studie van Partsch (2004) werd gevonden dat, na 2 jaar follow-up, drie patiënten in de kousen groep in vergelijking met de bedrust de controle groep zonder kous een recidief DVT ontwikkelde (Partsch, 2004).
Bijwerkingen en symptoomverlichting (comfort, huiduitslag)
Partsch (2000, 2004) vond een vermindering van pijn en oedeem in de eerste 9 dagen bij de kousen groep (vermindering van pijn en zwelling in de eerste 9 dagen (p<0,05).
Bij de studie van Partsch (2004) is gekeken naar zowel het dragen van een elastische kous als het dragen van niet elastische bandages. In deze twee behandelgroepen werd gevonden dat in 25% van de gevallen een kleine huidverandering of jeuk optrad. In geen van de gevallen leidde dit tot het stoppen van de therapie. Roumen-Klappe (2009) vond eveneens een reductie van klachten en oedeem in de eerste week.
Patiëntpreferentie/Kwaliteit van leven
In de studie van Partsch (2004) werd gerapporteerd dat er een significant snellere en duidelijkere verbetering van welbevinden en DVT-gerelateerde kwaliteit van leven was in de kousen groep in vergelijking met de bedrust groep in de eerste negen dagen na de DVT. De psychische en somatische kwaliteit van leven verschilde niet tussentwee groepen(geen verdere data gerapporteerd).
In de studie van Amin (2018) werd een significant verschil in kwaliteit van leven gevonden ten aanzien van de vorm van compressie in de acute fase, dit was ten gunste van de elastische kous (35mmHg) in vergelijking tot niet elastische zwachtelverbanden (Amin, 2018).
Bewijskracht van de literatuur
Na de acute fase
De bewijskracht voor de uitkomstmaten incidentie (ernstige) PTS, recidief VTE en bijwerkingen is met twee niveaus verlaagd naar laag gezien beperkingen in de onderzoeksopzet (onder andere geen blindering, onverklaarde lost to follow-up) (risk of bias) en heterogeniteit tussen de studies (inconsistentie). De bewijskracht voor de uitkomstmaat patiënttevredenheid/kwaliteit van leven is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias).
Acute fase
De bewijskracht voor de uitkomstmaten PTS en recidief VTE is met drie niveaus verlaagd naar zeer laag vanwege ernstige imprecisie (weinig geïncludeerde patiënten voor zeldzame uitkomstmaat) en beperkingen in studieopzet (onder andere geen blindering voor subjectieve uitkomstmaten). De bewijskracht voor bijwerkingen en kwaliteit van leven is met twee niveaus verlaagd naar laag vanwege imprecisie (weinig geïncludeerde patiënten) en beperkingen in de studieopzet (onder andere geen blindering).
Elastische kous gedurende 2 jaar versus elastische kous voor een kortere tijd
Naast de Cochrane review waarin twee studies zijn geïncludeerd die de duur van het dragen onderzoeken (Mol, 2016 en Aschwanden, 2008), werd de RCT van ten Cate-Hoek (2018) geïncludeerd. In deze studie wordt gekeken naar het effect van het dragen van een therapeutische elastische kous voor een gepersonaliseerde tijdsduur (n= 432) in vergelijking met het dragen van een therapeutische elastische kous gedurende 2 jaar (n= 424) op de incidentie van PTS bij patiënten na een DVT. Beide groepen werden behandeld met compressietherapie tot de knie met een druk van 30 tot 40 mmHg gedurende zes maanden. Na zes maanden werd de compressietherapie in de controle groep gecontinueerd tot 24 maanden. Voor de interventiegroep waren na zes maanden vier scenario’s mogelijk:
|
Scenario |
Villalta score na 3 maanden |
Villalta score na 6 maanden |
Beleid ten aanzien van compressietherapie |
|
1. |
≤4 |
≤4 |
Therapie staken |
|
2. |
>4 |
>4 |
Therapie continueren |
|
3. |
>4 |
≤4 |
Therapie continueren tot 12 maanden en dan:
|
|
4. |
≤4 |
>4 |
Therapie continueren |
Incidentie PTS
Ashwanden (2008) vond geen verschil in incidentie van PTS voor patiënten die gerandomiseerd werden naar een behandeling met elastische kous gedurende 6 maanden in vergelijking met patiënten die de kous langer (> 2 jaar) droegen. In de groep die de kous slechts 6 maanden droeg kregen 17/84 patiënten (20%) PTS in vergelijking met 11/84 patiënten (13%) (HR 0,60 (95% BI: 0,28 tot 1,28)) in de groep die de kous langduriger droeg.
Mol (2016) vond een significant hogere incidentie van PTS bij patiënten met een lage Villalta score en een zeer goede therapietrouw die een elastische kous droegen gedurende één jaar vergeleken met vergelijkbare patiënten die een elastische kous droegen gedurende twee jaar (RR 1,54 (95% BI: 1,03 tot 2,29)). In de interventiegroep (1 jaar kous) werden 51/256 gevallen (19,9%) van PTS gerapporteerd in vergelijking met 34/262 gevallen (13,0%) in de controlegroep na 2 jaar.
Ten Cate-Hoek (2018) vond geen verschil in incidentie van PTS bij patiënten die een elastische kous droegen gedurende een, op basis van de Villalta score gepersonaliseerde, tijdsduur (variërend van 6 maanden tot 2 jaar), vergeleken met patiënten die een elastische kous droegen gedurende twee jaar (OR 1,06 (95%BI: 0,78 tot 1,44). Het primaire eindpunt was de cumulatieve incidentie na 24 maanden van patiënten met een PTS (Villalta score ≥ 5) op 2 opeenvolgende bezoeken met tenminste 3 maanden interval. In de interventiegroep werden 125/432 (28,9%) gevallen van PTS gerapporteerd in vergelijking met 118/424 (27,8%) gevallen in de controlegroep. Bij de interventie groep kon 55% van de deelnemers (n=236) de elastische kous stoppen na 6 maanden en nog eens 11% (n=47) na 12 maanden. Bij het gebruik van de Villalta score ≥ 5 op één meetmoment bleek er wel een verschil in incidentie van PTS bij de interventiegroep (36%) in vergelijking met de standaardgroep (22%) (RR 1,6 (95% BI: 1,2 tot 2,3).
In zowel de studie van Mol (2016) als ten Cate-Hoek (2018) werden geen duidelijke verschillen tussen de groepen gevonden ten aanzien van de ernst van PTS.
Recidief VTE
Mol (2016) vond geen verschil tussen de groepen in recidiverende DVT (RR 1,36; 95%BI: 0,48 tot 3,88). Het aantal gevallen met recidief DVT was 8/256 (3,1%) in de interventiegroep en 6/262 (2,3%) in de controlegroep. Getallen met betrekking tot longembolie worden niet gerapporteerd.
Ten Cate-Hoek (2018) vond geen verschil tussen de groepen in recidiverende DVT (5% versus 6%) of longembolie (3% versus 2%).
Kwaliteit van leven
Kwaliteit van leven werd gerapporteerd in twee trials. Mol (2016) vond geen verschil tussen de groepen in mediane kwaliteit van leven, VEINES-QOL of VEINES-Sym score. Ten Cate-Hoek (2018) vond geen verschil tussen de groepen in SF36, EQ-5D of VEINES-QOL score.
Bijwerkingen
In de studie van Mol (2016) en van Aschwanden (2008) werden geen bijwerkingen gerapporteerd. In de studie van ten Cate-Hoek (2018) traden geen ernstige bijwerkingen op in relatie tot het dragen van een therapeutische elastische kous.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat incidentie PTS is met één niveau verlaagd naar redelijk gezien de inconsistentie in de studieresultaten. De bewijskracht voor de uitkomstmaat recidiverende DVT is met een niveau verlaagd naar redelijk gezien het beperkte aantal events (zeldzame uitkomstmaat). De bewijskracht voor bijwerkingen is met twee niveaus verlaagd naar laag vanwege imprecisie (weinig geïncludeerde patiënten, alleen de studie van ten Cate-Hoek (2018) heeft dit gerapporteerd).
De bewijskracht voor de uitkomstmaat patiënttevredenheid/kwaliteit van leven is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (de beschreven trials waren niet dubbelblind maar open tabel studies met geblindeerde beoordelaars).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat is het effect van een kous en met name welke duur van het dragen van een therapeutische elastische kous (compression stocking) moet worden geadviseerd met betrekking tot het voorkomen/optreden van het post trombotisch syndroom en recidief trombose? (zowel in de acute als na de acute fase)
P: patiënten met trombosebeen (deep vein thrombosis, deep venous thrombosis);
I: compressietherapie middels kous;
C: geen compressietherapie/ placebo; of Compressietherapie voor kortere (3, 6 of 12 maanden)of gepersonaliseerde duur.
Relevante uitkomstmaten
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de definities zoals gebruikt in de Cochrane review van Appelen (2017). De primaire uitkomstmaat in Appelen (2017) betreft incidentie van PTS tot twee jaar. Alle definities voor PTS werden geaccepteerd, zolang ze waren gebaseerd op een systematische beoordeling van de klinische geschiedenis en een score van het lichamelijk onderzoek.
Een aantal studies rapporteert getallen voor PTS en ernstige PTS. In de Cochrane review wordt niet omschreven welke definities de individuele studies voor ernstige PTS gebruikten (Appelen, 2017). Vaak wordt de Villalta score als uitgangspunt genomen waarbij een Villalta score van 5 of meer als PTS wordt gedefinieerd en een Villalta score hoger dan 15 of de aanwezigheid van een veneus ulcus op ernstige PTS duidt.
Secundaire uitkomstmaten betreffen VTE (terugkerend DVT en longembolie), bijwerkingen (waaronder ongemak, pijn en druk), patiënttevredenheid en kwaliteit van leven.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 8 augustus 2018 met relevante zoektermen gezocht naar systematische reviews, RCT’s en ander vergelijkend onderzoek. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 361 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: dragen van een therapeutisch elastische kous wordt vergeleken met het niet dragen van een kous, het dragen van een placebo kous of het dragen van een therapeutisch elastische kous gedurende een kortere periode bij patiënten met DVT. Op basis van titel en abstract werden in eerste instantie 30 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 28 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en een systematische review en twee additionele studies definitief geselecteerd.
De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Referenties
- Amin, E. E., Bistervels, I. M., Meijer, K., Tick, L. W., Middeldorp, S., Mostard, G., ... & Joore, M. A. (2018). Reduced incidence of vein occlusion and postthrombotic syndrome after immediate compression for deep vein thrombosis. blood, 132(21), 2298-2304.
- Amin EE, Ten Cate-Hoek AJ, Bouman AC, et al. Individually shortened duration versus standard duration of elastic compression therapy for prevention of post-thrombotic syndrome: a cost-effectiveness analysis. Lancet Haematol. 2018;5(11):e512–e519. doi:10.1016/S2352-3026(18)30151-0.
- Arpaia, G., Cimminiello, C., Mastrogiacomo, O., & de Gaudenzi, E. (2007). Efficacy of elastic compression stockings used early or after resolution of the edema on recanalization after deep venous thrombosis: the COM. PRE Trial. Blood coagulation & fibrinolysis, 18(2), 131-137.
- Appelen D, van Loo E, Prins MH, Neumann MH, Kolbach DN. Compression therapy for prevention of post-thrombotic syndrome. Cochrane Database Syst Rev. 2017;9(9):CD004174. Published 2017 Sep 26. doi:10.1002/14651858.CD004174.pub3.
- Aschwanden M, Jeanneret C, Koller MT, Thalhammer C, Bucher HC, Jaeger KA. Effect of prolonged treatment with compression stockings to prevent post-thrombotic sequelae: a randomized controlled trial. J Vasc Surg. 2008;47(5):1015–1021. doi:10.1016/j.jversus.2008.01.008.
- Brandjes, D. P., Büller, H. R., Heijboer, H., Huisman, M. V., de Rijk, M., Jagt, H., & ten Cate, J. W. (1997). Randomised trial of effect of compression stockings in patients with symptomatic proximal-vein thrombosis. The Lancet, 349(9054), 759-762.
- Ginsberg, J. S., Hirsh, J., Julian, J., Vander LaandeVries, M., Magier, D., MacKinnon, B., & Gent, M. (2001). Prevention and treatment of postphlebitic syndrome: results of a 3-part study. Archives of Internal Medicine, 161(17), 2105-2109.
- Jayaraj A, Meissner M. Impact of graduated compression stockings on the prevention of post-thrombotic syndrome - results of a randomized controlled trial. Phlebology. 2015;30(8):541–548. doi:10.1177/0268355514544781.
- Kahn, S.R., Shapiro, S., Wells, P.S. et al. Compression stockings to prevent post-thrombotic syndrome: a randomised placebo-controlled trial. Lancet. 2014; 383: 880–888.
- Mol. One versus two years of elastic compression stockings for prevention of post-thrombotic syndrome (OCTAVIA study): randomised controlled trial. BMJ. 2016 May 31;353:i2691. doi: 10.1136/bmj.i2691.
- Partsch H, Blättler W. Compression and walking versus bed rest in the treatment of proximal deep venous thrombosis with low molecular weight heparin. J Vasc Surg. 2000;32(5):861–869. doi:10.1067/mva.2000.110352.
- Partsch, H., Kaulich, M., & Mayer, W. (2004). Immediate mobilisation in acute vein thrombosis reduces post-thrombotic syndrome. International angiology, 23(3), 206.
- Prandoni, P., Lensing, A. W., Prins, M. H., Frulla, M., Marchiori, A., Bernardi, E., ... & Girolami, A. (2004). Below-knee elastic compression stockings to prevent the post-thrombotic syndrome: a randomized, controlled trial. Annals of internal medicine, 141(4), 249-256.
- Roumen-Klappe EM, den Heijer M, van Rossum J, et al. Multilayer compression bandaging in the acute phase of deep-vein thrombosis has no effect on the development of the post-thrombotic syndrome. J Thromb Thrombolysis. 2009;27(4):400–405. doi:10.1007/s11239-008-0229-7.
- Soosainathan, A., Moore, H. M., Gohel, M. S., & Davies, A. H. (2013). Scoring systems for the post-thrombotic syndrome. Journal of vascular surgery, 57(1), 254-261.
- Ten Cate-Hoek. Individualised Versus Standard Duration of Elastic Compression Therapy for Prevention of Post-Thrombotic Syndrome (IDEAL DVT): A Multicentre, Randomised, Single-Blind, Allocation-Concealed, Non-Inferiority Trial.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: what is the effectiveness and risk of complications of compression therapy versus no compression therapy/shorter use of compression therapy in people with deep vein thrombosis (DVT) for prevention of post-thrombotic syndrome (PTS)?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Appelen, 2017
|
SR and meta-analysis of RCTs and CCTs
Literature search up to March 2017
A: Aschwanden, 2008 B: Brandjes, 1997 C: Ginsberg, 2001 D: Jayaraj, 2015 E: Kahn, 2014 F: Mol, 2016 G: Partsch, 2004 H: Prandoni, 2004 I: Prandoni, 2012 J: Roumen-Klappe, 2009
Setting and Country: A: Switzerland B: The Netherlands C: Canada D: US E: Canada and US F: The Netherlands G: Austria H: Italy I: Italy J: The Netherlands
|
Inclusion criteria SR: - RCTs and CCTs (trials that used allocation processes that were transparent before assignment ) evaluating compression therapy for treatment of DVT. - DVT was objectively diagnosed by ultrasonography or venography) - Development of PTS was assessed as an outcome.
Exclusion criteria SR: - Anticoagulant therapy and/or surgical intervention for DVT not equally provided among participant groups.
10 studies included
N A: 169 B: 194 C: 47 D: 69 E: 803 F: 518 G: 53 (37 for incidence of PTS after 2 yr) H: 180 I: 267 J: 69
|
A: compression stockings after 6 months of standard care (including compression stockings) B: below-knee elastic compression stockings 2 to 3 weeks after DVT diagnosis, made to measure (Neodurelna Varitex) with an ankle pressure of 40 mmHg C: elastic compression stockings starting 1 year after DVT diagnosis; below-knee elastic compression stockings with ankle pressure of 20 to 30 mmHg at the ankle region D: graduated compression stockings started within 48 hours after diagnosis (below knee, 30 to 40mmHg) E: knee-length, 30 to 40 mmHg (Class II), graduated ECS worn on the DVT-affected leg daily for 2 years, starting within 2 weeks of DVT diagnosis F: cessation of ECS after 1 year of use (34 to 46 mmHg (Class III)) G: Group A; inelastic compression bandages (Unna boots on the lower leg, adhesive bandages on the thigh) Group B (n = 18): thigh-length compression stockings (class II, 30 mmHg) After 9 days, all participants were encouraged to walk with compression class II stockings H: below-knee ready-made flat knitted ECS with ankle pressure of 30 to 40 mmHg (Flebysan, Rovigo) at hospital discharge (± 1 week after admission) I: thigh-length graded ECS starting during the first week after DVT diagnosis. J: multi-layer bandaging on the first day
|
A: no compression stockings after 6 months of standard care (including compression stockings) B: no intervention C: placebo stocking D: no stockings E: knee-length, inactive (i.e. no compression/< 5 mmHg) stocking, identical in appearance to active ECS, worn on the DVT-affected leg daily for 2 years F: continuation of ECS for 1 more year (34 to 46 mm Hg (Class III)) G: bed rest for 9 days without compression. After 9 days, all participants were encouraged to walk with compression class II stockings H: no stockings I: below-knee graded ECS starting during the first week after DVT diagnosis. J: no multi-layer bandaging
|
End-point of follow-up: A: 3.2 - 2.9 yr (median 3.2) B: 5-8 yr (median 6.3) C: mean 4.6 - 4.9 yr D: 2 yr E: 2 yr F: 1 yr G: 2 yr H: 5 yr I: 3 yr J: 1 yr
For how many participants were no complete outcome data available? (intervention/control) A:55 B: 43 C: NR (3 died) D: 37 E: 186 F: 33 G: 16 H: 21 I: 66 J: 4
|
compression (elastic stockings, Unna boots, bandages) versus no compression or placebo
(5 studies in meta-analysis: A, B, C, E, H)
Cumulative incidence of any PTS Follow-up: 2 - 6.3 yr N: 1393 (5 RCTs) I: 248 per 1000 C: 400 per 1000 RR 0.62 (0.38 to 1.01) Quality of evidence: low
Cumulative incidence of severe PTS Follow-up: 2 - 6.3 yr N: 1224 (4 RCTs) I: 67 per 1000 C: 86 per 1000 RR 0.78 (0.53 to 1.15) Quality of evidence: low
Recurrence of DVT occurring in first 2 wks after initiation of treatment Follow-up: 2 - 6.3 yr N: 1212 (4 RCTs) I: 111 per 1000 C: 118 per 1000 RR 0.94 (0.69 to 1.28) Quality of evidence: low
Incidence of PE occurring in first 2 wks after initiation of treatment Follow-up: 2 – 5 yr N: 1296 (4 RCTs) PE occurrence was low and exactly when the PE occurred was unclear. Partsch reported no difference in PE occurrence between groups (Unna boot group: 2, stocking group: 1, bed rest group: 1) (Partsch 2004). Kahn reported 9 occurrences in the active stockings group and 12 in the placebo group (Kahn 2014). Prandoni reported recurrent VTE in 12 patients in the stockings group and in 13 controls; 7/ 25 were PE, but it was unclear when these occurred, and if they were from the control or stockings group (Prandoni 2004). In a later study, Prandoni reported no PE (Prandoni 2012) Quality of evidence: low
Adverse effects Follow-up: 2 - 5 yr N: 1296 (4 RCTs) No serious adverse events occurred. Side effects were poorly reported in 4 studies. The largest study found that 2% in either group reported itching (Kahn 2014). Another study reported itching in about 6% of the elastic stockings group (Prandoni 2004). Two studies found more frequent occurrence of side effects (Partsch 2004; Prandoni 2012). Of participants allocated to the thigh-length group, 40.7% developed side effects, as did 27.3% of those randomised to the below-knee group (P = 0.017) (Prandoni 2012). Combining the bandaging and elastic stockings group revealed that 25% had minor skin changes or itching, which did not lead to discontinuation (Partsch 2004). Quality of evidence: low
Patients satisfaction or QOL Follow-up: 2 yr N: 1377 (3 RCTs) E: (active stockings versus placebo): no signif icant difference in SF36 physical score (P = 0.12) and mental score (P = 0.79). No signif icant difference in VEINES-QOL score (P = 0.81) F: (1 year versus 2 years of compression stockings): no signif icant difference in median quality of life at end of follow-up (P = 0.99) or mean intraindividual change in VEINES-QOL (P = 0.21) and VEINES-Sym (P = 0. 12) G: signif icantly faster and more pronounced improvement in well-being and DVT-related quality of life with compression than with bed rest (P < 0.05) in the f irst 9 days after DVT. Psychological and somatic quality of life did not differ between groups Quality of evidence: moderate
Compliance Follow-up: 2 yr N: 1639 (8 RCTs) A: 92% stockings B: 76% stockings D: 60% stockings E: 56% in active stockings group and 55% in placebo group (56% for both) F: 85% stockings G: 73% in bed rest group and 50% in active group, with both receiving the same compression stockings for 2 years H: 80% stockings I: 67% in thigh-length stockings group and 83% in kneelength stockings group Quality of evidence: low
Compression stockings for 1 yr versus 2 yr
(1 study: F)
PTS incidence after DVT 2 yr was superior to 1 yr HR: 1.6 (95% CI 1.02- 2.5) RR: 1.54 (95% CI 1.03-2.29) P = 0.03)
DVT recurrence I: 8 (3.1%) C: 6 (2.3%) RR: 1.36 (95% CI 0.48 -3.88) P= 0.56
1. QOL 2. intraindividual change in VEINES-QOL 3. intraindividual change in VEINES-Sym: 1. P= 0.99 2. p= 0.21 3. p= 0.12
compliance rate 85% at two years |
Authors conclusion: Low-quality evidence suggests that elastic compression stockings may reduce the occurrence of PTS after DVT.
Meta-analysis for cumulative incidence of any PTS showed considerable heterogeneity ( 80%; P = 0.0005), which was mainly caused by one study (subgroup difference P < 0.0001), possibly because it included a much larger study population (Kahn 2014).
Results of subgroup analysis: The first subgroup showed a significant effect of compression treatment on the incidence of PTS (RR 0.50, 95% CI 0.38 to 0.66; P < 0.00001) (Aschwanden 2008; Brandjes 1997; Ginsberg 2001; Prandoni 2004). The second subgroup contained data from only one study and showed no significant differences between compression and control groups (RR 1.01, 95% CI 0.86 to 1.18; P = 0.91) (Kahn 2014). |
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Appelen, 2017 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Yes |
Yes |
Table of quality assessment for systematic reviews of RCTs and observational studies
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))1
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Type of study: RCT
Setting and country: Multicenter study in the Netherlands (12 hospitals) and Italy (2 hospitals)
Funding and conflicts of interest: funded by ZonMw. No competing interests declared. |
Inclusion criteria: adult patients who had an acute proximal thrombosis of the leg and were treated <24h of diagnosis with anticoagulant treatment and initial compression therapy according to local study protocol.
Exclusion criteria: life expectancy <6 months; underwent active thrombolysis, had previous ipsilateral deep vein thrombosis of the leg; pre-existent severe venous insufficiency; contraindication for compression therapy; recurrent ipsilateral thrombosis within the first 6 months after diagnosis.
N total at baseline: Intervention: 437 (432 in itt analysis) Control: 428 (424 in itt analysis)
|
In the initial phase, compression was applied within 24 h of diagnosis according to local protocols. Immediately after the initial phase (until resorption of acute oedema) compression therapy with knee length elastic compression (class III, ankle pressure 30-40 mmHg) was started and continued for at least 6 months.
After 6 months, there were three scenarios: 1) compression therapy was discontinued if the Villalta scores were 4 or less at both the 3-month and 6-month follow-up visits 2) compression therapy was continued for the total duration of 24 months if the Villalta score was 5 or more at both visits 3) compression therapy was continued for a further 6 months if the Villalta score was 5 or more at the 3-month follow-up visit followed by a score of 4 or less at the 6-month visit. Therapy was then discontinued at the 12-month visit if the score was four or less again; otherwise therapy was continued. |
In the initial phase, compression was applied within 24 h of diagnosis according to local protocols. Immediately after the initial phase (until resorption of acute oedema) compression therapy with knee length elastic compression (class III, ankle pressure 30-40 mmHg) was started and continued for 24 months.
|
Length of follow-up: 2 yrs (assessment 3, 6, 12, and 24 months after diagnosis)
Loss-to-follow-up: Intervention: 5/432 (1.2%) lost to follow up 18/432 (4.2%) withdrew from study 12/432 (2.8%) died
Control: 3/424 (0.7%) lost to follow up 17/424 (4.0%) withdrew from study 7/424 (1.7%) died
|
Incidence of PTS I: 125/432 (29%) C:118/424 (28%) OR 1.06 (95% CI 0.78 – 1.44) Absolute difference: 1.1% (95% CI -5.2 – 7.3)
PTS severity Distribution of severity of PTS was similar for both groups.
Recurrent VTE DVT I: 21/432 (5%) C:27/424 (6%) Pulmonary embolism I: 13/432 (3%) C: 9/424 (2%)
Adverse events No serious adverse events related to the intervention occurred.
Quality of life SF36 I: 0.62 -0.82 C: 0.61 – 0.82 P= 0.86 EQ-5D I: 0.82 – 0.9 C: 0.83 – 0.88 P= 0.51 VEINES-QOL T score I: 50.3 – 50.0 C: 49.8 – 50.0 p= 0.34 VEINES-QOL intrinsic score I: 0.63 – 0.76 C: 0.63 – 0.75 p= 0.64
Treatment adherence At 3 months I: 383/400 (96%) C: 382/399 (96%) At 6 months I: 369/395 (93%) C: 363/390 (93%) At 12 months I: 286/354 (81%) C: 328/377 (87%) At 24 months I: 240/313 (77%) C: 269/340 (79%) |
|
Risk of bias table for intervention studies (randomized controlled trials)
Research question: what is the effectiveness and risk of complications of compression therapy versus no compression therapy/shorter use of compression therapy in people with deep vein thrombosis (DVT) for prevention of post-thrombotic syndrome (PTS)?
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Ten Cate-Hoek 2018 |
By a webbased randomisation programme (TENALEA). A random block size (2–12) was used and randomisation was stratified for centre, age, and body-mass index (BMI). |
unlikely |
Likely (only for patient reported outcomes) |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
Exclusietabel
|
Auteur en jaartal |
Redenen van exclusie |
|
Berntsen, 2016 |
overlap Cochrane review en includeert geen additionele data |
|
Bouman, 2014 |
opinion paper |
|
Cohen, 2012 |
overlap Cochrane review en includeert geen additionele data |
|
Dennis, 2015 |
populatie voldoet niet |
|
Giannoukas, 2006 |
overlap Cochrane review en includeert geen additionele data |
|
Giannoukas, 2008 |
overlap Cochrane review en includeert geen additionele data |
|
Jayaraj, 2015 |
zit in Cochrane, primaire studie niet separaat geïncludeerd |
|
Jin, 2016 |
overlap Cochrane review en includeert geen additionele data |
|
Kanaan, 2012 |
overlap Cochrane review en includeert geen additionele data |
|
Kahn, 2016 |
zit in Cochrane, primaire studie niet separaat geïncludeerd |
|
Kakkos, 2006 |
overlap Cochrane review en includeert geen additionele data |
|
Mol, 2016 |
zit in Cochrane, primaire studie niet separaat geïncludeerd |
|
Musani, 2010 |
overlap Cochrane review en includeert geen additionele data |
|
Perrin, 2015 |
overlap Cochrane review en includeert geen additionele data |
|
Perrin, 2016 |
overlap Cochrane review en includeert geen additionele data |
|
Prandoni, 2012 |
interventie voldoet niet: knie versus. thight |
|
Rabe, 2018 |
overlap Cochrane review en includeert geen additionele data |
|
Schwahn-Schreiber, 2014 |
geen primaire studie of systematische review |
|
Shapiro, 2014 |
artikel is hetzelfde als studie van Kahn (2016) |
|
Skervin, 2016 |
overlap Cochrane review en includeert geen additionele data |
|
Subbiah, 2016 |
overlap Cochrane review en includeert geen additionele data |
|
Tie, 2015 |
overlap Cochrane review en includeert geen additionele data |
|
Ten Cate-Hoek, 2016 |
geen primaire studie of systematische review |
|
Vazquez, 2009 |
overlap Cochrane review en includeert geen additionele data |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 15-04-2021
Beoordeeld op geldigheid : 24-03-2021
Belangrijkste wijzigingenten opzichte van de vorige versie: Aantal nieuwe modules over compressie therapie bij DVT van het been; behandeling LMWH bij (risico op) VTE bij patiënten met nierfunctiestoornissen en strategie over bloed/ingreep bij trombolytica. De modules voor periprocedureel beleid en bloeding bij DOACS zijn gewijzigd
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule. Patiëntenparticipatie bij deze richtlijn werd mede gefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met stollingsproblemen.
Kerngroep
- Prof. dr. M.V. (Menno) Huisman, internist-vasculaire geneeskunde, LUMC, NIV (voorzitter)
- Dr. M.J.H.A. (Marieke) Kruip, internist-hematoloog, ErasmusMC, NIV, NVVH (Nederlandse Vereniging voor Hematologie)
- Dr. F.A. (Erik) Klok, internist-vasculaire geneeskunde, LUMC, NIV
- Dr. M.A. (Marc) Brouwer, cardioloog, RadboudUMC, NVVC
- Dr. H.B. (Harmen) Ettema, orthopedisch chirurg, Isala, NOV
- Drs. B. (Banne) Nemeth, aios orthopedie, LUMC, NOV
- Dr. A.M. (Arno) Wiersema, vaatchirurg, NVVH
- Dr. M.E. (Maarten) Tushuizen, maag-darm-leverarts, LUMC, NVMDL
- Dr. J.M. (Jonathan) Coutinho, neuroloog, AMC-UVA, NVN
- Drs. A. (Andrew) Oostindjer, huisarts/Kaderhuisarts HVZ, NHG
Klankbordgroep
- Dr. J.J.C.M. (Sjef) van de Leur, arts klinische chemie, Isala, NVKC
- Dr. A.W.M.M. (Ankie) Koopman - van Gemert, anesthesioloog, ASZ, NVA
- Dr. M.G. (Mariëlle) van Pampus, gynaecoloog, OLVG, NVOG
- Drs. R.J. (Repke) Snijder, longarts, Antoniusziekenhuis, NVALT
- Drs. R.J. (Rutger) Lely, radioloog, VUMC, NVVR
- Dr. C. (Bibi) van Montfrans, dermatoloog, ErasmusMC, NVDV
- Dr. R.A. (Richard) Faaij, klinisch geriater, Diakonessenhuis, NVKG
- Dr. B. (Bauke) van Minnen, kaakchirurg, UMCG, NVMKA
- Drs. A (Annemarie) Auwerda, beleidsadviseur, Harteraad
- Prof. dr. S (Saskia) Middeldorp, internist vasculaire-geneeskunde, AMC-UVA, NIV
- M.J. (Jacqueline) Krol- van Straaten, internist - nefroloog, Hagaziekenhuis, NIV
- Dr. L. (Lilly) Jakulj, internist-nefroloog, Amsterdam UMC, NIV
- Dr. M. (Marcel) Schouten, internist - nefroloog, Tergooi, NIV
- Dr. N. (Nakisa) Khorsand, ziekenhuisapotheker, OLVG, NVZA
- Dr. M.F. (Margreet) Warlé-van Herwaarden, openbaar apotheker, KNMP
Met ondersteuning van
- Dr. S.R. (Sabine) Zwakenberg, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. E. (Ellen) Paap, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. H. (Hanneke) Olthuis, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. E. (Eva) Volmeijer, adviseur, Kennisinstituut van de Federatie Medisch Specialisten [tot februari 2020]
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Kerngroep
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
prof. dr. M.V. (Menno) Huisman |
Internist vasculaire geneeskunde Leids Universitair Medisch Centrum |
- Voorzitter commissie herziening Antitrombotisch Beleid, onbetaald |
- Adviseur farmaceutische bedrijven die (nieuwe) antistollingsmiddelen maken (gelden gaan naar afdeling Interne Geneeskunde LUMC) - ZONMW grant Dutch-AF - registry met onderzoek op het gebied van antistolling bij patiënten met atriumfibrilleren (gelden gaan naar afdeling Interne Geneeskunde LUMC) - Research grants van farmaceutische bedrijven die (nieuwe) antistollingsmiddelen make; (gelden gaan naar afdeling Interne Geneeskunde LUMC) |
Deelname in werkgroep als voorzitter in verband met expertise op dit gebied. In verband met adviseur farmaceutische bedrijven: participeert niet bij besluitvorming middelen |
|
dr. M.J.H.A. (Marieke) Kruip |
Internist-hematoloog Erasmus MC |
Medisch leider trombosedienst Star-SHL, gedetacheerd vanuit het Erasmus MC |
- Anti-thrombotic stewardship S-team introduction (2015-2016) Boehringer-Ingelheim - 2016: Symposium over Richtlijn antitrombotisch beleid, internistendagen en bijscholing / Bayer / € 1169,- + € 129,-, € 224,- ten gunste van de afdeling hematologie |
In verband met belangen geen participatie besluitvorming keuze middelen |
|
dr. F.A. (Erik) Klok |
Internist Vasculair geneeskundige, LUMC, Leiden |
Adjunct Professor Universiteit van Mainz, Duitsland (onbetaald) |
Dr. F.A. Klok heeft financiële steun ontvangen voor studies (unrestricted research grants) van Bayer, BMS/Pfizer, Boehringer Ingelheim, Daiichi Sankyo, MSD, Actelion, Trombose Stichting Nederland, de Hartstichting en ZonMW. Dit betroffen allen studies naar diagnostiek van longembolie/DVT of voorkomen van lange termijn effecten (pulmonale hypertensie, lagere kwaliteit van leven et cetera). |
Geen, gesponsorde studies gaan over diagnostiek. Diagnostiek komt vooralsnog niet aan bod in deze richtlijn. Mocht dit het geval zijn belangen opnieuw bespreken. Geen actie nodig |
|
dr. M.A. (Marc) Brouwer |
Cardioloog, Radboudumc |
- Afgevaardigde van de NVVO bij LSKA (onbetaald) |
De researchafdeling cardiologie heeft voor verschillende projecten financiële ondersteuning ontvangen van : Astra Zeneca, BMS-Pfizer, Boehringer Ingelheim, Beyer, Daiichi Sankyo - Dutch AF registry |
Geen, ander onderwerp |
|
dr. H.B. (Harmen) Ettema |
Orthopedisch chirurg Isala Klinieken, Zwolle |
|
In verleden deelname verschillende RCT waarvan de laatste > 3 jaar gelden |
RCT's >3 jaar geleden, geen actie |
|
drs. B. (Banne) Nemeth |
AIOS Orthopedie LUMC Leiden PhD Klinische Epidemiologie en Orthopedie, LUMC Leiden |
|
|
geen |
|
dr. A.M. (Arno) Wiersema |
Vaatchirurg in het Westfriesgasthuis te Hoorn en AUMC, locatie Vumc |
Grant onderzoek ACT en heparine arteriële vaatingrepen Medtronic, geen onderwerp van deze richtlijn |
Grant onderzoek ACT en heparine arteriële vaatingrepen Medtronic, geen onderwerp van deze richtlijn |
geen |
|
dr. M.E. (Maarten) Tushuizen |
MDL-arts, staflid Leids Universitair Medisch Centrum, Leiden |
MDL-arts; DC-kliniek Almere, Almere, verrichten van endoscopie (betaald) |
|
geen |
|
dr. J.M. (Jonathan) Coutinho |
Neuroloog Amsterdam UMC |
|
RESPECT-CVT studie. Gefinancierd door Boehringer. Ondergetekende zit in het steering Committee van deze studie |
geen actie, studie gaat over andere patiëntpopulatie |
|
A. (Andrew) Oostindjer |
Huisarts - eigen praktijk in Oldenzaal. |
Als Kaderhuisarts HVZ: Consulent voor Pfizer - beoordelen van informatie materiaal bedoeld voor patiënten en medici. |
Momenteel wel lid van de antistollingscommissie van het Medisch Spectrum Twente (onbetaald) |
geen |
|
Klankbordgroep |
||||
|
dr. J.J.C.M. (Sjef) van de Leur |
Arts klinische chemie, Isala |
Bestuurslid FNT, onbetaald |
|
Geen |
|
dr. A.W.M.M. (Ankie) Koopman - van Gemert |
Anesthesioloog, opleider Albert Schweitzer ziekenhuis |
- participatie richtlijnen: neuraxisblokkade, bloedtransfusie, ESA (vacatiegelden) - bestuur TRIP en vz hemovigilantiekamer (onbetaald) - gebruikersgroep sanquin (onbetaald) |
|
Geen |
|
dr. M.G. (Mariëlle) van Pampus |
Gynaecoloog OLVG |
|
|
Geen |
|
drs. R.J. (Repke) Snijder |
Longarts st. Antonius Ziekenhuis Nieuwegein |
|
|
Geen |
|
drs. R.J. (Rutger) Lely |
(Interventie)radioloog AUMC, locatie Vumc |
|
|
Geen |
|
dr. C. (Bibi) van Montfrans |
Dermatoloog Erasmus MC |
- Lid board European academy of dermatology and venereology (EADV) (onbetaald) |
|
Geen |
|
dr. R.A. (Richard) Faaij |
Klinisch geriater Diakonessenhuis Utrecht-Zeist-Doorn |
|
|
Geen |
|
dr. B. (Bauke) van Minnen |
Kaakchirurg UMCG |
|
|
Geen |
|
mw. A (Annemarie) Auwerda |
Beleidsadviseur, Harteraad |
|
|
Geen |
|
prof. dr. S (Saskia) Middeldorp |
Internist-vasculair geneeskundige, hoogleraar Trombose en hemostase Amsterdam UMC - locatie AMC Meibergdreef 9, 1105 AZ Amsterdam |
Onbetaald: NVTH-voorzitter, Stichting Haemophilia-bestuurslid, Stichting Amstol - bestuurslid Betaald: Diverse honoraria naar AMR Medical Research B.V. Bedrijven: Aspen - Bayer - BMS/Pfizer - Boehringer Ingelhei - Daiichi Sankyo - GKS - Portola - Sanquin -Sanofi. Voor lezingen/onderwijs |
Research support, wordt betaald aan AMC Medical Research B.V. Bedrijven: Aspen - Bayer - BMS/Pfizer - Boehringer lngelheim - Daiichi Sankyo - GSK - Portola - Sanquin - Highlow studie, GSK, overgenomen door Aspen, financiering voor investigator initiated trial, wordt gestort op AMC Medical Research B.V - Sanquin, financiering voor vrijwilligersstudie naar reversal van NOACs in gezonde vrijwilligers, wordt gestort op AMR Medical Research BV - BMS/Pfizer, financiering voor vrijwilligersstudie naar reversal van NOACs in gezonde vrijwillers, wrodt gestort op AMR Medical Research BV - Daiichi Sankyo, financiering voor investigator initiated study naar lange termijn gevolgen van VTE |
Participeert niet bij besluitvorming omtrent middelen. In rol van klankbordgroeplid is hier echter ook geen sprake van. Participatie wegens expertise. Openheid over deze belangen is voldoende. |
|
M.J. (Jacqueline) Krol- van Straaten |
Internist - Nefroloog Haga ziekenhuis, Den Haag |
Lid werkgroep KNMP Geneesmiddelen en Dialyse. Reis- en onkosten vergoeding (1-4x per jaar) Richtlijncommissie Nederlandse Federatie voor Nefrologie - betaald (vacatiegelden) |
|
Geen |
|
dr. M. (Marcel) Schouten |
Internist-nefroloog Tergooi |
Richtlijncommissie Nederlandse Federatie voor Nefrologie - betaald (vacatiegelden) |
|
Geen |
|
dr. N. (Nakisa) Khorsand |
Ziekenhuisapotheker, OLVG, Amsterdam |
Voorzitter special interest group hematologie van NVZA (onbetaald) |
|
Geen |
|
dr. M.F. (Margreet) Warlé- van Herwaarden |
Apotheker, Apotheek Groesbeek |
participeert af en toe in onderzoek (onbetaald) |
|
Geen |
|
Dr. L. (Lilly) Jakulj |
Internist-nefroloog Stichting Dianet Internist-nefroloog Amsterdam UMC locatie AMC” |
Lid richtlijnencommissie Nederlandse Federatie voor Nefrologie (onbetaald) |
|
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde patiëntenvereniging in de klankbordgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Harteraad en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de werkgroep de knelpunten middels een enquête. Naast de in de kern- en klankbordgroep vertegenwoordigde partijen werden de FNT, IGJ, KiMO, NHG, NFU, NVZ, STZ, V&VN, Verenso, VIG, VWS, ZiNL en ZN uitgenodigd deze enquête in te vullen.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nul effect) liggen dan de MCID (Hultcrantz, 2017).
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwaliteit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, Glasziou P, Jaeschke R, Vist GE, Williams JW Jr, Kunz R, Craig J, Montori VM, Bossuyt P, Guyatt GH; GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008 May 17;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139.
Schünemann, A Holger J (corrected to Schünemann, Holger J). PubMed PMID: 18483053; PubMed Central PMCID: PMC2386626.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
