Behandeling maligniteit geassocieerde trombose
Uitgangsvraag
Is een DOAC een alternatief voor LMWH bij behandeling diepe veneuze trombose en longembolie bij patiënten met een actieve maligniteit?
Aanbeveling
Behandel patiënten met VTE en een maligniteit met therapeutisch LMWH of met een DOAC.
Behandel patiënten met VTE en een maligniteit van de tractus digestivus (inclusief lever- en pancreastumoren), tractus urogenitalis of hoog geschat bloedingsrisico op basis van andere factoren bij voorkeur met LMWH.
Er is ten tijde van de literatuursearch en analyse alleen bewijs voor edoxaban, voorafgegaan door tenminste 5 dagen LMWH), en in mindere mate voor rivaroxaban.
Overwegingen
Er zijn twee direct vergelijkende studies gepubliceerd. In de ene studie werd edoxaban in een dosering van 60 mg eenmaal daags of 30 mg eenmaal daags bij matig of ernstige nierfunctiestoornis (creatinineklaring 15 tot 50 ml/min) of een laag lichaamsgewicht (≤ 60 kg), voorafgegaan door tenminste 5 dagen LMWH, vergeleken met dalteparine 200 IU/kg gedurende de eerste maand, gevolgd door 150 IU/kg in de vervolgmaanden; in de andere werd rivaroxaban in een begindosering van 15 mg tweemaal daags gedurende de eerste 3 weken gevolgd door 20 mg eenmaal daags in de vervolgmaanden, vergeleken met dalteparine in dezelfde dosering als in de studie met edoxaban. In de eerste studie was het gecombineerde eindpunt recidief VTE en bloedingen gelijkwaardig tussen de twee studiegroepen. Patiënten in de edoxaban groep hadden minder recidief VTE (voornamelijk minder recidief diepe veneuze trombose) maar meer ernstige bloedingen. Dat laatste trad vooral op bij patiënten met een tumor in het maag/darm stelsel, maag, lever, pancreas of het urogenitale gebied. De tweede studie liet een lager risico op recidief VTE zien bij gebruik van rivaroxaban dan bij gebruik van dalteparine, wat ten koste ging van meer ernstige en klinisch relevante bloedingen. Directe vergelijkingen tussen deze of andere DOAC’s in de setting van maligniteit-gerelateerde trombose zijn niet verricht.
Interacties tussen DOAC’s en chemotherapeutica zijn maar in beperkte mate onderzocht. De opname en klaring van DOAC’s is afhankelijk van P-glycoproteïne en het CYP3A4-systeem, die beide kunnen worden geremd of versterkt door verschillende chemotherapeutica. Meestal verloopt de beïnvloeding in deze richting en niet andersom, dat wil zeggen dat de DOACS de opname en klaring van chemotherapeutica beïnvloeden. Er zijn intrinsieke verschillen tussen de vier beschikbare DOAC’s, maar de klinische impact hiervan is niet bekend en niet vergeleken tussen de verschillende DOAC’s. De farmacologisch meest ‘optimale’ DOAC zou dus per patiënt kunnen verschillen.
We hebben geen literatuur search gedaan naar de duur van antistollingsbehandeling bij patiënten met een VTE en een maligniteit. De beschreven adviezen zijn gebaseerd op de bestaande richtlijn antitrombotisch beleid (2016). De duur van de antistollingsbehandeling bij patiënten met een VTE en een maligniteit is tenminste zes maanden. Patiënten met een hoog bloedingsrisico dienen ten minste drie maanden behandeld te worden. Zolang er sprake is van actieve maligniteit dan wel chemotherapie of adjuvante behandeling kan deze behandeling worden verlengd. Er is geen overtuigend bewijs dat LMWH tijdens verlengde behandeling effectiever is dan orale antistolling. Derhalve kan, na een initiële behandeling met LMWH, na 6 maanden worden overgegaan op orale antistolling. Bij voorgezette behandeling is het aan te bevelen regelmatig, en in ieder geval jaarlijks, een individuele afweging te maken tussen het verlagen van het recidief tromboserisico en het bloedingsrisico tijdens behandeling met antistolling.
Samen met de patiënt kunnen de voor- en nadelen (waaronder toedieningscomfort (oraal versus subcutaan) van DOAC’s of LMWH worden overwogen en om tot een gezamenlijk behandelbesluit te komen.
De bewijskracht van deze richtlijnmodule is gebaseerd op twee gerandomiseerde studies in de setting van een maligniteit-geassocieerde trombose en een veelvoud van gerandomiseerde studies bij patiënten met VTE zonder maligniteit. De gradering ‘Redelijk’ en ‘Laag’ komt met name door de imprecisie van de resultaten (breed betrouwbaarheidsinterval van de primaire eindpunten). Daarnaast was het niet mogelijk de data van beide studies te poolen vanwege het hoge risico op bias in de SELECT-D studie, wat waarschijnlijk invloed heeft gehad op het optreden van bloedingen in de rivaroxaban arm van de studie.
Op dit moment rekruterende gerandomiseerde internationale studies waarvan de uitkomsten de komende jaren bekend worden, zullen de resultaten van de twee hierboven beschreven studies in een duidelijker perspectief plaatsen, en daarmee de bewijsvoering voor de rol van DOAC’s in patiënten met VTE en een maligniteit verder aanvullen.
Onderbouwing
Achtergrond
In de grote fase 3 studies waarin direct werkende orale anticoagulantia (DOAC’s) werden vergeleken met vitamine K antagonisten (VKA) werden weinig patiënten met diepe veneuze trombose en/of longembolie (VTE) en een actieve maligniteit geïncludeerd. Verschillende meta-analyses laten zien dat in deze relatief kleine groep patiënten het risico op recidief VTE en ernstige bloeding tenminste vergelijkbaar was met VKA, met gepoolde puntschatters voor beide eindpunten in het voordeel van DOAC’s, maar met betrouwbaarheidsintervallen die boven de 1,0 uitkwamen (van der Hulle, 2014; Carrier, 2014; Di Minno, 2017; Posch, 2015; Vedovati, 2015; Larsen, 2014; van Es, 2014; Schulman, 2016). De aanbevolen voorkeursbehandeling was tot voor kort op basis van diverse gerandomiseerde studies die laagmoleculair heparine (LMWH) en VKA vergeleken- LMWH in een therapeutische dosering (Kearon, 2016). Er zijn inmiddels vergelijkende studies gepubliceerd en gestart bij patiënten met VTE en een onderliggende maligniteit waarbij behandeling met LMWH is vergeleken met DOAC’s.
In de huidige update is alleen gezocht naar nieuwe studies die de effectiviteit van DOAC’s vergelijkt met LMWH in de setting van veneuze trombo-embolie en een maligniteit. Bovenstaande aanbeveling voor gebruik van LMWH als eerste keus behandeling voor VTE bij een maligniteit is als basis voor deze update gebruikt.
Conclusies / Summary of Findings
Recidief VTE
|
Redelijk GRADE |
Het is mogelijk dat het gebruik van edoxaban, voorafgegaan door een periode van minimaal vijf dagen met een therapeutische dosis LMWH, voor de behandeling van maligniteit-gerelateerde VTE, in vergelijking met dalteparine, de kans op een recidief VTE vermindert (HR) (95% BI) = 0,71 (0,48 tot 1,06).
Bronnen: (Raskob, 2018) |
|
Laag GRADE |
Het is mogelijk dat het gebruik van rivaroxaban voor de behandeling van maligniteit-gerelateerde VTE, in vergelijking met dalteparine, de kans op een recidief VTE vermindert (HR (95% BI) = 0,43 (0,19 tot 0,99).
Bronnen: (Young, 2018) |
Ernstige bloeding
|
Redelijk GRADE |
Het is waarschijnlijk dat het gebruik van edoxaban, voorafgegaan door een periode van minimaal vijf dagen met een therapeutische dosis LMWH, voor de behandeling van maligniteit-gerelateerde VTE, in vergelijking met dalteparine, de kans op een ernstige bloeding vergroot (HR (95% BI) = 1,77 (1,03 tot 3,04)).
Bronnen: (Raskob, 2018) |
|
Laag GRADE |
Het is waarschijnlijk dat het gebruik van rivaroxaban voor de behandeling van maligniteit-gerelateerde VTE, in vergelijking met dalteparine, de kans op een ernstige bloeding vergroot (HR (95% BI) = 1,83 (0,68 tot 4,96)).
Bronnen: (Young, 2018) |
Gecombineerd risico op recidief VTE of ernstige bloeding
|
Hoog GRADE |
Het is waarschijnlijk dat het gebruik van edoxaban, voorafgegaan door een periode van minimaal vijf dagen met een therapeutische dosis LMWH, voor de behandeling van maligniteit-gerelateerde VTE gelijkwaardig is aan dalteparine met betrekking tot de kans op het gecombineerde risico op een recidief VTE of ernstige bloeding (HR (95% BI) = 0,97 (0,70 tot 1,36)).
Bronnen: (Raskob, 2018) |
Samenvatting literatuur
De literatuurzoekactie leverde 540 treffers op. Op basis van titel en abstract werden 28 studies geselecteerd. Na raadpleging van de volledige tekst, werden 25 studies uitgesloten (zie exclusietabel onder het tabblad Verantwoording).
Beschrijving studies
We includeerden twee gerandomiseerde studies (Raskob, 2018; Young, 2018) en één systematische literatuurstudie (Li, 2018). De belangrijkste studiekarakteristieken zijn samengevat in de bewijstabel. De beoordeling van de individuele studieopzet (risk of bias) is samengevat in de risk-of-biastabel.
De systematische literatuurstudie onderzocht het effect van een DOAC (dabigatran, rivaroxaban, apixaban of edoxaban) in vergelijking met een LMWH (dalteparine, enoxaparine, tinzaparine, nadroparine) (Li, 2018). De auteurs includeerden naast de twee gerandomiseerde studies die wij in deze literatuuranalyse meenemen (Raskob, 2018; Young, 2018) ook observationele - niet gerandomiseerde - studies. We beperken ons in deze literatuuranalyse tot de resultaten van de gerandomiseerde studies.
In de Hokusai VTE cancer-studie (Raskob, 2018) werden 1.046 patiënten met actieve maligniteit en bewezen diepe veneuze trombose en/of longembolie gerandomiseerd tussen behandeling met de DOAC edoxaban en de LMWH dalteparine. De behandeling met edoxaban werd voorafgegaan door tenminste vijf dagen LMWH. Patiënten werden behandeld met 60 mg edoxaban eenmaal daags, of met 30 mg edoxaban eenmaal daags, als er sprake was van een geschatte klaring van 30-50ml/min, het lichaamsgewicht 60 kg of lager was, of als er comedicatie gebruikt werd met sterke remming van P-glycoproteïne. De LMWH-arm werd behandeld met dalteparine 200IU/kg eenmaal daags tijdens de eerste 30 dagen, daarna met dalteparine 150IU/kg eenmaal daags. In beide groepen werd de behandeling voortgezet voor tenminste 6 maanden met een uitloop tot en met 12 maanden.
In de SELECT-D studie (Young, 2018) werden 406 patiënten met een actieve maligniteit en bewezen diep veneuze trombose of longembolie gerandomiseerd naar rivaroxaban 15mg 2 maal daags gedurende de eerste 21 dagen, gevolgd door 20mg rivaroxaban eenmaal daags gedurende 6 maanden, of naar dalteparine 200IU/kg eenmaal daags tijdens de eerste 30 dagen gevolgd door dalteparine 150IU/kg eenmaal daags gedurende 5 additionele maanden. Vanwege de hoge incidentie van ernstige bloeding werden vanaf halverwege de studie patiënten met maligne tumoren van de oesofagus of gastro-oesofageale junctie niet meer in de studie geïncludeerd (Young, 2018).
Resultaten
Recidief VTE
Figuur 1. presenteert het risico op een recidief VTE bij het gebruik van edoxaban of rivaroxaban in vergelijking met dalteparine. Na twaalf maanden had 7,9% van de edoxaban gebruikers en 11,3% van de dalteparine gebruikers een recidief VTE (Hazard ratio (HR) (95% betrouwbaarheidsinterval (BI) = 0,71 (0,48 tot 1,06)) (Raskob, 2018).
Na zes maanden had 3,9% (absolute incidentie) van de deelnemers in de rivaroxaban groep een recidief VTE, versus 8,9% van de deelnemers in de dalteparine groep (HR (95% BI) = 0,43 (0,19 tot 0,99)) (Young, 2018).
Figuur 1 Risico op recidief VTE bij het gebruik van DOAC versus dalteparine (6 tot 12 maanden)
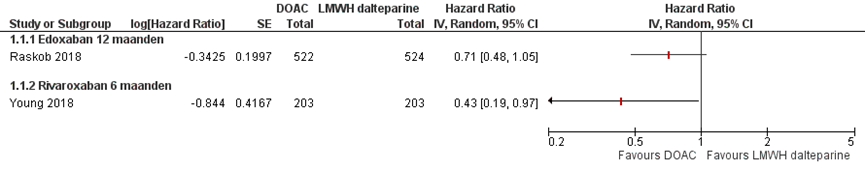
*Bovengrens 95% BI wijkt iets af van data in publicatie door afronding (1,05 versus 1,06; 0,97 versus 0,99)
Ernstige bloedingen
Figuur 2. presenteert het absolute risico op een ernstige bloeding bij het gebruik van edoxaban of rivaroxaban in vergelijking met dalteparine. Na twaalf maanden had 6,9% van de edoxaban gebruikers een ernstige bloeding en 4,0% van de dalteparine gebruikers (HR (95% BI) = 1,77 (1,03 tot 3,04)) (Raskob, 2018). Dit verschil kwam vooral door het relatief groter aantal ernstige bloedingen in patiënten met gastro-intestinale tumoren (inclusief lever- en pancreastumoren) in de edoxaban-groep dan in de dalteparine groep.
Na zes maanden had 5,4% van de deelnemers in de rivaroxaban groep een ernstige bloeding, versus 3,0% van de deelnemers in de dalteparine groep (HR (95% BI) = 1,83 (0,68 tot 4,96)) (Young, 2018). Bij de interpretatie van deze getallen dient in acht te worden genomen dat de patiënten categorie met een hoog risico op bloedingen (maligne tumoren van de oesofagus of gastro-oesofageale junctie) tijdens behandeling met rivaroxaban als boven beschreven vanaf halverwege de studie niet meer geïncludeerd werd (Young, 2018).
Figuur 2 Risico op ernstige bloeding bij het gebruik van DOAC versus dalteparine (6 tot 12 maanden)
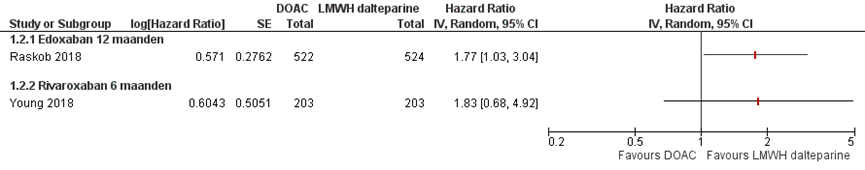
*Bovengrens 95% BI wijkt iets af van data in publicatie door afronding (4,92 versus 4,96)
Gecombineerd risico op recidief VTE of ernstige bloeding
Figuur 3. presenteert het gecombineerde risico op een recidief VTE of een ernstige bloeding bij het gebruik van edoxaban in vergelijking met dalteparine. Na twaalf maanden had 12,8% van de edoxaban gebruikers een recidief VTE of een ernstige bloeding en 13,5% van de dalteparine gebruikers (HR (95% BI) = 0,97 (0,70 tot 1,36)) (Raskob, 2018).
Figuur 3 Gecombineerd risico op recidief VTE of ernstige bloeding bij het gebruik van edoxaban versus dalteparine (12 maanden)
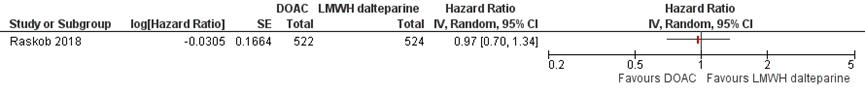
*Bovengrens 95% BI wijkt iets af van data in publicatie door afronding (1,34 versus 1,36)
Bewijskracht van de literatuur
We bepaalden voor iedere uitkomstmaat de bewijskracht van de onderliggende literatuur. Hiervoor gebruikten we de GRADE-methodiek (Guyatt, 2011) waarbij het resultaat gebaseerd op gerandomiseerde studies start met een gradering ‘Hoog’, maar op basis van vijf factoren (beperkingen in studieopzet, inconsistentie, indirectheid, imprecisie en publicatiebias) voor iedere factor met één of twee niveaus verlaagd kan worden (van ‘Hoog’, via ‘Redelijk’ naar ‘Laag’ of ‘Zeer laag’).
De bewijskracht van de literatuur voor het optreden van een recidief VTE of het optreden van een ernstige bloeding bij het gebruik van edoxaban werd vanwege het brede betrouwbaarheidsinterval (imprecisie) met één niveau verlaagd. We hebben de bewijskracht voor het optreden van het gecombineerde risico van een recidief VTE of ernstige bloeding bij het gebruik van edoxaban niet verlaagd voor imprecisie. Het betrouwbaarheidsinterval gaat weliswaar door de neutraalwaarde van geen effect, maar de conclusie is geschreven vanuit het oogpunt van non-inferioriteit.
De bewijskracht voor het optreden van een recidief VTE of het optreden van een ernstige bloeding bij het gebruik van rivaroxaban werd met twee niveaus verlaagd vanwege: 1) het brede betrouwbaarheidsinterval (imprecisie) en 2) het risico op bias doordat halverwege de studie de inclusiecriteria zijn aangepast.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat is het effect van direct werkende orale anticoagulantia in vergelijking met laagmoleculair heparine bij patiënten met maligniteit-gerelateerde diepe veneuze trombose en/of longembolie?
P: patiënten met maligniteit-gerelateerde diep veneuze trombose en/of longembolie (VTE);
I: antistollingstherapie met direct werkende orale anticoagulantia (DOAC);
C: antistollingstherapie met laagmoleculair heparine (LMWH).
Relevante uitkomstmaten
De werkgroep acht het optreden van een recidief VTE en het optreden van een ernstige bloeding voor de besluitvorming cruciale uitkomstmaten en een gecombineerd risico op recidief VTE een belangrijke uitkomstmaat. De werkgroep hanteerde de in de studies gebruikte definities.
De definitie van actieve maligniteit is:
- een diagnose van (recidief) kanker (anders dan basaalcelcarcinoom of plaveiselcelcarcinoom van de huid) in de afgelopen 6 maanden;
- 2) tot zes maanden na laatste oncologische behandeling; of
- bij bekende gemetastaseerde ziekte al dan niet in een (terminaal) palliatieve fase.
Zoeken en selecteren
In de databases Medline (via PubMed), Embase (via Ovid), Web of Science, The Cochrane Library en Academic Search Premier is op 23 april 2018 gezocht naar studies die het effect van antistollingstherapie met een DOAC vergeleken met antistollingstherapie met een LMWH bij patiënten met maligniteit-gerelateerde VTE. De zoekverantwoording is weergegeven onder het tabblad Verantwoording.
We includeerden systematische literatuurstudies en gerandomiseerde studies. Dose-finding studies (fase 2 onderzoek) en studies naar primaire profylaxe van VTE werden uitgesloten.
Referenties
- Agnelli, G., Buller, H. R., Cohen, A., Gallus, A. S., Lee, T. C., Pak, R., ... & Yamabe, T. (2015). Oral apixaban for the treatment of venous thromboembolism in cancer patients: results from the AMPLIFY trial. Journal of Thrombosis and Haemostasis, 13(12), 2187-2191.
- Alzghari, S. K., Seago, S. E., Garza, J. E., Hashimie, Y. F., Baty, K. A., Evans, M. F., ... & Herrington, J. D. (2018). Retrospective comparison of low molecular weight heparin versus. warfarin versus. oral Xa inhibitors for the prevention of recurrent venous thromboembolism in oncology patients: The Re-CLOT study. Journal of Oncology Pharmacy Practice, 24(7), 494-500.
- Bott-Kitslaar, D. M., Saadiq, R. A., McBane, R. D., Loprinzi, C. L., Ashrani, A. A., Ransone, T. R., ... & Wysokinski, W. E. (2016). Efficacy and safety of rivaroxaban in patients with venous thromboembolism and active malignancy: a single-center registry. The American journal of medicine, 129(6), 615-619.
- Brunetti, N. D., Gesuete, E., De Gennaro, L., Correale, M., Caldarola, P., Gaglione, A., & Di Biase, M. (2017). Direct oral anti-coagulants compared with vitamin-K inhibitors and low-molecular-weight-heparin for the prevention of venous thromboembolism in patients with cancer: a meta-analysis study. International journal of cardiology, 230, 214-221.
- Carrier, M., Cameron, C., Delluc, A., Castellucci, L., Khorana, A. A., & Lee, A. Y. (2014). Efficacy and safety of anticoagulant therapy for the treatment of acute cancer-associated thrombosis: a systematic review and meta-analysis. Thrombosis research, 134(6), 1214-1219.
- Davies, G. A., Lazo-Langner, A., Gandara, E., Rodger, M., Tagalakis, V., Louzada, M., ... & Kovacs, M. J. (2018). A prospective study of Rivaroxaban for central venous catheter associated upper extremity deep vein thrombosis in cancer patients (Catheter 2). Thrombosis research, 162, 88-92.
- Di Minno, M. N. D., Ageno, W., Lupoli, R., Conte, G., van Es, N., Buller, H. R., & Dentali, F. (2017). Direct oral anticoagulants for the treatment of acute venous thromboembolism in patients with cancer: a meta-analysis of randomised controlled trials. European Respiratory Journal, 50(3), 1701097.
- van Es, N., Coppens, M., Schulman, S., Middeldorp, S., & Büller, H. R. (2014). Direct oral anticoagulants compared with vitamin K antagonists for acute symptomatic venous thromboembolism: evidence from phase 3 trials. Blood, blood-2014.
- Guyatt, G., Oxman, A. D., Akl, E. A., Kunz, R., Vist, G., Brozek, J., ... & Rind, D. (2011). GRADE guidelines: 1. Introduction—GRADE evidence profiles and summary of findings tables. Journal of clinical epidemiology, 64(4), 383-394.
- Hirsh J and Ginsberg JS. (2018). Edoxaban for the Treatment of Venous Thromboembolism in Patients with Cancer. New England Journal of Medicine, 378, 673-674.
- van der Hulle, T., Den Exter, P. L., Kooiman, J., Van Der Hoeven, J. J. M., Huisman, M. V., & Klok, F. A. (2014). Meta‐analysis of the efficacy and safety of new oral anticoagulants in patients with cancer‐associated acute venous thromboembolism. Journal of Thrombosis and Haemostasis, 12(7), 1116-1120.
- Kearon C, Akl EA, Ornelas J, Blaivas A, Jimenez D, Bounameaux H, Huisman M, King CS, Morris TA, Sood N, Stevens SM, Vintch JRE, Wells P, Woller SC, Moores L. Antithrombotic Therapy for VTE Disease: CHEST Guideline and Expert Panel Report. Chest. 2016 Feb;149(2):315-352.
- Larsen, T. B., Nielsen, P. B., Skjøth, F., Rasmussen, L. H., & Lip, G. Y. (2014). Non-vitamin K antagonist oral anticoagulants and the treatment of venous thromboembolism in cancer patients: a semi systematic review and meta-analysis of safety and efficacy outcomes. PLoS One, 9(12), e114445.
- Lee, A. Y. (2018). Overview of VTE treatment in cancer according to clinical guidelines. Thrombosis research, 164, S162-S167.
- Li, A., Garcia, D. A., Lyman, G. H., & Carrier, M. (2018). Direct oral anticoagulant (DOAC) versus low-molecular-weight heparin (LMWH) for treatment of cancer associated thrombosis (CAT): A systematic review and meta-analysis. Thrombosis research.
- Mancuso, A., Vedovati, M. C., Pierpaoli, L., Paliani, U., Conti, S., Filippucci, E., ... & Becattini, C. (2016). PO-40-Real-life use of non-vitamin k antagonist oral anticoagulants in patients with cancer associated venous thromboembolism: data from a prospective cohort. Thrombosis research, 140, S191.
- Mantha, S., Laube, E., Miao, Y., Sarasohn, D. M., Parameswaran, R., Stefanik, S., ... & Soff, G. A. (2017). Safe and effective use of rivaroxaban for treatment of cancer-associated venous thromboembolic disease: a prospective cohort study. Journal of thrombosis and thrombolysis, 43(2), 166-171.
- Noble, S. I. (2016a). Direct oral anticoagulants and cancer: no swansong yet for the low-molecular-weight heparins. The Lancet Haematology, 3(8), e357-e358.
- Noble, S., & Sui, J. (2016b). The treatment of cancer associated thrombosis: does one size fit all? Who should get LMWH/warfarin/DOACs?. Thrombosis research, 140, S154-S159.
- Posch, F., Königsbrügge, O., Zielinski, C., Pabinger, I., & Ay, C. (2015). Treatment of venous thromboembolism in patients with cancer: a network meta-analysis comparing efficacy and safety of anticoagulants. Thrombosis research, 136(3), 582-589.
- Raskob, G. E., van Es, N., Segers, A., Angchaisuksiri, P., Oh, D., Boda, Z., ... & Zhang, G. (2016). Edoxaban for venous thromboembolism in patients with cancer: results from a non-inferiority subgroup analysis of the Hokusai-VTE randomised, double-blind, double-dummy trial. The Lancet Haematology, 3(8), e379-e387.
- Raskob, G. E., van Es, N., Verhamme, P., Carrier, M., Di Nisio, M., Garcia, D., ... & Meyer, G. (2018). Edoxaban for the treatment of cancer-associated venous thromboembolism. New England Journal of Medicine, 378(7), 615-624.
- Ross, J. A., Miller, M. M., & Hernandez, C. M. R. (2017). Comparative effectiveness and safety of direct oral anticoagulants (DOACs) versus conventional anticoagulation for the treatment of cancer-related venous thromboembolism: a retrospective analysis. Thrombosis research, 150, 86-89.
- Schulman, S., Goldhaber, S. Z., Kearon, C., Kakkar, A. K., Schellong, S., Eriksson, H., ... & Kreuzer, J. (2015). Treatment with dabigatran or warfarin in patients with venous thromboembolism and cancer. Thromb Haemost, 114(1), 150-157.
- Schulman, S., Shrum, J., & Majeed, A. (2016). Management of bleeding complications in patients with cancer on DOACs. Thrombosis research, 140, S142-S147.
- Simmons, B., Wysokinski, W., Saadiq, R. A., Bott‐Kitslaar, D., Henkin, S., Casanegra, A., ... & Hodge, D. (2018). Efficacy and safety of rivaroxaban compared to enoxaparin in treatment of cancer associated venous thromboembolism. European journal of haematology.
- Streiff, M. B., Milentijevic, D., McCrae, K., Yannicelli, D., Fortier, J., Nelson, W. W., ... & Khorana, A. A. (2018). Effectiveness and safety of anticoagulants for the treatment of venous thromboembolism in patients with cancer. American journal of hematology, 93(5), 664-671.
- Vedovati, M. C., Germini, F., Agnelli, G., & Becattini, C. (2015). Direct oral anticoagulants in patients With VTE and cancer. Chest, 147(2), 475-483.
- Xiang, E., Ahuja, T., Raco, V., Cirrone, F., Green, D., & Papadopoulos, J. (2018). Anticoagulation prescribing patterns in patients with cancer. Journal of thrombosis and thrombolysis, 45(1), 89-98.
- Young A. M., Phillips J, Hancocks H, Hill C, Joshi N, Marshall A, …& Chapman, O. (2016) OC-11 - Anticoagulation therapy in selected cancer patients at risk of recurrence of venous thromboembolism. Thrombosis Research, 140 Suppl 1:S172-S173
- Young, A. M., Marshall, A., Thirlwall, J., Chapman, O., Lokare, A., Hill, C., ... & MacCallum, P. (2018). Comparison of an oral factor Xa inhibitor with low molecular weight heparin in patients with cancer with venous thromboembolism: results of a randomized trial (SELECT-D). Journal of Clinical Oncology, 36(20), 2017-2023
Evidence tabellen
Evidence table for intervention studies
Research question: Wat is het effect van direct werkende orale anticoagulantia in vergelijking met laagmoleculair heparine bij patiënten met maligniteit-gerelateerde diep veneuze trombose en/of longembolie?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention |
Comparison/ control |
Follow-up |
Outcome measures and effect size |
Comments |
|
Raskob 2018
|
Design: RCT
Setting: Academic hospital
Country: Europe, Northern-America, Australia, New Zeeland Source of funding: Daiichi Sankyo |
Inclusion criteria: - Adults with lower extremity proximal DVT, or PE; - Cancer (other than basal-cell or squamous-cell carcinoma of the skin); - Intention for long-term treatment (at least 6 months) with parenteral LMWH.
Exclusion criteria: - Thrombectomy, insertion of a caval filter, or use of a fibrinolytic agent to treat the current episode of DVT and/or PE; - More than 72 hours pre-treatment with therapeutic anticoagulant treatment (LMWH, unfractionated heparin, and fondaparinux), oral direct anticoagulants or VKA prior to randomization; - Treatment with therapeutic doses of an anticoagulant including dalteparin for an indication other than VTE prior to randomization; - Active bleeding or any contra-indication for treatment with LMWH/dalteparin or edoxaban; - An ECOG performance status of 3 or 4 at the time of randomization; - CrCL < 30 mL/min; - History of heparin associated thrombocytopenia - Acute hepatitis, chronic active hepatitis, liver cirrhosis; - Hepatocelullar injury with concurrent transaminase elevations in the absence of a clinical explanation; - Life expectancy < 3 months; - Platelet count < 50,000/mL; - Uncontrolled hypertension as judged by the Investigator ; - Women of childbearing potential without contraceptive measures, and women who are pregnant or breast feeding; - Chronic treatment with NSAIDs including COX-1 and COX-2 inhibitors for ≥ 4 days/week anticipated to continue during the study; - Treatment with aspirin in a dosage of more than 100 mg/per day or dual antiplatelet therapy; - Treatment with the P-gp inhibitors ritonavir, nelfina vir, indinavir, or saquinavir anticipated to continue during the study; - Systemic use of the P-gp inhibitors ketoconazole, itraconazole, erythromycin, azithromycin or clarithromycin at the time of randomization; subsequent use is permitted (with appropriate dose reduction of edoxaban).
N total at baseline: Intervention: N=522 Control: N=524
Important prognostic factors edoxaban group: Age mean (SD) = 64.3 (11.0) Male N (%) = 277 (53.1) Weight KG mean (SD) = 78.8 (17.9) Met criteria for lower dose edoxaban N (%) = 122 (23.4)
Important prognostic factors dalteparin group: Age mean (SD) = 63.7 (11.7) Male N (%) = 263 (50.2) Weight KG mean (SD) = 79.1 (18.1) Met criteria for lower dose edoxaban N (%) = 117 (22.3) |
Edoxaban: Edoxaban was started after a course of therapeutic-dose low-molecular-weight heparin was given subcutaneously for at least 5 days.
Edoxaban administered orally at a fixed dose of 60 mg once daily. It was administered at a lower dose (30 mg once daily) in patients with a creatinine clearance of 30 to 50 ml per minute or a body weight of 60 kg or less or in those receiving concomitant treatment with potent P-glycoprotein inhibitors.
Edoxaban was to be continued for at least 6 months and up to 12 months. The duration beyond 6 months was determined by the treating physician. |
Dalteparin: Dalteparin subcutaneously at a dose of 200 IU per kilogram of body weight once daily for 30 days, with a maximum daily dose of 18,000 IU. Thereafter, dalteparin was given at a dose of 150 IU per kilogram once daily. If the platelet count declined to less than 1000,000 per microliter during treatment, the dose of dalteparin was temporarily reduced.
Dalteparin was to be continued for at least 6 months and up to 12 months. The duration beyond 6 months was determined by the treating physician. |
Length of follow-up: 12 months or until the end of the trial (minimum follow-up, 9 months).
Patients underwent assessment, in the clinic or by telephone, on day 31 after randomization and at months 3, 6, 9, and 12.
Loss-to-follow-up: Edoxaban: N = 6 (1%)
Dalteparin: N = 6 (1%) |
Recurrent venous thromboembolism: Events in edoxaban group: 41/522 Events in dalteparin group: 59/524 Hazard ratio (95% CI) = 0.71 (0.48 to 1.06)
Major bleeding: Events in edoxaban group: 36/522 Events in dalteparin group: 21/524 Hazard ratio (95% CI) = 1.77 (1.03 to 3.04)
Recurrent venous thromboembolism or major bleeding: Events in edoxaban group: 67/522 Events in dalteparin group: 71/524 Hazard ratio (95% CI) = 0.97 (0.70 to 1.36) |
|
|
Young 2018 |
Design: RCT
Setting: Academic hospital
Country: United Kingdom
Source of funding: Bayer AG |
Inclusion criteria: - Adults with active cancer (solid and hematologic malignancies, other than basal-cell or squamous-cell skin carcinoma) presenting with a primary objectively confirmed VTE, either symptomatic lower-extremity proximal DVT, symptomatic PE, or incidental PE. - ECOG performance status ≤2 and have adequate hematologic, hepatic, and renal function.
Exclusion criteria: - Any previous treatment dose of anticoagulant or >75 mg aspirin per day; - History of VTE; - Clinically significant liver disease, bacterial endocarditis; - Active bleeding or high risk of bleeding; - Uncontrolled hypertension; - Inadequate contraceptive measures if of childbearing potential; - Concomitant use of strong cytochrome P- 450 3A4 inhibitors or inducers or P-glycoprotein inhibitors or inducers was not permitted.
N total at baseline: Intervention: N=203 Control: N=203
Important prognostic factors rivaroxaban group: Age median (range) = 67 (22 to 87) Male N (%) = 116 (57) BMI median (range) = 26.7 (14.9 to 46.2)
Important prognostic factors dalteparin group: Age median (range) = 67 (34 to 87) Male N (%) = 98 (48) BMI median (range) = 26.6 (15.1 to 50.4) |
Rivaroxaban: Rivaroxaban, 15 mg tablets were administered orally with food twice daily for the first 3 weeks, followed by 20 mg tablets once daily for a total of 6 months.
If platelet counts were <50,000/mm3, rivaroxaban was to be discontinued until the platelet count recovered to >50,000/mm3. A dose reduction or discontinuation was specified for different levels of renal impairment. |
Dalteparin: Dalteparin, 200 IU/kg was administered subcutaneously once daily for the first 30 days of treatment, and then 150 IU/kg was administered subcutaneously once daily for an additional 5 months.
The total daily dose was not to exceed 18,000 IU. The dose was also adjusted or discontinued for low platelet count and significant renal failure until recovery. |
Length of follow-up: Patients were assessed at 3-month intervals until month 12 and then at 6-month intervals until month 24.
Loss-to-follow-up: Rivaroxaban: N = 16 (8%)
Dalteparin: N = 20 (10%) |
Recurrent venous thromboembolism: Events in rivaroxaban group: 8/203 Events in dalteparin group: 18/203 Hazard ratio (95% CI) = 0.43 (0.19 to 0.99
Major bleeding: Events in rivaroxaban group: 11/203 Events in dalteparin group: 6/203 Hazard ratio (95% CI) = 1.83 (0.68 to 4.96)
|
|
Risk of bias table for intervention studies (randomized controlled trials)
Research question: Wat is het effect van direct werkende orale anticoagulantia in vergelijking met laagmoleculair heparine bij patiënten met maligniteit-gerelateerde diep veneuze trombose en/of longembolie?
|
Study reference
(first author, publication year) |
Describe method of randomisation |
Bias due to inadequate concealment of allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?
(unlikely/likely/unclear) |
Bias due to loss to follow-up?
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?
(unlikely/likely/unclear) |
|
Raskob 2018 |
‘Randomization was performed with the use of an interactive Web-based system, with stratification according to…’ |
Unlikely |
Unlikely |
Unclear |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Young 2018 |
‘Patients were randomly assigned centrally by telephoning Warwick Clinical Trials Unit.’ ‘…randomly assigned at a one-to-one ratio using a computer-based minimization algorithm…’ |
Unlikely |
Unlikely |
Unclear |
Unlikely |
Unlikely |
Likely
‘The DSMC also noted a nonsignificant difference in major bleeding between arms in the 19 patients with cancer of the esophagus or gastroesophageal junction. These cancers were subsequently excluded from enrollment as a precautionary measure.’
This may have resulted in a selection bias, not due to loss to follow-up but by not including these (initial eligible patients) into the study. |
Unlikely |
Exclusietabel
|
Auteur en jaartal |
Redenen van exclusie |
|
Van der Hulle 2014 |
Meta-analyse DOAC versus VKA |
|
Carrier 2014 |
Geen vergelijking tussen DOAC en LMWH |
|
Di Minno 2017 |
Meta-analyse DOAC versus VKA |
|
Brunetti 2017 |
Meta-analyse DOAC versus VKA |
|
Posch 2015 |
Meta-analyse DOAC versus VKA |
|
Vedovati 2015 |
Meta-analyse DOAC versus VKA |
|
Larsen 2014 |
Meta-analyse DOAC versus VKA |
|
Van En 2014 |
Meta-analyse DOAC versus VKA |
|
Schulman 2016 |
Meta-analyse DOAC versus VKA |
|
Agnelli 2015 |
Geen gerandomiseerde studie |
|
Bott-Kitslaar 2016 |
Geen gerandomiseerde studie |
|
Davies 2018 |
Geen gerandomiseerde studie |
|
Mancuso 2016 |
Geen gerandomiseerde studie |
|
Mantha 2017 |
Geen gerandomiseerde studie |
|
Raskob 2016 |
Geen gerandomiseerde studie |
|
Schulman 2015 |
Geen gerandomiseerde studie |
|
Simmons 2018 |
Geen gerandomiseerde studie |
|
Alzghari 2017 |
Geen gerandomiseerde studie |
|
Streiff 2018 |
Geen gerandomiseerde studie |
|
Ross 2017 |
Geen gerandomiseerde studie |
|
Xiang 2018 |
Geen gerandomiseerde studie |
|
Hirsh 2018 |
Editorial |
|
Lee 2018 |
Beschrijvende literatuurstudie |
|
Noble 2016a |
Beschrijvende literatuurstudie |
|
Noble 2016b |
Beschrijvende iteratuurstudie |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 06-08-2020
Beoordeeld op geldigheid : 01-09-2020
Deze richtlijn is modulair herzien. Een aantal modules dienen binnen de tijdstermijn van 5 jaar herzien te worden. De NIV is daarom voornemens een deel van de werkgroep in stand te houden. Een nader uitgewerkt onderhoudsplan wordt tijdens de commentaarronde ter consultatie voorgelegd aan de NIV commissie richtlijnen en kwaliteitsmeting.
De NIV is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Omdat deze richtlijn in modulair onderhoud is zullen er de komende tijd regelmatig modules van deze richtlijn worden geüpdatet of waar nodig nieuwe modules worden ontwikkeld en toegevoegd. Er volgen hiervoor nog aparte commentaar- en autorisatiefases. Zie het ‘Overzicht modulair onderhoud’ bij de aanverwante producten van deze module voor een overzicht van de vragen die momenteel uitgewerkt worden.
Algemene gegevens
Deze richtlijnmodule is goedgekeurd door:
- Patiëntenfederatie Nederland
- Harteraad
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (https://www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Het doel is de multidisciplinaire nationale richtlijn Antitrombotisch beleid te herzien, waarbij er een duidelijke invulling komt van de gesignaleerde klinische knelpunten. Als voorbeeld wordt de hiaat met betrekking tot het beleid van perioperatief gebruik van antistolling herzien en wordt aandacht gegeven aan de introductie van DOACs.
Deze richtlijn is geschreven voor patiënten, trombosediensten, en alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met antitrombotische therapie.
Samenstelling werkgroep
Kerngroep
- prof. dr. M.V. (Menno) Huisman, internist-vasculaire geneeskunde, LUMC, NIV (voorzitter)
- dr. M.J.H.A. (Marieke) Kruip, internist-hematoloog, ErasmusMC, NIV, NVVH (Nederlandse Vereniging voor Hematologie)
- dr. F.A. (Erik) Klok, internist-vasculaire geneeskunde, LUMC, NIV
- dr. M.A. (Marc) Brouwer, cardioloog, RadboudUMC, NVVC
- dr. H.B. (Harmen) Ettema, orthopedisch chirurg, Isala, NOV
- drs. B. (Banne) Nemeth, aios orthopedie, LUMC, NOV
- dr. A.M. (Arno) Wiersema, vaatchirurg, NVVH
- dr. M.E. (Maarten) Tushuizen, maag-darm-leverarts, LUMC, NVMDL
- dr. J.M. (Jonathan) Coutinho, neuroloog, AMC-UVA, NVN
- drs. A. (Andrew) Oostindjer, huisarts/ Kaderhuisarts HVZ, NHG
Klankbordgroep
- dr. J.J.C.M. (Sjef) van de Leur, arts klinische chemie, Isala, NVKC
- dr. A.W.M.M. (Ankie) Koopman - van Gemert, anesthesioloog, ASZ, NVA
- dr. M.G. (Mariëlle) van Pampus, gynaecoloog, OLVG, NVOG
- drs. R.J. (Repke) Snijder, longarts, Antoniusziekenhuis, NVALT
- drs. R.J. Lely, radioloog, VUMC, NVVR
- dr. C. van Montfrans, dermatoloog, ErasmusMC, NVDV
- dr. R.A. (Richard) Faaij, klinisch geriater, Diakonessenhuis, NVKG
- dr. B. van Minnen, kaakchirurg, UMCG, NVMKA
- mw. A (Annemarie) Auwerda, beleidsadviseur, Harteraad (vanaf maart 2019)
- A.M. (Anne) Kors-Walraven MSc BA, beleidsadviseur, Harteraad (van November 2018 tot maart 2019).
- prof. dr. S (Saskia) Middeldorp, internist vasculaire-geneeskunde, AMC-UVA, NIV
- M.J. (Jacqueline) Krol- van Straaten, internist – nefroloog, Hagaziekenhuis, NIV
- dr. M. (Marcel) Schouten, internist – nefroloog, Tergooi, NIV
- dr. N. (Nakisa) Khorsand, ziekenhuisapotheker, OLVG, NVZA
- dr. M.F. (Margreet) Warlé- van Herwaarden, openbaar apotheker, KNMP
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Achternaam werkgroeplid |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Getekend op |
Acties |
|
Huisman |
Internist vasculaire geneeskunde Leids Universitair Medisch Centrum |
- Voorzitter commissie herziening Antitrombotisch Beleid, onbetaald |
Adviseur farmaceutische bedrijven die (nieuwe) antistollingsmiddelen maken - betaald; gelden gaan naar afdeling Interne Geneeskunde LUMC |
Niet van toepassing |
ZONMW grant Dutch-AF - registry met onderzoek op het gebied van antistolling bij patiënten met atriumfibrilleren; betaald, gelden gaan naar afdeling Interne Geneeskunde LUMC |
Niet van toepassing |
Niet van toepassing |
14-6-2018 |
Deelname in werkgroep als voorzitter in verband met expertise op dit gebied. In verband met adviseur farmaceutische bedrijven: participeert niet bij besluitvorming middelen |
|
Kruip |
Internist-hematoloog Erasmus MC |
Medisch leider trombosedienst Star-SHL, gedetacheerd vanuit het Erasmus MC |
Geen |
Geen |
- Anti-thrombotic standardship S-team introduction (2015-2016) Boehringer-Ingelheim |
Niet van toepassing |
- 2015: bezoek Sheffield trombosekliniek / Bayer / € 500,- (reiskosten) |
26-6-2018 |
In verband met belangen geen participatie besluitvorming keuze middelen |
|
Wiersema |
Vaatchirurg in het Westfriesgasthuis te Hoorn en AUMC, locatie Vumc |
Grant onderzoek ACT en heparine arteriële vaatingrepen Medtronic, geen onderwerp van deze richtlijn |
Geen |
Geen |
Grant onderzoek ACT en heparine arteriële vaatingrepen Medtronic, geen onderwerp van deze richtlijn |
Geen |
Geen |
24-7-2018 |
Geen acties |
|
Ettema |
Orthopedisch chirurg Isala Klinieken, Zwolle |
geen |
geen van bovenstaande |
geen van bovenstaande |
In verleden deelname verschillende RCT waarvan de laatste > 2 jaar gelden |
geen van bovenstaande |
geen |
31-7-2018 |
RCT's >3 jaar geleden, geen actie |
|
Coutinho |
Neuroloog Amsterdam UMC |
geen |
geen |
geen |
RESPECT-CVT studie. Gefinancierd door Boehringer. Ondergetekende zit in het steering Committee van deze studie |
geen |
geen |
31-8-2018 |
geen actie, studie gaat over andere patiëntpopulatie |
|
Warlé-van Herwaarden |
Apotherker, Apotheek Groesbeek |
participeert af en toe in onderzoek (onbetaald) |
geen |
geen |
geen |
geen |
Geen |
3-9-2018 |
Geen acties |
|
Brouwer |
Cardioloog, Radboudumc |
Afgevaardigde van de NVVO bij LSKA (Landelijke Standaard Keten Antistolling), onbetaald |
De research-afdeling cardiologie heeft voor verschillende projecten financiële ondersteuning ontvangen van : Astra Zeneca, BMS-Pfizer, Boehringer Ingelheim, Beyer, Daiichi Sankyo |
nee |
Dutch AF registry |
Niet van toepassing |
Niet van toepassing |
8-11-2017 |
Geen, ander onderwerp |
|
Klok |
Internist Vasculair geneeskundige, LUMC, Leiden |
Adjunct Professor Universiteit van Mainz, Duitsland (onbetaald) |
Geen |
Geen |
Dr. F.A. Klok heeft financiële steun ontvangen voor studies (unrestricted research grants) van Bayer, BMS/Pfizer, Boehringer Ingelheim, Daiichi Sankyo, MSD, Actelion, Trombose Stichting Nederland en de Hartstichting. Dit betroffen allen studies naar diagnostiek van longembolie/DVT of voorkomen van langetermijn effecten (pulmonale hypertensie, lagere kwaliteit van leven et cetera). |
Geen |
Geen |
21-9-2018 |
Geen, gesponsorde studies gaan over diagnostiek. Diagnostiek komt vooralsnog niet aan bod in deze richtlijn. Mocht dit het geval zijn belangen opnieuw bespreken. Geen actie nodig |
|
Alikhil |
* Huisarts, werkzaam in huisartspraktijk Alikhil |
* Huisartsenzorg in volle breedte |
Neen |
Neen |
Neen |
Neen |
Neen |
1-11-2018 |
Geen acties |
|
Tushuizen |
MDL-arts, staflid Leids Universitair Medisch Centrum, Leiden |
MDL-arts; DC-kliniek Almere, Almere, verrichten van endoscopie (betaald) |
Niet van toepassing |
Niet van toepassing |
Niet van toepassing |
Niet van toepassing |
Niet van toepassing |
14-12-2018 |
Geen acties |
|
Oostindjer |
Huisarts - eigen praktijk in Oldenzaal. |
Als Kaderhuisarts HVZ: |
Ik heb momenteel geen (financiële) belangen bij welke organisatie dan ook die producten produceert die van belang zijn voor deze richtlijn (antistolling). |
nvt |
nvt |
Ik heb geen belangen die geschaad of bevoordeeld kunnen worden. Enige wat zou kunnen is dat er meer vraag komt naar onderwijs op dit onderwerp welke ik dan zou kunnen verzorgen mogelijk een vorm van “vermarkting”. |
nvt |
19-8-2019 |
|
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiënten perspectief door een search naar het patiënten perspectief. Daarnaast zal bij de richtlijn een zogenaamde ‘option grid’ worden ontwikkeld (keuzehulp voor patiënten en zorgverleners samen) voor het onderwerp continueren antistolling.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten. De werkgroep heeft tevens interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken (zie indicatorenontwikkeling).
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen volgens het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is en op ‘richtlijnen voor richtlijn’ voor de beoordeling van de kwaliteit van richtlijnen (www.zorginstituutnederland.nl).
Doordat delen van de richtlijn niet herzien zijn, zijn door de evolutie van richtlijn ontwikkelmethodologie de gebruikte methodes verschillend voor verschillende delen.
De delen over diagnostiek bij diepe veneuze trombose, diagnostiek longembolie, aparte categorieën in kader van diagnostiek, arteriële preventie en bijzondere situaties veneuze preventie veneuze trombo-embolie uit de CBO richtlijn van 2008 zijn zo veel mogelijk in originele structuur en stijl behouden (hoewel er aan de structuur wijzigingen zijn gemaakt zodat deze teksten conform het richtlijnendatabase format zijn). De additionele secties over medicamenteuze behandeling van veneuze trombo-embolie, niet-medicamenteuze behandeling van veneuze trombo-embolie, bijzondere situaties veneuze trombo-embolie en preventie veneuze trombo-embolie bevatten nieuwe literatuur en aanbevelingen die werden ontwikkeld volgens nieuwe methodologie. Dit heeft onvermijdelijk geleid tot inconsistenties in de stijl. Bijvoorbeeld is de GRADE methodologie gebruikt in de nieuwe teksten om de kwaliteit en sterkte van de bewijskracht en aanbevelingen te graderen in de nieuwe stukken, waar in de oude stukken gebruik is gemaakt van de oudere EBRO methodologie, of gradering van de oude ACCP richtlijn (2004) is overgenomen. Daarnaast wordt in de oude delen van de richtlijn asymptomatische DVT als uitkomstmaat gehanteerd, maar meer recentelijk wordt zowel nationaal als internationaal deze uitkomstmaat niet meer gebruikt. In de nieuwe delen worden daarom alleen de resultaten met betrekking tot symptomatische DVT gerapporteerd.
De beschrijving van de methodologie bij de verschillende teksten bevatten een beschrijving van de details met betrekking tot de methodologie voor de betreffende module.
Het is van belang om te benadrukken dat hoewel de richtlijn methodologie is veranderd, ook de oudere aanbevelingen uit de CBO richtlijn 2008 onverminderd van kracht zijn.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de werkgroep de knelpunten middels een enquête. Naast de in de kern- en klankbordgroep vertegenwoordigde partijen werden de FNT, IGJ, KiMO, NHG, NFU, NVZ, STZ, V&VN, Verenso, VIG, VWS, ZiNL en ZN uitgenodigd deze enquête in te vullen.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur conceptuitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk en onbelangrijk. Tevens definieerde de werkgroep voor de kritieke en belangrijke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar systematische reviews [EMBASE, MEDLINE, Cochrane library]. Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in het hoofdstuk van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen schatten. Deze beoordelingen kunt u vinden in de Risk of bias tabellen.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org) (Schünemann H, 2013).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van vertrouwen in de literatuurconclusie.
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose
De GRADE methodiek is door de Nederlandse werkgroep GRADE-NL (nog) niet vastgesteld voor dit type vraagstelling. De bewijskracht van de conclusie is bepaald volgens de EBRO-methode (Van Everdingen, 2004).
Belangrijkste verschillen tussen de GRADE- en ACCP-indeling
- Met de ACCP-indeling worden aanbevelingen gegradeerd, met de GRADE methodiek worden conclusies gegradeerd. In de ACCP-aanbevelingen wordt wel rekening gehouden met overige (meer subjectieve) overwegingen (bijwerkingen, kosten, gemak voor patiënt), maar dit is niet expliciet terug te vinden; dit komt terug in grootte van het effect (zie punt 2). In de GRADE methodiek worden de overige overwegingen (bijwerkingen, kosten, patiëntenperspectief, expert opinion) gewogen en transparant beschreven, deze overwegingen samen met de wetenschappelijke conclusies leiden tot de aanbevelingen;
- In de ACCP-indeling wordt onderscheid gemaakt tussen een duidelijk klinisch effect (1) en een klein of onduidelijk effect (2), volgens de GRADE-methodiek wordt vooraf benoemde klinische relevantie meegewogen in de gradering van de conclusies.
Formuleren van de conclusies
Voor vragen over de waarde van diagnostische testen, over schade of bijwerkingen, etiologie en prognose is het wetenschappelijke bewijs samengevat in één of meerdere conclusie(s), waarbij het niveau van het meest relevante bewijs is weergegeven.
Bij interventievragen verwijst de conclusie niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence). Hierbij maakten de werkgroepleden de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals criteria die van invloed zijn op de aanbeveling, de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen of organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. De richtlijn bevat geen organisatie van zorg hoofdstuk, omdat er over organisatie van zorg en samenwerking binnen de keten reeds documenten bestaan (bijvoorbeeld LSKA 2.0).
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de richtlijn werden er interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken (de indicatoren zijn te vinden in de aanverwante producten). Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten (secretariaat@kennisinstituut.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek worden toegevoegd na de commentaarfase.
Commentaar- en autorisatiefase
De conceptrichtlijn wordt aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. De commentaren worden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren wordt de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn wordt aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
