Antipsychotica en langetermijneffecten bij het kind
Uitgangsvraag
Welke antipsychotica hebben de voorkeur voor gebruik in de zwangerschap met betrekking tot het risico op late gevolgen op motoriek, cognitie, gedrag en sociaal emotionele ontwikkeling bij het kind?
Aanbeveling
Bespreek met patiënte dat er vanwege de huidige beperkte kennis momenteel geen voorkeur aangegeven kan worden voor een specifiek antipsychoticum ten aanzien van de lange termijneffecten op het kind.
Bespreek met patiënte dat er nog niet veel bekend is over de lange termijneffecten van in de zwangerschap gebruikte antipsychotica op het kind, maar dat de momenteel bekende effecten op de motoriek, cognitie, gedrag en sociaal-emotionele ontwikkeling lijken mee te vallen.
Bespreek met patiënte dat de huidige beperkte kennis over de lange termijneffecten van de in de zwangerschap gebruikte antipsychotica op het kind, het momenteel niet noodzakelijk maakt de medicatie te stoppen of te wijzigen tijdens de zwangerschap.
Overwegingen
De kwaliteit van het bewijs
Er zijn geen studies die de lange termijn effecten beschrijven van intra-uteriene blootstelling aan antipsychotica bij kinderen vanaf de leeftijd van 5 tot 18 jaar.
Bij kinderen tot 5 jaar is de literatuur niet eenduidig en moeilijk te interpreteren. De relevante studies laten een wijde range zien van methodologie, interventies bij de zwangere met psychopathologie, duur van follow-up en het gebruikte meetinstrument voor de evaluatie van de ontwikkeling van het kind. Een klein aantal studies laat een vroege achterstand in de neurologische ontwikkeling zien op verschillende domeinen (motoriek, cognitie, gedrag, sociaal-emotioneel), met vaak een spontaan herstel tijdens de follow-up in de eerste 1 tot 2 levensjaren. Het meest consistente is een tijdelijke achterstand in de motoriek op de leeftijd van 6 maanden. Deze bevinding is echter maar gebaseerd op twee studies, en is mede gezien de grote variatie in ontwikkeling op deze leeftijd niet erg valide. Potentiele negatieve ontwikkelingseffecten na de leeftijd van 2 jaar zijn nog minder onderzocht en hierover kan zodoende geen betrouwbare uitspraak worden gedaan. Hetzelfde geldt voor de individuele antipsychotica, die in de meeste studies als groep worden beschreven, als gevolg van de kleine aantallen van de verschillende gebruikte middelen.
Van belang is dat veel studies bij de beoordeling van het effect van de maternale medicatie, niet adequaat hebben gecorrigeerd voor andere potentieel negatieve factoren. Idealiter zouden studies gericht moeten zijn op de vergelijking van blootgestelde versus niet-blootgestelde kinderen van moeders met vergelijkbare psychopathologie. De meeste studies vergeleken aan antipsychotica blootgestelde kinderen echter met niet blootgestelde kinderen van moeders zonder psychiatrische ziekte. Hierbij werd geen rekening gehouden met de psychiatrische conditie van de moeder, het verlengende effect van de medicatie via eventuele borstvoeding en de genetische predispositie van het kind, noch met omgevingsfactoren zoals de sociaal economische status, het opleidingsniveau van moeder, eventueel middelenmisbruik of het uitgevoerde ouderschap en de gezinssamenstelling. Deze factoren kunnen alle individueel een onafhankelijke invloed op de ontwikkeling van het kind hebben.
Daarnaast maakt het gebruik van verschillende meetinstrumenten de beoordeling van de onderzochte ontwikkelingsdomeinen erg moeilijk. Zowel prospectieve gestandaardiseerde ontwikkelingstesten als retrospectieve screenende ontwikkelingstesten en algemene ziektecoderingen (voor ontwikkelingsachterstand en gedragsproblemen) werden gebruikt, waarbij niet altijd voor de leeftijd gecorrigeerde normaalwaarden beschikbaar waren ter vergelijking.
Concluderend is er op dit moment onvoldoende informatie uit de literatuur beschikbaar over de lange termijneffecten op de neurologische, gedragsmatige en sociaal-emotionele ontwikkeling van kinderen die intra-uterien zijn blootgesteld aan antipsychotica. De beschreven risico’s op de korte en middellange termijn (tot de leeftijd van 5 jaar) lijken vooralsnog echter klein en zouden, met een voorbehoud voor de onzekere schattingen, kunnen meevallen.
Overige relevante literatuur
Behoudens de hier beschreven literatuur, zijn er geen andere (buitenlandse) richtlijnen of beschouwende artikelen, die een uitspraak doen over de lange termijneffecten bij antenataal aan antipsychotica blootgestelde neonaten. Ook het Handboek Psychiatrie en Zwangerschap (Lambregtse-Van den Berg, 2015) geeft geen aanvullende informatie.
Farmacologische overwegingen
Uit de literatuur is geen informatie naar voren gekomen over de relatie tussen de farmacokinetiek, trans-placentaire passage en lange termijneffecten van antipsychotica op de ontwikkeling van het kind.
Waarden en voorkeuren van patiënten
Er is geen literatuur ten aanzien van waarden en voorkeuren van patiënten met betrekking tot de lange termijneffecten op de ontwikkeling van het kind, die een rol spelen bij de besluitvorming rondom het gebruik van antipsychotica tijdens de zwangerschap. Samen met de (aanstaande) moeder die antipsychotica gebruikt en haar partner zullen, bij voorkeur preconceptioneel, de voor-en nadelen van het gebruik van antipsychotica tijdens zwangerschap moeten worden afgewogen, tegen haar ziektebeeld en het ziekteproces, psychosociale factoren, de mogelijkheid van het stoppen dan wel omzetten naar een ander medicament en de veiligheid voor moeder en het (toekomstig) kind. Het uitgangspunt zou moeten zijn het realiseren van maximale psychische stabiliteit van moeder in combinatie met maximale veiligheid voor het kind.
Kosten (middelenbeslag)
Kosteneffectiviteitsstudies zijn niet meegenomen bij de literatuursearch voor deze module. Bij het in stand houden van stabiliteit voor moeder en kind zal er echter naar verwachting, minder aanspraak gemaakt hoeven te worden op (crisis)zorg bij de GGZ en lange termijn (poli)klinische begeleiding/behandeling van het kind.
Aanvaardbaarheid, haalbaarheid en implementatie
Het is van belang om multidisciplinaire zorg voor alle kwetsbare zwangeren, ook die antipsychotica gebruiken, te implementeren in de geboortezorgketen. Hiervoor is expertise en informatie-uitwisseling noodzakelijk. Voorbeelden hiervan zijn POP-poliklinieken of een MDO psychiatrie/kwetsbare zwangere. Op deze manier zullen alle betrokkenen (huisarts, verloskundig zorgverlener, GGZ zorgverlener (psychiater, psycholoog, verpleegkundig specialist, sociaal-psychiatrisch verpleegkundige (SPV), physician assistant (PA)), kraamverzorgster, maatschappelijke werker, medewerkers van jeugdgezondheidszorg (CB/CJG) en kinderarts) tijdig geïnformeerd zijn over de afwegingen voor de individuele zwangere om een antipsychoticum wel of niet te continueren en de mogelijke lange termijneffecten ervan op het kind. De werkgroep verwacht binnen het kader van deze multidisciplinaire zorg geen problemen met de implementatie van deze aanbevelingen.
Idealiter zou je in verband met de mogelijke lange termijn effecten deze kinderen gedurende de schooltijd en adolescentie willen vervolgen, maar daar zijn in de praktijk in veel gevallen niet de financiële of logistieke middelen voor.
Rationale/ balans tussen de argumenten voor en tegen de interventie
Op basis van de momenteel voorhanden zijnde gegevens over de lange termijneffecten van antenataal gebruikte antipsychotica op het kind, geldt dat het deels nog onbekende, maar mogelijk meevallende risico op ontwikkelingsproblemen afgewogen dient te worden tegen de noodzaak van het gebruik tijdens de zwangerschap. Het abrupt stoppen van antipsychotica tijdens de zwangerschap kan leiden tot een ernstige verslechtering van de psychische conditie van moeder, wat onafhankelijk van de medicatie de cognitieve, gedragsmatige en emotionele ontwikkeling van het kind negatief kan beïnvloeden.
Dit laat onverlet dat een maximale inzet van niet-medicamenteuze interventies en de voorkeuren van de (toekomstige) zwangere meegenomen dient te worden, waarbij gestreefd wordt naar een zo laag mogelijke effectieve dosis van het medicament in monotherapie, en hetzelfde medicament tijdens de peri-conceptionele periode, de zwangerschap, de kraamtijd en het eerste jaar postpartum. Aangezien er geen specifieke aanbevelingen te geven zijn ten aanzien van welk antipsychoticum de voorkeur heeft, zal de keuze van het medicament met name afhankelijk zijn van de eventuele risico’s op zwangerschaps-/baringscomplicaties, congenitale afwijkingen, neonatale effecten en de mogelijkheid om borstvoeding te geven.
Onderbouwing
Achtergrond
Bij het afwegen van de voor- en nadelen van het voorschrijven van antipsychotica in de zwangerschap en tijdens lactatie, is naast kennis over de risico’s op korte termijn ook kennis noodzakelijk over de lange termijneffecten op het kind van prenatale blootstelling aan antipsychotica. In deze module wordt specifiek aandacht besteed aan de ontwikkeling van het kind in brede zin (motoriek, cognitie, gedrag en sociaal emotionele ontwikkeling).
Conclusies / Summary of Findings
|
Very low GRADE |
The evidence is very uncertain about the effect of antipsychotic use during pregnancy on BSID-III scores in 2-, 6- and 12-month-old children of women with psychiatric disorders, compared to children of antipsychotic unexposed healthy women.
Bronnen: (Peng, 2013) |
|
Very low GRADE |
The evidence is very uncertain about the effect of antipsychotic use during pregnancy on the INFANIB scores in 6 month-old children of women with psychiatric disorders, compared to children of antipsychotic unexposed healthy women.
Bronnen: (Johnson, 2012) |
|
Very low GRADE |
The evidence is very uncertain about the effect of antipsychotic use during pregnancy on the percentage of negative responses on the motor items on a 14-item questionnaire in 9 months-old children of women with psychiatric disorders, compared to children of antipsychotic unexposed healthy women.
Bronnen: (Hurault-Delarue, 2016) |
|
Very low GRADE |
The evidence is very uncertain about the effect of antipsychotic use during pregnancy on the prevalence of an abnormal Boel test (measuring psychomotor development, including hearing, sight and motor attention) in 7- to 10-months-old children of women with psychiatric disorders, compared to children of antipsychotic unexposed healthy women.
Bronnen: (Mortensen, 2003) |
|
Very low GRADE |
The evidence is very uncertain about the effect of antipsychotic use during pregnancy on the risk of neuromotor deficits in children ≤ 2 years old born to women with psychiatric disorders, compared to children of women not taking antipsychotics.
Bronnen: (Poels, 2018) |
|
Very low GRADE |
The evidence is very uncertain about the effect of antipsychotic use during pregnancy on neurodevelopment disorders and behavioral disorders within the first 5 years of life in children of women with psychiatric disorders, compared to children of healthy women not taking antipsychotics, or children of women with psychiatric diorders who discontinued antipsychotic therapy during pregnancy.
Bronnen: (Petersen, 2016) |
|
- GRADE |
No conclusions could be drawn about the effect of antipsychotic use onthe long-term motor, cognitive, behavioral and social-emotional development in 5 to 18 year-old children of women taking antipsychotics during pregnancy, compared to women not taking antipsychotics. |
Samenvatting literatuur
Description of studies
The 5 articles answering the PICO in the systematic review reported the results of comparative observational studies: 3 were retrospective cohort studies in prescription databases (Mortensen, 2003; Petersen, 2016; Hurault-Delarue, 2016) and 2 were longitudinal cohort studies (Johnson, 2012; Peng, 2013). The study size ranged from 22 to 290 women taking antipsychotics during pregnancy. Three of the studies used a control group of women without psychiatric disorders not taking antipsychotics (Mortensen, 2003; Peng, 2013; Hurault-Delarue, 2016). Petersen (2016) used, next to women who had not received a prescription for an antipsychotic, also a group of women who discontinued antipsychotic therapy during pregnancy. The control group in the Johnson (2012) study consisted of pregnant women with psychiatric disorders not taking antipsychotics.
The definition of exposure varied across the studies with respect to individual drugs and the trimester of pregnancy when the drugs were consumed. It was not possible to determine the effects of individual drugs due to small sample sizes, and therefore, different antipsychotics were grouped in the analyses. Each study used a different outcome measure of long-term neurodevelopment, varying from (standardized) scoring lists (INFANIB, BSID-III, Boel test, a 14-item list for pediatric examination) to a composite neurodevelopmental outcome based on a range of diagnoses identified in a primary care database. Four studies reported some degree of neurodevelopmental delays or deficits after in utero exposure to antipsychotics at different time points during 12 months postpartum (Johnson, 2012; Mortensen, 2003; Peng, 2013; Hurault-Delarue, 2016), and 1 study reported normal developmental outcomes in the first 5 years of life (Petersen, 2016). We found no studies describing relevant long-term outcomes in children aged between 5 and 18 years.
Results
Due to the differences in definitions of outcomes and the composition of comparison groups across the studies, the results are presented per comparison and per outcome for the crucial and important outcome measures, followed by the results of the meta-analysis for the outcome ‘neuromotor deficits’ in children ≤ 2 years old.
Exposed versus healthy unexposed
Long-term motor, cognitive, behavioral and social-emotional development in children of 5 to 18 years old (crucial outcome)
No studies assessed the effect of antipsychotic use in pregnancy on the long-term motor, cognitive, behavioral and social-emotional development in children of 5 to 18 years old, compared to no use of antipsychotics.
Neurodevelopment disorders and behavioral disorders within the first 5 years of life (crucial outcome)
The composite outcome “neurodevelopment disorders and behavioral disorders” in the study by Petersen (2016) included a broad range of codes from a primary healthcare database used to record developmental delay and behavioral problems within the first 5 years of life (Petersen, 2016). After exclusion of children with Down syndrome, the following codes were combined in the definition of this outcome: speech/language therapy; behavioral problems/behavioral disorder (at school); hyperactive/ADHD; tantrums/stammer/excessive blinking; child hyperkinetic syndrome; (infantile) autism; (global) development delay/communication skill development delay; on learning disability register (Petersen 2016).
The unadjusted relative risk ratio (RRR) for the outcome “neurodevelopment disorders and behavioural disorders” within the first 5 years of life was 1.58 (95% confidence interval (CI) 1.04 to 2.40, p=0.03). After controlling for the mothers’ age, obesity, alcohol problems, smoking, illicit drug use, antidepressant treatment and anticonvulsant mood stabilisers use, the adjusted RRR was not statistically significant, 1.22 (95% CI 0.80 to 1.84, p=0.34) (Petersen, 2016).
Exposed versus diseased discontinued
Neurodevelopment disorders and behavioral disorders within the first 5 years of life (crucial outcome)
There were no statistically significant differences between groups for the outcome “neurodevelopment disorders and behavioural disorders” within the first 5 years of life, when women taking antipsychotics were compared with women who discontinued antipsychotic therapy during pregnancy (RRR 0.74 (95% CI 0.45 to 1.23), p=0.25; adjusted RRR 0.83 (95% CI 0.49 to 1.39), p=0.49; Petersen, 2016).
Exposed versus healthy unexposed
Prevalence of an abnormal Boel test (important outcome)
The Boel test, used in Denmark, is a psychomotor development test based on 14 items, including screening tests for hearing, sight, and motor attention (Mortensen, 2003). In the study by Mortensen (2003) the Boel test was considered abnormal, if children failed at one or more of these items. The adjusted odds ratio (OR) for an abnormal Boel test in 7- to 10-months-old children of women redeeming prescriptions for antipsychotics during pregnancy was 4.1 (95% CI 1.3 to 13.0) (Mortensen, 2003).
Mean Bayley Scales of Infant and Toddler Development, third edition (BSID-III) scores (important outcome)
The Bayley-III includes cognitive, language, motor, social-emotional and adaptative behavior domains. The mean scores of the cognitive (90.3 versus 97.8), motor (92.3 versus 97.5), social-emotional (95.7 versus 101.9) and adaptive (93.1 versus 99.3) scales of BSID-III at 2 months follow-up were statistically significantly decreased in children of mothers who took antipsychotics (p < 0.001; Peng, 2013). At 6 months, only the mean scores of the social-emotional (99.4 versus 103.6, p=0.007) and adaptive scales were decreased (97.6 versus 100.7, p=0.01). At 12 months postpartum no statistically significant differences were found (Peng, 2013).
Percentage of ≥ 2 negative responses on a 14-item questionnaire (important outcome)
The 14-item questionnaire in the study by Hurault-Delarue (2016) included items pertaining motor development (such as sitting up unsupported, crawling, walking, stacking objects) as well as mental development (such as ‘reacts to own name’, ‘repeats a syllable’, ‘understands a simple instruction’, ‘associates 2 words’, ‘able to name at least 1 image’) at 9 and 24 months of age (Hurault-Delarue, 2016). In an unadjusted analysis, the percentage of ≥ 2 negative responses on the motor items of the questionnaire at 9 months was statistically significantly higher in children exposed to antipsychotics during gestation (13.9 % (n=9) versus 6.1% (n=1876), p=0.02; Hurault-Delarue, 2016).
Exposed versus diseased unexposed
INFANIB scores (important outcome)
INFANIB is a 20-item battery with five factors: spasticity, vestibular function, head and trunk, French angles and legs. It consists of an assessment of posture, extremity and axial tone, primitive reflexes and postural reaction. At 6-months age, transiently abnormal INFANIB scores were found in 75.5% (n=15) of children exposed to antipsychotics during gestation, and abnormal scores were found in 9.5% (n=2) of the exposed children (χ2 test p<0.01; Johnson, 2012).
Meta-analysis: neuromotor deficits in children ≤ 2 years old (important outcome)
The meta-analysis by Poels (2018) used data on the continuous outcomes (BSID-III, INFANIB and the scores derived from the 14-item paediatric questionnaire) from 3 studies (Johnson, 2012; Peng, 2013; Hurault-Delarue, 2016) for 2, 6, 12 and 24 months of follow-up.
The pooled relative risk (RR) of neuromotor deficits estimated with a fixed effect model was 1.97 (95% CI 1.47 to 2.62; p < 0.001), indicating a 97% increase in risk of neuromotor deficits in children of women taking antipsychotics during pregnancy compared to children of women not taking antipsychotics (Figure 1; Poels, 2018).
Figure 1 Risk of neuromotor deficits in children of women taking antipsychotics during pregnancy for follow-up assessments at 2, 6, 12 and 24 months (Poels, 2018)
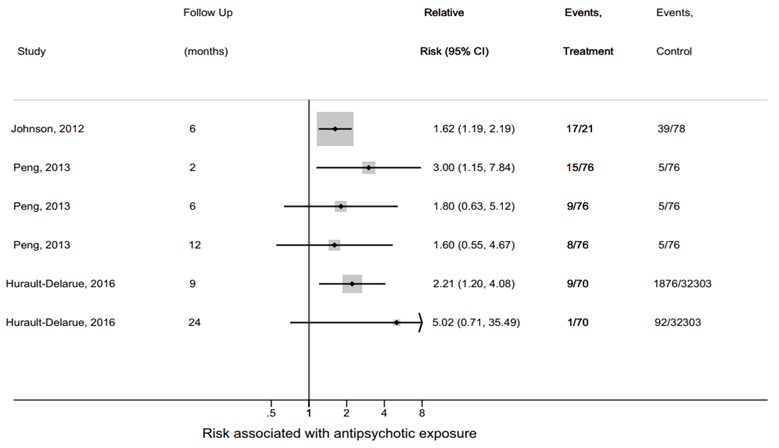
Figure 2 Risk of neuromotor deficits in children of women taking antipsychotics during pregnancy at 6 months follow-up (Poels, 2018)
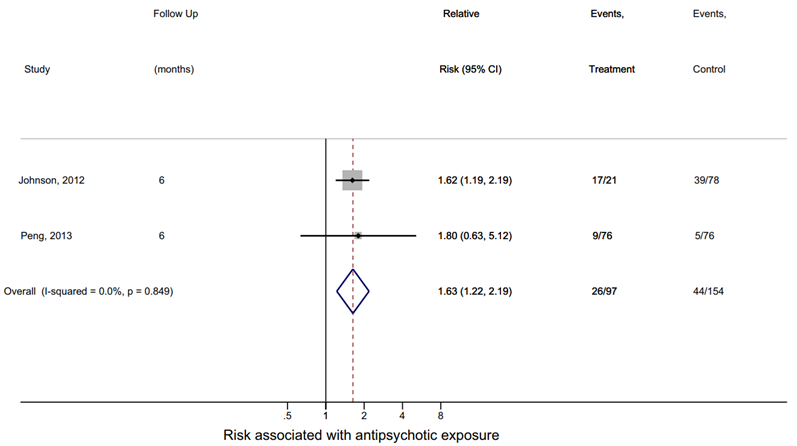
The relative risk of neuromotor deficits at 6 months estimated from 2 studies was 1.63 (95% CI 1.22 to 2.19, p = 0.001), suggesting a 63% increase in risk of neuromotor deficits in children of women taking antipsychotics during pregnancy compared to children of women not taking antipsychotics (Figure 2; Poels, 2018).
In an additional meta-regression analysis investigating the transient character of motor deficits, the direction of the regression coefficient showed that the impact of antipsychotic therapy during pregnancy on motor development decreased over time, but it was not statistically significant (-0.03 (95% CI -1.26 to 1.20); p=0.80).
Level of evidence of the literature
Most of the studies used healthy women as the unexposed group, which does not allow to account for the effect of underlying psychiatric conditions on the outcomes in children. Three of five included studies were performed using prescription data, which could lead to misclassification of the exposure.
The assessment of the quality of evidence for the crucial outcome ‘long-term motor, cognitive, behavioral and social-emotional development in children of 5 to 18 years old’ was not possible due to the absence of relevant literature.
We started at a low level of evidence for observational studies. The level of the quality of evidence for the crucial outcome measure ‘neurodevelopment disorders and behavioral disorders within the first 5 years of life’ was downgraded to very low, because of risk of bias (methodological study limitations) and indirectness (limited applicability, due to the outcome definitions and the choice of control group).
The quality of evidence for the important outcome measures ‘prevalence of an abnormal Boel test’, ‘mean BSID-III scores’, ‘percentage of ≥ 2 negative responses on a 14-item questionnaire’ and ‘INFANIB scores’ was downgraded to very low, due to risk of bias (methodological limitations of the studies) and serious imprecision (one study per outcome, very few patients).
The level of the quality of evidence for the important outcome measure ‘neuromotor deficits in children ≤ 2 years old’ was downgraded to very low, because of the risk of bias (study limitations), indirectness (limited applicability due to the choice of control group, the differences in assessment methods and the length of follow-up), and imprecision (a low number of patients).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the effect of antipsychotic use in pregnant women with psychiatric disorders on the long-term motor, cognitive, behavioural and social-emotional development of their children, compared to healthy women, women with psychiatric disorders not taking antipsychotics, and women who discontinued antipsychotics during pregnancy?
P: patients pregnant women with psychiatric disorders;
I: intervention use of antipsychotics during pregnancy;
C: control no use of antipsychotics during pregnancy or discontinuation of antipsychotics during pregnancy;
O: outcome long-term motor, cognitive, behavioral and social-emotional development in children of 5 to 18 years old; neurodevelopment disorders and behavioral disorders within the first 5 years of life; effects on psychomotor and socio-emotional development in children ≤ 2 years old.
Relevant outcome measures
The intention was to describe the long-term motor, cognitive, behavioral and social-emotional development in children after the age of 2 years, as the development under this age generally shows large variation. Due to the limited amount of evidence in the literature, however, studies before the age of 2 years (with a minimum age of 2 months) were also included.
The guideline development group considered the long-term motor, cognitive, behavioral and social-emotional development in children of 5 to 18 years old, and neurodevelopment disorders and behavioral disorders within the first 5 years of life as crucial outcome measures for decision making; and effects on psychomotor and socio-emotional development in children ≤ 2 years old as important outcome measures for decision making.
The minimal (clinically) important difference was defined according to the default recommendations of the international GRADE working group, as follows: for dichotomous outcomes as a relative risk reduction or an increase of 25% or more, and for continuous outcomes as a difference of half (0.5) a standard deviation.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from the 1st of January 2000 until the 11th of February 2019 for systematic reviews (and meta-analyses) and comparative observational studies. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 224 hits. Studies were selected based on the following criteria: systematic reviews (and meta-analyses) and comparative observational (case-control and cohort) studies in pregnant women with psychiatric disorders, comparing the effect of antipsychotics use with no use or discontinuation of antipsychotics during pregnancy on relevant outcome measures. Twenty-four studies were initially selected based on the title and abstract screening. After reading the full text, 18 studies were excluded (see the table with reasons for exclusion under the tab Methods), and 6 studies (of which 1 was a systematic review and meta-analysis) were included. Additionally, 4 potentially relevant studies, identified from the reference list of the included systematic review were assessed for eligibility, and were excluded (see the table with reasons for exclusion under the tab Methods).
Results
There were 6 studies included in the literature analysis: one was a systematic review and meta-analysis and 5 were comparative observational studies. These 5 studies were also described in the systematic review (Poels, 2018). The authors of the systematic review searched Embase, MEDLINE, Web of Science, PsychINFO, Cochrane, and Google Scholar databases until the 8th of June, 2017 for preclinical animal studies, case reports and comparative prospective clinical studies, investigating the effect of antipsychotic use in pregnancy on long-term neurodevelopment in the offspring. In total, the results of 11 preclinical studies, 26 case reports and 10 clinical studies (of which 5 answered the PICO and have been already identified by the systematic search) were included in the systematic review (Poels, 2018). The population of clinical studies varied from 14 to 2141 women exposed to antipsychotics during pregnancy, which were compared to either women without psychiatric disorders not taking antipsychotics (7 studies), and/or women with psychiatric disorders not taking antipsychotics (3 studies), and/or women with psychiatric disorders who discontinued the use of antipsychotics during pregnancy (1 study). One study compared clozapine in pregnancy against a few other antipsychotics as a group (risperidone, sulpiride, olanzapine, quetiapine) (Shao, 2015). In total, data on various long-term neurodevelopmental outcomes were available for 2934 children in 9 cohort studies (the study by Shao (2015) used the same population as the study by Peng (2013). The mean follow-up duration across the studies was between 14 days and 5 years. The outcome of the meta-analysis was defined as neuromotor deficits in the long term (beyond the new-born period) (Poels, 2018). Most studies in the review used standardized objective outcome measurements, but some studies relied solely on invalidated questionnaires or interviews. Results of only 3 studies could be used in the meta-analysis, and outcome measurements were pooled at different follow-up points (2, 6, 12 and 24 months postpartum; n=176), and separately for 6 months follow-up (n=97) (Johnson, 2012; Peng, 2013; Hurault-Delarue, 2016).
Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Hurault‐Delarue, C., Damase‐Michel, C., Finotto, L., Guitard, C., Vayssière, C., Montastruc, J. L.,... & Lacroix, I. (2016). Psychomotor developmental effects of prenatal exposure to psychotropic drugs: a study in EFEMERIS database. Fundamental & clinical pharmacology, 30(5), 476-482.
- Johnson, K. C., LaPrairie, J. L., Brennan, P. A., Stowe, Z. N., & Newport, D. J. (2012). Prenatal antipsychotic exposure and neuromotor performance during infancy. Archives of general psychiatry, 69(8), 787-794.
- Lambregtse-Van den Berg, M., Van Kamp, I., & Wennink, H. (Eds.). (2015). Handboek psychiatrie en zwangerschap. De Tijdstroom.
- Mortensen, J. T., Olsen, J., Larsen, H., Bendsen, J., Obel, C., & Sørensen, H. T. (2003). Psychomotor development in children exposed in utero to benzodiazepines, antidepressants, neuroleptics, and anti-epileptics. European journal of epidemiology, 18(8), 769-771.
- Peng, M., Gao, K., Ding, Y., Ou, J., Calabrese, J. R., Wu, R., & Zhao, J. (2013). Effects of prenatal exposure to atypical antipsychotics on postnatal development and growth of infants: a case-controlled, prospective study. Psychopharmacology, 228(4), 577-584.
- Petersen, I., McCrea, R. L., Sammon, C. J., Osborn, D. P., Evans, S. J., Cowen, P. J.,... & Nazareth, I. (2016). Risks and benefits of psychotropic medication in pregnancy: cohort studies based on UK electronic primary care health records. Health technology assessment (Winchester, England), 20(23), 1-176.
- Poels, E. M., Schrijver, L., Kamperman, A. M., Hillegers, M. H., Hoogendijk, W. J., Kushner, S. A., & Roza, S. J. (2018). Long-term neurodevelopmental consequences of intrauterine exposure to lithium and antipsychotics: a systematic review and meta-analysis. European child & adolescent psychiatry, 27(9), 1209-1230.
Evidence tabellen
Evidence table for systematic reviews of RCTs and observational studies (intervention studies)
Research question: What is the effect of antipsychotic use during pregnancy on long-term cognitive, behavioural, social and emotional development in children of women with psychiatric disorders, compared to women not taking antipsychotics during pregnancy?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Poels 2018
individual study characteristics deduced from Poels, 2018
|
SR and meta-analysis of cohort studies
Literature search up to June, 2017
A: Slone, 1977 B: Platt, 1989 C: Stika, 1990 D: Auerbach, 1992 E: Mortensen, 2003 F: Johnson, 2012 G: Peng, 2013 H: Shao, 2015 I: Hurault-Delarue, 2016 J: Petersen, 2016
Study design: A: prospective cohort B: prospective cohort C: cohort D: cohort E: retrospective cohort (database study) F: prospective cohort G: prospective cohort H: post-hoc analysis of a case-control study I: retrospective cohort (database study) J: retrospective cohort (database study)
No full text available for: A, B
|
Inclusion criteria SR: studies addressing long-term neurodevelopment of offspring exposed to lithium or antipsychotics during gestation; experimental preclinical and clinical investigations, and case reports.
Exclusion criteria SR: outcome not neurodevelopment; no lithium or antipsychotic exposure; language other than English; reviews, guidelines, conference abstracts, book chapters.
20 clinical studies included (of which 3 in meta-analysis)
N, mean age (exposed/unexposed) A: 2141/26217, N/A B: 192 ill exposed/116 ill unexposeda, N/A C: 66/66, N/A D: 14 (7 monotherapie AP) ill exposed (28.4 yrs)/18 ill unexposed (28.4 yrs)/26 healthy unexposed (27.6 yrs)c E: 63/755, N/A F: 22 exposed (34.1)/85 unexposed (32.4 yrs)/ 202 ADD exposed (34.1 yrs) G: 76 (30.5 yrs)/76 (29.4 yrs) H: 63 (n=33 clozapine, 31.5 yrs versus. n=30 other AP, 29.8 yrs) I: all exposed n=493 (32 yrs)/ exposed to AP n=70, NA/ unexposed n=32303 (30.3 yrs) J: 290 exposed (32 yrs)/492 discontinued (30 yrs)a/201966 unexposed (30 yrs)
Indication: A: N/A B: psychotic neurotic disorders C: N/A D: severe mental illness E: N/A F: anxiety and mood disorders G: schizophrenia H: schizophrenia I: N/A J: severe mental illness |
Antipsychotic use during pregnancy (drug name, daily dose)
A: phenothiazine AP, N/A B: antipsychotic neuroleptics, N/A C: chlorpromazine, 10–25 mg; chlorprotixene, 5 mg D: phenothiazine AP, varied E: neuroleptics, N/A F: AP combined, N/A G: atypical AP (clozapine, 178 mg (n=33), risperidone, 2mg (n=16), sulpride, 461 mg (n=13), olanzapine 8 mg (n=8), quetiapine, 550 mg (n=6)) H: clozapine, 178 mg (n=33), other AP (n=30), risperidone, 2mg (n=16), olanzapine 8 mg (n=8), quetiapine, 550 mg (n=6) I: Neuroleptics, N/A J: AP, N/A |
No antipsychotic (AP) use during pregnancy
A: no AP use B: (diseased + no AP use) C: no AP use D: (diseased + no AP use) and (healthy + no AP use) E: no AP use F: (diseased + no AP use) G: (healthy + no AP use) H: N/A I: no AP use J: (no AP use 24 months before and during pregnancy) and (diseased + discontinued)
|
End-point of follow-up:
A: 4 yrs B: 7 yrs C: 10 yrs D: 14 day s (!) E: 7-10 months F: 6 months G: 12 months H: 12 months I: 24 months J: 9 months-5 yrs
|
Long-term neurodevelopment defined as neurodevelopment beyond the new-born period; outcome of the meta-analysis: long-term neuromotor deficits
A: IQ scores B: motor development in the new-born period, at 8 months, 4 and 7 yrs C: questionnaire to assess behavioural defects, represented as ”mean behavioural score”, filled in by teachers D: NBASd on day 3 and 14 E: Boel test (psychomotor development test, including 14 items, screening for hearing, sight, motor attention) F: INFANIB at 6 months, visual habituation task G: BSID-III at 2, 6, 12 months standardized to a mean of 100 with an SD of 15 (range 50-150); delayed development defined as below 85 standard scores H: BSID at 2, 6, 12 months I: Pediatric examination (14 items on psychomotor development on a binary scale; “psychomotor development abnormalities”=at least 2 negative responses) J: NDBD reported in health records
Long-term neurodevelopment A: N/A B: N/A C: N/A (no numbers provided) D: NBAS day 3: F(2, 46) = 4.16, p = 0.02; NBAS day 14: F(2, 54) = 7.49, p <0.001 E: ORadj 4.1 (95% CI 1.3–13.0) F: INFANIB score (p<0.01): -normal n=4 (19%) -transiently abnormal n=15 (71.5%) -abnormal n=2 (9.5%) G: mean scores (±SD) at 2 months p < 0.001 (exposed/unexposed) -cognitive: 90.3±6.9 / 97.8 ±7.7 -motor: 92.3±7.9 / 97.5 ±7.7 -social-emotional: 95.7 ±9.4/101.9±8.7 -adaptive or behavioural: 93.1±8.6/ 99.3±6.3 at 6 months -social-emotional: 99.4±9.9 / 103.4±8.7, p=0.007 -adaptive or behavioural: 97.6±8.4 / 100.7±6.0, p=0.01 at 12 months no stat. sign. differences
H: mean scores (±SD) at 2 months, p < 0.001 (exposed/unexposed) -adaptive: 89.1±8.9 / 96.3±7.6 at 6 months, p< 0.01: -adaptive: 94.8±9.9) / 100.5±6.8 I: % of ≥2 negative items on the questionnaire at 9 months, p=0.02 (exposed/unexposed) -motor: 9 (13.9 %) / 1876 (6.1%) J: exposed versus unexposed: RRR 1.58 (95% CI 1.04 to 2.40), p=0.03 RRR adjustedb 1.22 (95% CI 0.80 to 1.84), p=0.34 exposed versus discontinued RRR 0.74 (95% CI 0.45 to 1.23), p=0.25 RRR adjustedb 0.83 (95% CI 0.49 to 1.39), p=0.49
Meta-analysis Included only F, G, I (all follow-up points) Neuromotor deficits after antipsychotic exposure in pregnancy: F: RR 1.62 (95%CI 1.19-2.19) (6 months) G: RR 3.00 (95%CI 1.15-7.84) (2 months) RR 1.80 (95%CI 0.63-5.12) (6 months) RR 1.60 (95%CI 0.55-4.67) (12 months) I: RR 2.21 (95%CI 1.20-4.08) (9 months) RR 5.02 (95%CI 0.71-35.49) (24 months)
Pooled RR (fixed effects model): RR 1.97 (95%CI 1.47 - 2.62) p < 0.001 Heterogeneity (I2): 0%, p=0.622. Included only F, G (follow-up at 6 months) Neuromotor deficits at 6 months after antipsychotic exposure in pregnancy: F: RR 1.62 (95%CI 1.19-2.19) G: RR 1.80 (95%CI 0.63, 5.12)
Pooled RR (fixed effects model): 1.63 (95% CI 1.22 - 2.19) p = 0.001
Heterogeneity (I2): 0%, p = 0.849 |
Author’s conclusions (SR): -there is a 63%-increased risk of neuromotor deficits in 6-month-old infants exposed to antipsychotics in utero; -this risk is likely transient (not stat. sig.) -“although several studies have reported a transient neurodevelopmental delay following intrauterine exposure to antipsychotics, the current lack of high quality clinical investigations substantially limits the conclusiveness of the available evidence”
*studies included in the calculation of the pooled estimate reported different outcomes and follow-up times *often in the description of the control group information on women’s (mental) health status was missing
A: no difference in IQ scores B: new-born: increased C: no difference in behavioral score (questionnaire not validated) D: reduced autonomic stability and higher abstinence score E: high prevalence of abnormal Boel test in women redeeming prescriptions for antipsychotics during pregnanacy F: lower INFANIB scores in 6-month-old infants after prenatal exposure to antipsychotics; no stat. sig. effect on number of trials to habituate or average looking time during habituation G: 2 months: lower on cognitive, motor, social-emotional and adaptive behavior scale, 6 months: lower on social-emotional and adaptive behavior scale, 12 months: no difference; “fetal exposure to atypical antipsychotics may cause short-term delayed development in cognitive, motor, social–emotional, and adaptive behavior, but not in language, body weight, or height” H: 2 and 6 months: lower adaptive behavior scores for clozapine-exposed children compared to other AP, I: 9 months: higher prevalence of motor deficits, no difference in mental development (“in 6 of the 9 children exposed to neuroleptics and presenting a psychomotor development abnormality, the mothers were exposed to chlorpromazine”); 24 months: no difference; J: No difference in relative risk of NDBD after adjustment
Level of evidence: GRADE
VERY LOW* antipsychotics versus no antipsychotics long-term neuromotor deficits
* Downgraded by 3 levels, because of serious risk of bias (limitations of study design), serious indirectness (choice of comparison group), and serious imprecision (small sample size) |
a Control group of women with a comparable indication, but no medication use or discontinued use during pregnancy.
b The adjusted models include adjustments for age, obesity, alcohol problems, smoking, illicit drug use, antidepressant treatment and anticonvulsant mood stabilisers.
c Only 7 of 14 patients used antipsychotics as monotherapy (+1 combined with lithium, +3 combined met benzodiazepines, +3 benzodiazepines only).
d The NBAS consists of two 6-point scales of initial and predominant states, twenty-seven 9-point behavioral scales, and 18 reflex items. The state of the infant, ranging from sleeping to alert to crying, plays a crucial role in both the administration and scoring of the test. The behavior items measure motor reactivity, ability to habituate to stimulation during sleep, ability to orient to auditory and visual stimulation, and ability to cope with other kinds of stimulation. The test measures both neurophysiological functioning and interaction with the caregiver. (Auerbach, 1992).
BSID-III, Bayley Scale of Infant and Toddler Development 3rd edition. INFANIB, infant neurological international battery. NBAS, Neonatal Brazelton Assessment Scale. NDBD, neurodevelopment disorders and behavioural disorders. AP, antipsychotics. ADD, antidepressant drugs. OR, odds ratio. RR, risk ratio. SD, standad deviation.
Table of quality assessment for systematic reviews of RCT’s and observational studies
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Poels, 2018 |
yes |
yes |
yes |
yes |
no |
yes |
unclear |
unclear |
no |
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table et cetera).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (for example square, I2)?
- An assessment of publication bias should include a combination of graphical aids (for example funnel plot, other available tests) and/or statistical tests (for example Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Risk of bias table for intervention studies (observational: non-randomized clinical trials, cohort and case-control studies)
Research question: What is the effect of antipsychotic use during pregnancy on long-term cognitive, behavioural, social and emotional development in children of women with psychiatric disorders, compared to women not taking antipsychotics during pregnancy?
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Mortensen, 2003 |
likely |
unlikely |
likely |
likely |
|
Johnson, 2012 |
likely |
unlikely |
unlikely |
unlikely |
|
Peng, 2013 |
likely |
unlikely |
unlikely |
likely |
|
Hurault-Delarue, 2016 |
likely |
unlikely |
likely |
likely |
|
Petersen, 2016 |
likely |
unlikely |
likely |
likely |
- Failure to develop and apply appropriate eligibility criteria: a) case-control study: under- or over-matching in case-control studies; b) cohort study: selection of exposed and unexposed from different populations.
- Bias is likely if: the percentage of patients lost to follow-up is large; or differs between treatment groups; or the reasons for loss to follow-up differ between treatment groups; or length of follow-up differs between treatment groups or is too short. The risk of bias is unclear if: the number of patients lost to follow-up; or the reasons why, are not reported.
- Flawed measurement, or differences in measurement of outcome in treatment and control group; bias may also result from a lack of blinding of those assessing outcomes (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Failure to adequately measure all known prognostic factors and/or failure to adequately adjust for these factors in multivariate statistical analysis.
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Gentile, 2014 |
review, geen SR, voldoet niet aan de PRISMA checklist |
|
Tosato, 2017 |
review, geen SR, voldoet niet aan PRISMA checklist |
|
Gentile, 2004 |
review, geen SR, voldoet niet aan de PRISMA checklist |
|
Galbally, 2014 |
review, geen SR, voldoet niet aan PRISMA checklist |
|
Haskey, 2017 |
SR, alleen 3 studies, inclusief de studie door Shao; geen meta-analyse |
|
Shao, 2015 |
voldoet niet aan de pico: clozapine versus. risperidone, olanzapine of quetiapine (als groep); gebruikt dezelfde populatie als Peng, 2013 (al geïncludeerd in de literatuuranalyse |
|
Gentile, 2017 |
geen SR, voldoet niet aan de PRISMA checklist |
|
Gentile, 2010 |
narrative review |
|
Jain, 2005 |
narrative review |
|
Rzewuska, 2009 |
narrative review |
|
Eberhard-Gran, 2005 |
narrative review |
|
Habermann, 2013 |
voldoet niet aan de pico: uitkomst teratogene effecten |
|
Einarson, 2005 |
narrative review |
|
Wurtz, 2017 |
voldoet niet aan de pico: uitkomst aantal huisartsenbezoeken |
|
Boden, 2012 |
voldoet niet aan de pico: uitkomst geen langtermijn effecten |
|
Wichman, 2009 |
retrospective chart review |
|
McCauley, 2014 |
case series |
|
Santucci, 2017 |
voldoet niet aan de pico: antipsychotica samen met antiepileptica en ander middelen in 1 groep, omdat polyfarmacie in meerderheid van pt (65%) |
|
Extra artikelen uit de SR door Poels et al., 2018: |
|
|
Aurbach, 1992 |
voldoet niet volledig aan de pico: follow-up 14 dagen, gebruik antipsychotica samen met benzodiazepinen (in een deel van de patiënten) |
|
Stika, 1990 |
uitkomst (means of behavioral score) niet gestandaardiseerd (vragenlijst), selectie van de controle groep onduidelijk beschreven, twee groepen patiënten (antipsychotica en benzodiazepinen, onduidelijk of ze overlappen) |
|
Slone, 1977 |
het risico op bias kan niet worden geschat, geen full text |
|
Platt, 1989 |
het risico op bias kan niet worden geschat, geen full text |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 23-07-2021
Bij het opstellen van de modules heeft de werkgroep een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden. De geldigheid van de richtlijnmodules komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Antipsychotica en langetermijneffecten bij het kind |
NVOG |
2021 |
2026 |
Eens in vijf jaar |
NVOG |
Nieuwe literatuur |
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
De ontwikkeling van deze richtlijn werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodules.
De richtlijn is ontwikkeld in samenwerking met:
- Patiëntenfederatie Nederland
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor zwangere patiënten die ‘niet-SSRI’ antidepressiva en/of antipsychotica gebruiken. De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Dr. A. Coumans, gynaecoloog-perinatoloog, Maastricht UMC+, Maastricht, NVOG
- Dr. H.H. Bijma, gynaecoloog, Erasmus Medisch Centrum, Rotterdam, NVOG
- Drs. R.C. Dullemond, gynaecoloog, Jeroen Bosch Ziekenhuis, Den Bosch, NVOG
- Drs. S. Meijer, gynaecoloog, Gelre Ziekenhuis, Apeldoorn, NVOG
- Dr. M.G. van Pampus, gynaecoloog, OLVG, Amsterdam, NVOG
- Drs. M.E.N. van den Heuvel, neonatoloog, OLVG Amsterdam, NVK
- Drs. E.G.J. Rijntjes-Jacobs, neonatoloog, Leids Universitair Medisch Centrum, Leiden, NVK
- Dr. K.M. Burgerhout, psychiater, Amphia Ziekenhuis, Breda, NVvP
- Dr. E.M. Knijff, psychiater, Erasmus Medisch Centrum, Rotterdam, NVvP
Meelezers
- Dr. A.J. Risselada, klinisch farmacoloog, Wilhelmina Ziekenhuis Assen
Met ondersteuning van
- Dr. E. van Dorp-Baranova, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. M. Moret-Hartman, senior-adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- N. Verheijen, senior-adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- M. Wessels, literatuurspecialist, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Dr. A. Coumans |
gynaecoloog-perinatoloog Maastricht UMC+ |
geen |
geen |
geen |
|
Dr. H. H. Bijma |
Gynaecoloog, Erasmus MC, afdeling verloskunde en gynaecologie, subafdeling verloskunde en prenatale geneeskunde |
lid werkgroep wetenschap LKPZ, onbetaald |
geen |
geen |
|
Drs. S. Meijer |
gynaecoloog Gelre Ziekenhuis, Apeldoorn |
geen |
geen |
geen |
|
Drs. R. C. Dullemond |
gynaecoloog- perinatoloog, Jeroen Bosch Ziekenhuis |
LKPZ bestuur - voorzitter, onbetaald mind 2 care - raad van toezicht, onbetaald dagelijks bestuur @verlosdenbosch (integrale geboortezorg organisatie) als gynaecoloog uit het JBZ, onbetaald danwel deels in werktijd |
geen |
geen |
|
Drs. E. G. J. Rijntjes-Jacobs |
kinderarts-neonatoloog, afdeling neonatologie, Leids Universitair Medisch Centrum |
LKPZ bestuur – secretaris, onbetaald |
geen |
geen |
|
Dr. M. G. van Pampus |
Gynaecoloog, OLVG Amsterdam |
onbetaalde nevenfuncties |
geen |
geen |
|
Dr. E. M. Knijff |
Psychiater, Erasmus MC polikliniek psychiatrie & zwangerschap medisch coördinator polikliniek Erasmus MC |
geen |
geen |
geen |
|
Drs. M. E. N. van den Heuvel |
kinderarts-neonatoloog, OLVG Amsterdam |
geen |
geen |
geen |
|
Dr. K. Burgerhout |
Psychiater, Reinier van Arkel, POP-poli |
geen |
geen |
geen |
Inbreng patiëntenperspectief
Er is een aantal acties uitgevoerd om het patiëntperspectief mee te nemen bij het ontwikkelen van deze richtlijn. Allereerst is contact gezocht met het MIND Platform voor afvaardiging van een patiëntvertegenwoordiger in de werkgroep. Zij hebben ons in contact gebracht met de Stichting Me Mam. Het bleek niet mogelijk een patiëntvertegenwoordiger voor de werkgroep te vinden. Daarna is een focusgroepbijeenkomst voor patiënten georganiseerd, maar deze is geannuleerd vanwege onvoldoende aanmeldingen. Tot slot is een schriftelijke enquête voor patiënten in samenwerking met de Patiëntenfederatie Nederland opgesteld en uitgezet. Dit heeft helaas nauwelijks reactie opgeleverd, de enquête is door twee patiënten ingevuld. Voor de ontwikkeling van het product voor patiënten (informatie op de website www.Thuisarts.nl) is een ervaringsdeskundige van de patiëntenvereniging ‘Plusminus-leven met bipolariteit’ afgevaardigd. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland en het MIND Platform.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijnmodules en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden in de bijlagen.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor vrouwen die antipsychotica of niet-SSRI antidepressiva tijdens zwangerschap en lactatie gebruiken. Tevens zijn er knelpunten aangedragen door IGJ, NHG, V&VN, Zorginstituut Nederland, Lareb, KNOV, NVvP, NVOG en NVK via een Invitational conference. Een verslag hiervan is opgenomen in de bijlagen. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module 'Organisatie van zorg'.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, Glasziou P, Jaeschke R, Vist GE, Williams JW Jr, Kunz R, Craig J, Montori VM, Bossuyt P, Guyatt GH; GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008 May 17;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139.
Schünemann, A Holger J (corrected to Schünemann, Holger J). PubMed PMID: 18483053; PubMed Central PMCID: PMC2386626. BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139. Schünemann, A Holger J [corrected to Schünemann, Holger J]
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
