Preoperatieve evaluatie bij het rAAA
Uitgangsvraag
Hoe moet het geruptureerd AAA worden behandeld?
Deze uitgangsvraag omvat de volgende deelvragen:
- Waaruit bestaat de preoperatieve diagnostiek?
- Waaruit bestaat het preoperatieve management?
- Wat is de behandelmethode van voorkeur?
- Speelt de leeftijd van de patiënt een rol bij de keuze voor behandelmethode?
Aanbeveling
Pas bij een patiënt met een rAAA, die helder en alert is, permissive hypotension toe, door vochttoediening te beperken.
(ESVS 2019 - Aanbeveling 66)
Maak bij een hemodynamisch stabiele patiënt met een verdenking op rAAA zo spoedig mogelijk een CT angiografie van de thoracoabdominale aorta tot en met de liezen.
(ESVS 2019 - Aanbeveling 63)
Overweeg bij een hemodynamisch instabiele patiënt met een verdenking op rAAA het maken van een CT angiografie van de thoracoabdominale aorta tot en met de liezen.
(ESVS 2019 - Aanbeveling 64)
Overweeg bij het symptomatisch, niet-geruptureerde AAA een uitgestelde spoedbehandeling, idealiter onder omstandigheden zoals bij een electieve AAA ingreep.
(ESVS 2019 - Aanbeveling 65)
Overweeg het gebruik van een aorta occlusieballon bij een hemodynamisch instabiele patiënt met een rAAA, zowel bij open als bij endovasculaire behandeling.
(ESVS 2019 - Aanbeveling 68)
Behandel een patiënt met een rAAA, die daarvoor anatomisch geschikt isendovasculair.
(ESVS 2019 - Aanbeveling 74)
Verricht endovasculaire behandeling van het rAAA bij voorkeur onder lokale anesthesie.
(ESVS 2019 - Aanbeveling 67)
Geef bij endovasculaire behandeling van het rAAA bij alle patiënten die daarvoor anatomisch in aanmerking komen de voorkeur aan een bifurcatie endoprothese boven een aorta-uniiliacale endoprothese.
(ESVS 2019 - Aanbeveling 69)
Overwegingen
Deelvraag 1. Wat is de preoperatieve diagnostiek?
Bij patiënten met verdenking op een rAAA is snelle en adequate diagnostiek van vitaal belang. Echografie is voor het aantonen of uitsluiten van een AAA accuraat, maar is ongeschikt voor het aantonen of uitsluiten van een ruptuur. Ook is echografie onvoldoende voor de planning van een endovasculaire behandeling. Daarom is CT angiografie (CTA) de hoeksteen van de diagnostiek. Een CTA, vanaf de aortaboog tot aan de liezen, moet dus bij alle hemodynamisch stabiele en zelfs indien mogelijk bij instabiele patiënten zo spoedig mogelijk worden gemaakt.
Deelvraag 2. Waaruit bestaat het preoperatieve management?
Streven naar een normale bloeddruk middels intraveneuze vochttoediening kan leiden tot een verminderde stolling en dus tot meer bloedverlies, in het geval van een rAAA. Alhoewel er geen gerandomiseerd onderzoek bestaat, is er ruime ervaring uit cohortstudies met het beperken van vochttoediening om zo de stolling op peil te houden. Bij patiënten met verdenking rAAA moet daarom, indien de patiënt aanspreekbaar is, een beleid worden gevoerd waarbij intraveneuze vochttoediening zoveel mogelijk wordt beperkt, de zgn. ‘permissive hypotension’. De systolische streeftensie bij deze ‘permissive hypotension’ is 70-90 mmHg, zolang de patiënt aanspreekbaar is. Indien toch vocht moet worden toegediend, dan verdient het aanbeveling om bloed en bloedproducten te gebruiken, met een verhouding tussen plasma en rode bloedcellen van circa 1:1.
Uit diverse gepubliceerde observationele series blijkt dat acute operatiecondities minder gunstig zijn en een hogere kans op complicaties met zich meebrengen dan operaties onder electieve condities (Cambria, 1994; de Martino, 2010; Haug, 2004; Tambyraja, 2004; Ten Bosch, 2016). Een symptomatisch, maar niet geruptureerd, AAA wordt daarom bij voorkeur uitgesteld behandeld, zodat dit onder (semi)electieve omstandigheden kan gebeuren.
Deelvraag 3. Welke behandelmethode verdient de voorkeur?
Er is wellicht geen klinisch relevant verschil in mortaliteit op de middellange termijn (tot 3 jaar na behandeling) wanneer endovasculaire en open behandeling van een rAAA met elkaar vergeleken worden. Ook is er wellicht geen klinisch relevant verschil in mortaliteit gerelateerd aan de behandeling van het rAAA. De algehele bewijskracht ten aanzien van de cruciale uitkomstmaat mortaliteit is laag. Dit betekent dat de werkelijke sterfte substantieel anders kan zijn dan geschat op basis van de studies.
Eén studie, met een lage bewijskracht, laat zien dat er na EVAR bij ruim tweemaal zoveel patiënten re-interventies moesten worden uitgevoerd (21% van de patiënten) vergeleken met de open behandeling (9% van de patiënten). Er is dus wellicht een verschil in het aantal patiënten dat vrij blijft van re-interventie na EVAR of open behandeling. Op basis van de beschikbare data uit de RCT’s kunnen er geen uitspraken worden gedaan over verschillen in morbiditeit/complicaties, kwaliteit van leven of kosteneffectiviteit.
Wel toont een recente meta-analyse van niet-gerandomiseerde studies bij hemodynamisch instabiele patiënten met een rAAA een lagere mortaliteit na EVAR aan in vergelijking met open behandeling. Bovendien zijn er uit diverse niet-gerandomiseerde series aanwijzingen dat niet-fatale complicaties minder vaak voorkomen bij endovasculair behandelde patiënten en dat ze gemiddeld korter op de intensive care en in het ziekenhuis liggen, vergeleken met de open behandeling (ESVS-richtlijn, 2019).
Patiënten die daarvoor anatomisch geschikt zijn moeten daarom bij voorkeur endovasculair behandeld worden, zo mogelijk percutaan. Bifurcatie endoprothesen hebben daarbij de voorkeur boven aorta-uniiliacale endoprothesen. Zowel bij open, als bij een endovasculaire behandeling moet de mogelijkheid van ballon occlusie van de aorta beschikbaar zijn.
Deelvraag 4. Speelt de leeftijd van de patiënt een rol bij de keuze voor behandelmethode?
Er zijn diverse scoringssystemen ontworpen om patiënten te kunnen selecteren die weinig kans hebben om baat te hebben bij operatieve behandeling en waarbij dus een palliatief beleid zou kunnen worden gevoerd. Uit diverse studies is geen van deze systemen voldoende accuraat gebleken. Ook de leeftijd van de patiënt als criterium is niet een goede graadmeter gebleken om een patiënt met een rAAA uit te sluiten van chirurgische behandeling. Op basis van individuele karakteristieken moet per patiënt een afweging worden gemaakt.
Onderbouwing
Achtergrond
Een geruptureerd AAA (rAAA) is een acute levensbedreigende aandoening die onbehandeld een hoge mortaliteit heeft. De laatste jaren is sprake van een gestage afname van de mortaliteit in gepubliceerde series van behandelde patiënten. Behandelmogelijkheden van het rAAA zijn open chirurgische behandeling en endovasculaire behandeling (EVAR). De klassieke trias van shock, buik-/rugpijn en een pulsatiele massa in de buik is slechts bij 50% van de patiënten met een rAAA aanwezig. Mede daarom is bij alle patiënten met een verdenking op een rAAA snelle diagnostiek aangewezen.
Conclusies / Summary of Findings
|
- GRADE |
Er is geen gerandomiseerd onderzoek naar het effect van “permissive hypotension” bij patiënten met rAAA. Cohortstudies suggereren dat het preoperatief beperken van vochttoediening mogelijk de stolling beter op peil houdt.
Bronnen: (ESVS-richtlijn, 2019) |
|
- GRADE |
Echografie is accuraat voor het aantonen of uitsluiten van een AAA, maar ongeschikt voor het aantonen of uitsluiten van een ruptuur. Ook is echografie onvoldoende voor de planning van een endovasculaire behandeling. CT angiografie (CTA) vanaf de aortaboog tot aan de liezen, is de aangewezen diagnostiek bij verdenking op een rAAA.
Bronnen: (ESVS-richtlijn, 2019) |
|
- GRADE |
Observationele studies suggereren dat een operatie in de acute situatie minder gunstig is en een hogere kans op complicaties met zich meebrengt dan een operatie onder electieve condities
Bronnen: (ESVS-richtlijn, 2019) |
|
Laag GRADE |
Er is mogelijk geen verschil in sterfte op middellange en lange termijn na EVAR in vergelijking met open behandeling van een rAAA.
Er is mogelijk geen verschil in sterfte ten gevolge van de behandeling na EVAR in vergelijking met open behandeling van een rAAA.
Bronnen: (Badger, 2016; Ulug, 2018) |
|
Laag GRADE |
EVAR leidt mogelijk tot meer reïnterventies in vergelijking met open behandeling bij patiënten met een rAAA.
Bronnen: (Badger, 2016; Ulug, 2018) |
|
Zeer laag GRADE |
Het is onduidelijk of er een verschil is in de kwaliteit van leven is na EVAR of open behandeling van een rAAA.
Het is onduidelijk of er een verschil in kosteneffectiviteit is tussen EVAR of open behandeling van een rAAA.
Bronnen: (Kapma, 2014; Ulug, 2018) |
|
- GRADE |
Scoringssystemen om patiënten te kunnen selecteren die zeer weinig kans hebben om baat te hebben bij operatieve behandeling en waarbij dus een palliatief beleid zou kunnen worden gevoerd, zijn onvoldoende accuraat.
Leeftijd van de patiënt als criterium voor wel of niet behandelen is geen goede graadmeter om een patiënt met een rAAA uit te sluiten van chirurgische behandeling.
Bronnen: (ESVS-richtlijn, 2019) |
Samenvatting literatuur
Description of studies
Badger (2016) conducted a meta-analysis of three multicentre RCTs of EVAR versus open repair in rAAA. A pre-specified analysis plan was used and 30-day or in-hospital mortality, AAA-specific and general complication rates, quality of life and an economic evaluation analysis were reported. The analysis included 761 patients.
Desgranges (2015) conducted a RCT in which patients from 14 centres with ruptured aorta-iliac aneurysms eligible for treatment by either endovascular (EVAR) or open surgical repair (OSR) from January 2008 to January 2013. A pre-specified analysis plan was used and 30-day mortality, post-operative morbidity, length of stay in the ICU, amount of blood transfused units and 6-month mortality was reported. The analysis included 108 patients.
Quality of selected systematic review
The systematic review of Badger (2016) adhered to the standards for systematic reviews given by The Cochrane Collaboration.
Quality of RCTs included in the systematic review
The study performed by Hinchliffe was underpowered (32 of the required 100 patients were recruited). The risk of bias within the studies was classified as low.
Quality of RCT not included in the systematic review
The study performed by Desgranges (2015) was quasi-randomized, since patients were allocated to the intervention group based on the week of the month. This might have introduced bias due to inadequate concealment of allocation. The risk of bias within this study was therefore classified as likely.
Overall mortality long-term outcome (>3-year follow-up) (crucial)
Ulug (2018) reported an overall follow-up mortality of 4.9 years (median 4.7 years; range 0.1 to 7.1), with a mean of 2.5 persons-years of observations (to death or censoring). There were 179 deaths (22.0 per 100 person-years) in the endovascular strategy group and 183 deaths (25.2 per 100 person-years) in the open repair group (HR 0.92, 95% CI 0.75 to 1.13; p = 0.41).
Overall mortality mid-term outcome (1-3 years) (crucial)
Ulug (2018): At 3 years, mortality was 48% and 56% in the endovascular strategy group and open repair group, respectively (OR 0.73, 95% CI 0.53 to 1.00; p = 0.053). By 3 years, 48% and 56% of participants had died and the mean numbers of life-years were 1.72 and 1.61 in the endovascular strategy group and open repair group, respectively (p = 0.32). Moreover, Ulug (2018) found that at 3-year follow-up, AAA related mortality was 35% EVAR-group (n=112) and 40% in the open repair group (n=120) (RR 0.88, 95% CI 0.72 to 1.07; p=0.21). The NNT would be 20 (95% CI 6 to -14), indicating that on average, 20 patients would have to receive EVAR (instead of open) for one additional patient not to die. Although the effect estimate was considered a clinically relevant difference in favour of EVAR by the working group, this effect was not statistically significant.
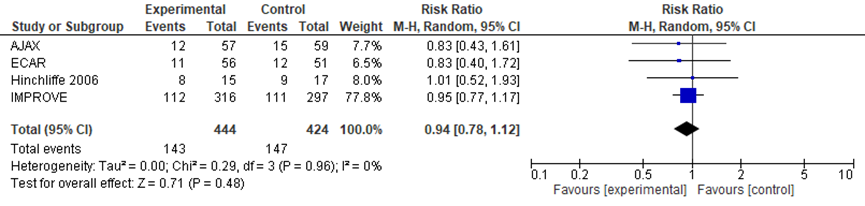
Procedure-related mortality (30-day or in-hospital mortality) (crucial)
The four included RCTs reported 30-days or in hospital mortality. We calculated by means of a random-effects model that there was no clinically relevant difference in mortality between EVAR (32%; 143/444) versus open repair (35%;147/424), RR 0.94 (95% CI 0.78 to 1.12; p=0.96) (Figure 1).
Figure 1 Forest plot of comparison: EVAR versus open repair. Overall mortality short-term outcome (30-day or in-hospital
Adverse events/complications (important)
Badger (2016) reported specified adverse events and complications that were derived from the Hinchliffe (2006) and AJAX-trial. See Table 4 for details.
Table 4 Adverse events and complications of EVAR versus open repair
|
Adverse event/complication Trial |
EVAR |
Open Repair |
||
|
|
Events |
Total |
Events |
Total |
|
Myocardial infarction |
|
|
|
|
|
Hinchliffe 2006 |
1 |
15 |
0 |
17 |
|
|
|
|
|
|
|
Stroke complication |
|
|
|
|
|
AJAX |
0 |
57 |
2 |
59 |
|
Hinchliffe 2006 |
1 |
15 |
0 |
17 |
|
|
|
|
|
|
|
Cardiac complication |
|
|
|
|
|
AJAX |
4 |
57 |
2 |
57 |
|
Hinchliffe 2006 |
5 |
15 |
7 |
17 |
|
|
|
|
|
|
|
Renal complication |
|
|
|
|
|
AJAX |
6 |
57 |
18 |
57 |
|
Hinchliffe 2006 |
7 |
15 |
5 |
17 |
|
|
|
|
|
|
|
Spinal cord ischemia |
|
|
|
|
|
AJAX |
1 |
57 |
0 |
59 |
|
|
|
|
|
|
|
Amputation |
|
|
|
|
|
AJAX |
0 |
57 |
3 |
59 |
|
|
|
|
|
|
|
Respiratory failure |
|
|
|
|
|
Hinchliffe 2006 |
1 |
15 |
0 |
17 |
Freedom from reinterventions (important)
Ulug (2018) found that between 3 months and 3 years, there were more reinterventions after EVAR (12.5 per 100 person-years and affecting 21% of participants) than after open repair (5.0 per 100 person-years affecting 9% of participants; p<0.001), but the majority of reinterventions after EVAR were considered to be minor arterial reinterventions.
Quality of life (supplementary)
Ulug (2018) reported the EQ-5D-3L, a descriptive system to quantify QoL comprising: mobility, self-care, usual activities, pain/discomfort and anxiety/depression. The EQ-5D-3L ranges from 0 (death) to 1 (perfect health). The mean EQ-5D-3L at 3 months for rAAA in the EVAR-group was 0.76 (SD: 0.24) compared with 0.67 (SD: 0.32) in the open repair group. The mean differences in the EQ-5D-3L score was 0.087 (95% CI 0.017 to 0.158; p=0.015).
At 12 months follow-up, no statistically significant difference was seen in QoL in the EVAR-group (0.77±0.20) compared with the open repair group (0.71±0.35). The mean difference in the EQ-5D-3L score was 0.068 (95% CI -0.004 to 0.140; p=0.063).
In the study of Kapma (2014) the SF-36 questionnaire was completed by 77% of the survivors and was used to quantify QoL comprising: vitality, physical functioning, bodily pain, general health perceptions, physical role functioning, emotional role functioning, mental health. There was no difference between EVAR and open surgery at the 30-day follow-up. Mean values were not given. After 6 months, the EQ-5D questionnaire showed no significant difference in scale division between EVAR (32 patients) and open repair (31 patients). Mean values were not given.
Cost-effectiveness (supplementary)
Ulug (2018): Among the endovascular strategy group, a cost difference of -£2,605 (95% CI -£5,966 to £702), leading to 88% of estimates in the cost-effectiveness plane being in the quadrant showing the endovascular strategy to be ‘dominant’, with lower mean costs and higher mean QALYs. The perspective for the analysis was not specified.
Kapma (2014) conducted a cost analysis from a provider perspective. The mean cost difference between EVAR and OR was €5,306 (95% CI -1,854 to 12,659) at 30 days and €10,189 (−2,477 to 24,506) at 6 months. EVAR was associated with higher costs and slightly higher QALYs.
Level of evidence of the literature
The quality of evidence for the outcome mid-term overall mortality was lowered with 2 levels to ‘Low’ due to low numbers of patients in only one study (serious imprecision).
The quality of evidence for procedure-related mortality was lowered with 2 levels to ‘Low’ due to the wide confidence interval which enclosed both a clinically relevant difference in favour of EVAR and open repair (imprecision).
The quality of evidence for the outcome freedom from reintervention was lowered with 2 levels to ‘Low’ due to low numbers of patients in only one study (serious imprecision).
This means that our confidence in the effect estimates of mortality (both at mid-term follow-up and procedure-related mortality) and freedom from reintervention is limited: the true effect may be substantially different from the estimate of the effect.
The quality of evidence for adverse events and complications could not be assessed due to paucity of data in the RCTs.
The quality of evidence for quality of life was lowered with 3 levels; 2 levels due to the very low number of patients in few studies (serious imprecision) and 1 level due to inconsistency. This means that we have very little confidence in the effect estimate: The true effect is likely to be substantially different from the estimate of effect.
The quality of evidence for cost-effectiveness was lowered with 3 levels; 2 levels due to the very low numbers of studies (serious imprecision) and 1 level due to inconsistency of results. This means that we have very little confidence in the effect estimate: The true effect is likely to be substantially different from the estimate of effect.
Conclusions
|
Low GRADE |
There seems to be no difference in (mid-term) mortality after EVAR compared to open repair in patients with a rAAA.
Bronnen: (Badger, 2016; Desgranges, 2015; Ulug, 2018) |
|
Low GRADE |
There seems to be no difference in procedure-related mortality after EVAR compared to open repair in patients with a rAAA.
Bronnen: (Badger, 2016; Desgranges, 2015) |
|
- GRADE |
No conclusions could be drawn for the outcome with regard to morbidity, adverse events and complications due to paucity of data.
Bronnen: (Badger, 2016; Desgranges, 2015) |
|
Low GRADE |
EVAR for a rAAA might result in more reinterventions between 3 months and 3 years after surgery compared to open repair.
Bronnen: (Ulug, 2018) |
|
Very low GRADE |
It is unsure if there’s a difference in quality of life after EVAR and open repair for a rAAA.
Bronnen: (Kapma, 2014; Ulug, 2018) |
|
Very low GRADE |
It is unsure if there’s a difference in cost-effectiveness of EVAR and open repair for a rAAA.
Bronnen: (Kapma, 2014; Ulug, 2018) |
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
Should endovascular repair or open repair be the preferred treatment modality of patients with ruptured AAA (rAAA)?
PICO
P: (patients) patients with rAAA;
I: (intervention) endovascular repair (EVAR);
C: (control) open repair;
O: (outcome measure) overall mortality, procedure-related mortality (i.e. mortality within 30 days post procedure or mortality during a hospitalization > 30 days due to the procedure), morbidity, adverse events/complications, freedom from reintervention, quality of life, cost-effectiveness.
Relevant outcome measures
The guideline development group considered overall mortality and procedure-related mortality as crucial outcome measures; and morbidity or adverse events/complications and freedom from reintervention as important outcome measures for the decision-making process. Quality of life and cost-effectiveness were considered as supplementary outcome measures.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies. The working group decided that follow-up should be a minimum period of 12 months, which is considered short-term follow-up. Mid-term follow-up refers to follow-up periods of greater than 1 to 3 years and long-term follow-up to be greater than 3 years of post-procedural follow-up.
The working group did not define a minimal clinically (patient) important difference for the outcome mortality, but used the number needed to treat/number needed to harm to weigh the impact for patients.
Search and select (Methods)
We searched the databases Medline (via OVID) and Embase (via Embase.com) with relevant search terms for AAA repair (elective or ruptured) from 2013 up to the 22nd of February 2019. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 370 hits. First, systematic reviews (SRs) were selected. When a relevant SR was found, publications of original research published after the search date of the SR, were selected. The following criteria were used: the study design was a systematic review or RCT, the patient population consisted of patients with rAAA and the study compared EVAR with open repair.
Eight studies were initially selected based on title and abstract screening. After reading the full text, four studies were excluded (see the table with reasons for exclusion under the tab Methods), and Badger (2016) (search date: 13 January 2014), Desgranges (2015), Ulug (2018), Kapma (2014) were included (Table 1).
Table 1 Overview of included studies
|
Reference Author, year |
Study design |
Outcomes |
Comments |
|
Badger, 2016 |
Systematic review and meta-analysis of RCTs |
30-day mortality, aneurysm-specific and general complication rates, quality of life and costs per patient |
Last search date January 13 2014 |
|
Desgranges, 2015 |
RCT |
30-days, 6 month and 1-year mortality, aneurysm-specific and general complications |
|
|
Ulug, 2018 |
RCT (3-year follow-up IMPROVE trial) |
3-year mortality, reinterventions, quality of life (QoL) and cost-effectiveness
|
|
|
Kapma, 2014 |
RCT |
30-days and 3-month Quality of Life (QoL) and cost-effectiveness |
Resource use was determined from the AJAX trial |
Important study characteristics and detailed results are described in Badger (2016). A summary of the results can be found in the evidence tables (Appendix).
Results
Badger (2016) conducted a meta-analysis of individual patient data from the Nottingham trial, AJAX trial and IMPROVE (see Table 2). These trials compared outcomes after EVAR or open repair for patients with rAAA. Ulug (2018) was published after the search date of Badger (2016). This publication described the 3-year follow-up data of the IMPROVE-trial. Kapma (2014) reported the cost-effectiveness and cost-utility of the AJAX trial.
Table 2 Details of the included trials in Badger (2016)
|
Trial |
Study period |
Country |
EVAR |
Open repair |
|
Hinchliffe 2006 |
2002 - 2004 |
UK |
15 |
17 |
|
AJAX 2013 |
2004 - 2011 |
Netherlands |
57 |
59 |
|
IMPROVE 2014 |
2009 - 2013 |
UK |
316 |
297 |
After the search date one RCT compared the rAIA with conventional open surgical. This study was conducted by Desgranges (2015) (see Table 3).
Table 3 Details of the Desgranges 2015 trial
|
Trial |
Study period |
Country |
EVAR |
Open repair |
|
ECAR |
2008 – 2013 |
France |
56 |
51 |
Referenties
- Badger, S. A., Harkin, D. W., Blair, P. H., Ellis, P. K., Kee, F., & Forster, R. (2016). Endovascular repair or open repair for ruptured abdominal aortic aneurysm: a Cochrane systematic review. BMJ open, 6(2), e008391. https://doi.org/10.1136/bmjopen-2015-008391
- Cambria, R. A., Gloviczki, P., Stanson, A. W., Cherry, K. J., Jr, Hallett, J. W., Jr, Bower, T. C., & Pairolero, P. C. (1994). Symptomatic, nonruptured abdominal aortic aneurysms: are emergent operations necessary?. Annals of vascular surgery, 8(2), 121–126. https://doi.org/10.1007/BF02018859
- De Martino, R. R., Nolan, B. W., Goodney, P. P., Chang, C. K., Schanzer, A., Cambria, R., Bertges, D. J., Cronenwett, J. L., & Vascular Study Group of Northern New England (2010). Outcomes of symptomatic abdominal aortic aneurysm repair. Journal of vascular surgery, 52(1), 5–12.e1. https://doi.org/10.1016/j.jvs.2010.01.095
- Desgranges, P., Kobeiter, H., Katsahian, S., Bouffi, M., Gouny, P., Favre, J. P., Alsac, J. M., Sobocinski, J., Julia, P., Alimi, Y., Steinmetz, E., Haulon, S., Alric, P., Canaud, L., Castier, Y., Jean-Baptiste, E., Hassen-Khodja, R., Lermusiaux, P., Feugier, P., Destrieux-Garnier, L., … ECAR Investigators (2015). Editor's Choice - ECAR (Endovasculaire ou Chirurgie dans les Anévrysmes aorto-iliaques Rompus): A French Randomized Controlled Trial of Endovascular Versus Open Surgical Repair of Ruptured Aorto-iliac Aneurysms. European journal of vascular and endovascular surgery : the official journal of the European Society for Vascular Surgery, 50(3), 303–310. https://doi.org/10.1016/j.ejvs.2015.03.028
- Haug, E. S., Romundstad, P., Aadahl, P., & Myhre, H. O. (2004). Emergency non-ruptured abdominal aortic aneurysm. European journal of vascular and endovascular surgery : the official journal of the European Society for Vascular Surgery, 28(6), 612–618. https://doi.org/10.1016/j.ejvs.2004.09.013
- Kapma, M. R., Dijksman, L. M., Reimerink, J. J., de Groof, A. J., Zeebregts, C. J., Wisselink, W., Balm, R., Dijkgraaf, M. G., & Vahl, A. C. (2014). Cost-effectiveness and cost-utility of endovascular versus open repair of ruptured abdominal aortic aneurysm in the Amsterdam Acute Aneurysm Trial. The British journal of surgery, 101(3), 208–215. https://doi.org/10.1002/bjs.9356
- Tambyraja, A. L., Raza, Z., Stuart, W. P., Murie, J. A., & Chalmers, R. T. (2004). Does immediate operation for symptomatic non-ruptured abdominal aortic aneurysm compromise outcome?. European journal of vascular and endovascular surgery : the official journal of the European Society for Vascular Surgery, 28(5), 543–546. https://doi.org/10.1016/j.ejvs.2004.06.017
- Ten Bosch, J. A., Koning, S. W., Willigendael, E. M., VAN Sambeek, M. R., Stokmans, R. A., Prins, M. H., & Teijink, J. A. (2016). Symptomatic abdominal aortic aneurysm repair: to wait or not to wait. The Journal of cardiovascular surgery, 57(6), 830–838.
- Ulug, P., Hinchliffe, R. J., Sweeting, M. J., Gomes, M., Thompson, M. T., Thompson, S. G., Grieve, R. J., Ashleigh, R., Greenhalgh, R. M., & Powell, J. T. (2018). Strategy of endovascular versus open repair for patients with clinical diagnosis of ruptured abdominal aortic aneurysm: the IMPROVE RCT. Health technology assessment (Winchester, England), 22(31), 1–122. https://doi.org/10.3310/hta22310
- Wanhainen, A., Verzini, F., Van Herzeele, I., Allaire, E., Bown, M., Cohnert, T., Dick, F., van Herwaarden, J., Karkos, C., Koelemay, M., Kölbel, T., Loftus, I., Mani, K., Melissano, G., Powell, J., Szeberin, Z., Esvs Guidelines Committee, de Borst, G. J., Chakfe, N., Debus, S., … Verhagen, H. (2019). Editor's Choice - European Society for Vascular Surgery (ESVS) 2019 Clinical Practice Guidelines on the Management of Abdominal Aorto-iliac Artery Aneurysms. European journal of vascular and endovascular surgery : the official journal of the European Society for Vascular Surgery, 57(1), 8–93. https://doi.org/10.1016/j.ejvs.2018.09.020 (ESVS-richtlijn 2019).
Evidence tabellen
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?
Yes/no/unclear |
Comprehensive and systematic literature search?
Yes/no/unclear |
Description of included and excluded studies?
Yes/no/unclear |
Description of relevant characteristics of included studies?
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?
Yes/no/unclear |
Potential risk of publication bias taken into account?
Yes/no/unclear |
Potential conflicts of interest reported?
Yes/no/unclear |
|
Badger, 2015 |
Yes |
Yes |
Yes |
Yes |
NA |
Yes |
Yes |
Yes (n=3) |
Yes |
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question:
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Badger et al., 2016
Study characteristics and results are extracted from the SR (unless stated otherwise) |
A systematic review of relevant publication was performed. Randomized controlled trials (RCTs) comparing EVAR with open surgical repair for RAAA were included.
Literature search up to February 2014
A: Hinchliffe, 2006 B: Reimerink (AJAX), 2013 C: Powell (IMPROVE) , 2014
Study design: RCT
Setting and Country: A: United Kingdom B: The Netherlands
Source of funding and conflicts of interest:
This research received no specific grant from any funding agency in the public, commercial or not-for-profit sectors. |
Inclusion criteria SR:
Only prospective RCTs comparing eEVAR with conventional open surgical repair were considered eligible for inclusion. Within the studies, all patients in whom a RAAA has been clinically diagnosed by CT, angiography, MR angiography or objective acute symptoms suggestive of impending rupture of the aneurysm to warrant inclusion.
Exclusion criteria SR: not specified
3 studies included
Important patient characteristics at baseline: Number of patients; characteristics important to the research question and/or for statistical adjustment (confounding in cohort studies); for example, age, sex, bmi, ...
N, mean age A: total: n=32 EVAR: n=15 OR: n=17
median age (IQR) EVAR=74 (68.8-79.5) OR= 80 (73.8-83.8)
B: total n=116 EVAR n= 57 OR n=59
mean age (95%CI) EVAR=74.5 (72.3-77.5) OR=74.5 (72.2-76.8)
C: total n=613 EVAR= n=316 OR n=297
Mean age (±SD) EVAR: 76.7 (7.4) OR: 76.7 (7.8)
Sex (M/F): A: EVAR=11/4 (73.3% Males) OR= 13/4 (76.5% males)
B: EVAR=49/8 (85.6% males) OR=50/9 (84.7% males)
C: EVAR= 246/70 (77.8% males) OR=234/63 (81.5% males)
Groups comparable at baseline? Yes, slightly less males in study a (probably due to the low sample) |
Describe intervention: Comparing EVAR with open surgical repair for RAAA
A: EVAR description: those with a diagnostic CT were transferred directly to operating theatre, and those without first had a CT scan to determine aortic measurement; performed in dedicated vascular operating theatre using a Siremobil 2000 image intensifier, with digital subtraction angiography facilities; most patients heparinised; two-piece aortouniiliac stent graft made with Gianturco stents with uncovered suprarenal component; occluding device used in contralateral common iliac artery; after deployment of stent graft, a femoro-femoral crossover graft was performed B: EVAR description: aortouniiliac endograft and contralateral iliac occluding device, followed by a femoro-femoral crossover bypass graft
C: EVAR description: endovascular supracoeliac aortic balloon occlusion will be used to support less stable patients; most interventions performed with aortouniiliac graft, but some patients received bifurcated grafts, with subsequent femoro-femoral crossover graft with contralateral iliac occlusion; control of aorta achieved using local/region anaesthesia, with general anaesthesia used later in procedure if necessary |
Describe control:
A: Open repair description: after randomisation to open repair, patients were transferred directly to the operating theatre, according to local practice; performed transperitoneally either by midline or transverse incisions; aorta clamped below renal arteries; patients no heparinised; inlay technique was used and grafts were gelatin-coated polyester
B: Open repair description: midline laparotomy and exclusion of rupture aneurysm by either polyester tube or bifurcated graft; conducted under general anaesthesia
C: Open repair description: CT scan is optional; aneurysms repaired by cross-clamping the proximal aorta and inserting a prosthetic inlay graft; performed under general anaesthesia
|
End-point of follow-up:
A: 30 days B: 30 days/ 6 months C: 30 days/ 12 month/ 3 year*
For how many participants were no complete outcome data available? (intervention/control) A: unknown B: unknown C: 10 were excluded after Data Monitoring Committee reviewed participants, 613 used in analysis
*reported by Ulug 2018 |
Outcome measure-1 Overall mortality short-term outcome (6 months) Effect measure: RR (95% CI)
B: 0.92 (0.52, 1.62)
Outcome measure-2 3 year mortality
C: At 3 years, AAA related mortality was 35% and 40% in the endovascular strategy group (n=112) and open repair group (n=120), respectively (RR 0.88, 95% CI 0.72 to 1.07; p=0.21).
Outcome measure-3 Short-term mortality (30 day, or in-hospital mortality) Effect measure: RR (95% CI)
A: 1.01 (0.52, 1.93) B: 0.83 (0.43, 1.61) C: 0.95 (0.77, 1.17)
Pooled effect (random effects model): 0.94 (95% CI 0.78 to 1.14) Heterogeneity (I2): 0%
When the IMPROVE study (C) was removed for sensitivity analysis, due to randomisation of patients that did not have rAAA, the RR was 0.92 and the CI became wider as the IMPROVE study had a larger study population than the other two included studies (95% CI 0.57 to 1.46; p=0.71).
Outcome measure-4 Adverse events/ complications
See table 3
Outcome measure-5 Quality of life at 6 and 12 months
C: The mean EQ-5D-3L utility scores were higher in the endovascular strategy group compared with the open repair group; the mean differences in the EQ-5D-3L score (among ruptured AAA survivors) were 0.087 (95% CI 0.017 to 0.158; p=0.015) and 0.068 (95% CI –0.004 to 0.140; p=0.063) at 3 and 12 months post randomisation.
Outcome measure-6 Cost effectiveness
C: At 3 years, considering all participants, there was a mean difference of 0.174 quality-adjusted life-years (QALYs) (95% CI 0.002 to 0.353 QALYs) and, among the endovascular strategy group, a cost difference of –£2605 (95% CI –£5966 to £702), leading to 88% of estimates in the cost-effectiveness plane being in the quadrant showing the endovascular strategy to be ‘dominant’.
|
Facultative:
Brief description of author’s conclusion
The major finding is that there is no difference seen between operative modalities for ruptured aneurysm repair in terms of morbidity or mortality.
The quality of the study is reduced by the lack of complete reporting in the trials.
Long-term outcome data would enhance the results of the meta-analysis and is still awaited.
Robust conclusions are difficult to draw due to paucity of data, but one modality should not be favoured over another based on current research.
Outcome measure-1 Mortality at 6 months GRADE: very low
Outcome measure-2 Mortality at 3 years GRADE: very low
Outcome measure-3 Procedure-related mortality (30 day or in hospital) GRADE: low
Outcome measure-4 Morbidity/adverse events/complications GRADE: very low
Outcome measure-5 Quality of life GRADE: very low
Outcome measure-6 Cost-effectiveness GRADE: very low |
|
|
|
|
|
|
|
Perioperative details of the three studies that are of interest when comparing EVAR with OR. Since two studies used median and IRQ an one study reported mean and SD, the findings could not be compared quantitively, but rather used for anecdotal analysis.
Measure-1 Time waiting for procedure
median, IQR B: EVAR: 74 min (39-126) OR: 45 min (35-70)
Mean, SD C: EVAR: 93 min (370) OR: 73 min (157)
Measure-2 Time in operating theatre
Median, IQR A: EVAR: 160 min (150-234) OR: 150 (141-204)
median, IQR B: EVAR: 185 min (160-236) OR: 157 min (136-194)
Mean, SD C: EVAR: 156 min (100) OR: 180 min (107)
Measure-3 Blood loss during operation
Median, IQR A: EVAR: 500 mL (200-1375) OR: 3500 mL (1000-4600)
median, IQR B: EVAR: 200 mL (163-450) OR: 2100 mL (1150-3985)
Measure-4 Length of hospital stay
Median, IQR A: EVAR: 10 days (6-28) OR: 12 days (4-52 days)
median, IQR B: EVAR: 9 days (4-21) OR: 13 days (5-21)
Mean, SD C: EVAR: 9.8 days (9) OR: 12.2 days (10.2) |
|
Table of excluded studies
|
First author, year |
Reason for exclusion |
|
Amado, 2018 |
Included studies are not relevant to the formulated PICO (e.g. Desgranges 2015, ECAR trial) |
|
Jalalzadeh, 2018 |
Limited outcomes are reported |
|
Antoniou, 2015 |
Same studies are included as in Badger et al., but no meta-analysis was performed |
|
Van Beek, 2014 |
Only reported short-term survival after 30 days |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 01-04-2021
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep in stand gehouden. Uiterlijk in 2026 bepaalt het bestuur van de Nederlandse Vereniging voor Heelkunde (NVvH) of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven (zie tabel). Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling zou moeten plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten, zoals bijvoorbeeld een herziening van de richtlijn van de European Society of Vascular Surgery (ESVS).
De NVvH is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Onderhoudsplan richtlijn AAA
|
Module |
Geautoriseerd in |
Geplande herbeoordeling |
|
Algemene inleiding en organisatie van zorg |
2021 |
2026 |
|
Diagnostiek en screening van het infrarenaal AAA |
2021 |
2026 |
|
Het kleine AAA |
2021 |
2026 |
|
Electieve behandeling van het infrarenaal AAA |
2021 |
2026 |
|
Behandeling van het geruptureerde AAA |
2021 |
2026 |
|
Lange termijn uitkomsten en follow up na herstel |
2021 |
2026 |
|
Behandeling van het juxtarenaal AAA |
2021 |
2026 |
|
Behandeling van het iliacaal AAA |
2021 |
2026 |
|
Overige AAA gerelateerde problemen |
2021 |
2026 |
Algemene gegevens
Het Kennisinstituut van de Federatie Medisch Specialisten ondersteunde de richtlijnontwikkeling en de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS) financierde de ontwikkeling. Patiëntenparticipatie bij deze richtlijn werd medegefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
De financiers hebben geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Deze richtlijn richt zich op wat volgens de huidige maatstaven de beste zorg is voor het vaststellen en behandelen van het AAA in Nederland. Het doel van de richtlijn is om de zorg voor patiënten met (verdenking op) een AAA te standaardiseren en af stemmen op hun wensen. Deze richtlijn betreft een adaptatie van de richtlijn van de European Society of Vascular Surgeons (2019).
Doelgroep
Deze richtlijn is bestemd voor alle zorgverleners die betrokken zijn bij de zorg voor patiënten met een AAA in de tweede lijn in Nederland.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met een AAA.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Prof. dr. M.M.P.J. (Michel) Reijnen, vaatchirurg, Rijnstate, Arnhem, NVvH (voorzitter)
- Dr. A.P.M. (Bart) Boll, vaatchirurg, Canisius-Wilhelmina Ziekenhuis Nijmegen, Nijmegen, NVvH
- Dr. B.M.E. (Barend) Mees, vaatchirurg, Maastricht UMC+, Maastricht, NVvH
- Dr. A.A.M. (Adrienne) Zandbergen, internist-vasculair geneeskundige, Erasmus MC, Rotterdam, NIV
- H.H. (Erik) Scholten, (cardio)-anesthesioloog, Amsterdam UMC Locatie AMC, Amsterdam, NVA
- Dr. J.A. (Jan Albert) Vos, interventieradioloog, St. Antonius Ziekenhuis, Nieuwegein, NVVR
- Dr. C.S.P. (Carla) van Rijswijk, interventieradioloog, LUMC, Leiden, NVVR
- Drs. J. (Jeroen) Nieuwenhuizen, intensivist-transplantatiechirurg, LUMC, Leiden, NVIC
- C.P.A. (Koen) van Hees, M ANP, verpleegkundig specialist, Elisabeth-TweeSteden Ziekenhuis, Tilburg, V&VN VS
- Drs. A.M.H.J. (Annemarie) Auwerda, beleidsadviseur Harteraad, Den Haag (patiëntvertegenwoordiger)
Klankbordgroep
- Dr. M.J.W. (Mark) Koelemay, Amsterdam UMC Locatie AMC, Amsterdam
- Dr. J.A. (Joost) van Herwaarden, UMC Utrecht, Utrecht
Beiden lid van de richtlijn commissie: “Abdominal Aorto-iliac Artery Aneurysms” (2019) van de ESVS
Ondersteuning van
- Dr. J. (Julitta) Boschman, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. D. (Dagmar) Nieboer, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Overzicht van functies, nevenfuncties, eventuele belangen en ondernomen acties
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen Aandelen |
Gemelde belangen Consultancy (contracten, namen) |
Gemelde belangen Wetenschap/ wetenschapsfunding |
Gemelde belangen Speakers fees |
Ondernomen actie |
|
Auwerda |
Beleidsadviseur Harteraad, Den Haag |
Geen |
Geen. 1-5-2018 |
Geen. 1-5-2018 |
Geen. 1-5-2018 |
Geen. 1-5-2018 |
Geen |
|
Boll |
- (vaat)chirurg CWZ: 0,5 fte - Voorzitter bestuur Jonkerbosch Medisch Specialistisch Bedrijf Nijmegen: 0,4 fte - Vicevoorzitter bestuur Vereniging Medische Staf CWZ: 0,1 fte |
Medisch Adviseur, onbezoldigd, Aorta stichting |
Geen. 4-6-2018
|
Geen. 4-6-2018
|
Intellectueel en reputatiebelang t.a.v. screening (onderwerp van promotieonderzoek). 4-6-2018
|
Geen. 4-6-2018
|
Geen, het gemelde belang is verjaard. |
|
Hees, van |
Verpleegkundig specialist intensieve zorg bij somatische aandoeningen, aandachtsgebied vaatchirurgie. Elisabeth Tweesteden Ziekenhuis (ETZ) Tilburg |
- Lid dagelijks bestuur vakgroep verpleegkundig specialisten ETZ, onbetaald - Voorzitter landelijk netwerk verpleegkundig specialisten vaatchirurgie Nederland (VSVN), onbetaald |
Geen. 13-6-2018 |
Geen. 13-6-2018 |
Geen. 13-6-2018 |
Geen. 13-6-2018 |
Geen |
|
Mees |
Vaatchirurg Mumc, Maastricht |
- Secretaris Nederlandse Vereniging van Vaatchirurgie (onbetaald) - Course Director I-meet (onbetaald) - Co-director EVC (onbetaald) - Adviesgroep Marfan Patientenvereniging (onbetaald)" |
Geen. 4-6-2018
|
Geen. 4-6-2018
|
XS-graft (InsCite) onderzoek naar nieuwe graft voor vaattoegang. Financier: DSM, MUMC, TUE, Provincie Limburg. 15-5-2018 |
Geen. 4-6-2018
|
Geen. Onderzoek niet gerelateerd aan richtlijnonderwerpen.
|
|
Nieuwenhuizen |
- Intensivist, Intensive Care volwassenen: LUMC, 50% - Transplantatiechirurg, afdeling Heelkunde: LUMC, 50% |
- Richtlijn commissie Acuut leverfalen, onbetaald - Werkgroep portale hypertensie, onbetaald |
Geen. 1-6-2018 |
Geen. 1-6-2018 |
Geen. 1-6-2018 |
Geen. 1-6-2018 |
Geen. |
|
Reijnen |
Vaatchirurg, Rijnstate, Arnhem |
Parttime hoogleraar (0,2 FTE) Aan de Universiteit van Twente, Multi-Modality Medical Imaging group (onbezoldigd) |
Geen. 18-9-2018 |
Consultancy activiteiten bij diverse bedrijven; W.L. Gore and Associates, Medtronic, Endologix, Terumo Aortic, Bentley. 9-8-2019 |
Research funding van diverse bedrijven. Participatie aan meerdere industry-initiated studies. W.L. Gore and Associates, Medtronic, Endologix, Terumo Aortic, Bentley, Triplemed. 9-8-2019 |
W.L. Gore and Associates, Medtronic, Endologix, Terumo Aortic, Bentley. 9-8-2019 |
Exclusie participatie bij het opstellen van aanbevelingen die niet geadapteerd worden uit de ESVS-richtlijn 2019. In de richtlijn worden géén uitspraken gedaan over specifieke prothesen. |
|
Rijswijk, van |
Interventieradioloog, LUMC Leiden (sectiehoofd Interventie Radiologie) |
Geen. (Overig: partner onderdeel van writing committee van ESVS-richtlijn 2019)
|
Geen. 23-5-2018 |
Geen. 23-5-2018 |
Geen. 23-5-2018 |
Geen. 23-5-2018 |
Geen, deze onbetaalde activiteit van de partner werd niet als belang beschouwd. |
|
Scholten |
(Cardio)-anesthesioloog, AMC, Amsterdam |
|
Geen. 2-8-2018 |
Geen. 2-8-2018 |
Geen. 2-8-2018 |
Geen. 2-8-2018 |
Geen.
|
|
Vos |
Interventieradioloog in vrije vestiging St. Antonius Ziekenhuis Utrecht/Nieuwegein/Woerden |
- Consulent Peripheral Arterial Disease Medtronic - Consulent Pulmonary Embolism BTG - Consulent Intra Arterial Stroke Treatment Stryker Allen betaald |
Geen. 25-5-2018 |
Consultancy onderwerpen niet gerelateerd aan richtlijnonderwerpen. |
Geen. 25-5-2018 |
Geen. 25-5-2018 |
Geen. |
|
Zandbergen |
- Internist - vasculair geneeskundige - Hoofdopleider Interne Geneeskunde Erasmus MC Rotterdam" |
|
Geen. 28-4-2018 |
Geen. 28-4-2018 |
Geen. 28-4-2018 Onderzoek niet gerelateerd aan richtlijnonderwerpen.
|
Geen. 28-4-2018 |
Geen. |
Inbreng patiëntenperspectief
Een patiëntvertegenwoordiger participeerde (namens Harteraad) in de werkgroep om aandacht voor het patiëntenperspectief te borgen. In de ESVS-richtlijn bleek de aandacht voor het patiëntenperspectief summier en bovendien niet zondermeer te vertalen naar de situatie voor de Nederlandse patiënt. Daarom zette Harteraad een digitale enquête uit tussen 18 april 2019 en 2 mei 2019 over de zorg voor mensen met een AAA. Het doel van de enquête was om inzicht te krijgen in de behoeften die patiënten hebben ten aanzien van de zorg en inzicht krijgen in de knelpunten die er bestaan in de zorgverlening aan mensen met een AAA. Een verslag hiervan (zie aanverwante producten) is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Harteraad.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt, verwijzen wij u naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase maakte de werkgroep gebruik van de knelpunteninventarisatie op basis van een invitational conference ‘Aneurysma Aorta Abdominalis’ in januari 2016. De werkgroep plande een invitational conference in 2018 om aanvullende knelpunten op te halen, maar hier bleek geen interesse voor vanuit de relevante partijen.
Randvoorwaarden (Organisatie van zorg)
Bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van Zorg.
Indicatorontwikkeling
De werkgroep ontwikkelde geen interne kwaliteitsindicatoren om het toepassen van de richtlijn in de praktijk te volgen en te versterken.
Kennislacunes
Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De werkgroep legde de conceptrichtlijn voor aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties ter commentaar. De werkgroep besprak de commentaren en paste de conceptrichtlijn aan of onderbouwde waarom aanpassingen niet nodig, relevant of wenselijk waren. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Werkwijze voorbereiding adaptatie ESVS-richtlijn
Tijdens de voorbereidende fase bleek de richtlijn van de European Society for Vascular Surgery (ESVS) (“Clinical Practice Guidelines on the Management of Abdominal Aorto-iliac Artery Aneurysms”) in herziening (Wanhainen, 2019). De werkgroep heeft publicatie van deze richtlijn (in januari 2019) afgewacht en besloten om deze richtlijn te adapteren conform het Adviesrapport Adapteren van internationale richtlijnen naar de Nederlandse praktijk (2016). Dit mede gezien het feit dat elk lid van de Nederlandse Vereniging voor Vaatchirurgie tevens lid is van de ESVS. De werkgroep heeft het stappenplan van het adaptatieproces gebruikt om de ESVS-richtlijn aan te passen voor de Nederlandse situatie. De werkgroep heeft dr. Mark Koelemay en dr. Joost van Herwaarden, medeauteur van de ESVS-richtlijn, gevraagd inzicht te verschaffen in het richtlijnontwikkelingsproces van de ESVS. Mede op basis daarvan is de werkgroep gekomen tot een adaptatieplan.
Onafhankelijkheid
De werkgroep had er vertrouwen in dat de ESVS-richtlijn op een zo onafhankelijk mogelijke wijze is opgesteld. De werkgroep vond geen aanwijzingen dat de internationale richtlijn werd beïnvloed door conflicterende belangen van de leden van de werkgroep of door de opvattingen of belangen van een financierende instantie.
Methodologie
De ESVS-richtlijnmethodiek was op enkele punten anders dan de richtlijnmethodiek Medisch Specialistische Richtlijnen 2.0. Een samenvatting van de werkwijze van de ESVS-werkgroep vindt u onder de paragraaf “Werkwijze richtlijnwerkgroep ESVS-richtlijn 2019”.
De werkgroep constateerde dat:
- literatuurzoekacties recent zijn en in samenwerking met medisch informatiespecialisten zijn uitgevoerd, maar dat deze niet gedocumenteerd zijn;
- het literatuurselectieproces is beschreven, maar niet per uitgangsvraag/PICO;
- de gradering van de bewijskracht is uitgevoerd volgens de systematiek van de European Society of Cardiology (ESC).
Ondanks deze beperkingen had de werkgroep voldoende vertrouwen in de kwaliteit van de ESVS-richtlijn. Voor sommige onderwerpen is namelijk nauwelijks of geen hoogwaardig bewijs beschikbaar. De werkgroep meende dat voor dergelijke onderwerpen er op dit moment geen reden was voor een nieuwe systematische literatuurzoekactie en -analyse.
De werkgroep besloot na het bestuderen van alle ESVS-hoofdstukken om zelf zeven (aanvullende) vragen volledig uit te werken, en zo de bevindingen van de ESVS-werkgroep te controleren en onvoldoende beantwoorde knelpunten uit te diepen.
- Kan medicamenteuze behandeling groei van het AAA vertragen?
- Wat is de optimale electieve behandeling van patiënten met een AAA?
- Wat is de optimale behandeling van patiënten met een geruptureerd AAA?
- Is routinematige coloscopie na een geruptureerd AAA geïndiceerd?
- Wanneer is er een behandelindicatie voor het type II endoleak?
- Wanneer is er een behandelindicatie bij het groeiend AAA?
- Wat is het ideale follow-up schema na EVAR?
Werkwijze adaptatie conclusies, aanbevelingen en overwegingen
Conclusies
Voor alle ESVS-hoofdstukken maakte de werkgroep van de relevante interventies de balans op van de gunstige en ongunstige effecten voor de patiënt en verifieerden of hun conclusie overeenkwam met de ESVS-richtlijn. Eventuele discrepanties werden benoemd en mogelijke redenen inzichtelijk gemaakt in de overwegingen.
Van bewijs naar aanbeveling
De werkgroep controleerde en bediscussieerde alle ESVS-aanbevelingen. Om te komen tot een Nederlandse richtlijnaanbeveling woog de werkgroep (de kwaliteit van) het wetenschappelijke bewijs en andere aspecten, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken.
Werkwijze aanvullende vragen danwel vragen ter controle
Uitkomsten
De werkgroep inventariseerde per vraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor de zeven aanvullende vragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5. De adviseur schreef de literatuursamenvatting in het Engels om (in de toekomst) de bevindingen internationaal te kunnen delen.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Werkwijze richtlijnwerkgroep ESVS-richtlijn 2019
Proces op hoofdlijnen
De ESVS selecteerde 16 inhoudsdeskundigen voor de richtlijnwerkgroep. Alle leden verstrekten informatie over potentiële belangen. De ESVS bewaart deze belangenverklaringen op haar hoofdkantoor en kunnen worden opgevraagd.
Alle werkgroepleden hebben het definitieve document goedgekeurd. De richtlijn onderging verder een formeel beoordelingsproces door externe deskundigen. In totaal hebben 23 recensenten, waaronder de 11 leden van werkgroep en 12 externe reviewers uit Europa, Amerika, Azië en Australië de richtlijn beoordeeld en de definitieve versie goedgekeurd.
Nieuw in de ESVS-richtlijn
Voor het eerst nam de ESVS-werkgroep het patiëntenperspectief op in de ESVS-richtlijn AAA. Verder heeft de werkgroep voor diverse onderwerpen de aanbevelingen herzien op basis van nieuw wetenschappelijk bewijs, zoals de aanbevelingen over EVAR als voorkeursbehandeling voor het geruptureerde AAA (rAAA), een gestratificeerd en minder frequent vervolgregime na EVAR, en een bijgewerkt protocol voor kleine AAA's.
Methodologie
De richtlijnwerkroep kwam enkele malen bijeen. Tijdens deze vergaderingen werden de taken vastgesteld en verdeeld. Concept-aanbevelingen werden bediscussieerd. Als er geen unanieme overeenstemming was, werd door middel van discussie getracht om tot consensus te komen. Als dit niet lukte, werd de formulering van de aanbeveling, de graad en/of het bewijsniveau bepaald op basis van stemming onder de werkgroepleden.
Zoeken en selecteren van literatuur
Leden van de commissie, ondersteund door literatuurspecialisten, voerden het literatuuronderzoek uit. Men zocht systematisch in Medline (via PubMed), Embase, Clinical Trial-databases en de Cochrane Library tot 31 december 2016. Men controleerde referenties en doorzocht, indien dat nodig werd geacht, handmatig relevante tijdschriften.
De werkgroepleden voerden een update van de literatuurzoekactie uit in mei 2018 om artikelen gepubliceerd tussen mei 2016 en januari 2018 te vinden.
De werkgroepleden voerden de literatuurselectie uit op basis van informatie in de titel en het abstract. Criteria voor zoeken en selectie waren (1) Taal: Engels. (2) Niveau van bewijs: de selectie van de literatuur werd uitgevoerd volgens de bewijspiramide, met geaggregeerde bewijs aan de top van de piramide (systematische beoordelingen, meta-analyses), vervolgens gerandomiseerde gecontroleerde studies (RCT’s, vervolgens observationele studies. Men excludeerde casestudies, dierstudies en in vitro studies.
Studies werden daarnaast beoordeeld op grootte: aan grotere studies kende men meer gewicht toe dan aan kleinere studies. Relevante artikelen gepubliceerd na de zoekdatum of in een andere taal includeerde de werkgroep alleen indien zij deze studies van groot belang achtte voor de richtlijn.
Bepalen van de bewijskracht
De richtlijnwerkgroep formuleerde conclusies op basis van het wetenschappelijk bewijs. De daaruit volgende aanbevelingen baseerde men op het beoordelingssysteem van de Europese Society of Cardiology (ESC). Elke aanbeveling classificeerde men door middel van de letter A, B of C. De werkgroep woog het bewijs en de mening van deskundigen en kende vervolgens aan elke aanbeveling een klasse toe: Klasse I, IIa, IIb of III (zie ESVS-richtlijn voor verdere details).
Het perspectief van de patiënt
De werkgroep maakte informatie voor patiënten bij elke (sub)module. Een gespecialiseerd vaatverpleegkundige en ten minste één leek of patiënt checkte deze informatie. Daarna legde de werkgroep de patiëntinformatie voor aan de “Leicester patient focus group”. Aan deze focusgroep bijeenkomst namen acht mannen met klein AAA deel. Tijdens de bijeenkomst discussieerde de deelnemers over de tekst en hieruit kwam onder andere naar voren dat men het belangrijk vindt dat feiten en aanbevelingen duidelijk, consistent en eenvoudig worden gepresenteerd. Een terugkerend voorbeeld dat door de deelnemers in de groep naar voren werd gebracht, was de vereiste voor contextualisering bij het presenteren van risico’s.
N.B. Bij Nederlandse richtlijnen levert de werkgroep zelf geen informatie voor patiënten op. De werkgroep ontwikkelt of herziet de informatie op Thuisarts in samenwerking met een redacteur.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., Fervers, B., Graham, I. D., Grimshaw, J., Hanna, S. E., Littlejohns, P., Makarski, J., Zitzelsberger, L., & AGREE Next Steps Consortium (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ : Canadian Medical Association journal = journal de l'Association medicale canadienne, 182(18), E839–E842. https://doi.org/10.1503/cmaj.090449
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwaliteit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Adapteren van internationale richtlijnen naar de Nederlandse praktijk (2016). Nederlandse Vereniging voor Urologie en de Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., Williams, J. W., Jr, Kunz, R., Craig, J., Montori, V. M., Bossuyt, P., Guyatt, G. H., & GRADE Working Group (2008). Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ (Clinical research ed.), 336(7653), 1106–1110. https://doi.org/10.1136/bmj.39500.677199.AE
Wanhainen, A., Verzini, F., Van Herzeele, I., Allaire, E., Bown, M., Cohnert, T., Dick, F., van Herwaarden, J., Karkos, C., Koelemay, M., Kölbel, T., Loftus, I., Mani, K., Melissano, G., Powell, J., Szeberin, Z., Esvs Guidelines Committee, de Borst, G. J., Chakfe, N., Debus, S., … Verhagen, H. (2019). Editor's Choice - European Society for Vascular Surgery (ESVS) 2019 Clinical Practice Guidelines on the Management of Abdominal Aorto-iliac Artery Aneurysms. European journal of vascular and endovascular surgery : the official journal of the European Society for Vascular Surgery, 57(1), 8–93. https://doi.org/10.1016/j.ejvs.2018.09.020 (ESVS-richtlijn 2019).
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Van Everdingen JJE, Burgers JS, Assendelft WJJ, et al. Evidence-based richtlijnontwikkeling. Bohn Stafleu Van Loghum 2004.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
2013 – februari 2019
|
1 exp Aortic Aneurysm, Abdominal/ or ((abdom* or thoracoabdom* or thoraco-abdom*) adj3 aneurysm*).ti,ab,kw. or aaa.ti,ab,kw. (30813) 2 ((open adj3 repair) or osr).ti,ab,kw. (8550) 3 exp Stents/ or (endovasc* or stent* or endostent* or evar or evrar or percutaneous or tevar or endoprosthe* or endograft* or palmaz or zenith or dynalink or hemobahn or intracoil or tantalum).ti,ab,kw. (249233) 4 1 and 2 and 3 (2351) 5 limit 4 to (english language and yr="2013 -Current") (988) 6 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (385338) 7 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1831092) 8 5 and 6 (99) 9 5 and 7 (222) 10 9 not 8 (169) 11 8 or 10 (268) = 268 |
370 |
|
Embase (Elsevier) |
('abdominal aortic aneurysm'/exp OR 'abdominal aortic aneurysm repair'/exp OR (((abdom* OR thoracoabdom* OR 'thoraco-abdom*') NEAR/3 aneurysm*):ti,ab) OR aaa:ti,ab) AND ('open surgical repair'/exp OR ((open NEAR/3 repair):ti,ab) OR osr:ti,ab) AND ('endovascular aneurysm repair'/exp OR 'stent graft'/exp OR endovasc*:ti,ab OR stent*:ti,ab OR endostent*:ti,ab OR evar:ti,ab OR evrar:ti,ab OR percutaneous:ti,ab OR tevar:ti,ab OR endoprosthe*:ti,ab OR endograft*:ti,ab OR palmaz:ti,ab OR zenith:ti,ab OR dynalink:ti,ab OR hemobahn:ti,ab OR intracoil:ti,ab OR tantalum:ti,ab) AND (2013-2019)/py AND (english)/lim NOT 'conference abstract':it
Gebruikte filters: Systematische reviews: ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab ORcinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematicreview'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) = 107
RCT’s: ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/expOR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it = 179
= 286 |
