Opioïdvrije Anesthesie bij obesitas – Peroperatief
Uitgangsvraag
Wat is de plaats van opioïdvrije anesthesie (peroperatief) bij patiënten met obesitas die een chirurgische ingreep ondergaan onder algehele anesthesie?
Aanbeveling
Overweeg opioïdvrije anesthesie peroperatief alleen in studieverband.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De werkgroep heeft een literatuuronderzoek verricht naar het effect van peroperatieve opioïdvrije anesthesie (OVA) in vergelijking met anesthesie mèt opioïden bij patiënten met obesitas die een chirurgische ingreep ondergaan onder algehele anesthesie. Er werden twee systematische reviews en één extra RCT geïncludeerd. De cruciale uitkomstmaten waren postoperatieve pijnscore en postoperatief rescue medicijngebruik. OVA leidt bij laparoscopische en/or bariatrische chirurgie niet tot nauwelijks tot lagere pijnscores in de verkoever en 4 tot 8 uur na de operatie (GRADE: laag). De pijnscores bleven beneden de grens die klinisch gehanteerd wordt voor geen verdere behandeling met pijnstilling (VAS score >4). Na 24 uur werd geen klinisch relevant verschil in pijnscores gevonden (GRADE: laag). OVA geeft mogelijk een vergelijkbaar gebruik van rescue medicijnen binnen 24 uur (GRADE: laag). Het gebruik van rescue medicijnen na 48 uur werd in de studies niet gerapporteerd. Er werd meestal afgewaardeerd voor inconsistente resultaten, kleine studiepopulaties, het beperkt aantal populaties waarin de studies zijn gedaan (laparoscopische urologische ingrepen en bariatrisch chirurgie) en tot slot omdat er nauwelijks OVA studies versus Remifentanil zijn gedaan. De algehele bewijskracht is laag, wat duidt op een kennislacune.
De belangrijkste uitkomstmaten waren postoperatieve misselijkheid of braken (POMB), ademdepressie, mortaliteit en hemodynamische uitkomsten. Het bleek dat OVA mogelijk POMB vermindert (GRADE: laag). OVA kan mogelijk de incidentie van hypertensie verlagen (GRADE: laag), maar voor de incidentie van hypotensie en bradycardie zien we mogelijk een voordeel voor anesthesie met opioïden (GRADE: laag). En hoewel respiratoire depressie vaak als reden wordt aangehaald om OVA nader te onderzoeken, was dit eindpunt in geen van de studies beschikbaar. Omdat de resultaten niet eenduidig zijn, kunnen de belangrijke uitkomstmaten geen duidelijke richting geven voor het besluit om OVA toe te passen.
Binnen de OVA was Dexmedetomidine het meest gebruikte middel (9 uit 11 studies), gevolgd door lidocaïne, Ketamine, en andere medicatie als de meest gebruikte extra keuzes binnen de OVA-methode. Vaak was het beleid multimodaal waarbij meerdere opioïdvrije middelen gecombineerd werden. Het was uit de studies niet goed te herleiden wat de exacte dosisrespons was van de OVA-medicatie op patiënten met obesitas. Bij opioïden is goed bekend hoe dosering bij patiënten met obesitas moet plaats vinden, maar vooral bij Dexmedetomidine en Ketamine speelt de vraag hoe de dosering aangepast moet worden bij toenemend gewicht.
Ook was er niet gecorrigeerd voor welke medicatie potentieel de meeste bijdrage leverde. Aangezien de medicatie als een synergistische toepassing werkt en moeilijk tot bijna niet individueel te toetsen is.
Overwegingen om OVA niet toe te passen zijn bekende bijwerkingen zoals psychoses bij Ketamine, bradycardie en hypotensie voor Dexmedetomidine, en systemische toxiciteit voor Lidocaïne. Omdat de invloed van toenemend gewicht op de dosis-effect relatie van deze middelen niet goed bekend is, zou bij toenemend gewicht er potentieel een groter risico op deze bijwerkingen zijn indien er te hoog wordt gedoseerd, dan wel verminderde kwaliteit van anesthesie verkregen kunnen worden indien er voor die patiënt te laag wordt gedoseerd.
Voor de postoperatieve pijn tussen de 4 en 8 uur waren er slechts 3 van de 11 studies die dit hadden onderzocht. Twee daarvan rapporteerden voor zowel OVA als opioïde-gebaseerde anesthesie een VAS-score gelijk aan of onder de 4, wat klinisch/in de praktijk wordt gehanteerd als de grens voor geen verdere behandeling met pijnstilling. Eén studie (Soudi, 2022) constateerde met relatief hoge pijnscores een klinisch relevant verschil in het voordeel van OVA ten opzichte van opioïde-gebaseerde anesthesie (VAS 4 vs. 7). Het mogelijk positieve effect van OVA op pijnscores komt dus nog niet consistent in alle studie even duidelijk naar voren.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Bij de overweging van peroperatieve OVA speelt de voorlichting aan en de betrokkenheid van patiënten en hun verzorgers een fundamentele rol. Het is van essentieel belang dat anesthesiologen een open dialoog voeren over de voordelen en potentiële beperkingen van OVA, rekening houdend met de individuele situatie van elke patiënt. Deze benadering verzekert dat de keuze voor anesthesie goed aansluit bij de persoonlijke waarden en voorkeuren van de patiënt.
- Zorguitkomsten relevant voor de patiënt: De keuze voor een anesthesiemethode dient gebaseerd te zijn op zorguitkomsten die van betekenis zijn voor de patiënt, zoals effectieve pijnbeheersing en minimalisatie van bijwerkingen. De voorkeuren van de patiënt ten aanzien van deze uitkomsten spelen een cruciale rol in de besluitvorming.
- Besluitvormingsproces: Het is belangrijk dat patiënten en hun verzorgers actief betrokken zijn bij het besluitvormingsproces. Dit vereist een evenwicht tussen het delen van expertise door de anesthesioloog en het respecteren van de waarden en voorkeuren van de patiënt.
- Veiligheid en comfort: De veiligheid en het comfort van de patiënt hebben de hoogste prioriteit. De beslissing voor het gebruik van OVA dient dan ook zorgvuldig afgewogen te worden tegen het bewijs voor effectiviteit en de individuele patiëntcontext.
Het streven naar een geïnformeerde, gezamenlijke besluitvorming tussen anesthesiologen, patiënten en hun verzorgers is essentieel voor het realiseren van optimale zorguitkomsten. Door deze benadering wordt gegarandeerd dat de keuze voor OVA niet alleen wetenschappelijk onderbouwd is, maar ook in lijn is met de persoonlijke waarden en voorkeuren van de patiënt.
Kosten (middelenbeslag)
De introductie van OVA vraagt om een zorgvuldige afweging van de kosten ten opzichte van de potentiële gezondheidsvoordelen. Dit is nog niet berekend of onderzocht. Deze afweging dient niet alleen de directe hogere kosten voor de inzet van OVA-medicatie ten opzichte van opioïden, maar ook de bredere economische impact, inclusief eventuele kostenbesparingen door verminderde postoperatieve complicaties, snellere hersteltijden en kortere ziekenhuisverblijven. Dit alles is nog niet bekend.
Kosteneffectiviteit: Het is van cruciaal belang om de kosteneffectiviteit van OVA in vergelijking met traditionele opioïde-anesthesie te beoordelen (stratificeren of remifentanil en Fentanyl groepen). Dit omvat een analyse van de (extra) middelen die OVA vereist tegenover de voordelen zoals verminderde postoperatieve pijn, misselijkheid, of braken, en potentieel korter verkoeververblijf. Wetenschappelijke onderbouwing op dit gebied is echter beperkt, waardoor de zekerheid over deze uitkomsten varieert.
Impact op ziekenhuisbudget en maatschappij: De implementatie van OVA kan invloed hebben op het ziekenhuisbudget en op maatschappelijke kosten, door mogelijke vermindering van opioïde gerelateerde bijwerkingen en complicaties. Het is belangrijk om de lange termijn financiële voordelen te overwegen, zoals verlaging van de kosten door verminderde noodzaak voor postoperatieve interventies en een potentiële afname in de lengte van ziekenhuisverblijven.
Aanvaardbaarheid, haalbaarheid en implementatie
Bezwaren en benodigdheden voor implementatie
Er zouden bezwaren kunnen zijn over de complexiteit van de OVA-protocollen, de noodzaak van training of de beschikbaarheid of aanschaf van middelen (zoals Dexmedetomidine) doordat er niet een eenduidig protocol waarin ook onderbouwde doseringen per gewichtsklasse zijn opgenomen bestaat, wat te zien was in de heterogeniteit van methodologische opzet in alle studies.
Patiënten kunnen zorgen hebben over de effectiviteit van pijnbeheersing zonder opioïden. Beide groepen kunnen behoefte hebben aan duidelijke informatie en bewijs van de voordelen van OVA, training voor zorgverleners, en verzekering van ondersteuning door het ziekenhuisbeleid.
Daarnaast is het onbekend welke OVA-methode de beste is of de voorkeur heeft, wat het opstellen van een OVA-protocol bemoeilijkt. Ditzelfde is ook onbekend bij opiaat arme toepassing.
Belemmerende factoren voor implementatie:
De implementatie van OVA stuit op diverse belemmerende factoren die een zorgvuldige aanpak vereisen. Deze omvatten niet alleen de algemene uitdagingen zoals de beschikbaarheid van adequaat getraind personeel, en de beperkingen in tijd en financiële middelen, maar ook de noodzaak voor uitgebreide patiëntacceptatie. Specifiek voor OVA speelt de samenwerking tussen verschillende medische disciplines en het alignement met externe stakeholders, waaronder zorgverzekeraars, een vitale rol in het overwinnen van deze obstakels. Daarnaast is de kennis en bekwaamheid van zorgverleners omtrent OVA van cruciaal belang; het integreren van gerelateerde modules binnen hun opleiding kan een fundament leggen voor brede acceptatie en effectieve toepassing van OVA-praktijken. Het is essentieel om deze specifieke belemmeringen te herkennen en te adresseren met gerichte strategieën om een succesvolle implementatie van OVA te waarborgen.
Een belangrijke hindernis voor de brede acceptatie van OVA is het ontbreken van vergelijkende studies met Remifentanil, een peroperatief veelgebruikt opioïde met snelle uitwerking waardoor minimale bijwerkingen na staken. Dit leidt tot een gebrek aan direct vergelijkbaar bewijs. Daarbij is er geen rapportage over incidentie van respiratoire depressie, wat oorspronkelijk als rationale voor OVA is gegeven. Bovendien beperkt de concentratie van het onderzoek binnen de laparoscopische en bariatrische chirurgie, waarbij 10 van de 11 studies zich op deze specifieke categorie richten, de toepasbaarheid van de bevindingen op een breder scala aan chirurgische procedures en patiëntengroepen. Tot slot is onvoldoende onderbouwd hoe de dosering van OVA-middelen met toenemend gewicht moet worden aangepast, wat consequenties kan hebben voor veranderende effectiviteit/veiligheidsbalans van OVA bij toenemend lichaamsgewicht. Dit alles roept vragen op over de uniformiteit van de effecten van OVA bij diverse soorten operaties.
Subgroepen met Specifieke Overwegingen
Bepaalde patiëntsubgroepen, zoals personen met een voorgeschiedenis van opioïde misbruik of ernstige co-morbiditeit van het hart, longen of nieren, kunnen specifieke overwegingen vereisen met betrekking tot de aanvaardbaarheid, haalbaarheid, en implementatie van OVA. Voor deze groepen kunnen aangepaste benaderingen of extra ondersteuning nodig zijn om de voordelen van OVA te maximaliseren en risico's te minimaliseren.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Gezien de complexiteit en het multidimensionale karakter van de invoering van peroperatieve opioïdvrije anesthesie (OVA) in de klinische praktijk, dienen de volgende aanbevelingen te worden overwogen voor opname in de richtlijn. Deze aanbevelingen zijn ontworpen om anesthesiologen te ondersteunen bij het afwegen van de voordelen en mogelijke beperkingen van OVA, met de nadruk op patiëntgerichte zorg, kosteneffectiviteit, en implementatie haalbaarheid.
Belangrijke aandachtspunten, die niet over het hoofd gezien mogen worden, betreffen de potentiële nadelen en uitdagingen van OVA:
- Er is een beperkte ervaring met de toepassing ervan.
- Er bestaat onduidelijkheid over welk middel te gebruiken en in welke dosering.
- Het is onduidelijk of OVA geschikt is voor alle soorten chirurgische ingrepen of dat het hoofdzakelijk gebruikt dient te worden voor laparoscopische procedures.
- Het is onduidelijk of OVA geschikt is voor alle subgroepen van patiënten met obesitas en andere co-morbiditeit.
- De bijwerkingen van veelgebruikte medicijnen binnen OVA, zoals Dexmedetomidine en Ketamine, moeten ook in beschouwing worden genomen (bijvoorbeeld bij hoger gewicht hogere dosering en mogelijk meer bijwerkingen).
- Het ontbreken van duidelijke onderbouwing voor dosering bij toenemend lichaamsgewicht.
- Een gebrek aan vergelijking met kortwerkende opioïden, zoals Remifentanil, vooral gezien de bezorgdheid over mogelijke respiratoire insufficiëntie die kan optreden bij langwerkende opioïden. Dit is een significante omissie, gezien het belang van een grondige evaluatie van alle beschikbare opties om potentiële respiratoire complicaties te vermijden.
Ten slotte merken we op dat, ondanks de focus op de voordelen zoals verminderde postoperatieve pijn en POMB, er in de inleiding gesproken werd over risico's zoals respiratoire insufficiëntie, waar in de verdere uitwerking geen aandacht aan is besteed door geen bewijs of gepresenteerde data. Een holistische benadering vereist dat deze aspecten eveneens worden geëxploreerd om een volledig beeld te geven van de implicaties van OVA.
Onderbouwing
Achtergrond
In de huidige medische praktijk worden bij chirurgische ingrepen vaak opioïden gebruikt tijdens de operatie, inclusief bij patiënten met obesitas. Met de toenemende focus op een multimodale aanpak van pijnbeheersing, rijst de vraag naar de effectiviteit en veiligheid van opioïdsparende en -vrije anesthesietechnieken. Deze benaderingen kunnen belangrijk zijn, vooral met het oog op het minimaliseren van het risico op postoperatieve respiratoire complicaties. Voor patiënten met obesitas is dit van bijzonder belang gezien hun verhoogde risico op aandoeningen zoals obstructief slaapapneu (OSA), waarbij de luchtwegen tijdens de slaap gedeeltelijk of volledig geblokkeerd kunnen raken.
Opioïdvrije anesthesie (OVA) zou een cruciale rol kunnen spelen in het verminderen van dit risico door het vermijden van langwerkende opioïden, die bekend staan om hun potentieel om ademhalingsdepressie te veroorzaken wat met name van belang is bij perioperatief gebruik van langwerkende opiaten tijdens kortdurende ingrepen. Dit maakt OVA een aantrekkelijke optie voor een brede reeks chirurgische procedures, vooral bij patiënten met een verhoogd risico op dergelijke complicaties.
Deze inleiding zet de toon voor een discussie over de potentiële voordelen van opioïdvrije anesthesie, met een specifieke focus op patiënten met obesitas en de klinische implicaties van het verminderen van het gebruik van opioïden in de operatiekamer, met als uiteindelijk doel postoperatieve respiratoire depressie te voorkomen.
Conclusies / Summary of Findings
|
Low GRADE |
Opioid-free anesthesia may result in little to no difference in early postoperative pain scores when compared with opioid-based strategies in patients with obesity undergoing laparoscopic urological and/or bariatric surgery requiring general anesthesia.
Sources: Ahmed, 2022; Feld, 2003; Feld, 2006; Hamed, 2019; Ibrahim, 2022; Mulier, 2018; Narejo, 2021; Soudi, 2022. |
|
Low GRADE |
Opioid-free anesthesia may result in little to no difference in intermediate postoperative pain scores when compared with opioid-based strategies in patients with obesity undergoing laparoscopic urological and/or bariatric surgery requiring general anesthesia.
Sources: Ahmed, 2022; Hamed, 2019; Soudi, 2022. |
|
Low GRADE |
Opioid-free anesthesia may result in little to no difference in late postoperative pain scores when compared with opioid-based strategies in patients with obesity undergoing laparoscopic urological and/or bariatric surgery requiring general anesthesia.
Sources: Ahmed, 2022; Feld, 2003; Hamed, 2019; Ibrahim, 2022; Mulier, 2018; Narejo, 2021; Soudi, 2022. |
|
Low GRADE |
Opioid-free anesthesia may not reduce postoperative rescue analgesic consumption in 24 hours when compared with opioid-based strategies in patients with obesity undergoing laparoscopic urological and/or bariatric surgery requiring general anesthesia.
Sources: Ahmed, 2022; Bhardwaj, 2019; Feld, 2003; Hamed, 2019; Ibrahim, 2022; Mulier, 2018; Narejo, 2021; Soudi, 2022. |
|
No GRADE |
No evidence was found regarding the effect of opioid-free anesthesia on postoperative rescue analgesic consumption in 48 hours when compared with opioid-based strategies in patients with obesity undergoing laparoscopic urological and/or bariatric surgery requiring general anesthesia.
Source: - |
|
Low GRADE |
Opioid-free anesthesia likely reduces postoperative nausea and vomiting when compared with opioid-based strategies in patients with obesity undergoing laparoscopic urological and/or bariatric surgery requiring general anesthesia.
Sources: Bhardwaj, 2019; Hamed, 2019; Mansour, 2013; Mulier, 2018; Narejo, 2021; Soudi, 2022; Ziemann-Gimmel, 2014. |
|
No GRADE |
No evidence was found or reported regarding the effect of opioid-free anesthesia on respiratory depression and mortality when compared with opioid-based strategies in patients with obesity undergoing laparoscopic urological and/or bariatric surgery requiring general anesthesia.
Source: - |
|
Low GRADE |
Opioid-free anesthesia may reduce the incidence of hypertension when compared with opioid-based strategies in patients with obesity undergoing laparoscopic urological and/or bariatric surgery requiring general anesthesia.
Sources: Mulier, 2018; Soudi, 2022. |
|
Low GRADE |
Opioid-free anesthesia may increase the incidence of hypotension when compared with opioid-based strategies in patients with obesity undergoing laparoscopic urological and/or bariatric surgery requiring general anesthesia.
Sources: Ahmed, 2022; Mulier, 2018; Soudi, 2022. |
|
Low GRADE |
Opioid-free anesthesia may increase the incidence of bradycardia when compared with opioid-based strategies in patients with obesity undergoing laparoscopic urological and/or bariatric surgery requiring general anesthesia.
Sources: Ahmed, 2022; Ibrahim, 2022; Mulier, 2018; Soudi, 2022. |
|
Very low GRADE |
The evidence is very uncertain regarding the effect of opioid-free anesthesia on the incidence of tachycardia when compared with opioid-based strategies in patients with obesity undergoing laparoscopic urological and/or bariatric surgery requiring general anesthesia.
Source: Mulier, 2018. |
Samenvatting literatuur
Description of studies
Hung (2022) performed a meta-analysis comparing OFA and opioid-based anesthesia in individuals with obesity receiving bariatric surgery. The literature search was performed up to May 2022. Outcomes of interest were the postoperative pain score, opioid consumption, and recovery quality (e.g., nausea/vomiting). Eight RCTs with a total of 485 participants were included in the meta-analysis. The age of the participants ranged from 30 to 51 years, with a BMI ranging from 38 to 61 kg/m2 across the studies. Various OFA strategies were used, including (a combination of) Dexmedetomidine, Ketamine, magnesium, lidocaine, clonidine and Propofol. In the opioid-based control group, fentanyl was used in seven RCTs and sufentanil in one RCT, none of the studies used the ultra-short-acting opioid remifentanil. The overall risk of bias judged by Hung was low in three RCTs and some concerns in five RCTs. This was due to the randomization process, deviations from intended interventions and missing trial registrations.
Zhang (2022) performed a meta-analysis investigating the analgesic effect of Dexmedetomidine on patients undergoing bariatric surgery. The literature search was performed up to April 2021. They included studies that used Dexmedetomidine as the experimental intervention and compared it with any other control drug. Therefore, not all included studies in the meta-analysis were included in the current literature analysis. Zhang (2022) included ten RCTs.
In the current analysis for this guideline, eight RCTs were excluded due to 1) a non-opioid control group (Bakhamees, 2007; Ranganathan, 2019; Salama, 2016; Tufanogullari, 2008); 2) postoperative initiation of the study drug (Abu-Halaweh, 2015; Zeeni, 2019) or 3) we already included the RCTs from Hung (2022) (Feld, 2006; Ziemann-Gimmel, 2014). Therefore, data from two RCTs were used in the current analysis (Hamed, 2019; Narejo, 2021). The studies compared Dexmedetomidine with remifentanil in 172 patients undergoing laparoscopic sleeve gastrectomy. Outcomes of interest were postoperative pain score, postoperative opioid consumption, PONV, length of hospital stay, intraoperative heart rate, and mean arterial pressure. The mean age was 38, and the mean BMI was 40 kg/m2.
The risk of bias was judged as low, conform the assessment by Zhang.
Bhardwaj (2019) performed an RCT comparing opioid-free anesthesia, which included Dexmedetomidine and lidocaine with fentanyl. Eighty patients with BMI ≥30 kg/m2 undergoing laparoscopic urological procedures under general anesthesia were enrolled. The mean age was 46, and the mean BMI was 37 kg/m2. Outcomes of interest were postoperative pain, analgesic requirement, time first to rescue analgesic, and total rescue analgesic consumed. The risk of bias was judged as ‘some concerns’ due to selection bias. Pain scores were assessed at various times, but the only pain score reported was when rescue analgesics were administered.
An overview of the characteristics of the included studies is presented in Table 1.
Table 1. Overview of the included studies.
|
Author, year |
N, total |
Population |
Intervention |
Control |
|
Included from SR of Hung (2022) |
||||
|
Ahmed, 2022 |
80 |
Patients with severe obesity (40-50 kg/m2) scheduled for laparoscopic bariatric surgeries.
Age ± SD: I: 39.7±9 C: 36.2±9
Sex: I: 32.5% M C: 25% M
BMI: C: 47±2.7 |
Dexmedetomidine, Ketamine, magnesium, lidocaine |
Fentanyl |
|
Feld, 2006 |
20 |
Patients undergoing surgery for open gastric bypass.
Age ± SD: I:40±8 C: 39±6
Sex: I: 40% M C:30% M
BMI: C: 54.4±6.8 |
Dexmedetomidine |
Fentanyl |
|
Feld, 2003 |
30 |
Obese patients (BMI > 50 kg/m2) undergoing gastric bypass by open laparotomy.
Age ± SD: I:44±8 C: 41±7
Sex: I: 37% M C:40% M
BMI: C: 54±12 |
Ketamine, magnesium, lidocaine, ketorolac, clonidine |
Fentanyl |
|
Ibrahim, 2022 |
103 |
Patients with BMI 40 to 60 planned for elective laparoscopic sleeve gastrectomy.
Age (IQR): I:30 (22-36) C: 32 (23-39)
Sex: I: 33% M C:20% M
BMI (IQR): C: 44 (42–45) |
Dexmedetomidine, Ketamine, lidocaine |
Fentanyl |
|
Mansour, 2013 |
28 |
Obese patients (BMI>50 kg/m2) undergoing laparoscopic sleeve gastrectomy.
Age ± SD: I:31±7 C: 30±9
Sex: Not reported
BMI: C: 47±13 |
Ketamine |
Fentanyl |
|
Mulier, 2018 |
45 |
Patients undergoing elective laparoscopic bariatric surgery.
Age ± SD: I:41.8±11.2 C: 44.3±11.1
Sex: I: 30% M C:45% M
BMI: C: 38±9 |
Dexmedetomidine, Ketamine, lidocaine |
Sufentanil |
|
Soudi, 2022 |
60 |
Patients undergoing scheduled laparoscopic bariatric surgery under general anesthesia with BMI 40 to 59.9 kg/m2.
Age ± SD: I:39.8±11.3 C: 35.1±9.4
Sex: I: 16.7% M C:20% M
BMI: C: 50.4±8.3 |
Dexmedetomidine, Ketamine |
Fentanyl |
|
Ziemann-Gimmel, 2014 |
119 |
Patients undergoing elective bariatric surgery.
Age ± SD: I: 50.5±13.7 C: 50.4±12.4
Sex: I: 35% M C: 27% M
BMI: I: 44.1±7.5 C: 45.3±7.0 |
Dexmedetomidine, Ketamine, Propofol |
Fentanyl |
|
Included from SR of Zhang (2022) |
||||
|
Narejo, 2021 |
40 |
Patients with BMI >35 kg/m2 scheduled to undergo elective laparoscopic sleeve gastrectomy.
Age ± SD: I: 38±11.3 C: 31.5±10.2
Sex: I: 19.7% M C: 27.3% M
BMI: I: 45±6 C: 45±6 |
Dexmedetomidine |
Remifentanil |
|
Hamed, 2019 |
132 |
Patients (BMI >35 kg/m2) assigned for bariatric surgery.
Age ± SD: I: 38.1±6.1 C: 38.7±7.5
Sex: I: 30% M C: 35% M
BMI: I: 40.7±3.3 C: 40±3.4 |
Dexmedetomidine |
Remifentanil |
|
Additional RCT |
||||
|
Bhardwaj, 2019 |
80 |
BMI of 30 kg/m2 or more undergoing laparoscopic urological procedures under general anesthesia.
Age ± SD: I: 46±8 C: 46±12
Sex: I: 55% M C: 35% M
BMI I: 35±4 C: 37±5 |
Dexmedetomidine, lidocaine |
Fentanyl |
Results
Postoperative pain
Early postoperative pain (PACU)
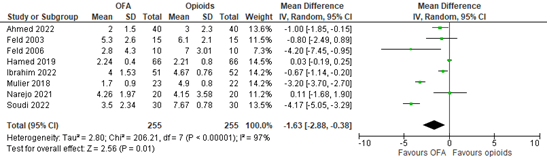
Eight studies reported early postoperative pain scores (Ahmed, 2022; Feld, 2003; Feld, 2006; Hamed, 2019; Ibrahim, 2022; Mulier, 2018; Narejo, 2021; Soudi, 2022). A meta-analysis is shown in Figure 1. The mean difference (MD) was -1.63 (95% confidence interval (CI) -2.88 to -0.38). The difference in early postoperative pain scores was not clinically relevant as the pain scores were relatively low.
Figure 1. Early postoperative pain scores.
Z: p-value of overall effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
Intermediate postoperative pain (4 to 8 hours)
Three studies reported postoperative pain between 4 and 8 hours.
As two studies did not report means and standard deviations, results could not be pooled.
Table 2 shows an overview of the postoperative pain scores.
Table 2. Intermediate postoperative pain scores.
|
Study |
Opioid-free |
Opioid-based |
Mean difference (95% CI) |
Timing |
|
Ahmed, 2022 |
2 (1-4) |
4 (1-5) |
-2 (not reported) |
6 hours |
|
Hamed, 2019 |
2.56±0.88 |
2.7±0.9 |
-0.14 (-0.37, 0.09) |
6 hours |
|
Soudi, 2022 |
4 (3-5) |
7 (7-8) |
-3 (not reported) |
6 hours |
Pain scores reported as mean ± SD or median (IQR).
Overall, significantly lower pain scores are reported in OFA compared to opioids at 4 to 8 hours postoperatively for two out of three studies, whereby only one study showed clinical relevance for OFA (Soudi, 2022).
Late postoperative pain (24 hours)
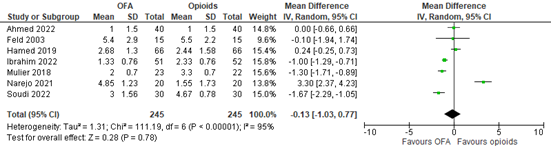
Seven studies reported late postoperative pain scores (Ahmed, 2022; Feld, 2003; Hamed, 2019; Ibrahim, 2022; Mulier, 2018; Narejo, 2021; Soudi, 2022). A meta-analysis is shown in Figure 2. The MD is -0.13 (95% CI -1.03 to 0.77). Late postoperative pain scores were not clinically relevant lower in OFA compared to opioids.
Figure 2. Late postoperative pain scores.
Z: p-value of overall effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
Postoperative rescue analgesic consumption
In 24 hours
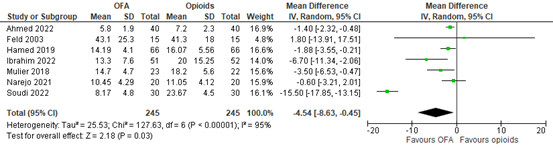
Seven studies reported postoperative rescue analgesic consumption in 24 hours (Ahmed, 2022; Feld, 2003; Hamed, 2019; Ibrahim, 2022; Mulier, 2018; Narejo, 2021; Soudi, 2022). All rescue analgesics were opioids, conversed to morphine equivalents. A meta-analysis is shown in Figure 3. The MD is -4.54 mg (95% CI -8.63 to -0.45). Postoperative rescue analgesic consumption was clinically relevant and reduced in OFA compared to opioids.
Figure 3. Postoperative analgesic consumption, morphine equivalents.
Z: p-value of overall effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
In addition to the pooled analysis, Bhardwaj (2019) reported total tramadol requirement in 24 hours. The OFA group required 64 mg tramadol (SD 69) and the opioid group 226 mg (SD 48) (MD -162.00; 95% CI -188.05 to -135.95). This is, contrary to the pooled analysis, clinically relevant lower in the OFA group.
In 48 hours
None of the included studies reported the postoperative analgesic consumption in 48 hours.
Postoperative nausea and vomiting (PONV)
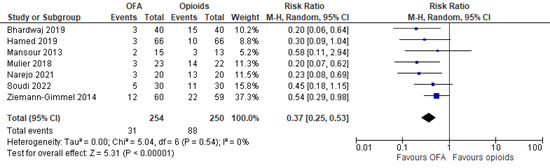
Seven studies reported postoperative nausea and vomiting (Bhardwaj, 2019; Hamed, 2019; Mansour, 2013; Mulier, 2018; Narejo, 2021; Soudi, 2022; Ziemann-Gimmel, 2014). Bhardwaj (2019) reported the total number of PONV events. Hamed (2019) and Narejo (2021) reported PONV on the first postoperative day. Hung (2022) did not report the follow-up for PONV for the included studies (Mansour, 2013; Mulier, 2018; Soudi, 2022; Ziemann-Gimmel, 2014). A meta-analysis is shown in Figure 4. The relative risk (RR) is 0.37 (95% CI 0.25 to 0.53). PONV was clinically relevant reduced in OFA compared to opioids.
Figure 4. Postoperative nausea and vomiting.
Z: p-value of overall effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
Respiratory depression
None of the included studies reported absolute data on respiratory depression.
One study from Bhardwaj (2019) reported a significant fall in SpO2 values from baseline till 40 min of surgery in opioid‑based anaesthesia, “suggesting that opioids lead to respiratory depression in obese patients (P<0.005).”
Since no absolute data was available, clinical relevance could not be assessed.
Mortality
None of the included studies reported the outcome measure ‘mortality’.
Hemodynamic variables
Hypertension
Two studies reported the incidence of hypertension; therefore data was not pooled.
Mulier (2018) reported hypertension in 7 out of 23 (30.4%) in the OFA group and 10 out of 22 (45.5%) in the opioid-based group (RR 0.67, 95% CI 0.31 to 1.44).
Soudi (2022) reported hypertension in 0 out of 30 (0%) in the OFA group and 5 out of 30 in the opioid-based group (RR 0.09, 95% CI 0.01 to 1.57).
Both results indicate that the incidence of hypertension was clinically relevant reduced in the OFA group.
Hypotension
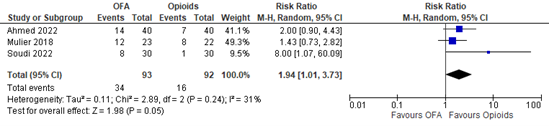
Three studies reported the incidence of hypotension. A meta-analysis is shown in Figure 5. The RR is 1.94 (95% CI 1.01 to 3.73). The incidence of hypotension is clinically relevant reduced in the opioid-based group.
Figure 5. Hypotension.
Z: p-value of overall effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
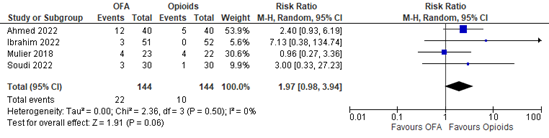
Bradycardia
Four studies reported the incidence of bradycardia. A meta-analysis is shown in Figure 6. The RR is 1.97 (95% CI 0.98 to 3.94). The incidence of bradycardia is clinically relevant reduced in the opioid-based group.
Figure 6. Bradycardia.
Z: p-value of overall effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
Tachycardia
Only one study reported the incidence of tachycardia, and therefore data were not pooled.
Mulier (2018) reported tachycardia in 11 out of 23 (47.8%) patients in the OFA group, compared to 13 out of 22 (59.1%) in the opioid-based group (RR 0.81, 95% CI 0.47 to 1.40). The incidence of tachycardia is clinically relevant reduced in the OFA group.
Level of evidence of the literature
The level of evidence regarding the outcome measure early postoperative pain was downgraded by two levels because of conflicting results (inconsistency, -1); and the optimal information size (OIS) was not met (imprecision, -1). The level of evidence is low.
The level of evidence regarding the outcome measure intermediate postoperative pain was downgraded by two levels because of conflicting results (inconsistency, -1); and the OIS was not met (imprecision, -1). The level of evidence is low.
The level of evidence regarding the outcome measure late postoperative pain was downgraded by one level because of conflicting results (inconsistency, -1); and the OIS was not met (imprecision, -1). The level of evidence is low.
The level of evidence regarding the outcome measure postoperative rescue analgesic consumption in 24 hours was downgraded by two levels because of conflicting results (inconsistency, -1); and the OIS was not met (imprecision, -1). The level of evidence is low.
The level of evidence regarding the outcome measure postoperative analgesic consumption in 48 hours could not be assessed, as none of the included studies reported this outcome.
The level of evidence regarding the outcome measure postoperative nausea and vomiting was downgraded by one level because OIS was not met (imprecision, -1). The level of evidence is moderate.
The level of evidence regarding the outcome measure respiratory depression could not be assessed, as none of the included studies reported this outcome.
The level of evidence regarding the outcome measure mortality could not be assessed, as none of the included studies reported this outcome.
The level of evidence regarding the outcome measure hypertension was downgraded by two levels as the confidence intervals cross both thresholds for clinical relevance and the OIS was not met (imprecision, -2). The level of evidence is low.
The level of evidence regarding the outcome measure hypotension was downgraded by two levels as the pooled confidence interval crosses one threshold for clinical relevance and the OIS was not met (imprecision, -2). The level of evidence is low.
The level of evidence regarding the outcome measure bradycardia was downgraded by two levels as the pooled confidence interval crosses one threshold for clinical relevance and the OIS was not met (imprecision, -2). The level of evidence is low.
The level of evidence regarding the outcome measure tachycardia was downgraded by three levels as the pooled confidence interval crosses one threshold for clinical relevance and the OIS was not met (imprecision, -3). The level of evidence is very low.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the favorable and unfavorable effects of opioid-free anesthesia (peroperative) in patients with obesity undergoing surgery requiring general anesthesia?
P: Patients with obesity (BMI≥30) undergoing surgery requiring general anesthesia
I: Opioid-free anesthesia (OFA) peroperative
C: (Classic) opioid-based strategy peroperative
O: Postoperative pain, postoperative rescue analgesic consumption, postoperative nausea and vomiting (PONV), respiratory depression, mortality, hemodynamic variables
Relevant outcome measures
The guideline development group considered postoperative pain and postoperative rescue analgesic consumption as a critical outcome measure for decision making; and PONV, respiratory depression, mortality and hemodynamic variables as important outcome measures for decision making.
A priori, the working group defined postoperative pain score as pain score assessed on a visual analogue scale (VAS) or numeric rating scale (NRS). We distinguish pain scores assessed in the early (PACU), intermediate (4 to 8 hours) or late (24 hours) postoperative period.
Postoperative rescue analgesics were assessed in the first 24 hours and 48 hours after surgery.
Hemodynamic variables were defined as hypertension, hypotension, bradycardia, and tachycardia.
The working group did not define the other outcome measures listed above but used the definitions used in the studies.
The working group defined the following as a minimal clinically (patient) important difference:
Postoperative pain score: MD (mean difference) >10% of the maximum score (Myles, 2017) on VAS or NRS > 4 seen as clinically relevant.
Postoperative rescue analgesic consumption: MD >20% comparing with control group
PONV: 0.8≥ risk ratio (RR) ≥1.25
Respiratory depression: 0.91≥ RR ≥1.10
Mortality: 0.95≥RR≥1.05
Hemodynamic variables: 0.91≥RR≥ 1.10
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 9-1-2023. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 1120 hits. The search was combined for per- and postoperative opioid-free anesthesia. Studies were selected based on the following criteria: 1) a systematic review of observational comparative studies or randomized controlled trials (RCTs), or an RCT, or an observational comparative study, 2) published after 2010, 3) including only patients with obesity (BMI ≥30) undergoing a surgical procedure and requiring general anesthesia 4) comparing an opioid-free anesthesia regimen with an opioid-based anesthesia regimen administered peroperatively, 5) reporting at least one of the following outcome measures: postoperative pain, postoperative rescue analgesic consumption, PONV, respiratory depression, mortality or hemodynamic variables. A total of 42 studies were initially selected based on title and abstract screening. After reading the full text, 39 studies were excluded (see the table with reasons for exclusion under the tab Methods), and three studies were included.
Results
Two systematic reviews and one RCT were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Ahmed SA, Abdelghany MS, Afandy ME. The effect of opioid-free anesthesia on the post-operative opioid consumption in laparoscopic bariatric surgeries: A randomized controlled double-blind study. J Opioid Manag. 2022 Jan-Feb;18(1):47-56. doi: 10.5055/jom.2022.0694. PMID: 35238013.
- Bhardwaj S, Garg K, Devgan S. Comparison of opioid-based and opioid-free TIVA for laparoscopic urological procedures in obese patients. J Anaesthesiol Clin Pharmacol. 2019 Oct-Dec;35(4):481-486. doi: 10.4103/joacp.JOACP_382_18. PMID: 31920231; PMCID: PMC6939571.
- Feld JM, Hoffman WE, Stechert MM, Hoffman IW, Ananda RC. Fentanyl or dexmedetomidine combined with desflurane for bariatric surgery. J Clin Anesth. 2006 Feb;18(1):24-8. doi: 10.1016/j.jclinane.2005.05.009. PMID: 16517328.
- Feld JM, Laurito CE, Beckerman M, Vincent J, Hoffman WE. Non-opioid analgesia improves pain relief and decreases sedation after gastric bypass surgery. Can J Anaesth. 2003 Apr;50(4):336-41. English, French. doi: 10.1007/BF03021029. PMID: 12670809.
- Hamed JME, Refaat HSM, Al-Wadaani H. Dexmedetomidine Compared to Remifentanil Infusion as Adjuvant to Sevoflurane Anesthesia during Laparoscopic Sleeve Gastrectomy. Anesth Essays Res. 2019 Oct-Dec;13(4):636-642. doi: 10.4103/aer.AER_126_19. Epub 2019 Dec 16. PMID: 32009708; PMCID: PMC6937887.
- Hung KC, Chiu CC, Hsu CW, Lin CM, Liao SW, Teng IC, Chen IW, Sun CK. Impact of Opioid-Free Anesthesia on Analgesia and Recovery Following Bariatric Surgery: a Meta-Analysis of Randomized Controlled Studies. Obes Surg. 2022 Sep;32(9):3113-3124. doi: 10.1007/s11695-022-06213-7. Epub 2022 Jul 19. PMID: 35854095.
- Ibrahim M, Elnabtity AM, Hegab A, Alnujaidi OA, El Sanea O. Combined opioid free and loco-regional anaesthesia enhances the quality of recovery in sleeve gastrectomy done under ERAS protocol: a randomized controlled trial. BMC Anesthesiol. 2022 Jan 21;22(1):29. doi: 10.1186/s12871-021-01561-w. PMID: 35062872; PMCID: PMC8781357.
- Mansour MA, Mahmoud AA, Geddawy M. Nonopioid versus opioid based general anesthesia technique for bariatric surgery: A randomized double-blind study. Saudi J Anaesth. 2013 Oct;7(4):387-91. doi: 10.4103/1658-354X.121045. PMID: 24348288; PMCID: PMC3858687.
- Mulier JP, Wouters R, Dillemans B, Dekock M. A randomized controlled, double-blind trial evaluating the effect of opioid-free versus opioid general anaesthesia on postoperative pain and discomfort measured by the QoR-40. J Clin Anesth Pain Med. 2018;6:2.
- Narejo AS, Khan MM, Alwhabi A, Alqarni A, Ahmed AE, Eldawlatly AA. Impact of Intraoperative Dexmedetomidine versus Remifentanil on Recovery Characteristics following Laparoscopic Sleeve Gastrectomy. J Coll Physicians Surg Pak. 2021 Feb;31(2):210-214. doi: 10.29271/jcpsp.2021.02.210. PMID: 33645192.
- Soudi AM, Hammad RA, ElShafie MA, Ahmed IM, Alhadidy MA. Comparing opioid free general anesthesia to traditional balanced general anesthesia regarding achievement of enhanced recovery in laparoscopic bariatric surgeries. Ain-Shams Journal of Anesthesiology. 2022 Mar 7;14(1).
- Ziemann-Gimmel P, Goldfarb AA, Koppman J, Marema RT. Opioid-free total intravenous anaesthesia reduces postoperative nausea and vomiting in bariatric surgery beyond triple prophylaxis. Br J Anaesth. 2014 May;112(5):906-11. doi: 10.1093/bja/aet551. Epub 2014 Feb 18. PMID: 24554545.
- Zhang Y, Zhou Y, Hu T, Tong X, He Y, Li X, Huang L, Fu Q. Dexmedetomidine reduces postoperative pain and speeds recovery after bariatric surgery: a meta-analysis of randomized controlled trials. Surg Obes Relat Dis. 2022 Jun;18(6):846-853. doi: 10.1016/j.soard.2022.03.002. Epub 2022 Mar 9. PMID: 35422388.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Hung, 2022
[individual study characteristics deduced from Hung, 2022]
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to May 2022
A: Ahmed, 2022 B: Feld, 2006 C: Feld, 2003 D: Ibrahim, 2022 E: Mansour, 2013 F: Mulier, 2018 G: Soudi, 2022 H: Ziemann-Gimmel, 2014
Study design: RCT
Setting and Country: A: Egypt B: USA C: USA D: Egypt E: Egypt F: Belgium G: Egypt H: USA
Source of funding and conflicts of interest: Not available
|
Inclusion criteria SR: (a) Patient population: adults with obesity receiving BS under general anesthesia, (b) Intervention: OFA in anesthetic induction and maintenance regardless of the selection of drugs, their uses (e.g., single or combined), and dosages in the OFA group. Studies involving opioid use in the OFA group before the end of surgery were excluded, (c) Comparison: the use of opioids with or without combining with other anesthetics/ analgesics during general anesthesia (control group), (d) Outcomes: parameters pertaining to postoperative pain-related outcomes such as pain severity and opioid consumption
Exclusion criteria SR: (1) unavailability of information about OFA, (2) lack of measurable parameters regarding postoperative pain-related outcomes, (3) being published as review articles, conference proceedings, case reports, communications, abstracts, or editorials instead of full-length original articles.
8 studies included
Important patient characteristics at baseline:
N, mean age A: 80 patients, 40 yrs B: 20 patients, 40 yrs C: 30 patients, 44 yrs D: 103 patients, 30 yrs E: 28 patients, 31 yrs F: 45 patients, 42 yrs G: 60 patients, 40 yrs H: 119 patients, 51 yrs
Sex: A: 28% Male B: 35% M C: 26.7% M D: 38.8% M E: NA F: 37.8% M G: 18.3% M H: 31.1% M
BMI (kg/m2) A: 47 B: 61 C: 56 D: 45 F: 38 G: 50 H: 44
Groups comparable at baseline? Yes |
Describe intervention:
A: dexmedetomidine, ketamine, magnesium, lidocaine B: dexmedetomidine C: ketamine, magnesium, lidocaine, ketorolac, clonidine D: dexmedetomidine, ketamine, lidocaine E: ketamine F: dexmedetomidine, ketamine, lidocaine G: dexmedetomidine, ketamine H: dexmedetomidine, ketamine, propofol
|
Describe control:
A: fentanyl B: fentanyl C: fentanyl D: fentanyl E: fentanyl F: sufentanil G: fentanyl H: fentanyl
|
End-point of follow-up:
Not reported, short-term follow-up assumed
For how many participants were no complete outcome data available? (intervention/control) Missing outcome data was judged as low risk of bias for all included RCTs. Therefore no incomplete outcome data were assumed.
|
Outcome measure-1 Defined as pain score 24h
Effect measure: mean difference [95% CI]: A: 0.00 [-0.66, 0.66] C: -0.10 [-1.94, 1.74] D: -1.00 [-1.29, -0.71] F: -1.30 [-1.71, -0.89] G: -1.67 [-2.29, -1.05]
Pooled effect (random effects model): -0.96 [95% CI -1.46 to -0.46] favoring OFA Heterogeneity (I2): 75%
Outcome measure-2 Defined as morphine consumption 24h
Effect measure: mean difference [95% CI]: A: -1.40 [-2.32, -0.48] C: 1.80 [-13.91, 17,51] D: -6.70 [-11.34, -2.06] F: -3.50 [-6.53, -0.47] G: -15.50 [-17.85, -13.15]
Pooled effect (random effects model): -5.58 [95% CI -12.78 to 1.08] favoring OFA Heterogeneity (I2): 97%
Outcome measure-3 Defined as pain score in PACU
Effect measure: mean difference [95% CI]: A: -1.00 [-1.85, -0.15] B: -0.80 [-2.49, 0.89] C: -4.20 [-7.45, -0.95] D: -0.67 [-1.14, -0.20] F: -3.20 [-3.70, -2.70] G: -4.17 [-5.05, -3.29]
Pooled effect (random effects model): -2.21 [95% CI -3.60 to -0.82] favoring OFA Heterogeneity (I2): 94%
Outcome measure-4 Defined as morphine consumption in PACU
Effect measure: mean difference [95% CI]: B: -2.60 [-4.73, -0.47] C: -8.50 [-12.75, -4.25] D: -6.60 [-9.54, -3.66] F: -10.40 [-13.49, -7.31]
Pooled effect (random effects model): -6.87 [95% CI -10.62 to -3.11] favoring OFA Heterogeneity (I2): 84%
Outcome measure 5 Defined as risk of PONV
Effect measure: RR [95% CI]: E: 0.58 [0.11, 2.94] F: 0.20 [0.07, 0.62] G: 0.45 [0.18, 1.15] F: 0.54 [0.29, 0.98]
Pooled effect (random effects model): 0.44 [95% CI -0.29 to 0.69] favoring OFA Heterogeneity (I2): 0%
|
Risk of bias (high, some concerns or low): Tool used by authors:
A: Low B: Some concerns C: Some concerns D: Low E: Some concerns F: Some concerns G: Some concerns H: Low
Facultative:
The results of the current meta-analysis on individuals undergoing bariatric surgery showed that OFA was associated with reductions in 24-h pain score and risk of PONV as well improvements in pain-related outcomes (i.e., pain severity and opioid consumption) in the PACU. Considering the increased risk of opioid use in this population, this approach may be recommended in clinical practice.
h Sensitivity analyses (excluding small studies; excluding studies with short follow-up; excluding low quality studies; relevant subgroup-analyses); revealed consistent findings when smaller studies were removed
|
|
Zhang, 2022
[individual study characteristics deduced from Zhang, 2022]
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to April 2021
A: Narejo, 2021 B: Hamed, 2019
Study design: RCT double-blind
Setting and Country: A: Saudi Arabia B: Egypt
Source of funding and conflicts of interest: Not available
|
Inclusion criteria SR: (1) the study design was RCT; (2) the participants with obesity underwent any type of bariatric surgery; (3) the study used dexmedetomidine as the experimental intervention and compared it with any other control drug; (4) the study explored the analgesic effects of dexmedetomidine.
Exclusion criteria SR: None
Out of 10 studies included by Zhang 2022, 2 RCTs were included in the current analysis
Important patient characteristics at baseline:
N, mean age A: 40 patients, 36 yrs B: 132 patients, 38 yrs
Sex: A: 30% Male B: 27% M
BMI (kg/m2) A: 45 B: 40
Groups comparable at baseline? Yes |
Describe intervention:
A: Dexmedetomidine (0.2-0.7 μg/kg/hour) B: Dexmedetomidine (0.2-0.5 μg/kg/hour)
|
Describe control:
A: Remifentanil (0.05-1 μg/kg /minute) B: Remifentanil (6-18 μg/kg/hour) |
End-point of follow-up:
Not reported, short-term follow-up assumed
For how many participants were no complete outcome data available? (intervention/control) Not available
|
Outcome measure-1 Defined as pain score POD1
Effect measure: mean difference [95% CI]: A: 3.30 [2.37, 4.23] B: 0.24 [-0.25, 0.73]
Pooled effect: Not applicable as only 2 studies were included
Outcome measure-2 Defined as morphine consumption POD1
Effect measure: mean difference [95% CI]: A: -0.60 [-3.21, 2.01] B: -1.88 [-3.55, -0.21]
Pooled effect: Not applicable as only 2 studies were included
Outcome measure-3 Defined as pain score in PACU
Effect measure: mean difference [95% CI]: A: 0.11 [-1.68, 1.90] B: 0.03 [-0.19, 0.25]
Pooled effect: Not applicable as only 2 studies were included
Outcome measure-4 Defined as morphine consumption in PACU
Effect measure: mean difference [95% CI]: A: 0.70 [-1.26, 2.66]
Pooled effect: Not applicable as only 1 study was included
Outcome measure 5 Defined as PONV in ward
Effect measure: RR [95% CI]: E: 0.23 [0.08, 0.69] B: 0.30 [0.09, 1.04]
Pooled effect: Not applicable as only 2 studies were included |
Risk of bias (high, some concerns or low): Tool used by authors: Cochrane Collaboration‘s Tool for Risk of Bias
A: Low B: Some concerns
Facultative:
The use of dexmedetomidine is conducive to enhanced recovery after bariatric surgery due to better postoperative opioid-sparing analgesia, a reduction in PONV, and a shortening of LOS
Sensitivity analyses not applied
|
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control ©
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Bhardwaj, 2019 |
Type of study: RCT
Setting and country: India
Funding and conflicts of interest: No sponsors or funding and nothing to declare. |
Inclusion criteria: aged 20–60 years with ASA classification II or III physical status with BMI of 30 kg/m2 or more undergoing laparoscopic urological procedures under general anesthesia
Exclusion criteria: history of known allergies to study drugs, opioid use 1 month prior to surgery, chronic opioid addiction, inability to comprehend visual analog scale (VAS), pregnant or lactating mothers and those with a history of significant hepatic, renal, or cardiac disease
N total at baseline: Intervention: 40 Control: 40
Important prognostic factors2: For example age ± SD: I: 46±8 C: 46±12
Sex: I: 55% M C: 35% M
BMI I: 35 C: 37
Groups comparable at baseline? Yes |
Describe intervention (treatment/procedure/test):
Loading dose of dexmedetomidine 0.5 µg/kg over 10 min, then 0.1 − 0.3 µg/kg/h for maintenance. Lignocaine 1.5 mg/kg was administered at induction and an infusion of 0.1 mg/kg/h was started immediately after the loading dose. Ketamine 0.5 mg/kg was given before incision.
|
Describe control (treatment/procedure/test):
Loading dose fentanyl 2 µg/kg, then 0.5 µg/kg bolus for maintenance |
Length of follow-up: 24 hours
Loss-to-follow-up: Not reported, not assumed
Incomplete outcome data: Not reported, not assumed
|
Outcome measures and effect size (include 95%CI and p-value if available):
Postoperative pain when rescue analgesic is administered (VAS) I: 5±1 C: 5±1
Total tramadol requirement 24h, mg I: 64±69 C: 226±48
PONV total, N I: 3/40 C: 15/40
Respiratory depression: No absolute data. “There was a significant fall in SpO2 values from baseline till 40 min of surgery in opioid‑based anesthesia suggesting that opioids lead to respiratory depression in obese patients (P<0.005).”
|
Author’s conclusion: In obese patients, opioid‑free anesthesia with dexmedetomidine, lignocaine, ketamine provides better postoperative analgesia and hemodynamics, with lesser postoperative tramadol requirement. |
Risk of bias table for intervention studies (randomized controlled trials; based on Cochrane risk of bias tool and suggestions by the CLARITY Group at McMaster University)
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded? Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
Bhardwaj, 2019 |
Probably yes;
Reason: computer generated random numbers were used |
No information;
|
Probably yes
Reason: Patients, investigator assessing the postoperative parameters, and the data analyst were blinded to the study. The anesthetist providing anesthesia was not blinded to the study drugs administered. |
Probably yes
Reason: not reported, not assumed |
Probably no
Reason: Pain scores and analgesic requirement were recorded for many different time points, but only one time point is reported. |
Definitely yes;
Reason: No other problems noted |
Some concerns (pain, opioid consumption)
Reason: selective reporting
|
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Mansour MA, Mahmoud AA, Geddawy M. Nonopioid versus opioid based general anesthesia technique for bariatric surgery: A randomized double-blind study. Saudi J Anaesth. 2013 Oct;7(4):387-91. doi: 10.4103/1658-354X.121045. PMID: 24348288; PMCID: PMC3858687. |
Included in SR Hung |
|
Ziemann-Gimmel P, Goldfarb AA, Koppman J, Marema RT. Opioid-free total intravenous anaesthesia reduces postoperative nausea and vomiting in bariatric surgery beyond triple prophylaxis. Br J Anaesth. 2014 May;112(5):906-11. doi: 10.1093/bja/aet551. Epub 2014 Feb 18. PMID: 24554545. |
Included in SR Hung |
|
Ruzzon A, Nassif PAN, Prigol L, Buzo L, Wendler G, Wendler E, Wendler IBT, Ruzzon I, Goveia CHM, Gonçalves LAP. ROUX-IN-Y GASTROJEJUNAL BYPASS: WHICH ANESTHETIC TECHNIQUE HAS BEST RESULTS? Arq Bras Cir Dig. 2021 May 14;34(1):e1530. doi: 10.1590/0102-672020200002e1530. PMID: 34008703; PMCID: PMC8121063. |
Wrong intervention |
|
El Sherif FA, Othman AH, Abd El-Rahman AM, Taha O. Effect of adding intrathecal morphine to a multimodal analgesic regimen for postoperative pain management after laparoscopic bariatric surgery: a prospective, double-blind, randomized controlled trial. Br J Pain. 2016 Nov;10(4):209-216. doi: 10.1177/2049463716668904. Epub 2016 Sep 15. PMID: 27867510; PMCID: PMC5102100. |
Wrong intervention |
|
Mehta SD, Smyth D, Vasilopoulos T, Friedman J, Sappenfield JW, Alex G. Ketamine infusion reduces narcotic requirements following gastric bypass surgery: a randomized controlled trial. Surg Obes Relat Dis. 2021 Apr;17(4):737-743. doi: 10.1016/j.soard.2020.11.027. Epub 2020 Dec 1. PMID: 33451962. |
Wrong intervention (opioid sparing) |
|
Zeeni C, Aouad MT, Daou D, Naji S, Jabbour-Khoury S, Alami RS, Safadi BY, Siddik-Sayyid SM. The Effect of Intraoperative Dexmedetomidine Versus Morphine on Postoperative Morphine Requirements After Laparoscopic Bariatric Surgery. Obes Surg. 2019 Dec;29(12):3800-3808. doi: 10.1007/s11695-019-04074-1. PMID: 31286397. |
In SR Zhang |
|
Zotou A, Siampalioti A, Tagari P, Paridis L, Kalfarentzos F, Filos KS. Does epidural morphine loading in addition to thoracic epidural analgesia benefit the postoperative management of morbidly obese patients undergoing open bariatric surgery? A pilot study. Obes Surg. 2014 Dec;24(12):2099-108. doi: 10.1007/s11695-014-1305-z. PMID: 24913242. |
Wrong intervention |
|
Mahrose R, Elgharabawy W. Role of intraoperative betablocker for morbid obese patients undergoing laparoscopic bariatric surgery. Sri Lankan Journal of Anaesthesiology. 2020 Jun 27;28(2):86-93. |
Wrong intervention |
|
Hung KC, Wu SC, Chang PC, Chen IW, Hsing CH, Lin CM, Chen JY, Chu CC, Sun CK. Impact of Intraoperative Ketamine on Postoperative Analgesic Requirement Following Bariatric Surgery: a Meta-analysis of Randomized Controlled Trials. Obes Surg. 2021 Dec;31(12):5446-5457. doi: 10.1007/s11695-021-05753-8. Epub 2021 Oct 13. PMID: 34647233. |
Studies overlap with Hung 2022 |
|
Cabrera Schulmeyer MC, de la Maza J, Ovalle C, Farias C, Vives I. Analgesic effects of a single preoperative dose of pregabalin after laparoscopic sleeve gastrectomy. Obes Surg. 2010 Dec;20(12):1678-81. doi: 10.1007/s11695-009-9944-1. Epub 2009 Aug 29. PMID: 19727980. |
Wrong intervention |
|
Albrecht E, Kirkham KR, Endersby RV, Chan VW, Jackson T, Okrainec A, Penner T, Jin R, Brull R. Ultrasound-guided transversus abdominis plane (TAP) block for laparoscopic gastric-bypass surgery: a prospective randomized controlled double-blinded trial. Obes Surg. 2013 Aug;23(8):1309-14. doi: 10.1007/s11695-013-0958-3. PMID: 23591549. |
Wrong intervention |
|
Kizilcik N, Koner O. Magnesium Sulfate Reduced Opioid Consumption in Obese Patients Undergoing Sleeve Gastrectomy: a Prospective, Randomized Clinical Trial. Obes Surg. 2018 Sep;28(9):2783-2788. doi: 10.1007/s11695-018-3243-7. PMID: 29754384. |
Wrong intervention |
|
Emile SH, Abdel-Razik MA, Elbahrawy K, Elshobaky A, Shalaby M, Elbaz SA, Gado WA, Elbanna HG. Impact of Ultrasound-Guided Transversus Abdominis Plane Block on Postoperative Pain and Early Outcome After Laparoscopic Bariatric Surgery: a Randomized Double-Blinded Controlled Trial. Obes Surg. 2019 May;29(5):1534-1541. doi: 10.1007/s11695-019-03720-y. PMID: 30706309. |
Wrong intervention |
|
Omar I, Abualsel A. Efficacy of Intraperitoneal Instillation of Bupivacaine after Bariatric Surgery: Randomized Controlled Trial. Obes Surg. 2019 Jun;29(6):1735-1741. doi: 10.1007/s11695-019-03775-x. PMID: 30790163. |
Wrong intervention |
|
Singh PM, Panwar R, Borle A, Mulier JP, Sinha A, Goudra B. Perioperative analgesic profile of dexmedetomidine infusions in morbidly obese undergoing bariatric surgery: a meta-analysis and trial sequential analysis. Surg Obes Relat Dis. 2017 Aug;13(8):1434-1446. doi: 10.1016/j.soard.2017.02.025. Epub 2017 Mar 10. PMID: 28396128. |
Overlaps with Zhang 2022 |
|
Jabbour H, Jabbour K, Abi Lutfallah A, Abou Zeid H, Nasser-Ayoub E, Abou Haidar M, Naccache N. Magnesium and Ketamine Reduce Early Morphine Consumption After Open Bariatric Surgery: a Prospective Randomized Double-Blind Study. Obes Surg. 2020 Apr;30(4):1452-1458. doi: 10.1007/s11695-019-04317-1. PMID: 31838622. |
In SR Hung 2021 |
|
Sakata RK, de Lima RC, Valadão JA, Leal PC, Moura EC, Cruz VP, de Oliveira CM. Randomized, Double-Blind Study of the Effect of Intraoperative Intravenous Lidocaine on the Opioid Consumption and Criteria for Hospital Discharge After Bariatric Surgery. Obes Surg. 2020 Apr;30(4):1189-1193. doi: 10.1007/s11695-019-04340-2. PMID: 31858394. |
Wrong intervention |
|
Kaur R, Seal A, Lemech I, Fisher OM, Williams N. Intraperitoneal Instillation of Local Anesthetic (IPILA) in Bariatric Surgery and the Effect on Post-operative Pain Scores: a Randomized Control Trial. Obes Surg. 2022 Jul;32(7):2349-2356. doi: 10.1007/s11695-022-06086-w. Epub 2022 May 4. PMID: 35508748; PMCID: PMC9276555. |
Wrong intervention |
|
Xue Q, Chu Z, Zhu J, Zhang X, Chen H, Liu W, Jia B, Zhang Y, Wang Y, Huang C, Hu X. Analgesic Efficacy of Transverse Abdominis Plane Block and Quadratus Lumborum Block in Laparoscopic Sleeve Gastrectomy: A Randomized Double-Blinded Clinical Trial. Pain Ther. 2022 Jun;11(2):613-626. doi: 10.1007/s40122-022-00373-1. Epub 2022 Mar 21. PMID: 35312948; PMCID: PMC9098772. |
Wrong intervention |
|
Ibrahim M, El Shamaa H. Efficacy of ultrasound-guided oblique subcostal transversus abdominis plane block after laparoscopic sleeve gastrectomy: A double blind, randomized, placebo controlled study. Egyptian Journal of Anaesthesia. 2014 Jul 1;30(3):285-92. |
Wrong intervention |
|
Salama AK, Abdallah NM. Multimodal analgesia with pregabalin and dexmedetomidine in morbidly obese patients undergoing laparoscopic sleeve gastrectomy: a prospective randomized double blind placebo controlled study. Egyptian Journal of Anaesthesia. 2016 Jul 1;32(3):293-8. |
Wrong intervention |
|
Safari S, Rokhtabnak F, Djalali Motlagh S, Ghanbari Garkani M, Pournajafian A. Effect of intraperitoneal bupivacaine on postoperative pain in laparoscopic bariatric surgeries. Surg Obes Relat Dis. 2020 Feb;16(2):299-305. doi: 10.1016/j.soard.2019.10.028. Epub 2019 Nov 7. PMID: 31836291. |
Wrong intervention |
|
Hasanein R, El-Sayed W, Nabil N, Elsayed G. The effect of combined remifentanil and low dose ketamine infusion in patients undergoing laparoscopic gastric bypass. Egyptian Journal of Anaesthesia. 2011 Oct 1;27(4):255-60. |
Wrong intervention |
|
Plass F, Nicolle C, Zamparini M, Al Issa G, Fiant AL, Le Roux Y, Gérard JL, Fischer MO, Alvès A, Hanouz JL. Effect of intra-operative intravenous lidocaine on opioid consumption after bariatric surgery: a prospective, randomised, blinded, placebo-controlled study. Anaesthesia. 2021 Feb;76(2):189-198. doi: 10.1111/anae.15150. Epub 2020 Jun 21. PMID: 32564365. |
Wrong intervention |
|
Mostafa SF, Abdelghany MS, Abu Elyazed MM. Ultrasound-Guided Erector Spinae Plane Block in Patients Undergoing Laparoscopic Bariatric Surgery: A Prospective Randomized Controlled Trial. Pain Pract. 2021 Apr;21(4):445-453. doi: 10.1111/papr.12975. Epub 2021 Jan 22. PMID: 33295128. |
Wrong intervention |
|
Seman MT, Malan SH, Buras MR, Butterfield RJ, Harold KL, Madura JA, Rosenfeld DM, Gorlin AW. Low-Dose Ketamine Infusion for Perioperative Pain Management in Patients Undergoing Laparoscopic Gastric Bypass: A Prospective Randomized Controlled Trial. Anesthesiol Res Pract. 2021 Jul 21;2021:5520517. doi: 10.1155/2021/5520517. PMID: 34335740; PMCID: PMC8321702. |
Wrong intervention |
|
Jarrar A, Eipe N, Wu R, Neville A, Yelle JD, Mamazza J. Effect of intraperitoneal local anesthesia on enhanced recovery outcomes after bariatric surgery: a randomized controlled pilot study. Can J Surg. 2021 Nov 10;64(6):E603-E608. doi: 10.1503/cjs.017719. PMID: 34759045; PMCID: PMC8592778. |
Wrong intervention |
|
Sun J, Wang S, Wang J, Gao X, Wang G. Effect of Intravenous Infusion of Lidocaine Compared with Ultrasound-Guided Transverse Abdominal Plane Block on the Quality of Postoperative Recovery in Patients Undergoing Laparoscopic Bariatric Surgery. Drug Des Devel Ther. 2022 Mar 21;16:739-748. doi: 10.2147/DDDT.S356880. PMID: 35340337; PMCID: PMC8956249. |
Wrong comparator |
|
Martins MJ, Martins CPMO, Castro-Alves LJ, Jesus GN, Campos GO, Sacramento BBC, Borges LF, Mello CAB, Alves RL, Módolo NSP. Pregabalin to improve postoperative recovery in bariatric surgery: a parallel, randomized, double-blinded, placebo-controlled study. J Pain Res. 2018 Oct 17;11:2407-2415. doi: 10.2147/JPR.S176468. PMID: 30425554; PMCID: PMC6200430. |
Wrong intervention |
|
Kasputytė G, Karbonskienė A, Macas A, Maleckas A. Role of Ketamine in Multimodal Analgesia Protocol for Bariatric Surgery. Medicina (Kaunas). 2020 Feb 26;56(3):96. doi: 10.3390/medicina56030096. PMID: 32110882; PMCID: PMC7142478. |
Wrong intervention |
|
Boerboom SL, de Haes A, Vd Wetering L, Aarts EO, Janssen IMC, Geurts JW, Kamphuis ET. Preperitoneal Bupivacaine Infiltration Reduces Postoperative Opioid Consumption, Acute Pain, and Chronic Postsurgical Pain After Bariatric Surgery: a Randomized Controlled Trial. Obes Surg. 2018 Oct;28(10):3102-3110. doi: 10.1007/s11695-018-3341-6. PMID: 29926357. |
Wrong intervention |
|
Tülübaş EK, Seyit H, Bostancı İ, Demir G, Köşük H, Şeker YT, Peker KD, Alış H. Laparoscopic transversus abdominal plane block is effective in multimodal analgesia for laparoscopic sleeve gastrectomy. Bakirkoy Tip Dergisi. 2019 Sep 1;15(3):198. |
Wrong intervention |
|
Aldohayan A, Alshammari S, Binjaloud A, Bamehriz F, Narejo AS, Aqil M, Aldahian N, Aldabaeab A, Eldawlatly A. Pre-incisional Laparoscopic Preperitoneal Local Anesthetic Technique in Laparoscopic Sleeve Gastrectomy. JSLS. 2022 Jul-Sep;26(3):e2022.00049. doi: 10.4293/JSLS.2022.00049. PMID: 36071990; PMCID: PMC9439284. |
Wrong intervention |
|
Hassani V, Pazouki A, Nikoubakht N, Chaichian S, Sayarifard A, Shakib Khankandi A. The effect of gabapentin on reducing pain after laparoscopic gastric bypass surgery in patients with morbid obesity: a randomized clinical trial. Anesth Pain Med. 2015 Feb 1;5(1):e22372. doi: 10.5812/aapm.22372. PMID: 25789237; PMCID: PMC4350186. |
Wrong intervention |
|
Rupniewska-Ladyko A, Malec-Milewska M, Kraszewska E, Pirozynski M. Gabapentin before laparoscopic sleeve gastrectomy reduces postoperative oxycodone consumption in obese patients: a randomized double-blind placebo-controlled trial. Minerva Anestesiol. 2018 May;84(5):565-571. doi: 10.23736/S0375-9393.17.12194-2. Epub 2017 Nov 6. PMID: 29108405. |
Wrong intervention |
|
Khan MU, Bamehriz FY, Aqil M, Dammas FA, Fadin A, Khokhar RS. The Effect of Gabapentin on Postoperative Pain, Morphine Sparing Effect and Preoperative Anxiety in Patients Going for Sleeve Gastrectomy Surgical Procedure. J Coll Physicians Surg Pak. 2019 Aug;29(8):697-701. doi: 10.29271/jcpsp.2019.08.697. PMID: 31358085. |
Wrong intervention |
|
Abu-Halaweh S, Obeidat F, Absalom AR, AlOweidi A, Abeeleh MA, Qudaisat I, Robinson F, Mason KP. Dexmedetomidine versus morphine infusion following laparoscopic bariatric surgery: effect on supplemental narcotic requirement during the first 24 h. Surg Endosc. 2016 Aug;30(8):3368-74. doi: 10.1007/s00464-015-4614-y. Epub 2015 Nov 5. PMID: 26541738. |
Wrong intervention |
|
Said AM, Balamoun HA. Continuous Transversus Abdominis Plane Blocks via Laparoscopically Placed Catheters for Bariatric Surgery. Obes Surg. 2017 Oct;27(10):2575-2582. doi: 10.1007/s11695-017-2667-9. PMID: 28389846. |
Wrong intervention |
|
Sharma M, Mehta Y, Sawhney R, Vats M, Trehan N. Thoracic epidural analgesia in obese patients with body mass index of more than 30 kg/m2 for off pump coronary artery bypass surgery. Ann Card Anaesth. 2010 Jan-Apr;13(1):28-33. doi: 10.4103/0971-9784.58831. PMID: 20075532. |
Wrong intervention |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 15-04-2025
Beoordeeld op geldigheid : 09-04-2025
Algemene gegevens
De ontwikkeling van deze richtlijn werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2022 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de anesthesiologische zorg voor patiënten met obesitas.
Werkgroep
Dr. T.A. Brouwer, anesthesioloog, NVA
Drs. M.A.M. Siepel, anesthesioloog, NVA
Drs. A.D. Pot, anesthesioloog, NVA
Drs. S.D.X. Oei, AIOS anesthesiologie, NVA (vanaf september 2022)
Dr. B. Torensma, PhD, anesthesiemedewerker, NVAM
Drs. J.A. Apers, chirurg, NVvH
Dr. L. Freeman, gynaecoloog, NVOG (tot oktober 2022)
Dr. D.D.C.A. Henriquez, gynaecoloog, NVOG (vanaf oktober 2022)
Prof. dr. C. A. J. Knibbe, ziekenhuisapotheker, NVZA
Drs. M.A. Damhof, ziekenhuisapotheker, NVZA (vanaf december 2023)
Dr. H.J. Reesink, longarts, NVALT
Drs. H.L. Lutgers, internist-endocrinoloog, NIV (vanaf april 2023)
N.G. Cnossen, patiëntvertegenwoordiger, Nederlandse Stichting Over Gewicht
Klankbordgroep
Dr. M. Klemt-Kropp, MDL-arts, NVMDL
Drs. Ö. Engin, oogarts, NOG
Dr. H. Buter, internist-intensivist, NVIC
N.J.C. Raeijmaekers, BSc, diëtist, NVD/NDBC
Met ondersteuning van
Drs. I. van Dusseldorp, literatuurspecialist, Kennisinstituut van de Federatie van Medisch Specialisten
Dr. J.C. Maas, adviseur, Kennisinstituut van de Federatie van Medisch Specialisten
Drs. I. van Dijk, adviseur, Kennisinstituut van de Federatie van Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Tammo Brouwer (voorzitter) |
Anesthesioloog, vrij ondernemer. |
Geen |
Geen |
Geen restricties |
|
Alice Dorien Pot |
Anesthesioloog in Meander Medisch Centrum Amersfoort |
Co-auteur boek 'klinische kinderanesthesiologie in de praktijk', initiatief vanuit NVA, uitgeverij Prelum (onbetaald). |
Geen |
Geen restricties |
|
Bart Torensma |
Klinisch epidemioloog en data scientist via eigen bedrijf Torensma Research Consultancy BV. |
"Dagelijks bestuurslid (penningmeester) Stichting COREON Algemeen bestuurslid Vereniging voor epidemiologen. Lesgeven aan de research verpleegkundige Breederode hogeschool Rotterdam
Masterclass gemaakt samen met Medtronic AUE over ERABS en team samenwerkingen." |
Voor PhD (<3 jaar geleden) onderzoek gedaan naar deep block verslapping bij patiënten met obesitas. Deze studie is destijds door MSD gesponsord in de vorm van gratis ampullen sugammadex.
|
Geen restricties |
|
Catherijne A.J. Knibbe |
Ziekenhuisapotheker-klinisch farmacoloog, St. Antonius ziekenhuis Nieuwegein en Utrecht, afdeling Klinische farmacie |
Lid CCMO, Lid Board ACCP |
Diverse studies gefinancierd door ZonMw of Antonius Onderzoeksfonds. De onderzoeken zijn niet gerelateerd aan de richtlijn. |
Geen restricties |
|
Dacia Henriquez |
Gynaecoloog, Amphia Ziekenhuis |
Geen |
Geen |
Geen restricties |
|
Helen Lutgers |
Internist in Ommelander Ziekenhuis Groningen |
Geen |
Geen |
Geen restricties |
|
Herre Reesink |
Longarts, OLVG Amsterdam |
Geen |
Geen |
Geen restricties |
|
Jan Apers |
Chirurg Franciscus Gasthuis & Vlietland |
NVGIC bestuur Dutch Obesity Academy |
Geen |
Geen restricties |
|
Liv Freeman |
Gynaecoloog Ikazia Ziekenhuis Rotterdam |
Voorzitter samenwerking obstetrie anesthesie (onbetaald)
|
Geen |
Geen restricties |
|
Michiel Damhof
|
Ziekenhuisapotheker Medisch Centrum Leeuwarden |
Geen |
Geen |
Geen restricties |
|
Muriel Arianne Michelle Siepel |
Anesthesioloog OLVG Amsterdam |
Geen |
Geen |
Geen restricties |
|
Nienke Cnossen |
Patiëntvertegenwoordiger |
Geen |
Geen |
Geen restricties |
|
Sander Oei |
Aios anesthesiologie. ErasmusMC |
SITdiensten Park Medisch Centrum, betaald. 1-2x/mnd ANWdiensten verpleeghuizen, betaald. 1x/mnd |
Geen |
Geen restricties |
|
Hanneke Buter |
Intensivist |
bestuurslid NVIC |
Geen |
Geen restricties |
|
Michael Klemt-Kropp |
MDL-arts |
Geen |
Geen |
Geen restricties |
|
Natascha Raeijmaekers |
Diëtist Obesitas Centrum, ETZ. Betaald. |
Bestuur Netwerk Diëtisten Bariatrische chirurgie, onbetaald. |
Geen |
Geen restricties |
|
Ozlem Engin |
Oogarts |
Geen |
Geen |
Geen restricties |
|
Irma van Dijk |
Adviseur kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen restricties |
|
José Maas |
Adviseur kennisinstituut van de Federatie Medisch specialisten |
Geen |
Geen |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van een afvaardiging van de Nederlandse ‘Stichting ‘Overgewicht’ in de werkgroep. Het verslag van de knelpunteninventarisatie [zie aanverwante producten] is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Stichting en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijn op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Module |
Uitkomst raming |
Toelichting |
|
Module Opioïdvrije anesthesie – peroperatief |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de anesthesiologische zorg voor patiënten met obesitas. Tevens zijn er knelpunten aangedragen door relevante partijen via een schriftelijke knelpunteninventarisatie. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effect model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Literature search strategy
|
Uitgangsvraag: Wat is de plaats van opioïde sparende anesthesie bij patiënten met obesitas die een chirurgische ingreep ondergaan onder algehele anesthesie |
|
|
Database(s): Ovid/Medline, Embase |
Datum: 9-1-2023 |
|
Periode: 2010 |
Talen: nvt |
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
134 |
42 |
137 |
|
RCTs |
486 |
134 |
515 |
|
Observationele studies |
464 |
188 |
468 |
|
Overig |
|
|
|
|
Totaal |
|
|
1.120 |
Zoekstrategie
Embase
|
No. |
Query |
Results |
|
#24 |
#7 AND #23 4 sleutelartikelen niet gevonden |
2 |
|
#23 |
#18 OR #19 OR #20 |
1084 |
|
#22 |
#20 NOT #19 NOT #18 OBS |
464 |
|
#21 |
#19 NOT #18 Clinical trials, RCT |
486 |
|
#20 |
#13 AND (#16 OR #17) |
971 |
|
#19 |
#13 AND #15 |
534 |
|
#18 |
#13 AND #14 SR |
134 |
|
#17 |
'case control study'/de OR 'comparative study'/exp OR 'control group'/de OR 'controlled study'/de OR 'controlled clinical trial'/de OR 'crossover procedure'/de OR 'double blind procedure'/de OR 'phase 2 clinical trial'/de OR 'phase 3 clinical trial'/de OR 'phase 4 clinical trial'/de OR 'pretest posttest design'/de OR 'pretest posttest control group design'/de OR 'quasi experimental study'/de OR 'single blind procedure'/de OR 'triple blind procedure'/de OR (((control OR controlled) NEAR/6 trial):ti,ab,kw) OR (((control OR controlled) NEAR/6 (study OR studies)):ti,ab,kw) OR (((control OR controlled) NEAR/1 active):ti,ab,kw) OR 'open label*':ti,ab,kw OR (((double OR two OR three OR multi OR trial) NEAR/1 (arm OR arms)):ti,ab,kw) OR ((allocat* NEAR/10 (arm OR arms)):ti,ab,kw) OR placebo*:ti,ab,kw OR 'sham-control*':ti,ab,kw OR (((single OR double OR triple OR assessor) NEAR/1 (blind* OR masked)):ti,ab,kw) OR nonrandom*:ti,ab,kw OR 'non-random*':ti,ab,kw OR 'quasi-experiment*':ti,ab,kw OR crossover:ti,ab,kw OR 'cross over':ti,ab,kw OR 'parallel group*':ti,ab,kw OR 'factorial trial':ti,ab,kw OR ((phase NEAR/5 (study OR trial)):ti,ab,kw) OR ((case* NEAR/6 (matched OR control*)):ti,ab,kw) OR ((match* NEAR/6 (pair OR pairs OR cohort* OR control* OR group* OR healthy OR age OR sex OR gender OR patient* OR subject* OR participant*)):ti,ab,kw) OR ((propensity NEAR/6 (scor* OR match*)):ti,ab,kw) OR versus:ti OR vs:ti OR compar*:ti OR ((compar* NEAR/1 study):ti,ab,kw) OR (('major clinical study'/de OR 'clinical study'/de OR 'cohort analysis'/de OR 'observational study'/de OR 'cross-sectional study'/de OR 'multicenter study'/de OR 'correlational study'/de OR 'follow up'/de OR cohort*:ti,ab,kw OR 'follow up':ti,ab,kw OR followup:ti,ab,kw OR longitudinal*:ti,ab,kw OR prospective*:ti,ab,kw OR retrospective*:ti,ab,kw OR observational*:ti,ab,kw OR 'cross sectional*':ti,ab,kw OR cross?ectional*:ti,ab,kw OR multicent*:ti,ab,kw OR 'multi-cent*':ti,ab,kw OR consecutive*:ti,ab,kw) AND (group:ti,ab,kw OR groups:ti,ab,kw OR subgroup*:ti,ab,kw OR versus:ti,ab,kw OR vs:ti,ab,kw OR compar*:ti,ab,kw OR 'odds ratio*':ab OR 'relative odds':ab OR 'risk ratio*':ab OR 'relative risk*':ab OR 'rate ratio':ab OR aor:ab OR arr:ab OR rrr:ab OR ((('or' OR 'rr') NEAR/6 ci):ab))) |
13755893 |
|
#16 |
'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'comparative study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
6767914 |
|
#15 |
random*:ti,ab OR (((pragmatic OR practical) NEAR/1 'clinical trial*'):ti,ab) OR ((('non inferiority' OR noninferiority OR superiority OR equivalence) NEAR/3 trial*):ti,ab) OR rct:ti,ab,kw OR 'clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti |
3703903 |
|
#14 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
733409 |
|
#13 |
#12 NOT (('adolescent'/exp OR 'child'/exp OR adolescent*:ti,ab,kw OR child*:ti,ab,kw OR schoolchild*:ti,ab,kw OR infant*:ti,ab,kw OR girl*:ti,ab,kw OR boy*:ti,ab,kw OR teen:ti,ab,kw OR teens:ti,ab,kw OR teenager*:ti,ab,kw OR youth*:ti,ab,kw OR pediatr*:ti,ab,kw OR paediatr*:ti,ab,kw OR puber*:ti,ab,kw) NOT ('adult'/exp OR 'aged'/exp OR 'middle aged'/exp OR adult*:ti,ab,kw OR man:ti,ab,kw OR men:ti,ab,kw OR woman:ti,ab,kw OR women:ti,ab,kw)) |
1651 |
|
#12 |
#11 AND [1-1-2010]/sd NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
1651 |
|
#11 |
#8 AND #9 AND #10 |
3669 |
|
#10 |
'anesthesia'/exp OR 'anesthetic agent'/exp OR (((general OR inhalat* OR rectal) NEAR/3 (anesthe* OR anesthe*)):ti,ab,kw) OR 'surgery'/exp OR 'surgical patient'/exp OR 'surgical risk'/exp OR 'perioperative period'/exp OR 'surgery'/lnk OR surgic*:ti,ab,kw OR surger*:ti,ab,kw OR operation*:ti,ab,kw OR operative:ti,ab,kw OR presurg*:ti,ab,kw OR preoperati*:ti,ab,kw OR 'pre-surg*':ti,ab,kw OR 'pre-operati*':ti,ab,kw OR perisurg*:ti,ab,kw OR perioperati*:ti,ab,kw OR 'peri-surg*':ti,ab,kw OR 'peri-operati*':ti,ab,kw OR postsurg*:ti,ab,kw OR postoperati*:ti,ab,kw OR 'post-surg*':ti,ab,kw OR 'post-operati*':ti,ab,kw |
8012174 |
|
#9 |
'opiate'/exp OR 'opiate agonist'/exp OR opiate*:ti,ab,kw OR opioid*:ti,ab,kw OR nonopioid*:ti,ab,kw OR nonopiat*:ti,ab,kw |
535189 |
|
#8 |
'obesity'/exp/mj OR obes*:ti,ab,kw OR obesit*:ti,ab,kw OR overweight*:ti,ab,kw OR 'over weight*':ti,ab,kw OR 'adipositas':ti,ab,kw OR 'adiposity':ti,ab,kw OR 'excess body weight':ti,ab,kw OR 'corpulen*':ti,ab,kw OR 'fat overload syndrome':ti,ab,kw OR 'increased bmi':ti,ab,kw OR bariatr*:ti,ab,kw |
661935 |
|
#7 |
(#1 OR #2 OR #3 OR #4 OR #5 OR #6) NOT letter:ti sleutelartikelen |
6 |
|
#6 |
'effect of intravenous paracetamol on postoperative morphine requirements in neonates and infants undergoing major noncardiac surgery: a randomized controlled trial' |
1 |
|
#5 |
'comparison of opioid-based and opioid-free tiva for laparoscopic urological procedures in obese patients' |
1 |
|
#4 |
'balanced opioid-free anesthesia with dexmedetomidine versus balanced anesthesia with remifentanil for major or intermediate noncardiac surgery' |
1 |
|
#3 |
'impact of opioid-free anesthesia on complications after deep inferior epigastric perforator flap surgery:' |
2 |
|
#2 |
'opioid-free general anesthesia, a new paradigm' |
1 |
|
#1 |
'opioid-free total intravenous anaesthesia reduces postoperative nausea and vomiting in bariatric surgery beyond triple prophylaxis.' |
1 |
Ovid/Medline
|
# |
Searches |
Results |
|
15 |
13 not 12 not 11 OBS |
188 |
|
14 |
12 not 11 Clinical trials, RCT |
134 |
|
13 |
6 and (8 or 9) |
348 |
|
12 |
6 and 8 |
156 |
|
11 |
6 and 7 SR |
42 |
|
10 |
Case-control Studies/ or clinical trial, phase ii/ or clinical trial, phase iii/ or clinical trial, phase iv/ or comparative study/ or control groups/ or controlled before-after studies/ or controlled clinical trial/ or double-blind method/ or historically controlled study/ or matched-pair analysis/ or single-blind method/ or (((control or controlled) adj6 (study or studies or trial)) or (compar* adj (study or studies)) or ((control or controlled) adj1 active) or "open label*" or ((double or two or three or multi or trial) adj (arm or arms)) or (allocat* adj10 (arm or arms)) or placebo* or "sham-control*" or ((single or double or triple or assessor) adj1 (blind* or masked)) or nonrandom* or "non-random*" or "quasi-experiment*" or "parallel group*" or "factorial trial" or "pretest posttest" or (phase adj5 (study or trial)) or (case* adj6 (matched or control*)) or (match* adj6 (pair or pairs or cohort* or control* or group* or healthy or age or sex or gender or patient* or subject* or participant*)) or (propensity adj6 (scor* or match*))).ti,ab,kf. or (confounding adj6 adjust*).ti,ab. or (versus or vs or compar*).ti. or ((exp cohort studies/ or epidemiologic studies/ or multicenter study/ or observational study/ or seroepidemiologic studies/ or (cohort* or 'follow up' or followup or longitudinal* or prospective* or retrospective* or observational* or multicent* or 'multi-cent*' or consecutive*).ti,ab,kf.) and ((group or groups or subgroup* or versus or vs or compar*).ti,ab,kf. or ('odds ratio*' or 'relative odds' or 'risk ratio*' or 'relative risk*' or aor or arr or rrr).ab. or (("OR" or "RR") adj6 CI).ab.)) |
5324402 |
|
9 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or cohort.tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] |
4330206 |
|
8 |
exp randomized controlled trial/ or randomized controlled trials as topic/ or random*.ti,ab. or rct?.ti,ab. or ((pragmatic or practical) adj "clinical trial*").ti,ab,kf. or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab,kf. or exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw. |
2544783 |
|
7 |
meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. |
639972 |
|
6 |
5 not ((Adolescent/ or Child/ or Infant/ or adolescen*.ti,ab,kf. or child*.ti,ab,kf. or schoolchild*.ti,ab,kf. or infant*.ti,ab,kf. or girl*.ti,ab,kf. or boy*.ti,ab,kf. or teen.ti,ab,kf. or teens.ti,ab,kf. or teenager*.ti,ab,kf. or youth*.ti,ab,kf. or pediatr*.ti,ab,kf. or paediatr*.ti,ab,kf. or puber*.ti,ab,kf.) not (Adult/ or adult*.ti,ab,kf. or man.ti,ab,kf. or men.ti,ab,kf. or woman.ti,ab,kf. or women.ti,ab,kf.)) |
547 |
|
5 |
limit 4 to yr="2010 -Current" |
574 |
|
4 |
1 and 2 and 3 |
784 |
|
3 |
Anesthetics/ or Anesthetics, Combined/ or Anesthetics, General/ or anesthe*.ti,ab,kf. or anaesthe*.ti,ab,kf. or Anesthesia/ or Anesthesia, Conduction/ or Anesthesia, General/ or Anesthesia, Intravenous/ or Anesthesia, Obstetrical/ or Anesthesia, Cardiac Procedures/ or exp Surgical Procedures, Operative/ or exp Specialties, Surgical/ or su.fs. or exp Perioperative Period/ or surgic*.ti,ab,kf. or surger*.ti,ab,kf. or operation*.ti,ab,kf. or operative.ti,ab,kf. or presurg*.ti,ab,kf. or preoperati*.ti,ab,kf. or pre-surg*.ti,ab,kf. or pre-operati*.ti,ab,kf. or perisurg*.ti,ab,kf. or perioperati*.ti,ab,kf. or peri-surg*.ti,ab,kf. or peri-operati*.ti,ab,kf. or postsurg*.ti,ab,kf. or postoperati*.ti,ab,kf. or post-surg*.ti,ab,kf. or post-operati*.ti,ab,kf. or nonsurg*.ti,ab,kf. or nonoperatic*.ti,ab,kf. or non-surg*.ti,ab,kf. or non-operati*.ti,ab,kf. or laparoscop*.ti,ab,kf. |
5658160 |
|
2 |
exp Analgesics, Opioid/ or exp Opiate Alkaloids/ or opiate*.ti,ab,kf. or opioid*.ti,ab,kf. or nonopioid*.ti,ab,kf. or nonopiat*.ti,ab,kf. |
217733 |
|
1 |
exp Obesity/ or obese*.ti,ab,kf. or obesit*.ti,ab,kf. or overweight*.ti,ab,kf. or 'over weight*'.ti,ab,kf. |
437780 |