BIS-Monitoring
Uitgangsvraag
Wat is de plaats van BIS-monitoring tijdens de operatie bij patiënten met obesitas die een chirurgische ingreep ondergaan onder algehele anesthesie?
Aanbeveling
Overweeg BIS-monitoring toe te passen om intra-operatieve bewustwording te voorkomen bij patiënten met obesitas die een operatie ondergaan onder algehele anesthesie met TIVA.
Overweeg BIS-monitoring toe te passen om de anesthesiediepte te titreren en daarmee het verbruik van anesthetica te minderen en daarmee te besparen op kosten en materiaal.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Gebruik van BIS-monitoring in patiënten met obesitas die een chirurgische ingreep ondergaan
De werkgroep heeft een literatuuronderzoek verricht naar het effect van wel of geen BIS-bewaking tijdens anesthesie bij chirurgische patiënten met obesitas. Hier werden drie artikelen gevonden die voldeden aan de PICO.
In deze studies was de cruciale uitkomstmaat een door de patiënt gerapporteerde awareness. Deze uitkomstmaat werd gerapporteerd door twee van de drie geïncludeerde studies. De bewijskracht over het effect van het toepassen van BIS-monitoring op het voorkomen van awareness is zeer laag. Dat komt mede door gebrek aan informatie over de allocatie en het ontbreken van een duidelijk studieprotocol. Daarnaast betrof het veelal kleine steekproefaantallen. Er konden dan ook geen conclusies getrokken worden over het effect van BIS-monitoring op de door de patiënt gerapporteerde awareness. Er bestaat hier een kennislacune.
De (belangrijke) uitkomstmaten mortaliteit en cardiovasculaire complicaties werden niet gerapporteerd in de geïncludeerde studies. Verblijfsduur op de uitslaapkamer werd in één studie gerapporteerd en tijd tot extubatie werd in alle drie de geïncludeerde studies gerapporteerd. De bewijskracht voor de uitkomstmaat verblijfsduur op de uitslaapkamer is zeer laag, waardoor er geen conclusies getrokken konden worden over het effect van BIS-monitoring. Voor deze uitkomstmaat is afgewaardeerd vanwege het gebrek aan informatie over de allocatie, het ontbreken van een studieprotocol en de brede betrouwbaarheidsintervallen. Voor de uitkomstmaat tijd tot extubatie leidt BIS-monitoring waarschijnlijk niet tot een verschil in uitkomst. De bewijskracht hiervoor is redelijk. Er is afgewaardeerd vanwege een risico op bias in verband met een gebrek aan informatie over de allocatie en het ontbreken van een gerapporteerd studieprotocol.
Literatuur over BIS-monitoring in algemene chirurgische populaties
In de algemene chirurgische populatie zijn vele studies gepubliceerd aangaande BIS-bewaking en het voorkomen van awareness.
Twee belangrijke studies zijn verschenen waar wel of niet gebruik werd gemaakt van BIS-bewaking: de B-AWARE Trial en B-UNAWARE Trial (Myles, 2004; Avidan, 2008). In de B-AWARE Trial werd BIS-geleide anesthesie vergeleken met routinematige zorg zonder BIS-bewaking. BIS-geleide anesthesie vermindert het risico op bewustwording met 82%: 2 van de 1225 van de hoog-risicopatiënten met BIS bewaking die een awareness door maakten ten opzichte van 11 van de 1238 waarbij geen gebruik werd gemaakt van BIS-bewaking. De kosten om één geval van bewustwording bij hoog-risico-patiënten te voorkomen bedroegen ongeveer $2.200. De effectiviteit en kostenefficiëntie van BIS-monitoring kunnen variëren afhankelijk van de specifieke anesthesie protocollen en risicoprofielen van de patiënt.
De B-UNAWARE Trial (Avidan, 2008) richtte zich op onbedoelde intra-operatieve bewustwording met expliciete herinnering (AWR). De B-UNAWARE Trial kon de resultaten van de B-AWARE trial niet herhalen. Mogelijkerwijs kwam dit doordat er enkel inhalatie-anesthetica werden toegediend ten opzichte van de groep patiënten die TIVA kreeg in de B-AWARE trial (40%). Er werd een lagere incidentie van awareness gevonden tijdens BIS-monitoring. Gelijktijdig vonden zij geen associatie met een verminderde toediening van inhalatie-anesthetica. Awareness trad zelfs op wanneer de BIS-waarden en de end-tidal anesthetic gas-concentraties binnen het doelbereik lagen (BIS-waarden 40 tot 60). De bevindingen van de B-UNAWARE Trial ondersteunen geen routinematige BIS-monitoring als onderdeel van de standaardpraktijk.
Bij het toepassen van TIVA (vaak continue toediening van Propofol) bestaat er het risico op een eventuele onder- of overdosering, zeker door fysiologische veranderingen van het lichaam bij patiënten met obesitas. Het toevoegen van BIS wordt hier aangeraden, ondanks dat de bewijslast hier niet toereikend naar voren kwam in de literatuur (Siampalioti, 2015). Volgens de ‘Joint Guidelines from the Association of Anaesthetists and the Society for Intravenous Anaesthesia’ (2018) wordt aanbevolen EEG-bewaking (bijvoorbeeld BIS-bewaking) toe te passen bij alle patiënten onder algehele anesthesie die spierverslapping krijgen toegediend tijdens TIVA (Nimmo, 2018). In Nederland bestaat zo’n aanbeveling niet.
Uit andere studies, die keken naar BIS-gebruik bij patiënten zonder obesitas, kwam naar voren dat BIS-geleide anesthesie het risico op awareness kan verminderen in vergelijking met klinisch geleide anesthesie op basis van de end-tidal gas concentratie (MAC) (Lewis, 2019; Wang, 2020). BIS-geleide anesthesie was significant geassocieerd met een lagere incidentie van het postoperatief delier.
Deze reviews suggereren dat BIS-monitoring een rol kan spelen bij het verminderen van awareness en het verbeteren van hersteltijden, vooral bij patiëntengroepen met een hoog risico en oudere patiënten. Echter, het bewijs wordt nog steeds als ‘low grade’ beschouwd vanwege de lage incidentie van intra-operatieve bewustwording, methodologische beperkingen van de studies, en de heterogeniteit in uitkomsten en patiëntenpopulatie.
Conclusie op basis van de literatuur
Er geen duidelijk bewijs dat BIS-monitoring awareness voorkomt bij patiënten met obesitas. Daarvoor is de incidentie te laag. In het geval van gebruik van TIVA wordt BIS-monitoring aangeraden en aanbevolen ter voorkoming van awareness (Gao, 2018; Nimmo, 2018).
Er is geen duidelijk bewijs dat BIS-bewaking tijdens inhalatie-anesthesie awareness kan voorkomen. Wel kan het verbruik van inhalatie-anesthetica met zo’n 20% worden gereduceerd (Liu, 2004; Poon, 2017) en daarmee ook de kosten (Shepherd, 2013). In de huidige tijd van duurzaamheid en besparing is dit niet onbelangrijk.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Er zijn verschillende factoren welke van belang zijn voor de patiënt:
- Informatiebehoefte: Patiënten en hun verzorgers kunnen gedetailleerde informatie wensen over de risico's en voordelen van BIS-monitoring, inclusief de potentiële vermindering van het risico op intra-operatieve bewustwording en de impact op hersteltijden.
- Angst voor bewustwording: De angst voor intra-operatieve bewustwording kan een significante zorg zijn voor patiënten. De wetenschap dat BIS-monitoring het risico hierop kan verminderen kan geruststellend zijn.
- Herstel na de operatie: Patiënten kunnen waarde hechten aan een sneller en comfortabeler herstelproces, wat een voordeel kan zijn van BIS-monitoring.
- Individuele risicofactoren: Patiënten met een hoger risico op intra-operatieve bewustwording (bijvoorbeeld door eerdere ervaringen of specifieke medische condities zoals het hebben van obesitas) kunnen meer voorkeur hebben voor BIS-monitoring.
- Besluitvormingsproces: Het betrekken van patiënten en hun verzorgers in het besluitvormingsproces over anesthesiemonitoring kan leiden tot meer gepersonaliseerde zorg en verhoogde tevredenheid.
Door rekening te houden met deze factoren, kunnen zorgverleners beter afstemmen op de behoeften en voorkeuren van patiënten en hun verzorgers bij het plannen van anesthesie en chirurgische ingrepen en dit afstemmen met de patiënt zijn/haar wensen en verwachtingen.
Kosten
Bij het vergelijken van de kosten van intra-operatieve bewustwording (awareness) met de kosten van het gebruik van BIS-monitoring, zijn er de volgende factoren om te overwegen:
- Kosteneffectiviteit en toegankelijkheid: De kosten van BIS-monitoring en de beschikbaarheid ervan in verschillende gezondheidszorgsystemen kunnen invloed hebben op de voorkeuren van patiënten en verzorgers. Een BIS-plakker kost ongeveer 16 euro.
- Kosten van Intra-operatieve bewustwording: Deze kunnen aanzienlijk zijn en omvatten de kosten van extra medische zorg, psychologische ondersteuning en potentiële juridische gevolgen. Patiënten die intra-operatieve bewustwording ervaren kunnen langdurige psychologische effecten ondervinden zoals posttraumatische stressstoornis, die intensieve behandeling vereisen.
Aanvaardbaarheid, haalbaarheid en implementatie
Als we BIS-monitoring succesvol willen implementeren, gezien de positieve aspecten, zouden de volgende stappen ondernomen kunnen worden om het haalbaar te maken:
- Training en onderwijs: Zorg voor uitgebreide training en onderwijs voor zorgverleners over het gebruik en de voordelen van BIS-monitoring.
- Budgettering en financiering: Zorg voor adequate budgettering om de aanschaf van BIS-apparatuur te ondersteunen.
- Integratie in protocollen: Integreer BIS-monitoring in de standaard anesthesieprotocollen, vooral voor patiënten met een hoog risico op bewustwording.
- Samenwerking en partnerschappen: Werk samen met verschillende stakeholders, waaronder zorgverzekeraars, om de toegankelijkheid en vergoeding van BIS-monitoring te bevorderen.
- Onderzoek en evaluatie: Voer regelmatig evaluaties uit om de effectiviteit van BIS-monitoring in de praktijk te beoordelen en waar nodig aanpassingen te maken.
Door deze stappen te volgen, kan de implementatie van BIS-monitoring soepel verlopen en kan het een standaard onderdeel worden van anesthesiezorg, met potentiële voordelen voor zowel patiënten als zorgverleners.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Weging van argumenten:
-
- Voordeel: Ondanks zeer lage bewijskracht, potentieel verminderd risico op intra-operatieve bewustwording, vooral bij patiënten met een hoog risico zoals in patiënten met obesitas.
- Voordeel: Ondanks een niet gevonden verschil in extubatietijden bij een redelijke bewijskracht, kan het toepassen van BIS wel inzicht geven in de mate van diepte van de anesthesie en gepersonaliseerde patiëntenzorg worden nagestreefd, zodat niet te veel medicatie wordt gegeven, wat beter is voor milieu en kosten.
- Voordeel: Het is niet erg belastend voor de patiënt en gemakkelijk aan te brengen. Getallen zijn makkelijk te interpreteren.
- Nadeel: Kosten en benodigde training kunnen beperkend werken.
- Weging: De werkgroep heeft de potentiële verbetering in patiëntveiligheid en herstel zwaar laten wegen, ondanks de initiële kosten en trainingsvereisten.
Onderbouwing
Achtergrond
Patiënten met obesitas hebben op basis van hun gewicht mogelijk een andere, hogere dosering van bepaalde anesthetica nodig in vergelijking met patiënten met een ‘normaal’ gewicht. Toediening van medicatie in deze patiëntenpopulatie is in het algemeen gebaseerd op de farmacokinetische en dynamische eigenschappen van het medicament en wordt vaak gedoseerd op basis van Total Body Weight, Ideal Body Weight of Lean Body Weight (Ingrande, 2010). Het is de vraag op welke manier de doseringen van de anesthetica vastgesteld zouden moeten worden bij patiënten met obesitas. Het bewaken van de anesthesiediepte met behulp van BIS-monitoring (dus op klinisch effect) zou kunnen bijdragen aan het individualiseren van de hypnotica/sedativa bij patiënten met obesitas, met als uiteindelijke doel awareness tijdens de ingreep te voorkomen. Een bijkomend voordeel is dat, in het kader van duurzaamheid, door te titreren op de BIS-waarde er mogelijk minder hypnotica/sedativa nodig is.
Het gebruik van BIS-monitoring
Het meten van de hersenactiviteit (BIS) bij patiënten onder algehele anesthesie wordt in de Nederlandse ziekenhuizen toegepast, maar hoe vaak, bij wie wel en bij wie niet is onbekend. Het belangrijkste doel van BIS-bewaking is het voorkomen dat de patiënt ‘wakker/zich bewust’ wordt (awareness). Awareness onder algehele anesthesie is een zeer serieuze complicatie met mogelijk levenslange psychologische schade zoals de ontwikkeling van een angst en/of post-traumatische stressstoornis. De incidentie van awareness varieert tussen de 0,1% en 0,9% afhankelijk van wel of geen BIS-gebruik en/of inhalatie-anesthesie versus totaal intraveneuze anesthetica (TIVA).
BIS-monitoring kan ook worden gebruikt om de hoeveelheid toegediende anesthetica te titreren op basis van de BIS-waarden (tussen de 40 en de 60) met het idee preciezer te werken en waarschijnlijk hiermee minder anesthetica te gebruiken.
BIS wordt vooral toegepast bij patiënten met een verhoogd risico op awareness zoals bijvoorbeeld in de hartchirurgie, en bij het gebruik van spierverslappers (zie tabel 1). Ook patiënten met obesitas zouden tot de groep behoren met een hoge kans op intra-operatief awareness. Toch wordt BIS-bewaking bij deze patiënten onder algehele anesthesie niet in alle ziekenhuizen routinematig toegepast, mogelijk wegens de lage bewijsvoering.
Men moet rekening houden met het feit dat de verandering in BIS-waarden volgens de fabrikant achterlopen op de anesthesieveranderingen (vertraging) (Mathur, 2023). Ook zijn de BIS-metingen volgens de fabrikant minder betrouwbaar bij het gebruik van Ketamine, Lachgas, Hypothermie (hartchirurgie) en bij kinderen jonger dan 3 jaar, en treden er storingen op bij het gelijktijdig gebruik van bijvoorbeeld de diathermie (Hans, 2004).
Tabel 1. Verhoogd risico op awareness (Butterworth, 2013).
|
Hartoperaties |
|
Gebruik van spierverslappers |
|
Gebruik van total intraveneuze anesthesie (TIVA) |
|
Hoog alcohol gebruik |
|
Patiënten met obesitas |
|
ASA IV |
|
Ernstig longlijden (GOLD III/IV) |
|
Beperkte inspanningstolerantie (MET < 4). |
|
Ejectie Fractie < 40% |
|
Moeilijke luchtweg |
Conclusies / Summary of Findings
|
Very low GRADE |
The evidence is very uncertain about the effect of BIS monitoring during anesthesia on patient-reported awareness when compared with not using BIS monitoring in patients with obesity undergoing a surgical procedure.
Source: Ibraheim, 2008; Ibrahim, 2013 |
|
- GRADE |
No evidence was found regarding the effect of BIS monitoring during anesthesia on mortality when compared with not using BIS monitoring in patients with obesity undergoing a surgical procedure.
Source: - |
|
- GRADE |
No evidence was found regarding the effect of BIS monitoring during anesthesia on cardiovascular complications when compared with not using BIS monitoring in patients with obesity undergoing a surgical procedure.
Source: - |
|
Very low GRADE |
The evidence is very uncertain about the effect of BIS monitoring during anesthesia on length of stay when compared with not using BIS monitoring in patients with obesity undergoing a surgical procedure.
Source: Siampalioti, 2015 |
|
Moderate GRADE |
The use of BIS monitoring during anesthesia likely results in little to no difference in time to extubation when compared with not using BIS monitoring in patients with obesity undergoing a surgical procedure.
Source: Ibraheim, 2008; Ibrahim, 2013; Siampalioti, 2015 |
Samenvatting literatuur
Description of studies
All studies compared the use of BIS monitoring during anesthesia with anesthesia without BIS monitoring in patients with obesity undergoing bariatric surgery. The type of anesthetic varied between studies. All studies included patients with obesity, though the specific BMI requirements varied.
Ibraheim (2008) compared BIS monitoring with no BIS monitoring while using Sevoflurane for anesthesia in patients with a BMI ³35.
Ibrahim (2013) compared BIS monitoring with no BIS monitoring while using Desflurane in patients with a BMI ³35.
Siampalioti (2015) compared BIS monitoring with no BIS monitoring for both Sevoflurane and Propofol in patients with a BMI ³50.
An overview of characteristics of the included studies is presented in table 2.
Table 2. Overview of the included studies.
|
Author, year |
Study design |
N (I/C) |
Population |
Intervention |
Control |
Risk of bias |
|
Ibraheim, 2008 |
RCT |
15/15 |
Patients with BMI >35 undergoing laparoscopic gastric banding. BMI ± SD: I: 43.2 ± 5.07 C: 45.8 ± 7.5
Age ± SD: I: 39 ± 4.50 C: 41.21 ± 5.07
Sex (M/F): I: 9/6 C: 11/4 |
BIS monitoring + anesthesia using sevoflurane |
No BIS monitoring + anesthesia using sevoflurane |
Some concerns: lack of detailed information (e.g., about the allocation sequence and concealment) and no study protocol available. |
|
Ibrahim, 2013 |
RCT |
20/20 |
Patients with BMI >35 undergoing laparoscopic sleeve gastrectomy. BMI ± SD: I: 44.04 ± 3.5 C: 45.51 ± 4.6
Age ± SD: I: 36.07 ± 3.5 C: 34.12 ± 4.2
Gender (F/M): I: 14/6 C: 15/5 |
BIS monitoring + anesthesia using desflurane |
No BIS monitoring + anesthesia using desflurane |
Some concerns: lack of detailed information (e.g., about the allocation sequence and concealment) and no study protocol available. |
|
Siampalioti, 2015 |
RCT |
Comparison 1: 25/25 |
Patients with BMI >50 undergoing bariatric surgery (biliopancreatic diversion). BMI ± SD: I1: 57 ± 9 C1: 61 ± 10
Age ± SD: I1: 36 ± 10 C1: 42 ± 8
Gender M/F: I1: 7/18 C1: 10/15 |
BIS monitoring + anesthesia using sevoflurane |
No BIS monitoring + anesthesia using sevoflurane |
Some concerns: no information on allocation, and not all information about the study outcomes was clearly described and complete. |
|
Comparison 2: 25/25 |
Patients with BMI >50 undergoing bariatric surgery (biliopancreatic diversion). BMI ± SD: I2: 55 ± 6 C2: 59 ± 11
Age ± SD: I2: 37 ± 9 C2: 36 ± 9
Gender M/F: I2: 6/19 C2: 8/17 |
BIS monitoring + anesthesia using Propofol |
No BIS monitoring + anesthesia using Propofol |
BMI: body mass index, BIS: bispectral index, RCT: randomized controlled trial, SD: standard deviation.
Results
1. Patient-reported awareness
Recall of intraoperative events
Ibraheim (2008) and Ibrahim (2013) both reported that there was no recall by any patient in the recovery room or 24 hours after surgery in both groups (RD 0.95%CI: -0.12, 0.12 and RD 0.95%CI: -0.09, 0.09, respectively). Siampalioti (2015) did not report on patient-reported awareness in his study.
2. Mortality
None of the studies reported the outcome ‘mortality’.
3. Cardiovascular complications
None of the studies reported the outcome ‘cardiovascular complications’.
4. Length of stay
Siampalioti (2015) reported the outcome ‘length of stay’ for each group, but it is unclear in which time unit (minutes/hours/days) these results were reported. In the first comparison (Sevoflurane) the mean length of stay (SD) did not differ between the BIS monitoring group and control group (8 ± SD 1 vs 8 ± SD 1; MD 0.00; 95% CI: -0.55 to 0.55). In the second comparison (Propofol), also no difference was reported (8 ± SD 1 vs 8 ± SD not reported; MD 0.00; 95%CI could not be calculated). Overall, there was no difference between groups in length of stay.
5. Time to extubation
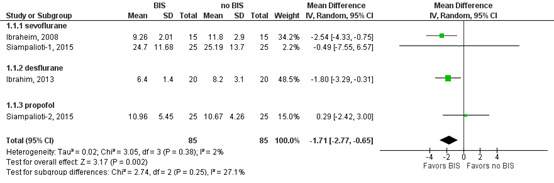
Ibraheim (2008), Ibrahim (2013) and Siampalioti (2015) all reported the outcome time to extubation in minutes. A meta-analysis was performed (see Figure 1). The different comparisons in the study from Siampalioti (2015) were added as separate studies, because a different anesthetic was used (see Table 1).
The pooled MD was -1.71 minutes (95% CI -2.77 to -0.65, Figure 1) in favor of the BIS monitoring group. This difference was considered as not clinically relevant.
Figure 1: Time to extubation in minutes; BIS-monitoring versus no BIS-monitoring
Z: p-value of overall effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval.
Level of evidence of the literature
The level of evidence of all outcome measures started as high, as the included studies were RCTs.
The level of evidence regarding the outcome measure patient-reported awareness was downgraded by three levels to very low. This was due to study limitations including lacking information on allocation and absence of a study protocol (risk of bias, -1) and because of wide confidence intervals, crossing both borders of clinical relevance (imprecision, -2).
The level of evidence for the outcome measure mortality could not be determined as none of the included studies reported these.
The level of evidence for the outcome measure cardiovascular complications could not be determined as none of the included studies reported these.
The level of evidence regarding the outcome measure length of stay was downgraded by three levels to very low. This was due unclear confidence intervals (imprecision, -3).
The level of evidence regarding the outcome measure ‘time to extubation’ was downgraded by one level to moderate. This was due to study limitations including lacking information on allocation and absence of a study protocol (risk of bias, -1).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question: What are the (un)favorable effects of BIS monitoring during surgery in obese patients undergoing surgery under general anesthesia?
P: Patients with obesity undergoing a surgical procedure under general anesthesia
I: BIS monitoring
C: No BIS monitoring
O: Patient-reported awareness, mortality, cardiovascular complications, length of stay, time to extubation
Relevant outcome measures
The guideline development group considered patient-reported awareness as a critical outcome measure for decision making; and mortality, cardiovascular complications, length of stay, and time to extubation as important outcome measures for decision making.
A priori, the working group did not define the outcome measures mortality, cardiovascular complications, length of stay and time to extubation but used the definitions used in the studies. For patient-reported awareness the working group defined the outcome as patient-reported recall of intra-operative events.
The working group defined the following as a minimal clinically (patient) important difference:
Patient-reported awareness: 0.91 ³ relative risk (RR) ³ 1.10.
Mortality: 0.95 ³ RR ³ 1.05.
Cardiovascular complications: 0.91 ³ RR ³ 1.10.
Length of stay: mean difference (MD) ³ 1 day.
Time to extubation: MD ≥ 10 minutes.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 20 March 2023. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 151 hits. Studies were selected based on the following criteria: 1) a systematic review of RCTs and observational comparative studies or a randomized controlled trial (RCT) or an observational comparative study (case control or cohort study), 2) including only patients with obesity (BMI≥30) undergoing a surgical procedure under general anesthesia 3) comparing BIS monitoring with no BIS monitoring, 4) reporting at least one of the following outcome measures: patient-reported awareness, mortality, cardiovascular complications, length of stay or time to extubation.
Initially, 30 studies were selected based on title and abstract screening. After reading the full text, 27 studies were excluded (see the table with reasons for exclusion under the tab Methods), and three studies were included.
Results
Three studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Butterworth JF, Mackey DC, Wasnick JD. Morgan & Mikhail's clinical anesthesiology. (No Title). 2013 Apr 1.
- Hans P, Dewandre PY, Brichant JF, Bonhomme V. Comparative effects of ketamine on Bispectral Index and spectral entropy of the electroencephalogram under sevoflurane anaesthesia. Br J Anaesth. 2005 Mar;94(3):336-40. doi: 10.1093/bja/aei047. Epub 2004 Dec 10. PMID: 15591328.
- Ibraheim O, Alshaer A, Mazen K, El-Dawlaty A, Turkistani A, Alkathery K, Al-Zahrani T, Al-Dohayan A, Bukhari A. Effect of bispectral index (BIS) monitoring on postoperative recovery and sevoflurane consumption among morbidly obese patients undergoing laparoscopic gastric banding. Middle East J Anaesthesiol. 2008 Feb;19(4):819-30. PMID: 18630768.
- Ibrahim TH, Yousef GT, Hasan AM, Eldesuky HI. Effect of bispectral index monitoring on desflurane consumption and recovery time in morbidly obese patients undergoing laparoscopic sleeve gastrectomy. Anesth Essays Res. 2013 Jan-Apr;7(1):89-93. doi: 10.4103/0259-1162.114010. PMID: 25885727; PMCID: PMC4173477.
- Ingrande J, Lemmens HJ. Dose adjustment of anaesthetics in the morbidly obese. Br J Anaesth. 2010 Dec;105 Suppl 1:i16-23. doi: 10.1093/bja/aeq312. PMID: 21148651.
- Lewis SR, Pritchard MW, Fawcett LJ, Punjasawadwong Y. Bispectral index for improving intraoperative awareness and early postoperative recovery in adults. Cochrane Database of Systematic Reviews 2019, Issue 9. Art. No.: CD003843. DOI: 10.1002/14651858.CD003843.pub4.
- Mathur S, Patel J, Goldstein S, et al. Bispectral Index. [Updated 2023 Nov 6]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK539809/
- Myles PS, Leslie K, McNeil J, Forbes A, Chan MT. Bispectral index monitoring to prevent awareness during anaesthesia: the B-Aware randomised controlled trial. Lancet. 2004 May 29;363(9423):1757-63. doi: 10.1016/S0140-6736(04)16300-9. PMID: 15172773.
- Nimmo AF, Absalom AR, Bagshaw O, Biswas A, Cook TM, Costello A, Grimes S, Mulvey D, Shinde S, Whitehouse T, Wiles MD. Guidelines for the safe practice of total intravenous anaesthesia (TIVA): Joint Guidelines from the Association of Anaesthetists and the Society for Intravenous Anaesthesia. Anaesthesia. 2019 Feb;74(2):211-224. doi: 10.1111/anae.14428. Epub 2018 Oct 31. PMID: 30378102.
- Shepherd J, Jones J, Frampton G, Bryant J, Baxter L, Cooper K. Clinical effectiveness and cost-effectiveness of depth of anaesthesia monitoring (E-Entropy, Bispectral Index and Narcotrend): a systematic review and economic evaluation. Health Technol Assess. 2013 Aug;17(34):1-264. doi: 10.3310/hta17340. PMID: 23962378; PMCID: PMC4781161.
- Siampalioti A, Karavias D, Zotou A, Kalfarentzos F, Filos K. Anesthesia management for the super obese: is sevoflurane superior to propofol as a sole anesthetic agent? A double-blind randomized controlled trial. Eur Rev Med Pharmacol Sci. 2015 Jul;19(13):2493-500. PMID: 26214787.
- Wang NF, Tang HM, Liu FL, Hong QY. Prolonged progression-free survival and overall survival are associated with diabetes mellitus but inversely associated with levels of blood glucose in patients with lung cancer. Chin Med J (Engl). 2020 Apr 5;133(7):786-791. doi: 10.1097/CM9.0000000000000739. PMID: 32195672; PMCID: PMC7147653.
Evidence tabellen
Evidence table for intervention studies
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Ibraheim, 2008 |
Type of study: RCT
Setting and country: King Khalid University Hospital, Saudi Arabia
Funding and conflicts of interest: Not reported. |
Inclusion criteria: After institutional Review Board approval, thirty morbidly obese (BMI >35 kg/m2), ASA I & II patients to undergo gastric banding procedures, were studied.
Exclusion criteria: Exclusion criteria consisted of renal, hepatic or neurological dysfunction or use of benzodiazepines, anticonvulsants, alcohol, opioids or other psychotropic drugs.
N total at baseline: Intervention: 15 Control: 15
Important prognostic factors: Age ± SD: I: 39 ± 4.50 C: 41.21 ± 5.07
Sex (M/F): I: 9/6 C: 11/4
BMI ± SD: I: 43.2 ± 5.07 C: 45.8 ± 7.5
Groups comparable at baseline? The two groups were similar in age, height, age, weight, BMI and duration of anesthesia. |
BIS monitoring
The second group, (15 patients) sevoflurane was titrated to maintain a BIS value between 40 and 60 during surgery, and then 60-70 during 15 min prior to the end of surgery (BIS group).
- BIS group: the anesthesiologist had access to the monitor and adjusted the concentration of sevoflurane to achieve a target BIS in the range 40-60.
|
No BIS monitoring
First group, (15 patients) were anesthetized without the use of BIS (non BIS or control group), and sevoflurane being administered according to standard clinical practice.
- No BIS (control) group: the anesthesiologist adjusted the sevoflurane concentration purely according to the clinical signs. |
Length of follow-up: Not reported. The authors do not state how long they continued to follow-up patients, but patients were asked about recall at 24 hours after surgery.
Loss-to-follow-up: Not reported.
Incomplete outcome data: Not reported.
|
Patient-reported awareness: Question at time of discharge from recovery room and 24h after surgery, whether they had dreams or recalled any intraoperative events.
Recall of intraoperative events I: 0 C: 0
Mortality: Not explicitly reported, but all patients were completely awake during the three postoperative hours without complications. I: 0 C: 0
Cardiovascular complications Not explicitly reported, but all patients were completely awake during the three postoperative hours without complications. I: 0 C: 0
Length of stay: Not reported.
Time to exctubation: Recovery times (in minutes): extubation (mean ± SD), I: 9.26 ± 2.01 C: 11.80 ± 2.9 MD: -2.54 (95% CI: -4.33, -0.75)
|
Author’s conclusion: In conclusion, the recovery variables were shorter with BIS monitoring which in turn made significant savings in sevoflurane consumption and influenced the speed of recovery after laparoscopic gastric banding in morbidly obese patients. |
|
Ibrabim, 2013 |
Type of study: RCT
Setting and country: University hospital, Zagazig, Egypt
Funding and conflicts of interest: Source of Support: Nil. Conflict of Interest: None declared. |
Inclusion criteria: After local institutional review board approval was obtained and all patients gave informed written consent, 40 morbidly obese patients [body mass index (BMI) >35 kg/m2 and ASA physical status II–III] undergoing laparoscopic sleeve gastrectomy were included in the study.
Exclusion criteria: Exclusion criteria were memory impairment, psychosis, known or suspected electroencephalograph abnormality (e.g., epilepsy, previous brain operation), chronic use of psychoactive medication, and operation time exceeding 6 h.
N total at baseline: I: 20 C: 20
Important prognostic factors: Age ± SD: I: 36.07 ± 3.5 C: 34.12 ± 4.2
Gender (F/M): I: 14/6 C: 15/5
BMI ± SD: I: 44.04 ± 3.5 C: 45.51 ± 4.6
Groups comparable at baseline. There were no significant differences between the two groups regarding demographic data (age, height, weight; BMI) or duration of anesthesia and surgery
|
Desflurane was titrated to maintain a BIS value between 40 and 60 during surgery, and then to 60–70 during 15 min before the end of surgery.
Desflurane 6% in 2 l/min fresh gas flow, mixed in air and oxygen, was administered to all patients after endotracheal intubation until skin incision; then the concentration was changed every 5 min as follows: in BIS group, the anesthesiologist adjusted the concentration of desflurane to achieve a target BIS in the range 40-60. End-tidal concentration of desflurane was also regularly recorded (by Datex-Ohmeda S/5 monitor). During the operation, the patients in both groups were observed for signs of inadequate anesthesia (increased BP and HR 20% from baseline, lacrimation). Significant hypotension or bradycardia was defined as 20% reduction of the baseline figures. Any instances of inadequate anesthesia were managed by increasing the concentration of desflurane. Rocuronium neuromuscular blockade was maintained to a single twitch of the train of four. During the last 15 min of surgery, in the BIS group, the BIS value was gradually titrated to 60-70 by decreasing the inhaled anesthetic concentration. |
Desflurane was administered according to standard clinical practice.
Desflurane 6% in 2 l/min fresh gas flow, mixed in air and oxygen, was administered to all patients after endotracheal intubation until skin incision; then the concentration was changed every 5 min as follows: Non-BIS group (control group), the anesthesiologist adjusted the desflurane concentration purely according to the clinical signs [heart rate (HR) and BP]. |
Length of follow-up: Not reported. The authors do not state how long they continued to follow-up patients, but patients were asked about recall at 24 hours after surgery
Loss-to-follow-up: Not reported.
Incomplete outcome data: Not reported.
|
Patient-reported awareness: Question at time of discharge from recovery room and 24h after surgery, whether they had bad dreams or recalled any intraoperative events.
Recall of intraoperative events I: 0 C: 0
Mortality: Not reported.
Cardiovascular complications “all patients were completely awake and discharged after 3 h from PACU without complications.”
Length of stay: Not reported.
Time to extubation: Mean time in minutes ± SD I: 6.4 ± 1.4 C: 8.2 ± 3.1 MD: -1.80 (95% CI: -3.29, -0.31)
|
Author’s conclusion: The use of BIS monitoring was effective in reducing intraoperative desflurane requirement (cost) and in shortening early recovery times after laparoscopic sleeve gastrectomy in morbidly obese patients without compromising the hemodynamic stability, adequacy of anesthesia, or patient outcome. |
|
Siampalioti, 2015 |
Type of study: RCT
Setting and country: University Hospital of Patras, Greece
Funding and conflicts of interest: The authors declared that there were no conflicts of interest. |
Inclusion criteria: Super obese patients (with body mass index greater than 50 kg/m²), aged 21 to 60 years old were recruited for this prospective randomized controlled study. All patients undergoing elective bariatric surgery were scheduled to have a variant of biliopancreatic diversion.
Exclusion criteria: Patients with severe cardiopulmonary disease (aortic stenosis, angina, chronic heart failure, previous cardiac or intrathoracic operations), significant renal dysfunction (serum creatinine > 1.8 mg/dl), liver dysfunction (evidenced by abnormal LFTs), history of hyper or hypothyroidism, serious psychiatric or neurologic disorders, recall during general anesthesia, allergy to local anesthetics, history of substance abuse (alcohol or other drugs), contra indications for placement of thoracic epidural catheter (previous spine surgery, coagulation abnormalities) and patients who refused to participate were excluded from the study.
Comparison 1: N total at baseline: I1: 25 C1:25
Important prognostic factors: Age ± SD: I1: 36 ± 10 C1: 42 ± 8
Gender M/F: I1: 7/18 C1: 10/15
BMI ± SD: I1: 57 ± 9 C1: 61 ± 10
Comparison 2: N total at baseline: I2: 25 C2: 25
Important prognostic factors: Age ± SD: I2: 37 ± 9 C2: 36 ± 9
Gender M/F: I2: 6/19 C2: 8/17
BMI ± SD: I2: 55 ± 6 C2: 59 ± 11
All groups comparable at baseline, except for comorbidity dyslipidemia |
BIS monitoring
Comparison 1: [for standard care protocol, see control group] + In the BIS monitoring group the sevoflurane concentrations were also adjusted to maintain a BIS level between 40 and 55. For every positive sympathetic response expressed with rise of blood pressure or heart rate > 15% of the baseline, a bolus inhalation of 8% sevoflurane (fresh gas flow 6 L/min, semi-closed circuit) was administered for 2 minutes. If the positive sympathetic response persisted and HR < 70/min, nifedipine 10 mg was administered sublingually, whereas if HR > 70/min diltiazem 10-20 mg was administered IV, followed by esmolol infusion if the response to diltiazem was unsatisfactory. The duration and frequency of positive sympathetic stress responses that required pharmacologic intervention were recorded.
Comparison 2: [for standard care protocol, see control group] + In the BIS monitoring group the rate of propofol administration was also adjusted to maintain a BIS level between 40 and 55. For every rise of BP or HR > 15% of the baseline, a bolus dose of remifentanil 1 μg · kg-1 IBW was administered, followed by a gradual increase in the continuous infusion rate of remifentanil to 1.0 μg/kg/min. The increased dose was interrupted when hemodynamic alterations returned to baseline. For any decrease in blood pressure <15% of the baseline, continuous infusion rate of remifentanil was reduced and if no response was evident in 3 minutes etilefrine was administered. For every drop of HR < 45/min a bolus dose of atropine 0.5 mg was administered, followed by a repeated dose if no response was evident in 5 minutes. The duration and the frequency of the hemodynamic changes were recorded. |
No BIS monitoring
Administration dose for all anesthetic drugs was based either on the ideal body weight (IBW), or the empirical formula of corrected body weight (CBW = IBW + [0.4 × excess weight]).
Comparison 1: In both Sevoflurane groups, rapid sequence induction (RSI) to anesthesia was performed with the administration of a bolus dose of propofol 2 mg·kg-1 CBW, followed by a bolus dose of remifentanil 1 μg·kg-1 IBW and succinylcholine 1 mg·kg-1 TBW and subsequent intubation of the trachea. The correct positioning of the endotracheal tube was confirmed by capnography and bilateral lung auscultation. Anesthesia was maintained with end-tidal sevoflurane concentrations of 1-3% (Siemens Multigaz Gas Analyzer).
Comparison 2: In both propofol groups general anesthesia was induced with a gradually reduced continuous IV propofol infusion (21 mg·kg-1 CBW for 5 min, 12 mg·kg-1 CBW for 10 min and then 6 mg·kg-1 CBW), followed by a bolus dose of remifentanil 1 μg·kg-1 IBW and succinylcholine 1 mg·kg-1 IBW. Anesthesia was maintained with continuous intravenous administration of propofol at 6-10 mg/kg/hr CBW and remifentanil at 0.1-1 μg/kg/min. |
Length of follow-up: Not reported. The authors do not state how long they continued to follow-up patients.
Loss-to-follow-up: Not reported.
Incomplete outcome data: Not reported.
|
Patient-reported awareness: Not reported.
Mortality: Not reported
Cardiovascular complications While the authors state that “all episodes of postoperative hypertension, nausea, vomiting and pain exacerbation were also recorded.”, the number of these episodes were not reported.
“In our high volume specialized bariatric center a thoracic epidural catheter was placed successfully in all patients with no early or late complications.”
Length of stay: Mean duration of stay ±SD units not specified
Comparison 1 I1: 8 ± 1 C1: 8 ± 1 MD: 0.00 (95% CI: -0.55, 0.55)
Comparison 2 I2: 8 ± 1 C2: 8 MD: not estimable.
Time to extubation: Mean time in minutes ± SD
Comparison 1 I1: 24.7 ± 11.68 C1: 25.19 ± 13.7 MD: -0.49 (95% CI: -7.55, 6.57)
Comparison 2 I2: 10.96 ± 5.45 C2: 10.67 ± 4.26 MD: 0.29 (95% CI: -2.42, 3.00)
|
|
Risk of bias table for intervention studies (randomized controlled trials; based on Cochrane risk of bias tool and suggestions by the CLARITY Group at McMaster University)
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH |
|
Probably yes
Reason: “Patients were randomly assigned to two groups.” Method not reported. |
No information. |
Probably yes
Reason: “In the present study, the protocol was designed as a single blinded comparison of the anesthetic administration, as sevoflurane was titrated intraoperatively against objective measures such as BIS, HR, MAP, and patient movements. Early recovery in the operative room (time to awakening and to extubation) was assessed by another anesthesia provider, that does not constitute an investigator associated bias. In addition, in the PACU, the nursing staff had no knowledge of the study.” |
Probably yes
Reason: Not explicitly reported, but the number of patients in the outcome section is the same as the number of patients randomized. |
Probably yes
Reason: no protocol or study registration available; all relevant outcomes mention in method section were reported. |
Probably yes. No other problems noted. |
Some concerns
Reason: overall study quality: lack of detailed information (e.g. about the allocation sequence and concealment) and no study protocol available.
|
|
|
Ibrahim, 2013 |
Probably yes
Reason: “Patients were randomly allocated into two groups.” Method not reported. |
No information. |
Probably yes
Reason: This study was designed to be a prospective randomized controlled single-blinded study as desflurane was titrated intraoperatively against objective measures such as BIS, HR, MAP, and end-tidal desflurane concentration. Early recovery times in the operating room (eye opening to verbal commands, extubation time, and orientation to time, place, and person) were also recorded by a blinded study anesthesia nurse, which may not constitute an investigator-associated bias. Also, in the PACU, the nursing staff did not have any idea about the study. |
Probably yes
Reason: Not explicitly reported, but the number of patients in the outcome section is the same as the number of patients randomized. |
Probably yes
Reason: no protocol or study registration available; all relevant outcomes mention in method section were reported. |
Probably yes. No other problems noted. |
Some concerns
Reason: overall study quality: lack of detailed information (e.g. about the allocation sequence and concealment) and no study protocol available.
|
|
Siampalioti, 2015 |
Definitely yes
Reason: “All patients were randomly divided into four groups via a computer-generated random number table.” |
No information. |
Probably yes
Reason: “Both the anesthesiologist performing the assessment and the patients were blinded to the general anesthetic used and the BIS monitoring. [...]
All data were collected by a blinded investigator.” |
Probably yes
Reason: Not explicitly reported, but the number of patients in the outcome section is the same as the number of patients randomized. |
Definitely yes
Reason: All relevant outcomes were reported. Trial registered: NCT01279499
Incomplete information: for the outcome length of stay: no specification of time units and SD not reported for one of the groups. |
Probably yes. No other problems noted.
|
Some concerns
Reason: no information on allocation, not all information about the study outcomes was clearly described and complete.
|
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Akbas S, Ozkan AS. Comparison of effects of low-flow and normal-flow anesthesia on cerebral oxygenation and bispectral index in morbidly obese patients undergoing laparoscopic sleeve gastrectomy: a prospective, randomized clinical trial. Wideochir Inne Tech Maloinwazyjne. 2019 Jan;14(1):19-26. doi: 10.5114/wiitm.2018.77265. Epub 2018 Jul 24. PMID: 30766625; PMCID: PMC6372857. |
No comparison between BIS and no BIS |
|
Albertin A, La Colla G, La Colla L, Bergonzi PC, Deni F, Moizo E. Effect site concentrations of remifentanil maintaining cardiovascular homeostasis in response to surgical stimuli during bispectral index guided propofol anestesia in seriously obese patients. Minerva Anestesiol. 2006 Nov;72(11):915-24. English, Italian. PMID: 17095989. |
No comparison between BIS and no BIS |
|
Albertin A, Poli D, La Colla L, Gonfalini M, Turi S, Pasculli N, La Colla G, Bergonzi PC, Dedola E, Fermo I. Predictive performance of 'Servin's formula' during BIS-guided propofol-remifentanil target-controlled infusion in morbidly obese patients. Br J Anaesth. 2007 Jan;98(1):66-75. doi: 10.1093/bja/ael321. Epub 2006 Nov 27. PMID: 17132644. |
No comparison between BIS and no BIS |
|
Arabadzhieva D, Radev Vl, Radev R, Petrov Vl. BIS monitoring titration of propofol for induction of anesthesia in adult patients with obesity. Anaesthesiology and Intensive Care 2014 Jan;43(5):3-7. |
Foreign language |
|
Arain SR, Barth CD, Shankar H, Ebert TJ. Choice of volatile anesthetic for the morbidly obese patient: sevoflurane or desflurane. J Clin Anesth. 2005 Sep;17(6):413-9. doi: 10.1016/j.jclinane.2004.12.015. PMID: 16171660. |
No comparison between BIS and no BIS |
|
Bansal T, Garg K, Katyal S, Sood D, Grewal A, Kumar A. A comparative study of desflurane versus sevoflurane in obese patients: Effect on recovery profile. J Anaesthesiol Clin Pharmacol. 2020 Oct-Dec;36(4):541-545. doi: 10.4103/joacp.JOACP_307_19. Epub 2021 Jan 18. PMID: 33840938; PMCID: PMC8022057. |
No comparison between BIS and no BIS |
|
Bergland A, Gislason H, Raeder J. Fast-track surgery for bariatric laparoscopic gastric bypass with focus on anaesthesia and peri-operative care. Experience with 500 cases. Acta Anaesthesiol Scand. 2008 Nov;52(10):1394-9. doi: 10.1111/j.1399-6576.2008.01782.x. PMID: 19025533. |
No comparison between BIS and no BIS |
|
Cortínez LI, Gambús P, Trocóniz IF, Echevarría G, Muñoz HR. Obesity does not influence the onset and offset of sevoflurane effect as measured by the hysteresis between sevoflurane concentration and bispectral index. Anesth Analg. 2011 Jul;113(1):70-6. doi: 10.1213/ANE.0b013e31821f105c. Epub 2011 May 19. PMID: 21596877. |
No comparison between BIS and no BIS |
|
Cox-Reijven PL, van Kreel B, Soeters PB. Accuracy of bioelectrical impedance spectroscopy in measuring changes in body composition during severe weight loss. JPEN J Parenter Enteral Nutr. 2002 Mar-Apr;26(2):120-7. doi: 10.1177/0148607102026002120. PMID: 11873761. |
No comparison between BIS and no BIS |
|
Feld JM, Hoffman WE, Stechert MM, Hoffman IW, Ananda RC. Fentanyl or dexmedetomidine combined with desflurane for bariatric surgery. J Clin Anesth. 2006 Feb;18(1):24-8. doi: 10.1016/j.jclinane.2005.05.009. PMID: 16517328. |
No comparison between BIS and no BIS |
|
Gaszyński T, Wieczorek A. A comparison of BIS recordings during propofol-based total intravenous anaesthesia and sevoflurane-based inhalational anaesthesia in obese patients. Anaesthesiol Intensive Ther. 2016;48(4):239-247. doi: 10.5603/AIT.2016.0044. PMID: 27797096. |
No comparison between BIS and no BIS |
|
Golmohammadi M, Abasgholizadeh M. Bispectral index monitoring in isoflurane anesthesia in laparoscopic cholecystectomy of morbid obese patients. Tehran university medical journal 2014 Oct;72(7):471-9. |
Foreign language |
|
Huang XM, Chen Y, Ren XT. Application of different doses of fentanyl combined with ketorolac tromethamine for painless gastroscopy in elderly obese patients. Shi Jie Hua Ren Xiao Hua Za Zhi 2022 Mar;30(5):242-8. |
Foreign language |
|
Lam F, Liao CC, Lee YJ, Wang W, Kuo CJ, Lin CS. Different dosing regimens for propofol induction in obese patients. Acta Anaesthesiol Taiwan. 2013 Jun;51(2):53-7. doi: 10.1016/j.aat.2013.06.009. Epub 2013 Aug 1. Erratum in: Asian J Anesthesiol. 2017 Jun 16;: PMID: 23968654. |
No comparison between BIS and no BIS |
|
Liu N, Lory C, Assenzo V, Cocard V, Chazot T, Le Guen M, Sessler DI, Journois D, Fischler M. Feasibility of closed-loop co-administration of propofol and remifentanil guided by the bispectral index in obese patients: a prospective cohort comparison. Br J Anaesth. 2015 Apr;114(4):605-14. doi: 10.1093/bja/aeu401. Epub 2014 Dec 10. PMID: 25500680. |
No comparison between BIS and no BIS |
|
Masuda T, Jinnouchi Y, Kitahata H, Kimura H, Oshita S. [Changes of arterial blood pressure and heart rate during induction of anesthesia with propofol--efficacy of propofol titration using bispectral index as an indicator]. Masui. 1999 Jun;48(6):621-6. Japanese. PMID: 10402814. |
Foreign language |
|
Masuda T, Jinnouchi Y, Kitahata H, Kimura H, Oshita S. [Changes of arterial blood pressure and heart rate during induction of anesthesia with propofol--efficacy of propofol titration using bispectral index as an indicator]. Masui. 1999 Jun;48(6):621-6. Japanese. PMID: 10402814. |
Foreign language |
|
Masuda T, Yamada H, Takada K, Sagata Y, Yamaguchi M, Tomiyama Y, Oshita S. [Bispectral index monitoring is useful to reduce total amount of propofol and to obtain immediate recovery after propofol anesthesia]. Masui. 2002 Apr;51(4):394-9. Japanese. PMID: 11995347. |
Foreign language |
|
Pandazi A, Bourlioti A, Kostopanagiotou G. Bispectral Index (BIS) monitoring in morbidly obese patients undergoing gastric bypass surgery: experience in 23 patients. Obes Surg. 2005 Jan;15(1):58-62. doi: 10.1381/0960892052993585. PMID: 15768482. |
No comparison between BIS and no BIS |
|
Pandin P, Van Cutsem N, Tuna T, D'hollander A. Bispectral index is a topographically dependent variable in patients receiving propofol anaesthesia. Br J Anaesth. 2006 Nov;97(5):676-80. doi: 10.1093/bja/ael235. Epub 2006 Aug 23. PMID: 16928697. |
No comparison between BIS and no BIS |
|
Paventi S, Santevecchi A, Perilli V, Sollazzi L, Grio M, Ranieri R. Effects of remifentanil infusion bis-titrated on early recovery for obese outpatients undergoing laparoscopic cholecystectomy. Minerva Anestesiol. 2002 Sep;68(9):651-7. English, Italian. PMID: 12370681. |
No comparison between BIS and no BIS |
|
Subramani Y, Riad W, Chung F, Wong J. Optimal propofol induction dose in morbidly obese patients: A randomized controlled trial comparing the bispectral index and lean body weight scalar. Can J Anaesth. 2017 May;64(5):471-479. English. doi: 10.1007/s12630-017-0852-x. Epub 2017 Feb 27. PMID: 28243855. |
Wrong outcome |
|
Timar C, Cotrau P, Daina C, Juncar R, Teușdea A, Vicaș L, Marian E, Vlad A.M, Juncar M. The benefit of entropy in the management of general anaesthesia for the patients with metabolic disorders. Farmacia 2021 Jan-Feb;69(5):897-906. |
No BIS monitoring |
|
Van Kralingen S, Diepstraten J, van de Garde EM, van der Lely AJ, van Dongen EP, van Ramshorst B, Knibbe CA. Comparative evaluation of propofol 350 and 200 mg for induction of anaesthesia in morbidly obese patients: a randomized double-blind pilot study. Eur J Anaesthesiol. 2010 Jun;27(6):572-4. doi: 10.1097/EJA.0b013e328335468a. PMID: 20308907. |
No comparison between BIS and no BIS |
|
Van Kralingen S, van de Garde EM, van Dongen EP, Diepstraten J, Deneer VH, van Ramshorst B, Knibbe CA. Maintenance of anesthesia in morbidly obese patients using propofol with continuous BIS-monitoring: a comparison of propofol-remifentanil and propofol-epidural anesthesia. Acta Anaesthesiol Belg. 2011;62(2):73-82. PMID: 21919373. |
No comparison between BIS and no BIS |
|
Wu Z, Gong J, He X, Wu Z, Shen J, Shang J. Body mass index and pharmacodynamics of target-controlled infusion of propofol: A prospective non-randomized controlled study. J Clin Pharm Ther. 2022 May;47(5):662-667. doi: 10.1111/jcpt.13594. Epub 2022 Jan 11. PMID: 35018648. |
No comparison between BIS and no BIS |
|
Zandomenico JG, Trevisol FS, Machado JA. Compliance with Enhanced Recovery After Surgery (ERAS) protocol recommendations for bariatric surgery in an obesity treatment center. Braz J Anesthesiol. 2023 Jan-Feb;73(1):36-41. doi: 10.1016/j.bjane.2021.10.018. Epub 2021 Dec 25. PMID: 34963616; PMCID: PMC9801194. |
No comparison between BIS and no BIS |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 15-04-2025
Beoordeeld op geldigheid : 09-04-2025
Algemene gegevens
De ontwikkeling van deze richtlijn werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2022 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de anesthesiologische zorg voor patiënten met obesitas.
Werkgroep
Dr. T.A. Brouwer, anesthesioloog, NVA
Drs. M.A.M. Siepel, anesthesioloog, NVA
Drs. A.D. Pot, anesthesioloog, NVA
Drs. S.D.X. Oei, AIOS anesthesiologie, NVA (vanaf september 2022)
Dr. B. Torensma, PhD, anesthesiemedewerker, NVAM
Drs. J.A. Apers, chirurg, NVvH
Dr. L. Freeman, gynaecoloog, NVOG (tot oktober 2022)
Dr. D.D.C.A. Henriquez, gynaecoloog, NVOG (vanaf oktober 2022)
Prof. dr. C. A. J. Knibbe, ziekenhuisapotheker, NVZA
Drs. M.A. Damhof, ziekenhuisapotheker, NVZA (vanaf december 2023)
Dr. H.J. Reesink, longarts, NVALT
Drs. H.L. Lutgers, internist-endocrinoloog, NIV (vanaf april 2023)
N.G. Cnossen, patiëntvertegenwoordiger, Nederlandse Stichting Over Gewicht
Klankbordgroep
Dr. M. Klemt-Kropp, MDL-arts, NVMDL
Drs. Ö. Engin, oogarts, NOG
Dr. H. Buter, internist-intensivist, NVIC
N.J.C. Raeijmaekers, BSc, diëtist, NVD/NDBC
Met ondersteuning van
Drs. I. van Dusseldorp, literatuurspecialist, Kennisinstituut van de Federatie van Medisch Specialisten
Dr. J.C. Maas, adviseur, Kennisinstituut van de Federatie van Medisch Specialisten
Drs. I. van Dijk, adviseur, Kennisinstituut van de Federatie van Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Tammo Brouwer (voorzitter) |
Anesthesioloog, vrij ondernemer. |
Geen |
Geen |
Geen restricties |
|
Alice Dorien Pot |
Anesthesioloog in Meander Medisch Centrum Amersfoort |
Co-auteur boek 'klinische kinderanesthesiologie in de praktijk', initiatief vanuit NVA, uitgeverij Prelum (onbetaald). |
Geen |
Geen restricties |
|
Bart Torensma |
Klinisch epidemioloog en data scientist via eigen bedrijf Torensma Research Consultancy BV. |
"Dagelijks bestuurslid (penningmeester) Stichting COREON Algemeen bestuurslid Vereniging voor epidemiologen. Lesgeven aan de research verpleegkundige Breederode hogeschool Rotterdam
Masterclass gemaakt samen met Medtronic AUE over ERABS en team samenwerkingen." |
Voor PhD (<3 jaar geleden) onderzoek gedaan naar deep block verslapping bij patiënten met obesitas. Deze studie is destijds door MSD gesponsord in de vorm van gratis ampullen sugammadex.
|
Geen restricties |
|
Catherijne A.J. Knibbe |
Ziekenhuisapotheker-klinisch farmacoloog, St. Antonius ziekenhuis Nieuwegein en Utrecht, afdeling Klinische farmacie |
Lid CCMO, Lid Board ACCP |
Diverse studies gefinancierd door ZonMw of Antonius Onderzoeksfonds. De onderzoeken zijn niet gerelateerd aan de richtlijn. |
Geen restricties |
|
Dacia Henriquez |
Gynaecoloog, Amphia Ziekenhuis |
Geen |
Geen |
Geen restricties |
|
Helen Lutgers |
Internist in Ommelander Ziekenhuis Groningen |
Geen |
Geen |
Geen restricties |
|
Herre Reesink |
Longarts, OLVG Amsterdam |
Geen |
Geen |
Geen restricties |
|
Jan Apers |
Chirurg Franciscus Gasthuis & Vlietland |
NVGIC bestuur Dutch Obesity Academy |
Geen |
Geen restricties |
|
Liv Freeman |
Gynaecoloog Ikazia Ziekenhuis Rotterdam |
Voorzitter samenwerking obstetrie anesthesie (onbetaald)
|
Geen |
Geen restricties |
|
Michiel Damhof
|
Ziekenhuisapotheker Medisch Centrum Leeuwarden |
Geen |
Geen |
Geen restricties |
|
Muriel Arianne Michelle Siepel |
Anesthesioloog OLVG Amsterdam |
Geen |
Geen |
Geen restricties |
|
Nienke Cnossen |
Patiëntvertegenwoordiger |
Geen |
Geen |
Geen restricties |
|
Sander Oei |
Aios anesthesiologie. ErasmusMC |
SITdiensten Park Medisch Centrum, betaald. 1-2x/mnd ANWdiensten verpleeghuizen, betaald. 1x/mnd |
Geen |
Geen restricties |
|
Hanneke Buter |
Intensivist |
bestuurslid NVIC |
Geen |
Geen restricties |
|
Michael Klemt-Kropp |
MDL-arts |
Geen |
Geen |
Geen restricties |
|
Natascha Raeijmaekers |
Diëtist Obesitas Centrum, ETZ. Betaald. |
Bestuur Netwerk Diëtisten Bariatrische chirurgie, onbetaald. |
Geen |
Geen restricties |
|
Ozlem Engin |
Oogarts |
Geen |
Geen |
Geen restricties |
|
Irma van Dijk |
Adviseur kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen restricties |
|
José Maas |
Adviseur kennisinstituut van de Federatie Medisch specialisten |
Geen |
Geen |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van een afvaardiging van de Nederlandse ‘Stichting ‘Overgewicht’ in de werkgroep. Het verslag van de knelpunteninventarisatie [zie aanverwante producten] is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Stichting en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijn op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Module |
Uitkomst raming |
Toelichting |
|
Module BIS-monitoring |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de anesthesiologische zorg voor patiënten met obesitas. Tevens zijn er knelpunten aangedragen door relevante partijen via een schriftelijke knelpunteninventarisatie. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effect model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Literature search strategy
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
2 |
2 |
3 |
|
RCTs |
71 |
44 |
80 |
|
Observationele studies |
52 |
34 |
68 |
|
Overig |
|
|
|
|
Totaal |
|
|
151 |
|
Database(s): Ovid/Medline, Embase |
Datum: 20-2-2023 |
|
Periode: nvt |
Talen: nvt |
Zoekstrategie
Embase
|
No. |
Query |
Results |
|
#16 |
#14 NOT #13 NOT #12 OBS |
52 |
|
#15 |
#13 NOT #12 Clinical trial |
71 |
|
#14 |
#7 AND (#10 OR #11) |
120 |
|
#13 |
#7 AND #9 |
73 |
|
#12 |
#7 AND #8 SR |
2 |
|
#11 |
'case control study'/de OR 'comparative study'/exp OR 'control group'/de OR 'controlled study'/de OR 'controlled clinical trial'/de OR 'crossover procedure'/de OR 'double blind procedure'/de OR 'phase 2 clinical trial'/de OR 'phase 3 clinical trial'/de OR 'phase 4 clinical trial'/de OR 'pretest posttest design'/de OR 'pretest posttest control group design'/de OR 'quasi experimental study'/de OR 'single blind procedure'/de OR 'triple blind procedure'/de OR (((control OR controlled) NEAR/6 trial):ti,ab,kw) OR (((control OR controlled) NEAR/6 (study OR studies)):ti,ab,kw) OR (((control OR controlled) NEAR/1 active):ti,ab,kw) OR 'open label*':ti,ab,kw OR (((double OR two OR three OR multi OR trial) NEAR/1 (arm OR arms)):ti,ab,kw) OR ((allocat* NEAR/10 (arm OR arms)):ti,ab,kw) OR placebo*:ti,ab,kw OR 'sham-control*':ti,ab,kw OR (((single OR double OR triple OR assessor) NEAR/1 (blind* OR masked)):ti,ab,kw) OR nonrandom*:ti,ab,kw OR 'non-random*':ti,ab,kw OR 'quasi-experiment*':ti,ab,kw OR crossover:ti,ab,kw OR 'cross over':ti,ab,kw OR 'parallel group*':ti,ab,kw OR 'factorial trial':ti,ab,kw OR ((phase NEAR/5 (study OR trial)):ti,ab,kw) OR ((case* NEAR/6 (matched OR control*)):ti,ab,kw) OR ((match* NEAR/6 (pair OR pairs OR cohort* OR control* OR group* OR healthy OR age OR sex OR gender OR patient* OR subject* OR participant*)):ti,ab,kw) OR ((propensity NEAR/6 (scor* OR match*)):ti,ab,kw) OR versus:ti OR vs:ti OR compar*:ti OR ((compar* NEAR/1 study):ti,ab,kw) OR (('major clinical study'/de OR 'clinical study'/de OR 'cohort analysis'/de OR 'observational study'/de OR 'cross-sectional study'/de OR 'multicenter study'/de OR 'correlational study'/de OR 'follow up'/de OR cohort*:ti,ab,kw OR 'follow up':ti,ab,kw OR followup:ti,ab,kw OR longitudinal*:ti,ab,kw OR prospective*:ti,ab,kw OR retrospective*:ti,ab,kw OR observational*:ti,ab,kw OR 'cross sectional*':ti,ab,kw OR cross?ectional*:ti,ab,kw OR multicent*:ti,ab,kw OR 'multi-cent*':ti,ab,kw OR consecutive*:ti,ab,kw) AND (group:ti,ab,kw OR groups:ti,ab,kw OR subgroup*:ti,ab,kw OR versus:ti,ab,kw OR vs:ti,ab,kw OR compar*:ti,ab,kw OR 'odds ratio*':ab OR 'relative odds':ab OR 'risk ratio*':ab OR 'relative risk*':ab OR 'rate ratio':ab OR aor:ab OR arr:ab OR rrr:ab OR ((('or' OR 'rr') NEAR/6 ci):ab))) |
13858148 |
|
#10 |
'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'comparative study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
7501589 |
|
#9 |
'clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti |
3729312 |
|
#8 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
902369 |
|
#7 |
#6 NOT (('adolescent'/exp OR 'child'/exp OR adolescent*:ti,ab,kw OR child*:ti,ab,kw OR schoolchild*:ti,ab,kw OR infant*:ti,ab,kw OR girl*:ti,ab,kw OR boy*:ti,ab,kw OR teen:ti,ab,kw OR teens:ti,ab,kw OR teenager*:ti,ab,kw OR youth*:ti,ab,kw OR pediatr*:ti,ab,kw OR paediatr*:ti,ab,kw OR puber*:ti,ab,kw) NOT ('adult'/exp OR 'aged'/exp OR 'middle aged'/exp OR adult*:ti,ab,kw OR man:ti,ab,kw OR men:ti,ab,kw OR woman:ti,ab,kw OR women:ti,ab,kw)) |
171 |
|
#6 |
#5 NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
170 |
|
#5 |
#2 AND #3 AND #4 |
267 |
|
#4 |
'neurophysiologic monitoring system'/exp OR 'consciousness monitor'/exp OR 'bispectral index'/exp OR 'bispectral index monitor'/exp OR 'bis':ti,ab,kw OR 'cascade elite':ti,ab,kw OR 'cascade pro':ti,ab,kw OR 'neuromaster g1':ti,ab,kw OR (((neurophysiologic* OR 'anaesthesia depth' OR 'anesthesia depth' OR consciousness) NEAR/3 monitor*):ti,ab,kw) OR 'intellivue':ti,ab,kw OR 'bispectral index*':ti,ab,kw |
109821 |
|
#3 |
'anesthesia'/exp OR 'anesthetic agent'/exp OR (((general OR inhalat* OR rectal) NEAR/3 (anesthe* OR anesthe*)):ti,ab,kw) OR 'surgery'/exp OR 'surgical patient'/exp OR 'surgical risk'/exp OR 'perioperative period'/exp OR 'surgery'/lnk OR surgic*:ti,ab,kw OR surger*:ti,ab,kw OR operation*:ti,ab,kw OR operative:ti,ab,kw OR presurg*:ti,ab,kw OR preoperati*:ti,ab,kw OR 'pre-surg*':ti,ab,kw OR 'pre-operati*':ti,ab,kw OR perisurg*:ti,ab,kw OR perioperati*:ti,ab,kw OR 'peri-surg*':ti,ab,kw OR 'peri-operati*':ti,ab,kw OR postsurg*:ti,ab,kw OR postoperati*:ti,ab,kw OR 'post-surg*':ti,ab,kw OR 'post-operati*':ti,ab,kw |
8095239 |
|
#2 |
'obesity'/exp/mj OR obes*:ti,ab,kw OR obesit*:ti,ab,kw OR overweight*:ti,ab,kw OR 'over weight*':ti,ab,kw OR 'adipositas':ti,ab,kw OR 'adiposity':ti,ab,kw OR 'excess body weight':ti,ab,kw OR 'corpulen*':ti,ab,kw OR 'fat overload syndrome':ti,ab,kw OR 'increased bmi':ti,ab,kw OR bariatr*:ti,ab,kw |
661935 |
|
#1 |
'a randomized comparative study on bispectral index monitoring on early postoperative recovery in morbidly obese patients undergoing laparoscopic sleeve gastrectomy' |
0 |
Ovid/Medline
|
# |
Searches |
Results |
|
14 |
12 not 11 not 10 OBS |
34 |
|
13 |
11 not 10 Clinical trial |
44 |
|
12 |
5 and (7 or 8) |
80 |
|
11 |
5 and 7 |
45 |
|
10 |
5 and 6 SR |
2 |
|
9 |
Case-control Studies/ or clinical trial, phase ii/ or clinical trial, phase iii/ or clinical trial, phase iv/ or comparative study/ or control groups/ or controlled before-after studies/ or controlled clinical trial/ or double-blind method/ or historically controlled study/ or matched-pair analysis/ or single-blind method/ or (((control or controlled) adj6 (study or studies or trial)) or (compar* adj (study or studies)) or ((control or controlled) adj1 active) or "open label*" or ((double or two or three or multi or trial) adj (arm or arms)) or (allocat* adj10 (arm or arms)) or placebo* or "sham-control*" or ((single or double or triple or assessor) adj1 (blind* or masked)) or nonrandom* or "non-random*" or "quasi-experiment*" or "parallel group*" or "factorial trial" or "pretest posttest" or (phase adj5 (study or trial)) or (case* adj6 (matched or control*)) or (match* adj6 (pair or pairs or cohort* or control* or group* or healthy or age or sex or gender or patient* or subject* or participant*)) or (propensity adj6 (scor* or match*))).ti,ab,kf. or (confounding adj6 adjust*).ti,ab. or (versus or vs or compar*).ti. or ((exp cohort studies/ or epidemiologic studies/ or multicenter study/ or observational study/ or seroepidemiologic studies/ or (cohort* or 'follow up' or followup or longitudinal* or prospective* or retrospective* or observational* or multicent* or 'multi-cent*' or consecutive*).ti,ab,kf.) and ((group or groups or subgroup* or versus or vs or compar*).ti,ab,kf. or ('odds ratio*' or 'relative odds' or 'risk ratio*' or 'relative risk*' or aor or arr or rrr).ab. or (("OR" or "RR") adj6 CI).ab.)) |
5359298 |
|
8 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or cohort.tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] |
4368344 |
|
7 |
exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw. |
2555347 |
|
6 |
meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. |
649711 |
|
5 |
4 not ((Adolescent/ or Child/ or Infant/ or adolescen*.ti,ab,kf. or child*.ti,ab,kf. or schoolchild*.ti,ab,kf. or infant*.ti,ab,kf. or girl*.ti,ab,kf. or boy*.ti,ab,kf. or teen.ti,ab,kf. or teens.ti,ab,kf. or teenager*.ti,ab,kf. or youth*.ti,ab,kf. or pediatr*.ti,ab,kf. or paediatr*.ti,ab,kf. or puber*.ti,ab,kf.) not (Adult/ or adult*.ti,ab,kf. or man.ti,ab,kf. or men.ti,ab,kf. or woman.ti,ab,kf. or women.ti,ab,kf.)) |
128 |
|
4 |
1 and 2 and 3 |
134 |
|
3 |
Anesthetics/ or Anesthetics, Combined/ or Anesthetics, General/ or anesthe*.ti,ab,kf. or anaesthe*.ti,ab,kf. or Anesthesia/ or Anesthesia, Conduction/ or Anesthesia, General/ or Anesthesia, Intravenous/ or Anesthesia, Obstetrical/ or Anesthesia, Cardiac Procedures/ or exp Surgical Procedures, Operative/ or exp Specialties, Surgical/ or su.fs. or exp Perioperative Period/ or surgic*.ti,ab,kf. or surger*.ti,ab,kf. or operation*.ti,ab,kf. or operative.ti,ab,kf. or presurg*.ti,ab,kf. or preoperati*.ti,ab,kf. or pre-surg*.ti,ab,kf. or pre-operati*.ti,ab,kf. or perisurg*.ti,ab,kf. or perioperati*.ti,ab,kf. or peri-surg*.ti,ab,kf. or peri-operati*.ti,ab,kf. or postsurg*.ti,ab,kf. or postoperati*.ti,ab,kf. or post-surg*.ti,ab,kf. or post-operati*.ti,ab,kf. or nonsurg*.ti,ab,kf. or nonoperatic*.ti,ab,kf. or non-surg*.ti,ab,kf. or non-operati*.ti,ab,kf. or laparoscop*.ti,ab,kf. |
5687645 |
|
2 |
Consciousness Monitors/ or exp Neurophysiological Monitoring/ or bis.ti,ab,kf. or cascade elite.ti,ab,kf. or cascade pro.ti,ab,kf. or neuromaster g1.ti,ab,kf. or ((neurophysiologic* or anaesthesia depth or anesthesia depth or consciousness) adj3 monitor*).ti,ab,kf. or intellivue.ti,ab,kf. or bispectral index*.ti,ab,kf. |
109606 |
|
1 |
exp Obesity/ or obese*.ti,ab,kf. or obesit*.ti,ab,kf. or overweight*.ti,ab,kf. or 'over weight*'.ti,ab,kf. |
441489 |