Voorkeurskeuze bij indicatie premedicatie
Uitgangsvraag
Wat is de plaats van premedicatie met alpha-2 agonisten in vergelijking met premedicatie met benzodiazepines bij kinderen die algehele anesthesie ondergaan?
Aanbeveling
Gebruik, indien gekozen wordt voor premedicatie, bij voorkeur clonidine of dexmedetomidine (alpha-2 agonisten) boven midazolam (benzodiazepines) gezien het gunstigere bijwerkingenprofiel.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Voor de cruciale uitkomstmaat (acceptatie van masker) zijn uitkomsten gerapporteerd door de systematic review van Fu (2023). Zeven studies uit de systematic review van Fu (2023) rapporteerden acceptatie van het masker (Akin, 2012; Ghosh, 2020; Gupta, 2017; Saad, 2020; Sheta, 2014; Singla, 2015; Sundaram, 2011) waarbij er geen klinisch relevant verschil gevonden werd tussen de groep die premedicatie met een alpha-2 agonist (dexmedetomidine) of benzodiazepine (midazolam) kreeg.
De cruciale uitkomstmaat angst in de context van anesthesie bij kinderen werd niet gerapporteerd.
De overall bewijskracht is laag. Dit heeft te maken met het risico op bias door onduidelijke of onvolledige rapportage van randomisatie en toewijzing of door het gebrek aan blindering. Daarnaast hebben een aantal studies de timing van toedienen van het medicijn als limitatie gerapporteerd (Akin, 2012; Patel, 2015; Saad, 2020; Sundaram, 2011). Deze studies gaven aan dat de tijd totdat de alpha-2 agonist werkzaam is, langer is dan bij de benzodiazepine (midazolam). Daardoor zou het effect van de alpha-2 agonist in deze studies onderschat kunnen worden.
Ook is er inconsistentie gevonden tussen de studie van Akin (2012) en de andere studies voor zowel de uitkomst scheidingsangst van ouders en acceptatie van het masker. Deze inconsistentie kan niet verklaard worden. Er was hierbij sprake van een substantiële heterogeniteit welke door middel van een sensitiviteitanalyse toegekend werd aan de inclusie van één studie (Akin, 2012). Na het bekijken van deze specifieke studie konden er geen inhoudelijke of methodologische redenen worden gevonden die deze inconsistentie zouden verklaren. Bij het weglaten van deze studie werd door Fu (2023) een significant effect gevonden in het voordeel van dexmedetomidine.
In het geselecteerde artikel wordt geconcludeerd dat premedicatie middels dexmedetomidine mogelijk scheidingsangst bij het kind kan reduceren in vergelijking met midazolam. In deze module wordt scheidingsangst bij het kind als important outcome beschouwd. Binnen Nederland is de aanwezigheid van ouder(s) bij inductie bij electieve chirurgie gangbaar en heeft dit ook de sterke voorkeur. Derhalve is de conclusie in deze setting waarschijnlijk minder relevant. Het maken van een beslissing op basis van deze uitkomstmaat alleen lijkt daarom niet wenselijk.
In Nederland wordt premedicatie voornamelijk via de orale toedieningsroute toegediend, echter heeft de geïncludeerde studie van Fu (2023) uitsluitend gekeken naar intranasale toediening. Bij interpretatie van deze aanbeveling dient dit in ogenschouw te worden genomen.
Orale toediening van midazolam heeft een inwerkingstijd van circa 30 minuten en bij intranasale toediening van dexmedetomidine is de inwerkingstijd circa 45 minuten. Echter, in de studies van Fu (2023) en Yang (2022) werd er geen significant verschil gevonden.
De inwerkingstijd bij orale toediening van clonidine is lang (piek plasmaconcentratie na 60-90 minuten), waarbij er geen verschil bestaat met intranasale toediening. Hier dient rekening mee gehouden te worden indien wordt gekozen voor clonidine als premedicatie.
Naast de effectiviteit dient ook het bijwerkingenprofiel meegenomen te worden in een eventuele beslissing. Bij intranasale toediening van dexmedetomidine vonden zowel Fu (2023) als Yang (2022) een lagere systolische en diastolische bloeddruk in vergelijking met midazolam. Een significant lagere hartslag werd alleen door Yang (2022) gezien. De hemodynamische effecten bleven echter binnen acceptabele grenzen. Daarentegen had dexmedetomidine een mindere incidentie van nasale irritatie / discomfort, postoperatieve pijn met noodzaak tot rescue analgesie en postoperatief rillen. Tevens werd een lagere incidentie van emergence delirium gezien. Er werden geen significante verschillen gevonden in inwerkingstijd en recovery tijd en postoperatieve misselijkheid en braken.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
In Nederland is het gebruikelijk dat een ouder of verzorger aanwezig is bij de inductie.
De keuze tussen het gebruik van een benzodiazepine (midazolam) of alfa-2 agonisten (dexmedetomidine en clonidine) betreft geen voorkeursgevoelige beslissing. Het doel van de interventie is de acceptatie van het masker bij inductie, de angst verminderen en het voorkomen van onwenselijke peri- en postoperatieve gedragsveranderingen.
Voor de patiënt is er in de handeling van intranasale toediening van premedicatie geen verschil. Indien de premedicatie intranasaal wordt toegediend kan midazolam gepaard gaan met een hogere incidentie van nasale prikkeling in vergelijking met alfa-2 agonisten (dexmedetomidine en clonidine). Bij orale toediening kan midazolam een bittere smaak hebben welke moeilijk te maskeren kan zijn met bijvoorbeeld siroop.
Kosten (middelenbeslag)
Gezien het gunstigere bijwerkingsprofiel van de alfa2-agonist dexmedetomidine ten opzichte van midazolam kan het om deze reden potentieel de voorkeur hebben, echter is er geen gericht onderzoek naar de kosteneffectiviteit gedaan. Derhalve kan de commissie op dit gebied geen aanbeveling doen.
Een overweging ten aanzien de kosten; in 2024 is dexmedetomidine niet als drankvorm beschikbaar op de Nederlandse markt. Om die reden dient een ampul voor intraveneuze toediening gebruikt te worden welke 21-22 euro per ampul/patiënt kost. Midazolam is als drankvorm beschikbaar en komt volgens www.medicijnkosten.nl op ongeveer 0,12-0,30 euro per kg (voor de doseringen 0,2-0,5 mg/kg). Er is met name in Amerika veel onderzoek gedaan met dexmedetomidine voor de registratie sedatie. Clonidine was hiervoor al op de Europese markt en werd off label gebruikt voor preoperatieve anxiolyse en sedatie op kinder intensive cares. Clonidine drank kost in 2024 ongeveer 0,04 euro per kg (voor de dosis van 4 mcg/kg).
Gezien de fors lagere kosten van de alfa2-agonist clonidine ten opzichte van het beter onderzochte alfa2-agonist dexmedetomidine in de geincludeerde studies, beveelt de commissie aan om in Nederland vooralsnog clonidine (drank) naast midazolam (drank) beschikbaar te hebben voor de perioperatieve zorg voor kinderen in Nederland en op individuele basis voor te schrijven.
Aanvaardbaarheid, haalbaarheid en implementatie
Belangrijk is om eerdere ervaringen van de patiënt mee te nemen bij de keuze voor het type premedicatie. Na toediening van de premedicatie is monitoring niet noodzakelijk, enkel direct toezicht is nodig.
Er zijn geen kwantitatieve of kwalitatieve onderzoeken gedaan naar aanvaardbaarheid en haalbaarheid van de interventie. In veel ziekenhuizen is premedicatie met benzodiazepines (midazolam) de standaard werkwijze. Eventuele kennisvragen en beperkte ervaring met alfa-2 agonisten (dexmedetomidine en clonidine) in combinatie met een verandering in standaard werkwijze kunnen mogelijke implementatie van de aanbeveling beïnvloeden.
Het verschil in kosten tussen midazolam, dexmedetomidine en clonidine kan ook een factor spelen bij implementatie waarbij er op basis van het gunstige bijwerkingen profiel van alfa2-agonisten en de kosten van clonidine er een kleine voorkeur lijkt te bestaan voor clonidine boven midazolam tenzij er vlot effect bereikt dient te worden dan lijkt midazolam in het voordeel te zijn. Er zijn geen belemmerende factoren ten aanzien van implementatie van de interventie in relatie tot het benodigde aantal zorgverleners, de aanwezigheid van apparatuur, benodigde tijd of te verwachten acceptatie van de pediatrische patiënt en hun wettelijk vertegenwoordigers. De interventie heeft geen invloed op de gezondheidsgelijkheid.
Onderbouwing
Achtergrond
Indien de keuze is gemaakt tot het voorschrijven van premedicatie bestaan er vervolgens meerdere mogelijkheden. In Nederland verschillen de werkwijzen tussen ziekenhuizen hierover en worden zowel benzodiazepines als alpha-2 agonisten gebruikt. Binnen deze module wordt er gekeken naar de effectiviteit van beide middelen om een gewogen en passende beslissing te maken.
Conclusies / Summary of Findings
|
- GRADE |
No evidence was found regarding the effect of premedication with alpha-2 agonists on anxiety score when compared with premedication with benzodiazepines in children between age 0 and 16 going for pediatric sedation. |
|
Very low GRADE |
Premedication with alpha-2 agonists may have little to no effect on mask acceptance when compared with premedication with benzodiazepines as sedatives for children between age 0 and 16 going for pediatric sedation but the evidence is very uncertain.
Sources: (Akin, 2012; Ghosh, 2020; Gupta, 2017; Saad, 2020; Sheta, 2014; Singla, 2015; Sundaram, 2011) |
|
Very low GRADE |
Premedication with alpha-2 agonists may reduce separation anxiety from parents when compared with premedication with benzodiazepines as sedatives for children between age 0 and 16 going for pediatric sedation but the evidence is very uncertain.
Sources: (Akin, 2012l; Diwan, 2020; Gupra, 2017; Mostafa, 2013: Patel, 2015; Sheta, 2014; Singla, 2015; Sundaram, 2011) |
|
- GRADE |
No evidence was found regarding the effect of premedication with alpha2-agonists on behavioral changes when compared with premedication with benzodiazepines in children between age 0 and 16 going for pediatric sedation. |
Samenvatting literatuur
Summary of literature
Description of studies
Fu (2023) performed a systematic review including twenty randomized controlled trials comparing intranasal midazolam (benzodiazepine) with intranasal dexmedetomidine (Alpha-2 agonist) as anesthetic premedication in children (Sundaram, 2011; Akin, 2012; Mostafa, 2013; Surendar, 2014; Sheta, 2014; Singla, 2015; Patel, 2015; Abdelaziz, 2016; Neville, 2016; Fei, 2017; Gupta, 2017; Messeha, 2018; Azizkhani, 2020; Diwan, 2020; Ghosh, 2020; Saad, 2020; Panda, 2021; Gupta, 2021; Abussina, 2022; Agarwal, 2022). Studies were included in the systematic review when study participants were under the age of 18 years, using midazolam versus alpha-2-adrenoceptor agonists via intranasal route as the sedative premedication, were randomized controlled trials and reported at least one of the following outcomes: Number of patients with satisfactory separation from parents, number of patients with satisfactory induction or mask acceptance and patient’s level of sedation.
The included studies were published from 2011 to 2022 and in total 1435 patients were included in the analysis with ages ranged from 1 month to 14 years.
Regarding the outcomes of interest in the present analysis, eight studies in the systematic review reported satisfactory parental separation (Akin, 2012; Diwan, 2020; Gupta, 2017; Mostafa, 2013; Patel, 2015; Sheta, 2014; Singla, 2015; Sundaram, 2011) and seven studies in the systematic review reported satisfactory induction or mask acceptance (Akin, 2012; Ghosh, 2020; Gupta, 2017; Saad, 2020; Sheta, 2014; Singla, 2015; Sundaram, 2011). These studies, patient and premedication characteristics and outcome measurement (scales) are summarized in table 1.
|
Number of patients (N) |
Patient age range (in years) |
Intranasal midazolam dose |
Intranasal dexmedetomidine dose |
Measurement (scale) satisfactory parental separation |
Measurement (scale) satisfactory induction or mask acceptance |
|
|
Diwan (2020) |
60 |
2-12 |
0.2 mg/kg |
1 µg/kg |
Successful parental separation yes/no |
NR |
|
Patel (2015) |
70 |
2-6 |
0.3 mg/kg |
1 µg/kg |
Child-Parent separation score (3-point scale); 1=successful |
NR |
|
Mostafa (2013) |
64 |
2-8 |
0.2 mg/kg |
1 µg/kg |
Sedation scale score (4-point scale); 1=successful |
NR |
|
Akin (2012) |
90 |
2-9 |
0.2 mg/kg |
1 µg/kg |
Anxiety score (4-point scale); 1=successful |
Three-point scale for degree of mask acceptance; 1- 2=successful |
|
Gupta (2017) |
60 |
1-8 |
0.2 mg/kg |
1 µg/kg |
Successful parental separation (patients were calm and sedated, not crying and agitated and allowed smooth induction) yes/no |
Observer’s Assessment of Alertness/Sedation (OAA/S) scale (6-point scale); 1-4 satisfactory sedation |
|
Sheta (2014) |
72 |
3-6 |
0.2 mg/kg |
1 µg/kg |
Sedation score at separation from parents (4-point scale); unsatisfactory response yes/no |
Mask appliance scale (4-point); 3-4=successful |
|
Singla (2015) |
60 |
3-10 |
0.5 mg/kg |
1 µg/kg |
Parental Separation Anxiety Scale (PSAS) (4-point scale); 1-2=successful |
Mask Acceptance Scale (MAS) (4-point scale); 1-2=successful |
|
Sundaram (2011) |
80 |
2-9 |
0.2 mg/kg |
1 µg/kg |
Satisfactory sedation at separation from parents; NR when successful |
Satisfactory sedation at induction; NR when successful |
|
Ghosh (2020) |
90 |
2-8 |
0.5 mg/kg |
2 µg/kg |
NR |
Ramsay Sedation Score (6-point scale); 3-6=successful |
|
Saad (2020) |
48 |
3-7 |
0.2 mg/kg |
1 µg/kg |
NR |
Mask Acceptance Score (3-point scale); 1-2=successful |
|
NR: Not reported; |
||||||
Results
Anxiety score – Critical outcome
The systematic review of Fu (2023) did not report anxiety scores.
Mask acceptance – Critical outcome
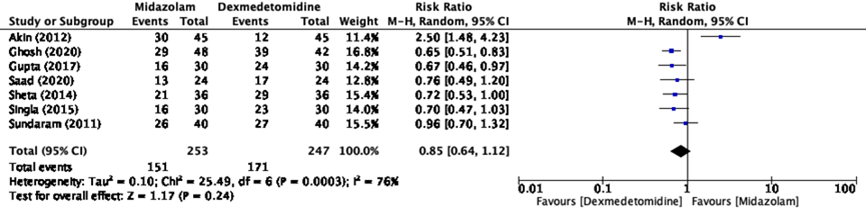
Seven studies in the systematic review of Fu (2023) reported patients with satisfactory induction or mask acceptance (Akin, 2012; Gosh, 2020; Gupta, 2017; Saad, 2020; Sheta, 2014; Singla, 2015; Sundaram, 2011). The pooled risk ratio is 0.85 (95%CI 0.64-1.12) favoring premedication with dexmedetomidine (figure 2). This difference is not clinically relevant.
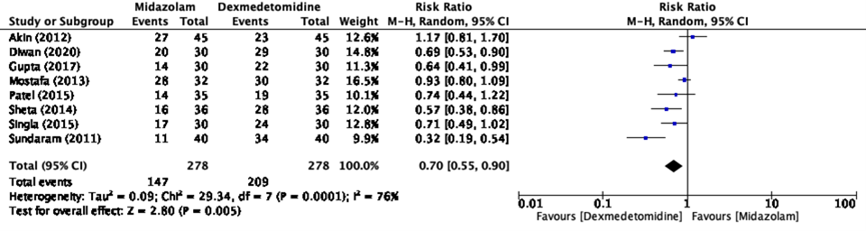
Figure 1 Satisfactory separation from parents for premedication with dexmedetomidine versus midazolam
Separation anxiety from parents – Important outcome
Eight studies in the systematic review of Fu (2023) reported satisfactory parental separation (Akin, 2012; Diwan, 2020; Gupta, 2017; Mostafa, 2013; Patel, 2015; Sheta, 2014; Singla, 2015; Sundaram, 2011). The pooled risk ratio is 0.70 (95%CI 0.55-0.90) favoring premedication with dexmedetomidine (figure 1). This difference is clinically relevant.
Figure 2 Satisfactory induction or mask acceptance for premedication with dexmedetomidine versus midazolam
Behavioral changes – Important outcome
The systematic review of Fu (2023) did not report behavioral changes.
Level of evidence of the literature
The level of evidence for all outcomes under this comparison was based on randomized studies and therefore starts at high.
Mask acceptance
The level of evidence regarding the outcome measure separation anxiety from parents was downgraded to very low GRADE because of study limitations (-1; risk of bias), conflicting results (-1; inconsistency) and number of included patients (-1; imprecision because the confidence interval includes the possibility of a positive effect or no effect).
Separation anxiety from parents
The level of evidence regarding the outcome measure separation anxiety from parents was downgraded to very low GRADE because of study limitations (-1; risk of bias), conflicting results (-1; inconsistency) and number of included patients (-1; imprecision because the confidence interval includes the possibility of a positive effect or no effect).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the effect of premedication with Alpha-2 agonists compared with premedication with benzodiazepines in children between age 0 and 16 going for pediatric sedation?
| P: | children between age 0 and 16 going for pediatric sedation; |
| I: | premedication with Alpha-2 agonists; |
| C: | premedication with benzodiazepines; |
| O: |
anxiety score (e.g. measured using the mYPAS), mask acceptance, separation anxiety and behavioral changes. |
Relevant outcome measures
The guideline development group considered anxiety score and mask acceptance as a critical outcome measure for decision making and separation anxiety (from parents) and behavioral change as an important outcome measure for decision making.
The working group defined a minimal clinically important difference as a difference of 10 points on the measurement instrument for the outcome anxiety. The working group defined 25% absolute difference, RR 0.8 < or > 1.25 as a minimal clinically (patient) important difference for the outcomes mask acceptance, separation anxiety (from parents) and behavioral changes.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until March 28, 2023. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 1091 hits (275 systematic reviews and 816 RCTs). The systematic review was selected based on the following criteria:
• Minimum of two databases searched;
• Detailed search strategy with search date;
• In- and exclusion criteria;
• Evidence table for included studies;
• Risk of bias assessment per study;
• Intervention and Comparison according to the PICO;
• Study population according to the PICO.
Additionally, systematic reviews were excluded when superseded by a more recent systematic review containing identical and newer relevant data. After reading the full text, nine studies were excluded (see the table with reasons for exclusion under the tab Methods), and one systematic review was included.
Results
One systematic review is included in the analysis of the literature. Important study characteristics and results are summarized in the evidence table. The assessment of the risk of bias is summarized in the risk of bias table.
Referenties
- Akin A, Bayram A, Esmaoglu A, Tosun Z, Aksu R, Altuntas R, Boyaci A. Dexmedetomidine vs midazolam for premedication of pediatric patients undergoing anesthesia. Paediatr Anaesth. 2012 Sep;22(9):871-6. doi: 10.1111/j.1460-9592.2012.03802.x. Epub 2012 Jan 23. PMID: 22268591.
- Diwan G, Bharti AK, Rastogi K, Gupta PK. Comparison of Intranasal Dexmedetomidine and Midazolam as Premedication in Pediatric Surgical Patients: A Prospective, Randomized Double-Blind Study. Anesth Essays Res. 2020 Jul-Sep;14(3):384-389. doi: 10.4103/aer.AER_102_20. Epub 2021 Mar 22. PMID: 34092846; PMCID: PMC8159050.
- Fu Y, Zhang Q, Jiang Y, Lang B. A comparative evaluation of intranasal ?2-adrenoceptor agonists and intranasal midazolam as premedication in pediatric sedation: A meta-analysis of randomized controlled trials. PLoS One. 2023 Feb 14;18(2):e0281751. doi: 10.1371/journal.pone.0281751. PMID: 36787332; PMCID: PMC9928077.
- Ghosh A, Das AK, Mukherjee M, Bagum SA, Chatterjee S. Comparative evaluation of intranasal dexmedetomidine & intranasal midazolam for pre-operative sedation in children. J Evol Med Dent Sci. 2020;9:731-735.
- Gupta A, Dalvi NP, Tendolkar BA. Comparison between intranasal dexmedetomidine and intranasal midazolam as premedication for brain magnetic resonance imaging in pediatric patients: A prospective randomized double blind trial. J Anaesthesiol Clin Pharmacol. 2017 Apr-Jun;33(2):236-240. doi: 10.4103/joacp.JOACP_204_16. PMID: 28781452; PMCID: PMC5520599.
- Mostafa MG, Morsy KM. Premedication with intranasal dexmedetomidine, midazolam and ketamine for children undergoing bone marrow biopsy and aspirate. Egypt J Anesth. 2013;29:131-135.
- Patel DD, Lisha M, Upadhyay MR. Pre anaesthetic medication in children: a comparison of intranasal dexmedetomidine versus intranasal midazolam. J Med Res. 2015;1(2):59-63.
- Saad BB, Tharwat AI, Ghobrial HN, Elfawal SM. Intranasal dexmedetomidine versus intranasal midazolam as pre-anesthetic medication in pediatric age group undergoing adenotonsillectomy. Ain Shams J Anaesthesiol. 2020;12(1):1-10.
- Sheta SA, Al-Sarheed MA, Abdelhalim AA. Intranasal dexmedetomidine vs midazolam for premedication in children undergoing complete dental rehabilitation: a double-blinded randomized controlled trial. Paediatr Anaesth. 2014 Feb;24(2):181-9. doi: 10.1111/pan.12287. Epub 2013 Nov 15. PMID: 24237879.
- Singla D, Chaudhary G, Dureja J, Mangla M. Comparison of dexmedetomidine versus midazolam for intranasal premedication in children posted for elective surgery: a double-blind, randomized study. South Afr J Anesth Analg. 2015;21:154-7.
- Sundaram AM, Mathian VM. A comparative evaluation of intranasal dexmedetomidine and intranasal midazolam for premedication in children: a double-blind randomized controlled trial. J Indian Dent Assoc. 2011;5:777-81.
- Yang CQ, Yu KH, Huang RR, Qu SS, Zhang JM, Li YL. Comparison of different sedatives in children before general anaesthesia for selective surgery: A network meta-analysis. J Clin Pharm Ther. 2022 Oct;47(10):1495-1505. doi: 10.1111/jcpt.13763. Epub 2022 Aug 27. PMID: 36029118.
Evidence tabellen
Research question: What is the effect of premedication with Alpha-2 agonists compared with premedication with benzodiazepines in children between age 0 and 16 going for pediatric sedation?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Fu, 2023
[individual study characteristics deduced from [Akin, 2012; Diwan, 2020; Ghosh, 2020; Gupta, 2017; Mostafa, 2013; Patel, 2015; Saad, 2020; Sheta, 2014; Singla, 2015; Sundaram, 2011 ]]
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to April 2022
A: Akin, 2012 B: Diwan, 2020 C: Ghosh, 2020 D: Gupta, 2017 E: Mostafa, 2013 F: Patel, 2015 G: Saad, 2020 H: Sheta, 2014 I: Singla, 2015 J: Sundaram, 2011
Study design: RCT [parallel / cross-over], cohort [prospective / retrospective], case-control
Setting and Country:
Source of funding and conflicts of interest: [commercial / non-commercial / industrial co-authorship]
|
Inclusion criteria SR: - Studies had to include children (< 18 years old) who experienced various presurgical and pre-pocedural sedation - Studies had to use midazolam versus alpha-2 adrenoceptor agonists via intranasal route as the sedative premedication - Studies had to report at least one of the following primary outcomes: Satisfactory parental separation, anesthesia induction or facemask acceptance and patient’s level of sedation. Onset of sedation, recovery time, general hemodynamic parameters, incidence of postoperative pain needed analgesics rescue and various adverse effect were considered as secondary outcomes - Randomized Controlled trial
Exclusion criteria SR: - Reviews, conference abstracts, cases, comments, preclinical studies, protocol, ongoing trials - Studies not published in English or Chinese - Studies with inappropriate comparisons or unrelated outcome measures
21 studies included; Regarding the scope of this review, only data of 10 studies are reported
Important patient characteristics at baseline:
N, patient age range A: 90, 2-9 years B: 60, 2-12 years C: 90, 2-8 years D: 60, 1-8 years E: 64, 2-8 years F: 70, 2-6 years G: 48, 3-7 years H: 72, 3-6 years I: 60, 3-10 years J: 80, 2-9 years
ASA status A: ASA I B: ASA I-II C: ASA I-II D: ASA I-II E: ASA II F: ASA I-II G: ASA I H: ASA I-II I: ASA I J: ASA I
Gender (F/M) A: 37/53 B: 27/33 C: 20/70 D: 26/34 E: NR F: NR G: 19/29 H: 41/31 I: 29/31 J: 40/40
Type of surgery/procedure A: Elective adenotonsillectomy B: Elective surgery C: Elective surgery D: Elective brain magnetic resonance imaging E: Bone marrow biopsy and aspirate F: Minor general surgical procedures G: Adenotonsillectomy H: Complete dental rehabilitation I: Elective surgery J: Elective full mouth rehabilitation
Groups comparable at baseline: No |
Alpha2-adrenoceptor agonist (Dexmedetomidine)
A: 0.2 mg/kg B: 0.2 mg/kg C: 0.5 mg/kg D: 0.2 mg/kg E: 0.2 mg/kg F: 0.3 mg/kg G: 0.2 mg/kg H: 0.2 mg/kg I: 0.5 mg/kg J: 0.2mg/kg
|
Benzodiazepines (Midazolam)
A: 1 µg/kg B: 1 µg/kg C: 2 µg/kg D: 1 µg/kg E: 1 µg/kg F: 1 µg/kg G: 1 µg/kg H: 1 µg/kg I: 1 µg/kg J: 1 µg/kg
|
End-point of follow-up: Not reported by systematic review
For how many participants were no complete outcome data available? Not reported by systematic review
|
Outcome measure-1 Defined as number of patients with satisfactory separation from parents
Effect measure: RR [95% CI]: A: 1.17 [0.81-1.70] B: 0.69 [0.53-0.90] C: - D: 0.64 [0.41-0.99] E: 0.93 [0.80-1.09] F: 0.74 [0.44-1.22] G: - H: 0.57 [0.38-0.86] I: 0.71 [0.49-1.02] J: 0.32 [0.19-0.54]
Pooled effect (random effects model model): RR 0.70 [95% CI 0.55 to 0.90] favoring dexmedetomidine Heterogeneity (I2): 76%
Outcome measure-2 Defined as number of patients with satisfactory induction or mask acceptance
Effect measure: RR [95% CI]: A: 2.50 [1.48-4.23] B: - C: 0.65 [0.51-0.83] D: 0.67 [0.46-0.97] E: - F: - G: 0.76 [0.49-1.20] H: 0.72 [0.53-1.00] I: 0.70 [0.47-1.03] J: 0.96 [0.70-1.32]
Pooled effect (random effects model model): RR 0.85 [95% CI 0.64 to 1.12] favoring dexmedetomidine Heterogeneity (I2): 76%
|
Risk of bias (high, some concerns or low): Tool used by authors (Cochrane Collaboration’s risk of bias tool):
A: Some concerns B: Low C: Some concerns D: Some concerns E: Some concerns F: Some concerns G: Some concerns H: Some concerns I: Some concerns J: Some concerns
Facultative: Brief description of author’s conclusion: And overall low and moderate quality evidences evaluated by GRADE system suggest that superiority of intranasal α2-adrenoceptor agonists in pediatric sedation needs to be validated by more future studies with high quality and large sample size.
Heterogeneity in study population between individual studies (age, measurement scales for outcomes)
Level of evidence: GRADE (per outcome measure): Satisfactory separation from parents: Moderate GRADE (downgrade for inconsistency) Satisfactory induction or mask acceptance: Moderate GRADE (downgrade for inconsistency)
Sensitivity analysis regarding outcome measure-2 (satisfactory induction or mask acceptance): Excluding Akin (2012); I2 = 0%; RR 0.73 (95%CI 0.64-0.83)
Some studies reported limitations regarding timing of drug administration, dexmedetomidine was not allowed to reach its peak effect before mask induction whereas 45-60 minutes is too long for midazolam |
Risk of bias table for intervention studies (randomized controlled trials; based on Cochrane risk of bias tool and suggestions by the CLARITY Group at McMaster University)
Research question: What is the effect of premedication with Alpha-2 agonists compared with premedication with benzodiazepines in children between age 0 and 16 going for pediatric sedation?
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
Akin, 2012 |
Definitely yes;
Reason: Random allocation by computer-generated table of random numbers |
No information;
Reason: No information on allocation concealment |
Probably yes;
Reason: Patients, health care providers and outcome assessors were blinded. |
Probably yes;
Reason: No loss to follow-up reported |
Probably yes;
Reason: All relevant outcomes were reported |
Probably no;
Reason: Study reported limitation regarding timing of drug administration, dexmedetomidine was not allowed to reach its peak effect before mask induction whereas 45-60 minutes is too long for midazolam |
Some concerns (regarding timing of drug administration) |
|
Diwan, 2020 |
Definitely yes;
Reason: Central randomization with computer generated random numbers |
Definitely yes;
Reason: Opaque, sealed envelopes were used. |
Probably yes;
Reason: Double-blind study, not clear if healthcare providers and/or outcome assessors were blinded |
Probably yes;
Reason: No loss to follow-up reported |
Probably yes
Reason: All relevant outcomes were reported; |
Probably yes;
Reason: No other problems noted |
LOW
|
|
Ghosh, 2020 |
Definitely yes;
Reason: Central randomization with computer generated random numbers |
No information;
Reason: No information on allocation concealment |
Probably yes;
Reason: Double-blind study, not clear if healthcare providers and/or outcome assessors were blinded |
Probably yes;
Reason: No loss to follow-up reported |
Probably yes;
Reason: All relevant outcomes were reported |
Probably yes;
Reason: No other problems noted |
|
|
Gupta, 2017 |
No information;
Reason: No information on generation of allocation sequence |
No information;
Reason: No information on allocation concealment |
Definitely yes;
Reason: Double-blind study, observers and attending anaesthesiologists were blinded to the study drug |
Probably yes;
Reason: No loss to follow-up reported |
Probably yes;
Reason: All relevant outcomes were reported |
Probably yes;
Reason: No other problems noted |
Some concerns (regarding no information on allocation generation and concealment) |
|
Mostafa, 2013 |
No information;
Reason: No information on generation of allocation sequence |
No information;
Reason: No information on allocation concealment |
Definitely yes;
Reason: Double-blind study, observers and attending anaesthesiologists were blinded to the study drug |
Probably yes;
Reason: No loss to follow-up reported |
Probably yes;
Reason: All relevant outcomes were reported |
Probably yes;
Reason: No other problems noted |
Some concerns (regarding no information on allocation generation and concealment) |
|
Patel, 2015 |
Definitely yes;
Reason: Randomization with software generated random numbers |
No information;
Reason: No information on allocation concealment |
Probably no;
Reason: Single-blinded study, no information on blinding of healthcare providers, assessors or data analysts |
Probably yes;
Reason: No loss to follow-up reported |
Probably yes;
Reason: All relevant outcomes were reported |
Probably no;
Reason: Study reported limitation regarding timing of drug administration, dexmedetomidine was not allowed to reach its peak effect before mask induction whereas 45-60 minutes is too long for midazolam |
Some concerns (regarding blinding and timing of drug administration) |
|
Saad, 2020 |
Definitely yes;
Reason: Central randomization with computer generated random numbers |
No information;
Reason: No information on allocation concealment |
Probably no;
Reason: Double-blind study, drug administration by anaesthetic technician who was not blinded |
Probably yes;
Reason: No loss to follow-up reported |
Probably yes;
Reason: All relevant outcomes were reported |
Probably no;
Reason: Study reported limitation regarding timing of drug administration, dexmedetomidine was not allowed to reach its peak effect before mask induction whereas 45-60 minutes is too long for midazolam |
Some concerns (regarding blinding and timing of drug administration) |
|
Sheta, 2014 |
Definitely yes;
Reason: Central randomization with computer generated random numbers |
No information;
Reason: No information on allocation concealment |
Definitely yes;
Reason: Patients, healthcare professionals, observer and data collectors were blinded to the study drug. Master codes were held by a person who did not participate in the observation |
Probably yes;
Reason: Three patients (8%) in the intervention group and four (11%) in the control group failed to take the medication. Patients were excluded and replaced to maintain equal numbers in both groups. |
Probably yes;
Reason: All relevant outcomes were reported |
Probably yes;
Reason: No other problems reported |
LOW
|
|
Singla, 2015 |
Definitely yes;
Reason: Central randomization with computer generated random numbers |
No information;
Reason: No information on allocation concealment |
Probably yes;
Reason: Double-blind study, not clear if healthcare providers and/or outcome assessors were blinded |
Probably yes;
Reason: No loss to follow-up reported |
Probably yes;
Reason: All relevant outcomes were reported |
Probably yes;
Reason: No other problems reported |
LOW
|
|
Sundaram, 2011 |
No information;
Reason: No information on generation of allocation sequence |
No information;
Reason: No information on allocation concealment |
Definitely yes;
Reason: Double-blind study, observers and attending anaesthesiologists were blinded to the study drug given. |
No information;
Reason: Six patients (6.5%) resisted intranasal drug administration, no information on distribution of the six patients in the intervention or control group. |
Probably yes;
Reason: All relevant outcomes were reported |
Probably no; Reason: Study reported premedication period of 60 minutes for intranasal dexmedetomidine, however some children were transferred to the OR slightly earlier. If longer premedication period was allowed, possibly more patients could have attained satisfactory sedation at separation from parents and at induction of anaesthesia. |
Some concerns (regarding no information on allocation generation or concealment, no information on loss to follow-up and premedication period) |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Lang, B. and Zhang, L. and Zhang, W. and Lin, Y. and Fu, Y. and Chen, S. A comparative evaluation of dexmedetomidine and midazolam in pediatric sedation: A meta-analysis of randomized controlled trials with trial sequential analysis. CNS Neuroscience and Therapeutics. 2020; 26 (8) :862-875
|
This study is superseded by a more recent systematic review |
|
Yang, C. Q. and Yu, K. H. and Huang, R. R. and Qu, S. S. and Zhang, J. M. and Li, Y. L. Comparison of different sedatives in children before general anaesthesia for selective surgery: A network meta-analysis. Journal of Clinical Pharmacy and Therapeutics. 2022; 47 (10) :1495-1505
|
This study is used in the considerations |
|
Goswami, M. and Sangal, A. and Rahman, B. and Chawla, S. Comparison of the safety and efficacy of dexmedetomidine with midazolam for the management of paediatric dental patients: A systematic review. Journal of the Indian Society of Pedodontics and Preventive Dentistry. 2021; 39 (3) :233-239
|
This study is superseded by a more recent systematic review |
|
Pasin, L. and Febres, D. and Testa, V. and Frati, E. and Borghi, G. and Landoni, G. and Zangrillo, A. Dexmedetomidine vs midazolam as preanesthetic medication in children: A meta-analysis of randomized controlled trials. Paediatric Anaesthesia. 2015; 25 (5) :468-476
|
This study is superseded by a more recent systematic review |
|
Feng, J. F. and Wang, X. X. and Lu, Y. Y. and Pang, D. G. and Peng, W. and Mo, J. L. Effects of dexmedetomidine versus midazolam for premedication in paediatric anaesthesia with sevoflurane: A meta-analysis. Journal of International Medical Research. 2017; 45 (3) :912-923 |
This study is superseded by a more recent systematic review |
|
Dwivedi, P. and Patel, T. K. and Bajpai, V. and Singh, Y. and Tripathi, A. and Kishore, S. Efficacy and safety of intranasal ketamine compared with intranasal dexmedetomidine as a premedication before general anesthesia in pediatric patients: a systematic review and meta-analysis of randomized controlled trials. Canadian Journal of Anesthesia. 2022; 69 (11) :1405-1418
|
Wrong comparison |
|
Sun, Y. and Lu, Y. and Huang, Y. and Jiang, H. Is dexmedetomidine superior to midazolam as a premedication in children? A meta-analysis of randomized controlled trials. Paediatric Anaesthesia. 2014; 24 (8) :863-874
|
This study is superseded by a more recent systematic review |
|
Peng, K. and Wu, S. and Ji, F. and Li, J. Premedication with dexmedetomidine in pediatric patients: a systematic review and meta-analysis. Clinics (São Paulo, Brazil). 2014; 69 (11) :777-786
|
This study is superseded by a more recent systematic review |
|
Taneja S, Jain A. Systematic review and meta-analysis comparing the efficacy of dexmedetomidine to midazolam as premedication and a sedative agent in pediatric patients undergoing dental procedures. Oral Maxillofac Surg. 2022 Jun 27. doi: 10.1007/s10006-022-01087-6. Epub ahead of print. PMID: 35759132. |
Wrong setting (sedative) |
|
Plambech, M. Z. and Afshari, A. Dexmedetomidine in the pediatric population: A review. Minerva Anestesiologica. 2015; 81 (3) :320-332
|
No systematic review |
|
Fitzsimons, J. and Bonanno, L. S. and Pierce, S. and Badeaux, J. Effectiveness of preoperative intranasal dexmedetomidine, compared with oral midazolam, for the prevention of emergence delirium in the pediatric patient undergoing general anesthesia: A systematic review. JBI Database of Systematic Reviews and Implementation Reports. 2017; 15 (7) :1934-1951
|
Wrong outcome |
|
AlSarheed, M. A. Intranasal sedatives in pediatric dentistry. Saudi Medical Journal. 2016; 37 (9) :948-956
|
Search was performed in 1 database. This study is superseded by a more recent systematic review |
|
Khurmi, N. and Patel, P. and Kraus, M. and Trentman, T. Pharmacologic Considerations for Pediatric Sedation and Anesthesia Outside the Operating Room: A Review for Anesthesia and Non-Anesthesia Providers. Pediatric Drugs. 2017; 19 (5) :435-446
|
Wrong outcome |
|
Zhang, C. and Li, J. and Zhao, D. and Wang, Y. Prophylactic midazolam and clonidine for emergence from agitation in children after emergence from sevoflurane anesthesia: A meta-analysis. Clinical Therapeutics. 2013; 35 (10) :1622-1631
|
Wrong outcome |
|
Parashchanka, A. and Schelfout, S. and Coppens, M. Role of novel drugs in sedation outside the operating room: Dexmedetomidine, ketamine and remifentanil. Current Opinion in Anaesthesiology. 2014; 27 (4) :442-447
|
No systematic review |
|
Meng, Q. Y. and Huang, H. M. and Xu, H. The sedative effect of dexmedetomidine in outpatient undergoing dental surgery compared to several sedative drugs:a meta analysis. Shanghai kou qiang yi xue = Shanghai journal of stomatology. 2019; 28 (1) :100-109
|
Written in foreign language (Chinese) |
|
Oza RR, Sharma V, Suryawanshi T, Lulla S, Bajaj P, Dhadse P. Comparative Analysis of Sedative Efficacy of Dexmedetomidine and Midazolam in Pediatric Dental Practice: A Systematic Review and Meta-Analysis. Cureus. 2022 Aug 26;14(8):e28452. doi: 10.7759/cureus.28452. PMID: 36176880; PMCID: PMC9510641. |
Wrong setting (sedative) |
|
Lee-Archer P, McBride C, Paterson R, Reade M, Regli-von Ungern-Sternberg B, Long D. Does dexmedetomidine given as a premedication or intraoperatively reduce post-hospitalisation behaviour change in children? A study protocol for a randomised controlled trial in a tertiary paediatric hospital. BMJ Open. 2018 Apr 17;8(4):e019915. doi: 10.1136/bmjopen-2017-019915. PMID: 29666130; PMCID: PMC5905739. |
Study protocol |
|
Jun JH, Kim KN, Kim JY, Song SM. The effects of intranasal dexmedetomidine premedication in children: a systematic review and meta-analysis. Can J Anaesth. 2017 Sep;64(9):947-961. English. doi: 10.1007/s12630-017-0917-x. Epub 2017 Jun 21. PMID: 28639236. |
This study is superseded by a more recent systematic review |
|
Xu C, Zhang Y, Zhang T, Wu D, Zhang K. Efficacy and Safety of Intranasal Dexmedetomidine During Recovery From Sevoflurane Anesthesia in Children: A Systematic Review and Meta-analysis. Clin Neuropharmacol. 2021 Sep-Oct 01;44(5):157-168. doi: 10.1097/WNF.0000000000000466. PMID: 34347636. |
This study is superseded by a more recent systematic review |
|
Dave NM. Premedication and Induction of Anaesthesia in paediatric patients. Indian J Anaesth. 2019 Sep;63(9):713-720. doi: 10.4103/ija.IJA_491_19. PMID: 31571684; PMCID: PMC6761781. |
No systematic review |
|
Lin J, Wu C, Zhao D, Du X, Zhang W, Fang J. The Sedative Effects of Inhaled Nebulized Dexmedetomidine on Children: A Systematic Review and Meta-Analysis. Front Pediatr. 2022 May 20;10:865107. doi: 10.3389/fped.2022.865107. PMID: 35669400; PMCID: PMC9163573. |
Wrong comparison |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 18-12-2024
Bij het opstellen van de module heeft de werkgroep een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijnmodule komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
|
Regiehouder(s)[1] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijnmodule[2] |
Frequentie van beoordeling op actualiteit[3] |
Wie houdt er toezicht op actualiteit[4] |
Relevante factoren voor wijzigingen in aanbeveling[5] |
|
NVA |
2024 |
2025 |
Jaarlijks |
NVA |
Geen |
[1] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[2] Maximaal na vijf jaar
[3] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[4] regie voerende vereniging, gedeelde regie voerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[5] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). Patiënten participatie bij deze richtlijn werd medegefinancierd uit de Stichting Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ. De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Het doel van de richtlijn Anesthesie bij kinderen is het beantwoorden van de vraag wat wij in Nederland verantwoorde anesthesiologische zorgverlening aan kinderen vinden. Het effect van de richtlijn moet zijn dat de kwaliteit en de veiligheid van de anesthesiologische zorgverlening aan kinderen verbetert. Met de richtlijn wordt inzichtelijk hoe deze zorg op een hoog niveau gehandhaafd blijft of daar waar nodig, zelfs verbetert of optimaliseert. Het definiëren van kwaliteitscriteria moet de toetsbaarheid vergroten.
Doelgroep
Deze richtlijn is geschreven voor zorgverleners in de tweede en derde lijn die betrokken zijn bij de zorg voor patiënten van 0 tot en met 15 jaar die een behandeling krijgen waarbij de ondersteuning van een anesthesioloog noodzakelijk is.
Afbakening van de richtlijn
De richtlijn anesthesie beperkt zich tot die anesthesiologische zorgverlening aan kinderen die gepland kan worden. Voor de niet geplande zorg verwijzen we naar het protocol “Acute opvang van zuigelingen en kinderen” welke te vinden is op de website van de Sectie KinderAnesthesie van de Nederlandse Verening voor Anesthesiologie.
Relevante richtlijnen en documenten
De afgelopen jaren zijn er veel richtlijnen verschenen of herzien die raakvlakken hebben met de anesthesiologische zorgverlening aan kinderen waardoor bij de herziening modules zijn verwijderd of adviezen moesten worden aangepast.
Belangrijke documenten zijn:
- NVA Leidraad perioperatieve zorg 2024
- Richtlijn Perioperatief Voedingsbeleid
- Richtlijn Sedatie, Analgesie en niet-farmacologische interventies voor begeleiding van kinderen bij medische procedures
- Richtlijn Postoperatieve Pijn, module ‘Postoperatieve pijnbehandeling bij kinderen’
Samenstelling werkgroep
Huidige samenstelling van de werkgroep:
- Dr. B. (Bouwe) Molenbuur, voorzitter, kinderanesthesioloog, werkzaam in het Universitair Medisch Centrum Groningen / Beatrix Kinderziekenhuis, NVA
- Drs. M.F. (Matthijs) Vogels, kinderanesthesioloog, werkzaam in het Erasmus MC Sophia, NVA
- Dr. J.A.W. (Jorinde) Polderman, kinderanesthesioloog, werkzaam in het Amsterdam UMC, NVA
- Drs. E.M.J.M. (Ellen) Backus, kinderanesthesioloog, werkzaam in het ZGT, vrijgevestigd, NVA
- Dr. A.F.W. (Lideke) van der Steeg, kinderchirurg, werkzaam in het Prinses Máxima Centrum, NVvH
- Dr. A.S. (Anneke) Jaarsma, kinderarts, werkzaam in het Universitair Medisch Centrum Groningen, NVK
- Drs. A.J.M. (Antoon) van der Rijt, KNO-arts, werkzaam in het Amphia Ziekenhuis Breda, NVKNO
- Mw. M. (Marjolein) Jager, beleids- en projectmedewerker, Stichting Kind en Ziekenhuis
- Mw. E. (Esen) Doganer, beleids- en projectmedewerker, Stichting Kind en Ziekenhuis
Klankbordgroeplid
- Dr. J.N.M (Jan) Schieveld, kinder- en jeugdpsychiater, werkzaam in het Maastricht UMC+
Met ondersteuning van
- Drs. T. (Tessa) Geltink, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. D. (Dagmar) Nieboer, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Molenbuur (voorzitter) |
Anesthesioloog en dedicated teamleider kinderanesthesiologie, Universitair Medisch Centrum Groningen / Beatrix Kinderziekenhuis
|
Voorzitter taskforce onverwachte perioperatieve encephalopathie
|
Geen |
Geen restricties |
|
Vogels |
Kinderanesthesioloog, Erasmus MC Sophia Kinderziekenhuis (per 01-12-2023)
|
APLS instructeur, Stichting Spoedeisende Hulp bij Kinderen (Riel, NL)
|
Geen |
Geen restricties |
|
Polderman |
Kinderanesthesioloog, Amsterdam UMC
|
Geen |
Geen |
Geen restricties |
|
Backus |
Kinderanesthesioloog ZGT, vrijgevestigd
|
Geen |
Geen |
Geen restricties |
|
Steeg |
Kinderchirurg, Prinses Máxima Centrum
|
Bestuur Nederlandse Vereniging voor Heelkunde (vacatiegelden)
|
Geen |
Geen restricties |
|
Jaarsma |
Kinderarts, UMCG |
Geen |
Geen |
Geen restricties |
|
Van der Rijt |
KNO-arts Amphia ziekenhuis Breda
|
Geen |
Geen |
Geen restricties |
|
Jager |
Junior beleids- en projectmedewerker |
Geen |
Geen |
Geen restricties |
|
Doganer |
Junior projectmanager/beleidsmedewerker. Stichting Kind en Ziekenhuis
|
Geen |
Geen |
Geen restricties |
|
Schieveld |
Kinder en jeugdpsychiater /research lid, MUMC+ , 4u/week
|
Idem & adviseur bij de Mutsaers Stichting te Venlo, 16u/week |
Geen |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiënten perspectief door een afgevaardigde van een patiëntenvereniging, Stichting Kind en Ziekenhuis, in de werkgroep te laten participeren.
WKKGZ-raming
|
Module |
Uitkomst raming |
Toelichting |
|
Module ‘Voorkeurskeuze bij indicatie premedicatie’ |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Implementatie
In de verschillende fasen van het ontwikkelproces is rekening gehouden met de implementatie van de richtlijnmodule en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de module in de praktijk kunnen bevorderen of belemmeren.
Werkwijze
AGREE
Deze module is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based module tot stand komt, wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Uit de inventarisatie van de knelpunten door werkgroep van de NVA (2021) bleek dat er een noodzaak was voor (revisie) van deze richtlijn.
Uitgangsvraag en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse is door de werkgroepleden en de adviseur een uitgangsvraag opgesteld. Vervolgens inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Aan de hand van specifieke zoektermen werd gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De geselecteerde databases waarin is gezocht en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie is opvraagbaar bij de Richtlijnendatabase, zie het tabblad Zoekverantwoording voor verdere details.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB-instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration:
• AMSTAR – voor systematische reviews.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Indien van toepassing: bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor: Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in één of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij één van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje ‘Overwegingen’.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en welke worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt, kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
Bij de ontwikkeling van de module is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die een randvoorwaarde zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag, randvoorwaarden die van invloed zijn op de implementatie van de aanbeveling zijn opgenomen in de implementatietabel.
Kennisvragen
Tijdens de ontwikkeling van deze module is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvraag. Er is nagegaan of (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Mocht dit bij deze module het geval zijn, dan is er een aanbeveling voor het doen van onderzoek opgenomen in de bijlage Kennisvragen. Deze bijlage is te vinden onder de aanverwante producten.
Commentaar- en autorisatiefase
De conceptmodule werd aan de betrokken (wetenschappelijke) verenigingen, instanties en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve module werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd. De commentaartabel is op te vragen bij het Kennisinstituut via: secretariaat@kennisinstituut.nl
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html. 2012.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html. 2013.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van de Federatie Medisch Specialisten.