Medicamenteuze behandeling bij volwassenen
Uitgangsvraag
Hoe kan alopecia areata bij volwassenen worden behandeld?
a. In het geval van milde alopecia areata (SALT score <50)
b. In het geval van ernstige alopecia areata (SALT score ≥50)
Aanbeveling
Algemeen
- Bespreek met de patiënt:
- acceptatie van AA
-de mogelijkheid om een expectatief beleid te voeren.
- verschillende conservatieve behandelingen (Zie module ‘Conservatief beleid’).
- verschillende behandelopties en het mogelijk onvoorspelbare beloop tijdens en na de medicamenteuze behandeling.
- Definieer behandeldoelen doormiddel van ‘samen beslissen’. Zie de algemene inleiding voor overwegingen omtrent samen beslissen.
- Monitor bij iedere behandeling de ziekteactiviteit (module ‘Classificatie’), ziektelast (module ‘Conservatief beleid’), bijwerkingen en behandelwensen van patiënt, en pas hier toekomstige therapie op aan.
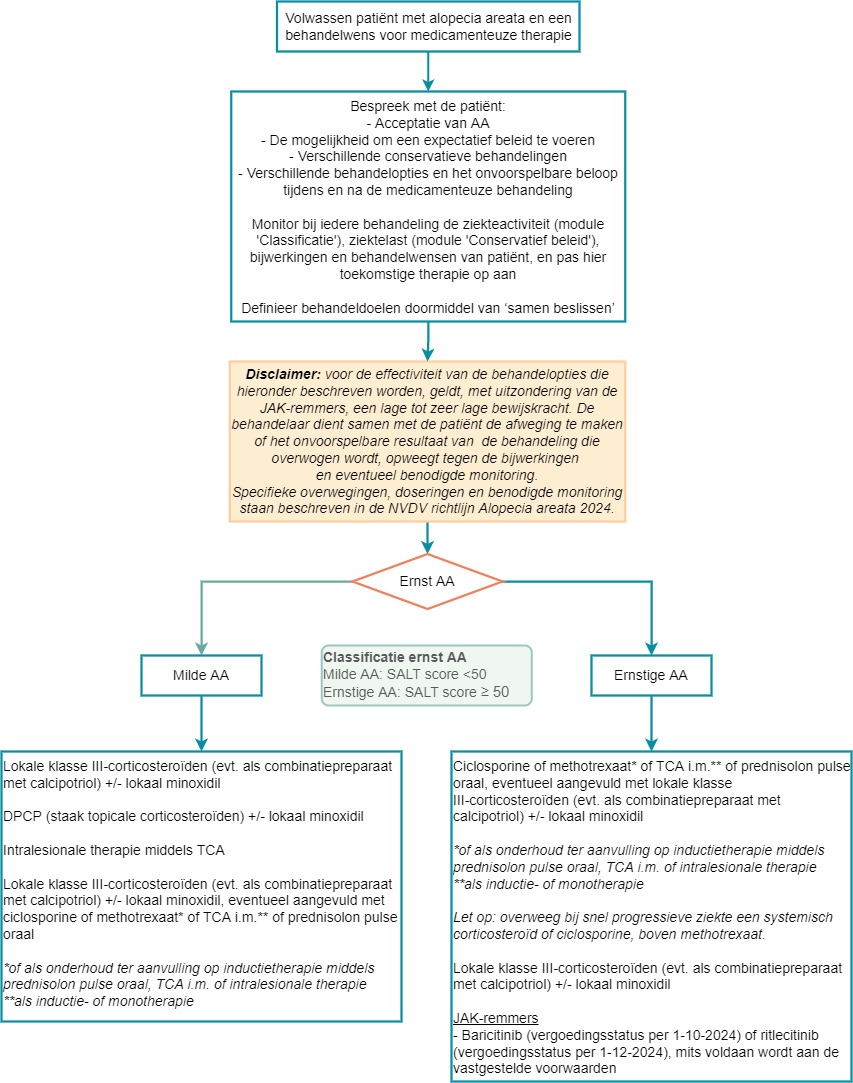
- Zie voor een overzicht van de verschillende behandelopties het flowdiagram ‘Overzicht medicamenteuze behandelingsmodaliteiten bij volwassenen met AA’.
Disclaimer: voor de effectiviteit van de behandelopties die hieronder beschreven worden, geldt, met uitzondering van de JAK-remmers, een lage tot zeer lage bewijskracht. De behandelaar dient samen met de patiënt de afweging te maken of het onvoorspelbare resultaat van de behandeling die overwogen wordt, opweegt tegen de bijwerkingen en eventueel benodigde monitoring.
Definities classificatie: Milde AA = SALT <50, ernstige AA = SALT ≥50 (zie ook de module ‘Classificatie’).
Lokale therapie
- Start laagdrempelig lokale klasse III-corticosteroïden bij volwassenen met milde of ernstige AA. Dit kan ook aanvullend worden toegepast als aanvulling op systemische therapie bij ernstige AA. Overweeg een intermitterend schema bij langdurig gebruik om bijwerkingen zoals atrofie te voorkomen.
- Overweeg lokale klasse III-corticosteroïden als combinatiepreparaat met calcipotriol toe te passen.
- Overweeg topicale minoxidil te starten als aanvulling op andere lokale en systemische therapieën.
- Overweeg DPCP te starten bij patiënten met milde AA. Tijdens deze behandeling dient behandeling middels topicale corticosteroïden gestaakt te worden.
Intralesionale therapie
- Overweeg intralesionale triamcinolonacetonide bij volwassenen met milde AA. Intralesionale therapie is niet geschikt bij ernstige AA. Zie het ‘Professioneel perspectief’ voor een toelichting op de dosering en behandelduur.
Conventionele systemische therapie
- Overweeg conventionele systemische therapie toe te passen bij volwassenen met milde of ernstige AA, zeker wanneer er sprake is van een hoge ziektelast. Zie het ‘Professioneel perspectief’ voor een toelichting op de dosering en behandelduur.
- Overweeg bij snel progressieve ziekte, waarbij AA totalis of universalis dreigt, een systemisch corticosteroïd of ciclosporine, boven methotrexaat.
Conventionele systemische therapie (niet in volgorde van voorkeur):
- Ciclosporine oraal
- Methotrexaat als monotherapie of als onderhoud ter aanvulling op inductietherapie
middels prenisolon pulse oraal, triamcinolonacetonide i.m. of intralesionale therapie
- Triamcinolonacetonide intramusculair als inductietherapie of onderhoudstherapie
- Prednisolon pulse oraal
JAK-remmers
-
Bespreek met de patiënt met ernstige AA de mogelijkheid tot behandeling middels baricitinib of ritlecitinib, mits aan de voorwaarden in het ‘Professioneel perspectief’ is voldaan. Voor beide geneesmiddelen is een vergoedingsstatus actief.
- Neem voor het starten met een JAK-remmer de overwegingen zoals beschreven in het ‘Professioneel perspectief’ in acht. Daarin wordt een nadere toelichting op de voorwaarden, dosering, screening, monitoring, speciale overwegingen en overwegingen voor/tijdens/na de behandeling beschreven.
Overwegingen
Kwaliteit van het bewijs
Over het algemeen was de bewijskracht van de studies omtrent de effectiviteit op de hergroei van haar laag. Mede doordat er per uitkomstmaat veelal naar een beperkte studiepopulatie werd gekeken (een enkele studie of meerdere studies met beperkte omvang). De studies naar de JAK-remmers vormen hierop een uitzondering (King 2022, King 2021, Winnette 2022, King 2023). Andere punten waarvoor veelvuldig, maar onderbouwd, is afgewaardeerd tijdens de GRADE analyse zijn heterogeniteit binnen de studiepopulatie (op basis van ernst AA), geen placebogroep, het niet benoemen van betrouwbaarheidsintervallen of de beschrijvende (deels overlappende) brede betrouwbaarheidsintervallen en als er geen studieprotocol beschikbaar was. Er is voor gekozen om niet af te waarderen wanneer er niet (dubbel) geblindeerd werd, omdat we niet verwachten dat dit een groot effect heeft op de uitkomstmaat.
De resultaten van de systematic review met netwerk meta-analyse van Gupta et al. (2019-2) zijn gebruikt als basis voor de literatuur omtrent lokale therapieën. Deze resultaten moeten met gepaste voorzichtigheid geïnterpreteerd worden gezien de limitaties van deze studie. Het is echter tot op heden de enige studie die zoveel therapieën beschouwd. Dit soort studies zijn zeer gewenst gezien de afweging tussen de verschillende therapieën complex kan zijn in de dagelijkse praktijk.
De aanbevelingen in deze module zijn, door eerder genoemde limitaties van de literatuur, mede gebaseerd op expert opinion. Door het ontbreken van goed uitgevoerde vergelijkende studies, is het voor de werkgroep niet altijd mogelijk om een duidelijke uitspraak te doen over de voorkeursbehandeling.
Balans van gewenste en ongewenste effecten
Alopecia areata is moeilijk te behandelen en er zijn weinig RCT’s met voldoende deelnemers verricht voor de medicamenteuze behandeling. Gezien spontane remissie vaak optreedt bij patiënten met milde AA van korte duur (<1 jaar), is deze patiëntengroep in het bijzonder met enkel geruststelling mogelijk afdoende gebaat. Indien gekozen wordt geen behandeling te starten, is het belangrijk te benoemen dat hergroei van haar niet te verwachten is binnen 3 maanden na het ontstaan van iedere individuele alopetische areaal.
Het is belangrijk om zowel de positieve als negatieve aspecten van een actieve behandeling af te wegen. Sommige patiënten reageren goed op behandeling, echter kan behandeling oncomfortabel zijn, tijdrovend en ongewenste bijwerkingen geven. Ook is er geen bewijs voorhanden dat medische interventies het ziektebeloop zouden beïnvloeden. Deze overwegingen geven het belang aan van goede counseling bij het al dan niet besluiten tot overgaan tot behandeling, zodat de patiënt realistische verwachtingen heeft en beter kan omgaan met tegenvallende behandelresultaten of terugval na initieel succesvolle therapie.
Professioneel perspectief
De behandelaar dient met de patiënt de verschillende behandelopties, het behandeldoel, het onvoorspelbare natuurlijke beloop en de onvoorspelbare therapeutische respons tijdens en na de medicamenteuze behandeling te bespreken.
Alvorens medicamenteuze behandeling wordt gestart, dient de behandelaar met elke patiënt een expectatief beleid en de conservatieve behandelingsmogelijkheden te bespreken.
Wanneer wordt overgegaan tot behandeling is het van belang om de ziekteactiviteit, bijwerkingen en behandelwensen te monitoren. De therapie kan hierop worden aangepast.
In onderstaand flowdiagram worden de verschillende medicamenteuze behandelingen weergegeven naar ernst van AA. De werkgroep definieerde een SALT score van <50 als milde alopecia en ≥50 als ernstige alopecia. Onder het flowdiagram worden de verschillende behandelingen nader toegelicht voor volwassenen.
Voor een overzicht van de conservatieve therapie opties verwijzen we naar de module ‘Conservatief beleid’.
Flowdiagram Overzicht medicamenteuze behandelingsmodaliteiten bij volwassenen met AA
Lokale therapie middels potente corticosteroïden klasse III, topicale minoxidil en DPCP wordt binnen de Nederlandse praktijk reeds toegepast. Het verwachte resultaat van deze therapieën neemt af naarmate de ernst van de ziekte toeneemt.
Behandeling middels corticosteroïden klasse III kan laagdrempelig gestart worden bij patiënten met milde of ernstige AA. Overweeg een intermitterend schema bij langdurig gebruik om bijwerkingen zoals atrofie te voorkomen. Intermitterend smeren houdt in dat de patiënt geïnstrueerd wordt om 4 of 5 dagen te smeren en 2 tot 3 dagen niet. Het hangt af van het type topicale corticosteroïd of de patiënt aansluitend smeert of bijvoorbeeld tussendoor een dag niet. Bij een lange halfwaardetijd, wordt het aanbevolen om aansluitend te smeren en bij een korte halfwaardetijd, is het ook mogelijk om tussendoor een dag niet te smeren.
Additionele behandeling middels topicale minoxidil kan altijd gestart worden naast lokale of een systemische behandeling. Indien topicale minoxidil goed verdragen wordt, kan dit als onderhoudsbehandeling gecontinueerd worden.
Lokale klasse III-corticosteroïden kunnen als combinatiepreparaat met calcipotriol, zoals calcipotriol/betamethason gel of schuim, worden toegepast.
Een studie naar het werkingsmechanisme van topicale toepassing van minoxidil keek naar het effect op de IL-1α gen expressie op menselijke keratinocytcellen. In dit onderzoek werd een statistisch significante reductie in deze gen expressie gezien in vergelijking tot cellen die geen behandeling kregen. (Pekmesci, 2018)
Diphencyprone (DPCP)
Diphencyprone is een zeer potent contactallergeen, sterk verdund met aceton die aangebracht dient te worden met een wattenstaaf. Bij de behandeling van DPCP treedt een reactie op dat geassocieerd is met hergroei van haar. Het is tot op heden niet duidelijk waarom deze respons optreedt. Gedacht wordt dat een immunomodulerend effect op inflammatie rondom haarfollikels een rol speelt.
Tijdens de behandeling kunnen verschillende bijwerkingen optreden, waaronder ernstige lokale dermatitis met lymfadenopathie, jeuk, urticaria, koorts, gegeneraliseerd eczeem, pigmentstoornissen en psychologische afhankelijkheid.
Let op!: Wanneer gestart wordt met DPCP dient behandeling middels corticosteroïden gestaakt te worden.
Behandeling middels DPCP kent drie fases: de sensibiliteitsfase, opbouwfase en responsfase. Hieronder worden deze verschillende fase nader toegelicht in een behandelschema. De opbouwfase die volgt na de sensibilisatiefase kan na adequate instructie ook bijvoorbeeld worden uitgevoerd door de partner of een familielid van de patiënt. Het is van belang dat deze persoon handschoenen draagt en de DPCP aanbrengt met een wattenstaaf.
Fase 1 (sensibilisatiefase)
- DPCP 2% wordt aangebracht op een veldje van 4x4 cm op de hoofdhuid
- De beoogde reactie bestaat uit laaggradig erytheem, milde pruritus op het behandelde gebied voor 24 tot 36 uur
- Als er geen merkbare reactie in het behandelde gebied is opgetreden wordt fase 1 tot maximaal 4 bezoeken herhaald.
Fase 2 (opbouwfase à kan ook thuis worden uitgevoerd na adequate instructie)
- De eerste helft van de scalp wordt behandeld met DPCP in een start concentratie van 0.001%
- Wanneer geen reactie is opgetreden moet per week de DPCP concentratie verhoogd worden (0.01%, 1%, 2%)
- De juiste concentratie DPCP wordt wekelijks aangebracht op de eerste helft van de scalp
- Vanaf het moment dat er haargroei geobserveerd wordt op de eerste helft van de scalp, mag de tweede helft van de scalp behandeld worden
Fase 3 (responsfase)
- Respons (hergroei van haar) treedt vaak op na 3 maanden
- Indien na 6 maanden geen respons optreedt, dient de behandeling te worden gestopt
- Bij een beginnende respons kan de applicatiefrequentie verlaagd worden
- Bij een totale respons (volledige hergroei van haar), dient de behandeling te worden gestopt
Maatregelen wanneer er een ernstige eczemateuze of bulleuze reactie optreedt:
- Was de DPCP van de huid
- Start applicatie van een lokaal corticosteroïd
- Overweeg de applicatie een week over te slaan
- Overweeg de DPCP concentratie te verlagen
De volgende adviezen geeft de behandelaar mee aan de patiënt:
- Patiënten dienen tot 24 uur na applicatie van de DPCP een hoed of haarwerk te dragen
- Na 48 uur mag de behandelde plek met shampoo gewassen worden
Conclusie werkgroep t.a.v. lokale therapieën
De werkgroep adviseert om:
- Laagdrempelig te starten met lokale klasse III corticosteroïden 1dd bij volwassenen met milde of ernstige AA. Dit kan ook aanvullend worden toegepast als aanvulling op systemische therapie bij matig ernstige AA. Overweeg een intermitterend schema bij langdurig gebruik om bijwerkingen zoals atrofie te voorkomen.
- Calcipotriol of topicale minoxidil te overwegen als aanvulling op andere lokale en systemische therapieën.
- DPCP te overwegen bij patiënten met milde AA. Tijdens deze behandeling dient behandeling middels topicale corticosteroïden gestaakt te worden.
Intralesionale therapieën
Intralesionale behandeling met triamcinolonacetonide (TCA) is een veel toegepaste behandeling bij AA. De mogelijkheid tot behandelen kan in de praktijk echter worden beperkt door pijnklachten bij de patiënt of door nadelige bijwerkingen zoals huidatrofie. Toch kan TCA een zeer geschikte en effectieve behandeling zijn bij beperkte vormen of specifieke lokalisaties van AA zoals in het gelaat, mits op de juiste manier en in de juiste dosering toegepast. Omdat het ontstekingsinfiltraat bij AA hoog in de subcutis rondom de bulbus van de haarfollikel gelokaliseerd is dient TCA ook hoog in de subcutis (langzaam) geïnjecteerd te worden. Hogere doseringen van TCA geven een grotere kans op atrofie terwijl lagere doseringen vaak al effectief zijn (Ustuner 2017, Rajan 2021). Om deze reden wordt er aanbevolen door de werkgroep om te starten met een dosering van 2,5-3,3mg/ml 0.1ml per cm2 welke bij onvoldoende effect en uitblijven van bijwerkingen kan worden opgehoogd tot maximaal 10 mg/ml (maximaal 5 mg/ml in het gelaat). Deze doseringen kunnen gemakkelijk worden verkregen door de standaardbereidingen van 40 mg/ml of 10 mg/ml te verdunnen met NaCl of lidocaïne (voorbeeld: voor een dosering van 2,5 mg/ml dient de een standaardbereiding van 10 mg/ml 1:3 verdund te worden). Een voordeel van deze lage doseringen is dat ook gebieden behandeld kunnen worden waarbij atrofie eerder cosmetisch onacceptabel is, zoals ter plaatse van de wenkbrauwen. De frequentie van behandeling is elke 4-6 weken waarbij na 2-3 behandelingen het effect beoordeeld kan worden. Tevens dient er ook gecontroleerd te worden op eventueel ontstane bijwerkingen. Bijwerkingen die bij deze behandeling kunnen optreden zijn o.a. atrofie, hypopigmentatie, teleangiëctasieën, pijn en infecties.
Conclusie werkgroep t.a.v. intralesionale therapieën
De werkgroep adviseert intralesionale triamcinolonacetonide te overwegen bij milde AA in een startdosering van 2,5-3,33 mg/mL (0.1ml per cm2) elke 4-6 weken. Evalueer het effect na 2-3 behandelingen en verhoog zo nodig de dosering naar maximaal 10 mg/mL (Let op: in het gelaat maximaal 5 mg/mL). Intralesionale therapie is niet geschikt bij matig ernstige AA.
Systemische therapieën
Immunosuppressieve therapieën kunnen toegepast worden om progressie van AA te staken en hergroei van haar te stimuleren. Alleen baricitinib en ritlecitnib, twee JAK-remmers, zijn geregistreerd voor de indicatie ernstige AA bij volwassenen, alle overige therapieën worden off-label toegepast. Overwegingen met betrekking tot de behandeling met JAK-remmers staan verder toegelicht onder het kopje ‘JAK-remmers’.
In de huidige klinische praktijk wordt systemische therapie hoogdrempelig voorgeschreven en bestaat uit onder andere systemische corticosteroïden, ciclosporine en methotrexaat. In de literatuur zijn daarnaast nog diverse andere (weinig succesvolle) therapeutische opties beschreven zoals dimethylfumaraat en apremilast.
Bij zowel milde als ernstige AA is systemische therapie te overwegen. Het moment van inzetten van systemische therapie is niet eenduidig. Het is belangrijk om de door patiënt ervaren ziektelast, patiëntvoorkeuren en comorbiditeiten mee te laten wegen in de uiteindelijke behandelkeuze.
‘The Alopecia Areata Consensus of Experts study’ (Delphi studie) concludeerde een voorkeur te hebben voor behandeling middels JAK-remmers, maar beschreef geen voorkeur met betrekking tot andere therapievormen (Meah, 2020). Wel werd consensus bereikt over het feit dat ciclosporine een effectieve monotherapie kan zijn met een dosering van 3-5mg/kg/dag met een maximale behandelduur van 6-12 maanden. Methotrexaat kan soms toegepast worden als monotherapie met een dosering van 15-20mg/week. Systemische corticosteroïden kunnen gecombineerd worden met ciclosporine, methotrexaat of een JAK-remmer. (Meah, 2020)
De Italiaanse richtlijn AA doet geen uitspraak over een voorkeursbehandeling. (Rossi et al., 2019)
De werkgroep is van mening dat bij snel progressieve AA, waarbij AA totalis of universalis dreigt, een relatief snel werkend systemische therapie (bijvoorbeeld systemische corticosteroïden of ciclosporine) de voorkeur heeft boven een relatief traag werkende therapie (zoals methotrexaat).
Monotherapie met methotrexaat is een therapie die in de praktijk wordt voorgeschreven. In de studie van Asilian et al. (2020) gaf monotherapie met methotrexaat een significant lagere verbetering van de SALT score vergeleken met methotrexaat gecombineerd met betamethason pulse-therapie.
Een vergelijkbare studie werd herhaald door Joly et al. (2023); deze studie is gezien de recente publicatiedatum niet in onze search opgenomen, maar werd door de werkgroep aangedragen als onmisbare literatuur. In deze dubbelblinde gerandomiseerde studie werden 89 patiënten met alopecia totalis (n=1) of alopecia universalis (n=88) behandeld middels methotrexaat 25 mg/week of placebo voor 6 maanden. Indien patiënten na 6 maanden meer dan 25% hergroei van haar hadden, werd dezelfde behandeling voortgezet tot en met 12 maanden. Patiënten die minder dan 25% hergroei van haar hadden, werden opnieuw gerandomiseerd in de methotrexaat in combinatie met prednison groep (20 mg/dag voor 3 maanden en vervolgens 15 mg/dag voor 3 maanden) of methotrexaat in combinatie met placebo tot en met 12 maanden.
De gemiddelde (SD) ziekteduur in jaren was als volgt verdeeld onder de verschillende groepen; interventie groep met alopecia areata: 8 (10,8), placebogroep met alopecia areata: 11,9 (11,9), interventie groep met alopecia universalis: 1,8 (2,2) en placebogroep met alopecia universalis: 2,4 (2,2).
In de gecombineerde groep lijkt het effect op hergroei van haar groter te zijn, maar er is geen sprake van statische significantie. Over het geheel genomen werd na 12 maanden gezien dat bij 7 van de 35 patiënten (20,0%; 95% BI, 8,4%-37,0%) die na 6 maanden opnieuw werden gerandomiseerd naar methotrexaat in combinatie met placebo (i.p.v. prednison), partiële hergroei van haar werd gezien. Ditzelfde werd gezien in de groep patiënten die de initiële monotherapie met methotrexaat hadden voortgezet na 6 maanden. Er was in totaal 1 patiënt met volledige hergroei van haar (gedefinieerd als SALT-score <10) en 1 patiënt met volledige hergroei van haar na 9 maanden die niet geëvalueerd kon worden na 12 maanden vanwege lost to follow up.
Van de 35 patiënten die methotrexaat (gedurende 6 of 12 maanden) en prednison (gedurende 6 maanden) kregen, hadden 21 patiënten (60,0%; 95% BI, 42,1%-76,1%) partiële hergroei van haar en 7 patiënten (20,0%; 95% BI, 8,4%-37,0%) volledige hergroei van haar.
Ten slotte, bij het beschouwen van de 16 patiënten die gedurende 12 maanden methotrexaat kregen (patiënten aanvankelijk gerandomiseerd naar de methotrexaatgroep) en die oraal prednison kregen van maand 6 tot maand 12 (naast methotrexaat), werd volledige hergroei van haar waargenomen bij 5 van de 16 patiënten (31,2%; 95% BI, 11,0%-58,7%). (Joly, 2023)
De Italiaanse richtlijn onderschrijft dat gecombineerde therapie effectiever lijkt te zijn dan monotherapie met methotrexaat (Rossi, 2019). Desalniettemin deelt de werkgroep van de NVDV richtlijn AA de mening dat monotherapie met methotrexaat wel degelijk een systemische therapeutische optie kan zijn met minder risico op bijwerkingen in vergelijking tot de gecombineerde systemische corticosteroïden therapie.
De opgenomen studies in deze richtlijn verschillen deels van de dagelijkse praktijk. Een deel van de studies includeert patiënten met een langere ziekteduur van AA (meerdere jaren) zodat kans op spontane remissie kan worden geminimaliseerd. Kortere ziekteduur kan een beter effect opleveren van een therapie. In de dagelijkse praktijk is het ook goed om te realiseren dat hergroei van haar pluksgewijs kan optreden en niet altijd diffuus. Het doorbehandelen bij pluksgewijs haargroei kan worden overwogen in afwachting van uiteindelijk diffuse hergroei van haar. Anderzijds kan de mate van activiteit van AA fluctueren; tijdelijke relapse kan optreden wanneer herstelgroei is ingezet. Overweeg daarom bij een relapse om de ingezette systemische therapie te continueren wanneer er initieel wel haargroei optrad; de richtlijnwerkgroep kan geen uitspraak doen over hoeveel tijd een relapse mag duren alvorens de systemische therapie te staken.
Constitutioneel eczeem
Bij patiënten met matig tot ernstig constitutioneel eczeem met een indicatie voor systemische therapie dient dit mee te worden gewogen in de keuze voor systemische therapie. Zie ook de richtlijn ‘Constitutioneel eczeem’.
Conclusie werkgroep t.a.v. conventionele systemische therapieën
De werkgroep adviseert systemische therapie te overwegen bij milde tot ernstige AA, zeker wanneer er sprake is van een hoge ziektelast.
De werkgroep adviseert bij snel progressieve ziekte een systemisch corticosteroïd of ciclosporine, boven methotrexaat.
Conventionele systemische therapie (niet in volgorde van voorkeur):
- Ciclosporine oraal begindosis 5 mg/kg per dag, verdeeld over 2 giften, waarna op geleide van het klinisch beeld zo snel mogelijk, veelal na 3-6 weken, afgebouwd wordt naar een onderhoudsdosering (2.5-3mg/kg/dag). Afhankelijk van verschillende patiëntfactoren kan eventueel van deze dosering worden afgeweken.
- Methotrexaat (15-20 mg/week) als monotherapie of als onderhoud ter aanvulling op inductietherapie middels prenisolon oraal, triamcinolonacetonoide intramusculair of intralesionaal.
- Triamcinolonacetonide intramusculair 0,5-1mg/kg elke 4-6 weken als inductie- of onderhoudstherapie tot maximaal 1 jaar.
- Prednisolon pulse oraal 0,5-1mg/kg 1dd voor 3 opeenvolgende dagen elke 4 weken gedurende 3 maanden.
Hieronder volgen overwegingen en voorzorgen voor het gebruik van conventionele systemische geneesmiddelen voor de behandeling van AA.
Ciclosporine
Voor relatieve en absolute contra-indicaties, interacties, aanvullende voorzorgen en de bijwerkingen verwijzen we naar de actuele SMPC tekst van het geneesmiddel: https://www.cbg-meb.nl/
Voorafgaand aan de behandeling adviseert de werkgroep het volgende:
• Anamnese en lichamelijk onderzoek: gericht op: hart- en vaatziekten, ernstige infecties, maligniteiten (waaronder huidmaligniteiten), nier- of leveraandoeningen, overige medicatie i.v.m. mogelijke geneesmiddelinteracties, actinisch beschadigde huid/verhoogd UV-blootstelling/hoge cumulatieve doses PUVA (> 1000 J/cm²)), borstvoeding.
• Aanvullend onderzoek:
- Controleer de bloeddruk
- Verricht laboratoriumonderzoek
(zie tabel Aanbevolen laboratoriumcontroles (ciclosporine))
• Besteed verder aandacht aan de volgende punten:
- Adviseer betrouwbare anticonceptie (let op verminderde betrouwbaarheid van progesteronhoudende anticonceptiva).
- Controleer de noodzaak van vaccinaties en inventariseer (toekomstige) vaccinatie
behoefte.
- Geef advies over verhoogde vatbaarheid voor infecties (alertheid op infecties, zo nodig medische hulp inroepen), mogelijke geneesmiddelinteracties, het vermijden van overmatige zonblootstelling en gebruik van zonnebrandcrèmes.
- Informeer de patiënt over een risico op chronische nefrotoxiciteit
- Informeer huisartsen en andere behandelaren over start CsA.
- Overweeg te attenderen op de importantie van cervixscreening
Tijdens de behandeling adviseert de werkgroep het volgende:
• Lichamelijk onderzoek: besteed bij lichamelijk onderzoek aandacht aan mogelijke bijwerkingen gerelateerd aan CsA: hypertrichose, gingivahyperplasie, tekenen van infectie, gastro-intestinale of neurologische symptomen (tremor, dysesthesie), spierkrampen/spierpijn/gewrichtspijn
• Controleer:
- of adviezen omtrent adequate zonbescherming en anticonceptie worden opgevolgd.
- op overige medicatie i.v.m. mogelijke geneesmiddelinteracties
- bloeddruk
• Verricht laboratoriumonderzoek (zie tabel Aanbevolen laboratoriumcontroles (ciclosporine
• Overweeg CsA niet te gebruiken bij pre-existente of optredende nierfunctiestoornis
• Overweeg te attenderen op de importantie van cervixscreening
• Informeer naar de tevredenheid van de behandeling in de dagelijkse praktijk, bijwerkingen en inpasbaarheid van de behandeling
• Monitoring van de bloedspiegels van ciclosporine wordt niet geadviseerd. Het bepalen van bloedspiegels ciclosporine is wel van toegevoegde waarde als men twijfelt aan de therapietrouw van de patiënt. Eventuele dosisaanpassing vindt plaats op geleide van klinisch effect of bijwerkingenprofiel.
Na de behandeling adviseert de werkgroep het volgende:
Na het staken van CsA dient er bij de follow-up aandacht te zijn voor de inspectie op huidkanker, vooral in het geval van uitgebreide eerdere therapeutische of natuurlijke UV-blootstelling en als de duur van de behandeling >1 jaar was. Bespreek dit met de patiënt.
Laboratoriumcontroles:
Tabel Aanbevolen laboratoriumcontroles (ciclosporine)
|
Parameter |
Voor behandeling |
Na 4 weken |
Na 8 weken |
Na 12 weken |
Daarna elke 3-6 maanden |
|
Volledig bloedbeeld* |
x |
x |
x |
x |
x |
|
ALAT, γGT, bilirubine |
x |
x |
x |
x |
x |
|
Natrium, kalium |
x |
x |
x |
x |
x |
|
Serumkreatinine/eGFR |
x |
x |
x |
x |
x |
|
Albumine/kreatinine ratio urine |
x |
x |
|
|
x |
|
Urinezuur |
x |
x |
x |
x |
x |
|
Zwangerschapstest (urine of bloed) |
x |
|
|
|
|
|
Cholesterol, triglyceriden |
x** |
|
x |
|
x |
|
Magnesium*** |
x |
|
x |
|
x |
|
HBV |
x |
|
|
|
|
|
HCV |
x |
|
|
|
|
|
HIV |
x |
|
|
|
|
|
Bloeddruk controle |
x |
x |
x |
x |
x |
|
Niet alle testen zijn nodig bij alle patiënten. De voorgeschiedenis, het blootstellingsrisico en de patiëntkenmerken moeten worden meegewogen. Aanvullende testen kunnen noodzakelijk zijn, afhankelijk van de klinische verschijnselen, risico’s en mate van blootstelling. * Hb, leukocyten, trombocyten ** Nuchter *** Alleen op indicatie (spierkrampen) |
|||||
Methotrexaat
Voor relatieve en absolute contra-indicaties, interacties, aanvullende voorzorgen en de bijwerkingen verwijzen we naar de actuele SMPC tekst van het geneesmiddel: https://www.cbg-meb.nl/
Voorafgaand aan de behandeling adviseert de werkgroep het volgende:
• Neem een anamnese af en verricht lichamelijk onderzoek o.a. gericht op: actuele maligniteit of maligniteit in de voorgeschiedenis, infecties (zie o.a. module virale hepatitis), zwangerschap(swens) en alcoholafhankelijkheid.
• Aanvullend onderzoek:
- Verricht laboratoriumonderzoek
(zie tabel Aanbevolen laboratoriumcontroles (ciclosporine))
- X-thorax
• Als er afwijkingen in de leverfuncties worden gevonden, verwijs de patiënt dan naar een MDL-arts voor verdere evaluatie.
• Controleer de noodzaak van vaccinaties en inventariseer (toekomstige) vaccinatie behoefte
• Adviseer betrouwbare anticonceptie bij vrouwen in de vruchtbare leeftijd (beginnend na de menstruatie) en bij mannen (zie ook module kinderwens en zwangerschap).
Tijdens de behandeling adviseert de werkgroep het volgende:
• Controleer gelijktijdig gebruik van andere medicatie i.v.m. mogelijke interacties.
• Verricht lichamelijk onderzoek.
• Aanvullend onderzoek:
- Verricht laboratoriumonderzoek
(zie tabel Aanbevolen laboratoriumcontroles (ciclosporine))
• Adviseer betrouwbare anticonceptie bij vrouwen in de vruchtbare leeftijd, maar ook bij mannen.
• Schrijf bij gebruik van methotrexaat altijd foliumzuur voor in een dosering van 5 of 10 mg eenmaal per week 24 uur na inname van methotrexaat. Overweeg een dosering van 10mg per week bij gastro-intestinale bijwerkingen.
• Adviseer alcoholonthouding.
• Informeer naar de tevredenheid van de behandeling in de dagelijkse praktijk, bijwerkingen en inpasbaarheid van de behandeling.
• Let bij het gebruik van MTX op eventuele geneesmiddeleninteracties
Na de behandeling adviseert de werkgroep het volgende:
Zowel mannen als vrouwen in de vruchtbare leeftijd dienen adequate anticonceptieve maatregelen te nemen. Voor vrouwen geldt een periode van ten minste 3 maanden na het staken van de behandeling en voor mannen ten minste ook 3 maanden (EMA beveelt 6 maanden uit voorzorg aan, de praktijk van de richtlijnwerkgroep wijkt hiervan af).
Laboratoriumcontroles:
Tabel Aanbevolen laboratoriumcontroles (methotrexaat)
|
Parameter*
|
Voor behandeling
|
< 4 weken
|
Na 8 weken |
Elke 3 maanden |
|
Volledig bloedbeeld (Hb, leukocyten, trombocyten)* |
x |
x |
x |
x |
|
Leverenzymen** |
x |
x |
x |
x |
|
Serumkreatinine |
x |
x |
x |
x |
|
Albumine/kreatinine ratio urine |
x |
|
|
|
|
Zwangerschapstest (urine of bloed)*** |
x |
|
|
|
|
HBV/HCV |
x |
|
|
|
|
HIV |
x |
|
|
|
|
Serumalbumine** |
x |
x |
x |
x |
|
Niet alle testen zijn nodig bij alle patiënten. De voorgeschiedenis, het blootstellingsrisico en de patiëntkenmerken moeten worden meegewogen. Aanvullende testen kunnen noodzakelijk zijn, afhankelijk van de klinische verschijnselen, risico’s en mate van blootstelling. * Indien aantal leukocyten < 3.0, neutrofielen < 1.0, trombocyten < 100, verlaag de dosis of stop de medicatie; indien de leverenzymen > 2-3x verhoogd zijn, start aanvullende diagnostiek (inclusief herhaling van testen), schakel MDL-arts in, en overweeg de dosis te verlagen of de medicatie te stoppen. ** Op indicatie Transaminases (ALAT), γGT, bilirubine (d.w.z. bij hypoalbuminemie of bij patiënten die medicijnen gebruiken met een hoge bindingsaffiniteit aan serum albumine). *** Indien klinisch noodzakelijk, zwangerschapstest herhalen. |
||||
Prednisolon
Voor relatieve en absolute contra-indicaties, aanvullende voorzorgen en de bijwerkingen verwijzen we naar de actuele SMPC tekst van het geneesmiddel: https://www.cbg-meb.nl/
Monitoring
Bij een kortdurende behandeling met orale glucocorticoïden is uitgebreide monitoring niet zinvol. Monitoring van (bestaande) diabetes mellitus is wel zinvol middels het bepalen van een bloedglucosewaarde. Bij patiënten die langdurig systemische corticosteroïden gebruik moet osteoporoseprofylaxe gegeven worden en kunnen controle van bloeddruk, oogonderzoek, hypothalamus-hypofyse-bijnier as suppressietesten, botdichtheid metingen en groeimetingen (kinderen) nodig zijn. (Sidbury 2014)
Waarschuwingen/voorzorgen
- Bij stress-situaties dient de dosering prednisolon te worden verhoogd (stress schema).
- Secundaire bijnierschorsinsufficiëntie kan het gevolg zijn van te snel staken van de corticosteroïden. Dit risico kan door geleidelijke dosisverlaging tot een minimum worden teruggebracht.
- Bij gebruik van corticosteroïden bestaat een verhoogde gevoeligheid voor infectie met maskering van de klinische verschijnselen hiervan; tevens kunnen tuberculose en parasitaire infecties worden gereactiveerd.
- Voor adviezen met betrekking tot fractuurpreventie bij glucocorticoïden verwijzen we naar de module ‘Medicatie voor fractuurpreventie bij glucocorticoïden’ in de richtlijn ‘Osteoporose en fractuurpreventie’ van de Nederlandse Internisten Vereniging.
JAK-remmers (baricitnib en ritlecitinib)
Baricitinib en ritlecitinib zijn twee JAK-remmers die geregistreerd zijn voor de behandeling van volwassen patiënten met ernstige AA (SALT-score ≥50). Tot op heden (maart 2024) is er geen vergoedingsstatus voor baricitinib en ritlecitinib voor de indicatie ernstige AA. De werkzaamheid van deze JAK-remmers bij volwassen patiënten met AA is onderzocht in ruim opgezette gerandomiseerde studies waarbij de JAK-remmers effectiever bleek dan placebobehandeling. Dit werd ook waargenomen voor adolescenten van 12 jaar en ouder met ernstige AA die behandeld werden middels ritlecitinib.
Het is essentieel om de psychosociale impact van AA te monitoren tijdens behandeling. Tot op heden is er echter geen gevalideerd meetinstrument beschikbaar in Nederland. In de module ‘Conservatief beleid’ staan voorbeeldvragen beschreven die richting kunnen geven in het gesprek met volwassen patiënten waarin inzicht wordt verkregen over mogelijk psychosociale problematiek.
Baricitinib is al enkele jaren geregistreerd voor de behandeling van reumatoïde artritis en sinds 2020 ook geregistreerd voor de behandeling van constitutioneel eczeem. Systemische immunosuppressiva in het algemeen kunnen op lange termijn (huid) maligniteiten veroorzaken. De follow-up van de beschreven studies is te kort om dat theoretische risico te kunnen detecteren. Dit risico dient meegenomen te worden in de afwegingen bij de keuze voor een JAK-remmer. Er zijn geen data beschikbaar met betrekking tot vergelijkende studies met de bestaande systemische behandelopties voor AA. Aangezien er geen systemisch medicijn geregistreerd is voor de behandeling van patiënten met AA, vormen baricitinib en ritlecitinib een belangrijke aanvulling op het therapeutisch arsenaal voor deze specifieke patiëntengroep.
Op basis van bovengenoemde overwegingen kunnen baricitinib of ritlecitinib in bepaalde omstandigheden worden ingezet. Nauwkeurige monitoring van het therapeutisch effect als ook mogelijke bijwerkingen is noodzakelijk.
Indicatie/voorwaarden voor voorschrijven
1. Een dermatoloog is hoofdbehandelaar.
2. De patiënt heeft ernstige AA (SALT ≥50%).
3. De huidige episode van AA is korter dan 8 jaar.
4. De hergroei van haar is onvoldoende ondanks de inzet van lokale middelen en ten minste één systemisch immunosuppressivum (methotrexaat, ciclosporine, prednison oraal of i.m.) in een adequate dosis voor een behandelduur van ten minste 6 maanden, tenzij er contra-indicaties zijn voor of bijwerkingen zijn van deze middelen.
5. Na 6 maanden wordt geëvalueerd door de behandelaar of de behandeling wordt voortgezet.
6. De ernst van de ziekte wordt bij voorkeur gemonitord middels de SALT-score en fotografische vastlegging in het patiëntendossier.
Registratie in landelijk register
De NVDV adviseert om de AA patiënten die starten met baricitinib of ritlecitinib op te nemen in een landelijk register. Zie ook: https://sta2r.nl/ (nog in ontwikkeling).
Dosering
De aanbevolen dosering baricitinib bij patiënten van 18 jaar en ouder met een ernstige vorm van AA is 4 mg 1dd.
De aanbevolen dosering van ritlecitinib bij patiënten van 12 jaar en ouder met een ernstige vorm van AA is 50 mg 1dd.
Er is tot op heden onvoldoende literatuur naar de behandelduur van deze geneesmiddelen.
Contra-indicaties baricitinib en ritlecitinib (Let op: neem begeleidende dikgedrukte tekst in acht)
Absolute contra-indicaties
- Ernstige actieve infecties, zoals actieve tuberculose (TBC)
- Onbehandelde latente TBC
- Actieve maligniteit
- Ernstige levercirrose (Child Pugh C)
- Ernstige nierfunctiestoornis: bij eGFR < 30 ml/min
- Actieve zwangerschap
- Het geven van borstvoeding
- Overgevoeligheid voor de werkzame stof of voor een van de hulpstoffen
Relatieve contra-indicaties
- Leeftijd ≥65 jaar*
- Verhoogd risico op of voorgeschiedenis van ernstige cardiovasculaire problemen (zoals myocardinfarct of herseninfarct)*
- Rokers of patiënten die in het verleden gedurende een langere tijd hebben gerookt*
- Patiënten met een verhoogd risico op maligniteiten*
- Maligniteit in de voorgeschiedenis, met uitzondering van non-melanoma skin cancer (NMSC)*
- Diep veneuze trombose of longembolie (in de voorgeschiedenis) of hoog risico hierop* (leeftijd, obesitas, grote chirurgische ingreep, immobilisatie)
- Recente of geplande vaccinatie met levend vaccin (zie paragraaf: speciale overwegingen)
- Diverticulitis
- Gastro-intestinale perforatie
- Diabetes, hypertensie en hypercholesterolemie (NB: indien lifestyleaanpassing en/of medicatie, met goed effect: géén contra-indicatie voor start JAK-remmer)
- Patiënten blootgesteld aan tuberculose (TBC) of woonachtig geweest of gereisd in gebieden met endemische TBC of endemische mycoses
- Behandelde hiv, hepatitis B en/of C (in de voorgeschiedenis); overleg met internist infectioloog danwel MDL-arts
- Chronische of recidiverende infecties
- Onderliggende conditie met verhoogde kans op infecties
- Voorgeschiedenis van een ernstige of opportunistische infectie
*Het CHMP van het EMA heeft een dringend aanvullend advies uitgebracht om de risico’s op maligniteit, ernstige cardiovasculaire events, ernstige infecties, veneuze trombo-embolie en mortaliteit tot een minimum te beperken bij gebruik van de JAK-remmers abrocitinib, baricitinib, upadacitinib, filgotinib en tofacitinib. De aanbeveling, zoals hieronder beschreven, geldt voor verschillende chronische inflammatoire aandoeningen, waaronder alopecia areata. (EMA/142279/2023)
Het EMA heeft geen advies afgegeven voor het gebruik van ritlecitinib. De NVDV adviseert om voorlopig de aanvullende relatieve contra-indicaties zoals hierboven aangeduid met een * mee te nemen in de afweging van de therapeutische opties bij patiënten met ernstige AA, aangezien ritlecitinib ook behoort tot de JAK remmers en theoretisch dus dezelfde bijwerkingen zou kunnen hebben.
Voorafgaand aan de behandeling adviseert de werkgroep als volgt:
• Anamnese: neem een anamnese af gericht op klachten passend bij of een voorgeschiedenis van: maligniteit (inclusief de huid), cardiovasculaire voorgeschiedenis en risicofactoren (m.n.: roken (of in het verleden), myocardinfarct, herseninfarct, DVT/longembolie), nier- en leverfunctiestoornissen, actieve infecties, herpesinfecties in de voorgeschiedenis. Vraag tevens naar: zwangerschap, lactatie, (actieve) kinderwens, vaccinatiestatus en toekomstige reisplannen.
• Lichamelijk onderzoek:
- Beoordeel de ernst van AA middels SALT
- Wees bij het lichamelijk onderzoek alert op huidmaligniteiten inclusief cutaan T
cellymfoom (in het bijzonder in het geval van erythrodermie, late onset eczeem zonder
atopische constitutie, forse aanhoudende exacerbatie, en/of therapieresistentie),
aanwezigheid van secundaire infecties, herpes simplex/zoster infectie, en acne.
• Aanvullend onderzoek: Laboratoriumonderzoek conform tabel ‘Aanbevolen laboratoriumcontroles (baricitinib en ritlecitinib)’.
•Adviseer, idealiter vóór start, het recombinante herpes zoster vaccin (Shingrix®) aan patiënten die behandeld gaan worden met een JAK-remmer. Zie ook: Uitbreiding vergoedingsvoorwaarden Shingrix.
• Inventariseer eventuele geplande/benodigde vaccinaties met een (verzwakt) levend vaccin in de toekomst en adviseer pneumokokkenvaccinatie en jaarlijkse influenzavaccinatie conform LCI-richtlijn: Vaccinatie bij chronisch inflammatoire aandoeningen.
• Adviseer bij verbetering van het eczeem de topicale steroïden geleidelijk af te bouwen en niet abrupt te staken.
• Geef algemene adviezen over zonbescherming vanwege verhoogde kans op huidmaligniteiten bij immuunsuppressie.
• Adviseer vrouwen die zwanger kunnen worden om effectieve anticonceptie te gebruiken tijdens en tot tenminste 1 week na de laatste dosis. Een zwangerschap moet vóór start en bij alle controlemomenten anamnestisch worden uitgesloten, bij twijfel wordt een zwangerschapstest aanbevolen.
Tijdens de behandeling adviseert de werkgroep als volgt:
• Anamnese: neem een anamnese af gericht op klachten passend bij of een voorgeschiedenis van maligniteit (inclusief de huid), recente cardiovasculaire events, actieve infecties, herpesinfecties, spierklachten, acne en (actieve) kinderwens.
• Lichamelijk onderzoek:
- Beoordeel de ernst van AA middels SALT
- Wees bij het lichamelijk onderzoek alert op huidmaligniteiten inclusief cutaan T
cellymfoom (in het bijzonder in het geval van erythrodermie, late onset eczeem zonder
atopische constitutie, forse aanhoudende exacerbatie, en/of therapieresistentie), en
aanwezigheid van secundaire infecties, herpes simplex/zoster infectie, en acne.
• Aanvullend onderzoek: Laboratoriumonderzoek conform tabel Aanbevolen laboratoriumcontroles (baricitinib en ritlecitinib).
• Een zwangerschap moet vóór start en bij alle controlemomenten anamnestisch worden uitgesloten, bij twijfel wordt een zwangerschapstest aanbevolen.
• Overweeg laagdrempelig om de dosis te verlagen of de behandeling te onderbreken bij het optreden van bijwerkingen (bijv. (ernstige) infecties, laboratorium afwijkingen) of comorbiditeiten (bijv. maligniteiten, cardiovasculaire events).
Na de behandeling adviseert de werkgroep als volgt:
• Monitor de ziekteactiviteit, bijwerkingen en behandelwensen van patiënt, en pas hier toekomstige therapie op aan.
• Vrouwen die zwanger kunnen worden dienen het advies te krijgen om effectieve anticonceptie te gebruiken tijdens en tot tenminste 1 week na de laatste dosis.
Screening baricitinib en ritlecitinib
In de praktijk wordt door de richtlijnwerkgroep voor alle JAK-remmers dezelfde screening en onderzoeken ter monitoring van de behandeling aanbevolen. Screening voorafgaand aan een behandeling betreft een volledig bloedbeeld, leukocyten differentiatie, nierfunctie, leverfunctie, en lipidenspectrum. Bepalen van de creatinekinase(CK)-waarde is op indicatie. Infectiescreening op HIV, hepatitis B en C en tuberculose is aan te raden voordat de therapie wordt gestart, al dan niet kan besloten worden tot laboratoriumonderzoek (voor tuberculosescreening bestaat een vast algoritme, zie tabel 5 voor meer informatie). Een zwangerschap moet bij alle controle momenten anamnestisch worden uitgesloten, bij twijfel wordt een zwangerschapstest aanbevolen.
De behandeling mag niet gestart worden bij patiënten met een absolute lymfocytentelling van minder dan 0,5 x 109/L, een absolute neutrofielentelling van minder dan 1 x 109/L, of met een hemoglobinewaarde van minder dan 5 mmol/L. De behandeling kan worden ingesteld zodra de waarden tot boven deze limieten hersteld zijn.
Laboratoriumcontroles bij baricitinib en ritlecitinib
Zie tabel ‘Aanbevolen laboratoriumcontroles’ voor adviezen en afkapwaardes.
Tabel Aanbevolen laboratoriumcontroles (baricitinib en ritlecitinib)
|
Parameter |
Bij intake |
Bij 4 weken |
Bij 12-16 weken |
Tijdens onderhoudsdosering (elke 3-6 maanden) |
|
Bloedonderzoek |
|
|
|
|
|
x |
x |
x |
x |
|
x |
x |
x |
x |
|
x |
x |
x |
x |
|
(x) |
(x) |
(x) |
(x) |
|
x |
|
x |
Jaarlijks |
|
Hiv* |
x |
|
|
|
|
HBV/HCV* |
x |
|
|
|
|
Zwangerschap** |
x |
x |
x |
x |
|
TBC screening*** |
x |
|
|
|
|
Grenswaarden: Hemoglobine <5 mmol/L à de behandeling moet worden onderbroken en mag worden hervat als het boven deze waarde is teruggekeerd. Absoluut lymfocyten aantal <0,5 x 109/L à de behandeling moet worden onderbroken en mag worden hervat als het boven deze waarde is teruggekeerd. Absoluut neutrofielen aantal <1 x 109/L de behandeling moet worden onderbroken en mag worden hervat als het boven deze waarde is teruggekeerd. Leukocyten <3,0 x 109/L. à de behandeling moet worden onderbroken en mag worden hervat als het boven deze waarde is teruggekeerd. Trombocyten <50 x 109/L. à de behandeling moet worden onderbroken en mag worden hervat als het boven deze waarde is teruggekeerd, streef naar >100 x 109/L. Bij 2x trombocyten tussen de 50-100 x 109/L: overweeg ook te onderbreken. ALAT ≥3 x de bovengrens van normaalwaarde → overleg/verwijzen MDL-arts. Cholesterol en triglyceriden à indien van toepassing verwijs naar de huisarts bij afwijkingen. Serum kreatinine >130% boven de uitgangswaarde van de patiënt → intensivering frequentie van controles en evt. aanpassing van de dosering. CK >5 x bovengrens van normaalwaarde à (sport)anamnese uitvragen, opnieuw controle binnen een week, indien persisterend overleg met reumatoloog. Waarden met een klinische consequenties zijn een veelvoud hiervan, waarbij >10.000 vaak pas sprake kan zijn van rhabdomyolyse of myositis. Een verhoogd CK behoeft maar zelden tot staken van de medicatie te leiden. |
||||
|
(X) = op indicatie (spierzwakte, spierstijfheid, verminderde inspanningstolerantie, snel optredende spierpijn met spierkrampen na inspanning, roodbruine urine, verwardheid). *Screenen middels serologie; bij recente test (<6 maanden) dient de indicatie ingeschat te worden door het uitvragen van het risico op deze infecties. **Anamnestisch uitsluiten en bij twijfel testen middels zwangerschapstest. ***Zie FMS-richtlijn Tuberculosescreening voorafgaande aan immunosuppressieve medicatie. |
||||
Speciale overwegingen baricitinib en ritlecitinib
Voor starten van de behandeling
- Infecties: de behandeling mag niet worden gestart wanneer een patiënt een ernstige actieve infectie heeft.
- Latente tuberculose: patiënten moeten vóór instelling van therapie op tuberculose (TBC) worden gescreend. De behandeling mag niet worden gegeven aan patiënten met actieve TBC. Bij patiënten met niet eerder behandelde, latente TBC moet anti-TBC-therapie vóór de start van de behandeling worden gegeven. Hierin wijkt de werkgroep af van de SmPC (Litfulo en Olumiant EPAR – Product information, 2023), welke dit ter overweging laat.
- Vaccinaties:
Vóór start behandeling wordt geadviseerd toekomstige reisplannen waarvoor vaccinaties nodig zijn in kaart te brengen en te zorgen voor een goede vaccinatiestatus.
Geïnactiveerde/dode/niet-levende vaccins
Deze vaccins kunnen in het algemeen zonder problemen worden gegeven; de respons op vaccinaties kan echter verminderd zijn.
- Het wordt aanbevolen om geïnactiveerde vaccins bij voorkeur 2 weken voorafgaand aan de start van systemische therapie te geven. Als patiënten reeds systemische immunosuppressieve therapie krijgen zou een geïnactiveerd vaccin moeten worden gegeven zonder onderbreking van de behandeling.[Wagner et al., 2019]
-
Het wordt aanbevolen om het recombinante herpes zoster vaccin (Shingrix®) voor te schrijven vóór de start met een JAK-remmer (idealiter 2 vaccinaties voor start behandeling, waarbij tussen de laatste vaccinatie en start 2 weken zit). In de praktijk zal de 2de vaccinatie vaak tijdens de behandeling plaatsvinden, om onnodig uitstellen van de behandeling te voorkomen.
- Adviseer pneumokokkenvaccinatie (eerst PCV13 gevolgd door PPV23 na ≥ 2 maanden, meestal tijdens behandeling met JAK-remmer; PPV23-booster herhalen elke 5 jaar) en jaarlijkse influenzavaccinatie conform LCI-richtlijn: Vaccinatie bij chronisch inflammatoire aandoeningen.
Levende en levende verzwakte vaccins
Deze vaccins worden niet aanbevolen tijdens of vlak voor start van baricitinib of ritlecitnib. Er zijn geen data beschikbaar over de veiligheid en respons op deze vaccins bij baricitinib of ritlecitnib gebruik. Verwijs hiervoor bij voorkeur naar een gespecialiseerd vaccinatiecentrum met ervaring m.b.t. vaccinatie bij patiënten die immuun-modulerende middelen gebruiken.
- Het is aanbevolen om patiënten te vaccineren met levende en levende verzwakte immunisaties in overeenstemming met de huidige vaccinatierichtlijnen minstens 4 weken voorafgaand aan de start van de behandeling. [ACR, 2022]
- In het geval van noodzakelijke indicatie tijdens behandeling, wordt aangeraden baricitinib of ritlecitnib minstens 1 week te onderbreken alvorens het toedienen van (verzwakt) levende vaccins. Na vaccinatie met een levend (verzwakt) vaccin moet minstens 4 weken gewacht worden met (her)start baricitinib of ritlecitnib.[ACR, 2022]
Tijdens de behandeling
- Infecties: bij patiënten met chronische of recidiverende infecties dient dosisaanpassing of staken overwogen te worden. De behandeling mag worden hervat wanneer de behandeling onder controle is.
- Herpes-zosterinfectie: de incidentie van herpes-zostervirus reactivatie bij patiënten op een JAK-remmer is verhoogd. Het is daarom belangrijk patiënten te instrueren over symptomen die passen bij een reactivatie, zodat de patiënt vroegtijdig contact op kan nemen met de behandelaar. Wij adviseren tijdelijke onderbreking van de behandeling, tot er duidelijk herstel optreedt en er geen uitbreiding van huidlaesies meer is. Vaccinatie tegen herpes zoster voorafgaand aan de start met een JAK-remmer wordt aanbevolen.
- Herpes-simplexinfectie: bij het gebruik van JAK-remmers bestaat er een verhoogde incidentie van reactivering van het herpes-simplexvirus. Omdat een herpes-simplexinfectie ernstiger kan verlopen tijdens het gebruik van een JAK-remmer is het te overwegen, afhankelijk van de ernst, om tijdelijk te stoppen met de JAK-remmer. De richtlijnwerkgroep adviseert zo nodig gedurende een aantal dagen te stoppen, tot er duidelijk herstel optreedt en er geen uitbreiding van huidlaesies meer is (vaak is dat 1 week). (NTvDV. 2023 januari) Bij patiënten met frequent recidiverende herpes-simplexinfecties kan een onderhoudsbehandeling met valaciclovir overwogen worden.
Maligniteit
Er zijn onvoldoende gegevens in de AA-populatie om specifieke uitspraken te doen over het risico op maligniteiten als gevolg van behandeling met een JAK-remmer. Hoewel gegevens uit fase 3 klinische onderzoeken naar systemische behandelingen voor AA geen signalen laten zien van verhoogde incidentie hebben deze studies onvoldoende follow-up tijd en zijn ze niet geschikt om veranderingen in de incidentie van kanker op te sporen. (Adam, 2023) Het risico op maligniteiten, waaronder lymfoom, is bij patiënten met reumatoïde artritis, die met een JAK-remmer werden behandeld, verhoogd.
- Start géén JAK-remmer bij patiënten met een actieve maligniteit.
- De risico’s en voordelen van baricitinib/ritlecitnib behandeling dienen overwogen te worden voor het starten van de behandeling bij patiënten met een maligniteit in de voorgeschiedenis (anders dan non-melanoma skin cancer (NMSC)). (Olumiant en Litfulo: EPAR – Product information, 2023) JAK-remmers dienen in deze situatie alleen te worden gebruikt als er géén geschikte behandelalternatieven beschikbaar zijn. Overleg bij patiënten met een maligniteit in de voorgeschiedenis waarvoor nog follow-up, met de desbetreffende behandelaar voorafgaande aan start met een JAK-remmer. Bij het ontwikkelen van een maligniteit tijdens de behandeling adviseert de richtlijnwerkgroep, op basis van expert opinion, de behandeling te onderbreken en te overleggen met een aangewezen specialist.
- Wees bij het lichamelijk onderzoek (voor en tijdens de behandeling) alert op huidmaligniteiten inclusief cutaan T-cellymfoom (in het bijzonder in het geval van erythrodermie, late onset eczeem zonder atopische constitutie, forse aanhoudende exacerbatie en/of therapieresistentie).
Zwangerschap, lactatie en kinderwens baricitinib (Olumiant: EPAR – Product information, 2023)
- Zwangerschap: de JAK/STAT-route blijkt een rol te spelen bij celadhesie en celpolariteit wat van invloed kan zijn op de vroegembryonale ontwikkeling. Er zijn geen adequate gegevens beschikbaar over het gebruik van baricitinib bij zwangere vrouwen. Uit dieronderzoek is reproductietoxiciteit gebleken. Bij ratten en konijnen was baricitinib teratogeen. De resultaten van dieronderzoek duiden erop dat baricitinib in hogere doseringen een ongunstig effect kan hebben op de botontwikkeling in utero. Baricitinib is gecontra-indiceerd tijdens de zwangerschap. Vrouwen die zwanger kunnen worden, moeten effectieve anticonceptie gebruiken tijdens en tot minstens 1 week na de laatste dosis. Als een patiënt tijdens het gebruik van baricitinib zwanger wordt, moeten de ouders worden geïnformeerd over het potentiële risico voor de foetus.
- Lactatie: het is niet bekend of baricitinib/metabolieten in de moedermelk wordt/worden uitgescheiden. Uit beschikbare farmacodynamische/toxicologische gegevens bij dieren blijkt dat baricitinib in melk wordt uitgescheiden. Risico voor pasgeborenen/zuigelingen kan niet worden uitgesloten en baricitinib dient niet te worden gebruikt tijdens de periode van borstvoeding. Er moet worden besloten of borstvoeding moet worden gestaakt of dat behandeling moet worden gestaakt, waarbij het voordeel van borstvoeding voor het kind en het voordeel van behandeling voor de vrouw in overweging moeten worden genomen.
- Kinderwens: onderzoeken bij dieren duiden erop dat behandeling met baricitinib het potentieel heeft om de vruchtbaarheid van vrouwen tijdens de behandeling te verlagen, maar er was bij mannelijke dieren was er geen effect op de spermatogenese. Niet onderzocht bij mensen.
Zwangerschap, lactatie en kinderwens ritlecitinib (Litfulo: EPAR – Product information, 2023)
- Zwangerschap: de JAK/STAT-route blijkt een rol te spelen bij celadhesie en celpolariteit wat van invloed kan zijn op de vroegembryonale ontwikkeling. Er zijn geen adequate gegevens beschikbaar over het gebruik van ritlecitinib bij zwangere vrouwen. Uit dieronderzoek is reproductietoxiciteit gebleken. Bij ratten en konijnen was ritlecitinib teratogeen in hoge doses. Ritlecitinib is gecontra-indiceerd tijdens de zwangerschap. Vrouwen die zwanger kunnen worden, moeten effectieve anticonceptie gebruiken tijdens en tot minstens 1 maand na de laatste dosis. Als een patiënt tijdens het gebruik van ritlecitinib zwanger wordt, moeten de ouders worden geïnformeerd over het potentiële risico voor de foetus.
- Lactatie: het is niet bekend of ritlecitinib/metabolieten in de moedermelk wordt/worden uitgescheiden. Uit beschikbare farmacodynamische/toxicologische gegevens bij dieren blijkt dat ritlecitinib in melk wordt uitgescheiden. Risico voor pasgeborenen/zuigelingen kan niet worden uitgesloten en ritlecitinib dient niet te worden gebruikt tijdens de periode van borstvoeding. Er moet worden besloten of borstvoeding moet worden gestaakt of dat behandeling moet worden gestaakt, waarbij het voordeel van borstvoeding voor het kind en het voordeel van behandeling voor de vrouw in overweging moeten worden genomen.
- Kinderwens: het effect van ritlecitinib op de vruchtbaarheid van de mens is niet geëvalueerd. Er waren geen effecten op de vruchtbaarheid van ratten bij klinisch relevante blootstellingen.
Waarden en voorkeuren van patiënten
Patiënten hebben mogelijk baat bij medicamenteuze behandeling van AA in verband met de vaak hoge ziektelast. Deze ziektelast omvat onder andere de mogelijke onzekerheid die de ziekte met zich meebrengt en de verdere psychologische gevolgen die door patiënten kan worden ervaren. Een effectieve behandeling van de haarziekte waarbij de hergroei van haar (grotendeels) hersteld wordt kan deze ziektelast doen afnemen. Bij het toepassen van medicamenteuze behandeling dient de patiënt te worden ingelicht over de mogelijke bijwerkingen van de verschillende geneesmiddelen. Daarnaast is het ook van belang om de patiënt juist voor te lichten over het mogelijk onvoorspelbare beloop tijdens en na de behandeling. Ook bij een goed effect van de ingestelde behandeling kunnen er later in het ziektebeloop redenen zijn om de behandeling te staken, zoals bijwerkingen of een zwangerschapswens. Dan is de kans groot dat de alopecia terugkeert. Ten slotte dienen patiënten met een reeds lange stabiele ziekteduur te worden geïnformeerd dat dit een slechtere prognose geeft, ondanks eventuele behandeling. Een passend behandelplan dient in samenspraak met de patiënt te worden opgesteld en aan te sluiten bij het behandeldoel van de patiënt. Daarbij is het belangrijk om te realiseren dat naarmate de tijd verstrijkt, het behandeldoel kan veranderen.
Onderbouwing
Achtergrond
Alopecia areata (AA) is een auto-immuunaandoening die gekarakteriseerd wordt door snel haarverlies van de schedel, wenkbrauwen en wimpers waarbij behandeling gelimiteerd is (King, 2022). Naast deze voorkeursplekken kan alle lichaamsbeharing aangedaan zijn. Het treft ongeveer 2% van de algehele bevolking op een bepaald moment in hun leven (Prat, 2017). De medicamenteuze behandeling van AA is moeilijk. Er zijn uiteenlopende behandelingen beschikbaar met lokale, intralesionale en/of systemische middelen waarmee gepoogd wordt het haarverlies tegen te gaan en de hergroei van haar te stimuleren. Echter zijn deze, op baricitinib na, niet geregistreerd voor de indicatie AA. Over de effectiviteit van verschillende middelen is weinig bekend doordat er weinig goede gerandomiseerde studies zijn uitgevoerd; bovendien speelt de factor spontane remissie ook altijd een rol. Tenslotte is follow-up data beperkt beschikbaar waardoor het onduidelijk is of, en in welke mate relapse optreedt na staken van de behandeling. In de dagelijkse praktijk is er wel off-label ervaring met verschillende, met name immunosuppressieve, middelen. Behandeling is symptomatisch waarbij het herstel van haarverlies door therapie veelal tijdelijk is; na staken van de behandeling kan haaruitval opnieuw optreden. Nieuwe therapieën met JAK-remmers, zoals baricitinib en ritlecitinib, laten hoopvolle eerste resultaten zien. Mogelijk bieden deze geneesmiddelen een uitkomst voor patiënten met ernstige alopecia die een behandelwens hebben.
Deze module heeft als doel om meer inzicht te krijgen in de beschikbare behandelingen en hun effectiviteit bij volwassenen met AA, en hierbij een handreiking te geven voor de therapeutische opties.
Conclusies / Summary of Findings
De GRADE analyse van onderstaande vergelijkingen is terug te vinden onder Evidence Tabellen
DPCP vs. placebo (bij milde en matig-ernstige AA)
|
Laag |
Uitkomstmaat: hergroei van haar (SALT) Gupta et al. (2019-2) |
Topicale corticosteroïden vs. placebo (bij milde en matig-ernstige AA)
|
Laag |
Uitkomstmaat: hergroei van haar (SALT)
|
Topicale minoxidil vs. placebo (matig-ernstige AA)
|
Laag |
Uitkomstmaat: hergroei van haar (SALT) |
Topicale minoxidil vs. placebo (milde AA)
|
Laag |
Uitkomstmaat: hergroei van haar (SALT) |
Topicale minoxidil vs. latanoprost (milde AA)
|
Zeer laag |
Uitkomstmaat: hergroei van haar (SALT)
|
Bimatoprost vs. topicale corticosteroïnden (milde AA)
|
Laag |
Uitkomstmaat: hergroei van haar (SALT)
|
Latanoprost vs. placebo (milde AA)
|
Laag |
Uitkomstmaat: hergroei van haar (SALT) |
Latanoprost vs. betamethason (topicaal) (milde AA)
|
Zeer laag |
Uitkomstmaat: hergroei van haar (SALT)
|
DPCP vs. DPCP + ditranol (milde tot matig-ernstige AA)
|
Laag |
Uitkomstmaat: hergroei van haar (SALT)
|
|
Zeer laag |
Uitkomstmaat: AASIS
|
|
Laag |
Uitkomstmaat: Veiligheid
|
Calcipotriol 0,005% vs. clobetasol 0,05% (milde AA)
|
Zeer laag |
Uitkomstmaat: hergroei van haar (SALT) en relaps (na 12 maanden)
|
Combinatietherapie met mometason 0.01% crème + calcipotriol 0.005% zalf vs mometason 0.01% crème monotherapie (milde AA)
|
Laag |
Uitkomstmaat: hergroei van haar (SALT)
Alam et al. (2019) |
Plaatsjesrijk plasma intralesionaal (single- en double-spin) vs. triamcinolonacetonide intralesionaal 5-10 mg/ml (3-5 sessies met een interval van 2-4 weken) (milde AA)
|
Redelijk |
Uitkomstmaat: hergroei van haar (SALT)
|
|
Laag |
Uitkomstmaat: Veiligheid
|
Triamcinolonacetonide intralesionaal 3.33mg/ml 0.1ml per cm2, maximaal 3ml (elke 4 weken, max 6 maanden) vs. placebo (milde AA)
|
Redelijk |
Uitkomstmaat: hergroei van haar (RGS)
|
Triamcinolonacetonide intralesionaal 5mg/ml of 10mg/ml 0.1ml per cm2, maximaal 3ml (elke 4 weken, max 6 maanden) vs. placebo (bij milde AA)
|
Redelijk |
Uitkomstmaat: hergroei van haar (RGS)
|
Triamcinolonacetonide intralesionaal 2.5mg/ml 0.1ml per cm2 (elke 4 weken, voor 3 maanden) vs placebo (milde AA)
|
Redelijk |
Uitkomstmaat: hergroei van haar (RGS)
|
Triamcinolonacetonide intralesionaal 5mg/ml of 10mg/ml 0.1ml per cm2 (elke 4 weken, voor 3 maanden) vs placebo (milde AA)
|
Redelijk |
Uitkomstmaat: hergroei van haar (RGS)
|
Triamcinolonacetonide intralesionaal 10mg/ml (elke 3 weken voor 12 weken) vs. betamethason (lokaal, 2dd voor 12 weken) vs. tacrolimus 0,1% (2dd voor 12 weken)
(onduidelijk bij welke ernst AA)
|
Zeer laag |
Uitkomstmaat: hergroei van haar (HRG)
|
Methotrexaat vs. betamethason pulse-therapie (bij ernstige AA)
|
Laag |
Uitkomstmaat: hergroei van haar (SALT, fotografisch score systeem en VAS (m.b.t. laesies))
Het zou kunnen dat betamethason pulse-therapie de hergroei van haar verhoogt ten opzichte van methotrexaat. |
Combinatietherapie met methotrexaat en betamethason pulse-therapie vs. methotrexaat (bij ernstige AA)
|
Laag |
Uitkomstmaat: hergroei van haar (SALT, fotografisch score systeem en VAS (m.b.t. laesies))
|
Combinatietherapie met methotrexaat en betamethason pulse-therapie vs betamethason pulse-therapie (bij ernstige AA)
|
|
Uitkomstmaat: hergroei van haar (SALT, fotografisch score systeem en VAS (m.b.t. laesies)) Het zou kunnen dat combinatietherapie met methotrexaat en betamethason pulse-therapie de hergroei van haar verhoogt ten opzichte van betamethason pulse-therapie (monotherapie).
Asilian et al. (2020) |
Dupilumab vs. placebo (bij milde tot ernstige AA)
|
Laag
|
Uitkomstmaat: hergroei van haar (SALT) |
Wekelijkse azathioprine pulse (WAP) therapie (300mg 1dd voor 2 opvolgende dagen per week voor 5 maanden) vs. betamethason orale pulse-therapie (5mg 1dd voor 2 opvolgende dagen per week voor 5 maanden (bij mild tot ernstige AA)
|
|
Uitkomstmaat: hergroei van haar (SALT en IGA)
|
Ciclosporine (4mg/kg/dag voor 3 maanden) vs. placebo (bij milde tot ernstige AA)
|
Laag |
Uitkomstmaat: hergroei van haar (SALT)
Wai Yun Lai et al (2019, 2021) |
|
Laag |
Uitkomstmaat: veiligheid
Wai Yun Lai et al (2019, 2021) |
|
|
Uitkomstmaat: impact op kwaliteit van leven (AQoL-8D en AASIS)
Wai Yun Lai et al (2019, 2021) |
TCA i.m. vs. dexamethason (bij milde tot ernstige AA)
|
Laag |
Uitkomstmaat: hergroei van haar (fotografisch score systeem met %)
Het zou kunnen dat TCA i.m. de mate van hergroei van haar verhoogt ten opzichte van dexamethason. |
|
Laag |
Uitkomstmaat: relaps 6 maanden na staken (nieuwe kale plekken of toename in haaruitval)
Het zou kunnen dat TCA i.m. en dexamethason een evenredig grote kans geven op relapse. |
TCA i.m. vs. prednisolon (bij milde tot ernstige AA)
|
Laag |
Uitkomstmaat: hergroei van haar (fotografisch score systeem met %)
Het zou kunnen dat TCA i.m. en prednisolon de mate van hergroei van haar evenredig verhogen. |
|
Laag |
Uitkomstmaat: relaps 6 maanden na staken (nieuwe kale plekken of toename in haaruitval)
Het zou kunnen dat TCA i.m. en prednisolon een evenredig grote kans geven op relapse. |
Prednisolon vs. dexamethason (milde tot ernstige AA)
|
Laag |
Uitkomstmaat: hergroei van haar (fotografisch score systeem met %)
Het zou kunnen dat prednisolon en dexamethason de mate van hergroei van haar evenredig verhogen. |
|
Laag |
Uitkomstmaat: relaps 6 maanden na staken (nieuwe kale plekken of toename in haaruitval)
Het zou kunnen dat prednisolon een lagere kans geeft op relapse dan dexamethason. |
Baricitinib 2 mg of 4 mg vs. placebo (bij ernstige AA)
|
Hoog |
Uitkomstmaat: hergroei van haar (SALT)
Baricitinib in 2 mg en 4 mg verhogen de mate van hergroei van haar. King et al. (2022) |
|
Laag |
Uitkomstmaat: veiligheid (t/m week 52) - Zie ook ‘contra-indicaties’ in professioneel perspectief
King et al. (2022) |
|
Redelijk |
Uitkomstmaat: hergroei van haar (PRO)
King et al. (2022) |
Ritlecitinib vs. placebo (ernstige AA)
|
Hoog |
Uitkomstmaat: hergroei van haar (SALT score, EBA-respons, ELA-respons)
Ritlecitinib verhoogt de mate van hergroei van haar ten opzichte van placebo. King et al. (2023), Winnette et al. (2022), King et al. (2021) |
|
|
Uitkomstmaat: hergroei van haar (IGA)
Ritlecitinib verhoogt waarschijnlijk de mate van hergroei van haar ten opzichte van placebo. Winnette et al. (2022), King et al. (2021) |
|
|
Uitkomstmaat: hergroei van haar (PGI-C)
Ritlecitinib verhoogt waarschijnlijk de mate van hergroei van haar ten opzichte van placebo. King et al. (2023) |
|
Laag |
Uitkomstmaat: veiligheid (t/m week 48) - Zie ook ‘contra-indicaties’ in professioneel perspectief
King et al. (2023), Winnette et al. (2022), King et al. (2021) |
|
Laag |
Uitkomstmaat: impact op kwaliteit van leven (AASIS)
Winnette et al. (2022), King et al. (2021) |
Samenvatting literatuur
Er werden in totaal 112 studies geïncludeerd op basis van beoordeling van titel en abstract. Uiteindelijk zijn er na full text screening 94 studies geëxcludeerd. Specifieke redenen voor exclusie zijn benoemd in de tabel in bijlage X.
Beschrijving van de studies
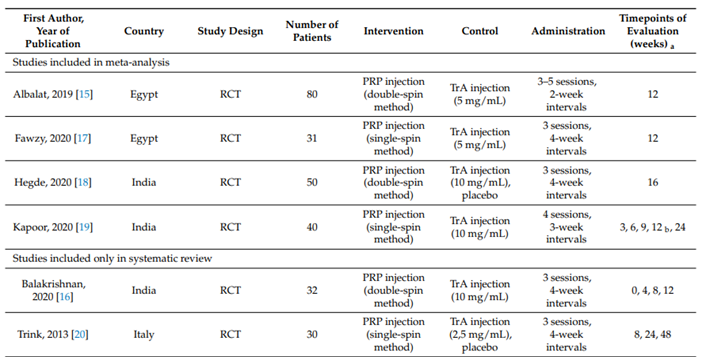
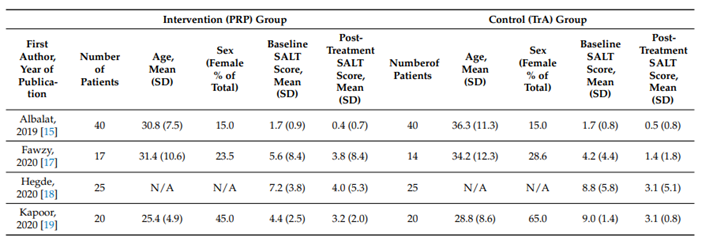
De zoekactie identificeerde 2 systematic reviews (44 studies),15 RCT’s en 1 observationele studie.
Gupta et al. (2019-2) voerden een systematic review met netwerk meta-analyse uit naar verschillende lokale en intralesionale (mono)therapieën. In totaal werden er 38 studies geïncludeerd waarvan 11 over patiënten met milde AA (<3 aangedane plekken) en 27 over patiënten met ernstige AA (>50% haarverlies). Een minimum van 2 studies werd gehanteerd om een vergelijking te kunnen analyseren. Case reports, single-arm studies en studies naar combinatietherapieën werden geëxcludeerd. Voor de netwerk meta-analyse werd gebruik gemaakt van directe en indirecte vergelijkingen. Daarbij werd gekeken naar de risk of bias en er werd een inconsistentie analyse en een GRADE analyse gedaan.
Alam et al. (2019) voerden een RCT zonder blindering uit onder 100 patiënten tussen de 12 en 65 jaar die zich presenteerden met alopecia areata met <50% haarverlies van de scalp (exclusie van patiënten die ook op andere plekken haarverlies hadden). De patiënten werden gerandomiseerd in de combinatietherapie van mometason 0.1% crème + calcipotriol 0.005% zalf groep (N=50) of de mometason monotherapie groep.
Ghandi et al. (2021) voerden een RCT zonder blindering uit onder 50 volwassen patiënten met alopecia areata met ≥25% haarverlies van de scalp en ≥3 maanden niet waren behandeld met een ander medicijn. De patiënten werden gerandomiseerd in de diphencyprone (DPCP) groep (wekelijks een toenemende dosis totdat een milde dermatitis optrad, vervolgens werd deze concentratie voor 6 maanden gecontinueerd) of de DPCP + ditranol groep (concentratie 0.5% 48 uur na DPCP applicatie en vervolgens de 4 dagen daaropvolgend, de duur en concentratie werd langzaam opgehoogd tot respectievelijk 1 uur en 1%).
Molinelli et al. (2020) voerden een observationele studie uit onder 35 volwassen patiënten met AA met 10-75% haarverlies. De patiënten kregen rechts en links behandeling met aan de ene zijde calcipotriol 0,005% en aan de andere zijde clobetasol 0,05% beide 2 maal daags voor 12 weken. Van week 13 tot 24 was het mogelijk om naar wens van de patiënt de therapie te continueren.
Bhat et al. (2021) voerden een RCT zonder blindering uit onder 50 patiënten met AA met <40% haarverlies. De patiënten werden behandeld middels latanoprost of betamethason beide 2dd gedurende 16 weken.
Ustuner et al. (2017) voerden een RCT zonder blindering uit onder 89 patiënten tussen de 16 en 51 jaar die zich presenteerden met alopecia areata <3 jaar met <50% haarverlies (1-6 plekken met haarverlies van max. 3cm in diameter, of AA subtotalis <50% haarverlies van de scalp of baardregio). De plekken met haarverlies (n=231) van de patiënten (n=83) werden gerandomiseerd in een van de triamcinolonacetonide intralesionaal (TCA) groepen of de saline (placebo) groep. TCA 40mg/ml werd verdund als volgt: TCA1 (1/4), TCA2 (1/8), TCA3 (1/12).
Kuldeep et al (2011) voerden een RCT zonder blindering uit onder 105 (analyse van 78) patiënten tussen de 10 en 50 jaar die zich presenteerden met alopecia areata. De patiënten werden gerandomiseerd in de betamethason foam 0,1% 2dd groep, de tacrolimus zalf 0,1% 2dd groep of de triamcinolonacetonide intralesionaal 10 mg/ml elke 3 weken groep, allen voor 12 weken.
Rajan et al. (2021) voerden een RCT zonder blindering uit onder 105 patiënten vanaf 12 jaar die zich presenteerden met alopecia areata met <50% haarverlies van de scalp. De plekken met haarverlies (n=168) van de patiënten (n=105) werden gerandomiseerd in een van de triamcinolonacetonide intralesionaal (TCA) groepen (10mg/ml, 5mg/ml of 2.5mg/ml) of de saline (placebo) groep.
Meznerics et al. (2022) voerden een systematic review en meta-analyse uit naar behandeling van AA middels plaatjesrijkplasma (PRP). Deze behandeling werd vergeleken met TCA en placebo. In totaal werden er 6 studies geïncludeerd. Hiervan werden 4 studies geïncludeerd in de meta-analyse.
King et al. (2022) voerden 2 randomized placebo-controlled trials uit onder 1200 volwassen patiënten die zich presenteerden met alopecia areata (huidige episode >6maanden en ≤8jaar) in één adaptieve fase II/III studie (BRAVE-AA1, n=654) en één fase III-studie (BRAVE-AA2, N=546). De resultaten werden gezamenlijk gepubliceerd in één publicatie. De patiënten werden gerandomiseerd in een baricitinib (2mg 1dd of 4mg 1dd voor 36 weken) of de placebogroep.
Winnette et al. (2022) en King et al. (2021) voerden een randomized placebo-controlled phase 2a studie uit onder 95 volwassen patiënten die zich presenteerden met alopecia areata (huidige episode ≤7 jaar) met ≥50% haarverlies van de scalp. De patiënten werden gerandomiseerd in de ritlecitinib (200mg 1dd voor 4 weken gevolgd door 50mg 1dd voor 20 weken) of de placebogroep.
Asilian et al. (2020) voerden een randomized placebo-controlled studie uit onder 36 patiënten (16-60 jaar) met alopecia areata met ≥50% haarverlies van de scalp en ≥6 maanden niet reagerend op lokale en systemische therapie. De patiënten werden gerandomiseerd in betamethason pulse groep (oraal, 0.5mg in doseringen van 1mg 1x/week voor 6 maanden), methotrexaat groep (2.5mg 2 tabletten 3dd 1x/week voor 6 maanden) of de combinatie van bethamethason en methotrexaat (respectievelijk, pulse-therapie 0.5mg in doseringen van 1mg 1x/week voor 6 maanden en 2.5mg 2 tabletten 3dd 1x/week voor 6 maanden).
Guttman-Yassky et al. (2021) voerden een fase 2a randomized clinical trial uit onder 60 volwassen patiënten die zich presenteerden met haarverlies van de scalp. Een van de inclusie criteria voor deze studie was dat 1/3 van de studiepopulatie constitutioneel eczeem (CE) of een voorgeschiedenis van constitutioneel eczeem moest hebben. De patiënten werden gerandomiseerd in de dupilumab (sc 300mg 1x/week voor 6 maanden) of de placebo groep (voor 6 maanden). Na deze periode werden beide groepen behandeld met dupilumab voor 6 maanden.
Wai Yun Lai et al. (2019, 2021) voerden een single center randomized placebo-controlled trial uit onder 36 volwassen patiënten die zich presenteerde met ≥20% haarverlies van de scalp. De patiënten werden gerandomiseerd in de cyclosporine (4mg/kg/dag voor 3 maanden) of de placebo groep (3 maanden). De uitkomstmaten van deze studies werden gepresenteerd in 2 losse artikelen.
Gupta et al. (2019-1) voerden een RCT uit onder 50 volwassen patiënten die zich presenteerden met >10% haarverlies van de scalp. De patiënten werden gerandomiseerd in wekelijks azathioprine pulse groep (oraal, 300mg 1x/week voor 4 maanden of totdat het haar compleet was terug gegroeid) of betamethason pulse groep (oraal, 5mg 1dd voor 2 opvolgende dagen per week voor 4 maanden of totdat het haar compleet was terug gegroeid).
Kurosawa et al. (2006) voerden een RCT zonder blindering uit onder 89 patiënten (16-63 jaar) met alopecia waaronder 51 patiënten ≥1 kale plekken hadden en 38 patiënten AA totalis/universalis hadden. De patiënten werden gerandomiseerd in de orale dexamethason groep (0.5mg/dag voor 6 maanden), de intramusculaire triamcinolonacetonide groep (imTA, 40mg 1x/maand voor 6 maanden, daarna 40mg 1/1,5maand voor 12 maanden) of de prednison pulse-therapie groep (80mg voor 3 opvolgende dagen eens per 3 maanden voor 6 maanden).
Risk of bias
Alle studies zijn onderzocht op het risico op bias. Hieronder zijn bondig de resultaten beschreven. De volledige beoordeling is beschreven in bijlage X.
De systematic review met netwerk meta-analyse van Gupta et al. (2019-2) is van lage kwaliteit. In de analyse werd niet gekeken naar terugkeer van de ziekte, terwijl dit bij AA juist een belangrijke parameter is. Daarnaast was er sprake van een hoge heterogeniteit binnen de studies, waardoor het onzeker is of de studies per vergelijking, maar zeker binnen een netwerk meta-analyse met elkaar vergeleken mogen worden. De resultaten werden opgesplitst in milde en matig-ernstige ziekte, maar sommige studies includeerden beide. De resultaten dienen daarom met gepaste voorzichtigheid geïnterpreteerd te worden. Verder is de studie zeer volledig in het beschrijven van de geïncludeerde studies en de daar bijhorende risk of bias en GRADE analyses.
De RCT van Alam et al. (2019) is van matige kwaliteit. Er is geen placebogroep opgenomen in de studie. Er is geen blindering toegepast op patiënten, personeel en onderzoekers. Echter verwachten we niet dat dit effect heeft op de uitkomstmaten. Daarnaast is er geen studieprotocol beschikbaar en is het aantal patiënten dat geanalyseerd is niet duidelijk op te maken uit het artikel.
De RCT van Ghandi et al. (2021) is van matige kwaliteit. Er is geen placebogroep opgenomen in de studie. Er is geen blindering toegepast op patiënten, personeel en onderzoekers. Echter verwachten we niet dat dit effect heeft op de uitkomstmaten. Daarnaast is er geen studieprotocol beschikbaar.
De observationale studie van Molinell et al. (2020) is van lage kwaliteit. Er is geen placebogroep opgenomen en het betreft een intrasubject design, wat betekent dat er op dezelfde scalp meerdere therapieën zijn toegepast.
De RCT van Bhat et al. (2021) is van matige kwaliteit. Er is geen placebogroep opgenomen in de studie. De geïncludeerde patiënten zijn onduidelijk beschreven.
De RCT van Ustuner et al. (2017) is van redelijke kwaliteit. Er is een placebogroep opgenomen in de studie. De randomisatie is juist uitgevoerd. De patiënten die uitvielen tijdens de studie zijn niet duidelijk beschreven en er is geen studieprotocol beschikbaar.
De RCT van Kuldeep et al (2011) is van lage tot matige kwaliteit. Er is geen placebogroep opgenomen in de studie. Er was sprake van een hoge uitval in de studie van 28,35%, maar deze uitval wordt niet nader toegelicht. Daarbij wordt de ernst van de alopecia aratea van de groep gepresenteerd als geheel, maar is het niet zeker of deze verdeling ook van toepassing is op de geanalyseerde groep patiënten.
De RCT van Rajan et al. (2021) is van redelijke kwaliteit. Er is een placebogroep opgenomen in de studie. De randomisatie is juist uitgevoerd. Er was sprake van een hoge uitval in de studie van 28,58%. Er is geen studieprotocol beschikbaar.
De systematic review met meta-analyse van Meznerics et al. (2022) is van matig tot redelijke kwaliteit. Er is gekozen om alleen RCT’s te includeren wat de studieresultaten sterker maakt. Er was wel sprake van een hoge heterogeniteit binnen de studies, waardoor het onzeker is of de studies binnen een meta-analyse met elkaar vergeleken mogen worden.
De RCT van King et al. (2022) is van zeer goede kwaliteit. Er is een placebogroep opgenomen in de studie. De randomisatie is goed uitgevoerd. Zowel de patiënten als de onderzoekers werden geblindeerd. De sample is representatief voor de populatie.
De RCT beschreven door Winnette et al. (2022) en King et al. (2020) is van goede kwaliteit. Er is een placebogroep opgenomen in de studie. Zowel de patiënten als het personeel werden geblindeerd. Het is niet duidelijk of ook de onderzoekers geblindeerd waren.
De RCT van Asilian et al. (2020) is van matig tot redelijke kwaliteit. Er is geen placebogroep opgenomen in de studie. De randomisatie is goed uitgevoerd en de patiënten werden geblindeerd. Echter is er onvoldoende informatie over de blindering van personeel en de onderzoekers beschikbaar. Daarnaast is het studieprotocol ook niet beschikbaar.
De RCT van Guttman-Yassky et al. (2021) is van redelijke kwaliteit. Er is een placebogroep opgenomen in de studie. De patiënten, het personeel en de onderzoekers waren geblindeerd. Het is echter onduidelijk of de sample, waarin werd gestreefd dat 1/3 van de steekproef CE of een voorgeschiedenis met CE had, representatief is.
De RCT van Wai Yun Lai et al. (2019, 2021) is van goede kwaliteit. Er is een placebogroep opgenomen in de studie. Zowel de patiënten als de onderzoekers waren geblindeerd en het studieprotocol komt overeen met de gerapporteerde resultaten.
De RCT van Gupta et al. (2019-1) is van matig tot redelijke kwaliteit. Er is geen placebogroep opgenomen in de studie. De randomisatie is goed uitgevoerd, echter waren de patiënten, het personeel en de onderzoekers niet geblindeerd. We verwachten echter niet dat dit een groot effect heeft op de uitkomstmaten. Er was een dropout rate van 18% wat mogelijk leidt tot attrition bias.
De RCT van Kurosawa et al. (2006) is van matige kwaliteit. Er is geen placebogroep opgenomen in de studie. Er vond geen blindering plaats, maar we verwachten niet dat dit effect heeft op de uitkomsten. Er is geen studieprotocol beschikbaar. In de verschillende groepen was de verhouding tussen patiënten met ≥2 AA plekken en AA universalis/totalis verschillend, waardoor de resultaten moeilijker de interpreteren zijn.
Beschrijving van de resultaten
Gezien de uiteenlopende inclusie van studies naar verschillende therapieën, is in de tabel hieronder ‘Overzicht samenvatting resultaten’ een beknopte uiteenzetting van de geïncludeerde studies en diens resultaten beschreven. Voor de interpretatie van deze resultaten is ook de GRADE bewijskracht in de tabel opgenomen. Onder de tabel worden alle resultaten uitgebreid beschreven.
De werkgroep heeft haarverlies van <50% gedefinieerd als milde alopecia areata en ≥50% als ernstige alopecia areata.
Tabel Overzicht samenvatting resultaten
|
Vergelijking |
Ernst AA in |
N |
Uitkomsten |
GRADE bewijskracht |
|
DPCP vs. placebo |
Mild – ernstig |
79 |
Bij milde AA: OR (95%BI), 2,35 (0,76-7,21), p=0,14 |
Laag |
|
Topicale corticosteroïden vs. placebo Gupta, 2019-2 |
Mild – ernstig |
134 |
Bij milde AA: OR (95%BI), 6,17 (1,19-32,10), p=0,03 |
Laag |
|
Topicale minoxidil vs. placebo Gupta 2019-2 |
Mild – ernstig |
80 |
Bij milde AA: OR (95%BI), 6,40 (0,09-468,65), p=0,40 |
Laag |
|
Topicale minoxidil vs. latanoprost Gupta 2019-2 |
Mild |
40 |
OR (95%BI), 0,29 (0,08-1,06), p=0,06) |
Zeer laag |
|
Bimatoprost vs. topicale corticosteroïnden |
Mild |
60 |
OR (95%BI), 3,82 (1,15-12,71), p=0,03 |
Laag |
|
Latanoprost vs. placebo |
Mild |
40 |
OR (95%BI), 18,38 (0,96-352,57), p=0,05 |
Laag |
|
Latanoprost vs. betamethason (topicaal) |
Mild |
50 |
De mate van hergroei van haar na 16 weken was lager in de latanoprost groep dan in de betamethason groep (median 11,1, IQR 0-99,1 en 100, IQR 13,6-100, p=0,02). Significant minder patiënten in de latanoprost groep hadden een complete respons ten opzichte van de betamethason groep (6 (24%) vs. 14 (56%), p=0,02). |
Zeer laag |
|
DPCP (D) vs. DPCP + ditranol (D/A) |
Mild – ernstig |
50 |
Complete hergroei van haar werd gezien bij 3 patiënten van elke groep (18,75% in de D groep, 15,79% in de D/A groep). In 25% en 31% van groep D en 21% en 47% in groep D/A hadden respectievelijk >75% en >50% hergroei van haar (p=0,696). |
Laag |
|
Calcipotriol 0,005% vs. clobetasol 0,05% |
Mild |
35 |
Na 24 weken werd er complete hergroei van haar geobserveerd bij 69% van de patiënten in de calcipotriol groep en 63% in de clobetasol groep. |
Zeer laag |
|
Combinatietherapie met mometason 0.01% crème + calcipotriol 0.005% zalf vs mometason 0.01% crème monotherapie |
Mild |
100 |
Aan het einde van de 24 weken was de gemiddelde SALT score respectievelijk 4,24 en 3,39 percentagepunten gedaald (p<0,001). |
Laag |
|
Plaatsjesrijk plasma intralesionaal (single- en double-spin) vs. triamcinolonacetonide intralesionaal 5-10 mg/ml (3-5 sessies met een interval van 2-4 weken) |
Mild |
102 |
Voor de meta-analyse werd gebruik gemaakt van de data over de effectiviteit na 12 weken. De gepoolde mean differences laten geen significant verschil zien in de SALT score gerapporteerd in de TCA en PRP groepen (MD= -2,04, 95%BI -4,72-0,65, I2=80%, p=0,14). |
Redelijk |
|
Triamcinolonacetonide intralesionaal 3.33 mg/ml of 5 mg/ml of 10 mg/ml 0.1ml per cm2, maximaal 3ml (elke 4 weken, max 6 maanden) vs placebo |
Mild |
83 |
Algemeen gezien was het percentage AA plekken waar hergroei van haar werd gezien op 6 maanden significant lager in de placebo groep (0%) dan in de TCA 10mg/ml (97.1%) en TCA 5mg/ml (87.9%) groepen (p<0.01). En niet in de TCA 3.33mg/ml groep (56.3%) |
Redelijk |
|
Triamcinolonacetonide intralesionaal 2.5 mg/ml of 5 mg/ml of 10 mg/ml 0.1ml per cm2 (elke 4 weken, voor 3 maanden) vs. placebo |
Mild |
105 |
Op week 12 vertoonden meer dan 50% van de scalp kwadranten een RGS score van 3 of 4 in de 10 mg/ml (66,9%), 5 mg/ml (57,9%) en 2,5 mg/ml (53,7%) groep behalve in de placebo groep (38,8%). De interventiegroepen lieten een positief significant effect zien op de duur van de behandeling ten opzichte van placebo (p<0.001) waarbij de interventiegroep voor een kortere duur behandeld hoefde te worden. De interventiegroepen zijn hier onderling niet op vergeleken. |
Redelijk |
|
Triamcinolonacetonide intralesionaal 10mg/ml (elke 3 weken voor 12 weken) vs. betamethason (lokaal, 2dd voor 12 weken) vs. tacrolimus 0,1% (2dd voor 12 weken) |
Onduidelijk |
105 |
78 patiënten werden uiteindelijk meegenomen in de analyse. Een eerste therapeutische respons werd gezien in de TCA groep op 3 weken (HRG I, p<0,005). >75% hergroei van haar werd na 12 weken gezien in de betamethason en de TCA groep, respectievelijk in 12 (42,9%) en 16 (60%) patiënten. In de tacrolimus groep werd na 12 weken geen hergroei van >75% waargenomen (p<0,0000079). |
Zeer laag |
|
Combinatietherapie van methotrexaat + betamethason pulse-therapie vs. methotrexaat vs. betamethason pulse-therapie |
Ernstig |
36 |
Op 9 maanden was de verbetering van de betamethason pulse-therapie groep 26% (SALT), 3 punten op de VAS score en 1 punt op het fotografische score systeem. In de betamethason en combinatie therapie groepen werd een significante grotere verbetering van de SALT score gezien ten opzichte van de methotrexaat groep. (respectievelijk p=0.006, p<0.001). |
Laag |
|
Dupilumab vs. placebo |
Mild – ernstig |
60 |
Op week 24 was het least-squares mean verschil in SALT score -6.3 (95% BI, -14.6 - 1.8) in de placebo groep en in de dupilumab groep was dit 2.3 (95% BI, -3.5 - 8.2) (p<0.05). Op 24 weken werd dus een betere uitkomst gezien in de dupilumab groep. Echter werd dit verschil vooral veroorzaakt door de verslechtering die gezien werd in de placebo groep en werd er in de dupilumab groep stabilisatie gezien van het ziektebeeld. |
Laag |
|
Wekelijkse azathioprine pulse (WAP) therapie (300mg 1dd voor 2 opvolgende dagen per week voor 5 maanden) vs. betamethason orale pulse-therapie (5mg 1dd voor 2 opvolgende dagen per week voor 5 maanden |
Mild – ernstig |
50 |
Na 4 maanden was het mediane percentage van scalp hergroei van haar en het mediane verschil in SALT score 44.52 en 9.5 (IQR 0-13.5, p=0.009) in de WAP groep en 71.43 en 14 (IQR 4-19, p=0.001) in de betamethason groep. De toename in de hergroei van haar toonde geen significant verschil tussen beide groepen. |
Laag |
|
Ciclosporine (4mg/kg/dag voor 3 maanden) vs. placebo |
Mild – ernstig |
36 |
In de ciclosporine groep trad bij 31.3% van de patiënten ten minste 50% vermindering in de SALT score op ten opzichte van 6.3% in de placebo groep (p=0,07). |
Laag |
|
Triamcinolonacetonide intramusculair vs. prednisolon pulse-therapie vs. dexamethason |
Mild – ernstig |
89 |
Respons (patiënten met >40% hergroei van haar) op 12 maanden werd gezien in 32/43 patiënten in de TCA i.m. groep (74%), 19/29 patiënten in de prednisolon groep (66%) en 7/19 in de dexamethason groep (37%). De totale respons was statistisch significant hoger in de TCA i.m. groep dan de dexamethason groep (p<0.02). Echter in de TCA i.m. groep zaten in verhouding ook meer patiënten met AA multiplex. Relapse (nieuwe of uitbreidende kale plekken) binnen 6 maanden na het staken van de therapie werd gezien in 33% in de prednisolon groep, 46% in de TCA i.m. groep en in 75% in de dexamethason groep. Alleen tussen de prednisolon en de dexamethason groep was dit verschil statistisch significant (p<0.02). |
Laag |
|
Baricitinib 2 mg of 4 mg vs. placebo |
Ernstig |
1200 |
Het percentage patiënten dat na 36 weken een SALT-score had van ≤20% waren in de BRAVE-AA1 en BRAVE-AA2 respectievelijk 38,8% en 35,9% in de 4 mg baricitinib groep, 22,8% en 19.4% in de 2 mg baricitinib groep en 6,2% en 3,3% in de placebo groep. Het verschil in aantal percentage punten tussen de 4 mg baricitinib groep en de placebogroep was 32,6 in de BRAVE-AA1 studie (95% BI 25,6 – 39,5; p<0,001) en tussen 2 mg baricinitib en placebo 16,6 (95% BI 9,5 – 23,8; p<0,001). In de BRAVE-AA2 studie was dit respectievelijk 32,6 percentage punten (95% BI 25,6-39,6; p<0,001) en 16,1 (95% BI 9,1-23,2; p<0,001). |
Hoog |
|
Ritlecitinib vs. placebo |
Ernstig |
718 in de fase 2b-3 trial beschreven door King 2023 |
Na 24 weken werd een SALT-score van ≤20 gerapporteerd bij 38 (31%) van de 124 patiënten in de ritlecitinib 200 mg + 50 mg groep, 27 (22%) van de 121 patiënten in de 200 mg + 30 mg groep, 29 (23%) van de 124 patiënten in de 50 mg groep, 17 (14%) van de 119 patiënten in de 30 mg groep, en twee (2%) van de 130 patiënten in de placebogroep. Het verschil in responspercentage op basis van een SALT-score ≤20 tussen de placebo en de ritlecitinib 200 mg + 50 mg groep was 29,1% (95% BI 21,2–37,9; p<0,0001), 20,8% (13,7–29,2; p<0,0001) voor de 200 mg + 30 mg groep, 21,9% (14,7–30,2; p<0,0001) voor de 50 mg groep, en 12,8% (6,7–20,4; p=0,0002) voor de 30 mg groep. Het SALT-responspercentage ≤20 nam verder toe tot 43% na 48 weken bij patiënten in de ritlecitinib 50 mg groep.
13,4% van de patiënten bereikte een SALT-respons ≤10 met 50 mg ritlecitinib vergeleken met 1,5% bij placebo na 24 weken. Het SALT-responspercentage ≤10 voor 50 mg ritlecitinib nam verder toe tot 31% na 48 weken. |
Hoog |
Een uitgebreide systematische review (Gupta 2019-2) met netwerk meta-analyse werd gebruikt als basis voor de beschikbare data over lokale therapieën. Enkele losse artikelen die hierin niet geïncludeerd werden, maar wel uit de zoekresultaten kwamen, zijn hieronder ook opgenomen.
De systematic review met meta-analyse van Gupta et al. (2019-2) onderzocht de effectiviteit van meerdere lokale en intralesionale monotherapieën. De geïncludeerde literatuur naar intralesionale therapieën is beperkt, daarom is er voor gekozen om deze literatuur inclusief een update van de beschikbare literatuur buiten deze review te bespreken. Noemenswaardig is echter de overkoepelende uitkomst uit de netwerk meta-analyse (met betrekking tot onze PICO); voor milde ziekte bleek therapie middels intralesionale corticosteroïden de hoogste respons te kunnen geven op basis van de SUCRA (78,9%), gevolgd door topicale steroïden (67,9%), prostaglandine analogen (67,1%), en DPCP (63,4%). Voor matig tot ernstige ziekte bleek therapie middels DPCP de hoogste respons te kunnen geven (87,9%), gevolgd door topicale minoxidil (55,5%) en topicale corticosteroïden (50,1%). Hieronder is de tabel weergegeven voor deze resultaten. Gezien er veel indirecte vergelijkingen zijn gebruikt voor de netwerk meta-analyse en er maar een beperkt aantal studies (met tevens een beperkte omvang) zijn geïncludeerd, moeten deze resultaten zeer voorzichtig geïnterpreteerd worden.
28 (mild: 11, matig-ernstig: 17) van de geïncludeerde studies komen overeen met de door de werkgroep opgestelde PICO met betrekking tot lokale therapie. Voldoende effectiviteit werd beschouwd als >75% hergroei van haar. Onderstaand is een overzicht weergegeven van alle vergelijkingen inclusief uitkomsten van de meta-analyse.
Tabel Lokale therapie bij matige tot ernstige AA uitkomsten meta-analyse van Gupta et al. (2019-2)
|
Vergelijking |
Odds ratio (95%BI), p-waarde |
Aantal patiënten |
|
Topicale minoxidil vs. placebo |
14,69 (2,21-97,78), p<0,001 |
195 |
|
Topicale corticosteroïnden vs. placebo |
8,13 (1,62-40,83), p=0,01 |
232 |
|
DPCP vs. placebo |
48,36 (20,93-111,76), p<0,001 |
885 |
Tabel Lokale therapie bij milde AA uitkomsten meta-analyse van Gupta et al. (2019-2)
|
Vergelijking |
Odds ratio (95%BI), p-waarde |
Aantal patiënten |
|
Topicale minoxidil vs placebo |
6,40 (0,09-468,65), p=0,40 |
80 |
|
Topicale corticosteroïden vs. placebo |
6,17 (1,19-32,10), p=0,03 |
134 |
|
DPCP vs. placebo |
2,35 (0,76-7,21), p=0,14 |
79 |
|
Bimatoprost vs. topicale corticosteroïden |
3,82 (1,15-12,71), p=0,03 |
60 |
|
Latanoprost vs. placebo |
18,38 (0,96-352,57), p=0,05 |
40 |
|
Latanoprost vs. topicale minoxidil |
0,29 (0,08-1,06), p=0,06) |
40 |
De onderzoekers hebben ook een analyse gemaakt om de verschillende therapieën te rangschikken. Hieronder zijn de resultaten weergegeven. Van belang om hierbij op te merken is dat niet alle studies geschikt waren voor de analyse en alleen de therapieën die zijn weergegeven, zijn ook daadwerkelijk geanalyseerd. De SUCRA (surface under the curve) is een analyse die de interpretatie van een meta-analyse beter inzichtelijk maakt. Met het cijfer wordt de positie in de rangschikking bepaald. Hoe hoger het cijfer, des te waarschijnlijker dat de behandeling in de top van de rangorde hoort. De PrRank (probability of a treatment to ranking first) toont de waarschijnlijkheid. Gezien er in deze meta-analyse sprake is van veel indirecte vergelijkingen, moeten dit soort resultaten altijd met voorzichtigheid geïnterpreteerd worden. Het is echter wel de eerste studie die op deze manier de clinicus meer handvatten probeert aan te reiken.
Tabel Rangschikking van verschillende lokale therapieën voor AA uit Gupta et al. (2019-2)
|
Treatment |
SUCRA1 |
PrRank12 |
Mean Rank |
|
Matige tot ernstige AA |
|||
|
DPCP |
87.9 |
50.4 |
1.8 |
|
Laser |
77.9 |
26.9 |
2.6 |
|
Topicale minoxidil |
55.5 |
4.8 |
4.1 |
|
Topicale corticosteroïden |
50.1 |
11.0 |
3.4 |
|
SADBE |
49.7 |
1.9 |
4.5 |
|
Topicale tofacitinib |
47.6 |
5.0 |
4.7 |
|
Placebo |
16.2 |
0.00 |
6.9 |
|
Milde AA |
|||
|
Intralesionale corticosteroïden |
78.9 |
36.2 |
2.5 |
|
Topicale corticosteroïden |
67.9 |
24.6 |
3.8 |
|
Prostaglandine analogen |
67.1 |
21.9 |
3.3 |
|
DPCP |
63.4 |
22.0 |
3.6 |
|
Topicale minoxidil |
61.2 |
11.1 |
3.7 |
|
SADBE |
35.0 |
3.9 |
5.5 |
|
Calcineurineremmers |
12.3 |
0.6 |
7.1 |
|
Placebo |
21.7 |
0.00 |
6.5 |
- SUCRA: surface under the curve
- PrRank1: probability of a treatment to ranking first
DPCP monotherapie vs. DPCP en ditranol (bij mild tot matig-ernstige AA)
DPCP als monotherapie (D groep) en in combinatie met ditranol (D/A groep) werd onderzocht in de studie van Ghandi et al. (2021) in 50 patiënten met een SALT ≥25. In de studie zaten zowel kinderen als volwassenen (<10 jaar: 6, 11-30 jaar: 24, >31 jaar: 13). Na zes maanden werd de effectiviteit van de therapie en de bijwerkingen beoordeeld. Complete hergroei van haar werd gezien bij 3 patiënten van elke groep (18,75% in de D groep, 15,79% in de D/A groep). In 25% en 31% van groep D en 21% en 47% in groep D/A hadden respectievelijk >75% en >50% hergroei van haar (p=0,696).
Calcipotriol 0,005% vs. clobetasol 0,05% (milde tot matige AA)
Behandeling middels calcipotriol 0,005% 2dd voor 12 weken en clobetasol 0,05% 2dd voor 12 weken werd onderzocht in de studie van Molinelli et al. (2020) in 35 volwassen patiënten met mild tot matige AA (10-75% haarverlies volgens AGS schaal). Beide therapieën werden voor 12 weken toegepast bij de patiënten middels een intrasubject half head design op de kale plekken. Na 12 weken werd er middels de AGS schaal (2=11-25% (n=12). 3=26-50% (n=12) en 4=51-75% (n=11)) de effectiviteit beoordeeld. Van week 13 tot week 24 hadden patiënten de keuze om de huidige behandeling door te zetten, alle patiënten kozen hiervoor. Kale plekken reageerden beter en sneller op behandeling middels calcipotriol, maar er werd geen statistisch significant verschil aangetoond. Na 24 weken werd er complete hergroei van haar geobserveerd bij 69% van de patiënten in de calcipotriol groep en 63% in de clobetasol groep. Teleangiectasieën en jeuk werden gemeld bij de behandeling met clobetasol bij 3 patiënten en bij 2 patiënten in de calcipotriol groep was er sprake van erytheem en jeuk. Na 12 maanden follow-up werd er bij 3 plekken die middel calcipotriol en bij 7 plekken die met clobetasol behandeld werden relaps gezien van de ziekte.
Latanoprost vs. betamethason (milde AA)
Behandeling middels latanoprost 2dd voor 16 weken en betamethason 2dd voor 16 weken werd onderzocht in de studie van Bhat et al. (2019) in 50 patiënten met AA waarbij er sprake was van <40% haarverlies. Elke 4 weken tot het eind van de studie werd de effectiviteit beoordeeld middels de RSG schaal. De mate van hergroei van haar na 16 weken was lager in de latanoprost groep dan in de betamethason groep (median 11,1, IQR 0-99,1 en 100, IQR 13,6-100, p=0,02). Significant minder patiënten in de latanoprost groep hadden een complete respons ten opzichte van de betamethason groep (6 (24%) vs. 14 (56%), p=0,02).
Mometason 0.1% + calcipotriol 0.005% vs. mometason 0,1% monotherapie (bij milde AA)
Behandeling middels mometason 0,1% crème met calcipotriol 0,005% zalf (1dd voor 24 weken) en mometason monotherapie (1dd voor 24 weken) werd onderzocht in de studie van Alam et al. (2019) in 100 patiënten met ≤40% haarverlies van de scalp. De gemiddelde SALT scores voor het starten van de therapie waren 7,22% in de combinatietherapiegroep en 6,05 in de monotherapiegroep (p=0,145). Aan het einde van de 24 weken was de gemiddelde SALT score respectievelijk 4,24 en 3,39 percentagepunten gedaald (p<0,001).
Triamcinolonacetonide intralesionaal (bij milde AA)
Triamcinolonacetonide werd in verschillende doseringen en vergelijkingen beschreven in 4 artikelen, Ustuner et al. (2017), Rajan et al. (2021), Kuldeep et al. (2011) en Gupta et al. (2019-2).
Triamcinolonacetonide intralesionaal (40mg/ml verdund in 1/4, 1/8 of 1/12, respectievelijk 10mg/ml, 5mg/ml of 3.33mg/ml, in 0.1ml per cm2 met een maximum van 3ml, elke 4 weken voor 6 maanden of tot voldoende mate van haargroei was bereikt) in vergelijking tot placebo (saline) werd onderzocht in de studie van Ustuner et al. (2017) in 83 patiënten >16 jaar met milde alopecia areata. De effectiviteit werd gemeten middels een 5-punts score systeem (RGS). De punten werden als volgt toegekend: 0 als de hergroei van haar <10% was, 1 bij 11-25%, 2 bij 26-50%, 3 bij 51-75% en 4 bij >75%. Een succesvolle behandeling werd gedefinieerd als 4 punten (>75% hergroei van haar). De kale plekken van de patiënten werden allemaal los meegenomen in de analyse (231). Na 2 sessies werd er bij 26 plekken geen respons gezien en werd de therapie gestaakt. De resterende 205 plekken waren ≥3 sessies behandeld: 24 plekken voor 3 sessies, 40 plekken voor 4 sessies, 29 plekken voor 5 sessies en 112 plekken voor 6 sessies. In de placebo groep was 6 het gemiddelde aantal sessies (SD: 0) en in de TCA 10mg/ml, 5mg/ml en 3.33mg/ml respectievelijk 3,74 (SD: 0.99), 4,91 (SD: 1.10) en 5.66 (SD 0.04). Deze uitkomsten waren statistisch significant verschillend (p<0.01). Het percentage AA plekken in de placebo groep dat een RGS score van 4 behaalde op 6 maanden (0%) was statistisch significant lager dan in de TCA 10mg/ml (85.7%) en TCA 5mg/ml (69.2%) groepen (p<0.01). Er werd geen statistisch significant verschil gezien in de TCA 3.33mg/ml groep (17.6%). Algemeen gezien was het percentage AA plekken waar hergroei van haar werd gezien op 6 maanden significant lager in de placebo groep (0%) dan in de TCA 10mg/ml (97.1%) en TCA 5mg/ml (87.9%) groepen (p<0.01) en niet in de TCA 3.33mg/ml groep (56.3%). Atrofie van de huid werd gezien in 6 plekken van de TCA 10mg/ml groep na 3 en 6 maanden, teleangiëctasieën werden gezien in 6 plekken van de TCA 10mg/ml groep na 3 en 6 maanden.
Triamcinolonacetonide intralaesionaal (10mg/ml, 5mg/ml of 2.5mg/ml, in 0.1ml per cm2, elke 4 weken voor 3 maanden) in vergelijking tot placebo (saline) werd onderzocht in de studie van Rajan et al. (2021) in 105 patiënten >12 jaar met milde alopecia areata. De effectiviteit werd gemeten middels een 5-punts score systeem (RGS). De punten werden als volgt toegekend: 0 als de hergroei van haar <10% was, 1 bij 11-25%, 2 bij 26-50%, 3 bij 51-75% en 4 bij >75%. Van de 105 patiënten werden in totaal 168 AA plekken behandeld. 75 patiënten en in totaal 121 AA plekken werden geanalyseerd aan het einde van de follow up op week 12. Op week 12 vertoonden meer dan 50% van de scalp kwadranten een RGS score van 3 of 4 in de 10 mg/ml (66,9%), 5 mg/ml (57,9%) en 2,5 mg/ml (53,7%) groep behalve in de placebo groep (38,8%). De interventiegroepen lieten een positief significant effect zien op de duur van de behandeling ten opzichte van placebo (p<0.001) waarbij de interventiegroep voor een kortere duur behandeld hoefde te worden. De interventiegroepen zijn hier onderling niet op vergeleken. Op week 12 werd in 33.1% van de kwadranten in de 10mg/ml, 23.4% in de 5mg/ml en 17.7% in de 2.5mg/ml groep atrofie gezien in vergelijking met 1.6% in de placebo groep. Op week 12 werd in 4.8% van de kwadranten in de 10mg/ml, 2.4% in de 5mg/ml en 1.6% in de 2.5mg/ml groep teleangiëctasieën gezien in vergelijking met 2.4% in de placebo groep.
Triamcinolonacetonide intralaesionaal (TCA) (10mg/ml elke 3 weken voor 12 weken) in vergelijking tot tacrolimus zalf (0,1% 2dd voor 12 weken) of betamethason valeraat foam (0,1% 2dd voor 12 weken) werd onderzocht in de studie van Kuldeep et al. (2011) in 105 patiënten van 10-50 jaar met elke vorm alopecia areata. De effectiviteit werd gemeten middels de HRG schaal (Hair Re-growth Grade). De schaal wordt als volgt opgedeeld: I (0-25%), II (26-50%), III (51-75%) en IV (76-100%). 78 patiënten werden uiteindelijk meegenomen in de analyse. Een eerste therapeutische respons werd gezien in de TCA groep op 3 weken (HRG I, p<0,005). >75% hergroei van haar werd na 12 weken gezien in de betamethason en de TCA groep, respectievelijk in 12 (42,9%) en 16 (60%) patiënten. In de tacrolimus groep werd na 12 weken geen hergroei van >75% waargenomen (p<0,0000079). In de TCA groep werd lokale pijn en atrofie gemeld bij 6 patiënten, jeuk bij 2 en branderigheid bij 3 patiënten. In de betamethason en tacrolimus groep werd in beide gevallen bij 3 patiënten lokale jeuk gemeld. In geen van de gevallen zijn serious adverse events gerapporteerd.
Devi et al. (2015) is niet geïncludeerd in onze literatuuranalyse, omdat er geen full tekst beschikbaar was. Gupta et al. (2019-2) heeft echter een meta-analyse gemaakt van deze studie en de studie van Kuldeep et al. (2011) naar de vergelijking van TCA en betamethason met een OR van 3.07 (95% BI 1,86-5,06).
Plaatjesrijkplasma vs. triamcinolonacetonide intralesionaal vs. placebo
Plaatjesrijkplasma (PRP) werd vergeleken met triamcinolonacetonide en placebo in de systematic review met meta-analyse door Meznerics et al. (2022). In deze studie werden 6 RCT’s geïncludeerd waarvan er 4 werden gebruikt voor de meta-analyse. 2 studies werden daarvan geëxcludeerd, omdat er niet voldoende data beschikbaar was. In de studies werden alleen volwassen patiënten met AA geïncludeerd, waarvan de ernst van de AA niet verder wordt beschreven. De effectiviteit van de behandelingen werd gemeten middels de SALT score. Hieronder zijn twee tabellen opgenomen waarin de karakterstieken van de studies en de patiëntpopulaties worden samengevat.
Tabel Karakteristieken van de geïncludeerde studies door Meznerics et al. (2022)
Tabel Patiënt karakteristieken van de geïncludeerde studies in de meta-analyse door Meznerics et al. (2022)
Voor de meta-analyse werd gebruik gemaakt van de data over de effectiviteit na 12 weken. De gepoolde mean differences laten geen significant verschil zien in de SALT score gerapporteerd in de TCA en PRP groepen (MD= -2,04, 95%BI -4,72-0,65, I2=80%, p=0,14).
Alle geïncludeerde studies lieten een significante vermindering in de SALT score zien in de PRP en de TCA groepen.
Balakrishnan et al. (2020), Hegde et al. (2020), and Trink et al. (2013) rapporteerden dat er geen bijwerkingen werden gezien tijdens de behandeling. Albalat et al. (2019) rapporteerden dat er in beide behandelgroepen erytheem en branderigheid werd gemeld. Kapoor et al. (2020) rapporteerden dat 5 patiënten in de TCA groep lokale atrofie hadden. Pijn gerelateerd aan de toediening van PRP werd in 3 studies gemeld (Balakrishnan, 2020, Hegde, 2020, Kapoor, 2020)
1 studie rapporteerde na 12 maanden een relaps percentage van 71% in de TCA groep en 31% in de PRP groep (Trink, 2013). Een andere studie rapporteerde na 6 maanden een relaps percentage van 25% in de TCA groep en 5% in de PRP groep (Albalat, 2019).
Er is geen meta-analyse gedaan van de vergelijking tussen TCA en placebo. Trink et al. (2013) en Hedge et al. (2020) toonden aan dat PRP een significante verbetering in de SALT score geeft ten opzichte van placebo (respectievelijk p<0,001, p=0,0108)
Baricitinib (bij ernstige AA)
Baricitnib 2 mg, 4mg en placebo werden onderzocht in de studie van King et al. (2022) in 1200 patiënten met ernstige AA in de leeftijdscategorie 18-70 jaar voor vrouwen en 18-60 jaar voor mannen. 53.2% van de gehele populatie had zeer ernstige AA met een SALT score van 95-100%. De hergroei van haar werd gemeten volgens de SALT score op 36 weken en 52 weken. Het percentage patiënten dat na 36 weken een SALT-score had van ≤20% waren in de BRAVE-AA1 en BRAVE-AA2 respectievelijk 38,8% en 35,9% in de 4 mg baricitinib groep, 22,8% en 19.4% in de 2 mg baricitinib groep en 6,2% en 3,3% in de placebo groep. Het verschil in aantal percentage punten tussen de 4 mg baricitinib groep en de placebogroep was 32,6 in de BRAVE-AA1 studie (95% BI 25,6 - 39,5; p<0,001) en tussen 2 mg baricinitib en placebo 16,6 (95% BI 9,5 - 23,8; p<0,001). In de BRAVE-AA2 studie was dit respectievelijk 32,6 percentage punten (95% BI 25,6-39,6; p<0,001) en 16,1 (95% BI 9,1-23,2; p<0,001).
Het voortzetten van de behandeling na 36 weken tot en met 52 weken werd beschreven in de studie van Kwon et al. (2023). De voortzetting van de behandeling resulteerde in een verdere toename van het aantal patiënten die hergroei van haar kregen op schedel, wimpers en wenkbrauwen. Het percentage met baricitinib behandelde patiënten dat een SALT score ≤20 bereikte, bleef doorstijgen tot 39,0% in de 4 mg groep en tot 22,6% in de 2 mg groep.In de baricitinib 4 mg en 2 mg groepen steeg het aantal patiënten dat een SALT score van ≤10% bereikte, respectievelijk 29.9% en 14.1% in BRAVE-AA1 en 27.8% en 16.7%
in BRAVE-AA2. Het percentage met baricitinib behandelde patiënten die een ClinRO Measure for Eyebrow en Eylash Hair Loss-score van 0 of 1 bereikte nam toe in zowel de 4 mg als de 2 mg groep.
Het bijwerkingsprofiel was over het algemeen mild-matig. Acne en een verhoogde creatinekinase en cholesterol werden vaker gezien in de baricitinib groep in vergelijking met de placebo groep.
Ritlecitinib (bij ernstige AA)
Onderstaande studies naar de effectiviteit van ritlecitinib zijn geïncludeerd naar aanleiding van de plaatsbepaling door de NVDV voor de beoordeling van het vergoedingsdossier door het Zorginstituut Nederland. De NVDV Commissie Dure Geneesmiddelen heeft verzocht dit geneesmiddel mee te nemen in de huidige herziening van de richtlijn AA. Gezien de systematische zoekactie voor dit geneesmiddel bij AA, is er ook een GRADE analyse verricht.
Fase 2a trial (King 2021, Winnette 2022)
De effectiviteit van ritlecitinib (200mg 1dd voor 4 weken gevolgd door 50mg 1dd voor 20 weken) in vergelijking tot placebo werd onderzocht in de studie van King et al. (2021) en Winnette et al. (2022) bij 95 volwassen patiënten met ernstige AA. De mate van hergroei van haar werd gescoord middels SALT (Severity of Alopecia Tool) en IGA (Investigator Global Assessment), de patiënttevredenheid met AASIS (Alopecia Areata Symptom Impact Scale) en er werd gekeken naar de veiligheid. De mate van hergroei van haar werd gemeten na 24 weken. Na 24 weken was het least-squares mean verschil in de SALT-score vanaf het begin van de therapie ten opzichte van placebo (least-squares means placebo: 1,4) 31,1 (95% BI,18,8-4,5) voor ritlecitinib. Na 24 weken werden een verbetering van 30% in de SALT score gezien in 50% van de patiënten in de ritlecitinib groep (90% BI, 38%-62%) en in 2% van de patiënten die in de placebo groep zaten (90% BI, 0%-9%). 90% verbetering in de SALT-score op 24 weken werd gezien in 25% van de patiënten in de ritlecitinib groep (90% CI, 15%-37%) en in 0% van de patiënten in de placebo groep (90% BI, 0%-6%). Voor de start van de therapie was er bij elke patiënt sprake van een IGA-score van 0 (geen verschil of geen toename haarverlies). Na 24 weken was de verhouding van patiënten met een IGA score van 0, 13/44 (30%) in de ritlecitinib groep en 27/35 (77%) in de placebo groep. Ongewenste effecten werden gerapporteerd in 35/47 (74%) in de riltecitinib groep en in 36/47 (77%) in de placebo groep. Bij drie patiënten (6%) in de ritlecitinib groep en bij vier patiënten (9%) in de placebo groep leidde dit tot het vroegtijdig staken van de therapie.
In de ritlecitinib groep werden statistisch significante verbeteringen gezien in de mean AASIS-scores voor de items in de haaruitval subonderdelen, ‘jeukende of pijnlijke huid’, ‘geïrriteerde huid’ en het item 'seksuele relaties'. Ook op alle andere items liet de ritlecitinib groep verbetering zien, maar deze verschillen waren niet statistisch significant.
De vaakst gerapporteerde bijwerkingen waren bovenste luchtweginfecties, nasopharyngitis, hoofdpijn, acne en misselijkheid. Er werden geen opportunistische infecties gerapporteerd. In beide groepen waren geen klinisch relevante verschillen vanaf de start van de therapie in hematologische laboratorium waarden, ECG’s of vitale parameters.
Fase 2b-3 trial (King 2023)
In de dubbel geblindeerde placebogecontroleerde RCT (AA-1) door King et al. (2023) werd de effectiviteit, dosisrespons en veiligheid van ritlecitinib onderzocht bij patiënten met alopecia areata van 12 jaar en ouder met ≥50% haaruitval van de scalp, waaronder alopecia totalis en alopecia universalis. Bij de geïncludeerde patiënten was er geen sprake van hergroei van terminaal haar in de voorgaande 6 maanden, het aantal jaar sinds de diagnose was ≤10 jaar en er was geen andere oorzaak van het haaruitval bekend.
Het onderzoek bestond uit een placebogecontroleerde, 24 weken durende periode en een 24 weken durende vervolgperiode. In totaal werden 718 patiënten geïncludeerd en gerandomiseerd naar een van de volgende behandelingsschema’s gedurende 48 weken:
1. 1dd 200 mg gedurende 4 weken, gevolgd door 1dd 50 mg gedurende 44 weken
2. 1dd 200 mg gedurende 4 weken, gevolgd door 1dd30 mg gedurende 44 weken
3. 1dd 50 mg gedurende 48 weken
4. 1dd 30 mg gedurende 48 weken
5. 1dd 10 mg gedurende 48 weken
6. placebo gedurende 24 weken, gevolgd door 1dd 200 mg gedurende 4 weken en 1dd 50 mg gedurende 20 weken
7. placebo gedurende 24 weken, gevolgd door 1dd 50 mg gedurende 24 weken.
In dit onderzoek werd als primaire uitkomstmaat gekeken naar het aantal proefpersonen dat een SALT-score van ≤10 (90% of meer bedekking met haar op de hoofdhuid) bereikte na 24 weken. Daarnaast werd in dit onderzoek als belangrijke secundaire uitkomst de Patient’s Global Impression of Change (PGI-C)-respons na 24 weken beoordeeld en werden als secundaire uitkomsten een SALT-score van ≤20 (80% of meer bedekking met haar op de hoofdhuid) na 24 weken en verbeteringen in hergroei van wenkbrauwhaar (EBA respons) en/of wimpers (ELA respons) na 24 weken beoordeeld.
In totaal werden er 105 (14,6%) patiënten van 12 tot 18 jaar, 593 (82,6%) patiënten van 18 tot 65 jaar en 20 (2,8%) patiënten van 65 jaar en ouder geïncludeerd. De gemiddelde (SD) SALT-score bij baseline varieerde in de behandelingsgroepen van 88,3 (16,87) tot 93,0 (11,50); onder de patiënten zonder alopecia totalis/alopecia universalis bij baseline varieerde de gemiddelde SALT score van 78,3 tot 87,0. In de behandelingsgroepen hadden respectievelijk 83,0% en 74,7% van de patiënten (deels) uitval van de wenkbrauwen of de wimpers. De gemiddelde duur sinds de diagnose van AA was 6,9 jaar en de gemiddelde duur van de huidige episode van AA was 2,5 jaar.
Na 24 weken werd een SALT-score van ≤20 gerapporteerd bij 38 (31%) van de 124 patiënten in de ritlecitinib 200 mg + 50 mg groep, 27 (22%) van de 121 patiënten in de 200 mg + 30 mg groep, 29 (23%) van de 124 patiënten in de 50 mg groep, 17 (14%) van de 119 patiënten in de 30 mg groep, en twee (2%) van de 130 patiënten in de placebogroep.
Het verschil in responspercentage op basis van een SALT-score ≤20 tussen de placebo en de ritlecitinib 200 mg + 50 mg groep was 29,1% (95% BI 21,2–37,9; p<0,0001), 20,8% (13,7–29,2; p<0,0001) voor de 200 mg + 30 mg groep, 21,9% (14,7–30,2; p<0,0001) voor de 50 mg groep, en 12,8% (6,7–20,4; p=0,0002) voor de 30 mg groep.
Het SALT-responspercentage ≤20 nam verder toe tot 43% na 48 weken bij patiënten in de ritlecitinib 50 mg groep.
13,4% van de patiënten bereikte een SALT-respons ≤10 met 50 mg ritlecitinib vergeleken met 1,5% bij placebo na 24 weken. Het SALT-responspercentage ≤10 voor 50 mg ritlecitinib nam verder toe tot 31% na 48 weken.
49,2% van de patiënten bereikte een PGI-C respons met 50 mg ritlecitinib vergeleken met 9,2% bij placebo na 24 weken.
Bij respectievelijk 29,0% en 28,9% van de patiënten werd verbetering gezien in de hergroei van wenkbrauwen en/of wimpers werden na 24 weken met 50 mg ritlecitinib groep ten opzichte van 4,7% en 5,2% in de placebogroep. De verbeteringen namen verder toe tot 29% na 48 weken voor beide uitkomstmaten in de ritlecitinib 50 mg groep.
Tot aan week 48 en inclusief de follow-up periode waren bijwerkingen gemeld bij 108 (82%) van de 131 patiënten in de ritlecitinib 200 mg + 50 mg groep, 105 (81%) van de 129 patiënten in de 200 mg + 30 mg groep, 110 (85%) van de 130 patiënten in de 50 mg groep, 106 (80%) van 132 patiënten in de 30 mg groep, 47 (76%) van 62 patiënten in de 10 mg groep, 54 (83%) van 65 patiënten in de placebo gevolgd door ritlecitinib 200 mg + 50 mg groep in de verlengingsperiode, en 57 (86%) van de 66 patiënten in de placebo gevolgd door ritlecitinib 50 mg groep.
Bijwerkingen die bij ≥10% van de patiënten werden gemeld waren bovenste luchtweginfecties, nasopharyngitis, misselijkheid, acne en hoofdpijn. De incidentie van de bijwerkingen die gezien werden waren vergelijkbaar tussen de groepen, behalve voor influenza, bovenste luchtweginfectie en urineweginfectie die vaker werden gezien in de ritlecitinib 200 mg + 50 mg groep.
16 serious adverse events werden gerapporteerd bij 14 patiënten (4 in de ritlecitinib 200 mg + 50mg, 2 in de 200 + 300 mg, 2 in de 50 mg, 1 in de 30 mg, 2 in de 10 mg groep en 3 in de placebogroep), waarvan 8 herpes zoster infecties (5 in de 50 mg groep, 0 in de twee placebo plus verlengde therapie groepen).
Dupilumab (bij mild tot ernstige AA (SALT ≥30%))
Dupilumab (sc 300mg 1x/week voor 6 maanden) in vergelijking tot placebo werd onderzocht in de studie van Guttman-Yassky et al. (2021) in 60 volwassen patiënten met een SALT score van ≥30%). In de studie werd gestreefd dat 1/3 van de geïncludeerde patiënten constitutioneel eczeem heeft of met een voorgeschiedenis daarvan. Dit werd gedaan met de hypothese dat deze patiënten mogelijk beter zouden reageren op therapie met dupilimab. Op week 24 was het least-squares mean verschil in SALT score -6.3 (95% BI, -14.6 - 1.8) in de placebo groep en in de dupilumab groep was dit 2.3 (95% BI, -3.5 - 8.2) (p<0.05). Op 24 weken werd dus een betere uitkomst gezien in de dupilumab groep. Echter werd dit verschil vooral veroorzaakt door de verslechtering die gezien werd in de placebo groep en werd er in de dupilumab groep stabilisatie gezien van het ziektebeeld. Vervolgens werd in beide groepen de therapie met dupilumab voor nog eens 24 weken voortgezet. Gezien er dan geen directe vergelijking meer gemaakt kan worden tussen de groepen, zijn deze uitkomsten niet meegenomen in de GRADE analyse.
Wekelijkse azathioprine pulse (WAP) therapie vs. betamethason pulse-therapie (oraal) (bij mild tot ernstige AA (SALT >10%)
Wekelijkse azathioprine pulse (WAP) therapie (oraal, 300mg 1x/week voor 4 maanden of tot volledig teruggroei van haren was bereikt) of betamethason pulse-therapie (oraal, 5mg 1dd voor 2 opvolgende dagen per week voor 4 maanden of tot volledige hergroei van haren was bereikt) werden onderzocht in de studie van Gupta et al. (2019-1) in 50 volwassen patiënten met mild tot ernstige AA die langer dan 3 maanden bestond. 41 patiënten zijn geanalyseerd. In de WAP groep (n=20) hadden patiënten voor de start van de therapie een gemiddelde SALT score van 24 (IQR 14-58) en in de betamethason groep (n=21) een gemiddelde SALT score van 19 (IQR 14-55). Na 4 maanden was het mediane percentage van scalp hergroei van haar en het mediane verschil in SALT score 44.52 en 9.5 (IQR 0-13.5, p=0.009) in de WAP groep en 71.43 en 14 (IQR 4-19, p=0.001) in de betamethason groep. De toename in de hergroei van haar toonde geen significant verschil tussen beide groepen. Na 9 maanden hadden 10 patiënten (50%) in de WAP groep en 13 (62%) in de betamethason groep complete hergroei van haar. 7 (35%) patiënten in de WAP groep en 5 (23,8%) in de betamethason groep ondervonden geen haar terugrroei of hadden een verdere afname van de dekking van het hoofdhaar aan het einde van de 4 maanden behandeling.
In de betamethason groep werden meer bijwerkingen gemeld; 16 (76.2%) patiënten in de betamethason groep (n=21) ontwikkelden zwelling in het gelaat, 7 gewichtstoename, 5 reflux gastritis en acne, 2 striae en 1 een schimmelinfectie. In de WAP groep werd bij 9 (35%) van de patiënten bij de eerste 1-2 doses misselijkheid die maximaal 1 dag aanhield vastgesteld.
Ciclosporine (mild tot ernstige AA (SALT ≥20%)
Ciclosporine (4mg/kg/dag voor 3 maanden) in vergelijking tot placebo werd onderzocht in de studie van Wai Yun Lai et al. (2019, 2021) in 36 (analyse van 32) volwassen patiënten met milde tot ernstige AA. De gemiddelde duur van de ziekte bedroeg 6,5 jaar en het gemiddelde haarverlies lag op 79.4%. De hergroei van haar werd gemeten middels de SALT score na 1, 2 en 3 maanden. In de ciclosporine groep trad bij 31.3% van de patiënten ten minste 50% vermindering in de SALT score op ten opzichte van 6.3% in de placebo groep (p=0,07).
Wimpers en wenkbrauwen: bij 18.8% in de ciclosporine groep en 0% in de placebo groep trad een verbetering van 1 graad op in de terug groei van wimpers (p=0.07). Bij 31.3 in de ciclosporine groep en 0% in de placebo groep trad een verbetering van 1 graad op in de terug groei van wenkbrauwen (p=0.02)
De impact op de kwaliteit van leven van de patiënten met AA (HRQoL) werd gemeten middels de vragenlijsten AASIS en AQoL-8D die door de patiënten zelf werden ingevuld na 1, 2 en 3 maanden. Voor zowel de placebo als de ciclosporine groep verbeterde de HRQoL gemeten middels AQoL-8D op 3 maanden. De ciclosporine groep liet een grotere verbetering zien, maar deze was niet statistisch significant (0.064 versus 0.050, p=0.763). De HRQoL gemeten middels AASIS liet een verbetering zien in de ciclosporine groep en een enige verslechtering in de placebo groep in de Global Symptom Impact score op 3 maanden. In de Global Interference Score werd er in beide groepen een verbetering gezien op 3 maanden.
Combinatietherapie van methotrexaat + betamethason pulse-therapie vs. methotrexaat vs. betamethason pulse-therapie (bij ernstige AA)
Combinatietherapie van methotrexaat (15mg 1x/week voor 6 maanden) en betamethason pulse-therapie (0.5mg in doseringen van 3mg/week voor 6 maanden) in vergelijking tot de 2 monotherapieën (methotrexaat en betamethason pulse) werd onderzocht in de studie van Asilian et al. (2020) in 36 patiënten met ernstige AA in de leeftijdscategorie 16-60 jaar. De hergroei van haar werd gemeten op 3, 6 en 9 maanden middels de SALT, een fotografisch score systeem en de VAS. Alle groepen lieten verbetering zien in de 3 meetinstrumenten op 3, 6 en 9 maanden. Op 9 maanden was de verbetering van de combinatietherapie groep 46% (SALT), 6 punten op de VAS score en 2 punten op het fotografische score systeem. Op 9 maanden was de verbetering van de methotrexaat groep 23% (SALT), 4 punten op de VAS score en 1 punt op het fotografische score systeem. Op 9 maanden was de verbetering van de betamethason pulse-therapie groep 26% (SALT), 3 punten op de VAS score en 1 punt op het fotografische score systeem. In de betamethason en combinatie therapie groepen werd een significante grotere verbetering van de SALT score gezien ten opzichte van de methotrexaat groep. (respectievelijk p=0.006, p<0.001).
Met betrekking tot de VAS score en het fotografisch score systeem liet de combinatiegroep significant betere resultaten zien dan de betamethason (respectievelijk p=0.015 en p=0.019) en de methotrexaat groep (respectievelijk p<0.001 en p<0.001). Er werden geen serieuze bijwerkingen gezien. 1 patiënt in de methotrexaat groep en 1 patiënt in de combinatie therapie groep hadden last van gastro-intestinale bijwerkingen die verholpen konden worden door dagelijkse foliumzuur suppletie tijdens de betreffende behandeling.
Triamcinolonacetonide intramusculair vs. prednisolon pulse-therapie vs. dexamethason (milde tot ernstige AA, 10-100%)
TCA i.m. (40mg 1x/maand voor 6 maanden gevolgd door 40mg 1x/1,5maand voor 1 jaar), dexamethason (0,5mg/dag voor 6 maanden) en prednisolon pulse-therapie (80mg 1dd voor 3 opvolgende dagen elke 3 maanden (duur van de behandeling is niet omschreven) werden onderzocht in de studie van Kurosawa et al. (2006) in 89 patiënten met milde tot ernstige AA (10-100%) in de leeftijdscategorie 16-63 jaar. De hergroei van haar werd gemeten op 3, 6 en 12 maanden middels een fotografisch score systeem. Daarmee werd het teruggroei percentage bijgehouden. Patiënten die goed reageerden werden gedefinieerd als patiënten met >40% hergroei van haar. Een terugval werd gedefinieerd als nieuwe of uitbreidende kale plekken. In de dexamethason groep zaten 10 patiënten met ≥2 AA plekken 9 patiënten met AA universalis, in de TCA i.m. groep 31 patiënten met ≥2 AA plekken en 12 patiënten met AA universalis, en in de prednisolon groep 12 patiënten met AA multiplex en 17 patiënten met AA universalis. Respons (patiënten met >40% hergroei van haar) op 12 maanden werd gezien in 32/43 patiënten in de TCA i.m. groep (74%), 19/29 patiënten in de prednisolon groep (66%) en 7/19 in de dexamethason groep (37%). De totale respons was statistisch significant hoger in de TCA i.m. groep dan de dexamethason groep (p<0.02). Echter in de TCA i.m. groep zaten in verhouding ook meer patiënten met AA multiplex. Relapse (nieuwe of uitbreidende kale plekken) binnen 6 maanden na het staken van de therapie werd gezien in 33% in de prednisolon groep, 46% in de TCA i.m. groep en in 75% in de dexamethason groep. Alleen tussen de prednisolon en de dexamethason groep was dit verschil statistisch significant (p<0.02).
Bijwerkingen werden gezien in 3/29 patiënten in de prednisolon groep (10%), 23/56 patiënten in de TCA i.m. groep (41%) en 6/20 patiënten in de dexamethason groep (30%).2 van deze 3 patiënten uit de prednisolon groep ontwikkelden dysmenorroe, 1 rapporteerde buikpijn. In de TCA i.m. groep hadden 3 patiënten met buikklachten, 1 patiënt met verergering van acne en 16 patiënten met dysmenorroe. In de dexamethason groep waren er 3 met gewichtstoename, 2 met buikklachten, 1 met algehele zwakte en 1 met zwelling in het gelaat. Geen van de patiënten ontwikkelden hypertensie, maagzweren, verhoogde nuchtere bloedsuikerspiegel, abnormale chemische serumprofielen of lenticulaire opaciteit na het starten van de behandeling.
Overige literatuur
Onderstaand artikel is aangedragen door de werkgroep gezien deze literatuur kan bijdragen aan de onderbouwing van de aanbevelingen. Van dit artikel is geen risk of bias of GRADE analyse uitgevoerd.
Italiaanse richtlijn over de diagnose en behandeling van AA (Rossi, 2019)
Volgens de auteurs van de Italiaanse richtlijn zou de benadering van de behandeling van patiënten met AA moeten verschillen op basis van de leeftijd, de ernst van de ziekte en de activiteit van de ziekte. Onderstaande stellingen worden beschreven door de Rossi et al. (2019).
Bij patiënten jonger dan 10 jaar, ongeacht de klinische presentatie, hebben lokale krachtige corticosteroïden de voorkeursbehandeling. Eventueel kan topicale minoxidil 5% worden toegevoegd. Ditranol kan worden overwogen bij zeer jonge kinderen (1-3 jaar).
Wanneer kinderen ouder dan 10 jaar zijn moet voldoende rekening worden gehouden met de activiteit en de ernst van de ziekte. Intralesionale en/of topicale corticosteroïden behoren tot de eerstekeusbehandeling wanneer trichoscopische tekenen van activiteit aanwezig zijn op de plek van het haarverlies, zoals black dots, afgebroken haren, vellushaar en zogenaamd ‘hair powder’. In specifieke gevallen kunnen korte kuren met systemische corticosteroïden worden toegevoegd om de progressie van de ziekte tijdelijk te stoppen.
De auteurs raden systemische corticosteroïden alleen aan als tijdelijke maatregel om snel voortschrijdende actieve ziekte te beheersen, na het bereiken van dit doel kunnen deze patiënten worden overgeschakeld op alternatieve therapieën. Veel voorkomende behandelingen zijn 50 mg prednisolon per dag bij volwassenen of 1 mg/kg per dag bij kinderen, afbouwend over vier tot zes weken, of 40 mg triamcinolonacetonide intramusculaire injectie elke 15 dagen, afbouwend over 6-12 weken.
In het artikel wordt gesteld dat methotrexaat (10-25mg/week) van toegevoegde waarde kan zijn in de behandeling, met name als toevoeging aan bestaande therapie met systemische corticosteroïden. Voor een goede respons moet de therapie ten minste 3-12 maanden worden voortgezet. Daarbij moet het risico op bijwerkingen en relaps van ziekte worden meegewogen in de keuze.
Azathioprine zou mogelijk de hergroei van haar kunnen stimuleren in patiënten met matig tot ernstige AA. Studies naar dit geneesmiddel voor de behandeling van AA zijn echter alleen in zeer kleine single-arm onderzoekspopulaties uitgevoerd. Waarbij in één studie vier patiënten (28%) de therapie niet voortzette in verband met (ernstige) bijwerkingen (diarree, verhoogde leverenzymwaardes, pancreatitis en beenmergsuppressie).
Rossi et al. beschrijft dat desoximetason, betamethasonvaleraat en clobetasolpropionaat de enige krachtige lokale corticosteroïden zijn die in de onderzoeken zijn geëvalueerd en daarom worden aanbevolen. Op basis van expert opinion van de Italiaanse werkgroep kan echter zelfs behandeling met vier verschillende krachtige lokale corticosteroïden in verschillende formuleringen worden overwogen. In dit therapeutische schema wordt de patiënt geïnstrueerd om lokale corticosteroïden in paren toe te passen (om de avond). Zo’n soort protocol zou volgens de auteurs nuttig kunnen zijn om een plotselinge afname van de respons te voorkomen.
Topicale corticosteroïden met een hoge potentie moeten gedurende 3 tot 6 maanden worden gebruikt voordat de effectiviteit ervan kan worden beoordeeld. Behandeling kan verlengd worden als onderhoudsbehandeling.
Zoeken en selecteren
Om de uitgangsvraag te beantwoorden is een systematische literatuuranalyse uitgevoerd. Voor de onderzoeksvraag is de volgende PICO opgesteld:
P Volwassenen met alopecia areata
I Lokale therapieën, intralesionale therapieën, systemische therapieën (zie onderstaand)
C Andere behandeling, geen behandeling, placebo
O Zie uitkomstmaten
Lokale therapieën: corticosteroïden, tacrolimus, topicale minoxidil, vitamine D-preparaten, diphencyprone, ditranol, prostaglandine analogen, topicale JAK-remmers, UV-kam.
Intralesionale therapieën: triamcinolonacetonide injecties, platelet rich plasma (PRP).
Systemische therapieën: triamcinolonacetonide i.m., prednisolon, dimethylfumaraat, methotrexaat, ciclosporine, mycofenolaatmofetil/mycofenolzuur, azathioprine, ezetimib/simvastatine, baricitinib, ritlecitinib, dupilumab, dexamethason minipulse.
Uitkomstmaten
De werkgroep definieerde de uitkomstmaten als volgt in volgorde van prioriteit:
Cruciaal
- Hergroei van haar (SALT score, foto’s, beoordeling door arts)
Belangrijk
- Veiligheid (o.a. serious adverse events (ziekenhuis opname, mortaliteit), andere bijwerkingen)
- Kwaliteit van leven (QOL)
- Patiënttevredenheid
- Relapse na staken
- Patient global assessment
- Investigator global assessment
- Drug survival
Er werd een systematische zoekstrategie uitgevoerd in de elektronische database Medline. De zoekstrategie is toegevoegd in bijlage X.
Zoeken en selecteren
Studies werden geïncludeerd wanneer deze overeenkwamen met de elementen van de PICO en aan de volgende in- en exclusiecriteria voldeden:
Inclusiecritera
- Vergelijkend onderzoek (n>30)
- Uitkomstmaten worden gemeten na tenminste 3 maanden, maar bij voorkeur na 6 maanden of 1 jaar
- Controlegroep: placebo, andere behandeling of geen behandeling (kanttekening:
natuurlijk beloop) - Een patiënt mag diens eigen controle zijn (ook wel beschreven als ‘half head’)
- Niet vergelijkend onderzoek wordt op hoofdlijnen beschreven als er geen RCT’s zijn, geen analyse middels GRADE.
Exclusiecriteria
- Interventies die niet in Nederland beschikbaar zijn of weinig toegepast worden: tofactinib, brepocitinib en CTP-543
- Studies waarin verschillende dosis of behandelfrequenties zijn onderzocht (zonder controle groep)
- Studies waarbij behandeling van alopecia areata in aanwezigheid van een comorbiditeit onderzocht werd.
Referenties
- Alam, M., Amin, S. S., Adil, M., Arif, T., Zahra, F. T., & Varshney, I. (2019). Comparative Study of Efficacy of Topical Mometasone with Calcipotriol versus Mometasone Alone in the Treatment of Alopecia Areata. International journal of trichology, 11(3), 123-127. https://doi.org/10.4103/ijt.ijt_18_19
- Asilian, A., Fatemi, F., Ganjei, Z., Siadat, A. H., Mohaghegh, F., & Siavash, M. (2021). Oral Pulse Betamethasone, Methotrexate, and Combination Therapy to Treat Severe Alopecia Areata: A Randomized, Double-blind, Placebo-controlled, Clinical Trial. Iranian journal of pharmaceutical research : IJPR, 20(1), 267-273. https://doi.org/10.22037/ijpr.2020.113868.14536
- Bass, A. R., Chakravarty, E., Akl, E. A., Bingham, C. O., Calabrese, L., Cappelli, L. C., Johnson, S. R., Imundo, L. F., Winthrop, K. L., Arasaratnam, R. J., Baden, L. R., Berard, R., Bridges, S. L., Jr, Cheah, J. T. L., Curtis, J. R., Ferguson, P. J., Hakkarinen, I., Onel, K. B., Schultz, G., Sivaraman, V., Reston, J. (2023). 2022 American College of Rheumatology Guideline for Vaccinations in Patients With Rheumatic and Musculoskeletal Diseases. Arthritis & rheumatology (Hoboken, N.J.), 75(3), 333-348. https://doi.org/10.1002/art.42386
- Bhat, S., Handa, S., & De, D. (2021). A randomized comparative study of the efficacy of topical latanoprost versus topical betamethasone diproprionate lotion in the treatment of localized alopecia areata. Indian journal of dermatology, venereology and leprology, 87(1), 42-48. https://doi.org/10.25259/IJDVL_787_19
- Buckley, D. A., & Du Vivier, A. W. (2001). The therapeutic use of topical contact sensitizers in benign dermatoses. The British journal of dermatology, 145(3), 385–405. doi: 10.1046/j.1365-2133.2001.04399.x.
- Ghandi, N., Daneshmand, R., Hatami, P., Abedini, R., Nasimi, M., Aryanian, Z., & Vance, T. M. (2021). A randomized trial of diphenylcyclopropenone (DPCP) combined with anthralin versus DPCP alone for treating moderate to severe alopecia areata. International immunopharmacology, 99, 107971. https://doi.org/10.1016/j.intimp.2021.107971
- Gupta, A. K., Carviel, J. L., Foley, K. A., Shear, N. H., Piraccini, B. M., Piguet, V., & Tosti, A. (2019-2). Monotherapy for Alopecia Areata: A Systematic Review and Network Meta-Analysis. Skin appendage disorders, 5(6), 331-337. https://doi.org/10.1159/000501940
- Gupta, P., Verma, K. K., Khandpur, S., & Bhari, N. (2019). Weekly Azathioprine Pulse versus Betamethasone Oral Mini-Pulse in the Treatment of Moderate-to-Severe Alopecia Areata. Indian journal of dermatology, 64(4), 292-298. https://doi.org/10.4103/ijd.IJD_481_16
- Guttman-Yassky, E., Renert-Yuval, Y., Bares, J., Chima, M., Hawkes, J. E., Gilleaudeau, P., Sullivan-Whalen, M., Singer, G. K., Garcet, S., Pavel, A. B., Lebwohl, M. G., & Krueger, J. G. (2022). Phase 2a randomized clinical trial of dupilumab (anti-IL-4Rα) for alopecia areata patients. Allergy, 77(3), 897-906. https://doi.org/10.1111/all.15071
- Happle, R., Hausen, B. M., & Wiesner-Menzel, L. (1983). Diphencyprone in the treatment of alopecia areata. Acta dermato-venereologica, 63(1), 49-52.
- King B, et al. wo Phase 3 Trials of Baricitinib for Alopecia Areata. Br J Dermatol. 2022 May; 386:1687-.
- King, B., Ko, J., Forman, S., Ohyama, M., Mesinkovska, N., Yu, G., McCollam, J., Gamalo, M., Janes, J., Edson-Heredia, E., Holzwarth, K., & Dutronc, Y. (2021). Efficacy and safety of the oral Janus kinase inhibitor baricitinib in the treatment of adults with alopecia areata: Phase 2 results from a randomized controlled study. Journal of the American Academy of Dermatology, 85(4), 847853. https://doi.org/10.1016/j.jaad.2021.05.050
- King, B., Zhang, X., Harcha, W. G., Szepietowski, J. C., Shapiro, J., Lynde, C., Mesinkovska, N. A., Zwillich, S. H., Napatalung, L., Wajsbrot, D., Fayyad, R., Freyman, A., Mitra, D., Purohit, V., Sinclair, R., & Wolk, R. (2023). Efficacy and safety of ritlecitinib in adults and adolescents with alopecia areata: a randomised, double-blind, multicentre, phase 2b-3 trial. Lancet (London, England), 401(10387), 1518-1529. https://doi.org/10.1016/S0140-6736(23)00222-2
- Kuldeep, C., Singhal, H., Khare, A. K., Mittal, A., Gupta, L. K., & Garg, A. (2011). Randomized comparison of topical betamethasone valerate foam, intralesional triamcinolone acetonide and tacrolimus ointment in management of localized alopecia areata. International journal of trichology, 3(1), 20-24.
- Kurosawa, M., Nakagawa, S., Mizuashi, M., Sasaki, Y., Kawamura, M., Saito, M., & Aiba, S. (2006). A comparison of the efficacy, relapse rate and side effects among three modalities of systemic corticosteroid therapy for alopecia areata. Dermatology (Basel, Switzerland), 212(4), 361-365. https://doi.org/10.1159/000092287
- Kwon, O., Senna, M. M., Sinclair, R., Ito, T., Dutronc, Y., Lin, C. Y., Yu, G., Chiasserini, C., McCollam, J., Wu, W. S., & King, B. (2023). Efficacy and Safety of Baricitinib in Patients with Severe Alopecia Areata over 52 Weeks of Continuous Therapy in Two Phase III Trials (BRAVE-AA1 and BRAVE-AA2). American journal of clinical dermatology, 1-9. Advance online publication. https://doi.org/10.1007/s40257-023-00764-w
- Lai, V. W. Y., Chen, G., & Sinclair, R. (2021). Impact of cyclosporin treatment on health-related quality of life of patients with alopecia areata. The Journal of dermatological treatment, 32(2), 250-257. https://doi.org/10.1080/09546634.2019.1654068
- Lai, V. W. Y., Chen, G., Gin, D., & Sinclair, R. (2019). Cyclosporine for moderate-to-severe alopecia areata: A double-blind, randomized, placebo-controlled clinical trial of efficacy and safety. Journal of the American Academy of Dermatology, 81(3), 694-701. https://doi.org/10.1016/j.jaad.2019.04.053
- Litfulo EPAR product information, 2023 - geraadpleegd op 12-12-2023. Beschikbaar via: https://www.ema.europa.eu/nl/documents/product-information/litfulo-epar-product-information_nl.pdf
- Meznerics, F. A., Illés, K., Dembrovszky, F., Fehérvári, P., Kemény, L. V., Kovács, K. D., Wikonkál, N. M., Csupor, D., Hegyi, P., & Bánvölgyi, A. (2022). Platelet-Rich Plasma in Alopecia Areata-A Steroid-Free Treatment Modality: A Systematic Review and Meta-Analysis of Randomized Clinical Trials. Biomedicines, 10(8), 1829. https://doi.org/10.3390/biomedicines10081829
- Molinelli, E., Campanati, A., Brisigotti, V., Sapigni, C., Paolinelli, M., & Offidani, A. (2020). Efficacy and Safety of Topical Calcipotriol 0.005% Versus Topical Clobetasol 0.05% in the Management of Alopecia Areata: An Intrasubject Pilot Study. Dermatology and therapy, 10(3), 515-521. https://doi.org/10.1007/s13555-020-00379-7
- Olumiant EPAR product information, 2023 - geraadpleegd op 12-12-2023. Beschikbaar via: https://www.ema.europa.eu/nl/documents/product-information/olumiant-epar-product-information_nl.pdf
- Pelin Ustuner, Ali Balevi & Mustafa Özdemir (2017) Best dilution of the best corticosteroid for intralesional injection in the treatment of localized alopecia areata in adults, Journal of Dermatological Treatment, 28:8, 753-761, DOI: 10.1080/09546634.2017.1329497
- Pratt CH, King LE Jr, Messenger AG, Christiano AM, Sundberg JP. Alopecia areata. Nat Rev Dis Primers. 2017 Mar 16;3:17011. S
- Rajan M B, Bhardwaj A, Singh S, et al. Identification of novel step-up regimen of intralesional triamcinolone acetonide in scalp alopecia areata based on a double-blind randomized controlled trial. Dermatologic Therapy. 2021;34:e14555. https://doi.org/10.1111/dth. 14555
- Rossi, A., Muscianese, M., Piraccini, B. M., Starace, M., Carlesimo, M., Mandel, V. D., Alessandrini, A., Calvieri, S., Caro, G., D'arino, A., Federico, A., Magri, F., Pigliacelli, F., Amendolagine, G., Annunziata, M. C., Arisi, M. C., Astorino, S., Babino, G., Bardazzi, F., Barruscotti, S., Fortuna, M. C. (2019). Italian Guidelines in diagnosis and treatment of alopecia areata. Giornale italiano di dermatologia e venereologia : organo ufficiale, Societa italiana di dermatologia e sifilografia, 154(6), 609-623. https://doi.org/10.23736/S0392-0488.19.06458-7
- Ustuner, P., Balevi, A., & Özdemir, M. (2017). Best dilution of the best corticosteroid for intralesional injection in the treatment of localized alopecia areata in adults. The Journal of dermatological treatment, 28(8), 753-761. https://doi.org/10.1080/09546634.2017.1329497
- Wagner N, Assmus F, Arendt G et al. Impfen bei Immundefizienz : Anwendungshinweise zu den von der Ständigen Impfkommission empfohlenen Impfungen. (IV) Impfen bei Autoimmunkrankheiten, bei anderen chronischentzündlichen Erkrankungen und unter immunmodulatorischer Therapie. Bundesgesundheitsblatt, Gesundheitsforschung, Gesundheitsschutz 2019; 62: 494-515
- Winnette, R., Banerjee, A., Sikirica, V., Peeva, E., & Wyrwich, K. (2022). Characterizing the relationships between patient-reported outcomes and clinician assessments of alopecia areata in a phase 2a randomized trial of ritlecitinib and brepocitinib. Journal of the European Academy of Dermatology and Venereology : JEADV, 36(4), 602-609. https://doi.org/10.1111/jdv.17909
Evidence tabellen
Systematische reviews:
Beoordeling risk of bias door middel van AMSTAR.
|
Study reference
(first author, publication year) |
Appropriate and clearly focused question? 1
Yes/no |
Comprehensive and systematic literature search?2
Yes/partial yes/ no |
Description of included and excluded studies?3
Yes/partial yes/ no |
Description of relevant characteristics of included studies?4
Yes/partial yes/no |
Assessment of scientific quality of included studies?5
Yes/partial yes/no |
Enough similarities between studies to make combining them reasonable?6
Yes/partial yes/ no |
Potential risk of publication bias taken into account?7
Yes/partial yes/ no |
Potential conflicts of interest reported?8
Yes/partial yes/ no |
|
Meznerics, 2022 |
Yes |
Yes |
Partial yes |
Yes |
Yes |
No |
Partial yes
Publication bias of every study was assessed and presented as high risk/some concerns/low risks but is not further specified. |
No |
|
Gupta, 2019 |
yes |
Partial yes |
Partial yes |
Yes |
Yes |
No |
Partial yes
Publication bias of every study was assessed and presented as high risk/some concerns/low risks but is not further specified. |
Yes |
Randomized controlled trial (RCT)
Beoordeling risk of bias door middel van Cochrane collaboration tool.
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Random sequence generation (selection bias)2
(high/unclear/low risk) |
Allocation concealment (selection bias)3
(high/unclear/low risk) |
Blinding of participants and personnel (performance bias)4,6 All outcomes
(high/unclear/low risk) |
Blinding of outcome assessor (detection bias)5,6 All outcomes
(high/unclear/low risk) |
Incomplete outcome data (attrition bias)7 All outcomes
(high/unclear/low risk) |
Selective reporting (reporting bias)8
(high/unclear/low risk) |
Other bias9
(high/unclear/low risk) |
|
|
Randomization was performed by a computer-generated random sequence with the use of an interactive Web-response system and was stratified according to geographic region (North America, Asia, or rest of the world) and duration of current episode (4 years or ≥4 years). |
Low risk. |
Low risk |
Low risk. |
Low risk.
A double-dummy design was used to conceal the trial-group assignments from the patients and investigators. |
Low risk. |
Low risk. Matches trial protocol. |
Unclear.
|
|
Winnette, 2022 and King, 2020 (same study) |
Using interactive response technology, enrolled patients were randomized 2:1 to receive, respectively, ritlecitinib or ritlecitinib matching placebo. |
Low risk. |
Low |
Low.
Participants and personnel were blinded (matching placebo). |
Unclear. |
Low risk AEs that led to study drug discontinuation occurred in 3 (6%) and 4 (9%) patients in the placebo and ritlecitinib groups. |
Unclear
Study protocol only available on request. |
|
|
Asilian, 2020 |
The randomization sequence was created by block randomization using the Random Allocation Software. The patients were randomly classified into three groups at a ratio of 1:1:1, including (A) The betamethasone therapy group, (B) The methotrexate therapy group and (C) The combination therapy with betamethasone plus methotrexate group. |
Low risk. |
Unclear. |
Unclear. Patients were blinded, but there is no information about blinding the personnel. |
Unclear. |
Low risk No dropout |
Unclear.
Study protocol not available. |
|
|
Ghandi, 2021 – 2 |
Patients were divided randomly into two groups by simple randomization. |
Low risk. |
Unclear. |
Unclear. |
Unclear. |
High risk. |
Unclear.
No study protocol available. |
Unclear.
Source of funding is not specified.
There is insufficient rationale or evidence that this identified problem will introduce bias. |
|
Wai Yun Lai, 2019 and Wai Yun Lai 2021. |
Participants, study researchers, and all outcome assessors were blinded to the allocation sequence through an independent pharmacy who randomized participants according to a computer-generated randomization list and had no clinical involvement in the trial |
Low risk. |
Low risk. |
Low risk. |
Low risk. |
Unclear risk.
Dropout: 4 (11%) |
Low risk- |
|
|
Gupta, 2019 – 1 |
Recruited patients were randomized into two groups using random number table generated online. |
Low risk. |
Unclear. |
High risk. |
High risk. |
Unclear |
Low risk. |
|
|
Guttman Yassky, 2021 |
The randomization for both sites was performed by a designated research personnel at the Icahn School of Medicine using an internetbased randomization system. The method uses random block sizes and randomly permuted blocks |
Low risk |
Low risk |
Low risk |
Low risk |
Unclear risk |
Low risk |
|
|
Bhat, 2021 |
Patients were randomized in a 1:1 ratio to receive either topical latanoprost 0.005% ophthalmic solution (group 1) or topical betamethasone diproproionate0.05% lotion (group 2). The randomization sequence was computer‑generated and the assignments were placed in sealed opaque envelopes. Patients were instructed to apply either latanoprost 0.005% ophthalmic solution twice daily (group 1) to alopecia areata patches using a cotton tip applicator or betamethasone propionate 0.05% lotion using fingers (group 2) twice daily |
Low risk |
Low risk |
High risk |
High risk |
Low risk |
Low risk |
|
|
Alam, 2019 |
All patients were randomly allocated into either of the two groups, Group A and Group B. Randomization was done through “Box and Chit method.” By this method, each and every patient taking part in the study had equal chance of being incorporated into either group. |
Low risk |
Unclear. |
High risk |
High risk |
Unclear |
Unclear |
|
|
Hajheydari, 2007 |
A total of 40 patients were recruited and were randomly assigned into two groups to receive garlic gel 5% or placebo. |
Low risk |
Unclear. |
Low risk |
Low risk |
Low risk |
Unclear |
They used a square centimeters scoring system, this may lead to under or over reporting of hairloss because there were also children from the age of 5 years old that might have less scalp hair compared to an adult. The use of percentages would have been more uniform. |
|
Kurosawa (2006) |
They were randomly divided into three groups depending on the time of their initial visit |
Unclear |
Unclear. |
High risk |
High risk |
Unclear |
Unclear risk. |
|
|
Ustuner, 2017 |
Simple randomization was performed using a random-numbers table. |
Low risk |
Unclear. |
High risk |
High risk |
Unclear |
Unclear risk. |
|
|
Kuldeep, 2011 |
105 patients of localized AA were initially registered but 27 were drop out. So, 78 patients allocated at random in group A (28), B (25) and C (25) |
Unclear |
Unclear. |
High risk |
High risk |
High risk |
Unclear risk. |
|
|
Rajan, 2021 |
These were randomized for four different treatment groups namely10, 5, and 2.5 mg/mL strengths of triamcinolone acetonide (Tricort, Cadila Pharmaceuticals, Ahmedabad) and Normal saline (NS) using a random number table created by the Research Randomizer free software.17 Allocation concealment was maintained using sealed envelopes |
Low risk |
Low risk |
Low risk |
Low risk |
High risk |
Unclear risk. |
|
Observationele studies
Beoordeling risk of bias middels Newcastle-Ottawa scale (NOS).
|
|
Selection |
Comparability |
Outcomes |
|
||||||
|
Studie |
Study design |
Representativeness of the intervention cohort |
Selection of the non intervention cohort |
Ascertainment of intervention
|
Demonstration that outcome of interest was not present at start of study
|
Comparability of cohorts on the basis of the design or analysis
|
Assessment of outcome
|
Was follow up long enough for outcomes to occur
|
Adequacy of follow up of cohorts
|
Explanations |
|
Molinelli 2020 |
Obsercvationele studie |
« |
« |
« |
- |
- |
« |
« |
- |
|
Vraagstelling: DPCP versus DPCP + ditranol voor de behandeling van milde tot ernstige AA
|
Certainty assessment |
Impact |
Certainty |
Importantie |
||||||
|
Aantal studies |
Studieopzet |
Risk of bias |
Inconsistentie |
Indirect bewijs |
Onnauwkeurigheid |
Andere factoren |
|||
|
SALT |
|||||||||
|
1 |
gerandomiseerde trials |
ernstiga |
niet ernstig |
niet ernstig |
ernstigb |
niet gevonden |
Hair regrowth>75% was seen in 25% of patients in the control group whereas this was the case in 21% of patients in the intervention group. In the control group, 6.25, 6.25 and 62.5% of patients obtained A3, A2 and A1 hair regrowth, respectively, after 6 months, while in the intervention group, 26.31, 10.52 and 42.10% of patients experienced A3, A2 and A1 clinical response, respectively (P value: 0.696). |
⨁⨁◯◯ |
|
|
AASIS |
|||||||||
|
1 |
gerandomiseerde trials |
ernstiga |
niet ernstig |
niet ernstigc |
ernstigb |
niet gevonden |
After 6 months:DPCP + anthralin/DPCP only:Mean symptom severity: 4.33/4.86 (P=0.442)Disease impact on daily functioning: 4.51/5.57 (P=0.248) |
⨁⨁◯◯ |
|
|
Safety |
|||||||||
|
1 |
gerandomiseerde trials |
ernstiga |
niet ernstig |
niet ernstig |
ernstigb |
niet gevonden |
DPCP + anthralin group: 3 patients experienced adverse events in an early stage of treatment. DPCP only group: 2 patients experienced adverse events in an early stage of treatment. 3 patients experienced unfavorable side effects after 3 months of treatment. |
⨁⨁◯◯ |
|
Explanations
a. Geen informatie over het blindering en allocation conceilment proces. Geen studieprotocol beschikbaar.
b. Zeer kleine onderzoekspopulatie.
c. AASIS is een vragenlijst over de afgelopen 24 uur, het is onduidelijk of dit middel geschikt is om de kwaliteit van leven te beoordelen.
Vraagstelling: Combinatietherapie met mometason 0.01% crème + calcipotriol 0.005% zalf vs mometason 0.01% crème monotherapie voor de behandeling van milde AA
|
Certainty assessment |
Impact |
Certainty |
Importantie |
||||||
|
Aantal studies |
Studieopzet |
Risk of bias |
Inconsistentie |
Indirect bewijs |
Onnauwkeurigheid |
Andere factoren |
|||
|
SALT score |
|||||||||
|
1 |
gerandomiseerde trials |
niet ernstiga |
niet ernstig |
ernstigb |
ernstigc |
niet gevonden |
Statistically, we found that there was a significant decrease (P < 0.001) in mean SALT score at 24 weeks in patients of both groups when compared with baseline value of the same group, indicating that the therapy instituted in both the groups was efficacious. Moreover, when decrease of mean SALT score of these two groups was compared together, we found a statistically significant difference (P < 0.001) with a higher decrement in patients that received the combination therapy. |
⨁⨁◯◯ |
|
CI: Confidence interval
Explanations
a. Patiënten, personeel en onderzoekers zijn niet geblindeerd. Er is geen studie protocol beschikbaar, het aantal geanalyseerde patiënten wordt niet benoemd.
b. Patiënten van 12 tot 65 jaar werden geanalyseerd. De verdeling van deze leeftijden wordt niet vermeld. Alleen een gemiddelde leeftijd van 22.38 jaar in groep A en 23.96 jaar in groep B wordt vermeld.
c. Er zijn 100 patiënten geïncludeerd, waarvan niet duidelijk is hoeveel er geanalyseerd zijn.
Vraagstelling: Methotrexaat vs. betamethason pulse-therapie voor de behandeling van ernstige AA
|
Certainty assessment |
Impact |
Certainty |
Importantie |
||||||
|
Aantal studies |
Studieopzet |
Risk of bias |
Inconsistentie |
Indirect bewijs |
Onnauwkeurigheid |
Andere factoren |
|||
|
SALT |
|||||||||
|
1 |
gerandomiseerde trials |
niet ernstiga |
niet ernstig |
niet ernstig |
zeer ernstigb |
niet gevonden |
Betamethasone therapy (P = 0.006) provided greater SALT improvement than methotrexate within nine months. |
⨁⨁◯◯ |
|
CI: Confidence interval
Explanations
a. Geen informatie over allocation conceilment en blindering van personeel + outcome assessor. Geen studie protocol beschikbaar.
b. Zeer kleine steekproef
Vraagstelling: Combinatietherapie met methotrexaat en betamethason pulse-therapie vs. methotrexaat voor de behandeling van ernstige AA
|
Certainty assessment |
Impact |
Certainty |
Importantie |
||||||
|
Aantal studies |
Studieopzet |
Risk of bias |
Inconsistentie |
Indirect bewijs |
Onnauwkeurigheid |
Andere factoren |
|||
|
SALT |
|||||||||
|
1 |
gerandomiseerde trials |
niet ernstiga |
niet ernstig |
niet ernstig |
zeer ernstigb |
niet gevonden |
Combination therapy (P < 0.001) provided greater SALT improvement than methotrexate within nine months, as the amount of reduction was 43% in the SALT score in the combination therapy group and 23% in the methotrexate group. |
⨁⨁◯◯ |
CRUCIAAL |
|
Photographic scoring |
|||||||||
|
1 |
gerandomiseerde trials |
niet ernstiga |
niet ernstig |
niet ernstig |
zeer ernstigb |
niet gevonden |
The photographic findings of the combination therapy were superior to methotrexate (P < 0.001) alone. |
⨁⨁◯◯ |
BELANGRIJK |
|
VAS |
|||||||||
|
1 |
gerandomiseerde trials |
niet ernstiga |
niet ernstig |
niet ernstig |
zeer ernstigb |
niet gevonden |
Combination therapy led to greater improvements in the VAS score (P < 0.001). |
⨁⨁◯◯ |
BELANGRIJK |
CI: Confidence interval
Explanations
a. Geen informatie over allocation conceilment en blindering van personeel + outcome assessor. Geen studie protocol beschikbaar.
b. Zeer kleine steekproef
Vraagstelling: Combinatietherapie met methotrexaat en betamethason pulse-therapie vs betamethason pulse-therapie voor de behandeling van ernstige AA
|
Certainty assessment |
Certainty |
Importantie |
|||||||
|
Aantal studies |
Studieopzet |
Risk of bias |
Inconsistentie |
Indirect bewijs |
Onnauwkeurigheid |
Andere factoren |
|||
|
SALT |
|||||||||
|
1 |
gerandomiseerde trials |
niet ernstiga |
niet ernstig |
niet ernstig |
zeer ernstigb |
niet gevonden |
Betamethasone therapy (P = 0.006) and combination therapy (P < 0.001) provided greater SALT improvement than methotrexate within nine months, as the amount of reduction was 43% in the SALT score in the combination therapy group, 26% in the betamethasone group and 23% in the methotrexate group and there was no significant difference between the betamethasone group and the combination therapy group in this respect (P > 0.05). |
⨁⨁◯◯ |
|
|
Photographic scoring |
|||||||||
|
1 |
gerandomiseerde trials |
niet ernstiga |
niet ernstig |
niet ernstig |
zeer ernstigb |
niet gevonden |
The photographic findings of the combination therapy were superior (P < 0.019) a |
⨁⨁◯◯ |
|
|
VAS |
|||||||||
|
1 |
gerandomiseerde trials |
niet ernstiga |
niet ernstig |
niet ernstig |
zeer ernstigb |
niet gevonden |
Combination therapy led to greater improvements in the VAS score (P = 0.015) |
⨁⨁◯◯ |
|
CI: Confidence interval
Explanations
a. Geen informatie over allocation conceilment en blindering van personeel + outcome assessor. Geen studie protocol beschikbaar.
b. Zeer kleine steekproef
Vraagstelling: Dupilumab vs. placebo voor de behandeling van milde tot ernstige AA
|
Certainty assessment |
Aantal patiënten |
Effect |
Certainty |
Importantie |
||||||||
|
Aantal studies |
Studieopzet |
Risk of bias |
Inconsistentie |
Indirect bewijs |
Onnauwkeurigheid |
Andere factoren |
Dupilumab |
placebo |
Relatief |
Absoluut |
||
|
SALT |
||||||||||||
|
gerandomiseerde trials |
niet ernstig |
niet ernstig |
ernstiga |
ernstigb |
niet gevonden |
At week 24, worsening of AA was documented in the placebo group, with a least-squares mean change in the SALT score of −6.3 (95% CI, −14.6 to 1.8), while in the drug arm we observed a least[1]squares mean change of 2.3 (95% CI, −3.5 to 8.2) as compared to baseline (p < .05). |
⨁⨁◯◯ |
|||||
CI: Confidence interval
Explanations
a. Als inclusie: minimaal 1/3 van de patiënten dient CE danwel een CE historie te hebben.
b. Geringe studiepopulatie.
Vraagstelling: Wekelijkse azathioprine pulse (WAP) therapie (300mg 1dd voor 2 opvolgende dagen per week voor 5 maanden) vs. betamethason orale pulse-therapie (5mg 1dd voor 2 opvolgende dagen per week voor 5 maanden voor de behandeling van milde tot ernstige AA
|
Certainty assessment |
Impact |
Certainty |
Importantie |
||||||
|
Aantal studies |
Studieopzet |
Risk of bias |
Inconsistentie |
Indirect bewijs |
Onnauwkeurigheid |
Andere factoren |
|||
|
SALT |
|||||||||
|
1 |
gerandomiseerde trials |
niet ernstiga |
niet ernstig |
niet ernstig |
zeer ernstigb |
niet gevonden |
WAP change in salt score, median (IQR): 9.5 (0-13.5) (P=0.009) Betamethasone change in salt score, median (IQR): 14 (4-19) (P=0.001). |
⨁⨁◯◯ |
|
|
Safety |
|||||||||
|
1 |
gerandomiseerde trials |
niet ernstiga |
niet ernstig |
niet ernstig |
zeer ernstigb |
niet gevonden |
Sixteen (76.2%) patients in betamethasone group (n=21) developed facial puffiness/moon facies, 7 had weight gain, 5 each had reflux gastritis and steroid acne, 2 had striae distensae, and 1 patient had dermatophytic infection, whereas transient nausea lasting for a day with initial 1–2 doses was observed in 7 (35%) patients in WAP group (n=20). The side effects did not necessitate discontinuation of treatment in any patient. No significant changes in biochemical parameters were noted in either group. |
⨁⨁◯◯ |
|
CI: Confidence interval
Explanations
a. No blinding of patients and investigators, dropout rate of 18%
b. Kleine steekproef
Vraagstelling: Ciclosporine (4mg/kg/dag voor 3 maanden) vs. placebo voor de behandeling van milde tot ernstige AA
|
Certainty assessment |
Impact |
Certainty |
Importantie |
||||||
|
Aantal studies |
Studieopzet |
Risk of bias |
Inconsistentie |
Indirect bewijs |
Onnauwkeurigheid |
Andere factoren |
|||
|
SALT |
|||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
niet ernstig |
zeer ernstiga |
niet gevonden |
Overall, 5 participants (31.3%) in the cyclosporine group achieved at least a 50% reduction at the end of 3 months, compared with 1 participant (6.3%) in the placebo. group (P =0.07). This response rate approached but did not reach statistical significance. One participant (6.3%) in the cyclosporine group achieved a 100% improvement in SALT score at 3 months, whereas none achieved this in the placebo group (P = 0.31). Participants in the cyclosporine group had on average a greater reduction in SALT score over time than did participants in the placebo group (14.8% vs 2.3% (P = .23) |
⨁⨁◯◯ |
|
|
QOL |
|||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
ernstigb |
zeer ernstiga |
niet gevonden |
There were no statistically significant differences between the cyclosporine and placebo groups in change from baseline in QOL measurements at 3 months. Participants receiving cyclosporine had, on average, greater improvement in all QOL measurements. Responders in the cyclosporine group had, on average, a greater improvement in Global Symptom Impact Score at 3 months. |
⨁◯◯◯ |
|
|
AASIS |
|||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
ernstigc |
zeer ernstiga |
niet gevonden |
Mean change from baseline in Alopecia Areata Symptom Impact Scale score at 3 months - Global Symptom Impact Score (SD):Cyclosporine: -0.041 (0.121Placebo: 0.009 (0.150) (P=0.558)Mean change from baseline in Alopecia Areata Symptom Impact Scale score at 3 months - Scalp Hair Loss Score (SD):Cyclosporine: 0.063 (1.389)Placebo: 0.313 (1.537)(P=902) |
⨁◯◯◯ |
|
|
Safety |
|||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
niet ernstig |
zeer ernstiga |
niet gevonden |
There were no statistically significant differences between the groups in terms of incidence of adverse events (Table III). In all, 83% of participants reported a total of 47 adverse events during the trial. Adverse events spanned a range of systems, with the most frequent complaints being headaches (n = 11) and hirsutism (n = 9). There were no serious adverse events. There were no clinically significant changes in blood biochemistry or blood pressure between the groups. The change in alkaline phosphatase level was statistically but not clinically significant. |
⨁⨁◯◯ |
|
CI: Confidence interval
Explanations
a. Small number of analysed participants (32)
b. AQoL-8D is een vragenlijst over de afgelopen 7 dagen, het is onduidelijk of dit middel geschikt is om de kwaliteit van leven te beoordelen.
c. AASIS is een vragenlijst over de afgelopen 24 uur, het is onduidelijk of dit middel geschikt is om de kwaliteit van leven te beoordelen.
|
Vraagstelling: DPCP vs. placebo voor de behandeling van milde tot ernstige AA |
||||||
|
Outcomes |
Anticipated absolute effects* (95% CI) |
Relative effect |
№ of patches |
Certainty of the evidence |
Comments |
|
|
Risk with control |
Risk with DPCP |
|||||
|
Responders |
7 per 1,000 |
241 per 1,000 |
OR 48.36 |
895 |
⨁⨁◯◯ |
|
|
*The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). |
||||||
a. High risk of bias detected in all studies
b. Imprecision - small sample size
|
Vraagstelling: topicale corticosteroïden vs. placebo voor de behandeling van milde tot ernstige AA |
||||||
|
|
||||||
|
Outcomes |
Anticipated absolute effects* (95% CI) |
Relative effect |
№ of patches |
Certainty of the evidence |
Comments |
|
|
Risk with Control |
Risk with topical steroids |
|||||
|
Responders |
17 per 1,000 |
125 per 1,000 |
OR 8.13 |
232 |
⨁⨁◯◯ |
|
|
*The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). |
||||||
Explanations
a. High risk of bias detected in all studies
b. Imprecision - small sample size
|
Vraagstelling: Topicale minoxidil vs. placebo voor de behandeling van matige tot ernstige AA |
||||||
|
|
||||||
|
Outcomes |
Anticipated absolute effects* (95% CI) |
Relative effect |
№ of patches |
Certainty of the evidence |
Comments |
|
|
Risk with control |
Risk with minoxidil |
|||||
|
Responders |
22 per 1,000 |
248 per 1,000 |
OR 14.69 |
195 |
⨁⨁◯◯ |
|
|
*The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). |
||||||
Explanations
a. Imprecision - small sample size
|
Vraagstelling: Topicale minoxidil vs. placebo voor de behandeling van milde AA |
||||||
|
Outcomes |
Anticipated absolute effects* (95% CI) |
Relative effect |
№ of patches |
Certainty of the evidence |
Comments |
|
|
Risk with control |
Risk with minoxidil |
|||||
|
Responders |
1,200 per 1,000 |
1000 per 1,000 |
OR 1.00 |
60 |
⨁⨁◯◯ |
|
|
*The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). |
||||||
Explanations
a. Risk of bias detected
b. Imprecision - small sample size
|
Vraagstelling: Bimatoprost vs. topicale steroïden voor de behandeling van milde AA |
||||||
|
|
||||||
|
Outcomes |
Anticipated absolute effects* (95% CI) |
Relative effect |
№ of patches |
Certainty of the evidence |
Comments |
|
|
Risk with topical steroids |
Risk with bimatoprost |
|||||
|
Bimatoprost |
567 per 1,000 |
833 per 1,000 |
OR 3.82 |
60 |
⨁⨁◯◯ |
|
|
*The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). |
||||||
Explanations
a. Risk of bias detected
b. Imprecision - small sample size
|
Summary of findings: |
||||||
|
Vraagstelling: Latanoprost vs. placebo voor de behandeling van milde AA |
||||||
|
|
||||||
|
Outcomes |
Anticipated absolute effects* (95% CI) |
Relative effect |
№ of patches |
Certainty of the evidence |
Comments |
|
|
Risk with control |
Risk with latanoprost |
|||||
|
Responders |
0 per 1,000 |
0 per 1,000 |
OR 18.38 |
40 |
⨁⨁◯◯ |
|
|
*The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). |
||||||
Explanations
a. Risk of bias detected
b. Imprecision - small sample size
Vraagstelling: Baricitinib 2 mg vs. placebo voor de behandeling van ernstige AA
|
Certainty assessment |
Aantal patiënten |
Effect |
Certainty |
Importantie |
||||||||
|
Aantal studies |
Studieopzet |
Risk of bias |
Inconsistentie |
Indirect bewijs |
Onnauwkeurigheid |
Andere factoren |
Baricitinib 2mg |
placebo |
Relatief |
Absoluut |
||
|
Haar teruggroei (SALT) |
||||||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
niet ernstig |
niet ernstig |
niet gevonden |
BRAVE-AA1: 22.8% van de patiënten in de 2mg baricitnib groep had na 36 weken een SALT score <20 vs 6,2 % in de placebo groep. Het verschil tussen 2mg vs placebo was 16.6% (95% CI 9,5 to 23,8) (P<0,001). BRAVE-AA2: 19.4% van de patiënten in de 2mg baricitnib groep had na 36 weken een SALT score <20 vs 3,3% % in de placebo groep. |
⨁⨁⨁⨁ |
||||
|
Scalp Hair Assessment Patient-Reported Outcome (PRO) |
||||||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
ernstiga |
niet ernstig |
niet gevonden |
BRAVE-AA1 % van patiënten met een PRO score van 0 of 1 met een reductie van ≥2 punten op week 36: 2mg baricitinib: 17.1%, Placebo: 5.1% BRAVE-AA2 % van patiënten met een PRO score van 0 of 1 met een reductie van ≥2 punten op week 36: 2mg baricitinib: 18.5%, Placebo: 5.1% In BRAVE-AA1, het verschil tussen 2mg baricitinib en placebo was 11.2 percentage punten (95% CI, 4.3-18.1) (P=0.001) In BRAVE-AA2, het verschil tussen 2mg baricitinib en placebo was 13.4 percentage punten (95% CI, 5.8-21) (P=0.002) |
⨁⨁⨁◯ |
||||
|
Safety |
||||||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
zeer ernstiga,b |
niet ernstig |
niet gevonden |
BRAVE-AA1: In 93 van de 183 patiënten (50.8%) in de 2mg baricitinib groep ontstonden adverse events of bestaande werden verergerd, vs 97 van de 189 in de placebo groep (51.3%). Serious adverse events werden gezien in 4 van de 183 (2.2%) in de 2mg baricitinib groep en 3 van de 189 (1.6% ) in de placebo groep. BRAVE-AA2: In 106 van de 155 patiënten (68.4%) in de 2mg baricitinib groep ontstonden adverse events of bestaande werden verergerd, vs 97 van de 154 in de placebo groep (63%). Serious adverse events werden gezien in 4 van de 155 (2.6) in de 2mg baricitinib groep en in 3 van de 154 (1.9%) in de placebo groep. |
⨁⨁◯◯ |
||||
Explanations
a. Het is onduidelijk of deze methode geschikt is om antwoord te geven op de uitgangsvraag
b. Investigators assessed most events as being mild or moderate in severity, but there was no independent adjudication of severity and no scale or measure for severity in the protocols
Vraagstelling: Baricitinib 4 mg vs. placebo voor de behandeling van ernstige AA
|
Certainty assessment |
Impact |
Certainty |
Importantie |
||||||
|
Aantal studies |
Studieopzet |
Risk of bias |
Inconsistentie |
Indirect bewijs |
Onnauwkeurigheid |
Andere factoren |
|||
|
SALT |
|||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
niet ernstig |
niet ernstig |
niet gevonden |
The percentages of patients who had a SALT score of 20 or less at week 36, estimated from multiple imputation for missing data, were 38.8% with 4-mg baricitinib, and 6.2% with placebo in BRAVE-AA1, and 35.9%, and 3.3%, respectively, in BRAVE-AA2. |
⨁⨁⨁⨁ |
|
|
Scalp hair assessment PRO |
|||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
ernstiga |
niet ernstig |
niet gevonden |
BRAVE-AA1 % van patiënten met een PRO score van 0 of 1 met een reductie van ≥2 punten op week 36: 4mg baricitinib: 35.8%, Placebo: 5.1% BRAVE-AA2 % van patiënten met een PRO score van 0 of 1 met een reductie van ≥2 punten op week 36: 4mg baricitinib: 37.8%, Placebo: 5.1% In BRAVE-AA1, het verschil tussen 4mg baricitinib en placebo was 30 percentage punten (95% CI, 22.6-39; P<0.001) In BRAVE-AA2, het verschil tussen 4mg baricitinib en placebo was 32.8 percentage punten (95% CI, 24.4-42.3; P<0.001) |
⨁⨁⨁◯ |
|
|
Safety |
|||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
zeer ernstiga,b |
niet ernstig |
niet gevonden |
Adverse events that emerged or worsened dur[1]ing the treatment period were reported in 167 of 280 patients (59.6%) with 4-mg baricitinib and 97 of 189 (51.3%) with placebo in BRAVE-AA1 and in 154 of 233 patients (66.1%) and 97 of 154 (63.0%), respectively, in BRAVE-AA2 . |
⨁⨁◯◯ |
|
Explanations
a. Het is onduidelijk of deze methode geschikt is om antwoord te geven op de uitgangsvraag.
b. Investigators assessed most events as being mild or moderate in severity, but there was no independent adjudication of severity and no scale or measure for severity in the protocols
|
Artikel |
Reden van exclusie |
|
Bandeira (2022) |
Geen vergelijkend onderzoek |
|
Zhang (2022) |
Voldoet niet aan inclusiecriteria |
|
Benton (2021) |
Overzichtsartikel |
|
Eisman (2021) |
Voldoet niet aan PICO (interventie) |
|
Al Sayed Mahgoob (2021) |
Geen vergelijkend onderzoek |
|
Kumutnart (2021) |
Geen vergelijkend onderzoek |
|
AlMarzoug (2021) |
Voldoet niet aan PICO |
|
Chinmanat (2021) |
Overzichtsartikel |
|
Ghandi (2021 1) |
Geen vergelijkend onderzoek |
|
Cruciani (2021) |
Conference abstract |
|
Al Bazzal (2021) |
Voldoet niet aan PICO / te kleine studiepopulatie |
|
Behrangi (2021) |
Bevat geen nieuw vergelijkend onderzoek |
|
King (2021) |
Voldoet niet aan inclusiecriteria |
|
Abedini (2021) |
Geen vergelijkend onderzoek |
|
Guttman-Yassky (2021 2) |
Zelfde populatie als King 2020 |
|
Hamdino (2021) |
Voldoet niet aan de PICO |
|
Stefanaki (2021) |
Geen vergelijkend onderzoek |
|
Husein-ElAhmed (2021) |
SR zonder goede verantwoording voor geïncludeerde studies |
|
Fukumoto (2021) |
Voldoet niet aan PICO |
|
Roohaninasab (2020) |
Geen vergelijkend onderzoek |
|
King (2020) |
BRAVE-AA1 studie à in King 2022 zit BRAVE-AA1 + BRAVE-AA2 |
|
Hamilton (2020) |
Overzichtsartikel |
|
Hedge (2020) |
Opgenomen in Meznerics (2022) |
|
Muhaidat (2020) |
Vergelijkt alleen doseringen van TCA, geen andere controlegroep |
|
Leong (2020) |
Geen vergelijkend onderzoek |
|
Fawzy (2020) |
Opgenomen in Meznerics (2022) |
|
Kapoor (2020) |
Opgenomen in Meznerics (2022) |
|
Barton (2020) |
Bevat geen vergelijkend onderzoek, primaire studies gecontroleerd |
|
Waśkiel-Burnat (2020) |
Geen nieuwe vergelijkende studies |
|
Lai (2020) |
Voldoet niet aan PICO |
|
Rinaldi (2020) |
Voldoet niet aan PICO |
|
Balakrishnan (2020) |
Opgenomen in Meznerics (2022) |
|
Yu (2019) |
Voldoet niet aan inclusiecriteria |
|
Marchitto (2019) |
SR, primaire artikelen bekeken, voldoet één aan |
|
Wai Yun Lai (2019) |
Zelfde populatie als Wai Yun Lai 2018 |
|
Tkachenko (2019) |
bevat geen nieuwe vergelijkingen (één primair artikel ook in onze eigen search) |
|
de Oliveira (2019) |
Narrative review |
|
Hesseler (2019) |
Systematic review: Shumez: is uit 2015 (recentere SR) El taieb: andere vergelijking |
|
Guo (2019) |
Voldoet niet aan inclusiecriteria |
|
El Taieb (2019) |
Voldoet niet aan PICO (narraw band UVB therapie). |
|
Sung (2019) |
Geen volledige tekst beschikbaar |
|
Crowley (2019) |
Narrative review/overzichtsartikel |
|
Tran Thi Van (2019) |
Geen vergelijkend onderzoek |
|
Rinaldi (2018) |
Voldoet niet aan PICO (interventie) |
|
Wu (2018) |
Niet vergelijkend onderzoek |
|
Shin (2018) |
Voldoet niet aan inclusiecriteria |
|
Phan (2018 1) |
tofacitinib in NL niet beschikbaar en recenter onderzoek is beschikbaar over andere Jaki’s: - Winnette (2022) - King (2020-2) |
|
Solam (2018) |
Twijfel -> indien beter onderzoek beschikbaar deze wellicht excluderen. |
|
Kutlubay (2018) |
Niet vergelijkend onderzoek |
|
Phan (2018 2) |
Niet vergelijkend onderzoek |
|
Almutairi (2018) |
Voldoet niet aan inclusiecriteria |
|
Zerbinati (2017) |
Voldoet niet aan inclusiecriteria |
|
Albalat (2017) |
Voldoet niet aan PICO (vergelijkingen met interventies die niet in de PICO zitten). |
|
Sriphojanart (2017) |
Zit in: Meznerics (2022) |
|
Nowicka (2017) |
Voldoet niet aan PICO |
|
Özdemir (2017) |
Te kleine studiepopulaite |
|
Shreberk-Hassidim (2017) |
SR, bevat geen vergelijkend onderzoek. |
|
Kennedy Crispin (2016) |
Geen vergelijkend onderzoek |
|
Lee (2016) |
Geen vergelijkend onderzoek |
|
Kaur (2016) |
Voldoet niet aan de PICO (interventie) |
|
Yoshimasu (2016) |
Voldoet niet aan de PICO (interventie) |
|
Lalosevic (2015) |
Niet vergelijkend onderzoek |
|
Devi (2015) |
Geen volledige tekst beschikbaar |
|
Hordinsky (2014) |
Overzichtsartikel |
|
Sardesai (2013) |
Te kleine studiepopulatie |
|
Trink (2013) |
Opgenomen in Meznerics (2022) |
|
Ucak (2011) |
Voldoet niet aan de PICO |
|
Ohlmeier (2011) |
Voldoet niet aan de PICO |
|
Narahari (2010) |
Geen volledige tekst beschikbaar |
|
Das (2010) |
Voldoet niet aan de PICO |
|
Chartaux (2010) |
Taal – frans |
|
Beom Joon Kim (2008) |
Geen vergelijkend onderzoek |
|
Delamere (2008) |
Recentere SR beschikbaar |
|
Sasmaz (2005) |
Voldoet niet aan de PICO (intereventie) |
|
Dall'Oglio (2005) |
Voldoet niet aan de PICO (intereventie) |
|
Charuwichitratana (2000) |
Comment |
|
Ro (1995) |
Voldoet niet aan de PICO (interventie) |
|
Olsen (1992) |
Onduidelijk resultaten en follow-up tijd |
|
van der Steen (1991) |
Vergelijking onvoldoende beschreven, onbekend na hoeveel tijd patiënten overgingen naar gehele hoofd behandeling |
|
Price (1987) |
Voldoet niet aan PICO (interventie) |
|
Price (1987 2) |
Voldoet niet aan PICO (interventie |
|
Tosti (1986) |
Geen goede vergelijking gemaakt, niet vanaf baseline gekeken |
|
Valsecchi (1986) |
Geen volledige tekst beschikbaar |
|
Fenton (1983) |
Te kleine studiepopulatie |
‘Referentie’ check: (SR waarvan primaire artikelen zijn geïncludeerd, SR zelf geëxcludeerd)
|
Barton 2020 |
||
|
Jung 2017 |
Exclusie |
Correspondentie |
|
Camacho 1999 |
Exclusie |
Originele artikel niet te vinden + voldoet niet aan PICO |
|
Fukumoto 2021 |
||
|
Almutairi 2019 |
Exclusie |
Zit in onze search. |
|
Aman 2010 |
Exclusie |
Referentie niet te vinden in artikel |
|
Bokhari 2018 |
Exclusie |
Referentie niet te vinden in artikel |
|
Charuwichitratanaa 2000 |
Exclusie |
Referentie niet te vinden in artikel |
|
e-Prost 1986 |
Exclusie |
Referentie niet te vinden in artikel |
|
Devi 2015 |
Exclusie |
Zit in onze search |
|
El-Ashmawy 2018 |
Exclusie |
Referentie niet te vinden in artikel |
|
El-Mofty 2015 |
Exclusie |
Voldoet niet aan PICO |
|
El-Taieb 2017 |
Exclusie |
Referentie niet te vinden in artikel |
|
El-Taweel 2019 |
Exclusie |
Voldoet niet aan PICO |
|
Fenton 1983 |
Exclusie |
Zit in onze search |
|
Fransway 1988 |
Exclusie |
Referentie niet te vinden in artikel |
|
Georgala 2006 |
Exclusie |
Voldoet niet aan PICO |
|
Gupta 2019 |
Exclusie |
Zit in onze search |
|
Guttman-Yassky 2018 |
Exclusie |
Zit in onze search |
|
Hay 1998 |
Exclusie |
Voldoet niet aan PICO |
|
Hossain 2015 |
Exclusie |
Referentie niet te vinden in artikel |
|
Jaiswal 2018 |
Exclusie |
Voldoet niet aan PICO |
|
Jalali 2014 |
Exclusie |
Voldoet niet aan PICO |
|
Khoury 1992 |
Exclusie |
Referentie niet te vinden in artikel |
|
Kuldeep (2011) |
Exclusie |
Zit in onze search |
|
Lai 2019 |
Exclusie |
Zit in onze search (exclusie voldoet niet aan PICO) |
|
Mehta 2011 |
Exclusie |
Voldoet niet aan PICO |
|
Mikhaylov 2019 |
Exclusie |
Voldoet niet aan PICO |
|
Perini 1994 |
Exclusie |
Voldoet niet aan PICO |
|
Pipoli 1995 |
Exclusie |
Voldoet niet aan PICO |
|
Price 2008 |
Exclusie |
Voldoet niet aan PICO |
|
Price_1987A |
Exclusie |
Zit in onze search |
|
Price_1987B |
Exclusie |
Zit in onze search |
|
Rinaldi 2019 |
Exclusie |
Zit in onze search |
|
Rongioletti 1992 |
Exclusie |
Voldoet niet aan PICO |
|
Ross 2005 |
Exclusie |
Referentie niet te vinden in artikel |
|
Sardesai 2012 |
Exclusie |
Zit in onze search |
|
Sasmaz 2005 |
Exclusie |
Voldoet niet aan PICO |
|
Shapiro 1993 |
Exclusie |
Referentie niet te vinden in artikel |
|
Strober 2009 |
Exclusie |
Voldoet niet aan PICO |
|
Swanson 1981 |
Exclusie |
Voldoet niet aan PICO |
|
Talpur 2009 |
Exclusie |
Voldoet niet aan PICO |
|
Thuangtong 2012 |
Exclusie |
Voldoet niet aan PICO |
|
Tiwary 2016 |
Exclusie |
Voldoet niet aan PICO |
|
Tosti 2006 |
Exclusie |
Zit in onze search |
|
Tosti 1991 |
Exclusie |
Voldoet niet aan PICO |
|
Trink 2013 |
Exclusie |
Zit in onze search |
|
Ustuner 2017 |
Exclusie |
Zit in onze search |
|
Vestey 1986 |
Exclusie |
Referentie niet te vinden in artikel |
|
Warin 1979 |
Exclusie |
Voldoet niet aan PICO |
|
White 1985 |
Exclusie |
Voldoet niet aan PICO (3% minoxidil) |
|
Xue 2018 |
Exclusie |
Voldoet niet aan PICO |
|
Yang 2013 |
Exclusie |
Voldoet niet aan PICO |
|
Yang 2012 |
Exclusie |
Voldoet niet aan PICO |
|
Zaher 2015 |
Exclusie |
Zit in onze search |
|
Zaib 2017 |
Exclusie |
Referentie niet te vinden in artikel |
|
Hesseler (2019) |
||
|
Trink 2013 |
Exclusie |
Zit in onze search |
|
Shumez 2015 |
exclusie |
Recentere SR beschikbaar |
|
El Taieb 2017 |
Exclusie |
Zit in onze search |
|
Marchitto (2019) |
||
|
El Taieb 2017 |
Exclusie |
Zit in onze search |
|
Shumez 2015 |
Inclusie |
Zie bovenstaand. |
|
Trink 2013 |
Exclusie |
Zit in onze search |
|
Khan 2016 |
Exclusie |
N = 20 |
|
Singh 2015 |
Exclusie |
N = 20 |
|
D’Ovidio 2014 |
Exclusie |
N = 25 |
|
De Vasconcelos 2016 |
Exclusie |
N = 1 |
|
Donovan 2015 |
Exclusie |
N = 1 |
|
Mubki 2016 |
Exclusie |
N = 1 |
|
Bissonnette 2000 |
Exclusie |
N = 6 |
|
Calzavara-Pinton 2013 |
Exclusie |
N = 7 AA |
|
Fernández-Guarino 2008 |
Exclusie |
N = 5 AA |
|
Lee 2010 |
Exclusie |
N = 1 AA |
|
Kaur 2015 |
Exclusie |
Voldoet niet aan PICO (UVB therapie) |
|
Bayramgürler 2011 |
Exclusie |
Voldoet niet aan PICO |
|
Jury 2006 |
Exclusie |
Voldoet niet aan PICO |
|
Herz-Ruelas 2017 |
Exclusie |
Voldoet niet aan PICO |
|
Kamel 2011 |
Exclusie |
Voldoet niet aan PICO (PUVA) |
|
Broniarczyk-Dyla 2006 |
Exclusie |
Voldoet niet aan PICO |
|
Mohamed 2005 |
Exclusie |
Voldoet niet aan PICO |
|
Alabdulkareem 1996 |
Exclusie |
Voldoet niet aan PICO |
|
Park 2013 |
Exclusie |
Voldoet niet aan PICO |
|
Açikgöz 2013 |
Exclusie |
Voldoet niet aan PICO |
|
Sahin 1998 |
Exclusie |
Voldoet niet aan PICO |
|
Taylor 1995 |
Exclusie |
Voldoet niet aan PICO |
|
Healy 1993 |
Exclusie |
Voldoet niet aan PICO |
|
Singla 1991 |
Exclusie |
Voldoet niet aan PICO |
|
Behrens-Williams 2001 |
Exclusie |
Voldoet niet aan PICO |
|
Yamazaki 2003 |
Exclusie |
Voldoet niet aan PICO |
|
Waiz 2006 |
Exclusie |
Voldoet niet aan PICO |
|
Yalici-Armagan 2016 |
Exclusie |
Voldoet niet aan PICO |
|
Eckert 2016 |
Exclusie |
Voldoet niet aan PICO |
|
Issa 2015 |
Exclusie |
Voldoet niet aan PICO |
|
Tsai 2016 |
Exclusie |
Voldoet niet aan PICO |
|
Yoo 2009 |
Exclusie |
Voldoet niet aan PICO |
|
Zakaria 2004 |
Exclusie |
Voldoet niet aan PICO |
|
Aubin 2005 |
Exclusie |
Voldoet niet aan PICO |
|
Al-Mutairi 2007 |
Exclusie |
Voldoet niet aan PICO |
|
Al-Mutairi 2009 |
Exclusie |
Voldoet niet aan PICO |
|
Nisticò 2009 |
Exclusie |
Voldoet niet aan PICO |
|
Ohtsuki 2013 |
Exclusie |
Voldoet niet aan PICO |
|
Ohsuki 2010 |
Exclusie |
Voldoet niet aan PICO |
|
Byun 2015 |
Exclusie |
Voldoet niet aan PICO |
|
Gencoglan 2010 |
Exclusie |
Voldoet niet aan PICO |
|
Fenniche 2018 |
Exclusie |
Voldoet niet aan PICO |
|
Roohaninasab (2020) |
||
|
Rahul 2019 |
Inclusie |
Te kleine steekproef |
|
Satyendra Kumar Singh 2020 |
Exclusie |
Voldoet niet aan PICO |
|
Gentile 2019 |
Exclusie |
Voldoet niet aan PICO |
|
Fayed 2018 |
exclusie |
Volledige tekst niet beschikbaar |
|
Razooqi Al-aajem 2018 |
Exclusie |
Voldoet niet aan PICO |
|
Behrangi 2019 |
Exclusie |
Voldoet niet aan PICO |
|
Singh 2015 |
Exclusie |
Te kleine steekproef |
|
Rossana 2015 |
Exclusie |
Voldoet niet aan PICO |
|
Tkachenko 2019 |
||
|
Hajheydari 2007 |
Inclusie |
Zit in onze search |
|
Rest van de artikelen |
Exclusie |
Voldoen niet aan PICO |
|
Delamere (2008) |
||
|
Bissonnette 2000 |
Exclusie |
Voldoet niet aan PICO (I) |
|
Charuwichitratana |
exclusie |
comment |
|
Galbraith 1987 |
Exclusie |
Voldoet niet aan PICO (I) |
|
Khoury 1992 |
Exclusie |
N = 20 |
|
Mancuso 2003 |
- |
Zit in eigen search |
|
Nelson 1994 |
Exclusie |
N = 14, twijfel I |
|
Perini 1994 |
Exclusie |
Voldoet niet aan PICO |
|
Pipoli 1995 |
Exclusie |
Voldoet niet aan PICO |
|
Price 1987a |
- |
Zit in eigen search |
|
Price 1987b |
- |
Zit in eigen search |
|
Rongioletti 1992 |
Exclusie |
Voldoet niet aan PICO |
|
Ross 2005 |
Exclusie |
Twijfel vergelijkend + N=8 |
|
Shapiro 1993 |
Exclusie |
N = 13 |
|
Tosti 1991 |
Exclusie |
Voldoet niet aan PICO |
|
Tosti 2005 |
- |
Zit in eigen search |
|
White 1985 |
Exclusie |
Minoxidil 3% + N=12 |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 05-09-2024
Beoordeeld op geldigheid : 16-05-2024
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep grotendeels in stand gehouden. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update).
De Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV) is regiehouder van deze richtlijn actinische keratose en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Tabel Overzicht betrokken partijen ontwikkeling richtlijn Alopecia areata 2024
|
Overzicht betrokken partijen richtlijn Alopecia areata 2024 |
Zitting neming in werkgroep |
Knelpunten analyse |
Commentaarfase |
Autorisatie |
Opmerkingen |
|
Wetenschappelijke verenigingen |
|||||
|
Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV) |
X |
X |
X |
X |
|
|
Nederlandse Internisten Vereniging (NIV) |
X |
X |
X |
X |
|
|
Nederlandse Vereniging voor Kindergeneeskunde (NVK) |
|
X |
X |
X |
|
|
Overige organisaties |
|
|
|
|
|
|
Nederlandse Vereniging Huidtherapeuten (NVH) |
X |
X |
X |
X |
|
|
Verpleegkundigen & Verzorgenden Nederland (V&VN) |
|
|
X |
X |
|
|
Nederlandse Associatie Physician Assistants (NAPA) |
X |
|
X |
X |
|
|
Nederlands Huisartsen Genootschap (NHG) |
|
|
X |
X |
|
|
Patiëntenverenigingen |
|||||
|
Alopecia Vereniging |
X |
|
X |
X |
|
|
Huid Nederland (HN) |
|
X |
X |
X |
|
|
Stakeholders |
|||||
|
Nederlandse Vereniging Ziekenhuizen (NVZ) |
|
|
X |
|
|
|
Nederlandse Federatie van Universitair Medische Centra (NFU) |
|
|
|
|
|
|
Zelfstandige klinieken Nederland (ZKN) |
|
|
|
|
|
|
Zorgverzekeraars Nederland (ZN) |
|
|
|
|
|
|
Zorginstituut Nederland (ZiN) |
|
|
|
|
|
|
Vereniging Innovatieve Geneesmiddelen (VIG) |
|
|
X |
|
|
|
Inspectie Gezondheidszorg en Jeugd (IGJ) |
|
|
|
|
|
|
Nederlandse Vereniging voor Ziekenhuis Apothekers (NVZA) |
|
|
|
|
|
*alle partijen werden uitgenodigd voor de knelpuntenanalyse (invitational conference) en de commentaarfase.
Deelname aan de werkgroep en autorisatie wordt enkel aan de wetenschappelijke verenigingen, patiëntenverenigingen en overige organisaties voorgelegd.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn werd een multidisciplinaire werkgroep ingesteld. Bij het samenstellen van de werkgroep werd rekening gehouden met de geografische spreiding van de werkgroepleden en met een evenredige vertegenwoordiging van academische en niet-academische achtergrond. De werkgroepleden hebben onafhankelijk gehandeld en geen enkel lid ontving gunsten met het doel de richtlijnen te beïnvloeden. Naast de afgevaardigden van de verschillende beroepsgroepen is er ook een patiëntenvertegenwoordiger betrokken geweest bij de ontwikkeling van de richtlijn.
|
Werkgroepleden – richtlijnontwikkeling 2024 |
Vereniging |
|
Petra Dikrama (dermatoloog) |
NVDV |
|
Tristan van Dongen (dermatoloog) |
NVDV |
|
Alexander Lokin (dermatoloog) |
NVDV |
|
Marlies de graaf (dermatoloog) |
NVDV |
|
Patrick Kemperman (dermatoloog) |
NVDV |
|
Barbara Horvath (dermatoloog) |
NVDV |
|
Marja Oldhoff (dermatoloog) |
NVDV |
|
Ilse Bakker (AIOS dermatologie) |
NVDV |
|
Bashar Razoki (AIOS dermatologie) – vanaf februari 2023 |
NVDV |
|
Zana Brkic (internist) |
NIV |
|
Meike Jutten (physician assistant) |
NAPA |
|
Karlijn Sterkenburg (huidtherapeut) |
NVH |
|
Caroline Vos (patiëntvertegenwoordiger) |
Alopecia Vereniging |
|
Ondersteuning werkgroep |
Vereniging |
|
Carin Smit (arts-onderzoeker) – Januari 2023 t/m mei 2024 |
NVDV |
|
Ayla de Waal (arts-onderzoeker) – April 2022 t/m december 2022 |
NVDV |
|
Esther van Veen (arts-onderzoeker) – Mei 2021 t/m april 2022 |
NVDV |
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u hieronder.
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van de Nederlandse Vereniging voor Dermatologie en Venereologie.
|
Werkgroep-lid |
Namens |
Hoofdfunctie |
Neven-functies |
Persoonlijke financiële belangen, Persoonlijke relaties, Reputatie management |
Extern gefinancierd onderzoek |
Overige belangen |
Getekend op |
Acties |
|
Petra Dikrama (voorzitter) |
NVDV |
Dermatoloog Erasmus MC Rotterdam (0,65 fte) Onderwijs coördinator Erasmus MC Rotterdam (0,05 fte) |
Dermatoloog Bodyclinic Amsterdam, (injectables) betaald
|
Geen, echter ik superviseer wel een haar-poli in het Erasmusmc en wordt wel eens gevraagd om te spreken voor de alopecia patientenvereniging (onbetaald) |
Geen |
Geen |
21-08-2020 |
|
|
Marlies de Graaf |
NVDV |
Dermatoloog, met aandachtsgebied kinderen (kinderdermatoloog) Universitair Medisch Centrum Utrecht |
NVT |
Geen |
Ik neem deel aan onderzoek met JAK remmers bij de behandeling van constitutioneel eczeem. |
Geen |
03-01-2022 |
|
|
Patrick Kemperman |
NVDV |
Dermatoloog Amsterdam UMC en Dijklander ziekenhuis |
NVT |
Geen |
Geen |
Geen |
28-10-2021 |
|
|
Tristan van Dongen |
NVDV |
Arts in opleiding tot dermatoloog, Erasmus MC, Rotterdam |
NVT |
Geen |
Geen |
Geen |
07-01-2022 |
|
|
Barbara Horvath |
NVDV |
Afdelingshoofd dermatologie, Universitair Medisch Centrum Groningen |
Onbetaald: Medisch adviseur van Hidradenitis patiëntenvereniging en van Pemphigus pemfigoïd Netwerk Nederland, Associate Editor the British Journal of Dermatology, Board member ERN-SKIN, Member EADV taskforces on Autoimmune Blistering Diseases, Member EADV taskforces on Acne, Rosacea and Hidradenitis, Lid NVDV domeingroep inflammatoire dermatosen, lid NVDV commissie Dure geneesmiddelen |
Alle fees betaald aan het UMCG: On topics: Blaarziekten, hidradenitis, Acne - Janssen-Cilag: advisory boards, educational grants, consultations, investigator initiative studies, multicenterstudies - AbbVie: aDvisory boards, educational grants, consultations, investigator initiative studies, multicenter studies - Novartis: Advisory boards, consultations, Multicenter studies, investigator initiative studies - UCB Pharma: Advisory boards, consultations - Leo Pharma: Consultations - Solenne B.V.: Investigator Initiative Studies - Celgene: Consultations, Investigator Initiative Studies - Akari therapeutics: Consultations, investigator initiative studies - Philips: consultation - Regeneron: consultation - Sanofi: consultation |
NVT in verband met de inhoud van deze richtlijn |
Geen |
01-12-2021 |
|
|
Marja Oldhoff |
NVDV |
Dermatoloog, opleider UMCG |
NVT |
Geen |
Geen |
Geen |
03-01-2022 |
|
|
Alexander Lokin |
NVDV |
AIOS dermatologie, Amsterdam UMC |
Lid patiëntenvoorlichtingscommissie NVDV, Lid werkgroep Richtlijn Chronische Jeuk NVDV, onbetaald |
Geen |
Geen |
Geen |
30-11-2021 |
|
|
Zana Brkic |
NIV |
Internist-allergoloog/klinisch immunoloog Erasmus Medisch Centrum |
NVT |
Geen |
Geen |
Geen |
03-12-2021 |
|
|
Caroline Vos |
Alopecia Vereniging |
Vertegenwoordiger patientvereniging. In het dagelijks leven gynaecoloog in het ETZ. |
Geen betaalde nevenwerkzaamheden behoudens gastlessen als gynaecoloog in bachelorcursus Seksuologie voor psychologen UvT. Eerder meegeschreven aan de richtlijn vulvodynie en Medische leidraad zorg voor vrouwen en meisjes na VGV. Actief in medische adviesraad bekkenbodem4all. Diverse onderzoeksactiviteiten naar leefstijl bij baarmoederkanker en keuzehulpen bij verzakkingen |
Persoonlijke relaties: als patiënt vanzelfsprekend zelf |
Geen |
Geen |
11-01-2022 |
|
|
Meike Jutten |
NAPA |
Physician Assistent Maurits Kliniek |
NVT |
Geen |
Geen |
Geen |
18-02-2022 |
|
|
Karlijn Sterkenburg |
NVH |
Beleidsmedewerker Onderzoek en Kwaliteit bij de Nederlandse Vereniging van Huidtherapeuten |
Projectlid Eczeemvriendelijk Veenendaal |
Geen |
Geen |
Geen |
28-06-2022 |
|
|
Ilse Bakker |
NVDV |
AIOS Dermatologie UMCG |
NVT |
Geen |
Geen |
Geen |
19-12-2022 |
|
Inbreng patiëntenperspectief
Er is aandacht besteed aan het patiëntenperspectief door de zitting neming van een patiëntvertegenwoordiger in de werkgroep en de opname van een stuk over samen beslissen in de algemene inleiding van de richtlijn. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Alopecia Vereniging en Huid Nederland.
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (gebaseerd op het stroomschema ontwikkeld door FMS).
Uit de kwalitatieve raming blijkt dat er à beoordeling volgt.
|
Module |
Uitkomst Raming |
Toelichting |
|
Medicamenteuze behandeling bij volwassenen |
Geen substantiële financiële gevolgen* |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (5.000-40.000 patiënten), volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen financiële gevolgen verwacht. |
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn(module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. De richtlijn wordt via het internet verspreid onder alle relevante beroepsgroepen en ziekenhuizen en er zal in verschillende specifieke vaktijdschriften aandacht worden besteed aan de richtlijn. Tevens zal een samenvatting worden gemaakt. Het volledige implementatieplan is opgenomen in het bijlagedocument.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Onderstaand is de methode stapsgewijs beschreven.
Knelpuntenanalyse
In de voorbereidingsfase heeft een bijeenkomst plaatsgevonden waarvoor alle belanghebbenden zijn uitgenodigd. In deze bijeenkomst zijn knelpunten aangedragen door de werkgroepleden; NVDV, NIV, NVK, NAPA, NVH en de Alopecia Vereniging. Tevens werden uitgenodigd Zorgverzekeraars Nederland (ZN), Nederlandse Vereniging Ziekenhuizen (NVZ), Zorginstituut Nederland (ZiNL), Vereniging Innovatieve Geneesmiddelen (VIG) en de Nederlandse Federatie van Universitair Medische Centra (NFU).
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse heeft de werkgroep uitgangsvragen opgesteld. Daarbij inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen en consultatie van experts. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. Literatuur is geselecteerd op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in bijlage 4.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen zijn overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs (2021)
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog
|
|
|
Redelijk
|
|
|
Laag
|
|
|
Zeer laag
|
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008) en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
C) Voor vragen over de waarde van meet- of classificatie-instrumenten (klinimetrie)
Deze instrumenten werden beoordeeld op validiteit, intra- (test-hertest) en inter-beoordelaarsbetrouwbaarheid, responsiviteit (alleen bij meetinstrumenten) en bruikbaarheid in de praktijk. (naar keuze: optie-1 ‘Bij ontbreken van een gouden standaard, werd een beoordeling van de bewijskracht van literatuurconclusies achterwege gelaten.’ Of optie-2 ‘De kracht van het wetenschappelijk bewijs werd bepaald met de generieke GRADE-methode’).
Beoordelen van het niveau van het wetenschappelijke bewijs (oude modules)
Bij de EBRO-methode (Evidence Based Richtlijn Ontwikkeling) wordt een andere classificatie voor de beoordeling van de kwaliteit van studies aangehouden (van Everdingen 2004). Hierbij ligt de belangrijkheid van de uitkomstmaten niet van tevoren vast en is er geen vastgelegde procedure voor upgraden en downgraden van bewijs, zoals die bij GRADE geldt.
|
Kwaliteit |
Interventie |
Diagnostisch accuratesse-onderzoek |
Schade/bijwerkingen*, etiologie, prognose |
|
A1 |
Systematische review van ten minste twee onafhankelijk van elkaar uitgevoerde onderzoeken van A2-niveau |
||
|
A2 |
Gerandomiseerd dubbelblind vergelijkend klinisch onderzoek van goede kwaliteit van voldoende omvang |
Onderzoek ten opzichte van een referentietest (een ‘gouden standaard’) met tevoren gedefinieerde afkapwaarden en onafhankelijke beoordeling van de resultaten van test en gouden standaard, betreffende een voldoende grote serie van opeenvolgende patiënten die allen de index- en referentietest hebben gehad |
Prospectief cohortonderzoek van voldoende omvang en follow-up, waarbij adequaat gecontroleerd is voor ‘confounding’ en selectieve follow-up voldoende is uitgesloten. |
|
B |
Vergelijkend onderzoek, maar niet met alle kenmerken als genoemd onder A2 (hieronder valt ook patiënt-controleonderzoek, cohortonderzoek) |
|
|
|
C |
Niet-vergelijkend onderzoek |
||
|
D |
Mening van deskundigen |
||
* Deze classificatie is alleen van toepassing in situaties waarin om ethische of andere redenen gecontroleerde trials niet mogelijk zijn. Zijn die wel mogelijk dan geldt de classificatie voor interventies.
Bij het werken volgens de EBRO-methode zijn op basis van de beschikbare literatuur een of meerdere conclusies geformuleerd. Afhankelijk van het aantal onderzoeken en de mate van bewijs is een niveau van bewijskracht toegekend aan de conclusie (van Everdingen 2004).
|
Niveau |
Conclusie gebaseerd op |
|
1 |
Onderzoek van niveau A1 of ten minste 2 onafhankelijk van elkaar uitgevoerde onderzoeken van niveau A2 |
|
2 |
1 onderzoek van niveau A2 of ten minste 2 onafhankelijk van elkaar uitgevoerde onderzoeken van niveau B |
|
3 |
1 onderzoek van niveau B of C |
|
4 |
Mening van deskundigen |
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in één of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overkoepelende bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overkoepelende conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk. Door gebruik te maken van de Guideline Development Tool werd het Evidence to decision framework conform GRADE methodiek toegepast. Alle werkgroepleden hebben systematisch antwoord gegeven op vragen over de grootte van het effect en grootte van negatieve consequenties, waarden en voorkeuren van de patiënt, kosten en kosteneffectiviteit, beschikbaarheid van voorzieningen, aanvaardbaarheid, en overwegingen voor subgroepen in de patiëntenpopulatie. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg
Indicatorontwikkeling
Er werden geen indicatoren ontwikkeld voor deze richtlijn.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling beschreven (zie bijlage 10).
Juridische betekenis van richtlijnen
Richtlijnen zijn geen wettelijke voorschriften maar wetenschappelijk onderbouwde en breed gedragen inzichten en aanbevelingen waaraan zorgverleners zouden moeten voldoen om kwalitatief goede zorg te verlenen. Aangezien richtlijnen uitgaan van ‘gemiddelde patiënten’, kunnen zorgverleners in individuele gevallen zo nodig afwijken van de aanbevelingen in de richtlijn. Afwijken van richtlijnen is, als de situatie van de patiënt dat vereist, soms zelfs noodzakelijk. Een richtlijn beschrijft wat goede zorg is, ongeacht de financieringsbron (Zorgverzekeringswet (Zvw), Wet langdurige zorg (Wlz), Wet maatschappelijke ondersteuning (Wmo), aanvullende verzekering of eigen betaling door de cliënt/patiënt). Opname van een richtlijn in een register betekent dus niet noodzakelijkerwijs dat de in de richtlijn beschreven zorg verzekerde zorg is. Informatie over kosten zoals beschreven in de richtlijn is gebaseerd op beschikbare gegevens ten tijde van schrijven.
Commentaar- en autorisatiefase
De conceptrichtlijn is aan de betrokken (wetenschappelijke) verenigingen, (patiënt) organisaties en stakeholders voorgelegd ter commentaar (zie ook tabel ‘Overzicht betrokken partijen ontwikkeling richtlijn Alopecia areata 2024’). De commentaren zijn verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren is de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn is aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter autorisatie.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Higgins JPT, Green S (editors). Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0 [updated March 2011]. The Cochrane Collaboration, 2011. Available from www.handbook.cochrane.org.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit.. Online beschikbaar op http://richtlijnendatabase.nl/ Laatst geraadpleegd op [DATUM geraadpleegd voor concepttekst]
Van Everdingen JJE, Burgers JS, Assendelft WJJ, et al. Evidence-based richtlijnontwikkeling. Bohn Stafleu Van Loghum 2004.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html
Zoekverantwoording
Voor alle hoofdstukken geldt dat de zoekstrategieën zijn uitgevoerd in de Medline database. Enkel de keywords gebruikt in de Medline database zijn weergeven. De search is geüpdatet tot 6 september 2022.
De zoekactie is met behulp van de PICO-systematiek opgebouwd. De zoekvragen hebben de P als gemeenschappelijke onderdeel. De overige onderdelen van de PICO werden geformuleerd op basis van de uitgangsvraag.
P Kinderen/Volwassenen alopecia areata
I Lokale therapieën, intralesionale therapieën, systemische therapieën (zie onderstaand)
C Andere behandeling, geen behandeling, placebo
O Zie uitkomstmaten
Interventies:
|
Lokale therapie |
Intralaesionale therapie |
Systemische therapie |
|
|
|
Inclusiecritera
- Vergelijkend onderzoek (n>30)
- Uitkomstmaten worden gemeten na tenminste 3 maanden, maar bij voorkeur na 6 maanden of 1 jaar
- Controlegroep: placebo, andere behandeling of geen behandeling (kanttekening:
natuurlijk beloop) - Een patiënt mag diens eigen controle zijn (ook wel beschreven als ‘half head’)
- Niet vergelijkend onderzoek wordt op hoofdlijnen beschreven als er geen RCT’s zijn, geen analyse middels GRADE.
Exclusiecriteria
- Interventies die niet in Nederland beschikbaar zijn of weinig toegepast worden: tofactinib, brepocitinib en CTP-543
- Studies waarin verschillende dosis of behandelfrequenties zijn onderzocht (zonder controle groep)
- Studies waarbij behandeling van alopecia areata in aanwezigheid van een comorbiditeit onderzocht werd.
Uitgangsvragen
- Hoe kan alopecia areata bij kinderen worden behandeld?
a. In het geval van milde alopecia areata (<50% haarverlies)
b. In het geval van ernstige alopecia areata (>50% haarverlies) - Hoe kan alopecia areata bij volwassenen worden behandeld?
a. In het geval van milde alopecia areata (<50% haarverlies)
b. In het geval van ernstige alopecia areata (>50% haarverlies)
MEDLINE (datum 06-09-2022)
|
ID |
Search |
hits |
|
#3 |
#1 AND #2 |
990 |
|
#2 |
"Anthralin"[Mesh] OR "Prednisone"[Mesh] OR "Fumarates"[Mesh] OR "Methotrexate"[Mesh] OR "Cyclosporine"[Mesh] OR "Mycophenolic Acid"[Mesh] OR "Azathioprine"[Mesh] OR "Janus Kinase Inhibitors"[Mesh] OR "dupilumab" [Supplementary Concept] OR "Dexamethasone"[Mesh] OR "Triamcinolone Acetonide"[Mesh] OR "Platelet-Rich Plasma"[Mesh] OR "Mesotherapy"[Mesh] OR topical corticosteroid* [tiab] OR topical steroid* [tiab] OR protopic [tiab] OR topical tacrolimus [tiab] OR topical minoxidil [tiab] OR calcipotriol betamethasone [tiab] OR calcitriol [tiab] OR calcipotriol [tiab] OR diphencypron* [tiab] OR DPCP [tiab] OR diphenylcyclopropenon* [tiab] OR topical immunotherap* [tiab] OR contact immunotherap* [tiab] OR dithranol [tiab] OR DTH [tiab] OR prostaglandin analog* [tiab] OR topical JAK inhibitor* [tiab] OR UV B comb [tiab] OR UV comb [tiab] OR garlic* [tiab] OR anthralin* [tiab] OR prednisone [tiab] OR fumaric acid ester* [tiab] OR FAE [tiab] OR methotrexate [tiab] OR MTX [tiab] OR cyclosproin* [tiab] OR CsA [tiab] OR mycophenolate acid* [tiab] OR mycophenolic acid* [tiab] OR MPA [tiab] OR cellcept [tiab] OR mycophenolate mofetil [tiab] OR MMF [tiab] OR azathioprin* [tiab] OR AZA [tiab] OR ezetimib simvastatine [tiab] OR JAKi* [tiab] OR janus kinase inhibitor* [tiab] OR JAK inhibitor* [tiab] OR dupilumab [tiab] OR dexamethasone* [tiab] OR dexamethasone oral minipulse therap* [tiab] OR triamcinolone acetonide [tiab] OR kenacort injection* [tiab] OR platelet-rich plasma [tiab] OR PRP [tiab] or mesotherap* [tiab] |
380,191 |
|
#1 |
"Alopecia Areata"[Mesh] OR alopecia areata* [tiab] OR alopecia universalis [tiab] OR alopecia totalis [tiab] OR alopecia areata incognita [tiab] OR diffuse alopecia areata [tiab] OR ophiasis alopecia [tiab] OR alopecia ophiasis [tiab] |
5563 |