Behandeling van allergie en astma bij allergie van de bovenste luchtwegen
Uitgangsvraag
Wat is de rol van behandeling van de bovenste luchtwegen op de astma regulatie bij kinderen, volwassenen en zwangere vrouwen met allergie van de bovenste luchtwegen en astma/ klachten van de lagere luchtwegen?
Aanbeveling
Behandel zowel de bovenste als de onderste luchtwegen bij patiënten met allergie van de bovenste luchtwegen en allergisch astma.
Overwegingen
De onderstaande overwegingen en aanbevelingen gelden voor het overgrote deel van de populatie waarop de uitgangsvraag betrekking heeft.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
In het kader van personalized medicine in astma wordt een behandeling van een allergie van de bovenste luchtwegen als cruciaal gezien (Agusti, 2016). Toch laat literatuur onderzoek zien dat dit met weinig evidence ondersteund wordt. Zeker als de astma behandeld is met een ICS wordt geen effect meer gezien van een behandeling van een allergie van de bovenste luchtwegen op astma symptomen.
De kwaliteit van het bewijs kan hierbij meespelen. Veel van de studies zijn gedateerd met niet gevalideerde uitkomstmaten zoals somscores van symptomen. Geen van de studies heeft gevalideerde scores als ACQ of AQLQ als uitkomstmaat gehanteerd. Daarnaast zijn het allemaal kortlopende studies en is het de vraag of een klinisch relevant verschil in astma controle in deze korte tijd bereikt kan worden.
Pathofysiologische studies laten echter zien dat er een duidelijke relatie is tussen inflammatie in de bovenste luchtwegen ten gevolge van allergie en inflammatie in de onderste luchtwegen. Er is daarom een brede expert opinion dat het belangrijk is voor een goede behandeling van astma ook de bovenste luchtwegen worden mee behandeld.
Geconcludeerd moet worden dat voor de cruciale uitkomstaten er alleen bewijs is gevonden met een lage tot zeer lage bewijskracht. Er is hier duidelijk sprake van een kennislacune.
Op basis van internationale expert opinion is één van de behandelmogelijkheden (treatable traits) in de behandeling van allergisch astma de behandeling van de bovenste luchtwegen. Deze mening wordt ondersteund door pathofysiologische studies waarbij ook een duidelijke relatie wordt gezien tussen de inflammatie in de bovenste en onderste luchtwegen. Daarom is het advies van de werkgroep dat inventarisatie en behandeling van allergie van de bovenste luchtwegen relevant is voor een goede behandeling van allergisch astma. Voor de verschillende behandelmogelijkheden voor allergie van de bovenste luchtwegen verwijzen we naar de andere modules in deze richtlijn.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Voor patiënten met een allergie van de bovenste luchtwegen en een allergisch astma is het van belang dat beide goed, onderlinge afstemming, behandeld worden. Dit zal leiden tot een lagere ziektelast en mogelijk minder gebruik van astma medicatie.
Kosten (middelenbeslag)
Patiënten met astma en allergie van de bovenste luchtwegen krijgen standaard astma medicatie voorgeschreven. De kosten voor daarnaast de behandeling van een allergie van de bovenste luchtwegen zijn beperkt en wegen niet op tegen de lagere ziektelast die een patiënt ervaart.
Aanvaardbaarheid voor de overige relevante stakeholders
De werkgroep voorziet geen bezwaar van overige relevante stakeholders voor behandeling van allergie van de bovenste luchtwegen bij patiënten met allergisch astma met als doel verlaging van de algehele ziektelast van een patiënt.
Haalbaarheid en implementatie
Optimale behandeling van een allergie van de bovenste luchtwegen bij patiënten met een allergisch astma maakt al deel uit van de dagelijkse zorgpraktijk. Veelal zijn er in de tweede lijn gecombineerde spreekuren waarbij de bovenste en onderste luchtweg problematiek gezamenlijk wordt beoordeeld door meerdere disciplines. De werkgroep voorziet dan ook geen problemen op het gebied van haalbaarheid en implementatie.
Onderbouwing
Achtergrond
Een van behandelingsmogelijkheden (treatable traits) van allergisch astma is de behandeling van een allergie van de bovenste luchtwegen. Goed behandelde bovenste luchtwegen worden als essentieel gezien voor een goede astma regulatie. Pathofysiologisch wordt dit ook ondersteund door het "united airways" model waarbij de bovenste en onderste luchtwegen als één geheel worden beschouwd. Het doel van deze PICO is een structurele ondersteuning van deze aanname door literatuur.
Conclusies / Summary of Findings
Corticosteroïden
Symptomen van astma (INCS spray versus placebo)
|
Laag GRADE |
Intranasale corticosteroïden spray vermindert mogelijk de symptomen van astma bij patiënten met astma én allergie van de bovenste luchtwegen vergeleken met placebo.
Bron: Lohia, 2012 |
Symptomen van astma (INCS spray + astma medicatie versus astma medicatie)
|
Laag GRADE |
Er is mogelijk geen verschil in symptomen van astma bij patiënten met astma én allergie van de bovenste luchtwegen tussen het gebruik van intranasale corticosteroïden spray plus astma medicatie vergeleken met astma medicatie alleen.
Bron: Lohia, 2012 |
Symptomen van astma (nasaal geïnhaleerde corticosteroïden versus placebo)
|
Zeer laag GRADE |
Het is onduidelijk of nasaal geïnhaleerde corticosteroïden effect hebben op de symptomen van astma bij patiënten met astma én allergie van de bovenste luchtwegen vergeleken met placebo.
Bron: Lohia, 2012 |
Longfunctie (FEV1) (INCS spray versus placebo)
|
Laag GRADE |
Intranasale corticosteroïden spray resulteert mogelijk in een kleine, niet klinisch relevante, verbetering van FEV1 bij patiënten met astma én allergie van de bovenste luchtwegen vergeleken met placebo.
Bron: Lohia, 2012 |
Longfunctie (FEV1) (INCS spray + astma medicatie versus astma medicatie)
|
Laag GRADE |
Intranasale corticosteroïden spray en astma medicatie in plaats van astma medicatie alleen heeft mogelijk geen effect op FEV1 bij patiënten met astma én allergie van de bovenste luchtwegen.
Bron: Lohia, 2012 |
|
- GRADE |
De klachten ten gevolge van allergie van behandeling met corticosteroïden vergeleken met placebo is onbekend bij patiënten met astma én allergie van de bovenste luchtwegen. Geen van de studies rapporteert klachten ten gevolge van allergie. |
|
- GRADE |
De bijwerkingen van behandeling met corticosteroïden vergeleken met placebo is onbekend bij patiënten met astma én allergie van de bovenste luchtwegen. Geen van de studies rapporteert klachten ten gevolge van allergie. |
Medicijngebruik (INCS spray versus placebo)
|
Laag GRADE |
Intranasale corticosteroïden spray resulteert mogelijk in een kleine, niet klinisch relevante, vermindering van het medicijngebruik bij patiënten met astma én allergie van de bovenste luchtwegen vergeleken met placebo.
Bron: Lohia, 2012 |
Medicijngebruik (INCS spray + astma medicatie versus astma medicatie)
|
Laag GRADE |
Intranasale corticosteroïden spray en astma medicatie in plaats van astma medicatie alleen heeft mogelijk geen effect op het medicijngebruik bij patiënten met astma én allergie van de bovenste luchtwegen.
Bron: Lohia, 2012 |
Medicijngebruik (nasaal geïnhaleerde corticosteroïden versus placebo)
|
Zeer Laag GRADE |
Het is onduidelijk of nasaal geïnhaleerde corticosteroïden effect hebben op het medicijngebruik bij patiënten met astma én allergie van de bovenste luchtwegen vergeleken met placebo.
Bron: Lohia, 2012 |
Conclusies antihistaminica
Symptomen van astma
|
Zeer laag GRADE |
Het is onduidelijk of antihistaminica symptomen van astma bij patiënten met astma én allergie van de bovenste luchtwegen kunnen verminderen vergeleken met placebo.
Bronnen: Aaronson, 1996; Berger, 2002 |
Longfunctie (FEV1)
|
Zeer laag GRADE |
Het is onduidelijk of antihistaminica effect hebben op FEV1 bij patiënten met astma én allergie van de bovenste luchtwegen vergeleken met placebo.
Bronnen: Aaronson, 1996 |
Overige klachten ten gevolge van allergie
|
Zeer laag GRADE |
Het is onduidelijk of antihistaminica symptomen van allergische rhinitis bij patiënten met astma én allergie van de bovenste luchtwegen kunnen verminderen vergeleken met placebo.
Bronnen: Aaronson, 1996; Berger, 2002 |
Medicijngebruik
|
Zeer laag GRADE |
Het is onduidelijk of antihistaminica effect hebben op het medicijngebruik bij patiënten met astma én allergie van de bovenste luchtwegen vergeleken met placebo.
Bronnen: Aaronson, 1996; Berger, 2002 |
Bijwerkingen
|
Zeer laag GRADE |
Het is onduidelijk of het gebruik van antihistaminica tot meer bijwerkingen leidt bij patiënten met astma én allergie van de bovenste luchtwegen dan een placebo.
Bronnen: Aaronson, 1996; Berger, 2002 |
Samenvatting literatuur
Beschrijving studies
Nasale corticosteroïden
In de review van Lohia (2012) is gekeken naar het effect van intranasale corticosteroïden (INCS) op astma-uitkomsten bij patiënten met een allergie van de bovenste luchtwegen en astma. Er is gezocht tot mei 2012. De search werd niet beperkt op taal. Artikelen werden geïncludeerd wanneer het RCT’s (Randomized Controlled Trials) betroffen. Gedetailleerde inclusiecriteria zijn opgenomen in de evidence-tabel. De review includeerde 18 studies, die allemaal voldoen aan de geformuleerde PICO van deze module. Studies includeerden in totaal 2162 patiënten, waarvan 1659 patiënten tot het eind van de follow-up deelnamen. Studies includeerden zowel kinderen als volwassenen. Type en dosering van INCS en de manier van toediening verschilde tussen de studies. Details zijn terug te vinden in de evidencetabel. De volgende door de review gerapporteerde uitkomstmaten worden meegenomen in de systematische literatuuranalyse: volume uitgeblazen in de eerste seconde van de geforceerde vitale capaciteit test (FEV1), astmasymptomen en medicijngebruik. De Risk of Bias werd beoordeeld aan de hand van de Cochrane ‘Risk of bias’ tool. De auteurs vermeldden dat de geïncludeerde studies over het algemeen een lage risk of bias hebben.
Antihistaminica
In de dubbel geblindeerde RCT van Aaronson (1996) is gekeken naar het effect van cetirizine op astma- en rhinitisuitkomsten bij patiënten met allergie van de bovenste luchtwegen en milde tot matige astma. Gedetailleerde in- en exclusiecriteria zijn opgenomen in de evidencetabel. Aaronson (1996) includeerde 28 patiënten, waarvan 13 (46%) vrouwen en 15 (54%) mannen. De gemiddelde leeftijd was 29,7 (range 13,3 tot 59,1) jaar. De interventiegroep nam gedurende 26 weken, iedere avond na de peak flow meting, 20 mg cetirizine in. De controlegroep ontving een placebo, maar de studie rapporteerde niet wat voor placebo gegeven werd. Indien nodig werd het gebruik van alleen Salbutamol toegestaan (geen ICS) en mochten patiënten bij neusverstoppingen iedere 6 uur, 30 mg Pseudo-efedrine gebruiken. In totaal vielen 10 van de 28 patiënten af gedurende de studieduur. De auteurs beschreven echter slechts van twee patiënten de reden.
In de dubbel geblindeerde RCT van Berger (2002) is gekeken naar het effect van desloratadine op astma- en rhinitisuitkomsten bij patiënten met milde seizoensgebonden allergie van de bovenste luchtwegen en milde seizoensgebonden allergische astma exacerbaties. Gedetailleerde in- en exclusiecriteria zijn opgenomen in de evidencetabel. Ook hier was ICS een exclusie criterium. Berger (2002) includeerde 331 patiënten, waarvan 168 in de desloratadinegroep versus 163 in de controlegroep. De gemiddelde leeftijd van de interventiegroep was 32,5 (range 15 tot 75) jaar en van de controlegroep 32,0 (range 15 tot 73) jaar. In de interventiegroep was 38% man versus 30% in de controlegroep. De interventiegroep nam gedurende vier weken, iedere ochtend, een tablet van 5 mg desloratadine in. De controlegroep ontving een placebo, maar de studie rapporteerde niet wat voor placebo gegeven werd. Indien nodig werd het gebruik van Salbutamol toegestaan om astma symptomen te controleren.
Resultaten
Nasale corticosteroïden
Symptomen van astma
Negen van de 18 geïncludeerde studies in de review van Lohia (2012) rapporteerden het verschil in astma symptomen na gebruik van intranasale corticosteroïden. Astma werd gediagnosticeerd op basis van klinische symptomen en fysiologische kenmerken, the Global Initiative for Asthma (GINA-criteria) of the American Thoracic Society (ATS-criteria). De studies gebruikten verschillende schalen voor het meten van astmasymptomen.
Zes studies onderzochten het effect van INCS spray in vergelijking met placebo op astmasymptomen. De meta-analyse resulteerde in een matige verbetering in astma symptomen in het voordeel van INCS spray ten opzichte van placebo (SMD 0,61; 95% BI: 0,02 tot 1,20) (zie Figuur 1).
Figuur 1 Meta-analyse van het effect van INCS spray versus placebo op astmasymptomen gepresenteerd als standardized mean difference (hogere score = minder symptomen)
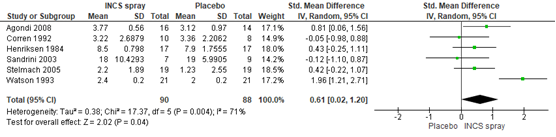
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Drie studies onderzochten het effect van INCS sprays inclusief astmamedicatie (inhalatiecorticosteroïden (ICS)) ten opzichte van astmamedicatie alleen op astmasymptomen. Er werden verschillende niet-gevalideerde symptoomscores gebruikt. Er werd geen klinisch relevant verschil gevonden in astma symptomen tussen de behandelingen (SMD -0,03; 95% BI: -0,16 tot 0,10) (zie figuur 2).
Figuur 2 Meta-analyse van het effect van INCS spray met inhalatiecorticosteroïden (ICS) versus inhalatiecorticosteroïden (ICS) alleen op astmasymptomen gepresenteerd als standardized mean difference (hogere score = minder symptomen)
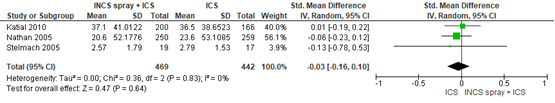
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Eén studie (Pedersen, 1998) uit de review van Lohia (2012) onderzocht het effect van nasaal geïnhaleerde corticosteroïden versus placebo op astmasymptomen in een cross-over trial bij 24 kinderen. De patiënten hadden minder symptomen in de periode waarin ze nasaal geïnhaleerde corticosteroïden gebruikten (zie tabel 1).
Tabel 1 Effect van nasaal geïnhaleerde corticosteroïden versus placebo op astmasymptomen gepresenteerd als gemiddelde ± standaarddeviatie (hogere score = minder symptomen)
|
Astmasymptomen (gemiddelde ± SD) |
Nasaal geïnhaleerde corticosteroïden |
Placebo |
|
Groep 1 (corticosteroïden-placebo) |
2,67 ± 0,31 |
2,08 ± 0,42 |
|
Groep 2 (placebo-corticosteroïden) |
3,27 ± 0,24 |
1,09 ± 0,42 |
Longfunctie (FEV1)
Tien van de 18 geïncludeerde studies in de review van Lohia (2012) rapporteerden het verschil in FEV1 na gebruik van intranasale corticosteroïden.
Acht studies, in de meta-analyse van Lohia (2012) onderzochten het effect van INCS sprays op FEV1 ten opzichte van placebo.
De meta-analyse liet een klein, niet klinische relevant, verschil in FEV1 zien in het voordeel van het gebruik van INCS spray ten opzichte van placebo (SMD 0,29; 95% BI: -0,01 tot 0,58) (zie figuur 3).
Figuur 3 Meta-analyse van het effect van INCS spray versus placebo op het verschil in FEV1 gepresenteerd als standardized mean difference
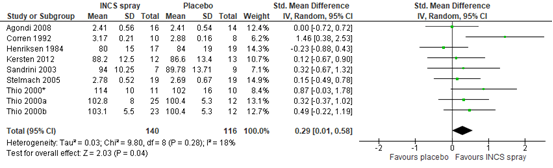
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Drie studies onderzochten het effect van INCS sprays inclusief astmamedicatie (inhalatiecorticosteroïden) op FEV1 ten opzichte van astma medicatie alleen. Er was geen verschil in FEV1 (SMD 0,04; 95% BI: -0,15 tot 0,22) (zie figuur 4).
Figuur 4 meta-analyse van het effect van INCS spray met inhalatiecorticosteroïden (ICS) versus ICS op het verschil in FEV1 gepresenteerd als standardized mean difference (Bron: Lohia, 2012)
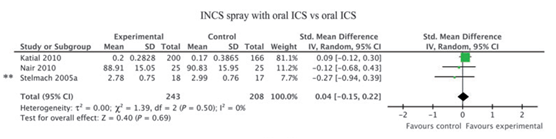
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Overige klachten ten gevolge van allergie
Deze uitkomstmaat werd niet gerapporteerd.
Medicijngebruik
Negen van de 18 geïncludeerde studies in de review van Lohia (2012) rapporteerden het verschil in medicijngebruik (rescue) na gebruik van intranasale corticosteroïden. De geïncludeerde studies gebruikten verschillende schalen en zowel dichotome als continue uitkomstmaten.
Vijf studies onderzochten het effect van INCS sprays ten opzichte van placebo op medicijngebruik. INCS spray resulteerde in een kleine niet-klinisch relevante daling van medicijngebruik ten opzichte van placebo (SMD 0,21; 95% BI: -0,05 tot 0,47) (zie figuur 5).
Figuur 5 Meta-analyse van het effect van INCS spray versus placebo op het verschil in medicijngebruik gepresenteerd als standardized mean difference (Bron: Lohia, 2012)
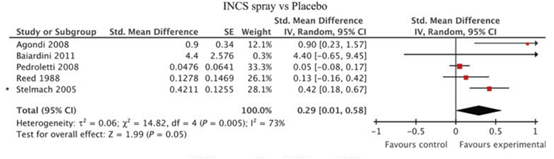
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Drie studies onderzochten het effect van INCS sprays inclusief astma medicatie (inhalatiecorticosteroïden) op medicatiegebruik ten opzichte van astma medicatie alleen. Er was geen verschil in medicatiegebruik tussen de behandelingen (SMD 0,00; 95% BI: -0,14 tot 0,15) (zie figuur 6).
Figuur 6 Meta-analyse van het effect van INCS spray met inhalatiecorticosteroïden (ICS) versus ICS op het verschil in medicatiegebruik gepresenteerd als standardized mean difference (Bron: Lohia, 2012)
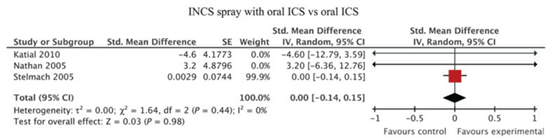
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Twee studies (Pedersen, 1998; Pedersen, 1990) uit de review van Lohia (2012) onderzochten het effect van nasaal geïnhaleerde corticosteroïden versus placebo op het medicijngebruik. Nasaal geïnhaleerde corticosteroïden resulteerden in een kleine niet-klinisch relevante daling van medicijngebruik ten opzichte van placebo (SMD 0,35; 95% BI: -0,03 tot 0,74) (zie figuur 7).
Figuur 7 Meta-analyse van het effect van nasaal geïnhaleerde corticosteroïden versus placebo op het verschil in medicatiegebruik gepresenteerd als standardized mean difference (Bron: Lohia, 2012)
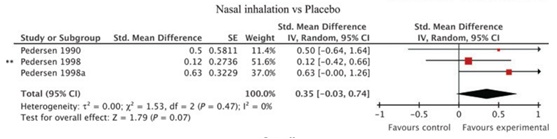
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bijwerkingen
Deze uitkomstmaat werd niet gerapporteerd.
Antihistaminica
Aaronson (1996) Patiënten scoorden twee keer per dag (ochtend en avond) hun astma- en rhinitissymptomen op een schaal van 0 tot 9, waarbij score 0 geen symptomen betekende en score 9 ondraaglijke symptomen. De hieronder gerapporteerde resultaten werden afgelezen uit de grafieken, aangezien de studie geen specifieke aantallen rapporteerde.
Berger (2002) Patiënten scoorden in de ochtend (voor het innemen van medicatie) en in de avond hun astma- en rhinitissymptomen op een schaal van 0 tot 3, waarbij score 0 geen symptomen betekende en score 3 ernstige symptomen (slecht te verdragen symptomen, invloed op algemeen dagelijkse levensverrichtingen en/of slaap).
Symptomen van astma
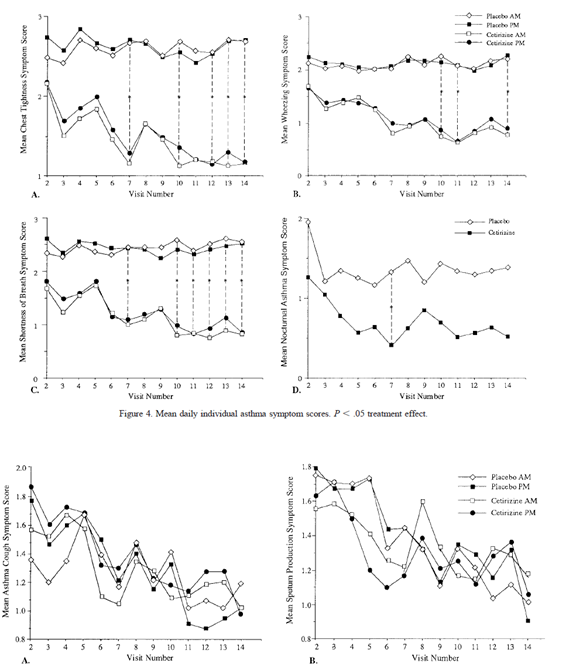
Aaronson (1996) rapporteerde geen somscore voor astmasymptomen, om deze reden worden alleen de gemiddelde individuele symptoomscores (schaal 0 tot 9) gerapporteerd. Het effect van cetirizine werd gedurende de gehele dag ervaren. Patiënten rapporteerden namelijk geen verschil in ochtend- en avond scores. Zie figuur 8 en tabel 2.
Tabel 2 Gemiddelde individuele astmasymptoomscores (Bron: Aaronson, 1996)
|
Astmasymptoom |
(ochtend)score placebogroep |
(ochtend)score cetirizine groep |
|
Beklemmend gevoel op de borst “Chest tightness” |
2,5 |
0,33 |
|
Piepende ademhaling |
2,33 |
0,75 |
|
Kortademigheid |
2,5 |
0,75 |
|
Hoesten |
1,2 |
1,0 |
|
Sputum productie |
1,2 |
1,0 |
|
Nachtelijke astma symptomen |
1,33 |
0,5 |
Figuur 8 Individuele astmasymptoomscores (Bron: Aaronson, 1996)
Berger (2002) Na 15 dagen was de totale reflectieve astma somscore (schaal 0 tot 9), gedefinieerd als de gemiddelde ochtend- en avond symptoombeoordeling van de afgelopen 12 uur, gedaald in het voordeel van de desloratadine groep (-1,35) ten opzichte van de placebogroep (-0,94) (p < 0,023). Na 29 dagen was dit verder gedaald in het voordeel van de desloratadine groep (-1,54) ten opzichte van de placebogroep (-1,18) (p < 0,055).
Longfunctie (FEV1)
Aaronson (1996) rapporteerde geen significant verschil in FEV1 tussen de cetirizinegroep en de placebogroep, maar rapporteerde geen specifieke cijfers.
Overig klachten ten gevolge van allergie
Figuur 9 Somscores van de gemiddelde dagelijkse totale symptoomscore van allergie van de bovenste luchtwegen (Bron: Aaronson, 1996)
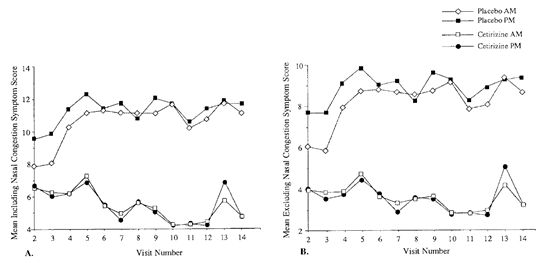
Aaronson (1996) Aan het einde van de studieduur was de somscore (schaal 0 tot 63) van de individuele symptomen van allergische rhinitis van patiënten die met cetirizine behandeld werden lager (5 punten) dan de somscore van patiënten uit de placebogroep (11 punten). Het effect van cetirizine werd gedurende de gehele dag ervaren. Patiënten rapporteerden namelijk geen verschil in ochtend- en avond scores (zie figuur 9).
Berger (2002) Na 15 dagen was de totale reflectieve somscore (schaal 0 tot 24), gedefinieerd als de gemiddelde ochtend- en avond symptoombeoordeling van de afgelopen 12 uur, gedaald in het voordeel van de desloratadine groep (-4,90) ten opzichte van de placebogroep (-2,98) (p < 0,001). Er werden geen specifieke aantallen gerapporteerd voor het verschil tussen de eerste meting en de laatste meting (na 29 dagen). De auteurs rapporteren echter dat de daling in somscore gedurende de gehele studieperiode is doorgezet.
Aan het eind van de studieduur (na 29 dagen) is het verschil ten opzichte van de baseline meting, in de totale somscore (schaal 0 tot 24) van de ochtendbeoordeling, gedaald in het voordeel van de desloratadine groep (-4,54) ten opzichte van de placebogroep (-2,99) (p = 0,002).
Medicijngebruik
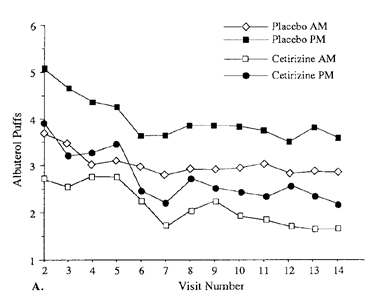
Aaronson (1996) Over het algemeen gebruikte de cetirizinegroep minder salbutamol pufjes (ochtend: 1,75; avond: 2,25) ten opzichte van de controlegroep (ochtend 3; avond 3,75). De auteurs rapporteerden geen p-waarde, maar in het artikel werd wel vermeld dat het een niet statistisch significant verschil was (zie figuur 10). In beide groepen werd gemiddeld ’s avonds meer salbutamol gebruikt.
Figuur 10 Aantal salbutamol pufjes (Bron: Aaronson, 1996)
Berger (2002) Het gebruik van β-agonist inhalers verminderde in het voordeel van de desloratadine groep (na 15 dagen: p = 0,031; na 29 dagen: p = 0,087). Er werden geen specifieke cijfers gerapporteerd.
Bijwerkingen
Aaronson (1996) Vier patiënten (28,6%) uit de placebogroep en twee patiënten uit de cetirizinegroep (14,3%) rapporteerden bijwerkingen (RR: 0,50; 95% BI: 0,11 tot 2,30). Hiervan werd slechts één bijwerking, namelijk slaperigheid, gerelateerd aan cetirizinegebruik.
Berger (2002) Het aantal en de soort bijwerkingen verschilden niet tussen de groepen. In de desloratadine groep hadden 26 patiënten (15,5%) van de patiënten last van bijwerkingen versus 23 patiënten (14,1%) in de placebogroep (RR: 1,10; 95BI: 0,65 tot 1,84). Patiënten in de desloratadine groep rapporteerden de volgende bijwerkingen:
- hoofdpijn (3%);
- vermoeidheid (2,4%);
- misselijkheid (1,2%);
- droge mond (1,2%).
Patiënten in de controlegroep rapporteerden de volgende bijwerkingen:
- hoofdpijn (3,7%);
- misselijkheid (2,5%);
- droge mond (2,5%);
- vermoeidheid (<1%).
Er werden geen cardiovasculaire bijwerkingen, hartritmestoornissen of ECG-veranderingen gerapporteerd in de desloratadinegroep. Eén patiënt uit de controlegroep rapporteerde hartkloppingen. Deze waren echter onafhankelijk van de behandeling.
Bewijskracht van de literatuur
Nasale corticosteroïden
De bewijskracht voor de uitkomstmaten symptomen van astma, longfunctie (FEV1) en medicijngebruik (INCS spray versus placebo en INCS spray met astma medicatie versus astma medicatie) is met 2 niveaus verlaagd naar laag gezien beperkingen in de onderzoeksopzet (risk of bias: randomisatie en inadequate concealment of allocation) en imprecisie (geringe aantal patiënten en 95% BI omvat: waarde van zowel geen effect als wel een effect).
De bewijskracht voor de uitkomstmaten symptomen van astma en medicijngebruik betreffende de vergelijking nasaal geïnhaleerde corticosteroïden versus placebo, is met 3 niveaus verlaagd naar zeer laag gezien beperkingen in de onderzoeksopzet (risk of bias: randomisatie en inadequate concealment of allocation) en imprecisie (geringe aantal patiënten en 95% BI omvat: waarde van zowel geen effect als wel een effect).
Vanwege het ontbreken van studies die de uitkomst overige klachten ten gevolge van allergie of bijwerkingen rapporteren is de bewijskracht voor deze uitkomsten niet beoordeeld.
Antihistaminica
De bewijskracht voor de uitkomstmaten symptomen van astma, longfunctie (FEV1), klachten ten gevolge van allergie en medicijngebruik is met 3 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias: randomisatie, inadequate concealment of allocation en lost to follow-up) en het geringe aantal patiënten (imprecisie).
De bewijskracht voor de uitkomstmaat bijwerkingen is met 3 niveaus verlaagd gezien de beperkingen in de onderzoeksopzet (risk of bias: randomisatie, inadequate concealment of allocation en lost to follow-up) en imprecisie (geringe aantal patiënten en overschrijden grenzen van klinische relevantie).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat is het effect van een medicamenteuze behandeling van een allergie van de bovenste luchtwegen op symptomen van astma, klachten ten gevolge van allergie en controle (exacerbatie en medicijngebruik) bij kinderen, volwassenen en zwangere vrouwen met allergie van de bovenste luchtwegen én astma?
P: kinderen, volwassenen, zwangere vrouwen met allergie van de bovenste luchtwegen en astma;
I: medicamenteuze behandeling van allergie van de bovenste luchtweg;
C: geen medicamenteuze behandeling van allergie van de bovenste luchtweg of placebo;
O: symptomen van astma scores, longfunctie (FEV1), overige klachten ten gevolge van allergie, astma controle (exacerbatie en medicijngebruik), bijwerkingen van allergie medicatie.
Relevante uitkomstmaten
De werkgroep achtte symptomen van astma, longfunctie en astma controle (exacerbatie en medicijngebruik) scores voor de besluitvorming cruciale uitkomstmaten; en klachten ten gevolge van allergie en bijwerkingen (een) voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
De werkgroep definieerde voor geen van de uitkomstmaten klinische (patiënt) relevante verschillen, maar sloot aan bij de door GRADE aangegeven default grenzen van 0,5 SD voor continue uitkomstmaten, RR < 0,75 of > 1,25) (GRADE recommendation) of Standardized mean difference (SMD=0,2 (klein); SMD=0,5 (matig); SMD=0,8 (groot).
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op is op 27 oktober 2018 met relevante zoektermen gezocht naar relevante literatuur. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 115 systematische reviews, 504 RCT’s en 459 observationele studies op. Studies werden geselecteerd op grond van de volgende selectiecriteria: betrof het de juiste medicatie, originele publicaties en de geselecteerde uitkomstmaten. Provocatiestudies of studies met medicijnen die niet beschikbaar zijn in Nederland werden geëxcludeerd. Op basis van titel en abstract werden in eerste instantie 48 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 45 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 3 studies definitief geselecteerd.
Drie onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Referenties
- Aaronson DW. Evaluation of cetirizine in patients with allergic rhinitis and perennial asthma. Ann Allergy Asthma Immunol. 1996;76(5):440-6. PubMed PMID: 8630718.
- Agusti A, Bel E, Thomas M, Vogelmeier C, Brusselle G, Holgate S, Humbert M, Jones P, Gibson PG, Vestbo J, Beasley R, Pavord ID. Treatable traits: toward precision medicine of chronic airway diseases. Eur Respir J. 2016 Feb;47(2):410-9. doi: 10.1183/13993003.01359-2015. PubMed PMID: 26828055.
- Berger WE, Schenkel EJ, Mansfield LE; Desloratadine Study Group. Safety and efficacy of desloratadine 5 mg in asthma patients with seasonal allergic rhinitis and nasal congestion. Ann Allergy Asthma Immunol. 2002;89(5):485-91. PubMed PMID: 12452207.
- Lohia S, Schlosser RJ, Soler ZM. Impact of intranasal corticosteroids on asthma outcomes in allergic rhinitis: a meta-analysis. Allergy. 2013;68(5):569-79. PubMed PMID: 23590215.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Lohia, 2012
(individual study characteristics deduced from (1st author, year of publication ))
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search: - PubMed (1950 to May 2012) and - Cochrane Library (May 2012) - MEDLINE database (January 1966 to May 2012)
A: Agondi, 2008 B: Baiardini, 2001 C: Corren, 1992 D: Dahl, 2005 E: Henriksen, 1984 F: Katial, 2010 G: Kersten, 2012 H: Nair, 2010 I: Nathan, 2005 J: Pedersen, 1990 K: Pedersen, 1998 L: Pedroletti, 2008 M: Reed, 1998 N: Sandrini, 2003 O: Scichilone, 2010 P: Stelmach, 2005 Q: Thio, 2000 R: Watson, 1993
Study design: RCT parallel: R, H, J, K. cross-over: A – G, I, L - Q
Setting and Country: Not reported
Source of funding and conflicts of interest: Review has no source of funding or conflicts of interest. Source of funding or support was not indicated for each of the included studies.
|
Inclusion criteria SR: - Randomized controlled trials (RCTs) - evaluating the efficacy of INCS medications - on adults or children - if studies assessed at least one asthma-specific clinical outcome measure, to include pulmonary function, bronchial reactivity, asthma symptom scores, asthma-specific quality of life, or use of rescue medications. - Single and double-blind studies were both included, as were appropriate crossover trials. - clear diagnostic criteria for AR and asthma. The diagnosis of AR was established based on typical symptoms plus a positive skin prick test or serumspecific IgE to at least one inhalant allergen. Diagnosis of asthma was established by clinical symptoms and physiologic features, the Global Initiative for Asthma (GINA) criteria, or the American Thoracic Society (ATS) criteria. - interventions: INCS spray versus placebo, INCS spray plus asthma-specific medications versus placebo nasal spray plus asthma-specific medications and nasally inhaled corticosteroid versus placebo. - Standard asthma medications could include short and long acting beta-agonists, orally inhaled corticosteroids, systemic corticosteroids (oral or parenteral), leukotriene receptor antagonists, 5-lipoxygenase inhibitors, ipratropium bromide, sodium cromoglycate, and theophylline. - To isolate the impact of nasal therapies, studies were included only if asthma medications remained constant throughout the study and the only variable that changed was the nasal therapy
Exclusion criteria SR: If studies assessed the efficacy of two or more treatments simultaneously, had a washout period <1 week between treatments, or did not have a placebo control group.
18 studies included
Important patient characteristics at baseline:
N, mean age Not reported, studies included children, adults or a mixed group A: 30, mixed B: 51, adults C: 18, adults D: 236, mixed E: 36, children F: 366, adults G: 25, children H: 25, adults I: 509, adults J: 30, adults K: 24, children L: 40, children M: 74, mixed N: 16, adults O: 17, adults P: 54, adults Q: 93, adults R: 42, children
Sex: Not reported
Groups comparable at baseline? yes |
Describe intervention: BDP, beclomethasone dipropionate; MMF, mometasone furoate; FP, fluticasone propionate; FF, fluticasone furoate; TA, triamcinolone acetonide;
A: BDP nasal spray B: MMF nasal spray C: BDP nasal spray D: 1. FP nasal spray 2. FP nasal spray, orally inhaled FP E: BPD nasal spray F: FP nasal spray, orally inhaled FP/salmeterol G: FF nasal spray H: FP nasal spray, orally inhaled I: FP nasal spray J: Nasally inhaled budesonide K: Nasally inhaled budesonide L: MMF nasal spray M: 1. Flunisolide nasal spray 2. Beclomethasone nasal spray N: TA nasal spray O: Budesonide nasal spray P: 1. BDP nasal spray; placebo inhaler 2. BDP nasal spray; orally inhaled BDP Q: 1. FP nasal spray 2. FP nasal spray 3. BDP nasal spray R: BDP nasal spray
|
Describe control:
All studies included one control arm with administration of a placebo nasal spray unless noted otherwise
H: Placebo nasal spray, orally inhaled FP P: 3. Placebo nasal spray; placebo inhaler 4. Placebo nasal spray; orally inhaled BPD
|
End-point of follow-up:
A: 125 days B: 4 weeks C: 7 weeks D: 6 weeks E: 4 weeks F: 4 weeks G: 22 ± 3 days H: 12 weeks I: 4 weeks J: 2 weeks K: 1 weeks L: 4 weeks M: 4 weeks N: 4 weeks O: 2 weeks P: 16 weeks Q: 6 weeks R: 4 weeks
For how many participants were no complete outcome data available? Studies included a total of 2162 patients, of which 1659 completed the full study and 503 withdrew or dropped out.
|
FEV1 Defined as Forced Expiratory Volume in 1 s
INCS spray to placebo Effect measure: standardized mean difference. Pooled effect (random effects model): 0.21 (95% CI -0.05 to 0.47) favoring INCS spray Heterogeneity (I2): 0%
INCS spray in addition to baseline administration of orally inhaled corticosteroids Effect measure: standardized mean difference. Pooled effect (random effects model): 0.04 (95% CI -0.15 to 0.22) not favoring any treatment group Heterogeneity (I2): 0%
Asthma symptom scores INCS spray to placebo Effect measure: standardized mean difference. Pooled effect (random effects model): 0.61 (95% CI 0.02 to 1.20) favoring INCS spray Heterogeneity (I2): 71%
INCS spray in addition to baseline administration of orally inhaled corticosteroids Effect measure: standardized mean difference. Pooled effect (random effects model): 0.04 (95% CI -0.15 to 0.22) not favoring any treatment group Heterogeneity (I2): 0%
Nasal inhalation versus placebo (mean± SD)
Nasal inhalation Trial 1 2,67 ± 0,31 Trial 2 2,08 ± 0,42 Placebo Trial 1 3,27 ± 0,24 Trial 2 1,09 ± 0,42
Rescue medication use INCS spray to placebo Effect measure: standardized mean difference. Pooled effect (random effects model): 0.29 (95% CI 0.01 to 0.58) favoring INCS spray Heterogeneity (I2): 73%
INCS spray in addition to baseline administration of orally inhaled corticosteroids Effect measure: standardized mean difference. Pooled effect (random effects model): 0.00 (95% CI -0.14 to 0.15) not favoring any treatment group Heterogeneity (I2): 0%
|
Facultative:
The results of this meta-analysis demonstrated that intranasal corticosteroid medications significantly improve some asthma-specific outcome measures in patients suffering from both AR and asthma. This effect was most pronounced with INCS sprays when patients were not on orally inhaled corticosteroids, or when corticosteroid medications were inhaled through the nose into the lungs. Overall, intranasal corticosteroid medications improve some asthma-specific outcome measures in patients with both AR and asthma. Further research is needed to clarify the role of INCS sprays as asthma-specific therapy, as well as the role of the nasal inhalation technique as a monotherapy in patients suffering from both asthma and AR. |
Table of quality assessment for systematic reviews of RCTs and observational studies
|
Study
First author, year |
Appropriate and clearly focused question?
Yes/no/unclear |
Comprehensive and systematic literature search?
Yes/no/unclear |
Description of included and excluded studies?
Yes/no/unclear |
Description of relevant characteristics of included studies?
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?
Yes/no/unclear |
Potential risk of publication bias taken into account?
Yes/no/unclear |
Potential conflicts of interest reported? |
|
Lohia, 2012 |
Yes, the objective of this study was to perform an updated systematic review with meta-analysis assessing the impact of INCS medications upon asthma outcomes in patients with AR and comorbid asthma. |
yes |
Yes |
yes |
Not applicable |
Yes, Risk of bias for each study was evaluated using the Cochrane ‘Risk of bias’ tool, including selection bias (random sequence generation and allocation concealment), performance bias (blinding of participants and personnel), detection bias (blinding of outcome assessment), attrition bias (incomplete outcome data), and reporting bias (selective reporting) |
yes |
Yes, publication bias could not be assessed because there were fewer than 10 included studies per outcome measure. |
No, source of funding or support was not indicated for each of the included studies.
|
Evidence table for intervention studies
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation |
Bias due to inadequate concealment of allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?
(unlikely/likely/unclear) |
Bias due to loss to follow-up?
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?
(unlikely/likely/unclear) |
|
Aaronson, 1995 |
Not described |
Unclear, method of randomisation not described |
Unlikely, both investigators and patients were blinded to the treatment regimen |
Unlikely, both investigators and patients were blinded to the treatment regimen |
Unlikely, both investigators and patients were blinded to the treatment regimen |
Unlikely, authors all outcomes that were reported at method section were described |
Unclear, 10 of 28 patients were lost to follow-up. Two patients discontinued due to lack of efficacy. Other reasons were not described. |
Unlikely. Authors reported that study data were analyzed based on the intent-to-treat principle. However exact numbers of patients participating in intervention or control group are missing. |
|
Berger, 2001 |
Not described |
Unclear, method of randomisation not described |
Unlikely, authors state this is a double blinded study, but no more information is given |
Unlikely, authors state this is a double blinded study, but no more information is given |
Unclear, authors state this is a double blinded study, but no more information is given |
Unlikely, authors all outcomes that were reported at method section were described |
Unlikely, loss-to-follow-up for intervention group was: 2 (1.2%) and the control group: 3 (1.8%) However reasons were not described. |
Unlikely, patients were analyzed in the intervention groups to which they were randomized. |
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Cruz 2005 |
Geen systematisch review of origineel artikel |
|
Cruz 2007 |
Geen systematisch review of origineel artikel |
|
Lange 2005 |
Artikel in Duits |
|
Philip 2005 |
Voldoet niet aan PICO: medicatie niet specifiek voor allergie |
|
Agondi 2008 |
Geïncludeerd in review Lohia |
|
Blaiss 2003 |
Geen systematisch review of origineel artikel |
|
Brozek 2017 |
Richtlijn |
|
Bachert 2010 |
Geen systematisch review of origineel artikel |
|
Baiardini 2011 |
Geïncludeerd in review Lohia |
|
McGowan 2013 |
Geen fulltekst beschikbaar |
|
Ribeiro 2006 |
Fulltekst in Portugees |
|
Taramarcaz 2003 |
Recenter review beschikbaar |
|
Tsabouri 2014 |
Voldoet niet aan PICO: niet specifiek voor astma populatie |
|
Dahl 2005 |
Geïncludeerd in review Lohia |
|
Greenberger 2015 |
Comment |
|
Jindal 2016 |
Voldoet niet aan PICO: Fluticasone propionate versus montelukast |
|
Moller 2002 |
Voldoet niet aan PICO: immunotherapie |
|
Nair 2010 |
Geïncludeerd in review Lohia |
|
Nathan 2015 |
Geïncludeerd in review Lohia |
|
Obimbo 2013 |
Geen systematisch review of origineel artikel |
|
Perry 2004 |
Voldoet niet aan PICO: medicatie niet specifiek voor allergie |
|
Philip 2004 |
Voldoet niet aan PICO: medicatie niet specifiek voor allergie |
|
Thio 2000 |
Geïncludeerd in review Lohia |
|
Voltolini 2010 |
Voldoet niet aan PICO: immunotherapie |
|
Meltzer 2013 |
Geen systematisch review of origineel artikel |
|
Nayak 2007 |
Artikelen zijn geïncludeerd in review Lohia |
|
Cogo 2003 |
Geen Engelse fulltekst |
|
Corren 1997 |
Voldoet niet aan PICO: loratadine plus pseudoephedrine |
|
Katial 2010 |
Geïncludeerd in review Lohia |
|
Kersten 2012 |
Geïncludeerd in review Lohia |
|
Nathan 2006 |
Voldoet niet aan PICO: medicatie niet specifiek voor allergie |
|
Okano 2015 |
Geen systematisch review of origineel artikel |
|
Pedroletti 2008 |
Geïncludeerd in review Lohia |
|
Phipatanakul 2000 |
Medicatie wordt in Nederland niet gegeven voor allergie |
|
Profita 2013 |
Medicatie wordt in Nederland niet gegeven voor allergie |
|
Sandrini 2003 |
Geïncludeerd in review Lohia |
|
Scichilone 2011 |
Geïncludeerd in review Lohia |
|
Watson 1993 |
Geïncludeerd in review Lohia |
|
Wood 1995 |
Medicatie wordt in Nederland niet gegeven voor allergie |
|
Zhang 2009 |
Geen Engelse fulltekst |
|
Stelmach 2005 |
Geïncludeerd in review Lohia |
|
Pedersen 2005 |
Geïncludeerd in review Lohia |
|
Dixon 2014 |
Voldoet niet aan PCIO: andere patiëntenpopulatie |
|
Mygind 1999 |
Artikelen zijn geïncludeerd in review Lohia |
|
Aubier 2001 |
Klinische studie (allergic challenge) |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 12-02-2020
Uiterlijk in 2024 bepaalt het bestuur van de Nederlandse Vereniging voor Keel-Neus-Oorheelkunde en Heelkunde van het Hoofd-Halsgebied of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Keel-Neus-Oorheelkunde en Heelkunde van het Hoofd-Halsgebied is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied. Op modulair niveau is een onderhoudsplan beschreven.
|
Module |
Regiehouder(s) |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn |
Frequentie van beoordeling op actualiteit |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
Behandeling van allergie en astma |
KVKNO |
2019 |
2024 |
5 jaarlijks |
NVKNO/ NVALT |
- |
Algemene gegevens
Deze richtlijn kreeg goedkeuring door de Vereniging van Allergie Patiënten (VAP) en de Patiëntenfederatie Nederland.
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Deze multidisciplinaire richtlijn beoogd de kwaliteit van zorg en het komen tot een goede klinische besluitvorming bij de behandeling van allergie van de bovenste luchtwegen op basis van de huidige wetenschappelijke inzichten te verhogen. Deze zorg behelst zowel de diagnostiek als behandeling van de allergie en aandacht voor de bijkomende co-morbiditeit. Daarnaast beoogt deze richtlijn een uniform beleid ten aanzien van het doorverwijzen en terugverwijzen van de patiënt te geven. Deze zorg wordt geleverd in de eerste lijn en in verschillende groepen binnen tweede en derde lijn, vandaar de samenwerking tussen huisartsen, KNO-artsen, allergologen, kinderartsen, oogartsen, longartsen en apothekers. Dit schept meer duidelijkheid voor patiënten, verwijzers en zorgverzekeraars.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de tweede en derde lijn zorg voor volwassenen en kinderen met allergische klachten van de bovenste luchtwegen. Voor de eerste lijn wordt verwezen naar de NHG-Standaard ‘Allergische en niet-allergische rhinitis’.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met allergie van de bovenste luchtwegen te maken hebben.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Dr. R.J.H. (Robbert) Ensink, KNO-arts, Gelre ziekenhuizen, Zutphen, Nederlandse Vereniging voor Keel-Neus-Oorheelkunde en Heelkunde van het Hoofd-Halsgebied (voorzitter)
- Prof. Dr. W.J. (Wytske) Fokkens, KNO-arts, Academisch Medisch Centrum Amsterdam, Nederlandse Vereniging voor Keel-Neus-Oorheelkunde en Heelkunde van het Hoofd-Halsgebied
- Dr. C.H.M. (Cor) Stengs, KNO-arts, Rijnstate Ziekenhuizen, Arnhem, Nederlandse Vereniging voor Keel-Neus-Oorheelkunde en Heelkunde van het Hoofd-Halsgebied
- Dr. H. (Hans) de Groot, allergoloog, Reinier de Graaf Groep, Delft, Nederlandse Vereniging voor Allergologie en Klinische Immunologie en Nederlandse Vereniging voor Kindergeneeskunde
- Dr. J.A. (Joost) Aalberse, huisarts, Huisartsenpraktijk Postjesweg, Amsterdam, Nederlands Huisartsen Genootschap
- Dr. Ir. J. (Jasper) Kappen, longarts, Franciscus Gasthuis & Vlietland, Rotterdam, Vereniging van Artsen voor Longziekten en Tuberculose
- Dr. K. (Khaled) Mansour, oogarts, Tjongerschans, Heerenveen, Nederlands Oogheelkundig Gezelschap
- Dr. O. (Olivia) Liem, kinderarts-allergoloog i.o., Sophia Kinderziekenhuis Erasmus MC, Rotterdam, Nederlandse Vereniging voor Kindergeneeskunde
- Y. (Yola) de Vries, Secretaris bij de Vereniging van Allergie Patiënten (VAP), Wijk aan Zee, Vereniging van Allergie Patiënten
Meelezer
- Drs. M.A.G.E. (Michiel) Bannier (meelezer), kinderarts-pulmonoloog, Maastricht UMC, Maastricht, Nederlandse Vereniging voor Kindergeneeskunde
Met ondersteuning van
- D. (Dieuwke) Leereveld, MSc., adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. S.N. (Stefanie) Hofstede, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- I. (Ingeborg) van Dusseldorp, literatuurspecialist, Van Dusseldorp, Delvaux & Ket
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Ensink (voorzitter) |
KNO-arts in Gelre ziekenhuizen, locatie Zutphen |
Lid Adviescommissie Richtlijn Kennisinstituut Medisch Specialisten Lid Richtlijn commissie NVKNO |
Geen |
Geen |
|
Fokkens |
Hoogleraar Keel-neus-Oorheelkunde Academisch Medisch Centrum Amsterdam |
Secretaris generaal ERS: onbetaald Editor in Chief Rhinology: onbetaald Editor in Chief Rhinology online: onbetaald Accociate Editor Allergy: betaald |
Werkgroep ARIA EUFOREA
ZonMw MEDA EU Studies 1 en 2 zijn in patiënten met rhinitis en kunnen m.i. gezien worden als COI. Studies 3-5 zijn studies naar patiënten met neuspoliepen. 1. BM4SIT: Novel concept for Birch Pollen Allergy Treatment (immunotherapie hooikoorts, voornamelijk berkenpollen: EU, AMC (Prof. R. van Ree) is coördinerend centrum, geïnitieerd vanuit de industrie (Biomay AG) ondersteund door EU 2. Control in patients with allergic rhinitis (hooikoorts): MEDA (principal investigator) 3. Clinical Benefit and cost effectiveness of endoscopic sinus surgery (ESS) in adult patients with chronic rhinosinusitis with nasal polyps (CRSwNP): ZonMw (principal investigator) 4. Een gerandomiseerd, dubbelblind, placebo gecontroleerd, fase II onderzoek om de behandeling met meerdere doses AK001 bij patiënten met matige tot ernstige polyposis nasi te beoordelen: Allakos (deelnemend centrum) 5. A randomized, 24-week treatment, double-blind, placebo-controlled efficacy and safety study of dupilumab 300 mg every other week, in patients with bilateral nasal polyposis on a background therapy with intranasal corticosteroids: Sanofi (deelnemend centrum) |
De belangen zijn besproken. Betrokkene participeert vanwege specifieke expertise op het gebied van allergie in de keel, neus en oorheelkunde |
|
Stengs |
Lid vakgroep KNO en HHO chirurgie Rijnstate Ziekenhuizen als KNO arts/ aangezichtschirurg |
Voorzitter vakgroep: onbetaald lid allergie werkgroep: onbetaald lid aangezichtswerkgroep: onbetaald Docent masterclasses allergische rhinitis met vergoeding volgens vacatieregeling (visitatie) commentaar ronde NHG standaard allergische rhinitis: onbetaald |
Masterclasses Allergie opgestart om te komen tot een richtlijn voor de allergie van de bovenste luchtwegen en een uniform behandelplan voor deze aandoening voor de eerste en tweede lijn. |
Geen |
|
De Groot |
Allergoloog Reinier de Graaf Groep, Delft |
Jaarlijkse organisatie en geven van een masterclass voor KNO-artsen, deels gefinancierd door ALK Abello en MILAN |
Deelname aan de RELIEF studie, een postmarketing onderzoek met de huisstofmijt tablet (Sublinguale immunotherapie), gefinancierd door ALK Abello |
Geen actie. Er komt een aparte richtlijn voor immunotherapie, waardoor dit onderwerp buiten de afbakening van de richtlijn valt. |
|
Aalberse |
Huisarts Huisartsenpraktijk Postjesweg Amsterdam |
NHG werkgroep, ZZP werkzaam tegen betaling en arts allergoloog bij DC klinieken. Maar sinds uitbreiding werkzaamheden als huisarts sinds 2018 niet meer daar gewerkt. |
Geen |
Geen |
|
Kappen |
Longarts Franciscus |
Honorary Staff Member lmmunotollerance group Imperia! college Londen (onbetaald) Lid: EAACI Task Force Biomarkers in Immunotherapie (onbetaald) Lid: Commissie kwaliteit NVAL T (onbetaald) Lid: Sectie Astma NVAL T (onbetaald) |
2017 (eenmalig): ALK adviesraad biomarkers in immunotherapie |
Geen actie. Lid adviesraad is twee jaar geleden gestopt. |
|
Mansour |
Vertegenwoordiging van het NOG: Nederlands Oogheelkunde Gezelschap. Werkzaam in Tjongerschans ziekenhuis Heerenveen Nijsmellinghe Drachten |
Voorzitter OOG (wetenschappelijke vereniging), lid Fischerstichting, lid Catharina heerd stichting, advieslid Sjogren’s patiëntenvereniging, alle nevenwerkzaamheden zijn onbetaald |
Geen |
Geen |
|
Liem |
Kinderarts-allergoloog i.o., Sophia Kinderziekenhuis Erasmus MC |
Geen |
Geen |
Geen |
|
De Vries |
Secretaris bij de Vereniging van Allergie Patiënten |
Secretaris is vrijwilligerswerk, onbetaald. |
Geen |
Geen |
|
Bannier (meelezer) |
Kinderarts-pulmonoloog Maastricht UMC+ |
Geen |
Geen |
Geen |
|
Leereveld (Kennisinstituut) |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen |
|
Hofstede (Kennisinstituut) |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde van de Vereniging van Allergie Patiënten (VAP) in de werkgroep. De VAP heeft input gegeven tijdens de knelpuntenanalyses en op de teksten, waaronder de overwegingen. Daarnaast is er een module opgenomen over zelfmedicatie. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de VAP.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten. De werkgroep heeft besloten geen indicatoren te ontwikkelen bij de huidige richtlijn, omdat er of geen substantiële barrières konden worden geïdentificeerd die implementatie van de aanbeveling zouden kunnen bemoeilijken.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door Nederlandse Vereniging voor Keel-Neus-Oorheelkunde en Heelkunde van het Hoofd-Halsgebied (NVKNO), het Nederlands Huisartsen Genootschap (NHG), Verpleegkundigen & Verzorgenden Nederland (V&VN), Nederlands Oogheelkundig Gezelschap (NOG), College van Medisch Immunologen (CMI), Zorginstituut Nederland (ZiNL), Artsenfederatie (KNMG), de Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie (KNMP) en Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde (NVKC) via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen en systematische reviews in Medline en Embase. Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews en Cochrane – voor gerandomiseerd gecontroleerd onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaalt dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaat van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk om mee te wegen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn heeft de werkgroep overwogen om interne kwaliteitsindicatoren te ontwikkelen om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van de Federatie Medisch Specialisten. De werkgroep heeft besloten geen indicatoren te ontwikkelen bij de huidige richtlijn, omdat er of geen substantiële barrières konden worden geïdentificeerd die implementatie van de aanbeveling zouden kunnen bemoeilijken.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwaliteit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
