Medicatie bij preventie recidief diverticulitis
Uitgangsvraag
Wat zijn medicamenteuze opties om recidieven en/of persisterende klachten te voorkomen?
De uitgangsvraag omvat de volgende deelvragen:
- wat is het effect van slecht-resorbeerbare antibiotica?
- wat is het effect van anti-inflammatoire medicatie?
- wat is het effect van probiotica?
Aanbeveling
Behandel patiënten na een doorgemaakte diverticulitis episode niet met rifaximine.
Behandel patiënten na een doorgemaakte diverticulitis episode niet met mesalazine.
Behandel patiënten na een doorgemaakte diverticulitis episode niet met probiotica.
Overwegingen
Rather than waiting for a potential recurrent episode of acute diverticulitis when the initial episode is in remission, clinicians would like to treat patients medically to prevent recurrent episodes. Diverticulitis researchers focussed on three candidates; poorly absorbed antibiotics (mainly rifaximin), anti-inflammatory agents (mainly mesalazine) and probiotics. Despite the attention to this topic, many trials suffer from methodological limitations and low patient numbers.
Antibiotics
The effect of 7 to 10 days a month rifaximin was assessed in one RCT (rifaximin versus placebo) and two observational studies (rifaximin versus mesalazine). The RCT found no difference in recurrent diverticulitis rates at 48 weeks in the intention-to-treat analysis, although some benefit of rifaximin was seen in additional analyses that were adjusted for several confounders. Furthermore, this study was terminated early because of low accrual rates and the intention of the study was therefore changed to proof-of-concept. One of the 2 observational studies found results in favour of mesalazine rather than rifaximin treatment but this study compared a 7-day per month rifaximin treatment with a continuous and daily mesalazine treatment. Although the same author published a study which showed a significantly better effect of daily treatment than intermittent treatment in diverticular disease patients. (Tursi, 2013) Therefore, a comparison between a daily mesalazine treatment with an intermittent rifaximin treatment seems to be irrelevant. The other study found opposite results; rifaximin yielded lower risks for recurrent diverticulitis than mesalazine treatment. In summary, current evidence on the effect of rifaximin is scarce, contradictory and of mostly of low quality. Although rifiximin may be a promising treatment in the future, current evidence is far from sufficient to make firm conclusions about its effectivity and to promote treatment in diverticulitis patients.
Anti-inflammatory agents
The effect of mesalazine was studied in 4 randomized and placebo controlled trials. At both 12 months and 24 months after initiation of treatment no differences in rates of recurrent diverticulitis were seen. Different dosages of mesalazine were assessed in one RCT but also higher dosages did not show a beneficial effect on recurrence rates. Although not only imaging proven acute diverticulitis patients were included in all trials, the results of all trials are consistent. Mesalazine showed some improvement in physical quality of life in one study but failed to show an effect on recurrence rates in all studies. Therefore prophylactic treatment of mesalazine after an episode of acute diverticulitis cannot be advocated.
Probiotics
One randomized controlled trial studied the effect of probiotics on rates of recurrent diverticulitis and persistent gastrointestinal complaints. However, this study only included a combined probiotics and mesalazine treatment group and compared this group with a mesalazine and a placebo treatment group. Rates of recurrent diverticulitis were highest in the probiotics/mesalazine group and mesalazine monotherapy was superior to combined treatment with probiotics regarding persistent gastrointestinal complaints. In summary, evidence on the effect of probiotics is very limited and the available evidence did not show a beneficial effect. Further studies are needed to draw any conclusion about the effectivity of probiotics. Meanwhile, treatment with probiotics does not seem to be advisable.
In summary, all three medical interventions (rifaximin, mesalazine and probiotics) have not been proven beneficial for acute diverticulitis patients regarding the prevention of recurrent diverticulitis or persistent complaints and can therefore not be advocated. However, the quality of evidence is relatively low (particularly for rifaximin and probiotics). These medical interventions could be considered for individual patients who are no candidates for preferred treatments (for example surgery).
Onderbouwing
Achtergrond
Approximately 20% of acute diverticulitis patients develops one or more episodes of recurrent diverticulitis. Several studies have focussed on the medical treatment in the prevention of these recurrences. The main candidates are antibiotics (rifaximin), anti-inflammatory drugs (mesalazine) and probiotics.
Conclusies / Summary of Findings
|
Zeer laag GRADE |
De effectiviteit van rifaximine ter preventie van recidief diverticulitis en/of persisterende klachten is niet bewezen.
Bronnen (Lanas, 2013; Festa, 2017; Tursi, 2013) |
|
Hoog GRADE |
Mesalazine is niet effectief voor de preventie van recidief diverticulitis en/of persisterende klachten.
Bronnen (Raskin, 2014; Parente, 2013; Stollmann, 2013) |
|
Zeer laag GRADE |
De combinatie van probiotica met mesalazine is niet effectief.
Bronnen (Stollmann, 2013) |
Samenvatting literatuur
Beschrijving studies
Antibiotics
One randomised placebo controlled trial (RCT) that confirmed the acute diverticulitis diagnosis by imaging or colonoscopy and two observational cohort studies (1 prospective and 1 retrospective) that confirmed the diverticulitis diagnosis using computed tomography or ultrasound were included. (Lanas, 2013; Festa, 2017; Tursi, 2013) All studies employed an intermittent antibiotic treatment protocol with rifaximin (a poorly absorbed antibiotic which is therefore mainly used in gastrointestinal diseases); Festa 10 days a month, Lanas and Tursi 7 days a month. Festa treated all patients with probiotics simultaneously. (Festa, 2017) In both observational studies, the control group consisted of patients treated with mesalazine (anti-inflammatory agent). Festa treated patients with mesalazine 10 days a month (similar to the rifaximin treatment), Tursi treated the patients in the control group with mesalazine continuously (daily) in contrast with the 7 days a month rifaximin treatment. Lanas treated and followed patients for 48 weeks. Festa reported results from a median follow-up duration 15 months and accounted for different follow-up durations between the treatment groups using hazard ratios. Tursi on the other hand, did not state anything about the exact follow-up duration. That study only reported a maximum follow-up duration of 24 months but no information on what percentage of patients reached that 24 months of follow-up. Festa reported rates and hazard ratios for diverticulitis recurrences. Tursi only provided the proportion of patients that were in clinical remission. However, no exact results were reported but figures only.
Anti-inflammatory agents
Three papers including four randomized controlled trials (Parente, 2013; Raskin, 2014; Stollmann, 2013) were included. All randomized controlled trials were double-blinded and randomized uncomplicated or conservatively treated diverticulitis patients between mesalazine treatment and placebo treatment. Stollmann treated patients daily for 3 months with a total follow-up of 12 months. Parente treated patients daily during the entire follow-up duration of 24 months. Raskin reported results from 2 identical and worldwide RCT’s (PREVENT 1 and PREVENT 2) with daily mesalazine or placebo treatment during 2 years. In addition, Raskin divided mesalazine patients in 3 subgroups (1.2g/d, 2.4g/d and 4/8g/d) of different dosages. Therefore the study included a total of 4 groups in which patients were randomised to in a 1:1:1:1 ratio. Outcome measures were recurrent diverticulitis at the end of follow-up (clinical recurrence in the study of Stollmann and imaging proven recurrence in the study of Parente and Raskin). Stollmann additionally evaluated Global Symptom Scores (GSS) at 3 and 12 months. The GSS is a composite score made of the sum of the scores from 10 individual gastrointestinal symptoms (on a scale from 0 (none) to 6 (severe)) most commonly associated with diverticular disease. This score was created by the authors of the study since no validated instrument existed. Parente additionally assessed quality of life using a Therapy Impact Questionnaire (TIQ).
Probiotics
One randomized controlled trial (Stollman, 2013) that confirmed the diverticulitis diagnosis using computed tomography was included. This study included 3 treatment groups; a mesalazine monotherapy group, a mesalazine plus probiotics group and a placebo group. Patients were treated for three months after which all treatment was discontinued and the patients were followed until 12 months after start of treatment. All three groups suffered from high withdrawal numbers; 75% of all patients completed their 12-week treatment and only 62% completed the 52-week study. Main reasons for withdrawal were adverse events, voluntary withdrawal and recurrent diverticulitis requiring surgery. Also, the number of withdrawals differed between groups. Global Symptom Scores (GSS) were reported at 12 weeks and 52 weeks. Furthermore, rates of recurrent diverticulitis on clinical grounds were reported at 52 weeks.
Resultaten
Antibiotics
Lanas found no differences in rates of recurrent diverticulitis at 48 weeks between the rifaximin group and the placebo group (rifaximin 19.3% (17/88) versus placebo 10.4% (8/77); p=0.111). However, additional logistic regression and cox regression analyses adjusting for age, sex, duration and localization of illness, time from last episode and centre recruitment rate demonstrated a beneficial effect of rifaximin compared to placebo treatment (placebo OR 3.20, 95% CI 1.16 to 8.82 and placebo HR 2.64, 95% CI 1.08 to 6.46 respectively). Festa found 9.7% recurrent diverticulitis (7/72) in the rifaximin group versus 26.9% (14/52) in the mesalazine group. This resulted in an unadjusted hazard ratio of 0.33 (95% CI 0.13 to 0.86) for the rifaximin group opposed to the mesalazine group. Adjusting this result for age and gender in a multivariable analysis revealed comparable results (adjusted HR 0.27; 95% CI 0.10 to 0.72). The estimated cumulative proportion of patients free of recurrence at 24 months was 83.3% in the rifaximin group and 71.1% in the mesalazine group. Tursi found opposite results; significantly more patients treated with rifaximin had a recurrent episode of diverticulitis (p=0.002). However, this study reported no exact results but figures and p-values only.
Anti-inflammatory agents
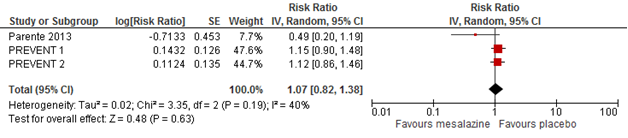
Two randomized and placebo controlled trials reported risks for recurrent diverticulitis at 12 months after start of treatment. Pooled results showed comparable risks for the mesalazine group and the placebo group (RR 0.90; 95% CI 0.48-1.70) (Figure 1) (Parente, 2013; Stollmann, 2013). Also two trials reported 24 months follow-up results showing comparable risks as well (pooled RR 1.07; 95% CI 0.82 to 1.38) (Figure 2) (Raskin, 2014; Parente, 2013). The physical condition quality of life (according to a Therapy Impact Questionnaire) was significantly better in the mesalazine group. (Parente, 2013).
Figure 1 Forest plot of risk ratios for recurrent diverticulitis at 12 months in mesalazine and placebo groups
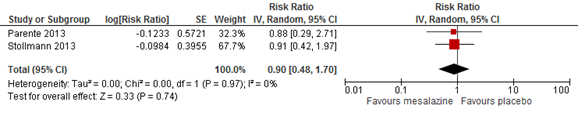
Figure 2 Forest plot of risk ratios for recurrent diverticulitis at 24 months in mesalazine and placebo groups
Probiotics
Clinical recurrent diverticulitis was reported in 31.0% of patients in the placebo group, 28.1% in the mesalazine group and 37.0% in the mesalazine/probiotics group. The study did not provide any GSS scores but no significant differences were found between the treatment groups. At both 12 weeks and 52 weeks, the placebo group reported the highest symptom scores, followed by the mesalazine/probiotics group and the mesalazine group. The proportion of GSS responders (patients that scores 0 or 1 for all 10 symptoms) at 12 weeks was highest in the mesalazine group (63%), followed by the mesalazine/probiotics group (48%) and the placebo group (41%). At 52 weeks the higher proportion of GSS responders was again highest in the mesalazine group (67%), followed by the placebo group (50%) and the mesalazine/probiotics group (29%).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat aantal recidieven en/of persisterende klachten bij behandeling met antibiotica afkomstig uit de gerandomiseerde studie begon op ‘hoog’, en werd vervolgens met 3 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (proof of concept studie) en het geringe aantal patiënten (imprecisie). De bewijskracht afkomstig uit de observationele onderzoeken begon op ‘laag’ en werd vervolgens 1 niveau verlaagd gezien het geringe aantal patiënten (imprecisie).
De bewijskracht voor de uitkomstmaat aantal recidieven en/of persisterende klachten bij behandeling met anti-inflammatoire medicatie begon op ‘hoog’, aangezien het bewijs afkomstig is uit gerandomiseerd gecontroleerd onderzoek. Vervolgens is de bewijskracht niet verlaagd.
De bewijskracht voor de uitkomstmaat aantal recidieven en/of persisterende klachten bij behandeling met probiotica begon op ‘hoog’, aangezien het bewijs afkomstig is uit gerandomiseerd gecontroleerd onderzoek. Vervolgens is de bewijskracht met 3 niveaus verlaagd gezien beperkingen in de extrapoleerbaarheid (bias ten gevolge van indirectheid - alle vergelijkingen zijn gecombineerd met mesalazine) en het geringe aantal patiënten (imprecisie).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvragen:
Wat zijn de (on)gunstige effecten van slecht-resorbeerbare antibiotica ten opzichte van geen of een andere medicamenteuze behandeling bij patiënten met een doorgemaakte acute diverticulitis episode?
Patiënt: doorgemaakte acute diverticulitis episode;
Interventie: slecht-resorbeerbare antibiotica;
Controle: geen of een andere medicamenteuze behandeling;
Outcome: aantal recidieven en/of persisterende klachten.
Wat zijn de (on)gunstige effecten van anti-inflammatoire medicatie ten opzichte van geen of een andere medicamenteuze behandeling bij patiënten met een doorgemaakte acute diverticulitis episode?
Patiënt: doorgemaakte acute diverticulitis episode;
Interventie: anti-inflammatoire medicatie;
Controle: geen of een andere medicamenteuze behandeling;
Outcome: aantal recidieven en/of persisterende klachten.
Wat zijn de (on)gunstige effecten van probiotica ten opzichte van geen of een andere medicamenteuze behandeling bij patiënten met een doorgemaakte acute diverticulitis episode?
Patiënt: doorgemaakte acute diverticulitis episode;
Interventie: probiotica;
Controle: geen of een andere medicamenteuze behandeling;
Outcome: aantal recidieven en/of persisterende klachten.
Relevante uitkomstmaten
De werkgroep achtte recidief diverticulitis en persisterende klachten voor de besluitvorming kritieke uitkomstmaten en kwaliteit van leven een voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Zoeken en selecteren (Methode)
In de databases Medline (OVID), EMBASE en de Cochrane Library (Wiley) is met relevante zoektermen gezocht naar gerandomiseerde klinische onderzoeken, observationele cohortstudies, systematische reviews en/of meta-analyses. Voor de deelvraag over anti-inflammatoire medicatie werden alleen gerandomiseerde onderzoeken geselecteerd. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 931 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- Volledige tekst artikelen beschikbaar (geen taalrestricties).
- Vergelijkend onderzoek.
- Diagnose diverticulitis gesteld op basis van kliniek of beeldvorming.
- Minimaal één van de interventies (antibiotica, anti-inflammatoire medicatie en probiotica).
- Minimaal één van de uitkomstmaten beschreven.
Op basis van titel en abstract werden in eerste instantie 80 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 74 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en 6 studies definitief geselecteerd.
Zes onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Referenties
- Festa V, Spila Alegiani S, Chiesara F, et al. Retrospective comparison of long-term ten-day/month rifaximin or mesalazine in prevention of relapse in acute diverticulitis. European review for medical and pharmacological sciences. 2017;21:1397-404.
- Lanas A, Ponce J, Bignamini A, et al. One year intermittent rifaximin plus fibre supplementation versus fibre supplementation alone to prevent diverticulitis recurrence: A proof-of-concept study. Digestive and Liver Disease. 2013;45(2):104-9.
- Parente F, Bargiggia S, Prada A, et al. Intermittent treatment with mesalazine in the prevention of diverticulitis recurrence: A randomised multicentre pilot double-blind placebo-controlled study of 24-month duration. International journal of colorectal disease. 2013;28:1423-31.
- Raskin JB, Kamm MA, Jamal MM, et al. Mesalamine did not prevent recurrent diverticulitis in phase 3 controlled trials. Gastroenterology. 2014;147(4):793-802.
- Stollman N, Magowan S, Shanahan F, et al. A randomized controlled study of mesalamine after acute diverticulitis: Results of the DIVA trial. Journal of clinical gastroenterology. 2013;47:621-9.
- Tursi A, Elisei W, Giorgetti GM, et al. Effectiveness of different therapeutic strategies in preventing diverticulitis recurrence. European review for medical and pharmacological sciences. 2013;17:342-8.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3 |
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Festa, 2017 |
Type of study: retrospective cohort study
Setting: Single centre
Country: Italy
Source of funding: none |
Inclusion criteria: Acute diverticulitis patients ≥18 years, computed tomography (CT) proven, at least one documented episode of acute diverticulitis in the previous 24 months that resolved without surgery, elevated white blood cell count, elevated C-reactive protein, and abdominal pain
Exclusion criteria: previous abdominal surgery (except appendectomy and hernia repair), history of inflammatory bowel disease or cancer, active psychiatric disease, pregnancy and breast-feeding.
N total at baseline: Intervention: 72 Control: 52
Important prognostic factors2: No significant differences in baseline characteristics |
Ten-day/month treatment with rifaximin 400 mg bid, all patients were invited to introduce a high fibre diet and to assume Lactobacillyus casei DH for 15 days every months. Treatment was started after the index episode.
|
Ten-day/month treatment with mesalazine 2.4 g/daily, all patients were invited to introduce a high fibre diet and to assume Lactobacillyus casei DH for 15 days every months. Treatment was started after the index episode.
|
Length of follow-up: Median 15 months (range 1 to 50), not specified for each treatment group
Loss-to-follow-up: Intervention: none
Control: none
Incomplete outcome data: Intervention: not reported
Control: not reported
|
Recurrence diverticulitis crude 9.7% (7/72) in rifaximin group versus 26.9% (14/52) in mesalazine group Recurrence diverticulitis unadjusted hazard ratio (HR) HR 0.33 (0.13 to 0.86) Recurrence diverticulitis adjusted hazard ratio (R ->M) adjHZ 0.27 (0.10 to 0.72); adjusted for age and gender Patients free of recurrence at 24 months 83.3% in rifaximin group versus 71.1% in mesalazine group (estimated cumulative proportions based on Kaplan-Meier survival)
|
Diverticulitis recurrence was defined as either surgical intervention for diverticular disease or the presence of all of the following: positive CT scan of the abdomen/pelvis, elevated white blood cell count, elevated C-reactive protein, and abdominal pain. |
|
Tursi, 2013 |
Type of study: prospective cohort study
Setting: multicentre
Country: Italy
Source of funding: Not reported |
Inclusion criteria: uncomplicated acute diverticulitis patients, computed tomography proven,
Exclusion criteria: Patients refusing any further treatment after remission of initial episode
N total at baseline: Intervention: 52 Control: 59
Important prognostic factors2: Not any patients characteristics reported |
Rifaximin 800 mg/day for 7 days every month.
All patients were treated with mesalazine 3.2 g/day, rifaximin 800 mg/day, and metronidazole 1 g/day for 7 days to obtain remission of the initial episode. Hereafter study treatment was initiated. Endoscopic control after 6, 12, and thereafter every 12 months. Pan- colonoscopy (clean colon colonoscopy) was per- formed and six biopsy samples of colonic mucosa were collected in the sigmoid tract for histological examination. Biopsies were taken from the mucosa between diverticula. Colonoscopy was again performed at the time of an eventual recurrence. |
Mesalazine 1.6 g/day.
All patients were treated with mesalazine 3.2 g/day, rifaximin 800 mg/day, and metronidazole 1 g/day for 7 days to obtain remission of the initial episode. Hereafter study treatment was initiated. Endoscopic control after 6, 12, and thereafter every 12 months. Pan- colonoscopy (clean colon colonoscopy) was per- formed and six biopsy samples of colonic mucosa were collected in the sigmoid tract for histological examination. Biopsies were taken from the mucosa between diverticula. Colonoscopy was again performed at the time of an eventual recurrence. |
Length of follow-up: Not reported, only a maximum of 24 months of follow-up was reported.
Loss-to-follow-up: 7 patients, no reasons provided nor the number of patients per treatment group
Incomplete outcome data: Not reported
|
Clinical remission No numbers provided, only a figure in which the mesalazine group had a significantly higher proportion of patients with clinical remission (p=0.002) Endoscopic remission No numbers provided, only a figure in which the mesalazine group had a significantly higher proportion of patients with clinical remission (p=0.000) Histological remission No numbers provided, only a figure in which the mesalazine group had a significantly higher proportion of patients with clinical remission (p=0.000) |
No specification of reasons for treatment allocation provided.
Persistence of endoscopic inflammation was defined as detection of signs of inflammation (hyperaemia, erosions, and petechiae) around the diverticular opening.
Recurrence of diverticulitis was defined as return to observation at least 30 days after the initial presentation of the disease because of abdominal pain with or without other symptoms (constipation or diarrhoea and/or fever), associated with detection of increased faecal calprotectin. |
Anti-inflammatory agents in the prevention of recurrent diverticulitis or persistent complaints
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Festa, 2017 |
Type of study: retrospective cohort study
Setting: Single centre
Country: Italy
Source of funding: none |
Inclusion criteria: Acute diverticulitis patients ≥18 years, computed tomography (CT) proven, at least one documented episode of acute diverticulitis in the previous 24 months that resolved without surgery, elevated white blood cell count, elevated C-reactive protein, and abdominal pain.
Exclusion criteria: previous abdominal surgery (except appendectomy and hernia repair), history of inflammatory bowel disease or cancer, active psychiatric disease, pregnancy and breast-feeding.
N total at baseline: Intervention: 52 Control: 72
Important prognostic factors2: No significant differences in baseline characteristics |
Ten-day/month treatment with mesalazine 2.4 g/daily, all patients were invited to introduce a high fibre diet and to assume Lactobacillyus casei DH for 15 days every months. Treatment was started after the index episode.
|
Ten-day/month treatment with rifaximin 400 mg bid, all patients were invited to introduce a high fibre diet and to assume Lactobacillyus casei DH for 15 days every months. Treatment was started after the index episode.
|
Length of follow-up: Median 15 months (range 1 to 50), not specified for each treatment group
Loss-to-follow-up: Intervention: none
Control: none
Incomplete outcome data: Intervention: not reported
Control: not reported
|
Recurrence diverticulitis crude 9.7% (7/72) in rifaximin group versus 26.9% (14/52) in mesalazine group Recurrence diverticulitis unadjusted hazard ratio (HR) (R->M) HR 0.33 (0.13 to 0.86) Recurrence diverticulitis adjusted hazard ratio (R ->M) adjHZ 0.27 (0.10 to 0.72); adjusted for age and gender Patients free of recurrence at 24 months 83.3% in rifaximin group versus 71.1% in mesalazine group (estimated cumulative proportions based on Kaplan-Meier survival)
|
Diverticulitis recurrence was defined as either surgical intervention for diverticular disease or the presence of all of the following: positive CT scan of the abdomen/pelvis, elevated white blood cell count, elevated C-reactive protein, and abdominal pain. |
|
Parente, 2013 |
Type of study: randomized controlled trial
Setting: multicentre
Country: Italy
Source of funding: SOFAR S.p.A., Trezzano Rosa, Milan, Italy |
Inclusion criteria: age between 18 and 85 years, documented episode of uncomplicated diverticulitis during the last months (maximum 12 months). Exclusion criteria: complicated diverticulitis, previous colonic surgery
N total at baseline: Intervention: 45 Control: 47
Important prognostic factors2: No significant differences in baseline characteristics between groups. |
mesalazine (Pentacol®) 800mg one tablet bid for 10 days every month one tablet bid for 10 days every month for a period of 24 months. No selective dietary regimen was prescribed at entry, except the recommendation of a high-fibre diet in all patients. |
Placebo one tablet bid for 10 days every month for a period of 24 months. No selective dietary regimen was prescribed at entry, except the recommendation of a high-fibre diet in all patients. |
Length of follow-up: 24 months
Loss-to-follow-up: Intervention: n=8 (8 serious side effects)
Control: n=8 (4 dropouts, 4 serious side effects
Incomplete outcome data: None
|
Recurrence at 24 months 13.3% (6/45) in mesalazine group versus 27.7% (13/47) in placebo group
Risk of recurrence (M->P) At 6 months: RR 1.061 (95% CI 0.225 to 5.010) At 18 months: RR 0.707 (95% CI 0.272 to 1.841) At 24 months: RR 0.490 (95% CI 0.202 to 1.187)
Quality of life at 24 months TIQ* physical condition: 5.4±2.7 in mesalazine group versus 8.3±5.7 in placebo group (p=0.022) |
Diverticulitis recurrence was diagnosed clinically in the presence of abdominal pain, associated with leucocytosis (more than 11×109/l) and/or fever exceeding 38 °C and con- firmed by imaging techniques (computed tomography and/or bowel ultrasound).
* Therapy Impact Questionnaire; lower score indicates a better quality of life |
|
Stollmann, 2013 |
Type of study: Randomized controlled trial
Setting: Multicentre
Country: USA
Source of funding: Warner Chilcott |
Inclusion criteria: 35 to 85 years of age, clinical diagnosis of acute diverticulitis (first, second, or third attack) confirmed by computed tomography
Exclusion criteria: complicated diverticulitis, pregnancy, irritable bowel syndrome, several other gastrointestinal diseases or surgery recent therapy with corticosteroids or antibiotics (except for those treating the current diverticulitis attack and topical antibiotics).
N total at baseline: Placebo: 41 Mesalazine: 40 Probiotics + mesalazine: 36
Important prognostic factors2: No significant differences in baseline characteristics between treatment groups |
2 groups: mesalazine monotherapy or probiotics/mesalazine
During the first 10 to 14 days, patients received either standard of care plus mesalamine (as six 400mg tablets of Asacol once daily) or standard of care plus placebo, which they took for 10 to 14 days. Dietary supplementation with probiotic or placebo was added after patients had completed their antibiotic regimen for acute diverticulitis, at which time patients randomized to the combined mesalamine/probiotic group received in addition, once daily, capsules of probiotic, whereas patients in the 2 other groups received matching placebo capsules. This regimen was administered for 12 weeks and then discontinued. |
1 placebo monotherapy
During the first 10 to 14 days, patients received either standard of care plus mesalamine (as six 400mg tablets of Asacol once daily) or standard of care plus placebo, which they took for 10 to 14 days. Dietary supplementation with probiotic or placebo was added after patients had completed their antibiotic regimen for acute diverticulitis, at which time patients randomized to the combined mesalamine/probiotic group received in addition, once daily, capsules of probiotic, whereas patients in the 2 other groups received matching placebo capsules. This regimen was administered for 12 weeks and then discontinued. |
Length of follow-up: 12 months
Loss-to-follow-up: Placebo: n=19 (adverse events 3x, investigator’s discretion 3x, lost to follow-up 2x, relapse 3x, voluntary 8x) Mesalazine: n=13 (adverse events 5x, lost to follow-up 2x, relapse 3x, voluntary 3x) Probiotics + mesalazine: n=12 (adverse events 1x, lost to follow-up 2x, relapse 1x, voluntary 6x, protocol violation 2x)
Incomplete outcome data: None |
Clinical recurrent diverticulitis at 52 weeks Placebo 31.0% (9/29), mesalazine 28.1% (9/32), mesalazine+probiotics 37.0% (10/27) Global Symptom Score at 12 weeks No scores reported. No significant differences between groups. Mesalazine/probiotics vs placebo; p=0.629 Global Symptom Score at 52 weeks No scores reported. No significant differences, placebo group highest scores, mesalazine group lowest scores Global Symptom Score responders (= scored 0 or 1 for all 10 symptoms) at 12 weeks Placebo 41.4%, mesalazine 62.5%, mesalazine+probiotics 48.1% (only mesalazine versus placebo statistically significant; p=0.058) Global Symptom Score responders (= scored 0 or 1 for all 10 symptoms) at 52 weeks Placebo 50.0%, mesalazine 66.7%, mesalazine+probiotics 29.2% (no information on significance) |
|
|
Tursi, 2013 |
Type of study: prospective cohort study
Setting: multicentre
Country: Italy
Source of funding: Not reported |
Inclusion criteria: uncomplicated acute diverticulitis patients, computed tomography proven,
Exclusion criteria: Patients refusing any further treatment after remission of initial episode
N total at baseline: Intervention: 59 Control: 52
Important prognostic factors2: Not any patients characteristics reported |
Mesalazine 1.6 g/day.
All patients were treated with mesalazine 3.2 g/day, rifaximin 800 mg/day, and metronidazole 1 g/day for 7 days to obtain remission of the initial episode. Hereafter study treatment was initiated. Endoscopic control after 6, 12, and thereafter every 12 months. Pan- colonoscopy (clean colon colonoscopy) was per- formed and six biopsy samples of colonic mucosa were collected in the sigmoid tract for histological examination. Biopsies were taken from the mucosa between diverticula. Colonoscopy was again performed at the time of an eventual recurrence. |
Rifaximin 800 mg/day for 7 days every month.
All patients were treated with mesalazine 3.2 g/day, rifaximin 800 mg/day, and metronidazole 1 g/day for 7 days to obtain remission of the initial episode. Hereafter study treatment was initiated. Endoscopic control after 6, 12, and thereafter every 12 months. Pan- colonoscopy (clean colon colonoscopy) was per- formed and six biopsy samples of colonic mucosa were collected in the sigmoid tract for histological examination. Biopsies were taken from the mucosa between diverticula. Colonoscopy was again performed at the time of an eventual recurrence. |
Length of follow-up: Not reported, only a maximum of 24 months of follow-up was reported.
Loss-to-follow-up: 7 patients, no reasons provided nor the number of patients per treatment group
Incomplete outcome data: Not reported
|
Clinical remission No numbers provided, only a figure in which the mesalazine group had a significantly higher proportion of patients with clinical remission (p=0.002) Endoscopic remission No numbers provided, only a figure in which the mesalazine group had a significantly higher proportion of patients with clinical remission (p=0.000) Histological remission No numbers provided, only a figure in which the mesalazine group had a significantly higher proportion of patients with clinical remission (p=0.000)
|
No specification of reasons for treatment allocation provided.
Persistence of endoscopic inflammation was defined as detection of signs of inflammation (hyperaemia, erosions, and petechiae) around the diverticular opening.
Recurrence of diverticulitis was defined as return to observation at least 30 days after the initial presentation of the disease because of abdominal pain with or without other symptoms (constipation or diarrhoea and/or fever), associated with detection of increased faecal calprotectin. |
Probiotics in the prevention of recurrent diverticulitis or persistent complaints
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Stollmann, 2013 |
Type of study: Randomized controlled trial
Setting: Multicentre
Country: USA
Source of funding: Warner Chilcott |
Inclusion criteria: 35 to 85 years of age, clinical diagnosis of acute diverticulitis (first, second, or third attack) confirmed by computed tomography
Exclusion criteria: complicated diverticulitis, pregnancy, irritable bowel syndrome, several other gastrointestinal diseases or surgery recent therapy with corticosteroids or antibiotics (except for those treating the current diverticulitis attack and topical antibiotics).
N total at baseline: Placebo: 41 Mesalazine: 40 Probiotics + mesalazine: 36
Important prognostic factors2: No significant differences in baseline characteristics between treatment groups |
Probiotics and mesalazine
During the first 10 to 14 days, patients received either standard of care plus mesalamine (as six 400mg tablets of Asacol once daily) or standard of care plus placebo, which they took for 10 to 14 days. Dietary supplementation with probiotic or placebo was added after patients had completed their antibiotic regimen for acute diverticulitis, at which time patients randomized to the combined mesalamine/probiotic group received in addition, once daily, capsules of probiotic, whereas patients in the 2 other groups received matching placebo capsules. This regimen was administered for 12 weeks and then discontinued. |
2 groups: 1 placebo monotherapy and 1 mesalazine monotherapy
During the first 10 to 14 days, patients received either standard of care plus mesalamine (as six 400mg tablets of Asacol once daily) or standard of care plus placebo, which they took for 10 to 14 days. Dietary supplementation with probiotic or placebo was added after patients had completed their antibiotic regimen for acute diverticulitis, at which time patients randomized to the combined mesalamine/probiotic group received in addition, once daily, capsules of probiotic, whereas patients in the 2 other groups received matching placebo capsules. This regimen was administered for 12 weeks and then discontinued. |
Length of follow-up: 12 months
Loss-to-follow-up: Placebo: n=19 (adverse events 3x, investigator’s discretion 3x, lost to follow-up 2x, relapse 3x, voluntary 8x) Mesalazine: n=13 (adverse events 5x, lost to follow-up 2x, relapse 3x, voluntary 3x) Probiotics + mesalazine: n=12 (adverse events 1x, lost to follow-up 2x, relapse 1x, voluntary 6x, protocol violation 2x)
Incomplete outcome data: None |
Clinical recurrent diverticulitis at 52 weeks Placebo 31.0%, mesalazine 28.1%, mesalazine+probiotics 37.0% Global Symptom Score at 12 weeks No scores reported. No significant differences between groups. Mesalazine/probiotics vs placebo; p=0.629 Global Symptom Score at 52 weeks No scores reported. No significant differences, placebo group highest scores, mesalazine group lowest scores Global Symptom Score responders (= scored 0 or 1 for all 10 symptoms) at 12 weeks Placebo 41.4%, mesalazine 62.5%, mesalazine+probiotics 48.1% (only mesalazine vs placebo statistically significant; p=0.058) Global Symptom Score responders (= scored 0 or 1 for all 10 symptoms) at 52 weeks Placebo 50.0%, mesalazine 66.7%, mesalazine+probiotics 29.2% (no information on significance) |
|
Risk of bias tabellen
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Parente, 2013 |
Not reported. |
Unclear |
Unlikely |
Unlikely |
Unclear |
Unlikely |
Unlikely |
Unlikely |
|
Stollmann, 2013 |
Investigator or designated representative called an Interactive Voice Response System for patient randomization and allocation of study medication. |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Likely due to high number of loss to follow-up and withdrawals |
Unlikely |
Probiotics in the prevention of recurrent diverticulitis or persistent complaints
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Stollmann, 2013 |
Investigator or designated representative called an Interactive Voice Response System for patient randomization and allocation of study medication. |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Likely due to high number of loss to follow-up and withdrawals |
Unlikely |
Anti-inflammatory agents in the prevention of recurrent diverticulitis or persistent complaints
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Festa, 2017 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Tursi, 2013 |
Unlikely |
Likely |
Likely |
Likely |
Antibiotics in the prevention of recurrent diverticulitis or persistent complaints
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Festa, 2017 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Tursi, 2013 |
Unlikely |
Likely |
Likely |
Likely |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 31-05-2018
Beoordeeld op geldigheid : 09-05-2018
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2023 bepaalt het bestuur van de Nederlandse Vereniging voor Heelkunde of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Heelkunde is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (http://www.kennisinstituut.nl) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). Patiëntenparticipatie bij deze richtlijn werd mede gefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ. De SKMS heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Deze richtlijn is bedoeld om een evidence-based beleid voor de zorg voor patiënten met diverticulitis in de tweede lijn op te stellen.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met diverticulitis, te weten chirurgen, maag- lever- darmartsen, internisten, radiologen en huisartsen. Een secundaire doelgroep zijn zorgverleners uit de eerste lijn die betrokken zijn bij de zorg rondom patiënten met diverticulitis, waaronder huisarts, verpleegkundigen (waaronder continentieverpleegkundige en verpleegkundig specialisten) en physician assistants.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2016 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met diverticulitis te maken hebben. Het Nederlands Huisartsen Genootschap (NHG) en de Nederlandse Vereniging voor Spoedeisende Hulp Artsen (NVSHA) zijn uitgenodigd om te participeren in de werkgroep maar heeft geen gebruik gemaakt van de uitnodiging.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn. Stefan van Dijk heeft onder begeleiding van Marja Boermeester de systematische analyses van de literatuur uitgewerkt.
Werkgroep
- Prof. dr. M.A. Boermeester, chirurg, Amsterdam UMC locatie AMC, Amsterdam, NVvH (voorzitter)
- Dr. M.G.J. de Boer, internist, infectioloog, Leids Universitair Medisch Centrum, Leiden, NIV
- S. van Dijk, MSc, arts-onderzoeker chirurgie, Amsterdam UMC locatie AMC, Amsterdam, NVvH
- Dr. W.A. Draaisma, chirurg, Jeroen Bosch Ziekenhuis, Den Bosch, NVvH
- Dr. R.J.F. Felt-Bersma, MDL-arts, VU Medisch Centrum, Amsterdam, NVMDL
- Dr. B.R. Klarenbeek, chirurg, Radboud UMC, Nijmegen, NVvH
- Dr. J.A. Otte, internist, ZorgSaam Zeeuws-Vlaanderen, Terneuzen, NIV
- Dr. J.B.C.M. Puylaert, radioloog, Medisch Centrum Haaglanden, Den Haag, NVvR
Met ondersteuning van:
- Dr. W.A. van Enst, senior-adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Boermeester |
Gastrointestinaal chirurg, hoogleraar chirurgie van abdominale infecties, chirurgisch hoofd van darmfalenteam AMC |
Geen |
"Niet gerelateerd aan deze richtlijn. Niet-gerelateerde institutional grants van J&J/Ethicon, Acelity/KCI, Ipsen, Baxter, Bard, Mylan" |
Geen |
|
De Boer |
Internist, LUMC |
Geen |
Geen |
Geen |
|
Draaisma |
Chirurg, AMC |
lid werkgroep richtlijn Pleuravocht |
Geen |
Geen |
|
Felt-Bersma |
MDL arts, VUMC |
Consultant in de Proctoskliniek Bilthoven |
TEVA sponsort een studie tvgl 3 laxeermiddelen wat we op 1 dec 2016 gaan doen, de gelden komen ten bate van het onderzoek en de ANIOS aanstelling voor 2 mnd |
Geen |
|
Klarenbeek |
Gastrontestinaal en oncologisch chirurg, Radboud UMC |
Geen betaalde nevenfuncties |
ZonMw doelmatigheidssubsidie voor FORCE-trail (BFT na LAR voor rectumcarcinoom). MITEC-subsidies (intern Radboudumc) voor MRI en fluorescentie onderzoek bij oesofaguscarcinoom" |
Geen |
|
Otte |
Internist, ZorgSaam Zeeuws-Vlaanderen |
onbetaald |
Geen |
Geen |
|
Puylaert |
Radioloog, Medisch Centrum Haaglanden |
Geen |
Geen |
Geen |
|
Van Dijk |
Arts-onderzoeker chirurgie, AMC |
Betaald promotieonderzoek bij professor M.A. Boermeester over diverticulitis appendicitis en secundaire peritonitis. |
Geen |
Geen |
|
Van Enst |
Senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten, |
Lid van de GRADE working group/ Dutch GRADE Network |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een focusgroep te houden. Deze werd georganiseerd door de Patiëntenfederatie Nederland. Een verslag hiervan (zie aanverwante producten) is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. De conceptrichtlijn wordt tevens voor commentaar voorgelegd aan de Patiëntenfederatie.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Stakeholders zijn uitgenodigd voor een knelpuntenbijeenkomst (Invitational conference). Vanwege het lage aantal aanmeldingen (twee, NHG en ZN) is de bijeenkomst geannuleerd. Gevraagd is schriftelijk op het raamwerk te reageren. Daarop kwamen geen reacties.
De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn (NVvH, 2014) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen vanuit een patiëntenfocusgroep. De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter, arts-onderzoeker en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De adviseur of werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn heeft de werkgroep overwogen om interne kwaliteitsindicatoren te ontwikkelen om het toepassen van de richtlijn in de praktijk te volgen en te versterken. De werkgroep heeft besloten geen indicatoren te ontwikkelen bij de huidige richtlijn, omdat er of geen substantiële barrières konden worden geïdentificeerd die implementatie van de aanbeveling zouden kunnen bemoeilijken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten (secretariaat@kennisinstituut.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn wordt aan de betrokken (wetenschappelijke) verenigingen en de Patiëntenfederatie Nederland voorgelegd ter commentaar. De commentaren worden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren zal de conceptrichtlijn aangepast worden en definitief vastgesteld door de werkgroep. De definitieve richtlijn wordt aan de deelnemende (wetenschappelijke) verenigingen en de Patiëntenfederatie Nederland voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
- Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
- Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html. 2012.
- Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html. 2013.
- Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
- Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van de Federatie Medisch Specialisten.
Zoekverantwoording
|
Databases:
Geraadpleegd tot: 18-04-2017 |
Zoekstrategie: (diverticulitis(mesh) OR "diverticulitis, colonic"(mesh) OR diverticulitis(tiab) OR diverticular(tiab)) AND ("Anti-Inflammatory Agents"(Mesh) OR “anti-inflammatory” OR mesalamine[tiab] OR mesalazine(tiab) OR sulfasalazine(tiab) OR balsalazide(tiab) OR "5 ASA"(tiab) OR "Probiotics"(Mesh) OR probiotic*(tiab) OR prebiotic*(tiab) OR rifaximin*(tiab)) |
Resultaten: Pubmed 350 hits Embase 581 hits Cochrane 0 hits
Duplicaten: 231 hits
Inclusie: 6 artikelen |
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Annibale, 2011 |
No imaging proven diverticulitis diagnosis |
|
Anonymous 2010 |
No fulltext available |
|
Anonymous 2010 |
No fulltext available |
|
Anonymous 1998 |
No fulltext available |
|
Barbara 2016 |
Irrelevant article type |
|
Bartle 1978 |
No fulltext available |
|
Bassotti 2012 |
Irrelevant article type |
|
Beckham 2009 |
Irrelevant article type |
|
Bianchi 2011 |
No original data |
|
Brandimarte 2004 |
No imaging proven diverticulitis diagnosis |
|
Cianci 2014 |
No clinical outcomes |
|
Cohen 2006 |
Irrelevant article type |
|
Colecchia 2007 |
No imaging proven diverticulitis diagnosis |
|
Comparato 2007 |
No imaging proven diverticulitis diagnosis |
|
Comparato 2007 |
No imaging proven diverticulitis diagnosis |
|
Conte 2013 |
Irrelevant article type |
|
Cuomo 2017 |
Irrelevant article type |
|
Cuomo 2017 |
No fulltext available |
|
Dai 2016 |
Irrelevant article type |
|
Dai 2016 |
Irrelevant article type |
|
Di Mario 2005 |
No imaging proven diverticulitis diagnosis |
|
Di Mario 2006 |
Irrelevant article type |
|
D’Inca 2007 |
No imaging proven diverticulitis diagnosis |
|
Dughera 2004 |
No imaging proven diverticulitis diagnosis |
|
Festi 2009 |
Irrelevant article type |
|
Floch 2015 |
Irrelevant article type |
|
Fric 2003 |
No imaging proven diverticulitis diagnosis |
|
Gatta 2010 |
No original data |
|
Gatta 2012 |
No imaging proven diverticulitis diagnosis |
|
Guslandi 2013 |
Irrelevant article type |
|
Humes 2016 |
Irrelevant article type |
|
Ierfone 2006 |
No imaging proven diverticulitis diagnosis |
|
Iosca 1993 |
No fulltext available |
|
Khan 2016 |
No original data |
|
Kruis 2013 |
No imaging proven diverticulitis diagnosis |
|
Kruse 2015 |
Irrelevant article type |
|
Lahner 2012 |
No imaging proven diverticulitis diagnosis |
|
Lahner 2016 |
Irrelevant article type |
|
Lahner 2016 |
Irrelevant article type |
|
Lamiki 2010 |
No imaging proven diverticulitis diagnosis |
|
Latella 2003 |
No imaging proven diverticulitis diagnosis |
|
Latella 2009 |
Irrelevant article type |
|
Lue 2016 |
Irrelevant article type |
|
Maconi 2011 |
Irrelevant article type |
|
Maconi 2013 |
No fulltext available |
|
Mario 2005 |
No imaging proven diverticulitis diagnosis |
|
Narula 2010 |
Irrelevant article type |
|
Papi 1992 |
No imaging proven diverticulitis diagnosis |
|
Papi 1995 |
No imaging proven diverticulitis diagnosis |
|
Papi 2005 |
Irrelevant article type |
|
Picchio 2016 |
No original data |
|
Pistoia 2004 |
No imaging proven diverticulitis diagnosis |
|
Scaioli 2016 |
Irrelevant article type |
|
Scarpignato 2016 |
Irrelevant article type |
|
Sheth 2009 |
Irrelevant article type |
|
Simon 2006 |
No imaging proven diverticulitis diagnosis |
|
Sopena 2011 |
Irrelevant article type |
|
Stallinger 2014 |
No imaging proven diverticulitis diagnosis |
|
Trepsi 1999 |
No imaging proven diverticulitis diagnosis |
|
Trespi 1997 |
No fulltext available |
|
Trespi 1997 |
No imaging proven diverticulitis diagnosis |
|
Tursi 2002 |
No imaging proven diverticulitis diagnosis |
|
Tursi 2005 |
No imaging proven diverticulitis diagnosis |
|
Tursi 2006 |
No imaging proven diverticulitis diagnosis |
|
Tursi 2007 |
No imaging proven diverticulitis diagnosis |
|
Tursi 2007 |
No imaging proven diverticulitis diagnosis |
|
Tursi 2008 |
No imaging proven diverticulitis diagnosis |
|
Tursi 2008 |
No imaging proven diverticulitis diagnosis |
|
Tursi 2011 |
Irrelevant article type |
|
Tursi 2012 |
Irrelevant article type |
|
Tursi 2013 |
No imaging proven diverticulitis diagnosis |
|
Tursi 2013 |
Irrelevant article type |
|
Tursi 2013 |
Patient cohort overlapping with included study ‘Tursi, 2013’ and study comparing different mesalazine protocols instead of comparison between mesalazine and different or no medication. |
|
Tursi 2013 |
Study on effect of mesalazine but no randomised trial |
|
Tursi 2015 |
Irrelevant article type |
|
Tursi 2016 |
No original data |
|
Tursi 2016 |
Irrelevant article type |
|
Unlu 2012 |
No original data |
|
Weiss 2008 |
Irrelevant article type |
