Follow-up colonoscopie na diverticulitis
Uitgangsvraag
Dient na een episode diverticulitis een colonscopie ter uitsluiting van maligniteit of ander onderliggend lijden verricht te worden?
Aanbeveling
Een colonoscopie ter uitsluiting van een maligniteit lijkt niet geïndiceerd bij patiënten die een episode van ongecompliceerde diverticulitis hebben doorgemaakt.
Overweeg een colonoscopie te verrichten na een echo- of CT-bewezen, conservatief behandelde gecompliceerde diverticulitis (abces of perforatie), bij patiënten met persisterende klachten of anderszins een verdenking op maligniteit (alarmsymptomen als gewichtsverlies, microcytaire anemie of langduriger wisselend defaecatiepatroon et cetera).
Overwegingen
Sixteen observational studies reported rates of advanced colorectal neoplasm (ACN) or colorectal carcinoma (CRC). However, only two studies included a control group of asymptomatic individuals. These two studies demonstrated comparable rates of ACN (diverticulitis pooled 4.4% versus control pooled 8.2%; RR 0.59, 95% CI 0.33 to 1.04) and CRC (diverticulitis pooled 0.7% versus control pooled 0.6%; RR 1.80, 95% CI 0.66 to 4.96).
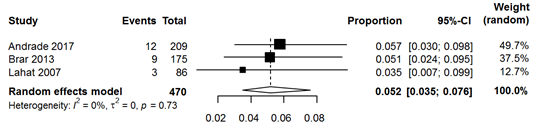
More evidence is available from studies including only acute diverticulitis patients, eight studies on ACN rates and 16 studies on CRC rates. ACN was found in 6.9% (95% CI 5.0% to 9.4%) and CRC was found in 2.2% (95% CI 1.5% to 3.2%). However, studies reporting rates in subgroups of uncomplicated acute diverticulitis patients found lower rates of ACN and CRC. Three studies found 5.2% ACN in these uncomplicated patients and six studies found 0.5% CRC in uncomplicated diverticulitis patients.
Since most studies did not include a control group, these rates can only be compared to rates in literature. The incidence of ACN in studies including asymptomatic screening colonoscopy populations varies between 3.8% and 10.3% (Hilsden, 2015; Quintero, 2012), with most studies (including one meta-analysis with 68,324 patients) reporting rates between 6% and 8%. (Blumenstein, 2013; Bokemeyer, 2009; Lisa, 2010; Niv, 2008; Segnan, 2007; Stoop, 2012). The 6.9% in the present review seems to be comparable to these rates in literature.
The incidence of CRC however seems to be higher in acute diverticulitis patients, which was 2.2% in the present review. In literature, asymptomatic screening populations demonstrate slightly lower CRC rates from 0.4% to 1.0%. (Blumenstein, 2013; Bokemeyer, 2009; Hilsden, 2015; Lisa, 2010; Niv, 2008; Quintero, 2012; Segnan, 2007; Stoop, 2012) Although these screening patients were not matched to the acute diverticulitis patients from the studies included in the present review, patients in literature seem to be comparable. The screening studies included asymptomatic patients from a general population mostly aged between 50 and 75 years, whereas patients with a familial history of colorectal cancer were mostly excluded.
Although the overall incidence of CRC in acute diverticulitis seems to be slightly higher, the rate of CRC in patients with uncomplicated acute diverticulitis appeared to be only 0.5% which is similar to the rates in asymptomatic screening populations. Therefore, routine colonoscopy after an uncomplicated diverticulitis episode seems not necessary, whereas a colonoscopy after a conservatively treated episode of complicated diverticulitis (including abscess) may be appropriate.
It should be noted that all patients included in the present study were diagnosed with acute diverticulitis based on CT. Some studies stated that patients with lesions suspected of malignancy were excluded. These suspected lesions could have been missed on ultrasound and therefore the incidence of malignancy may be slightly higher in patients who did not undergo CT. Although an earlier Dutch study (Van de Wall, 2012) including both CT-proven and ultrasound-proven diverticulitis patients, found comparable prevalences (ACN in 7 out of 205 patients (3.4%) and CRC in 2 out of 205 patients (1.0%)). Furthermore, patients with persistent complaints after an episode of acute diverticulitis may not have been included in the studies when they underwent surgery before colonoscopy or were excluded in studies since such patients underwent colonoscopy on indication rather than a mere screening colonoscopy after a period of diverticulitis.
Routine colonoscopy seems appropriate for patients with persistent complaints after an episode of acute diverticulitis and may be considered to rule out malignancy in patients with non-surgical treatment of complicated diverticulitis. In contrast, patients with uncomplicated acute diverticulitis do not appear to have an increased risk for ACN or CRC and routine colonoscopy may be omitted. These patients can be referred back to the national colorectal cancer screening programme.
Onderbouwing
Achtergrond
Routine colonoscopy to exclude an underlying malignancy has been considered mandatory for decades, based on studies that showed increased rates of colorectal malignancies in acute diverticulitis patients. In recent years this strategy has been topic of debate because computed tomography (CT) increased the diagnostic accuracy of acute diverticulitis and decreased the number of misclassifications of colorectal malignancy as acute diverticulitis. If acute diverticulitis patients do not have a higher risk for colorectal malignancy or advanced colorectal neoplasia compared to the healthy reference population but merely a diagnostic uncertainly in a minority of patients, the discomfort, costs and possible morbidity of a colonoscopy could be avoided in most patients.
Conclusies / Summary of Findings
|
Zeer laag GRADE |
Het aantal patiënten na een episode van acute diverticulitis waarbij een advanced adenoom werd aangetroffen lijkt vergelijkbaar met een gezonde screeningspopulatie (RR 0,59, 95% CI 0,33 to 1,04).
Bronnen (Daniels, 2015; Lecleire, 2014) |
|
Zeer laag GRADE |
Het aantal patiënten na een episode van acute diverticulitis waarbij een colorectaal carcinoom werd aangetroffen lijkt vergelijkbaar met een gezonde screeningspopulatie (RR 1.80, 95% CI 0.66 to 4.96).
Bronnen (Daniels, 2015; Lecleire, 2014) |
|
- GRADE |
Na een episode van acute diverticulitis wordt bij 6,9% van de patiënten een advanced adenoom aangetroffen, bij patiënten na een episode van ongecompliceerde diverticulitis is dit percentage iets lager met 5,2%.
Bronnen (Andrade, 2017; Brar, 2013; Choi, 2014; Daniels, 2015; Lahat, 2007; Lecleire, 2014; Ou, 2015; Schmilovitz, 2012) |
|
- GRADE |
Na een episode van acute diverticulitis wordt bij 2,2% van de patiënten een colorectaal carcinoom aangetroffen, bij patiënten na een episode van ongecompliceerde diverticulitis is dit percentage lager met 0,5%.
Bronnen (Alexandersson, 2014; Andrade, 2017; Brar, 2013; Chabok, 2013; Choi, 2014; Daniels, 2015; Elmi, 2013; Hjern, 2007; Lahat, 2007; Lau, 2011; Lecleire, 2014; Ou, 2015; Sakhnini, 2004; Sallinen, 2014; Schmilovitz, 2012; Suhardja, 2017) |
Samenvatting literatuur
Sixteen observational cohort studies were included. Ten studies were conducted in Europe, 2 in Canada, 2 in Australia, 1 in the USA and 1 in Korea (from which only left-sided diverticulitis patients were included in the present review). From five studies only left-sided diverticulitis patients could be included and the other studies did not report the proportion of left-sided diverticulitis but were from Western origin. Most studies only included patients treated conservatively and excluded patients who had undergone a colonoscopy in the year(s) prior to the acute diverticulitis episode. Six of 16 studies reported outcomes of either only uncomplicated diverticulitis patients or reported outcomes only in subgroups of uncomplicated diverticulitis (Alexandersson, 2014; Andrade, 2017; Brar, 2013; Lahat, 2007; Schmilovitz, 2012; Suhardja, 2017). Only patients who underwent a colonoscopy were included in the present review. Most follow-up colonoscopies were performed within a few months after the acute diverticulitis episode, although also colonoscopies performed later but within 1 year after the episode were included. Only two studies included a control group of healthy individuals. (Daniels, 2015; Lecleire, 2014) A Dutch study (Daniels, 2015) included control patients from a general population screening colonoscopy cohort that were randomly selected from the population in the age of 50 to 75 years. A French study (Lecleire, 2015) included sex and age matched control patients with a familial history of colorectal cancer or neoplasia (not occurring below the age of 50) that underwent screening colonoscopy in the same hospitals as the diverticulitis patients. All 16 studies reported rates of colorectal carcinoma (of which 6 studies reported results in an uncomplicated diverticulitis subgroup) and 8 studies reported rates of advanced colorectal neoplasms (of which 3 studies reported results in an uncomplicated diverticulitis subgroup). Advanced colorectal neoplasm was defined by colorectal carcinoma or another advanced neoplasm (adenoma of 10mm or larger, 25% or more villous features (also classified as tubulovillous or villous histology), or with high-grade dysplasia).
Resultaten
Advanced colorectal neoplasms (ACN)
Only two studies compared rates of ACN between acute diverticulitis patients and healthy controls. ACN was found non-significantly less in diverticulitis patients (diverticulitis patients pooled 4.4% versus controls pooled 8.2%; RR 0.59, 95% CI 0.33 to 1.04) (Figure 1). Eight studies reported ACN rates in only diverticulitis patients, yielding a pooled rate of 6.9% (Figure 2). Meta-analysis of uncomplicated diverticulitis subgroup from 3 studies demonstrated a slightly (non-significantly) lower rate of 5.2% (Figure 3).
Figure 1 Forest plot of studies reporting rates of ACN in CT-proven acute diverticulitis patients compared with healthy patients from a screening reference population.
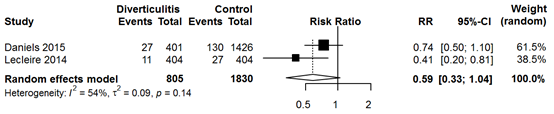
Figure 2 Forest plot of studies reporting rates of ACN in all CT-proven acute diverticulitis patients.
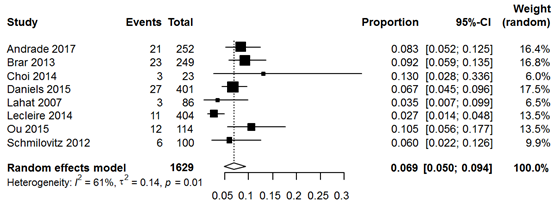
Figure 3 Forest plot of studies reporting rates of ACN in CT-proven uncomplicated acute diverticulitis patients.
Colorectal carcinoma (CRC)
The same two studies compared rates of CRC between acute diverticulitis patients and healthy controls. Rates of CRC were comparable among groups (diverticulitis patients pooled 0.7% versus controls pooled 0.6%; RR 1.80, 95% CI 0.66 to 4.96) (Figure 4). Sixteen studies reported CRC rates in only diverticulitis patients, yielding a pooled rate of 2.2% (Figure 5). Meta-analysis of uncomplicated diverticulitis subgroup from 6 studies demonstrated a lower rate of 0.5% (Figure 6). Colorectal carcinomas were located at the site of the acute diverticulitis segment in the vast majority of cases. Nine studies, including 42 cases of CRC, reported locations of CRC; only 2 cases were not left-sided.
Figure 4 Forest plot of studies reporting rates of CRC in CT-proven acute diverticulitis patients compared with healthy patients from a screening reference population.
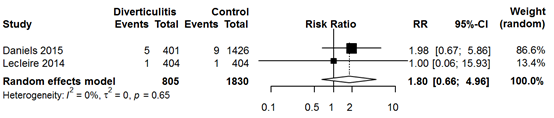
Figure 5 Forest plot of studies reporting rates of CRC in all CT-proven acute diverticulitis patients.
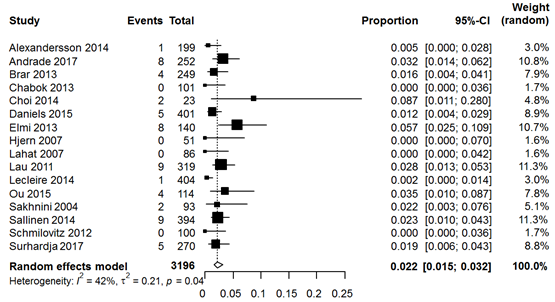
Figure 6 Forest plot of studies reporting rates of CRC in CT-proven uncomplicated acute diverticulitis patients.
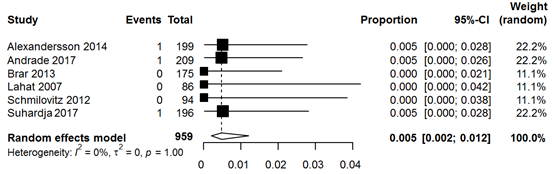
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat advanced adenoom begon op ‘laag’ aangezien het bewijs afkomstig is uit observationeel onderzoek. Vervolgens is de bewijskracht met 1 niveau verlaagd gezien het gering aantal patiënten dat geïncludeerd werd in de vergelijkende studies (imprecisie).
De bewijskracht voor de uitkomstmaat colorectaal carcinoom begon op ‘laag’ aangezien het bewijs afkomstig is uit observationeel onderzoek. Vervolgens is de bewijskracht met 1 niveau verlaagd gezien het gering aantal patiënten dat geïncludeerd werd in de vergelijkende studies (imprecisie).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Is de kans op het hebben van colorectale neoplasmata verhoogd in patiënten die een episode acute diverticulitis hebben doorgemaakt ten opzichte van de gezonde populatie?
Patiënt: episode van acute diverticulitis doorgemaakt;
Interventie: incidentie in acute diverticulitis patiënten;
Controle: incidentie is gezonde referentiepopulatie;
Outcome: advanced adenoom, colorectaal carcinoom.
Relevante uitkomstmaten
De werkgroep achtte advanced adenoom en colorectaal carcinoom voor de besluitvorming kritieke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Zoeken en selecteren (Methode)
In de databases Medline (OVID), EMBASE en de Cochrane Library (Wiley) is met relevante zoektermen gezocht naar gerandomiseerde klinische onderzoeken. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 3933 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- Volledige tekst artikelen beschikbaar (geen taalrestricties).
- Observationele cohortstudies of gerandomiseerde klinische onderzoeken.
- CT-bewezen acute diverticulitis.
- Minimaal 80% linkszijdige diverticulitis, indien proportie linkszijdige diverticulitis niet beschrijven alleen Westerse studies (zeer aannemelijk dat hierin de grote meerderheid linkszijdige diverticulitis betreft).
- Follow-up middels colonoscopie.
- Follow-up colonoscopie na diagnose acute diverticulitis en maximaal 1 jaar na acute diverticulitis.
- Minimaal één van de uitkomsten beschreven.
Op basis van titel en abstract werden in eerste instantie 127 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 111 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 16 studies definitief geselecteerd.
Zestien onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Referenties
- Alexandersson BT, Hreinsson JP, Stefansson T, et al. The risk of colorectal cancer after an attack of uncomplicated diverticulitis. Scandinavian journal of gastroenterology. 2014;49(5):576-80.
- Andrade P, Ribeiro A, Ramalho R, et al. Routine Colonoscopy after Acute Uncomplicated Diverticulitis - Challenging a Putative Indication. Digestive surgery. 2017;34(3):197-202.
- Blumenstein I, Tacke W, Bock H, et al. Prevalence of colorectal cancer and its precursor lesions in symptomatic and asymptomatic patients undergoing total colonoscopy: results of a large prospective, multicenter, controlled endoscopy study. Eur J Gastroenterol Hepatol. 2013;25(5):556-61.
- Bokemeyer B, Bock H, Huppe D, et al. Screening colonoscopy for colorectal cancer prevention: results from a German online registry on 269000 cases. Eur J Gastroenterol Hepatol. 2009;21(6):650-5.
- Brar MS, Roxin G, Yaffe PB, et al. Colonoscopy following nonoperative management of uncomplicated diverticulitis may not be warranted. Diseases of the colon and rectum. 2013;56(11):1259-64.
- Chabok A, Smedh K, Nilsson S, et al. CT-colonography in the follow-up of acute diverticulitis: patient acceptance and diagnostic accuracy. Scandinavian journal of gastroenterology. 2013;48(8):979-86.
- Choi YH, Koh SJ, Kim JW, et al. Do we need colonoscopy following acute diverticulitis detected on computed tomography to exclude colorectal malignancy? Digestive diseases and sciences. 2014;59(9):2236-42.
- Daniels L, Ünlü Ç, de Wijkerslooth TR, et al. Yield of colonoscopy after recent CT-proven uncomplicated acute diverticulitis: a comparative cohort study. Surgical endoscopy. 2015;29(9):2605-13.
- Elmi A, Hedgire SS, Pargaonkar V, et al. Is early colonoscopy beneficial in patients with CT-diagnosed diverticulitis? AJR American journal of roentgenology. 2013;200(6):1269-74.
- Hilsden RJ, Dube C, Heitman SJ, et al. The association of colonoscopy quality indicators with the detection of screen-relevant lesions, adverse events, and postcolonoscopy cancers in an asymptomatic Canadian colorectal cancer screening population. Gastrointest Endosc. 2015;82(5):887-94.
- Hjern F, Jonas E, Holmström B, et al. CT colonography versus colonoscopy in the follow-up of patients after diverticulitis - a prospective, comparative study. Clinical radiology. 2007;62(7):645-50.
- Lahat A, Yanai H, Menachem Y, et al. The feasibility and risk of early colonoscopy in acute diverticulitis: a prospective controlled study. Endoscopy. 2007;39(6):521-4.
- Lau KC, Spilsbury K, Farooque Y, et al. Is colonoscopy still mandatory after a CT diagnosis of left-sided diverticulitis: can colorectal cancer be confidently excluded? Diseases of the colon and rectum. 2011;54(10):1265-70.
- Lecleire S, Nahon S, Alatawi A, et al. Diagnostic impact of routine colonoscopy following acute diverticulitis: A multicenter study in 808 patients and controls. United European gastroenterology journal. 2014;2(4):301-6.
- Lisi D, Hassan C, Crespi M, et al. Participation in colorectal cancer screening with FOBT and colonoscopy: an Italian, multicentre, randomized population study. Dig Liver Dis. 2010;42(5):371-6.
- Niv Y, Hazazi R, Levi Z, et al. Screening colonoscopy for colorectal cancer in asymptomatic people: a meta-analysis. Dig Dis Sci. 2008;53(12):3049-54.
- Ou G, Rosenfeld G, Brown J, et al. Colonoscopy after CT-diagnosed acute diverticulitis: Is it really necessary? Canadian journal of surgery Journal canadien de chirurgie. 2015;58(4):226-31.
- Quintero E, Castells A, Bujanda L, et al. Colonoscopy versus fecal immunochemical testing in colorectal-cancer screening. N Engl J Med. 2012;366(8):697-706.
- Sai VF, Velayos F, Neuhaus J, et al. Colonoscopy after CT diagnosis of diverticulitis to exclude colon cancer: a systematic literature review. Radiology. 2012;263(2):383-90.
- Sakhnini E, Lahat A, Melzer E, et al. Early colonoscopy in patients with acute diverticulitis: results of a prospective pilot study. Endoscopy. 2004;36(6):504-7.
- Sallinen V, Mentula P, Leppäniemi A. Risk of colon cancer after computed tomography-diagnosed acute diverticulitis: is routine colonoscopy necessary? Surgical endoscopy. 2014;28(3):961-6.
- Schmilovitz-Weiss H, Yalunin E, Boaz M, et al. Does a colonoscopy after acute diverticulitis affect its management?: a single center experience. Journal of clinical gastroenterology. 2012;46(4):317-20.
- Segnan N, Senore C, Andreoni B, et al. Comparing attendance and detection rate of colonoscopy with sigmoidoscopy and FIT for colorectal cancer screening. Gastroenterology. 2007;132(7):2304-12.
- Stoop EM, de Haan MC, de Wijkerslooth TR, et al. Participation and yield of colonoscopy versus non-cathartic CT colonography in population-based screening for colorectal cancer: a randomised controlled trial. Lancet Oncol. 2012;13(1):55-64.
- Suhardja TS, Norhadi S, Seah EZ, et al. Is early colonoscopy after CT-diagnosed diverticulitis still necessary? International journal of colorectal disease. 2017;32(4):485-9.
- Van de Wall BJ, Reuling EM, Consten EC et al. Endoscopic evaluation of the colon after an episode of diverticulitis: a call for a more selective approach. Int J Colorectal Dis. 2012 Sep;27(9):1145-50. doi: 10.1007/s00384-012-1448-0.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Alexandersson, 2014 |
Type of study: retrospective cohort study
Setting: monocentre
Country: Iceland |
Inclusion criteria: primary and uncomplicated diverticulitis
Exclusion criteria: none
N total at baseline: 282 of whom 199 underwent colonoscopy
Important prognostic factors2: Age median 58 (IQR 50-67) Proportion left-sided not reported |
Incidence rates in CT proven acute diverticulitis patients |
None
|
Length of follow-up: colonoscopy after 6 to 8 weeks
|
CRC incidence 0.5% (1/199) |
|
|
Andrade, 2017 |
Type of study: retrospective cohort study
Setting: monocentre
Country: Portugal
|
Inclusion criteria: conservatively treated patients
Exclusion criteria: none
N total at baseline: 252
Important prognostic factors2: Age mean 55 (SD 11.1) Proportion left-sided not reported |
Incidence rates in CT proven acute diverticulitis patients |
None |
Length of follow-up: Colonoscopy after mean 16 weeks (SD 11.4), all within 1 year |
ACN incidence 8.3% (21/252) (all patients) 5.7% (12/209) (uncomplicated subgroup)
CRC incidence 3.2% (8/252) (all patients) 0.5% (1/209) (uncomplicated subgroup) |
|
|
Brar, 2013 |
Type of study: retrospective cohort study
Setting: monocentre
Country: Canada
|
Inclusion criteria: conservatively treated patients
Exclusion criteria: patients who underwent colonoscopy within 2 years before acute diverticulitis
N total at baseline: 249
Important prognostic factors2: Age mean 55 (range 27-90) 100% left-sided |
Incidence rates in CT proven acute diverticulitis patients |
None |
Length of follow-up: Colonoscopy after median 90 days (IQR 85), all within 1 year |
ACN incidence 9.2% (23/249) (all patients) 5.1% (9/175) (uncomplicated subgroup)
CRC incidence 1.6% (4/249) (all patients) 0.0% (0/175) (uncomplicated subgroup)
|
|
|
Chabok, 2013
|
Type of study: prospective cohort study
Setting: multicentre
Country: Sweden
|
Inclusion criteria: none
Exclusion criteria: patients who underwent colonoscopy within 2 years before acute diverticulitis
N total at baseline: 101
Important prognostic factors2: Age median 56 (range 27-84) 100% left-sided |
Incidence rates in CT proven acute diverticulitis patients
|
None |
Length of follow-up: Colonoscopy after 6 to 8 weeks |
CRC incidence 0.0% (0/101) |
|
|
Choi, 2014 |
Type of study: retrospective cohort study
Setting: multicentre
Country: Korea
|
Inclusion criteria: only left-sided patients included in the present study
Exclusion criteria: history of colorectal cancer, patients who underwent colonoscopy within 1 year before acute diverticulitis
N total at baseline: 23
Important prognostic factors2: Age not reported 100% left-sided |
Incidence rates in CT proven acute diverticulitis patients
|
None |
Length of follow-up: Within 1 year |
ACN incidence 13.0% (3/23)
CRC incidence 8.7% (2/23) |
|
|
Daniels, 2015 |
Type of study: retrospective cohort study
Setting: monocentre
Country: Netherlands
|
Inclusion criteria: Hinchey 1a and 1b diverticulitis, included in RCT (DIABOLO trial), endoscopy within 6 months after acute diverticulitis
Exclusion criteria: none
N total at baseline: Diverticulitis: 401 Control: 1426
Important prognostic factors2: Age median 57 (IQR 49-65) 100% left-sided |
Incidence rates in CT proven acute diverticulitis patients
|
1426 participants for screening colonoscopy (6600 invited) from the general population, randomly selected from the regional municipal administration, aged 50–75 years, and living in the wider Amsterdam and Rotterdam regions |
Length of follow-up: Colonoscopy after median 55 days, all within 6 months
|
ACN incidence 6.7% (27/401) (diverticulitis) 8.7% (124/1426) (control)
CRC incidence 1.2% (5/401) (diverticulitis) 0.6% (9/1426) (control)
|
|
|
Elmi, 2013
|
Type of study: retrospective cohort study
Setting: monocentre
Country: USA
|
Inclusion criteria: colonoscopy within 6 months after acute diverticulitis
Exclusion criteria: patients with history of colorectal carcinoma
N total at baseline: 140
Important prognostic factors2: Age not reported Proportion left-sided not reported |
Incidence rates in CT proven acute diverticulitis patients
|
|
Length of follow-up: colonoscopy within 6 months
|
CRC incidence 5.7% (8/140) |
|
|
Hjren, 2007 |
Type of study: prospective cohort study
Setting: monocentre
Country: Sweden
|
Inclusion criteria: none
Exclusion criteria: none
N total at baseline: 51
Important prognostic factors2: Age mean 56 (range 29-79) Proportion left-sided not reported |
Incidence rates in CT proven acute diverticulitis patients
|
|
Length of follow-up: colonoscopy after median 85 days (range 29 to 153)
|
CRC incidence 0.0% (0/51) |
|
|
Lahat 2007
|
Type of study: prospective cohort study
Setting: monocentre
Country: Israel
|
Inclusion criteria: uncomplicated diverticulitis
Exclusion criteria: patients with a lesion seen on CT that was suspicious of colonic cancer, patients who had undergone a colonoscopy within the year prior
N total at baseline: 86
Important prognostic factors2: Age 60.4 years (SD 12.7) Proportion left-sided not reported |
Incidence rates in CT proven acute diverticulitis patients
|
None |
Length of follow-up: Colonoscopy within 19 weeks
|
ACN incidence 3.5% (3/86) (uncomplicated subgroup)
CRC incidence 0.0% (0/86) (uncomplicated subgroup)
|
|
|
Lau, 2011 |
Type of study: retrospective cohort study
Setting: multicentre
Country: Australia
|
Inclusion criteria: none
Exclusion criteria: patients who underwent colonoscopy within 1 year before acute diverticulitis
N total at baseline: 319
Important prognostic factors2: Age mean 59.8 (SD 15.2) 100% left-sided |
Incidence rates in CT proven acute diverticulitis patients
|
None
|
Length of follow-up: colonoscopy within 1 year
|
CRC incidence 2.8% (9/319) |
|
|
Lecleire 2014 |
Type of study: retrospective cohort study
Setting: multicentre
Country: France
|
Inclusion criteria: primary diverticulitis
Exclusion criteria: Patients with haematochezia, recent change in bowel habits or a history of colorectal neoplasia and patients who had undergone a colonoscopy within the 2 years before diverticulitis
N total at baseline: Diverticulitis: 404 Control: 404
Important prognostic factors2: Age Mean 60.9 (SD 12.6) Proportion left-sided not reported |
Incidence rates in CT proven acute diverticulitis patients
|
Sex and age matched patients from a control population with familial history of colorectal adenoma or neoplasia, no digestive complain or symptom, screening colonoscopy in same 3 hospital during the same 7 year period. Excluded were patients with alarm symptoms, such as haematochezia, abdominal pain or recent change in bowel habits; patients with a history of inflammatory bowel disease or carrier of a genetic mutation, such as Lynch syndrome or familial adenomatous polyposis (FAP); patients with a personal history of colorectal neoplasia; and patients with a familial history of colorectal neoplasia that occurred before 50 years of age |
Length of follow-up: colonoscopy after mean 62 days, all within 6 months
|
ACN incidence 2.7% (11/404) (diverticulitis)
CRC incidence 0.2% (1/404) (diverticulitis) 0.2% (1/404) (control) |
|
|
Ou, 2015 |
Type of study: retrospective cohort study
Setting: monocentre
Country: Canada
|
Inclusion criteria: none
Exclusion criteria: none
N total at baseline: 114
Important prognostic factors2: Age mean 59.4 (SD 15.1) Proportion left-sided not reported |
Incidence rates in CT proven acute diverticulitis patients
|
None
|
Length of follow-up: colonoscopy after median 3 months (IQR 2.0 to 5.5), all within 1 year |
ACN incidence 10.5% (12/114)
CRC incidence 3.5% (4/114) |
|
|
Sakhnini. 2004 |
Type of study: prospective cohort study
Setting: monocentre
Country: Israel
|
Inclusion criteria: none
Exclusion criteria: patients who had undergone a colonoscopy within 1 year before diverticulitis
N total at baseline: 93
Important prognostic factors2: Age mean 63 (range 30-89) Proportion left-sided not reported |
Incidence rates in CT proven acute diverticulitis patients
|
None
|
Length of follow-up: colonoscopy after median 5.8 days (range 4 to 12)
|
CRC incidence 2.2% (2/93) |
|
|
Sallinen. 2014 |
Type of study: retrospective cohort study
Setting: monocentre
Country: Finland
|
Inclusion criteria: conservatively treated patients
Exclusion criteria: none
N total at baseline: 394
Important prognostic factors2: Age mean 58.3 (13.9) Proportion left-sided not reported |
Incidence rates in CT proven acute diverticulitis patients
|
None
|
Length of follow-up: colonoscopy after mean 122 days (SD 180)
|
CRC incidence 2.3% (9/394) |
|
|
Schmilovitz, 2012 |
Type of study: retrospective cohort study
Setting: monocentre
Country: Israel
|
Inclusion criteria: none
Exclusion criteria: none
N total at baseline: 100
Important prognostic factors2: Age mean 61.8 (14.3) Proportion left-sided not reported |
Incidence rates in CT proven acute diverticulitis patients
|
None
|
Length of follow-up: colonoscopy after 4 to 6 weeks
|
ACN incidence 6.0% (6/100) (all patients)
CRC incidence 0.0% (0/100) (all patients) 0.0% (0/94) (uncomplicated subgroup)
|
|
|
Suhardja, 2017 |
Type of study: retrospective cohort study
Setting: monocentre
Country: Australia
|
Inclusion criteria: none
Exclusion criteria: none
N total at baseline: 270
Important prognostic factors2: Age mean 58.8 (IQR 47-71) Proportion left-sided not reported |
Incidence rates in CT proven acute diverticulitis patients
|
None
|
Length of follow-up: colonoscopy within 12 months
|
CRC incidence 1.9% (5/270) (all patients) 0.5% (1/196) (uncomplicated subgroup)
|
|
Risk of bias tabel
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Alexandersson 2014 |
Unlikely |
Unlikely |
Unlikely |
Unclear |
|
Andrade 2017 |
Unlikely |
Unlikely |
Unlikely |
Unclear |
|
Brar 2013 |
Unlikely |
Unlikely |
Unlikely |
Unclear |
|
Chabok 2013 |
Unlikely |
Unlikely |
Unlikely |
Unclear |
|
Choi 2014 |
Unlikely |
Unlikely |
Unlikely |
Unclear |
|
Daniels 2015 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Elmi 2013 |
Unlikely |
Unlikely |
Unlikely |
Unclear |
|
Hjern 2007 |
Unlikely |
Unlikely |
Unlikely |
Unclear |
|
Lahat 2007 |
Unlikely |
Unlikely |
Unlikely |
Unclear |
|
Lau 2011 |
Unlikely |
Unlikely |
Unlikely |
Unclear |
|
Lecleire 2014 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Ou 2015 |
Unlikely |
Unlikely |
Unlikely |
Unclear |
|
Sakhnini 2004 |
Unlikely |
Unlikely |
Unlikely |
Unclear |
|
Sallinen 2014 |
Unlikely |
Unlikely |
Unlikely |
Unclear |
|
Schmilovitz 2012 |
Unlikely |
Unlikely |
Unlikely |
Unclear |
|
Suhardja 2017 |
Unlikely |
Unlikely |
Unlikely |
Unclear |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 31-05-2018
Beoordeeld op geldigheid : 09-05-2018
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2023 bepaalt het bestuur van de Nederlandse Vereniging voor Heelkunde of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Heelkunde is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (http://www.kennisinstituut.nl) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). Patiëntenparticipatie bij deze richtlijn werd mede gefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ. De SKMS heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Deze richtlijn is bedoeld om een evidence-based beleid voor de zorg voor patiënten met diverticulitis in de tweede lijn op te stellen.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met diverticulitis, te weten chirurgen, maag- lever- darmartsen, internisten, radiologen en huisartsen. Een secundaire doelgroep zijn zorgverleners uit de eerste lijn die betrokken zijn bij de zorg rondom patiënten met diverticulitis, waaronder huisarts, verpleegkundigen (waaronder continentieverpleegkundige en verpleegkundig specialisten) en physician assistants.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2016 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met diverticulitis te maken hebben. Het Nederlands Huisartsen Genootschap (NHG) en de Nederlandse Vereniging voor Spoedeisende Hulp Artsen (NVSHA) zijn uitgenodigd om te participeren in de werkgroep maar heeft geen gebruik gemaakt van de uitnodiging.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn. Stefan van Dijk heeft onder begeleiding van Marja Boermeester de systematische analyses van de literatuur uitgewerkt.
Werkgroep
- Prof. dr. M.A. Boermeester, chirurg, Amsterdam UMC locatie AMC, Amsterdam, NVvH (voorzitter)
- Dr. M.G.J. de Boer, internist, infectioloog, Leids Universitair Medisch Centrum, Leiden, NIV
- S. van Dijk, MSc, arts-onderzoeker chirurgie, Amsterdam UMC locatie AMC, Amsterdam, NVvH
- Dr. W.A. Draaisma, chirurg, Jeroen Bosch Ziekenhuis, Den Bosch, NVvH
- Dr. R.J.F. Felt-Bersma, MDL-arts, VU Medisch Centrum, Amsterdam, NVMDL
- Dr. B.R. Klarenbeek, chirurg, Radboud UMC, Nijmegen, NVvH
- Dr. J.A. Otte, internist, ZorgSaam Zeeuws-Vlaanderen, Terneuzen, NIV
- Dr. J.B.C.M. Puylaert, radioloog, Medisch Centrum Haaglanden, Den Haag, NVvR
Met ondersteuning van:
- Dr. W.A. van Enst, senior-adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Boermeester |
Gastrointestinaal chirurg, hoogleraar chirurgie van abdominale infecties, chirurgisch hoofd van darmfalenteam AMC |
Geen |
"Niet gerelateerd aan deze richtlijn. Niet-gerelateerde institutional grants van J&J/Ethicon, Acelity/KCI, Ipsen, Baxter, Bard, Mylan" |
Geen |
|
De Boer |
Internist, LUMC |
Geen |
Geen |
Geen |
|
Draaisma |
Chirurg, AMC |
lid werkgroep richtlijn Pleuravocht |
Geen |
Geen |
|
Felt-Bersma |
MDL arts, VUMC |
Consultant in de Proctoskliniek Bilthoven |
TEVA sponsort een studie tvgl 3 laxeermiddelen wat we op 1 dec 2016 gaan doen, de gelden komen ten bate van het onderzoek en de ANIOS aanstelling voor 2 mnd |
Geen |
|
Klarenbeek |
Gastrontestinaal en oncologisch chirurg, Radboud UMC |
Geen betaalde nevenfuncties |
ZonMw doelmatigheidssubsidie voor FORCE-trail (BFT na LAR voor rectumcarcinoom). MITEC-subsidies (intern Radboudumc) voor MRI en fluorescentie onderzoek bij oesofaguscarcinoom" |
Geen |
|
Otte |
Internist, ZorgSaam Zeeuws-Vlaanderen |
onbetaald |
Geen |
Geen |
|
Puylaert |
Radioloog, Medisch Centrum Haaglanden |
Geen |
Geen |
Geen |
|
Van Dijk |
Arts-onderzoeker chirurgie, AMC |
Betaald promotieonderzoek bij professor M.A. Boermeester over diverticulitis appendicitis en secundaire peritonitis. |
Geen |
Geen |
|
Van Enst |
Senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten, |
Lid van de GRADE working group/ Dutch GRADE Network |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een focusgroep te houden. Deze werd georganiseerd door de Patiëntenfederatie Nederland. Een verslag hiervan (zie aanverwante producten) is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. De conceptrichtlijn wordt tevens voor commentaar voorgelegd aan de Patiëntenfederatie.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Stakeholders zijn uitgenodigd voor een knelpuntenbijeenkomst (Invitational conference). Vanwege het lage aantal aanmeldingen (twee, NHG en ZN) is de bijeenkomst geannuleerd. Gevraagd is schriftelijk op het raamwerk te reageren. Daarop kwamen geen reacties.
De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn (NVvH, 2014) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen vanuit een patiëntenfocusgroep. De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter, arts-onderzoeker en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De adviseur of werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn heeft de werkgroep overwogen om interne kwaliteitsindicatoren te ontwikkelen om het toepassen van de richtlijn in de praktijk te volgen en te versterken. De werkgroep heeft besloten geen indicatoren te ontwikkelen bij de huidige richtlijn, omdat er of geen substantiële barrières konden worden geïdentificeerd die implementatie van de aanbeveling zouden kunnen bemoeilijken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten (secretariaat@kennisinstituut.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn wordt aan de betrokken (wetenschappelijke) verenigingen en de Patiëntenfederatie Nederland voorgelegd ter commentaar. De commentaren worden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren zal de conceptrichtlijn aangepast worden en definitief vastgesteld door de werkgroep. De definitieve richtlijn wordt aan de deelnemende (wetenschappelijke) verenigingen en de Patiëntenfederatie Nederland voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
- Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
- Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html. 2012.
- Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html. 2013.
- Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
- Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van de Federatie Medisch Specialisten.
Zoekverantwoording
|
Databases:
Geraadpleegd tot: 05-05-2017 |
Zoekstrategie: (Diverticulitis(Mesh) OR "diverticulitis, colonic"(mesh) OR diverticulitis(tiab) OR diverticular(tiab)) AND (“Colonoscopy”(Mesh) OR colonoscop*(tiab) OR “Colonography, Computed Tomographic”(Mesh) OR colonograph*(tiab) OR "colonic evaluation"(tiab) OR "colon cancer"(tiab) OR "colon carcinoma"(tiab) OR "colorectal cancer"(tiab) OR "colorectal carcinoma"(tiab) OR "sigmoid cancer"(tiab) OR "sigmoid carcinoma"(tiab)) |
Resultaten: Pubmed 1228 hits Embase 2705 hits Cochrane 0 hits
Duplicaten: 731 hits
Inclusie: 16 artikelen |
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Agarwal 2014 |
Irrelevant article type |
|
Ahmed 2013 |
Irrelevant article type |
|
Ahmeidat 2012 |
Irrelevant article type |
|
Alatawi 2012 |
Irrelevant article type |
|
Alexandersson 2012 |
Irrelevant article type |
|
Alexandersson 2013 |
Irrelevant article type |
|
Allan 2013 |
Irrelevant article type |
|
Altgarde 2015 |
Irrelevant article type |
|
Anderson 2016 |
Irrelevant article type |
|
Andrade 2014 |
Irrelevant article type |
|
Aparicio 2016 |
Irrelevant article type |
|
Atkinson 2012 |
Irrelevant article type |
|
Bar 2012 |
No colonoscopy ≤ 1 year |
|
Barret 2013 |
Irrelevant article type |
|
Barroso 2015 |
Irrelevant article type |
|
Boulos 1985 |
Not only CT diagnosed diverticulitis |
|
Boulos 1984 |
Not only CT diagnosed diverticulitis |
|
Brar 2012 |
Irrelevant article type |
|
Chabok 2012 |
Irrelevant article type |
|
Chan 2017 |
No left-sided diverticulitis |
|
Chan 2013 |
Irrelevant article type |
|
Chia 2014 |
Irrelevant article type |
|
Chintapalli 1999 |
No colonoscopy ≤ 1 year |
|
Cho 2015 |
Irrelevant article type |
|
Chung 2015 |
Irrelevant article type |
|
Colvin 2012 |
Irrelevant article type |
|
Cristiano 2014 |
Irrelevant article type |
|
Daker 2012 |
Irrelevant article type |
|
Daker 2012 |
Irrelevant article type |
|
Daniels 2014 |
Irrelevant article type |
|
Del Rio 2014 |
Not only CT diagnosed diverticulitis |
|
Disbrow 2015 |
Irrelevant article type |
|
Ekbom 2012 |
Irrelevant article type |
|
Elramah 2010 |
Irrelevant article type |
|
Flor 2014 |
Irrelevant article type |
|
Friend 2011 |
Irrelevant article type |
|
Goncalves 2016 |
Irrelevant article type |
|
Grahnat 2016 |
Not only CT diagnosed diverticulitis |
|
Granlund 2011 |
Not only CT diagnosed diverticulitis |
|
Gross 2015 |
Irrelevant article type |
|
Grove 2013 |
Irrelevant article type |
|
Gunturu 2011 |
Irrelevant article type |
|
Haboubi 2010 |
Irrelevant article type |
|
Herron 2016 |
Irrelevant article type |
|
Hirata 2008 |
No colonic diverticulitis |
|
Horesh 2016 |
No colonoscopy ≤ 1 year |
|
Horesh 2015 |
Irrelevant article type |
|
Huang 2014 |
Not only CT diagnosed diverticulitis |
|
Hussain 2017 |
Irrelevant article type |
|
Iqbal 2016 |
Irrelevant article type |
|
Kim 2013 |
Irrelevant article type |
|
Kim 2014 |
Less than 10 patients |
|
Kochar 2016 |
Irrelevant article type |
|
Kratt 2010 |
Irrelevant article type |
|
Kronborg 2004 |
Irrelevant article type |
|
Lahat 2008 |
Overlapping patient cohort |
|
Lam 2010 |
No colonoscopy ≤ 1 year |
|
Lau 2009 |
Irrelevant article type |
|
Meireles 2015 |
Not only CT diagnosed diverticulitis |
|
Meurs 2008 |
Not only CT diagnosed diverticulitis |
|
Meyer 2014 |
Irrelevant article type |
|
Meyer 2014 |
Irrelevant article type |
|
Meyer 2015 |
No colonoscopy ≤ 1 year |
|
Mizuki 2015 |
Irrelevant article type |
|
Moorthy 2015 |
Irrelevant article type |
|
Morini 2002 |
No colonic diverticulitis |
|
Mortensen 2017 |
Not only CT diagnosed diverticulitis |
|
Muhammad 2014 |
Not only CT diagnosed diverticulitis |
|
O’Connor 2016 |
Irrelevant article type |
|
Oh 2013 |
Less than 10 patients |
|
Oistamo 2012 |
Irrelevant article type |
|
Öistämö 2013 |
No colonoscopy ≤ 1 year |
|
Ou 2016 |
Irrelevant article type |
|
Page 2011 |
Irrelevant article type |
|
Page 2012 |
Irrelevant article type |
|
Papagrigoriadis 2016 |
Irrelevant article type |
|
Prosst 2016 |
Irrelevant article type |
|
Ramphal 2016 |
No colonoscopy ≤ 1 year |
|
Regula 2016 |
Irrelevant article type |
|
Reibetanz 2014 |
Irrelevant article type |
|
Sallinen 2015 |
Irrelevant article type |
|
Sallinen 2013 |
Irrelevant article type |
|
Schmilovitz 2011 |
Irrelevant article type |
|
Schmilovitz 2011 |
Irrelevant article type |
|
Schout 2012 |
Not only CT diagnosed diverticulitis |
|
Schwander 1998 |
Not only CT diagnosed diverticulitis |
|
Shahid 2015 |
Irrelevant article type |
|
Stefánsson 2004 |
Not only CT diagnosed diverticulitis |
|
Syed 2016 |
No colonoscopy ≤ 1 year |
|
Szczebiot 2015 |
Irrelevant article type |
|
Tan 2013 |
Irrelevant article type |
|
Torabi 2011 |
Irrelevant article type |
|
Tsiamoulos 2014 |
Irrelevant article type |
|
Tursi 2014 |
Irrelevant article type |
|
Tursi 2014 |
Irrelevant article type |
|
Tursi 2012 |
Irrelevant article type |
|
Ünlü 2013 |
No colonoscopy ≤ 1 year |
|
van de Wall 2011 |
Irrelevant article type |
|
Van de Wall 2012 |
Not only CT diagnosed diverticulitis |
|
Vuolo 1995 |
No colonic diverticulitis |
|
Walker 2015 |
Irrelevant article type |
|
Walker 2016 |
No colonoscopy ≤ 1 year |
|
Weiss 2012 |
Irrelevant article type |
|
Westwood 2011 |
No colonoscopy ≤ 1 year |
|
Wilkins 2013 |
Irrelevant article type |
|
Wilson 2014 |
Irrelevant article type |
|
Wong 2016 |
No colonic diverticulitis |
|
Younis 2015 |
Irrelevant article type |
|
Younis 2015 |
Irrelevant article type |
|
Zdichavsky 2016 |
Irrelevant article type |
