Primaire anastomose bij diverticulitis
Uitgangsvraag
Dient bij resectie een Hartmann procedure te worden uitgevoerd of kan een primaire anastomose aangelegd worden bij Hinchey 3 en 4 en patiënten?
Aanbeveling
Overweeg een primaire anastomose, al dan niet met stoma, aan te leggen bij patiënten die een resectie ondergaan wegens geperforeerde acute diverticulitis en weeg hierbij de klinische conditie van de patiënt en expertise van de operateur mee. Overweeg bij overige patiënten de Hartmann procedure.
Overwegingen
Following several observational studies that showed clear benefits of primary anastomosis compared to a Hartmann’s procedure for perforated diverticulitis, three randomized clinical trials have been conducted and published thus far. A major limitation of these trials is the premature termination of all three trials due to difficulties to recruit patients. Studies were terminated at only 15% to 47% of the intended sample size resulting in seriously underpowered studies. Another limitation is the randomisation by regular envelopes in two out of three studies. The unequal distribution of patients among groups in Binda (34 patients in the primary anastomosis group versus 56 in the Hartmann group) could be a sign of a dysfunctional randomisation process, although this could also be explained by chance due to the lack of stratification. Furthermore, follow-up durations were not described appropriately for several outcomes. Outcomes were assessed after resection without description of the actual follow-up length or in-hospital hampering comparison of outcomes between the studies.
Complicated acute diverticulitis is associated with considerable mortality which is therefore the most important outcome when comparing treatment strategies. Although earlier meta-analyses of mostly observational studies showed a significant reduction in mortality in primary anastomosis patients compared to Hartmann patients, three randomised clinical trials demonstrated no difference in mortality rates. Furthermore, performing a primary anastomosis in an inflamed area during emergency surgery may be considered a risk factor for surgical complications but all three trials did not show an increase in complications in these patients. Another important outcome that may affect patients’ quality of life is the number of patients that end up with a permanent stoma. Two studies showed significantly less patients with a stoma at the end of follow-up in the primary anastomosis group. Some patients never had a stoma and ileostomies were reversed more often than colostomies.
A primary anastomosis seems to be a safe alternative to a Hartmann’s procedure for perforated acute diverticulitis. Although, the methodological limitations of these RCT’s should be taken into account. In most primary anastomosis patients a diverting ileostomy was created. In only one trial this decision was left to the discretion of the surgeon and in only ten primary anastomosis patients no diverting ileostomy was created. Therefore, although omitting a diverting ileostomy may actually be safe, this could not be concluded from these trials. In patients that are considered to be unfit for any stoma reversal, a Hartmann’s procedure with definitive end colostomy may be preferred. Furthermore, the included RCT’s may have suffered from selection bias by including clinically stable patients rather than critically ill patients. On the other hand, 38% of patients that underwent a Hartmann’s procedure ended up with a definitive stoma. This rate could be decreased considerably by performing a primary anastomosis in selected patients.
Onderbouwing
Achtergrond
Target group of patients: Hinchey 3 and 4 diverticulitis
Perforated diverticulitis is traditionally treated by sigmoid resection with end colostomy (Hartmann’s procedure). However, the reversal of a colostomy is associated with higher morbidity than ileostomy reversal and literature shows that a considerable number of colostomies never get reversed. A resection with primary anastomosis could be a one stage operation (without diverting ileostomy). Even if a diverting ileostomy is created, reversal is less burdensome and is more frequently performed compared to a colostomy. On the other hand, surgical morbidity may be higher when creating a primary anastomosis in an inflamed area and during emergency surgery rather than elective surgery.
Conclusies / Summary of Findings
|
Laag GRADE |
Het aanleggen van een primaire anastomose (met of zonder deviërend ileostoma) in plaats van het verrichten van een Hartmann procedure lijkt niet tot een hogere of lagere mortaliteit te leiden in patiënten met Hinchey 3 of 4 diverticulitis.
Bronnen (Binda, 2012; Bridoux, 2017; Oberkofler, 2012) |
|
Laag GRADE |
Het aanleggen van een primaire anastomose (met of zonder deviërend ileostoma) in plaats van het verrichten van een Hartmann procedure lijkt niet tot een hogere of lagere morbiditeit te leiden in patiënten met Hinchey 3 of 4 diverticulitis.
Bronnen (Binda, 2012; Bridoux, 2017; Oberkofler, 2012) |
|
Laag GRADE |
Het aanleggen van een primaire anastomose (met of zonder deviërend ileostoma) lijkt het aantal permanente stoma’s te verminderen in vergelijking met het initieel te verrichten van een Hartmann procedure bij patiënten met Hinchey 3 of 4 diverticulitis
Bronnen (Binda, 2012; Bridoux, 2017; Oberkofler, 2012) |
Samenvatting literatuur
Three randomized clinical trials were included, all conducted in Europe. (Binda, 2012; Bridoux, 2017; Oberkofler, 2012) All studies included perforated acute diverticulitis patients with purulent of faecal peritonitis, although only two included intra-operatively verified peritonitis patients. (Binda, 2012; Bridoux, 2017) Binda and Oberkofler created a diverting ileostomy in every primary anastomosis patient, Bridoux left this decision to the discretion of the surgeon. All three studies were prematurely terminated due to low accrual rates; Binda only randomised 15% of the intended sample size, Bridoux randomised 41% of patients and Oberkofler terminated the trial at 47% of the intended sample size. Mortality and overall morbidity was reported in all trials, serious morbidity was only reported by Bridoux and Oberkofler but with different definitions (Clavien Dindo 3 to 4 and Clavien Dindo 3b to 4). The number of patients alive with stoma at the end of follow-up was reported or could be calculated in the studies from Bridoux and Oberkofler The reported follow-up durations differed per study. Binda reported all outcomes within 30 days and additionally reported a combined mortality rate during the first 30 days after resection and after the stoma reversal surgery. Bridoux reported outcomes after the resection but did not state the length of follow-up and additionally reported outcomes at 18 months. Oberkofler reported outcomes after resection and after resection plus stoma reversal combined but did not state the exact length of follow-up.
Resultaten
Mortality
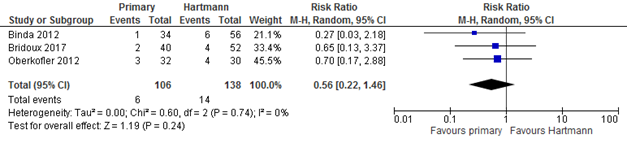
Mortality rates were not different between primary anastomosis and Hartmann’s procedure on short-term (after resection within 30 days or in-hospital); RR for primary anastomosis 0.67 (95% CI 0.25 to 1.81), pooled rate primary anastomosis 6% versus Hartmann 9% (Figure 1). When also mortality after stoma reversal surgery is taken into account, comparable results were found; RR for primary anastomosis 0.56 (95% CI 0.22 to 1.46), pooled rate primary anastomosis 6% versus Hartmann 10%. (Figure 2).
Figure 1 Forest plot of mortality after resection (30-day or in-hospital)
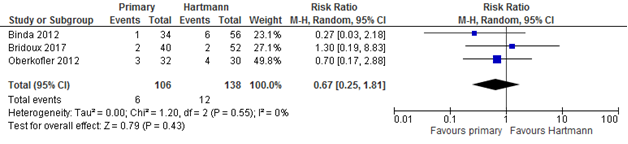
Figure 2 Forest plot of mortality after resection and stoma reversal surgery
Morbidity
Short-term overall morbidity was reported by all three studies which revealed no differences among groups (Figure 3). Also morbidity on long-term, which was reported by two studies, was not different in Bridoux (primary 44% versus Hartmann 39% at 18 months; p=0.423) and Oberkofler (primary 84% versus Hartmann 80% after resection and stoma reversal surgery combined; p=0.764). Two studies reported serious morbidity rates as well. Bridoux defined serious morbidity as Clavien Dindo 3 or 4 and found comparable results among groups; primary 14% versus Hartmann 14% (p=0.937) on short-term after resection and primary 16% versus Hartmann 17% (p=0.859) at 18 months. Oberkofler defined serious morbidity as Clavien Dindo 3b or 4 and found comparable rates as well; primary 44% versus Hartmann 40% (p=0.802) on short-term after surgery and primary 50% versus Hartmann 44% (p=0.799) on long-term after resection and stoma reversal surgery combined.
Figure 3 Forest plot of overall morbidity after resection (30-day or in-hospital)
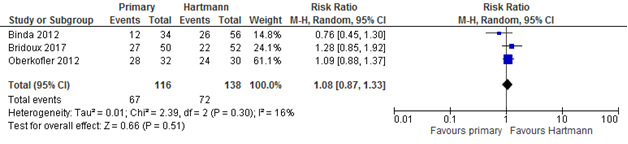
Patients with stoma
In the primary anastomosis group, significantly less patients were alive with a (probably permanent) stoma at the end of follow-up which was 18 months in Bridoux and unknown in Oberkofler; RR primary anastomosis 0.18 (95% CI 0.07 to 0.45), pooled rate primary anastomosis 7% versus Hartmann 38% (Figure 4).
Figure 4 Forest plot of patients alive with stoma at end of follow-up
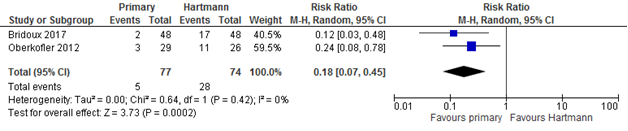
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat mortaliteit begon op ‘hoog’ aangezien het bewijs afkomstig is uit gerandomiseerde klinische onderzoeken. Vervolgens is de bewijskracht met 2 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (enveloprandomisatie in 2 van de 3 studies met aanwijzingen voor foutieve randomisatie en onduidelijke follow-up tijden), waarschijnlijke patiëntselectie (zieke patiënten en/of nachtelijke operaties niet geïncludeerd) en het voortijdig afbreken van alle 3 geïncludeerde RCT’s.
De bewijskracht voor de uitkomstmaat morbiditeit begon op ‘hoog’ aangezien het bewijs afkomstig is uit gerandomiseerde klinische onderzoeken. Vervolgens is de bewijskracht met 2 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (enveloprandomisatie in 2 van de 3 studies met aanwijzingen voor foutieve randomisatie en onduidelijke follow-up tijden), waarschijnlijke patiëntselectie (zieke patiënten en/of nachtelijke operaties niet geïncludeerd) en het voortijdig afbreken van alle 3 geïncludeerde RCT’s.
De bewijskracht voor de uitkomstmaat patiënten met stoma begon op ‘hoog’ aangezien het bewijs afkomstig is uit gerandomiseerde klinische onderzoeken. Vervolgens is de bewijskracht met 2 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (enveloprandomisatie in 2 van de 3 studies met aanwijzingen voor foutieve randomisatie en onduidelijke follow-up tijden), waarschijnlijke patiëntselectie (zieke patiënten en/of nachtelijke operaties mogelijk niet geïncludeerd) en het voortijdig afbreken van alle 3 geïncludeerde RCT’s.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat zijn de (on)gewenste effecten van het aanleggen van een primaire anastomose met of zonder deviërend ileostoma ten opzichte van een Hartmann procedure bij geperforeerde diverticulitis?
Patiënt: geperforeerde (purulent of fecaal) diverticulitis;
Interventie: resectie met primaire anastomose;
Controle: resectie met eindstandig colostoma (Hartmann procedure);
Outcome: mortaliteit, morbiditeit, patiënten met stoma.
Relevante uitkomstmaten
De werkgroep achtte ‘mortaliteit’ en ‘morbiditeit’ voor de besluitvorming kritieke uitkomstmaten; en ‘patiënten met stoma’ voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Zoeken en selecteren (Methode)
In de databases Medline (OVID), EMBASE en de Cochrane Library (Wiley) is met relevante zoektermen gezocht naar gerandomiseerde klinische onderzoeken. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 1341 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- Volledige tekst artikelen beschikbaar (geen taalrestricties).
- Gerandomiseerde klinische onderzoeken die een primaire anastomose (met of zonder ileostoma) vergelijken met een Hartmann procedure bij patiënten met geperforeerde (Hinchey 3 of 4) diverticulitis.
- Minimaal één van de uitkomsten beschreven.
Op basis van titel en abstract werden in eerste instantie 17 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 14 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 3 studies definitief geselecteerd.
Drie onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Referenties
- Binda GA, Karas JR, Serventi A, et al. Primary anastomosis versus nonrestorative resection for perforated diverticulitis with peritonitis: a prematurely terminated randomized controlled trial. Colorectal disease: the official journal of the Association of Coloproctology of Great Britain and Ireland. 2012;14:1403-10.
- Bridoux V, Regimbeau JM, Ouaissi M, et al. Hartmann's Procedure or Primary Anastomosis for Generalized Peritonitis due to Perforated Diverticulitis: A Prospective Multicenter Randomized Trial (DIVERTI). Journal of the American College of Surgeons. 2017.
- Oberkofler CE, Rickenbacher A, Raptis DA, et al. A multicenter randomized clinical trial of primary anastomosis or Hartmann's procedure for perforated left colonic diverticulitis with purulent or fecal peritonitis. Annals of surgery. 2012;256:819-26; discussion 26-7.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Binda, 2012 |
Type of study: randomised clinical trial
Setting: multicentre
Country: France, Norway, Turkey, Spain, Israel, Slovenia, Poland, Italy |
Inclusion criteria: Adult patients with intra-operatively verified peritonitis secondary to perforated diverticulitis of the left colon
Exclusion criteria: None
N total at baseline: Primary: 34 Hartmann: 56
Important prognostic factors2: Groups comparable at baseline
|
Laparotomy or laparoscopy, primary double-stapled anastomosis and loop ileostomy. |
Laparotomy or laparoscopy, end colostomy. |
Length of follow-up: 1 year
Loss-to-follow-up: Intervention: 2.9% (1/34)
Control: 5.4% (3/56)
|
30-day mortality Primary 2.9% (1/34) Hartmann 10.7% (6/56); p=0.247
30-day mortality after resection and stoma reversal Primary 2.9% (1/34) Hartmann 10.7% (6/56); p=0.247
30-day morbidity overall Primary 35.3% (12/34) Hartmann 46.4% (26/56) P=0.380
30-day anastomotic leak reoperation Primary 2.9% (1/34) Hartmann 1.8% (1/56) P=0.999
30-day organ space SSI Primary 0% (0/34) Hartmann 10.7% (6/56) P=0.079 |
The study was prematurely terminated due to low accrual rates after inclusion of 15% (90 patients) of the intended sample size of 600 patients.
Number of patients alive with stoma could not be calculated from reported results. |
|
Bridoux, 2017 |
Type of study: randomised clinical trial
Setting: multicentre
Country: France
Source of funding: French Ministry of Health |
Inclusion criteria: Adult patients with intra-operatively verified purulent or fecal peritonitis secondary to perforated diverticulitis.
Exclusion criteria: Physical states that prevented patients participation (that is septic shock or multivisceral failure)
N total at baseline: Primary: 50 Hartmann: 52
Important prognostic factors2: Groups comparable at baseline
|
Laparotomy, primary anastomosis according to surgeon preferences, ileostomy was left to the discretion of the surgeon |
Laparotomy, end colostomy |
Length of follow-up: 18 months
Loss-to-follow-up: Intervention: 0 Control: 0 |
Mortality after resection Primary 4% (2/40) Hartmann 4% (2/52) P=1.000
18-months mortality Primary 4% (2/40) Hartmann 7.7% (4/52) P=0.678
Morbidity overall after resection Primary 54% (27/50) Hartmann 42% (22/52) P=0.237
18 months morbidity overall] Primary 44% (28/50) Hartmann 39% (25/52) P=0.423
Serious morbidity (Clavien Dindo 3-4) after resection Primary 14% (7/50) Hartmann 14% (7/52) P=0.937
18 months serious morbidity (Clavien Dindo 3-4) Primary 16% (8/50) Hartmann 17% (9/52) P=0.859
Patients alive with stoma at end of follow-up (18 months) Primary 4% (2/48) Hartmann 35% (17/48) P=<0.001 |
The study was prematurely terminated due to low accrual rates after inclusion of 41% (102 patients) of the intended sample size of 246 patients. |
|
Oberkofler, 2012
|
Type of study: randomized clinical trial
Setting: multicentre
Country: Switzerland
Source of funding: not reported |
Inclusion criteria: Adult patients with purulent or fecal peritonitis secondary to perforated left-sided colonic diverticulitis
Exclusion criteria: Evidence of metastatis
N total at baseline: Primary: 32 Hartmann: 30
Important prognostic factors2: Groups comparable at baseline
|
Primary anastomosis with diverting ileostomy |
End colostomy |
Length of follow-up: Hospital stay initial surgery and hospital stay stoma reversal surgery
Loss-to-follow-up: None
|
In-hospital mortality after resection Primary 9% (3/32) Hartmann 13% (4/30) P=0.703
In-hospital mortality after resection and stoma reversal Primary 9% (3/32) Hartmann 13% (4/30) P=0.703
Morbidity overall after resection Primary 84% (28/32) Hartmann 80% (24/30) P=0.764
Morbidity overall after resection and stoma reversal Primary 84% (28/32) Hartmann 80% (24/30) P=0.764
Serious morbidity (Clavien Dindo 3b-4) after resection Primary 44% (14/32) Hartmann 40% (12/30) P=0.802
Serious morbidity (Clavien Dindo 3b-4) after resection and stoma reversal Primary 44% (14/32) Hartmann 50% (15/30) P=0.799
Patients alive with stoma at end of follow-up Primary 10% (3/29) Hartmann 42% (11/26) P=0.007 |
The study was prematurely terminated due to low accrual rates and reasons for safety (secondary outcomes in favour of primary anastomosis) after inclusion of 47% (62 patients) of the intended sample size of 132 patients |
Risk of bias tabel
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Binda 2012 |
Randomization without stratification by closed envelopes containing patient inclusion numbers and allocation to treatment arms. |
Likely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Bridoux 2017 |
Randomization by means of envelopes that were sequentially numbered and send to the centres. |
Likely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Oberkofler 2012 |
Randomization by a web-based patient randomization service for multicenter clinical trials (www. randomizer.at) |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 31-05-2018
Beoordeeld op geldigheid : 09-05-2018
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2023 bepaalt het bestuur van de Nederlandse Vereniging voor Heelkunde of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Heelkunde is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (http://www.kennisinstituut.nl) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). Patiëntenparticipatie bij deze richtlijn werd mede gefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ. De SKMS heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Deze richtlijn is bedoeld om een evidence-based beleid voor de zorg voor patiënten met diverticulitis in de tweede lijn op te stellen.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met diverticulitis, te weten chirurgen, maag- lever- darmartsen, internisten, radiologen en huisartsen. Een secundaire doelgroep zijn zorgverleners uit de eerste lijn die betrokken zijn bij de zorg rondom patiënten met diverticulitis, waaronder huisarts, verpleegkundigen (waaronder continentieverpleegkundige en verpleegkundig specialisten) en physician assistants.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2016 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met diverticulitis te maken hebben. Het Nederlands Huisartsen Genootschap (NHG) en de Nederlandse Vereniging voor Spoedeisende Hulp Artsen (NVSHA) zijn uitgenodigd om te participeren in de werkgroep maar heeft geen gebruik gemaakt van de uitnodiging.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn. Stefan van Dijk heeft onder begeleiding van Marja Boermeester de systematische analyses van de literatuur uitgewerkt.
Werkgroep
- Prof. dr. M.A. Boermeester, chirurg, Amsterdam UMC locatie AMC, Amsterdam, NVvH (voorzitter)
- Dr. M.G.J. de Boer, internist, infectioloog, Leids Universitair Medisch Centrum, Leiden, NIV
- S. van Dijk, MSc, arts-onderzoeker chirurgie, Amsterdam UMC locatie AMC, Amsterdam, NVvH
- Dr. W.A. Draaisma, chirurg, Jeroen Bosch Ziekenhuis, Den Bosch, NVvH
- Dr. R.J.F. Felt-Bersma, MDL-arts, VU Medisch Centrum, Amsterdam, NVMDL
- Dr. B.R. Klarenbeek, chirurg, Radboud UMC, Nijmegen, NVvH
- Dr. J.A. Otte, internist, ZorgSaam Zeeuws-Vlaanderen, Terneuzen, NIV
- Dr. J.B.C.M. Puylaert, radioloog, Medisch Centrum Haaglanden, Den Haag, NVvR
Met ondersteuning van:
- Dr. W.A. van Enst, senior-adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Boermeester |
Gastrointestinaal chirurg, hoogleraar chirurgie van abdominale infecties, chirurgisch hoofd van darmfalenteam AMC |
Geen |
"Niet gerelateerd aan deze richtlijn. Niet-gerelateerde institutional grants van J&J/Ethicon, Acelity/KCI, Ipsen, Baxter, Bard, Mylan" |
Geen |
|
De Boer |
Internist, LUMC |
Geen |
Geen |
Geen |
|
Draaisma |
Chirurg, AMC |
lid werkgroep richtlijn Pleuravocht |
Geen |
Geen |
|
Felt-Bersma |
MDL arts, VUMC |
Consultant in de Proctoskliniek Bilthoven |
TEVA sponsort een studie tvgl 3 laxeermiddelen wat we op 1 dec 2016 gaan doen, de gelden komen ten bate van het onderzoek en de ANIOS aanstelling voor 2 mnd |
Geen |
|
Klarenbeek |
Gastrontestinaal en oncologisch chirurg, Radboud UMC |
Geen betaalde nevenfuncties |
ZonMw doelmatigheidssubsidie voor FORCE-trail (BFT na LAR voor rectumcarcinoom). MITEC-subsidies (intern Radboudumc) voor MRI en fluorescentie onderzoek bij oesofaguscarcinoom" |
Geen |
|
Otte |
Internist, ZorgSaam Zeeuws-Vlaanderen |
onbetaald |
Geen |
Geen |
|
Puylaert |
Radioloog, Medisch Centrum Haaglanden |
Geen |
Geen |
Geen |
|
Van Dijk |
Arts-onderzoeker chirurgie, AMC |
Betaald promotieonderzoek bij professor M.A. Boermeester over diverticulitis appendicitis en secundaire peritonitis. |
Geen |
Geen |
|
Van Enst |
Senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten, |
Lid van de GRADE working group/ Dutch GRADE Network |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een focusgroep te houden. Deze werd georganiseerd door de Patiëntenfederatie Nederland. Een verslag hiervan (zie aanverwante producten) is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. De conceptrichtlijn wordt tevens voor commentaar voorgelegd aan de Patiëntenfederatie.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Stakeholders zijn uitgenodigd voor een knelpuntenbijeenkomst (Invitational conference). Vanwege het lage aantal aanmeldingen (twee, NHG en ZN) is de bijeenkomst geannuleerd. Gevraagd is schriftelijk op het raamwerk te reageren. Daarop kwamen geen reacties.
De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn (NVvH, 2014) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen vanuit een patiëntenfocusgroep. De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter, arts-onderzoeker en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De adviseur of werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn heeft de werkgroep overwogen om interne kwaliteitsindicatoren te ontwikkelen om het toepassen van de richtlijn in de praktijk te volgen en te versterken. De werkgroep heeft besloten geen indicatoren te ontwikkelen bij de huidige richtlijn, omdat er of geen substantiële barrières konden worden geïdentificeerd die implementatie van de aanbeveling zouden kunnen bemoeilijken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten (secretariaat@kennisinstituut.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn wordt aan de betrokken (wetenschappelijke) verenigingen en de Patiëntenfederatie Nederland voorgelegd ter commentaar. De commentaren worden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren zal de conceptrichtlijn aangepast worden en definitief vastgesteld door de werkgroep. De definitieve richtlijn wordt aan de deelnemende (wetenschappelijke) verenigingen en de Patiëntenfederatie Nederland voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
- Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
- Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html. 2012.
- Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html. 2013.
- Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
- Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van de Federatie Medisch Specialisten.
Zoekverantwoording
|
Databases:
Geraadpleegd tot: 15-11-2017 |
Zoekstrategie: (Diverticulitis(Mesh) OR “diverticulitis, colonic”(Messh) OR diverticul*(tiab)) AND (primary(tiab) AND anastomo*(tiab)) |
Resultaten: Pubmed 520 hits Embase 821 hits Cochrane 0 hits
Duplicaten: 291 hits
Inclusie: 3 artikelen |
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Abbas 2007 |
No original data |
|
Binda 2015 |
No original data |
|
Constantinides 2006 |
No original data |
|
Gooszen 2001 |
No randomised study |
|
Gooszen 2001 |
No randomised study |
|
Herzog 2011 |
No randomised study |
|
Menon 2002 |
No randomised study |
|
Salem 2004 |
No original data |
|
Schilling 2001 |
No randomised study |
|
Toro 2012 |
No original data |
|
Trenti 2011 |
No randomised study |
|
Vermeulen 2010 |
No randomised study |
|
Zingg 2010 |
No randomised study |
