Chirurgische behandeling
Uitgangsvraag
Wat is de waarde van chirurgische behandeling bij een primaire, acute achillespeesruptuur?
Aanbeveling
Bespreek samen met de patiënt met een acute achillespeesruptuur de verschillende mogelijkheden, voor- en nadelen, zoals:
- Chirurgische complicaties (de geschatte kans op infectie is ongeveer 3%, en de geschatte kans op nervus suralis schade is minder dan 1%) *
- Re-rupturen (de geschatte range ligt tussen de 2% en 4% na operatieve behandeling en tussen de 4% en 10% na conservatieve behandeling) *
Overweeg daarbij de patiënt met een acute achillespeesruptuur in opzet conservatief te behandelen.
Overweeg een operatieve behandeling bij patiënten met een verhoogde kans op een re-ruptuur (met name competitieve sporters of mensen met fysiek zwaar werk).
Overweeg patiënten zoveel mogelijk conservatief te behandelen wanneer ze een verhoogde kans hebben op complicaties (roken, perifeer vaatlijden of diabetes).
* Lees voor de nuance betreffende deze percentages de overwegingen.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is literatuuronderzoek verricht naar de waarde van chirurgische behandeling bij een primaire, acute achillespeesruptuur. Functionele uitkomsten, zoals dagelijks functioneren gemeten middels de ATRS-score, werd gedefinieerd als cruciale uitkomst. Re-rupturen, complicaties (zoals diepe veneuze trombose en infecties), range of motion, complicaties, terugkeer naar sport, kwaliteit van leven, tijd tot terugkeer naar werk en re-operatie werden als belangrijke uitkomsten beschouwd.
Voor de cruciale uitkomstmaat dagelijks functioneren gemeten met de ATRS-score is er een lage bewijskracht dat er geen verschil is tussen chirurgisch en conservatief behandelen van een achillespeesruptuur.
Er is redelijk robuuste bewijskracht dat chirurgische behandeling van een achillespeesruptuur het risico op een re-ruptuur aanzienlijk verlaagt vergeleken met een conservatieve behandeling. De geïncludeerde studies in deze richtlijn laten een risicoreductie in het percentage re-rupturen zien van 6.6% (10.4% na conservatieve behandeling en 3.8% na operatieve behandeling). Dit is zoals gezegd gebaseerd op data uit een meta-analyse waarin alleen RCT’s werden geïncludeerd. Een recente meta-analyse van Ochen (2019), waarin naast RCT's ook observationeel onderzoek werd meegewogen, liet een veel kleinere risicoreductie in het aantal re-rupturen zien van 1.6% (3.9% na conservatieve behandeling en 2.3% na operatieve behandeling). Hoewel dit verschil nog steeds statistisch significant is, valt op dat de risicoreductie fors lager is in vergelijking met de meta-analyse waarin alleen RCTs werden geïncludeerd. Dit verschil wordt waarschijnlijk verklaard door de beperkt power van RCT’s om incidentie aan te tonen. Bovendien is de sample size, in de meta-analyse van Ochen (2019), van de observationele studies vele malen groter (14616 versus 944 totaal geïncludeerd). Een nadeel van het includeren van observationele studies kan zijn dat de mate van bias hoger kan zijn.
Voor de volledigheid is het belangrijk om zowel de resultaten van observationele studies als de RCTs mee te nemen in de overwegingen. Het is waarschijnlijk dat het daadwerkelijke percentage re-rupturen binnen de range ligt die wordt gerapporteerd met inclusie van alleen RCT’s versus inclusie van aanvullende observationele studies. Deze geschatte range ligt tussen de 2-4% voor operatieve behandeling en tussen de 4-10% na conservatieve behandeling.
Voor de functionele uitkomsten kans op terugkeer naar sport lijkt chirurgische behandeling van een achillespeesruptuur in weinig tot geen verschil te resulteren in vergelijking met conservatieve behandeling.
Nervus suralis schade lijkt logischerwijs minder vaak voor te komen bij patiënten die conservatief zijn behandeld, maar hiervoor is de bewijskracht laag. De gepoolde data van de studies in deze richtlijn laten een risico op nervus suralis schade zien van 7.8% na operatieve behandeling. Echter, in de meta-analyse van Ochen (2019), met inclusie van observationele studies, is dit percentage 0.4%. De ervaring van de werkgroep is echter dat deze complicatie in de praktijk zelden door patiënten spontaan gerapporteerd wordt. Dat deze in de RCTs frequent naar voren komt zou verklaard kunnen worden omdat er proactief naar gevraagd wordt in tegenstelling tot observationele database onderzoeken. Het is daarom onduidelijk welk effect deze complicatie op het dagelijks functioneren heeft. Op basis van de klinische ervaring van de werkgroep en bovenstaande gegevens wordt aangenomen dat <1% van de chirurgisch behandelde patiënten significante klachten krijgt van een n.suralis letsel.
Indien alle complicaties in het algemeen behoudens de re-ruptuur werden samengenomen lijkt het erop dat chirurgische behandeling resulteert in meer complicaties in vergelijking met conservatieve behandeling. De bewijskracht hiervoor is laag.
De bewijskracht voor de uitkomsten diepe veneuze trombose, oppervlakkige en diepe infecties, range of motion, de duur van werkverzuim en kwaliteit van leven werden beoordeeld als ‘zeer laag’ en hierdoor kunnen er geen conclusies uit worden getrokken.
Aangaande de incidentie van infecties na operatieve behandeling biedt de meta-analyse van Ochen (2019) uitkomst gezien de inclusie van observationeel onderzoek. Ochen (2019) rapporteert 2.8% infecties na operatieve behandeling en maakt geen onderscheid tussen oppervlakkig of diep. De gepoolde data van RCTs in deze richtlijn laat 4.7% voor oppervlakkig en 2.2% voor diepe infecties zien na operatieve behandeling.
Diepe veneuze trombose leek iets vaker voor te komen bij patiënten die conservatief werden behandeld (schatting vanuit gepoolde RCTs 2,1% versus 1,1%). De systematische review van She (2021) beschrijft dat dit te wijten zou kunnen zijn aan de lange periode van immobilisatie in een aantal van de studies en omdat na chirurgische behandeling standaard tromboseprofylaxe wordt toegediend. Door de lage incidentie van deze complicatie en methodologische beperkingen in de onderzoeken is er echter onzekerheid over de waarde van deze bevinding. Er kan eveneens geen conclusie getrokken worden over het aantal re-operaties, omdat deze uitkomst in geen van de geïncludeerde studies werd gerapporteerd.
Waarden en voorkeuren van patiënten
In het verleden werd de operatieve behandeling frequenter uitgevoerd. Tegenwoordig lijkt een trend naar een meer conservatieve behandeling te ontstaan. Dit kan onzekerheid geven bij de patiënt, omdat de perceptie bij de meeste patiënten met een doorgemaakte achillespeesruptuur nog is dat een operatie de meest geschikte behandeling is. Dit fenomeen is bij patiënten met een acute achillespeesruptuur vastgesteld (Alrabaa, 2022).
Er is geen Nederlands onderzoek naar verschil in tevredenheid tussen operatieve of conservatieve behandeling na een acute achillespeesruptuur. Een buitenlandse studie van Maempel (2020) laat zien dat er op lange termijn geen verschil is in tevredenheid tussen operatief en conservatief behandelde patiënten.
Het belangrijkste doel van de interventie bij een achillespeesruptuur is herstel van de functie van de achillespees ten einde de dagelijkse, sport- en werkactiviteiten te kunnen hervatten op het niveau van voor het letsel. Hiervoor geldt dat er geen verschil is in de uiteindelijke functionele uitkomsten. Het is de taak van de zorgverlener om patiënten goed voor te lichten en duidelijk te maken dat er voor de uiteindelijke functionele uitkomst geen verschil te verwachten is tussen chirurgische en conservatieve behandeling. Tevens dient te worden aangegeven dat er na zowel operatieve als bij conservatieve behandeling een nabehandeling met een periode van immobilisatie aan de orde is. Dit betekent concreet dat het herstel niet sneller of met minder immobilisatie verloopt na een operatieve behandeling. De specifieke vorm en duur van nabehandelen lijkt nog niet volledig uitgekristalliseerd en kan verschillen tussen ziekenhuizen en zorgverleners (zie module 4). Het risico op complicaties is klein, maar wel groter bij een operatieve behandeling. Patiënten dienen daarover uiteraard geïnformeerd te worden. Hierbij zijn met name oppervlakkige en diepe infectie, alsmede nervus suralis letsel van belang. Concluderend is het zo dat de functionele uitkomsten en nabehandeling gelijk zijn maar het risico op complicaties hoger is na operatieve behandeling. Daarom lijkt het te verantwoorden om met name patiënten met een verhoogd risico op perioperatieve complicaties, een conservatieve behandeling te adviseren.
Preventie van een recidief achillespeesruptuur dient ook met de patiënt besproken te worden. Hiervoor geldt dat het risico op een re-ruptuur groter lijkt na een conservatieve behandeling, maar dat de verschillen klein zijn. Dit kan echter toch relevant zijn voor subgroepen patiënten. Bijvoorbeeld voor patiënten die tijdens werk of sportactiviteiten een achillespeesruptuur opliepen en de ambitie hebben om in dezelfde sport terug te keren. Hierdoor kan er angst of onzekerheid ontstaan bij het hervatten van deze activiteiten. Tevens zijn er patiënten die de kans op een re-ruptuur zo klein mogelijk willen maken omdat de tijdinvestering tot volledig herstel fors is. Hierover moet de zorgverlener in gesprek met de patiënt om de voor- (lagere kans re-ruptuur) en nadelen (complicaties) te bespreken en in het juiste perspectief te plaatsen.
Vanuit de Patiëntenfederatie Nederland komt een aantal aspecten naar voren ten aanzien van de waarden en voorkeuren van patiënten. Ten eerste verwachten patiënten voorlichting te krijgen over het verwachte herstel met de beide behandelingen. Hiervoor geldt dat beide behandelingen een nabehandeling met immobilisatie kennen. De vorm van immobilisatie kan verschillen tussen ziekenhuizen en zorgverleners (zie module 4). De behandelduur van beide interventies is niet significant anders. Op basis van deze informatie besluiten de zorgverlener en de patiënt samen tot de meest optimale behandeling. Ten tweede komt naar voren dat er aandacht moet zijn voor het welzijn van de patiënt met een gepaste bejegening. Het doel hiervan is het voorkómen van onnodige stress. Hiervoor geldt dat – ongeacht de gekozen behandeling – zorgverleners de patiënt moeten informeren over het feit dat het merendeel van de patiënten herstelt zonder complicaties en met een goede functie. Ten derde dient er aandacht te zijn voor eventuele mentale ondersteuning van patiënten, met name vanwege het lange traject. De zorgverleners die patiënten na een achillespeesruptuur initieel opvangen kunnen hieraan aandacht schenken en ook advies geven ten aanzien van begeleiding in dit traject. Op de spoedeisende hulp, of daarna in het poliklinische traject, behoort bovenstaande informatie aan de orde te komen. Tevens dient begeleiding in de vorm van fysiotherapie tijdig en laagdrempelig aangeboden te worden (zie module 4).
Zowel de (professionele) sporter als de patiënt die fysiek zware arbeid verricht behoort tot een subgroep van patiënten waarbij andere waarden en voorkeuren een rol kunnen spelen ten opzichte van de algemene populatie. Er was geen verschil in het percentage terugkeer naar sport en in tijd tot terugkeren naar werk tussen operatieve en conservatieve behandeling. Wel is het goed om rekening te houden met de specifieke waarden en voorkeuren van deze subgroepen. Hierbij kan gedacht worden aan de verlaagde kans op re-ruptuur na een operatieve behandeling om zo een nieuwe periode van absentie in werk/sport te voorkomen. Daartegenover staat ook bij deze groep het verhoogde risico op complicaties na een operatie. Bovenstaande factoren spelen een rol in de besluitvorming bij deze subgroep.
Kosten (middelenbeslag)
Het is te verwachten dat de kosten van de operatieve behandeling, met opname en (dag)verpleging hoger zijn dan die van een poliklinische conservatieve behandeling. Doordat de nabehandeling vergelijkbaar is zal het nabehandelingstraject geen doorslaggevende rol spelen ten aanzien van de uiteindelijke kosten (zie module 4). De groep die conservatief behandeld is en een re-ruptuur krijgt, zal opnieuw behandeld moeten worden, een deel hiervan operatief. Dit scenario zal, operatief dan wel conservatief, uiteindelijk tot meer directe en indirecte kosten leiden op individueel niveau, maar waarschijnlijk blijven de kosten op maatschappelijk niveau alsnog lager in het scenario re-ruptuur na conservatieve behandeling met vervolgens nieuwe behandeling dan de kosten voor initiële operatieve behandeling van alle patiënten met een ruptuur. (Er is geen literatuur beschikbaar om dit te onderbouwen).
Er zijn geen studies gevonden die voor de Nederlandse situatie een kosteneffectiviteit analyse hebben uitgevoerd met als vergelijking operatieve versus conservatieve behandeling na een acute achillespeesruptuur. De uitgevoerde buitenlandse studies naar kosteneffectiviteit zijn niet of nauwelijks naar de Nederlandse situatie te extrapoleren omdat de opbouw en hoogte van directe kosten (medisch) duidelijk anders is. Ten tweede zijn de consequenties van complicaties of re-ruptuur op de indirecte kosten (productieverlies) waarschijnlijk verschillend tussen landen.
Er zijn twee buitenlandse studies uitgevoerd naar kosteneffectiviteit van operatieve en conservatieve behandeling. Koltsov 2020 (USA) komt tot de conclusie dat conservatieve behandeling met lagere kosten dezelfde voordelen heeft als operatieve therapie. Tijd tot terugkeer naar werk speelt hierbij wel een rol, aangezien hierdoor de kosten in de conservatieve groep hoger zijn. Hierbij gaan zij, in tegenstelling tot de bevindingen van de gepoolde RCTs in deze richtlijn, uit van een tragere terugkeer naar werk na de conservatieve therapie met een verschil van tweeënhalve week. In de geïncludeerde studies voor deze richtlijn komt geen verschil in terugkeer naar werk naar voren. Westin 2018 (Zweden) voerde de kosteneffectiviteitsanalyse uit in een Zweedse populatie en kwam hierbij tot de conclusie dat na operatieve behandeling de directe kosten (medisch) hoger zijn maar de indirecte kosten (productieverlies, oftewel het aantal dagen werkverzuim) lager zijn. Echter, zij hanteerden een protocol waarbij in de conservatieve groep in de nabehandeling twee weken langer een brace draagt. Bovendien was er grote variatie in de mate van productieverlies omdat dit gerelateerd is aan functietaken per baan (denk aan kantoorbaan versus bouwwerkzaamheden).
Aanvaardbaarheid, haalbaarheid en implementatie
In Nederland worden op dit moment nog verschillende behandelingen uitgevoerd voor een acute achillespeesruptuur. Het ene centrum kiest nog vaker voor een operatieve behandeling dan het andere centrum. De trend is dat er de afgelopen jaren steeds meer patiënten conservatief behandeld worden. Ook binnen de operatieve en conservatieve behandeling is er een groot aantal verschillende opties. Een minimaal invasieve techniek kan een andere uitkomst geven dan een open operatie. De techniek van opereren wordt in module 3 van deze richtlijn uiteengezet. Ook een rigide conservatieve behandeling in gips zou andere resultaten kunnen geven dan een functionele nabehandeling. Hierop wordt in module 4 ingegaan. Het landelijk stroomlijnen van de behandeling is haalbaar, waar samen beslissen bij verschillende subgroepen van belang lijkt. De afweging van het risico op een re-ruptuur bij een conservatieve behandeling tegenover de over het algemeen grotere kans op complicaties bij een operatieve behandeling moet hierbij centraal staan.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
De functionele uitkomst na een acute achillespeesruptuur is niet verschillend na operatieve of conservatieve behandeling. Bovendien herstellen de meeste patiënten hiervan goed en naar tevredenheid. Er is wel bewijs dat de chirurgische behandeling resulteert in meer complicaties (oppervlakkige en diepe infecties) dan een conservatieve behandeling. Het enige voordeel van opereren is een verlaagd risico op een re-ruptuur. Overige uitkomstmaten zoals range of motion, kans op DVT en tijd tot terugkeer naar sport- en werk, lijken niet te verschillen tussen beide behandelingen. De directe kosten van een conservatieve behandeling zijn lager dan die van een operatieve behandeling. Er is echter geen Nederlands kosten-effectiviteitstudie om dit wetenschappelijk te onderbouwen. De maatschappelijke kosten (direct en indirect door bijvoorbeeld werkverzuim) van een re-ruptuur na conservatieve behandeling, met dus noodzaak tot een nieuwe behandeling, zijn niet bekend maar waarschijnlijk alsnog lager dan die van initieel operatieve behandeling.
In dit hoofdstuk wordt niet gedifferentieerd tussen verschillende operatietechnieken, maar ook niet tussen verschillende soorten conservatieve behandeling, bijvoorbeeld of deze rigide is of functioneel. Een conservatieve behandeling werd gedefinieerd als een niet-invasieve behandeling. In module 3 en 4 van deze richtlijn wordt dit verder gespecificeerd. Ook wordt er geen onderscheid gemaakt in de uitkomst tussen (top)sporters en mensen met bijvoorbeeld door zwaar fysiek werk. Voor deze groep gelden mogelijk dezelfde voor- en nadelen van een operatieve en conservatieve ingreep. De werkgroep adviseert om bij deze subgroep rekening te houden met de specifieke waarden en voorkeuren. De verlaagde kans op re-ruptuur na een operatieve behandeling kan een belangrijke overweging zijn voor deze subgroep om zo een nieuwe periode van absentie in werk/sport te voorkomen. De grotere complicatiekans dient meegenomen te worden in het gesprek. Het is daarom het advies om patiënten met een verhoogd risico op perioperatieve complicaties een conservatieve behandeling te adviseren.
Onderbouwing
Achtergrond
Behandeling van een primaire acute achillespeesruptuur is controversieel. Frequent toegepaste initiële conservatieve behandelingen zijn het toepassen van immobilisatie met gips of een brace. Operatieve behandelingen bestaan uit herstel van de achillespees via een open procedure of minimaal invasieve percutane procedure. Er is veel praktijkvariatie in de keuze om operatief of conservatief te behandelen. Dit hangt meestal af van de voorkeur van de zorgverlener, lokaal behandelprotocol en/of patiëntvoorkeur.
Conclusies / Summary of Findings
1. Functional outcomes
|
Low GRADE |
Surgical treatment may not reduce or increase functional outcomes when compared with conservative treatment in patients with primary, acute Achilles tendon ruptures.
Sources: She (2021) (Keating, 2011; Maempel, 2020; Manent, 2019; Nilsson-Helander, 2010). |
2. Re-rupture
|
Moderate GRADE |
Surgical treatment likely reduces the incidence of re-ruptures when compared with conservative treatment in patients with primary, acute Achilles tendon ruptures.
Sources: She (2021) (Cetti, 1993; Fischer, 2020; Keating, 2011; Lantto, 2016; Manent, 2019; Metz, 2008; Möller, 2001; Nistor, 1981; Nilsson-Helander, 2010; Olsson, 2013; Twaddle and Poon, 2007; Willits, 2010); Maempel (2020). |
3. Complications
|
Low GRADE |
Surgical treatment increases the number of complications (deep venous thrombosis, superficial- and deep infections, and sural nerve injury taken together, other than re-ruptures) when compared with conservative treatment in patients with primary, acute Achilles tendon ruptures.
Sources: She (2021) (Cetti, 1993; Fischer, 2020; Keating, 2011; Lantto, 2016; Metz, 2008; Möller, 2001; Nilsson-Helander, 2010; Nistor, 1981; Olsson, 2013; Twaddle and Poon, 2017; Willits, 2010). |
3.a. Deep venous thrombosis
|
Very low GRADE |
The evidence is very low on the effect of surgical treatment on the incidence of deep venous thrombosis when compared with conservative treatment in patients with primary, acute Achilles tendon ruptures.
Sources: She (2021) (Fischer, 2020; Keating, 2011; Metz, 2008; Möller, 2001; Nilsson-Helander, 2010; Olsson, 2013; Willits, 2010); Maempel (2020). |
3.b. Superficial infections
|
Low GRADE |
The evidence suggests that surgical treatment increases the incidence of superficial infections (clinically relevant) when compared with conservative treatment in patients with primary, acute Achilles tendon ruptures.
Sources: She (2021) (Keating, 2011; Manent, 2019; Möller, 2001; Nilsson-Helander, 2010; Olsson, 2013; Willits, 2010). |
3.c. Deep infections
|
Low GRADE |
The evidence suggests that surgical treatment increases the incidence of deep infections (clinically relevant) when compared with conservative treatment in patients with primary, acute Achilles tendon ruptures.
Sources: She (2021) (Cetti, 1993; Keating, 2011; Lantto, 2016; Manent, 2019; Metz, 2008; Nilsson-Helander, 2010; Twaddle and Poon, 2017; Willits, 2010). |
3.d. Sural nerve injury
|
Low GRADE |
Surgical treatment may increase the incidence of sural nerve injuries when compared with conservative treatment in patients with primary, acute Achilles tendon ruptures.
Sources: She (2021) (Cetti, 1993; Metz, 2008; Möller, 2001; Nilsson-Helander, 2010; Nistor, 1981; Olsson, 2013). |
4. Range of motion
|
Very low GRADE |
The evidence is very uncertain about the effect of surgical treatment on the range of motion when compared with conservative treatment in patients with primary, acute Achilles tendon ruptures.
Sources: She (2021) (Keating, 2011; Manent, 2019; Möller, 2001; Willits, 2010). |
5. Return to sport
|
Low GRADE |
Surgical treatment may not reduce or increase return to sport rate after a minimum of 12 months when compared with conservative treatment in patients with primary, acute Achilles tendon ruptures.
Sources: She (2021) (Cetti, 1993; Fischer, 2020; Keating, 2011; Manent, 2019; Metz, 2008; Möller, 2001; Nistor, 1981). |
6. Quality of life
|
Very low GRADE |
The evidence is very uncertain about the effect of surgical treatment on quality of life when compared with conservative treatment in patients with primary, acute Achilles tendon ruptures.
Sources: 1e Maempel (2020). |
7. Time to return to work
|
Very low GRADE |
The evidence is very uncertain about the effect of surgical treatment on time to return to work when compared with conservative treatment in patients with primary, acute Achilles tendon ruptures.
Sources: She (2021) (Cetti, 1993; Möller, 2001; Nistor, 1981). |
8. Re-operation
|
No GRADE |
Because of a lack of data in the included studies of this guideline, it was not possible to draw any conclusions regarding the outcome re-operation in patients with primary, acute Achilles tendon ruptures undergoing surgical or conservative treatment.
Sources: - |
Samenvatting literatuur
Description of studies
Systematic review(s)
The systematic review of She (2021) was used for the syntheses of the literature. She (2021) aimed to compare surgical repair and conservative treatment in patients with Achilles tendon ruptures. She (2021) searched the electronic databases of Pubmed, Embase, Cochrane Central Register of Controlled Trials (CENTRAL), and ClinicalTrial.gov until the 1st of July 2020. Randomized controlled trials (RCTs) that reported on the comparison of surgical versus conservative treatment of Achilles tendon ruptures were included in this meta-analysis. Reviews, letters, editorial comments, conference abstracts, discussions, notes, viewpoints, non-published studies, and case reports were excluded. The eligibility criteria for inclusion in this systematic review were (I) patients with Achilles tendon ruptures; (II) surgical treatment (open or minimally invasive surgery) compared with conservative treatment (cast immobilization or functional bracing); (III) patients aged 16 years and older; (IV) treatment initiated within four weeks of injury; (V) reporting of re-rupture, complications, functional outcomes, or patient satisfaction on corresponding treatment and outcomes. In total, twelve trials from the systematic review of She (2021), involving 1053 patients, were included for the purpose of this guideline (Cetti, 1993; Fischer, 2020; Keating, 2011; Lantto, 2016; Manent, 2019; Metz, 2008; Möller, 2001; Nilsson-Helander, 2010; Nistor, 1981; Olsson, 2013; Twaddle and Poon, 2017; Willits, 2010). The mean age of enrolled patients was around 40 years old, ranging from 18 to 63 years old. Overall, the population consisted of 891 males and 162 females. The shortest period between injury and treatment was two days, whilst 21 days was the longest period. The investigated surgical and conservative interventions included in the systematic review of She (2021) are listed in the evidence table of this guideline. Duration of follow-up ranged from twelve to 24 months. The risk of bias was assessed with the Cochrane Collaboration Tool. The included outcomes in She (2021) were re-rupture, return to sport, complications, deep venous thrombosis, sural nerve injury, infections, return to work, functional outcomes (Achilles Tendon Rupture Score), and range of motion. The individual study characteristics of the included studies are described in the evidence table of this guideline.
Randomized controlled trial(s)
The RCT of Maempel (2020) aimed to compare long-term patient-reported outcome measures (PROMs) after operative and non-operative treatment of acute Achilles tendon rupture. Maempel (2020) compared open repair using a Kessler stitch with a below-the-knee cast for ten weeks and reported long-term (sixteen years) follow-up outcomes of the same population as the study of Keating (2011), which is included in the systematic review of She (2021).
Results
1. Functional outcomes
Achilles Tendon Rupture Score
The Achilles Tendon Rupture Score (ATRS) is a disease-specific, self-administered PROM that can be used to quantify functional outcomes related to symptoms and physical activity after treatment in patients with an Achilles tendon rupture (10 questions using an 11-point (0-10) Likert scale, in which 0 means no symptoms and full function/recovery and 100 points means maximum disability).
The ATRS was reported in three studies, retrieved from the systematic review of She (2021) (Keating, 2011; Manent, 2019; Nilsson-Helander, 2010). The results were pooled in a meta-analysis. This resulted in a pooled mean difference (MD) in ATRS between the surgical and conservative intervention group of 4.27 (95% CI -0.24 to 8.77) points, in favor of the conservative treatment group. This is not considered as a clinically relevant difference.
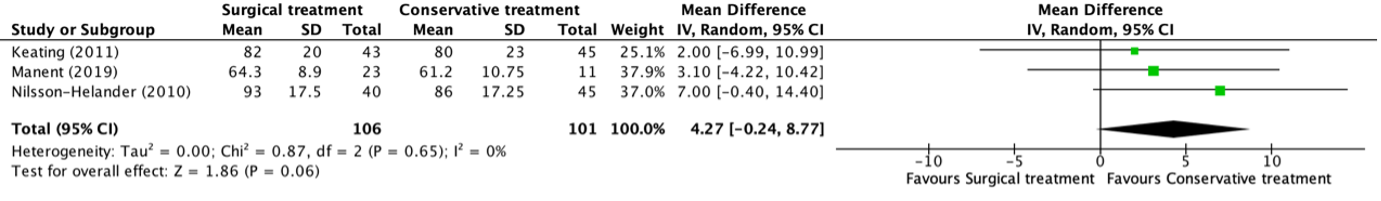
Figure 1. Forest plot showing the comparison between surgical treatment to conservative treatment for the Achilles Tendon Rupture Score. Pooled mean difference, random effects model. Z: p-value of overall effect; df: degrees of freedom; I2; statistical heterogeneity; CI: confidence interval.
Maempel (2020) reported the median (IQR) ATRS at sixteen years follow-up. The median (IQR) ATRS in the surgical treatment group at nearly sixteen years follow-up was 2.08 (0.00 to 12.50), compared to 0.00 (0.00 to 6.25) in the conservative treatment group. This is not considered as a clinically relevant difference.
2. Re-rupture
Rre-rupture were reported in twelve studies, retrieved from the systematic review of She (2021) (Cetti, 1993; Fischer, 2020; Keating, 2011; Lantto, 2016; Manent, 2019; Metz, 2008; Möller, 2001; Nilsson-Helander, 2010; Nistor, 1981; Olsson, 2013; Twaddle and Poon, 2007; Willits, 2010). The results were pooled in a meta-analysis. The pooled number of patients with re-ruptures in the surgical treatment group was 20/525 (3.8%), compared to 54/518 (10.4%) in the conservative treatment group. This resulted in a pooled relative risk ratio (RR) of 0.41 (95% CI 0.24 to 0.69) and a number needed to harm of 15.2, in favor of the surgical treatment group. This is considered as a clinically relevant difference.
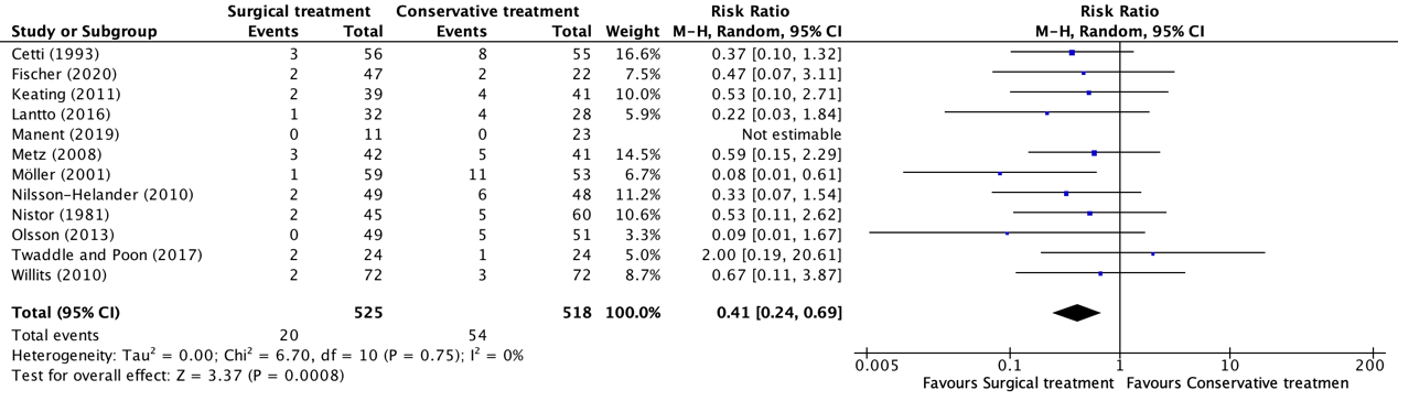
Figure 2. Forest plot showing the comparison between surgical treatment to conservative treatment for re-ruptures. Pooled risk ratio, random effects model. Z: p-value of overall effect; df: degrees of freedom; I2; statistical heterogeneity; CI: confidence interval.
Maempel (2020) reported the number of patients with re-ruptures but reported the results of 64 patients at nearly sixteen years follow-up. In total, six re-ruptures (four out of 37 in the surgical treatment group and two out of 39 in the conservative treatment group) occurred within 12 months follow-up. These twelve months follow-up results were published in the study of Keating (2011), which was already included in the systematic review of She (2021) (figure 1). Besides the four people in the surgical treatment group and two people in the conservative treatment group who experienced a re-rupture within 12 months follow-up, no additional re-ruptures occurred in the period from 12 months follow-up up to nearly sixteen years follow-up.
3. Complications
3.a. Deep venous thrombosis
The outcome deep venous thrombosis was reported in seven studies, retrieved from the systematic review of She (2021) (Fischer, 2020; Keating, 2011; Metz, 2008; Möller, 2001; Nilsson-Helander, 2010; Olsson, 2013; Willits, 2010). The results were pooled in a meta-analysis. The pooled number of patients that experienced deep venous thrombosis in the surgical treatment group was 4/355 (1.1%), compared to 7/326 (2.1%) in the conservative treatment group. This resulted in a pooled relative risk ratio (RR) of 0.63 (95% CI 0.21 to 1.91), in favor of the surgical treatment group. There is no statistically significant difference between-group difference in the onset of deep venous thrombosis. The absolute numbers are very low, making the clinical relevance of this finding uncertain.
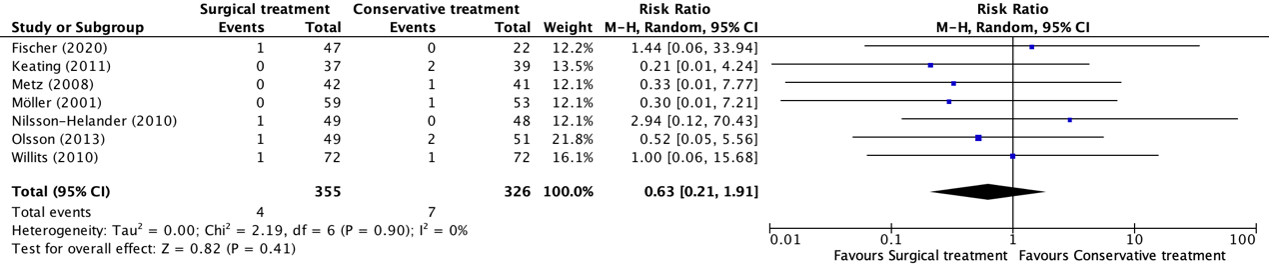
Figure 3. Forest plot showing the comparison between surgical treatment to conservative treatment for deep venous thrombosis. Pooled risk ratio, random effects model. Z: p-value of overall effect; df: degrees of freedom; I2; statistical heterogeneity; CI: confidence interval.
3.b. Superficial infections
Superficial infections were reported in six studies, retrieved from the systematic review of She (2021) (Keating, 2011; Manent, 2019; Möller, 2001; Nilsson-Helander, 2010; Olsson, 2013; Willits, 2010). The results were pooled in a meta-analysis. The pooled number of patients that experienced superficial infections in the surgical treatment group was 13/277 (4.7%), compared to 0/286 (0%) in the conservative treatment group. This resulted in a pooled risk difference (RD) of 0.03 (95% CI 0.01 to 0.11) and a number needed to harm of 21.3, in favor of the conservative treatment group. This is considered as a clinically relevant difference. A risk difference was calculated, because of the incidence of zero in the conservative group, a risk difference provides a more accurate estimate than a relative risk.
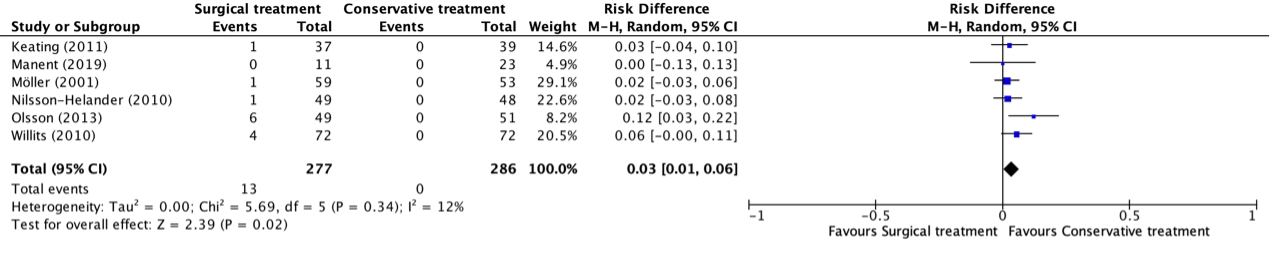
Figure 4. Forest plot showing the comparison between surgical treatment to conservative treatment for superficial infections. Pooled risk difference, random effects model. Z: p-value of overall effect; df: degrees of freedom; I2; statistical heterogeneity; CI: confidence interval.
3.c. Deep infections
Deep infections were reported in eight studies, retrieved from the systematic review of She (2021) (Cetti, 1993; Keating, 2011; Lantto, 2016; Manent, 2019; Metz, 2008; Nilsson-Helander, 2010; Twaddle and Poon, 2017; Willits, 2010). The results were pooled in a meta-analysis. The pooled number of patients that experienced deep infections in the surgical treatment group was 7/323 (2.2%), compared to 0/330 (0%) in the conservative treatment group. This resulted in a pooled risk difference (RD) of 0.02 (95% CI -0.00 to 0.04) and a number needed to harm of 45.5, in favor of the conservative treatment group. This is considered as a clinically relevant difference. A risk difference was calculated, because of the incidence of zero in the conservative group, a risk difference provides a more accurate estimate than a relative risk.
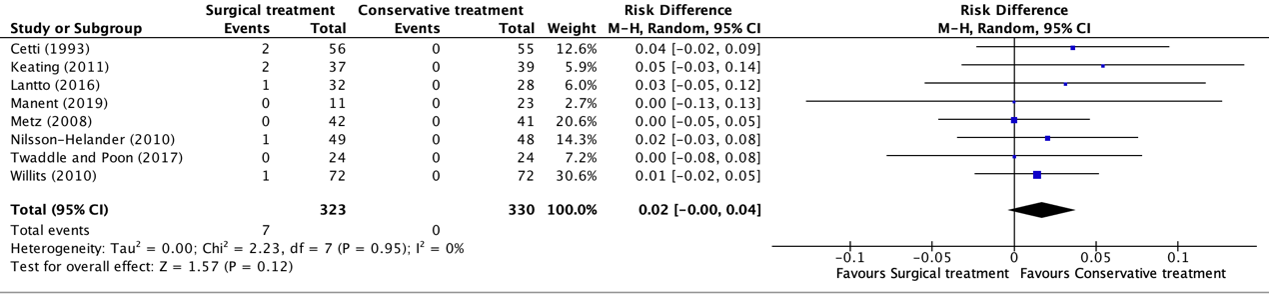
Figure 5. Forest plot showing the comparison between surgical treatment to conservative treatment for deep infections. Pooled risk difference, random effects model. Z: p-value of overall effect; df: degrees of freedom; I2; statistical heterogeneity; CI: confidence interval.
3.d. Sural nerve injury
Sural nerve injuries were reported in six studies, retrieved from the systematic review of She (2021) (Cetti, 1993; Metz, 2008; Möller, 2001; Nilsson-Helander, 2010; Nistor, 1981; Olsson, 2013). The results were pooled in a meta-analysis. The pooled number of patients with sural nerve injuries in the surgical treatment group was 23/295 (7.8%), compared to 2/308 (0.7%) in the conservative treatment group. This resulted in a pooled relative risk ratio (RR) of 5.45 (95% CI 1.87 to 15.90), in favor of the conservative treatment group. This was considered as a clinically relevant difference.
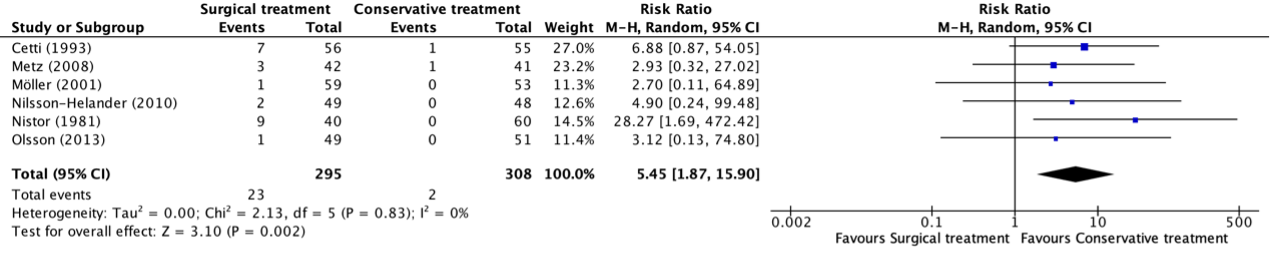
Figure 6. Forest plot showing the comparison between surgical treatment to conservative treatment for sural nerve injury. Pooled risk difference, random effects model. Z: p-value of overall effect; df: degrees of freedom; I2; statistical heterogeneity; CI: confidence interval.
4. Range of motion
Dorsiflexion
The range of motion of dorsiflexion in the ankle was reported in two studies, retrieved from the systematic review of She (2021) (Keating, 2011; Willits, 2010). The results were pooled in a meta-analysis. This resulted in a pooled mean difference (MD) in dorsiflexion between the surgical and the conservative treatment group of 0.62 (95% CI -3.23 to 4.46) degrees, in favor of the conservative treatment group. This is not considered as a clinically relevant difference.

Figure 7. Forest plot showing the comparison between surgical treatment to conservative treatment for dorsiflexion of the ankle. Pooled mean difference, random effects model. Z: p-value of overall effect; df: degrees of freedom; I2; statistical heterogeneity; CI: confidence interval.
Plantarflexion
The range of motion of plantarflexion in the ankle was reported in four studies, retrieved from the systematic review of She (2021) (Keating, 2011; Manent, 2019; Möller, 2001; Willits, 2010). The results were pooled in a meta-analysis. This resulted in a pooled mean difference (MD) in plantarflexion between the surgical and conservative treatment group of 2.43 (95% CI -1.97 to 6.83) degrees, in favor of the conservative treatment group. This is not considered as a clinically relevant difference.
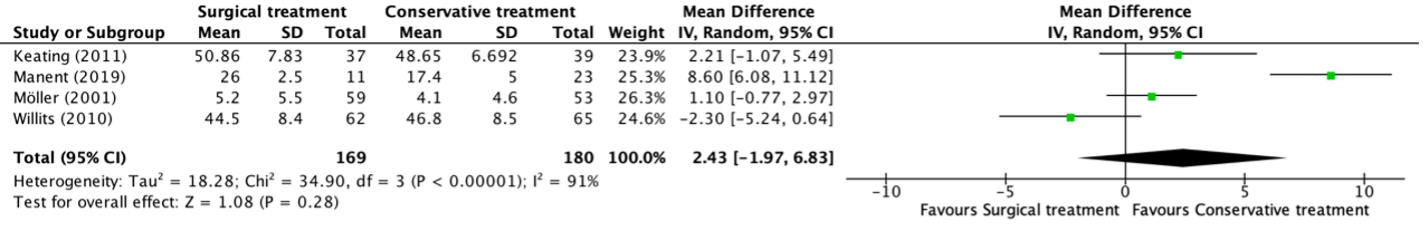
Figure 8. Forest plot showing the comparison between surgical treatment to conservative treatment for plantarflexion of the ankle. Pooled mean difference, random effects model. Z: p-value of overall effect; df: degrees of freedom; I2; statistical heterogeneity; CI: confidence interval.
5. Return to sport
The outcome return to sport (at the same level before the injury) after a minimum of twelve months follow-up was reported in seven studies, retrieved from the systematic review of She (2021) (Cetti, 1993; Fischer, 2020; Keating, 2011; Manent, 2019; Metz, 2008; Möller, 2001; Nistor, 1981). The results were pooled in a meta-analysis. The pooled number of patients that returned to sport in the surgical treatment group was 94/249 (37.8%), compared to 91/231 (39.4%) in the conservative treatment group. This resulted in a pooled relative risk ratio (RR) of 1.01 (95% CI 0.76 to 1.33), in favor of the conservative treatment group. This is not considered as a clinically relevant difference.
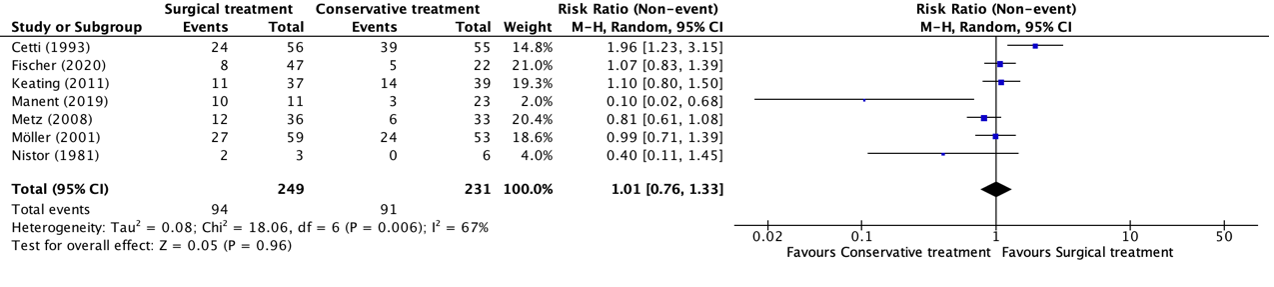
Figure 9. Forest plot showing the comparison between surgical treatment to conservative treatment for return to sport. Pooled risk ratio, random effects model. Z: p-value of overall effect; df: degrees of freedom; I2; statistical heterogeneity; CI: confidence interval.
6. Quality of life
The outcome quality of life was reported in one study (Maempel, 2020). Maempel (2020) measured quality of life with the EuroQol five-dimension five-level (EQ-5D-5L) questionnaire. The EQ-5D-5L index comprises five domains (mobility, self-care, usual activities, pain and discomfort, and anxiety and depression) used to calculate an index score ranging between -0.59 and +1.
The median (IQR) EQ-5D-5L score in the surgical treatment group was 1.00 (0.75 to 1.00), compared to 1.00 (0.84 to 1.00) in the conservative treatment group at nearly sixteen years follow-up. This is not considered as a clinically relevant difference.
7. Time to return to work
The outcome time to return to work was reported in three studies, retrieved from the systematic review of She (2021) (Cetti, 1993; Möller, 2001; Nistor, 1981). The results were pooled in a meta-analysis. This resulted in a pooled mean difference (MD) in time to return to work between the surgical and conservative intervention group of -0.22 (95% CI -4.32 to 3.89) days, in favor of the surgical treatment group. This is not considered as a clinically relevant difference.
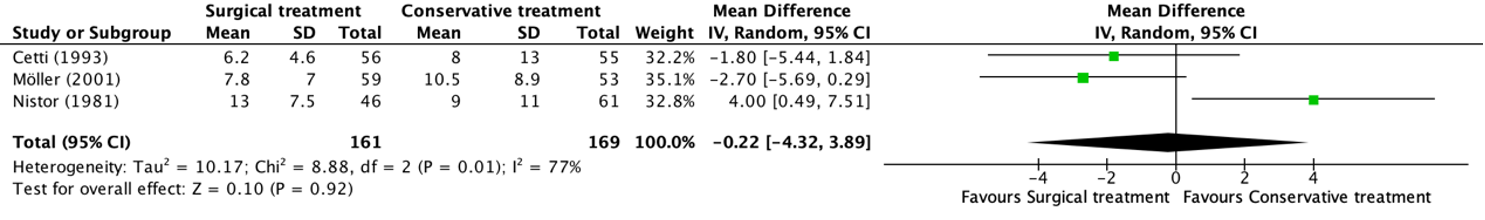
Figure 10. Forest plot showing the comparison between surgical treatment to conservative treatment for time to return to work in days. Pooled mean difference, random effects model. Z: p-value of overall effect; df: degrees of freedom; I2; statistical heterogeneity; CI: confidence interval.
8. Re-operation
None of the included studies in this guideline reported the outcome re-operation in patients with acute Achilles tendon ruptures undergoing surgical or conservative treatment.
Level of evidence of the literature
1. Functional outcomes
The level of evidence regarding the outcome functional outcomes was derived from randomized controlled trials and therefore started high. The level of evidence was downgraded by two levels because of a lack of blinding (risk of bias, -1) and the small number of included patients (imprecision, -1). The level of evidence is low.
2. Re-rupture
The level of evidence regarding the outcome re-rupture was derived from randomized controlled trials and therefore started high. The level of evidence was downgraded by one level because the small number of events (imprecision, -1). The level of evidence is moderate.
3. Complications
The level of evidence regarding the outcome complications (deep venous thrombosis, superficial- and deep infections, and sural nerve injury taken together, other than re-ruptures) was derived from randomized controlled trials and therefore started high. The level of evidence was downgraded by two levels because of a lack of blinding (risk of bias, -1) and the wide confidence interval crossing the border of clinical relevance (imprecision, -1). The level of evidence is low.
3.a. Deep venous thrombosis
The level of evidence regarding the outcome deep venous thrombosis was derived from randomized controlled trials and therefore started high. The level of evidence was downgraded by three levels because of a lack of blinding (risk of bias, -1), the wide confidence interval crossing the borders of clinical relevance and the small number of cases (imprecision, -2). The level of evidence is very low.
3.b. Superficial infections
The level of evidence regarding the outcome superficial infections was derived from randomized controlled trials and therefore started high. The level of evidence was downgraded by two levels because of a lack of blinding (risk of bias, -1) and the small number of cases (imprecision, -1). The level of evidence is low.
3.c. Deep infections
The level of evidence regarding the outcome deep infections was derived from randomized controlled trials and therefore started high. The level of evidence was downgraded by two levels because of a lack of blinding (risk of bias, -1) and the small number of cases (imprecision, -1). The level of evidence is low.
3.d. Sural nerve injury
The level of evidence regarding the outcome deep infections was derived from randomized controlled trials and therefore started high. The level of evidence was downgraded by two levels because of a lack of blinding (risk of bias, -1) and the small number of cases (imprecision, -1). The level of evidence is low.
4. Range of motion
The level of evidence regarding the outcome infections was derived from randomized controlled trials and therefore started high. The level of evidence was downgraded by three levels because of a lack of blinding (risk of bias, -1), heterogeneity in the study results (inconsistency, -1), and the wide confidence interval crossing the border of clinical relevance (imprecision, -1). The level of evidence is very low.
5. Return to sport
The level of evidence regarding the outcome return to sport was derived from randomized controlled trials and therefore started high. The level of evidence was downgraded by two levels because of lack of blinding (risk of bias, -1) and the wide confidence interval crossing the borders of clinical relevance (imprecision, -1). The level of evidence is low.
6. Quality of life
The level of evidence regarding the outcome quality of life was derived from randomized controlled trials and therefore started high. The level of evidence was downgraded by three levels because of lack of blinding and frequent lost to follow-up (risk of bias, -1) and the small number of included patients (imprecision, -2). The level of evidence is very low.
7. Time to return to work
The level of evidence regarding the outcome time to return to work was derived from randomized controlled trials and therefore started high. The level of evidence was downgraded by two levels because of lack of blinding (risk of bias, -1) and heterogeneity in the study results (inconsistency, -2). The level of evidence is very low.
8. Re-operation
Because of a lack of data, it was not possible to grade the literature for the outcome re-operation in patients with acute Achilles tendon ruptures undergoing surgical or conservative treatment.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question: What are the (un)beneficial effects of surgical treatment for an initial Achilles tendon rupture?
P: Adult patients with acute (diagnosed within 72 hours) Achilles tendon rupture (primary rupture and no re-rupture)
I: Surgical treatment (all techniques an no distinction made between minimally invasive and open techniques).
C: Conservative treatment (all non-operative treatments, such as plaster casts or immobilization with an orthosis).
O: Re-rupture, functional outcomes (such as daily function); range of motion (such as dorsiflexion and plantarflexion); complications (such as superficial and deep infections, deep venous thrombosis; sural nerve injury); return to sport; quality of life; time to return to work; re-operation.
Relevant outcome measures
The guideline development group considered functional outcomes (such as daily function) as critical outcomes for decision making; and re-rupture, range of motion, complications (such as superficial and deep infections, deep venous thrombosis, sural nerve injury), return to sport, quality of life, time to return to work, and re-operation as important outcomes for decision making.
The working group defined a threshold of 10% for continuous outcomes and a relative risk (RR) for dichotomous outcomes of <0.80 and >1.25 as a minimal clinically (patient) important difference. For Achilles tendon rupture score (ATRS), which measures daily function, values of 13.5 and 28.5 were considered as minimal clinically important differences at three and six months after an Achilles tendon rupture (Dams, 2020).
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until the 20th of December 2021. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 123 hits. First, systematic reviews were selected comparing surgical treatment to a conservative intervention for Achilles tendon ruptures. Twenty-seven systematic reviews were initially selected based on title and abstract screening. After reading the full-text, 26 systematic reviews were excluded (see table with reasons for exclusion under the tab Methods), and one systematic review was included. The final date of search of this systematic review was July 2020.
Secondly, 33 randomized controlled trials (RCTs) were selected, which were published from July 2020 until 27 January 2022. Four randomized controlled trials were initially selected based on title and abstract screening. After reading the full text, three randomized controlled trials were excluded (see the table with reasons for exclusion under the tab Methods), and one randomized controlled trial was included.
Results
One systematic review (She, 2021) was included in the analysis of the literature. We extracted the data of the individual RCTs (reported in the systematic review) which investigated surgical treatment compared to conservative treatment. In addition, we included one RCT, published after the final search date of the included systematic review of She (2021). Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Alrabaa RG, Freibott C, Vosseller JT. Patient perception of Achilles tendon rupture treatment. Injury. 2020 Nov;51(11):2710-2716. doi: 10.1016/j.injury.2020.08.003. Epub 2020 Aug 2. PMID: 32773115.Cetti R, Christensen SE, Ejsted R, Jensen NM, Jorgensen U. Operative versus nonoperative treatment of Achilles tendon rupture. A prospective randomized study and review of the literature. Am J Sports Med. 1993 Nov-Dec;21(6):791-9. doi: 10.1177/036354659302100606. PMID: 8291628.
- Cetti R, Christensen SE, Ejsted R, Jensen NM, Jorgensen U. Operative versus nonoperative treatment of Achilles tendon rupture. A prospective randomized study and review of the literature. Am J Sports Med. 1993 Nov-Dec;21(6):791-9. doi: 10.1177/036354659302100606. PMID: 8291628.
- Dams OC, Reininga IHF, Zwerver J, Diercks RL, van den Akker-Scheek I. The Achilles tendon Total Rupture Score is a responsive primary outcome measure: an evaluation of the Dutch version including minimally important change. Knee Surg Sports Traumatol Arthrosc. 2020 Oct;28(10):3330-3338. doi: 10.1007/s00167-020-05924-7. Epub 2020 Mar 7. PMID: 32146524; PMCID: PMC7511458.Fischer S, Colcuc C, Gramlich Y, Stein T, Abdulazim A, von Welck S, Hoffmann R. Prospective randomized clinical trial of open operative, minimally invasive and conservative treatments of acute Achilles tendon tear. Arch Orthop Trauma Surg. 2021 May;141(5):751-760. doi: 10.1007/s00402-020-03461-z. Epub 2020 May 4. PMID: 32367375.
- Fischer S, Colcuc C, Gramlich Y, Stein T, Abdulazim A, von Welck S, Hoffmann R. Prospective randomized clinical trial of open operative, minimally invasive and conservative treatments of acute Achilles tendon tear. Arch Orthop Trauma Surg. 2021 May;141(5):751-760. doi: 10.1007/s00402-020-03461-z. Epub 2020 May 4. PMID: 32367375.
- Keating JF, Will EM. Operative versus non-operative treatment of acute rupture of tendo Achillis: a prospective randomised evaluation of functional outcome. J Bone Joint Surg Br. 2011 Aug;93(8):1071-8. doi: 10.1302/0301-620X.93B8.25998. PMID: 21768631.
- Koltsov JCB, Gribbin C, Ellis SJ, Nwachukwu BU. Cost-effectiveness of Operative Versus Non-operative Management of Acute Achilles Tendon Ruptures. HSS J. 2020 Feb;16(1):39-45. doi: 10.1007/s11420-019-09684-0. Epub 2019 Jun 8. PMID: 32015739; PMCID: PMC6974171.Lantto I, Heikkinen J, Flinkkila T, Ohtonen P, Siira P, Laine V, Leppilahti J. A Prospective Randomized Trial Comparing Surgical and Nonsurgical Treatments of Acute Achilles Tendon Ruptures. Am J Sports Med. 2016 Sep;44(9):2406-14. doi: 10.1177/0363546516651060. Epub 2016 Jun 15. PMID: 27307495.
- Lantto I, Heikkinen J, Flinkkila T, Ohtonen P, Siira P, Laine V, Leppilahti J. A Prospective Randomized Trial Comparing Surgical and Nonsurgical Treatments of Acute Achilles Tendon Ruptures. Am J Sports Med. 2016 Sep;44(9):2406-14. doi: 10.1177/0363546516651060. Epub 2016 Jun 15. PMID: 27307495.
- Maempel JF, Clement ND, Wickramasinghe NR, Duckworth AD, Keating JF. Operative repair of acute Achilles tendon rupture does not give superior patient-reported outcomes to nonoperative management. Bone Joint J. 2020 Jul;102-B(7):933-940. doi: 10.1302/0301-620X.102B7.BJJ-2019-0783.R3. PMID: 32600149.
- Manent A, López L, Corominas H, Santamaría A, Domínguez A, Llorens N, Sales M, Videla S. Acute Achilles Tendon Ruptures: Efficacy of Conservative and Surgical (Percutaneous, Open) Treatment-A Randomized, Controlled, Clinical Trial. J Foot Ankle Surg. 2019 Nov;58(6):1229-1234. doi: 10.1053/j.jfas.2019.02.002. Erratum in: J Foot Ankle Surg. 2020 Jul - Aug;59(4):874. PMID: 31679677.
- Metz R, Verleisdonk EJ, van der Heijden GJ, Clevers GJ, Hammacher ER, Verhofstad MH, van der Werken C. Acute Achilles tendon rupture: minimally invasive surgery versus nonoperative treatment with immediate full weightbearing--a randomized controlled trial. Am J Sports Med. 2008 Sep;36(9):1688-94. doi: 10.1177/0363546508319312. Epub 2008 Jul 21. PMID: 18645042.
- Möller M, Movin T, Granhed H, Lind K, Faxén E, Karlsson J. Acute rupture of tendon Achillis. A prospective randomised study of comparison between surgical and non-surgical treatment. J Bone Joint Surg Br. 2001 Aug;83(6):843-8. doi: 10.1302/0301-620x.83b6.11676. PMID: 11521926.
- Nilsson-Helander K, Silbernagel KG, Thomeé R, Faxén E, Olsson N, Eriksson BI, Karlsson J. Acute achilles tendon rupture: a randomized, controlled study comparing surgical and nonsurgical treatments using validated outcome measures. Am J Sports Med. 2010 Nov;38(11):2186-93. doi: 10.1177/0363546510376052. Epub 2010 Aug 27. PMID: 20802094.
- Nistor L. Surgical and non-surgical treatment of Achilles Tendon rupture. A prospective randomized study. J Bone Joint Surg Am. 1981 Mar;63(3):394-9. PMID: 7204438.
- Ochen Y, Beks RB, van Heijl M, Hietbrink F, Leenen LPH, van der Velde D, Heng M, van der Meijden O, Groenwold RHH, Houwert RM. Operative treatment versus nonoperative treatment of Achilles tendon ruptures: systematic review and meta-analysis. BMJ. 2019 Jan 7;364:k5120. doi: 10.1136/bmj.k5120. PMID: 30617123; PMCID: PMC6322065.
- Olsson N, Silbernagel KG, Eriksson BI, Sansone M, Brorsson A, Nilsson-Helander K, Karlsson J. Stable surgical repair with accelerated rehabilitation versus nonsurgical treatment for acute Achilles tendon ruptures: a randomized controlled study. Am J Sports Med. 2013 Dec;41(12):2867-76. doi: 10.1177/0363546513503282. Epub 2013 Sep 6. PMID: 24013347.
- She G, Teng Q, Li J, Zheng X, Chen L, Hou H. Comparing Surgical and Conservative Treatment on Achilles Tendon Rupture: A Comprehensive Meta-Analysis of RCTs. Front Surg. 2021 Feb 18;8:607743. doi: 10.3389/fsurg.2021.607743. PMID: 33681281; PMCID: PMC7931800.
- Twaddle BC, Poon P. Early motion for Achilles tendon ruptures: is surgery important? A randomized, prospective study. Am J Sports Med. 2007 Dec;35(12):2033-8. doi: 10.1177/0363546507307503. Epub 2007 Sep 20. PMID: 17885221.
- Westin O, Svensson M, Nilsson Helander K, Samuelsson K, Grävare Silbernagel K, Olsson N, Karlsson J, Hansson Olofsson E. Cost-effectiveness analysis of surgical versus non-surgical management of acute Achilles tendon ruptures. Knee Surg Sports Traumatol Arthrosc. 2018 Oct;26(10):3074-3082. doi: 10.1007/s00167-018-4953-z. Epub 2018 Apr 25. PMID: 29696317; PMCID: PMC6154020.
- Willits K, Amendola A, Bryant D, Mohtadi NG, Giffin JR, Fowler P, Kean CO, Kirkley A. Operative versus nonoperative treatment of acute Achilles tendon ruptures: a multicenter randomized trial using accelerated functional rehabilitation. J Bone Joint Surg Am. 2010 Dec 1;92(17):2767-75. doi: 10.2106/JBJS.I.01401. Epub 2010 Oct 29. PMID: 21037028.
Evidence tabellen
Evidence tabel
Systematic review(s)
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
She (2021)
|
SR and meta-analysis of RCTs
Literature search up to 1 July 2020
Study design: RCT (parallel)
Setting and Country:
Source of funding and conflicts of interest: The authors declare that the research was conducted in the absence of any commercial or financial relationships that could be construed as a potential conflict of interest.
|
Inclusion criteria SR:
Exclusion criteria SR:
12 studies included.
Important patient characteristics at baseline: Number of patients; characteristics important to the research question and/or for statistical adjustment (confounding in cohort studies); for example, age, sex, bmi, ...
N (surgical versus conservative)
Mean age (surgical versus conservative)
Sex M/F (surgical versus conservative)
Groups comparable at baseline? Yes. |
Describe intervention:
|
Describe control:
|
End-point of follow-up:
|
Outcome measure: Re-rupture rate
Re-rupture rate in accelerated functional rehabilitation, n/N (%)
F (Nilsson-Helander, 2010) I: 2/49 (4.1%) C: 6/48 (12.5%) RR 0.33 (95% CI 0.07 to 1.54)
D (Twaddle and Poon, 2007) I: 2/24 (8.3%) C: 1/24 (4.2%) RR 2.00 (95% CI 0.19 to 20.61)
G (Willits, 2010) I: 2/72 (2.8%) C: 3/72 (4.2%) RR 0.67 (95% CI 0.11 to 3.87)
Re-rupture not in accelerated functional rehabilitation
B (Cetti, 1993) I: 3/56 (5.4%) C: 8/55 (14.5%) RR 0.37 (95% CI 0.10 to 1.32)
L (Fischer, 2020) I: 2/47 (4.3%) C: 2/22 (9.1%)
H (Keating, 2011) I: 2/39 (5.1%) C: 4/41 (9.8%) RR 0.53 (95% CI 0.10 to 2.71)
J (Lantto, 2016) I: 1/32 ( C: 4/28 ( RR 0.22 (95% CI 0.03 to 1.84)
K (Manent, 2019) I: 0/11 (0%) C: 0/23 (0%) RR not estimable
E (Metz, 2008) I: 3/42 (7.1%) C: 5/41 (12.2%) RR 0.59 (95% CI 0.15 to 2.29)
C (Möller, 2008) I: 1/59 (1.7%) C: 11/53 (20.8%) RR 0.08 (95%CI 0.01 to 0.61)
A (Nistor, 1981) I: 2/45 (4.4%) C: 5/60 (8.3%)
I (Olsson, 2013) I: 0/49 (0%) C: 5/51 (9.8%) RR 0.09 (95% CI 0.01 to 1.67)
Outcome measure: Return to sport
B (Cetti, 1993) I: 24/56 (42.9%) C: 39/55 (70.9%) RR 0.60 (95% CI 0.43 to 0.85)
L (Fischer, 2020) I: 8/47 (17.0%) C: 5/22 (22.7%) RR 0.75 (95% CI 0.28 to 2.03)
H (Keating, 2011) I: 11/37 (29.7%) C: 14/39 (35.9%) RR 0.83 (95% CI 0.43 to 1.58)
K (Manent, 2019) I: 10/11 (90.9%) C: 3/23 (13.0%) RR 6.97 (95% CI 2.39 to 20.35)
E (Metz, 2008) I: 12/36 (33.3%) C: 6/33 (18.2%) RR 1.83 (95% CI 0.78 to 4.33)
C (Möller, 2008) I: 27/59 (45.8%) C: 24/53 (45.3%) RR 1.01 (95% CI 0.67 to 1.52)
A (Nistor, 1981) I: 2/3 (66.7%) C: 0/6
Outcome measure: complication rate Defined as complication that occurred after achilles tendon rupture treatment other than re-rupture.
F (Nilsson-Helander, 2010) I: 6/49 (12.2%) C: 3/48 (6.3%) RR 1.96 (95% CI 0.52 to 7.39)
D (Twaddle and Poon, 2007) I: 0/24 (0%) C: 0/24 (0%) RR not estimable
G (Willits, 2010) I: 11/72 (15.3%) C: 3/72 (4.2%) RR 3.67 (95% CI 1.07 to 12.60)
J (Lantto, 2016) I: 1/32 (3.1%) C: 0/28 (0%) RR 2.64 (95% CI 0.11 to 62.23)
E (Metz, 2008) I: 9/42 (21.4%) C: 15/41 (36.6%) RR 0.59 (95% CI 0.29 to 1.19)
C (Möller, 2008) I: 12/59 (20.3%) C: 1/53 (1.9%) RR 10.78 (95% CI 1.45 to 80.13)
A (Nistor, 1981) I: 31/46 (67.4%) C: 0/61 (0%) RR 83.11 (95% CI 5.22 to 1323.46)
I (Olsson, 2013) I: 8/49 (16.3%) C: 2/51 (3.9%) RR 4.16 (95% CI 0.93 to 18.64)
B (Cetti, 1993) I: 17/56 (30.4%) C: 4/55 (7.3%) RR 4.17 (95% CI 1.50 to 11.62)
L (Fischer, 2020) I: 9/47 (19.1%) C: 4/22 (18.2%) RR 1.05 (95% CI 0.36 to 3.05)
H (Keating, 2011) I: 3/39 (7.7%) C: 2/41 (4.9%) RR 1.58 (95% CI 0.28 to 8.94)
Outcome measure: deep venous thrombosis
G (Willits, 2010) I: 1/72 (1.4%) C: 1/72 (1.4%) RR 1.00 (95% CI 0.06 to 15.68)
L (Fischer, 2020) I: 1/47 (2.1%) C: 0/22 (0%) RR 1.44 (95% CI 0.06 to 33.94)
H (Keating, 2011) I: 0/37 (0%) C: 2/39 (5.1%) RR 0.21 (95% CI 0.01 to 4.24)
E (Metz, 2008) I: 0/42 (0%_ C: 1/41 (2.4%) RR 0.33 (95% CI 0.01 to 7.77)
C (Möller, 2008) I: 0/59 (0%) C: 1/53 (1.9%) RR 0.30 (95% CI 0.01 to 7.21)
F (Nilsson-Helander, 2010) I: 1/49 (2.0%) C: 0/48 (0%) RR 2.94 (95% CI 0.12 to 70.43)
I (Olsson, 2013) I: 1/49 (2.0%) C: 2/51 (3.9%) RR 0.52 (95% CI 0.05 to 5.56)
Outcome measure: adhesion to underlying tendon
B (Cetti, 1993) I: 6/56 (10.7%) C: 2/55 (3.6%) RR 2.95 (95% CI 0.62 to 13.97)
E (Metz, 2008) I: 3/42 (7.1%) C: 0/41 (0%) RR 6.84 (95% Ci 0.36 to 128.37)
A (Nistor, 1981) I: 20/40 (50%) C: 0/60 (0%) RR 61.00 (95% CI 3.79 to 980.65)
Outcome measure: sural nerve injury
F (Nilsson-Helander, 2010) I: 2/49 (4.1%) C: 0/48 (0%) RR 4.90 (95% CI 0.24 to 99.48)
E (Metz, 2008) I: 3/42 (7.1%) C: 1/41 (0%) RR 2.93 (95% CI 0.32 to 27.02)
B (Cetti, 1993) I: 7/56 (12.5%) C: 1/55 (1.8%)
A (Nistor, 1981) I: 9/40 (22.5%) C: 0/60 (0%) RR 28.27 (95% CI 1.69 to 472.42)
I (Olsson, 2013) I: 1/49 (2.0%) C: 0/51 (0%) RR 3.12 (95% CI 0.13 to 74.80)
C (Möller, 2008) I: 1/59 (1.7%) C: 0/53 (0%) RR 2.70 (95% CI 0.11 to 64.89)
|
Author’s conclusion:
In this meta-analysis, surgical treatment was revealed to be significant in the reduction of re-rupture rate but associated with a higher complication rate. Conservative treatment was found to be capable of having similar functional outcomes with surgical treatment. Collectively, we recommend conservative treatment if patients’ status and expectations are suitable, but surgeon and physician discretion is also important in decision making.
|
Randomized controlled trial(s)
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Maempel (2020) |
Type of study: Randomized controlled trial.
Setting and country: Not reported.
Funding and conflicts of interest: No benefits in any form have been received or will be received from a commercial party related directly or indirectly to the subject of this article.
|
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: N = 33 Control: N = 31
Important prognostic factors2: age ± range I: 56.0 (37 to 75) C: 59.4 (46 to 77)
Sex: I: 22/33 (66.7%) M C: 23/31 (74.2%) M
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test):
Repair was carried out by an open technique via a posteromedial longitudinal incision. Dissection was continued into the paratenon and full-thickness flaps were reflected to expose the ruptured tendon. A core Kessler stitch with a double-stranded PDS suture (Ethicon, Woluew, Belgium) was used to appose the tendon ends and then supplemented with interrupted Vicryl circumferential sutures (Ethicon). The paratenon was sutured over the repair and the skin closed with interrupted fine nylon mattress sutures (Ethicon). The limb was immobilised in a full equinus cast for four weeks, and changed to a semi-equinus cast for a further two weeks. The cast was then removed and weight-bearing allowed.
|
Describe control (treatment/procedure/test):
Patients allocated to non-operative treatment were immobilised in a below-knee cast for a total of ten weeks. The initial cast was in full equinus for four weeks; it was then changed to a semi-equinus cast for four weeks, followed by a cast in neutral for two weeks. Patients were advised to be non-weight-bearing while in the equinus and semi-equinus casts, and partial weight-bearing was allowed in the neutral cast. This was our standard regime for the non-operative treatment of tendo Achillis rupture before the trial, and an internal audit had shown a re-rupture rate of 8%, which compares favourably with reported rates of re-rupture.
|
Length of follow-up: Long term > mean of just under 16 years follow-up.
Loss-to-follow-up: Intervention: N = 5 (13.5%) Reasons: LTFU (N=4); deceased (N=1)
Control: N = 9 (23.1%) Reasons: LTFU (N=8); deceased (N=1)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Functional outcome
Short Musculoskeletal Function Assessment, mediab (IQR) I: 2.08 (0.00 to 12.50) C: 0.00 (0.00 to 6.25) P=0.074
Achilles Tendon Rupture Score, median (IQR) I: 94 (86 to 100) C: 95 (81 to 100) P=0.313
Euro-Qol five-dimension five-level questionnaire (DQ-5D-5L score)
Mobility, no problems vs problems, n/N (%) I: 9/33 (27.3%) vs 24/33 (72.7%) C: 5/31 (16.1%) vs 26/31 (83.9%) P=0.220
Selfcare, no problems vs problems, n/N (%) I: 1/33 (3.0%) vs 32/33 (97.0%) C: 0/31 (0%) vs 31/31 (100%)
Usual activity, no problems vs problems, n/N (%) I: 8/33 (24.2%) vs 25/33 (75.8%) C: 4/31 (12.9%) vs 27/31 (87.1%)
Pain/discomfort, no problems vs problems, n/N (%) I: 16/33 (48.5%) vs 17/33 (51.5%) C: 10/31 (33.3%) vs 21/31 (66.7%)
Anxiety/depression, no problems vs problems, n/N (%) I: 8/33 (24.2%) vs 25/33 (75.8%) C: 8/31 (25.8%) vs 23/31 (74.2%)
EQ-5D-5L questionnaire score at nearly 16 years follow-up, median (IQR) I: 1.00 (0.75 to 1.00) C: 1.00 (0.84 to 1.00) P=0.137 |
Author’s conclusion:
At a mean of just under 16 years follow-up, patients treated both operatively and nonoperatively for acute atR reported good outcomes. surgically treated patients did not report superior smfa scores to those treated nonoperatively. there was no demonstrable difference in assessed outcomes across a range of injury specific, general musculoskeletal and HRQoL PROMs, and measures of patient satisfaction and sentiment.
|
Risk of bias tabel
Systematic review(s)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
She (2021) |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Yes |
Yes |
Randomized controlled trial(s)
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
Maempel (2020) |
Definitely yes
Reason: “Randomization was through sealed envelope allocation at first presentation to clinic.”
|
No information
Reason: |
No information
Reason: |
Definitely no
Reason: N=4 LTFU in surgical group and N=8 LTFU in conservative group. |
Definitely yes
Reason: all predefined outcomes were reported. |
Probably yes
Reason: no other problems reported.
|
High
Reason: possible selection bias and no blinding |
|
Fischer (2020) |
Probably yes
Reason: not specifically described. |
No information
Reason: |
No blinding
Reason: “Some limitations of this study need to be considered. The design of the study did not allow blinding.” |
Probably yes
Reason: little lost to follow-up. |
Definitely yes
Reason: all predefined outcomes were reported. |
Probably yes
Reason: no other problems reported. |
High
Reason: possible selection bias and no blinding |
|
Manent (2019) |
Definitely yes
Reason: “A computer-generated randomization schedule was prepared at the start of the study with stratification by 4 variables (to minimize possible bias) according to age (>40 years); whether the patient was a professional athlete or performed regular sports (>4 times per week for 30 min); whether the patient had a previous pathology such as diabetes mellitus, rheumatic diseases, or collagen diseases; and whether the patient had been treated with quinolones or systemic/local corticosteroids.” |
No information
Reason: |
Definitely no
Reason: no blinding. |
Definitely yes
Reason: no lost to follow-up reported. |
Definitely yes
Reason: all predefined outcomes were reported. |
Probably no
Reason: small sample size > overestimation of effect. |
Low
Reason: |
|
Lantto (2016) |
Definitely yes
Reason: “A biostatistician generated a random allocation sequence using computer software. A randomly varying block size (4, 6, or 8) was used, with each block having an equal number of surgically and nonsurgically treated patients. To control the possible confounding effect of age, randomization was performed separately in 2 age groups (<36 and >35 years) with a ratio of 1:3 (n = 20) and 2:3 (n = 40), respectively.” |
No information
Reason: |
Probably no
Reason: “Assessors of outcomes were not systematically blinded to the treatment method.”
|
Probably yes
Reason: |
Definitely yes
Reason: all predefined outcomes were reported. |
Probably yes
Reason: |
Low
Reason: |
|
Olsson (2013) |
Definitely yes
Reason: The patients were randomized directly after inclusion.
|
Definitely yes
Reason: computer-generated opaque and sealed envelopes were used in the randomization process.
|
Definitely no
Reason: The patients and the treating physician and physical therapists responsible for treatment and evaluations were not blinded to treatment group.
|
Probably yes
Reason: |
Definitely yes
Reason: all predefined outcomes were reported. |
Probably no
Reason: “it is possible that we need to consider a possible type II error, which is important when analyzing the superiority of either treatment in terms of function, patient-reported outcomes, and reruptures, as discussed above.” |
Some concerns
Reason: no blinding. |
|
Keating (2011) |
Definity yes
Reason: “Of the total of 80 patients in the study, 39 were randomised to surgical and 41 to non-operative treatment.” |
No information
Reason: - |
Definitely yes
Reason: ““The allocation of treatment was through blind envelope selection.” |
Probably yes
Reason: 1 lost to follow-up per group. |
Definitely yes
Reason: all predefined outcomes were reported. |
Probably yes
Reason: “All of the assessments were performed by a research physiotherapist independent of treatment selection to minimise bias.” |
Low
Reason: |
|
Willits (2010) |
Definitely yes
Reason: “One hundred and forty-four patients gave their consent and were randomized; seventy-two patients were allocated to the operative group and seventy-two, to the nonoperative group.”
|
Definitely yes
Reason: “Group allocation was revealed to patients only after the surgeon determined patient eligibility and the patient signed the consent document.”
|
Definitely no
Reason: |
Probably yes
Reason: no lost to follow-up reported. |
Definitely yes
Reason: all predefined outcomes were reported. |
Probably yes
Reason: However, small sample size. |
Low |
|
Nilsson-Helander (2010) |
Definitely yes
Reason: “Patients eligible for the study were randomized to receive either surgical treatment or nonsurgical treatment.” |
Definitely yes
Reason: “Computer-generated sealed envelopes were used in the randomization procedure that was administered by the study coordinator.” |
No information
Reason: |
Probably yes
Reason: no lost to follow-up reported. |
Definitely yes
Reason: all predefined outcomes were reported. |
No information
Reason: |
Low
Reason: |
|
Metz (2008) |
Definitely yes
Reason: “randomization was stratified by hospital in blocks of 4 to balance groups over hospitals.”
|
Definitely yes
Reason: “The surgeon, surgical resident, or emergency department doctor allocated treatment to patients. This was done in a concealed manner via a specially designed Internet site for which treatment randomization was stratified by hospital in blocks of 4 to balance groups over hospitals.” |
Definitely no
Reason: “The treatment nature was open to patients, physicians, and physical therapists.”
|
Definitely yes
Reason: |
Definitely yes
Reason: all predefined outcomes were reported. |
No information
Reason: |
Low |
|
Twaddle and Poon (2007) |
Definitely yes
Reason: “patients who were referred to the acute orthopaedic service at Auckland Hospital with a rupture of the Achilles tendon who agreed to take part in this study were randomized to surgical or nonsurgical management.”
|
Definitely yes
Reason: “Randomization was determined by tossing a coin 50 consecutive times and recording the heads or the tails in sequence. “Heads” received operative treatment, and “tails” received nonoperative treatment. This sequence was then used to allocate the sequence of envelopes that were uncovered when the patient signed the informed consent to be part of the study.” |
Definitely yes
Reason: “envelopes that were uncovered when the patient signed the informed consent to be part of the study.” |
Probably yes
Reason: |
Definitely yes
Reason: all predefined outcomes were reported. |
No information
Reason: |
Low |
|
Möller (2001) |
Probably yes
Reason: randomisation process not specifically stated.
|
Probably yes
Reason: The patients were randomly allocated to either treatment in plaster in equinus or surgical repair followed by early functional rehabilitation. |
Definitely yes
Reason: The randomisation was blinded, using identical envelopes.
|
No information
Reason: |
Definitely yes
Reason: all predefined outcomes were reported. |
No information
Reason:
|
Some concerns
Reason: possible selection bias |
|
Cetti (1993) |
Probably yes
Reason: “Each of the eight involved hospitals randomly assigned the patients for operative or nonoperative treatment.” |
No information
Reason: |
No information
Reason: |
No information
Reason:
|
Definitely yes
Reason: all predefined outcomes were reported. |
Probably no
Reason: “Even though the differences between operative and nonoperative treatment in the review are statistically different in favor of operative treatment, there are many biases, known and unknown, that are impossible to calculate in the statistics used. So the statistical analyses only show that the differences in the results are significant, but the grounds for the results are not taken into consideration. Therefore, we are aware that the differences of the results in the literature review are unreliable.” |
Some concerns
Reason: possible selection bias |
|
Nistor (1981) |
Definitely yes
Reason: Patients were assigned randomly for non-surgical or surgical treatment depending on which department supervised their care. |
No information
Reason: |
No information
Reason: |
No information
Reason: |
Definitely yes
Reason: all predefined outcomes were reported. |
No information
Reason: |
Some concerns
Reason: inadequate blinding. |
Exclusie tabel
Systematic review(s)
|
Author and year |
Reason for exclusion |
|
Holm (2014) |
Includes the same studies as a more recent systematic review (She (2021)). |
|
Mundi (2014) |
Wrong study design. |
|
Wu (2019) |
Includes the same studies as a more recent systematic review (She (2021)). |
|
Sun (2013) |
Study was withdrawn. |
|
Kearney (2012) |
Wrong study design. |
|
McCormack (2015) |
Does not match PICO. |
|
Trickett (2011) |
Does not match PICO and wrong study design. |
|
Bartel (2014) |
Does not match PICO and wrong study design. |
|
Erickson (2015) |
Does not match PICO. |
|
Wu (2016) |
Includes the same studies as a more recent systematic review (She (2021)). |
|
Yang (2018) |
Does not match PICO. |
|
Shi (2020) |
Includes the same studies as a more recent systematic review (She (2021)). |
|
Ochen (2019) |
Includes the same studies as a more recent systematic review (She (2021)). |
|
Wilkins (2012) |
Includes the same studies as a more recent systematic review (She (2021)). |
|
Zhao (2011) |
Includes the same studies as a more recent systematic review (She (2021)). |
|
Huang (2015) |
Does not match PICO. |
|
Van der Eng (2013) |
Includes the same studies as a more recent systematic review (She (2021)). |
|
Khan (2010) |
Includes the same studies as a more recent systematic review (She (2021)). |
|
Carmont (2013) |
Does not match PICO. |
|
Deng (2017) |
Includes the same studies as a more recent systematic review (She (2021)). |
|
Zhang (2015) |
Does not match PICO. |
|
Zhou (2018) |
Includes the same studies as a more recent systematic review (She (2021)). |
|
Reda (2020) |
Includes the same studies as a more recent systematic review (She (2021)). |
|
Kearney (2012a) |
Includes the same studies as a more recent systematic review (She (2021)). |
|
Seow (2021) |
Includes the same studies as a more recent systematic review (She (2021)). |
|
Meulenkamp (2021) |
Does not match PICO. |
Randomized controlled trial(s)
|
Author and year |
Reason for exclusion |
|
Manent (2019) |
Included in SR of She (2021) |
|
Fischer (2021) |
Included in SR of She (2021) |
|
Westin (2020) |
Included in SR of She (2021) |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 14-12-2023
Beoordeeld op geldigheid : 22-09-2023
Algemene gegevens
De ontwikkeling van deze richtlijnmodules werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Werkgroep
- Dr. E.J.M.M. (Egbert Jan) Verleisdonk, chirurg, Nederlandse Vereniging voor Heelkunde.
- Dr. M. (Maayke) van Sterkenburg, chirurg, Nederlandse Vereniging voor Heelkunde (Nederlandse Vereniging voor Traumachirurgie).
- Dr. S. (Steven) Ferree, AIOS-chirurgie, Nederlandse Vereniging voor Heelkunde (Nederlandse Vereniging voor Traumachirurgie).
- Dr. M. (Matthijs) van Ark, fysiotherapeut, Koninklijk Nederlands Genootschap voor Fysiotherapie.
- Dr. D.E. (Duncan) Meuffels, orthopedisch chirurg, Nederlandse Orthopaedische Vereniging.
- Drs. T.E. (Ties) Maijs, radioloog, Nederlandse Vereniging voor Radiologie.
- Drs. L.N. (Lisanne) Hollander, spoedeisende hulp arts, Nederlandse Vereniging voor Spoedeisende Hulp Artsen.
- Dr. R.J. (Robert-Jan) de Vos, sportarts, Vereniging voor Sportgeneeskunde.
Meelezers
- Drs. K. (Klaartje) Spijkers, Patiëntenfederatie Nederland.
Met ondersteuning van:
- Dr. A.C.J. (Astrid) Balemans, adviseur, Kennisinstituut van Medisch Specialisten.
- M. (Mitchel) Griekspoor MSc, adviseur, Kennisinstituut van Medisch Specialisten.
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Dhr. dr. E.J.M.M. (Egbert Jan) Verleisdonk |
Chirurg. |
Voorzitter stichting ALSG (onbezoldigd).
|
Persoonlijke financiële belangen Geen.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek Geen.
Intellectuele belangen en reputatie Geen.
Overige belangen Geen.
|
Geen. |
|
Mevr. dr. M. (Maayke) van Sterkenburg
|
Chirurg. |
Geen. |
Persoonlijke financiële belangen Geen.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek Geen.
Intellectuele belangen en reputatie Geen.
Overige belangen Geen.
|
Geen. |
|
Dhr. dr. S. (Steven) Ferree
|
AIOS-chirurgie. |
Geen. |
Persoonlijke financiële belangen Geen.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek Geen.
Intellectuele belangen en reputatie Geen.
Overige belangen Geen.
|
Geen. |
|
Dhr. dr. M. (Matthijs) van Ark
|
Docent onderzoeker B - Opleiding Fysiotherapie (0,7 FTE)
|
(Onbetaald) Lid projectteam bij het project: Deïmplementatie operatieve behandeling AchillesPeesruPtuur. Het bevorderen van gepaste zorg en terugdringen van ‘niet-gepaste zorg'.
|
Persoonlijke financiële belangen Geen.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek Geen.
Intellectuele belangen en reputatie Geen.
Overige belangen Geen.
|
Geen |
|
Dhr. dr. D.E. (Duncan) Meuffels
|
Orthopaedisch Chirurg en Universitair Hoofd Docent Erasmus MC (fulltime).
|
Voorzitter Nederlandse Orthopaedie Traumatologie en Sport Werkgroep (onbezoldigd)
Associate editor van British Journal of Sports Medicine
|
Persoonlijke financiële belangen Geen.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek Geen.
Intellectuele belangen en reputatie Geen.
Overige belangen Geen.
|
Geen |
|
Dhr. drs. T.E. (Ties) Maijs
|
Radioloog. |
Geen. |
Persoonlijke financiële belangen Geen. Persoonlijke relaties Geen.
Extern gefinancierd onderzoek Geen.
Intellectuele belangen en reputatie Geen.
Overige belangen Geen.
|
Geen.
|
|
Mevr. drs. L.N. (Lisanne) Hollander
|
Spoedeisende hulp arts KNMG. |
Lid van richtlijnen commissie NVSHA, onbetaald
|
Persoonlijke financiële belangen Geen.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek Geen.
Intellectuele belangen en reputatie Geen.
Overige belangen Geen.
|
Geen. |
|
Dhr. dr. R.J. (Robert Jan) de Vos
|
Sportarts en Universitair Hoofddocent, Erasmus MC Universitair Medisch Centrum Rotterdam (0.8 fte)
|
Associate editor British Journal of Sports Medicine (onbetaald) Werkgroeplid SKMS richtlijnen commissie (betaald)
|
Persoonlijke financiële belangen Geen.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek In de afgelopen 5 jaar zijn er onderzoeksprojecten uitgevoerd onder mijn supervisie die zijn gefinancierd door ReumaNederland, Annafonds, ZonMw, Maria SklodowskaCurie, GE Healthcare en de National Basketball Association (NBA). Deze financiers hebben echter geen belangen bij de aanbevelingen die zullen worden gedaan in deze richtlijn. Consultancy functie voor een project naar nieuwe injectie behandeling voor Achilles tendinopathie, gesponsord door Novartis.
Intellectuele belangen en reputatie Eén van de persoonlijke drijfveren om als werkgroeplid te fungeren in deze richtlijn is dat het meer expertise zal verschaffen en daardoor zal leiden tot een betere reputatie in het wetenschappelijke veld. Een neveneffect kan zijn dat het leidt tot
Overige belangen Geen.
|
Geen. |
|
Mw. drs. K. (Klaartje) Spijkers |
Senior Adviseur Patientenbelang bij Patientenfederatie Nederland.
|
Niet van toepassing. |
Persoonlijke financiële belangen Niet van toepassing.
Persoonlijke relaties Niet van toepassing.
Extern gefinancierd onderzoek Niet van toepassing.
Intellectuele belangen en reputatie Niet van toepassing.
Overige belangen Niet van toepassing. |
Geen. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van de Patiëntenfederatie Nederland voor de schriftelijke knelpuntenanalyse en door een patiëntenvertegenwoordiger in de klankbordgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptmodules zijn tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Methode ontwikkeling
Evidence based
Implementatie
|
Aanbeveling |
Tijdspad voor implementatie: 1 tot 3 jaar of > 3 jaar |
Verwacht effect op kosten |
Randvoorwaarden voor implementatie (binnen aangegeven tijdspad) |
Mogelijke barrières voor implementatie1 |
Te ondernemen acties voor implementatie2 |
Verantwoordelijken voor acties3 |
Overige opmerkingen |
|
Alle aanbevelingen |
<1 jaar |
Mogelijke afname van directe kosten i.vm. in opzet conservatief behandelen van achillespeesruptuur. |
Geen. |
Geen. |
Presenteren van de nieuwe richtlijn achillespeesruptuur tijdens congresdagen/traumadagen. Daarnaast kan er een verzoek worden ingediend voor het schrijven van een artikel in het NTvG. De laatste keer dat er een artikel in het NTvG is gepubliceerd m.b.t. achillespeesrupturen was in de 2009. Er vindt tevens een jaarlijks sport-medisch congres plaats waar de nieuwe richtlijn onder de aandacht gebracht kan worden. |
Wetenschappelijke verenigingen en de werkgroepleden van de huidige werkgroep achillespeesruptuur.
|
Geen. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten die een achillespeesruptuur ervaren. Tevens zijn er knelpunten aangedragen door middel van een schriftelijke knelpuntenanalyse. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Algemene informatie
|
Richtlijn: Achillespeesruptuur |
|
|
Uitgangsvraag: Wat is de waarde van chirurgische behandeling bij een initiële achillespeesruptuur? |
|
|
Database(s): Ovid/Medline, Embase |
Datum: 27-1-2022 21-12-2021 |
|
Periode: 2010- heden |
Talen: Engels, Nederlands |
|
Literatuurspecialist: Miriam van der Maten |
|
|
BMI zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting: 27-01-2022
21-12-2021
|
|
|
Te gebruiken voor richtlijnen tekst: In de databases Embase en Ovid/Medline is op 20 december 2021 met relevante zoektermen gezocht naar systematische reviews over de waarde van chirurgische behandeling bij een initiële achillespeesruptuur. De literatuurzoekactie leverde 90 unieke treffers op. |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
RCT (27-1-2022) |
28 |
14 |
33 |
|
SRs (21-12-2021) |
68 |
64 |
90 |
Zoekstrategie 27-01-2022
Embase.com
|
No. |
Query |
Results |
|
#8 |
#4 AND #6 NOT #7 |
28 |
|
#7 |
#4 AND #5 |
21 |
|
#6 |
'randomized controlled trial'/exp OR random*:ti,ab OR (((pragmatic OR practical) NEAR/1 'clinical trial*'):ti,ab) OR ((('non inferiority' OR noninferiority OR superiority OR equivalence) NEAR/3 trial*):ti,ab) OR rct:ti,ab,kw |
1868078 |
|
#5 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
794402 |
|
#4 |
#1 AND #2 AND #3 AND ([english]/lim OR [dutch]/lim) AND [01-05-2020]/sd NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) |
211 |
|
#3 |
'conservative treatment'/exp/mj OR 'non surg*':ti,ab,kw OR nonsurg*:ti,ab,kw OR nonoperati*:ti,ab,kw OR 'non operati*':ti,ab,kw OR conservative:ti,ab,kw OR 'weight bearing'/exp OR weightbearing:ti,ab,kw OR ((weight NEAR/3 (exercise* OR training OR bearing)):ti,ab,kw) OR 'immobilization'/exp OR immobili*ation:ti,ab,kw OR immobili*e:ti,ab,kw OR ((functional NEAR/3 (treatment* OR therap*)):ti,ab,kw) OR 'orthopedic equipment'/exp OR brace*:ti,ab,kw OR splint*:ti,ab,kw OR cast*:ti,ab,kw OR orthosis:ti,ab,kw OR 'rehabilitation'/exp/mj OR rehabilit*:ti,ab,kw |
1256575 |
|
#2 |
'surgery'/exp OR 'surgery'/lnk OR surgical:ti,ab,kw OR surger*:ti,ab,kw OR operation*:ti,ab,kw OR operative:ti,ab,kw OR 'achilles tendon repair':ti,ab,kw OR 'open repair':ti,ab,kw |
6884406 |
|
#1 |
'achilles tendon rupture'/exp/mj OR ((achill* NEAR/5 (rupture* OR tenorraph* OR tear*)):ti,ab,kw) OR (('achilles tendon'/exp OR achill*:ti,ab,kw) AND ('rupture'/exp OR rupture*:ti,ab,kw OR tear*:ti,ab,kw)) |
4967 |
Medline via Ovid
|
# |
Searches |
Results |
|
9 |
(5 and 7) not 8 |
14 |
|
8 |
5 and 6 |
17 |
|
7 |
(exp randomized controlled trial/ or randomized controlled trials as topic/ or random*.ti,ab. or rct?.ti,ab. or ((pragmatic or practical) adj "clinical trial*").ti,ab,kf. or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab,kf.) not (animals/ not humans/) |
1347598 |
|
6 |
(meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) |
543953 |
|
5 |
limit 4 to dt=20200501-20220201 |
115 |
|
4 |
1 and 2 and 3 |
1248 |
|
3 |
exp Conservative Treatment/ or (nonsurg* or nonoperati* or conservative).ti,ab,kf. or exp Weight-Bearing/ or weightbearing.ti,ab,kf. or (weight adj3 (exercise* or training or bearing)).ti,ab,kf. or exp Immobilization/ or immobili*ation.ti,ab,kf. or immobili*e.ti,ab,kf. or exp *Rehabilitation/ or (functional adj3 (treatment* or therap*)).ti,ab,kf. or exp Orthopedic Equipment/ or brace*.ti,ab,kf. or splint*.ti,ab,kf. or cast*.ti,ab,kf. or orthosis.ti,ab,kf. |
687741 |
|
2 |
exp Specialties, Surgical/ or su.fs. or (surgical or surger* or nonsurg* or operation* or operative or nonoperative).ti,ab,kf. or 'achilles tendon repair'.ti,ab,kf. or 'open repair'.ti,ab,kf. |
3642324 |
|
1 |
achilles tendon/in, pa, pp or ((exp *achilles tendon/ or achill*.ti,ab,kf. or Tendoachill*.ti,ab,kf.) and (exp *rupture/ or exp *Tendon Injuries/ or rupture*.ti,ab,kf. or tear*.ti,ab,kf.)) or ((Achill* or Tendoachill*) adj5 (rupture* or tenorraph* or tear*)).ti,ab,kf. |
6590 |
Zoekstrategie 21-12-2021
Embase
|
No. |
Query |
Results |
|
#14 |
#12 AND #13 |
68 |
|
#13 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
783248 |
|
#12 |
#9 AND #10 AND #11 AND ([english]/lim OR [dutch]/lim) AND [2010-2021]/py NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) |
810 |
|
#11 |
'conservative treatment'/exp/mj OR 'non surg*':ti,ab,kw OR nonsurg*:ti,ab,kw OR nonoperati*:ti,ab,kw OR 'non operati*':ti,ab,kw OR conservative:ti,ab,kw OR 'weight bearing'/exp OR weightbearing:ti,ab,kw OR ((weight NEAR/3 (exercise* OR training OR bearing)):ti,ab,kw) OR 'immobilization'/exp OR immobili*ation:ti,ab,kw OR immobili*e:ti,ab,kw OR ((functional NEAR/3 (treatment* OR therap*)):ti,ab,kw) OR 'orthopedic equipment'/exp OR brace*:ti,ab,kw OR splint*:ti,ab,kw OR cast*:ti,ab,kw OR orthosis:ti,ab,kw OR 'rehabilitation'/exp/mj OR rehabilit*:ti,ab,kw |
1256575 |
|
#10 |
'surgery'/exp OR 'surgery'/lnk OR surgical:ti,ab,kw OR surger*:ti,ab,kw OR operation*:ti,ab,kw OR operative:ti,ab,kw OR 'achilles tendon repair':ti,ab,kw OR 'open repair':ti,ab,kw |
6884406 |
|
#9 |
'achilles tendon rupture'/exp/mj OR ((achill* NEAR/5 (rupture* OR tenorraph* OR tear*)):ti,ab,kw) OR (('achilles tendon'/exp OR achill*:ti,ab,kw) AND ('rupture'/exp OR rupture*:ti,ab,kw OR tear*:ti,ab,kw)) |
4967 |
Ovid/Medline
|
# |
Searches |
Results |
|
7 |
5 and 6 |
64 |
|
6 |
(meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) |
537212 |
|
5 |
limit 4 to yr="2010-Current" |
691 |
|
4 |
1 and 2 and 3 |
1245 |
|
3 |
exp Conservative Treatment/ or (nonsurg* or nonoperati* or conservative).ti,ab,kf. or exp Weight-Bearing/ or weightbearing.ti,ab,kf. or (weight adj3 (exercise* or training or bearing)).ti,ab,kf. or exp Immobilization/ or immobili*ation.ti,ab,kf. or immobili*e.ti,ab,kf. or exp *Rehabilitation/ or (functional adj3 (treatment* or therap*)).ti,ab,kf. or exp Orthopedic Equipment/ or brace*.ti,ab,kf. or splint*.ti,ab,kf. or cast*.ti,ab,kf. or orthosis.ti,ab,kf. |
684267 |
|
2 |
exp Specialties, Surgical/ or su.fs. or (surgical or surger* or nonsurg* or operation* or operative or nonoperative).ti,ab,kf. or 'achilles tendon repair'.ti,ab,kf. or 'open repair'.ti,ab,kf. |
3624744 |
|
1 |
achilles tendon/in, pa, pp or ((exp *achilles tendon/ or achill*.ti,ab,kf. or Tendoachill*.ti,ab,kf.) and (exp *rupture/ or exp *Tendon Injuries/ or rupture*.ti,ab,kf. or tear*.ti,ab,kf.)) or ((Achill* or Tendoachill*) adj5 (rupture* or tenorraph* or tear*)).ti,ab,kf. |
6558 |
