Abdominoplastiek bij patiënten met obesitas
Uitgangsvraag
Hoe om te gaan met patiënten met een body mass index (BMI) ≥ 30 kg/m2?
Aanbeveling
Informeer patiënten met een BMI ≥ 30 kg/m2 dat er mogelijk sprake is van een (licht) verhoogd risico op complicaties.
Overwegingen
Kwaliteit van bewijs
De kwaliteit van bewijs voor de risico’s op complicaties ten gevolge van een verhoogde BMI is laag, deels vanwege beperkingen in opzet en uitvoering van de studies, deels vanwege aanzienlijke variatie in de effectgroottes van de BMI als prognostische factor, en deels vanwege het feit dat de BMI in diverse studies geen statistisch significante prognostische factor was.
Waarden en voorkeuren van patiënten
Het betreft hier vooral waarden en voorkeuren met betrekking tot het afwegen van de gewenste uitkomsten tegen mogelijke risico’s op complicaties. Waarschijnlijk bestaat er variatie in de waarden en voorkeuren van goed geïnformeerde patiënten in het afwegen van de baten en de complicaties: sommige patiënten zijn bereid meer risico’s te accepteren dan andere patiënten.
Professioneel perspectief
Onder plastisch chirurgen bestaan wereldwijd verschillen in de afweging van baten en risico’s op complicaties. Zo wordt bijvoorbeeld in diverse Deense ziekenhuizen de beleidslijn gevolgd dat alleen patiënten met een BMI<25 kg/m2 voor een abdominoplastiek in aanmerking komen.
Balans van gunstige en ongunstige effecten
Over het algemeen lijken de toename van de kwaliteit van leven en de patiënttevredenheid over het cosmetisch resultaat aanzienlijk zwaarder te wegen dan het risico op complicaties (Stuerz et al, 2013; Chowdry et al, 2015; Tremp et al, 2015).
Aanvaardbaarheid en haalbaarheid
Op zichzelf is een abdominoplastiek een aanvaardbare ingreep. De haalbaarheid ervan hangt vooral af van de perceptie van plastisch chirurgen bij welke omvang van het risico op complicaties bij patiënten met (ernstig) overgewicht zij abdominoplastiek nog aanvaardbaar vinden. Bij verder gezonde patiënten lijkt er sprake van een licht risico op complicaties, wellicht met uitzondering van ernstige niercomplicaties en veneuze trombose.
Rationale voor de aanbeveling
Bij het opstellen van onderstaande aanbeveling is groot gewicht toegekend aan de toename van de tevredenheid over het lichaam en de grotere kwaliteit van leven na een abdominoplastiek. De werkgroep meent voorts dat de risico’s op ernstige complicaties niet zo groot zijn dat een BMI >30kg/m2 een contra-indicatie vormt voor het uitvoeren van een abdominoplastiek.
Onderbouwing
Achtergrond
In een artikel getiteld An Evidence-Based Approach to Abdominoplasty schrijven Buck en Mustoe (2010; p. 2190) dat een Body Mass Index (BMI) van >30 kg/m2 (betekent obesitas (internationale afspraak)) met een hoger risico op een longembolie gepaard gaat. Hurvitz et al (2014; p. 1215) schrijven in hun artikel Evidence-Based Medicine: Abdominoplasty dat een BMI van >30 kg/m2 een verhoogd risico op wondcomplicaties en seroom geeft. Larsen en Plaisier (2010) rapporteren dat abdominoplastiek bij post-bariatrische patiënten meer complicaties geeft naarmate de BMI hoger is.
In deze paragraaf wordt geprobeerd de risico’s van een verhoogde BMI op complicaties van abdominoplastiek bij niet-post-bariatrische patiënten zo goed mogelijk te kwantificeren.
Hierbij gaat het tevens om de vraag in hoeverre een verhoogde BMI een onafhankelijke risicofactor is. Dit betekent dat een verhoogde BMI een risicofactor is nadat is gecorrigeerd voor andere variabelen die de risico’s op complicaties kunnen vergroten. Doorgaans gebeurt dit in een multivariate analyse.
Conclusies / Summary of Findings
|
Laag GRADE |
Studies met alleen niet-post-bariatrische patiënten
Wondcomplicaties Het is onzeker of een verhoogde BMI het risico op wondcomplicaties verhoogt ten opzichte van patiënten met een BMI<30 kg/m2 die een abdominoplastiek ondergaan.
Bon Staalesen et al, 2012; Breiting et al, 2011; Momeni et al, 2008 |
|
Laag GRADE |
Studie met deelnemers van wie een bekend deel wel en een bekend deel geen bariatrische chirurgie had ondergaan:
Wondcomplicaties Obesitas lijkt een gering effect te hebben op het optreden van wondcomplicaties bij patiënten die een abdominoplastiek ondergaan.
Bron Greco et al, 2008 |
|
Niet bepaald GRADE |
Indirect bewijs*
Per- en postoperatieve complicaties Uit registratiestudies blijkt dat een BMI >30 kg/m2 een gering effect lijkt te hebben op het optreden van per- en postoperatieve complicaties bij patiënten die een abdominoplastiek ondergaan. Een uitzondering hierop is het voorkomen van ernstige niercomplicaties en veneuze trombose.
Bron Fischer et al, 2013; Nelson et al, 2014a; Nelson et al, 2014b; Koolen et al, 2014 |
Moet daar niet >* indirect bewijs vanwege het niet bekend zijn van het aantal studiedeelnemers dat voorafgaande aan de abdominoplastiek, bariatrische chirurgie heeft ondergaan, of vanwege het feit dat het een aan abdominoplastiek verwante ingreep betrof.
Samenvatting literatuur
Review van Hasanbegovic & Sørensen (2013)
De vraagstelling in de matig uitgevoerde systematische review van Hasanbegovic & Sørensen (2013) is een wat andere dan de hiervoor geformuleerde PICO[1]. Het gaat de reviewers om de vraag of de frequentie van complicaties verschilt tussen patiënten die zijn afgevallen via dieet/bewegen, en patiënten die zijn afgevallen door bariatrische chirurgie, en welke andere factoren op de gevonden complicaties van invloed zijn. De laatste groep is voor onze vraagstelling niet van belang, de eerste wel.
Hasanbegovic & Sørensen (2013) includeerden zeven studies (Vastine et al, 1999; Greco et al, 2008; Breiting et al, 2011; Staalesen et al, 2012; Fearmonti et al, 2012; Vico et al, 2010; Gusenoff et al, 2009). Vijf hiervan waren retrospectief van opzet (Vastine et al, 1999; Greco et al, 2008; Breiting et al, 2011; Staalesen et al, 2012; Vico et al, 2010). Het percentage niet-post-bariatrische patiënten met een of meer complicaties (hematoom, infectie, seroom, dehiscentie, necrose, DVT/longembolie, ‘overige’) varieerde van 11,7% tot 33,3%. In vier studies (Vastine et al, 1999; Greco et al, 2008; Breiting et al, 2011; Staalesen et al, 2012) werd nagegaan in hoeverre de BMI van invloed was op het percentage complicaties.[2] Deze studies worden hierna besproken.
Voor de studies van Staalesen et al (2012) en Breiting et al (2011) geldt dat het, gezien de gemiddelde BMI van de onderzochte patiënten, zo goed als onmogelijk was om een effect van een BMI > 30 te vinden. Zo hadden de niet-post-bariatrische patiënten van Breiting et al (2011) een BMI van gemiddeld 24.0 kg/m2 en was de range 20 – 28 kg/m2. Er waren dus geen patiënten met obesitas aanwezig in deze studie. Zij vonden in een logistisch regressiemodel waarin werd gecorrigeerd voor bariatrische chirurgie, een odds ratio (OR) van 1.10 (95% BI: 0.70 – 1.072) voor het risico op een complicatie ten gevolge van een verhoogde BMI (voorafgaand aan abdominoplastiek). De niet-post-bariatrische patiënten in Staalesen et al (2012) hadden een gemiddelde BMI van 26.5 kg/m2 met standaardafwijking van 3.1. Enig rekenwerk bij aanname van een normale verdeling van de BMI, leert dat ca. 84% van deze patiënten een BMI heeft van <30 kg/m2, ofwel bij een aantal van 66 patiënten zijn er slechts 10 (16%) die obees zijn. Overigens vonden Staalesen et al (2012) een preoperatieve BMI van 26.2 kg/m2 in de groep niet-post-bariatrische patiënten die vroege wondcomplicaties had, in vergelijking met een BMI van 27.2 kg/m2 in dezelfde groep maar zonder vroege wondcomplicaties. Dit verschil van 1 kg/m2 was niet statistisch significant. In het logistische regressiemodel werd alleen voor resectiegewicht gecorrigeerd.
Vastine et al (1999) vonden dat personen met obesitas een verhoogd risico op complicaties hadden. Obesitas was gedefinieerd als een lichaamsgewicht van meer dan 45 kg boven het “ideale lichaamsgewicht” zoals berekend door de Metropolitan Insurance Company. In deze studie betreft het 90 patiënten, van wie er 36 bariatrische chirurgie hebben gehad. 43 patiënten zijn niet-obees (<23 kg verwijderd van het ideale lichaamsgewicht), 27 borderline (23-45 kg verwijderd van het ideale lichaamsgewicht). Volgens een variantieanalyse, die onduidelijk en onvolledig is gerapporteerd, zou bariatrische chirurgie geen effect hebben op de ernstige noch op de minder belangrijke complicaties. Ernstige complicaties waren gedefinieerd als mortaliteit, heropname, noodzaak tot chirurgische of invasieve interventie, of noodzaak tot wondzorg langer dan zes maanden. Alle andere complicaties werden als minder belangrijk bestempeld. Vanwege de onduidelijke berekeningen in dit artikel heeft de werkgroep zelf een berekening uitgevoerd op basis van de tekst en tabel 2 uit het artikel. Daarbij worden de categorieën niet-obees en borderline samengenomen onder de noemer niet-obees. Voor ernstige complicaties vanwege obesitas (>45 kg verwijderd van het ideale lichaamsgewicht) kan een OR van 7.11 (95% BI: 2.09 – 24.21) worden berekend. De Pearson χ2-test geeft een test-waarde van 11.70; p=0.001. Voor de minder belangrijke complicaties kan een OR van 1.362 (95% BI: 0.49 – 3.79) worden berekend. De Pearson χ2-test geeft een niet significante test-waarde van 0.35; p=0.55.[3] Onderstreept moet worden dat informatie over andere factoren die van invloed kunnen zijn op het optreden van complicaties, zoals comorbiditeit of multimorbiditeit, of met operatie-gerelateerde factoren zoals de duur van de operatie, in de studie van Vastine et al (1999) niet worden vermeld.
Greco et al (2008) rapporteerden over 222 patiënten van wie er 89 een abdominoplastiek en 133 een panniculectomie ondergingen. De gemiddelde BMI was 32.5 kg/m2 (range: 19.1–81.4). 139 patiënten hadden bariatrische chirurgie ondergaan. Hiervoor werd in een multivariate analyse gecontroleerd. Voor het classificeren van wondinfecties en wondproblemen werd het ASEPSIS-systeem toegepast. Tabel 1 met de resultaten van een multivariate regressieanalyse geeft de bevindingen weer. Op het eerste gezicht werd adequaat gecontroleerd voor alle andere potentiële risicofactoren voor wondcomplicaties dan de BMI. Dit is de enige studie die werd gevonden, waarin dit op adequate wijze is gebeurd. De gevonden odds ratio voor BMI wijst er niet direct op dat deze een significante risicofactor is. De algemene gezondheidstoestand van de patiënt, weerspiegeld in de ASA-klasse, is de belangrijkste risicofactor, gevolgd door de operatietijd. Voor andere uitkomstmaten dan wondcomplicaties werden soortgelijke regressieanalyses niet uitgevoerd.
Tabel 1 Multiple Logistic Regression Utilizing All Patients in Study Testing the Effects of Each Variable on the Chance of Any Wound Complication
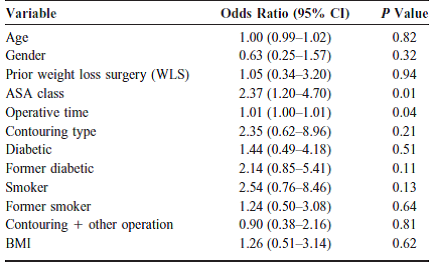
Bron: Greco et al (2008)
Patiëntenseries en cohortstudies
Momeni et al (2008) berekenden voor patiënten met een BMI>30 kg/m2 een percentage ernstige complicaties van 20.8 tegen 9.7% bij niet-obese patiënten, en rapporteerden dat dit statistisch significant zou zijn, zonder te vermelden op grond van welke statistische test de significantie werd berekend.[4] Aan de hand van de genoemde percentages en aantallen patiënten heeft de werkgroep berekend bij hoeveel niet-obese en obese patiënten een ernstige complicatie optrad. Dat zijn er 5/24 (20.8%) en 11/113 (9.7%) bij obese respectievelijk niet-obese patiënten. Een Pearson χ2-test geeft een test-waarde van 2.364 en een p-waarde van 0.124, die niet significant is. De Mantel-Haenszel Common Odds Ratio is 2.44 (95% BI: 0.761 – 7.824) en duidt dus ook op niet significantie.[5]
Registratie-studies
Vier van de zes studies zijn zogeheten registratie-studies (Fischer et al, 2013; Nelson et al, 2014a; Nelson et al, 2014b; Koolen et al, 2014). De registraties zijn alle onderdeel van de American College of Surgeons National Surgical Quality Improvement Program Databases. Een van de beperkingen van dit programma (en registraties) is dat de uitkomsten van de ingrepen niet langer dan tot 30 dagen na de operatie worden geëvalueerd en geregistreerd. Het is zeker vanuit het perspectief van de patiënt gewenst de uitkomsten tot 6-12 maanden na de ingreep te kennen.
De patiënten in Koolen et al (2014) hebben een abdominoplastiek en/of or panniculectomie ondergaan.[6] Bij 92% van de patiënten in Fischer et al (2013) was sprake van ‘abdominal contouring and/or contouring of the hips and buttocks’. In de twee andere registratie-studies (Nelson et al 2014a en 2014b) betrof het patiënten die een abdominoplastiek met hernia reparatie hebben ondergaan. In geen van deze registratie-studies werd vermeld in welke mate van eerdere bariatrische chirurgie sprake was. Belangrijke pluspunten echter van deze registratie-studies zijn onder andere de grote aantallen patiënten, de vermelding van aard en omvang van de comorbiditeit, en de gedegen statistische analyse die nodig is om te onderzoeken of een verhoogd BMI een onafhankelijke risicofactor is.
In de evidence tabellenstaan de belangrijkste karakteristieken van de vier registratie-studies vermeld; in de evidence tabellen wordt de beoordeling van de risk of bias van de individuele studies gerapporteerd. De patiënten in de studies van Koolen et al (2014) en Fischer et al (2013) bestaan voor 90% uit vrouwen. Deze twee studies telden bij elkaar meer dan 4900 patiënten. Zij hadden een gemiddelde BMI van rond de 31 kg/m2. Ongeveer 26% had hypertensie en 6-8% diabetes mellitus. Bij 0.4-15.0% van hen was in de 6 maanden voorafgaande aan de ingreep sprake van meer dan 10% gewichtsverlies. Fischer et al (2013) hebben de gemiddelde leeftijd van de patiënten niet vermeld; die van de patiënten in Koolen et al (2014) was 46 jaar. De patiënten van Nelson et al (2014a en 2014b) zijn 53-57 jaar. In Nelson et al (2014a) was 46% vrouw, hadden ca. 20% diabetes en 6% COPD, 10% was ondervoed en bijna 25% had een anemie. De incidentie van hypertensie in de groep werd niet vermeld. Nelson et al (2014b) beschrijven voor een deel dezelfde patiëntengroep, die in Nelson et al (2014a) werd beschreven, namelijk degenen die niet obees zijn (gemiddelde BMI: 25.7 kg/m2) en degenen die morbide obees (≥40 kg/m2) zijn. In Nelson et al (2014a) is de BMI van niet-obese patiënten 25.7 kg/m2, die van obese patiënten 37.6 kg/m2. In Nelson et al (2014b) hebben patiënten die morbide obees zijn, aanzienlijk meer multimorbiditeit (24.5% versus 13.5%) en ondervoeding (18.2% versus 9.0%) dan degenen die niet obees zijn.
In hoeverre leveren deze vier studies nu aanwijzingen op dat een verhoogd BMI een onafhankelijke risicofactor voor complicaties is?
Fischer et al (2013) onderscheidt drie categorieën complicaties: ernstige chirurgische complicaties, medische complicaties en minder belangrijke wondcomplicaties (zie in de evidence tabellen om welke precieze complicaties het gaat). Na correctie voor andere variabelen die van invloed kunnen zijn op het optreden van complicaties blijkt een BMI>30 kg/m2 alleen statistisch significant in geval van medische complicaties (OR=1.06; p=0.03)[7], wat een zeer licht verhoogd risico kan worden genoemd.
Koolen et al (2014) vonden dat een BMI>30 kg/m2 een onafhankelijke risicofactor was voor wondcomplicaties en ernstige complicaties: OR=1.06 (p <0.001) respectievelijk OR=1.04 (p<0.001). Ook hier is dus sprake van een zeer licht verhoogd risico, wanneer gecorrigeerd wordt voor de mogelijke invloed van demografische factoren en comorbiditeit op het optreden van complicaties.
Nelson et al (2014a) vonden dat een BMI>30 kg/m2 alleen voor ernstige niercomplicaties statistisch significant was: OR=4.4 (1.1–17.5), wat een sterk verhoogd risico inhoudt. Voor ernstige chirurgische complicaties, andere medische complicaties en wondcomplicaties werd geen statistisch significant effect van een verhoogde BMI gevonden. In een vervolgstudie (Nelson et al, 2014b) werd een groep van niet-obese patiënten vergeleken met een groep van morbide obese patiënten. Noch voor wondcomplicaties noch voor ernstige chirurgische complicaties noch voor medische complicaties werd een statistisch significant effect van morbide obesitas gevonden. Wel werd een verhoogd risico op terugkeer naar de operatiekamer en op veneuze trombose gevonden voor patiënten met morbide obesitas: OR=2.8 (p=0.001) respectievelijk OR=5.2 (p=0.04), waarbij werd gecorrigeerde voor andere comorbiditeit.
Samenvatting van de gevonden effectgroottes en kwaliteit van bewijs van studies met niet-post-bariatrische patiënten of met deels niet-post-bariatrische patiënten
|
Studie |
Populatie/interventie |
Effectgrootte van BMI op complicaties |
Risk of Bias* |
Kwaliteit van bewijs** |
|
Staalesen 2012 |
Niet-post-bariatrische patiënten / abdominoplastiek |
Wondcomplicaties: |
Risk of bias: moderate to high |
Laag1 |
|
Breiting 2011 |
Niet-post-bariatrische patiënten / abdominoplastiek |
Complicaties: |
Risk of bias: moderate to high |
|
|
Momeni 2008 |
Niet-post-bariatrische patiënten / abdominoplastiek |
Ernstige complicaties: |
Risk of bias: high |
|
|
Vastine 1999 |
Niet-post-bariatrische + post-bariatrische patiënten/ abdominoplastiek [geen multivariate regressieanalyse uitgevoerd waarin werd gecontroleerd voor “eerder bariatrische chirurgie ondergaan”] |
Ernstige complicaties: OR=7.11 (95% BI: 2.09 – 24.21) [BMI≥30 kg/m2 vs BMI<30 kg/m2] Minder belangrijke complicaties: |
Risk of bias: high |
Laag2,3 |
|
Greco 2009 |
Niet-post-bariatrische + post-bariatrische patiënten / Abdominoplastiek of panniculectomie [in multivariate regressieanalyse gecontroleerd voor “eerder bariatrische chirurgie ondergaan”] |
Wondcomplicaties: |
Risk of bias: low |
*: zie evidence tabellen.
* *: vanwege heterogeniteit van de uitkomstmaten is de kwaliteit van bewijs meer bepaald op het niveau van ‘een complicatie’ dan op het niveau van het type complicatie.
1: afgewaardeerd met -1 voor moderate to high risk of bias en met -1 voor inconsistentie
2: afgewaardeerd met -2 voor zeer grote onnauwkeurigheid (odds ratio’s verschillen zeer)
3: niet afgewaardeerd voor risk of bias omdat de studie van Greco een veel groter aantal patiënten heeft
Kwaliteit van bewijs
Bewijs met betrekking tot gewenste en ongewenste effecten
Deze kan als laag worden getypeerd. Met andere woorden er is flinke onzekerheid over de grootte van het risico van een verhoogde BMI als onafhankelijke risicofactor.
[1] Voor een systematische review is het aantal gebruikte bronnen erg summier (Medline/PubMed). De beschrijving van de karakteristieken van de geïncludeerde studies is te summier. Er heeft geen beoordeling van de methodologische kwaliteit van de geïncludeerde studies plaatsgevonden. De keuze voor een fixed effects meta-analyse is gezien de statistische en klinische heterogeniteit van de studies niet correct. Een random effects meta-analyse zou meer voor de hand hebben gelegen.
[2] De belangrijkste karakteristieken van deze studies zijn samengevat in evidence tabellen in de evidence tabellen. De risk of bias beoordeling van deze vier studies is opgenomen in de evidence tabellen.
[3] Berekeningen werden uitgevoerd met IBM SPSS 20.0.0 (procedure crosstabs).
[4] Voor de belangrijkste studiekarakteristieken zie de evidence tabellen, voor de risk of bias beoordeling de evidence tabellen.
[5] Berekeningen werden uitgevoerd met IBM SPSS 20.0.0 (procedure crosstabs).
[6] De patiënten bij wie tevens sprake was van behandeling van een buikhernia, worden hier niet besproken.
[7] De auteurs hebben verzuimd betrouwbaarheidsintervallen te rapporteren voor de odds ratio’s.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht met de volgende PICO-vraagstelling:
Is er een relatie tussen de preoperatieve hoogte van de BMI (BMI ≥ 30 kg/m2 versus BMI < 30 kg/m2) en de effecten van een abdominoplastiek in termen van (majeure) complicaties (zie selectie- en exclusiecriteria).
Selectie- en exclusiecriteria:
|
Type studies |
- SRs - oorspronkelijke observationele studies |
|
Type patiënten |
- patiënten die een buikwandcorrectie (abdominoplastiek) ondergaan |
|
Type uitkomstmaten |
- longembolie; - peroperatief bloedverlies dat een bloedtransfusie noodzakelijk maakt; - mortaliteit binnen 30 dagen; - myocardinfarct binnen 30 dagen; - heringreep noodzakelijk vanwege postoperatieve wondinfectie, necrose of hematoom; - wonddehiscentie > 3cm. OPM: De manier waarop complicaties gemeten zijn is geen selectiecriterium. |
|
Type setting |
- ziekenhuis of ZBC |
|
Exclusiecriteria |
- post-bariatrische chirurgie en hernia cicatricalis patiënten - publicaties in andere talen dan Nederlands en Engels |
In een literatuursearch met Medline en de Cochrane Library (DARE en CENTRAL) d.d. 19-06-2015 als bronnen werden in Medline op een totaal van 108 potentieel relevante studies 6 primaire studies (Fischer et al, 2013; Nelson et al, 2014a; Nelson et al, 2014b; Koolen et al, 2014; Momeni et al, 2008; Staalesen, Olsén en Elander, 2012) en 1 relevante systematische review (Hasanbegovic & Sørensen, 2013) gevonden die aan de selectie- en inclusiecriteria voldeden. In de Cochrane Library werden geen potentieel relevante studies gevonden (zie zoekstrategie). Een van de gevonden primaire studies (Staalesen, Olsén en Elander, 2012) was opgenomen in genoemde systematische review. Alle 7 geselecteerde studies heeft de werkgroep opgenomen in de samenvatting van de literatuur.
Referenties
- Au K, Hazard S.W. 3rd, Dyer A.M., Boustred A.M., Mackay D.R., Miraliakbari R. (2008). Correlation of complications of body contouring surgery with increasing body mass index. Aethetic Surgery Journal 28, 425-9.
- Breiting L.B., Lock-Andersen J., Matzen S.H. (2011). Increased morbidity in patients undergoing abdominoplasty after laparoscopic gastric bypass. Danish Medical Bulletin, 58, A4251.
- Buck D.W. 2nd, Mustoe T.A. (2010). An evidence-based approach to abdominoplasty. Plastic and reconstructive surgery, 126, 2189-95.
- Chowdhry S., Davis J., Boyd T., Choo J., Brooks R.M., Kelishadi S.S., Tutela J.P., Yonick D., Wilhelmi B.J. (2015). Safe Tummy Tuck: Anatomy and Strategy to Avoid Injury to the Lateral Femoral Cutaneous Nerve During Abdominoplasty. Eplasty. Jun 17;15:e22.
- Fearmonti RM, Blanton M, Bond JE, Pestana IA, Selim MA, Erdmann D. Changes in dermal histomorphology following surgical weight loss versus diet-induced weight loss in the morbidly obese patient. Ann Plast Surg 2012;68:507e12.
- Fischer J.P., Wes A.M., Serletti J.M., Kovach S.J. (2013). Complications in body contouring procedures: an analysis of 1797 patients from the 2005 to 2010 American College of Surgeons National Surgical Quality Improvement Program databases. Plastic and reconstructive surgery, 132, 1411-20.
- Gusenoff JA, Coon D, Rubin JP. Implications of weight loss method in body contouring outcomes. Plast Reconstr Surg 2009;123:373.
- Hayden J.A., Côté P., Bombardier C. (2006). Evaluation of the quality of prognosis studies in systematic reviews. Annals of Internal Medicine, 144, 427-37.
- Hurvitz K.A., Olaya W.A., Nguyen A., Wells JH (2014). Evidence-based medicine: Abdominoplasty. Plastic and reconstructive surgery, 133, 1214-21.
- Koolen P.G., Ibrahim A.M., Kim K., Sinno H.H., Lee B.T., Schneider B.E., Jones D.B., Lin .S.J. (2014). Patient selection optimization following combined abdominal procedures: analysis of 4925 patients undergoing panniculectomy/abdominoplasty with or without concurrent hernia repair. Plastic and reconstructive surgery, 134, 539e-50e.
- Larsen M., P.W. Plaisier (2010). Complications in Abdominoplasty Patients After Bariatric Surgery. In: M.A. Shiffman en A. Di Giuseppe. Body Contouring. Art, Science, and Clinical Practice, pp 775-782. Springer Berlin Heidelberg.
- Momeni A., Heier M., Bannasch H., Stark G.B. (2009). Complications in abdominoplasty: a risk factor analysis. Journal of plastic, reconstructive & aesthetic surgery, 62, 1250-4.
- Nelson J.A., Fischer J.P., Wink J.D., Kovach S.J. 3rd (2014b). A population-level analysis of abdominal wall reconstruction by component separation in the morbidly obese patient: can it be performed safely? Journal of plastic surgery and hand surgery, 48, 305-11.
- Nelson J.A., Fischer J.P., Cleveland E.C., Wink J.D., Serletti J.M., Kovach S.J. 3rd (2014a). Abdominal wall reconstruction in the obese: an assessment of complications from the National Surgical Quality Improvement Program datasets. American Journal of Surgery, 207, 467-75.
- Staalesen T., Olsén M.F., Elander A. (2012). Complications of abdominoplasty after weight loss as a result of bariatric surgery or dieting/postpregnancy. Journal of plastic surgery and hand surgery, 46, 416-20.
- Stuerz K., Piza H., Kinzl J.F. (2013). The impact of abdominoplasty after massive weight loss: a qualitative study. Annals of Plastic Surgery, 71, 547-9.
- Tremp M., Delko T., Kraljevic M., Zingg U., Rieger U.M., Haug M., Kalbermatten D.F. (2015). Outcome in body-contouring surgery after massive weight loss: A prospective matched single-blind study. Journal of plastic, reconstructive & aesthetic surgery, Sep 6. pii: S1748-6815(15)00419-2. doi: 10.1016/j.bjps.2015.08.037.
- Vastine V.L., Morgan R.F., Williams G.S., Gampper T.J., Drake D.B., Knox L.K., Lin K.Y. (1999). Wound complications of abdominoplasty in obese patients. Annals of Plastic Surgery, 42, 34-9.
- Vico PG, De Voogth A, Nokerman B. Circumferential body contouring in bariatric and non-bariatric patient. J Plast Reconstr Aesthet Surg 2010;63:814e9.
Evidence tabellen
|
Reference |
Study design |
Number of patients |
Patient characteristics |
Prognostic factor(s) |
Length of follow-up |
Outcome measures |
Results |
Comments |
|
Momeni 2008
Source of funding: not reported |
Retrospective cohort |
139 |
-126 females and 13 males -mean age of 42.8 years -past medical history Hypothyroidism (12.2%) Diabetes mellitus (0.7%) Coronary artery disease COPD -past surgical history* Appendectomy (28.4%) Cholecystectomy (12.6%) Hysterectomy Abdominoplasty (8.4%) Caesarian section (30.5%) *note: bariatric surgery has probably not been conducted! |
BMI as a central prognostic factor in abdominoplasty patients |
Unclear |
Minor complications*: Delayed wound healing Skin necrosis Wound dehiscence Umbilical necrosis Bleeding/haematoma
Major complications*: Infected seroma Bleeding Abscess Wound infection Skin necrosis Pneumonia
*according to definition of authors |
Major complications: BMI ≥30: 20.8% BMI<30%: 9.7% (p<0.05 reported by authors but corrected by working group: i.e. not significant in χ2-test)
Minor complications: Both BMI groups: 29.2%
No significant gender differences
Patients without previous abdominal surgery were found to have significantly more complications after abdominoplasty |
No multivariate regression conducted to take into effect of other potential prognostic factors.
Unclear which statistical tests were used.
Critical appraisal: High risk of bias
|
|
Greco 2008
Source of funding: authors reported they had no financial interests
|
Retrospective cohort |
222 |
-34 males and 188 females -mean age of 43.5 years -medical information 26 diabetics 35 former diabetics 59 (former) smokers Mean BMI: 32.5 kg/m2 (range:19.1–81.4) Operative time 199.5 min Mean ASA class 2 89 Abdominoplasty 133 Panniculectomy
139 patients had weight loss surgery |
Any independent predictors in Abdominoplasty patients |
Unclear |
Primary outcome: any wound complication. Secondary outcomes: wound healing disturbance, wound infection, hematoma, and seroma. Wound classification according to ASEPSIS system. |
Multiple logistic regression of any wound complication. ASA class and operative time were significant predictors of any wound complication in this model with a resulting increase in odds ratio (OR) of 2.37 (95% CI: 1.20-4.70; P= 0.01) for ASA class and 1.01 (95% CI: 1.00-1.01; P=0.04) for operative time. Neither prior WLS (OR 1.04, 95% CI: 0.34-3.20; P =0.94) or precontouring BMI (OR 1.26, 95% CI: 0.51-3.14; P=0.62) were statistically significant independent predictors. Additionally, the effects of age, gender, prior WLS, contouring type, diabetic status, smoking status, and combined procedure did not significantly affect the model. |
Multivariate regression controlled for bariatric surgery in identifying potential prognostic factors.
Critical appraisal: Low risk of bias
|
|
Breiting 2011
Source of funding: authors reported funding was not relevant |
Retrospective cohort |
72 |
-95% females -Mean age of 41-42 years -65-71% non-smokers -BMI loss: 12-22 kg/m2 -BMI at abdominoplasty: 24-26 kg/m2 (range 23-29 and 20-28) -operative time: 120-125 min No adequate information on comorbidities |
Any independent predictors in Abdominoplasty patients |
At least 3 months |
Complications: -Haematoma requiring (not) surgical intervention -superficial and deep Infection requiring antibiotics -Seroma (not) requiring drainage -Minor complications: haematoma or seroma not requiring intervention and superficial wound infection -Major complications: haematoma, wound infection and skin necrosis that required surgical intervention and seroma that required aspiration
|
Multiple logistic regression of a complication. Results: Bariatric surgery (OR=4.81, 95% CI:0.92-25.04), BMI before bariatric surgery (OR=0.95, 95%CI:0.84-1.08) BMI after bariatric surgery (OR=1.10, 95% CI: 0.70-1,072) |
Multivariate regression controlled for bariatric surgery on in identifying potential prognostic factors.
There were no patients with a BMI>30 kg/m2 at the time of abdominoplasty. That’s an important limitation of this study. |
|
Vastine 1999
Source of funding: not reported |
Retrospective cohort |
108 (90 had “adequate documentation”) |
-81 females; 9 males -mean age of 39 years -36 had previous bypass surgery
No information on comorbidities was provided. |
BMI as central prognostic factor |
24 months on average |
Major complications defined as a complication resulting in death; required hospitalization, surgical or invasive intervention; or resulted in wound care needs of more than 6 months. Minor complications: any non-major complication |
Multifactor analysis of variance of two factors. Preoperative weight statistically significant effect (p=0.001; previous bariatric surgery had no statistically significant effect (p=0.18) |
No effect sizes on prognostic factors (preoperative weight and previous bariatric surgery) were reported.
Other potential prognostic factors such as smoking, comorbidities, ASA class etc. were not controlled for.
Critical appraisal: High risk of bias |
|
Fischer 2013
Source of funding: Authors reported they have no financial interest |
Prospective cohort |
1797 |
-1600 females and 192 males* -mean age: not reported (adults) -BMI: 31.6 kg/m2 -hypertension -diabetes (ca. 6%) -multiple comorbidities (ca 5.5%) -recent weight loss (>10% in 6 mo) (0.4%)
* 5 not reported |
Predictors of surgical and medical morbidity in patients undergoing Body Contouring Procedures |
30 days postoperative |
Major surgical complications (incidence: 6.8%): -deep wound infection -unplanned return to the operating room within 30 days -decreased functional status
Medical Complications (incidence: 2.2%): pneumonia pulmonary embolism postoperative renal insufficiency (creatinine > 2 mg/dl) urinary tract infection stroke myocardial infarction symptomatic deep venous thrombosis sepsis septic shock
Minor wound complications (incidence: 6.3%): nonoperative and limited to superficial surgical site infections or wound dehiscence
|
Risk factors * minor wound complications: Multiple comorbidities: OR=15.9; p =0.01 Presence of a bleeding disorder: OR=20.3; p = 0.03, Decreased albumin Level: OR=0.14; p = 0.001.
Risk factors* major surgical complications: Decreased functional status: OR=9.7; p = 0.01
Risk factors* medical complications: BMI>30 kg/m2: OR=1.06 (95% BI: 1.0–1.1); p=0.03
* all derived from multivariate regression models. |
91.9 percent receiving abdominal contouring and/or contouring of the hips and buttocks.
Number of patients with a history of bariatric surgery is unknown.
Critical appraisal: Low risk of bias |
|
Nelson 2014a
Source of funding: Authors reported they have no financial interest |
Prospective cohort |
1695 |
-906 males and 783 females* -mean age of ca. 56 y -BMI (non-obese): -BMI (obese): 37.6 kg/m2 -diabetes -COPD -weight loss >10% in 6 mo -malnutrition (albumin value <3.5 g/dL) -anemia * 6 not reported
|
Predictors of complications among obese patients undergoing Abdominal Wall Reconstruction |
30 days postoperative |
Surgical complications: surgical site infection wound dehiscence deep wound infection unplanned return to the operating room (OR) within 30 days
Major surgical complications: a deep infection unplanned return to the OR Medical Complications: pneumonia pulmonary embolism postoperative renal insufficiency (creatinine > 2 mg/dl) urinary tract infection stroke myocardial infarction symptomatic deep venous thrombosis sepsis septic shock |
Major renal complications OR=4.4 (1.1–17.5) was the only significant independent risk factor in obese patients*
* derived from multivariate regression models. |
Number of patients with a history of bariatric surgery is unknown.
Study likely does not represent the true number of patients undergoing AWR.
Critical appraisal: Low risk of bias |
|
Nelson 2014b
Source of funding: Authors reported they have no financial interest |
Prospective cohort |
928 |
-501 males and 424 females*
Non-obese: -mean age of 57.0y -BMI: 25.7 -diabetes (10.9%) -dyspnoe -COPD history (5.4%) -anemia -malnutrition (9.0%) -highly comorbid (>2 co-existing diseases)
Morbidly Obese: (≥40 kg/m2) -mean age of ca 53.1 y -diabetes -dyspnea -COPD history (5.1%) -anemia -malnutrition -highly comorbid (>2 co-existing diseases)
*in 3 cases sex not reported
Patients with BMI 30-40 kg/m2 were excluded |
Morbid obesity as a central prognostic factor in patients undergoing Abdominal Wall Reconstruction |
30 days postoperative |
Major surgical complications: deep wound infection unplanned return to the OR
Major medical Complications: pneumonia pulmonary embolism postoperative renal insufficiency (creatinine > 2 mg/dl) urinary tract infection stroke myocardial infarction symptomatic deep venous thrombosis sepsis septic shock
Major wound complications: surgical site infection wound dehiscence
Major respiratory complications: Prolonged ventilation>48 hr Reintubation
Major renal complications: Pre-renal failure Renal insufficiency
|
Presence of morbid obesity was not an independent risk factor for medical (OR=0.9; p=0.8), surgical (OR=1.5; p=0.17) or wound (OR=1.2; p=0.53) complications when controlling for other comorbid conditions
Presence of morbid obesity was an independent risk factor for unplanned return to operation room (OR=2.8; p=0.001) and VTE (OR=5.2; p=0.04) |
Number of patients with a history of bariatric surgery is unknown
Reasons for return to operation room were unknown.
VTE prophylaxis was unknown |
|
Koolen 2014
Source of funding: Authors reported they have no financial interest |
Prospective cohort |
3135 (only abdominoplasty or panniculectomy; no hernia repair) |
-2826 females and 300 males* -mean age of 46.1 y -BMI:30.7 kg/m2 -diabetes -hypertension (25.8%) - >10% weight loss 6 mo before surgery (15%)
* 9 not reported
patients undergoing simultaneous major intra-abdominal surgery (general, gynecologic, or urologic) and patients having preexisting grade 3 or 4 wounds in the surgical area were excluded |
Predictors of complications (no specific prognostic factor was mentioned) in abdominoplasty / panniculectomy patients |
30 days postoperative |
wound complications (incidence: 6.3%): -superficial surgical-site infection (above fascia) -deep incisional surgical-site infection (at or below fascia) -wound disruption (partial or complete separation of wound layers)
major complications (incidence: 4.5%): -bleeding transfusion -graft/ prosthesis/flap failure -sepsis -septic shock -pneumonia -pulmonary embolism -unplanned intubation -deep vein thrombosis -cerebrovascular accident/stroke, -peripheral nerve disease -myocardial infarction
minor complications (incidence: 3.5%): urinary tract infection |
Risk factors for wound complications: body mass index: OR=1.06 wound infection: OR=2.71 (p < 0.026) weight loss >10% 6 mo before surgery OR=7.41 (p < 0.00)1
major complications: body mass index >30 kg/m2: OR=1.04 (p<0.001) minor complications no significant predictors |
Number of patients with a history of bariatric surgery is unknown.
Albumin level was not considered as a prognostic factor
Critical appraisal: Low risk of bias |
|
Staalesen 2012
Source of funding: Authors reported they have no financial interest
|
Retrospective cohort |
161 (66 non-bariatric; 95 bariatric patients)*
* all columns pertain to non-bariatric patients |
-8 males and 58 females -mean age of 40 y -BMI: 26.5 kg/m2
Comorbidities not reported
Inclusion criteria: single procedure cases (including concurrent hernia repair).
Exclusion criteria: Patients undergoing abdominoplasty with modified incision lines due to surgical scars -patients undergoing belt-lipectomy, panniculectomy, concurrent liposuction, or partial abdominoplasty |
Predictive factors associated with the development of postoperative complications (no specific prognostic factor was mentioned) in abdominoplasty patients |
Early complications within 1 month and late complications within 1 year |
Early complications: Wound dehiscence Skin necrosis Seroma/haematoma Local infections Fat necrosis Fistulation Ulcus DVT Late negative effects: Skin sensation disturbance Chronic pain Keloid Eczema around the scar Suspected hernia |
Max BMI, delta BMI, or preoperative BMI had no influence on the incidence of early local complications No analysis of late negative effects by BMI. |
No correction for confounders other than resection weight in regression analysis
BMI and late negative effect relationship was not analyzed
Critical appraisal: Moderate to high risk of bias |
|
Study ID |
Study type/ Intervention |
Adequate definition of the ‘‘case’’/‘‘control’’ or ‘‘cohort’’ groups |
Bias in selection of cases or cohort |
Presence of control groups or comparatives? |
Comparability between groups? |
Ascertainment of exposure* |
Assessment of outcome |
Follow-up duration long enough to evaluate results? ** |
Adequate follow-up quality: > 80% Not lost to follow-up |
All relevant confounding factors taken into account? |
Risk of bias assessment by guideline development group |
|
Momeni 2008 |
retrospective chart review |
Y |
Y |
N |
See column ‘confounding factors’ |
Not blinded |
Not blinded |
Y |
Y |
N |
High risk of bias |
|
Greco 2008 |
retrospective chart review |
Y |
N |
N |
See column ‘confounding factors’ |
Not blinded |
Not blinded |
Y |
Y |
Y |
Low risk of bias |
|
Breiting 2011 |
retrospective chart review |
Y |
Y |
N |
See column ‘confounding factors’ |
Not blinded |
Not blinded |
Y |
Y |
N |
Moderate risk of bias |
|
Vastine 1999 |
retrospective chart review |
Y |
Y |
N |
See column ‘confounding factors’ |
Not blinded |
Not blinded |
Y |
Y |
N |
High risk of bias |
|
Staalesen 2012 |
retrospective chart review |
Y |
N |
N |
See column ‘confounding factors’ |
Not blinded |
Not blinded |
Y |
Y |
N |
High risk of bias |
|
Fischer 2013 |
Registry based study |
Y |
Y |
N |
See column ‘confounding factors’ |
Not blinded |
Not blinded |
Y |
Y |
Y |
Moderate risk of bias |
|
Koolen 2014 |
Registry based study |
Y |
Y |
N |
See column ‘confounding factors’ |
Not blinded |
Not blinded |
Y |
Y |
Y |
Moderate risk of bias |
|
Nelson 2014a |
Registry based study |
Y |
Y |
N |
See column ‘confounding factors’ |
Not blinded |
Not blinded |
Y |
Y |
Y |
Moderate risk of bias |
|
Nelson 2014b |
Registry based study |
Y |
Y |
N |
See column ‘confounding factors’ |
Not blinded |
Not blinded |
Y |
Y |
Y |
Moderate risk of bias |
Notes: *) BMI was considered as “exposure”; **) in case of a time frame of 30 days postoperatively.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 03-05-2017
Beoordeeld op geldigheid : 14-09-2016
Uiterlijk in 2021 bepaalt het bestuur van de Nederlandse Vereniging voor Plastische Chirurgie of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Plastische Chirurgie is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door J. de Beer, zelfstandig richtlijnmethodoloog en B. Niël-Weise, zelfstandig richtlijnmethodoloog en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Het doel van de richtlijn is duidelijkheid en uniformiteit te creëren voor behandelaars over de behandeling van patiënten met een abdominaal huid en/of vet surplus met of zonder klachten (functioneel, cosmetisch of medisch).
Specifieke doelen zijn:
- het preoperatief risicomanagement, zoals antibioticaprofylaxe;
- het geven van adequate patiëntenvoorlichting;
- de indicaties voor de verschillende typen abdominoplastieken;
- het verrichten van de ingreep in de correcte klasse operatiekamer;
- de randvoorwaarden om een abdominoplastiek te mogen uitvoeren.
Doelgroep
De richtlijn beoogt een praktisch handvat te bieden aan behandelaars van patiënten met een abdominaal huid en/of vet surplus met of zonder klachten (functioneel, cosmetisch of medisch), zoals (plastisch) chirurgen, dermatologen, microbiologen, infectiologen, anesthesiologen en huisartsen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2015 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten die met abdominoplastiek te maken hebben.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende 18 maanden aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
In 2015 tot 2016 hebben de volgende personen deelgenomen aan de ontwikkeling van de richtlijn:
Drs. M.A. van Huizum (voorzitter), plastisch chirurg, Antoni van Leeuwenhoek Ziekenhuis, 148 Amsterdam
Drs. N. Posch, plastisch chirurg, Erasmus Medisch Centrum, Rotterdam
Drs. W.G. van Selm, plastisch chirurg, sint Lucas Andreas Ziekenhuis, Amsterdam
Dr. S. Klein, plastisch chirurg, Elisabeth Tweesteden Ziekenhuis, Tilburg
Drs. A. van Engeland, plastisch chirurg, Bergman Clinics, Bilthoven
Dr. M. Larsen, plastisch chirurg, MCHaaglanden/Bronovo, Den Haag
Dr. A.T. Bernards, arts-microbioloog, LUMC, Leiden
Meelezers:
Dr. J.A. Otte, internist, ZorgSaam Zeeuws-Vlaanderen, Terneuzen
Dr. C. den Hengst, dermatoloog, UMC, Utrecht; Zuwe Hofpoort Ziekenhuis, Woerden
Dr. S. Nienhuijs, algemeen chirurg, Catharina Ziekenhuis, Eindhoven
Met ondersteuning van:
Mw. B.S. Niël-Weise, arts-microbioloog (niet praktiserend), zelfstandig richtlijnmethodoloog, Deventer
Dr. ir. J.J.A. de Beer, zelfstandig richtlijnmethodoloog, Utrecht
Mw. Drs. H. Deurenberg, SIROSS, informatiespecialist, Oss
In 2017 tot 2018 hebben de volgende personen deelgenomen aan de ontwikkeling van het addendum rectus diastase:
Drs. M.A. van Huizum (voorzitter), plastisch chirurg, Antoni van Leeuwenhoek Ziekenhuis, Amsterdam
Dr. S. Klein, plastisch chirurg, Elisabeth Tweesteden Ziekenhuis, Tilburg
Prof. dr. B. van der Lei, plastisch chirurg, Universitair Medisch Centrum Groningen/Bergman Clinics (Nederland)
Meelezers:
Dr. S. Nienhuijs, algemeen chirurg, Catharina Ziekenhuis, Eindhoven
R.E. Genders, dermatoloog, LUMC, Leiden
F.E.J.A. Willemssen, radioloog, Erasmus Medisch Centrum, Rotterdam
Met ondersteuning van:
Mw. B.S. Niël-Weise, arts-microbioloog (niet praktiserend), zelfstandig richtlijnmethodoloog, Deventer
Dr. ir. J.J.A. de Beer, zelfstandig richtlijnmethodoloog, Utrecht
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen d.m.v. reputatiemanagement, belangen vanwege extern gefinancierd onderzoek, en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij de Nederlandse Vereniging voor Plastische Chirurgie, een overzicht vindt u hieronder:
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Reputatie-management |
Extern gefinancierd onderzoek |
Kennis Valorisatie |
Overige belangen |
|
Van Huizum |
Plastisch chirurg |
Lid Kwaliteitscommissie NVPC (onbetaald); Voorzitter richtlijnen commissie NVPC (onbetaald); Penningmeester Dr. N. Tulp Foundation |
geen |
geen |
geen |
geen |
geen |
geen |
|
Posch |
Plastisch chirurg |
Lid Kwaliteitscommissie en lid richtlijnencommissie van de NVPC |
geen |
geen |
geen |
geen |
geen |
geen |
|
Van Selms |
Plastisch chirurg |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Klein |
Plastisch chirurg |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Van Engeland |
Plastisch chirurg |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Larsen |
Plastisch chirurg |
Lid Medisch Ethische ToetsingsCommissie ZuidWest Holland (betaald) |
geen |
geen |
geen |
geen |
geen |
geen |
|
Bernards |
Arts-microbioloog |
Vakdeskundige (auditor) Raad van Accreditatie (betaald) |
geen |
geen |
geen |
geen |
geen |
geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door in de voorbereidende fase Patiëntenfederatie NPCF (NPCF) te vragen om schriftelijke input omtrent knelpunten en aandachtspunten. De NPCF gaf aan dat er geen specifieke patiëntenorganisatie is voor dit onderwerp om input aan te vragen. Er konden dan ook geen knelpunten aangeleverd worden. Wel heeft de NPCF commentaar geleverd in de commentaarfase. Ook is tijdens de commentaarfase beroep gedaan op patiëntreferenten, die geworven zijn via de plastisch chirurgen in de werkgroep. Tevens is er een search gedaan naar het patiëntenperspectief.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren (zie ook het implementatie onder aanverwant).
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen volgens het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (www.agreecollaboration.org), dat een internationaal breed geaccepteerd instrument is en op ‘richtlijnen voor richtlijn’ voor de beoordeling van de kwaliteit van richtlijnen.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Deze werden met de werkgroep besproken en vervolgens per mail aan de volgende organisaties voorgelegd met de vraag om input: het Zorginstituut Nederland, Inspectie voor de Gezondheidszorg, Nederlandse Zorgautoriteit, Nederlandse Patiënten Consumenten Federatie, Nederlands Huisartsen Genootschap en Zorgverzekeraars Nederland.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen [http://www.g-i-n.net/library/international-guidelines-library; https://www.ahrq.gov] en naar systematische reviews [Cochrane Library; Medline]. Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in de module van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de methodologische checklijsten.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kwaliteit van bewijs (‘quality of evidence’) werd beoordeeld met behulp van GRADE (Guyatt et al., 2008). GRADE is een methode die per uitkomstmaat van een interventie, of voor een risico- of prognostische factor, een gradering aan de kwaliteit van bewijs toekent op basis van de mate van vertrouwen in de schatting van de effectgrootte (tabel 1 en 2).
Tabel 1 Indeling van de kwaliteit van bewijs volgens GRADE
|
Hoog |
Er is veel vertrouwen dat het werkelijke effect dicht in de buurt ligt van het geschatte effect. |
|
|
|
|
Matig |
Er is matig vertrouwen in het geschatte effect: het werkelijk effect ligt waarschijnlijk dicht bij het geschatte effect, maar er is een mogelijkheid dat het hiervan substantieel afwijkt. |
|
|
|
|
Laag |
Er is beperkt vertrouwen in het geschatte effect: het werkelijke effect kan substantieel verschillen van het geschatte effect. |
|
|
|
|
Zeer laag |
Er is weinig vertrouwen in het geschatte effect: het werkelijke effect wijkt waarschijnlijk substantieel af van het geschatte effect. |
Tabel 2 De kwaliteit van bewijs wordt bepaald op basis van de volgende criteria
|
Type bewijs |
Voor studies over interventies: RCT start in de categorie ‘hoog’. Observationele studie start in de categorie ‘laag’. Alle overige studietypen starten in de categorie ‘zeer laag’.
Voor studies over een risico- of prognostische factor: Prospectieve of retrospectieve cohortstudie start in de categorie ‘hoog’. Voor andere studieontwerpen wordt afgewaardeerd via ‘risk of bias’. |
|
|
|
|
|
|
Afwaarderen |
‘Risk of bias’ |
- 1 Serieus - 2 Zeer serieus |
|
|
|
|
|
|
Inconsistentie |
- 1 Serieus - 2 Zeer serieus |
|
|
|
|
|
|
Indirect bewijs |
- 1 Serieus - 2 Zeer serieus |
|
|
|
|
|
|
Onnauwkeurigheid |
- 1 Serieus - 2 Zeer serieus |
|
|
|
|
|
|
Publicatiebias |
- 1 Waarschijnlijk - 2 Zeer waarschijnlijk |
|
|
|
|
|
|
|
|
|
Opwaarderen |
Groot effect |
+ 1 Groot + 2 Zeer groot |
|
|
|
|
|
|
Dosis-respons relatie |
+ 1 Bewijs voor gradiënt |
|
|
|
|
|
|
Alle plausibele ‘confounding’ |
+ 1 zou een effect kunnen reduceren + 1 zou een tegengesteld effect kunnen suggereren terwijl de resultaten geen effect laten zien. |
Formuleren van de conclusies
Een conclusie verwijst niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence).
Overwegingen
Voor het komen tot een aanbeveling zijn naast de kwaliteit van het wetenschappelijk bewijs over de gewenste en ongewenste effecten van een interventie, of over de effectgrootte van een risico- of prognostische factor, vaak ook nog andere aspecten van belang.
Genoemd kunnen worden:
- kosten,
- waarden, voorkeuren en ervaringen van patiënten en behandelaars met betrekking tot interventies en uitkomsten van zorg,
- aanvaardbaarheid van interventies,
- haalbaarheid van een aanbeveling.
Bij voorkeur wordt ook voor deze aspecten naar wetenschappelijk bewijs gezocht. De werkgroep die deze richtlijn heeft opgesteld, heeft hiervan afgezien omdat de hiervoor benodigde tijd in geen enkele verhouding zou staan tot de verwachte opbrengst. De werkgroep heeft, daar waar dit noodzakelijk werd geacht, op basis van eigen ervaring en expertise de hiervoor genoemde aspecten geïnventariseerd.
Deze aspecten worden besproken na de ‘conclusie’ onder het kopje ‘overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beste beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de modules ‘Operatieafdeling per type abdominoplastiek’ en ‘Eisen ziekenhuis/kliniek bij abdominoplastiek’.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn werden er interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Hiervoor werd gebruik gemaakt van de methodiek zoals beschreven in Programm für Nationale VersorgungsLeitlinien von BÄK, KBV und AWMF Qualitätsindikatoren. Manual für Autoren: 6. Qualitätsindikatoren für Nationale VersorgungsLeitlinien (2009).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek staat in de Kennislacunes.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken wetenschappelijke verenigingen voorgelegd voor commentaar. Tevens werd de richtlijn voorgelegd aan de volgende organisaties ter becommentariëring: het Zorginstituut Nederland, Inspectie voor de Gezondheidszorg, Nederlandse Zorgautoriteit, Nederlandse Patiënten Consumenten Federatie, Nederlands Huisartsen Genootschap en Zorgverzekeraars Nederland. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Literatuur
Guyatt et al., 2008Guyatt GH, Oxman AD, Vist GE, Kunz R, Falck-Ytter Y, Alonso-Coello P, Schünemann HJ; GRADE Working Group (2008). GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ. 336: 924-6.
Programm für Nationale VersorgungsLeitlinien von BÄK, KBV und AWMF Qualitätsindikatoren. Manual für Autoren: 6. Qualitätsindikatoren für Nationale VersorgungsLeitlinien (2009).
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
2000 – June 19th 2015
Dutch or English |
1 abdominoplast*.tw. (1215) 2 "fleur de lis".tw. (27) 3 mini?abdominopl*.tw. (16) 4 Surgery, Plastic/ (23175) 5 abdomen/ or abdominal wall/ (34846) 6 Abdominoplasty/ (195) 7 Cosmetic Techniques/ (3276) 8 (cosmetic adj3 (techni* or surg*)).tw. (3043) 9 abdom*.tw. (264494) 10 5 or 9 (275097) 11 4 or 7 or 8 (28330) 12 10 and 11 (885) 13 "Body contouring surgery".kw. (8) 14 from 13 keep 6 (1) 15 (body adj3 contour* adj5 surg*).tw. (230) 16 1 or 2 or 3 or 12 or 13 or 15 (1999) 17 Reconstructive Surgical Procedures/ (31865) 18 (reconstructive adj3 surgical adj3 procedur*).tw. (289) 19 (clean adj3 surg*).tw. (717) 20 (cosmetic adj3 surg*).tw. (2754) 21 10 and 20 (125) 22 16 or 17 or 18 or 19 or 21 (34381)=P 23 "P abdominoplasty 31 maart 2015".ti. (0) 24 22 (34381) 25 limit 24 to yr="2013 -Current" (5705) 26 exp "body weights and measures"/ or body mass index/ (465768) 27 (bmi or (body adj3 mass adj3 index)).tw,kw. (150027) 28 obesity/ or obesity, abdominal/ or obesity, morbid/ (147595) 29 obes*.tw,kw. (198490) 30 Overweight/ (13949) 31 overweight.tw,kw. (43017) 32 or/26-31 (600433)= BMI 33 risk.tw,kw. (1365964) 34 exp risk/ (889405) 35 reconstructive surgical procedures/ae or abdominoplasty/ae (2065) 36 ae.fs. (1415543) 37 or/33-36 (2862012) 38 exp Comorbidity/ (74355) 39 comorbidity.kw,tw. (32534) 40 (morbidity adj3 rate?).tw. (19117) 41 (predictive adj3 factor?).tw. (21622) 42 (complication adj3 rate?).tw. (36620) 43 or/38-42 (169282) 44 37 or 43 (2948016) 45 22 and 32 and 44 (434) 46 33 or 34 or 35 (1743609) 47 45 and 46 (311) 48 35 and 47 (96) 49 "24005367".an. (1) 50 "23088637".an. (1) 51 "18692451".an. (1) 52 49 or 50 or 51 (3) 53 "controle refs bmi".ti. (0) 54 48 and 52 (2) 55 52 not 54 (1) 56 predict*.tw,kw. (1034079) 57 35 or 38 or 39 (97494) 58 45 and 52 (3) 59 43 and 56 (40574) 60 33 or 34 or 35 or 59 (1762402) 61 22 and 60 and 32 (316) 62 complicat*.ti. (144188) 63 *Postoperative Complications/ (120659) 64 *Postoperative Complications/ep (9403) 65 62 or 64 (151223) 66 59 and 65 (1550) 67 (33 or 34 or 35 or 66) and 22 and 32 (313)=P + risk +BMI 68 exp *"body weights and measures"/ or *body mass index/ (162142) 69 (bmi or (body adj3 mass adj3 index)).ti. (12393) 70 *weight gain/ or *weight loss/ (18147) 71 (weight adj3 (loss or gain)).ti. (16120) 72 obesity/su or obesity, abdominal/su or obesity, morbid/su (11553) 73 *obesity/su or *obesity, abdominal/su or *obesity, morbid/su (8133) 74 or/68-73 (178551)=focus BMI 75 67 and 74 (108) = P + risk + BMI focus 76 75 (108) 77 limit 76 to yr="2000 -Current" (100) 78 "filter systematic reviews".ti. (0) 79 meta analysis.pt. (56963) 80 (meta-anal$ or metaanal$).af. (100994) 81 (quantitativ$ adj10 (review$ or overview$)).tw. (5187) 82 (systematic$ adj10 (review$ or overview$)).tw. (77005) 83 (methodologic$ adj10 (review$ or overview$)).tw. (6972) 84 medline.tw. and review.pt. (46651) 85 (pooled adj3 analy*).tw. (9797) 86 or/79-85 (182384) 87 "filter systematic reviews".ti. (0) 88 "cochrane$".fc_jour. (11489) 89 86 or 88 (183694)= systrev filter 90 75 and 89 (1) = P + risk + BMI focus + systrev |
1 SR, 107 divers |
|
Cochrane Library |
Abdominoplasty/Abdominoplasty .adverse effects/ |
16 |
