Verblijfsdrain versus pleurodese
Uitgangsvraag
Wat is de plaats van de verblijfsdrain ten opzichte van pleurodese bij patiënten met maligne pleuravocht met of zonder een trapped lung?
Aanbeveling
Informeer de patiënt over de voor- en nadelen van de verschillende behandelopties van maligne pleuravocht. Betrek de patiënt bij de besluitvorming omtrent de behandeling van maligne pleuravocht.
Overweeg een verblijfsdrain bij patiënten met symptomatisch maligne pleuravocht.
Adviseer patiënten zonder evidente trapped lung en een verblijfsdrain dagelijks pleuravocht te draineren om de kans op “spontane pleurodese” te vergroten.
Overwegingen
In het veld van de behandeling van maligne pleuravocht is weinig gerandomiseerd onderzoek voorhanden met focus op de verblijfsdrain. Patiënten met de slechtste prognose en patiënten met een trapped lung werden niet in deze studies geïncludeerd. Daardoor is de subvraag “de rol van de verblijfsdrain bij de niet-ontplooiende long” niet door gerandomiseerd onderzoek gesteund.
De standaardbehandeling bij de trapped lung is herhaalde ontlastende puncties. De verblijfsdrain is een alternatief hiervoor. Indien er bij een trapped lung een (herhaalde) symptomatisch toename van pleuravocht ontstaat, dient de afweging gemaakt te worden om een verblijfsdrain te plaatsen. Bij deze afweging met de patiënt zullen de (on-)mogelijkheid om naar het ziekenhuis te komen voor herhaalde puncties en de (on-)wenselijkheid om zelf thuis vocht af te nemen meegenomen moeten te worden. De op dat moment geldende financiële vergoeding zal de eventuele keuze voor een verblijfsdrain beïnvloeden.
Met betrekking tot de plaats van de verblijfsdain bij de behandeling van maligne pleuravocht bij de ontplooiende long: Geen van de RCT’s toont een verschil tussen behandeling met verblijfsdrain of talkpleurodese in termen van kortademigheid en kwaliteit van leven. De secundaire eindpunten verschillen ten voordele van verblijfsdrains. Patiënten bij wie een verblijfsdrain werd geplaatst, hadden een significant kortere opnameduur dan patiënten die werden behandeld met pleurodese. Ook het aantal pleurale re-interventies en nieuwe ziekenhuisopnames was lager. Overigens kan uitgebreid gedebatteerd worden over de manier waarop talkpleurodese plaatsvindt. Dit kan zowel via thoracoscopie (poudrage) als via een thoraxdrain (talkslurry). Aangezien de succespercentages tussen deze behandelingen min of meer vergelijkbaar zijn (Clive, 2016), en niet alle longartsen thoracoscopieën verrichten, hebben we ons hier beperkt tot het alomvattende talkpleurodese. Overigens worden binnenkort de resultaten van een RCT verwacht die poudrage met slurry vergelijkt (Bhatnagar, 2014).
Bijwerkingen van verblijfsdrains zijn acceptabel. Pleurale infecties door verblijfsdrains komen even weinig voor als bij talkpleurodese. In een internationale multicenter studie werd bevestigd dat de incidentie van pleurale infecties ongeveer 5% is (Fysh, 2013). Het overgrote deel van deze pleurale infecties kon met antibiotica worden gecontroleerd. Infecties traden veelal op na 2 maanden, hetgeen suggereert dat infecties meer gerelateerd zijn aan het gebruik dan aan de plaatsing zelf. Antibioticaprofylaxe rondom plaatsing lijkt dan ook niet zinvol. In meerdere studies werd gesuggereerd dat het aantal pleurale infecties niet hoger is als de patiënt na plaatsing een chemotherapeutische behandeling ondergaat (Morel, 2011; Davies, 2012; Boshuizen, 2017).
Vaststellen van kosteneffectiviteit wordt bemoeilijkt door verschillen in vergoeding tussen de verschillende landen en in de loop van de tijd. Dit in acht nemend zijn er aanwijzingen dat bij een beperktere overlevingsduur verblijfsdrains kosteneffectief kunnen zijn. (Puri, 2012; Boshuizen, 2013; Olden, 2010). In de praktijk lijken kosten tussen verblijfsdrains die als eerstelijnsbehandeling werden geplaatst en verblijfsdrains geplaatst na gefaalde pleurodese gelijk (Boshuizen, 2013). Gebruikskosten waren per tumortype verschillend, hetgeen wordt veroorzaakt door verschil in overleving. Patiënten met maligne pleuravocht ten gevolge van longkanker hadden gemiddeld de laagste gebruikskosten, mesothelioompatiënten de hoogste. In deze Nederlandse observationele studie bleek 75% van de patiënten in staat om zonder professionele hulp (maar bijvoorbeeld met hulp van familie) de drainages te verrichten, hetgeen bespaart op thuiszorgkosten (Boshuizen, 2013).
Hoewel er geen verschil in kwaliteit van leven (kortademigheid, pijn) kon worden aangetoond tussen talkpleurodese en verblijfsdrain, blijkt de patiënttevredenheid over de verblijfsdrain goed. De vraag of ze nogmaals voor een verblijfsdrain zouden kiezen en deze behandeling medepatiënten zouden aanraden, werd door de overgrote meerderheid bevestigend geantwoord (Sabur, 2013). In een Australische studie bleek dat de patiënten een voorkeur hadden voor een verblijfsdrain of talkpleurodese (Fysh, 2012). Aangezien patiënten blijkbaar één van beide behandelingen prefereren, zouden zij nadrukkelijk moeten worden betrokken bij deze keuze. Zeker bij een beperkte levensverwachting zou een verblijfsdrain moeten worden besproken wanneer maligne pleuravocht recidiveert.
Tot voor kort werden diverse drainageschema’s gehanteerd, wisselend van aftappen in een vast schema tot op zo nodig basis. Recent werd in een gerandomiseerde studie aangetoond dat dagelijks aftappen bij patiënten bij wie een trapped lung niet is aangetoond eerder en vaker leidt tot pleurodese (Wahidi, 2017). De commissie adviseert dan ook op grond van deze resultaten om na het plaatsen van de verblijfsdrain dagelijks pleuravocht te draineren bij deze groep patiënten.
Een zeer recente ontwikkeling is de behandeling middels de combinatie van een verblijfsdrain en talkpleurodese. In een gerandomiseerde studie werden patiënten tien dagen na plaatsing van een verblijfsdrain in geval van een aanliggende long behandeld met talk slurry of placebo via de verblijfsdrain. Significant meer mensen hadden een succesvolle pleurodese wanneer talk was ingespoten. Bovendien kan deze talkpleurodese in een poliklinische setting verricht worden, hetgeen veel opnamedagen scheelt (Bhatnagar, 2018). Meer onderzoeken zouden moeten uitwijzen of de optimale behandeling voor maligne pleuravocht bestaat uit een combinatie van talkpleurodese en een verblijfsdrain in welke vorm of volgorde dan ook.
Onderbouwing
Achtergrond
Momenteel worden in Nederland patiënten met maligne pleuravocht behandeld met talkpleurodese, waarvan het succespercentage in een intention-to-treat analyse 32 tot 71% is (Burgers, 2008). Na een mislukte talkpleurodese of wanneer talkpleurodese niet zinvol wordt geacht (bijvoorbeeld bij patiënten met een trapped lung of in een slechte conditie), zou een thoracale verblijfsdrain (Indwelling Pleural Catheter, IPC) kunnen worden geplaatst. Met een thoracale verblijfsdrain wordt de patiënt in staat gesteld pleuravocht op vaste momenten en/of in geval van klachten te draineren. De verblijfsdrain is in Nederland echter nog niet algemeen geaccepteerd en specifieke financiële vergoeding ontbreekt.
Conclusies / Summary of Findings
|
Laag GRADE |
Er zijn aanwijzingen dat een verblijfsdrain ten opzichte van pleurodese eenzelfde effect heeft op de kwaliteit van leven van patiënten met maligne pleuravocht met of zonder trapped lung.
Bronnen: Davies, 2012; Putman, 1999; Thomas, 2017 |
|
Laag GRADE |
Er zijn aanwijzingen dat een verblijfsdrain ten opzichte van pleurodese eenzelfde effect heeft op dyspneu bij patiënten met maligne pleuravocht met of zonder trapped lung.
Bronnen: Boshuizen 2017; Davies, 2012; Demmy, 2012; Putman, 1999; Thomas, 2017 |
|
Laag GRADE |
Er zijn aanwijzingen dat de behandeling van pleurale effusie met behulp van een verblijfsdrain leidt tot een kortere (totale) opnameduur dan pleurodese bij patiënten met maligne pleuravocht met of zonder trapped lung.
Bronnen: Boshuizen, 2017; Davies, 2012; Putman, 1999; Thomas, 2017 |
|
Zeer laag GRADE |
Het is onduidelijk of de kosten voor een verblijfsdrain even hoog zijn als de kosten voor talkpleurodese. Ook is het onduidelijk of de verblijfsdrain kosteneffectief is ten opzichte van de talkpleurodese bij patiënten met maligne pleuravocht met of zonder trapped lung.
Bronnen: Penz, 2014; Olfert, 2017 |
|
Zeer laag GRADE |
Het is onduidelijk of de verblijfsdrain een effect heeft op het aantal serious adverse events in vergelijking met talkpleurodese bij patiënten met maligne pleuravocht met of zonder trapped lung.
Bronnen: Boshuizen, 2017; Davies, 2012; Demmy, 2012; Putman, 1999; Thomas, 2017 |
|
Laag GRADE |
Er zijn aanwijzingen dat patiënten met maligne pleuravocht met of zonder trapped lung die behandeld worden met een verblijfsdrain minder re-interventies ondergaan dan patiënten die behandeld worden met talkpleurodese.
Bronnen: Boshuizen, 2017; Davies, 2012; Putman, 1999; Thomas, 2017 |
Samenvatting literatuur
Beschrijving studies
Boshuizen (2017) verrichtte een gerandomiseerde gecontroleerde studie waarin een vergelijking werd gemaakt tussen talkpleurodese en een verblijfsdrain bij patiënten met maligne pleuravocht. In totaal konden 94 patiënten gerandomiseerd worden, 48 patiënten lootten voor talkpleurodese en 46 voor de verblijfsdrain. Uitkomsten waren onder andere de uitkomsten op de modified Borg scale (na 6 weken en na 3 en 6 maanden), het aantal re-interventies en de lengte van ziekenhuisopname. Adverse events werden bijgehouden. Van de 94 patiënten konden de data van 40 patiënten geïncludeerd worden in de intention-to-treat analyse. De resultaten van de per protocol analyse (exclusie van patiënten die geen talk toegediend hadden gekregen of waarbij de er binnen 6 weken ipsilateraal een re-interventie nodig was) gaven ongeveer dezelfde resultaten en worden hier niet verder behandeld. Helaas zijn er geen spreidingsmaten gerapporteerd; dit maakt het lastig om deze studie mee te nemen in een eventuele meta-analyse van de lineaire uitkomstmaten.
Davies (2012) onderzocht in de TIME2-studie de effectiviteit van een verblijfsdrain ten opzichte van talkpleurodese. Honderdzes patiënten met een maligne pleurale effusie namen deel aan de studie. Bij 52 patiënten werd poliklinisch (tenzij de patiënt was opgenomen) een verblijfsdrain geplaatst. De overige 54 patiënten werden opgenomen in het ziekenhuis en kregen pleurodese. Bij patiënten met een uitgebreide trapped lung werd geen talk ingespoten, maar deze patiënten bleven wel in de studie. De uitkomstmaten waren onder andere dyspneu (100mm VAS; waarbij een score 0 de maximale kortademigheid of pijn aangaf en 100 de best mogelijke score), kwaliteit van leven (globale kwaliteit van leven schaal van de EORTC QLQ-30, een hogere score geeft een beter kwaliteit van leven aan), opnameduur en complicaties. Er waren kleine verschillen op baseline tussen de groepen, bijvoorbeeld met betrekking tot het type maligniteit en de score voor dyspneu (verblijfsdrain: 62 mm, pleurodese: 55 mm). Patiënten werden tot hun overlijden (mediane overleving 200 dagen voor de patiënten behandeld met pleurodese en 153 dagen voor de patiënten met een verblijfsdrain) of tot een jaar follow-up gevolgd. Twintig patiënten, 5 geloot voor de verblijfsdrain en 15 geloot voor pleurodese overleden binnen de eerste 42 dagen. Na 6 weken, na 3 en 6 maanden waren respectievelijk nog 86, 69 en 54 patiënten in leven. De analyses werden gecorrigeerd voor performance status en mesothelioom ja/nee. Sommige van de co-auteurs hadden banden met de industrie.
In de studies van Penz (2014) en Olfert (2017) werden de kosten en kosteneffectiviteit van de TIME2-studie in kaart gebracht vanuit het perspectief van de Britse zorgbetaler. De volgende kosten werden meegenomen: kosten voor de initiële procedure en ziekenhuisopname, adverse events en de kosten voor de drainage. De kosten werden omgerekend naar de kostprijs in 2013 (Penz, 2014) of 2014 (Olfert, 2017). Olfert (2017) berekende de QALY’s door de gegevens van overleving en de utiliteit (bepaald middels de EQ-5D-3L) te combineren. De grens voor de kosteneffectiviteit lag op een willingness to pay threshold van $50,000/QALY. Er werden in beide studies een aantal sensitiviteitsanalyses uitgevoerd. Zo werd er gekeken naar het effect van de overleving <14 weken en naar het effect van extra verpleegkundige hulp voor het uitvoeren van de drainage.
Demmy (2012) vergeleek in een gerandomiseerde gecontroleerde studie de effectiviteit van talkpleurode ten opzichte van een verblijfsdrain bij patiënten met een maligniteit en unilateraal pleuravocht. Patiënten verdacht voor trapped lung, overleving minder dan 60 dagen en ernstige comorbiditeit werden geëxcludeerd. Volgens de powerberekening zouden 530 patiënten moeten deelnemen aan de studie, maar uiteindelijk konden slechts 67 patiënten geregistreerd en gerandomiseerd worden. Van deze 67 patiënten werden tien later nog geëxcludeerd wegens bilaterale effusies (n=6), andere complicaties (n=3) of een onbekende reden (n=1). Uiteindelijk zijn de gegevens van 57 patiënten meegenomen in de analyses. In zeven patiënten kon de behandeling niet worden voltooid door geloketteerd pleuravocht (talkpleurodese: n=1, verblijfsdrain: n=2), geen longontplooiing (pleurodese n=2) of door verstopping van de drain (n=1 voor beide groepen). In deze studie werd de kwaliteit van leven (inclusief acceptatie, tevredenheid, symptomen en dyspneu) na 7, 30 en 60 dagen door zowel de arts als de patiënt bepaald met behulp van de Condensed Memorial Symptom Assessment Scale, dyspnea index en de Karnofsky Self-reported Performance Rating Scale. Echter alleen de resultaten voor dyspneu worden (zij het zeer beperkt) gerapporteerd.
Putman (1999) evalueerde in een gerandomiseerde studie (n=144) de effectiviteit van een verblijfsdrain ten opzichte van doxycycline pleurodese op kwaliteit van leven (dyspneu component van de Guyatt Chronic Respiratory Questionnaire), dyspneu (Borg score (0 tot 10) in rust en na het wandelen van ~30 meter (100ft)), opnameduur, late recidieven en adverse events. De patiënten werden in een 2:1 ratio geloot naar één van de twee groepen, waarbij de meeste patiënten (n=99) een verblijfsdrain kregen. Het effect van de behandeling werd geëvalueerd na 30, 60 en 90 dagen. De loss to follow-up was groot (56-67%), voornamelijk veroorzaakt door de hoge mortaliteit. De mediane overleving was 87 dagen voor patiënten met een verblijfsdrain en 90 dagen voor de patiënten die een pleurodese hadden gehad. De studies werd ondersteund door Denver Biomaterials (Denver, Colorado), de fabrikant van de verblijfsdrain. Drie van de auteurs hadden aandelen in het moederbedrijf van Denver Biomaterials.
Thomas (2017) verrichtte een gerandomiseerd gecontroleerde studie waarin de effectiviteit van verblijfscatheters ten opzichte van talkpleurodese werd onderzocht in negen centra in Australië, Nieuw-Zeeland, Singapore en Hong Kong. Honderdzesenveertig patiënten met symptomatisch maligne pleuravocht die nog niet eerder waren behandeld met één van de interventies participeerden in de trial en werden 12 maanden gevolgd (of tot overlijden). Uitkomsten van de studie waren ziekenhuisopnameduur binnen 12 maanden (of overlijden), verdere pleurale interventies, dyspneu (‘breathlessness’; VAS), kwaliteit van leven (VAS en EQ5D) en adverse events. Sommige auteurs waren lid van advisory boards van farmaceutische of medische technologiebedrijven.
Resultaten
1. Kwaliteit van leven
Boshuizen (2017) heeft geen data voor de uitkomstmaat kwaliteit van leven bepaald.
Davies (2012) rapporteerde de gegevens over kwaliteit van leven beschikbaar van respectievelijk 69, 56 en 41 patiënten voor de meetmomenten op zes weken, drie en zes maanden. Er werden geen verschillen tussen de groepen gevonden. Het gemiddeld verschil op zes weken was 4,8 (95%BI=-1,6 tot 11,2) op de globale kwaliteit van leven schaal van de EORTC QLQ-30.
Demmy (2012) heeft wel de kwaliteit van leven van de patiënten op verschillende tijdstippen bepaald, maar niet gerapporteerd.
Putman (1999) rapporteerde dat de verschilscores van de twee groepen op de dyspneu component van de Guyatt Chronic Respiratory Questionnaire op geen van de tijdstippen significant van elkaar verschilden. De gemiddelde verandering (SD) na 30 dagen was 5,2 (7,5) bij patiënten met een verblijfsdrain en 5,5 (8,7) bij de patiënten die pleurodese hadden gekregen. Na 90 dagen was dit respectievelijk 7,2 (7,1) en 6,3 (8,2).
Thomas (2017) rapporteerde dat de kwaliteit van leven in beide groepen na de interventie verbeterde, maar dat er geen verschil gevonden werd in de vooruitgang in kwaliteit van leven.
Gezien de grote heterogeniteit tussen de studies wat betreft de gebruikte meetinstrumenten en tijdstippen is besloten geen meta-analyse uit te voeren.
2. Dyspneu
Boshuizen (2017) rapporteerde dat er geen verschil werd gevonden in de verschilscores voor dyspneu, berekend als het verschil tussen de scores na zes weken en de scores op de modified Borgscore voor de randomisatie (rust: gemiddelde talkpleurodese= 2,2; gemiddelde verblijfsdrain= 1,6, p=0,25; inspanning: gemiddelde talkpleurodese= 2,1; gemiddelde verblijfsdrain= 1,8, p=0,44). Ook na drie en zes maanden werd er geen verschil tussen de groepen gevonden.
Davies (2012) rapporteerde dat de gemiddelde VAS scores voor dyspneu tijdens de eerste 42 dagen niet verschilden tussen de groepen (verblijfsdrain: 24,7 mm, 95%BI=19,3 tot 30,1 mm; pleurodese: 24,4 mm, 95%BI=19,4 tot 29,4, gemiddeld verschil: 0,16 mm, 95%BI=-6,82 tot 7,15). Alleen op zes maanden werd een significant verschil tussen de groepen gevonden, waarbij de groep met de verblijfsdrain significant minder dyspneu rapporteerde (gemiddeld verschil: -14,0 mm (95%BI= -25,2 tot -2,8).
Demmy (2012) rapporteerde dat patiënten behandeld met een verblijfsdrain gemiddeld betere dyspneu scores hadden (verblijfsdrain: 8,5, talkpleurodese: 6,1, p=0,047). De analyse was gecorrigeerd voor de baseline score, de hoeveelheid vocht die in eerste instantie was gedraineerd, geslacht, opname status en de performance status op baseline. Tijdstip van de meting was echter onbekend en ook informatie over de spreiding ontbreekt.
Putman (1999) rapporteerde dat de verbetering in de Borg scores na inspanning tussen baseline en 30 dagen follow-up significant groter was bij patiënten met een verblijfsdrain dan bij de patiënten behandeld met pleurodese (gemiddelde (SD) verblijfsdrain: 2,2 (2,4), pleurodese: 1,0 (2,4), p=0,05). Er werden verder geen significante verschillen tussen de groepen gevonden.
Thomas (2017) rapporteerde dat de mate van dyspneu in beide groepen na de interventie verminderde, maar dat er geen verschil gevonden werd in de vooruitgang tussen de groepen.
Gezien de grote heterogeniteit tussen de studies wat betreffend de gekozen uitkomstmaten en timing van de metingen, de soms wat beperkte rapportage van de resultaten (geen spreidingsmaat weergegeven in de studie van Boshuizen (2017) en Demmy (2012) is besloten om geen meta-analyse uit te voeren.
3. Opnameduur
Boshuizen (2017) rapporteerde dat de duur van de ziekenhuisopname voor de gealloceerde behandeling significant langer was voor de talkpleurodes (mediaan talkpleurodese: 4 dagen, mediaan verblijfsdrain: 0 dagen, p<0,0001). Ook het totale aantal ziekenhuisdagen sinds randomisatie was groter in deze groep (mediaan talkpleurodese: 6, mediaan verblijfsdrain: 3 dagen, p=0,002).
Davies (2012) rapporteerde een kortere opnameduur voor de patiënten die een verblijfsdrain kregen (mediaan=0, IQR=0 tot 1) dan voor patiënten behandeld met pleurodese (mediaan=4, IQR=2 tot 6; verschil tussen de groepen: -3,5 dagen, 95%BI=-4,8 tot -1,5). De totale draingerelateerde opnameduur (initiële drainplaatsing en eventuele draingerelateerde complicaties) was ook significant korter voor de verblijfsdrain dan wanneer patiënten werden behandeld met pleurodese (verblijfsdrain: 1 dag, IQR= 0 tot 3, pleurodese: 4,5 dagen, IQR=2,5 tot 7,5, p<0,001).
Demmy (2012) heeft geen data over de opnameduur gerapporteerd.
De patiënten met een verblijfsdrain in de studie van Putman (1999) hadden een significant kortere mediane opnameduur (1,0 dag) dan de patiënten die een pleurodese hadden gehad (6,5 dag, p<0,001).
Thomas (2017) rapporteerde dat patiënten die voor een verblijfsdrain hadden geloot significant minder lang in het ziekenhuis opgenomen waren geweest dan de patiënten die hadden geloot voor de pleurodese (totale aantal dagen opgenomen, mediaan (IQR) verblijfsdrain: 12,7 (13,4) dagen, pleurodese: 16,3 (15,2) dagen, geschat verschil (95%BI): 2,92 (0,43 tot 5,84). Er was ook een significant verschil in effusie gerelateerde ziekenhuisopname (geschat verschil (95%BI): 2,06 (1,53 tot 2,58)), waarbij er een verschil was in de mediane opnameduur voor de gealloceerde behandeling (geschat verschil (95%BI): 2,09 (1,78 tot 2,39)), maar niet tussen de latere effusiegerelateerde opnameduur (geschat verschil (95%BI): -0,18 (-0,41 tot 0,01)).
Gezien de studies over het algemeen medianen hebben gerapporteerd, hebben we ervoor gekozen om de resultaten van de verschillende studies niet te poolen.
4. Kosten
Boshuizen (2017); Demmy (2012); Putman (1999) en Thomas (2017) hebben geen data over kosten gerapporteerd.
Er werd door Penz (2014) geen verschil in gemiddelde totale kosten gevonden tussen de verblijfsdrain ($4993) en talkpleurodese ($4581), gemiddeld verschil: $+401, 95BI=-$1387 tot $2261. De sensitiviteitsanalyses lieten zien dat bij patiënten die binnen 14 weken overleden, het plaatsen en draineren via een verblijfsdrain, significant goedkoper was ($2944 versus $4671, gemiddeld verschil: -$1719, 95%BI=-$3376 tot -$85, en dat wanneer wordt aangenomen dat patiënten met een verblijfsdrain 2 uur verpleging per week nodig hebben, een verblijfsdrain significant duurder is dan talkpleurodese ($6807 versus $4638, gemiddeld verschil=$2130, 95%BI=$205 tot $4184). De resultaten van de kosteneffectiviteitsanalyse (Olfert, 2017) laten eenzelfde beeld zien: Er waren geen significante verschillen tussen de groepen in kosten, utiliteitscores en QALY’s. Behandeling met een verblijfsdrain was kosteneffectief; de estimated incremental cost-effectiveness ratio (ICER) voor de verblijfsdrain ten opzichte van talkpleurodese was $10870 per gewonnen QALY, maar er was sprake van een grote onzekerheid over deze schatting. De ICER was -$79303/QALY voor patiënten met een overleving<14 weken en $77213/QALY als men uit gaat dat patiënten met een verblijfsdrain 2 uur verpleging per week nodig hebben.
5. Complicaties (infecties, bloedingen, pijn en entmetastasen)
Boshuizen (2017) gaf aan dat er geen significante verschillen waren tussen de groepen, er waren echter ook weinig adverse events in deze studie (zeven in de groep behandeld met talkpleurodese en acht in de groep behandeld met een verblijfsdrain).
Davies (2012) rapporteerde adverse events bij 40% van de patiënten met een verblijfsdrain en bij 13% in de pleurodese patiënten, een significant verschil (OR=4,7, 95%BI=1,75 tot 12,60). Het aantal SAE’s verschilde niet significant tussen de groepen (verblijfsdrain, n=9; pleurodese, n=5, OR=2,1, 95%BI=0,57 tot 7,71). Het is onduidelijk hoe deze statistische analyses zijn uitgevoerd. De SAE’s waren pleurale infecties (verblijfsdrain n=5, pleurodese n=1), cellulitus (verblijfsdrain n=1), twee geloketteerd vocht waarvoor behandeling met fibrinolytica (beide groepen n=1), blokkade van de katheter (beide groepen n=1), pijn (verblijfsdrain n=1), subcutaan emfyseem (pleurodese n=1) en luchtlek (pleurodese n=1).
Demmy (2012) rapporteerde dat er iets meer complicaties waren in de groep waarbij een verblijfsdrain werd geplaatst. De data van zes patiënten die geëxcludeerd waren uit de overige analyses werden hier wel meegenomen. Eén patiënt met verblijfsdrain is overleden aan ARDS. In deze groep was er verder één graad 4 SAE (myocardinfarct) en zes graad drie SAE’s (pijn n=3, leukocytose, wondinfectie en neutropenie). Er waren twee graad 4 SAE’s in de talkpleurodesegroep (vermoeidheid en dyspneu) en één graad drie SAE (dyspneu). Er zijn geen resultaten van statistische analyses gerapporteerd.
Putman (1999) heeft onderscheid gemaakt tussen de morbiditeit op korte termijn (in het ziekenhuis) en de morbiditeit tijdens de gehele follow-up. Er waren tijdens de ziekenhuisopname adverse events bij zes van de 43 pleurodeses (koorts n=2, ernstige pijn waarvoor PCA n=2, hydropneumothorax n=1, verstopte drain n=1) en tien van de 96 verblijfsdrains (koorts n=3, pneumothorax n=3, verkeerde plaatsing katheter n=2, re-expansie longoedeem n=1, respiratoir falen ten gevolge van oversedatie n=1). Putman, 1999 rapporteerde ook de AE’s gemeld in de 90 dagen follow-up periode: Verblijfsdrain: pleurale infectie n=1, cellulitis n=6, entmetastase n=3, pijn tijdens drainage n=7; pleurodese: pijn n=1. Er zijn geen statistische analyses uitgevoerd.
Thomas (2017) rapporteerde dat er in de trial vier SAE’s zich voor hadden gedaan, één in de verblijfsdraingroep en drie in de pleurodesegroep. Bij tweeëntwintig patiënten (30%) in de verbijfscathetergroep en 13 patiënten in de pleurodesegroep (18%) was er sprake van ten minste één adverse event.
Gezien de heterogeniteit waarmee deze uitkomstmaat is bepaald is er besloten om geen meta-analyse uit te voeren.
6. Re-interventies
Boshuizen (2017) rapporteerde dat het aantal patiënten met tenminste één re-interventie niet verschilde tussen de groepen (15 van de 48 in de pleurodesegroep en zeven van de 46 patiënten met een verblijfsdrain, p=0,09). Het gemiddelde aantal re-interventies per patiënt was 0,5 voor de patiënten behandeld met talkpleurodese en 0,2 voor de patiënten met behandeld met een verblijfsdrain, p=0,05.
Davies (2012) rapporteerde dat 22% van de patiënten behandeld met pleurodese en 6% van de patiënten met een verblijfsdrain verdere pleurale interventies ondergingen, en dit verschil is significant (OR=0,21, 95%BI=0,04 tot 0,86).
Demmy (2012) heeft geen data over re-interventies gerapporteerd. Uit het artikel blijkt dat er een groter gedeelte van de patiënten waarbij een verblijfsdrain was geplaatst 30 dagen na de ingreep in leven en zonder recidief was (verblijfsdrain: 23 van de 28, 82% versus 15 van de 29, 52%; p=0,024).
Putman (1999) heeft het aantal (%) late recidieven gerapporteerd: bij 6 van de 28 patiënten (21%) behandeld met pleurodese en 12 van de 91 verblijfsdrain-patiënten (13%) is tijdens de studie een laat recidief vastgesteld. Het verschil was niet significant, p=0,631.
Thomas (2017) rapporteerde dat drie patiënten (4,1%) die voor de verblijfsdrain hadden geloot en 16 patiënten in de pleurodesegroep verdere pleurale interventies hebben ondergaan (p=.001, verschil in verhoudingen: 0,18, 95%BI: 0,08 tot 0,29).
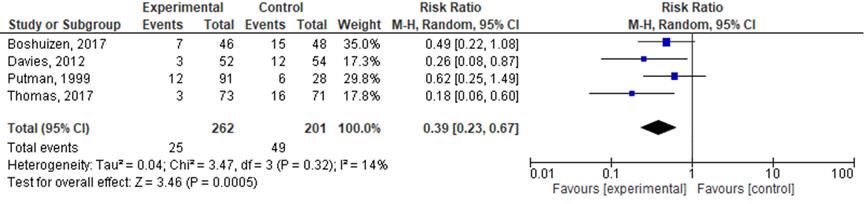
De resultaten van Boshuizen (2017); Davies (2012); Putman (1999) en Thomas (2017) zijn gepoold. De resultaten zijn weergegeven in figuur 1. Een verblijfsdrain zorgt voor een vermindering met een factor 0,39 in het aantal re-interventies (95%BI=0,23 tot 0,67).
Figuur 1 Effect van verblijfsdrain ten opzichte van pleurodese bij patiënten met maligne pleuravocht met of zonder trapped lung op het aantal re-interventies.
Bewijskracht van de literatuur
RCT’s beginnen hoog. De bewijskracht voor de uitkomstmaat kwaliteit van leven is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (studies waren niet geblindeerd, grote loss to follow-up, het niet rapporteren van de uitkomsten in Demmy (2012)). De uiteindelijke bewijskracht is laag.
De bewijskracht voor de uitkomstmaat dyspneu is met twee niveaus verlaagd gezien de beperkingen in de onderzoeksopzet (studies waren niet geblindeerd, grote loss to follow-up op de lange termijn follow-up metingen, beperkte rapportage van de resultaten bij Boshuizen (2017) en Demmy (2012)). De uiteindelijke bewijskracht is laag.
De bewijskracht voor de uitkomstmaat opnameduur is met twee niveaus verlaagd gezien de beperkingen in de onderzoeksopzet (grote loss to follow-up, geen blindering), en de imprecisie (het is niet mogelijk is om de resultaten van de individuele studies te poolen, hierdoor kan het daadwerkelijke effect niet bepaald worden). Het uiteindelijke niveau is laag.
De bewijskracht voor de uitkomstmaat kosten is met drie niveaus verlaagd gezien de beperkingen in de onderzoeksopzet in de onderliggende RCT (grote loss to follow-up, geen/beperkte blindering), de imprecisie (onzekerheid over de schatting van het effect en de inclusie van een enkele studie met een beperkt aantal patiënten) en de indirectheid (Het is de vraag in hoeverre de resultaten van een Britse studie waarbinnen is uitgegaan van het perspectief van de zorgbetaler, generaliseerbaar zijn tot de Nederlandse situatie). De uiteindelijke bewijskracht is zeer laag.
De bewijskracht voor de uitkomstmaat (serious) adverse events is met drie niveaus verlaagd gezien de heterogeniteit tussen de gerapporteerde uitkomstmaten en de gevonden resultaten, en de imprecisie (klein aantal cases, studies niet gepowerd om deze uitkomstmaat te bepalen). Het uiteindelijke niveau is zeer laag.
De bewijskracht voor de uitkomstmaat re-interventies is met 2 niveaus verlaagd gezien de beperkingen in de onderzoeksopzet (grote loss to follow-up, geen blindering) en de imprecisie (klein aantal cases). De uiteindelijke bewijskracht is laag.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat zijn de gunstige en nadelige effecten van een verblijfsdrain in vergelijking met pleurodese bij patiënten met maligne pleuravocht met of zonder trapped lung?
P: patiënten met maligne pleuravocht met of zonder trapped lung;
I: verblijfsdrain;
C: (Talk)pleurodese;
O: kwaliteit van leven, dyspneu, opnameduur, kosten, complicaties, re-interventies.
Relevante uitkomstmaten
De werkgroep achtte kwaliteit van leven en dyspneu voor de besluitvorming cruciale uitkomstmaten; en opnameduur, kosten, complicaties, re-interventies voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde de uitkomstmaat complicaties als het aantal en type AE’s en SAE. Onder re-interventies worden ook de late recidieven meegenomen. De overige uitkomstmaten werden niet a priori gedefinieerd, de werkgroep hanteerde de in de studies gebruikte definities.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 6 januari 2017 met relevante zoektermen gezocht naar systematische reviews, gerandomiseerd gecontroleerd onderzoek en observationeel onderzoek. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 213 treffers op. In het najaar 2017 waren de resultaten van Boshuizen, 2017 ook gepubliceerd, en is er besloten om een update uit te voeren van de search. Deze update is op 1 november 2017 uitgevoerd en leverde 40 aanvullende treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: systematische reviews (gezocht in ten minste twee databases, gedetailleerde zoekstrategie beschikbaar en risk of bias beoordeling) of gerandomiseerde of quasi-gerandomiseerde trials waarin patiënten met maligne pleuravocht met of zonder trapped lung participeerden en waarin een vergelijking werd gemaakt tussen een verblijfsdrain en pleurodese. Daarnaast moest ten minste één van bovenstaande uitkomstmaten zijn geïncludeerd.
Op basis van titel en abstract werden in eerste instantie 19 studies voorgeselecteerd.
In januari 2018 werden de laatste studies opgevraagd, en bleek één van deze 19 studies (Thomas, 2017) een abstract voor een congres te zijn waar inmiddels ook een recent gepubliceerd artikel van beschikbaar was. Dit artikel is toen ook opgevraagd (totaal komt daarmee op 20). Na raadpleging van de volledige tekst, werden vervolgens 13 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en vijf studies, die waren beschreven in zeven publicaties, definitief geselecteerd.
Vijf gerandomiseerde gecontroleerde studies konden worden opgenomen in deze literatuuranalyse. Hiernaast zijn nog twee publicaties geïncludeerd waarin de resultaten met betrekking tot de kosten en de kosteneffectiviteit van één van de geïncludeerde gerandomiseerde studies werden gepresenteerd. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Referenties
- Bhatnagar R, Laskawiec-Szkonter M, Piotrowska HE, Kahan BC, Hooper E, Davies HE, Harvey JE, Miller RF, Rahman NM, Maskell NA. Evaluating the efficacy of thoracoscopy and talc poudrage versus pleurodesis using talc slurry (TAPPS trial): protocol of an open-label randomised controlled trial. BMJ Open. 2014 Nov 26;4(11):e007045. doi: 10.1136/bmjopen-2014-007045. PubMed PMID: 25428632; PubMed Central PMCID: PMC4248086.
- Bhatnagar R, Keenan EK, Morley AJ, et al. Outpatient Talc Administration by Indwelling Pleural Catheter for Malignant Effusion. N Engl J Med. 2018;378(14):1313-1322. doi: 10.1056/NEJMoa1716883. PubMed PMID: 29617585.
- Boshuizen RC, vd Noort V, Burgers JA, et al. A randomized controlled trial comparing indwelling pleural catheters with talc pleurodesis (NVALT-14). Lung Cancer. 2017;108:9-14.
- Boshuizen RC, Onderwater S, Burgers SJ, et al. The use of indwelling pleural catheters for the management of malignant pleural effusion--direct costs in a Dutch hospital. Respiration. 2013;86(3):224-8. doi: 10.1159/000351796. Epub 2013 Jul 23. PubMed PMID: 23887083.
- Burgers JA, Kunst PW, Koolen MG, et al. Pleural drainage and pleurodesis: implementation of guidelines in four hospitals. Eur Respir J. 2008 Nov;32(5):1321-7. doi: 10.1183/09031936.00165607. Epub 2008 Jul 9. PubMed PMID: 18614555.
- Clive AO, Jones HE, Bhatnagar R, et al. Interventions for the management of malignant pleural effusions: a network meta analysis. CochraneDatabase Syst Rev. 2016 May 8;(5):CD010529. doi: 10.1002/14651858.CD010529.pub2. Review. PubMed PMID: 27155783.
- Davies HE, Mishra EK, Kahan BC, et al. Effect of an indwelling pleural catheter versus chest tube and talc pleurodesis for relieving dyspnea in patients with malignant pleural effusion: the TIME2 randomized controlled trial. Jama. 2012;307(22):2383-9.
- Demmy TL, Gu L, Burkhalter JE, et al. Optimal management of malignant pleural effusions (results of CALGB 30102). J. 2012;10(8):975-82.
- Fysh ETH, Tremblay A, Feller-Kopman D, et al. Clinical outcomes of indwelling pleural catheter-related pleural infections:an international multicenter study. Chest. 2013;144(5):1597-1602. doi: 10.1378/chest.12-3103. PubMed PMID: 23828305.
- Fysh ETH, Waterer GW, Kendall PA, et al. Indwelling pleural catheters reduce inpatient days over pleurodesis for malignant pleural effusion. Chest. 2012;142(2):394-400. doi: 10.1378/chest.11-2657. PubMed PMID: 22406960.
- Morel A, Mishra E, Medley L, et al. Chemotherapy should not be withheld from patients with an indwelling pleural catheter for malignant pleural effusion. Thorax. 2011;66(5):448-9. doi:10.1136/thx.2009.133504. Epub 2010 Sep 29. PubMed PMID: 20880866.
- Olden AM, Holloway R. Treatment of malignant pleural effusion: PleuRx catheter or talc pleurodesis? A cost-effectiveness analysis. J Palliat Med. 2010;13(1):59-65. doi: 10.1089/jpm.2009.0220. PubMed PMID: 19839739; PubMed Central PMCID: PMC2939851.
- Olfert JA, Penz ED, Manns BJ, et al. Cost-effectiveness of indwelling pleural catheter compared with talc in malignant pleural effusion. Respirology. 2017;22(4):764-770. doi: 10.1111/respectievelijk12962. Epub 2016 Dec 16. PubMed PMID: 27983774.
- Penz ED, Mishra EK, Davies HE, et al. Comparing cost of indwelling pleural catheter versus talc pleurodesis for malignant pleural effusion. Chest. 2014;146(4):991-1000.
- Putnam JB Jr, Light RW, Rodriguez RM, et al. A randomized comparison of indwelling pleural catheter and doxycycline pleurodesis in the management of malignant pleural effusions. Cancer. 1999;86(10):1992-9.
- Puri V, Pyrdeck TL, Crabtree TD, et al. Treatment of malignant pleural effusion: a cost-effectiveness analysis. Ann Thorac Surg. 2012;94(2):374-9; discussion 379-80. doi: 10.1016/j.athoracsur.2012.02.100. Epub 2012 May 10. PubMed PMID: 22579398; PubMed Central PMCID: PMC3783957.
- Sabur NF, Chee A, Stather DR, et al. The impact of tunneled pleural catheters on the quality of life of patients with malignant pleural effusions. Respiration.2013;85(1):36-42. doi: 10.1159/000342343. Epub 2012 Nov 13. PubMed PMID:23154202.
- Thomas R, Fysh ETH, Smith NA, et al. Effect of an Indwelling Pleural Catheter vs Talc Pleurodesis on Hospitalization Days inPatients With Malignant Pleural Effusion: The AMPLE Randomized Clinical Trial.JAMA. 2017;318(19):1903-1912. doi: 10.1001/jama.2017.17426. PubMed PMID:29164255.
- Wahidi MM, Reddy C, Yarmus L, et al. Randomized Trialof Pleural Fluid Drainage Frequency in Patients with Malignant Pleural Effusions. The ASAP Trial. Am J Respir Crit Care Med. 2017 Apr 15;195(8):1050-1057. doi: 10.1164/rccm.201607-1404OC. PubMed PMID: 27898215.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Boshuizen, 2017 |
Type of study: RCT
Setting: multicenter
Country: the Netherlands
Source of funding: Nuts-OHRA foundation and the Dutch Cancer Society. Materials were provided by Rocket Medical. This latter company had no role in the design of the study. |
Inclusion criteria: - patients with histologically or cytologically confirmed MPE. - patients with a progressive malignancy and pleural effusion after exclusion of alternative diagnoses.
Exclusion criteria - previous treatment with either talc pleurodesis or indwelling pleural catheter for ipsilateral MPE. - impaired immunity or thrombocytopenia.
N total at baseline Intervention: 48 Control: 46
Important prognostic factors: Median age (range): I: 60 (35-81) C:64 (30-84)
Sex: I: 56% M C: 41% M
Diagnosis: I:lung 33%, breast 21% C:lung 33%, breast 22%
Groups comparable at baseline? There were less females in the intervention groups.
|
Talc pleurodesis. Patients were admitted to the hospital. |
Indwelling pleural catheter, inserted on an outpatient basis. Instruction to drain on as-needed basis. |
6 weeks, 3 and 6 months. The Modified Borg Scale scores were assessed daily in the first two weeks after randomization.
Registration: n=154 Randomized: n=94
Reasons for loss-to-follow-up according to the consort diagram for the per protocol analysis (talk pleurodeses: n=13 evaluable, IPC: n=18 evaluable). I: n=35 (72%), reasons:
C: n=28 (61%), reasons:
40 patients were evaluable in de intention to treat analysis (20:20). Per protocol analysis: excludes patients who had no talk instilled or underwent an ipsilateral re-intervention within 6 weeks.
|
Not reported
Modified Borg Scale at rest at 6 weeks I: 2.2 C:1.6 P=0.25
Modified Borg Scale during exercise at 6 weeks I: 2.1 C:1.8 P=0.44
“improvement in dyspnea wasn’t different between both treatments at 3 and 6 months”
Defined as length of hospital admission during randomized treatment I: 4 C:0 P<0.0001
Defined as length of total hospitalization I: 6 C:3 P<0.002
Not reported
I: Pain (1), dyspnea (2), infection (2), cardiovascular events (1), general malaise (1) C: Pain (2), dyspnea (3), infection (2), cardiovascular events (1), general malaise (0).
There were no differences between the groups.
6. Re-interventions Defined as the mean number of re-interventions, per patient I: 0.5 C:0.2 P<0.05
Defined as the number of patients with >1 re-intervention I:15/45 C:7/46 P=0.09 |
At registration patients were treated with therapeutic thoracentesis. Patients were randomized when fluid recurred within 6 months.
No significant difference between adverse events in the groups were found, but the numbers are very small.
Quality of life among the outcome measures in the trial register, results published. |
|
Demmy, 2012 |
Type of study: RCT
Setting: multicenter
Country: USA
Source of funding: NCI. The authors have disclosed that they have no financial relationships. |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 33, 28 included in the analyses. Control: 34, 29 included in the analyses
Important prognostic factors: age ± SD: I: 64±NR C:60±NR
Sex: I: 61% M C: 55% M
Diagnosis: I:lung 68%, breast 11% C:lung 59%, breast 4%
Groups comparable at baseline? Yes |
PleurX Catheter, daily drainage.
|
Talc pleurodesis.
|
Length of follow-up: 30 and 60 days
Loss-to-follow-up: Intervention:5 (15%) Reasons: not clear
Control: 5 (15%) Reasons: not clear
In the text it is stated that nine patients were excluded from analysis (n=6 bilateral effusions, n=3 did not start protocol treatment due to other disease complications). However according to figure 1, 10 patients were excluded.
Incomplete outcome data: See loss-to-follow-up section
|
Data was not reported
I: 8.5 C: 6.1 P=0.047. Analysis adjusted for baseline dyspnea score, initial drainage, gender, inpatient status and patients performance status at baseline.
Not reported
Not reported
I: one acute respiratory distress syndrome related death (n=1), myocardial infarction (n=1), pain (n=3), leucocytosis (n=1), wound infection (n=1), neutropenia (n=1) C: fatigue (n=1), dyspnea (n=2, one grade 4).
6. Re-interventions Defined as the number of patients alive without effusion recurrences within 30 days, n(%) I: 23 (82) C: 15 (52) P=0.0239
|
Due to slow accrual, the study was closed early. The original aim was to include 530 patients. Patients refused to be randomized.
Not all patients received the allocated therapy:
|
|
Davies, 2012; Penz, 2014 Olfert, 2017 |
Type of study: RCT, cost-effectiveness study
Setting: multicenter
Country: England
Source of funding: six of the authors of the publication by Davies, 2012 had relations with the pharmaceutical industry. The study was supported by non-commercial grants, the IPC and drainage bottles were provided by Rocket Medical. |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 52 Control: 54
Important prognostic factors: For example age ± SD: I: 67 ± 11 C: 67 ± 12
Sex: I: 44% M C:43% M
Cancer diagnosis: I: 31%breast, 17% lung C: 20% breast, 30% lung
Groups comparable at baseline? Yes, although there were some small differences between the groups in dyspnea (I:62, C:55), chest pain (I:29, C:22) and diagnosis.
|
Placement of an indwelling pleural catheter, initial large volume drainage and home drainage. The advice was to drain 3x per week, or as required. |
Talc slurry pleurodesis Patients with trapped lung (<50% of lung surface in apposition of the chest wall) did not undergo treatment, but remained in the study. |
Length of follow-up: 12 months. Median survival was 200 days in the control group and 153 in the intervention group.
Loss-to-follow-up: 5 patients in the intervention group and 15 patients in the control group died during the first 42 days. 86 patients were alive at 6 weeks follow-up, 69 at 3 months and 54 at 6 months.
Incomplete outcome data: For the primary outcome (VAS dyspnea) in the first 42 days Intervention: n=3 (5.8%) Reasons: no recorded VAS scores Control: n=7 (12.9%) Reasons: no recorded VAS scores
The VAS scores for dyspnea was available for 62 patients at 6 weeks, 57 at 3 months and 43 at six months
Data concerning the length of hospital admission was available for I: 51 patients (n=1 lack of information) C: 48 patients (n=3 lack of information, n=3 died while being hospitalized_
Data concerning QOL was available in 69 patients at 6 weeks, 56 at 3 months and 41 at 6 months.
Costs data were missing for 10 patients (18.5%) in the control group and 23 patients (44%) in the intervention group.
EQ-5D-3L utility scores were missing in: I: Baseline: 2% 14 weeks:11% 26 weeks:24% 1 year:28% C: Baseline: 2% 14 weeks:22% 26 weeks:25% 1 year:41%
|
All analyses were adjusted for performance status and mesothelioma.
Assessed using the EORTC QLQ-C30 global health status scale, mean (SD), at 6 weeks: I: 59.0 (95%CI=51.8;66.3) C: 48.3 (95%CI=50.1;56.5) Difference: 4.8 (95%CI=-1.6;11.2, p=0.14) “there was no significant difference in the quality of life at any time point”
Assessed using a 100 mm VAS. 0= no breathlessness, 100=maximal breathlessness First 42 days, mean: I: 24.7 (95%CI=19.3-30.1) C: 24.4 (95%CI=19.4-29.4) Difference, also adjusted for baseline VAS: 0.16 (95%CI=-6.82;7.15, p=0.96).
Difference at 3 months: -8.9 (95%CI=1.7;-19.4) Difference at 6 months: -14.0 (95%CI=-25.2;-2.8)
Measured as the nights spend in the hospital from randomisation to discharge, median (OQR) I: 0 (0;1) C: 4 (2;6) Difference: -3.5 (95%CI:-4.8;-. 1.5, p<0.001)
Measured as the length of the hospital admission for drainage or drain related complications over 12 months, median (QOR): I: 1 (0;3) C: 4.5 (2.5;7.5) Difference: p<0.01
Total mean costs (SD): I: $4993 (5529) C:$4581 (4359) Difference: +$401 (95%CI=-1387;2261)
Mean costs for patients who survived >14 weeks: I: $5705 (1122) C:$4625 (1085) Difference: +$1098 (95%CI=-1418;4010)
Mean costs for patients who survived <14 weeks: I: $2944 (656) C:$4671 (642) Difference: -$1719 (95%CI=-3376;-85)
If it is assumed that IPC requires 2h nursing care per week, the costs are: I: $6807 (6225) C:$4638 (4411) Difference: +$2130 (95%CI=-205;4184)
Cost-effectiveness Utility scores Baseline, mean (SD): I: 0.59 (0.17) C: 0.61 (0.17) P=0.65
Follow-up, mean (SD): I: 0.79 (0.16) C: 0.67 (0.32) P=0.30
1 year, mean QUALY gained (SD): I: 0.35 (0.296) C: 0.33 (0.303) Difference: 0.026 (95%CI:-0.09;0.13), p=0.64 Mean ICER for IPC: $10870/QUALY
Survival <14 weeks QUALY gained I: 0.064 (0.052) C: 0.04 (0.039) Difference: 0.024 (95%CI:-0.005;0.05), p=0.13 Mean ICER for IPC: $ -79303/QUALY
Survival >14 weeks QUALY gained I: 0.495 (0.261) C: 0.539 (0.226) Difference: 0.044 (95%CI:-0.159;0.076), p=0.48 Mean ICER for IPC: $ -22299/QUALY
Nursing care 2 h per week I: 0.354 (0.296) C: 0.328 (0.303) Difference: 0.026 (95%CI:-0.085;0.134), p=0.64 Mean ICER for IPC: $ 77213/QUALY
Measured as the number of patients with AE’s I: 21 (40%) C: 7 (13%) OR=4.7, 95%CI=1.75;12.6, p=0.002
Number of patients with SAE’s I: 9 (17%) C: 5 (9%) OR=2.1, 95%CI=0.57;7.71, p=0.26
Serious pleural infections I: n=5 C: n=1
Serious cellulitis I: 1 C: 0
Chest pain requiring admission I: 1 C: 0
Symptomatic fluid loculation requiring fibronolytics I: 1 C: 1
Catheter blockage: I: 1 C:1
Other: I:0 C:2
Defined as the further pleural procedures: I: n=3 (6%) C: n=12 (22%) OR =0.21 (95%CI=0.04;0.86, p=0.03) |
Outcomes on the VAS scales were analysed using a mixed-effects linear regression model.
Costs (Penz, 2014) Costs were calculated from a health-care payer perspective. The following categories were included: initial intervention procedures and hospital length of stay, resources related to ongoing drainage, and adverse events. Costs were inflated to 2013 values. Missing data was imputed.
Cost-effectiveness (Olfert, 2017) Cost-effective analysis was performed from a healthcare payer perspective using costs and utility scores derived from the EQ-5D-3L data. QUALYs were determined using the survival and utility scores. Costs were inflated to 2014 values.
Cost-effectiveness = difference in costs between the groups/difference in QUALYs between the groups. A willingness to pay threshold of $50000 was used.
There seems a small error in the article: the mean QLQ-C30 score for the control condition is situated the 95%CI. |
|
Putman, 1999 |
Type of study: RCT
Setting: multicenter
Country: USA
Source of funding: Denver Biomaterials |
Inclusion criteria:
Exclusion criteria:
Patients could receive systemic chemotherapy or mediastinal radiation, but no intrapleural chemotherapy or radiation therapy to the ipsilateral chest.
N total at baseline: Intervention: 99 Control: 45
Important prognostic factors: age ± SD: I: 60.3 ±13.6 C:63.4±13.6
Sex: I: 42% M C:42% M
Cancer diagnosis: I: lung: 39%, breast: 25% C:lung: 42%, breast: 31%
Groups comparable at baseline? Yes, although there were more right-sided effusions (61% vs 39%) in the intervention group and the initial size of the effusion was larger in the intervention group (p=0.031)
|
Placement of an Indwelling pleural catheter and initial drainage of 1500mL. Hereafter 1000mL was drained every 8h until drainage was completed. Patients were instructed to perform the drainage every other day.
|
Doxycycline pleurodesis via tube thoracostomy
|
Length of follow-up: 12 weeks. Median survival was 90 days for the patients in the control group and 87 days in de intervention group.
Loss-to-follow-up: Intervention: 5 patients were withdrawn after randomisation. Reasons: Radiographs were misinterpreted (n=2), loculated effusion (n=1), protocol violations (n=2),
Control: 4 patients were withdrawn after randomisation Reasons: Patient treated with radiotherapy instead of a chest tube (n=1), patient withdrew from the study after being randomized to the control condition (n=1), patient mistakenly given talc (n=1), patient received second administration of doxycycline before justified (n=1). One patient died 3 days after chest tube insertion.
Incomplete outcome data: See outcome measure
|
Assessed with Dyspnea component of the Guyatt Chronic Respiratory Questionnaire (mean change from baseline, (SD), (number of patients evaluated) I: 30 days: 5.2 (7.5) (59) 60 days: 6.5 (8.5) (44) 90 days: 7.2 (7.1) (33)
C: 30 days: 5.5 (8.7) (27) 60 days: 7.8 (7.1) (20) 90 days: 6.3 (8.2) (21) The improvements were similar in both groups.
Assessed with the Modified Borg scale score for dyspnea (0-10) at rest and after walking 100 feet
At rest, mean (SD), (number of patients evaluated) I: 30 days: 0.9 (1.8) (62) 60 days: 1.3 (1.2) (49) 90 days: 0.4 (2.1) (35)
C: 30 days: 0.5 (2.1) (28) 60 days: 1.3 (1.4) (20) 90 days: 0.4 (1.9) (21) No significant differences between the groups were found.
After exercise (mean (SD)) I: 30 days: 2.2 (2.4) (60) 60 days: 2.3 (2.5) (46) 90 days: 2.2 (2.3) (34)
C: 30 days: 1.0 (2.4) (26) 60 days: 1.6 (2.3) (20) 90 days: 1.3 (2.3) (20) There was a significant greater improvement in the indwelling catheter group at 30 days (p=0.05). No significant differences were found between the groups on the other time points.
Admission, median, days I: 1.0 C: 6.5 P<0.001
Not reported
During follow-up Pleural infection, n (%) I: 1 (1) C: 0 (0)
Cellulitis, n (%) I: 6 (7) C: 0 (0)
Tumor seeding of catheter, tract, n(%) I: 3 (3) C: 0 (0)
Pain, n I: 7 C: 1
In-hospital morbidity I: fever (n=3), pneumothorax (n=3), re-expansion pulmonary edema (n=1), misplacement of catheter (n=2), re-expansion pulmonary edema (n=1), hypercapnic respiratory failure secondary to over-sedation (n=1) C: fever (n=2), severe pain requiring PCA (n=2), hydropneumothorax (n=1), occluded chest tube requiring replacement (n=1)
Defined as the number of late failures: Recurrence of effusion after an initially successful pleurodesis /recurrence of effusion after initial successful control (intervention group), n (%) I: 12 (13%) C: 6 (21%) P=0.631 |
The patients in the control group had a minimum hospitalization of 3 days, while patients in the intervention group could be discharged within 16-24h.
Multiple imputation of the missing data in QoL and dyspnea outcomes did not change the outcome of the study.
The authors conclude that the difference in hospitalization was of uncertain clinical importance.
The authors did not proceed with the cost-effectiveness analysis, as these costs vary worldwide, and also within the participating centers. |
|
Thomas, 2017 |
Type of study: RCT
Setting: multicenter
Country: Australia, New Zealand, Singapore, and Hong Kong
Source of funding: likely non-commercial. “The funders had no role in the design and conduct of the study; collection, management, analysis and interpretation of the data; preparation, review, or approval of the manuscript; and decision to submit the manuscript for publication” Some of the authors served on advisory boards of pharmaceutical companies or medical technology companies |
Inclusion criteria: - adults with malignant pleural effusions with histocytological confirmation of pleural malignancy or recurrent exudative pleural effusions with no alternative cause in the setting of histocytologically proven extrapleural cancer.
Exclusion criteria: - age younger than 18 years - effusion less than 2 cm at maximum depth on imaging, - expected survival of less than 3 months - chylotholrax - previous lobectomy or pneumonectomy on the side of effusion - previous attempted pleurodesis - pleurodesis - pleural infection - hypercapnic ventilatory failure - blood leukocyte count less than 1000/µL - pregnant or lactating women - irreversible bleeding diathesis - visual impairment
N total at baseline: Intervention: 74 Control: 72
Important prognostic factors2: age (range): I: 71.0 (38-92) C:70.5 (43-90)
Sex: I: 53% M C: 60% M
Cancer diagnosis: I: lung: 26%, breast: 19%, mesothelioma: 27% C:lung: 40%, breast: 6%, mesothelioma: 25%
Groups comparable at baseline? Some difference in % lung and breast cancer, but overall fairly similar.
|
Indwelling pleural catheter insertion, same day or overnight-stay procedure unless there were other medical reasons necessitating continual hospitalization. Drainage were performed by caregivers or nurses, guided by symptoms of patients. |
Tube thoracostomy and instillation of talc slurry as per routine practice. |
12 months
Two patients withdraw before receiving the allocated intervention, one in each group. Data of 144 patients were included in the intention-to-treat analyses.
The hospital admission data was complete (no missings). 19% of the data was missing in QoL and breathlessness scores. |
Assessed using the EQ5D Baseline, estimated mean (95%CI) I: 31.2 (26.7;35.7) C: 32.3 (27.8;36.8)
30d after intervention estimated mean (95%CI) I: 35.2 (30.6;39.8) C: 34.5 (29.8;39.2)
“No significant differences were found in the magnitude of QoL improvement derived from indwelling pleural catheter treatment or pleurodesis”.
Assessed using a 100mm VAS Baseline, estimated mean (95%CI) I: 52.4 (43.4;61.4) C: 56.7 (47.5;65.9)
30d after intervention, estimated mean (95%CI) I: 61.5 (52.2;70.8) C: 67.3 (57.6;77.0)
Assessed using a VAS scale Baseline, estimated mean (95%CI) I: 50.0 (37.2;62.7) C: 52.2 (39.3;63.1)
30 days after procedure, estimated mean (95%CI) I: 69.7 (56.7;82.6) C:72.2 (59.0;85.5)
“No significant differences were found in the magnitude of symptom benefits derived from indwelling pleural catheter treatment or pleurodesis”
Admission Defined as the total number of days spent in hospital from trial intervention to death or up to the 12-month follow-up visit, median (IRQ) I: 10 (3-17) C: 12 (7-21) Estimated difference: 2.92, 95%CI=0.43;5.84)
“The difference in total hospitalization days remained consistent after adjustment for minimization variables and days in trial and fitting center as a random effect during intention-to-treat and per-protocol analyses (Table 2).”
Defined as the total number of days and episodes of hospitalization from pleural effusion-related causes, median (IQR) I: 1 (1-3) C: 4 (3-6) Estimated difference: 2.06, 95%CI=1.53;2.58)
This remained significant when adjusted for minimization variables and days in trial (p<0.001).
The median (IQR) days in hospital for the initial admission (for indwelling pleural catheter insertion or pleurodesis) was shorter for the indwelling pleural catheter group than the pleurodesis group. I:1 (1-2) C: 3 (3-4) Estimated difference: 2.09, 95%CI=1.78;2.39)
“There was no subsequent number of effusion-related hospital days in the indwelling pleural catheter group until death (or 12 months follow-up) (median, 0 days (IQR, 0-1) vs 0 days (IQR, 0-5) for talc group; P=.08; HL estimate, -0.18 days; 95%CI, -0.41 to 0.01).”
Not reported
number of patients experiencing a serious adverse event, n(%) I: 1 (1) C: 3 (4)
Number of patients that experienced at least one adverse event, n(%) I: 22 (30) C: 13 (18)
Defined as the number of patients that required further pleural interventions for ipsilateral fluid, n(%) I: 3 (4.1) C: 16 (22.5) P=0.001, difference in proportions: 0.18, 95%CI=0.08;0.29. |
|
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation |
Bias due to inadequate concealment of allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?
(unlikely/likely/unclear) |
Bias due to loss to follow-up?
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?
(unlikely/likely/unclear) |
|
Boshuizen, 2017 |
Randomization software, 1:1 ratio, stratified for tumor type and WHO performance status. |
unlikely |
Likely |
Likely |
Likely |
Unclear/likely, results for quality of life not published (were mentioned in trial register). Furthermore, no standard deviations provided, which hampers pooling of the results. |
Unclear, loss of follow-up is high, reasons for loss-to-follow up for the per protocol analyses provided. |
unlikely |
|
Demmy, 2012 |
Permuted block randomization, stratified for inpatient status, disease type and current systematic chemotherapy treatment. |
Unlikely |
Likely |
likely |
Likely |
Likely, the results of the QOL questionnaires are not reported. |
Unclear, the reasons for loss-to-follow-up are not reported per groups. Furthermore, only information about survival provided. |
Unclear, not stated |
|
Davies, 2012 |
Minimization, criteria were the tissue type (mesothelioma vs nonmesothelioma) and WHO performance status. Randomisation was carried out by a central telephone randomisation service |
unlikely |
Likely |
Likely |
Likely for PRO’s. Unlikely for SAE’s and costs (blinded independent reviewer) |
Unlikely |
Likely, loss to follow-up is quite high. Mortality rate was high, reasons for loss-to-follow up not further provided. |
Unlikely: “data were analysed on an intention-to-treat basis and all randomized patients in whom an outcome was available were included in the analysis.” |
|
Putnam, 1999 |
Consecutively numbered envelops. Distribution indwelling catheter: doxycycline pleurodese = 2:1 |
Unclear, not clear whether the envelopes were sealed and opaque. |
Likely |
Likely |
Likely |
Unlikely |
Likely. Loss to follow-up was quite high, probably due to a high mortality rate, but the reasons have not been provided. Furthermore, loss to follow-up is higher in the intervention group (65% vs 53%) |
Unclear. “…Only patients who received the appropriate treatment without protocol violation were included” |
|
Thomas, 2017 |
Computer randomization (1:1; in real time). A balance between kept between key prognostic factors (mesothelioma vs nonmesothelioma, known trapped lung vs not) and Australia/New Zealand vs Asian. |
Unlikely |
Likely |
Likely |
Likely |
Unlikely |
Unlikely |
unlikely |
Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Wahidi, 2016 |
Maakt een vergelijking tussen agressieve, dagelijkse drainage via IPC en standaard (om de dag) drainage. Geen pleurodese |
|
Patil, 2016 |
Abstract |
|
Kheir, 2016 |
Systematische review, voldoet op zich aan de inclusiecriteria, maar kijkt alleen naar de uitkomstmaten success rate, reinterventies en complicaties. De geïncludeerde artikelen zijn afzonderlijk geïncludeerd in deze literatuursamenvatting |
|
Clive, 2016 |
Netwerkanalyse, ook veel vergelijkingen geïncludeerd die niet interessant voor de PICO. De twee RCT’s die de PICO beantwoorden zijn afzonderlijk geïncludeerd in deze literatuursamenvatting. |
|
Puri, 2012 |
Kijkt naar de kosteneffectiviteit, maar gaat uit van de resultaten van prospectieve en retrospectieve, waarschijnlijk geen vergelijkende studies. Amerikaanse kostprijzen |
|
Fysh, 2014 |
Geen RCT: “Patients were not randomized but were allowed to choose, in consultation with the attending physician, between IPC and pleurodesis” |
|
Beyea, 2012 |
Lijkt narratieve review, wel search uitgevoerd |
|
Michaud, 2011 |
Abstract |
|
Olden, 2010 |
Kijkt naar de kosteneffectiviteit, maar gebaseerd op voornamelijk retrospectieve studies. Amerikaanse kostprijzen |
|
Walker, 2016 |
Geen RCT “the major limitation of this study is the lack of randomisation” |
|
Freeman, 2013 |
Geen RCT |
|
Putnam, 2000 |
Geen RCT |
|
Thomas, 2017 |
Abstract |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 23-04-2019
Beoordeeld op geldigheid : 09-04-2019
|
Module |
Regiehouder(s) |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn |
Frequentie van beoordeling op actualiteit |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
Verblijfsdrain versus pleurodese |
NVALT |
2018 |
2023 |
Elke 5 jaar |
NVALT |
Mogelijk zou nieuw onderzoek naar de combinatie van verblijfsdrain en talkpleurodese eerdere herziening noodzakelijk maken. |
Voor zover bekend zijn er geen lopende studies die nieuwe inzichten zullen geven in de behandeling van maligne pleuravocht.
Uiterlijk in 2023 bepaalt het bestuur van de Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (http://www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
In deze richtlijn worden aanbevelingen gedaan over diagnostische ingrepen van de pleura, diagnostiek en behandeling van pleura-empyeem, de behandeling van maligne pleuravocht en het uitvoeren van een thoracoscopie. Hiermee wordt een bijdrage geleverd aan een meer eenduidige en doelgerichte behandeling van patiënten met aandoeningen van de pleura. Bovendien kunnen de, door deze richtlijn geïdentificeerde, kennislacunes een aanzet geven tot wetenschappelijk onderzoek om de diagnostiek en behandeling verder te verbeteren.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met aandoeningen van de pleura. Dit betreft voornamelijk longartsen, radiologen, chirurgen, internisten, artsen-microbioloog, pathologen, nucleair geneeskundigen, SEH-artsen, intensivisten, cardiologen, oncologen, huisartsen en verpleegkundigen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2016 een multidisciplinaire werkgroep samengesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten die met aandoeningen van de pleura te maken hebben. De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep:
- dr. J.M.A. Daniels, longarts, werkzaam in het Amsterdam UMC, Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose, voorzitter
- dr. R.C. Boshuizen, arts in opleiding tot specialist longziekten, werkzaam in het Onze Lieve Vrouwe Gasthuis te Amsterdam, Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose (per 1 mei 2019 geregistreerd longarts en werkzaam in het Deventer Ziekenhuis)
- dr. I. Bronsveld, longarts, werkzaam in het Universitair Medisch Centrum Utrecht, Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose
- dr. J.A. Burgers, longarts, werkzaam in het Antoni van Leeuwenhoek te Amsterdam, Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose
- dr. W.A. Draaisma, chirurg, werkzaam in het Jeroen Bosch Ziekenhuis te 's-Hertogenbosch, Nederlandse Vereniging voor Heelkunde
- dr. M. Heusinkveld, arts-microbioloog, werkzaam in de Gelderse Vallei te Ede, Nederlandse Vereniging voor Medische Microbiologie
- dr. J.H. von der Thüsen, klinisch patholoog, werkzaam in het Erasmus Medisch Centrum te Rotterdam, Nederlandse Vereniging voor Pathologie
- drs. H.P.M. Verhees, radioloog, werkzaam in het Catharina Ziekenhuis te Eindhoven, Nederlandse Vereniging voor Radiologie
- dr. E.R. van der Vorm, arts-microbioloog, werkzaam in het Reinier de Graaf Ziekenhuis te Delft, Nederlandse Vereniging voor Medische Microbiologie
- drs. D.N.J. Wyndaele, nucleair geneeskundige, werkzaam in het Catharina Ziekenhuis te Eindhoven, Nederlandse Vereniging voor Nucleaire Geneeskunde
Met ondersteuning van:
- dr. E.M.E. den Breejen, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot september 2017)
- dr. S. Persoon MSc, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Met dank aan:
- M.E. Wessels MSc, Medisch informatiespecialist, Kennisinstituut van de Federatie Medisch Specialisten
- A. Gallmann, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door “belangenverstrengeling” is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten (secretariaat@kennisinstituut.nl).
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Boshuizen |
AIOS longgeneeskunde Arts-onderzoeker thoraxoncologie (AVL) |
Promotieonderzoek naar behandeling van maligne pleuravocht
|
Eerste auteur NVALT14 studie (talkpleurodese vs IPC). Studie gesponsord door NUTS-OHRA, en KWF. Materialen werden verschaft door Rocket medical. |
Geen actie
|
|
Burgers |
Longarts Antoni van Leeuwenhoek Ziekenhuis |
Consultant bij Roche, AstraZeneca en Boehringer Ingelheim. Hiervoor zijn vergoedingen betaald aan het Nederlands Kanker Instituut – Antoni van Leeuwenhoek Ziekenhuis. Geen persoonlijke vergoedingen ontvangen.
Voorzitter van de sectie Asbest-Gerelateerde Aandoeningen van de NVALT (onbezoldigd) -Medisch consulent van de patiëntenvereniging voor Asbestslachtoffers en voor het Instituut Asbestslachtoffers (beide onbezoldigd). |
|
Geen actie De onderwerpen van de consultfuncties vallen buiten de afbakening van de richtlijn. |
|
Bronsveld |
Longarts |
NVALT en ECFS commissies (onbetaald) |
- |
Geen actie |
|
Daniels |
Longarts VUmc |
Lid programmacommissie longartsenweek - Lid sectie pulmonale interventies NVALT - Cursusleider School of Respirology (http://www.bronchoscopy.nl) |
- |
Geen actie |
|
Draaisma |
Oncologisch en longchirurg |
- |
- |
Geen actie |
|
Heusinkveld |
Arts-microbioloog Ziekenhuis Gelderse Vallei, Ede 0.8 FTE Ziekenhuis Rieverenland, Tiel 0.2 FTE |
- |
- |
Geen actie |
|
Van der Vorm |
Arts-microbioloog |
- |
- |
Geen actie |
|
Verhees |
Radioloog |
Lid commissie van beroep NVvR (onbetaald) Bestuurslid thorax sectie NVvR (onbetaald) Docent Oor onderwijs regio zuid NVvR (onbetaald) Lid onderwijscommissie NVvR (onbetaald) Lid sandwichcommissie NVvR (onbetaald) |
- |
Geen actie |
|
Von der Thüsen |
Patholoog, Erasmus MC/MC Haaglanden |
- |
- |
Geen actie |
|
Wyndaele
|
Nucleair geneeskundige, Catharina Ziekenhuis Eindhoven |
|
- |
Geen actie |
|
Persoon |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Gastvrijheidsaanstelling afdeling Revalidatie Academisch Medisch Centrum, Amsterdam, in verband met promotietraject. Project: Physical fitness to improve fitness and combat fatigue in patients with multiple myeloma or lymphoma treated with high dose chemotherapy.
April 2018 t/m augustus2018: Docent Team Technologie, Fontys Paramedische Hogeschool. Begeleiden van studenten bij afstudeerstages. Max 1 dag in de week, betaald. |
Geen, promotieonderzoek werd gefinancierd door KWF, financier had geen invloed op uitkomsten onderzoek of op huidige werkzaamheden. |
Geen actie |
|
Den Breejen |
Senior adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Lid commissie kwaliteitsdocumenten NVOG (onbetaald) Secretaris Commissie richtlijnen fertiliteit (onbetaald) Promovendus thesis shared guideline making in fertility care (richtlijnen en patiëntparticipatie, onbetaald. |
Tool voor patiëntenparticipatie in richtlijnen, maar geen belang in vermarkting, NVOG cie kwaliteitsdocumenten en richtlijnen fertiliteit (reputatiemanagement). Extern gefinancierd onderzoek ZonMW, geen belangen, onafhankelijke financiering. |
Geen actie |
|
Wessels |
Medisch informatiespecialist |
Secretaris Stichting Groene Juliana, onbetaald. |
- |
Geen actie |
Inbreng patiëntenperspectief
Er is binnen deze richtlijn getracht om aandacht te besteden aan het patiëntenperspectief door het organiseren van een focusgroep. De werkgroep heeft voor de werving van patiënten hulp gevraagd aan de patiëntverenigingen Borstkankervereniging Nederland en Longkanker Nederland. Helaas waren er geen aanmeldingen, waardoor de focusgroep niet door kon gaan. De conceptrichtlijn is ter commentaar voorgelegd aan de Patiëntenfederatie Nederland en aan Longkanker Nederland (via Patiëntenfederatie Nederland).
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren, die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. De implementatietabellen zijn te vinden bij de aanverwante producten. De werkgroep heeft tevens een interne kwaliteitsindicator ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken (zie Indicatorontwikkeling).
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door NVALT, NVT, NVVC, NVVR en ZINL via een schriftelijke stakeholderraadpleging. Een overzicht van de aangedragen knelpunten/vragen en de reactie van de werkgroep is opgenomen als aanverwant product.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken, waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal, belangrijk en onbelangrijk. Tevens definieerde de werkgroep, tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen is aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies, aan de hand van de literatuurlijsten, van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de, via de zoekactie, gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met de desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: Cochrane – voor gerandomiseerd gecontroleerd onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten.
Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. In deze richtlijn is daarnaast een module opgenomen waarin de randvoorwaarden voor het verrichten van medische thoracoscopie worden behandeld.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn werd er een interne kwaliteitsindicator ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van de Federatie Medisch Specialisten (secretariaat@kennisinstituut.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Er is een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht opgenomen in de aanverwante producten.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwaliteit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
Engels
1997-feb. 2017 |
9 "Pleural Effusion, Malignant"/ (3255) 10 ((malignan* or cancer* or tumor* or tumour* or neoplas* or carcinom*) adj10 ("pleural effusion" or "pleural fluid*")).ti,ab,kf. or MPE.ti,ab. or (malignan* adj10 pleur*).ti,ab,kf. (9375) 11 9 or 10 (10887) 12 "Catheters, Indwelling"/ (17204) 13 (((Indwelling or pleura or permanentl) adj3 catheter*) or IPC* or ("tunnel* pleural" adj3 cathete*) or TPC* or Rocket* or PleurX or "permanent chest drai*" or (permanent adj6 drain*)).ti,ab,kf. (18991) 14 12 or 13 (33990) 15 11 and 14 (247) 16 limit 15 to (english language and yr="1997 -Current") (223) 17 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (307515) 18 16 and 17 (7) 19 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1659986) 20 16 and 19 (64) 21 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw,kw. or (cohort adj (study or studies)).tw,kw. or Cohort analy$.tw,kw. or (Follow up adj (study or studies)).tw,kw. or (observational adj (study or studies)).tw,kw. or Longitudinal.tw,kw. or Retrospective.tw,kw. or Prospective.tw,kw. or Cross sectional.tw,kw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ (Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies) (2485704) 22 comparative study.pt. (1766639) 23 21 or 22 (3888250) 24 16 and 23 (81) 25 18 or 20 (67) 26 24 not 25 (54) 27 remove duplicates from 25 (64) 28 remove duplicates from 26 (52) |
213 |
|
Embase (Elsevier) |
'malignant pleura effusion'/exp OR ('pleura effusion'/exp AND 'malignant neoplastic disease'/exp AND (1997-2013)/py) OR (malignan* NEAR/10 'pleural effusion'):ti,ab OR mpe:ti,ab OR (malignan* NEAR/10 pleur*):ti,ab
AND ('indwelling catheter'/exp OR (((indwelling OR pleural) NEAR/3 catheter*):ti,ab OR ipc*:ti,ab OR ('tunnel* pleural' NEAR/3 cathete*):ti,ab OR tpc*:ti,ab OR rocket*:ti,ab OR pleurx:ti,ab) OR 'permanent chest drai*':ti,ab OR (permanent NEAR/6 drain*):ti,ab)
AND (english)/lim AND (embase)/lim AND (1997-2017)/py
'meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR (systematic NEAR/1 (review OR overview)):ab,ti OR (meta NEAR/1 analy*):ab,ti OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de NOT ('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp NOT 'human'/exp)
OR 'clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti NOT 'conference abstract':it)) NOT 'conference abstract':it (70) – 33 uniek
AND 'clinical study'/exp (112) – 64 uniek |
