Zuurstoftoediening bij sepsis
Uitgangsvraag
Wat is de optimale modus van zuurstoftoediening of (niet-invasieve dan wel invasieve) beademing bij respiratoire insufficiëntie bij patiënten met sepsis?
Aanbeveling
Start zo snel mogelijk zuurstoftoediening/beademing bij respiratoire insufficiëntie bij (dreigende) sepsispatiënten.
Weeg de voor- en nadelen van de volgende opties op basis van patiëntkenmerken:
- High-flow nasal canula oxygen.
- Conventionele zuurstoftherapie.
- Niet-invasieve beademing.
Maak duidelijke afspraken (intensivist betrekken) binnen een ziekenhuisinstelling over de bewaking en opvang van patiënten met een dreigende sepsis, niet opgenomen op de IC die behandeld worden met high-flow nasal canula oxygen therapie of niet-invasieve beademing.
Overwegingen
De onderstaande overwegingen en aanbevelingen gelden voor het overgrote deel van de populatie waarop de uitgangsvraag betrekking heeft.
Het gebruik van niet-invasieve beademingstechnieken bij respiratoire insufficiëntie is in veel ziekenhuizen een gebruikelijke therapie, niet alleen voorbehouden aan IC of medium/high care-afdelingen.
Het tijdig starten van adequate zuurstoftherapie is een logische interventie om achteruitgang zowel klinisch als ventilatoir te voorkomen.
Respiratoire insufficiëntie is een symptoom bij meerdere acute ziektebeelden, niet alleen bij sepsis. Dit is ook duidelijk terug te vinden in de patiëntenpopulaties van de geïncludeerde studies. De verschillende studies hebben een klein aantal sepsispatiënten; het percentage patiënten met een pneumonie ligt hoger. De studie van Lemiale (2015) onderzocht alleen immuungecompromitteerde patiënten met respiratoir falen.
De plaats van behandeling is in de geïncludeerde studies op een IC (Frat, 2015; Lemiale, 2015; Azevedo, 2015) of een SEH-setting (Jones, 2015; Bell, 2015; Doshi, 2018). Geen van de studies heeft gekeken naar de veiligheid of effectiviteit van het toepassen van niet-invasieve beademingsmodaliteiten in een andere setting (bijvoorbeeld een acute opname afdeling).
De verschillen tussen HFNO en conventionele zuurstoftherapie of niet-invasieve beademing in intubatie, mortaliteit en duur van IC-opname zijn niet significant. Mogelijk dat HFNO wel een voorkeur heeft vanuit het oogpunt van patiëntcomfort, echter dit is niet systematisch onderzocht in geïncludeerde studies. Verdere voordelen van HFNO zijn het gebruik van bevochtigde lucht en het generen van enige positive endexpiratory pressure (PEEP).
Het goed kunnen monitoren van patiënten met een respiratoire insufficiënte op basis van een (dreigende) sepsis of een ander acuut ziektebeeld buiten een IC-setting is van groot belang om tijdig falen van de behandeling te kunnen herkennen. Hiervoor zijn goede afspraken nodig tussen de verschillende betrokken poortspecialismes, spoedafdelingen en IC-afdelingen, in het bijzonder de intensivist.
Aanbeveling-1
Rationale/ balans tussen de argumenten voor en tegen de interventie
Het gebruik van HFNO heeft geen significante voordelen ten opzichte van conventionele zuurstoftherapie of niet-invasieve beademing ten aanzien van falen van de behandeling of mortaliteit. Praktische overwegingen, patiëntkenmerken en lokale expertise dienen leidend te zijn in de keuze van zuurstoftoediening. Aangezien de patiëntkenmerken veel omvattend kunnen zijn, heeft de werkgroep ervoor gekozen in het algemeen te spreken van patiëntkenmerken in plaats van een lijst van relevante patiëntkenmerken te geven.
Aanbeveling-2
Rationale/ balans tussen de argumenten voor en tegen de interventie
Voor het behandelen van patiënten met een (dreigende) sepsis buiten een IC-setting met HFNO-therapie of niet-invasieve beademing is het nodig dat duidelijke afspraken bestaan binnen de ziekenhuisinstelling over de vorm en invulling van de monitoring van de patiënt. Zie ook de Kwaliteitsstandaard Intensive Care. De werkgroep acht het belangrijk dat bij het opstellen van afspraken met betrekking tot HFNO-therapie of niet-invasieve beademing op andere afdelingen dan een IC de intensivist betrokken is.
Onderbouwing
Achtergrond
Zuurstoftoediening bij patiënten met (pneumo)sepsis kan op diverse afdelingen via diverse routes. Methoden kunnen worden ingedeeld van low flow low-oxygen naar high flow high-oxygen. Naast het klassieke zuurstofbrilletje en non-rebreathing maskers wordt op diverse niet IC-afdelingen in toenemende mate high flow nasal canula oxygen (HFNO)-therapie toegepast. Deze werkwijze roept een aantal hulpvragen op:
- Is deze methode beter dan de al bestaande methoden?
- Is deze methode non-inferieur aan niet-invasieve beademing en invasieve beademing?
- En welke effecten, bijvoorbeeld uitstel van intuberen heeft deze beademingsvorm bij kritiek zieke ((pneumo)sepsis) patiënten?
Conclusies
Conversie naar intubatie: HFNO-zuurstoftoediening versus conventionele zuurstoftherapie
|
Zeer laag GRADE |
Het is onzeker of er een verschil is in de conversie naar intubatie bij volwassen patiënten die HFNO-zuurstoftoediening krijgen vergeleken met conventionele zuurstoftherapie.
Bronnen: (Zhoa, 2017) |
Conversie naar intubatie: HFNO-zuurstoftoediening versus niet-invasieve beademing
|
Zeer laag GRADE |
Het is onzeker of er een verschil is in de conversie naar intubatie bij volwassen patiënten die HFNO-zuurstoftoediening krijgen vergeleken met niet-invasieve beademing.
Bronnen: (Zhoa, 2017; Lin, 2017; Doshi, 2018) |
Mortaliteit: HFNO-zuurstoftoediening versus conventionele zuurstoftherapie
|
Zeer laag GRADE |
Het is onzeker of er een verschil is in mortaliteit bij volwassen patiënten die HFNO-zuurstoftoediening krijgen vergeleken met conventionele zuurstoftherapie.
Bronnen: (Corley, 2017, Zhao, 2017) |
Mortaliteit: HFNO-zuurstoftoediening versus niet-invasieve beademing
|
Zeer laag GRADE |
Het is onzeker of er een verschil is in mortaliteit bij volwassen patiënten die HFNO-zuurstoftoediening krijgen vergeleken met niet-invasieve beademing.
Bronnen: (Corley, 2017, Zhao, 2017) |
Verblijfsduur IC: HFNO-zuurstoftoediening versus conventionele zuurstoftherapie
|
Zeer laag GRADE |
Het is onzeker of er een verschil is in verblijfsduur op de IC bij volwassen patiënten die HFNO-zuurstoftoediening krijgen vergeleken met conventionele zuurstoftherapie.
Bronnen: (Corley, 2017; Ou, 2017) |
Verblijfsduur IC: HFNO-zuurstoftoediening versus niet-invasieve beademing.
|
Zeer laag GRADE |
Het is onzeker of er een verschil is in verblijfsduur op de IC bij volwassen patiënten die HFNO-zuurstoftoediening krijgen vergeleken met niet-invasieve beademing.
Bronnen: (Doshi, 2018) |
Samenvatting literatuur
Beschrijving studies
De data van zes RCT’s uit drie systematische literatuurreviews is samengevoegd (Zhao, 2017; Corley, 2017; Lin, 2017) en geüpdatet met één nieuwe RCT (Doshi, 2018).
Patiënten met een post-extubation respiratoir falen (Hernandez 2016a; Hernandez, 2016b; Maggiore, 2014; Parke, 2013; Stephan, 2015), een zeer afwijkende patiëntenpopulatie (Corley, 2015) en patiënten waarbij HFNO-therapie slechts gebruikt werd ter overbrugging van een bronchoscopische ingreep (Simon, 2014) werden geëxcludeerd.
In tabel 1 staan alle zeven geïncludeerde studies met de belangrijkste karakteristieken over setting, patiëntenpopulatie en de gebruikte vergelijkende zuurstoftherapie samengevat. De redenen voor zuurstoftoediening kunnen verschillen zoals aangegeven in tabel 1. In de studies had slechts een deel sepsis; resultaten voor deze subgroep zijn niet apart gepresenteerd. De resultaten zijn apart gepresenteerd en geanalyseerd voor conventionele zuurstoftherapie en niet-invasieve beademing.
In de systematische Cochraneliteratuurreview van Corley (2017) is gezocht tot en met maart 2016. Er werden elf RCT’s geïncludeerd waarbij HFNO-therapie werd vergeleken met niet-invasieve beademing voor volwassenen met acuut respiratoir falen op de IC. De uitkomstmaten mortaliteit en verblijfduur op de IC waren relevant voor deze uitgangsvraag. De primaire uitkomst in de Cochrane review behandelingsfalen (geïndiceerd door de noodzaak voor noninvasive positive pressure ventilation (NIPPV) of invasieve ventilatie) voldoet niet aan onze intubatie uitkomstmaat. Van de elf studies in de Cochrane studie excluderen wij vier studies omdat dit cross-over RCT’s zijn en er blijven drie studies over die rapporteren over de twee relevante uitkomstmaten in de juiste populatie (Corley, 2017).
In de systematisch review van Zhao (2017) is gezocht tot en met oktober 2016. Er werden elf RCT’s geïncludeerd met in totaal 3459 patiënten. HFNO-therapie (n=1681) werd vergeleken met conventionele zuurstoftherapie (in acht studies) of niet-invasieve beademing (in twee studies) of beide (in één studie) bij volwassenen met respiratoir falen op zowel de SEH als IC. Er werden zeven studies geëxcludeerd, en er bleven vier studies over in de juiste populatie met de uitkomstmaten intubatie en mortaliteit waren relevant voor deze uitgangsvraag (Zhao, 2017).
In de systematisch review van Lin (2017) is gezocht tot en met september 2016. Er werden acht RCT’s geïncludeerd met in totaal 1818 patiënten. HFNO-therapie werd vergeleken met conventionele zuurstoftherapie (in vier studies) of niet-invasieve beademing (in twee studies) of beide (in één studie) bij volwassenen met respiratoir falen op zowel de SEH als IC. De uitkomstmaten intubatie en mortaliteit waren relevant voor deze uitgangsvraag. Eén studie werd niet meegenomen omdat dit een cross-over RCT’s was en twee studies werden geëxcludeerd vanwege een post-extubatie populatie (Lin, 2017).
De drie systematische literatuur reviews overlappen gedeeltelijk in uitkomstmaten, inclusiecriteria en studies, daarom zijn deze allen meegenomen in de literatuuranalyse. Eén recente RCT, Doshi (2018) wordt toegevoegd aan de literatuuranalyse en meta-analyse.
Doshi (2018) beschrijft een RCT met 204 patiënten die zich presenteerden op de SEH met respiratoir falen met de noodzaak voor niet-invasieve beademing met positieve druk. HFCN-zuurstoftoediening (n=104) werd vergeleken met niet-invasieve beademing met positieve druk (n=100). De primaire uitkomstmaat was therapiefalen na 72 uur, waarbij cross-over naar de alternatieve therapie was toegestaan. De secundaire en relevante uitkomstmaten voor onze uitgangsvraag was intubatie binnen 72 uur na opname en verblijfsduur op de IC. In de HFNO-groep waren er 15 (14%) patiënten met een ontslagdiagnose sepsis en 20 (20%) in de niet-invasieve beademing met positieve druk groep.
Tabel 1 Karakteristieken geïncludeerde RCT’s met HFNO
|
Auteur, jaartal |
Vergelijkende zuurstoftoediening |
Setting |
Patiëntengroep |
Sepsis N(%)1 |
Pneumonia N(%)2 |
|
Bell, 2015 |
COT (Facemask/nasal prongs) |
ED |
Acute undifferentiated shortness of breath |
Not reported |
Not reported |
|
Frat, 2015 |
1. COT (facemask) 2.NIV (facemask with PEEP) |
ICU |
Acute hypoxaemic respiratory failure (without hypercapnia) |
HFNC: 4 (4) COT: 5 (5) NIV: 7 (6) |
HFNC:77 (72) COT:61 (65) NIV:79 (72) |
|
Jones, 2015 |
COT (Facemask/nasal prolongs) |
ED |
Hypoxia and tachypnea |
Not reported |
HFNC:34 (21) COT: 38 (28) |
|
Lemiale, 2015 |
COT (facemask) |
ICU |
Immunocompromised patients with acute hypoxaemic respiratory failure |
HFNC: 25 (48) COT: 25 (52) |
HFNC: 5 (10) COT: 2 (4) |
|
Azevedo, 2015 |
NIPPV |
ICU |
Acutehypoxemic respiratory failure |
HFNC: 5(36) COT: 5 (31) |
HFNC: 2(14) COT: 0 (0) |
|
Doshi, 2018 |
NIPPV |
ED |
Acute respiratory failure requiring escalation to noninvasive positive-pressure ventilation |
HFNC: 15 (14) NIPPV: 20 (20) (discharge diagnosis pneumonia or sepsis) |
|
|
Parke, 2011 |
NIV (high-flow face mask with humidifier) |
ICU |
Mild to moderate acute hypoxaemic respiratory failure |
Not reported |
Not reported |
BiPAP=bilevel positive airway pressure; COT=Conventional Oxygen Therapy; ED: Emergency Department; HFNC=High-flow nasal cannulae; ICU=Intensive Care Unit; NIPPV=Non-invasive positive-pressure ventilation; NIV=Non-invasive ventilation; PEEP=positive end-expiratory pressure
1 Sepsis gerapporteerd als (ontslag)diagnose
2 Pneumonia als reden voor zuurstoftoediening of initiële diagnose. De gepresenteerde cijfers excluderen ventilator-acquired pneumonia of nosociomal pneumonia.
Resultaten
Conversie naar intubatie
Vier studies rapporteerden over de conversie naar intubatie waarbij HFNO-zuurstoftoediening werd vergeleken met conventionele zuurstoftherapie. 26 van de 326 patiënten in de HFNO moesten worden geïntubeerd en 52 van de 347 patiënten in de conventionele zuurstoftherapie groep. In figuur 1 zijn de resultaten gepresenteerd, met een niet-significante relevante risk ratio (RR) van 0,81 (95% Betrouwbaarheidsinterval (BI) 0,56 tot 1,19) in het voordeel van HFNO. Patiënten met HFNO-zuurstoftoediening hadden gemiddeld 19% lagere kans op conversie naar intubatie dan patiënten die conventionele zuurstoftherapie kregen. Het absolute risicoverschil is 2,8% (6,6% minder tot 2,8% meer) minder conversie naar intubatie.
Figuur 1 Uitkomstmaat intubatie vergelijking HFNO versus conventionele zuurstoftherapie
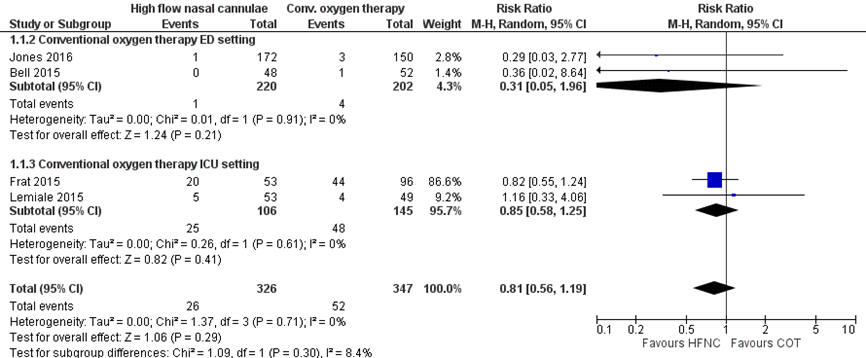
Z: p-waarde van het gepoolde effect; df: vrijheidsgraden; I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Drie studies rapporteerden over de conversie naar intubatie waarbij HFNO-zuurstoftoediening werd vergeleken met niet-invasieve beademing. 33 van de 171 patiënten in de HFNO moest worden geïntubeerd en 74 van de 226 patiënten in de niet-invasieve beademing groep. In figuur 2 zijn de resultaten gepresenteerd, met een niet-significante risk ratio (RR) van 0,76 (95% BI 0,54 tot 1,06). Patiënten met HFNO-zuurstoftoediening hadden gemiddeld 24% lagere kans op conversie naar intubatie dan patiënten die niet-invasieve beademing kregen. Het absolute risicoverschil is 7,9% (15,1% minder tot 2% meer) minder conversie naar intubatie.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat noodzaak voor intubatie of invasieve ventilatie bij conventionele zuurstoftherapie is met twee niveaus verlaagd gezien de imprecisie (geringe aantal events en het betrouwbaarheidsinterval overlapt aan twee kanten met de grenzen voor klinische besluitvorming). De bewijskracht is één extra niveau verlaagd vanwege de extrapoleerbaarheid (indirectheid) van de resultaten, omdat dit niet allemaal om (dreigende) sepsispatiënten gaat. De blindering ontbrak in alle studies, maar hier is niet voor afgetrokken omdat niet wordt verwacht dat dit deze uitkomsten beïnvloed. Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
Figuur 2 Uitkomstmaat intubatie vergelijking HFNO versus niet-invasieve beademing
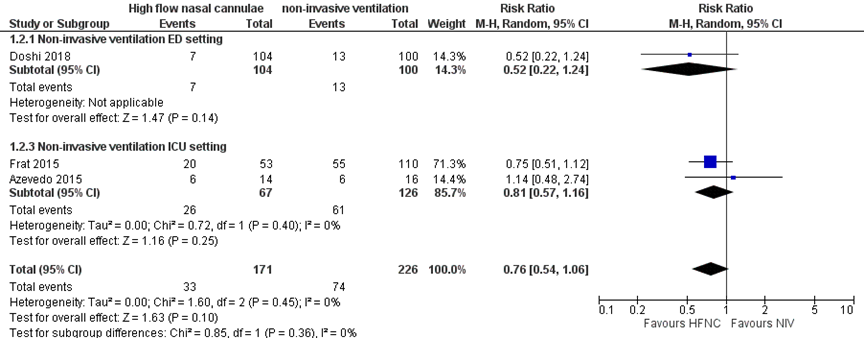
Z: p-waarde van het gepoolde effect; df: vrijheidsgraden; I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat noodzaak voor intubatie of invasieve ventilatie bij niet-invasieve beademing is ook met twee niveaus verlaagd gezien de imprecisie (geringe aantal events en aantal studies). De bewijskracht is één extra niveau verlaagd vanwege de extrapoleerbaarheid (indirectheid) van de resultaten, omdat dit niet allemaal om (dreigende) sepsispatiënten gaat. De blindering ontbrak in alle studies, maar hier is niet voor afgetrokken omdat niet wordt verwacht dat dit deze uitkomsten beïnvloed. Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
Mortaliteit
Eén studie op de IC rapporteerde over de mortaliteit waarbij HFNO-zuurstoftoediening werd vergeleken met conventionele zuurstoftherapie. Zes van de 53 patiënten in de HFNO overleed en 18 van de 94 patiënten in de conventionele zuurstoftherapie groep. Er werd een niet-significante risk ratio (RR) van 0,59 (95% BI 0,25 tot 2,05) gevonden. Patiënten met HFNO-zuurstoftoediening hadden gemiddeld 41% lagere kans om te overlijden dan patiënten die conventionele zuurstoftherapie kregen. Het absolute risicoverschil is 7,9% (14,4% minder tot 7,7% meer) minder mortaliteit.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat mortaliteit bij conventionele zuurstoftherapie is met twee niveaus verlaagd gezien de imprecisie (zeer geringe aantal events en het betrouwbaarheidsinterval overlapt met de grenzen voor klinische besluitvorming). De bewijskracht is één extra niveau verlaagd vanwege de extrapoleerbaarheid (indirectheid) van de resultaten, omdat dit niet om (dreigende) sepsispatiënten gaat. De blindering ontbrak in alle studies, maar hier is niet voor afgetrokken omdat niet wordt verwacht dat dit deze uitkomsten beïnvloed. Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
Eén studie op de IC rapporteerde over mortaliteit waarbij HFNO-zuurstoftoediening werd vergeleken met niet-invasieve beademing. 6 van de 53 patiënten in de HFNO overleed en 27 van de 110 patiënten in de niet-invasieve beademing groep. Er werd een niet-significante risk ratio (RR) van 0,46 (95% BI 0,20 tot 1,05) gevonden. Patiënten met HFNO-zuurstoftoediening hadden gemiddeld 54% lagere kans om te overlijden dan patiënten die niet-invasieve beademing kregen. Het absolute risicoverschil is 19,6% (6,6% minder tot 1,2% meer) minder mortaliteit.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat mortaliteit bij niet-invasieve beademing is met twee niveaus verlaagd gezien de imprecisie (zeer geringe aantal events en het betrouwbaarheidsinterval overlapt met de grens voor klinische besluitvorming). De bewijskracht is één extra niveau verlaagd vanwege de extrapoleerbaarheid (indirectheid) van de resultaten, omdat dit niet om (dreigende) sepsispatiënten gaat. De blindering ontbrak in alle studies, maar hier is niet voor afgetrokken omdat niet wordt verwacht dat dit deze uitkomsten beïnvloed. Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
Verblijfsduur op de IC
Eén studie rapporteerde over de verblijfsduur op de IC of SEH waarbij HFNO-zuurstoftoediening werd vergeleken met conventionele zuurstoftherapie. Er werd een niet significant gemiddeld verschil van 1,60 (95% BI -2,54 tot 5,47) dagen gevonden. Patiënten met HFNO-zuurstoftoediening verbleven gemiddeld 1,60 dagen langer in het ziekenhuis dan patiënten die conventionele zuurstoftherapie kregen (Frat, 2015).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat verblijfsduur bij conventionele zuurstoftherapie is met twee niveaus verlaagd vanwege de imprecisie (gering aantal patiënten en studies). De bewijskracht is één extra niveau verlaagd vanwege de extrapoleerbaarheid (indirectheid) van de resultaten, omdat dit niet om (dreigende) sepsispatiënten gaat. De blindering ontbrak in alle studies, maar hier is niet voor afgetrokken omdat niet wordt verwacht dat dit deze uitkomst beïnvloed. Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
Eén studie rapporteerde over de verblijfsduur op de IC waarbij HFNO-zuurstoftoediening werd vergeleken met niet-invasieve beademing. Er werd een niet significant gemiddeld verschil van -0,60 (95% BI -2,17 tot -0,97) dagen gevonden. Patiënten met HFNO-zuurstoftoediening verbleven gemiddeld 0,60 dagen korter in het ziekenhuis dan patiënten die niet-invasieve beademing kregen (Doshi, 2018).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat verblijfsduur bij conventionele zuurstoftherapie is met twee niveaus verlaagd vanwege de imprecisie (gering aantal patiënten en slechts één studie en het betrouwbaarheidsinterval overlapt met de grens voor klinische besluitvorming). De bewijskracht is één extra niveau verlaagd vanwege de extrapoleerbaarheid (indirectheid) van de resultaten, omdat dit niet om (dreigende) sepsispatiënten gaat. De blindering ontbrak, maar hier is niet voor afgetrokken omdat niet wordt verwacht dat dit deze uitkomsten beïnvloed. Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag (vragen):
Wat zijn de (on)gunstige effecten van zuurstoftoediening volgens HFNO-therapie versus low flow oxygen, niet-invasieve beademing, invasieve beademing?
P: patiënten van 18 jaar en ouder met verdenking sepsis (vitaal bedreigde patiënten/acuut respiratoir falen) in het ziekenhuis;
I: HFNO-therapie;
C: low flow oxygen, niet-invasieve beademing, invasieve beademing;
O: mortaliteit, ligduur IC, conversie naar invasieve ventilatie/intubatie.
Relevante uitkomstmaten
De werkgroep achtte de noodzaak voor intubatie een voor de besluitvorming kritieke uitkomstmaat en mortaliteit en duur van IC-opname voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Tenzij anders vermeld werden de door de internationale GRADE-werkgroep voorgestelde standaardgrenzen gehanteerd voor klinische relevantie: een verschil in relatief risico van 25% bij dichotome uitkomstmaten, en een verschil van een halve standaarddeviatie voor continue uitkomstmaten.
De werkgroep definieerde een relatief risico van 15% als een klinisch (patiënt) relevant verschil voor intubatie, gebaseerd op de studie van Doshi (2018), voor non-inferioriteit bij intubatie.
De werkgroep definieerde een verschil van één dag in verblijfsduur op de IC als een klinisch (patiënt) relevant verschil.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 23 augustus 2018 met relevante zoektermen gezocht naar Engelstalige publicaties van systematische reviews en gerandomiseerde gecontroleerde trial (RCT) over zuurstoftoediening volgens HFNO-therapie versus low flow oxygen, niet-invasieve beademing, invasieve ventilatie bij sepsis en/of vitaal bedreigde patiënten. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 238 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: volwassenen met een noodzaak voor zuurstoftoediening, vergelijking van HFNO-therapie met low flow oxygen therapy, niet-invasieve beademing en/of invasieve beademing en ten minste één van de door de werkgroep benoemde relevante uitkomstmaten. Studies met zuurstoftoediening in post-extubatie patiënten werden geëxcludeerd. Cross-over trials en observationele studies (ook binnen de geïncludeerde systematische reviews) werden geëxcludeerd. Op basis van titel en abstract werden in eerste instantie 29 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 25 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en vier studies definitief geselecteerd.
Vier studies zijn opgenomen in de literatuuranalyse (Zhao, 2017; Corley, 2017; Lin, 2017; Doshi, 2018). De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Referenties
- Corley A, Rickard CM, Aitken LM, Johnston A, Barnett A, Fraser JF, Lewis SR,Smith AF. High-flow nasal cannulae for respiratory support in adult intensive care patients. Cochrane Database Syst Rev. 2017 May 30;5:CD010172. doi:10.1002/14651858.CD010172.pub2.
- Doshi P, Whittle JS, Bublewicz M, Kearney J, Ashe T, Graham R, Salazar S, Ellis TW Jr, Maynard D, Dennis R, Tillotson A, Hill M, Granado M, Gordon N, Dunlap C, Spivey S, Miller TL. High-Velocity Nasal Insufflation in the Treatment of Respiratory Failure: A Randomized Clinical Trial. Ann Emerg Med. 2018 Jul;72(1):73-83.e5. doi: 10.1016/j.annemergmed.2017.12.006. Epub 2018 Jan 6.
- Lin SM, Liu KX, Lin ZH, Lin PH. Does high-flow nasal cannula oxygen improve outcome in acute hypoxemic respiratory failure? A systematic review and meta-analysis. Respir Med. 2017 Oct;131:58-64. doi: 10.1016/j.rmed.2017.08.005. Epub 2017 Aug 9. Review.
- Ou X, Hua Y, Liu J, Gong C, Zhao W. Effect of high-flow nasal cannula oxygen therapy in adults with acute hypoxemic respiratory failure: a meta-analysis of randomized controlled trials. CMAJ. 2017 Feb 21;189(7):E260-E267. doi:10.1503/cmaj.160570.
- Zhao H, Wang H, Sun F, Lyu S, An Y. High-flow nasal cannula oxygen therapy is superior to conventional oxygen therapy but not to noninvasive mechanical ventilation on intubation rate: a systematic review and meta-analysis. Crit Care. 2017 Jul 12;21(1):184. doi: 10.1186/s13054-017-1760-8. Review.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: Wat zijn de (on)gunstige effecten van zuurstoftoediening volgens HFNO-therapie versus Low flow oxygen, niet-invasieve ventilatie, invasieve ventilatie.
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Corley, 2017
Study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs (parallel or cross-over design, however for this purpose only parallel designs are included)
Literature search up to Dec 2016
A: Corley, 2014 B: Cuquemelle 2012 C: Frat 2015 D: Lemiale 2015 E: Maggiore 2014 F: Parke 2011 G: Parke 2013a H: Stephan 2015
Cross-over studies excluded: Chanques 2013; Rittayamai 2014; Schwabbauer 2014
Study design: All RCTs parallel
Setting and Country: Setting: all ICU A: Australia B: France C: France and Belgium D: France E: Italy F: New Zealand G: New Zealand H: France
Source of funding: Nine studies declared funding or provision of equipment from manufacturers of the HFNC system (Fisher &Paykel Healthcare) (Chanques 2013; Corley 2014; Cuquemelle 2012; Frat 2015; Lemiale 2015; Maggiore 2014; Parke 2011; Parke 2013a; Schwabbauer 2014). Six of these reported that the manufacturer had not been involved in study design, management, or data analyses, and we considered these studies to have low risk of bias (Corley 2014; Cuquemelle 2012; Frat 2015; Lemiale 2015; Parke 2013a; Schwabbauer 2014); two of these six did not report involvement of the manufacturer, and we were unclear whether this funding represented risk of bias (Chanques 2013; Maggiore 2014); one study reported that the manufacturer had been involved in the study design and had paid for statistical analysis; we judged this study to have high risk of bias (Parke 2011). |
Inclusion criteria SR: all randomized, parallel, and quasi-randomized studies (including cross-over studies) that compared HFNC versus other forms of non-invasive respiratory support for selected outcome measures.
Exclusion criteria SR: retrospective studies and prospective cohort or observational studies
11 studies included, of which 8 used (4 cross-over studies were excluded) in this analysis and 5 with relevant outcomes
Important patient characteristics at baseline:
N, mean age A: 155 patients, 63 (± 11.4) years (I); 65 (± 11.1) years (C) B: 30 patients, 39-77 years C: 313 patient, 61 (± 16) years (I); 59 (± 17) years (C1); 61 (± 17) years (C2) D. 102 patients, Age median (25th to 75th percentile): 59.3 (43 to 70) years (I); Age median (25th to 75th percentile): 64.5 (53.25 to 72) years E. 105 patients, 65 (± 18) years (I); 64 (± 17) years (C) F. 56 participants, mean (range): 64 (39 to 83) years (I); 64 (26 to 85) years (C) G. 340 participants, Age median (range) 65 (19 to 88) years (I) and 66 (21 - 87) years (C) H: 830 participants; 63.8 (95% CI 62.5 to 65.2) years (I) and 63.9 (95% CI 62.6 to 65.2) years (C)
Groups were mostly comparable at baseline. However, for study B participants in the intervention group were older and had higher rates of infectious pneumonia. Reasons for exclusion potentially related to treatment |
Describe intervention: high flow oxygen
A: HFNC (optiflow) n=81 B: HFNC (optiflow) C: HFNC (optiflow) n=106 D: HFNC E: HFNC n=53 F: HFNC (optiflow) n=29 G: HFNC (optiflow) n=169 H: HFNC (optiflow) n=414
|
Describe control: low flow oxygen
A: Standard oxygen therapy (face mask); n = 74 B: Standard oxygen therapy Use of a flow meter from wall oxygen without humidification. Randomized to receive therapy during first 24 hours, then crossed-over to alternative therapy for 4 hours to reduce drop-outs C-1: Standard oxygen (nonrebreather face mask) n=94 C-2: Non-invasive ventilation (face mask connected to an ICU ventilator with pressure support applied in NIV mode;) n=110 D: Venturi mask E: Venturi mask n=52 F: Standard oxygen therapy (HFFM standard face mask) n=27 G: Simple face mask (n=171) H: BiPAP (n=416)
|
End-point of follow-up: NA
For how many participants were no complete outcome data available? (intervention/control) A: no losses B: Of 37 participants randomized, 7 were excluded from analysis, as they were unable to complete the study (5 owing to deterioration and 2 because of rapid improvement in respiratory status) C: 3 losses (2 in standard oxygen group and 1 in NIV group) due to withdrawal of consent. D: Loss of two participants after randomization due to withdrawal of consent. E: no losses F: Of 60 enrolled in the study, 4 participants (1 from the HFNC group, and 3 from the HFFM group) were excluded: 2 refused consent for all data collection, and 2 failed the screening. Five of 27 participants in the high-flow facemask group were switched to nasal high flow - no mention of how these data were treated. G: Attrition fully reported. Small number of losses H: no losses
|
Outcome measure-1 Defined as Failure of treatment as indicated by the need for non- invasive positive-pressure ventilation or invasive ventilation à we decided not to include this outcome measure, is different from intubation rate
Outcome measure-2 Defined as In-hospital mortality up to 90 days
Effect measure: RR (95% CI): C-1: 0.59 ( 0.25, 1.40) C-2: 0.46 ( 0.20, 1.05) E: 1.18 ( 0.38, 3.62) G: 1.01 ( 0.06, 16.05)
Pooled effect (random effects model): RR 0.63 (95% CI 0.38 to 1.06),p=0.08 favoring HFNC Heterogeneity (I2):0%
H. RR: 1.22 (95% CI 0.72 – 2.09) à not included in Cohrane in meta-analyse (uncomparable control group), in our meta-anlaysis we included this in the NIV group.
Outcome measure-3 Defined as length of ICU stay
Effect measure: (95% CI): C-1: 1.60 ( -2.54, 5.74 ) E: 1.30 ( -2.29, 4.89 ) A: 0.0 ( -0.39, 0.39 ) G: 0.19 ( -0.02, 0.40 )
Pooled effect (random effects model): 0.15 ( 95%CI -0.03 to 0.34 ) favoring low flow oxygen Heterogeneity (I2):0%
H. LOS ICU: (I) Median (IQR) 6 (4 to 10) (C) Median (IQR) 6 (4 to 10) P=0.77 H. LOS hospital: (I) Median (IQR) 13 (9 to 22) (C)Median (IQR) 14 (9 to 20) P=0.59
Studies B, Cuquemelle 2012, D Lamiale 2014, and F Parke 2011 did not report on any of the outcomes of interest. |
Brief description of author’s conclusion: We were unable to demonstrate whether HFNC was a more effective or safe oxygen delivery device compared with other oxygenation devices in adult ICU patients. Meta-analysis could be performed for few studies for each outcome. In addition, we identified some risks of bias among included studies, differences in patient groups, and high levels of statistical heterogeneity for some outcomes, leading to uncertainty regarding the results of our analysis. Consequently, evidence is insufficient to show whether HFNC provides safe and efficacious respiratory support for adult ICU patients.
Level of evidence according to authors: GRADE (per comparison and outcome measure) including reasons for down/upgrading 2. GRADE: Low (Evidence downgraded by two levels, as some studies had high or unclear risk of bias in some domains and some studies showed indirectness including participants requiring respiratory support for dif ferent purposes) 3. GRADE: Low (Evidence downgraded by two levels, as some studies had high or unclear risk of bias in some domains and some studies showed indirectness including participants requiring respiratory support for dif ferent purposes)
|
|
Zhao, 2017
Study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to 20 October 2016
A: Bell, 2015 B: Corley, 2015 C: Frat, 2015 D: Hernandez, 2016 (COT) E: Jones, 2015 F: Lemiale, 2015 G: Maggiore, 2014 H: Parke 2013 I: Parke, 2011 J: Stephan 2015 K: Hernandez, 2016 (NIV)
Study design: RCTs
Setting and Country: A: ED, Australia B: ICU, Australia C: ICU, France D: ICU, Spain E: ED, New Zealand F: ICU, France G: ICU, Italy H: CVICU, New Zealand I: CVICU, New Zealand J: CTVS ICU, France K: ICU, Spain
Source of funding: No funding was received fort he SR.
Commercial interference was reported. Seven of the articles stated that the trial design and data analysis was independent of commercial interference; nevertheless, another three studies did not make this clarification. |
Inclusion criteria SR: 1. Type of study: randomized controlled trials; 2. Population: adult patients with respiratory failure who received oxygen therapy; 3. Intervention: HFNC treatment compared either COT or NIV; 4. Predefined outcomes: intubation, mechanical ventilation (includes noninvasive mechanical ventilation and invasive mechanical ventilation), escalation of respiratory support (HFNC, NIV or intubation) and mortality.
Exclusion criteria SR: Without complete information - Not English/Chinese - Applying HFNC for bronchoscopy, not for treatment - Not included relevant outcomes
11 studies included
Important patient characteristics at baseline:
N, age Total enrolled 3459 patients (HFNC, n = 1681)
Age was not reported
Unknown wether groups were comparable at baseline. |
Describe intervention: high flow nasal cannula oxygen (HFNC)
A: HNFC B: HNFC C: HNFC D: HNFC E: HNFC F: HNFC G: HNFC H: HNFC I: HNFC J: HNFC K: HNFC
|
Describe control: Convential oxygen therapy or non-invasive ventilation FM=face mask
A: FM/nasal prongs B: FM/nasal cannula C: FM/NIV D: FM/nasal cannula E: FM/nasal prongs F: FM G: FM H: FM/or nasal Prongs I: FM J: NIV K: NIV
|
End-point of follow-up: NA
For how many participants were no complete outcome data available? (intervention/control) Not reported, however for all studies was incomplete outcome data (attrition bias) reported as low risk according tot the Cochrane RoB tool.
|
Outcome measure-1a Defined as intubation rate COT versus HFNC
Effect measure: OR (95% CI): A: 0.35 (0.01-8.9) B: 0.18 (0.01-3.77) C: 0.72 (0.41-1.26) D: 0.37 (0.19-0.73) E: 0.29 (0.03-2.78) F: 1.17 (0.30-4.64) G: 0.29 (0.10-0.81) H: 5.09 (0.24-106.8)
COT Pooled effect (random effects model): OR 0.52 (95% CI 0.34 to 0.79),p=0.002 favoring Heterogeneity (I2):9%
Outcome measure-1b Defined as intubation rate NIV versus HFNC
Effect measure: OR (95% CI): C: 0.62 (0.36-1.06) J: 1.25 (0.84-1.85) K: 1.03 (0.69-1.52)
NIV Pooled effect (random effects model): OR 0.96 (95% CI 0.66 to 1.39 ),p=0.84 favoring Heterogeneity (I2):53%
Outcome measure-2a Defined as In-hospital mortality COT versus HFNC
Effect measure: OR (95% CI): C: 0.55 (0.25-1.22) D: 1.00 (0.20-4.98) E: 1.34 (0.76-2.38) G: 1.20 (0.34-4.20) H: 1.01 (0.06-16.21)
Pooled effect (random effects model): OR 1.01 (95% CI 0.67 to 1.73),p=0.52 favoring COT Heterogeneity (I2):0%
Outcome measure-2b Defined as In-hospital mortality NIV versus HFNC
Effect measure: OR (95% CI): C: 0.40 (0.19-0.83) J: 1.15 (0.59-2.24) K: 1.24 (0.70-2.19)
Pooled effect (random effects model): OR 0.85 (95% CI 0.43 to 1.68 ),p=0.65 favoring HFNC Heterogeneity (I2):69%
|
Brief description of author’s conclusion: Compared to COT, HFNC reduced the rate of intubation, mechanical ventilation and the escalation of respiratory support. When compared to NIV, HFNC showed no better outcomes. Large-scale randomized controlled trials are necessary to prove our findings.
Level of evidence according to authors: GRADE (per comparison and outcome measure) including reasons for down/upgrading
Intubation rate: moderate (lack of blinding of participants and personnel) Mortality: Low (lack of blinding and imprecision)
|
|
Lin, 2017
Study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to September 2016
A: Azevedo 2015 B: Bell 2015 C: Frat 2015 D: Jones 2015 E: Lemaile 2015 F: Maggiore 2014 G: Rittayami 2015à exclusion: cross-over trial H: Stephan 2015
Study design: Parallel RCTs, one cross-over trial we exclude for our literature analysis
Setting: A: surgical ICU B: ED C: ICU D: ED E: General ICU F: General ICU G: ED H: Cardiac ICU
Source of funding: No funding bodies played any role in study design, data collection and analysis, decision to publish, or preparation this manuscript. |
Inclusion criteria SR: RCTs that compared administration of HFNC versus conventional oxygen therapy (COT) and noninvasive ventilation (NIV) in acute hypoxemic respiratory failure and not requiring immediate ventilatory support patients (such as those admitted to an ICU or emergency department), and which reported the incidence of the rate of intubation, or mortality.
8 studies included
Important patient characteristics at baseline:
N A: 30 B: 100 C: 310 D: 303 E: 100 F: 105 G: 40 H: 830
All with acute respiratory failure E: immunocompromised patients F: postextubation H: postextubation
Unknown whether groups were comparable at baseline. |
Describe intervention: high flow oxygen
A: HFNC (n=14) B: HFNC (n=48) C: HFNC (n=14)
D: HFNC (n=106) E: HFNC (n=165) F: HFNC (n=52) G: HFNC (n=20) H: HFNC (n=414)
|
Describe control: low flow oxygen
A: NIV (n=16) B: COT (n=52) C-1: COT: 95 C-2: NIV:110 D: COT (n=138) E: COT (n=48) F: COT (n=52) G: COT (n=20) H: NIV (n=416)
|
End-point of follow-up: NA
For how many participants were no complete outcome data available? (intervention/control) Attrition bias was defined low for all studies except Jones (D) reported some severely hypoxic patients were excluded from the study because clinicians were not comfortable with delaying NIV even for 30 min to deliver the study interventions.
|
Outcome measure-1a Defined as intubation rate HFNC versus COT
Effect measure: OR (95% CI): B: 0.35 (0.01-8.90) C-1: 0.64 (0.40-1.04) D: 0.27 (0.03-2.67) E: 1.92 (0.33-10.97) F: 0.15 (0.03-0.70) G: Not estimable (no events)
Pooled effect (random effects model): OR 0.58 (95% CI 0.36 to 0.92),p=0.02 favoring HFNC Heterogeneity (I2):29%
Outcome measure-1b Defined as intubation rate HFNC versus NIV
Effect measure: OR (95% CI): A: 1.25 (0.29-5.41) C-2: 0.64 (0.40-1.04) H: 1.03 (0.69-1.52)
Pooled effect (random effects model): OR 0.87 (95% CI 0.64 to 1.19),p=0.27 favoring HFNC Heterogeneity (I2):24%
Outcome measure-2 Defined as In-hospital mortality HFNC versus NIV and COT
Effect measure: OR (95% CI): C: 0.45 (0.23-0.90) D: 1.15 (0.51-2.60) F: 1.20 (0.34-4.20) H: 1.24 (0.70-2.19)
Pooled effect (random effects model): OR 0.89 (95% CI to),p=0.51 favoring HFNC Heterogeneity (I2):47% |
Brief description of author’s conclusion: The use of HFNC showed a trend toward reduction in the intubation rate, which did not meet statistical significance, in patients with acute respiratory failure compared with conventional oxygen therapy (COT) and noninvasive ventilation (NIV). Moreover no difference in mortality. So, Large, well-designed, randomized, multi-center trials are needed to confirm the effects of HFNC in acute hypoxemic respiratory failure patients.
RoB according to authors: Low risk on selection bias for all studies High risk on performance bias (no blinding of participants and personnel) in all studies and all but one study also no blinding for outcome assessment. One study had high risk for attrition bias and one study had high risk for reporting bias. All other studies had a low risk for attrition and reporting bias. No other biases were reported.
|
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))
Research question: Wat zijn de (on)gunstige effecten van zuurstoftoediening volgens High flow oxygen therapy versus Low flow oxygen, non-invasieve ventilatie, invasieve ventilatie.
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Doshi, 2018 |
Type of study: RCT
Setting: ED, multicenter
Country: US
Source of funding: Dr. Doshi reports receiving funding from Zoll Inc for coordination of the clinical trial. Dr. Miller and Mr. Dunlap were employed by Vapotherm. All authors report receiving study-related support from Vapotherm, Inc. The trial was sponsored by Vapotherm, which participated in the design of the protocol and the selection and management of the sites. The sponsor agreed a priori to allow publication of the findings of the trial at the discretion of the principal investigators. A steering committee composed of the principal investigators oversaw the analysis and interpretation of the data, wrote the first and subsequent drafts of the article, and made the decision to submit the article for publication. |
Inclusion criteria: -older than 18 years -with clinical judgment of the treating clinician of acute respiratory failure requiring escalation to noninvasive positive-pressure ventilation or to maintain noninvasive positive-pressure ventilation if the patient was delivered to the ED while receiving either type of ventilation from the out-of-hospital setting.
Exclusion criteria: suspected drug overdose, cardiovascular instability (hypotension requiring immediate intervention), end-stage cancer, life expectancy less than 6 months, significant respiratory depression on presentation (eg, drug overdose), Glasgow Coma Scale score less than 9, cardiac or respiratory arrest on presentation, need for emergency intubation, known or suspected cerebrovascular accident, known or suspected ST-segment elevation myocardial infarction, and patients with increased risk of pulmonary aspiration, agitation, or uncooperativeness.
N total at baseline: Intervention: 116, 104 received allocated intervention Control: 112, 100 received allocated intervention
Important prognostic factors2: age ± SD: I: 63.4 (13.6) C: 63.3 (14.8)
Sex: I: 42% M C: 44 % M
Sepsis/pneumonia discharge diagnosis HFNC: 15 (14%) NIPPV: 20 (20%) Groups were comparable at baseline |
Describe intervention (treatment/procedure/test): High-velocity nasal insufflation (Precision Flow; Vapotherm, Inc, Exeter, NH) using a small-bore nasal cannula was initiated with a flow rate set to 35 L/min, with a starting temperature between 35°C and 37°C and FiO2 at 1.0. Adjustments in flow (up to 40 L/min) and temperature (typically between 35°C and 37°C) were made to alleviate respiratory distress and optimize comfort.
The target for each intervention was to decrease breathing rate to fewer than 25 breaths/min and optimize comfort, whereas FiO2 was adjusted to maintain a pulse oximetry reading (SpO2) greater than 88%. The study model provided for having a respiratory therapist at bedside for the first 4 hours, which facilitated rapid changing of settings as needed.
|
Describe control (treatment/procedure/test):
Noninvasive positive-pressure ventilation (Respironics Vision V60; Philips Healthcare, Murrysville, PA) was initiated with an oronasal mask, with inspiratory and expiratory positive airway pressures (IPAP, EPAP) set at the lower end of the following settings and increased as necessary to alleviate respiratory distress: IPAP 10 to 20 cm H2O (or 5 to 15 cm H2O above EPAP), and EPAP 5 to 10 cm H2O. FiO2 was initiated at 1.0 for noninvasive positive-pressure ventilation.
The target for each intervention was to decrease breathing rate to fewer than 25 breaths/min and optimize comfort, whereas FiO2 was adjusted to maintain a pulse oximetry reading (SpO2) greater than 88%. The study model provided for having a respiratory therapist at bedside for the first 4 hours, which facilitated rapid changing of settings as needed. |
Length of follow-up: NA
Loss-to-follow-up/incomplete outcome data: The 24 patients randomized but not enrolled were excluded for meeting exclusion criteria (10), consent not obtained or withdrawn (6), bedside clinician not comfortable with enrollment after randomization (2), and patient identified to not need noninvasive positive-pressure ventilation after initial evaluation, thus failing to meet inclusion criteria (6).
|
Outcome measures and effect size (include 95%CI and p-value if available):
Need for intubation within 72 hours: I: 7/104 C: 13/100 % Risk difference: -7 (95% CI -14 to 2)
Arm failure rate, defined as the decision for crossover to the alternate therapy, within 72 hours of initiation of assigned therapy. I: 27/104 C: 17/100 % Risk difference: 9 (95% CI -2 to 20)
LOS ICU, mean days (sd) I: 3.3 (3.7) n=48 C: 3.9 (4.1) n=47 Difference (95%CI): -0.6 (-2.2 to 1.0)
LOS ED, hours (sd) I: 7.6 (5.0) n=104 C: 8.0 (8.5)n=400 Difference (95%CI): -0.4 (-2.3 to 1.5)
LOS hospital, mean days (sd) I: 6.8 (5.7) n=104 C: 6.0 (4.4) n=100
Difference: 0.8 (95% CI -0.6 to 2.2) |
|
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Ni 2018 |
Overlap met andere geïncludeerde systematische reviews en meta-analyses |
|
Beng 2018 |
Overlap met andere geïncludeerde systematische reviews en meta-analyses |
|
Huang 2018 |
Overlap met andere geïncludeerde systematische reviews en meta-analyses, bovendien veel observationeel en alleen in immunocompromised |
|
Helviz 2018 |
Hele brede systematische review over HFNC, niet perse een vergelijking met low flow oxygen |
|
Ou 2017 |
Overlap met andere geïncludeerde systematische reviews en meta-analyses |
|
Zhu 2017 |
Overlap met andere geïncludeerde systematische reviews en meta-analyses |
|
Ni 2017 |
Overlap met andere geïncludeerde systematische reviews en meta-analyses |
|
Nedel 2017 |
Overlap met andere geïncludeerde systematische reviews en meta-analyses |
|
Monro-Somerville 2017 |
Overlap met andere geïncludeerde systematische reviews en meta-analyses |
|
Liesching 2017 |
Overlap met andere geïncludeerde systematische reviews en meta-analyses |
|
Leies 2017 |
Overlap met andere geïncludeerde systematische reviews en meta-analyses |
|
Huang 2017 |
Overlap met andere geïncludeerde systematische reviews en meta-analyses |
|
Maitra 2016 |
Overlap met andere geïncludeerde systematische reviews en meta-analyses |
|
Lee 2016 |
Overlap met andere geïncludeerde systematische reviews en meta-analyses |
|
Jones 2016 |
Zit al in geïncludeerde systematische review |
|
Vourc'h 2015 |
Zit al in geïncludeerde systematische review, exclusie: different procedure with pre-oxygenation before intubation |
|
Vargas 2015 |
Prospective sequential study |
|
Lemiale 2015 |
Zit al in geïncludeerde systematische review |
|
Frat 2015 |
Zit al in geïncludeerde systematische review |
|
Frat 2015 |
Zit al in geïncludeerde systematische review |
|
Azevedo 2015 |
Zit al in geïncludeerde systematische review |
|
Schwabbauer 2014 |
Zit al in geïncludeerde systematische review. Exclusie: Cross-over trial |
|
Cuquemelle 2012 |
Zit al in geïncludeerde systematische. Exclusie: data niet goed te achterhalen, cross-ver trial |
|
Parke 2011 |
Zit al in geïncludeerde systematische review |
|
Roca 2010 |
Zit al in geïncludeerde systematische review. Exclusie :Cross-over trial |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 26-03-2020
Laatst geautoriseerd : 26-03-2020
Geplande herbeoordeling : 01-01-2025
|
Module |
Regiehouder(s) |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn |
Frequentie van beoordeling op actualiteit |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
Zuurstoftoediening |
NIV |
2020 |
2025 |
Eens in de vijf jaar |
NIV |
- |
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2024 bepaalt het bestuur van de Nederlandse Internisten Vereniging of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NIV is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
De ontwikkeling van deze richtlijn wordt gefaseerd doorlopen en opgeleverd. Op dit moment wordt alleen Sepsis fase 1 opgeleverd. Later wordt het ontwikkeltraject voor Sepsis fase 1 uitgebreid met fase 2 en 3. Er wordt naar gestreefd om de gehele richtlijn in 2021 af te ronden.
In fase 1 zijn de thema’s vroege herkenning, diagnostiek en eerste behandeling (vloeistofrecusatie en zuurstoftoediening) reeds behandeld.
In het vervolgtraject komen fase 2 en 3 aan bod en worden samengevoegd tot één richtlijn. Deze omvatten de volgende thema’s:
- Fase 2 (behandeling): vasopressoren en/of inotropica, nierfunctievervangende therapie, transfusiebeleid, sedatiemethode en delier.
- Fase 3 (nazorg en aandacht voor langetermijngevolgen voor de patiënt): (vroeg)mobilisatie, voeding, aandacht voor langetermijneffecten, revalidatie, voorlichting en begeleiding van patiënt en/of naasten.
Aan het einde van het gehele traject wordt er een overkoepelende gezamenlijke module over de organisatie van zorg/randvoorwaarden opgeleverd.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). Patiëntenparticipatie bij deze richtlijn werd medegefinancierd uit de Stichting Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ. De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Het doel van de richtlijn is om een discipline overstijgende evidence-based richtlijn te ontwikkelen, gericht op de vroegtijdige herkenning, diagnose, (initiële) behandeling, monitoring, nazorg en revalidatie van patiënten met (dreigende) sepsis.
Met deze richtlijn kan de kwaliteit van de sepsiszorg worden verbeterd en gewaarborgd, met als doel minder sepsis gerelateerde morbiditeit en mortaliteit.
Doelgroep
Deze richtlijn wordt geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor volwassen patiënten met (dreigende) sepsis in de ziekenhuiszorg.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met sepsis te maken hebben.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- Dr. A.R.H. van Zanten, internist-intensivist, Ziekenhuis Gelderse Vallei te Ede, NIV (voorzitter)
- Dr. S.U.C. Sankatsing, internist-infectioloog/ internist-acute geneeskunde, Diakonessenhuis te Utrecht, NIV
- Dr. M.J.A. de Regt, internist-infectioloog/ internist-acute geneeskunde, Onze Lieve Vrouwe Gasthuis te Amsterdam, NIV
- Dr. L.P.G Derde, internist-intensivist, Universitair Medisch Centrum Utrecht te Utrecht NVIC
- Drs. A. Klijn, AIOS Spoedeisende geneeskunde, Westfriesgasthuis te Hoorn, NVSHA
- Drs. R. Schellaars, intensivist, Ziekenhuis Gelderse Vallei te Ede, NVA
- Drs. R.M. Wilting, chirurg-intensivist, Elisabeth-TweeSteden ziekenhuis te Tilburg, NVvH
- Dr. D. Snijders, longarts, Spaarne Gasthuis te Haarlem en te Hoofddorp, NVALT
- Dr. A.K. van der Bij, arts-microbioloog, Diakonessenhuis te Utrecht, NVMM
- I. Nutma, patiëntenvertegenwoordiger (Stichting Family and Patient Centered Intensive Care (FCIC))/ IC connect
- V. Bon, verpleegkundig Specialist spoedeisende hulp, Onze Lieve Vrouwe Gasthuis te Amsterdam en Ambulanceverpleegkundige bij Ambulance Amsterdam, V&VN-SEH
- M. Hoogendoorn, kwaliteitsmedewerker Vakgroep Anesthesiologie & Intensive Care, Isala, beleidsmedewerker Raad van Bestuur, Isala te Zwolle, V&VN-IC
- Dr. W.G. Ista, senior onderzoeker Sector Verplegingswetenschap afdeling Interne Geneeskunde en senior onderzoeker Kinder IC, Erasmus MC te Rotterdam, V&VN-IC
- Dr. R.W.M.M. Jansen, klinisch geriater, Noordwest ziekenhuisgroep te Alkmaar, NVKG
- Prof. dr. D. van de Beek, neuroloog, Amsterdam UMC locatie AMC te Amsterdam, NVN
- Drs. O.J.D. Snieders, uroloog, Diakonessenhuis, te Utrecht/Zeist/Doorn en St. Antonius ziekenhuis, te Utrecht/Nieuwegein, NVU
Met ondersteuning van
- Dr. F. Willeboordse, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. M.S. Ruiter, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
A. van Zanten (voorzitter) |
lnternist-intensivist, afdeling lntensive Care Ziekenhuis Gelderse Vallei, Ede, Medisch Hoofd IC, Ziekenhuis Gelderse Vallei, Ede |
Onbetaald:
|
Participatie als onderzoeker in lC sepsis trials (b.v. AKPA-ART 123 trombomoduline trial), opbrengsten vloeien naar Stichting lC research en worden niet uitgekeerd aan onderzoekers.
Echtgenote heeft een Congres- en Organisatiebureau lnteractie dat voor vele wetenschappelijke verenigingen congressen organiseert. Bestaande activiteiten rond sepsis lopen al meer dan 10 jaar en door de richtlijn zullen deze niet wijzigen.
|
Geen actie |
|
S. Sankatsing |
internist-infectioloog/internist-acute geneeskunde in het Diakonessenhuis Utrecht |
Bestuurslid Nederlandse Vereniging van Internist Infectiologen (NVII)
Lid Commissie Richtlijnen Nederlandse Internisten Vereniging (NIV) |
Geen |
Geen actie |
|
M. de Regt |
Internist Acute Geneekunde/infectioloog Onze Lieve Vrouwe Gasthuis, Amsterdam (sinds april 2019, daarvoor in UMCU) |
Geen |
Geen |
Geen actie |
|
L. Derde |
Intensivist UMC Utrecht |
Co-lead WP5 PREPARE Lid NVVM influenza richtlijn Lid ESICM (European Society of Intensive Care Medicine) commissie voor ernstige CAP (community acquired pneumonia) Voorzitter van de Clinical Training Committee (CTC) van ESICM. Faculty ESICM masterclass sepsis and severe infections. |
Betrokken bij onderzoek dat door EU wordt gefinancierd: 1. Co-lead van WP5 PREPARE project (EU FP7 funded): doel is zoeken naar optimale behandeling voor patiënten met community acquired pneumonie op de IC 2. Lid International Trial Steering Committee, European Regional Management Committee en diverse domein-specifieke werkgroepen van REMAP-CAP. REMAP-CAP is de internationale overkoepelende studie waarvan PREPARE-WP5 het Europese deel is. REMAP-CAP wordt in andere regio's van de wereld ondersteund door andere funding (investigator driven). Op moment van tekenen is er geen industrie-betrokkenheid. |
Geen actie |
|
A. Klijn |
AIOS SEG in het Dijklander Ziekenhuis te Hoorn |
Buitengewoon lid richtlijnen commissie van de NVSHA, onbetaald. |
Geen |
Geen actie |
|
R. Schellaars |
intensivist, Ziekenhuis Gelderse Vallei, Ede |
bestuurslid SIC-NVA |
Geen |
Geen actie |
|
R. Wilting |
chirurg-intensivist, afdeling IC Elisabeth-TweeSteden ziekenhuis Tilburg |
Lid GIC (NVvH) |
Geen |
Geen actie |
|
D. Snijders |
longarts, medisch manager vakgroep longziekten Spaarne Gasthuis |
Docent Inholland, opleiding EHLH verpleegkundige, vergoeding. Lid richtlijn bronchiëctasieën NVALT, vergoeding. |
Geen |
Geen actie |
|
A. van der Bij |
Arts-microbioloog, werkzaam bij het Diakonessenhuis/Medisch Specialistisch Bedrijf Domstad (MSBD) Utrecht |
voorzitter van de Commissie Kwaliteitsbevordering van de NVMM. |
Geen |
Geen actie |
|
I. Nutma |
- Ex-patiënt, voormalig verpleegkundige, auteur van Septische shock en Sepsis en daarna. - Ervarings-professional. Eigenaar van Sepsis en daarna. - Mede-initiatiefnemer van de website www.opeenicliggen.nl; overgegaan in icconnect.nl
|
- Werkzaamheden op het gebied van voorlichting (Lezingen, lessen, workshops), begeleiding (huisbezoek, telefonische consulten) en advisering (bij onderzoek, richtlijnen, etc.) geschieden, betaald. - Mede-initiatiefnemer van de website opeenicliggen.nl, inmiddels overgegaan in de website icconnect.nl, onbetaald -Lid werkgroep ervaringsdeskundigen FCIC/IC-connect tot jan. 2019, onbetaald - beheerder (sinds ’17) online sepsis- lotgenotenplatform, onbetaald - organisator Sepsis Lotgenoten Dag, (vanaf 2018), onbetaald |
Geen |
Geen actie |
|
V. Bon |
Verpleegkundig Specialist SEH (18 uur/week) OLVG Ambulanceverpleegkundige bij Ambulance Amsterdam (12uur/week) |
instructeur bij opleidingsinstituut spoedeisende geneeskunde in Houten (betaald). |
Meegewerkt aan de Phantasi trial, het prehospitaal toedienen van AB bij sepsis (https://clinicaltrials.gov/ct2/show/NCT01988428). |
Geen actie |
|
M. Hoogendoorn |
Kwaliteitsmedewerker Vakgroep Anesthsesiologie & Intensive Care, Isala, Zwolle (0,5 FTE) Beleidsmedewerker Raad van Bestuur, Isala, Zwolle (0,5 FTE) |
Managing Director Athena Care B.V. - Research organisatie Vakgroep Anesthesiologie & Intensive Care (betaald) Bestuurslid V&VN-IC (onbetaald) Bestuurslid NICE (onbetaald)" |
Geen |
Geen actie |
|
E. Ista |
universitair docent/senior onderzoeker, IC Kinderen, Erasmus MC-Sophia Kinderziekenhuis, Rotterdam |
universitair Docent/Senior onderzoeker, Verplegingswetenschap, Interne Geneeskunde, Erasmus MC, Rotterdam
Lid Bestuurscommissie Richtlijne V&VN, Utrecht (onbetaald) |
|
Geen actie |
|
R. Jansen |
100% dienstverband als klinisch geriater Noordwest ziekenhuisgroep, locatie Alkmaar |
Onderwijs aan Amsteracademie voor verschillende verpleegkundigen opleidingen (betaald). |
Honoraria van Bayer, Boehringer en BMS voor houden lezingen, webTV, etc over atriumfibrilleren en gebruik NOAC's en schrijven van bijdrage aan zakboekjes. |
Geen actie |
|
D. van de Beek |
Neuroloog, Amsterdam UMC, locatie AMC |
Consultancy GSK malaria vaccin (betaald aan werkgever, AMC) |
Geen |
Geen actie |
|
O. Snieders |
functioneel uroloog maatschap Urologen voor U (diakonessenhuis utrecht/zeist/doorn en st. antonius ziekenhuis utrecht/nieuwegein) |
lid calamiteiten onderzoeksgroep (COG) diakonessenhuis (betaald) penningmeester regiomaatschap (onbetaald) |
Geen |
Geen actie |
|
F. Willeboordse |
Adviseur Kennisinstituut |
Geen |
Geen |
Geen actie |
|
M. Ruiter |
Adviseur Kennisinstituut |
Geen |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een patiëntenfocusgroep en afgevaardigde patiëntvertegenwoordiger in de werkgroep. Een verslag hiervan (zie aanverwante producten) is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. De conceptrichtlijn is voor commentaar voorgelegd aan Stichting Family and patient Centered Intensive Care (Stichting FCIC), aan IC Connect, de patiëntenorganisatie voor (voormalig) IC-patiënten en naasten en aan de Patiëntenfederatie Nederland.
Patiëntenparticipatie bij deze richtlijn werd medegefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stapbeschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door vertegenwoordigers van Ambulancezorg Nederland, Inspectie Gezondheidszorg en Jeugd, Nederlandse Internisten Vereniging, Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose, Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde, Nederlandse Vereniging van Ziekenhuizen, Nederlandse Vereniging van Ziekenhuisapothekers, Family and Paitent Centered Intensive Care/ IC connect, Sepsis en daarna, Stichting Werkgroep Antibiotica Beleid, Vereniging Innovatieve Geneesmiddelen, Dutch Acute Medicine via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur conceptuitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vond.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk-of-bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de risk-of-biastabellen. De gebruikte risk-of-biasinstrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk-of-bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module toekomstige module Randvoorwaarden. Die wordt ontwikkeld bij de richtlijn Sepsis fase 2 en 3.
Indicatorontwikkeling
De werkgroep heeft besloten geen indicatoren te ontwikkelen bij de huidige richtlijn, omdat er of geen substantiële barrières konden worden geïdentificeerd die implementatie van de aanbeveling zouden kunnen bemoeilijken en er zijn al voldoende ondersteunende maatregelen actief zijn in de zorgpraktijk zoals de huidige indicator vroege herkenning sepsis in de basisset 2019.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
