Methadon
Uitgangsvraag
Wat is de meerwaarde van de toevoeging van intra-operatief methadon bij patiënten die een chirurgische ingreep ondergaan?
Aanbeveling
Gebruik methadon als intra-operatief opioïde wanneer matige tot ernstige postoperatieve pijn wordt verwacht. Methadon heeft hierbij de voorkeur boven andere opioïden.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is een systematische literatuur analyse uitgevoerd naar de effectiviteit van intra-operatief methadon vergeleken met andere opioïden bij patiënten die een chirurgische ingreep ondergingen. Postoperatieve pijn was de cruciale uitkomstmaat en het postoperatieve gebruik van opioïden was een belangrijke uitkomstmaat voor klinische besluitvorming. De literatuur omvat studies bij patiënten in dagbehandeling en bij patiënten met een langere ziekenhuisopname.
De bewijskracht is redelijk (GRADE) voor pijnscores op de verkoeverkamer, 4 tot 8, 12, 24 en 48 uur postoperatief doordat het kleine studies omvat. Er werd op alle tijdstippen een klinisch relevant verschil gevonden in het voordeel van methadon.
Voor het effect van methadon op postoperatief gebruik van opioïden is een redelijke bewijskracht gevonden in het voordeel van methadon voor de periode in de verkoeverkamer, 24 uur postoperatief en totale postoperatieve periode.
Vooral de combinatie van lagere pijn scores en lager opioïdengebruik wijst op een sterk analgetische effect van de intra-operatieve toediening van methadon.
Er is ook gekeken naar de incidentie van adverse events, zoals respiratoire depressie, hartritmestoornissen en postoperatieve misselijkheid bij intra-operatieve toediening van methadon. De bewijskracht van respiratoire depressie is redelijk (GRADE) vanwege weinig events. Er werd geen klinisch relevant verschil gevonden tussen de groepen. De bewijskracht van hartritmestoornissen is laag (GRADE), omdat er slechts twee studies werden geïncludeerd met weinig patiënten en weinig events.
Voor postoperatieve misselijkheid en braken is de bewijskracht zeer laag (GRADE) omdat de resultaten inconsistent en imprecies zijn.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Voor patiënten is het belangrijk om een adequate postoperatieve pijnstilling te hebben, met zo min mogelijk complicaties. De voorkeur gaat ernaar uit om indien mogelijk het gebruik van opioïden postoperatief te beperken. Hierdoor zal het risico op de bijwerkingen door opioïden afnemen, zoals obstipatie, sufheid en postoperatieve misselijkheid en braken. Deze literatuuranalyse suggereert een langdurig analgetisch effect bij gebruik methadon intra-operatief, waardoor een lager postoperatief gebruik van aanvullende opioïden nodig is. Daarnaast lijkt methadon voor de patiënt niet tot meer adverse events te zorgen, omdat er niet tot nauwelijks een verschil is gerapporteerd in respiratoire depressie en hartritmestoornissen. Voor misselijkheid en braken kan de werkgroep geen eenduidige conclusie trekken over het effect van methadon.
Kosten (middelenbeslag)
De eenmalige intra-operatieve toediening van methadon is goedkoper dan of vergelijkbaar met de intra-operatieve toediening van korter werkende opioïden. Daarnaast wordt er bespaard op materialen en personele inzet postoperatief op de verkoeverkamer en op de afdeling vanwege het lager postoperatieve gebruik van aanvullende opioïden en de lagere pijnscores.
Aanvaardbaarheid, haalbaarheid en implementatie
De intra-operatieve toediening van methadon is kosteneffectief en tijdseffectief. Bij veel centra is er in Nederland al enige ervaring met parenteraal methadon. Bij sommige centra waar parenteraal methadon momenteel geen onderdeel is van het assortiment, kan een implementatietraject benodigd zijn. In die centra dient nagegaan te worden of parenteraal methadon in het assortiment moet worden opgenomen en hoe parenteraal methadon dusdanig geïmplementeerd wordt, dat het veilig kan worden toegediend. Op dit moment is er geen farmaceutisch bedrijf dat methadon als injectievloeistof in Nederland commercieel aanbiedt, maar wordt het alleen door grootbereiders bereid.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
De intra-operatieve toediening van methadon heeft een sterk analgetisch effect en leidt mogelijk tot een vermindering van postoperatieve pijnscores en postoperatief gebruik van opioïden.
Dit effect is al door de eenmalige toediening van 0,125 – 0,2 mg/kg (ideal body weight) methadon i.v. bijvoorbeeld bij of kort na inleiding te bereiken. Vaak is daarna geen verdere toediening van intra-operatieve opioïden nodig.
Onderbouwing
Achtergrond
Methadon is een potent opioïde met een lange halfwaardetijd en een langdurig analgetisch effect. Terwijl agonisme van de µ-opioïde receptor het primaire werkingsmechanisme is, werkt methadon ook als een agonist van κ- en σ-opioïde receptoren in het centrale en perifere zenuwstelsel. Daarnaast is methadon een antagonist aan de N-methyl-d-aspartate (NMDA) receptor en werkt via de inhibitie van serotonine en noradrenaline reuptake. Daarmee is het een potente pijnstiller die zowel de nociceptieve als de neuropathische pijn bestrijdt. Intra-operatieve toediening van methadon vermindert mogelijk postoperatieve pijnscores en postoperatief gebruik van opioïden. Methadon is al sinds 1947 beschikbaar, maar werd in Nederland nauwelijks intra-operatief als opioïde gebruikt. Lange tijd was in de anesthesie een focus op steeds korter werkende opioïden, pas sinds kort is er weer een toenemende interesse aan het intra-operatieve gebruik van langwerkende opioïden.
Conclusies
Postoperative pain
|
Moderate GRADE |
Intraoperative methadone likely lowers pain scores at PACU arrival, at 4 to 8 hours, at 12 hours, at 24 hours and 48 post-surgery when compared to other opioids in surgical patients.
Sources: Bastian, 2019; Gottschalk, 2011; Komen, 2019; Laur, 1995; Machado, 2018 Murphy, 2015; Murphy, 2017. |
Postoperative opioid consumption
|
Moderate GRADE |
Intraoperative methadone likely reduces postoperative opioid consumption in PACU, 24 hours and total postoperative period when compared to other opioids in surgical patients.
Sources: Bastian, 2019; Chui, 1992; Gottschalk, 2011; Komen, 2019; Laur, 1995; Machado, 2018; Murphy, 2015; Murphy, 2017. |
Adverse events
|
Moderate GRADE |
Intraoperative methadone likely results in little to no difference in the incidence of respiratory depression in surgical patients compared to other opioids.
Sources: Chui, 1992; Gottschalk, 2011; Komen, 2019; Murphy, 2015. |
|
Low GRADE |
Intraoperative methadone may result in little to no difference in the incidence of arrhythmias in surgical patients compared to other opioids.
Sources: Gottschalk, 2011; Murphy, 2015. |
|
Very low GRADE |
The evidence is very uncertain about the effect of intraoperative methadone on postoperative nausea and/or vomiting in surgical patients receiving intraoperative methadone compared to those receiving other opioids.
Sources: Bastian, 2019; Chui, 1992; Gottschalk, 2011; Komen, 2019; Machado, 2018; Murphy, 2015. |
Samenvatting literatuur
Description of studies
As shown in table 1, different controls were used, in various surgeries and using different scales to assess postoperative pain. All studies were single-centered RCTs.
Table 1. Characteristics of studies that compared methadone with controls.
|
Author, year |
N (I/C) |
Surgery type |
Intervention |
Control |
||
|
Dose |
Timing |
Dose |
Timing |
|||
|
Bastian, 2019 |
73/57 |
Moderate–severe painful surgery (i.e. thoraco-abdominal, including laparotomy and laparoscopy; breast; orthopedic; and vascular) |
0.2 mg/kg methadone |
Before induction |
3 mcg/kg fentanyl |
Before induction |
|
Chui, 1992 |
15/15 |
Abdominal hysterectomies |
0.25 mg/kg methadone |
At induction |
0.25 mg/kg morphine |
At induction |
|
Gottschalk, 2011 |
13/16 |
Spine |
0.2 mg/kg methadone |
Subsequent to intubation |
Sufentanil infusion of 0.25 g/kg/h after a load of 0.75 g/kg |
End of surgery |
|
Komen, 2019 |
21/21 |
Laparoscopic cholecystectomy, tubal ligation, and oophorectomy/ salpingectomy |
0.15 mg/kg IBW methadone |
At induction |
Mixed |
Unrestricted during surgery |
|
Laur, 1995 |
15/15 |
Orthopedic |
0.3 mg/kg methadone |
3 intervals during induction |
0.3 mg/kg morphine |
3 intervals during induction |
|
Machado, 2019 |
16/16 |
Bariatric |
0.15 mg/kg (IBW + 20%) methadone |
At induction |
6 mcg/kg fentanyl |
At induction |
|
Murphy, 2015 |
77/79 |
Cardiac |
0.3 mg/kg methadone |
At induction and over 2 hrs |
12 mcg/kg fentanyl |
At induction and over 2 hrs |
|
Murphy, 2017 |
62/53 |
Spinal fusion |
0.2 mg/kg methadone |
Start of surgery |
2 mg hydromorphone |
End of surgery |
IBW: ideal body weight
Results
Methadone versus standard care
1. Postoperative pain
1.1 Postoperative pain at PACU arrival
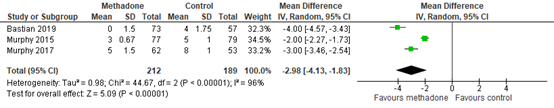
Median pain scores at PACU arrival (between 0 and 15 minutes following admission) were reported by Bastian (2019), Murphy (2015) and Murphy (2017). Means and standard deviations were estimated from the medians and interquartile ranges using the method by Hozo (2005). The results are presented in figure 1. A mean difference (MD) of -2.98 (95% CI -4.13, -1.83) was found in favour of methadone. This difference is considered clinically relevant.
Figure 1. Postoperative pain at PACU arrival.
Z: p-value of the pooled effect; df: degrees of freedom; I2: statistic heterogeneity; CI: Confidence Interval
In addition to the pooled data, Komen (2019) reported pain scores in figures. A verbal scale (0 to 10) was used to collect the data. The methadone group that received 0.15 mg/kg methadone had far lower pain scores than the control group that used other opioids.
1.2 Postoperative pain at 4 to 8 hours post-surgery
Pain scores at 4 to 8 hours post-surgery were reported by Chui (1992), Komen (2019), Machado (2018) and Murphy (2015). Data were too limited to be pooled. Therefore, the results are described below.
Chui (1992) reported pain scores in figures. At 4 hours post-surgery, the median pain score was 1 in the methadone group and 3 in the morphine group. At 8 hours post-surgery, the median pain score was 1 in the methadone group and 2.5 in the morphine group. This difference was considered clinically relevant in favour of methadone.
Komen (2019) reported pain scores in figures. A verbal scale (0 to 10) was used to collect the data. The methadone group and the control group had similar pain scores at 4 hours post-surgery.
Machado (2018) reported pain scores in figures and as mean difference. At 6 hours post-surgery, the pain score in the fentanyl group was 2.4 and in the methadone group 0 (MD 2.4, 95% CI 1.5 to 3.3). This difference was considered clinically relevant in favour of methadone.
Murphy (2015) reported median pain scores. At 4 hours post-surgery, this was 2 (IQR 1-4) in the methadone group and 3 (IQR 1-6) in the fentanyl group (median difference −1 (99% CI −2 to 0)). At 8 hours post-surgery, the methadone group had a pain score of 2 (IQR 0-4) and the fentanyl group had a pain score of 4 (IQR 2-6) (median difference −2 (99% CI −3 to 0)) This difference was considered clinically relevant in favour of methadone.
1.3 Postoperative pain at 12 hours post-surgery
Pain scores at 12 hours post-surgery were reported by Chui (1992) and Murphy (2015).
Chui (1992) reported pain scores in figures. At 12 hours post-surgery, the median pain score was 2 in the methadone group and 3 in the morphine group.
Murphy (2015) reported median pain scores. At 12 hours post-surgery, the methadone group reported a pain score of 2 (IQR 0-4) and the fentanyl group a pain score of 4 (IQR 2- 5) (median difference −1 (99% CI −2 to 0)). This difference was considered to be clinically relevant in favour of methadone.
1.4 Postoperative pain at 24 hours post-surgery
Several studies pain scores at 24 hours post-surgery. If mean or median pain scores in the control group was 0 or 1, no conclusions can be made about a pain score lowering effect of methadone at this time point. Therefore, these data were not included. No pooled data were obtained, since no absolute data were presented or data were reported in medians. The results are described below.
Chui (1992) reported pain scores in figures. The median pain score was 1 in the methadone group and 3 in the morphine group.
Gottschalk (2011) reported pain scores in figures. The mean pain score was 4 in the methadone group and 5 in the sufentanil group.
Murphy (2015) reported median pain scores. This was 2 (IQR 1-4) in the methadone group and 4 (IQR 2-7) in the fentanyl group (median difference −2 (99% CI −3 to 0)).
Murphy (2017) reported median pain scores. This was 4 (IQR 2-5) in the methadone group and 5 (IQR 3-8) in the hydromorphone group (median difference −1).
Machado (2018) reported VAS (0-10) pain scores in figures and mean difference. The methadone group reported a pain score of 0 and the fentanyl group a slightly higher pain score (MD 0.9, 95% CI 0.2 to 1.5).
1.5 Postoperative pain at 48 hours post-surgery
Pain scores at 48 hours post-surgery were found in Bastian (2019), Gottschalk (2011), Murphy (2015) and Murphy (2017). Bastian (2019), Murphy (2015) and Murphy (2017) reported median pain scores. Therefore, means and standard deviations were estimated from the medians and interquartile ranges using the method by Hozo (2005). For all scales, a lower score indicated less pain. If mean or median pain scores in the control group was 0 or 1 no conclusions can be made about a pain score lowering effect of methadone at this time point. Therefore, these data were not included.
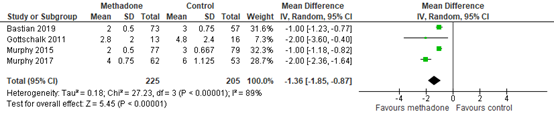
In figure 2, pain scores at 48 hours post-surgery are presented. A MD favour of -1.36 (95% CI -1.85, -0.87) was found in favour of methadone. This difference is considered clinically relevant.
Figure 2. Postoperative pain at 48 hours post-surgery
Z: p-value of the pooled effect; df: degrees of freedom; I2: statistic heterogeneity; CI: Confidence Interval
In addition to the pooled data, Machado (2018) reported pain scores at 48 hours post-surgery that could not be pooled.
The pain scores were 0 in both groups at 48 hours (MD 0.2, 95% CI -0.1 to 0.6).
2. Postoperative opioid consumption
Five studies reported postoperative opioid consumption. All reported doses were converted to morphine milligram equivalents (MME) i.v. The postoperative period varied between studies. Two studies reported postoperative opioid consumption in PACU (Bastian, 2019; Murphy, 2017), four studies reported 24 hours post-surgery (Laur, 1995; Murphy, 2015; Murphy, 2017; Gottschalk, 2011), and three total postoperative periods (Murphy, 2015; Murphy, 2017; Bastian, 2019). Rescue opioids included fentanyl (Bastian 2019) morphine (Murphy 2015), hydromorphone (Murphy, 2017) or is unspecified (Gottschalk, 2011; Laur, 1995).
In PACU:
Murphy (2017) reported median postoperative hydromorphone consumption. The methadone group consumed 1 (0.5–1.60) mg hydromorphone and the hydromorphone group 1.85 (1.5–3.53) mg hydromorphone.
Bastian (2019) reported mean postoperative morphine dose in figures. The methadone group consumed on PACU a far lower dose of morphine than the fentanyl group (P<0.01).
Komen (2019) reported median postoperative opioid consumption in mg morphine equivalent. The 0.15 mg/kg methadone group consumed 0.1 mg MME, the control (short duration opioid) group consumed 9.3 mg MME.
In 24h:
Murphy (2015) reported median postoperative morphine consumption. The methadone group consumed 6 mg morphine (IQR: 4-12) and the fentanyl group 10 mg (6-22).
Murphy (2017) reported median postoperative hydromorphone consumption. The methadone group consumed 4.56 (IQR 2.30-7.10) and the hydromorphone group 9.90 (6.45-13.20) mg hydromorphone.
Laur (1995) reported postoperative narcotic use in means. It was not specified what narcotics were used. The methadone group required 54.7 mg MME (SD: 55.3) and the morphine group 45.3 mg MME (SD: 32.9).
Gottschalk (2011) reported median postoperative opioid requirement in figures. The methadone group consumed 49 mg and the sufentanil group 103 mg.
Bastian (2019) reported mean postoperative morphine dose in figures. The methadone group consumed on day 1 a far lower dose of morphine than the fentanyl group (P<0.05).
Machado (2018) reported mean postoperative morphine consumption in figures. The methadone group consumed a far lower dose of morphine in the first 24h than the fentanyl group.
Total postoperative period:
Murphy (2015) reported median postoperative morphine consumption. The methadone group required 8 mg (IQR: 4-14) and the fentanyl group required 14 mg (8-28).
Murphy (2017) reported median postoperative hydromorphone consumption. The methadone group consumed 8.78 (IQR 4.65–14.7) and the hydromorphone group 21.9 (14.7–34.95) mg MME.
Bastian (2019) reported median postoperative morphine dose in figures. The total postoperative period was 72 hours. The methadone group consumed a far lower dose of morphine than the fentanyl group (P<0.001).
Gottschalk (2011) reported in a figure a far lower median opioid requirement in morphine equivalents at each of the first three postoperative days in the methadone group compared to the sufentanil group.
Chui (1992) reported in a figure a far lower number of injections of morphine 7.5 mg im in the methadone group compared to the morphine group administered in the 48-hour study period.
3. Adverse events
3.1 Respiratory depression
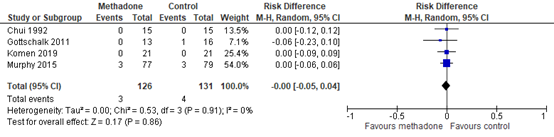
Four studies reported the incidence of respiratory depression. As shown in figure 3, a risk difference (RD) of -0.00 (95% CI -0.05, 0.04) was found. This difference was not considered clinically relevant.
Figure 3. Respiratory depression
Z: p-value of the pooled effect; df: degrees of freedom; I2: statistic heterogeneity; CI: Confidence Interval
3.2 Arrhythmia
Two studies reported the incidence of arrhythmia as outcome measure. Due to limited data, these could not be pooled.
Gottschalk (2011) reported arrhythmia in 1 out of 13 (7.7%) in the methadone group and 0 out of 16 (0%) in the control group.
Murphy (2015) reported 30 out of 77 (39.0%) cases of arrhythmia in the methadone group and 33 out of 79 (41.8%) in the control group. These were all cardiac patients.
3.3 Postoperative nausea and/or vomiting
Six studies reported the incidence of postoperative nausea and/or vomiting. As shown in figure 4, a RR of 0.97 (95% CI 0.65, 1.44) was found.
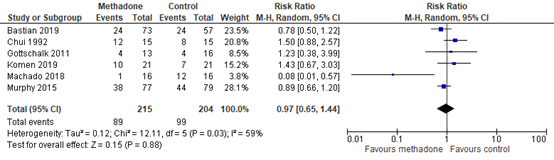
Figure 4. Postoperative nausea and/or vomiting
Z: p-value of the pooled effect; df: degrees of freedom; I2: statistic heterogeneity; CI: Confidence Interval
Level of evidence of the literature
The level of evidence regarding the outcome measure postoperative pain at each time point started as high, because the studies were RCTs.
The level of evidence regarding the outcome measure postoperative pain at PACU arrival was downgraded by 1 level because number of included patients (imprecision, -1). The level of evidence is moderate (GRADE).
The level of evidence regarding the outcome measure postoperative pain at 4 to 8 hours post-surgery was downgraded by 1 level because of number of included patients (imprecision, -1). The level of evidence is moderate (GRADE).
The level of evidence regarding the outcome measure postoperative pain at 24 hours post-surgery was downgraded by 1 level because of the number of included patients (imprecision, -1). The level of evidence is moderate (GRADE).
The level of evidence regarding the outcome measure postoperative pain at 48 hours post-surgery was downgraded by 1 level because of the pooled effect crossing the border of clinical relevance (imprecision, -1). The level of evidence is moderate (GRADE).
The level of evidence regarding the outcome measure postoperative opioid consumption started as high, because the studies were RCTs.
The level of evidence for postoperative opioid consumption in PACU was downgraded by 1 level because of the number of included patients (imprecision, -1). The level of evidence is moderate (GRADE).
The level of evidence for postoperative opioid consumption in 24h was downgraded by 1 level because of the pooled effect crossing the border of clinical relevance (imprecision, -1). The level of evidence is moderate (GRADE).
The level of evidence for total postoperative opioid consumption was downgraded by 1 level because of the number of included patients (imprecision, -1). The level of evidence is moderate (GRADE).
The level of evidence regarding the outcome measure adverse events started as high, because the studies were RCTs.
The level of evidence of respiratory depression was downgraded by 1 level because of very few events (imprecision, -1). The level of evidence is moderate (GRADE).
The level of evidence of arrhythmia was downgraded by 2 levels because of the number of included patients and very few events (imprecision, -2). The level of evidence is low (GRADE).
The level of evidence of postoperative nausea and/or vomiting was downgraded by 3 levels because of conflicting results (inconsistency, -1) and the pooled effect crossing the border of clinical relevance (imprecision, -2). The level of evidence is very low (GRADE).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the effectiveness of adding methadone intraoperatively to standard care in surgical patients on postoperative pain, adverse outcomes and rescue analgesic consumption?
P (patients) patients undergoing a surgical procedure
I (intervention) intraoperative methadone i.v.
C (comparison) standard care
O (outcomes) postoperative pain
postoperative opioid consumption
adverse events
Relevant outcome measures
The guideline development group considered postoperative pain as a critical outcome measure for decision making; and postoperative opioid consumption and adverse events as an important outcome measure for decision making.
The working group defined the outcome measures as follows:
Postoperative pain at rest: Validated pain scale (Visual Analogue Scale (VAS), Numeric Rating Scale (NRS) or Verbal Rating Scale (VRS)) at post-anesthesia care unit (PACU) arrival, 4 to 8, 12, 24 and 48 hours post-surgery. Postoperative opioid consumption was assessed in PACU, 24 hours post-surgery and total postoperative period.
Adverse events included in this analysis were respiratory depression, arrhythmia, and postoperative nausea and vomiting. These adverse events were not defined a priori by the working group, but the definitions used in the studies were applied.
Chronic postoperative pain is acknowledged by the working group as a relevant patient outcomes measure, however scarcely studied. In this module chronic postoperative pain is not described in the PICO and results only mentioned in the knowledge gaps.
The working group defined one point as a minimal clinically (patient) important difference on a 10-point pain score and 10 mm on a 100 mm pain scale. Regarding postoperative opioid consumption, a difference of 10 mg was considered clinically relevant. For dichotomous variables, a difference of 10% was considered clinically relevant (RR ≤0.91 or ≥1.10; RD 0.10).
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 29-06-2021. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 179 hits. Studies were selected based on the following criteria:
- Systematic review or RCT
- Published ≥ 1980
- Patients ≥ 18 years
- Conform PICO
Twenty-nine studies were initially selected based on title and abstract screening. After reading the full text, 27 studies were excluded (see the table with reasons for exclusion under the tab Methods), and two studies were included: one systematic review (Cheriyan, 2021) and one RCT (Chui, 1992).
Results
Eight studies (of which seven studies originated from one systematic review (Cheriyan, 2021) and one single RCT (Chui, 1992) were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Bastian K, Buehler PK, Slizyte D, Rüst CA, Toft K, Studer W, Lecheler L, Aguirre J, Siegemund M, Hollinger A. A preoperative single dose of methadone for moderate-to-severely painful surgery reduces postoperative morphine consumption. Minerva Anestesiol. 2019 Oct;85(10):1053-1061. doi: 10.23736/S0375-9393.19.13136-7. Epub 2019 May 14. PMID: 31106550.
- Chui PT, Gin T. A double-blind randomised trial comparing postoperative analgesia after perioperative loading doses of methadone or morphine. Anaesth Intensive Care. 1992 Feb;20(1):46-51. doi: 10.1177/0310057X9202000109. PMID: 1609941.
- Gottschalk A, Durieux ME, Nemergut EC. Intraoperative methadone improves postoperative pain control in patients undergoing complex spine surgery. Anesth Analg. 2011 Jan;112(1):218-23. doi: 10.1213/ANE.0b013e3181d8a095. Epub 2010 Apr 24. PMID: 20418538.
- Hozo SP, Djulbegovic B, Hozo I. Estimating the mean and variance from the median, range, and the size of a sample. BMC Med Res Methodol. 2005 Apr 20;5:13. doi: 10.1186/1471-2288-5-13. PMID: 15840177; PMCID: PMC1097734.
- Komen H, Brunt LM, Deych E, Blood J, Kharasch ED. Intraoperative Methadone in Same-Day Ambulatory Surgery: A Randomized, Double-Blinded, Dose-Finding Pilot Study. Anesth Analg. 2019 Apr;128(4):802-810. doi: 10.1213/ANE.0000000000003464. PMID: 29847382; PMCID: PMC6995343.
- Laur DF, Sinkovich J, Betley K. A comparison of intraoperative morphine sulfate and methadone hydrochloride on postoperative visual analogue scale pain scores and narcotic requirements. CRNA. 1995 Feb;6(1):21-5. PMID: 7599543.
- Machado FC, Palmeira CCA, Torres JNL, Vieira JE, Ashmawi HA. Intraoperative use of methadone improves control of postoperative pain in morbidly obese patients: a randomized controlled study. J Pain Res. 2018 Oct 2;11:2123-2129. doi: 10.2147/JPR.S172235. PMID: 30323647; PMCID: PMC6174683.
- Murphy GS, Szokol JW, Avram MJ, Greenberg SB, Marymont JH, Shear T, Parikh KN, Patel SS, Gupta DK. Intraoperative Methadone for the Prevention of Postoperative Pain: A Randomized, Double-blinded Clinical Trial in Cardiac Surgical Patients. Anesthesiology. 2015 May;122(5):1112-22. doi: 10.1097/ALN.0000000000000633. PMID: 25837528.
- Murphy GS, Szokol JW, Avram MJ, Greenberg SB, Shear TD, Deshur MA, Vender JS, Benson J, Newmark RL. Clinical Effectiveness and Safety of Intraoperative Methadone in Patients Undergoing Posterior Spinal Fusion Surgery: A Randomized, Double-blinded, Controlled Trial. Anesthesiology. 2017 May;126(5):822-833. doi: 10.1097/ALN.0000000000001609. PMID: 28418966.
Evidence tabellen
Evidence tables
Risk of bias table for intervention studies
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
Chui, 1992 |
Probably no
Reason: Method of randomization is not discussed. |
Probably yes
Reason: Drugs were prepared in precoded syringes and administered in a double blind manner |
Probably yes
Reason: Patients, health care providers and outcome assessors blinded (blinding of data collectors and analysts not reported) |
Probably yes
Reason: No loss to follow-up was mentioned |
Definitely yes
Reason: All relevant outcomes were reported; |
Definitely yes;
Reason: No other problems noted |
LOW
|
Table of quality assessment for systematic reviews of RCTs and observational studies
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Cheriyan, 2021 |
Yes Research question corresponds to question of our review |
Yes |
No Reason for exclusion is not provided |
Yes |
Not applicable |
Yes Determined with Cochrane risk of bias tool |
Unclear Different surgery types, doses, comparators and low I2 |
No |
Yes however individual studies are not discussed
|
Evidence table for intervention studies - RCTs
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Chui, 1992 |
Type of study: RCT
Setting and country: China
Funding and conflicts of interest: Unknown |
Inclusion criteria: Patients scheduled for elective abdominal hysterectomies, aged below 60, ASA classes I or 11, had not received any opioids for 24 hours before surgery and did not have a history of psychiatric illness or drug abuse
Exclusion criteria: -
N total at baseline: Intervention: 15 Control: 15
Important prognostic factors2: age ± SD: I: 40.7 C: 41.5
Groups comparable at baseline? Yes |
Describe intervention (treatment/procedure/test):
At induction of anaesthesia, 0.25 mg.kg -1 methadone was given intravenously (IV), followed 20 seconds later by thiopentone 4.5 mg.kg-1 and vecuronium 0.12 mg.kg-1
|
Describe control (treatment/procedure/test):
At induction of anaesthesia, 0.25 mg.kg -1 morphine was given intravenously (IV), followed 20 seconds later by thiopentone 4.5 mg.kg-1 and vecuronium 0.12 mg.kg-1
|
Length of follow-up: 48h
Loss-to-follow-up: Not reported
Incomplete outcome data: Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
Pain scores Displayed in figures. “Pain scores in the methadone group declined subsequently and the scores remained low for the 48 hour study period. The morphine group of patients had a higher total pain score for the 48 hour study period (P< 0.001) despite having received more supplementary doses of morphine. Further analysis showed that the difference in pain scores between groups was significant at all time points from 4 hours to 48 hours except at 12 hours and the difference was greatest at 20 hours.”
Nausea and/or vomiting in PACU I: 11/15 C: 3/15
Nausea and/or vomiting in ward I: 12/15 C: 8/15
Respiratory depression I: 0 C: 0
Postoperative opioid consumption Number of 7.5 mg morphine injections in 48 h post-operative was reported I: 0 injections (n=10), 1 injection (n=3), 2 injections (n=1), 4 injections (n=1)* C: 2 injections (n=6), 3 injection (n=3), 4 injections (n=2), 5 injections (n=4), 6 injections (n=1)** *total dose: 67.5 mg **total dose: 412.5 mg |
|
Evidence table for intervention studies – SRs
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Cheriyan 2021 |
SR and meta-analysis of 9 RCTs
Literature search up to May 1, 2020
A: Carvalho, 2018 B: Udelsmann, 2011 C: Laur, 1995 D: Komen, 2019 E: Machado, 2019 F: Murphy, 2015 G: Gottschalk, 2010 H: Murphy, 2017 I: Bastian, 2019
Source of funding: Unknown
|
Inclusion criteria SR: peer-reviewed published RCTs that compared between intraoperative methadone and other opioids (morphine, hydromorphone, fentanyl, or sufentanyl) and reported on at least one of these outcome measures: postoperative opioid consumption, number of patients who received postoperative opioids, time to first analgesic, and pain score within 24 hours and between 24 and 72 hours, time to first analgesic received, time to extubation, incidence of nausea and/or vomiting, and respiratory depression
No baseline characteristics or potential confounders were reported. |
Methadone
Dose A: 0.1 mg/kg B: 20 mg C: 0.3 mg/kg D: 0.1 mg/kr OR 0.15 mg/kr E: 0.15 mg/kr F: 0.3 mg/kg (max. 30 mg) G: 0.2 mg/kg H: 0.2 mg/kg I: 0.2 mcg/kg
|
Opioids
Morphine dose: A: 0.1 mg/kg B: 20 mg C: 0.3 mg/kg
Mixed
Fentanyl dose: E: 6 mcg/kg IBW F: 12 mcg/kg (max. 1200 mcg) I: 3 mcg/kg
Sufentanyl dose: G: 0.25 g/kg/h after a load of 0.75 g/kg
Hydromorphone dose: H: 2 mg |
Endpoint of follow-up: Unknown for individual studies
For how many participants were no complete outcome data available? Unknown for individual studies
|
Postoperative opioid consumption, number of patients who received postoperative opioids, pain score within 24 hours and between 24 and 72 hours, time to first analgesic received, time to extubation, incidence of nausea and/or vomiting, and respiratory depression
Postoperative opioid consumption I vs C Mean (SD); SMD [95% CI]
C: 54.7 (55.3) vs 45.3 (32.9); 0.20 [-0.52, 0.92] F: 10.4 (8.2) vs 24.7 (28.9); -0.67 [-0.99, -0.34] H: 31.8 (31.88) vs 76.4 (62.8); -0.91 [-1.30, -0.53] I: 34 (33) vs 34 (33.8); 0.00 [-0.35, 0.35] Total: -0.39 [-0.87, 0.10]
Pain score at 24 h I vs C Mean (SD); SMD [95% CI] A: 1.9 (2.2) vs. 2.9 (2.6); -0.41 [-0.81, -0.02] B: 0.5 (0.71) vs. 1.84 (1.38); -1.18 [-1.89, -0.48] C: 4.4 (2.87) vs. 4.53 (2.23); -0.05 [-0.77, 0.67] E: 0 (0.1) vs. 0.9 (0.31); -0.94 [-1.68, -0.21] F: 2.63 (2.06) vs. 4.43 (3.11); -0.68 [--1.01, -0.35] G: 3.9 (1.8) vs. 5 (2.7); -0.46 [-1.20, 0.29] H: 3.98 (2.4) vs. 5.27 (2.7); -0.50 [-0.88, -0.13] I: 1.3 (1.5) vs. 1.3 (1.6); 0.00 [-0.35, 0.35] Total: -0.49 [-0.74, -0.23]
Pain score at 24 – 72 h I vs C Mean (SD); SMD [95% CI] A: 0.5 (1.2) vs. 0.5 (1.1); 0.00 [-0.39, 0.39] E: 0 (0) vs. 0.1 (0) F: 1.73 (1.67) vs. 3 (2.6); -0.58 [-0.90, -0.25] G: 3.2 (1.9) vs. 4.3 (1.9); -0.56 [-1.31, 0.19] H: 3.98 (2.4 vs. 5.27 (2.7); -0.50 [-0.88, -0.13] I: 1.3 (1) vs. 0.96 (1.3); 0.29 [-0.21, 0.79] Total: -0.27 [-0.61, 0.07]
Nausea and/or vomiting I vs C Event/total; OR [95% CI] B: 1/18 vs. 6/19; 0.13 [0.01, 1.19] I: 24/73 vs. 24/57; 0.67 [0.33, 1.38] Total: 0.41 [0.09, 1.84]
Nausea I vs C Event/total; OR [95% CI] A: 8/50 vs. 10/50; 0.76 [0.27, 2.12] D: 10/21 vs. 7/21; 1.82 [0.52, 6.33] E: 1/16 vs. 12/16; 0.02 [0.00, 0.23] F: 38/77 vs. 44/79; 0.78 [0.41, 1.45] G: 4/13 vs. 4/16; 1.33 [0.26, 6.83] Total: 0.75 [0.35, 1.60]
Vomiting I vs C Event/total; OR [95% CI] A: 3/50 vs. 2/50; 1.53 [0.24, 9.59] D: 2/21 vs 1/21; 2.11 [0.18, 25.17] E: 1/16 vs 12/16; 0.02 [0.00, 0.23] F: 18/77 vs. 15/79; 1.30 [0.60, 2.81] G: 1/13 vs. 3/16; 0.36 [0.03, 3.96] Total: 0.57 [0.16, 2.04]
Respiratory depression I vs C Event/total; OR [95% CI] A: 1/50 vs 2/50; 0.49 [0.04, 5.58] D: 0/21 vs 0/21 F: 3/77 vs. 3/79; 1.03 [0.20, 5.25] G: 0/13 vs 1/16; 0.38 [0.01, 10.20] Total: 0.73 [0.21, 2.56] |
Authors conclude that there is currently insufficient evidence to support the use of intraoperative methadone to decrease postoperative opioid requirements, when compared with other opioids. There was no reduction in the number of patients who required postoperative opioids. Although there was a decrease in average pain scores in the methadone cohort when compared with controls at 24 hours, there was no difference between 24 and 72 hours |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Lobova, 2021 |
Not conform PICO (limited P, wrong publication types included) |
|
Porter, 1983 |
Not conform PICO (wrong C, O) |
|
Tognoli, 2020 |
Not conform PICO (wrong I) |
|
Simoni 2009 |
Not conform PICO (wrong O) |
|
Hu, 2020 |
Not conform PICO (wrong I) |
|
Ebneshahidi, 2021 |
Not conform PICO (wrong I) |
|
Carta, 1987 |
Not conform PICO (wrong C) |
|
Murphy, 2021 |
Not conform PICO (wrong C) |
|
Pacreu, 2012 |
Not conform PICO (wrong C) |
|
Murphy, 2020 |
Not conform PICO (wrong O) |
|
D'Souza, 2020 |
Overlap with Cheriyan (2021) |
|
Arriaza, 2021 |
Intervention is below minimum effective dose |
|
Pontes, 2021 |
Intervention is below minimum effective dose |
|
Kendall, 2020 |
Overlap with Cheriyan (2021) |
|
Machado, 2019 |
Overlap with Cheriyan (2021), included pediatric patients |
|
Richlin, 1991 |
Postoperative opioid differs between groups |
|
Bastian, 2019 |
Already included in Cheriyan (2021) |
|
Carvalho, 2018 |
Intervention is below minimum effective dose |
|
Gottschalk, 2011 |
Already included in Cheriyan (2021) |
|
Udelsmann, 2011 |
Limited information on patient population |
|
Martin, 2018 |
Not conform PICO (wrong I, C) |
|
Murphy, 2015 |
Already included in Cheriyan (2021) |
|
Murphy, 2017 |
Already included in Cheriyan (2021) |
|
Gourlay, 1986 |
Postoperative opioid differs between groups |
|
Komen, 2019 |
Already included in Cheriyan (2021) |
|
Laur, 1995 |
Already included in Cheriyan (2021) |
|
Machado, 2018 |
Already included in Cheriyan (2021) |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 01-09-2023
Laatst geautoriseerd : 01-09-2023
Geplande herbeoordeling : 01-09-2028
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met postoperatieve pijn.
Samenstelling van de werkgroep
Werkgroep
Prof. dr. J. (Jörgen) Bruhn, anesthesioloog, (voorzitter) NVA
Prof. dr. dr. M.W. (Markus) Hollmann, anesthesioloog, NVA
Dr. M.F. (Markus) Stevens, anesthesioloog, NVA
Drs. L.J.H. (Lea) van Wersch, anesthesioloog, NVA
Dr. M.H.J. (Margot) Roozekrans, anesthesioloog, NVA
Dr. S.A.S. (Sandra) van den Heuvel, anesthesioloog/pijnspecialist, NVA
Drs. S.J. (Stijn) Westerbos, orthopeed, NOV
Drs. W.L. (Wilson) Li, cardiothoracaal chirurg, NVT
S.F. (Cedric) Lau MSc, ziekenhuisapotheker, NVZA
Dr. R.L.M. (Rianne) van Boekel, verpleegkundig pijnconsulent, V&VN
Drs. I.L. (Ilona) Thomassen-Hilgersom, patiëntvertegenwoordiger, Samenwerkingverband Pijnpatiënten naar één stem
Klankbordgroep
Drs. N.C. (Niels) Gritters van den Oever, intensivist, NVIC
J.P. (Patrick) Rensink, anesthesiemedewerker/pijnconsulent, NVAM
Dr. G. (Gijs) Helmerhorst, orthopeed, NOV
Dr. C.D. (Cor) de Kroon, gynaecoloog-oncoloog, NVOG
Dr. W.J. (Wietse) Eshuis, chirurg, NVvH
Dr. D. (Daphne) Roos, chirurg, NVvH
Met ondersteuning van
Dr. F. Willeboordse, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Dr. L.M.P. Wesselman, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Dr. L.M. van Leeuwen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
I. van Dijk, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Bruhn, voorzitter |
Professor & Afdelingshoofd afdeling Anesthesiologie, Radboud UMC |
Editorial Board Journal of Clinical Monitoring and Computing, onbetaald |
Geen |
Geen actie |
|
Hollmann |
Professor & Afdelingshoofd afdeling Anesthesiologie, Amsterdam UMC, locatie AMC |
|
Geen |
Restricties t.a.v. modules over ketamine en lidocaïne. |
|
Lau |
|
Nationale Werkgroep morbide obesitas en bariatrische chirurgie (KNMP), vergoeding voor bestede uren |
Geen belangenverstrengeling, promotie-onderzoek is op een ander vlak dan waar beoogde werkgroep zich over buigt
|
Geen actie |
|
Boekel, van |
|
|
Geen |
Geen actie |
|
Thomassen-Hilgersom |
Voorzitter Samenwerkingsverband Pijnpatiënten naar één stem vrijwilliger en geen werkgever |
|
Geen |
Geen actie |
|
Li |
Cardiothoracaal chirurg (Radboudumc, Nijmegen) |
Bestuurslid NVT (Nederlandse Vereniging voor Thoraxchirurgie) |
Radboudumc zal in 2021 meedoen aan een RCT naar de optimale vorm van pijnstilling ten tijde van longchirugie (epiduraal versus paravertebraal) OPtriAL - met ZonMw subsidie, geïniteerd vanuit het MMC |
Geen actie |
|
Roozekrans |
Anesthesioloog - Pijnspecialist - Noordwest Ziekenhuisgroep |
Geen |
Geen |
Geen actie |
|
Stevens |
Chef de Clinique kinderanesthesie AUMC locatie AMC |
|
Geen |
Geen actie |
|
Heuvel, van den |
Anesthesioloog-pijnarts, Radboud UMC |
Geen |
Geen |
Geen actie |
|
Wersch, van |
Anesthesioloog, Maasziekenhuis Pantein |
Geen |
Geen |
Geen actie |
|
Westerbos |
Orthopeed, Alrijne ziekenhuis |
Geen |
Geen |
Geen actie |
|
Gritters van den Oever |
Anesthesioloog-intensivist Treant Zorggroep |
|
Geen |
Geen actie |
|
Rensink |
|
|
Geen |
Geen actie |
|
Kroon, de |
Gynaecoloog-oncoloog Leids Univesitair Medisch Centrum (1.0 fte) |
|
Geen |
Geen actie |
|
Roos |
Chirurg |
Geen |
Geen |
Geen actie |
|
Eshuis |
Chirurg, Amsterdam UMC |
Geen |
Geen |
Geen actie |
|
Willeboordse |
Senior adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Partner werkzaam bij Janssen Vaccines, onderdeel van Johnsson &Johnsson, via partner ook financiële belangen (aandelen J&J) |
Geen actie |
|
Wesselman |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
|
|
Geen actie |
|
Leeuwen, van |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
|
|
Geen actie |
|
Dijk, van |
Junior adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door zitting van een afgevaardigde van de patiëntenvereniging (Pijnpatiënten naar één stem) in de werkgroep. De Patiëntenfederatie Nederland en Pijnpatiënten naar één stem werden uitgenodigd voor de invitational conference. Het verslag hiervan [zie aanverwante producten] is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland en Pijnpatiënten naar één stem en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|
Module Organisatie van Zorg |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Transitionele Pijn Service (TPS) |
Geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (>40.000 patiënten). Hoewel de aanbeveling aangeeft dat een andere of nieuwe manier van zorgverlening gewenst is (i.e. andere manier van samenwerking/afstemming tussen zorgverleners) waarbij een TPS-model met TPS-team geïnitieerd wordt, laten eerste kosten-effectiviteitsstudies kostenbesparingen zien. De verwachting is dat TPS leidt tot betere zorg-op-maat, waarbij chronische postoperatieve pijn zorg doelmatiger wordt behandeld. Per ziekenhuis zal de vorm, intensiteit en organisatie van het TPS-model variëren. Zo kunnen ziekenhuizen ook kiezen voor een minder uitgebreid TPS. De aanbeveling geeft relatief veel ruimte voor de precieze invulling. Alle overwegingen tezamen, worden er geen substantiële financiële gevolgen verwacht. |
|
Module Pijnmeting |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Niet-medicamenteuze interventies |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Buikwandblokken |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Borstwandblokken bij mammachirurgie |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Borstwandblokken intrathoracaal |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Continue Wond infusie |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Cryoanalgesie |
Geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module Dexmethason |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Gabapentinoïden |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Ketamine |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Magnesium |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Methadon |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Beta blokkers -Esmolol |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Alpha 2 agonist - Clonidine |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Alpha 2 agonist – Dexmedetomidine |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Lidocaïne |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Multimodale pijnbestrijding |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met postoperatieve pijn.
De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn Postoperatieve pijn (NVA, 2013) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door relevante partijen middels een invitational conference.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
De beoordelingen van de literatuur en de conclusies zijn gedaan op basis van de GRADE systematiek. De werkgroep vindt het belangrijk om relevante beperkingen hiervan aan te geven.
De klinische vraag gaat vaak over een reductie van ernstige postoperatieve pijn en opioïdenconsumptie in een aantal patiënten met resp. over een klinisch relevante reductie van ernstige postoperatieve pijn opioïdenconsumptie bij een individuele patiënt. Hetzelfde geldt voor opioïdenconsumptie; de keuze van een absolute drempelwaarde in mg (i.p.v. een relatieve drempelwaarde in %) maakt dit afhankelijk van tijdstip, ingreep en ernst van de pijn: vroege postoperatieve tijdstippen en (studies met) ingrepen met relatief lage opioïdconsumptie kunnen vaak de MCID niet bereiken.
De keuze van de MCID heeft een bepaalde mate van willekeurigheid en is niet absoluut te zien. Ook zijn de conclusies zo geformuleerd (en geven alleen beperkt antwoord op het effect op een individuele patiënt voor een specifieke ingreep).
In de literatuur worden de eindpunten pijnscores en opioïdenconsumptie separaat van elkaar weer gegeven, suggererend dat deze onafhankelijk van elkaar zijn. Echter kunnen deze twee eindpunten niet onafhankelijk van elkaar beoordeeld worden; in ieder protocol is opgenomen dat pijn behandeld moet worden. Deze separate beoordeling geeft niet altijd een adequaat antwoord op de klinische vraag naar het analgetische effect van een interventie.
Daarnaast worden multimodale componenten als aparte interventies beoordeeld, echter de klinische vraag is naar de effectiviteit als bouwsteen van een multimodale werkwijze.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.