Dexmedetomidine
Uitgangsvraag
Wat is de meerwaarde van het toevoegen van dexmedetomidine aan de multimodale pijnbehandeling bij chirurgische patiënten?
Aanbeveling
Zet dexmedetomidine niet in als eerste keus voor pijnbehandeling.
Overweeg het intra-operatieve gebruik van dexmedetomidine i.v. alleen bij patiënten met relatief hoge hartfrequentie én hoge bloeddruk ondanks voldoende diepe anesthesie.
Houd rekening met de mogelijkheid van ernstige bradycardie. Begin met een lage dosering continu of een laag gedoseerde oplaaddosis.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is een systematische literatuuranalyse uitgevoerd naar de effectiviteit van het toevoegen perioperatief dexmedetomidine, vergeleken met standard zorg of placebo, bij patiënten die een chirurgische ingreep ondergingen. Er werden een systematische review met 24 relevante studies en 14 individuele (additionele) RCT’s geïncludeerd. De studies includeerden 15 tot 68 patiënten per arm. De gemiddelde leeftijd van patiënten varieerde van 24 jaar tot 73 jaar. De chirurgische ingrepen die zij ondergingen waren divers.
Postoperatieve pijn gemeten op 6 en 24 uur postoperatief was de cruciale uitkomstmaat en het postoperatief gebruik van opioïden en adverse events was een belangrijke uitkomstmaat voor klinische besluitvorming. De literatuur omvat studies bij patiënten in dagbehandeling en bij patiënten met een langere ziekenhuisopname.
De bewijskracht voor de cruciale uitkomstmaat postoperatieve pijn op 6 en 24 uur was laag tot redelijk. Hiermee is de overall bewijskracht ook laag tot redelijk. Op 6 en 24 uur na de operatie was de pijnscore van de patiënten die dexmedetomidine kregen lager dan de pijnscore van de patiënten in de controlegroep. Het verschil bereikte echter niet de grens van klinische relevantie (-0.93 en -0.84 op 6 uur en -0.47 en -0.55 op 24 uur na operatie bij een grens van 1 / 10 punten verschil).
De bewijskracht voor de belangrijke uitkomstmaat postoperatief gebruik van opioïden is laag. Het postoperatief gebruik van opioïden lag lager in de interventie groep, maar de verschillen bereikten de grens van klinische relevantie niet (-6.76 mg en -8.54 mg bij een grens van 10 mg).
De bewijskracht voor de belangrijke uitkomstmaat hypotensie is laag tot redelijk. Intra-operatieve en postoperatieve hypotensie heeft een hogere incidentie bij patiënten die dexmedetomidine kregen, dit is een klinisch relevant verschil.
De bewijskracht voor de belangrijke uitkomstmaat bradycardie is redelijk tot hoog. Intra-operatieve en postoperatieve bradycardie heeft een hogere incidentie bij patiënten die dexmedetomidine kregen, dit is een klinisch relevant verschil.
De auteurs van Demiri (2019) geven aan dat intra-operatieve hypotensie en postoperatieve bradycardie niet optraden bij een bolusdosering van dexmedetomidine van minder dan 0,5 µg/kg of als dexmedetomidine alleen continu werd toegediend (zonder bolus). Maar er zijn twijfels over de evidence van de dosisafhankelijkheid van deze bijwerkingen. Daarnaast is er een discussie of een dergelijk lage dosering aan de ene kant wel veilig is, maar waarschijnlijk wel minder effectief is. Een beperking is dat de search van Demiri (2019) slechts tot en met 2018 was.
Belangrijk om mee te nemen in de overwegingen is de POFA-trial van Beloeil (2021). Deze studie werd niet meegenomen in de analyse van het analgetische effect omdat studies die geen placebo als controle hadden (hier remifentanil als controle) werden geëxcludeerd. Deze trial (n=316) werd vervroegd beëindigd in verband met het optreden van ernstige bradycardie bij vijf patiënten in de dexmedetomidine groep vooral bij hogere dosering en op het moment van een additionele vagale stimulatie namelijk CO2-insufflatie voor laparoscopie.
De literatuur alleen kan onvoldoende richting geven aan de besluitvorming. De aanbeveling is daarom mede gebaseerd op aanvullende argumenten waaronder expert opinie, waar mogelijk aangevuld met (indirecte) literatuur.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Voor patiënten is het belangrijk om een adequate postoperatieve pijnbehandeling te hebben, met zo min mogelijk weinig complicaties. De voorkeur gaat ernaar uit om indien mogelijk het gebruik van opioïden te beperken. Hierdoor zal het risico op de bijwerkingen door opioïden afnemen, zoals obstipatie, sufheid en postoperatieve misselijkheid en braken.
Het potentiële toegenomen risico op hypotensie en bradycardie moet wel in acht genomen worden.
Kosten (middelenbeslag)
De algehele kosteneffectiviteit van dexmedetomidine is nog niet in kaart gebracht. Dexmedetomidine is een relatief duurder middel ten opzichte van andere middelen.
Het is onduidelijk of het toedienen van dexmedetomidine leidt tot kortere opnameduur in het ziekenhuis en de daarbij behorende kosten.
Aanvaardbaarheid, haalbaarheid en implementatie
Er zijn geen evaluaties gedaan met betrekking tot de aanvaardbaarheid, implementatie en haalbaarheid van toediening van dexmedetomidine. De toediening van dexmedetomidine vraagt geen extra inzet van zorgverleners en geen ander materiaal. Dexmedetomidine is niet standaard beschikbaar op de meerderheid van de operatiekamers.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Lagere postoperatieve pijnscores zowel na 6 uur als ook na 24 uur in combinatie met een vermindering van het opioïdengebruik na 24 uur spreken voor een klinisch, maar beperkt analgetisch effect van dexmedetomidine.
Dexmedetomidine geeft een verhoogd risico op bradycardie en hypotensie. Hierbij lijken een hogere dosering en een moment van additionele vagale stimulatie, zoals CO2-insufflatie voor laparoscopie, mogelijk belangrijke factoren te zijn.
In vergelijking met andere multimodale componenten met een lager risicoprofiel lijkt dexmedetomidine niet de eerste keuze te zijn. Als een patiënt bij voldoende diepe anesthesie intra-operatief hypertensief en tachycard is, dan kan dexmedetomidine met zijn bloeddruk en hartfrequentie verlagend effect en zijn (beperkt) analgetisch effect als multimodale component overwogen worden.
Onderbouwing
Achtergrond
Multimodale pijnbehandeling wordt gezien als standard of care perioperatief. Verschillende niet-opioïden worden hiervoor gebruikt, waaronder dexmedetomidine en clonidine (Alfa-2 agonisten). Voor deze middelen is het belangrijk om niet alleen naar het analgetische effect te kijken maar ook om dit af te wegen tegen mogelijke hemodynamische bijwerkingen zoals hypotensie en bradycardie.
Conclusies
Postoperative pain
|
Low GRADE
|
Perioperative use of dexmedetomidine may result in little to no difference in postoperative pain at 6 hours when compared to standard analgesics or standard care in adult patients undergoing surgery.
Source: Bielka, 2018; Nikoubakht, 2021; Wang, 2018; Wu, 2022; Xu, 2021; Ye, 2021 |
|
Moderate GRADE
|
Perioperative use of dexmedetomidine likely results in little to no difference in postoperative pain at 24 hours when compared to standard analgesics or standard care in adult patients undergoing surgery.
Source: Bielka, 2018; Chen, 2021; Chilkoti, 2020; Du, 2019; Efe Mercanoglu, 2022; Hadi, 2019; Liu, 2022; Nikoubakht, 2021; Rekatsina, 2021; Shu, 2022; Wang, 2018; u, 2021; Ye, 2021 |
Postoperative analgesic consumption in 24 hours
|
Low GRADE
|
Perioperative use of dexmedetomidine may result in little to no difference in postoperative analgesic consumption in 24 hours when compared to standard analgesics or standard care in adult patients undergoing surgery.
Source: Bielka, 2018; Chilkoti, 2020; Efe Mercanoglu, 2022; Hadi, 2019; Rekatsina, 2021; Wang, 2018 |
Adverse events
|
Moderate
|
Perioperative use of dexmedetomidine likely results in a higher incidence of intraoperative hypotension when compared to standard analgesics or standard care in adult patients undergoing surgery.
Source: Demiri, 2019 |
|
Low GRADE
|
Perioperative use of dexmedetomidine may result in a higher incidence of postoperative hypotension when compared to standard analgesics or standard care in adult patients undergoing surgery.
Source: Demiri, 2019 |
|
High
|
Perioperative use of dexmedetomidine results in a higher incidence of intraoperative bradycardia when compared to standard analgesics or standard care in adult patients undergoing surgery.
Source: Demiri, 2019 |
|
Moderate GRADE
|
Perioperative use of dexmedetomidine likely results in a higher incidence of postoperative bradycardia when compared to standard analgesics or standard care in adult patients undergoing surgery.
Source: Demiri, 2019 |
Samenvatting literatuur
Description of studies
Two systematic reviews and 14 additional RCTs were included in the summary of literature.
Wang (2018) searched the Cochrane Central Register of Controlled Trials, PubMed and Embase until April 2016. RCTs were eligible with patients undergoing surgery receiving a2-adrenoceptor agonist (dexmedetomidine) perioperatively, compared with placebo. Studies comparing dexmedetomidine with non-placebo control were excluded. A total of 40 RCTs were included in the quantitative analysis. Studies reporting the outcomes that were relevant for the current literature summary were included. In total, 24 RCTs from Wang (2018) were included in the current summary. This review was included for the outcome measures of postoperative pain (6 and 24 hours) and postoperative opioid consumption (24 hours).
Demiri (2019) searched the Cochrane Central Register of Controlled Trials, MEDLINE,
Embase, and LILACS databases until July 2018. RCTs were eligible with patients undergoing major noncardiac surgery receiving a2-adrenoceptor agonist (dexmedetomidine or clonidine) perioperatively. Out of the 56 RCTs included in the quantitative analysis, 40 studies administered dexmedetomidine as study drug and were therefore included in the current literature analysis. This review was included for the outcome measures of adverse events. No additional studies were included for this outcome measure after the search date.
In table 1 an overview of study characteristics is provided. More detailed study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Table 1: Overview of the included studies
|
Study, year |
Intervention |
Dosage |
Control |
Surgery type |
N (I/C) |
|
Systematic reviews |
|||||
|
Wang, 2018 |
Dexmedetomidine |
- |
Placebo |
All surgery |
|
|
Demiri, 2019 |
Dexmedetomidine |
- |
Placebo |
Major surgery (noncardiac) |
4,868¹ |
|
Randomized controlled trials from Wang |
|||||
|
Abdel-Meguid, 2013 |
i.v. DEX during general anesthesia |
1µg/kg + 0.6µg/kg/h |
placebo |
Cardiac surgery |
15/15 |
|
Altindis, 2008 |
i.v. DEX during general anesthesia |
0.5 µg/kg/hr |
placebo |
Lower abdominal surgery |
20/20 |
|
Bakhamees, 2007 |
i.v. DEX during general anesthesia |
1µg/kg + 0.6µg/kg/h |
placebo |
Laparascopic gastric bypass |
40/40 |
|
Cheung, 2014 |
i.v. DEX during general anesthesia |
1µg/kg + 0.5µg/kg/h |
placebo |
Colorectal surgery |
50/46 |
|
Cho, 2015 |
i.v. DEX during general anesthesia |
0.5µg/kg + 0.4µg/kg/h |
placebo |
Laparoscopic gastrectomy |
46/44 |
|
Ham, 2014 |
i.v. DEX during general anesthesia |
1µg/kg |
placebo |
Ortognathic surgery |
36/34 |
|
Harsoor, 2014 |
i.v. DEX during general anesthesia |
1µg/kg + 0.5 µg/kg/h |
placebo |
Abdominal surgery |
20/20 |
|
Jung, 2015 |
i.v. DEX during general anesthesia |
1µg/kg |
placebo |
Nasal surgery |
19/19 |
|
Kim, 2013 [ref 41] |
i.v. DEX during general anesthesia |
0.5µg/kg |
placebo |
Laparoscopic hysterectomy |
30/30 |
|
Kim, 2015 [56] |
i.v. DEX during general anesthesia |
0.4µg/kg/h |
placebo |
Orthopedic surgery |
58/57 |
|
Lawrence, 1997 |
i.v. DEX during general anesthesia |
2µg/kg |
placebo |
Orthopedic, urological, or general surgery |
25/25 |
|
Lee, 2013 [ref 43] |
i.v. DEX during general anesthesia |
1µg/kg |
placebo |
Laparoscopic hysterectomy |
29/28 |
|
Lee, 2016 [ref 60] |
i.v. DEX during general anesthesia |
1µg/kg |
placebo |
VATS |
50/50 |
|
Mizrak, 2010 |
i.v. DEX during general anesthesia |
0.5µg/kg |
placebo |
General surgery |
30/30 |
|
Mohamed, 2014 |
i.v. DEX during general anesthesia |
0.5µg/kg/h |
placebo |
Abdominal surgery |
25/25 |
|
Naik, 2016 |
i.v. DEX during general anesthesia |
1µg/kg + 0.5µg/kg/h |
placebo |
Lumbar spinal surgery |
68/63 |
|
Ozkose, 2006 |
i.v. DEX during general anesthesia |
1µg/kg + 0.2µg/kg/h |
placebo |
Lumbar surgery |
20/20 |
|
Park, 2012 |
i.v. DEX during general anesthesia |
0.5µg/kg/h |
placebo |
Laparoscopic cholecystectomy |
21/21 |
|
Peng, 2015 |
i.v. DEX during general anesthesia |
0.5µg/kg + 0.4µg/kg/h |
placebo |
Craniotomy |
38/38 |
|
Shin, 2013 |
i.v. DEX during general anesthesia |
0.5µg/kg/h |
placebo |
Gynecological surgery |
21/21 |
|
Song, 2016a [ref 58] |
i.v. DEX during general anesthesia |
0.5µg/kg + 0.2-0.5µg/kg/h |
placebo |
Craniotomy |
26/26 |
|
Song, 2016b [ref 63] |
i.v. DEX during general anesthesia |
0.5µg/kg |
placebo |
Lumbar spinal surgery |
52/53 |
|
Tufanogullari, 2008 |
i.v. DEX during general anesthesia |
0.5µg/kg |
placebo |
Laparascopic bariatric surgery |
20/20 |
|
Wang, 2015 |
i.v. DEX during general anesthesia |
1µg/kg |
placebo |
Gastrectomy |
20/20 |
|
Additional Randomised controlled trials after 2016 |
|||||
|
Bielka, 2018 |
i.v. DEX during general anesthesia |
0.5µg/kg/h |
placebo |
laparoscopic cholecystectomy |
30/30 |
|
Chen, 2021 |
DEX postoperative |
1µg/kg + 0.3µg/kg/h |
placebo |
Lung cancer: radical resection for rectal cancer |
58/58 |
|
Chilkoti, 2020 |
i.v. DEX during general anesthesia |
0.5µg/kg/h |
placebo |
laparoscopic cholecystectomy |
40/40 |
|
Du, 2019 |
i.v. DEX during general anesthesia |
0.6µg/kg/h |
placebo |
laparoscopic cholecystectomy |
20/20 |
|
Efe Mercanoglu, 2022 |
i.v. DEX during general anesthesia |
0.5µg/kg/h |
placebo |
Laparoscopic Cholecystectomy |
30/30 |
|
Ge, 2016 |
i.v. DEX during general anesthesia |
0.5µg/kg/h |
placebo |
Abdominal Hysterectomy |
32/32 |
|
Hadi, 2019 |
DEX postoperative |
0.5µg/kg/h |
placebo |
lumbar foraminotomy surgery |
20/20 |
|
Liu, 2022 |
i.v. DEX during general anesthesia |
0.5µg/kg + 0.2µg/kg/h |
placebo |
Radical Gastrectomy for Gastric Cancer |
43/43 |
|
Nikoubakht, 2021 |
i.v. DEX during general anesthesia |
0.2µg/kg/h |
placebo |
posterior spinal fusion surgery |
29/29 |
|
Rekatsina, 2021 |
i.v. DEX during general anesthesia |
0.9µg/kg + 0.15µg/kg/h |
placebo |
Abdominal Gynecological Surgery |
26/26 |
|
Shu, 2022 |
i.v. DEX during general anesthesia |
0.5µg/kg + 0.5µg/kg/h |
placebo |
Thyroid Cancer Surgery |
40/40 |
|
Wu, 2022 |
i.v. DEX during general anesthesia |
0.5µg/kg + 0.2µg/kg/h |
placebo |
laparoscopic hysteromyomectomy |
54/52 |
|
Xu, 2021 |
i.v. DEX during general anesthesia |
0.5µg/kg + 0.4µg/kg/h |
placebo |
laparoscopic hysterectomy |
40/40 |
|
Ye, 2021 |
i.v. DEX during general anesthesia |
0.4/0.6/0.8µg/kg/h |
placebo |
laparoscopic cholecystectomy |
30/30/30/30 |
1Total number of patients receiving clonidine, dexmedetomidine or placebo
DEX=Dexmedetomidine
Results
In case data could be pooled in a meta-analysis, means and standard deviations were estimated from the medians and interquartile ranges using the method by Hozo (2005).
1. Postoperative pain
1.1 Postoperative pain at 6 hours
Of the studies included in Wang (2018), 21 studies reported postoperative pain 6 hours after
surgery. The individual mean differences can be found in the evidence table of this summary or in the systematic review (Wang, 2018). Absolute results were not reported and therefore, the results of studies from Wang (2018) were not pooled with results of the included individual RCTs. The pooled MD was -0.93 (95% CI -1.34 to -0.53), in favour of the intervention group receiving dexmedetomidine. This difference did not reach the threshold for clinical relevance (1 / 10 points).
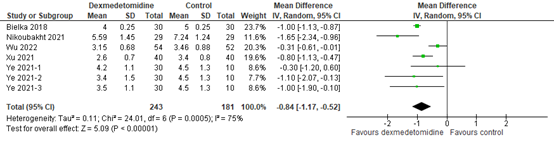
Five of the additional RCTs reported postoperative pain 6 hours after surgery and were pooled in a meta-analysis, as shown in figure 1. The pooled MD was -0.84 (95% CI -1.17 to -0.52), in favour of the intervention group receiving dexmedetomidine. This difference did not reach the threshold for clinical relevance (1/10 points). This result is in line with the pooled result of Wang (2018).
Figure 1. Postoperative pain at 6 hours post-surgery
Z: p-value of the pooled effect; df: degrees of freedom; I2: statistic heterogeneity; CI: Confidence Interval
1.2 Postoperative pain at 24 hours
Of the studies included in Wang (2018), eight studies reported postoperative pain 24 hours after surgery. The individual mean differences can be found in the evidence table of this summary or in the systematic review (Wang, 2018). The pooled MD was -0.47 (95% CI -0.83 to -0.11), in favour of the intervention group receiving dexmedetomidine. This difference does not reach the threshold for clinical relevance (1 / 10 points).
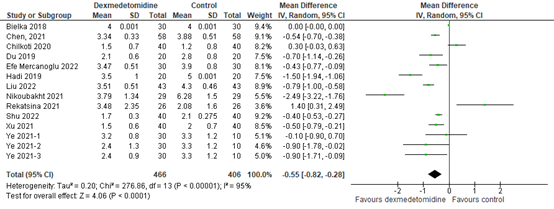
Twelve of the additional RCTs reported postoperative pain 24 hours after surgery and were pooled in a meta-analysis, as shown in figure 2. The pooled MD was -0.55 (95% CI -0.82 to -0.28), in favour of the intervention group receiving dexmedetomidine. This difference does not reach the threshold for clinical relevance (1/10 points). This result is in line with the pooled result of Wang (2018).
Figure 2. Postoperative pain at 24 hours post-surgery
Z: p-value of the pooled effect; df: degrees of freedom; I2: statistic heterogeneity; CI: Confidence Interval
2. Postoperative analgesic consumption in 24 hours
Of the studies included in Wang (2018), twelve studies reported postoperative analgesic consumption in 24 hours. The individual mean differences can be found in the evidence table of this summary or in the systematic review (Wang, 2018).
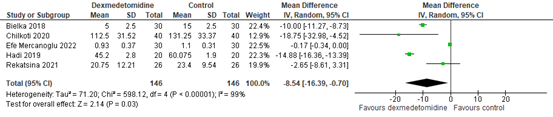
The pooled MD was -6.76 mg (95% CI -10.16 to -3.35), in favour of the intervention group receiving dexmedetomidine. This difference did not reach the threshold for clinical relevance (10 mg). Five of the additional RCTs reported postoperative analgesic consumption in 24 hours and were pooled in a meta-analysis, as shown in figure 3. The pooled MD was -8.54 mg (95% CI -16.39 to -0.70), in favour of dexmedetomidine. This difference did not reach the threshold for clinical relevance (10 mg). This result is in line with the pooled result of Wang (2018).
Figure 3. Postoperative analgesic consumption at 24 hours
Z: p-value of the pooled effect; df: degrees of freedom; I2: statistic heterogeneity; CI: Confidence Interval
3. Adverse events
3.1 Hypotension
In Demiri (2019) undesirable hypotension (requiring the administration of a drug to correct it) was reported in 23 RCTs. The pooled analysis revealed that the incidence of intraoperative hypotension was higher with dexmedetomidine than with placebo, with an RR of 1.89 (95% CI 1.1 to 3.25) in favour of placebo [13 studies, n=1004], this was a clinically relevant difference in favour of the placebo group.
The pooled analysis revealed that the incidence of postoperative hypotension was higher with dexmedetomidine than with placebo, with an RR of 1.76 (95% CI 0.95 to 3.29) in favour of placebo [14 studies, n=1161], this was a clinically relevant difference in favour of the placebo group.
Demiri (2019) did not report individual outcome data per study for this adverse event.
3.2 Bradycardia
In Demiri (2019) undesirable bradycardia (requiring the administration of a drug to correct it) was reported in 25 RCTs. The pooled analysis revealed that the incidences of intraoperative and postoperative bradycardia were higher with dexmedetomidine than with placebo, with RRs of 2.68 (95% CI 1.78 to 4.05) and 2.44 (95% CI 1.71 to 3.48), respectively. This was considered a clinically relevant difference in favour of the placebo group.
3.3 Sedation
Demiri (2019) did not report the outcome sedation.
Level of evidence of the literature
The level of evidence started as ‘high’ since the included studies were all (systematic reviews of) RCTs.
The level of evidence regarding the outcome measure postoperative pain at 6 hours was downgraded by 2 levels because of study limitations (risk of bias,-1) and the pooled effect crossing the border of clinical relevance (imprecision, -1). The level of evidence is low.
The level of evidence regarding the outcome measure postoperative pain at 24 hours was downgraded by 1 level because of study limitations (risk of bias,-1). The level of evidence is moderate.
The level of evidence regarding the outcome measure postoperative analgesic consumption in 24 hours was downgraded by 2 levels because of study limitations (risk of bias,-1) and the pooled effect crossing the border of clinical relevance (imprecision, -1). The level of evidence is low.
The level of evidence regarding the outcome measure intraoperative hypotension was downgraded by 1 level because the optimal information size was not reached (imprecision, -1). The level of evidence is moderate.
The level of evidence regarding the outcome measure postoperative hypotension was downgraded by 2 levels because of insufficient data quality (-1) and the optimal information size was not reached (imprecision, -1). The level of evidence is low.
The level of evidence regarding the outcome measure intraoperative bradycardia was not downgraded. The level of evidence is high.
The level of evidence regarding the outcome measure postoperative bradycardia was downgraded by 1 level because the optimal information size was not reached (imprecision, -1). The level of evidence is moderate.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the effectiveness of adding dexmedetomidine to standard care in surgical patients on postoperative pain, adverse events and rescue analgesic consumption?
P: patients Surgical non-cardiac patient
I: intervention Adding perioperative systemic dexmedetomidine to standard analgesic methods (multimodal analgesia, opioid or local anesthesia)
C: control Adding placebo to standard analgesic methods
O: outcome measure Postoperative pain, opioid consumption, adverse events (bradycardia, hypotension and sedation)
Relevant outcome measures
The guideline development group considered acute postoperative pain as a critical outcome measure for decision making; and postoperative opioid consumption and adverse events, as important outcome measures for decision making.
The working group defined the outcome measures as follows:
Postoperative pain (at rest and during mobilization/cough): Validated pain scale (VAS or NRS) at arrival at 6, and 24 hours. Postoperative opioid consumption was defined as the total consumption in the first 24 hours after surgery in Morphine Milligram Equivalents (MME).
The working group did not define the other outcome measures listed above a priori, but used the definitions used in the studies.
For pain, the working group defined one point as a minimal clinically (patient) important difference on a 10-point scale and 10 mm on a 100 mm scale. Regarding postoperative opioid consumption, a difference of 10 mg MME between groups was considered clinically relevant. For dichotomous variables, a difference of 10% was considered clinically relevant (RR ≤0.91 or ≥1.10; RD 0.10).
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 17-9-2022. The detailed search strategy is depicted under the tab Methods. One was search was performed for systematic reviews (SRs) and one for randomized controlled trials (RCTs). The systematic literature search resulted in 430 hits for SRs and 739 for RCTs. Studies were selected based on the following criteria:
- Systematic review or RCT
- Published ≥ 2000 for SRs
- Published ≥ 2000 for RCTs
- Patients ≥ 18 years
- Conform PICO
Studies that used dexmedetomidine for another indication than postoperative pain (such as (prevention of) delirium) were excluded. Studies comparing dexmedetomidine with non-saline control (such as remifentanil) were excluded.
41 systematic reviews studies were initially selected based on title and abstract screening. Sequentially, 19 additional RCT’s were selected based on title and abstract screening
After reading the full text, 39 systematic reviews and five RCTs were excluded (see the table with reasons for exclusion under the tab Methods). Two systematic reviews (Wang, 2018; Demiri, 2019), describing 24 and 40 RCTs respectively, and 14 individual RCTs were included.
Referenties
- Abdul Hadi B, Sbeitan SM, Shakya AK. Fentanyl vs fentanyl-dexmedetomidine in lumbar foraminotomy surgery. Ther Clin Risk Manag. 2019 Jul 15;15:885-890. doi: 10.2147/TCRM.S195108. PMID: 31406463; PMCID: PMC6642633.
- Beloeil H et al.: Balanced opioid-free anesthesia with dexmedetomidine versus balanced anesthesia withy remifentanil for major or intermediate noncardiac surgery. Anesthesiology 2021; 134:541-51
- Bielka K, Kuchyn I, Babych V, Martycshenko K, Inozemtsev O. Dexmedetomidine infusion as an analgesic adjuvant during laparoscopic ?holecystectomy: a randomized controlled study. BMC Anesthesiol. 2018 Apr 20;18(1):44. doi: 10.1186/s12871-018-0508-6. PMID: 29678158; PMCID: PMC5910570.
- Chen G, Zheng G, Cai L, Guo Y, Zhou J, Yuan F, Wang Z. Effects of dexmedetomidine on perioperative blood circulation micrometastasis, postoperative analgesia, serum pain mediators and immune function in patients with lung cancer. Acta Medica Mediterranea. 2021; 37(1): 341-345. doi: 10.19193/0393-6384_2021_1_53.
- Chilkoti GT, Karthik G, Rautela R. Evaluation of postoperative analgesic efficacy and perioperative hemodynamic changes with low dose intravenous dexmedetomidine infusion in patients undergoing laparoscopic cholecystectomy - A randomised, double-blinded, placebo-controlled trial. J Anaesthesiol Clin Pharmacol. 2020 Jan-Mar;36(1):72-77. doi: 10.4103/joacp.JOACP_184_17. Epub 2020 Feb 18. PMID: 32174662; PMCID: PMC7047684.
- Du X, Song F, Zhang X, Ma S. Protective efficacy of combined use of parecoxib and dexmedetomidine on postoperative hyperalgesia and early cognitive dysfunction after laparoscopic cholecystectomy for elderly patients. Acta Cir Bras. 2019 Nov 28;34(9):e201900905. doi: 10.1590/s0102-865020190090000005. PMID: 31800679; PMCID: PMC6889861.
- Efe Mercanoglu E, Girgin Kelebek N, Turker G, Aksu H, Ozgur M, Karakuzu Z, Turkcan S, Ozcan B. Comparison of the Effect of Ketamine and Dexmedetomidine Combined with Total Intravenous Anesthesia in Laparoscopic Cholecystectomy Procedures: A Prospective Randomized Controlled Study. Int J Clin Pract. 2022 Jul 21;2022:1878705. doi: 10.1155/2022/1878705. PMID: 35936068; PMCID: PMC9334052.
- Ge DJ, Qi B, Tang G, Li JY. Intraoperative Dexmedetomidine Promotes Postoperative Analgesia and Recovery in Patients after Abdominal Hysterectomy: a Double-Blind, Randomized Clinical Trial. Sci Rep. 2016 Feb 23;6:21514. doi: 10.1038/srep21514. PMID: 26903197; PMCID: PMC4763240.
- Liu R, Suo S, Wang Y, Wang M. Effects of Dexmedetomidine and Propofol on Postoperative Analgesia and the Cellular Immune Function of Patients Undergoing Radical Gastrectomy for Gastric Cancer. Contrast Media Mol Imaging. 2022 Sep 25;2022:7440015. doi: 10.1155/2022/7440015. PMID: 36237583; PMCID: PMC9527420.
- Nikoubakht N, Alimian M, Faiz SHR, Derakhshan P, Sadri MS. Effects of ketamine versus dexmedetomidine maintenance infusion in posterior spinal fusion surgery on acute postoperative pain. Surg Neurol Int. 2021 Apr 26;12:192. doi: 10.25259/SNI_850_2020. PMID: 34084620; PMCID: PMC8168657.
- Rekatsina M, Theodosopoulou P, Staikou C. Effects of Intravenous Dexmedetomidine Versus Lidocaine on Postoperative Pain, Analgesic Consumption and Functional Recovery After Abdominal Gynecological Surgery: A Randomized Placebo-controlled Double Blind Study. Pain Physician. 2021 Nov;24(7):E997-E1006. PMID: 34704710.
- Shu T, Xu S, Ju X, Hu S, Wang S, Ma L. Effects of Systemic Lidocaine Versus Dexmedetomidine on the Recovery Quality and Analgesia After Thyroid Cancer Surgery: A Randomized Controlled Trial. Pain Ther. 2022 Dec;11(4):1403-1414. doi: 10.1007/s40122-022-00442-5. Epub 2022 Oct 6. PMID: 36203077; PMCID: PMC9633913.
- Wang X, Liu N, Chen J, Xu Z, Wang F, Ding C. Effect of Intravenous Dexmedetomidine During General Anesthesia on Acute Postoperative Pain in Adults: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Clin J Pain. 2018 Dec;34(12):1180-1191. doi: 10.1097/AJP.0000000000000630. PMID: 29771731.
- Wu Y, Cai Z, Liu L, Wang J, Li Y, Kang Y & An N. Impact of intravenous dexmedetomidine on gastrointestinal function recovery after laparoscopic hysteromyomectomy: a randomized clinical trial. 2022
- Xu S, Hu S, Ju X, Li Y, Li Q, Wang S. Effects of intravenous lidocaine, dexmedetomidine, and their combination on IL-1, IL-6 and TNF-? in patients undergoing laparoscopic hysterectomy: a prospective, randomized controlled trial. BMC Anesthesiol. 2021 Jan 6;21(1):3. doi: 10.1186/s12871-020-01219-z. PMID: 33407156; PMCID: PMC7786488.
- Ye Q, Wang F, Xu H , Wu L & Gao X. Effects of dexmedetomidine on intraoperative hemodynamics, recovery profile and postoperative pain in patients undergoing laparoscopic cholecystectomy: a randomized controlled trial. BMC Anesthesiology volume. 2021 ; 63. doi: 10.21203/rs.3.rs-103750/v1.
Evidence tabellen
Evidence tables
|
Systematic review reference (if applicable) |
RCT reference |
Study designs |
Setting and country |
Funding and conflicts of interest |
N at baseline; mean age (y), % male |
Type of surgery |
Intervention |
Control |
Loss-to-follow-up / incomplete data of intervention (I) or control (C) group |
|
Wang, 2018 |
A: Abdel-Meguid, 2013 B: Altindis, 2008 C: Bakhamees, 2007 D: Cheung, 2014 E: Cho, 2015 F: Ham, 2014 G: Harsoor, 2014 H: Jung, 2015 I: Kim, 2013 [ref 41] J: Kim, 2015 [56] K: Lawrence, 1997 L: Lee, 2013 [ref 43] M: Lee, 2016 [ref 60] N: Mizrak, 2010 O: Mohamed, 2014 P: Naik, 2016 Q: Ozkose, 2006 R: Park, 2012 S: Peng, 2015 T: Shin, 2013 U: Song, 2016a [ref 58] V: Song, 2016b [ref 63] W: Tufanogullari, 2008 X: Wang, 2015 |
A: RCT B: RCT C: RCT D: RCT E: RCT F: RCT G: RCT H: RCT I: RCT J: RCT K: RCT L: RCT M: RCT N: RCT O: RCT P: RCT Q: RCT R: RCT S: RCT T: RCT U: RCT V: RCT W: RCT X: RCT |
A: n.s., Saudi Arabia B: n.s., Turkey C: n.s., Egypt D: n.s., China E: n.s., Korea F: n.s., Ham G: n.s., India H: n.s., Korea I: n.s., Korea J: n.s., Korea K: n.s., the Netherlands L: n.s., Korea M: n.s., Korea N: n.s., Turkey O: n.s., India P: n.s., USA Q: n.s., Turkey R: n.s., Korea S: n.s., China T: n.s., Korea U: n.s., China V: n.s., Korea W: n.s., USA X: n.s., China |
A: n.s. B: n.s. C: n.s. D: n.s. E: n.s. F: n.s. G: n.s. H: n.s. I: n.s. J: n.s. K: n.s. L: n.s. M: n.s. N: n.s. O: n.s. P: n.s. Q: n.s. R: n.s. S: n.s. T: n.s. U: n.s. V: n.s. W: n.s. X: n.s. |
A: 15/15; 53.5y; 76,7% B: 20/20; 49,2y; 50% C: 40/40; 30y; 42,5% D: 50/46; 63,1y; 51% E: 46/44; 55,3y; 54,4% F: 36/34; 24y; 41,1% G: 20/20; 43,5y; 45% H: 19/19; 30,3y; 100% I: 30/30; 46,1y; 0% J: 58/57; 73,3y; 30,4% K: 25/25; 40,5y; n.s.% L: 29/28; 48,7y; 0% M: 50/50; 62y; 49% N: 30/30; 41y; 33,3% O: 25/25; 65,9y; 90% P: 68/63; 56-70y; n.s.% Q: 20/20; 47y; 50% R: 21/21; 42,9y; 45,2% S: 38/38; 42,9y; 43,4% T: 21/21; 46,1y; 0% U: 26/26; 45,5y; 61,5% V: 52/53; 57,5y; 0% W: 20/20; 45,5y; 17,5% X: 20/20; 57y; 77,5% |
A: Cardiac surgery B: Lower abdominal surgery C: Laparascopic gastric bypass D: Colorectal surgery E: Laparoscopic gastrectomy F: Ortognathic surgery G: Abdominal surgery H: Nasal surgery I: Laparoscopic hysterectomy J: Orthopedic surgery K: Orthopedic, urological, or general surgery L: Laparoscopic hysterectomy M: VATS N: General surgery O: Abdominal surgery P: Lumbar spinal surgery Q: Lumbar surgery R: Laparoscopic cholecystectomy S: Craniotomy T: Gynecologic surgery U: Craniotomy V: Lumbar spinal surgery W: Laparascopic bariatric surgery X: Gastrectomy |
All: IV dexmed during general anesthesia
|
All: placebo or other analgesics
|
A: I: n.s.; C: n.s. B: I: n.s.; C: n.s. C: I: n.s.; C: n.s. D: I: n.s.; C: n.s. E: I: n.s.; C: n.s. F: I: n.s.; C: n.s. G: I: n.s.; C: n.s. H: I: n.s.; C: n.s. I: I: n.s.; C: n.s. J: I: n.s.; C: n.s. K: I: n.s.; C: n.s. L: I: n.s.; C: n.s. M: I: n.s.; C: n.s. N: I: n.s.; C: n.s. O: I: n.s.; C: n.s. P: I: n.s.; C: n.s. Q: I: n.s.; C: n.s. R: I: n.s.; C: n.s. S: I: n.s.; C: n.s. T: I: n.s.; C: n.s. U: I: n.s.; C: n.s. V: I: ; C: W: I: n.s.; C: n.s. X: I: n.s.; C: n.s. |
|
Individual RCTs |
|||||||||
|
|
Bielka, 2018 |
RCT |
single-centre, Ukraine |
n.s.; reported that no conflicting interests exist |
30/30; 54y; 12% |
laparoscopic cholecystectomy |
Dexmedetomidine |
placebo |
n.s.
|
|
|
Chen, 2021 |
RCT |
single-centre, China |
For funding referred to project title; potential conflicts not mentioned |
58/58; 69y; 67% |
Lung cancer: radical resection for rectal cancer |
Dexmedetomidine |
saline |
n.s.
|
|
|
Chilkoti, 2020 |
RCT |
n.s., India |
Reported that no financial support was provided; reported that no conflicting interests exist |
40/40; 35y; 3% |
laparoscopic cholecystectomy |
Dexmedetomidine |
normal saline |
n.s.
|
|
|
Du, 2019 |
RCT |
single-centre, China |
for funding referred to project and project nr / reported that no conflicting interests exist |
20/20; 69y; 38% |
laparoscopic cholecystectomy (elderly) |
Dexmedetomidine |
saline |
n.s.
|
|
|
Efe Mercanoglu, 2022 |
RCT |
n.s., Turkey |
n.s.; reported that no conflicting interests exist |
30/30; 36y; 45% |
Laparoscopic Cholecystectomy Procedures |
Dexmedetomidine |
Total IV anesthesia + saline |
n.s. |
|
|
Ge, 2016 |
RCT |
single-centre, China |
n.s.; reported that no conflicting interests exist |
32/32; 53y; 0% |
Abdominal Hysterectomy |
Dexmedetomidine |
propofol/ remifentanil/ saline (PRS) |
I: 0/35; C: 6/35 |
|
|
Hadi, 2019 |
RCT |
single-centre, Jordan |
n.s.; reported that no conflicting interests exist |
20/20; 51y; 53% |
lumbar foraminotomy surgery |
Dexmedetomidine |
fentanyl + saline |
n.s. |
|
|
Liu, 2022 |
RCT |
single-centre, China |
n.s.; reported that no conflicting interests exist |
43/43; 58y; 60% |
Radical Gastrectomy for Gastric Cancer |
Dexmedetomidine |
sodium chlorine |
n.s. |
|
|
Nikoubakht, 2021 |
RCT |
single-centre, Iran |
Reported that no financial support was provided; reported that no conflicting interests exist |
29/29; 53% 40-60y; 39% >60yy; 60% |
posterior spinal fusion surgery |
Dexmedetomidine |
saline |
n.s. |
|
|
Rekatsina, 2021 |
RCT |
single-centre, Greece |
funding reported; reported that no conflicting interests exist |
26/26; 47y; 0% |
Abdominal Gynecological Surgery |
Dexmedetomidine |
control |
n.s. |
|
|
Shu, 2022 |
RCT |
single-centre, China |
funding reported; reported that no conflicting interests exist |
40/40; 46y; 24% |
Thyroid Cancer Surgery |
Dexmedetomidine |
control |
n.s. |
|
|
Wu, 2022 |
RCT |
single-centre, China |
n.s.; reported that no conflicting interests exist |
54/52; 47y; 0% |
laparoscopic hysteromyomectomy |
Dexmedetomidine |
saline |
3/57; C: 4/56 |
|
|
Xu, 2021 |
RCT |
single-centre, China |
funding reported; reported that no conflicting interests exist |
40/40; 48y; 0% |
laparoscopic hysterectomy |
Dexmedetomidine |
saline |
n.s. |
|
|
Ye, 2021 |
RCT |
single-centre, China |
funding reported; reported that no conflicting interests exist |
30/30/30/30; 43y; 62% |
laparoscopic cholecystectomy |
Dexmedetomidine |
saline |
n.s. |
Evidence tables – results
|
|
Postoperative pain 6h |
Postoperative pain 24h |
Postoperative opioid consumption – 24h |
|||||||
|
Study reference |
Studies |
Intervention vs. control |
Intervention vs. control |
Intervention vs. control |
||||||
|
|
|
WMD |
95% CI lower limit |
95% CI upper limit
|
WMD |
95% CI lower limit |
95% CI upper limit
|
WMD |
95% CI lower limit |
95% CI upper limit
|
|
Wang, 2018 |
Abdel-Meguid, 2013 |
-1.00 |
-1.46 |
-0.54 |
-1.00 |
-1.21 |
-0.79 |
-12.10 |
-23.05 |
-1.15 |
|
Altindis, 2008 |
-0.50 |
-0.92 |
-0.08 |
|
|
|
-7.13 |
-11.04 |
-3.22 |
|
|
Bakhamees, 2007 |
-2.25 |
-2.51 |
-1.99 |
|
|
|
-12.40 |
-15.57 |
-9.23 |
|
|
Cheung, 2014 |
0.10 |
-0.75 |
0.95 |
|
|
|
1.75 |
-11.30 |
14.80 |
|
|
Cho, 2015 |
-0.50 |
-1.29 |
0.29 |
0.40 |
-0.33 |
1.13 |
|
|
|
|
|
Ham, 2014 |
-1.50 |
-2.75 |
-0.25 |
|
|
|
|
|
|
|
|
Harsoor, 2014 |
-1.60 |
-1.97 |
-1.23 |
|
|
|
|
|
|
|
|
Jung, 2015 |
-0.70 |
-1.56 |
0.16 |
|
|
|
|
|
|
|
|
Kim, 2013 [ref 41] |
-0.38 |
-1.30 |
0.54 |
-0.50 |
-1.17 |
0.17 |
-0.63 |
-2.22 |
0.96 |
|
|
Kim, 2015 [56] 1 |
-1.30 |
-2.30 |
-0.30 |
|
|
|
|
|
|
|
|
2 |
-0.60 |
-1.58 |
0.38 |
|
|
|
|
|
|
|
|
Lawrence, 1997 |
0.60 |
-0.24 |
1.44 |
|
|
|
|
|
|
|
|
Lee, 2013 [ref 43] |
-1.74 |
-2.28 |
-1.20 |
-0.64 |
-1.00 |
-0.28 |
-2.10 |
-3.17 |
-1.03 |
|
|
Lee, 2016 [ref 60] |
-1.67 |
-3.32 |
-0.02 |
|
|
|
|
|
|
|
|
Mizrak, 2010 |
0.00 |
-0.98 |
0.98 |
|
|
|
|
|
|
|
|
Mohamed, 2014 |
|
|
|
|
|
|
-27.20 |
-35.76 |
-18.64 |
|
|
Naik, 2016 |
-0.67 |
-1.59 |
0.25 |
-0.66 |
-1.33 |
0.01 |
5.00 |
-6.81 |
16.81 |
|
|
Ozkose, 2006 |
-4.20 |
-5.63 |
-2.77 |
|
|
|
|
|
|
|
|
Park, 2012 |
|
|
|
|
|
|
0.20 |
-2.01 |
2.41 |
|
|
Peng, 2015 |
-0.25 |
-0.83 |
0.33 |
|
|
|
|
|
|
|
|
Shin, 2013 |
-1.50 |
-2.38 |
-0.62 |
|
|
|
|
|
|
|
|
Song, 2016a [ref 58] |
-0.90 |
-1.28 |
-0.52 |
-0.20 |
-0.58 |
0.18 |
-16.30 |
-19.76 |
-12.84 |
|
|
Song, 2016b [ref 63] |
|
|
|
|
|
|
-2.70 |
-5.10 |
-0.30 |
|
|
Tufanogullari, 2008 |
1.00 |
-0.86 |
2.86 |
1.00 |
-0.86 |
2.86 |
-11.00 |
-30.07 |
8.07 |
|
|
Wang, 2015 |
|
|
|
-0.80 |
-1.61 |
0.01 |
|
|
|
|
Results of additional RCTs (presented in Mean, SD, N, unless stated otherwise)
|
|
|
Postoperative pain 6h |
Postoperative pain 24h |
Postoperative opioid consumption – 24h |
|||||||||||||||
|
|
|
Intervention |
Control |
Intervention |
Control |
Intervention |
Control |
||||||||||||
|
|
|
Mean |
SD |
N |
Mean |
SD |
N |
Mean |
SD |
N |
Mean |
SD |
N |
Mean |
SD |
N |
Mean |
SD |
N |
Bielka, 2018 |
Verbal rating scale (VRS) 0-10 |
Median (IQR)4 (4–5) |
30 |
Median (IQR)5 (4–5) |
30 |
Median (IQR)4 (4–4) |
30 |
Median (IQR)4 (4–4) |
30 |
Median (IQR) 5 (0–10) |
30 |
Median (IQR) 15 (10–20) |
30 |
||||||
Chen, 2021 |
VAS 0-10 |
|
|
|
|
|
|
3.34 |
0.33 |
58 |
3.88 |
0.51 |
58 |
|
|
|
|
|
|
Chilkoti, 2020 |
VAS 0-10 |
|
|
|
|
|
|
1.5 |
0.7 |
40 |
1.2 |
0.8 |
40 |
112.50 |
31.52 |
40 |
131.25 |
33.37 |
40 |
Du, 2019 |
VAS 0-10 |
|
|
|
|
|
|
2.1 |
0.6 |
20 |
2.8 |
0.8 |
20 |
PCIA pressing times reported |
|||||
Efe Mercanoglu, 2022 |
VAS 0-10 |
|
|
|
|
|
|
3.47 |
0.51 |
30 |
3.90 |
0.80 |
30 |
0.93 |
0.37 |
30 |
1.10 |
0.31 |
30 |
Ge, 2016 |
VAS 0-10 |
|
|
|
|
|
|
|
|
35 |
|
|
29 |
|
|
35 |
|
|
29 |
Hadi, 2019 |
VAS 0-10 |
|
|
|
|
|
|
median [IQR] (range)3.5 [3–4] (3–5) |
20 |
median [IQR] (range)5 [5–5] (4–8) |
20 |
median [IQR] (range)45.1 [43.7–46.9] (42.3–48.1) |
20 |
median [IQR] (range)60.1 [59.1–61.0] (58.1–62.2) |
20 |
||||
Liu, 2022 |
VAS 0-10 |
|
|
|
|
|
|
3.51 |
0.51 |
43 |
4.30 |
0.46 |
43 |
|
|
|
|
|
|
Nikoubakht, 2021 |
VAS 0-10 |
5.59 |
1.45 |
29 |
7.24 |
1.24 |
29 |
3.79 |
1.34 |
29 |
6.28 |
1.5 |
29 |
|
|
29 |
|
|
29 |
Rekatsina, 2021 |
NRS rest (0-10) |
|
|
|
|
|
|
3.48 |
2.35 |
26 |
2.08 |
1.60 |
26 |
20.75 |
12.21 |
26 |
23.40 |
9.54 |
26 |
Shu, 2022 |
VAS 0-10 |
|
|
|
|
|
|
Median (IQR)1.7 (1.1–2.3) |
40 |
Median (IQR)2.1 (1.4–2.5) |
40 |
|
|
|
|
|
|
||
Wu, 2022 |
NRS 0-10 |
3.15 |
0.68 |
54 |
3.46 |
0.88 |
52 |
|
|
|
|
|
|
|
|
|
|
|
|
Xu, 2021 |
VAS 0-10 |
2.6 |
0.7 |
40 |
3.4 |
0.8 |
40 |
1.5 |
0.6 |
40 |
2.0 |
0.7 |
40 |
|
|
|
|
|
|
Ye, 2021* D1 |
VAS 0-10 |
4.2 |
1.1 |
30 |
4.5 |
1.3 |
10 |
3.2 |
0.8 |
30 |
3.3 |
1.2 |
10 |
|
|
|
|
|
|
D2 |
|
3.4 |
1.5 |
30 |
4.5 |
1.3 |
10 |
2.4 |
1.3 |
30 |
3.3 |
1.2 |
10 |
|
|
|
|
|
|
D3 |
|
3.5 |
1.1 |
30 |
4.5 |
1.3 |
10 |
2.4 |
0.9 |
30 |
3.3 |
1.2 |
10 |
|
|
|
|
|
|
*Results of the control groups are repeated (total number of patients / 3 ) in order to include results of 3 arms (different dosage; total N=90) in the meta-analysis.
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
Risk of bias of RCTs included in SR Wang, 2018 (from: Wang, 2018; according to the Cochrane Risk of Bias Tool)
|
Study |
Sequence generation |
Allocation concealment |
Blinding of participants and personnel |
Blinding of outcome assessment |
Incomplete outcome data |
Selective outcome reporting |
Other sources of bias |
Overall |
|
Abdel-Meguid, 2013 |
Low |
Low |
Low |
Low |
Low |
Low |
Unclear |
Low |
|
Altindis, 2008 |
Low |
Unclear |
Low |
Low |
Low |
Low |
Unclear |
Low |
|
Bakhamees, 2007 |
Low |
Low |
Low |
Low |
Low |
Low |
Unclear |
Low |
|
Cheung, 2014 |
Low |
Low |
Low |
Low |
Low |
Low |
Unclear |
Low |
|
Cho, 2015 |
Low |
Low |
Low |
Low |
Low |
Unclear |
Unclear |
Low |
|
Ham, 2014 |
Low |
Low |
Low |
Low |
Low |
Low |
Unclear |
Low |
|
Harsoor, 2014 |
Low |
Low |
Low |
Low |
Low |
Low |
Unclear |
Low |
|
Jung, 2015 |
Low |
Low |
Low |
Unclear |
Low |
Unclear |
Unclear |
Unclear |
|
Kim, 2013 [ref 41] |
Low |
Low |
Low |
Low |
Low |
Unclear |
Unclear |
Low |
|
Kim, 2015 [56] |
Low |
Low |
Low |
Low |
Low |
Unclear |
Unclear |
Low |
|
Lawrence, 1997 |
Low |
Low |
Low |
Low |
Low |
Low |
Unclear |
Low |
|
Lee, 2013 [ref 43] |
Low |
Low |
Unclear |
Low |
Low |
Unclear |
Unclear |
Low |
|
Lee, 2016 [ref 60] |
Low |
Low |
Low |
Low |
Low |
Unclear |
Unclear |
Low |
|
Mizrak, 2010 |
Low |
Unclear |
Unclear |
Low |
Low |
Unclear |
Unclear |
Unclear |
|
Mohamed, 2014 |
Low |
Low |
Low |
Low |
Low |
Low |
Unclear |
Low |
|
Naik, 2016 |
Low |
Low |
Unclear |
Low |
Low |
Low |
Unclear |
Low |
|
Ozkose, 2006 |
Low |
Low |
Low |
Low |
Unclear |
Unclear |
Unclear |
Unclear |
|
Park, 2012 |
Low |
Low |
Low |
Low |
Low |
Unclear |
Unclear |
Low |
|
Peng, 2015 |
Low |
Low |
Low |
Low |
Low |
Low |
Unclear |
Low |
|
Shin, 2013 |
Low |
Low |
Low |
Low |
Low |
Low |
Unclear |
Low |
|
Song, 2016a [ref 58] |
Low |
Low |
Low |
Low |
Low |
Low |
Unclear |
Low |
|
Song, 2016b [ref 63] |
Low |
Low |
Low |
Low |
Low |
Low |
Unclear |
Low |
|
Tufanogullari, 2008 |
Low |
Low |
Low |
Low |
Low |
Low |
Unclear |
Low |
|
Wang, 2015 |
Low |
Low |
Low |
Low |
Low |
Low |
Unclear |
Low |
Risk of bias table for intervention studies (randomized controlled trials; based on Cochrane risk of bias tool and suggestions by the CLARITY Group at McMaster University)
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
Bielka, 2018 |
Probably yes
Reason: “sequence was generated using a computer algorithm.” |
Definitely yes
Reason: “Randomization and data analysis were conducted by an independent blinded member of the research team” |
Probably yes
Reason: researcher that randomized patients and analysed the data was blinded; patients are care providers were not. |
Probably yes
Reason: no loss to follow-up reported; 30 patients described in results |
Probably no
Reason: outcomes differ from register regarding definition of primary and secondary, and the follow-up of outcomes |
Probably yes
Reason: no other issues reported or observed |
Some concerns
Concealment of allocation; blinding; choices for outcome reporting |
|
Chen, 2021 |
No information |
No information |
No information |
Probably yes
Reason: no loss to follow-up reported; 58 patients per group described in results |
No information
No trial registration, no protocol described |
Probably yes
Reason: no other issues reported or observed |
HIGH risk of bias
No details about randomization, concealment of allocation, blinding; no protocol/registration |
|
Chilkoti, 2020 |
Probably yes
Reason: “Patients were randomly allocated into two groups by using a computer‑ generated random numbers tables.” |
No information
Reason: “The consultant in‑charge enrolled the participants and assigned the intervention and did not participate in data collection.” |
Probably yes
Reason: “The investigator, the patient as well as the outcome assessors were blind to the group allocation.”
No information about blind data analysis |
Probably yes
Reason: no loss to follow-up reported; 40 patients per group described in results |
No information
No trial registration, no protocol described |
Probably yes
Reason: no other issues reported or observed |
Some concerns
Concealment of allocation; blinding; no protocol / registration available |
|
Du, 2019 |
Probably yes
Reason: “according to a computer generated randomization list run by the hospital pharmacist” |
No information |
Probably no
Reason: “single blinded study |
Probably yes
Reason: no loss to follow-up reported; 20 patients per group described in results |
No information
No trial registration, no protocol described |
Probably no
Reason: inconsistency in paper (numbers in Table 1 do not add up to 20 patients per group); no other issues reported or observed |
Some concerns
Concealment of allocation; blinding; no protocol / registration available |
|
Efe Mercanoglu, 2022 |
No information |
No information |
No information
Reason: “not being a double-blinded study” |
Probably yes
Reason: no loss to follow-up reported; 30 patients per group described in results |
No information
No trial registration, no protocol described |
Probably yes
Reason: no other issues reported or observed |
HIGH risk of bias
No details about randomization, concealment of allocation, blinding; no protocol/registration |
|
Ge, 2016 |
Probably yes
Reason: “using a computer-generated randomized table.” |
No information |
Probably yes
Reason: “The maintenance syringe pumps were prepared by a different anaesthesiologist to maintain this study as a randomized, double-blinded investigation”; No information about outcome assessor and data analyst. |
Probably no
Reason: control group 6/35 patients lost to FU, 0/35 in intervention group; |
Probably yes
Trial was registered and protocol is available |
Probably no
Reason: no other issues reported or observed |
Some concerns
Concealment of allocation; blinding; infrequent loss to FU |
|
Hadi, 2019 |
No information |
No information |
No information
Reason: “All the data were collected blindly” No information about patient, care provider en data analyst |
Probably yes
Reason: no loss to follow-up reported; 20 patients per group described in results |
No information
No trial registration, no protocol described |
Probably no
Reason: no other issues reported or observed |
Some concerns
Randomization, concealment of allocation; blinding; no protocol/registration |
|
Liu, 2022 |
Probably yes
Reason: “were established by the random number table method” |
No information |
No information |
Probably yes
Reason: no loss to follow-up reported; 43 patients per group described in results |
No information
No trial registration, no protocol described |
Probably no
Reason: no other issues reported or observed |
Some concerns
Concealment of allocation; blinding; no protocol/registration |
|
Nikoubakht, 2021 |
No information
Reason: “The patients were randomly divided into three groups by block randomization” |
No information |
No information |
Probably yes
Reason: no loss to follow-up reported; 29 patients per group described in results |
Probably yes
Trial was registered |
Probably no
Reason: no other issues reported or observed |
Some concerns
Randomization, concealment of allocation; blinding; no protocol/registration |
|
Rekatsina, 2021 |
Probably yes
Reason: : A computer generated list (https://www.ran-domizer.org) was used for randomization.” |
Probably yes
Reason: “An independent nurse who did not further participate in the study prepared the solutions and syringes according to group allocation.” |
Probably yes
Reason: “The solution volumes, appearance and infusion rates were the same in all groups, thus the intervention was masked to the investigators, patients, and personnel.” Blinding of data analyst not reported |
Probably yes
Reason: no loss to follow-up reported; 26, 29 and 26 patients per group described in results, in line with results. Unclear why group numbers were not 3x27 |
Probably yes
Trial was registered |
Probably no
Reason: no other issues reported or observed |
LOW risk of bias |
|
Shu, 2022 |
Probably yes
Reason: “using a computer- generated random table.” |
Definitely yes
Reason: “The randomization sequence was kept in opaque envelopes, and a research nurse who was responsible for preparing the anaesthetics opened the corresponding envelopes.” |
Probably yes
Reason: “To attain double-blinding, 50-ml syringes containing lidocaine (12 mg/ml), dexmedetomidine (4 lg/ml) or saline were prefilled.” No information about blinding of outcome assessor and data analyst. |
Probably yes
Reason: no loss to follow-up reported; 40 patients per group described in results |
Probably yes
Trial was registered |
Probably no
Reason: no other issues reported or observed |
Some concerns
Blinding; no protocol/registration |
|
Wu, 2022 |
Probably yes
Reason: “The random sequence is a computer-generated random number based on the network security system” |
Definitely yes
Reason: “A nurse not involved in the study filled the corres-ponding drugs into identical 50 ml syringes, the information of which was contained in a sequentially numbered sealed envelope. Patients themselves, the gynaecologist, and the researchers evaluating the results were all unaware of the specific grouping.” |
Definitely yes
Reason: “Patients themselves, the gynecologist, and the researchers evaluating the results were all unaware of the specific grouping.” |
Probably yes
Reason: 3/57 and 4/56 lost to follow-up |
Probably yes
Trial was registered |
Probably no
Reason: no other issues reported or observed |
LOW risk of bias |
|
Xu, 2021 |
Probably yes
Reason: “according to computer-generated random numbers” |
Probably yes
Reason: “by a nurse in the postanesthesia care unit (PACU) who did not participate in the study according to computer-generated random numbers and sealed envelopes.” |
Probably yes
Reason: “Study participants, including anesthesiologists, clinicians, and subjects, were blinded to the treatment assignments.” Blinding of analyst not reported |
Probably yes
Reason: no loss to follow-up reported; 40 patients per group described in results |
Probably yes
Trial was registered |
Probably no
Reason: no other issues reported or observed |
LOW risk of bias |
|
Ye, 2021 |
Probably yes
Reason: “using computer-generated random numbers and a 1:1:1: 1 allocation ratio.” |
Definitely yes
Reason: “Marked these random numbers on the cards. Put the marked cards in sealed envelopes in an opaque box. When the patient arrived in the operating room, the anaesthesia nurse randomly drew an envelope and administrated the test drug according to the group in the envelope, which used sealed envelopes indicating the allocation” |
Probably yes
Reason: “Patients, the anesthesiologist and the statistician did not know the grouping, meanwhile anesthesia nurse did not participate in anesthesia management, postoperative follow-up and data analysis.” Blinding of outcome assessor not reported |
Probably yes
Reason: no loss to follow-up reported; 30 patients per group described in results |
Probably yes
Trial was registered |
Probably no
Reason: no other issues reported or observed |
LOW risk of bias |
Table of excluded studies
SR’s
|
Reference |
Reason for exclusion |
|
Grape, S. 2019 |
Not conform PICO: [C]=only remifentanil |
|
Peng, K. 2017 |
Not conform PICO: [I] Post-operative and combi with opioid |
|
Ju, J. Y. 2020 |
Not conform PICO: [I] Only pre-operative administration |
|
Hwang, S. H. 2018 |
Not conform PICO: [P] P is limited to specific surgery type, SR not useful |
|
Lee, H. S. 2018 |
Not conform PICO: [P] P is limited to specific surgery type, SR not useful |
|
Habibi, V. 2018 |
Not conform PICO: [P] P is limited to specific surgery type, SR not useful |
|
Yang, Q. 2020 |
Not conform PICO: [P] P is limited to specific surgery type, SR not useful |
|
Li, C. 2017 |
Not conform PICO: [P] P is limited to specific surgery type, SR not useful |
|
Deng, S. 2021 |
Not conform PICO: [P] P is limited to specific surgery type, SR not useful |
|
Motaghi, E. 2021 |
Not conform PICO: [P] P is limited to specific surgery type, SR not useful |
|
Liu, C. 2020 |
Not conform PICO: [P] P is limited to specific surgery type, SR not useful |
|
Galvin, I. 2019 |
Not conform PICO: [P] P is limited to specific surgery type, SR not useful |
|
Song, C. 2022 |
Not conform PICO: [P] P is limited to specific surgery type, SR not useful |
|
Jessen L. 2016 |
Not conform PICO: [P] P is limited to specific surgery type, SR not useful |
|
Liu, Y. 2018 |
Not conform PICO: [P] P is limited to specific surgery type, SR not useful |
|
Zhang, Y. 2022 |
Not conform PICO: [P] P is limited to specific surgery type, SR not useful |
|
Liu, Y. 2021 |
Not conform PICO: [P] P is limited to specific surgery type, SR not useful |
|
Karmaniolou, I. 2021 |
Not conform PICO: [I] Additive to Intravenous Regional Anesthesia |
|
Tian, C. 2022 |
Not conform PICO: [I] standalone |
|
Jones, J. H. 2020 |
Not conform PICO: [P] wrong population |
|
Liu, S. 2020 |
Dexmed for another indication prolong the duration of sensory and motor block during spinal anesthesia. |
|
Jin, C. 2019 |
Not conform PICO: [P] P is limited to specific surgery type, SR not useful |
|
Hussain, N. 2017 |
Not conform PICO: [I] adjuvant in block |
|
Dong, H. 2021 |
Not conform PICO: [I] adjuvant CWI |
|
Ren, Y. 2021 |
Not conform PICO: [I] adjuvant CWI |
|
Feng, M. 2019 |
Not conform PICO: [I] Dexmed + sufentanil vs sufentanil alone |
|
Bansal, P. 2019 |
Not conform PICO: [I] adjuvant bij block |
|
Dieu, A. 2021 |
Not conform PICO: [I] not limited to systemic perioperative dexmed |
|
Pan, L. 2020 |
Not conform PICO: [I] adjuvant in block |
|
Ren, Y. 2019 |
Not conform PICO |
|
Rojas González, A. 2019 |
Not conform PICO |
|
Sun, Q. 2019 |
Not conform PICO |
|
Wang, K. 2018 |
Not conform PICO |
|
Miao, S. 2018 |
Dexmed for another indication: shivering |
|
Jin, S. 2017 |
Not conform PICO: [O] wrong outcome measures, focus on PONV |
|
Davoudi, A. 2017 |
Not conform PICO: [P] Dental surgery outside scope and dexmed as sedative |
|
Brock, L. 2019 |
Not conform PICO: [P] Cardiac surgery |
|
Liu, Z. 2021 |
Wrong outcome: hemodynamic stability focus |
|
Miao, M. 2020 |
Dexmed for another indication: shivering |
RCT’s
|
Reference |
Reason for exclusion |
|
Liu, T. 2022 |
Dexmed for another indication: prevention delirium |
|
Liu, Z. 2022 |
Dexmed for another indication:meliorate renal function and prognosis after kidney transplantation. |
|
Panchgar. 2017 |
Not conform PICO: [O] wrong outcome measures |
|
Yu Z. 2016 |
Wrong comparison |
|
Zhao, J. N. 2016 |
Not conform PICO: [I/C]: Dexmed with or without loading dose |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 01-09-2023
Laatst geautoriseerd : 01-09-2023
Geplande herbeoordeling : 01-09-2028
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met postoperatieve pijn.
Samenstelling van de werkgroep
Werkgroep
Prof. dr. J. (Jörgen) Bruhn, anesthesioloog, (voorzitter) NVA
Prof. dr. dr. M.W. (Markus) Hollmann, anesthesioloog, NVA
Dr. M.F. (Markus) Stevens, anesthesioloog, NVA
Drs. L.J.H. (Lea) van Wersch, anesthesioloog, NVA
Dr. M.H.J. (Margot) Roozekrans, anesthesioloog, NVA
Dr. S.A.S. (Sandra) van den Heuvel, anesthesioloog/pijnspecialist, NVA
Drs. S.J. (Stijn) Westerbos, orthopeed, NOV
Drs. W.L. (Wilson) Li, cardiothoracaal chirurg, NVT
S.F. (Cedric) Lau MSc, ziekenhuisapotheker, NVZA
Dr. R.L.M. (Rianne) van Boekel, verpleegkundig pijnconsulent, V&VN
Drs. I.L. (Ilona) Thomassen-Hilgersom, patiëntvertegenwoordiger, Samenwerkingverband Pijnpatiënten naar één stem
Klankbordgroep
Drs. N.C. (Niels) Gritters van den Oever, intensivist, NVIC
J.P. (Patrick) Rensink, anesthesiemedewerker/pijnconsulent, NVAM
Dr. G. (Gijs) Helmerhorst, orthopeed, NOV
Dr. C.D. (Cor) de Kroon, gynaecoloog-oncoloog, NVOG
Dr. W.J. (Wietse) Eshuis, chirurg, NVvH
Dr. D. (Daphne) Roos, chirurg, NVvH
Met ondersteuning van
Dr. F. Willeboordse, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Dr. L.M.P. Wesselman, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Dr. L.M. van Leeuwen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
I. van Dijk, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Bruhn, voorzitter |
Professor & Afdelingshoofd afdeling Anesthesiologie, Radboud UMC |
Editorial Board Journal of Clinical Monitoring and Computing, onbetaald |
Geen |
Geen actie |
|
Hollmann |
Professor & Afdelingshoofd afdeling Anesthesiologie, Amsterdam UMC, locatie AMC |
|
Geen |
Restricties t.a.v. modules over ketamine en lidocaïne. |
|
Lau |
|
Nationale Werkgroep morbide obesitas en bariatrische chirurgie (KNMP), vergoeding voor bestede uren |
Geen belangenverstrengeling, promotie-onderzoek is op een ander vlak dan waar beoogde werkgroep zich over buigt
|
Geen actie |
|
Boekel, van |
|
|
Geen |
Geen actie |
|
Thomassen-Hilgersom |
Voorzitter Samenwerkingsverband Pijnpatiënten naar één stem vrijwilliger en geen werkgever |
|
Geen |
Geen actie |
|
Li |
Cardiothoracaal chirurg (Radboudumc, Nijmegen) |
Bestuurslid NVT (Nederlandse Vereniging voor Thoraxchirurgie) |
Radboudumc zal in 2021 meedoen aan een RCT naar de optimale vorm van pijnstilling ten tijde van longchirugie (epiduraal versus paravertebraal) OPtriAL - met ZonMw subsidie, geïniteerd vanuit het MMC |
Geen actie |
|
Roozekrans |
Anesthesioloog - Pijnspecialist - Noordwest Ziekenhuisgroep |
Geen |
Geen |
Geen actie |
|
Stevens |
Chef de Clinique kinderanesthesie AUMC locatie AMC |
|
Geen |
Geen actie |
|
Heuvel, van den |
Anesthesioloog-pijnarts, Radboud UMC |
Geen |
Geen |
Geen actie |
|
Wersch, van |
Anesthesioloog, Maasziekenhuis Pantein |
Geen |
Geen |
Geen actie |
|
Westerbos |
Orthopeed, Alrijne ziekenhuis |
Geen |
Geen |
Geen actie |
|
Gritters van den Oever |
Anesthesioloog-intensivist Treant Zorggroep |
|
Geen |
Geen actie |
|
Rensink |
|
|
Geen |
Geen actie |
|
Kroon, de |
Gynaecoloog-oncoloog Leids Univesitair Medisch Centrum (1.0 fte) |
|
Geen |
Geen actie |
|
Roos |
Chirurg |
Geen |
Geen |
Geen actie |
|
Eshuis |
Chirurg, Amsterdam UMC |
Geen |
Geen |
Geen actie |
|
Willeboordse |
Senior adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Partner werkzaam bij Janssen Vaccines, onderdeel van Johnsson &Johnsson, via partner ook financiële belangen (aandelen J&J) |
Geen actie |
|
Wesselman |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
|
|
Geen actie |
|
Leeuwen, van |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
|
|
Geen actie |
|
Dijk, van |
Junior adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door zitting van een afgevaardigde van de patiëntenvereniging (Pijnpatiënten naar één stem) in de werkgroep. De Patiëntenfederatie Nederland en Pijnpatiënten naar één stem werden uitgenodigd voor de invitational conference. Het verslag hiervan [zie aanverwante producten] is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland en Pijnpatiënten naar één stem en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|
Module Organisatie van Zorg |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Transitionele Pijn Service (TPS) |
Geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (>40.000 patiënten). Hoewel de aanbeveling aangeeft dat een andere of nieuwe manier van zorgverlening gewenst is (i.e. andere manier van samenwerking/afstemming tussen zorgverleners) waarbij een TPS-model met TPS-team geïnitieerd wordt, laten eerste kosten-effectiviteitsstudies kostenbesparingen zien. De verwachting is dat TPS leidt tot betere zorg-op-maat, waarbij chronische postoperatieve pijn zorg doelmatiger wordt behandeld. Per ziekenhuis zal de vorm, intensiteit en organisatie van het TPS-model variëren. Zo kunnen ziekenhuizen ook kiezen voor een minder uitgebreid TPS. De aanbeveling geeft relatief veel ruimte voor de precieze invulling. Alle overwegingen tezamen, worden er geen substantiële financiële gevolgen verwacht. |
|
Module Pijnmeting |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Niet-medicamenteuze interventies |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Buikwandblokken |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Borstwandblokken bij mammachirurgie |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Borstwandblokken intrathoracaal |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Continue Wond infusie |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Cryoanalgesie |
Geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module Dexmethason |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Gabapentinoïden |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Ketamine |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Magnesium |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Methadon |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Beta blokkers -Esmolol |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Alpha 2 agonist - Clonidine |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Alpha 2 agonist – Dexmedetomidine |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Lidocaïne |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Multimodale pijnbestrijding |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met postoperatieve pijn.
De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn Postoperatieve pijn (NVA, 2013) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door relevante partijen middels een invitational conference.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
De beoordelingen van de literatuur en de conclusies zijn gedaan op basis van de GRADE systematiek. De werkgroep vindt het belangrijk om relevante beperkingen hiervan aan te geven.
De klinische vraag gaat vaak over een reductie van ernstige postoperatieve pijn en opioïdenconsumptie in een aantal patiënten met resp. over een klinisch relevante reductie van ernstige postoperatieve pijn opioïdenconsumptie bij een individuele patiënt. Hetzelfde geldt voor opioïdenconsumptie; de keuze van een absolute drempelwaarde in mg (i.p.v. een relatieve drempelwaarde in %) maakt dit afhankelijk van tijdstip, ingreep en ernst van de pijn: vroege postoperatieve tijdstippen en (studies met) ingrepen met relatief lage opioïdconsumptie kunnen vaak de MCID niet bereiken.
De keuze van de MCID heeft een bepaalde mate van willekeurigheid en is niet absoluut te zien. Ook zijn de conclusies zo geformuleerd (en geven alleen beperkt antwoord op het effect op een individuele patiënt voor een specifieke ingreep).
In de literatuur worden de eindpunten pijnscores en opioïdenconsumptie separaat van elkaar weer gegeven, suggererend dat deze onafhankelijk van elkaar zijn. Echter kunnen deze twee eindpunten niet onafhankelijk van elkaar beoordeeld worden; in ieder protocol is opgenomen dat pijn behandeld moet worden. Deze separate beoordeling geeft niet altijd een adequaat antwoord op de klinische vraag naar het analgetische effect van een interventie.
Daarnaast worden multimodale componenten als aparte interventies beoordeeld, echter de klinische vraag is naar de effectiviteit als bouwsteen van een multimodale werkwijze.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.