Beste ingreep HNP
Uitgangsvraag
Wat is de beste chirurgische ingreep bij patiënten met HNP?
Aanbeveling
Verwijderen van slechts het sequester indien deze wortelcompressie veroorzaakt lijkt voldoende te zijn.
Uitvoeren van een microdiscotomie bij een lumbale hernia kan zowel middels een open benadering als via een benadering door een tube.
De interlaminaire techniek heeft de eerste voorkeur, er is geen bewijs om te menen dat de transforaminale techniek tot een beter resultaat zou leiden. Extra onderzoek zou behulpzaam zijn.
Researchaanbeveling
Het opzetten en uitvoeren van een grote RCT zou behulpzaam kunnen zijn om na te gaan wat de plaats is van sequestrectomie en/of PTED.
Overwegingen
De literatuurstudie laat zien dat de wijze waarop de hernia wordt verwijderd niet aantoonbaar leidt tot verschillen in resultaat voor de patiënt. Als wortelcompressie wordt veroorzaakt door een sequester dan kan volstaan worden met het wegnemen van het sequester. Aanbevolen wordt alsnog een discotomie te verrichten indien de chirurg daar peroperatief aanleiding toe ziet.
Het verwijderen van een lumbale hernia via een conventionele microdiscotomie of een microdiscotomie door een buisje lijkt alleen een verschil in benaderingsweg te zijn, en geen verschil in weefselschade (Arts, 2011), worteldecompressie, recidiefkans of complicatie te geven. Daarom is het aan het oordeel van de chirurg aan welke benaderingswijze hij/zij de voorkeur geeft; voor de patiënt levert het één, noch het ander, (klinisch) voordeel op.
Tenslotte lijkt ditzelfde te gelden voor de transforaminale benadering; het lijkt voor de patiënt geen voordeel op te leveren.
De bewijskracht voor alle drie de (bovenstaande) literatuurconclusies is laag tot zeer laag. Met betrekking tot de vergelijking tussen Interlaminaire minimaal invasieve discotomie (ILMI) versus conventionele microdiscotomie (MD) is er voldoende onderzoek gedaan en is het geen aanbeveling om hier nog een studie aan te wijden. Voor de vraagstelling over sequestrectomie en de vraagstelling over PTED zou het zinvol kunnen zijn om een grotere RCT op te zetten om te evalueren of er daadwerkelijk een verschil bestaat in klinische uitkomst.
Onderbouwing
Achtergrond
Indien eenmaal besloten is tot het chirurgisch behandelen van een lumbale hernia, doet zich de vraag voor of er een ‘beste chirurgische ingreep’ bestaat. De meest gangbare operatie om een lumbale hernia te reduceren is de microdiscectomie, waarbij via een unilaterale benadering de gecomprimeerde spinale zenuwwortel wordt bereikt en waarbij de hernia wordt verwijderd. Vaak is het hiervoor nodig dat het ligamentum longitudinale posterior en de annulus fibrosus wordt ingesneden, zodat er wel een directe verbinding wordt gecreëerd tussen de tussenwervelschijf en het wervelkanaal. Dit kan een toegangsweg zijn voor een nieuwe (recidief) hernia.
In vroeger tijden werd vaker een bilaterale benadering of een laminectomie verricht om meer zicht te krijgen op de gecomprimeerde zenuwwortel. Tegenwoordig is dit niet meer zo opportuun omdat de chirurg de beschikking heeft over hoofdlamp en loupebril of microscoop om beter zicht te hebben op het operatiegebied, de zogenaamde conventionele microdiscotomie (MD).
Ook kan de hernia worden geopereerd door een nog kleinere toegangsweg dan de microdiscectomie, namelijk door een buis (tube) in te brengen met een dilatator techniek. Door de buis kan dan met behulp van microscoop of endoscoop gewerkt worden (ILMI). Ook kan de hernia benaderd worden via het lumbale neuroforamen; dit gebeurt dan met de zogenaamde transforaminale endoscopische techniek.
Het is de vraag of er in de literatuur aanwijzingen zijn of één van deze technieken de voorkeur zou moeten genieten. Tenslotte wordt antwoord gegeven of er in de literatuur aanwijzingen zijn of in geval van een sequester uit de tussenwervelschijf die de spinale zenuw comprimeert, het verwijderen van alleen het sequester voldoende is of dat het een beter resultaat geeft om tevens een discotomie te verrichten.
Conclusies
Vergelijking 1
1.1
Zeer laag GRADE |
Er lijkt geen verschil te zijn tussen de patiëntengroepen die zijn geholpen met een sequestrectomie alleen of met een discectomie in pijn in de rug 24 maanden na de ingreep.
Bronnen (Barth, 2008; Kast, 2008; Schick, 2009; Kotil, 2014) |
1.2
1.3
Zeer laag GRADE |
Er lijkt geen verschil te zijn in de hoeveelheid complicaties tussen de patiëntengroepen die zijn geholpen met een sequestrectomie alleen of met een discectomie.
Bronnen (Boyaci, 2014; Kast, 2008; Schick, 2009; Kotil, 2014) |
Vergelijking 2
2.1
Laag GRADE |
Er lijkt geen verschil te zijn tussen de patiëntengroepen die zijn geholpen met een sequestrectomie alleen of met een discectomie in pijn in het been 24 maanden na de ingreep.
Bronnen (Barth, 2008; Kast, 2008; Schick, 2009; Kotil, 2014) |
2.2
Laag GRADE |
Er zijn aanwijzingen dat er geen verschil is in functioneren op lange termijn (≥12 maanden) tussen ILMI en MD.
Bronnen (Arts, 2009; Franke, 2009; Garg, 2011; Righesso, 2007; Ryang, 2008 Teli, 2010) |
2.3
Laag GRADE |
Er zijn aanwijzingen dat er geen verschil is in pijn in de rug op korte termijn (≤1 maand) tussen ILMI en MD.
Bronnen (Arts, 2009; Brock, 2008; Shin, 2008; Teli, 2010) |
2.4
Matig GRADE |
Er zijn aanwijzingen dat er geen verschil is in pijn in de rug op lange termijn (≥12 maanden) tussen ILMI en MD.
Bronnen (Arts, 2009; Ryang, 2009; Teli, 2010) |
2.5
Laag GRADE |
Er zijn aanwijzingen dat er geen verschil is in pijn in het been op korte termijn (≤1 maand) tussen ILMI en MD.
Bronnen (Arts, 2009; Brock, 2008; Huang, 2005; Righesso, 2007; Shin, 2008; Teli, 2010) |
2.6
Laag GRADE |
Er zijn aanwijzingen dat er geen verschil is in pijn in het been op lange termijn (≥12 maanden) tussen ILMI en MD.
Bronnen (Arts, 2009; Righesso, 2007; Teli, 2010) |
2.7
Zeer laag GRADE |
Er lijkt geen verschil te zijn in de hoeveelheid complicaties tussen ILMI en MD.
Bronnen (Arts, 2009; Franke, 2009; Garg, 2011; Huang, 2005; Righesso, 2007; Ryang, 2008; Schick, 2002; Teli, 2010) |
Vergelijking 3
3.1
Laag GRADE |
Er zijn aanwijzingen dat er geen verschil is in pijn in het aangedane been na drie maanden tussen PTED en microdiscectomie.
Bronnen (Gibson, 2016) |
3.2
Laag GRADE |
Er zijn aanwijzingen dat er een verschil is in pijn in het aangedane been na 24 maanden in het voordeel van PTED ten opzichte van microdiscectomie. Dit verschil is echter niet klinisch relevant.
Bronnen (Gibson, 2016) |
3.3
Laag GRADE |
Er zijn aanwijzingen dat er geen verschil is in het functioneren na drie maanden tussen PTED en microdiscectomie.
Bronnen (Gibson, 2016) |
3.4
Laag GRADE |
Er zijn aanwijzingen dat er geen verschil is in het functioneren na 24 maanden tussen PTED en microdiscectomie.
Bronnen (Gibson, 2016) |
3.5
Laag GRADE |
Er zijn aanwijzingen dat er geen verschil is in pijn in de rug na drie maanden tussen PTED en microdiscectomie.
Bronnen (Gibson, 2016) |
3.6
Laag GRADE |
Er zijn aanwijzingen dat er geen verschil is in pijn in de rug na 24 maanden tussen PTED en microdiscectomie.
Bronnen (Gibson, 2016) |
3.7
Zeer laag GRADE |
Er lijkt geen verschil in het aantal complicaties te zijn na een PTED of een microdiscectomie.
Bronnen (Gibson, 2016; Hermantin, 1999) |
Samenvatting literatuur
Vergelijking 1 Sequestrectomie versus microdiscotomie
Voor deze vergelijking is één artikel (vijf studies) meegenomen in de literatuuranalyse. Het betreft een systematische review, uitgevoerd door Azarhomayoun in 2015. Deze review beschreef vijf studies (Barth, 2008; Kast, 2008; Schick, 2009; Kotil, 2014; Boyaci, 2014). In de review werden één RCT en vier prospectieve studies beschreven. In totaal zijn er 769 patiënten beschreven en de follow-up varieerde van 24 tot 60 maanden. De studie van Barth (2008) is een RCT, de andere studies betreffen prospectieve cohortonderzoeken.
1.1
Uitkomstmaat Pijn in het been na 24 maanden:
Deze uitkomstmaat is in vier studies beschreven (Barth, 2008; Kast, 2008; Schick, 2009; Kotil, 2014) bij in totaal 462 patiënten. De uitkomstmaat werd uitgedrukt als het verschil tussen de twee onderzoeksgroepen op een VAS-score van 0 tot 10. De mean difference tussen de twee groepen was -0,19 [95% CI -0,31 tot -0,07] (tabel 1; de mean geeft de gemiddelde VAS beenpijn na 24 maanden follow up aan) met een zeer lage mate van heterogeniteit (τ2 = 0,03; I2=16%). Het effect is in het voordeel van de sequestrectomie groep maar is niet significant, daarnaast werd de grens van klinische relevantie niet gehaald. De studie van Kotil uit 2014 weegt erg zwaar mee in het gepoolde effect. Wanneer we deze studie uit de analyse halen verschuift de mean difference naar 0,09 [95% CI -0,50 tot 0,68]. Er lijkt geen verschil tussen de twee interventies te zitten.
Tabel 1 Uitkomstmaat Pijn in het been na 24 maanden
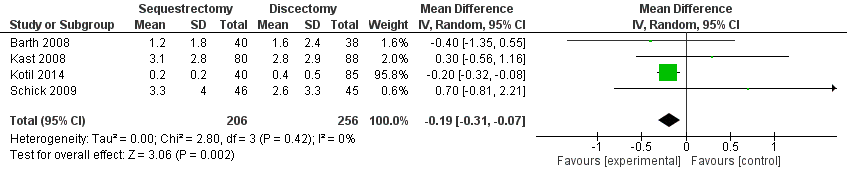
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat Pijn in het been na 24 maanden is met één niveau verlaagd gezien ernstige beperkingen in de onderzoeksopzet (geen randomisatie in verschillende studies) en het niet halen van de grens van klinische besluitvorming (imprecisie). Het niveau van de bewijskracht voor deze uitkomstmaat is zeer laag.
1.2
Uitkomstmaat operatie gerelateerde complicaties:
Deze uitkomstmaat is beschreven in vier studies (Boyaci, 2014; Kast, 2008; Kotil, 2014; Schick, 2009) en is gedefinieerd als durotomie, wondinfectie, instabiliteit, foot-drop, een hematoom of stenose. De uitkomstmaat is beschreven voor een groep van 685 patiënten, het percentage complicaties betrof ≈3%. In de sequestrectomie groep werden zeven complicaties gezien en in de discectomie groep vijftien complicaties. Dit leidde tot een risk ratio van 0,75 (95% CI 0,30 – 1,83) (tabel 2) met een zeer lage mate van heterogeniteit (τ2 = 0,00; I2=0%). Er lijkt geen verschil te zijn tussen de twee behandelingen in het aantal complicaties.
Tabel 2 Uitkomstmaat Operatie gerelateerde complicaties
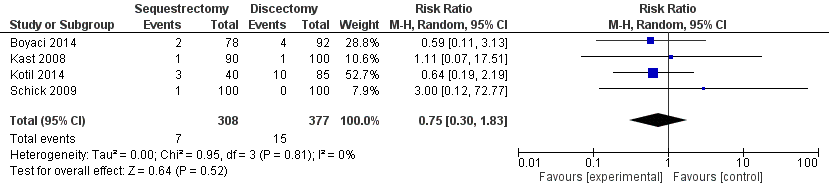
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat complicaties door operatie is met één niveau verlaagd gezien ernstige beperkingen in de onderzoeksopzet (geen randomisatie in verschillende studies) en het passeren van de grens van klinische besluitvorming (imprecisie) en het geringe aantal events (imprecisie). Het niveau van de bewijskracht voor deze uitkomstmaat is zeer laag.
1.3
Uitkomstmaat Pijn in de rug na 24 maanden:
Deze uitkomstmaat is in vier studies beschreven (Barth, 2008; Kast, 2008; Schick, 2009; Kotil, 2014) bij in totaal 462 patiënten. De uitkomstmaat werd uitgedrukt als het verschil tussen de twee onderzoeksgroepen op een VAS-score van 0 tot 10. De mean difference tussen de twee groepen was -0,25 (95% CI -0,65 tot 0,15) (tabel 3; de mean geeft de gemiddelde VAS rugpijn na 24 maanden follow up aan) met een zeer lage mate van heterogeniteit (τ2 = 0,03; I2=16%). Er lijkt geen verschil te zijn tussen de twee behandelingen.
Tabel 3 Uitkomstmaat Pijn in de rug na 24 maanden
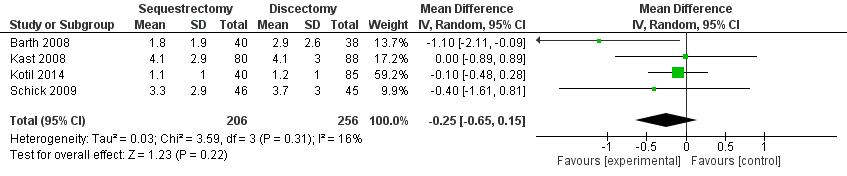
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat pijn in de rug is met één niveau verlaagd gezien ernstige beperkingen in de onderzoeksopzet (geen randomisatie in verschillende studies) en het niet halen van de van de grens van klinische besluitvorming (imprecisie). Het niveau van de bewijskracht voor deze uitkomstmaat is zeer laag.
Vergelijking 2 Interlaminaire minimaal invasieve discotomie (ILMI) versus conventionele microdiscotomie (MD)
Er is een systematische review geïncludeerd die deze vergelijking heeft beschreven (Wang, 2014). In deze review zijn elf RCT’s beschreven. (Arts, 2009; Brock, 2008; Franke, 2009; Garg, 2011; Huang, 2005; Righesso, 2007; Ryang, 2008; Sasaoka, 2006; Schick, 2002; Shin, 2008; Teli, 2010). In de interventiegroep werden studies geïncludeerd waarbij de operatie gedaan werd door een tube. Er werd geen onderscheid gemaakt in het verrichten van de operatie (door de tube) met behulp van de microscoop of de endoscoop. Het is niet duidelijk aangegeven of de conventionele microdiscectomie waarmee vergeleken werd een unilaterale of bilaterale benadering betrof. Deze elf studies beschreven in totaal 1012 patiënten (594 mannen en 418 vrouwen). De studies komen uit verschillende landen (Nederland, Duitsland (4x), India, Taiwan, Brazilië, Japan, Zuid-Korea en Italië). De follow-up varieerde van één dag tot 25 maanden, de meeste studies rapporteerden een follow-up van 12 maanden. Een studie includeerde de gegevens van twee RCT’s uitgevoerd in twee verschillende centra (Franke, 2009). De twee beschreven situaties in deze studie zijn apart vermeld als index en transfer. Alle in de analyse meegenomen studies betreffen RCT’s.
In de systematische review worden bij de uitkomstmaten twee meetmomenten beschreven. Korte termijn en lange termijn, waar kort wordt gezien als ≤1 maand en lang als ≥12 maanden.
2.1
Uitkomstmaat Pijn in het been korte termijn (≤1 maand):
Deze uitkomstmaat is beschreven in zes studies (Arts, 2009; Brock, 2008; Huang, 2005; Righesso, 2007; Shin, 2008; Teli, 2010) en is gemeten met een VAS binnen uiterlijk één maand na de ingreep. De meeste studies gebruikten een VAS van 0 tot 10, alleen in de studie van Arts werd een VAS van 0 tot 100 gebruikt. De uitkomstmaat is beschreven bij 684 patiënten. De resultaten van de zes studies werden gepoold, dit leidde tot een standardized mean difference van 0,14 (95%CI -0,01 tot 0,29) met een hoge mate van heterogeniteit (I2=85%). (tabel 4) Er lijkt geen verschil te zijn tussen de twee behandelingen.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat Pijn in het been korte termijn (≤1 maand) is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (limitations in study design) en een beperkte omvang van de studiepopulatie (imprecisie). De uiteindelijke bewijskracht is GRADE laag.
2.2
Uitkomstmaat Pijn in het been lange termijn (≥12 maanden):
Deze uitkomstmaat is beschreven in drie studies (Arts, 2009; Righesso, 2007; Teli, 2010) en is gemeten met een VAS minstens 12 maanden na de ingreep. De meeste studies gebruikten een VAS van 0 tot 10, alleen in de studie van Arts werd een VAS van 0 tot 100 gebruikt. De uitkomstmaat is beschreven bij 507 patiënten. De resultaten van de drie studies werden gepoold, dit leidde tot een standardized mean difference van 0,12 [95%CI -0,05 tot 0,30] met een lage mate van heterogeniteit (I2=0%). (tabel 5) Het effect is minimaal in het voordeel van de MD groep, echter is dit verschil niet statistisch significant.
Tabel 4 en 5 Uitkomstmaat Pijn in het been op de korte termijn (boven) en lange termijn (onder)
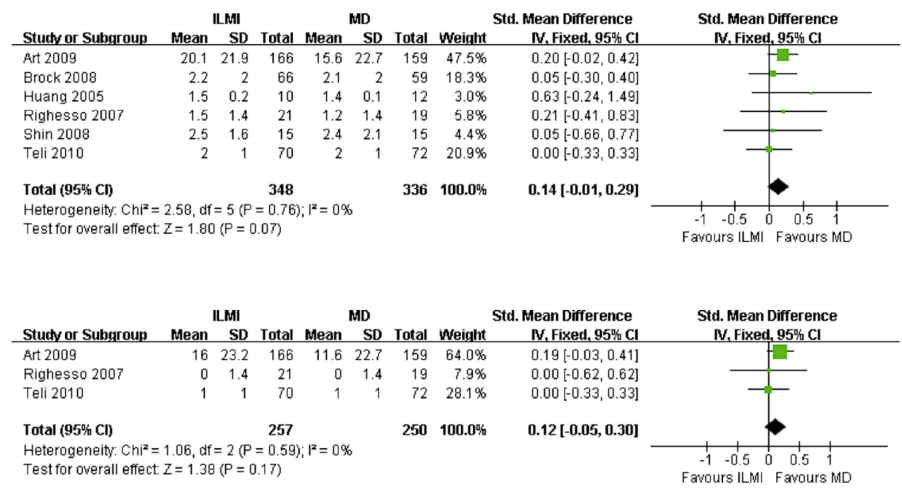
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat Pijn in het been lange termijn (≥12 maanden) is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (limitations in study design) en een beperkte omvang van de studiepopulatie (imprecisie). De uiteindelijke bewijskracht is GRADE laag.
2.3
Uitkomstmaat Functioneren korte termijn (≤1 maand):
Deze uitkomstmaat is beschreven in zes studies (Arts, 2009; Franke, 2009 index; Franke, 2009 transfer; Garg, 2011; Righesso, 2007; Teli, 2010) en is gedefinieerd als de Oswestry Disability Index (ODI) binnen een maand na de ingreep. De uitkomstmaat is beschreven bij 719 patiënten. De resultaten van de zes studies werden gepoold, dit leidde tot een standardized mean difference van 0,01 [95%CI -0,14 tot 0,15] met een lage heterogeniteit (I2=0%). (tabel 6) Er lijkt geen verschil te zijn tussen de twee behandelingen.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat Functioneren korte termijn (≤1 maand) is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (limitations in study design) en een beperkte omvang van de studiepopulatie (imprecisie). De uiteindelijke bewijskracht is GRADE laag.
2.4
Uitkomstmaat Functioneren lange termijn (≥12 maanden):
Deze uitkomstmaat is beschreven in zeven studies (Arts, 2009; Franke, 2009 index; Franke, 2009 transfer; Garg, 2011; Righesso, 2007; Ryang, 2008; Teli, 2010) en is gedefinieerd als de Oswestry Disability Index (ODI) 12 maanden of later na de ingreep. De uitkomstmaat is beschreven bij 779 patiënten. De resultaten van de zeven studies werden gepoold, dit leidde tot een standardized mean difference van 0,11 [95%CI -0,03 tot 0,25] met een lage heterogeniteit (I2=0%). (tabel 7). Er lijkt geen verschil te zijn tussen de twee behandelingen.
Tabel 6 en 7 Uitkomstmaat functioneren op de korte termijn (boven) en lange termijn (onder)
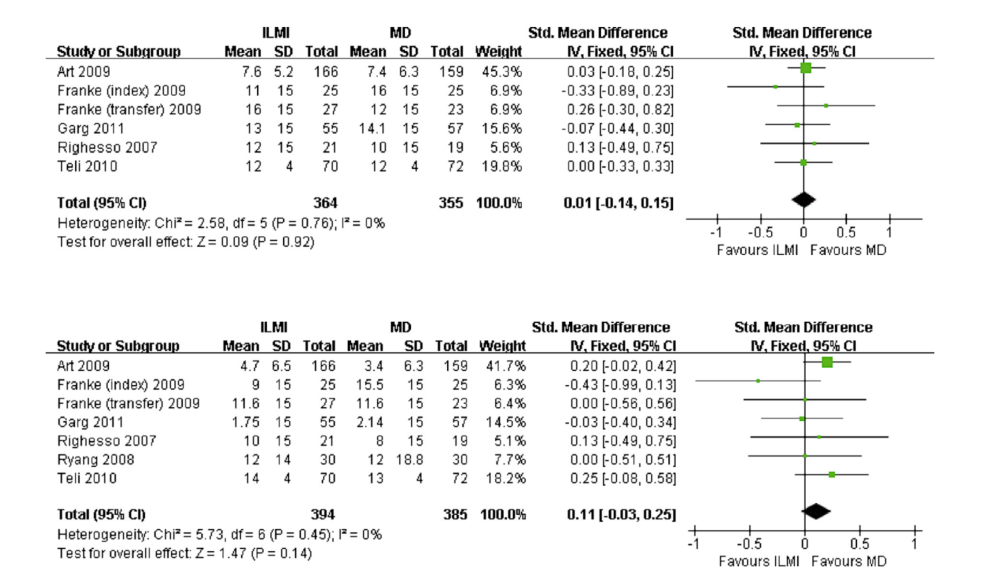
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat Functioneren lange termijn (≥12 maanden) is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (limitations in study design) en een beperkte omvang van de studiepopulatie (imprecisie). De uiteindelijke bewijskracht is GRADE laag.
2.5
Uitkomstmaat Pijn in de rug korte termijn (≤1 maand):
Deze uitkomstmaat is beschreven in vier studies (Arts, 2009; Brock, 2008; Shin, 2008; Teli, 2010) en is gemeten met een VAS binnen uiterlijk één maand na de ingreep. De meeste studies gebruikten een VAS van 0 tot 10, alleen in de studie van Arts werd een VAS van 0 tot 100 gebruikt. De uitkomstmaat is beschreven bij 622 patiënten. De resultaten van de vier studies werden gepoold, dit leidde tot een standardized mean difference van -0,34 [95%CI -0,81 tot 0,14] met een hoge mate van heterogeniteit (I2=85%). (tabel 8) Er lijkt geen verschil te zijn tussen de twee behandelingen.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat Pijn in de rug korte termijn (≤1 maand) is met twee niveaus verlaagd gezien inconsistentie tussen de onderzoeksresultaten en een beperkte omvang van de studiepopulatie (imprecisie). De uiteindelijke bewijskracht is GRADE laag.
2.6
Uitkomstmaat Pijn in de rug lange termijn (≥12 maanden):
Deze uitkomstmaat is beschreven in drie studies (Arts, 2009; Ryang, 2008; Teli, 2010) en is gemeten met een VAS minstens 12 maanden na de ingreep. De meeste studies gebruikten een VAS van 0 tot 10, alleen in de studie van Arts werd een VAS van 0 tot 100 gebruikt. De uitkomstmaat is beschreven bij 527 patiënten. De resultaten van de drie studies werden gepoold, dit leidde tot een standardized mean difference van 0,13 [95%CI -0,04 tot 0,30] met een lage mate van heterogeniteit (I2=0%). (tabel 49) Er lijkt geen verschil te zijn tussen de twee behandelingen.
Tabel 8 en 9 Uitkomstmaat Pijn in de rug op de korte termijn (boven) en lange termijn (onder)
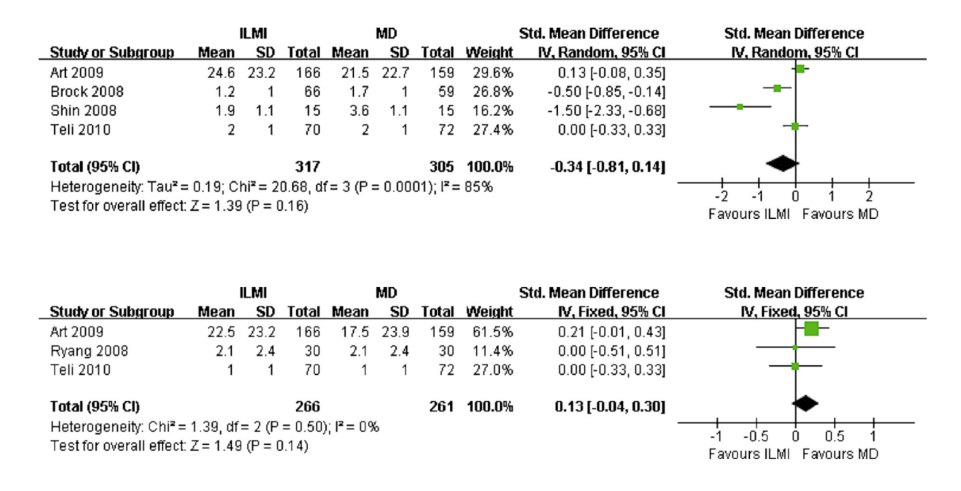
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat Pijn in de rug lange termijn (≥12 maanden) is met een niveau verlaagd gezien de beperkte omvang van de studiepopulatie (imprecisie). De uiteindelijke bewijskracht is GRADE matig.
2.7
Uitkomstmaat Complicaties:
Deze uitkomstmaat is beschreven in acht studies (Arts, 2009; Franke (index) 2009; Garg, 2011; Huang, 2005; Righesso, 2007; Ryang, 2008; Schick, 2002; Teli, 2010). De uitkomstmaat is in de systematische review niet verder gespecificeerd. De uitkomstmaat is beschreven bij 831 patiënten. De resultaten van de acht studies werden gepoold, dit leidde tot een Risk Ratio van 1,22 [95%CI 0,88 tot 1,69] met een lage mate van heterogeniteit (I2=0%). (tabel 10) Er lijkt geen verschil te zijn tussen de twee behandelingen.
Tabel 10 Uitkomstmaat Complicaties
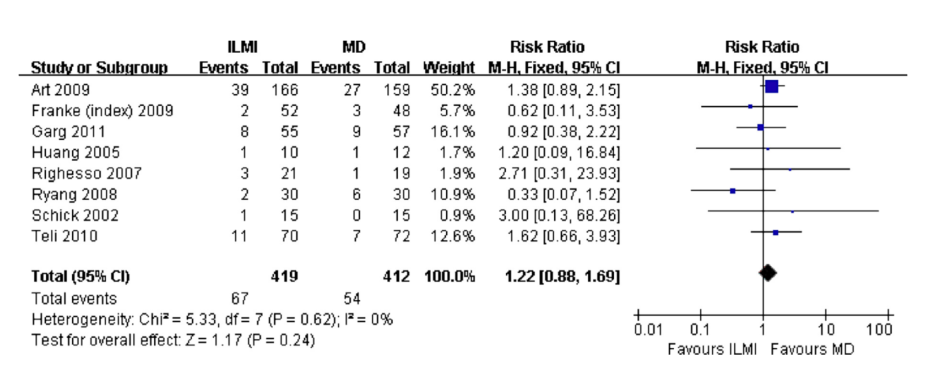
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat Complicaties is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet; onvoldoende duidelijke beschrijving van de uitkomstmaat (indirectheid) beperkte omvang van de studiepopulatie (imprecisie). De uiteindelijke bewijskracht is GRADE zeer laag.
Vergelijking 3 Percutane transforaminale endoscopische decompressie (PTED) versus open microdiscectomy
Deze vergelijking is in twee verschillende studies beschreven. Het betreft een RCT (Hermantin, 1999) welke was opgenomen in een systematische review (Nellensteijn, 2010) en een recent gepubliceerde RCT (Gibson, 2016). Het artikel van Hermantin beschrijft een RCT uitgevoerd in de Verenigde Staten waar 60 patiënten aan meededen. Zij vergeleken een open laminotomie en discotomie met een video-assisted arthroscopische microdiscotomie. In de trial van Gibson zijn 140 patiënten uit de UK geïncludeerd. In die studie werd microdiscotomie vergeleken met transforaminale endoscopische discotomie.
3.1
Uitkomstmaat Pijn in het aangedane been korte termijn (drie maanden):
Deze uitkomstmaat is in één studie beschreven (Gibson, 2016) bij 140 patiënten en is gemeten met een visueel analoge schaal drie maanden na de ingreep. De PTED-groep scoorde 2,8 ± 2,9 en de microdiscectomie-groep scoorde 3,2 ± 3,0. Dit resulteerde in een mean difference van -0,40 95% CI (-1,38 tot 0,58). Het resultaat was niet statistisch significant. Er lijkt geen verschil te zijn tussen de twee behandelingen.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat Functioneren korte termijn (drie maanden) is met twee niveaus verlaagd gezien de beperkte omvang van de studiepopulatie (imprecisie). De uiteindelijke bewijskracht is GRADE laag.
3.2
Uitkomstmaat Pijn in het aangedane been lange termijn (24 maanden):
Deze uitkomstmaat is in één studie beschreven (Gibson, 2016) bij 140 patiënten en is gemeten met een visueel analoge schaal 24 maanden na de ingreep. De PTED-groep scoorde 1,9 ± 2,6 en de microdiscectomie-groep scoorde 3,5 ± 3,1. Dit resulteerde in een mean difference van -1,60 95% CI (-2,55 tot -0,65). De grens van klinische relevantie werd niet gehaald. Er lijkt geen verschil te zijn tussen de twee behandelingen.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat Pijn in het aangedane been lange termijn (24 maanden) is met twee niveaus verlaagd gezien de beperkte omvang van de studiepopulatie (imprecisie). De uiteindelijke bewijskracht is GRADE laag.
3.3
Uitkomstmaat Functioneren korte termijn (3 maanden):
Deze uitkomstmaat is in één studie beschreven (Gibson, 2016) bij 140 patiënten en is gemeten op de Oswestry Disability Index drie maanden na de ingreep. De PTED-groep scoorde 27 ± 18 en de microdiscectomie-groep scoorde 27 ± 18. Dit resulteerde in een mean difference van 0,0 95% CI (-5,96 tot 5,96). Het resultaat was niet statistisch significant. Er lijkt geen verschil te zijn tussen de twee behandelingen.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat Functioneren korte termijn (drie maanden) is met twee niveaus verlaagd gezien de beperkte omvang van de studiepopulatie (imprecisie). De uiteindelijke bewijskracht is GRADE laag.
3.4
Uitkomstmaat Functioneren lange termijn (24 maanden):
Deze uitkomstmaat is in één studie beschreven (Gibson, 2016) bij 140 patiënten en is gemeten op de Oswestry Disability Index 24 maanden na de ingreep. De PTED-groep scoorde 18 ± 17 en de microdiscectomie-groep scoorde 18 ± 22. Dit resulteerde in een mean difference van 0,0 95% CI (-6,51 tot 6,51). Het resultaat was niet statistisch significant. Er lijkt geen verschil te zijn tussen de twee behandelingen.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat Functioneren lange termijn (24 maanden) is met twee niveaus verlaagd gezien de beperkte omvang van de studiepopulatie (imprecisie). De uiteindelijke bewijskracht is GRADE laag.
3.5
Uitkomstmaat Pijn in de rug korte termijn (drie maanden):
Deze uitkomstmaat is in één studie beschreven (Gibson, 2016) bij 140 patiënten en is gemeten met een visueel analoge schaal drie maanden na de ingreep. De PTED-groep scoorde 3,0 ± 2,7 en de microdiscectomie-groep scoorde 3,1 ± 2,9. Dit resulteerde in een mean difference van -0,10 95% CI [-1,03 tot 0,83]. Het resultaat was niet statistisch significant. Er lijkt geen verschil te zijn tussen de twee behandelingen.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat Pijn in de rug korte termijn (drie maanden) is met twee niveaus verlaagd gezien de beperkte omvang van de studiepopulatie (imprecisie). De uiteindelijke bewijskracht is GRADE laag.
3.6
Uitkomstmaat Pijn in de rug lange termijn (24 maanden):
Deze uitkomstmaat is in één studie beschreven (Gibson, 2016) bij 140 patiënten en is gemeten met een visueel analoge schaal 24 maanden na de ingreep. De PTED-groep scoorde 2,5 ± 2,5 en de microdiscectomie-groep scoorde 3,0 ± 2,8. Dit resulteerde in een mean difference van -0,50 95% CI (-1,38 tot -0,38). Het resultaat was niet statistisch significant. Er lijkt geen verschil te zijn tussen de twee behandelingen.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat Pijn in de rug lange termijn (24 maanden) is met twee niveaus verlaagd gezien de beperkte omvang van de studiepopulatie (imprecisie). De uiteindelijke bewijskracht is GRADE laag.
3.7
Uitkomstmaat Complicaties:
Deze uitkomstmaat is in twee studies beschreven (Gibson, 2016; Hermantin, 1999). In Gibson werden intra-operatieve en perioperatieve complicaties beschreven. In geen van de twee groepen kwamen dergelijke complicaties voor. In de studie van Hermantin werden postoperatieve complicaties beschreven. In de PTED-groep waren er twee complicaties en in de open discectomie-groep vonden geen complicaties plaats.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat Complicaties is met drie niveaus verlaagd gezien de beperkte omvang van de studiepopulatie (imprecisie) en verschillen in de definitie van de uitkomstmaat. De uiteindelijke bewijskracht is GRADE zeer laag.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende vraagstellingen:
Vergelijking 1:
Leidt sequestrectomie alleen tot betere uitkomsten bij patiënten met HNP dan sequestrectomie plus conventionele microdiscotomie?
Vergelijking 2:
Leidt interlaminaire minimaal invasieve discotomie (ILMI) tot betere uitkomsten bij patiënten met HNP dan conventionele microdiscotomie (MD)?
Vergelijking 3:
Leidt percutane transforaminale endoscopische decompressie (PTED) tot betere uitkomsten bij patiënten met HNP dan conventionele microdiscotomie?
Relevante uitkomstmaten
De werkgroep achtte pijn in het been en functioneren voor de besluitvorming kritieke uitkomstmaten; pijn in de rug, en (ingreep-gerelateerde) complicaties voor de besluitvorming belangrijke uitkomstmaten. Geselecteerde uitkomstmaten zijn mede gebaseerd op een Delphi-studie (Chiarotto, 2015).
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Minimaal klinisch relevant verschil
Voor het vaststellen van de Minimal clinically important difference (MCID) is gebruikt gemaakt van het artikel van Ostelo (2008), waar een 20% tot 30% verbetering ten opzichte van de baseline meting als minimaal klinisch relevant verschil wordt aangehouden (within-group change). Dit komt grofweg overeen met een verschil van 2 op de VAS schaal (0 tot 10), 2 op de NRS schaal (0 tot 10), 5 op de Roland Disability Questionnaire (0 tot 24) en 15 op de Oswestry Disability Questionnaire (0 tot 100). De werkgroep houdt dezelfde waarde aan als klinisch relevant verschil tussen de groepen (between-group change). Pas indien er bij een uitkomstmaat een statistisch significant verschil wordt gevonden worden er uitspraken over de klinische relevantie van dit verschil gedaan.
Zoeken en selecteren (Methode)
In de databases Medline (OVID), Embase (Elsevier) is met relevante zoektermen gezocht naar studies die naar verschillende chirurgische ingrepen voor HNP hebben gekeken. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 204 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- studiedesign: systematische review van RCT’s;
- gepubliceerd tussen 1995 – februari 2016;
- full-tekst artikel beschikbaar in het Engels of Nederlands;
- studiepopulatie: patiënten met een HNP;
- vergelijking van chirurgische ingrepen bij HNP;
- beschrijving van minimaal één van de bovengenoemde uitkomstmaten.
Op basis van titel en abstract werden in eerste instantie tien studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens zes studies geëxcludeerd (zie exclusietabel), en vier studies definitief geselecteerd.
Vergelijking 1
Er is één artikel (Azarhomayoun, 2015) uit de search geselecteerd. Het betreft een systematische review (met vijf studies). Na cross-referencing zijn er geen andere studies toegevoegd.
Vergelijking 2
Er is één artikel (Wang, 2014) uit de search geselecteerd. Het betreft een systematische review (met elf studies). Na cross-referencing zijn er geen andere studies toegevoegd.
Vergelijking 3
Er is één artikel uit de search geselecteerd (Nellensteijn, 2010). Het betreft een systematische review waarin studies met verschillende designs zijn beschreven. Na cross-referencing is nog één studie (Gibson, 2016) toegevoegd.
Resultaten
Er zijn drie systematische reviews beschreven, in totaal zijn 18 verschillende onderzoeken opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De evidence-tabellen en beoordeling van individuele studiekwaliteit zijn opgenomen onder het tabblad Onderbouwing.
Referenties
- Arts MP, Brand R, van den Akker ME, et al. Leiden-The Hague Spine Intervention Prognostic Study Group (SIPS). Tubular diskectomy vs conventional microdiskectomy for sciatica: a randomized controlled trial. JAMA. 2009;8;302(2):149-58.
- Arts M, Brand R, van der Kallen B, et al. Does minimally invasive lumbar disc surgery result in less muscle injury than conventional surgery? A randomized controlled trial. European Spine Journal 2011; 20(1):517.
- Azarhomayoun A, Chou R, Shirdel S, et al. Sequestrectomy Versus Conventional Microdiscectomy for the Treatment of a Lumbar Disc Herniation: A Systematic Review. Spine (Phila Pa 1976). 2015;40(24):E1330-9.
- Barth M, Weiss C, Thomé C. Two-year outcome after lumbar microdiscectomy versus microscopic sequestrectomy: part 1: evaluation of clinical outcome. Spine (Phila Pa 1976). 2008;1;33(3):265-72.
- Boyaci S, Aksoy K. Long-term clinical outcome of the lumbar micro-discectomy and fragmentectomy. Neurosurg Quart. 2014;1:17.
- Brock, Kunkel, Papavero. Lumbar microdiscectomy: subperiosteal versus transmuscular approach and in?uence on the early postoperative analgesic consumption. Eur Spine J. 2008;17:51822.
- Chiarotto A, Deyo RA, Terwee CB, et al. Core outcome domains for clinical trials in non-specific low back pain. Eur Spine J. 2015;24(6):1127-42.
- Franke, Greiner-Perth, Boehm, et al. Comparison of a minimally invasive procedure versus standard microscopic discotomy: a prospective randomised controlled clinical trial. Eur Spine J. 2009;18: 9921000.
- Garg B, Nagraja UB, Jayaswal A. Microendoscopic versus open discectomy for lumbar disc herniation: a prospective randomised study. J Orthop Surg (Hong Kong). 2011;19(1):30-4.
- Gibson JN, Subramanian AS, Scott CE. A randomised controlled trial of transforaminal endoscopic discectomy vs microdiscectomy. Eur Spine J. 2017 Mar;26(3):847-856. doi: 10.1007/s00586-016-4885-6. Epub 2016 Nov 24. Erratum in: Eur Spine J. 2017 Jun 12;:. PubMed PMID: 27885470.
- Hermantin FU, Peters T, Quartararo L, et al. A prospective, randomized study comparing the results of open discectomy with those of video-assisted arthroscopic microdiscectomy. J Bone Joint Surg Am. 1999;81(7):958-65.
- Huang TJ, Hsu RW, Li YY, et al. Less systemic cytokine response in patients following microendoscopic versus open lumbar discectomy. J Orthop Res. 2005;23(2):406-11.
- Kast E, Mohr K, Richter HP, et al. Results of simple fragment excision in lumbar disc surgery. Orthopade. 2005;34(9):931-7. German.
- Kotil K, Köksal NS, Kayaci S. Long term results of lumbar sequestrectomy versus aggressive microdiscectomy. J Clin Neurosci. 2014;21(10):1714-8.
- Ostelo RW, Deyo RA, Stratford P, et al. Interpreting change scores for pain and functional status in low back pain: towards international consensus regarding minimal important change. Spine (Phila Pa 1976). 2008;1;33(1):90-4.
- Righesso O, Falavigna A, Avanzi O. Comparison of open discectomy with microendoscopic discectomy in lumbar disc herniations: results of a randomized controlled trial. Neurosurgery. 2007;61(3):545-9; discussion 549.
- Ryang YM, Oertel MF, Mayfrank L, et al. Standard open microdiscectomy versus minimal access trocar microdiscectomy: results of a prospective randomized study. Neurosurgery. 2008;62(1):174-81; discussion 181-2.
- Sasaoka R, Nakamura H, Konishi S, et al. Objective assessment of reduced invasiveness in MED. Compared with conventional one-level laminotomy. Eur Spine J. 2006;15(5):577-82.
- Schick U, Elhabony R. Prospective comparative study of lumbar sequestrectomy and microdiscectomy. Minim Invasive Neurosurg. 2009;52(4):180-5.
- Schick U, Döhnert J, Richter A, et al. Microendoscopic lumbar discectomy versus open surgery: an intraoperative EMG study. Eur Spine J. 2002;11(1):20-6.
- Shin DA, Kim KN, Shin HC, et al. The efficacy of microendoscopic discectomy in reducing iatrogenic muscle injury. J Neurosurg Spine. 2008;8(1):39-43.
- Teli M, Lovi A, Brayda-Bruno M, et al. Higher risk of dural tears and recurrent herniation with lumbar micro-endoscopic discectomy. Eur Spine J. 2010;19(3):443-50.
- Wang XS, Sun RF, Ji Q, et al. A meta-analysis of interlaminar minimally invasive discectomy compared to conventional microdiscectomy for lumbar disk herniation. Clin Neurol Neurosurg. 2014;127:149-57.
Evidence tabellen
SR
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Comparison 1
Azarhomayoun, 2015
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of [RCTs & prospective cohort ]
Literature search up to [November 2014]
A: Barth, 2008 B: Kast, 2008 C: Schick, 2009 D: Kotil, 2014 E: Boyaci, 2014
Study design: A: RCT B: prospective cohort C: prospective cohort D: prospective cohort E: prospective cohort
Source of funding: No funding received |
Inclusion criteria SR: - RCT or prospective study; - Adults between 18 y – 80 y; - undergoing surgical treatment for 1-level LDH;
Exclusion criteria SR: - None mentioned
5 studies included
Important patient characteristics at baseline:
N, mean age A: 84 patients (I:42; C:42), XX yrs B: 190 patients (I:90; C: 100), XX yrs C: 200 patients (I: 100; C: 100), XX yrs D: 125 patients (I: 40; C: 85), XX yrs E: 170 patients (I: 78; C: 92), XX yrs
Groups comparable at baseline |
Describe intervention:
A: microscopic sequestrectomy B: C: sequestrectomy D: microscopic sequestrectomy E: microscopic sequestrectomy |
Describe control:
A: microdiscectomy B: discectomy C: discectomy D: discectomy E: microdiscectomy |
End-point of follow-up:
A: 24 months B: 24 months C: 35 months D: 60 months E: 24 months
For how many participants were no complete outcome data available? (intervention/control) A: C: 4; I:2 B: C: 12; I:10 C: C: 55; I:54 D: C: 0; I:0 E: C: 0; I:0 |
Outcome measure- Leg Pain Defined as VAS leg pain
Effect measure: mean difference [95% CI]: A: -0,4 [-1,35 : 0,55] B: 0,30 [ -0,56 : 1,16] D: -0,20 [-0,32 : -0,08] E: 0,70 [ -0,81 : 2,21]
-0,19 [95% CI -0,31 to -0,07] (τ2 = 0,03; I2=16%)
Outcome measure- Back Pain Defined as VAS back pain
Effect measure: mean difference [95% CI]: A: -1,10 [-2,11 : -0,09] B: 0,00 [ -0,89 : 0,89] D: -0,10 [-0,48 : -0,28] E: -0,40 [ -1,61 : 0,81]
-0,25 [95% CI -0,65 to 0,15] (τ2 = 0,03; I2=16%)
Outcome measure-Procedure related complications Defined as Durotomy, wound infection, instability, foot drop, hematoma, stenosis.
Effect measure: RR [95% CI]: B: I: 1/90 : C: 1/100 C: I: 1/100 : C: 0/100 D: I: 3/40 : C: 10/85 E: I: 2/78 : C: 4/92
RR 0,75 [95% CI 0,30 – 1,83] (τ2 = 0,00; I2=0%) |
Facultative:
Outcome measure- Leg Pain Defined as VAS leg pain GRADE VERY LOW: due to shortcomings in study design and imprecision (crossing the line of MCID).
Outcome measure- Back Pain Defined as VAS back pain GRADE VERY LOW: due to shortcomings in study design and imprecision(crossing the line of MCID).
Outcome measure-Procedure related complications Defined as Durotomy, wound infection, instability, foot drop, hematoma, stenosis. GRADE VERY LOW: due to shortcomings in study design and imprecision (low amount of events and crossing the line of MCID). |
|
Comparison 2 Wang, 2014
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of [RCTs]
Literature search up to [May 2014]
A: Arts, 2009 B: Brock, 2008 C: Franke, 2009 (index) D: Franke, 2009 (transfer) E: Garg, 2011 F: Huang, 2005 G: Righesso, 2007 H: Ryang, 2008 I: Sasaoka, 2006 J: Schick, 2002 K: Shin, 2008 L: Teli, 2010
Study design: A: RCT B: RCT C: RCT D: RCT E: RCT F: RCT G: RCT H: RCT I: RCT J: RCT K: RCT L: RCT
Source of funding: Not mentioned
|
Inclusion criteria SR: - Studydesign RCT; - Patients with Sciatica caused by one level LDH;
Exclusion criteria SR: - Neoplastic etiology; - Infection; - Traumatic fracture; - Spinal stenosis.
11 studies included
Important patient characteristics at baseline:
Number of patients (N)
A: I: 166 C: 159 B: I: 66 C: 59 C: I: 25 C: 25 D: I: 27 C: 23 E: I: 55 C: 57 F: I: 10 C: 12 G: I: 21 C: 19 H: I: 30 C: 30 I: I: 15 C: 11 J: I: 15 C: 15 K: I: 15 C: 15 L: I: 70 C: 72
Mean age A: I: 41,6 ± 9,8 C: 41,3 ±11,7 B: 51 (20-79) C: 44,0 ± 11,7 D: 44,0 ± 11,7 E: I: 37,0 ± 8,0 C:38,0 ± 6,0 F: I: 39,2 ± 10,8 C: 39,8 ± 11,0 G: I: 42,0 ± 10,7 C: 46,0 ± 12,4 H: I: 38,2 ± 9,3 C: 39,1 ± 11,3 I: I: 36,5 (25-60) C: 37,7 (20-58) J: I: 42 (23-76) C: 42 (23-76) K: I: 42,7 ± 17,7 C: 48,1 ± 10,6 L: I: 39,0 ± 12,0 C: 40,0 ± 12 12,0
Gender (%M) A: I: 51% C: 55% B: 61% C: 60% D: 60% E: I: 65% C: 77% F: I: 60% C: 75% G: I: 48% C: 68% H: I: 43% C: 63% I: I: 40% C: 72% J: I: 53% C: 60% K: I: 46% C: 67% L: I: 64% C: 67%
Groups comparable at baseline |
Describe intervention:
ILMI: Interlaminar minimally invasive discectomy. |
Describe control:
MD: open microdiscectomy |
End-point of follow-up:
A: 12 months B: 0,25 month C: 12 months D: 12 months E: 12 months F: 25 months G: 12 months H: 16 months I: 1 day J: 1 month K: 0,25 month L: 12 months
For how many participants were no complete outcome data available? (intervention/control) Not mentioned |
Outcome measure- Functioning (short term) Defined as Oswestry Disability Index at 1 or earlier.
Effect measure: std. mean difference [95% CI]: A: I: 7,6 ± 5,2 C: 7,4 ± 6,3 Std.M.Diff 0,03 [-0,18;0,25] C: I: 11 ± 15 C: 16 ± 15 Std.M.Diff -0,33 [-0,89;0,23] D: I: 16 ± 15 C: 12 ± 15 Std.M.Diff 0,26 [-0,30;0,82] E: I: 13 ± 15 C: 14,1 ± 15 Std.M.Diff -0,07 [-0,44;0,30] G: I: 12 ± 15 C: 10 ± 15 Std.M.Diff 0,13 [-0,49;0,75] L: I: 12 ± 4 C: 12 ± 4 Std.M.Diff 0,00 [-0,33;0,33]
Overall Std. M. Diff. fixed effect. 0,01 [95% CI -0,14 to 0,15] (I2=0%) I: N= 365 C: N= 355
Outcome measure- Functioning (long term) Defined as Oswestry Disability Index at 1 year or later.
Effect measure: std. mean difference [95% CI]: A: I: 4,7 ± 6,5 C: 3,4 ± 6,3 Std.M.Diff 0,20 [-0,02;0,42] C: I: 9 ± 15 C: 15,6 ± 15 Std.M.Diff -0,43 [-0,99;0,13] D: I: 11,6 ± 15 C: 11,6 ± 15 Std.M.Diff 0,00 [-0,56;0,56] E: I: 1,75± 15 C: 2,14 ± 15 Std.M.Diff -0,07 [-0,44;0,30] G: I: 10 ± 15 C: 8 ± 15 Std.M.Diff 0,13 [-0,49;0,75] H: I: 12 ± 14 C: 12 ± 18,8 Std.M.Diff 0,00 [-0,51;0,51] L: I: 14 ± 4 C: 13 ± 4 Std.M.Diff 0,25 [-0,08;0,58]
Overall Std. M. Diff. fixed effect. 0,11 [95% CI -0,03 to 0,25] (I2=0%) I: N= 394 C: N= 385
Outcome measure- back pain (short term) Defined as VAS. 0-10 or 0-100
Effect measure: mean difference [95% CI]: A: I: 24,6 ± 23,2 C: 21,5 ± 22,7 Std.M.Diff 0,13 [-0,08;0,35] B: I: 1,2 ± 1 C: 1,7 ± 1 Std.M.Diff -0,50 [-0,85;0,14] K: I: 1,9 ± 1,1 C: 3,6 ± 1,1 Std.M.Diff -1,5 [-2,33;0,68] L: I: 2 ± 1 C: 2 ± 1 Std.M.Diff 0,00 [-0,33;0,33]
Overall Std. M. Diff. random effect. -0,34 [95% CI -0,81 to 0,14] (τ2 = 0,19 I2=85%) I: N= 317 C: N= 305
Outcome measure- back pain (long term) Defined as VAS. 0-10 or 0-100
Effect measure: mean difference [95% CI]: A: I: 22,5 ± 23,2 C: 17,5 ± 23,9 Std.M.Diff 0,21 [-0,01;0,43] H: I: 2,1 ± 2,4 C: 2,1 ± 2,4 Std.M.Diff 0,0 [-0,51;0,51] L: I: 1 ± 1 C: 1 ± 1 Std.M.Diff 0,00 [-0,33;0,33]
Overall Std. M. Diff. fixed effect. 0,13 [95% CI -0,04 to 0,30] (I2=0%) I: N= 266 C: N= 261
Outcome measure- leg pain (short term) Defined as VAS. 0-10 or 0-100
Effect measure: mean difference [95% CI]: A: I: 20,1 ± 21,9 C: 15,6 ± 22,7 Std.M.Diff 0,20 [-0,02;0,42] B: I: 2,2 ± 2 C: 2,1 ± 2 Std.M.Diff 0,05 [-0,30;0,40] F: I: 1,5 ± 0,2 C: 1,4 ± 0,1 Std.M.Diff 0,63 [-0,24;1,49] G: I: 1,5 ± 1,4 C: 1,2 ± 1,4 Std.M.Diff 0,21 [-0,41;0,83] K: I: 2,5 ± 11,6 C: 2,4 ± 2,1 Std.M.Diff 0,05 [-0,66;0,77] L: I: 2 ± 1 C: 2 ± 1 Std.M.Diff 0,00 [-0,33;0,33]
Overall Std. M. Diff. fixed effect. 0,14 [95% CI -0,01 to 0,29] (I2=0%) I: N= 348 C: N= 336
Outcome measure- leg pain (long term) Defined as VAS. 0-10 or 0-100
Effect measure: mean difference [95% CI]: A: I: 16 ± 23,2 C: 11,6 ± 22,7 Std.M.Diff 0,19 [-0,03;0,41] G: I: 0 ± 1,4 C: 0 ± 1,4 Std.M.Diff 0,00 [-0,62;0,62] L: I: 1 ± 1 C: 1 ± 1 Std.M.Diff 0,00 [-0,33;0,33]
Overall Std. M. Diff. fixed effect. 0,12 [95% CI -0,05 to 0,30] (I2=0%) I: N= 257 C: N= 250
Outcome measure- Complications Not specified
Effect measure: std. mean difference [95% CI]: A: I: 39/166 C: 27/159 RR 1,38 [0,89;2,15] C: I: 2/52 C: 3/48 RR 0,62 [0,11;3,53] E: I: 8/55 C 9/57 RR 0,92 [0,38 – 2,22] F: I: 1/10 C: 1/12 RR 1,20 [0,09 – 16,84] G: I: 3/21 C: 1/19 RR 2,71 [ 0,31 – 23,93] H: I: 2/30 C: 6/30 RR 0,33 [0,07 – 1,52] J: I: 1/15 C: 0/15 RR 3,00 [0,13 – 68,26] L: I: 11/70 C: 7/72 RR 1,62 [0,66 – 3,93]
Overall RR. fixed effect. 1,22 [95% CI 0,88 to 1,69] (I2=0%) I: Events: 67 N= 419 C: Events: 54 N= 412 |
Facultative: Remarks: All studies reported a VAS of 0-10 except Arts, 2009 where a VAS of 0-100 was reported.
Outcome measure- Functioning (short term) GRADE: LOW Limitations in study design and imprecision. Outcome measure- Functioning (long term) GRADE:LOW Limitations in study design and imprecision.
Outcome measure- back pain (short term) GRADE:LOW Limitations in study design and imprecision.
Outcome measure- back pain (long term) GRADE: MODERATE Limitations in study design and imprecision.
Outcome measure- leg pain (short term) GRADE: LOW Limitations in study design and imprecision.
Outcome measure- leg pain (long term) GRADE:LOW Limitations in study design and imprecision.
Outcome measure- Complications GRADE:VERY LOW1 Limitations in study design and imprecision. |
RCT
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3 |
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Hermantin, 1999 |
Type of study: RCT
Setting: Singe-center
Country: USA
Source of funding: One or more of the authors has received or will receive bene- fits for personal or professional use from a commercial party related directly or indirectly to the subject of this article. In addition, bene- fits have been or will be received, but are directed solely to a re- search fund, foundation, educational institution, or other nonprofit organization with which one or more of the authors is associated. No funds were received in support of this study. |
Inclusion criteria: single intracanalicular disc herniation at the level between the second and third, the third and fourth, or the fourth and fifth lumbar vertebrae or between the fifth lumbar vertebra and the first sacral segment, with associated radiculopathy.
Exclusion criteria: central or lateral stenosis of the spinal canal; severe degenerative narrowing of the intervertebral disc space at the index level; evidence, on imaging, of global bulging of the intervertebral disc 10 associated with central or lateral stenosis; a sequestered herniation that had mi-grated; a large central or extraligamentous herniation between the fifth lumbar and first sacral vertebrae; drug dependency; and known psychological disorders.
N total at baseline: Intervention: 30 Control:30
Important prognostic factors2: age (range): I:39 (15-66) C:40 (18-67)
Sex: I: 73% M C: 57% M
Groups comparable at baseline. |
Describe intervention:
video-assisted arthroscopic microdiscectomy:
All patients had been managed nonoperatively elsewhere and were referred to our institution for consideration of operative management. However, when the nonoperative measures appeared to have been suboptimum, additional nonoperative treatment was employed. The arthroscopic microdiscectomy was performed with use of an oval five by eight-millimeter (internal diameter) cannula (Figs. 1-A and 1-B), introduced into the triangular working zone.
The arthroscopic microdiscectomy was performed on an outpatient basis. |
Describe control:
open laminotomy and discectomy:
All patients had been managed nonoperatively elsewhere and were referred to our institution for consideration of operative management. However, when the nonoperative measures appeared to have been suboptimum, additional nonoperative treatment was employed. The open laminotomy and discectomy was per- formed in a standard fashion. A four-centimeter poste-rior midline incision was made, and a small laminotomy and discectomy was performed at the specified level.
The laminotomy and discectomy necessitated one night of hospitalization. |
Length of follow-up: I: mean 32 (21-42) C: Mean 31 months (range 19-42)
Loss-to-follow-up: I:0% C: 0%
Incomplete outcome data: Not mentioned
|
Outcome measures and effect size:
Duration of postoperative disability
I: 49 days C: 27 days
Return to work I:29/30 C: 28/30
Postoperative Complications I:0/30 C:2/30
VAS Pain I:1,2 C: 1,9
Re-operations I:1/30 C: 2/30 |
|
|
Gibson, 2016 |
Type of study: RCT
Setting: Single center
Country: UK
Source of funding: Not mentioned
Trial registration |
Inclusion criteria: - age 25-70 - a single level prolapse with exiting and/or traversing nerve root com- pression and failure of conservative management (>6 weeks of physiotherapy)
Exclusion criteria: - upper lumbar disc disease (L2/3 or above) - previous disc prolapse, - massive sequestered disc prolapse, - weight >115 kg - malignancy. N total at baseline: Intervention: 70 Control:70
Important prognostic factors2: age ± SD: I: 42 ± 9 C: 39 ± 9
Sex: I: 43% M C: 57% M
Groups comparable at baseline. |
Describe intervention:
Transforaminal endoscopic discectomy
All TED were performed using a standardised trans-foraminal approach and ‘outside-in’ surgical techniqueusing the TESSYS TM System
Patients were treated in the lateral position with the operating table ‘broken’ at the level of the affected disc. Conscious ‘analgo-sedation’ was administered. Cannulae and endoscope placements were monitored using orthogonal bi-planar imaging (AP and lateral) with an image intensifier. No intra-operative discography was performed to outline the disc (to prevent possible internal disc fragmentation). After identification of the exiting root, pedicle and disc margin, all prolapsed material was excised using endoscopic rongeurs and a powered resector ensuring that both the exiting and traversing roots lay free. Haemostasis was secured using a radiofrequency probe with *0.02 mm penetration depth.
Direct entry into the disc was avoided unless a central herniation was present. Proximal or distal disc material was accessed by angledgraspers and cannula manipulation.
Immediate postoperative rehabilitation was identical for both treatment arms with a minimum of 2 h of bed rest before mobilisation. Patients were discharged home when comfortable and at two weeks postoperatively were allowed to drive, swim and return to work. Physiotherapy was offered if stiffness was present. |
Describe control:
Microdiscectomy
Microdiscectomy was performed using a standardised technique under general anaesthesia (GA). The ligamentum flavum was divided and the traversing nerve root identified and retracted under magnification (Zeiss, UK). Only prolapsed material was excised unless a fragment was herniating through the outer annulus in which case the disc was irrigated after prolapse extraction to ensure no sequestered fragments remained. Loose fragments underlying the posterior longitudinal ligament or extending into the exit foramen were cleared. A small (\0.75 cm) piece of absorbable haemostatic gelatin sponge was laid against the dura. No fat graft was inserted.
Immediate postoperative rehabilitation was identical for both treatment arms with a minimum of 2 h of bed rest before mobilisation. Patients were discharged home when comfortable and at two weeks postoperatively were allowed to drive, swim and return to work. Physiotherapy was offered if stiffness was present. |
Length of follow-up: 24 months
Loss-to-follow-up: N=13 9,3(%) at 24 months Reasons (not mentioned)
Incomplete outcome data: N=13 9,3(%) Reasons (not mentioned) |
Outcome measures and effect size:
Pain leg (VAS) short term 3mths I: 2,8 ± 2,9 C:3,2 ± 3,0 Pain leg (VAS) long term 24 mths I: 1,9 ± 2,6 C: 3,5 ± 3,1
Functioning (ODI) short 3 mths I:27 ± 18 C: 27 ± 18
Functioning (ODI) long 3 mths I:18 ± 17 C: 18 ± 22
Pain back (VAS) short term 3mths I: 3,0 ± 2,7 C: 3,1 ± 2,9
Pain back (VAS) long term 24 mths I: 2,5 ± 2,5 C: 3,0 ± 2,8
Complications I: 0/70 C:0/70 |
|
RoB tabellen
SR
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Azarhomayoun, 2015 |
yes |
yes |
yes |
unclear |
no |
yes |
yes |
no |
unclear |
|
Wang, 2014 |
yes |
Unclear |
yes |
yes |
N/A |
yes |
yes |
unclear |
yes |
RCT
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Hermantin, 1999 (individuele studie uit SR Nellensteijn) |
Sealed envelopes |
unlikely |
unlikely |
unlikely |
unclear |
unclear |
unlikely |
unlikely |
|
Gibson, 2016 |
random number generating computer program with block design |
unlikly |
unlikely |
unlikely |
unclear |
unlikely |
unlikely |
unlikely |
Selectietabel
|
Artikel-nr |
Auteur + jaartal |
In- / exclusie |
Toelichting? |
|
SR18 |
Azarho-mayoun, 2015
|
Inclusie |
|
|
SR34 |
Chang, 2014 |
Exclusie |
Voldeed niet aan PICO |
|
SR39 |
Cong, 2016 |
Exclusie |
Voldeed niet aan PICO |
|
SR86 |
Jacobs, 2012 |
Exclusie |
Voldeed niet aan PICO |
|
SR96 |
Kamper, 2014 |
Exclusie |
Studie van Wang, 2014 geschikter. |
|
SR136 |
Mu, 2015 |
Exclusie |
Studie van Jacobs, 2012 geschikter.
|
|
SR141 |
Nellensteijn, 2010 |
Inclusie |
Uitgebreid met studie van Gibson, 2016 |
|
SR159 |
Rasouli, 2014 |
Exclusie |
RCTs and quasi-RCTs.
SR beschrijft alle relevante informatie (Cochrane review). |
|
SR192 |
Wang, 2014 |
Inclusie |
|
|
X Gibson, 2016 |
|
Inclusie |
|
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 06-03-2018
Laatst geautoriseerd : 06-03-2018
Geplande herbeoordeling : 01-01-2023
Uiterlijk in 2022 bepaalt het bestuur van de NVvN of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). Deze overwegingen van de werkgroep zijn gebundeld en opgenomen in de Richtlijnendatabase onder aanverwante producten. Deze tekst geeft tevens aan welke modules naar verwachting voor de praktijk het meest onderhoudsintensief zijn en vormt daarmee een leidraad voor toekomstige modulaire herziening. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVvN is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen invloed gehad op de inhoud van de richtlijn.
Patiëntenparticipatie bij deze richtlijn werd mede gefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
Doel en doelgroep
Doel
Doel is duidelijkheid te verkrijgen over de effectiviteit van de verschillende operatieve behandelingen van een symptomatische lumbale hernia nuclei pulposi of een lumbaalspinaalstenose. Daarnaast is inzicht geven over het gewenste tijdstip van operatief ingrijpen en het postoperatieve beleid gewenst. Dit alles moet bijdragen aan een meer eenduidig beleid inzake deze ziektebeelden.
Doelgroep
Deze richtlijn is geschreven voor allen die betrokken zijn bij een symptomatische lumbale hernia nuclei pulposi of een lumbale kanaalstenose, die niet spontaan verbetert met of zonder conservatieve therapie, adequate pijnstilling of wanneer neurologisch symptomatologie zich ontwikkelt die een verder conservatief beleid niet rechtvaardigt. Dit betreffen zorgverleners maar ook patiënten.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2015 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met symptomatische lumbale hernia nuclei pulposi of een lumbale kanaalstenose te maken hebben (zie hiervoor de samenstelling van de werkgroep). De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende 20 maanden aan de totstandkoming van de richtlijn. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- prof. dr. R.H.M.A. Bartels, Neurochirurg, Radboudumc Nijmegen, voorzitter, NVvN
- dr. R. Dammers, Neurochirurg, Erasmus MC Rotterdam, NVvN
- dr. C.L.A.M. Vleggeert – Lankamp, Neurochirurg, LUMC Leiden, NVvN
- dr. S.M. van Gaalen, Orthopedisch chirurg, Diakonessenhuis Utrecht, NOV
- drs. J.J. Nieuwenhuis, Orthopedisch chirurg, VieCuri Medisch Centrum Venlo, NOV
- dr. R.H. Boerman, Neuroloog, Rijnstate Arnhem, NVN
- drs. E.J. Wouda, Neuroloog, OLVG Amsterdam en Zaans Medisch Centrum Zaandam, NVN
- drs. M.A.M.B. Terheggen, Anesthesioloog, Rijnstate Arnhem, NVA
- dr. P.R. Algra, Radioloog, Noordwest Ziekenhuisgroep Alkmaar, NVvR
- L. Voogt, Patiëntvertegenwoordiger, Nederlandse Vereniging van Rugpatiënten ‘De Wervelkolom’
- J. S. van der Kraan MSc, Patiëntvertegenwoordiger, Patiëntenfederatie Nederland
- prof. dr. R.W.J.G. Ostelo, Hoogleraar evidence-based fysiotherarpie, Vrije Universiteit Amsterdam, KNGF
Klankbordgroep
- drs. J. Schnieders, Revalidatiearts, OCA, Amsterdam en Winnock, Zeist, VRA
- dr. H.R. Schiphorst Preuper, Revalidatiearts, Universitair Medisch Centrum Groningen, VRA
- drs. A.F.E. Verburg, Huisarts, wetenschappelijk medewerker NHG
Met ondersteuning van
- A.A. Lamberts MSc, Adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- dr. M.L. Molag, Adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- M.E. Wessels MSc, Medisch informatiespecialist, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar directe financiële (betrekking commercieel bedrijf, persoonlijke financiële belangen, onderzoek financiering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en oordeel over het omgaan met eventuele belangen vindt u in de bijlage van deze richtlijn. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Werkgroepleden |
||||||||
|
Achternaam |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Reputatiemanagement |
Extern gefinancierd onderzoek |
Kennis-valorisatie |
Overige belangen |
|
Voogt |
Voorzitter NVVR "de Wervelkolom" |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Bartels |
afdelingshoofd afdeling neurochirurgie. Hoogleraar Neurochirurgie |
Lid editorial board Acta neurochirurgica (onbetaald), European spine journal, int. Advisory board for neurosurgery. (onbetaald), Frontiers of Neurology (onbetaald) |
geen |
geen |
President van CSRS Europe/ Lid bestuur NVvN |
geen |
geen |
geen |
|
Wouda |
Neuroloog, Zaans Medisch Centrum |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Vleggeert-Lankamp |
Neurochirurg LUMC |
Reviewer voor Spine tijdschriften (onbetaald) |
geen |
geen |
Member of CSRS Europe Board |
National Health organisation sponsors a trial on treatment of cervical radiculopathy, and has been paying a trial on the treatment of spinal stenosis, BBraun sponsors a study after the surgical treatment of cervical discectomies. Medtronic sponsors a study after the surgical treatment of spondylolytic listhesis. Paradigm Spine sponsors a study after the surgical treatment of spinal stenosis. These are all investigator initiated trials. The payment is not made to my own account but to our research department. Lectures for physiotherapists, financed by the Dutch National Organisatie of physiotherapists, course for neurosurgical trainees on a BBraun sponsored course. The payment is not made to my own account but to our research department. |
geen |
geen |
|
Boerman |
Neuroloog, Rijnstate |
Werkgroep-voorzitter werkgroep Pijn NVN (onbetaald) |
geen |
geen |
geen |
geen |
geen |
geen |
|
Dammers |
Neurochirurg Erasmus MC Rotterdam, Neurochirurg Admiraal de Ruyterziekenhuis Goes in het kader van de Maatschap neurochirurgie Rotterdam |
geen |
geen. |
geen. |
geen. |
geen. |
geen. |
geen. |
|
Van der Kraan |
Beleidsmedewerker Patiënten-federatie Nederland |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Van Gaalen |
Orthopedisch chirurg Diakonessenhuis Utrecht-Zeist. Vice opleider |
Consultant EIT (betaald), member of the scientific advisory board Safe orthopeadics (betaald) |
geen |
geen |
geen |
De maatschap orthopedie in het Diakonessenhuis heeft een wetenschappelijke stichting (Clinical Orthopaedic Research Foundation Midden-Nederland) die ten behoeve van wetenschappelijk onderzoek gelden ontvangt van een aantal orthopedische implantaat firma's: |
geen |
geen |
|
Terheggen |
Anesthesioloog / pijnspecialist, Rijnstate |
geen |
geen |
geen |
geen |
nvt |
geen |
geen |
|
Ostelo |
Hoogleraar Evidence Based Physiotherapie, VUmc |
geen |
geen |
geen |
geen |
Subsidies voor onderzoeksprojecten verworven bij: |
geen |
geen |
|
Nieuwenhuis |
1. Orthopedisch chirurg 5. Opleider Orthopedie |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Lamberts |
Adviseur Kennisinstituut |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Klankbordgroepleden |
||||||||
|
Achternaam |
Functie |
Nevenfuncties |
Persoonlijke financiele belangen |
Persoonslijke relaties |
Reputatiemanagement |
Extern gefinancierd onderzoek |
Kennis-valorisatie |
Overige belangen |
|
Schiphorst - Preuper |
Revalidatiearts UMCG |
Voorzitter van de WPN (Werkgroep Pijnrevalidatie Nederland), bestuurslid van de PAiN (Pijnalliantie in Nederland) en redactielid NTPP (Nederlands Tijdschrift Pijn en Pijnbestrijding) |
geen |
geen |
geen |
geen |
geen |
geen |
|
Schnieders |
Revalidatiearts, OCA |
Werkzaam als revalidatie arts bij ZBC's: OCA en Winnock, lid van VRA (Ver. Voor Revalidatieartsen) en WPN (Werkgroep Pijn Nederland) |
geen |
geen |
geen |
geen |
geen |
geen |
|
Verburg |
Huisarts 0,4 fte |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door twee afgevaardigden van patiëntenorganisaties plaats te laten nemen in de werkgroep (NVVR ‘De Wervelkolom’ & Patiëntenfederatie Nederland). Tijdens de oriënterende zoekactie werd gezocht op literatuur naar patiëntenperspectief (zie Strategie voor zoeken en selecteren van literatuur). Er is één module gewijd aan Shared Decision Making bij ongeïnstrumenteerde wervelkolomchirurgie en er is op basis van deze richtlijn patiënteninformatie ontwikkeld, die te vinden is op Thuisarts (https://www.thuisarts.nl/hernia-in-rug)”. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de betrokken patiëntenorganisaties.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is als aparte module opgenomen en zal later als aanverwant product worden toegevoegd. De werkgroep heeft een voorstel gedaan voor interne kwaliteitsindicatoren.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen volgens het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is en op de ‘richtlijn voor richtlijnen’ voor de beoordeling van de kwaliteit van richtlijnen (www.zorginstituutnederland.nl).
Knelpuntanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door verschillende veldpartijen tijdens de invitational conference. Een verslag van deze bijeenkomst is opgenomen als bijlage 1.
De werkgroep stelde een long list met knelpunten op en prioriteerde de knelpunten op basis van:
- Klinische relevatie;
- De beschikbaarheid van evidence van hoge kwaliteit;
- De te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk en onbelangrijk. Tevens definieerde de werkgroep voor de kritieke en belangrijke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden. De werkgroep meent dat het in de toekomst wenselijk is om zoveel mogelijk aan te sluiten bij initiatieven zoals ICHOM & PROMS om zoveel mogelijk gebruik te maken van universele uitkomstmaten.
Strategie voor zoeken en selecteren van literatuur
Er zijn twee oriënterende literatuursearches uitgevoerd (voor Stenose en HNP) naar bestaande buitenlandse richtlijnen, systematische reviews en literatuur over patiëntenvoorkeuren (patiëntenperspectief). De resultaten hiervan zijn beschreven in module 1.1 en module 1.2. Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden in tweetallen de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of bias tabellen.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose.
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie en publicatiebias).
Formuleren van de conclusies
Bij interventievragen verwijst de conclusie niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence). Hierbij maakten de werkgroepleden de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen. Er is in deze richtlijn voor gekozen om bij elke uitkomstmaat de minimal clinically important difference te hanteren en deze te gebruiken bij het formuleren van de conclusies. De werkgroep heeft ervoor gekozen om niet de number needed to treat te berekenen.
Overwegingen
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn heeft de werkgroep een voorstel gedaan voor een set interne kwaliteitsindicatoren. De conceptindicatoren zijn op het verzoek van de NVvN en NOV opgeleverd en zullen na het publiceren van de richtlijn verder doorontwikkeld worden. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten (secretariaat@kennisinstituut.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de module Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;14;182(18):E839-42. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwalitieit.
Richtlijn voor Richtlijnen (herziene versie). Regieraad Kwaliteit van Zorg Beschikbaar via: www.zorginstituutnederland.nl. 2012.
Schünemann H, Brożek J, Guyatt G, et al. editors. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html. 2013.
Schünemann HJ, Oxman AD, Brozek J, et al. GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;17;336(7653):1106-10. PubMed PMID: 18483053.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
