Niet kleincellig longcarcinoom - Criteria voor medische (in)operabiliteit
Uitgangsvraag
Welke criteria zijn een aanleiding voor medische (in)operabiliteit?
Aanbeveling
Leeftijd
Bij patiënten van 70-80 jaar lijkt het verhoogde operatierisico geen reden om longchirurgie vanwege de leeftijd te onthouden. Het advies is deze patiënten te evalueren voor longchirurgie conform onderstaande aanbevelingen met extra aandacht voor comorbiditeit en algemene conditie. Bij rechtszijdige pneumonectomie is echter voorzichtigheid geboden.
Ook bij patiënten boven de 80 jaar zonder belangrijke comorbiditeit en in goede conditie dient een resectie als behandelingsmodaliteit te worden overwogen, indien arts en patiënt het operatierisico acceptabel achten.
Cardiovasculaire risicofactoren
Preoperatief dienen door middel van anamnese, lichamelijk onderzoek en ECG hartziekten zoals coronair lijden, hartfalen, kleplijden en ritmestoornissen te worden opgespoord.
Bij voorgenomen longchirurgie en (vermoeden van) een hartziekte dient een cardioloog, een intensive care geneeskundige of een anesthesioloog een inschatting te maken van het perioperatieve risico en te adviseren over het perioperatieve beleid.
Longfunctieonderzoek
Wanneer de geforceerde-expiratievolume in één seconde (FEV1) en de diffusiecapaciteit (TLCO) beide > 80% zijn en er geen onverwachte dyspnoe d'effort is, is het operatierisico als niet verhoogd te beschouwen.
Geadviseerd wordt, indien niet aan deze criteria wordt voldaan, door middel van de calculatiemethode (perfusiescan met links-rechtsverhouding en bij lobectomie aangevuld met de segmentenmethode) de voorspelde postoperatieve longfunctie te berekenen.
Indien wordt getwijfeld aan de operabiliteit op grond van het longfunctieonderzoek en/of de anamnese (onverwachte dyspnoe d'effort), wordt een inspanningstest met bepaling van de maximale zuurstofopname (VO2max) geadviseerd.
Overig
Preoperatief dient te worden besloten welke maximale mate van parenchymresectie functioneel verantwoord lijkt.
Bij patiënten met een verhoogd operatierisico dienen in een multidisciplinaire bespreking alternatieven zoals een beperktere resectie of chemo- en/of radiotherapie of stereotactische radiotherapie te worden afgewogen tegen chirurgie met verhoogd risico.
Overwegingen
Longfunctieonderzoek
In verschillende onderzoeken is er een verband tussen TLCO en perioperatief risico aangetoond. Naast deze bepaling is de FEV1 als standaardtest opgenomen in de aanbevelingen. In de recentere literatuur is de trend om geen absolute longfunctiewaarden als grenswaarde te gebruiken, maar het percentage van de voorspelde waarde (%pred).
Bij verminderde longfunctie (FEV1 en/of TLCO < 80% van voorspeld) dient de voorspelde postoperatieve longfunctie (FEV1 ppo en TLCO ppo) te worden berekend met de calculatiemethode (kwantitatieve perfusiescan gecombineerd met segmentenmethode). Bij twijfel, als de inspanningstolerantie veel beter of veel slechter lijkt dan op grond van longfunctieonderzoek wordt verwacht, of in andere situaties waarbij een verhoogd risico wordt vermoed, is het aan te bevelen een inspanningstest te doen met bepaling van de VO2max. De theoretische achtergrond van deze aanbeveling is dat de VO2max de meest fysiologische waarde is die de zwakste schakel in hart, longen, vaten of spieren bloot kan leggen.
Onderbouwing
Conclusies
Leeftijd
Boven de 70 jaar is het perioperatieve risico voor longchirurgie verhoogd, vooral voor pneumonectomie, met name rechtszijdig. Deze stijging is vooral toe te schrijven aan verhoogde comorbiditeit. Boven de 80 jaar lijkt het perioperatieve risico nog meer verhoogd te zijn.
Niveau 3: C Naunheim 1994, (8) Damhuis 1996, (1) Pagni 1997, (6) Sioris 1999, (7) De Perrot 1999, (2) Van Meerbeeck 2002. (36)
Longfunctieonderzoek
Er zijn aanwijzingen dat er geen verhoogd operatierisico is indien: de postbronchodilatator-FEV1 voor lobectomie > 1,5 L (voor pneumonectomie: > 2 L) is, of de FEV1 > 80%; en TLCO> 80% bij uitsluiting van interstitiële ziekten.
Niveau 3: C Boushy 1971, (12) Bernard 2000, (13) Brunelli 2009. (11)
Het perioperatieve risico is niet verhoogd als, op basis van een kwantitatieve longperfusiescan /of de segmentenmethode, de na resectie verwachte FEV1 > 40% van de referentiewaarde is, de diffusiecapaciteit TLCO > 40% is en er geen onverwachte dyspnoe d'effort is. Bij FEV1 < 40% en TLCO < 40% is er een verhoogd operatierisico.
Niveau 3: C Markos 1989, (14) Pierce 1994, (16) Kearny 1994, (24) Ferguson 1995, (22) Wang 1999. (23)
Aan een inspanningstest met bepaling van de VO2max kunnen de volgende aanwijzingen worden ontleend:
- VO2max > 20 ml/min/kg: geen verhoogd risico;
- VO2max > 15 ml/min/kg: geen verhoogd risico voor lobectomie of kleinere resecties;
- met VO2max en perfusiescan: voorspelde postoperatieve VO2max < 10 ml/min/kg: sterk verhoogd operatierisico.
Niveau 3: C Smith 1984, (31) Bechard 1987, (32) Morice 1992, (34) Walsh 1994, (33) Bolliger 1995. (15)
Samenvatting literatuur
Preoperatief wordt een inschatting gemaakt van het risico op sterfte ten gevolge van longchirurgie (perioperatieve sterfte) en van de kwaliteit van leven na longchirurgie voor NSCLC. Risico op perioperatieve morbiditeit is in het algemeen geen reden om van longchirurgie af te zien en is om deze reden niet in de vraagstelling betrokken. Voor de volgende drie factoren werd geprobeerd een uitspraak te doen:
- A. Leeftijd
- B. Cardiovasculaire risicofactoren
Hiervoor bestaat vrijwel geen specifieke literatuur met betrekking tot longchirurgie. Wel is er literatuur en een internationaal geaccepteerde richtlijn betreffende het inschatten van het cardiale risico voor niet-cardiale chirurgie (inclusief longchirurgie). De werkgroep heeft gemeend op basis van deze richtlijnen aanbevelingen te kunnen doen. - C. Longfunctieonderzoek
Er waren voldoende data voorhanden voor een risico-inschatting van de perioperatieve sterfte als functie van de leeftijd en de longfunctieparameters geforceerde-expiratievolume in één seconde (FEV1), diffusiecapaciteit (TLCO) en maximale zuurstofopname (VO2max). Voor andere longfunctieparameters en voor bloedgaswaarden in rust of bij inspanning zijn er in de literatuur geen of onvoldoende aanwijzingen voor een invloed op het operatierisico. Voor andere factoren die mogelijk het operatierisico beïnvloeden, zoals voedingstoestand, ‘performance'-status en andere comorbiditeit, werd geen literatuur gevonden specifiek voor longchirurgie. Voor deze factoren is niet gepoogd een extrapolatie te maken vanuit de algemene chirurgische literatuur. De literatuur blijkt slechts sporadisch onderzoeken te bevatten waarbij de kwaliteit van leven na longchirurgie een uitkomstmaat is, waardoor een conclusie hierover onmogelijk is.
A. Leeftijd
Patiënten boven de 70 jaar hebben een verhoogd operatierisico voor longchirurgie: bij meer dan 1.500 longoperaties in de regio van de IKNL locatie Rotterdam werd bij deze leeftijdsgroep een perioperatieve sterfte gevonden van 4%: 8% bij pneumonectomieën en 3% bij kleinere resecties (1). In andere onderzoeken wordt vaak een iets hogere sterfte gevonden (2) (3). Recente Nederlandse studies laten een 30 dagen chirurgische mortaliteit van 7,5% zien in patiënten boven de 75 jaar (4) (5). Dit verhoogde risico bij ouderen is waarschijnlijk vooral toe te schrijven aan een hogere comorbiditeit. Onder andere data van de Vlaamse kankerregistratie laten zien dat vooral bij rechtszijdige pneumonectomie het operatierisico verhoogd is: bij alle leeftijden 10,6% en boven de 70 jaar 17,8% versus respectievelijk 3,9 en 8,1% postoperatieve sterfte voor linkszijdige pneumonectomie (3). Voor patiënten boven de 80 jaar werd voor longchirurgie met name lobectomie en kleinere resecties in relatief kleine onderzoeken een perioperatieve sterfte beschreven van 4-15% (6) (7) (8).
B. Cardiovasculaire risicofactoren
Er is geen Nederlandse richtlijn voor preoperatieve cardiovasculaire evaluatie. Er zijn weinig specifieke data voor het inschatten van het cardiovasculaire risico bij longchirurgie. De geschatte postoperatieve ejectiefractie likt de beste maat voor inschatting van de cardiale restfunctie. Recente Amerikaanse (ACCP) en Engelse (BTS) richtlijnen voor longcarcinoom verwijzen naar de richtlijn van de American Heart Association en de American College of Cardiology met betrekking tot de preoperatieve cardiovasculaire evaluatie voor niet-cardiale chirurgie (9) (10). Recentere aanvullende informatie staat beschreven in een Europese richtlijn van de ERS/ESTS (11). Mede op grond van deze laatste richtlijn heeft de commissie de volgende aanbevelingen geformuleerd.
C. Longfunctieonderzoek
Figuur 1: Stroomdiagram voor het bepalen van peroperatief risico voor longchirurgie, door middel van longfunctieonderzoek.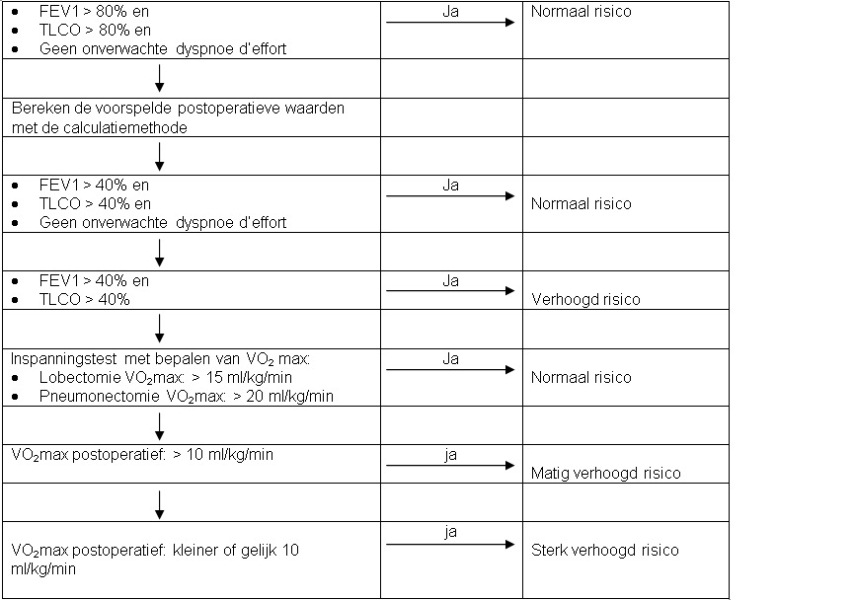
FEV = geforceerde expiratievolume in één seconde
TLCO = difussiecapaciteit
VO2max = maximale zuurstofopname
De calculatiemethode houdt in dat de relatieve functionele bijdragen van de rechter en linker long worden berekend met de perfusiescan, bij lobectomie wordt de functionele bijdrage van de resterende kwab(ben) van de aangedane long berekend door het aantal resterende segmenten te delen door het totaal aantal segmenten.
Gebruik van het stroomschema wordt aanbevolen ter evaluatie van het perioperatieve risico.
Uit oudere onderzoeken is gebleken dat er geen verhoogd operatierisico is als de FEV1 voor een pneumonectomie groter is dan 2 l (voor een lobectomie: > 1,5 l) (12). In recentere onderzoeken wordt daarentegen vaak een FEV1 boven 80% van de voorspelde waarde en een normale TLCO veilig bevonden (13).
Bij patiënten met een gestoorde longfunctie is in verschillende onderzoeken gebleken dat met een kwantitatieve longperfusiescan, de FEV1 en de TLCO een schatting kan worden gemaakt van de restfunctie na een longresectie (FEV1 ‘predicted postoperatief' (ppo) en de TLCO ppo) (14) (15) (16). Ook kan deze ppo-waarde worden uitgerekend door middel van de segmentenmethode (16) (17), kwantitatieve ventilatiescan (18) (19), of kwantitatieve CT (20). Meestal wordt echter voor de berekening van de FEV1 ppo en TLCO ppo de calculatiemethode gebruikt: de relatieve functionele bijdrage van de rechter- en linkerlong wordt berekend met de perfusiescan, en bij (bi)lobectomie wordt de functionele bijdrage van de te resterende kwab(ben) van de aangedane long berekend met de segmentenmethode (het aantal resterende segmenten gedeeld door het totale aantal segmenten). Hierbij is uit de meeste onderzoeken gebleken dat als de FEV1 ppo > 40% is en de TLCO ppo > 40%, er geen verhoogd risico is voor resectie (14) (16) (21) (22) (23) (24).
Indien de FEV1 ppo < 30% is of indien zowel de FEV1 ppo als de TLCO ppo < 40% is, is het operatierisico in de meeste onderzoeken verhoogd (14) (16) (21) (22) (25) (26) (27). Dat deze waarden niet synoniem zijn met inoperabiliteit, blijkt uit een aantal ondezoeken waarin patiënten met lagere FEV1-waarden zonder verhoogde sterfte zijn geopereerd. In een serie uit de Mayo Clinic kon geen verhoogd risico worden aangetoond bij patiënten met een slechte longfunctie en een mediane FEV1 ppo van 34% (28). Wel hadden patiënten met een FEV1 onder deze mediane waarde vaker thuis zuurstof nodig. In twee andere onderzoeken met patiënten met een gemiddelde FEV1 ppo van 31% respectievelijk 24% van de voorspelde waarde, werden goede resultaten beschreven (geen verhoogde perioperatieve sterfte) van lobectomie van een slecht geperfundeerde kwab en van longvolumereductiechirurgie gecombineerd met resectie van verdachte nodules (29) (30).
Bij patiënten met een FEV1 ppo < 40%, een TLCO ppo < 40% of onverwachte dyspnoe d'effort kan met behulp van een inspanningstest worden gepoogd het perioperatieve risico in te schatten. Hoewel een aantal onderzoeken laat zien dat het aantal trappen dat een patiënt kan oplopen, samenhangt met het perioperatieve risico, wordt in de meeste onderzoeken gebruikgemaakt van een fietstest waarbij de VO2max wordt gemeten. Bij een VO2max > 20 ml/min/kg is er geen verhoogd risico voor een longoperatie (pneumonectomie of kleinere resecties) (31) (32). Voor een lobectomie geeft een VO2max > 15 ml/min/kg geen verhoging van het risico (33) (34). Bij een VO2max < 10 ml/min/kg wordt in enkele onderzoeken met kleine patiëntenaantallen een hoge perioperatieve sterfte gevonden van 30-100%. Bij een dergelijk lage VO2max werd ook bij abdominale chirurgie een hoge sterfte gevonden (35). In dat onderzoek overleden perioperatief behalve patiënten met een slechte longfunctie ook twee patiënten met een goede FEV1 (2,5-3 l) en een dergelijk slechte VO2max. Bolliger et al. hebben een VO2max ppo berekend aan de hand van VO2max en longperfusiescan (14). In dat onderzoek was er geen perioperatieve sterfte bij een VO2max ppo > 10 ml/min/kg en een hoge sterfte bij een VO2max ppo < 10 ml/min/kg. Niet in alle onderzoeken werd een verband tussen VO2max en perioperatieve sterfte/morbiditeit gevonden (14).
Hoewel in de meeste onderzoeken de VO2max in ml/min/kg wordt uitgedrukt, wordt er ook wel voor gepleit de voorspelde waarde van de VO2max in de berekening te betrekken, omdat in de eerstgenoemde geen rekening zou worden gehouden met onder- of overgewicht, geslacht en leeftijd. Hierbij is gesuggereerd een VO2max ppo van 35% van de voorspelde waarde als grenswaarde aan te houden. De literatuur is echter nog te schaars om conclusies te kunnen trekken.
Overig
De behandelaar en medebehandelaars zullen op grond van bovenstaande gegevens, conclusies en aanbevelingen samen met de overige klinische gegevens en de aard van de voorgenomen operatie het perioperatieve risico moeten inschatten.
Om te anticiperen op onverwachte peroperatieve bevindingen die een uitgebreidere resectie dan verwacht nodig maken, is het verstandig preoperatief te besluiten welke mate van parenchymresectie verantwoord lijkt; is ook een bilobectomie of pneumonectomie functioneel mogelijk? Aan de hoge mortaliteit van een rechts pneumonectomie na voorbehandeling dient nadrukkelijk aandacht te worden besteed bij de overwegingen.
Indien het risico verhoogd is, moet het team van behandelaars beslissen of dit risico acceptabel wordt geacht, of dat de voorkeur moet worden gegeven aan alternatieven zoals een beperktere resectie of chemo- en/of radiotherapie. Na uitleg over aard en risico van de operatie aan de patiënt, wordt deze gevraagd of hij of zij akkoord gaat met de voorgestelde behandeling.
Referenties
- 1 - Damhuis RA, Schutte PR. Resection rates and postoperative mortality in 7899 patiënts with lung cancer. Eur Respir J 9:97-100, 1996.
- 2 - de Perrot M, Licker M, Reymond MA, Robert J, Spiliopoulos A. Influence of age on operative mortality and longterm survival after lung resection for bronchogenic carcinoma. Eur Respir J 14:419-422, 1999.
- 3 - Meerbeeck JP van, Damhuis RA, Vos de Wael ML. High postoperative risk after pneumonectomy in elderly patiënts with right-sided lung cancer. Eur Respir J 19:141-5, 2002.
- 4 - Palma D, Visser O, Lagerwaard FJ, Belderbos J, Slotman BJ, Senan S. Impact of introducing stereotactic lung radiotherapy for elderly patiënts with stage I non–small-cell lung cancer: A population-based time-trend analysis. J Clin Oncol 28:5153-5159; 2010.
- 5 - Wouters MW, Siesling S, Jansen-Landheer ML, Elferink MA, Belderbos J, Coebergh JW, Schramel FM. Variation in treatment and outcome in patients with non-small cell lung cancer by region, hospital type and volume in the Netherlands. Eur. J. Surg. Oncol Suppl1: s83-92, 2010.
- 6 - Pagni S, Frederico JA, Ponn RB. Pulmonary resection for lung cancer in octogenarians. Ann Thorac Surg 63:785-789, 1997.
- 7 - Sioris T, Salo J, Perhoniemi V, Mattila S. Surgery for lung cancer in the elderly. Scand Cardiovasc J 33:222-227, 1999
- 8 - Naunheim KS, Kesler KA, D’Orazio SA, Fiore AC, Judd DR. Lung cancer surgery in the octogenarian. Eur J Cardiothorac Surg 8:453-456, 1994.
- 9 - British Thoracic Society. Society of Cardiothoracic Surgeons of Great Britain and Ireland Working Party. BTS guidelines: guidelines on the selection of patiënts with lung cancer for surgery. Thorax 56:89-108, 2001.
- 10 - Eagle KA, Berger PB, Calkins H, Chaitman BR, Ewy GA, Fleischmann KE, et al. American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee to Update the 1996 Guidelines on Perioperative Cardiovascular Evaluation for Noncardiac Surgery). ACC/AHA guideline update for perioperative cardiovascular evaluation for noncardiac surgery – executive summary. Circulation 105:1257-1267, 2002.
- 11 - Brunelli A., Charloux A, Bollinger CT, Rocco CT, Sculier JP, Varela G, et al. European Respiratory Society and European Society of Thoracic Surgeons joint task force on fitness for radical therapy. Eur Respir J 34:17-41; 2009.
- 12 - Boushy SF, Billig DM, North LB, Helgason AH. Clinical course related to preoperative and postoperative pulmonary function in patiënts with bronchogenic carcinoma. Chest 59:383-391, 1971.
- 13 - Bernard A, Ferrand L, Hagry O, Benoit L, Cheynel N, Favre JP. Identification of prognostic factors determining risk groups for lung resection. Ann Thorac Surg ;70:1161-1167, 2000.
- 14 - Markos J, Mullan BP, Hillman DR, Musk AW, Antico VF, Lovegrove FT, et al. Preoperative assessment as a predictor of mortality and morbidity after lung resection. Am Rev Respir Dis 139:902-910, 1989
- 15 - Bolliger CT. Exercise capacity as a predictor of postoperative complications in lung resection candidates. Am J Respir Crit Care Med 151:1472-1480, 1995.
- 16 - Pierce RJ, Copland JM, Sharpe K, Barter CE. Preoperative risk evaluation for lung cancer resection: Predicted postoperative product as a predictor of surgical mortality. Am J Respir Crit Care Med 150:947-955, 1994.
- 17 - Zeiher BG, Gross TJ, Kern JA, Lanza LA, Peterson MW. Predicting postoperative pulmonary function in patiënts undergoing lung resection. Chest 108:68-72, 1995.
- 18 - Bria WF, Kanarek DJ, Kazemi H. Prediction of postoperative pulmonary function following thoracic operations. Value of ventilation-perfusion scanning. Thorac Cardiovasc Surg 86:186-192, 1983.
- 19 - Corris PA, Ellis DA, Hawkins T, Gibson GJ. Use of radionuclide scanning in the preoperative evaluation of pulmonary function after pneumonectomy. Thorax 42:285-291, 1987.
- 20 - Wu MT, Pan HB, Chiang AA, Hsu HK, Chang HC, Peng NJ, et al. Prediction of postoperative lung function in patiënts with lung cancer: comparison of quantitative CT with perfusion scintigraphy. Am J Roentgenol 178:667-672, 2002.
- 21 - Ferguson MK, Little L, Rizzo L, Popovich KJ, Glonek GF, Leff A, et al. Diffusing capacity predicts morbidity and mortality after pulmonary resection. J Thorac Cardiovasc Surg 96:894-900, 1988.
- 22 - Ferguson MK. Optimizing selection of patiënts for major lung resection. J Thorac Cardiovasc Surg 109:275-281; discussion 281-3, 1995.
- 23 - Wang J. Diffusing capacity predicts operative mortality but not long-term survival after resection for lung cancer. J Thorac Cardiovasc Surg 117:581-586; discussion 586-7, 1999
- 24 - Kearney DJ. Assessment of operative risk in patiënts undergoing lung resection. Importance of predicted pulmonary function. Physiologic evaluation of pulmonary function in the candidate for lung resection. Chest 105:753-759, 1994.
- 25 - Wang J. Diffusing capacity predicts operative mortality but not long-term survival after resection for lung cancer. J Thorac Cardiovasc Surg 117:581-6; discussion 586-587, 1999.
- 26 - Nakahara K, Ohno K, Hashimoto J, Miyoshi S, Maeda H, Matsumura A, et al. Prediction of postoperative respiratory failure in patiënts undergoing lung resection for lung cancer. Ann Thorac Surg 46:549-552, 1988.
- 27 - Varela G, Cordovilla R, Jimenez MF, Novoa N. Utility of standardized exercise oximetry to predict cardiopulmonary morbidity after lung resection. Eur J Cardio Thorac Surg 2001;19:351-4 .
- 28 - Cerfolio RJ, Allen MS, Trastek VF, Deschamps C, Scanlon PD, Pairolero PC. Lung resection in patiënts with compromised pulmonary function. Ann Thorac Surg 62:348-351, 1996
- 29 - DeRose-JJ Jr, Argenziano M, El Amir N, Jellen PA, Gorenstein LA, Steinglass KM, et al. Lung reduction operation and resection of pulmonary nodules in patiënts with severe emphysema. Ann Thorac Surg 65:314-318, 1998
- 30 - Edwards JG, Duthie DJ, Waller DA. Lobar volume reduction surgery: a method of increasing the lung cancer resection rate in patiënts with emphysema. Thorax 56:791-795, 2001
- 31 - Smith TP. Exercise capacity as a predictor of post-thoracotomy morbidity. Am Rev Respir Dis 129:730-734, 1984
- 32 - Bechard D. Assessment of exercise oxygen consumption as preoperative criterion for lung resection. Ann Thorac Surg 44(4):344-349, oct.1987
- 33 - Walsh GL. Resection of lung cancer is justified in high-risk patiënts selected by exercise oxygen consumption. Ann Thorac Surg 58:704-710; discussion 711, 1994.
- 34 - Morice RC. Exercise testing in the evaluation of patiënts at high risk for complications from lung resection. Chest 101:356-361, 1992.
- 35 - Older P. Preoperative evaluation of cardiac failure and ischemia in elderly patiënts by cardiopulmonary exercise testing. Chest 104:701-704, 1993
- 36 - Van Meerbeeck JP, Kramer GW, Van Schil PE, Legrand C, Smit EF, Schramel F, et al. Randomized controlled trial of resection versus radiotherapy after induction chemotherapy in stage IIIA-N2 non-small-cell lung cancer. J Natl Cancer Inst 99:442-450; 2007.
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 22-05-2011
Laatst geautoriseerd : 22-05-2011
Geplande herbeoordeling :
Voorwaarden voor revisie en beoordelingsfrequentie zijn vastgelegd in de richtlijn. De geldigheidstermijn voor de richtlijn (maximaal 5 jaar na vaststelling) wordt vanuit het programmabureau IKNL bewaakt. Om verscheidene redenen kan actualisatie eerder dan beoogd nodig zijn. Zo nodig zal de richtlijn tussentijds op onderdelen worden bijgesteld.
Algemene gegevens
Betrokken verenigingen
- Nederlandse Vereniging voor Medische Oncologie (NVMO)
- Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose (NVALT)
- Nederlandse Vereniging voor Thoraxchirugie (NVT)
- Nederlandse Vereniging Voor Heelkunde (NVVH), subvereniging Nederlandse Vereniging Voor Longchirurgie (NVVL)
- Nederlandse Vereniging voor Radiologie (NVVR)
- Nederlandse Vereniging voor Nucleaire Geneeskunde (NVNG)
- Nederlandse Vereniging voor Pathologie (NVVP)
- Nederlandse Vereniging voor Radiotherapie en Oncologie (NVRO)
- Nederlandse Federatie van Kankerpatiëntenverenigingen (NFK)
- Verpleegkundigen en Verzorgenden Nederland (V&VN)
- Stichting Longkanker Info (longkankerinfo)
Organisatie
Integraal Kankercentrum Nederland (IKNL)
IKNL bevordert dat mensen met kanker en hun naasten zo dicht mogelijk bij huis toegang hebben tot een samenhangend en kwalitatief verantwoord zorgaanbod. IKNL is erop gericht behandeling, zorg en klinisch onderzoek binnen de oncologie te verbeteren. Daarnaast hebben zij een taak in het opzetten en ondersteunen van netwerken voor palliatieve zorg.
IKNL werkt aan multidisciplinaire richtlijnontwikkeling voor de oncologische en palliatieve zorg. Naast deze ontwikkeling van richtlijnen faciliteert IKNL ook het onderhoud, het beheer, de implementatie en de evaluatie van deze richtlijnen
Houderschap
De houder van de richtlijn moet kunnen aantonen dat de richtlijn zorgvuldig en met de vereiste deskundigheid tot stand is gekomen. Onder houder wordt verstaan de wetenschappelijke verenigingen van beroepsbeoefenaren die de richtlijn autoriseren. IKNL draagt zorg voor het beheer en de ontsluiting van de richtlijn.
Juridische betekenis
De houder van de richtlijn moet kunnen aantonen dat de richtlijn zorgvuldig en met de vereiste deskundigheid tot stand is gekomen. Onder houder wordt verstaan de wetenschappelijke verenigingen van beroepsbeoefenaren die de richtlijn autoriseren. IKNL draagt zorg voor het beheer en de ontsluiting van de richtlijn.
Doel en doelgroep
Doelstelling
Deze richtlijn is een document met aanbevelingen ter ondersteuning van de dagelijkse praktijkvoering. De richtlijn berust op de resultaten van wetenschappelijk onderzoek en aansluitende meningsvorming gericht op het vaststellen van goed medisch handelen. Er wordt aangegeven wat in het algemeen de beste zorg is voor patiënten met NSCLC.
De richtlijn geeft aanbevelingen over de diagnostiek, de behandeling, de follow-up en vormen van ondersteuning van patiënten met NSCLC. De richtlijn kan worden gebruikt bij het geven van voorlichting aan patiënten. Ook biedt de richtlijn aanknopingspunten voor bijvoorbeeld transmurale afspraken of lokale protocollen ter bevordering van de implementatie van deze richtlijn.
Specifieke doelen van deze richtlijn voor NSCLC zijn:
- introductie van de nieuwe TNM-classificatie 7e editie van de International Association for the Study of Lung Cancer (IASLC);
- plaatsbepaling van de endo-echodiagnostiek, zoals transbronchiale echografie (EBUS) met naald aspiratie (TBNA), transoesofageale echografie (EUS) met fijne naald aspiratie (FNA) en fluorodesoxyglucose-positronemissietomografie (FDG-PET) bij het stadiëren;
- plaatsbepaling van epidermal growth factor receptor (EGFR)-mutatie-analyse;
- plaatsbepaling van concomitante chemoradiotherapie;
- plaatsbepaling van stereotactische radiotherapie;
- plaatsbepaling van adjuvante chemotherapie;
- plaatsbepaling van systemische therapie bij stadium IV-ziekte
Doelgroep
Deze richtlijn is bestemd voor alle professionals die betrokken zijn bij de diagnostiek, behandeling en begeleiding van patiënten met NSCLC, zoals longartsen, (thorax)chirurgen, radiotherapeuten, medisch oncologen, huisartsen, nurse practitioners, oncologieverpleegkundigen, IKNL-consulenten, pathologen, psychologen, radiologen, nucleair-geneeskundigen, epidemiologen en patiënten(-organisaties).
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die met de diagnostiek en behandeling van NSCLC te maken hebben. Bij het samenstellen van de werkgroep is rekening gehouden met de geografische spreiding van de werkgroepleden, met een evenredige vertegenwoordiging van de diverse betrokken verenigingen en instanties, alsmede met een spreiding al dan niet in academische achtergrond. De werkgroepleden hebben onafhankelijk gehandeld en zijn gemandateerd door hun vereniging voor hun inbreng.
Leden van de werkgroep:
Hr. dr. J.T. Annema, longarts, Leids Universitair Medisch Centrum
Mw. dr. J.S.A. Belderbos, radiotherapeut, NKI - Antoni van Leeuwenhoek Ziekenhuis
Mw. T.T.M. Bluemink-Holkenborg, secretariële ondersteuning IKNL
Mw. dr. A.M.C. Dingemans, longarts, Maastricht Universitair Medisch Centrum
Hr. dr. J.P. Eerenberg, chirurg, Tergooiziekenhuizen
Mw. drs. M.M. van Gameren, radiotherapeut, Universitair Medisch Centrum Groningen
Hr. prof. dr. H.J.M. Groen, longarts, voorzitter werkgroep UMG Groningen
Mw. dr. I.J.C. Hartmann, radioloog, Erasmus MC
Hr. dr. P.A. Helle, radiotherapeut, Medisch Spectrum Twente
Hr. prof. dr. O.S. Hoekstra, nucleair geneeskundige, VU medisch centrum
Mw. dr. C.C.M. Holtkamp, procesbegeleider namens, IKNL
Mw. D. van den Hurk, verpleegkundig specialist oncologie, UC voor Chronische Ziekten
Hr. prof.dr. P.L. Jager, nucleair geneeskundige, Isala klinieken
Hr. drs. T.J. Klinkenberg , cardiothoracaal chirurg, UMC Groningen
Mw. prof. dr. C.C.E. Koning, radiotherapeut, Academisch Medisch Centrum
Hr. dr. E. Lammers, longarts, voorzitter van het Longkanker Informatiecentrum Gelre ziekenhuizen
Hr. drs. A.P.W.M. Maat, cardiothoracaal chirurg, Erasmus MC
Hr. dr. M.A. Paul. chirurg, VU medisch centrum
Mw. J.P. Salomé, verpleegkundig specialist oncologie, Sint Franciscus Gasthuis
Mw. dr. C. Schaefer-Prokop, radioloog, Academisch Medisch Centrum
Mw. dr. J. Sietsma, patholoog, Universitair Medisch Centrum Groningen
Hr. prof. dr. E.F. Smit, longarts, VU medisch centrum
Hr. dr. W.H. Steup, chirurg, Haga Ziekenhuis
Hr. dr. F.B.J.M. Thunnissen, patholoog, VU medisch centrum
Mw. dr. J.N.H. Timmer-Bonte, internist, UMC St. Radboud
Mw. dr. A.L.J. Uitterhoeve, radiotherapeut, Academisch Medisch Centrum
Hr. drs. A.F.T.M. Verhagen, cardiothoracaal chirurg, UMC St. Radboud
Mw. drs. N.M. Verheijen; longarts i.o., Catharina Ziekenhuis
Hieronder staat een aanvullende lijst van werkgroepleden genoemd die (alleen) betrokken waren bij de ontwikkeling van de eerste versie van deze richtlijn in 2004:
Hr. prof. dr. J.P. van Meerbeeck, longarts, voorzitter
Mw. dr. V.C.G. Tjan-Heijnen, medisch oncoloog, vice-voorzitter
Mw. drs. J. Wittenberg, epidemioloog, adviseur (tot oktober 2003)
Mw. dr. C.J.E. Kaandorp, arts, adviseur (vanaf oktober 2003)
Hr. dr. J.S. Burgers, huisarts, senior-adviseur (vanaf oktober 2003)
Hr. drs. A.G. Boekema, sociaal geneeskundige, procesbegeleider
Hr. drs. V.K.Y. Ho, methodoloog, beleidsmedewerker landelijke richtlijnen
Hr. dr. P. Baas, longarts
Hr. dr. M. den Bakker, klinisch patholoog
Mw. dr. P.F.A. Bakker, cardiothoracaal chirurg
Hr. dr. B. Biesma, longarts
Hr. dr. E.C.M. Bollen, chirurg
Hr. dr. J. Bussink, radiotherapeut
Hr. drs. H.E. Codrington, longarts
Mw. drs. C.E. van Die, thorax-radioloog
Hr. dr. J.M.W. van Haarst, longarts
Hr. drs. A.G. Hensens, cardiopulmonaal chirurg
Hr. dr. F.M.J. Heijstraten, radioloog
Mw. dr. M.L.G. Janssen-Heijnen, epidemioloog
Mw. dr. M.J.A. de Jonge, internist-oncoloog
Hr. dr. G.W.P.M. Kramer, radiotherapeut
Hr. dr. H.B. Kwa, longarts
Hr. dr. W.B. Lastdrager, chirurg
Hr. dr. H.J. Mulder, chirurg
Hr. prof. dr. E.M. Noordijk, radiotherapeut
Hr. dr. B.P. Ponsioen, huisarts
Hr. dr. J.W.G. van Putten, longarts
Mw. drs. A.M.C. Raat, huisarts
Hr. drs. P.T.R. Rodrigus, radiotherapeut
Hr. dr. W.J.G. Ros, sociaal psycholoog
Hr. drs. N.J.J. Schlösser, longarts
Hr. dr. J.H. Schouwink, longarts
Mw. N.A.W.P. Schrama, verpleegkundig specialist oncologie
Hr. dr. F.M.H.H. Schramel, longarts
Hr. drs. A.H.M. van Straten, cardiothoracaal chirurg
Hr. dr. J.R.M. van der Sijp, chirurg
Hr. drs. E.F. Ullmann, longarts
Hr. dr. G.P.M. ten Velde, longarts
Hr. drs. B.A. Verheij, huisarts
Hr. dr. M.I.M. Versteegh, cardiothoracaal chirurg
Mw. drs. M.S. Vos, psychiater
Hr. drs. S.L. Wanders, radiotherapeut
Hr. dr. L.N.A. Willems, longarts
Belangenverklaringen
Aan alle werkgroepleden is gevraagd een belangenverklaring in te vullen, waarin ze hun banden met de farmaceutische en andere industrie aangeven bij de start en opnieuw bij het eind van het richtlijntraject.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de ontwikkeling van het concept van de richtlijn is zoveel mogelijk rekening gehouden met de implementatie van de richtlijn en de daadwerkelijke uitvoerbaarheid van de aanbevelingen. De richtlijn wordt verspreid onder de professionals via de (wetenschappelijke) verenigingen en de locaties van IKNL. Ook wordt een samenvatting van de richtlijn ter publicatie aangeboden aan het Nederlands Tijdschrift voor Geneeskunde. Daarnaast wordt de richtlijn beschikbaar gesteld op www.richtlijnendatabase.nl (gepubliceerd door IKNL). De vraag of de richtlijn wordt opgevolgd zal beantwoord worden door metingen in het veld te doen naar de implementatie van de richtlijn. Op basis van indicatoren zal getoetst worden in hoeverre dit gebeurt. De uitwerking hiervan ligt bij IKNL.
Werkwijze
Aanleiding
In 2004 is de eerste ‘evidence based' richtlijn gepubliceerd voor de diagnostiek en behandeling van patiënten met NSCLC. De Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose (NVALT), Integraal Kankercentrum Nederland (IKNL) en het Kwaliteitsinstituut voor de Gezondheidszorg CBO hebben toen het initiatief genomen om een multidisciplinaire richtlijn te ontwikkelen over zowel de stadiëring als de behandelmogelijkheden van het NSCLC. De herziening van de richtlijn is nodig omdat de afgelopen zes jaar de inzichten in diagnostiek en behandeling op verschillende onderdelen veranderd zijn. Door middel van een enquête onder betrokken medisch specialisten en zorgverleners van patiënten met NSCLC is een inventarisatie gemaakt van de belangrijkste diagnostische en therapeutische knelpunten in de dagelijkse praktijk.
Werkwijze werkgroep
In 2007 is het eerste initiatief genomen om een inventarisatie te maken van veranderingen in diagnostiek, behandeling en overige zorg rondom de patiënt met NSCLC. Gezien de omvang van het werk is in samenspraak met IKNL in 2008 een werkgroep samengesteld (zie samenstelling werkgroep) uit verschillende disciplines die betrokken zijn bij de zorg van de patiënt met NSCLC. De gemandateerde werkgroepleden werden verdeeld in subgroepen voor het beantwoorden van de uitgangsvragen waarbij gezorgd is dat de relevante disciplines vertegenwoordigd waren. Daarnaast zorgde een redactieteam, bestaande uit de voorzitter, de procesbegeleider en de secretaresse van IKNL voor de coördinatie en onderlinge afstemming van de subgroepen. De subgroepen hebben gedurende een periode van meer dan twee jaar gewerkt aan een conceptrichtlijntekst die betrekking heeft op een bepaald deel van het traject. De werkwijze van de werkgroep bestond uit een knelpuntenanalyse (zie bijlage) waarvoor een enquête werd gehouden onder specialisten die zich met de zorg van patiënten met NSCLC bezighouden en de werkgroep formuleerde vervolgens uitgangsvragen (zie bijlage). Met behulp van de zogenaamde PICO-methode zijn er door het CBO onafhankelijke literatuursearches gedaan (zie bijlage). Deze nieuwe literatuur (vanaf 2002) werd inhoudelijk, methodologisch en statistisch beoordeeld om tot een zo goed mogelijke afweging te komen voor de beantwoording van de uitgangsvragen. De werkgroepleden schreven afzonderlijk of in de subgroepen teksten die tijdens vergaderingen besproken en na verwerking van de commentaren werden geaccordeerd. De voltallige werkgroep is vier keer bijeen geweest om de resultaten van de subgroepen in onderling verband te bespreken. De teksten van de subgroepen zijn door het redactieteam samengevoegd en op elkaar afgestemd tot één document, gepubliceerd op Oncoline. Eind 2010 heeft een landelijke commentaarronde plaatsgevonden waarbij alle leden van alle relevante wetenschappelijke verenigingen en patiëntenvereniging werden uitgenodigd, persoonlijk of via een aankondiging in een vaktijdschrift. De commentaren van deze enquête zijn verwerkt in de definitieve richtlijn.
De leidraad voor de ontwikkeling van de richtlijnen voor oncologische en palliatieve zorg is het AGREE instrument. Dit instrument is gemaakt voor de beoordeling van bestaande, nieuwe en herziene richtlijnen. Het AGREE Instrument beoordeelt zowel de kwaliteit van de verslaglegging als de kwaliteit van bepaalde aspecten van de aanbevelingen. Het beoordeelt de kans dat een richtlijn zijn gewenste doel zal behalen, maar niet de daadwerkelijke impact op patiëntuitkomsten.
Het AGREE Instrument is opgebouwd uit 23 items verdeeld over zes domeinen. Elk domein beslaat een aparte dimensie van kwaliteit van richtlijnen, namelijk:
- Onderwerp en doel betreft het doel van de richtlijn de specifieke klinische vragen waarop de richtlijn een antwoord geeft en de patiëntenpopulatie waarop de richtlijn van toepassing is;
- Betrokkenheid van belanghebbenden richt zich op de mate waarin de richtlijn de opvattingen van de beoogde gebruikers weerspiegelt;
- Methodologie hangt samen met het proces waarin bewijsmateriaal is verzameld en samengesteld en met de gebruikte methoden om aanbevelingen op te stellen en te herzien;
- Helderheid en presentatie gaat over het taalgebruik en de vorm van de richtlijn;
- Toepassing houdt verband met de mogelijke organisatorische, gedragsmatige en financiële consequenties van het toepassen van de richtlijn;
- Onafhankelijkheid van de opstellers betreft de onafhankelijkheid van de aanbevelingen en erkenning van mogelijke conflicterende belangen van leden van de werkgroep.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
