Palliatieve zorg bij eindstadium nierfalen - Advance care planning
Uitgangsvraag
Leidt advance care planning bij patiënten met eindstadium nierfalen tot een betere kwaliteit van leven en/of hogere tevredenheid van de patiënt en de familieleden?
|
P |
Patiënten met eindstadium nierfalen |
|
I |
Advance care planning |
|
C |
Geen advance care planning/standaard zorg |
|
O |
Kwaliteit van leven van de patiënt, tevredenheid van de patiënt en patiëntvertegenwoordiger met het besluitproces |
Methodiek: Evidence based (GRADE)
Aanbeveling
Bij patiënten met eindstadium nierfalen:
- Maak ACP een onderdeel van de standaard (palliatieve) zorg.
- Start gestructureerde patiënt-georiënteerde ACP bij voorkeur in een vroeg stadium bij patiënten:
- >75 jaar, en/of
- met een negatief antwoord op de vraag of de behandelaar verbaasd zou zijn als de patiënt binnen een jaar overleden zou zijn (de zogenaamde surprise question, zie hoofdstuk 1), en/of
- met een CCI ≥6 of CCI ≥5 met ziekenhuisopname in afgelopen 6 maanden, en/of
- met de wens om niet te starten of te stoppen met dialyse, en/of
- met de wens van de patiënt om ACP te bespreken.
- Neem als behandelend arts het initiatief voor het bespreekbaar maken van ACP.
- Hanteer een gestructureerde ACP-methode, zoals bijv. de SPIRIT-methode. Volg hierbij de volgende stappen:
- Check het begrip van de patiënt over zijn huidige medische situatie, de prognose en de mogelijke toekomstige medische gebeurtenissen;
- Onderzoek het begrip van toekomstige medische beslissingen;
- Neem de onderbouwing van toekomstige medische beslissingen door;
- Bied hulp aan de patiënt om mogelijke toekomstige complicaties en behandelingen te kunnen begrijpen, met gebruik van de wilsbeschikking;
- Vat de conclusies samen, met aangeven van de noodzaak van een nieuw gesprek als de situatie of de wens van de patiënt verandert.
- Bespreek voor de patiënt relevante zaken zoals redenen om dialyse niet te starten of te staken, reanimatiebeleid, wilsbeschikking, gewenste plaats van overlijden en beslissingen rond het levenseinde, zoals palliatieve sedatie of euthanasie.
- Bepaal in overleg met de patiënt welke naasten betrokken worden bij de ACP. Bepaal in overleg met de patiënt wie als vertegenwoordiger wordt aangewezen voor situaties waarin de patiënt zelf niet meer in staat is om beslissingen te nemen.
- Betrek de huisarts of specialist ouderengeneeskunde (bij patiënten die - al dan niet tijdelijk - in het verpleeghuis verblijven) bij ACP.
- Leg een samenvatting van de ACP vast in het dossier van de patiënt.
- Evalueer minimaal 1 x per jaar de gemaakte afspraken van ACP.
- Schakel in geval van een taalbarrière een professionele tolk in.
Overwegingen
Naast de hierboven beschreven positieve effecten van gestructureerde ACP (gebaseerd op studies van lage kwaliteit) werd er ook een significant toegenomen overeenstemming (congruentie) van behandeldoelen tussen patiënt en zijn vertegenwoordiger gevonden en een significant toegenomen vertrouwen in de besluitvorming van de patiëntvertegenwoordiger in de eerste twee maanden na de ACP-gesprekken [Song 2015 (12)]. Na 6 en 12 maanden waren deze effecten verdwenen. Dit suggereert dat herhaling van gesprekken noodzakelijk is om het gunstige effect van ACP te handhaven.
Tevens rapporteerde de trial van Song 2015 (12) ook over symptomen van angst, depressie en post-traumatische stress bij de nabestaanden op baseline en 2 weken, en 3 en 6 maanden na het overlijden van de patiënt, waarbij gebruik werd gemaakt van de Hospital Anxiety and Depression Scale (HADS, range 0-21) en de Post Traumatic Stress Scale 10 (PTSS-10, range 10-70). Hogere scores geven meer intense symptomen aan. Na 2 weken namen in beide groepen de scores toe. Na 3 en 6 maanden waren de depressiescores in de patient-centered advance care groep significant lager dan in de controle groep (respectievelijk 3.3 en 3.4 versus 5.9 en 5.9, p< 0.01). In multivariate analyse was er een significant effect van de interventie op angst en depressie na 3 en 6 maanden en op PTSS na 3 maanden.
Bij andere patiëntengroepen met beperkte levensverwachting zijn er aanwijzingen dat gestructureerde ACP bijdraagt aan een betere kwaliteit van zorg en tevredenheid van patiënten en hun naasten. In een RCT bij 309 opgenomen oudere patiënten (>80 jaar) met zowel internistische, cardiale als pulmonale problemen vond men dat 6 maanden na randomisatie tussen ACP en standaardzorg, ACP in 86% van de patiënten leidt tot bewustzijn en naleving van wensen rondom de laatste levensfase, terwijl dit in de controlegroep bij slechts 30% het geval was (p<0.001). De tevredenheid over de geleverde zorg was in de ACP-groep zowel bij de patiënten en hun familie significant groter dan in de controlegroep. Na overlijden hadden de familieleden van de overleden patiënten in de ACP-groep minder last van depressie, angst en posttraumatische stress dan de controlegroep [Detering 2010].
Hoewel bij de uitgangsvraag de effecten van ACP op de invulling en intensiteit van medische zorg in de laatste levensfase niet zijn meegenomen, kan dit wel een overweging zijn om ACP in deze patiëntengroep vorm te geven.
In een recente RCT van Kirchhoff et al. [Kirchoff 2012 (6)] waren 313 patiënten-patiëntvertegenwoordigerparen geïncludeerd, waarvan 134 patiënten eindstadium nierfalen hadden, terwijl de overige patiënten chronisch hartfalen hadden {Kirchhoff, 2012 #17}. Patiënten werden gerandomiseerd tussen patient-centered ACP en de gebruikelijke behandeling. Patiënten in de patient-centered ACP-groep kozen iets minder vaak voor intensieve behandelingen (zoals intensive care opname of reanimatie) dan de groep die de gebruikelijke zorg kreeg. De verschillen waren echter niet statistisch significant. Indien er een lage kans op overleving zou bestaan zou 21,4% vs. 26,6% ervoor kiezen om alle behandelingen te continueren, terwijl 72,9% vs. 54,7% er voor zou kiezen om alle behandelingen te stoppen. In het geval er reanimatie nodig zou zijn zou 32,8% vs. 53,1% kiezen voor reanimatie terwijl 27,1% vs. 18,8% ervoor zou kiezen om niet gereanimeerd te worden.
In tegenstelling hierop kozen patiënten uit de patient-centered ACP-groep in een trial van Song 2010 (2) na een follow-up van één week iets vaker intensieve behandelingen dan de groep die de gebruikelijke interventie kreeg. Hoewel de statistische significantie van de verschillen niet werd gerapporteerd en het om zeer kleine aantallen patiënten ging, leken er wel grote verschillen in keuzes te bestaan tussen de twee groepen. Indien er een lage kans op overleving zou bestaan zou 80% in de patient-centered ACP groep vs. 28,6% in de controle groep ervoor kiezen om alle behandelingen te continueren; in het geval er reanimatie nodig zou zijn zou respectievelijk 90% vs. 57% ervoor kiezen om gereanimeerd te worden.
Aan welke voorwaarden zou ACP moeten voldoen?
ACP kan op verschillende wijzen worden vormgegeven. In de huidige praktijk vindt er in de meeste gevallen een gesprek plaats tussen de patiënt en één of meerdere hulpverleners, waarin wensen ten aanzien van reanimatie, intensieve behandelingen en een eventuele wilsbeschikking aan de orde komen. Hierbij is geen structureel format of follow-up gewaarborgd. Ook de rol van de naasten is hierin niet altijd duidelijk vastgelegd. Voor een structurele patiënt-georiënteerde ACP is dus meer nodig. Hierbij wordt in het zorgplan opgenomen wat de relevante lichamelijke, psychosociale en existentiële problemen van een patiënt zijn en hoe hierop geanticipeerd kan worden. Hierbij wordt rekening gehouden met bestaande problemen, maar ook met de te verwachten scenario’s bij verandering van gezondheidstoestand. Zo kunnen zaken op tijd geregeld worden, kan de draaglast van de mantelzorg bewaakt worden en de eerste lijn tijdig geïnformeerd worden. Ook wordt vastgelegd wanneer bepaalde acties worden geëvalueerd (zie ook module Organisatie van zorg).
De eerder beschreven SPIRIT-methode in de onderzoeken van Song is een format waarin de ACP uitgewerkt kan worden.
In een recent kwalitatief onderzoek [Goff 2015] met diepte-interviews bij dialysepatiënten en hun familie is ook een aantal aandachtspunten aangaande implementatie van ACP geformuleerd. In dit onderzoek waren de dialysepatiënten van mening dat het initiatief voor ACP bij de nefrologen ligt en vroeg in het ziekteproces moet worden opgepakt. Bij een (te) late start van ACP gaan belangrijke momenten voor vervulling van palliatieve zorgbehoeftes (zoals verder uitgewerkt in module Organisatie van zorg) verloren. Daarnaast is regelmatige (minimaal 1x per jaar) evaluatie van de gemaakte afspraken gewenst. Ook het belang van de betrokkenheid van de eerstelijnszorg wordt in dit onderzoek benadrukt. Specifieke onderwerpen die ter sprake zouden kunnen komen zijn redenen om dialyse niet te starten of te staken, reanimatiebeleid, wettelijke vertegenwoordigerschap wilsbeschikking, gewenste plaats van overlijden en beslissingen rond het levenseinde. Vertrouwen in en persoonlijke betrokkenheid van het betrokken behandelteam zijn van cruciaal belang voor een bevredigend ACP proces.
In de onderstaande tabel staan een aantal best practice adviezen voor de invulling en uitvoering van ACP bij patiënten met nierfalen [Davison 2012 (14)].
Tabel 1 - Een benadering voor ACP bij patiënten met chronisch nierfalen [Davison 2012 (14)]
- Identificeer patiënten met chronisch nierfalen waarvoor ACP zinvol is:
- hoog risico op overlijden binnen een jaar;
- stadium 5 nierfalen waarbij besloten is om niet te dialyseren;
- als het antwoord op de surprise-question (‘Zou ik verbaasd zijn als deze patiënt over een jaar zou zijn overleden?’) ‘nee’ is;
- functionele achteruitgang;
- andere markeringspunten zoals ziekenhuisopname of acute ziekte;
- slechte score in prognostische modellen;
- hoge symptoomlast (fysiek, psychosociaal, existentieel);
- overweging om dialyse niet te starten of te staken;
- moeite met beslissingen en wensen rond het levenseinde;
- verzoek van de patiënt en/of bij zorgen van patiënt en naasten over het levenseinde.
- Bepaal het vermogen en de bereidheid van patiënt en naasten voor (een gesprek over) ACP aan hand van:
- cognitieve vermogens;
- psychische symptomen: angst, depressie;
- culturele, religieuze en existentiële context;
- taalbarrière;
- ondersteuning door mantelzorg.
- Licht ACP toe:
- Leg de patiënt uit wat de betekenis en de waarde van ACP is;
- Leg de patiënt uit dat hij/zij maximaal behandeld zal worden tenzij hij/zij aangeeft geen levensverlengende behandelingen te willen ondergaan;
- Als de patiënt niet over levenseindevragen wil spreken, kan dit betekenen dat hij/zij dit nog niet betrekking vindt hebben op de eigen situatie;
- Vraag na wie de wettelijk vertegenwoordiger van de patiënt is, en wie hij/zij bij de ACP wil betrekken, waarbij de mogelijkheid bestaat dat de patiënt de ACP gesprekken liever (eerst) met de naasten bespreekt dan met de eigen arts.
- Maak afspraken over de ACP:
- Bepaal voorkeuren en doelen ten aanzien van behandeling en zorg gedurende de laatste levensfase;
- Beslissingen kunnen betrekking hebben op het al dan niet starten van dialyse, of stoppen van dialyse;
- Bespreek de rol en de beslissingsbevoegdheden van de wettelijk vertegenwoordiger.
- Leg afspraken over de ACP vast en maak afspraken over follow-up:
- wilsbeschikking;
- opdrachten in medisch dossier;
- betrek zo nodig andere zorgverleners voor expertise en ondersteuning.
Onderbouwing
Achtergrond
Advance care planning (ACP) is een onderdeel van palliatieve zorg, waarbij op interactieve wijze wensen, doelen en voorkeuren van zowel patiënt als zijn naasten met betrekking tot toekomstige zorg en de laatste levensfase worden besproken en vastgelegd. Een belangrijk verschil met de gebruikelijke zorg is dat ACP gekenmerkt wordt door een structurele, vroegtijdige multidisciplinaire aanpak en vastlegging.
De laatste tijd is er in diverse gremia veel aandacht voor het thema ACP, waarbij dit als onderdeel van het geven van goede (palliatieve) zorg wordt gezien.
Zaken die bij ACP aan de orde kunnen komen zijn bijvoorbeeld situaties waarin men wil dat een behandeling gestopt of niet gestart wordt, reanimatiebeleid, wensen ten aanzien van plaats van overlijden en beslissingen rond het levenseinde zoals palliatieve sedatie of euthanasie. Voor (pre)dialysepatiënten betekent dit ook aandacht voor lichamelijke en emotionele aspecten, als ook spirituele zaken, die gerelateerd zijn aan het starten, het niet starten of het stoppen van dialyse.
Het is hierbij van belang dat de patiënt en zijn naasten begrip hebben van hun ziekte en prognose en van de verschillende behandelopties (inclusief conservatieve behandeling), en dat duidelijk is welke behandeldoelen bereikt willen worden. Dit vereist bij mensen die laaggeletterd zijn specifieke communicatieve vaardigheden (Heijmans 2016 (1)). Bij anderstaligen kan inschakeling van een (professionele) tolk behulpzaam zijn. Gedeelde besluitvorming is een onmisbaar onderdeel van dit proces. Het wordt aanbevolen om iemand uit de nabije omgeving van de patiënt, die betrokken is bij het hele ACP proces, te machtigen om besluiten te mogen nemen op het moment dat de patiënt daar niet meer toe in staat is. Vooral voor dit laatste aspect van ACP is er de laatste tijd toenemende aandacht [Song 2010 (2)].
In diverse patiëntengroepen is ACP geassocieerd met verbetering van kwaliteit van leven en tevredenheid over zorg rondom de laatste levensfase van zowel patiënt als familie en patiëntvertegenwoordigers [Detering 2010 (3)], en gaat ACP gepaard met minder levensverlengende handelingen en meer gebruik van een hospice [Bernacki 2014 (4), Lorenz 2008 (5), Kirchhoff 2012 (6)].
Ondanks het feit dat (oudere) dialysepatiënten gemiddeld een hogere mortaliteit hebben dan bijv. patiënten met kanker en hartfalen [Swidler 2012 (7)] is advance care planning bij dialysepatiënten nog geen gewoonte. Het stoppen met dialyse is een belangrijke oorzaak van overlijden, met name in de oudere (>75 jaar) patiëntengroep. Desondanks is er slechts in een minderheid een gesprek geweest tussen patiënt, zijn/haar naasten en behandelteam over situaties en omstandigheden waarin de wens om te stoppen met dialyse zou kunnen ontstaan. Mede hierdoor ondergaan dialysepatiënten in de laatste maand van hun leven meer intensieve medische behandelingen dan bijv. patiënten met kanker of hartfalen, en overlijden ze vaker in het ziekenhuis in plaats van thuis of in een hospice [Wong 2012 (8), Davison 2010 (9)].
Om die reden werd in de huidige richtlijn gekeken naar welke effecten en kenmerken van ACP beschreven zijn bij patiënten met eindstadium nierfalen.
Conclusies
Er is bewijs van lage kwaliteit dat er drie maanden na de interventie geen verschil is in psychospiritueel welzijn van patiënten met eindstadium nierfalen, wanneer zij een advance care planning interventie kregen volgens de SPIRIT-methode, of wanneer zij de gebruikelijke zorg kregen.
Song 2009 (11)
Er is bewijs van matige kwaliteit dat patiënten met eindstadium nierfalen tot drie maanden na een patient-centered advance care planning interventie volgens de SPIRIT-methode meer tevreden zijn over de communicatie* van de hulpverlener over zorg rondom een mogelijk levenseinde, vergeleken met patiënten die de gebruikelijke zorg kregen.
Song 2009 (11)
Er is bewijs van lage kwaliteit dat patiënten met eindstadium nierfalen tot drie maanden na een patient-centered advance care planning interventie volgens de SPIRIT-methode meer tevreden zijn over de interactie* met de hulpverlener over zorg rondom een mogelijk levenseinde, vergeleken met patiënten die de gebruikelijke zorg kregen.
Song 2009 (11)
Er is bewijs van lage kwaliteit dat patiëntvertegenwoordigers tot drie maanden na een patient-centered advance care planning interventie volgens de SPIRIT-methode meer tevreden zijn over de communicatie* van en de interactie* met de hulpverlener, over zorg rondom een mogelijk levenseinde, vergeleken met patiëntvertegenwoordigers die de gebruikelijke zorg kregen.
Song 2009 (11)
Er is geen bewijs dat patiënt-centered advance care planning na 2, 6 en 12 maanden meer vertrouwen bij de patiëntvertegenwoordiger geeft in het nemen van de juiste beslissing over de patiënt dan bij de patiënt vertegenwoordigers die de gebruikelijke zorg kregen.
Song 2015 (12)
Algehele kwaliteit van bewijs = laag
*voor uitleg begrip communicatie en interactie: zie ‘Literatuurbeschrijving’.
Samenvatting literatuur
Literatuurbeschrijving
Beschrijving van de studies
Eén systematische review [Luckett 2014 (10)] en drie gerandomiseerde gecontroleerde trials (RCTs) [Song 2009 (11), Song 2010 (2), Song 2015 (12)] evalueerden advance care planning bij patiënten met eindstadium nierfalen.
De systematische review van Luckett 2014 zocht naar studies over advance care planning bij patiënten met chronisch nierfalen en includeerde elke studie met informatie daarover [Luckett 2014 (10)]. Er werden vier RCTs geïncludeerd, waarvan de eerste RCT [Perry 2005] over een interventie ging die voor de Nederlandse situatie niet relevant is (advance care planningsessie die door lotgenoten wordt gefaciliteerd). Van de tweede RCT [Singer 1995] werden geen relevante uitkomsten gerapporteerd. De Songstudie uit 2010 is een pilotstudie bij een beperkt aantal patiënten en met korte follow up van 1 week. Deze voegt naar het oordeel van de werkgroep zeer weinig toe aan de studie uit 2009 en is daarom niet meegenomen in de literatuurbeschouwing.
In de trial van Song 2009 (11) werden 58 Afro-Amerikaanse patiënt-patiëntvertegenwoordigerparen gerandomiseerd tussen patient-centered advance care planning en de gebruikelijke zorg [Song 2009 (11)]. De gebruikelijke zorg bestond uit een gesprek met een medisch maatschappelijk werker op de eerste dag van dialyse, waarin de patiënt schriftelijke informatie kreeg over een medische wilsbeschikking, eventuele vragen over de wilsbeschikking beantwoord werden, en de patiënt aangemoedigd werd om een medische wilsbeschikking te maken. Patient-centered advance care planning (SPIRIT: Sharing Patients’s Illness Representations to Increase Trust) bestond uit een gesprek met een getrainde gezondheidswerker van één tot anderhalf uur. Het gesprek bestond steeds uit vijf onderdelen.
- een check van het begrip van de patiënt en zijn naasten over de huidige medische situatie, prognose en mogelijke toekomstige medische gebeurtenissen, en de impact hiervan op zowel het leven van de patiënt als zijn naasten;
- duidelijkheid krijgen over mogelijke misvattingen van de patiënt en zijn naasten over toekomstige medische beslissingen;
- mogelijkheid bieden voor het delen van ideeën over de laatste levensfase en overlijden tussen patiënt en zijn naasten, waarbij verwachtingen en grenzen voor uitkomsten van behandeling worden uitgesproken;
- hulp aan de patiënt en zijn plaatsvervangend besluitvormer om mogelijke toekomstige complicaties en behandelingen te kunnen begrijpen en te weten hoe er dan gehandeld moet worden. Wensen hiervoor worden vastgelegd in een wilsbeschikking;
- een samenvatting van de conclusies door de zorgverlener, met aangeven van de noodzaak van een nieuw gesprek als de situatie of de wens van de patiënt verandert, en de waarde van de discussie voor de patiënt en patiëntvertegenwoordiger.
De follow-up was tot drie maanden na dit gesprek.
In een latere RCT van Song 2015 (12) werden 210 patiënt-patiëntvertegenwoordigerparen gerandomiseerd tussen patient-centered advance care planning (SPIRIT) en de gebruikelijke zorg [Song 2015 (12)]. De patiëntenselectie bestond uit dialysepatiënten met een hoge Charlson Comorbidity Index (CCI ≥ 6) (voor berekening zie: http://nephron.com/cgi-bin/rpa_sdm.cgi) of ziekenhuisopname in afgelopen 6 maanden met een CCI ≥5, die minimaal 6 maanden dialyseerden. De gebruikelijke behandeling en de patient-centered advance care planning waren zoals bij Song 2009 (11), hierboven beschreven. Echter, de patient-centered advance care planning bestond uit twee gesprekken met een tussenpoos van twee weken. In het tweede, korte gesprek bij de patiënt thuis werd de medische wilsbeschikking besproken en eventuele onenigheid binnen de familie werd aan de orde gesteld. De follow-up was tot 12 maanden na het eerste gesprek.
Kwaliteit van het bewijs
Er werd afgewaardeerd volgens de GRADE-methode omdat twee trials een hoog risico op bias kenden, en één trial had een onbekend risico op bias. Voor bijna alle uitkomstmaten werd ook afgewaardeerd omdat het 95% betrouwbaarheidsinterval (BI) de Minimally Important Difference van 0,5 of -0,5 (uitgedrukt in de standardised mean difference) kruiste. Hiervoor werd als vuistregel aangehouden dat 0,2 een klein verschil tussen groepen betekent, terwijl 0,5 een matig verschil en 0,8 een groot verschil tussen groepen betekent [Guyatt 2013 (13)].
Effect op kwaliteit van leven van de patiënt: kritische uitkomstmaat
De trial van Song 2009 (11) rapporteerde over ‘psychospiritueel welzijn’ van de patiënt, met behulp van het 28-item Self-Perception and Relationship Tool na een follow-up van drie maanden [Song 2009 (11), Song 2010 (2)]. Drie maanden na de interventie was het verschil in gemiddelde score -0,27 (95%BI: -0,78 tot 0,24) ten gunste van de SPIRIT methode.
Effect op tevredenheid patiënt: kritische uitkomstmaat
De trial van Song 2009 (11) rapporteerde over de tevredenheid van patiënten, over de communicatie van hulpverleners over de zorg rondom het levenseinde en over de tevredenheid over de interactie met zorgverleners [Song 2009 (11), Song 2010 (2)]. De communicatie werd gemeten aan de hand van scores op een schaal van 1-3 over aandacht en houding van hulpverlener, en of de wens ten aanzien van het einde van leven gehoord werd (hoe hoger de score, hoe beter de communicatie). Interactie werd gemeten d.m.v. een score (op een schaal van 1-4) van 5 vragen over specifiek gedrag van de hulpverlener aangaande mate van luisteren, uitleggen, respect, beschikbare tijd en participatie in de besluitvorming. Hoe lager de score, hoe beter de interactie. Na drie maanden waren patiënten in de patient-centered advance care planning groepen meer tevreden over de communicatie van de hulpverlener over zorg rond het levenseinde, vergeleken met de patiënten in de groep die de gebruikelijke interventie kreeg (verschil in gemiddelde somscore op een schaal van 3-12 (hogere scores betekenden betere communicatie) 3,78 (95%BI: 2,29 tot 5,27). Na drie maanden waren patiënten in de patient-centered advance care planning groepen meer tevreden over de interactie met de hulpverlener over zorg rond het levenseinde, vergeleken met de patiënten in de groep die de gebruikelijke interventie kreeg (verschil in gemiddelde scores op een generiek instrument met een schaal van 5-20 (lagere scores betekende betere interactie), -1,61 (95%BI: -2,65 tot -0,57).
De trial van Song 2015 (12) rapporteerde over de Patient Decisional Conflict Scale (PDCS), een instrument dat meet of iemand het moeilijk vond een beslissing te nemen [Song 2015 (12)]. Een score kan variëren van één tot vijf en een score van twee of hoger duidt op moeilijkheden bij het nemen van een beslissing. Twee maanden na de advance care planning interventie was er geen verschil tussen behandelgroepen, gemeten met de PDCS (gemiddelde score PDCS 1,7 (standaard deviatie (SD) 0,5 vs. 1,7 (0,5)). Na zes en 12 maanden waren er kleine, statistisch significante verschillen tussen de behandelgroepen (1,6 (SD: 0,5) vs. 1,8 (SD: 0,4), p=0,007, respectievelijk 1,6 (SD: 0,4) vs. 1.8 (SD: 0,5), p<0,01).
Effect op tevredenheid van de patiëntvertegenwoordiger: kritische uitkomstmaat
De trial van Song 2009 (11) rapporteerde over de tevredenheid van patiëntvertegenwoordigers over de communicatie van hulpverleners over de zorg rondom het levenseinde, en de tevredenheid over de interactie met zorgverleners [Song 2009 (11), Song 2010 (2)]. Na drie maanden waren patiëntvertegenwoordigers in de patient-centered advance care planning groepen meer tevreden over de communicatie van de hulpverlener over zorg rond het levenseinde, vergeleken met patiëntvertegenwoordigers in de groep die de gebruikelijke interventie kreeg (verschil in gemiddelde scores op een generiek instrument met een schaal van 3-12 (hogere scores betekenden betere communicatie) respectievelijk 4,89 (95%BI: 3,58 tot 6,21) en 1,36 (95%BI: 0,38 tot 2,34). Na drie maanden waren patiëntvertegenwoordigers in de patient-centered advance care planning groepen meer tevreden over de interactie met de hulpverlener over zorg rond het levenseinde, vergeleken met de patiëntvertegenwoordigers in de groep die de gebruikelijke interventie kreeg (verschil in gemiddelde scores op een generiek instrument met een schaal van 5-20 (lagere scores betekende betere interactie), -1,47 (95%BI: -2,64 tot -0,30).
Song 2015 (12) rapporteerde over het vertrouwen dat de patiëntvertegenwoordiger had in het nemen van een beslissing over de patiënt [Song 2015 (12)]. Hiervoor werd een Decision Making Confidence Scale (DMCS) gebruikt (range: 1-4, hogere waardes geven meer vertrouwen aan). Na twee, zes en twaalf maanden follow-up was er nauwelijks verschil in scores tussen de twee behandelgroepen (3,7 (SD: 0,4) vs. 3,6 (SD: 0,5); 3,7 (SD: 0,4) vs. 3,6 (SD: 0,5); 3,7 (SD: 0,4) vs. 3,7 (SD:0,5)).
Zoeken en selecteren
Search strings Question advance care planning
medline (ovid)
1 Renal Insufficiency/ (11476)
2 exp Renal Insufficiency, Chronic/ (90384)
3 (end-stage renal or end-stage kidney or endstage kidney or endstage renal or end stage kidney or end stage renal).tw. (27211)
4 ((kidney$ or renal) adj2 (disease$ or failure$ or sufficien$ or insufficien$)).tw. (164853)
5 CRF.tw. (11504)
6 (ESKD or ESKF or ESRD or ESRF).tw. (11303)
7 Renal Replacement Therapy/ (3809)
8 renal replacement therapy.tw. (6806)
9 exp Renal Dialysis/ (98771)
10 Hemodialysis, Home/ (1723)
11 exp Hemofiltration/ (5880)
12 (HDF or HF or AFB or RRT).tw. (26697)
13 kidney, artificial/ (4308)
14 ultrafiltration/ (8925)
15 dialysis/ (12293)
16 ((kidney$ or renal) adj2 (replac$ or artificial or extracorporeal)).tw. (9522)
17 biofilt$.tw. (1401)
18 (hemodia$ or haemodia$ or hemofilt$ or haemofilt$ or diafilt$).tw. (64794)
19 or/1-18 (315459)
20 exp Advance Care Planning/ (7244)
21 (advance care adj (plan or plans or planning)).tw. (921)
22 (advance adj (directive* or decision*)).tw. (2623)
23 living will*.tw. (1039)
24 Right to Die/ (4671)
25 right to die.tw. (863)
26 ((patient or patients) adj5 (advocat* or advocacy)).tw. (4220)
27 power of attorney.tw. (304)
28 ((end of life or EOL) adj5 (care or discuss* or decision* or plan or plans or planning or preference*)).tw. (8136)
29 Terminal Care/ (22359)
30 Treatment Refusal/ (10972)
31 exp Withholding Treatment/ (13169)
32 (treatment adj5 (refus* or withhold* or withdraw*)).tw. (12728)
33 Patient Advocacy/ (22735)
34 terminal care.tw. (1381)
35 palliative approach.mp. (247)
36 or/20-35 (85516)37 19 and 36 (1762)
38 limit 37 to yr="2005 - 2015" (813)
PreMedline (OVID)
3 (end-stage renal or end-stage kidney or endstage kidney or endstage renal or end stage kidney or end stage renal).tw. (2625)
4 ((kidney$ or renal) adj2 (disease$ or failure$ or sufficien$ or insufficien$)).tw. (12542)
5 CRF.tw. (634)
6 (ESKD or ESKF or ESRD or ESRF).tw. (1298)
8 renal replacement therapy.tw. (915)
12 (HDF or HF or AFB or RRT).tw. (6579)
16 ((kidney$ or renal) adj2 (replac$ or artificial or extracorporeal)).tw. (1067)
17 biofilt$.tw. (109)
18 (hemodia$ or haemodia$ or hemofilt$ or haemofilt$ or diafilt$).tw. (4247)
19 or/1-18 (22541)
21 (advance care adj (plan or plans or planning)).tw. (176)
22 (advance adj (directive* or decision*)).tw. (171)
23 living will*.tw. (35)
25 right to die.tw. (23)
26 ((patient or patients) adj5 (advocat* or advocacy)).tw. (410)
27 power of attorney.tw. (13)
28 ((end of life or EOL) adj5 (care or discuss* or decision* or plan or plans or planning or preference*)).tw. (1077)
32 (treatment adj5 (refus* or withhold* or withdraw*)).tw. (779)
34 terminal care.tw. (44)
35 palliative approach.mp. (43)
36 or/20-35 (2522)
37 19 and 36 (87)
38 limit 37 to yr="2005 - 2015" (82)
EMBASE (via embase.com)
|
#1 |
'kidney failure'/de OR 'chronic kidney failure'/exp OR 'renal replacement therapy'/exp OR 'renal replacement therapy-dependent renal disease'/exp OR 'dialysis'/de OR 'ultrafiltration'/exp OR 'artificial kidney'/exp |
299825 |
|
#2 |
'end-stage renal':ab,ti OR 'end-stage kidney':ab,ti OR 'endstage kidney':ab,ti OR 'endstage renal':ab,ti OR 'end stage kidney':ab,ti OR 'end stage renal':ab,ti |
38532 |
|
#3 |
((kidney* OR renal) NEAR/2 (disease* OR failure* OR sufficien* OR insufficien*)):ab,ti |
234268 |
|
#4 |
crf:ab,ti |
14919 |
|
#5 |
eskd:ab,ti OR eskf:ab,ti OR esrd:ab,ti OR esrf:ab,ti |
17866 |
|
#6 |
'renal replacement therapy':ab,ti |
11447 |
|
#7 |
hdf:ab,ti OR hf:ab,ti OR afb:ab,ti OR rrt:ab,ti |
54347 |
|
#8 |
ultrafiltrat*:ab,ti OR dialy*:ab,ti |
140731 |
|
#9 |
((kidney* OR renal) NEAR/2 (replac* OR artificial OR extracorporeal)):ab,ti |
14939 |
|
#10 |
biofilt*:ab,ti |
2232 |
|
#11 |
hemodia*:ab,ti OR haemodia*:ab,ti OR hemofilt*:ab,ti OR haemofilt*:ab,ti OR diafilt*:ab,ti |
87695 |
|
#12 |
#1 OR #2 OR #3 OR #4 OR #5 OR #6 OR #7 OR #8 OR #9 OR #10 OR #11 |
514118 |
|
#13 |
'living will'/exp OR 'right to die'/exp OR 'patient advocacy'/exp OR 'power of attorney'/exp OR 'terminal care'/exp OR 'treatment refusal'/exp OR 'treatment withdrawal'/exp |
91929 |
|
#14 |
(living NEAR/1 will*):ab,ti |
1283 |
|
#15 |
('advance care' NEAR/1 (plan OR plans OR planning)):ab,ti |
1608 |
|
#16 |
'right to die':ab,ti |
897 |
|
#17 |
((patient OR patients) NEAR/5 (advocat* OR advocacy)):ab,ti |
6043 |
|
#18 |
'power of attorney':ab,ti |
424 |
|
#19 |
(('end of life' OR eol) NEAR/5 (care OR discuss* OR decision* OR plan OR plans OR planning OR preference*)):ab,ti |
12087 |
|
#20 |
'terminal care':ab,ti |
1636 |
|
#21 |
(treatment NEAR/2 (refus* OR withhold* OR withdraw*)):ab,ti |
9295 |
|
#22 |
#13 OR #14 OR #15 OR #16 OR #17 OR #18 OR #19 OR #20 OR #21 |
107864 |
|
#23 |
#12 AND #22 |
2945 |
|
#24 |
#23 AND ([article]/lim OR [article in press]/lim OR [review]/lim) AND ([dutch]/lim OR [english]/lim) AND [2005-2015]/py |
1348 |
Cochrane library (via wiley)
#1 MeSH descriptor: [Renal Insufficiency] 1 tree(s) exploded
#2 MeSH descriptor: [Renal Insufficiency, Chronic] 1 tree(s) exploded
#3 ("end-stage renal" or "end-stage kidney" or "endstage kidney" or "endstage renal" or "end stage kidney" or "end stage renal"):ti,ab
#4 ((kidney* or renal) and (disease* or failure* or sufficien* or insufficien*)):ti,ab
#5 CRF:ti,ab
#6 (ESKD or ESKF or ESRD or ESRF):ti,ab
#7 MeSH descriptor: [Renal Replacement Therapy] 1 tree(s) exploded
#8 renal replacement therapy:ti,ab
#9 MeSH descriptor: [Renal Dialysis] 1 tree(s) exploded
#10 MeSH descriptor: [Hemodialysis, Home] 1 tree(s) exploded
#11 MeSH descriptor: [Hemofiltration] 1 tree(s) exploded
#12 (HDF or HF or AFB or RRT):ti,ab
#13 MeSH descriptor: [Kidneys, Artificial] 1 tree(s) exploded
#14 MeSH descriptor: [Ultrafiltration] 1 tree(s) exploded
#15 MeSH descriptor: [Dialysis] 1 tree(s) exploded
#16 (ultrafiltrat* or dialy*):ti,ab
#17 ((kidney* or renal) and (replac* or artificial or extracorporeal)):ti,ab
#18 biofilt*:ti,ab
#19 (hemodia* or haemodia* or hemofilt* or haemofilt* or diafilt*):ti,ab
#20 #1 or #2 or #3 or #4 or #5 or #6 or #7 or #8 or #9 or #10 or #11 or #12 or #13 or #14 or #15 or #16 or #17 or #18 or #19
#21 MeSH descriptor: [Advance Care Planning] explode all trees
#22 MeSH descriptor: [Right to Die] 1 tree(s) exploded
#23 MeSH descriptor: [Terminal Care] 1 tree(s) exploded
#24 MeSH descriptor: [Treatment Refusal] 1 tree(s) exploded
#25 MeSH descriptor: [Withholding Treatment] 1 tree(s) exploded
#26 MeSH descriptor: [Patient Advocacy] 1 tree(s) exploded
#27 ("advance care" and (plan or plans or planning)):ti,ab
#28 (advance and (directive* or decision*)):ti,ab
#29 living will*:ti,ab
#30 "right to die":ti,ab
#31 ((patient or patients) and (advocat* or advocacy)):ti,ab
#32 "power of attorney":ti,ab
#33 (("end of life" or EOL) and (care or discuss* or decision* or plan or plans or planning or preference*)):ti,ab
#34 (treatment and (refus* or withhold* or withdraw*)):ti,ab
#35 "terminal care":ti,ab
#36 "palliative approach":ti,ab
#37 #21 or #22 or #23 or #24 or #25 or #26 or #27 or #28 or #29 or #30 or #31 or #32 or #33 or #34 or #35 or #36
#38 #20 and #37
Referenties
- 3 - Detering KM, Hancock AD, Reade MC, Silvester W. The impact of advance care planning on end of life care in elderly patients: randomised controlled trial..BMJ, 2010.340:c1345.
- 4 - Bernacki RE, Block SD; American College of Physicians High Value Care Task Force. Communication about serious illness care goals: a review and synthesis of best practices. JAMA Intern Med. 2014 Dec;174(12):1994-2003.
- 5 - Lorenz KA et al. Evidence for improving palliative care at the end of life: a systematic review. Ann Intern Med. 2008 Jan 15;148(2):147-59
- 7 - Swidler MA. Geriatric Renal Palliative Care. J Gerontol A Biol Sci Med Sci. 2012 Dec;67(12):1400-9
- 8 - Wong SP, Kreuter W, O'Hare AM. Treatment intensity at the end of life in older adults receiving long-term dialysis. Arch Intern Med. 2012 Apr 23;172(8):661-3
Evidence tabellen
Evidence tabel advance care planning, zie aanverwant.
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld :
Laatst geautoriseerd : 01-03-2017
Geplande herbeoordeling :
Actualisatie
Deze richtlijn is goedgekeurd op 1 maart 2017. IKNL en PAZORI bewaken samen met betrokken verenigingen de houdbaarheid van deze en andere onderdelen van de richtlijn. Zo nodig zal de richtlijn tussentijds op onderdelen worden bijgesteld. De geldigheidstermijn van de richtlijn is maximaal 5 jaar na vaststelling. Indien de richtlijn dan nog actueel wordt bevonden, wordt de geldigheidsduur van de richtlijn verlengd.
Houderschap richtlijn
De houder van de richtlijn moet kunnen aantonen dat de richtlijn zorgvuldig en met de vereiste deskundigheid tot stand is gekomen. Onder houder wordt verstaan de verenigingen van beroepsbeoefenaren die de richtlijn autoriseren.
IIKNL draagt zorg voor het beheer en de ontsluiting van de richtlijn.
Juridische betekenis van richtlijnen
De richtlijn bevat aanbevelingen van algemene aard. Het is mogelijk dat deze aanbevelingen in een individueel geval niet van toepassing zijn. Er kunnen zich feiten of omstandigheden voordoen waardoor het wenselijk is dat in het belang van de patiënt van de richtlijn wordt afgeweken. Wanneer van de richtlijn wordt afgeweken, dient dit beargumenteerd gedocumenteerd te worden. De toepassing van de richtlijnen in de praktijk is de verantwoordelijkheid van de behandelende arts.
Algemene gegevens
Initiatief
Platform PAZORI (Palliatieve Zorg Richtlijnen)
IKNL (Integraal Kankercentrum Nederland)
Autoriserende en betrokken verenigingen
Patiëntenfederatie Nederland*
Nierpatiënten Vereniging Nederland (NVN)*
Nederlands Huisartsen Genootschap (NHG)*
Nederlandse Internisten Vereniging/Nederlandse Federatie voor Nefrologie (NIV/NfN)
Vereniging Maatschappelijk Werk Nefrologie (VMWN)
Nederlandse Vereniging van Ziekenhuisapothekers (NVZA)
Palliactief
Specialisten ouderengeneeskunde (Verenso)
Verpleegkundigen en Verzorgenden Nederland (V&VN) Palliatieve zorg
Verpleegkundigen en Verzorgenden Nederland (V&VN) Dialyse & Nefrologie
*Deze verenigingen autoriseren niet, maar stemmen in met de inhoud.
Financiering
Deze richtlijn c.q. module is gefinancierd door IKNL. De inhoud van de richtlijn c.q. module is niet beïnvloed door de financierende instantie.
Een richtlijn is een kwaliteitsstandaard. Een kwaliteitsstandaard beschrijft wat goede zorg is, ongeacht de financieringsbron (Zorgverzekeringswet (Zvw), Wet langdurige zorg (Wlz), Wet maatschappelijke ondersteuning (Wmo), aanvullende verzekering of eigen betaling door de cliënt/patiënt). Opname van een kwaliteitsstandaard in het Register betekent dus niet noodzakelijkerwijs dat de in de kwaliteitsstandaard beschreven zorg verzekerde zorg is.
Procesbegeleiding en verantwoording
IKNL (Integraal Kankercentrum Nederland) is het kennis- en kwaliteitsinstituut voor professionals en bestuurders in de oncologische en palliatieve zorg dat zich richt op het continu verbeteren van de oncologische en palliatieve zorg.
IKNL benadert preventie, diagnose, behandeling, nazorg en palliatieve zorg als een keten waarin de patiënt centraal staat. Om kwalitatief goede zorg te waarborgen ontwikkelt IKNL producten en diensten ter verbetering van de oncologische zorg, de nazorg en de palliatieve zorg, zowel voor de inhoud als de organisatie van de zorg binnen en tussen instellingen. Daarnaast draagt IKNL nationaal en internationaal bij aan de beleidsvorming op het gebied van oncologische en palliatieve zorg.
IKNL rekent het (begeleiden van) ontwikkelen, implementeren en evalueren van multidisciplinaire, evidence based richtlijnen voor de oncologische en palliatieve zorg tot een van haar primaire taken. IKNL werkt hierbij conform de daarvoor geldende (inter)nationale kwaliteitscriteria. Bij ontwikkeling gaat het in toenemende mate om onderhoud (modulaire revisies) van reeds bestaande richtlijnen.
Doel en doelgroep
Doel
Een richtlijn is een aanbeveling ter ondersteuning van de belangrijkste knelpunten uit de dagelijkse praktijk. Deze richtlijn is zoveel mogelijk gebaseerd op wetenschappelijk onderzoek en consensus. De richtlijn palliatieve zorg bij eindstadium nierfalen geeft aanbevelingen over begeleiding en behandeling van patiënten met eindstadium nierfalen en beoogt hiermee de kwaliteit van de zorgverlening te verbeteren.
Doelpopulatie
Door de werkgroep is besloten dat de huidige richtlijn van toepassing is op alle volwassen patiënten (> 18 jaar) die stadium V nierfalen (eGFR < 15 ml/min) hebben.
Doelgroep
Deze richtlijn is bestemd voor alle professionals die betrokken zijn bij de zorg voor patiënten met nierfalen in de palliatieve fase zoals huisartsen, specialisten ouderengeneeskunde, medisch specialisten (vooral nefrologen), apothekers, verpleegkundigen, verpleegkundig specialisten, physician assistants, medisch maatschappelijk werkers, diëtisten, geestelijk verzorgers, GZ- en klinisch psychologen.
Indien in de richtlijn wordt gesproken over zorgverleners rondom de patiënt met nierfalen, worden afhankelijk van de specifieke situatie van de patiënt alle bovengenoemde professionals bedoeld.
Samenstelling werkgroep
Alle werkgroepleden zijn afgevaardigd namens wetenschappelijke en beroepsverenigingen en hebben daarmee het mandaat voor hun inbreng. Bij de samenstelling van de werkgroep is geprobeerd rekening te houden met landelijke spreiding, inbreng van betrokkenen uit zowel academische als algemene ziekenhuizen/instellingen en vertegenwoordiging van de verschillende verenigingen/ disciplines. Het patiëntenperspectief is vertegenwoordigd door middel van afvaardiging van een ervaringsdeskundige (nierpatiënt) en een beleidsmedewerker van de Nierpatiënten Vereniging Nederland (NVN). Bij de uitvoer van het literatuuronderzoek is een methodoloog/epidemioloog/literatuuronderzoeker betrokken.
|
Naam |
Rol |
Functie |
Vereniging |
|
|
|||
|
Werkgroepleden |
|||
|
Mw. dr. M. van Buren |
Voorzitter |
Internist-nefroloog |
NIV/NfN |
|
Mw. I. Beckers |
Lid |
Medisch maatschappelijk werker |
VMWN |
|
Dhr. dr. A. de Graeff |
Lid |
Internist-oncoloog en hospice-arts |
Palliactief |
|
Mw. A. van Heuvelen |
Lid |
Ervaringsdeskundige |
NVN |
|
Mw. dr. J.M.H. Joosten |
Lid |
Nefroloog en internist-ouderengeneeskunde |
NIV/NfN |
|
Mw. P. Lansink |
Lid |
Dialyseverpleegkundige |
V&VN |
|
Dhr. drs. D.J. van Maare |
Lid |
Huisarts |
NHG |
|
Mw. drs. C. van den Oever |
Lid |
Ziekenhuisapotheker |
NVZA |
|
Mw. dr. M. Oolbekkink |
Lid |
Specialist Ouderengeneeskunde |
Verenso |
|
Mw. drs. K. Prantl |
Lid |
Medewerker kwaliteitsbeleid |
NVN |
|
|
|
|
|
|
Ondersteuning |
|||
|
Mw. drs. M.G. Gilsing |
adviseur (richtlijnen) palliatieve zorg |
IKNL |
|
|
Mw. T.T.M. Bluemink-Holkenborg |
secretaresse |
IKNL |
|
|
Mw. drs. Y. Smit |
literatuuronderzoeker |
Freelance |
|
|
Dhr. dr. J. Vlayen |
literatuuronderzoeker |
ME-TA |
|
Belangenverklaringen
Om de beïnvloeding van de richtlijnontwikkeling of formulering van de aanbevelingen door conflicterende belangen te minimaliseren zijn de leden van werkgroep gemandateerd door de wetenschappelijke en beroepsverenigingen. Alle leden van de richtlijnwerkgroep hebben verklaard onafhankelijk gehandeld te hebben bij het opstellen van de richtlijn. Een onafhankelijkheidsverklaring ‘Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling' zoals vastgesteld door onder meer de KNAW, KNMG, Gezondheidsraad, CBO, NHG en Orde van Medisch Specialisten is door de werkgroepleden bij aanvang en bij afronding van het traject ingevuld. De bevindingen zijn schriftelijk vastgelegd in de belangenverklaring en opvraagbaar via info@iknl.nl.
Inbreng patiëntenperspectief
Twee patiëntvertegenwoordigers namen (via de NPCF en NVN) zitting in de richtlijnwerkgroep: een ervaringsdeskundige (nierpatiënt) en een beleidsmedewerker van de Nierpatiënten Vereniging Nederland (NVN). De input van patiëntvertegenwoordigers is nodig voor de ontwikkeling van kwalitatief goede richtlijnen. Goede zorg voldoet immers aan de wensen en eisen van zowel zorgverlener als patiënt. Door middel van onderstaande werkwijze is informatie verkregen en zijn de belangen van de patiënt meegenomen:
- Bij aanvang van het richtlijntraject hebben de patiëntvertegenwoordigers knelpunten aangeleverd.
- Via de NPCF en haar organisatielid de Nierpatiënten Vereniging Nederland is een enquête gehouden voor het inventariseren van de knelpunten.
- De patiëntvertegenwoordigers waren aanwezig bij de vergaderingen van de richtlijnwerkgroep.
- De patiëntvertegenwoordigers hebben de conceptteksten beoordeeld om het patiëntenperspectief in de formulering van de definitieve tekst te optimaliseren.
- De NPCF (met organisatielid Nierpatiënten Vereniging Nederland) is geconsulteerd in de externe commentaarronde.
- De NPCF (en daarmee de NVN) heeft ingestemd met de inhoud van de richtlijn.
Patiënteninformatie/een patiëntensamenvatting wordt opgesteld en gepubliceerd op de daarvoor relevante sites.
Methode ontwikkeling
Evidence based
Implementatie
Bevorderen van het toepassen van de richtlijn in de praktijk begint met een brede bekendmaking en verspreiding van de richtlijn. Bij verdere implementatie gaat het om gerichte interventies om te bevorderen dat professionals de nieuwe kennis en kunde opnemen in hun routines van de palliatieve zorgpraktijk, inclusief borging daarvan. Als onderdeel van elke richtlijn stelt IKNL samen met de richtlijnwerkgroep een implementatieplan op. Activiteiten en interventies voor verspreiding en implementatie vinden zowel op landelijk als regionaal niveau plaats. Deze kunnen eventueel ook op maat gemaakt worden per instelling of specialisme. Informatie hierover is te vinden op www.iknl.nl. Het implementatieplan bij deze richtlijn is een belangrijk hulpmiddel om effectief de aanbevelingen uit deze richtlijn te implementeren voor de verschillende disciplines.
Werkwijze
De werkgroep is op 11 februari 2015 voor de eerste maal bijeengekomen. Op basis van een door de werkgroepleden opgestelde enquête heeft een knelpuntenanalyse plaatsgevonden onder professionals en patiënten(vertegenwoordigers). Na het versturen van de enquête hebben 275 professionals en 7 patiënten gereageerd en knelpunten geprioriteerd en/of ingebracht. De meest relevante knelpunten zijn uitgewerkt tot 4 uitgangsvragen.
Op basis van de uitkomsten van de enquête zijn de onderwerpen communicatie- en conflicttechnieken, advance care planning en medicamenteuze en niet-medicamenteuze behandeling van symptomen bij patiënten met nierfalen uitgewerkt volgens de evidence based methodiek GRADE in respectievelijk hoofdstukken Conflicten/Communicatie, Advance Care Planning en Symptomen. Voor iedere uitgangsvraag werd uit de richtlijnwerkgroep een subgroep geformeerd. Bij de beantwoording van deze uitgangsvragen verzorgde een externe methodoloog het literatuuronderzoek. Dit betrof het uitvoeren van een systematische literatuursearch, het kritisch beoordelen van de literatuur en het verwerken van de literatuur in evidence tabellen. Daarnaast werd door de methodoloog een concept literatuurbespreking met bijbehorende conclusies aangeleverd voor deze uitgangsvragen. Vervolgens pasten de subgroepleden, na interne discussie met de methodoloog, de concept literatuurbespreking en conclusies aan en stelden overwegingen en aanbevelingen op.
De werkgroepleden raadpleegden de door hen zelf verzamelde relevante literatuur. Op basis hiervan hebben de werkgroepleden de conclusies, overige overwegingen en aanbevelingen herzien. Voor de uitgangsvraag die betrekking heeft op de definiëring en vormgeving van palliatieve zorg bij patiënten met eindstadium nierfalen (hoofdstuk Organisatie van zorg) werd geen systematisch literatuur onderzoek gedaan, omdat er verwacht werd dat er geen studies te vinden waren die antwoord geven op deze vraag, specifiek voor de Nederlandse situatie. Er worden dan ook geen conclusies vermeld. De aanbevelingen bij deze uitgangsvragen zijn uitsluitend gebaseerd op overwegingen die zijn opgesteld door de werkgroepleden op basis van kennis uit de praktijk en waar mogelijk onderbouwd door (niet-systematisch) literatuuronderzoek.
De werkgroep heeft gedurende 14 maanden gewerkt aan de tekst van de conceptrichtlijn. Alle teksten zijn tijdens plenaire vergaderingen besproken en na verwerking van de commentaren door de werkgroep geaccordeerd. De conceptrichtlijn is eind mei 2016 ter becommentariëring aangeboden op http://pallialine.nl/ en aan alle voor de knelpuntenanalyse benaderde wetenschappelijke, beroeps- en patiëntenverenigingen en de landelijke en regionale werkgroepen. Het commentaar geeft input vanuit het veld om de kwaliteit en de toepasbaarheid van de conceptrichtlijn te optimaliseren en landelijk draagvlak voor de richtlijn te genereren. Alle commentaren worden vervolgens beoordeeld en verwerkt door de richtlijnwerkgroep. Aan de commentatoren is teruggekoppeld wat met de reacties is gedaan.
Waarna de richtlijn inhoudelijk is vastgesteld. Tenslotte is de richtlijn ter autorisatie/accordering gestuurd naar de betrokken verenigingen/instanties.
Knelpunteninventarisatie
De uitkomsten van de knelpunteninventarisatie ziet u via onderstaande drie hyperlinken:
- Gegevens enquête professionals Nierfalen
- Subanalyse resondentengroep Anders_Nierfalen enquête professionals - Respondenten die bij de vraag naar ‘specialistische registratie’ het antwoord ‘anders’ hebben ingevuld. De voor hen relevante registratie stond niet bij de keuzemogelijkheden (6% van totaal aantal respondenten)
- Gegevens Patientenenquête Nierfalen
Methode ontwikkeling
Elk hoofdstuk van de richtlijn bestaat uit een richtlijntekst. De teksten naar aanleiding van de uitgangsvragen zijn opgebouwd volgens het volgende vaste stramien: uitgangsvraag en aanbevelingen, literatuurbespreking, conclusies en overwegingen. De referenties zijn aangeleverd per hoofdstuk (of paragraaf) en de evidence tabellen staan in bijlage 9. De antwoorden op de uitgangsvragen (derhalve de aanbevelingen in deze richtlijn) zijn voor zover mogelijk gebaseerd op gepubliceerd wetenschappelijk onderzoek.
De hoofdstukken zijn via de evidence based systematische methodiek uitgewerkt (hoofdstuk 2, 3 en 4). Alleen hoofdstuk 1 (organisatie van zorg) is zonder systematisch literatuuronderzoek uitgewerkt omdat de werkgroep verwachtte geen studies te vinden die antwoord geven op de vraag, specifiek voor de Nederlandse situatie.
De GRADE-methodiek
Hoofdstukken 2, 3 en 4 zijn via de evidence based GRADE methodiek uitgewerkt.
Selectie
Naast de selectie op relevantie werd tevens geselecteerd op bewijskracht. Hiervoor werd gebruik gemaakt van de volgende hiërarchische indeling van studiedesigns gebaseerd op bewijskracht:
- Gerandomiseerde gecontroleerde studies (RCT's)
- Niet gerandomiseerde gecontroleerde studies (CCT's)
Waar deze niet voorhanden waren, werd verder gezocht naar vergelijkend cohortonderzoek.
Critical appraisal
De kwaliteit van bewijs wordt weergegeven in vier categorieën: hoog, matig, laag en zeer laag. RCT's starten hoog en observationele studies starten laag. Vijf factoren verlagen de kwaliteit van de evidentie (beperkingen in onderzoeksopzet, inconsistentie, indirectheid, imprecisie, publicatie bias) en drie factoren kunnen de kwaliteit van de evidentie verhogen (sterke associatie, dosis-respons relatie, plausibele (residuele) confounding) (zie tabel 1).
Tabel 1. GRADE-methodiek voor het graderen van bewijs
|
Quality of evidence |
Study design |
Lower if * |
Higher if * |
|
High (4) |
Randomized trial |
Study limitations -1 Serious -2 Very serious Inconsistency -1 Serious -2 Very serious Indirectness -1 Serious -2 Very serious Imprecision -1 Serious -2 Very serious Publication bias -1 Likely -2 Very likely |
Large effect + 1 Large + 2 Very large Dose response + 1 Evidence of a gradient All plausible confounding + 1 Would reduce a demonstrated effect, or + 1 Would suggest a spurious effect when results show no effect |
|
Moderate (3) |
|
||
|
Low (2)
|
Observational study |
||
|
Very low (1) |
|
Algehele kwaliteit van bewijs
Omdat het beoordelen van de kwaliteit van bewijs in de GRADE-benadering per uitkomstmaat geschiedt, is er behoefte aan het bepalen van de algehele kwaliteit van bewijs. Zowel voor als na het literatuuronderzoek wordt door de richtlijnwerkgroep bepaald welke uitkomstmaten cruciaal, belangrijk en niet belangrijk zijn.
Het niveau van de algehele kwaliteit van bewijs wordt in principe bepaald door de cruciale uitkomstmaat met de laagste kwaliteit van bewijs. Als echter de kwaliteit van het bewijs verschilt tussen de verschillende cruciale uitkomstmaten zijn er twee opties:
- De uitkomstmaten wijzen in verschillende richtingen (zowel gewenst als ongewenste effecten) of de balans tussen gewenste en ongewenste effecten is onduidelijk, dan bepaalt de laagste kwaliteit van bewijs van de cruciale uitkomstmaten de algehele kwaliteit van bewijs;
- De uitkomstmaten in dezelfde richting wijzen (richting gewenst of richting ongewenst effecten), dan bepaalt de hoogste kwaliteit van bewijs van de cruciale uitkomstmaat dat op zichzelf voldoende is om de interventie aan te bevelen de algehele kwaliteit van bewijs.
Tabel 2. Formulering conclusies op basis van kwaliteit van bewijs per uitkomstmaat
|
Kwaliteit van bewijs |
Interpretatie |
Formulering conclusie |
|
Hoog |
Er is veel vertrouwen dat het werkelijk effect dicht in de buurt ligt van de schatting van het effect. |
Er is bewijs van hoge kwaliteit dat...
(Referenties) |
|
Matig |
Er is matig vertrouwen in de schatting van het effect: het werkelijk effect ligt waarschijnlijk dicht bij de schatting van het effect, maar er is een mogelijkheid dat het hier substantieel van afwijkt. |
Er is bewijs van matige kwaliteit dat...
(Referenties) |
|
Laag |
Er is beperkt vertrouwen in de schatting van het effect: het werkelijke effect kan substantieel verschillend zijn van de schatting van het effect. |
Er is bewijs van lage kwaliteit dat....
(Referenties) |
|
Zeer laag |
Er is weinig vertrouwen in de schatting van het effect: het werkelijke effect wijkt waarschijnlijk substantieel af van de schatting van het effect. |
Er is bewijs van zeer lage kwaliteit dat....
(Referenties) |
|
Formulering algehele kwaliteit van bewijs: hoog/matig/laag/zeer laag |
||
Methode voor het formuleren van ‘Overwegingen’
Naast de evidence uit de literatuur (conclusies) zijn er andere overwegingen die meespelen bij het formuleren van de aanbeveling. Deze aspecten worden besproken onder het kopje ‘Overwegingen' in de richtlijntekst. Hierin worden de conclusies (op basis van de literatuur) geplaatst in de context van de dagelijkse praktijk en vindt een afweging plaats van de voor- en nadelen van de verschillende beleidsopties. De uiteindelijk geformuleerde aanbeveling is het resultaat van de conclusie(s) in combinatie met deze overwegingen.
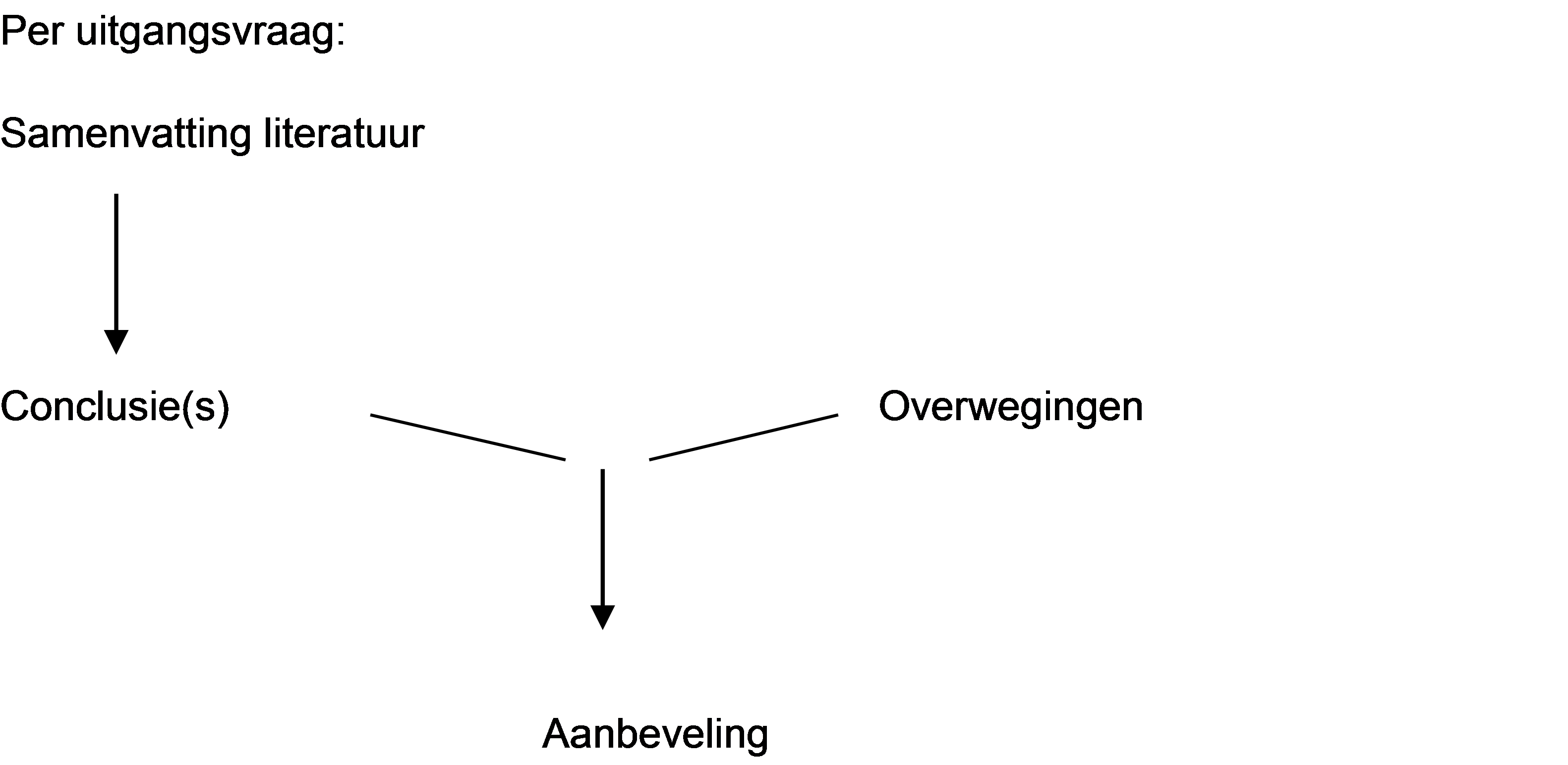
Figuur 1. Van bewijs naar aanbeveling
Bij het schrijven van de overwegingen zijn onderstaande zaken in acht genomen.
- Kwaliteit van het bewijs
Hoe hoger de algehele kwaliteit van het bewijs, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling. - Balans van gewenste en ongewenste effecten
Hoe groter het verschil is tussen de gewenste en ongewenste effecten, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling. Hoe kleiner dit verschil of hoe meer onzekerheid over de grootte van het verschil, des te waarschijnlijker wordt het formuleren van een conditionele aanbeveling.
Toelichting:- Bespreken effectiviteit in relatie tot bijwerkingen en complicaties in het licht van de kwaliteit van bewijs, de precisie van de effectgrootte en minimaal klinisch relevant geacht voordeel.
- Sterkte van het effect vergeleken met geen interventie.
- Aanwezigheid van comorbiditeit.
- Klinisch niet relevantie van het effect.
- Patiëntenperspectief
Hoe groter de uniformiteit in waarden en voorkeuren van patiënten bij het afwegen van de voor- en nadelen van een interventie, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling. - Professioneel perspectief
Hoe groter de uniformiteit in waarden en voorkeuren van professionals ten aanzien van de toepasbaarheid van een interventie, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling.
Toelichting:- Kennis en ervaring met technieken/therapieën.
- Risico’s die professional loopt bij het toepassen van de interventie.
- Verwachte tijdbesparing.
- Verlies aan tijd door het invoeren van de interventie.
N.B.: de hierna volgende factoren (5, 6 en 7) alleen evalueren als een positief geformuleerde aanbeveling wordt overwogen! Een positief geformuleerde aanbeveling is een aanbeveling waarbij een bepaalde interventie wel ‘dient’ plaats te vinden (sterk) of wel ‘kan worden overwogen’ (zwak/conditioneel). Als dat daarentegen juist niet het geval is, is sprake van een negatief geformuleerde aanbeveling.
- Middelenbeslag
Hoe minder middelen er worden gebruikt (m.a.w. hoe lager de kosten van een interventie zijn vergeleken met de beschouwde alternatieven en andere kosten gerelateerd aan de interventie), des te waarschijnlijker wordt het formuleren van een sterke aanbeveling. Hoe meer onzekerheid over het middelenbeslag, des te waarschijnlijker wordt een conditionele aanbeveling.
- Organisatie van zorg
Hoe meer onzekerheid of de geëvalueerde interventie daadwerkelijk op landelijke schaal toepasbaar is, des te waarschijnlijker wordt het formuleren van een conditionele aanbeveling.
Toelichting:- De beschikbaarheid/aanwezigheid van faciliteiten & medicijnen.
- De wijze waarop de organisatie van de zorg aangeboden dient te worden/grootte van de verandering in de organisatie-zorgproces/infrastructuur voor implementatie.
- Voorbeeld: een bepaalde diagnostiek of behandeling kan alleen in bepaalde centra worden uitgevoerd in verband met de aanwezigheid van faciliteiten zoals een PET scan.
- Maatschappelijk perspectief
(Juridische overwegingen/ethische overwegingen/industriële belangen/vergoeding door verzekeraars/politieke en strategische consequenties)
Hoe groter de onzekerheid hierover is, des te waarschijnlijker wordt het formuleren van een conditionele aanbeveling.
Toelichting:
Indien twee behandelingen even effectief zijn waarvan één behandeling wordt vergoed, zal deze laatste behandeling mogelijk de voorkeur hebben.
Methode voor het formuleren van aanbevelingen
GRADE kent twee soorten aanbevelingen: sterke aanbevelingen of conditionele (zwakke) aanbevelingen. De sterkte van aanbevelingen reflecteert de mate van vertrouwen waarin – voor de groep patiënten waarvoor de aanbevelingen zijn bedoeld - de gewenste effecten opwegen tegen de ongewenste effecten.
Formulering:
- Sterke aanbevelingen: Er dient…. te worden gegeven/gedaan
- Zwakke/conditionele aanbevelingen: Overweeg….. te geven/te doen.
Methodiek bij de uitgangsvraag zonder systematisch literatuuronderzoek
Bij uitgangsvraag 1 (organisatie van zorg) is geen systematisch literatuuronderzoek verricht omdat de werkgroep verwachtte geen studies te vinden die antwoord geven op de vraag, specifiek voor de Nederlandse situatie. Er zijn dan ook geen conclusies vermeld.
De aanbevelingen zijn uitsluitend gebaseerd op overwegingen die zijn opgesteld door de werkgroepleden op basis van kennis uit de praktijk en waar mogelijk onderbouwd door (niet systematisch) literatuuronderzoek.
De teksten zijn gebaseerd op evidence, maar de artikelen zijn niet methodologisch beoordeeld.
Methode voor het formuleren van ‘Overwegingen'
Bij uitgangsvraag 1 (organisatie van zorg) zijn de aanbevelingen uitsluitend gebaseerd op overwegingen die zijn opgesteld door de werkgroepleden op basis van kennis uit de praktijk en waar mogelijk onderbouwd door (niet systematisch) literatuuronderzoek. De overwegingen staan onder een apart kopje in de richtlijntekst. Hierin wordt de context van de dagelijkse praktijk beschreven en vindt een afweging plaats van de voor- en nadelen van de verschillende beleidsopties.
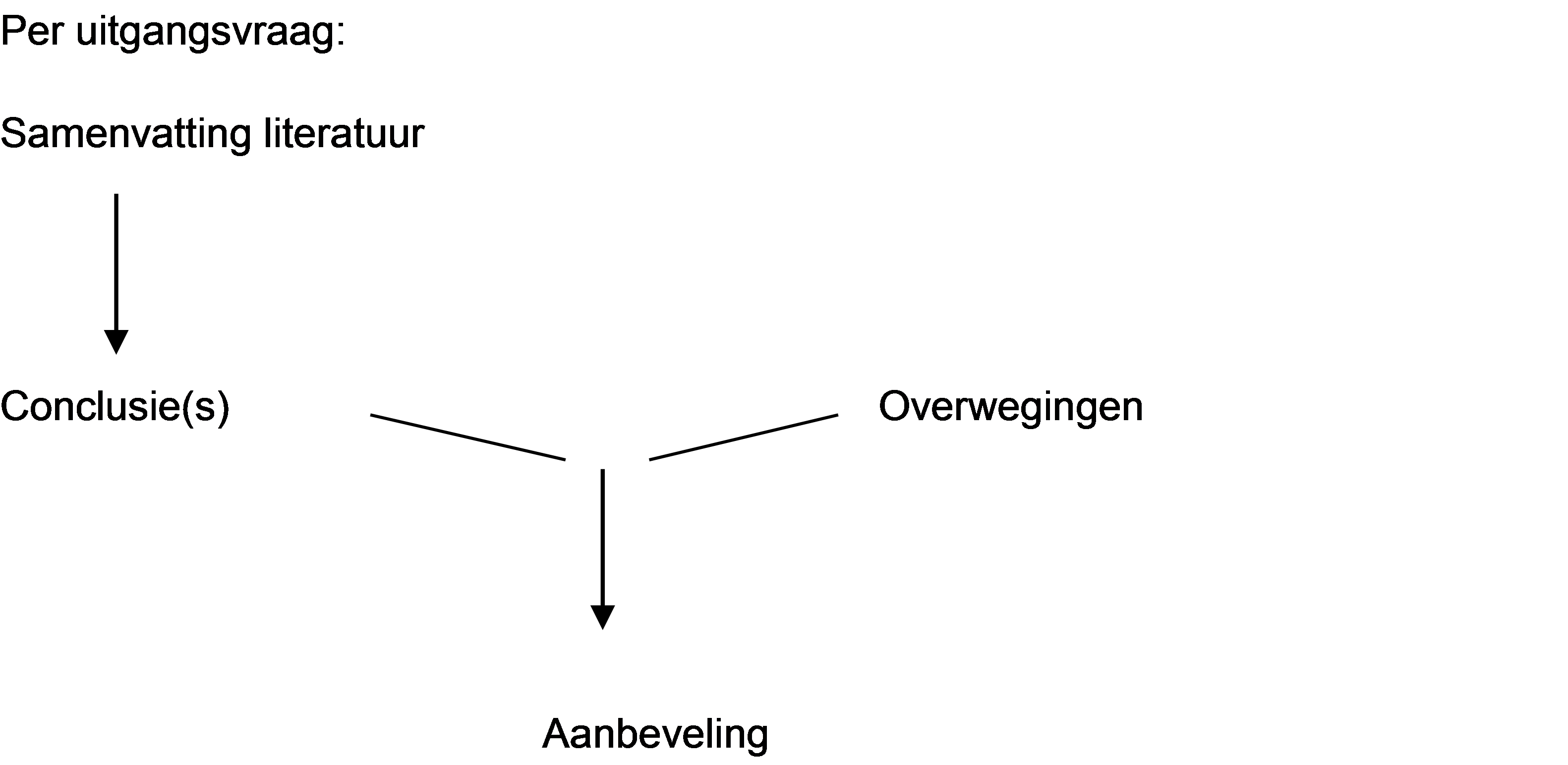
Figuur 1. Van bewijs naar aanbeveling
Bij het schrijven van de overwegingen zijn onderstaande zaken in acht genomen.
- Kwaliteit van het bewijs
Hoe hoger de algehele kwaliteit van het bewijs, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling. - Balans van gewenste en ongewenste effecten
Hoe groter het verschil is tussen de gewenste en ongewenste effecten, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling. Hoe kleiner dit verschil of hoe meer onzekerheid over de grootte van het verschil, des te waarschijnlijker wordt het formuleren van een conditionele aanbeveling.
Toelichting:- Bespreken effectiviteit in relatie tot bijwerkingen en complicaties in het licht van de kwaliteit van bewijs, de precisie van de effectgrootte en minimaal klinisch relevant geacht voordeel.
- Sterkte van het effect vergeleken met geen interventie.
- Aanwezigheid van comorbiditeit.
- Klinisch niet relevantie van het effect.
- Patiëntenperspectief
Hoe groter de uniformiteit in waarden en voorkeuren van patiënten bij het afwegen van de voor- en nadelen van een interventie, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling. - Professioneel perspectief
Hoe groter de uniformiteit in waarden en voorkeuren van professionals ten aanzien van de toepasbaarheid van een interventie, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling.
Toelichting: - Kennis en ervaring met technieken/therapieën.
- Risico’s die professional loopt bij het toepassen van de interventie.
- Verwachte tijdbesparing.
- Verlies aan tijd door het invoeren van de interventie.
N.B.: de hierna volgende factoren (5, 6 en 7) alleen evalueren als een positief geformuleerde aanbeveling wordt overwogen! Een positief geformuleerde aanbeveling is een aanbeveling waarbij een bepaalde interventie wel ‘dient’ plaats te vinden (sterk) of wel ‘kan worden overwogen’ (zwak/conditioneel). Als dat daarentegen juist niet het geval is, is sprake van een negatief geformuleerde aanbeveling.
- Middelenbeslag
Hoe minder middelen er worden gebruikt (m.a.w. hoe lager de kosten van een interventie zijn vergeleken met de beschouwde alternatieven en andere kosten gerelateerd aan de interventie), des te waarschijnlijker wordt het formuleren van een sterke aanbeveling. Hoe meer onzekerheid over het middelenbeslag, des te waarschijnlijker wordt een conditionele aanbeveling. - Organisatie van zorg
Hoe meer onzekerheid of de geëvalueerde interventie daadwerkelijk op landelijke schaal toepasbaar is, des te waarschijnlijker wordt het formuleren van een conditionele aanbeveling.
Toelichting: - De beschikbaarheid/aanwezigheid van faciliteiten & medicijnen.
- De wijze waarop de organisatie van de zorg aangeboden dient te worden/grootte van de verandering in de organisatie-zorgproces/infrastructuur voor implementatie.
- Voorbeeld: een bepaalde diagnostiek of behandeling kan alleen in bepaalde centra worden uitgevoerd in verband met de aanwezigheid van faciliteiten zoals een PET scan.
- Maatschappelijk perspectief
(Juridische overwegingen/ethische overwegingen/industriële belangen/vergoeding door verzekeraars/politieke en strategische consequenties)
Hoe groter de onzekerheid hierover is, des te waarschijnlijker wordt het formuleren van een conditionele aanbeveling.
Toelichting:
Indien twee behandelingen even effectief zijn waarvan één behandeling wordt vergoed, zal deze laatste behandeling mogelijk de voorkeur hebben.
