Hyperbare zuurstoftherapie bij NWDI
Uitgangsvraag
Is er een indicatie voor hyperbare zuurstof bij de behandeling van NWDI?
Aanbeveling
Overweeg hyperbare zuurstoftherapie bij de behandeling van necrotiserende wekedeleninfecties nadat adequate chirurgische necrotectomie is uitgevoerd indien een HBO-centrum nabij beschikbaar is.
Overwegingen
Door lage incidentie van NWDI’s en het feit dat dit vaak hemodynamisch niet-stabiele patiënten in een IC setting zijn, zijn er geen prospectieve studies met voldoende patiëntenaantallen. Omdat er twee zeer recente Cochrane reviews beschikbaar waren, zijn deze als basis gebruikt voor de zoekstrategie. Hierin zijn geen geschikte referenties gevonden omdat zij uitgaan van alle gerandomiseerde en pseudogerandomiseerde studies die de effecten van hyperbare zuurstoftherapie analyseerden. Er werden retrospectieve studies geïncludeerd waarbij vergelijking mogelijk was tussen wel en niet met HBO behandelde patiënten en waarbij ten minste meer dan drie patiënten per jaar met HBO behandeld waren. Op basis van theoretische gronden lijkt HBO-therapie meer voordeel te bieden bij patiënten met NWDI op basis van anaërobe verwekkers.
In veel van de beschikbare studies is onduidelijk welke behandeling patiënten voorafgaand aan de transfer naar het centrum met HBO-capaciteit kregen en of er sprake was van een delay in de eerste chirurgische behandeling. Uit eerdere studies blijkt dat een delay voor eerste necrotectomie van meer dan 24 uur leidt tot een hogere mortaliteit (Endorf, 2008; Holena, 2011).
Patiënten met NWDI’s zijn ernstig ziek en worden vaak in een IC-setting verpleegd; dit stelt bijzondere eisen aan monitoring en transport van deze patiënten naar een HBO-faciliteit. In de regel zal behandeling van deze patiënten met HBO alleen mogelijk zijn in een faciliteit die zich in het ziekenhuis en nabij de IC bevindt (korte transportwegen) en die geschikt is qua grootte, toegang en uitrusting voor een IC-patiënt met bed, ventilator, monitor en eventueel perfusiepompen. In Europa bestaan deze mogelijkheden onder andere in Noorwegen (Oslo, Bergen), Zweden (Stockholm), Duitsland (Murnau), Frankrijk (Lille) en er is internationaal goede ervaring in de HBO-behandeling van patiënten in een IC-setting. HBO-therapie is in Nederland op dit moment in tien centra voorhanden, vijf van deze centra bevinden zich in een ziekenhuis.
Toepassing van HBO-behandeling mag uiteraard nooit leiden tot een delay in de chirurgische necrotectomie. Indien er een HBO-centrum op korte afstand van de IC beschikbaar is, dat tevens geschikt is voor dit type patiënt, biedt adjuvante HBO-therapie een aantal theoretische voordelen, die in retrospectieve studies ook gevonden worden. Uiteraard dient voldoende opgeleid en gekwalificeerd hyperbaar personeel bij de HBO-kamer aanwezig te zijn en de behandeling vindt plaats in aanwezigheid van de hyperbaar arts in samenwerking met en onder verantwoording van een intensivist en IC-verpleegkundige die hiervoor speciaal getraind zijn.
Mits in de juiste setting en door ervaren behandelteams toegepast, leidt HBO-behandeling bij IC-behoeftige patiënten niet tot extra complicaties. Bij patiënten met verlaagd bewustzijn die niet kunnen klaren, moet overwogen worden vooraf een paracentese of trommelvliesbuisjes te geven (Kot, 2015; Mathieu, 2015; Lind, 2015).
Gezien het ontbreken van prospectief gerandomiseerd onderzoek, maar de beschikbaarheid van multiple retrospectieve cohortstudies waarvan een groot deel een tendens laat zien ten faveure van HBO-behandeling, kunnen we met de criteria van Bradford Hill toch een waarde-inschatting maken (Evans, 2015; Hill, 1965).
Onderbouwing
Achtergrond
Hyperbare zuurstof (HBO)-therapie kan door het ademen van 100% zuurstof onder druk zeer hoge partiële zuurstofspanningen in ischemisch weefsel geven. Op theoretische gronden wordt verwacht dat weefselhypoxie, zoals die optreedt bij necrotiserende wekedeleninfecties (NWDI’s), opgeheven kan worden. Daarnaast kunnen de bactericide activiteit van fagocyten en de werking van bepaalde antibiotica verbeterd worden en kunnen anaërobe bacteriën in dit zeer zuurstofrijke milieu worden gedood. Na het verdwijnen van de infectie kan hyperbare zuurstoftherapie de wondgenezing verbeteren. In deze module wordt uitgezocht of hyperbare zuurstoftherapie een plek heeft in de behandeling van patiënten met NWDI.
Conclusies
|
Zeer laag GRADE |
Er zijn voorzichtige aanwijzingen dat er een lagere mortaliteit is bij patiënten met NWDI die adjuvante HBO-therapie hebben gekregen ten opzichte van de patiënten met NWDI die geen HBO-therapie hebben gekregen.
Bronnen (Li, 2015; Shaw, 2014; Soh, 2012; Wilkinson, 2004; Hollabaugh, 1999; Shupak, 1995; Brown, 1994; Riseman, 1990) |
|
Zeer laag GRADE |
Het is onduidelijk of HBO-therapie het aantal benodigde necrotectomieën beïnvloedt.
Bronnen (Li, 2015; Shupak, 1995; Brown, 1994; Riseman, 1990) |
|
Zeer laag GRADE |
Er zijn voorzichtige aanwijzingen dat de opnameduur voor de groep die adjuvante HBO-therapie heeft gekregen niet verschilt van de groep die geen HBO-therapie heeft gekregen.
Bronnen (Li, 2015; Soh, 2012; Shaw, 2012; Shupak, 1995) |
|
Zeer laag GRADE |
Er zijn voorzichtige aanwijzingen dat de groep die adjuvante HBO-therapie heeft gekregen minder NWDI-gerelateerde complicaties heeft dan de groep die geen HBO-therapie heeft gekregen.
Bronnen (Shaw, 2014; SOH, 2012) |
Samenvatting literatuur
Beschrijving studies
Alle geïncludeerde studies betreffen observationele retrospectieve studies waarbij HBO-therapie is vergeleken met de standaard zorg bij NWDI of gangreen van Fournier. De follow-up van de studies varieerde van 2 maanden tot 21 jaar. In de interventiegroep was de gemiddelde leeftijd 55 ± 7 jaar en het gemiddelde percentage man was 72 ± 20 procent. In de controlegroep was de gemiddelde leeftijd 56 ± 5 jaar en het gemiddelde percentage man was 76 ± 20 procent.
In de retrospectieve studie van Li (2015) werden in een periode van 10 jaar 28 patiënten met Fourniers gangreen (FG) geanalyseerd. Er werden 16 patiënten met HBO en 12 patiënten zonder HBO behandeld. In deze studie zijn alleen mannen geïncludeerd. De gemiddelde leeftijd was in de interventiegroep 46,13 jaar ± 13,11 en in de controlegroep 48,42 jaar ± 15,31.
De studie van Shaw (2014) is een retrospectieve cohortstudie, waarin 1583 patiënten met NWDI 2 jaar lang werden geanalyseerd in de Verenigde Staten. Alleen centra met HBO-mogelijkheid werden uitgevraagd. Van de totale groep werden 117 (7%) patiënten met HBO behandeld. De gemiddelde leeftijd en percentage man waren respectievelijk 56 jaar (range 50 tot 64) en 71% man in de interventiegroep en 54 jaar (range 44 tot 64) en 98% man in de controlegroep.
In de studie van Soh (2012) werden retrospectief over 20 jaar 45.193 patiënten met NWDI geanalyseerd in de Verenigde Staten. Hier werd bij 405 patiënten HBO toegepast (<1% van het totaal). De gemiddelde leeftijd en percentage man waren respectievelijk 54 jaar en 60% man in de interventiegroep en 56 jaar en 65,1% man in de controlegroep.
In de studie van Wilkinson (2004) werden in een tertiair ziekenhuis in Australië met HBO-mogelijkheid voor IC-patiënten retrospectief over 5 jaar 44 patiënten met NWDI geanalyseerd. Er werden 33 patiënten met HBO en 11 patiënten zonder HBO behandeld. De gemiddelde leeftijd was voor de hele groep 56,5 jaar en 68 % was man.
In de studie van Hollabaugh (1999) werden 26 patiënten met gangreen van Fournier in een tertiair universiteitsziekenhuis in de Verenigde Staten geanalyseerd. Er werden 14 patiënten met HBO en 12 patiënten zonder HBO behandeld. Alle patiënten waren man. De gemiddelde leeftijd van de hele groep was 57 jaar (range 26 tot 87).
In de Israëlische studie van Shupak (1995) werden retrospectief in een periode van 10 jaar 37 patiënten met NWDI geanalyseerd. Er werden 25 patiënten met HBO en 12 zonder HBO behandeld. De gemiddelde leeftijd en percentage man waren respectievelijk 54 jaar en 60% man in de interventiegroep en 56 jaar en 65% man in de controlegroep.
In de Canadese retrospectieve studie van Brown (1994) werden 54 patiënten met NWDI geanalyseerd, er werden 30 patiënten met HBO en 24 patiënten zonder HBO behandeld. De gemiddelde leeftijd en percentage man waren respectievelijk 51,3 jaar ± 17,1 en 73% man in de interventiegroep en 61,1 jaar ± 12,6 en 54% man in de controlegroep.
In de studie van Riseman (1980 tot 1990) werden 29 patiënten met gangreen van Fournier onderzocht. In deze populatie werden 17 patiënten behandeld met HBO en 12 patiënten werden zonder HBO behandeld. De gemiddelde leeftijd en het percentage man waren respectievelijk 68,5 jaar (range 41-88) en 58% man in de interventiegroep en 59,7 jaar (range 14 tot 82) en 65% man in de controlegroep.
Resultaten mortaliteit
Mortaliteit is onderzocht in alle geïncludeerde studies (Li, 2015; Shaw, 2014; Soh, 2012; Wilkinson, 2004; Hollabaugh, 1999; Shupak,1995; Brown, 1994; Riseman, 1990).
De meeste studies hebben de percentages mortaliteit berekend en onderzocht of deze significant verschillend waren in de groep patiënten die HBO-therapie hebben gekregen ten opzichte van patiënten die geen HBO-therapie hebben gekregen. Op één studie na (Shupak, 1995) vonden alle studies verschillen in mortaliteit in het voordeel van de groep die HBO-therapie heeft gekregen ten opzichte van de groep die geen HBO-therapie heeft gekregen (Shaw, 2014; Soh, 2012; Wilkinson, 2004; Hollabaugh, 1999; Brown, 1994; Riseman, 1990).
De risk ratio van deze studies kon worden berekend en daarmee kon de data van mortaliteit worden gepoold. De meta-analyse van deze resultaten laat zien dat mortaliteit lager is in de groep die HBO-therapie heeft gekregen ten opzichte van de groep die geen HBO-therapie heeft gekregen. Risk Ratio=0,47; 95%-BI: 0,35 tot 0,64; I2= 22% (zie figuur 1).
Bij de gepoolde data is een aantal kanttekeningen waar rekening mee dient te worden gehouden. Het zijn niet-gerandomiseerde retrospectieve studies. Hierbij bestaat een groot risico voor selectiebias; dat wil zeggen dat HBO met name is aangeboden indien de behandelaar dat verstandig achtte. Op drie studies (Shaw, 2014; Soh, 2012; Hollabaugh, 1996) na, is er niet gecorrigeerd voor confounding, wat een belangrijke voorwaarde is voor het analyseren van observationele data.
Figuur 1 Forest plot van een meta-analyse waarin het effect van HBO op mortaliteit is gepresenteerd
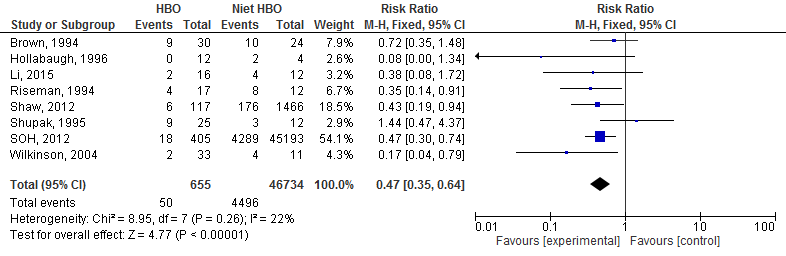
De studie van Shaw (2014) heeft univariate data gepresenteerd waarbij mortaliteit is onderzocht bij zeer ernstig zieke patiënten. In de multivariate analyses hebben zij de odds ratio voor overlijden zonder HBO-therapie berekend. In deze analyse zijn wel alle categorieën van de mate van ernst van ziekte meegenomen en daarom niet te vergelijken met de univariate analyse. De odds ratio was 10,6 [95% BI 5,23 tot 25,1].
De studie van Soh (2012) is gecorrigeerd voor confounding en de odds op overlijden zijn multivariaat geanalyseerd. De odds en het 95% betrouwbaarheidsinterval van de ongecorrigeerde analyse en de multivariate analyse liggen dicht bij elkaar, respectievelijk 0,44 [95% BI 0,28 tot 0,71], 0,49 [95% BI 0,29 tot 0,83]. Daarbij is de risk ratio nagenoeg gelijk aan de odds ratio. Om die reden is de studie van Soh (2012) wel meegenomen in de gepoolde analyse.
De studie van Hollabaugh (1996) heeft door middel van logistische regressie het relatieve risico op overleven onderzocht. Het relatieve risico op overleven is 9 maal groter in de groep die HBO-therapie heeft gekregen ten opzichte van de groep die geen HBO-therapie heeft gekregen (p=0,062). Na het corrigeren voor leeftijd als confounder is de kans op overleven 11 maal groter. Deze studie geeft aan dat dit een significant verschil is, maar presenteert geen p-waarde. Een kanttekening hierbij is dat deze studie waarschijnlijk de odds heeft berekend in plaats van het relatieve risico. Daarbij zijn geen spreidingsmaten gepresenteerd. Dit maakt het onmogelijk om de uitkomsten voor deze uitgangsvraag voldoende te interpreteren.
Eén studie (Wilkinson, 2014) heeft door middel van survivalanalyses de overlevingskans onderzocht van de groep die HBO-therapie heeft gekregen ten opzichte van de groep die geen HBO-therapie heeft gekregen. Hierbij geven zij aan dat de HBO-groep op lange termijn een grotere overlevingskans heeft ten opzichte van de niet-HBO-groep (p=0,002). Echter, de Hazard ratio en de spreidingsmaten van de survivalanalyse zijn niet gepresenteerd. Daarbij was de follow-up 100 maanden. Dit maakt het onmogelijk om de uitkomsten voor deze uitgangsvraag voldoende te interpreteren. Wilkinson, 2014 presenteert het number needed to treat (NNT) van 3.
Mortaliteit in subgroepen
De studie van Soh (2012) heeft mortaliteit in twee subgroepen onderzocht, waarbij rekening is gehouden met confounding. De eerste groep zijn patiënten gediagnosticeerd met spiernecrose (=myonecrose) door de bacterie Clostridium sp. De odds voor mortaliteit zijn onderzocht bij patiënten die HBO-therapie hebben gekregen ten opzichte van patiënten die geen HBO-therapie hebben gekregen 1,16 [0,45 tot 2,98]. Echter, er waren minder dan 10 patiënten in de HBO-groep. Daarom zijn de resultaten niet goed te interpreteren voor onze uitgangsvraag. Ook is de odds ratio op overlijden onderzocht bij een groep patiënten waarbij Clostridium spp niet de veroorzaker van NWDI was, 0,38 [95%BI 0,20 tot 0,73].
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat mortaliteit is gestart op laag gezien de observationele studieopzet. Daarnaast is de bewijskracht met één niveau verlaagd gezien het geringe aantal incidenten in de interventiegroep (imprecisie). De uitkomsten van de subgroepen zijn niet gegradeerd omdat er te weinig data beschikbaar was, noch was het duidelijk of de gepresenteerde subgroepen a priori aan de studieopzet zijn opgesteld.
Aantal necrotectomieën
Vier studies (Li, 2015; Shupak, 1995; Brown, 1994; Riseman, 1990) hebben het aantal necrotectomieën vergeleken tussen de groep die HBO-therapie heeft gekregen en de groep die geen HBO-therapie heeft gekregen. Twee studies (Li, 2015; Riseman, 1990) lieten een significant lager aantal necrotectomieën in de HBO-groep zien, terwijl de andere twee studies juist een significant hoger aantal necrotectomieën in de HBO-groep zien. Het gemiddelde van necrotectomieën uit de verschillende groepen kon niet worden gepoold omdat de data te heterogeen was.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat necrotectomie is gestart op laag gezien de observationele studieopzet. Daarna is de bewijskracht verder verlaagd gezien de ernstige heterogeniteit (inconsistentie).
Opnameduur
Vier studies (Li,2015; Soh, 2012; Shaw, 2012; Shupak, 1995) hebben het verschil onderzocht in aantal dagen dat patiënten zijn opgenomen. De resultaten waren niet eenduidig. Studies toonden zowel een kortere ligduur voor de interventiegroep als de controlegroep aan. De studie van Shupak (2012) vond een gemiddelde van 15,9 ± 6,4 dagen in de HBO-groep en 20,0 ± 13,8 in de niet-HBO-groep. De studie van Shaw (2012) vond een mediaan van 16 dagen [IQR 11-23] in de HBO-groep en een mediaan van 14 dagen [IQR 8-23] in de niet-HBO-groep (p= 0,049). De studie van Soh (2012) vond 14,1 [95 % BI 12,9 tot 15,4] dagen in de HBO-groep en 10,7 [95% BI 10,6 tot 10,9] in de niet-HBO groep (p=0,001). Eén studie vond geen verschil (Li, 2015: 31,44± 12,51 vs. 31,24 ± 14,47).
Vanwege de heterogeniteit en de onderzoeksopzet konden de data niet worden gepoold.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat opnameduur is gestart op laag gezien de observationele studieopzet. Daarna is de bewijskracht verder verlaagd gezien de ernstige heterogeniteit (inconsistentie).
Resultaten complicaties
De studie van Shaw (2014) laat zien dat de patiënten met een zeer ernstige NWDI in de HBO-groep minder complicaties ondervonden in vergelijking met de niet-HBO groep (45% vs. 66%, p<0,01). De studie van Soh (2012) geeft aan dat geen van de patiënten die HBO-therapie hebben gekregen, daaraan gerelateerde complicaties hebben ondervonden (barotrauma van de oren, seizures, pneumothorax, hypoglycemia). Wel vonden zij een significant verschil tussen beide groepen in complicaties gerelateerd aan NWDI; 32,4 % patiënten in de HBO-groep versus 37,2 % patiënten in de niet-HBO groep (p=0,04). Beide studies specificeren niet wat onder complicaties gerelateerd aan NWDI wordt verstaan. Deze uitkomstmaat kon niet worden gegradeerd.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende wetenschappelijke vraagstellingen:
Wat zijn de (on)gunstige effecten van adjuvante behandeling met hyperbare zuurstof na eerste necrotectomie bij patiënten met NWDI ten opzichte van geen behandeling met hyperbare zuurstof?
P: patiënt met NWDI die een eerste necrotectomie hebben ondergaan;
I: hyperbare zuurstofbehandeling;
C: geen hyperbare zuurstofbehandeling;
O: mortaliteit, morbiditeit, aantal/volume necrotectomieën, aantal IC-ligdagen en aantal hospitalisatiedagen.
Wat zijn de (on)gunstige effecten van adjuvante behandeling met hyperbare zuurstof na de eerste necrotectomie bij patiënten met NWDI en diabetes mellitus ten opzichte van geen behandeling met hyperbare zuurstof?
P: patiënten met NWDI en DM die een eerste necrotectomie hebben ondergaan;
I: hyperbare zuurstofbehandeling;
C: geen hyperbare zuurstofbehandeling;
O: mortaliteit, morbiditeit, aantal/volume necrotectomieën, aantal IC-ligdagen en aantal hospitalisatiedagen.
Hebben NWDI’s met bepaalde bacteriën meer baat bij hyperbare zuurstoftherapie dan andere, bijvoorbeeld infecties met Clostridium perfringens (gasgangreen)?
P: patiënten met NWDI door Clostridium sp die een eerste necrotectomie hebben ondergaan;
I: hyperbare zuurstofbehandeling;
C: geen hyperbare zuurstofbehandeling;
O: mortaliteit, morbiditeit, aantal/volume necrotectomieën, aantal IC-ligdagen en aantal hospitalisatiedagen.
Relevante uitkomstmaten
De werkgroep achtte mortaliteit een voor de besluitvorming kritieke uitkomstmaat; en hospitalisatieduur een voor de besluitvorming belangrijke uitkomstmaat.
Zoekverantwoording
In de databases Medline (OvidSP) en EMBASE (OvidSP) is met relevante zoektermen gezocht naar een indicatie voor adjuvante behandeling met hyperbare zuurstof na eerste necrotectomie. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 284 treffers op.
Studies werden geselecteerd op grond van de volgende selectiecriteria:
- patiënten met NWDI, of patiënten met NWDI en diabetes mellitus, of patiënten met NWDI ten gevolge van de Clostridium-bacterie;
- HBO-therapie is gegeven als interventie;
- primair origineel onderzoek, waarbij te minste één van de volgende uitkomstmaten zijn beschreven: mortaliteit, morbiditeit, aantal necrotectomieën, aantal IC-dagen, aantal hospitalisatiedagen.
Op basis van titel en abstract werden in eerste instantie alleen de Cochrane reviews van Levett (2015) en Yang (2015) geselecteerd en de prospectieve studie van Brink (2014). De Cochrane studies hadden ieder een andere vraagstelling onderzocht. De geïncludeerde studies werden daarom apart nagelopen op relevantie. Zodoende zijn deze geëxcludeerd. De studie van Brink had geen vergelijkende studieopzet en werd op deze grond geëxcludeerd.
Na raadpleging van deze reviews werden acht retrospectieve studies definitief geselecteerd (op basis van de volledige tekst), omdat deze studies informatie gaven over het mogelijke therapeutische effect van HBO. Deze acht studies zijn opgenomen in de literatuuranalyse. De evidencetabellen hiervan en beoordeling van individuele studiekwaliteit kunt u onder het tabblad Onderbouwing vinden.
Referenties
- Brink M, Arnell P, Lycke H, et al. A series of severe necrotising soft-tissue infections in a regional centre in Sweden. Acta Anaesthesiol Scand. 2014;58:882890.
- Brown DR, Davis NL, Lepawsky M, et al. A multicenter review of the treatment of major truncal necrotizing infections with and without hyperbaric oxygen therapy. American Journal of Surgery. 1994;167(5):485-9. [PUBMED:8185032].
- Endorf FW, Klein MB, Mack CD, et al. Necrotizing soft-tissue infections: differences in patients treated at burn centers and non-burn centers. J Burn Care Res. 2008;29:9338.
- Evans DW, Lucas N, Kerry R. Time, space and form: Necessary for causation in health, disease and intervention? Med Health Care and Philos. 2015. DOI 10.1007/s11019-015-9662-5.
- Fourniers Gangrene. Urol Int. 2015;94:453458.
- Hill AB. The Environment and disease: Association or Causation? Royal Soc of Med. 1965;295-300.
- Holena DN, Mills AM, Carr BG, et al. Transfer status: a risk factor for mortality in patients with necrotizing fasciitis. Surgery. 2011;150:36370.
- Hollabaugh RS Jr, Dmochowski RR, Hickerson WL, et al. Fourniers gangrene: therapeutic impact of hyperbaric oxygen. Plastic and Reconstructive Surgery. 1998;101(1):94-100. [PUBMED:9427921].
- Kot J. Staffing and training issues in critical care hyperbaric medicine. Diving hyperb Med. 2015;45(1):47-50.
- Levett D, Bennett MH, Millar I. Adjunctive hyperbaric oxygen for necrotizing fasciitis (Review). The Cochrane of Database of Systematic Reviews. 2015;1:CD007937. DOI:10.1002/14651858.CD007937.pub2.
- Li C, Zhou X, Liu LF, et al. Hyperbaric oxygen therapy as an adjuvant therapy for comprehensive treatment of Lind F. A pro/con review comparing the use of mono- and multiplace hyperbaric chambers for critical care. Diving Hyperb Med. 2015;45(1):56-60.
- Mathieu D, Ratzenhofer-Komenda B, Kot J. Hyperbaric oxygen treatment for intensive care patients: position statement by the European Committee for Hyperbaric Medicine. Diving Hyperb Med. 2015;45(1):42-6.
- Psoinos CM, Flahive JM, Shaw JJ, et al. Contemporary trends in necrotizing soft-tissue infections in the United States. Surg 2013;153(6):819-827.
- Riseman JA, Zamboni WA, Curtis A, et al. Hyperbaric oxygen therapy for necrotizing fasciitis reduces mortality and the need for debridements. Surgery. 1990;108(5):847-50. [PUBMED:2237764]
- Shaw JJ, Psoinos C, Emhoff TA, et al. Not Just Full of Hot Air:?Hyperbaric Oxygen Therapy Increases Survival in Cases of Necrotizing Soft Tissue Infections. Surg Inf. 2014;15(3):328-335.
- Shupak A, Shoshani O, Goldenberg I, et al. Necrotizing fasciitis: an indication for hyperbaric oxygen therapy? Surgery. 1996;118(5):873-8. [PUBMED:7482275].
- Soh CR, Pietrobon R, Freiberger JJ, et al. Hyperbaric oxygen therapy in necrotising soft tissue infections: a study of patients in the United States Nationwide Inpatient Sample. Intensive Care Med. 2012;38:11431151. DOI 10.1007/s00134-012-2558-4.
- Wilkinson D, Doolette D. Hyperbaric Oxygen Treatment and Survival From Necrotizing Soft Tissue Infection. Arch Surg. 2004;139:1339-1345. [PUBMED:1561459].
- Yang Z, Hu J, Qu Y, et al. Interventions for treating gas gangrene (Review). The Cochrane Databae of Systematic Reviews. 2015;CD010577. DOI: 10.1002/14651858.CD010577.pub2.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3 |
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Li, 2015 |
Type of study:
A retrospective study of clinical data
Setting: Xiangya Hospital, Central South University
Country: China
Source of funding:
Not mentioned |
Inclusion criteria:
Diagnostic criteria included erythema or swelling of the scrotum, perineum or perianal areas, fluctuation, crepitus, or purulence of the subcutaneous tissue (demonstrated by physical examination and laboratory data or radiologic imaging), surgical findings of necrotic tissue, debridement, and histopathology with proven necrotizing fasciitis.
Exclusion criteria:
Patients with incomplete clinical data, debridement histopathology data that did not support necrotizing infection, and those patients who did not complete the treatment procedures were excluded from the analysis.
N total at baseline: 28
Intervention (HBO group): 16 Control (Non HBO group): 12
Important prognostic factors2:
Age Mean ± SD: I: 46.13 ± 13.11 C: 48.42 ± 15.31
Sex: I: 100% M C: 100% M
Mean age was significantly different between both groups |
Intervention:
Adjuvant HBO treatment
After the initial debridement, HBOT was given twice a day for 5–7 days (2.5 units of absolute atmosphere oxygen, 90–120 min each time, interval for 10 h).
|
Control:
No HBO therapy
Antibiotics. All patients were treated with the early debridement and incisiond rainage after admission. Wound dressings were changed twice a day, by cutting off the necrotic devitalized tissue, down to the deep fascia, and washed repeatedly with 3% hydrogen peroxide. |
Length of follow-up:
Two months
No loss to follow up. Patients with incomplete data were excluded from this study.
|
Outcome measures:
Mortality N (%): I: 2 (12.5%) C: 4 (33.3%)
Risk ratio [95%CI]: 0.38 [0.08 to 1.72] P=0.21 in favour of the HBO group
Debridements Mean ± SD: I: 1.32 ± 0.48 C: 2.17 ± 0.72
Mean difference [95%CI]: -0.85 [-1.31 to -0.39] P= 0.00 in favour of the Non HBO group
Length of hospital stay (days) Mean ± SD:
I: 31.44 ± 12.51 C: 31.25 ± 14.47
Mean difference [95%CI]: 0.19 [-10.04 to 10.42] P= 0.97 |
Risk ratio/ Mean difference recalculated
No correction for confounding.
|
|
Shaw, 2014 |
Type of study:
Retro perspective observational study
Setting:
The dataset was obtained from the University Health Consortium (UHC). The UHC is an administrative data Gathering collaborative, with participation from more than 90% of all US academic centers and over 200 of their affiliated hospitals, focusing on optimization of quality of care while containing cost
Country:
USA
Source of funding: Not mentioned |
Inclusion criteria:
Cases were selected by the presence of an ICD-9 diagnosis code for NSTI (Fournier gangrene, necrotizing fasciitis, or gas gangrene) and at least one surgical debridement from dataset of the University Health Consortium (UHC).
Exclusion criteria: Patients who were transferred from another hospital were excluded due to the absence of data on duration and type of care provided at the transferring facility. Thus, we ensured that all patients had the same starting time of admission.
N total at baseline: Intervention (HBO group): 117 Control (Non HBO group): 1466
Important prognostic factors:
Age (IQR): I: 56 (50-64) C: 554 (44-64)
Sex: I: 71 % M C: 98 % M
Demographics, insurance status, co-morbid conditions, and severity of illness.
Groups were comparable at baseline |
Intervention
Adjuvant HBO treatment
These NSTI patients were stratified according to whether or not they had received the primary intervention, HBOT.
The methods of HBO were net described |
Control:
No HBO
|
Length of follow-up: 3 years
Loss-to-follow-up: Not mentioned
|
Outcome measures:
Mortality N (%)
I: 6 (5%) C: 176 (12%)
Risk ratio [95%CI]: 0.43 [0.19 to 0.94] P=0.04 in favour of the HBO group
Multivariable analysis; Non-HBO vs HBO group; Odds ratio [95%CI]:
10.6 [5.23 to 25.1] P=<0.05 in favour of the HBO group
Multivariable analysis; HBO group vs Non-HBO : Odds ratio [95%CI].
0.09 [… to …]
Length of hospital stay
Median days [IQR]
I: 16 [11-23] C: 14 [8-23] P= 0.049
|
In this study the outcomes were categorized in the analyses.
In the unvariate analyses only the severe ill patients showed a significant difference in mortality between the HBO and the non-HBO group.
By multivariate analyses the chance of mortality was compared between the non-HBO group vs the HBO group.
All categories were included in the analyses. Therefore this group could not be compared to the univariate analyse.
Geen subgroepen bekeken |
|
Soh, 2012 |
Type of study:
The study involved secondary analysis of the dataset in the Nationwide Inpatient Sample (NIS) database which avoids any linkage to individual patients and effectively anonymizes the patients captured in the dataset. The NIS is an all-payer inpatient care database that is part of the Healthcare Cost and Utilisation Project (HCUP) of the Agency for Healthcare Research and Quality in the USA.
Setting:
Duke-NUS Graduate Medical School, Singapore
Singapore General Hospital
Research Group, Duke University Medical Center, Durham
Country: Singapore/ USA
Source of funding: Not mentioned |
Inclusion criteria:
All patients in the (Nationwide Inpatient Sample) NIS database who have NSTI were included in the study. Patients were identified using the International Classification of Diseases, Ninth Revision, Clinical Modification (ICD-9-CM) codes.
Exclusion criteria: Incomplete data on the main outcomes
N total at baseline: Intervention (HBO group): 405 Control (Non HBO group): 45913
Important prognostic factors:
Age I: 54 C: 56
Sex: I: 60.0% M C: 65.1% M
Gender, discharge, hospital size, type of hospital, Deyo co- morbidity index, admission type, admission source, site of NSTI, aetiology of NSTI)
There were significant differences between gender and complications.
|
Intervention:
Adjuvant HBO treatment
The moment at which the HBO was given is not described in the study
|
Control:
Non HBO |
Length of follow-up:
21 years
Loss-to-follow-up: Only patients with complete data were included.
|
Outcome measures:
Mortality total group N (%): I: 18 (4.5) C: 4289 (9.4)
Risk ratio [95%CI]: 0.47 [0.30 to 0.74] P=0.001 in favour of the HBO group
Odds ratio (unadjusted) [95%CI]: 0.44 [0.28, 0.71] P=0.00 in favour of the HBO group
Odds ratio (adjusted) [95%CI] 0.49 [0.29 to 0.83] P = 0.008 om favour of the HBO group
Mortality total Clostridial myonecrosisa N (%):
I: < N= 10 C: 932 (9.3)
Odds ratio (unadjusted) [95%CI]: 0.97 [0.42 to 2.26] P= 0.95 In favour of the HBO group
Odds ratio (adjusted) [95%CI]: 1.16 [0.45–2.98] P= 0.76 in favour of the HBO group
Mortality total non-clostridial myonecrosis N (%):
I: 12 (3.6) C: 3,357 (9.5) P= 0.001
Odds ratio (unadjusted) [95%CI]: 0.35 [0.20 to 0.63] P= 0.0001 In favour of the HBO group
Odds ratio (adjusted) [95%CI]: 0.38 [0.20 to 0.73] P= 0.003 in favour of the HBO group
Length of hospital stay
Including deceased patients:
Adjusted median days [95%CI]: I: 14.3 [13 to16] C: 10.7 [10 to 11] P=0.001.
Including patients who survived hospital discharge:
Adjusted median days [95%CI]: I: 14.1 [95 % CI 12.9 to 15.4] C: 10.7 [95%CI 10.6 to 10.9] P=0.001.
Complications N(%):
I: 131 (32.4) C: 16949 (37.2) P = 0.04 |
No standard deviation was given with age.
Odds ratio adjusted (including propensity score with the following confounders: gender, discharge, hospital size, type of hospital, Deyo co- morbidity index, admission type, admission source, site of NSTI, aetiology of NSTI)
Om te poolen heb ik ook de RR berekend. Deze verschilt nauwelijks van de Odds. Daarbij is er geen sprake van confounding.
< N= 10 wordt niet gerapporteerd i.v.m. traceerbaarheid patiënten. |
Wilkinson, 2004
|
Type of study: Retrospective cohort study
Setting: Major tertiary hospital, Adelaide
Country: Australia
Conflicts of interest: Not mentioned |
Inclusion criteria: all patients admitted with a diagnosis of NSTO across a 5 year period.
Exclusion criteria: ND
N total at baseline: 44 Intervention: 33 Control: 11
Important prognostic factors2:
Age total group: 56.5 yrs
Sex total group: 68 % male
Diabetes, PAD, CAD, Steroid medication, Obese, Smoker, Alcohol abuse, myonecrosis
Groups were comparable at baseline
|
Intervention:
Adjuvant HBO treatment
Hyperbaric oxygen therapy was provided using a steelhulled multiplace hyperbaric chamber (Cowan Manufacturing Pty Ltd, Warners Bay, Australia; Fink International Pty Ltd, Melbourne, Australia). Treatment was provided at 2.8 atm absolute for 60 minutes with a 30-minute decompression. Three treatments were provided in the first 24 hours and twice a day thereafter until the infection was controlled. A combination of clinical parameters and appearance of the wound at surgical review determined control of infection. A trained nurse attendant was present within the chamber at all times. For intubated patients, ventilation was maintained using a Dräger Hyperlog (Drägerwerk, Lobeck, Germany).
Moment HBO was given was not described. |
Control:
Non HBO |
Length of follow-up: 5 year period (medical charts) 100 months (medical charts/ birth death and marriage registers) Loss-to-follow-up: Not mentioned
|
Outcome measures:
Mortality N (%): I: 2 (7%) C: 4 (36%)
Risk ratio [95%CI]: 0.17 [0.04 to 0.79]
P= 0.02 in favour of the HBO group
Number needed to treat: 3
Long-term survival analyses:
Median months (range)
I: 53 (0.07 to 99.00) C: 1 (0.07 to 61.00 months)
(P=0.002; Cox F test).
Amputation
Amputation of a limb (NSTI was isolated in the limb)
HBO group: 0 of 12 patients Non HBO group: 2 of 4 patients
Risk Ratio [95% CI]: 0.04 [0.00 to 1.11] P= 0.02 in favour of the HBO group |
Long follow-up. Effect measures were not presented. No correction for confounding in the analyses.
Risk ratio recalculated.
No correction for confounding.
Hazard ratio of the survival analysis and measures of disparity were not presented. Moreover an follow-up of 100 months was included. This may have biased the results because I believe such a long follow-up is unnecessary for the outcome mortality.
Does it involve only survival during hospitalization?
Amputation too small number of patients to be included |
|
Hollabaugh, 1997
|
Type of study:
Retrospective observational study
Setting: University of Tennessee Medical Center
Country: USA
Conflicts of interest: Not mentioned |
Inclusion criteria:
All patients diagnosed of Fournier’s Gangrene
Exclusion criteria: Exclusion criteria for receiving HBO or not, was the availability of HBO in the hospital.
Total N at baseline: 26 Intervention (HBO group)= 14 Control (Non- HBO)= 12
Important prognostic factors2:
Mean age (range): 57 years (26-87)
Sex: All patients were male
Mean hospital stay was 21 days (5-53).
Comparable at baseline? Not mentioned
|
Intervention:
Adjuvant HBO treatment
In all of these cases, initiation of HBO began as soon as the patient was stabilized after diagnosis and initial debridement. Eleven of the 14 patients initiated therapy within 72 hours. Duration of therapy averaged 12 days. With only minimal deviation, patients had 2 dives per day for 7 days, followed by daily dives until therapy was terminated. Hyperbaric oxygen continued until wounds showed complete beds of proliferating granulation tissue or until skin graft coverage had been successful. |
Control:
No HBO treatment
All patients received prompt surgical treatment once the diagnosis had been made. Multiple operative interventions were needed, with a mean of 3 operations per patient.
|
Length of follow-up:
Long term follow up was available for all surviving patients, but they did not mention final data of examination.
Loss-to-follow-up: none, but 6 patients died Intervention: 14 N (%)=1 Reasons (describe): ND, probably because of the severity of the disease
Control:12 N (%)=5 Reasons (describe): Not mentioned
|
Outcome measures:
Mortality N (%): I: 1 (7%) C: 5 (42%)
Risk Ratio [95% CI]: 0.17 [0.02 to 1.27] P=0.04
Logistic regression (copied from text:
Using logistic regression, the relative risk of survival is nine times greater in the group receiving hyperbaric oxygen therapy, compared with the group not receiving hyperbaric oxygen therapy (p=0.062). Even controlling for age, logistic regression reveals a statistically significant survival advantage for those receiving hyperbaric oxygen therapy, with a relative risk for survival being 11 times greater than that of the group not receiving hyperbaric oxygen therapy.
Survival chance:
Logistic regression: Odds ratio [95% CI]: 9.2 [0.89 to 95.95] P=0.062 |
Small group.
Risk Ratio recalculated.
No correction for confounding
|
|
Shupak et. al. 1995
|
Type of study:
Retrospective analysis of medical records
Setting: All patients admitted to one of four surgical departments at RamBam medical centre, in Haifa.
Country: Israel
Conflicts of interest: Not mentioned |
Inclusion criteria:
Diagnosis of necrotising fasciitis based on patient symptoms.
Exclusion criteria: ND
N total at baseline: 18 Intervention: 25 Control: 12
Important prognostic factors:
Mean age : I: 54 C:56
% Male: I:60 % M C: 65.1% M
Both groups were comparable at baseline
|
Intervention:
Adjuvant HBO treatment HBO therapy was only commenced after completion of the first surgical excision of necrotic tissue. Treatment was given in the Israel Naval Medical Institute (INMI)'s walk-in chamber at a pressure of 2.5 atmospheres absolute. At this pressure the patient breathes oxygen spontaneously via a tightly fitting mask with a demand valve, via a hood with continuous oxygen flow, or is mechanically ventilated by a Drager respirator (Drager Inc., Lfibeck, Germany). The mode of oxygen administration depends on the patient's respiratory function, his state of consciousness, and whether he is cooperative. The HBO therapy protocol for necrotizing fasciitis included two cycles of 45 minutes of net oxygen breathing separated by an interval of 5 minutes air breathing to prevent oxygen toxicity. This was given twice daily until local control over the necrotizing process was achieved and the patient's toxic signs resolved, and once a day thereafter. 2 |
Control:
Non HBO treatment
All patients were treated by extensive surgical excision of necrotic tissue, broad spectrum antibiotics, and resuscitative measures as required |
Length of follow-up: 10 years Loss-to-follow-up: Not mentioned
|
Outcome measure:
Mortality N (%): I: 9 (36%) C: 3 (2%)
Risk Ratio [95% CI]: 1.44 [0.47 to 4.37] P=0.52 in favour of the Non HBO group
Debridements Mean ± SD: I: 3.3 ± 2.0 C: 1.5 ± 0.8
Mean difference [95%CI]: 1.80 [0.89 to 2.71] P=0.0001 in favour of Non HBO group
Length of hospital stay Mean ± SD days. I: 15.9 ± 6.4 C: 20 ± 13.8
Mean difference [95%CI]: -4.10 [-12.30 to 4.10] P=0.33 in favour of the HBO group
|
The necessity for further debridement in necrotizing fasciitis implies continued spreading and aggressiveness of the infection.
RR, MD recalculated
No correction for confounding.
|
|
D. Ross Brown, 1993 |
Type of study
Retrospective analysis of medical records
Setting:
Vancouver, General Hospital, Calgary General Hospital
Country: Canada
Conflicts of interest: Not mentioned |
Inclusion criteria:
A computer search was conducted for patients admitted between January 1th, 1980 and December 31, 1991
Patients were diagnosed with necrotizing fasciitis, crepitant anaerobic cellulitis, gangrene, Fourniers gangrene, or nonclostradial/clostodial myonecrosis.
Exclusion criteria: To only select patients with major truncal necrotizing infections, those with the following diagnoses or treatment codes were eliminated: complications of radiotherapy (990); primary peripheral vascular disease with dry gangrene (443.9); gangrene as a single diagnosis (040); joint reconstruction com- plications (996.4); or an infection only involving an extremity.
N total at baseline: Intervention: 30 Control: 24
Important prognostic factors2: For example age ± SD: I: 51.3 ± 17.) C: 61.6 ± 12.6
Sex % M: I: 73 C 54
APACHE II Mean ± SD I : 12.2 ± 7.0 C : 16.0 ± 9.2
Patients in the control group were significantly younger patients and had more clostridial infections. |
Intervention:
Adjuvant HBO treatment
The HBO protocol for necrotizing fasciitis involved administering hyperbaric oxygen at 2.5 to 3.0 atmospheres for 90 minutes per treatment session. Patients receive hyperbaric oxygen as an adjunct to adequate surgical debridement and following each debridement, until there is no on- going evidence of necrosis. |
Control:
Non HBO treatment |
Length of follow-up: This study selected data between January 1980 and December 1991, thus 11 years. Loss-to-follow-up: Not mentioned
|
Outcome measures:
Mortality N (%): I: 9 (30%) C: 10 (24%HBO group: 9, 30% Non HBO groep: 10, 24 % NS)
Risk ratio [95% CI]: 0.72 [0.35 to 1.48] P=0.37
Debridements Mean ± SD:
I: 2.4 ± 1.5 C: 1.3 ± 1.0
Risk ratio [95% CI]: 1.10 [0.43 to 1.77] P=0.001 in favour of the HBO group.
|
The decision to use HBO therapy was made on the basis of clinician preference.
For the purpose of this paper, operations were classified as being for debridement or re- construction.
No correction for confounding.
Risk ratio recalculated.
|
|
Riseman, 1990
|
Type of study: Retrospective patient record study.
Setting: Memorial Medical Center, Springfield
Country: USA
Conflicts of interest: Not mentioned |
Inclusion criteria:
All patients referred or have been admitted with the diagnosis for necrotizing fasciitis. Gas gangrene, or Fournier’s disease.
Exclusion criteria: ND
N total at baseline:29 Intervention: 17 Control:12
Important prognostic factors:
Important prognostic factors:
Age Mean (range): I: 68.5 (41-88) C: 59.7 (14-82)
Sex: I: 58 % M C: 65% M
Age, sex, race, wound bacteriology, presence or absence of diabetes mellitus, peripheral arterial disease, obesity and antecedent trauma were analysed.
Both groups were comparable at baseline |
Intervention:
Adjuvant HBO treatment
All HBO group 2 patients received their first HBO treatment within the first 24 hours after admission. Five patients had their first HBO treatment before surgery. The HBO-treatment protocol included 90 minutes in the monoplace chamber at 2.5 atm every 8 hours the first day and then twice daily for a total of 10 treatments. |
Control:
No HBO treatment |
Length of follow-up: 12 years Loss-to-follow-up: ND Not mentioned
|
Outcome measures:
Mortality N (%):
I: 4 (23%) C: 8 (66 %)
Risk ratio [95% CI]: 0.35 [0.14 to 0.91] P=0.03
Debridement
Total debridements in patients that lived N: I: 14 C:13
Mean debridements per patient
I: 1.16 C: 3.24 P=<0.03
|
Preservation of tissue appears to be an important factor benefit of adding HBO.
No correction for confounding.
Risk ratio recalculated |
Risk of bias table for observational studies
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Li, 2015 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Shaw, 2014 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Soh, 2012 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Wilkinson, 2004 |
Unlikely |
Likely |
Unlikely |
Unlikely |
|
Hollabaugh, 1997 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Shupak et. al. 1995 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
D. Ross Brown, 1993 |
Unlikely |
Unlikely |
Unlikely |
Likely |
|
Riseman, 1990 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 12-03-2018
Laatst geautoriseerd : 12-03-2018
Geplande herbeoordeling : 01-01-2021
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2021 bepaalt het bestuur van de Nederlandse Vereniging voor Heelkunde (NVvH) of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten moeten worden geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVvH is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De overige aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Deze richtlijn beoogt een leidraad te geven voor de dagelijkse praktijk van diagnostiek en behandeling van necrotiserende wekedeleninfectie. Het doel van deze richtlijn is het vaststellen van de zorg betreffende de diagnostiek en behandeling van necrotiserende wekedeleninfecties. Standaardisatie van therapeutische opties door middel van een diagnose- en behandelalgoritme is noodzakelijk om praktijkvariatie te reduceren en de kwaliteit van de zorg te verhogen.
Doelgroep
De richtlijn beperkt zicht tot de diagnostiek en behandeling van necrotiserende wekedeleninfectie bij volwassenen in de tweede lijn.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2015 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met necrotiserende wekedeleninfectie. De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- Drs. V.M. de Jong, traumachirurg, Academisch Medisch Centrum, Amsterdam [NVvH] (voorzitter)
- Dr. C.H.E. Boel, arts-microbioloog, Universitair Medisch Centrum, Utrecht [NVMM]
- Dr. O. Boonstra, traumachirurg, Spijkenisse Medisch Centrum, Spijkenisse [NVvHG]
- Dr. C.S.C. Bouman, intensivist, Academisch Medisch Centrum, Amsterdam [NVIC]
- Drs. S. Janssen, verpleegkundig specialist, Elkerliek Ziekenhuis, Helmond [V&VN]
- Dr. J. Oskam, vaatchirurg, Isala, Zwolle [NVvH]
- Drs. P.A.C. van Rijn, radioloog, Slingeland Ziekenhuis, Doetinchem [NVvR]
- Dr. B. Rikken, uroloog, IJsselland Ziekenhuis, Capelle aan de IJsel [NVU]
- Drs. A.J.M. van Trier, plastisch chirurg, Rode Kruis ziekenhuis, Beverwijk [NVPC]
Met dank aan:
- Gerard Niersman namens de Vereniging van Mensen met Brandwonden
Met ondersteuning van:
- Dr. W.A. van Enst, senior adviseur, Kennisinstituut van Medisch Specialisten
- Drs. H. Kooijmans, adviseur, Kennisinstituut van Medisch Specialisten
- Drs. H. Vreeken, adviseur, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Achternaam |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Reputatiemanagement |
Extern gefinancierd onderzoek |
Kennisvalorisatie |
Overige belangen |
Getekend |
|
Boel |
Arts-microbioloog/ medisch hoofd zorg afdeling medische microbiologie |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Ja, 02 mei 2015 |
|
Boonstra |
Traumachirurg - Spijkenisse Medisch Centrum (in dienst Min.v.Defensie) Medisch Directeur - IvHG BV (hyperbaar geneeskundig instituut) Directeur - OnSiteMedicals BV (duikgeneeskunde en heelkunde expertise en advies) -> alle functies zijn betaald |
Lid Nederlandse Vereniging voor Hyperbare Geneeskunde (NVvHG), onbetaalde functies voor wetenschappelijke commissie van deze vereniging. |
Directeur Groot Aandeelhouder OnSiteMedicals BV Geen aandelen of opties in Instituut voor Hyperbare Geneeskunde (IvHG BV) |
Geen |
Geen |
Effect van HBO bij behandeling van sarcomen (bestralingen en operaties), EMC (DDHK) Effect van HBO voorkomen van restenosering van buismaag na oesophagus-cardio resectie en buismaagreconstructie, UMCU |
Geen patenteigendommen Wel expert op het gebied van toepassingen van hyperbare geneeskunde in de behandeling van progressieve wekedeleninfecties |
Geen |
Ja, 18 april 2015 |
|
Bouman |
Medisch Specialist (intensivist) afdeling intensive care volwassenen AMC |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Ja, 7-12-2015 |
|
De Jong |
Traumachirurg, AMC |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Ja, 14-03-2017 |
|
Janssen |
V.S. Wondzorg Elkerliek ziekenhuis |
Docent wondopleidingen Zorgacademie Radboud en Zorgacademie Erasmus (wisselen aantal uren per jaar, betaald). Verzorgen van verschillende lessen over wondzorg in brede zin van het woord en afstuurders begeleiden. Bestuurslid V&VN Wondexpertise (niet betaald, wel vergadervergoeding), 6-wekelijks vergaderen, organisaties met 400 leden. Jaarlijks ALV en symposium organiseren. Onderhandelingen inspectie, CZO accreditatie wondopleidingen enz. Lid Wondplatform Nederland (niet betaald), zitting namens wondopleidingen in NL. Lid decubituscommissie WCS (niet betaald, wel vergaderingvergoeding). Bijhouden hoofdstuk decubitus WCS Wondenboek, verzorgen decubituspresentaties op WCS congres enz. Lid Dorpsplatfom Aarle-Rixtel (onbetaald) |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Ja, 12-06-2015 |
|
Oskam |
Praktiserend chirurg |
Geen |
- Minderheidsbelang aandelen Qualityzorg BV, thuiszorgorganisatie Zwanenburg - Minderheidsbelang aandelen Keizerkliniek Assen, ZBC voor o.a. Vaat-Wondzorg |
Geen |
Geen |
Geen |
Geen |
Geen |
Ja, 29-06-2016 |
|
Rikken |
Uroloog |
IKL kerngroep urologie Rotterdam voorzitter, onbetaald |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Ja, 08-07-2015 |
|
Van Rijn |
Radioloog, ziekenhuis Slingerland |
Screeningsradioloog bev. Onderzoek oost, deventer (betaald) |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Ja, 29 mei 2015 |
|
Van Trier |
- Plastisch chirurg RKZ Beverwijk - Plaatsvervangend opleider |
- Bestuur N.V.B.Z. (Nederlandse Vereniging Brandwonden Zorg) – onbetaald - Raad van Advies Stichting Kind en Brandwond – onbetaald - RvT Nederlandse Brandwonden Stichting. (onbetaald) |
Nee |
Nee |
Nee |
Niet aan de orde |
Niet aan de orde |
Nee |
Ja, 04-04-2016 |
Inbreng patiëntenperspectief
Er is aandacht besteed aan het patiëntenperspectief door een focusgroep te organiseren in samenwerking met de Nederlandse Brandwonden Stichting in samenspraak met de Patiëntenfederatie Nederland. Negen patiënten en één naaste namen deel aan de focusgroep. Het verslag van de focusgroep is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn (zie 'Verslag focusgroepgesprek’). Daarnaast zijn de conceptteksten voorgelegd aan de Nederlandse Brandwonden Stichting gedurende de ontwikkelfase.
Een punt dat door patiënten als zeer belangrijk werd ervaren, was vroegtijdige herkenning. Dit is verwerkt door een module te ontwikkelen over diagnostiek. Daarnaast is door de werkgroep een bijdrage geleverd aan de ontwikkeling van de NHG-standaard Bacteriële huidinfecties, aangezien vroegtijdige herkenning in de eerste lijn zeer belangrijk is.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten. De werkgroep heeft tevens een interne kwaliteitsindicator ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken (zie Indicatoren).
Werkwijze
AGREE II
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stapbeschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens is een knelpuntanalyse uitgevoerd door veldpartijen te vragen hun knelpunten kenbaar te maken tijdens een invitational conference op 10 juni 2015. De volgende veldpartijen zijn gevraagd om input te leveren: Inspectie voor de Gezondheidszorg, Zorginstituut Nederland, Nederlandse Vereniging van Ziekenhuizen (NVZ), Nederlandse Federatie van Universitair Medische Centra (NFU), Zelfstandige Klinieken Nederland (ZKN), Zorgverzekeraars Nederland (ZN), Patiëntenfederatie (NPCF), Nederlands Huisartsen Genootschap (NHG), Wondplatform Nederland Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV), Wondplatform Nederland, WCS Kenniscentrum Wondzorg, Nederlandse Brandwonden Stichting , Nefemed, Nederlandse Vereniging voor Revalidatieartsen (VRA), Nederlandse Vereniging van Ziekenhuizen (NZA), Samenwerkende Topklinische opleidingsZiekenhuizen (STZ), Federatie van Medisch Coördinerende Centra (FMCC), DBC Onderhoud, Lareb, Nefarma, Nederlandse Vereniging van Maag-Darm-Leverartsen (NVMDL), Nederlandse Vereniging voor Neurologie (NVN), Nederlandse Vereniging van Spoedeisende Hulp Artsen (NVSHA), Nederlandse Vereniging Spoedeisende Hulp Verpleegkundigen (NVSHV), Koninklijk Nederlands Genootschap voor Fysiotherapie (KNFG), Nederlandse Internisten Vereniging (NIV), Nederlandse Vereniging van Keel-Neus-Oorheelkunde en Heelkunde van het Hoofd-Halsgebied (NVKNO), Nederlandse Vereniging voor Mondziekten, Kaak- en Aangezichtschirurgie (NVMKA), Nederlandse Vereniging voor Pathologie (NVVP), Nederlandse Vereniging voor Anesthesiologie (NVA). Daarnaast zijn ook de participerende verenigingen gevraagd zijnde Nederlandse Vereniging voor Heelkunde (NVvH), Nederlandse Vereniging voor Medische Microbiologie (NVMM), Nederlandse Vereniging voor Plastische Chirurgie (NVPC), Nederlandse Vereniging voor Urologie (NVU), Nederlandse Vereniging voor Radiologie (NVvR), Nederlandse Vereniging voor Hyperbare Geneeskunde (NVvHG), Nederlandse Vereniging voor Intensive Care (NVIC) en Verpleegkundigen & Verzorgenden Nederland Wondexpertise (V&VN Wondexpertise). De ontvangen input is meegewogen in het opstellen van de definitieve knelpunten voor de richtlijn. Het verslag van de invitational conference is na te lezen in het 'Verslag invitational conference’.
Uit de invitational conference kwam naar voren dat het beoogde onderwerp van de richtlijn, fasciitis necroticans, te specifiek was. Het veld had behoefte aan aanbeveling over necrotiserende wekedeleninfecties in algemene zin. Zodoende heeft de werkgroep besloten de scope van de richtlijn te verbreden tot het onderwerp necrotiserende wekedeleninfecties. Een tweede belangrijk punt was de vroegtijdige herkenning van NWDI (tevens genoemd in de focusgroep). Dit is opgepakt door een bijdrage te leveren aan de NHG-standaard Bacteriële huidinfecties.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur conceptuitgangsvragen opgesteld. Deze zijn met de werkgroep besproken, waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep ten minste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt-)relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor iedere uitgangsvraag werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met de desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en het patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (Risk of Bias, RoB) te kunnen inschatten. Deze beoordelingen kunt u vinden in de RoB-tabellen. De gebruikte RoB-instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; EBRO – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
Gradaties GRADE
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008). In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt-)relevante uitkomstmaten, een systematische review per uitkomstmaat en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroep maakte de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming, waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten van belang, zoals de expertise van de leden van de werkgroep, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (meegewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs, de belangrijkste overwegingen en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten samen.
Randvoorwaarden (organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg; de randvoorwaarden voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur).
Een van de belangrijkste knelpunten bleek de herkenning van necrotiserende wekedeleninfecties (genoemd in invitational conference en patiëntfocusgroep). Er kan aanzienlijke gezondheidswinst behaald worden wanneer de diagnose in een eerder stadium wordt herkend. Echter, dit knelpunt valt binnen de eerste lijn (huisartsenzorg en spoedeisende hulp), waar patiënten zich als eerste melden. De werkgroep heeft zodoende een bijdrage geleverd aan de NHG-standaard Bacteriële huidinfecties.
Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken deel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende of bijkomende aspecten van de organisatie van zorg worden behandeld in een aparte module.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn werd een interne kwaliteitsindicator ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten (secretariaat@kennisinstituut.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk onderzoek van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn wordt aan de betrokken (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd ter commentaar. De commentaren worden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren wordt de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn wordt aan de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html. 2012.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. 2015. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html. 2013.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
