Epidurale steroïdinjecties bij LRS
Uitgangsvraag
Aanbeveling
Overweeg een fluoroscopisch gecontroleerde injectie met glucocorticoïden bij patiënten met een acuut lumbosacraal radiculair syndroom en ernstige pijnklachten ondanks adequate pijnmedicatie.
Overwegingen
De onderstaande overwegingen en aanbevelingen gelden voor het overgrote deel van de populatie waarop de uitgangsvraag betrekking heeft.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
In de klinische praktijk worden ESI veelvuldig toegepast. Hoeveel precies is onbekend. De indruk bestaat bij vele patiënten en zorgverleners dat ESI een positieve bijdrage kunnen leveren bij patiënten met ernstige pijnklachten bij een acuut LRS. Door adequate pijnstilling in de acute fase hoopt men zo de patiënt conservatief te kunnen blijven behandelen en operatieve interventies zoveel mogelijk te vermijden. Immers, het spontane beloop is gunstig bij een LRS.
Uit literatuurstudie lijkt er sprake van slechts een (klein) positief effect van epidurale injecties op pijn bij lage rughernia ten opzicht van placebo bij kans op pijn na 1 maand (uitkomstmaat 1.2), en pijn na 3 maanden (uitkomstmaat 1.4) en de pijnintensiteit na 6 maanden (uitkomstmaat 1.6). Enkele andere uitkomstmaten tonen wel een statistisch significant verschil in het voordeel van ESI die niet de grens van klinische relevantie halen, dit geldt voor pijnreductie na 1 maand (uitkomstmaat 1.1) en pijnintensiteit na 3 maanden (uitkomstmaat 1.5). Bij deze uitkomstmaten moet worden opgemerkt dat de kwaliteit van het bewijs laag is.
De lage kwaliteit van bewijs heeft te maken met: 1) dat de meeste studies patiënten includeren met subacute (> 6 weken) en chronische (> 3 maanden) klachten terwijl het radiculair syndroom vooral een acute presentatie is (selectie bias); 2) er vergeleken wordt met placebo injecties in plaats van met usual care; 3) er doorgaans methodologisch in feite een onjuist placebo wordt gebruikt (lokaal anestheticum).
Toekomstige onderzoeken zouden zich vooral moeten richten op acute patiënten en een vergelijking maken met usual care. Oftewel: de vraag is of een tweedelijns behandeling in de vorm van een epidurale injectie met steroïden in het ziekenhuis effectiever is dan eerstelijnsbehandeling in de vorm van pijnmedicatie en fysiotherapie (usual care).
De kennislacune betreft de acute fase. Er zijn weinig onderzoeken die deze onderzocht hebben, terwijl het acuut radiculair syndroom normaliter een kort beloop heeft: de meeste patiënten (70 %) herstellen binnen 3 maanden (Hofstee, 2002).
Op basis van de onderzoeken moet worden geconcludeerd dat de bewijskracht van het effect van epidurale injecties met steroïden bij het lumbaal radiculair syndroom gering is, en het effect beperkt lijkt. De vraag is wel of de meest relevante subgroep in deze richtlijn namelijk patiënten met een acuut LRS (< 6 tot 12 weken) wel voldoende onderzocht is. Hier ligt een hiaat.
De meest voorkomende complicaties zijn duraperforaties (in 2-5% van de injecties) met als gevolg hoofdpijn (Benoist, 2012). Al dan niet tijdelijke toename van rug- en beenpijn en tijdelijke zenuwworteluitval, die zich kan manifesteren als spierzwakte of gevoelsverlies. Andere directe complicaties, zoals bloeding, infectie en vasculair myelumletsel, zijn incidenteel beschreven als casuïstiek en bij injecties die boven conus-niveau gegeven zijn (L2). Hyperaldosteronisme, hyperglykemieën, gewichtstoename en vochtretentie zijn indirecte complicaties die te wijten zijn aan het gebruik van glucocorticoïden. Deze zijn slechts incidenteel beschreven.
Een retrospectieve studie (Botwin, 2000) bij > 200 patiënten kwamen de volgende bijwerkingen het meest voor kortdurende hoofdpijn (3,1%), toename van rugpijn (2,4%), toename van beenpijn (0,6%).
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Het doel van de patiënt is om snel pijn verlichting te krijgen en beter te functioneren. De belastbaarheid van de procedure is gering (bezoek aan de dagbehandeling voor een procedure onder doorlichting).
Kosten (middelenbeslag)
De kosten zijn relatief laag (geschat op € 120,-) en de interventie kan in dagbehandeling plaatsvinden.
Aanvaardbaarheid voor de overige relevante stakeholders
Het voornaamste bezwaar de interventie aan te bevelen is het weinig overtuigende wetenschappelijke bewijs. Een juridisch bezwaar is dat epidurale steroïden off-label worden voorgeschreven. Gezien het geringe complicatierisico zou dit niet zwaarwegend moeten zijn.
Haalbaarheid en implementatie
De meeste Nederlandse ziekenhuizen beschikken over een pijnpoli waar ESI laagdrempelig kan worden uitgevoerd. Verwijzing geschiedt doorgaans door de neuroloog die de patiënt met lumbosacraal radiculair syndroom op zijn spreekuur ziet op verzoek van de huisarts. Andere verwijsroutes, bijvoorbeeld rechtstreeks via de huisarts of via orthopedisch chirurg of neurochirurg zijn minder gebruikelijk.
Het is niet duidelijk welke patiënten de neuroloog doorstuurt (duur, ernst klachten, wel/geen beeldvorming). Hier is sprake van praktijkvariatie. Anesthesiologen zullen doorgaans kiezen voor een transforaminale benadering die als superieur ten opzichte van de interlaminaire techniek beschouwd wordt (Schaufele, 2006), ofschoon meer recente studies equivalentie laat zien (Rados, 2011; Gharibo, 2011). Er is veel variatie wat betreft de ingespoten vloeistof, die bestaat uit een mix van lokale anesthetica (bijvoorbeeld procaine of levobupivacaine) en glucocorticosteroïden (methylprednisolon, triamcinolon). Ook hier is sprake van praktijkvariatie.
Rationale/ balans tussen de argumenten voor en tegen de interventie
Voordelen van de interventie zijn dat er mogelijk een beperkt gunstig effect op pijn en functioneren is in de acute fase. De kans op bijwerkingen en complicaties is al met al gering. Er lijkt een discrepantie tussen waargenomen effect in de praktijk en de conclusies uit de (laag kwalitatieve) beschikbare evidence.
Indien adequate pijnmedicatie of andere conservatieve vormen van pijnvermindering tekortschieten voor de patiënt en dat de patiënt (door de pijn) ook niet kunnen bewegen, dan kan worden overwogen te informeren over de mogelijkheden voor ESI. Hierbij dienen de (mogelijk beperkte) voordelen en de mogelijke nadelen dan wel bijwerkingen te worden besproken en dient het besluit om hiervoor al dan niet te verwijzen in samenspraak tussen arts en patiënt te worden genomen.
Onderbouwing
Achtergrond
Het natuurlijke beloop van een lumbosacraal radiculair syndroom (LRS) op basis van een HNP is gunstig; bij het 70% van alle patiënten is de uitstralende pijn binnen 3 maanden verdwenen (Koes, 2007; Vroomen, 2000). Het heeft dan ook de voorkeur deze patiënten te behandelen met conservatieve maatregelen en een operatie pas te overwegen wanneer de klachten 3 maanden of langer aanwezig zijn.
Als onderdeel van een niet-operatief traject kan men behalve bewegingsadviezen, oefentherapie en pijnmedicatie ook epidurale steroïden injecties (ESI) geven. Dit gebeurt in de regel door een anesthesioloog/pijnspecialist onder fluoroscopische controle, wat inhoudt dat contrastvloeistof wordt ingespoten onder continue röntgendoorlichting voor een juiste plaatsbepaling. In de CBO-Richtlijn ‘Lumbosacraal radiculair syndroom’ uit 2008 wordt geconcludeerd dat epidurale glucocorticoïdinjecties kunnen worden overwogen als andere vormen van pijnstilling tekortschieten. Transforaminale toediening verdient dan de voorkeur (Van Zundert, 2010).
Hoewel bijwerkingen doorgaans mild zijn, zijn de bijwerkingen niet zeldzaam. Pijn bij inspuiten en na de behandeling en systemische bijwerkingen van de steroïden (flushes, hartkloppingen) komen regelmatig voor. Ernstige complicaties van ESI zijn uiterst zeldzaam en treden enkel op bij injecties boven conus (L2) niveau (Benzon, 2015). Verder is in de praktijk niet altijd duidelijk wat met ‘tekortschieten van pijnstilling’ wordt bedoeld en wanneer het verstandig is over te gaan tot een injectie. De meeste klinieken in Nederland beschikken over een eigen pijnpoli waar vaak laagdrempelig injecties gegeven kunnen worden, mogelijk zonder dat pijnmedicatie voldoende geprobeerd is. Het percentage patiënten met een lumbosacraal radiculair syndroom dat geïnjecteerd wordt, is niet bekend. Bovenstaande vraagt om een nadere beschouwing van de rol van transforaminale epidurale injecties met glucocorticoïden bij patiënten met het lumbosacraal radiculair syndroom.
Conclusies
1. Uitkomstmaat Pijn (cruciaal)
1.1 pijnreductie na 1 maand
|
Laag GRADE |
Epidurale steroïden-injectie lijkt pijn na 1 maand enigszins te verminderen ten opzichte van placebo.
Bronnen: (Lee, 2018; Manchikanti, 2016) |
1.2 relatief risico op pijn na 1 maand
|
Laag GRADE |
Epidurale steroïden-injectie lijkt het relatieve risico op pijn na 1 maand te verminderen ten opzichte van placebo.
Bronnen: (Lee, 2018) |
1.3 pijnreductie na 3 maanden
|
Laag GRADE |
Epidurale steroïden-injectie lijkt pijn na 3 maanden niet te verminderen ten opzichte van placebo.
Bronnen: (Lee, 2018) |
1.4 relatief risico op pijn na 3 maanden
|
Laag GRADE |
Epidurale steroïden-injectie lijkt het relatieve risico op pijn na 3 maanden enigszins te verminderen ten opzichte van placebo.
Bronnen: (Lee, 2018) |
1.5 Intensiteit van beenpijn na 3 maanden
|
Laag GRADE |
Epidurale steroïden-injectie zou beenpijn na 3 maanden enigszins kunnen verminderen ten opzichte van placebo.
Bronnen: (Pinto, 2012) |
1.6 intensiteit van pijn na 6 maanden
|
Laag GRADE |
Epidurale steroïden-injectie lijkt de pijnintensiteit na 6 maanden te verminderen ten opzichte van usual care.
Bronnen: (Lewis, 2011) |
2. Uitkomstmaat Functioneren (cruciaal)
2.1 & 2.2 functionele score na 1 en 3 maanden
|
Laag GRADE |
Epidurale steroïden-injectie lijkt functionele score na 1 en 3 maanden niet te verminderen ten opzichte van placebo.
Bronnen: (Lee, 2018; Manchikanti, 2016) |
2.3 Fysieke beperking op korte termijn
|
Redelijk GRADE |
Epidurale steroïden-injectie vermindert fysieke beperking op korte termijn waarschijnlijk niet ten opzichte van placebo.
Bronnen: (Pinto, 2012; Bhatia, 2016) |
3. Uitkomstmaat Adverse effects (belangrijk)
|
Laag GRADE |
Epidurale steroïden-injectie zou de kans op adverse effects enigszins kunnen doen toenemen. Ten opzichte van usual care is dit verschil klinisch relevant, ten opzichte van placebo-injectie niet.
Bronnen: (Lewis, 2012) |
4. Uitkomstmaat werkhervatting (belangrijk)
|
- GRADE |
Er zijn geen studies gevonden die deze uitkomstmaat beschreven |
Samenvatting literatuur
Beschrijving studies
De systematische review van Lee (2018) vergelijkt in een groot aantal studies (Carette, 1977; Cohen, 2012; Ghai, 2015; Ghahreman, 201; Iverson, 2011; Manchikanti, 2011; Manchikanti,2013; Manchikanti, 2014; Nandi, 2017; Ng, 2005; Sayegh, 2009; Tafazal, 2009; Valat, 2003) pijnvermindering, relatief risico op pijn en functionele score tussen epidurale steroïd-injecties en placebo injectie op diverse meetmomenten. Aanvullend op deze review zijn in Manchikanti (2016) vier extra studies met pijn na 1 maand en functionele score na 3 maanden gevonden (Arden, 2005; Cohen, 2015; Fukusaki, 1998; Karppinen, 2001). De studies in de SR van Pinto (2012) vergelijken beenpijn en disability na epidurale corticosteroïde-injecties versus placebo injectie, en onderscheiden daarbij caudale, interlaminaire en transforaminale toediening (Bush, 1991; Manchikanti, 2011; Klenerman, 1984; Helliwell, 1985; Carette, 1997; Valat, 2003; Arden, 2005; Manchikanti, 2010; Karppinen, 2001; Ng, 2005; Tafazal, 2009; Ghahreman, 2010; Cohen, 2012; Iverson, 2011). Lewis (2011) vergelijkt epidurale corticosteroïde-injecties met usual care en beschrijft daarbij de uitkomstmaten pijnintensiteit en adverse effects (Buchner, 2000; Laiq, 2009; Dincer, 2007; Murata, 2009; Pirbudak, 2003; Blonna, 2004; Bush, 1991; Carette, 1997; Dilke, 1973; Karppinen, 2001; Klenerman, 1984; Price, 2005; Ridley, 1988; Valat, 2003; Bronfort, 2000; Bronfort, 2004; Veihelman, 2006). Bhatia (2016) beschrijft “perceived disability” en “analgesic efficacy” 3 maanden na epidurale steroïd- versus placebo-injecties (Karppinen, 2001; Manchikanti, 2014; Ng, 2015; Tafazal, 2009). De SR van Liu (2016) beschrijft verschillen in pijn en functionaliteit tussen caudale en transforaminale injecties (Ackerman, 2007; Ploumis, 2014; Manchikanti, 2015). Studies uit verschillende reviews zijn zoveel mogelijk samengevoegd en enkele studies zijn verwijderd wanneer de waarden niet overeenkwamen met de gedefinieerde PICO, met name vanwege een overschrijding van de duur van de symptomen (> 6 maanden). Enkele studies komen in meerdere reviews terug omdat verschillende uitkomstmaten beschreven zijn in de SR’s.
Resultaten
1. Uitkomstmaat Pijn (cruciaal)
De uitkomstmaat pijn is goed beschreven in de literatuur. Het samenvoegen van data wordt echter bemoeilijkt door de verschillende manieren waarop pijn wordt uitgedrukt, bijvoorbeeld als absolute score versus verschil met baseline, algemene pijn versus pijn in het been, als gemiddeld verschil versus relatieve risico op pijn. Daarnaast zijn verschillende meetmomenten gehanteerd in de diverse studies. Waar mogelijk is de locatie van de pijn gespecificeerd. Door de werkgroepleden is aangegeven dat 6 weken en 3 maanden de meest relevante meetmomenten zijn voor klinische besluitvorming, dus zijn deze (of vergelijkbare) tijdspunten in detail uitgewerkt. Waar mogelijk is onderscheid gemaakt tussen caudale, interlaminaire en transforaminale injecties.
1.1 Uitkomstmaat pijnreductie na 1 maand
Figuur 1 geeft de verbetering in pijnscores 1 maand na behandeling weer, waarbij een hogere waarde staat voor een grotere verbetering ten opzichte van de baseline waarde. Een maand na behandeling was dit verschil in numerical rating scale (NRS, van 0 tot 10) of visual analog scale (VAS, 0 tot 100, getransformeerd naar NRS-schaal) groter in de steroïde-groep dan in de placebogroep, met een gemiddeld verschil van 0,94 (95% BI 0,14 tot 1,73). Dit is niet klinisch relevant, aangezien op een schaal van 0 tot 10 een verschil van 1,1 (10%) doorgaans beschouwd wordt als een klinisch relevant verschil (bijvoorbeeld in reumatoïde artritis).
Caudale injectie (1,78; 95% BI 1,24 tot 2,35) leek een sterker positief effect te hebben dan interlaminaire (0,76; 95% BI 0,02 tot 1,49) en transforaminale (0,11; 95% BI -0,07 tot 0,29) toediening, maar gezien het beperkte aantal waarnemingen (twee studies per toediening met 69-122 patiënten per conditie) dient dit verschil niet te worden overschat. In een directe vergelijking van caudale en transforaminale toediening vond de SR van Liu (2016), ook in een beperkt aantal studies, geen consistente verschillen in pijn; van de twee studies die pijn na 3 maanden beschreven, was de ene in het voordeel van caudale en de andere in het voordeel van transforaminale toediening, waarbij het gepoolde verschil niet significant verschillend was (zie evidencetabel).
Figuur 1 Pijnreductie (getransformeerde VAS of NRS) na 1 maand bij epidurale corticosteroïde-injecties versus placebo
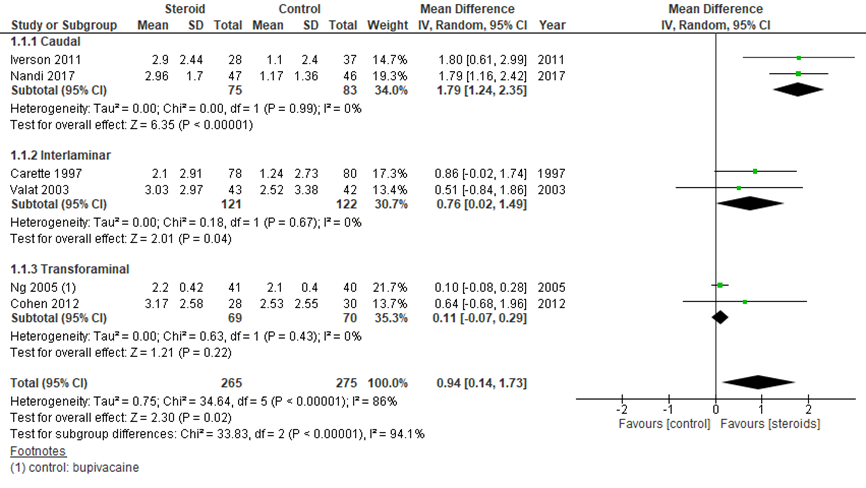
Z: p-waarde van gepoolde effect: df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘pijnreductie na 1 maand’ is met twee niveaus verlaagd gezien het geringe aantal patiënten en voor het overschrijden van de grenzen voor klinische relevantie (-2, imprecisie). Vanwege het studiedesign is het startpunt GRADE ‘hoog’, de uiteindelijke bewijskracht komt uit op GRADE ‘laag’.
1.2 Uitkomstmaat relatief risico op pijn na 1 maand
Wanneer pijn na 1 maand wordt uitgedrukt als relatief risico (RR) na epidurale steroïde-injecties ten opzichte van placebo, zoals weergegeven in figuur 2, dan was het RR 2,09 (95% BI 1,29 tot 3,38) in het voordeel van epidurale steroïde-injecties. Dit verschil is klinisch relevant.
Figuur 2 Relatief risico op pijn na 1 maand bij epidurale corticosteroïde-injecties versus placebo
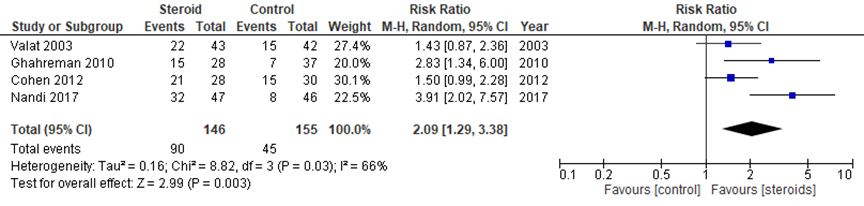
Z: p-waarde van gepoolde effect: df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘relatief risico op pijn na 1 maand’ is met twee niveaus verlaagd gezien het geringe aantal patiënten (-2, imprecisie). Vanwege het studiedesign is het startpunt GRADE ‘hoog’, de uiteindelijke bewijskracht komt uit op GRADE ‘laag’.
1.3 pijnreductie na 3 maanden
De verschillen tussen steroïde- en placebo-injecties na 3 maanden waren kleiner dan na 1 maand. De reductie in pijnscore in 9 studies (figuur 3) is nagenoeg gelijk tussen de groepen met een gepoold effect van -0,01 (95% BI -0,49 tot 0,46). Dit verschil is niet klinisch relevant.
Figuur 3 Pijnreductie (getransformeerde VAS of NRS) na 3 maanden bij epidurale corticosteroïde-injecties versus placebo
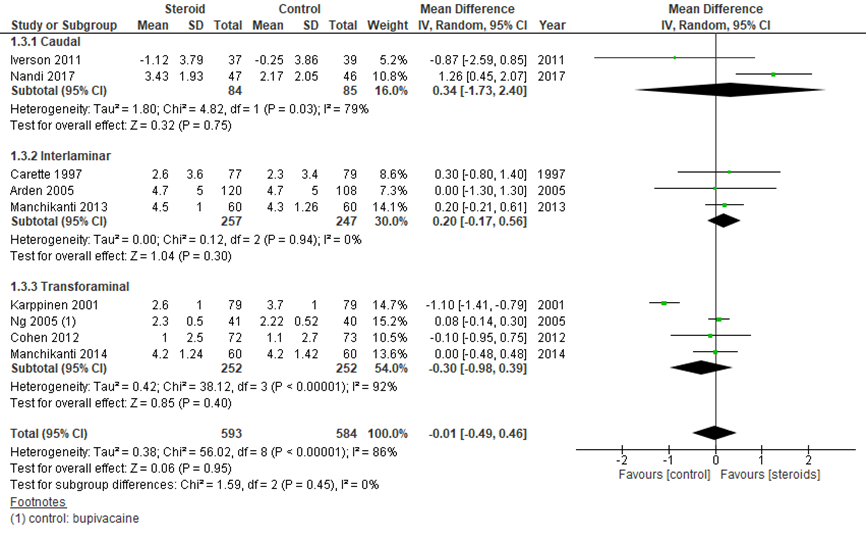
Z: p-waarde van gepoolde effect: df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘pijnreductie na 3 maanden’ is met twee niveaus verlaagd gezien vanwege het geringe aantal patiënten (imprecisie) en vanwege variatie in de resultaten (inconsistentie). Vanwege het studiedesign is het startpunt GRADE ‘hoog’, de uiteindelijke bewijskracht komt uit op GRADE ‘laag’.
1.4 relatief risico op pijn na 3 maanden
Het gepoolde RR op pijn in vier studies was 1,26 (95% BI 1,03 tot 1,54) in het voordeel van steroïde-injecties. Dit verschil klinisch relevant.
Figuur 4 Relatief risico op pijn na 3 maanden bij epidurale corticosteroïde-injecties versus placebo
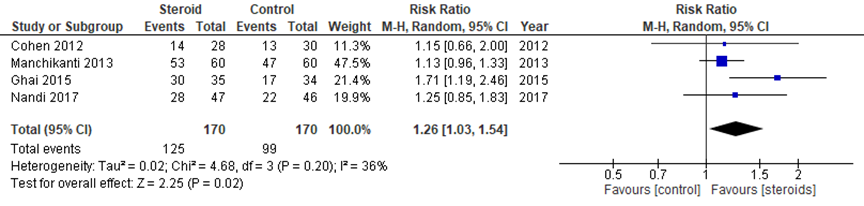
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘relatief risico op pijn na 3 maanden’ is met twee niveaus verlaagd gezien het geringe aantal patiënten en voor het overschrijden van de grenzen voor klinische relevantie (imprecisie). Vanwege het studiedesign is het startpunt GRADE ‘hoog’, de uiteindelijke bewijskracht komt uit op GRADE ‘laag’.
1.5 Intensiteit van beenpijn na 3 maanden
De intensiteit van beenpijn na 3 maanden leverde uit 11 studies een gemiddeld verschil op in VAS van 5,87 (95% BI 1,19 tot 10,55) in het voordeel van steroïde-injecties. Op een schaal van 0 tot 100 is dit verschil niet klinisch relevant. Daarnaast was er geen verschil in beenpijn tussen caudale, interlaminaire en transforaminale toediening (figuur 5). Bhatia (2016) definieerde pijn in de vorm van “analgesic efficacy” maar dit leverde geen aanvullende informatie op ten opzichte van de uitgewerkte pijnscores (zie evidencetabel).
Figuur 5 Intensiteit van beenpijn (VAS) na 3 maanden bij epidurale corticosteroïde-injecties versus placebo
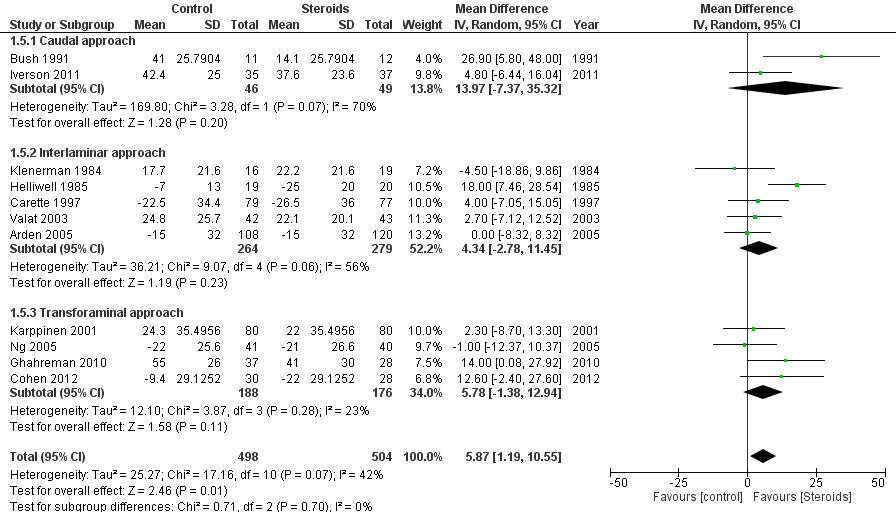
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘intensiteit van beenpijn na 3 maanden’ is met twee niveaus verlaagd gezien het geringe aantal patiënten en voor het overschrijden van de grenzen voor klinische relevantie (-2, imprecisie). Vanwege het studiedesign is het startpunt GRADE ‘hoog’, de uiteindelijke bewijskracht komt uit op GRADE ‘laag’.
1.6 intensiteit van pijn na 6 maanden
In de vergelijking tussen epidurale corticosteroïde-injecties en usual care, dan gaf eerstgenoemde een sterkere reductie in pijn na 6 maanden, zoals weergegeven in figuur 6. Vergeleken met usual care (fysiotherapie, pijnstilling en/of rust) resulteerde epidurale CS in een gemiddeld verschil van 14,33 (95% BI 4,45 tot 24,45). Dit verschil is klinisch relevant in het voordeel van corticosteroïde-injectie.
Figuur 6 Intensiteit van pijn (VAS) na 6 maanden bij epidurale corticosteroïde-injecties versus usual care
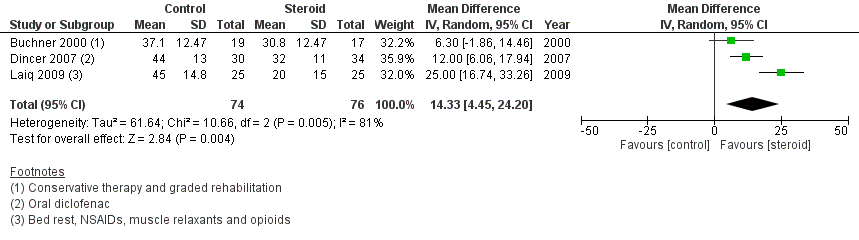
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘intensiteit van pijn na 6 maanden’ is met twee niveaus verlaagd gezien het geringe aantal patiënten en voor het overschrijden van de grenzen voor klinische relevantie (-2, imprecisie). Vanwege het studiedesign is het startpunt GRADE ‘hoog’, de uiteindelijke bewijskracht komt uit op GRADE ‘laag’.
2. Uitkomstmaat Functioneren (cruciaal)
Functionele score bij (behandeling van) LRS is in de literatuur gerapporteerd op basis van de Oswestry disability score (ODI), Roland Morris index (RMI), of Modified Oswestry Disability Questionnaire (MODQ). Deze scores zijn weergegeven in figuur 7 (na 1 maand) en figuur 8 (na 3 maanden), waarbij een hogere score staat voor betere fysieke functie. Om de waarden van de verschillende meetinstrumenten met elkaar te kunnen vergelijken wordt gebruik gemaakt van het gestandaardiseerd gemiddelde verschil (standardized mean difference, SMD).
2.1. functionele score na 1 maand
Bij vergelijking van epidurale corticosteroïde- en placebo-injecties in zes studies is een SMD van 0,32 (95% BI -0,58 tot 1,22) gevonden in het voordeel van CS injectie. De statistische heterogeniteit van de resultaten is zeer hoog met een I2 van 96%. Het verschil is niet klinisch relevant.
Figuur 7 Functionele score na 1 maand bij epidurale corticosteroïde-injecties versus placebo
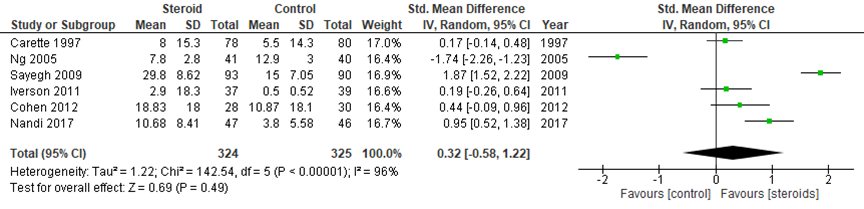
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘functionele score na 1 maand’ is met twee niveaus verlaagd gezien vanwege het geringe aantal patiënten (imprecisie) en vanwege variatie in de resultaten (inconsistentie). Vanwege het studiedesign is het startpunt GRADE ‘hoog’, de uiteindelijke bewijskracht komt uit op GRADE ‘laag’.
2.2. functionele score na 3 maanden
De functionele score na 3 maanden is nagenoeg gelijk tussen de twee interventies met een SMD van -0,05 (95% BI -0,21 tot 0,11) in 10 studies. Ook dit verschil is niet klinisch relevant.
Figuur 8 Functionele score na 3 maanden bij epidurale corticosteroïde-injecties versus placebo
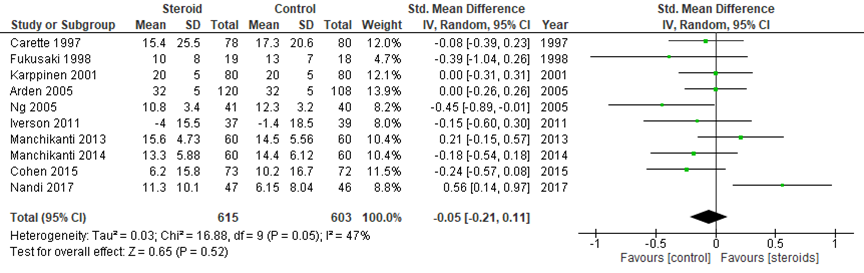
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘functionele score na 3 maanden’ is met twee niveaus verlaagd gezien vanwege het geringe aantal patiënten (imprecisie) en vanwege variatie in de resultaten (inconsistentie). Vanwege het studiedesign is het startpunt GRADE ‘hoog’, de uiteindelijke bewijskracht komt uit op GRADE ‘laag’.
2.3 Fysieke beperking op korte termijn
In figuur 9 is functie uitgedrukt als fysieke beperking (disability), waarbij een hogere waarde correspondeert met meer beperking. Het gepoolde SMD van 7 studies is 0.16 (95% BI 0.03 tot 0.30) in het voordeel van corticosteroïde-injecties. Dit verschil is niet klinisch relevant. Clustering van caudale, interlaminaire en transforaminale toediening toont geen verschillen in fysieke beperking tussen de toedieningsmethoden. Ook bij directe vergelijking van caudale en transforaminale toediening in twee studies beschreven in de SR van Liu (2016) werd geen significant verschil tussen de toedieningsmethoden (zie evidencetabel). De functiescore zoals beschreven door Manchikanti (2016) had geen aanvullende waarde ten opzichte van de uitgewerkte gegevens (zie evidencetabel).
Figuur 9 Fysieke beperking op korte termijn bij epidurale corticosteroïde-injecties versus placebo
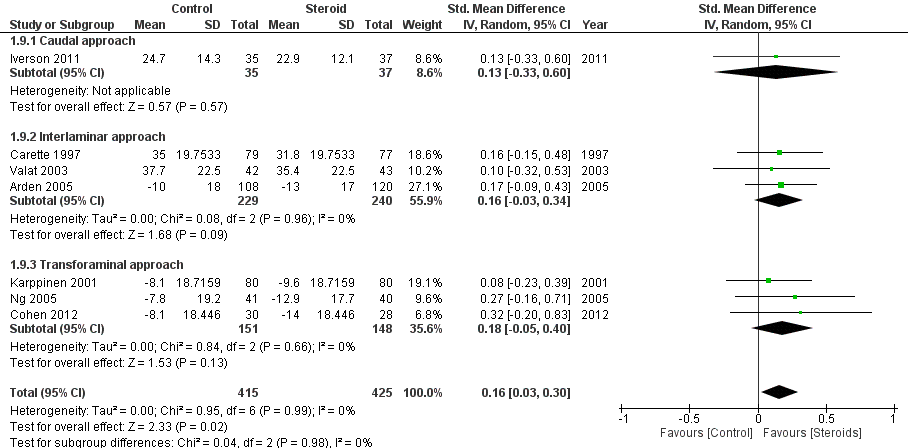
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘intensiteit van pijn na 6 maanden’ is met één niveau verlaagd gezien het geringe aantal patiënten (imprecisie). Vanwege het studiedesign is het startpunt GRADE ‘hoog’, de uiteindelijke bewijskracht komt uit op GRADE ‘redelijk’.
3. Uitkomstmaat Adverse effects (belangrijk)
In figuur 10 zijn de verschillen in adverse effects tussen epidurale corticosteroïde-injecties en placebo injecties of alternatieve zorg (usual care) samengevat zoals geanalyseerd door Lewis (2011). In deze review is niet gespecificeerd welke adverse events werden gerapporteerd per studie, maar in het algemeen kunnen bij epidurale corticosteroïde-injecties adverse events voorkomen ten gevolge van de procedure (dural puncture, hematoom, infectie, zenuwschade), welke ook kunnen optreden bij placebo-injectie, en ten gevolge van de steroïden (hyperglykemie, hypertensie, oedeem, gewichtstoename, myopathie, osteoporose en fracturen, infecties, psychose, en cataract), zoals beschreven in de review van Bhatia (2016). In 7 studies die corticosteroïden vergeleken met injectie zonder actieve component is een relatief risico gevonden van 0,82 (95% BI 0,54 tot 1,26) in het voordeel van de placebogroep. Dit verschil is niet klinisch relevant. Vergeleken met usual care, bestaande uit fysiotherapie, pijnstilling, zelfzorginstructie en/of activiteitsmodificatie, gaf steroïde-injectie een RR op adverse effects van 0,30 (95% BI 0,12 tot 0,75), een klinisch relevant verschil. Samengenomen was het RR op adverse effects van de interventie corticosteroïde-injecties ten opzichte van placebo/usual care 0,57 (95% BI 0,38 tot 0,85) in het voordeel van de controlegroep. Dit verschil is klinisch relevant.
Figuur 10 Adverse effects bij epidurale corticosteroïde-injecties versus usual care
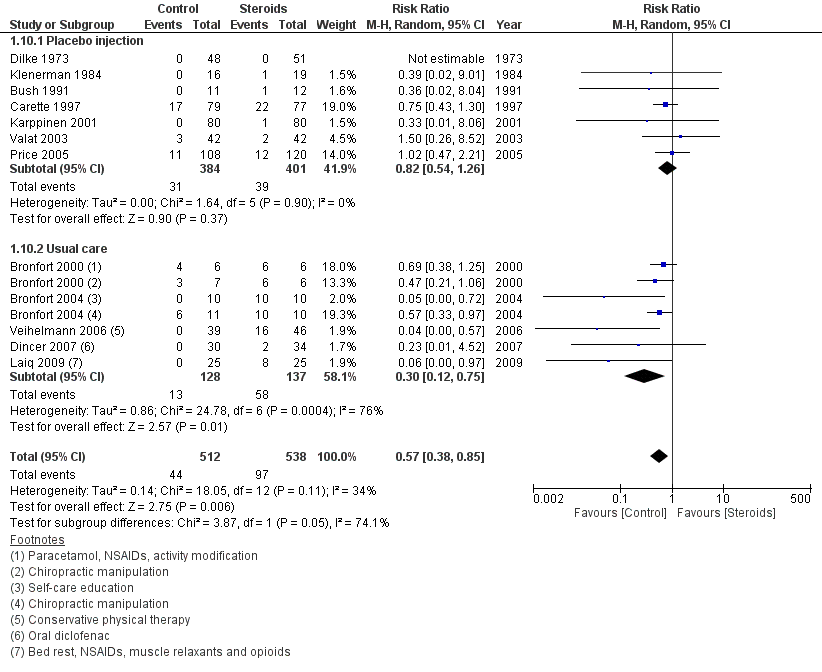
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘Adverse effects’ is met twee niveaus verlaagd gezien het geringe aantal patiënten en voor het overschrijden van de grenzen voor klinische relevantie (-2, imprecisie). Vanwege het studiedesign is het startpunt GRADE ‘hoog’, de uiteindelijke bewijskracht komt uit op GRADE ‘redelijk’.
4. Uitkomstmaat Werkhervatting (belangrijk)
Deze uitkomstmaat werd niet gerapporteerd.
Bewijskracht van de literatuur
Er is geen GRADE-beoordeling voor de uitkomstmaat ‘Werkhervatting’ in verband met het ontbreken van studies die deze uitkomstmaat beschrijven.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Leiden epidurale steroïdinjecties tot betere uitkomsten bij patiënten met LRS vergeleken met usual care?
PICO
P: patiënten met (sub)acute lumbosacraal radiculair syndroom;
I: steroïd-injectie (+ usual care);
C: usual care;
O: Pijn(vermindering), functioneren, adverse effects en werkhervatting.
Relevante uitkomstmaten
De werkgroep achtte pijn en functioneren voor de besluitvorming cruciale uitkomstmaat; en adverse effects en werkhervatting voor de besluitvorming belangrijke uitkomstmaten. De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Voor het vaststellen van klinische relevantie, de zogenaamde minimal clinically important difference (MCID), heeft de werkgroep zich gebaseerd op het artikel van Ostelo (2008), waar een 20% tot 30% verbetering ten opzichte van de baseline meting als minimaal klinisch relevant verschil wordt aangehouden (within-group change; verschil binnen een groep). De werkgroep is echter geïnteresseerd in between-group changes (verschil tussen twee groepen). Een verschil van 20-30 % tussen groepen werd door de werkgroep als (te) groot bestempeld. De werkgroep heeft besloten om een verschil van 10% aan te duiden als minimaal klinisch relevant verschil. Dit komt grofweg overeen met een verschil van één op de visuele analoge schaal (VAS-schaal: 0 tot 10), één op de numeric rating scale (NRS-schaal: 0 tot 10), drie op de Roland Disability Questionnaire (0 tot 24) en 10 op de oswestry disability (ODI) index (schaal 0 tot 100). Bij risk ratio’s en odds ratio’s worden de grenzen 0,91 en 1,1 aangehouden. Standardized mean difference (SMD=0,2 (klein); SMD=0,5 (matig); SMD=0,8 (groot).
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 31 januari 2019 met relevante zoektermen gezocht naar de effectiviteit van epidurale steroïde-injecties bij lumbosacraal radiculair syndroom. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 243 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- gepubliceerd tussen 2007 en januari 2019;
- (systematische reviews over) primair vergelijkend onderzoek;
- artikel full-tekst beschikbaar in het Engels of Nederlands;
- beschrijving van patiënten met acute en subacute LRS.
Voor controlegroep en uitkomstmaat werd in eerste instantie niet geselecteerd. Op basis van titel en abstract werden 27 systematische reviews (SR’s) voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 21 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en 6 SR’s definitief geselecteerd. Gezien de recente publicatie en hoeveelheid studies beschreven in de SR’s zijn er geen afzonderlijke RCT’s toegevoegd.
Resultaten
Zes SR’s van Lee (2018), Manchikanti (2016), Pinto (2012), Lewis (2011), Bhatia (2016) en Liu (2016) zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Bhatia A, Flamer D, Shah PS, Cohen SP. Transforaminal Epidural Steroid Injections for Treating Lumbosacral Radicular Pain from Herniated Intervertebral Discs: A Systematic Review and Meta-Analysis. Anesth Analg. 2016 Mar;122(3):857-70. doi: 10.1213/ANE.0000000000001155. Review. PubMed PMID: 26891397
- Benoist M, Boulu P, Hayem G. Epidural steroid injections in the management of low-back pain with radiculopathy: an update of their efficacy and safety. Eur Spine J 2012;21:204-13.
- Benzon HT, Huntoon MA, Rathmell JP. Improving the Safety of Epidural Steroid Injections. JAMA. 2015;313(17):1713–1714.
- Gharibo CG, Varlotta GP, Rhame EE, Liu EC, Bendo JA, Perloff MD. Interlaminar versus transforaminal epidural steroids for the treatment of subacute lumbar radicular pain: a randomized, blinded, prospective outcome study. Pain Physician. 2011;14:499–511.
- Hofstee DJ, Gijtenbeek JM, Hoogland PH, et al. Westeinde sciatica trial: randomized controlled study of bed rest and physiotherapy for acute sciatica. J Neurosurg. 2002;96(Suppl):45-9
- Koes BW, van Tulder MW, Peul WC. Diagnosis and treatment of sciatica. BMJ. 2007;23;334(7607):1313-7. Review. PubMed PMID: 17585160; PubMed Central PMCID: PMC1895638
- Lee JH, Kim DH, Kim DH, Shin KH, Park SJ, Lee GJ, Lee CH, Yang HS. Comparison of Clinical Efficacy of Epidural Injection With or Without Steroid in Lumbosacral Disc Herniation: A Systematic Review and Meta-analysis. Pain Physician. 2018 Sep;21(5):449-468. PubMed PMID: 30282390
- Lewis R, Williams N, Matar HE, Din N, Fitzsimmons D, Phillips C, Jones M, Sutton A, Burton K, Nafees S, Hendry M, Rickard I, Chakraverty R, Wilkinson C. The clinical effectiveness and cost-effectiveness of management strategies for sciatica: systematic review and economic model. Health Technol Assess. 2011 Nov;15(39):1-578. doi: 10.3310/hta15390. Review. PubMed PMID: 22078311; PubMed Central PMCID: PMC4781007
- Liu J, Zhou H, Lu L, Li X, Jia J, Shi Z, Yao X, Wu Q, Feng S. The Effectiveness of Transforaminal Versus Caudal Routes for Epidural Steroid Injections in Managing Lumbosacral Radicular Pain: A Systematic Review and Meta-Analysis. Medicine (Baltimore). 2016 May;95(18):e3373. doi: 10.1097/MD.0000000000003373. Review. PubMed PMID: 27149443; PubMed Central PMCID: PMC4863760
- Manchikanti L, Knezevic NN, Boswell MV, Kaye AD, Hirsch JA. Epidural Injections for Lumbar Radiculopathy and Spinal Stenosis: A Comparative Systematic Review and Meta-Analysis. Pain Physician. 2016 Mar;19(3):E365-410. Review. PubMed PMID: 27008296
- Ostelo RW, Deyo RA, Stratford P, et al. Interpreting change scores for pain and functional status in low back pain: towards international consensus regarding minimal important change. Spine (Phila Pa 1976). 2008;1;33(1):90-4.
- Pinto RZ, Maher CG, Ferreira ML, Hancock M, Oliveira VC, McLachlan AJ, Koes B, Ferreira PH. Epidural corticosteroid injections in the management of sciatica: a systematic review and meta-analysis. Ann Intern Med. 2012 Dec 18;157(12):865-77. Review. PubMed PMID: 23362516.
- Rados I, Sakic K, Fingler M, Kapural L. Efficacy of interlaminar versus transforaminal epidural steroid injection for the treatment of chronic unilateral radicular pain: prospective, randomized study. Pain Med. 2011;12:1316–1321.
- Schaufele MK, Hatch L, Jones W. Interlaminar versus transforaminal epidural injections for the treatment of symptomatic lumbar intervertebral disc herniations. Pain Physician. 2006 Oct;9(4):361-6.
- Ter Meulen BC, Maas ET, Vyas A, van der Vegt M, de Priester K, de Boer MR, van Tulder MW, Weinstein HC, Ostelo RWJG. Treatment of acute sciatica with transforaminal epidural corticosteroids and local anesthetic: design of a randomized controlled trial. BMC Musculoskelet Disord. 2017 May 25;18(1):215.
- Vroomen PC, de Krom MC, Slofstra PD, et al. Conservative treatment of sciatica: a systematic review. J Spinal Disord. 2000;13:463–469.
Evidence tabellen
Risk of Bias tabellen
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/ unclear |
Comprehensive and systematic literature search?2
Yes/no/ unclear |
Description of included and excluded studies?3
Yes/no/ unclear |
Description of relevant characteristics of included studies?4
Yes/no/ unclear |
Appropriate adjustment for potential confounders in observational studies?5 Yes/no/ unclear/ notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/ unclear |
Enough similarities between studies to make combining them reasonable?7 Yes/no/ unclear |
Potential risk of publication bias taken into account?8
Yes/no/ unclear |
Potential conflicts of interest reported?9
Yes/no/ unclear |
|
Lee, 2018 |
Yes: “This study investigated whether epidural injection of steroids produces better clinical effects than local anesthetics or saline in the treatment of LDH.” |
yes |
yes |
yes |
NA |
yes |
yes |
Yes: “Publication bias was not assessed because fewer than 10 studies were included in each meta-analysis.” |
Unclear |
|
Bhatia, 2016 |
Yes: The primary objective of this SR-MA was to determine the analgesic efficacy of TFE steroids compared with local anesthetics and/or saline or conservative management for lumbosacral radicular pain secondary to herniated intervertebral disks 1 to 3 months after injection.” |
yes |
yes |
yes |
NA |
yes |
yes |
Yes: “Publication bias was not assessed with a funnel plot because low number of eligible studies (<10) decreases the power of the tests to distinguish chance from real asymmetry.” |
Unclear |
|
Liu, 2016 |
Yes: “In this review, we compared the effectiveness of TF-ESIs and C-ESIs with respect to pain and functional improvements in the treatment of radiculopathy.” |
yes |
yes |
yes |
NA |
yes |
yes |
No |
Unclear |
|
Manchi-kanti, 2016 |
Yes: “The purpose of this systematic review, therefore, is to assess the efficacy or lack thereof of injections of epidural steroids with saline, local anesthetics alone, or local anesthetic with steroids” |
yes |
yes |
no |
NA |
yes |
yes |
No |
Unclear |
|
Pinto, 2012 |
Yes: the aim of this systematic review was to determine the efficacy of all 3 anatomical approaches to epidural corticosteroid injection in the management of sciatica compared with placebo-control interventions. |
yes |
yes |
yes |
NA |
yes |
yes |
Yes, a Funnel plot was presented. |
Unclear |
|
Lewis, 2011 |
Yes: “To undertake a systematic review of the clinical effectiveness and cost-effectiveness of different management strategies for sciatica.” |
yes |
yes |
yes |
NA |
yes |
yes |
Yes: “For all comparisons for which there were more than eight studies, funnel plots together with associated statistical tests were used to assess the potential publication bias.” |
Unclear |
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table et cetera).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (for example Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (for example funnel plot, other available tests) and/or statistical tests (for example Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Akuthota, 2009 |
Narrative review |
|
Benny, 2011 |
Narrative review |
|
Benoist, 2012 |
Data niet op bruikbare wijze beschreven |
|
Chou, 2015a |
Overlapt met andere reviews/studies |
|
Chou, 2015b |
Geen afzonderlijke studiedata, niet te combineren met andere studies |
|
Chou, 2009 |
Oude versie van Chou, 2015 |
|
Guo, 2017 |
Geen onderscheid acuut-chronisch |
|
Jordan, 2011 |
Semikwantitatief, niet bruikbaar |
|
Jordan, 2009 |
Oude versie van Jordan, 2011 |
|
Lee, 2018 |
Voldoet niet aan de PICO |
|
Levin, 2009 |
Narrative review |
|
Luijsterberg, 2007 |
Data niet op bruikbare wijze beschreven |
|
MacVicar, 2013 |
Data niet op bruikbare wijze beschreven |
|
Metha, 2017 |
Data niet kwantitatief beschreven |
|
Pinto, 2012 |
Data niet op bruikbare wijze beschreven |
|
Quraishi, 2012 |
Onvoldoende informatie beschreven in SR |
|
Roberts, 2009 |
Narrative review |
|
Roncoroni, 2011 |
Beschrijft systemische steroïden, voldoet niet aan PICO. |
|
Sethee, 2009 |
Data niet op bruikbare wijze beschreven |
|
Stafford, 2007 |
Data niet op bruikbare wijze beschreven |
|
Vorobeychik, 2016 |
Beschrijft geen RCTs |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 21-09-2020
Laatst geautoriseerd : 21-09-2020
Geplande herbeoordeling :
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2025 bepaalt het bestuur van de Nederlandse Vereniging voor Neurologie (NVN) of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVN is regiehouder van deze richtlijnmodules en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module1 |
Regiehouder(s)2 |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn3 |
Frequentie van beoordeling op actualiteit4 |
Wie houdt er toezicht op actualiteit5 |
Relevante factoren voor wijzigingen in aanbeveling6 |
|
epidurale steroïd-injecties |
NVN |
2020 |
2021 |
Elke 3 jaar |
NVN |
Zodra de PLUS-studie en de STAR-trial zijn gepubliceerd kan worden overwogen de module te herzien. Echter beantwoorden deze vragen een net iets andere PICO. |
|
1 Naam van de module 2 Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders) 3 Maximaal na vijf jaar 4 (half)Jaarlijks, eens in twee jaar, eens in vijf jaar 5 Regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft 6 Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen |
||||||
Algemene gegevens
Deze richtlijn is ontwikkeld in samenwerking met:
-
Nederlands Huisartsen Genootschap
- Nederlandse Vereniging voor Arbeids- en Bedrijfsgeneeskunde
-
Koninklijk Nederlands Genootschap voor Fysiotherapie
- Samenwerkingsverband Pijnpatiënten naar één stem
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Het doel van de richtlijn is tweeledig. Enerzijds is de richtlijn een voortzetting van de richtlijn LRS uit 2008 met herziening op basis van de nieuwe literatuur. Anderzijds dient de richtlijn als handleiding voor de praktijk met betrekking tot de patiënt met rugpijn met uitstraling in een been. Er is namelijk, voorafgaande aan beeldvorming, geen klinische test of vragenlijst waarmee de klinische diagnose LRS met volledige zekerheid kan worden gesteld (zie module diagnostiek). Het kunstmatige onderscheid tussen radiculaire en niet-radiculaire pijn komt hiermee te vervallen.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met LRS. De richtlijn is bedoeld voor neurologen, anesthesiologen, radiologen, neurochirurgen, orthopeden, huisartsen, fysiotherapeuten, bedrijfs- en verzekeringsartsen revalidatieartsen, en eventuele andere behandelaars van patiënten zoals Caesar- en Mensendieck therapeuten en ergotherapeuten.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met een verdenking lumbosacraal radiculair syndroom (LRS) te maken hebben.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Dr. R.H. Boerman, neuroloog, werkzaam in Rijnstate, Arnhem, NVN (voorzitter)
- Dr. W.J.P. Henneman, radioloog, werkzaam in het Maastricht UMC+, Maastricht, NVvR (vanaf oktober 2019)
- Drs. B.A. Brouwer, neuroloog, werkzaam in het Maastricht UMC+, Maastricht, NVN
- Drs. J. de Haan, orthopedisch chirurg, werkzaam in het Amphia Ziekenhuis, Breda, NOV
- Dr. J.L. Hoving, senior onderzoeker, werkzaam in het Amsterdam UMC, locatie AMC, Amsterdam, NVAB
- Dr. E.M. Kingma, AIOS neurologie, werkzaam in het Universitair Medisch Centrum Groningen, Groningen, NVN
- Dr. B.C. ter Meulen, neuroloog, werkzaam in het Zaans Medisch Centrum, Zaandam, NVN
- Dr. E. de Schepper, huisarts, werkzaam in het Erasmus MC, Rotterdam. NHG
- Prof. dr. R.J.E.M. Smeets, hoogleraar Revalidatiegeneeskunde & revalidatiearts, werkzaam in bij de Universiteit Maastricht & CIR Revalidatie, VRA
- Dr. J. B. Staal, fysiotherapeut n.p. & senior onderzoeker/epidemioloog, werkzaam in het Radboudumc en de Hogeschool van Arnhem en Nijmegen, Nijmegen, KNGF
- Drs. M.A.M.B. Terheggen, anesthesioloog, werkzaam in Rijnstate, Arnhem, NVA
- Drs. I.L. Thomassen, patiëntvertegenwoordiger & voorzitter van Samenwerkingsverband Pijnpatiënten naar één stem.
- Dr. C.L.A.M. Vleggeert – Lankamp, Neurochirurg, Leids Universitair Medisch Centrum, Leiden, NVvN
Met ondersteuning van
- Dr. J. Buddeke, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. A.A. Lamberts, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. L.H.M. Niesink-Boerboom, literatuurspecialist, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u hieronder. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Achternaam werkgroeplid |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Getekend op |
Ondernomen actie? |
|
Boerman |
neuroloog staflid Rijnstate ziekenhuis |
lid tuchtcolleges Groningen, Eindhoven, Amsterdam en Zwolle |
geen |
geen |
geen |
geen |
geen |
20-6-2018 |
Geen actie |
|
Brouwer |
Neuroloog afdeling anesthesiologie MUMC+ |
Lid algemeen bestuur P.A.I.N. (onbetaald) |
geen |
geen |
geen |
geen |
Afdeling waar WG-lid werkzaam is heeft van Medtronic een Grant ontvangen. |
12-6-2018 |
Geen actie |
|
Buddeke |
Adviseur, Kennisinstituut van de Federatie Medisch Specialisten |
geen |
geen |
geen |
geen |
geen |
geen |
2018 |
Geen actie |
|
de Haan |
Orthopaedisch chirurg, Amphia breda |
geen |
geen |
geen |
geen |
geen |
geen |
5-6-2018 |
Geen actie |
|
de Schepper |
Onderzoeker (UD), huisarts (np), afdeling Huisartsgeneeskunde, Erasmus MC Rotterdam |
geen |
geen |
geen |
geen |
Promotieonderzoek Beeldvormende diagnostiek |
geen |
1-5-2018 |
Geen actie |
|
Henneman |
Radiolooog MUMC+, Maastricht |
geen |
geen |
geen |
geen |
geen |
geen |
16-12-2019 |
Geen actie |
|
Hoving |
Wetenschappelijk onderzoeker, Coronel Instituut voor Arbeid en Gezondheid, Academisch Medisch Centrum in Amsterdam |
geen |
geen |
geen |
geen |
Betrokken bij richtlijn Arbeid en rugklachten LRS van de NVAB. |
geen |
2-7-2018 |
Geen actie |
|
Kingma |
Arts-assistent in opleiding tot neuroloog, Universitair Medisch Centrum Groningen |
geen |
geen |
geen |
geen |
geen |
geen |
11-6-2018 |
Geen actie |
|
Lamberts |
Senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten |
Beleidsmedewerker Kwaliteit Nederlandse Vereniging voor Klinische Geriatrie |
geen |
geen |
geen |
geen |
geen |
2014 |
Geen actie |
|
Smeets |
Hoogleraar Revalidatiegeneeskunde, Universiteit Maastricht (0.4 fte) |
Eigen bedrijf genaamd RevaXpert; inhuur van mijn expertise voor scholing derden op het gebied van chronische pijn in houding en bewegingsapparaat in de vorm van presentaties, gemiddeld twee keer per jaar. (Betaald) |
geen |
geen |
Niet betrokken bij wetenschappelijk onderzoek dat betrekking heeft op de inhoud van deze richtlijn. |
Geen risico op aantasting van intellectuele belangen of reputatie |
geen |
8-6-2018 |
Geen actie |
|
Staal |
Lector musculoskeletale revalidatie hogeschool, van Arnhem en Nijmegen (0,8 fte), |
-Section editor BMC Musculosceletal disorders (betaald) |
geen |
geen |
geen |
geen |
geen |
14-5-2018 |
Geen actie |
|
ter Meulen |
Neuroloog zaans MC |
Lid Raad van Advies NVvR de Wervelkolom (onbetaald) |
geen |
geen |
geen |
Promotieonderzoek naar Wortelblokkades, Amsterdam UMC, locatie Vumc |
geen |
27-6-2018 |
Geen actie |
|
Terheggen |
Anesthesioloog/pijnspecialist Rijnstate Arnhem/Velp/Zevenaar (1,0 fte) |
Specialist-manager Pijncentrum en Acute PijnService Rijnstate (betaald) |
geen |
Echtgenote is werkzaam bij Pfizer inc. .Geen mogelijke belangen-verstrengeling aangezien Pfizer geen gepatenteerde producten (meer) levert geïndiceerd bij LRS |
geen |
geen |
geen |
3-7-2018 |
Geen actie |
|
Thomassen |
Voorzitter Samenwerkingsverband Pijnpatiënten naar één stem (vacatiegelden) Voorzitter Patiëntenvereniging CRPS (vrijwilliger) |
geen |
geen |
geen |
geen |
geen |
geen |
19-7-2018 |
Geen actie |
|
Vleggeert |
Neurochirurg LUMC, (1,0 fte) |
- Secretaris van de Board van de Cervical Spine Research Society Europe (onbetaald) |
geen |
geen |
Onderzoek naar epiduraalinjecties bij sciatica (Ynske Meyesfonds). |
geen |
geen |
25-4-2018 |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde van een patiëntenvereniging plaats te laten nemen in de werkgroep. Tijdens de oriënterende zoekactie werd gezocht op literatuur naar patiëntenperspectief (zie Strategie voor zoeken en selecteren van literatuur). De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland, het Samenwerkingsverband Pijnpatiënten naar één stem, de Nederlandse Vereniging van Rugpatiënten 'De Wervelkolom' en de Dwarslaesie Organisatie Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijnmodules en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naarhet stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door verschillende stakeholders tijdens de invitational conference. Een verslag van deze bijeenkomst is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur conceptuitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er is op 23 januari 2019 oriënterend gezocht naar bestaande buitenlandse richtlijnen en literatuur over patiëntvoorkeuren en patiëntrelevante uitkomstmaten. Voor de afzonderlijke uitgangsvragen is aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaalt dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008) en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Randvoorwaarden conservatief en in de module Randvoorwaarden chirurgische ingreep.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.

