Fosfodiësterase-3 en -4 remmers bij longaanval astma
Uitgangsvraag
Wat is de plaats van fosfodiësterase-3 en -4 remmers in de behandeling op de spoedeisende hulp en intensive care van volwassenen met een longaanval astma?
Aanbeveling
Vermijd routinematige inzet van fosfodiësteraseremmers bij de behandeling van een longaanval astma.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er zijn geen gerandomiseerde studies gevonden die rapporteerden over de cruciale uitkomstmaten voorkomen van beademing, duur van beademing, verblijfsduur op de IC, IC opname en mortaliteit. Op basis van de geïncludeerde systematische review is het effect van fosfodiësterase-3 en -4 remmers op het voorkomen van bijwerkingen onduidelijk. Zo lijkt het dat behandeling met fosfodiësterase-3 en -4 remmers de kans op overgeven en palpitatie/hartritmestoornis kan verhogen, de kans op het ontstaan van een tremor is onduidelijk. De onduidelijkheid van de resultaten is te wijten aan de zeer ruime onzekerheidsmarges in de resultaten, die het gevolg zijn van een klein aantal deelnemers aan de geïncludeerde studie en het gebrek aan een duidelijk effect (het effect is kleiner dan het op voorhand vastgestelde klinisch relevante effect). Daarnaast liet een subgroep-analyse zien dat er geen verschil leek te zijn in het effect van behandeling met fosfodiësterase-3 en -4 remmers van patiënten met een matige of een ernstige longaanval astma. De geïncludeerde studie was kwalitatief goed uitgevoerd, echter onnauwkeurigheid (imprecisie) en indirectheid van de resultaten leidden tot afwaardering binnen de GRADE-methodiek (met 1 tot 2 levels) toch tot een lage bewijskracht. De algemene bewijskracht voor alle uitkomstmaten komt daarmee op laag. Het is mogelijk dat goed uitgevoerd onderzoek in grotere onderzoekspopulaties de precisie van de resultaten sterk zou vergroten.
Een in 2014 verschenen case-series van Beute et al (BJA, 2014), niet in het literatuuroverzicht opgenomen vanwege te lage bewijslast, behandelt de toepassing van een intraveneuze bolus van de PDE-3 remmer enoximone. In totaal kregen 8 patiënten met een respiratoire acidose op basis van een longaanval astma een bolus van 30-100mg enoximone, meestal gevolgd door continue toediening van 8mg/uur naast standard of care. Twee patiënten hadden 1 en 5 dagen beademing nodig; 4 patiënten zijn na SEH-bezoek naar huis ontslagen, 2 zijn opgenomen waarvan 1 om een andere reden dan longaanval astma. Cardiovasculaire bijwerkingen werden niet gezien. Hoewel het effect opvallend is, kan op grond van deze studie en aan de hand van de in de discussie van dat artikel gepresenteerde literatuuroverzicht geen conclusie worden getrokken over de werkzaamheid van een bolus enoximone bij patiënten die presenteren met een ernstige longaanval astma en respiratoire acidose. Overigens is milrinone (eveneens PD#-remmer) in de acute setting niet geschikt: het middel heeft sterker vaatverwijdende eigenschappen waarmee het ernstige hypotensie kan veroorzaken in geval van toediening van een bolus.
Op basis van gebrek aan gedocumenteerde effectiviteit in de setting van een longaanval astma en het verhoogde risico op bijwerkingen lijkt er vooralsnog geen plaats te zijn voor inzet van PDE-3 or PDE-4 remmers in de standaardbehandeling van een longaanval astma op de SEH. Het is niet te verwachten dat er in de nabije toekomst nog studies gedaan gaan worden naar gebruik van theofylline en aanverwante middelen bij patiënten met een longaanval astma aangezien deze geneesmiddelen al langdurig uit patent zijn. In incidentele gevallen kan bij eerder bewezen effectiviteit en veiligheid gekozen worden voor een intraveneuze fosfodiësteraseremmer. Wel is het van belang om de patiënt klinisch te monitoren met hartfrequentie en spiegelbepaling.
In een 'rug tegen de muur-situatie’ is bij zeer ernstig zieke patiënten die op grond van hun longaanval astma een respiratoire acidose hebben ontwikkeld waarvoor beademing noodzakelijk is, anekdotisch bewijs dat een bolus enoximone tot snelle bronchusrelaxatie zou kunnen leiden. Echter dient dit altijd in een bewaakte setting toegediend te worden. Op dit moment ontbreekt vooralsnog het bewijs om hierover een aanbeveling te kunnen formuleren.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Vanwege goede alternatieve behandelingen die voor handen zijn lijkt er geen plaats te zijn voor fosfodiësteraseremmers bij de acute behandeling van een longaanval astma, uitzonderingen daargelaten (zie vorige paragraaf). Mocht het middel gestart worden, dan is het van belang om mogelijke effectiviteit, bijwerkingen en risico’s indien mogelijk met de patiënt te bespreken om zodoende een gezamenlijke afweging te maken.
Kosten (middelenbeslag)
Fosfodiësteraseremmers zijn goedkoop waardoor kosten geen argument zijn om het middel niet in te zetten. Wat wel een steeds groter probleem wordt is de slechte beschikbaarheid ten gevolge van beperkte productiecapaciteit en leveringsproblemen.
Aanvaardbaarheid, haalbaarheid en implementatie
Gezien eerdergenoemde argumenten lijkt de inzet van fosfodiësteraseremmers geen aanvullende waarde te hebben bij de protocollaire behandeling van een longaanval astma. Een implementatietraject is daarmee niet aan de orde.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Het ontbreken van bewezen effectiviteit, afgezet tegen het verhoogde risico op ernstige bijwerkingen, maken fosfodiësteraseremmers niet geschikt in de setting van een longaanval astma. In incidentele gevallen (zie overwegingen) kan hiervan afgeweken worden.
Onderbouwing
Achtergrond
Fosfodiësterase-3 en -4 remmers, zoals theofylline, aminofylline en enoximone worden al meer dan 50 jaar gebruikt bij de behandeling van (een longaanval) astma. Het kan systemisch worden toegediend waardoor de werking snel is. Deze werking bestaat uit luchtwegverwijding en ontstekingsremming. In gladde spiercellen veroorzaken PDE-remmers een toename van het cAMP en cGMP, wat resulteert in relaxatie van bronchiale gladde spiercellen en daarmee verwijding van de luchtwegen. Het ontstekingsremmende effect komt door remming van PDE4 en histone deacetylase (HDAC)-2 activatie, waardoor geactiveerde ontstekingsgenen worden uitgeschakeld. Vergeleken met systemische corticosteroïden en β2-mimetica is de effectiviteit echter beperkt. Bijkomende nadelen voor theofylline zijn de smalle therapeutische breedte waardoor monitoring met spiegelbepaling in het bloed noodzakelijk is en frequente bijwerkingen zoals hartritmestoornissen en gastro-intestinale klachten. Mede hierdoor worden fosfodiësterase-3 en -4 remmers enkel als “last resort” ingezet bij de behandeling van een longaanval astma.
Conclusies
|
No GRADE |
No evidence was found regarding the effect of PDE3 or PDE4 inhibitors on ICU admission of patients with an acute asthma exacerbation. |
|
No GRADE |
No evidence was found regarding the effect of PDE3 or PDE4 inhibitors on the length of stay at the ICU of patients with an acute asthma exacerbation. |
|
No GRADE |
No evidence was found regarding the effect of PDE3 or PDE4 inhibitors on the prevention of mechanical ventilation in patients with an acute asthma exacerbation. |
|
No GRADE |
No evidence was found regarding the effect of PDE3 or PDE4 inhibitors on the duration of mechanical ventilation in patients with an acute asthma exacerbation. |
|
No GRADE |
No evidence was found regarding the effect of PDE3 or PDE4 inhibitors on mortality in patients with an acute asthma exacerbation. |
|
Low GRADE |
PDE3 or PDE4 inhibitors may increase the occurrence of palpitation/arrythmia as compared to control in patients with an acute asthma exacerbation.
Source: Nair (2012) |
|
Very low GRADE |
Due to the lack of data, it is not possible to draw a conclusion about the effect of PDE3 or PDE4 inhibitors on seizure (convulsions) in patients with an acute asthma exacerbation.
Source: Nair (2012) |
|
Moderate GRADE |
PDE3 or PDE4 inhibitors likely increase the occurrence of vomiting as compared to control in patients with an acute asthma exacerbation.
Source: Nair (2012) |
|
Very low GRADE |
The evidence is very uncertain regarding the effect PDE3 or PDE4 inhibitors on the occurrence of tremor in patients with an acute asthma exacerbation.
Source: Nair (2012) |
Samenvatting literatuur
Description of studies
Nair (2012) performed a systematic review of randomized controlled trials to compare the effect of intravenous aminophylline plus inhaled beta2- agonist with either placebo or inhaled or beta2-agonist in adult patients with moderate or severe acute asthma who attended the ED or other acute care settings. Patients all received standard of care, and were treated with or without corticosteroids or other bronchodilators, which was not part of the randomized treatment. Patients with COPD or patients who required mechanical ventilation at presentations and inpatients for more than 24 hours were excluded. Patients could receive intravenous aminophylline at an initial loading dose, maintenance infusion or both. The doses of aminophylline and other medications varied among studies. A total of 17 studies were included, of which 11 studies were relevant for this guideline as they reported on adverse events (seizure, tremor, vomiting, arrythmia/palpitation). Of note, 2 studies (Siegel, 1985 and Wrenn, 1991) were included in this systematic review and reported on adverse events. These studies were included in the systematic review by Nair, but the results were not reported because the results could not be extracted from the original articles nor retrieved from the authors.
Results
The (un)beneficial effects of administrating PDE3 and/or PDE4 inhibitors – ICU admission (crucial)
No studies reported on the crucial outcome measure ICU admission.
The (un)beneficial effects of administrating PDE3 and/or PDE4 inhibitors – length of stay at the ICU (crucial)
No studies reported on the crucial outcome measure length of stay at the ICU.
The (un)beneficial effects of administrating PDE3 and/or PDE4 inhibitors – prevention of mechanical ventilation (crucial)
No studies reported on the crucial outcome measure prevention of mechanical ventilation.
The (un)beneficial effects of administrating PDE3 and/or PDE4 inhibitors – duration of mechanical ventilation (crucial)
No studies reported on the crucial outcome measure duration of mechanical ventilation.
The (un)beneficial effects of administrating PDE3 and/or PDE4 inhibitors – mortality (crucial)
No studies reported on the crucial outcome measure mortality.
The (un)beneficial effects of administrating PDE3 and/or PDE4 inhibitors – palpitation /arrythmia (crucial)
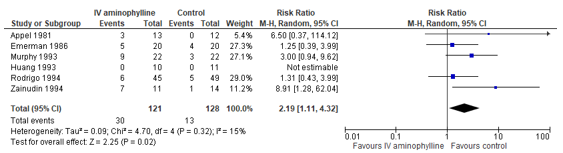
Nair (2012) reported odds ratios to estimate the effect of aminophylline versus control on the occurrence of palpitation/arrythmia. Eight (8) studies reported occurrence of palpitation/arrythmia, which were used to calculate a pooled risk ratio (see Figure 1). In the aminophylline group, the risk of arrhythmia was more than double the risk in the control group (represented by a pooled risk ratio of 2.19, 95% CI: 1.11 to 4.32). The confidence interval includes the minimal clinical important difference, but not the null effect.
Figure 1. Forest plot to compare the effect of aminophylline versus control on the occurrence of palpitation/arrythmia
The (un)beneficial effects of administrating PDE3 and/or PDE4 inhibitors – seizure (crucial)
Nair (2012) reported an odds ratio on convulsions (i.e. seizures). One study by Huang (1993) reported convulsions, but no patients in this study experienced a convulsion. Thereforem a risk ratio could not be estimated.
The (un)beneficial effects of administrating PDE3 and/or PDE4 inhibitors – vomiting (important)
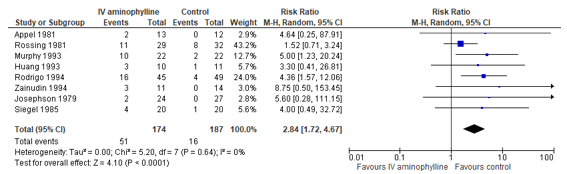
Nair (2012) reported odds ratios to estimate the effect of aminophylline versus control on the occurrence of vomiting. Eight (8) studies reported occurrence of vomiting, which were used to calculate a pooled risk ratio (see Figure 2). The risk of vomiting was 184% higher in the aminophylline group, compared to the control group (represented by a pooled risk ratio of 2.84, 95% CI: 1.72 to 4.67). The confidence interval does not include the minimal clinical important difference, nor the null effect.
Figure 2. Forest plot to compare the effect of aminophylline versus control on the occurrence of vomiting
The (un)beneficial effects of administrating PDE3 and/or PDE4 inhibitors – tremor (important)
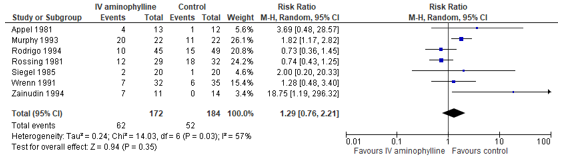
Nair (2012) reported odds ratios to estimate the effect of aminophylline versus control on the occurrence of tremor. Seven (7) studies reported occurrence of tremor, which were used to calculate a pooled risk ratio (see Figure 3). The risk of tremor was 29% higher in the group that was treated with aminophylline than in the control group (represented by a pooled risk ratio of 1.29, 95% CI: 0.76 to 2.21). The confidence interval includes the minimal clinical important difference, as well as the null effect.
Figure 3. Forest plot to compare the effect of aminophylline versus control on the occurrence of tremor
Level of evidence of the literature
The (un)beneficial effects of administrating PDE3 and/or PDE4 inhibitors – ICU admission (crucial)
The level of evidence regarding the outcome measure ICU admission was ungraded due to lack of data.
The (un)beneficial effects of administrating PDE3 and/or PDE4 inhibitors – length of stay at the ICU (crucial)
The level of evidence regarding the outcome measure length of stay at the ICU was ungraded due to lack of data.
The (un)beneficial effects of administrating PDE3 and/or PDE4 inhibitors – prevention of mechanical ventilation (crucial)
The level of evidence regarding the outcome measure prevention of mechanical ventilation was ungraded due to lack of data.
The (un)beneficial effects of administrating PDE3 and/or PDE4 inhibitors – duration of mechanical ventilation (crucial)
The level of evidence regarding the outcome measure duration of mechanical ventilation was ungraded due to lack of data.
The (un)beneficial effects of administrating PDE3 and/or PDE4 inhibitors – mortality (crucial)
The level of evidence regarding the outcome measure mortality was ungraded due to lack of data.
The (un)beneficial effects of administrating PDE3 and/or PDE4 inhibitors – palpitation /arrythmia (crucial)
The level of evidence regarding the outcome measure palpitation/arrythmia started as High (systematic review of clinical trials) and was downgraded by two levels to Low because of the imprecision (confidence interval crosses clinically important difference and low numbers of patients).
The (un)beneficial effects of administrating PDE3 and/or PDE4 inhibitors – seizure (crucial)
The level of evidence regarding the outcome measure seizure was ungraded due to lack of data.
The (un)beneficial effects of administrating PDE3 and/or PDE4 inhibitors – vomiting (important)
The level of evidence regarding the outcome measure palpitation/arrythmia started as High (systematic review of clinical trials) and was downgraded by one level to Moderate because of the imprecision (low numbers of patients).
The (un)beneficial effects of administrating PDE3 and/or PDE4 inhibitors – tremor (important)
The level of evidence regarding the outcome measure tremor started as High (systematic review of clinical trials) and was downgraded by three levels to Very low because of the imprecision (two levels: confidence intervals crossed clinically important difference on detrimental as well as beneficial effect directions) and the inconsistency (one level: effects of individual studies are both in the detrimental as well as beneficial effect directions).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the (un)beneficial effects of administrating phosphodiesterase-3 (PDE3) and -4 (PDE4) inhibitors to adults with an asthma exacerbation who present to the emergency department (ED) or who are subsequently admitted to an intensive care unit (ICU)?
P (Patients): Adult patients who present at the ED or who are admitted to an ICU with an asthma exacerbation
I (Intervention): Treatment with a PDE3 or PDE4 inhibitor (e.g. enoximone, theophylline, aminophylline, dimethylxanthine)
C (Comparison): Standard of care without treatment with a PDE3 or PDE4 inhibitor
O (Outcomes): CU admission and length of stay, prevention and duration of mechanical ventilation, mortality and adverse effects
Relevant outcome measures
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies. Following assessment of included literature, the guideline development group considered ICU admission, length of stay at the ICU, prevention of mechanical ventilation, duration of mechanical ventilation, mortality, and adverse effects palpitation/arrythmia and seizure as critical outcome measures for decision making. In addition, adverse effects vomiting and tremor were considered as important outcome measures for decision making.
The working group defined a reduction of the length of stay at the ICU with 1 day as a minimal clinically important difference. For the other outcome measures, the conventional minimal clinically important differences were used: a 10% difference in risk of mechanical ventilation, and mortality, and a 25% higher or lower risk of adverse events.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until December 21, 2021. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in unique 496 hits. Studies were selected based on the following criteria: systematic review of randomised controlled trials, randomised controlled trial, relevant to PICO, article in English or Dutch, no conference abstract. Eight (8) studies were initially selected based on title and abstract screening. After reading the full text, 7 studies were excluded (see the table with reasons for exclusion under the tab Methods), and 1 study was included.
Results
One (1) study was included in the analysis of the literature. Important study characteristics and results are summarized in the evidence table. The assessment of the risk of bias is summarized in the risk of bias table.
Referenties
- Hart SP. Should aminophylline be abandoned in the treatment of acute asthma in adults? QJM. 2000 Nov;93(11):761-5. doi: 10.1093/qjmed/93.11.761. PMID: 11077034.
- Littenberg B. Aminophylline treatment in severe, acute asthma. A meta-analysis. JAMA. 1988 Mar 18;259(11):1678-84. PMID: 3278146.
- Mahemuti G, Zhang H, Li J, Tieliwaerdi N, Ren L. Efficacy and side effects of intravenous theophylline in acute asthma: a systematic review and meta-analysis. Drug Des Devel Ther. 2018 Jan 10;12:99-120. doi: 10.2147/DDDT.S156509. PMID: 29391776; PMCID: PMC5768195.
- Nair P, Milan SJ, Rowe BH. Addition of intravenous aminophylline to inhaled beta(2)-agonists in adults with acute asthma. Cochrane Database Syst Rev. 2012 Dec 12;12(12):CD002742. doi: 10.1002/14651858.CD002742.pub2. PMID: 23235591; PMCID: PMC7093892.
- Nuhoglu Y, Nuhoglu C. Aminophylline for treating asthma and chronic obstructive pulmonary disease. Expert Rev Respir Med. 2008 Jun;2(3):305-13. doi: 10.1586/17476348.2.3.305. PMID: 20477194.
- Parameswaran K, Belda J, Rowe BH. Addition of intravenous aminophylline to beta2-agonists in adults with acute asthma. Cochrane Database Syst Rev. 2000;(4):CD002742. doi: 10.1002/14651858.CD002742. Update in: Cochrane Database Syst Rev. 2012;12:CD002742. PMID: 11034753.
- Johnson AJ, Spiro SG, Pidgeon J, Bateman S, Clarke SW. Intravenous infusion of salbutamol in severe acute asthma. Br Med J. 1978 Apr 22;1(6119):1013-5. doi: 10.1136/bmj.1.6119.1013. PMID: 638577; PMCID: PMC1603977.
- Yamauchi K, Kobayashi H, Tanifuji Y, Yoshida T, Pian HD, Inoue H. Efficacy and safety of intravenous theophylline administration for treatment of mild acute exacerbation of bronchial asthma. Respirology. 2005 Sep;10(4):491-6. doi: 10.1111/j.1440-1843.2005.00730.x. PMID: 16135173.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: What are the (un)beneficial effects of administrating phosphodiesterase-3 (PDE3) and -4 (PDE4) inhibitors to adults with an asthma exacerbation who present to the emergency department (ED) or who are admitted to an intensive care unit (ICU)?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Nair, 2012 |
SR of RCTs
Literature search up to 2002
A: Appel, 1981 B: Murphy, 1993 C: Rodrigo, 1994 D: Rossing, 1981 E: Zainudin, 1994 F: Huang, 1993 G: Josephson, 1979 H: Emerman, 1986
Study design and country: A: RCT, Not reported B: RCT, Not reported C: RCT, Not reported D: RCT, Not reported E: RCT, Not reported F: RCT, Not reported G: RCT, Not reported H: RCT, Not reported Source of funding and conflicts of interest: A: Not reported B: Not reported C: Not reported D: Not reported E: Not reported F: Not reported G: Not reported H: Not reported |
Inclusion criteria SR: -RCTs -Adult patients -Acute asthma attending EDs or acute care settings
Exclusion criteria SR: -Studies involving only children -Patients with COPD -Patients requiring mechanical ventilation at presentation -Inpatients >24 h
15 studies included in total, but 8 studies reported on relevant outcomes
N, mean age (SD) A: 12; 33 (19) B: 44; 28 (Not reported) C: 94; 36.2 (Not reported) D: 89; 30 (Intervention), 29 (Control) (Not reported) E: 25; Not reported (Not reported) F: 21; 32.8 (Intervention), 33.9 (Control) (Not reported) G: 44; 28 (Not reported) H: 40; 33 (Intervention); 29 (control) (Not reported)
Sex % Male A: 25% (total) B: 81.8% (total) C: 35.1% (total) D: 16.8% (total) E: Not reported F: 47.6% (total) G: 81.8% (total) H: I: 66% (total)
Groups comparable at baseline? A: Probably yes B: Probably yes C: Probably yes D: Probably yes E: Probably yes F: Probably yes G: Probably yes H: Probably yes |
Describe intervention:
A: 6mg/kg mg for 15 min; epinephrine SC: 1:1000: 0.3, 0.4 or 0.5 mL depending on body weight B: initial: metaproterenol sulfate nebulised. After 1 h: aminophylline IV 8 mg/kg/30 min + methylprednisolone IV 125 mg bolus C: All O2 by nasal prongs, 4L/min; aminophylline IV 5.6 mg/kg/20 min followed by 0.9 mg/kg/h maintenance salbutamol INH 400 µg + hydrocortisone IV 500 mg bolus D: All O2 by nasal prongs, 4L/min; aminophylline IV 5.6 mg/kg/20 min + epinephrine SC 1:1000, 0.3 ml at 0, 20 and 40 min E: All O2 45% for 24h; hydrocortisone IV and prednisolone; aminophylline IV for 48h + salbutamol INH 5mg F: All O2 to keep saturation >92%, aminophylline IV 1 mg/kg in 5% dextrose for 30 min. Levels maintained at theophylline concentrations 10-20 µg/ml + albuterol INH if needed G: aminophylline IV 5.6 mg/kg/ 20 min followed by 0.9 mg/kg/h for maintenance + epinephrine SC 1:1000, 0.3-0.5 ml at 0, 30 and 60 min H: All O2 by nasal cannula, 3L/min; aminophylline IV 5.6 mg/kg/20 min + epinephrine SC 1:1000, 0.3 ml every 20 min
|
Describe control:
A: placebo; epinephrine SC: 1:1000: 0.3, 0.4 or 0.5 mL depending on body weight B: initial: metaproterenol sulfate nebulised. After 1 h: saline + methylprednisolone IV 125 mg bolus
C: All O2 by nasal prongs, 4L/min; placebo + 0.9 mg/kg/h maintenance salbutamol INH 400 + hydrocortisone IV 500 mg bolus D: All O2 by nasal prongs, 4L/min; placebo (nothing) + epinephrine SC 1:1000, 0.3 ml at 0, 20 and 40 min
E: All O2 45% for 24h; hydrocortisone IV and prednisolone; placebo + salbutamol INH 5mg F: All O2 to keep saturation >92%, 5% dextrose + albuterol INH if needed G: saline + epinephrine SC 1:1000, 0.3-0.5 ml at 0, 30 and 60 min H: All O2 by nasal cannula, 3L/min; saline + epinephrine SC 1:1000, 0.3 ml every 20 min
|
End-point of follow-up:
A: Not reported B: Not reported C: Not reported D: Not reported E: Not reported F: Not reported G: Not reported H: Not reported
For how many participants were no complete outcome data available (%)? (intervention/control) A: 8.3% (total) B: Not reported C: I: 0%; C: 0% D: I: 0%; C: 0% E: I: 0%; C: 0% F: I3.3% (total) G: Not reported H: Not reported |
Outcome measure-1 Defined as tremor (AE)
Effect measure: OR [95% CI]: A: 4.89 (95% CI: 0.46, 51.87) B: 10 (95% CI: 1.87, 53.48) C: 0.65 (95% CI: 0.26, 1.64) D: 0.55 (95% CI: 0.2, 1.52) E: 48.33 (95% CI: 2.28, 1022.45) F: NA G: NA H: NA
Test for overall effect: Z=1.3 (P=0.19) Heterogeneity (I2): 77.4%
Outcome measure-2 Defined as vomiting (AE)
Effect measure: OR [95% CI]: A: 5.43 (95% CI: 0.24, 125.59) B: 8.33 (95% CI: 0.61, 5.49) C: 6.21 (95% CI: 1.89, 20.42) D: 1.83 (95% CI: 0.61, 5.49) E: 11.94 (95% CI: 0.55, 260.28) F: 4.29 (95% CI: 0.37, 50.2) G: 6.11 (95% CI: 0.28, 133.91) H: NA
Test for overall effect: Z=2.25 (P=0.02) Heterogeneity (I2): 0%
Outcome measure-3 Defined as arrhythmia /palpitations (AE)
Effect measure: OR [95% CI]: A: 8.33 (95% CI: 0.39, 180.36) B: 4.38 (95% CI: 0.99, 19.36) C: 1.35 (95% CI: 0.38, 4.79) D: NA E: 22.75 (95% CI: 2.11, 244.87) F: Not estimable G: NA H: 1.33 (95% CI: 0.3, 5.93)
Test for overall effect: Z=2.25 (P=0.02) Heterogeneity (I2): 34.18% |
Conclusion SR: There is insufficient evidence to support the routine use of aminophylline in the management of acute asthma when adequate inhaled beta2-agonist treatment is provided. The side effects associated with aminophylline treatment were more common than in the groups treated with beta2-agonists alone.
Personal remarks: The studies by Siegel, 1985 and Wrenn, 1991 were not included in the analysis for adverse events, without the provision of a reason for exclusion. Therefore, these 2 studies were manually included in the current analysis.
GRADE from SR per outcome Tremor: low Vomiting: moderate Arrhythmia/palpitation: moderate |
Risk of bias tabellen
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?
Yes/no/unclear |
Comprehensive and systematic literature search?
Yes/no/unclear |
Description of included and excluded studies?
Yes/no/unclear |
Description of relevant characteristics of included studies? Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies? Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?
Yes/no/unclear |
Potential risk of publication bias taken into account?
Yes/no/unclear |
Potential conflicts of interest reported?
Yes/no/unclear |
|
Nair, 2012 |
Yes |
Yes |
Yes |
No
Asthma exacerbation severity not reported. |
NA |
Yes |
Yes |
Yes |
Yes |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Mahemuti, G. (2018) |
Very unclear what the intervention is compared to (separate treatments or combined treatments of active comparators) and whether this is standard of care. => unable to process. |
|
Nuhoglu, Y. (2008) |
Narrative review |
|
Hart, S.P. (2000) |
sr <2002 |
|
Littenberg, B. (1988) |
sr <2002 |
|
Parameswaran, K. (2000) |
sr <2002 |
|
Yamauchi, K. (2005) |
Wrong comparison (control) |
|
Spiro, S.G. (1976) |
rct <2002 |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 19-02-2024
Laatst geautoriseerd : 19-02-2024
Geplande herbeoordeling : 19-02-2027
Algemene gegevens
De ontwikkeling van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2020 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg rondom de longaanval astma.
Samenstelling werkgroep
- Dr. E.J.M. (Els) Weersink, longarts, Amsterdam UMC te Amsterdam, NVALT (voorzitter)
- Drs. A. (Annelies) Beukert, longarts, Martini Ziekenhuis te Groningen, NVALT
- Dr. G.J. (Gert-Jan) Braunstahl, longarts, Franciscus Gasthuis & Vlietland te Rotterdam, NVALT
- Drs. R.C. (Rachel) Numan, AIOS longgeneeskunde, HagaZiekenhuis te ’s Gravenhage, NVALT
- Drs. L.C. (Louise) Urlings-Strop, intensivist, Reinier de Graaf Ziekenhuis, Delft, NVIC
- Drs. F.E.C. Geijsel, SEH-artsKNMG, OLVG te Amsterdam, NVSHA
- Dr. E.C. (Erwin) Vasbinder, ziekenhuisapotheker, Franciscus Gasthuis & Vlietland te Rotterdam, NVZA
- Prof. Dr. J.W.M. (Jean) Muris, huisarts en hoogleraar huisartsgeneeskunde, Maastricht UMC+ te Maastricht, NHG
- M.H.A. (Mariëtte) Scholma MSc, verpleegkundig specialist longziekten, Wilhelmina Ziekenhuis Assen te Assen, V&VN
- L.A.M. (Betty) Frankemölle, patiëntvertegenwoordiger, Longfonds
- M.A.P. (Marjo) Poulissen, patiëntvertegenwoordiger, Longfonds
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Weersink* |
Longarts, afdeling longziekten Academisch Medisch Centrum, Amsterdam |
voorzitter RL ernstig astma (afgerond) |
In 2017 voor meerdere farmaceutische bedrijven een betaald adviseurschap. (GSK, Novartis, TEVA, Chiesi Boehringer). In 2019-2020 nog wel adviseurschap niet meer tegen betaling. 2019: dienstverlening, bijdrage aan sympsoium van Astra Zeneca, Novartis, Genzyme BV 2019: vergoeding gastvrijheid Genzyme BV.
Bestuurslid stichting RAPSODI, de stichting die de database voor ernstig astma beheerd en mede gefinancierd wordt door ZONMW, Novartis, GSK, TEVA, Astra Zeneca en Sanofi. Hier is inmiddels een governance vastgelegd welke rol de farmaceuten hierbij hebben. |
Geen actie |
|
Urlings |
Intensivist (longarts) – Reinier de Graaf Gasthuis |
Waarneming diverse ziekenhuizen Intensive Care – betaald |
Geen |
Geen actie |
|
Vasbinder |
ziekenhuisapotheker |
Redacteur van medisch-farmaceutisch handboek “Praktische Farmacotherapie bij Longaandoeningen”, betaald door uitgever Lannoo Campus |
Betrokken bij meerdere onderzoeken bij patiënten met moeilijk behandelbaar/ernstig astma dat financieel wordt ondersteund door: * diverse zorgverzekeraars * TEVA (farmaceutische industrie) * Astra Zeneca (hoofdonderzoeker)
Geneesmiddeleninkoop voor het ziekenhuis, waaronder biologicals, verwachting dat deze binnen het kader van deze RL niet relevant zijn |
Geen actie |
|
Muris |
Universiteit Maastricht 1.0 fte Huisartspraktijk Geulle 17 werkdagen spreekuur / jaar |
Geen |
Webinar over orale corticosteroïden bij astma (GSK) |
Geen actie |
|
Geijsel |
SEH arts KNMG bij OLVG, tevens plaatsvervangend opleider en fellow opleider (95%) SEH arts bij MyEmergencyDoctor, Australische werkgever, telehealth (5%) |
EM-masterclass ontwikkelaar en faculty (betaald) |
Geen |
Geen actie |
|
Poulissen |
Projectleider zorg Longfonds full time (met detachering voor 12 uur naar astmaVereniging Nederland en Davos). |
Geen |
Geen |
Geen actie |
|
Beukert |
longarts te Martini Ziekenhuis Groningen tot 1-8-2021 Longarts te Deventer Ziekenhuis, Deventer, vanaf 23-8-2021 |
Secretaris Sectie Astma en Allergie (SAA) van de NVALT, onbetaald Lid werkgroep binnen SAA over biologicals, onbetaald |
Enkele keer deelname aan een betaalde adviesraadbijeenkomst (laatste in 2021, over biologicals) bij farmaceut maar dat houdt m.i. geen relatie met de inhoud van deze richtlijn |
Geen actie |
|
Numan |
AIOS longgeneeskunde HAGA ziekenhuis |
Geen |
Geen |
Geen actie |
|
Frankemölle |
Vrijwilligster bij het Longfonds, lid van de Longfonds Ervaringsdeskundigengroep. astmaVereniging Nederland en Davos Vrijwilligster European Lung Foundation, lid van SHARP |
Ik neem deel aan diverse werkgroepen maar geen van allen heeft als hoofdthema astma-aanval. |
Geen |
Geen actie |
|
Braunstahl |
Longarts, Franciscus Gasthuis & Vlietland Rotterdam |
Null-aanstelling ErasmusMC voor onderzoek: onbetaald. Deelname RL ernstig astma en KNO-RL, obesitas |
Vergoeding: Presentaties en incidenteel advieswerk voor Boehringer Ingelheim, Sanofi, Novartis, GSK, AstraZeneca, ALK, MEDA en Chiesi. (wrsch speelt deze longmedicatie geen rol in deze richtlijn)
Deelname richtlijn ernstig astma Deelname klankbordgroep van het project ‘Obesitas volwassenen’
Webinar over orale corticosteroïden bij astma (GSK)
Geen vergoeding: Redactie NTvAAKI Bestuur RoLeX astma/COPD nascholingen Bestuur Rapsodi, ernstig astma database NL Voorzitter astmasectie NVALT Wetenschappelijke adviescommissie Longfonds |
Geen actie |
|
Scholma |
Verpleegkundig specialist longziekten Wilhelmina Ziekenhuis Assen |
vrijwilliger longfonds, expertgroep zorgaanpak COPD (chiesi). Geen relatie met longaanval astma voorzitter kwaliteitsteam Assen van de HZD |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntperspectief door afgevaardigde patiëntenvereniging Longfonds in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan het Longfonds en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|
Module Fosfodiësterase-3 en -4 remmers bij longaanval astma |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met een longaanval astma.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodi
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. Doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. Doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. Doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. Doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. Doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. Doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.