Valpreventieprogramma’s
Uitgangsvraag
Wat is de plaats van valpreventie(oefen)programma’s op het voorkomen van vallen na een herseninfarct en/of hersenbloeding?
Aanbeveling
Overweeg valpreventieprogramma’s aan te bieden bij patiënten die weer loopvaardig worden of zijn na een hersenbloeding of herseninfarct.
Verwijzing naar valpreventieprogramma’s wordt gesteld door de behandelend medisch specialist (zoals neuroloog of revalidatiearts) dan wel behandelend fysio- of ergotherapeut.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Schattingen suggereren dat patiënten met een herseninfarct of hersenbloeding ongeveer 10 keer zoveel kans hebben om te vallen dan gezonde leeftijdsgenoten (Denissen, 2020). Geschat wordt dat 14 tot 65% van de patienten met een herseninfarct of hersenbloeding tenminste een keer valt tijdens opname in het ziekenhuis (Sullivian, 2020) Uit de literatuursamenvatting blijkt dat er een klinisch relevant effect is in het voordeel van valpreventieprogramma’s, in vergelijking met standaardzorg wanneer gekeken naar de cruciale uitkomstmaten valincidentie (per persoon/per bed) en het aantal patiënten dat ten minste één keer viel. Deze proportionele reductie is om nabij 21% t.o.v. de controlegroep. Deze programma’s laten zien dat ze veilig uit te voeren zijn. Er worden geen verschillen gevonden tussen patiënten qua ernst van infarct suggererend dat ook patiënten met een ‘minor’ stroke baat hebben bij valpreventieprogramma’s. Als gevolg van het ontbreken van grote trials en daarmee imprecisie van het effect, is de bewijskracht van deze gevonden effecten nog erg laag. De lage bewijskracht heeft ook te maken met beperkingen in de studieopzet door gebrek aan blindering en incomplete data (risk of bias). Vast staat echter dat door oefentherapie de kans om te vallen met ongeveer 10 tot 20% kan worden verminderd, terwijl medicatie of niet-oefentherapie-gerelateerde interventies niet helpen. Interventies gericht op contextuele factoren, zoals de huiselijke omgeving veiliger inrichten, zijn nog vrijwel niet onderzocht.
Het handhaven van de balans tijdens (op)staan en zich verplaatsen is bij patiënten met een herseninfarct of hersenbloeding in de meeste gevallen verminderd. Zelfs bij patiënten die een ‘minor stroke' of ‘licht herseninfarct’ hebben doorgemaakt, worden stoornissen in het handhaven van de balans gevonden, naast een twee keer zo hoge kans op vallen (Roelofs et al., 2023). Vanwege de voorname rol van balansstoornissen als valrisicofactor bestaan de onderzochte interventies veelal (deels) uit oefentherapie ter verbetering van de balans. De wijze waarop de oefentherapie wordt vormgegeven binnen de onderzochte interventies verschilt echter, en is mede afhankelijk van de ernst van de beperkingen en de beschikbare faciliteiten en apparatuur. Ernstig aangedane patiënten die nog een slechte stabalans hebben door sensomotorische uitval en/of angstig zijn om te vallen kunnen vooral in de vroege fase na CVA, oefenen met een vest, gezekerd aan een frame of plafond, zodat wordt voorkomen dat men werkelijk valt tijdens het oefenen (bijv. Dean, 2010). Ook bij minder ernstig aangedane patiënten wordt dit gebruikt tijdens uitdagende balansoefeningen, zoals het oefenen van opvangreacties na een balansverstoring (bijv. Mansfield, 2018). Een meerderheid van de onderzochte interventies betreft echter groepstrainingen onder begeleiding van een fysiotherapeut, welke vaak poliklinisch, in particuliere praktijken of in sportcentra gegeven worden. Van alle onderzochte interventies lijkt een programma waarbinnen taakspecifiek wordt getraind op alle drie de domeinen van balanshandhaving (steady-state, proactief en reactief; Shumway-Cook & Woollacott, 2017) het meest veelbelovend (Marigold, 2005). Inmiddels is er internationale consensus bereikt over hoe we zit- en stabalans en lopen na een beroerte klinisch moeten meten (vanCriekinge et al, 2023). Echter er is geen internationale consensus over de invulling van CVA-specifieke (oefen)protocollen ter preventie van vallen.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Vallen is een van de meest voorkomende redenen voor heropname in het ziekenhuis na een herseninfarct of hersenbloeding. Echter specifiek op CVA gerichte interventies voor valpreventie prospectieve epidemiologische cijfers rondom vallen na een herseninfarct of hersenbloeding ontbreken vooralsnog in Nederland en ook internationaal staat het onderzoek hiernaar nog relatief in haar kinderschoenen. Dit staat in contrast met het onomstotelijk bewijs voor de effectiviteit van oefentherapeutische valpreventieprogramma’s bij zelfstandig wonende ouderen, met een overall reductie in het aantal valincidenten van ~30% (McDermott, 2012). Voor thuiswonende CVA patiënten met een zelfstandige loopvaardigheid (FAC score van 4 of 5) kan deelname aan een van deze programma’s worden overwogen. Voor het programma Vallen Verleden Tijd hebben Van Duijnhoven et al. (2012) laten zien dat dit goed haalbaar is met relatief geringe aanpassingen. De belangrijkste doelen van deze interventie voor de patiënt zijn: 1) beter leren de balans te controleren tijdens verschillende omstandigheden en in verschillende omgevingen, met of zonder afleiding; 2) beter opvangen tijdens het vallen; en 3) minder angstig zijn om te vallen. Dit past uitstekend in het verlengde van de reguliere revalidatiebehandeling, die meestal als doel heeft om weer goed te leren zitten en te staan, wat op zich weer voorwaardelijk is voor zelfstandige loopvaardigheid (van Criekinge et al, 2023). Twee van de drie beschikbare valpreventieprogramma’s worden in groepen gegeven, met het belangrijke voordeel van (patiënten)contact en gedeelde ervaring.
Tevens kan op individueel niveau taakspecifieke en uitdagende balanstraining worden overwogen, gericht op het verbeteren van de opvangreacties na een verstoring van de balans. Mede als gevolg van technologische ontwikkelingen zijn in de laatste jaren de mogelijkheden voor dergelijke uitdagende balanstraining sterk gegroeid. De meeste revalidatiecentra beschikken over de benodigde technologische middelen hiervoor (bijv. een GRAIL), echter deze zijn in veel ziekenhuizen en perifere praktijken nauwelijks voorhanden.
Kosten (middelenbeslag)
Vooralsnog zijn geen nadelen van valpreventieprogramma’s bekend. De kosten-effectiviteit-berekeningen van valpreventieprogramma’s ontbreken. Echter, logischerwijs mag worden aangenomen dat door het geven van valpreventieprogramma’s, de kosten van training zich snel terug betalen en niet opwegen tegen de kosten van heropnames en de gevolgen van letsel. De invloed van factoren zoals ernst van infarct of bloeding en leeftijd op effectiviteit van valprogramma’s is nog onzeker en vraagt verder onderzoek.
Aanvaardbaarheid, haalbaarheid en implementatie
Er zijn geen ethische or morele bezwaren voor het geven van valpreventie programma’s aan iedere CVA-patiënt die weer loopvaardig wordt. Een mogelijk belemmerende factor is dat voor de meest uitdagende vormen van balanstraining, waarbij patiënten onverwacht in hun evenwicht worden verstoord, speciale apparatuur (zoals een GRAIL) en valbeveiliging nodig zijn. Deze apparatuur is echter niet in iedere setting voorhanden. Voor het kunnen aanbieden van adequate balans- en valpreventieprogramma’s is scholing noodzakelijk.
Rationale van de aanbevelingen: weging van argumenten voor en tegen de interventies
Valpreventieprogramma’s zouden in principe aan iedere patiënt met een herseninfarct of hersenbloeding moeten worden aangeboden die weer loopvaardig wordt. Er is voldoende evidentie voor de effectiviteit van valpreventieve oefentherapie na een herseninfarct os hersenbloeding, die zich met name richt op het handhaven van de zit-, sta- en loopbalans. Er bestaan echter geen internationale consensus over de invulling van CVA-specifieke protocollen hiervoor. Op dit gebied dient verder wetenschappelijk onderzoek te worden verricht.
In Nederland wordt momenteel geen specifiek op CVA gerichte valpreventie aangeboden. Derhalve wordt, gezien het breed aanwezige aanbod van drie erkende en bewezen effectieve valpreventieprogramma’s voor ouderen, aanbevolen om voor thuiswonende CVA patiënten met een zelfstandige loopvaardigheid deelname aan deze programma’s te overwegen. Deze kunnen met geringe aanpassingen geschikt zijn voor mensen na een CVA. Tevens kan in revalidatiecentra die beschikken over de benodigde apparatuur op individueel niveau taakspecifieke en uitdagende balanstraining worden overwogen, gericht op het verbeteren van de opvangreacties na een verstoring van de balans. Specifieke scholing over balans en het geven van valpreventieprogramma’s is voorwaardelijk bij het aanbieden van de voorgestelde interventies.
Onderbouwing
Achtergrond
Vallen is één van de meest voorkomende complicaties na een herseninfarct of hersenbloeding, met een incidentie tussen de 7% (Indredavik, 2008) in de eerste week en 55% (Ashburn, 2008) tot 73% (Sackley, 2008; Denissen, 2019) in het eerste jaar na het event. Vallen kan leiden tot complicaties als heupfracturen, extra zorgbehoefte, extra fysiotherapie of (her) opname in het ziekenhuis. Niet elke val is zo ernstig dat er medische aandacht nodig is, maar ook minder ernstige vallen kunnen leiden tot een verminderd niveau van dagelijks functioneren. Om deze reden is het kunnen voorkomen van vallen in de vorm van valpreventie programma’s essentieel. In de afgelopen decennia zijn er verschillende programma’s ontwikkeld waarin patiënten worden geoefend om de kans op vallen te voorkomen en de nadelige gevolgen van vallen te verminderen. Sommige programma’s richten zich hierbij op het oefenen van het evenwicht tijdens het staan en lopen al dan niet met afleiding (dubbeltaken) tijdens het handhaven van het evenwicht zoals lopen in drukke omgeving, lopen en andere taak uitvoeren en lopen op een onregelmatige ondergrond. Andere programma’s richten zich ook op het aanpassen van de omgeving van de patiënt en het wegnemen van eventuele obstakels in de woonomgeving om zo de kans om te vallen te verkleinen. Tenslotte zijn in de laatste jaren verschillende devices ontwikkeld, zoals balansplatformen en loopbandapparatuur, waarmee het evenwicht tijdens het staan en/of lopen bij de patiënt actief kan worden verstoord dan wel de veiligheid ermee worden gecontroleerd. Hiermee kunnen patiënten worden geoefend in het corrigeren van plotselinge, opgelegde evenwichtsverstoringen. Al deze valpreventieprogramma’s zijn gebaseerd op oefentherapie (‘exercise- related’) en hebben tot doel om uiteindelijk de kans en angst om te vallen bij de patiënt te verminderen (zie Tabel 1). Daarnaast wordt ook verwezen naar de richtlijn valpreventieprogramma’s bij ouderen https://richtlijnendatabase.nl/richtlijn/preventie_van_valincidenten_bij_ouderen.
Conclusies
1. Rate of falls (critical)
|
Low GRADE |
Exercise-related interventions for preventing falls may reduce rate of falls when compared with usual care in patients after stroke.
Source: Ada, 2013; Barreca, 2004; Batchelor, 2012; Bernhardt, 2008; Dean, 2010; Dean, 2012; Drummond, 2012; Lau, 2012; Mansfield, 2018; Marigold, 2005; Morone, 2016; Taylo- Piliae, 2014; von Koch, 2001. |
2. Number of fallers (critical)
|
Very Low GRADE |
The evidence is very uncertain wheather exercise-related interventions for preventing falls may reduce the number of fallers when compared with usual care in patients after stroke.
Source: Ada, 2013; Andrade, 2017; Batchelor, 2012; Correia, 2021; da Fonseca, 2017; Dean, 2010; Green, 2002; Haran, 2010; Holmgren, 2010; Kluding, 2013; Langhammer, 2009; Lau, 2012; Mansfield, 2018; Marigold, 2005; Mead, 2007; Morone, 2016; Pang, 2018a; Pang, 2018b; Taylor-Piliae, 2014. |
3. Fall-related (serious) adverse events (important)
|
No GRADE |
No evidence was found regarding the effect of exercise-based or passive interventions for preventing falls on fall-related (serious) adverse events when compared with usual care in patient after stroke.
Source: - |
Samenvatting literatuur
Description of studies
Systematic reviews
Batchelor (2010) described a systematic review and meta-analysis about the evidence on interventions that reduce falls after stroke. The systematic literature search was conducted in March 2019 in 10 databases. Studies were included if 1) the design was a randomized controlled trial; 2) patients were adult stroke survivors at any stage after stroke; 3) the intervention affected falls outcome; 4) primary or secondary fall-related outcomes were included. In total, 13 RCTs were included in the meta-analysis. For this module, 4 RCTs were eligible, since four did not report predefined outcome measures (Cheng, 2001; Sato, 2005b; Widén Homqvist, 1998; Thorsen, 2005), three did not describe exercise-related interventions (Rossi, 1990; Sato, 2003; Sato, 2005a; Sato, 2005c) and one study included the same population of patients as included in von Koch (2001) (von Koch, 2000). Rate of falls and proportion of fallers after a follow-up at different time points were reported as outcome measures. Risk of bias was assessed by the PEDro scores.
Denissen (2019) described a systematic review and meta-analysis about the effectiveness of interventions aimed at preventing falls in people after stroke. A systematic literatures search was performed in September 2018 in four trial registers. Studies were included if 1) the design was a randomized controlled trial; 2) patients were adult in the hyperacute, acute, early subacute, late subacute or chronic phase following stroke; 3) interventions were aiming to prevent falls; 4) trials reported outcome measures that were related to the rate of falls or the number of fallers. In total, 14 studies were included in the meta-analysis. For this module, 13 RCTs were eligible since one described a non-exercise related intervention (Haran, 2010). Rate of falls and number of fallers were reported as outcome measures. Risk of bias was assessed by the Cochrane risk of bias tool.
Yang (2021) described a systematic review and meta-analysis aiming to find effective interventions to prevent falls among people in the post-acute and chronic stage of stroke. A systematic literature search was performed in 11 databases between June and September 2019. Studies were included if 1) adults diagnosed with stroke at the post-acute or chronic phase after stroke were included; 2) the design was an RCT; 3) fall incidence in daily living was assessed an outcome; 4) the study was published in English. In total, 13 studies were included in the meta-analysis. For this module, 12 RCTs were eligible since on described a non-exercise related intervention (Rossi, 1990). Rate of falls (including a subgroup analysis for different intervention types), balance, mobility and strength were reported as outcome measures. Risk of bias was assessed by the PEDro score.
Randomized controlled trial
Correia (2021) performed a randomized controlled trial investigating the effects of a domiciliary program targeting oculomotor and gaze stability exercises on the incidence of falls and risk of fall in stroke survivors. Patients were included if: 1) stroke occurred 3-15 months before recruitment; 2) impaired balance was verified; 3) they were able to walk at least three meters by themselves (with or without device). A total of 79 patients were recruited. They all received the current rehabilitation program. Based on preintervention assessments, patients were randomly assigned to the control group receiving the current program (n=39) or the intervention group receiving a supplemental domiciliary intervention program of oculomotor and gaze stability exercises (n=40). The number of falls during follow-up and the estimated risk of falling after three weeks of intervention were reported as outcome measures.
In total, 22 RCTs were included in the summary of the literature. Individual study characteristics are shown in Table 1.
Table 1: Table of Randomized Controlled Trials (RCTs) characteristics
|
RCT |
Included in SR |
Population |
Intervention |
Comparator/Control |
Outcome |
|
Ada, 2013 |
Denissen, 2019; Yang, 2021 |
Subjects with stroke with a high risk of falling living in the community (n=66) |
Treadmill training without body weight support (2 groups) (n=59) |
No intervention (n=27) |
Number of fallers, quality of life |
|
Andrade, 2017 |
Denissen, 2019 |
Acute ischaemic stroke patients (n=60) |
1) Anodal tDCS; 2) bilateral tDCS; 3) cathodal tDCS (n=45) |
Sham tDCS (n=15) |
Number of fallers, adverse events |
|
Barreca, 2004 |
Batchelor, 2010 |
Patients 30 days after stroke (n=48) unable to perform sit-to-stand independently |
Group sit to stand practice (n=25) |
Recreational therapy (n=23) |
Rate of falls, number of fallers during study time. |
|
Batchelor, 2012 |
Denissen, 2019 |
People at risk of recurrent falls discharged from rehabilitation 3 months post stroke (n=156) |
A physiotherapist providing multifactorial, individually tailored falls prevention program (n=71) |
A falls prevention booklet (n=85) |
Rate of falls, number of fallers |
|
Bernhardt, 2008 |
Batchelor, 2010 |
Acute stroke patients, <24h (n=71); NIHSS=10 |
Very early mobilization (n=38) |
Usual care (n=33) |
Falls (during stroke unit stay and at 3 months) |
|
Correia, 2021 |
Not applicable |
Stroke survivors (3-15 months) (n=68) |
Current rehabilitation program and a supplemental domiciliary intervention program (n=35) |
Current rehabilitation program only (n=33) |
Number of fallers. |
|
Da Fonseca, 2017 |
Yang, 2021 |
Post stroke patients (n=30) |
Virtual reality physical therapy (n=14) |
Conventional physical therapy (n=13) |
Number of fallers (3 months) |
|
Dean, 2010 |
Denissen, 2019; Yang, 2021 |
Patients unable to walk <3 weeks after stroke (n=126) |
Walking in a treadmill while supported in a harness (n=64) |
Assisted overground walking (n=62) |
Rate of falls, number of fallers, quality of life |
|
Dean, 2012 |
Denissen, 2019 |
Community-dwelling people after stroke (n=151) |
Exercise classes, aimed to improve walking preventing falls and increase physical activity (n=76) |
Exercise classes aimed to improve upper limb and cognitive functions (n=75) |
Rate of falls, number of fallers after 12 months of intervention. |
|
Drummond, 2012 |
Denissen, 2019 |
Stroke patients transferred from an acute stroke unit (n=85) |
Predischarge home assessment visit with an occupational therapist identifying potential problems in home environment at home (n=42) |
Predischarge home assessment with an occupational therapist identifying potential problems in home environment in the hospital (n=43) |
Rate of falls, economic evaluation, quality of life |
|
Green, 2002 |
Batchelor, 2010; Denissen, 2019 |
Patients >1 yr after stroke with mobility problems due to stroke (n=170) |
Community physiotherapy sessions (n=85) |
No additional treatment (n=85) |
Fallers at 3, 3-6 and 6-9 months |
|
Holmgren, 2010 |
Denissen, 2019 |
People after stroke with risk of falls in subacute phase (n=34) |
High-intensity functional exercises (n=15) |
Educational sessions (n=19) |
Number of fallers, quality of life, adverse events |
|
Kluding, 2013 |
Yang, 2021 |
Stroke patients ≥ 3 months after stroke with gait speed ≤ 0.8 m/s (n=197) |
Foot drop Stimulator (n=99) |
Ankle Foot Orthotic (n=98) |
Number of fallers |
|
Langhammer, 2019 |
Yang, 2021 |
People <12 months post stroke (n=75) |
Intensive Exercise (n=35) |
Self-Initiated exercise (n=40) |
Number of fallers 12 months post stroke. |
|
Lau, 2012 |
Denissen, 2019; Yang, 2021 |
Chronic stroke patients > 6 months post stroke (n=82) |
Whole-body vibration training sessions (n=41) |
Training sessions without vibration platform (n=41) |
Rate of falls, number of fallers, fall-related fractures, fall-related hospital admissions, adverse events |
|
Mansfield, 2018 |
Denissen, 2019; Yang, 2021 |
Individuals > 6 months post stroke (n=88) |
External perturbation training (N=44) |
Keep Moving with Stroke program n=44) |
Rate of falls, number of fallers, fall-related fracturs, fall-related hospital admissions, quality of life, adverse events |
|
Marigold, 2005 |
Denissen, 2019; Yang, 2021 |
Older adults with a mild chronic stroke living in the community (n=61). (NIHSS ~ 3) |
Agility group (n=30) |
Stretching/weight- shifting (n=31) |
Rate of falls, number of fallers, fall-related fracturs, quality of life |
|
Mead, 2007 |
Yang, 2021 |
Ambulatory stroke patients (n=66) |
Exercise therapy (n=32) |
Relaxation (n=34) |
Number of fallers, quality of life (SF-36) after intervention (3 months) and 7 months after baseline. |
|
Morone, 2016 |
Denissen, 2019 |
Unilateral stroke patients < 90 days post stroke (n=44) |
Walking training using i-Walker (n=22) |
Overground ambulation exercises on the parallel bars (n=22) |
Rate of falls and number of fallers |
|
Pang, 2018 |
Yang, 2021 |
Chronic stroke patients (n=84) |
2 groups: a) Dual-task mobility & cognitive exercise (n=28); b) single-task mobility & cognitive exercise (n=28) |
Upper limb exercise (n=28) |
Adverse events, dual-task interference, number of fallers, number of fallers with injury, number of falls (per 100 persons) number of falls with injury (per 100 persons) |
|
Taylor-Piliae, 2014 |
Denissen, 2019; Yang, 2021 |
Stroke survivors >3 months post stroke living in the community (n=145) |
2 groups: 1) Tai Chi (n=53); 2) SilverSneakers (n=44) |
Usual care (n=48) |
Number of fallers (3 months) |
|
Von Koch, 2001 |
Batchelor, 2010 |
Acute stroke patients followed up to 6 months post stroke (n=83) |
Home rehabilitation (n=39) |
Routine rehabilitation (n=38) |
Self-reported n of falls in 12 months |
Results
1. Rate of falls
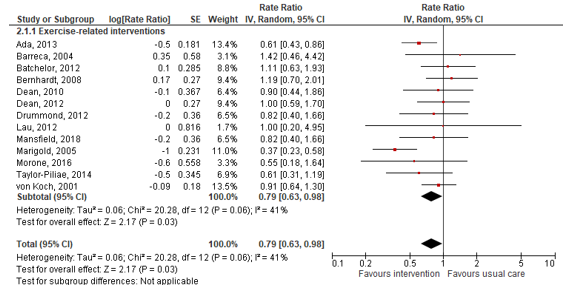
For exercise-related interventions data was pooled and expressed by the rate ratio, showing the rate of an event in the intervention group to that in the control group. Pooled data resulted in a rate ratio of 0.79 (95% CI 0.63 to 0.98) in favor of the intervention (n=1206). This was considered clinically relevant. Results are shown in Figure 1.
Figure 1: Forest plot showing the effect of exercise-related fall prevention programs on the rate of falls, compared to usual care.
2. Number of fallers
For exercise-related interventions, data was pooled and expressed by the risk ratio, showing the ratio of the risk of falling in the intervention group to that in the control group. Pooled data resulted in a risk ratio of 0.88 (95% CI 0.47 to 1.18) in favor of the intervention (n=1720). This difference was considered clinically relevant. Results are shown in Figure 2.
Figure 2: Forest plot showing the effect of exercise-related fall prevention programs on the number of fallers, compared to usual care.
3. Fall-related (serious) adverse events
No data was available for the outcome fall-related (serious) adverse events.
Level of evidence of the literature
The level of evidence for all outcome measures started at high because they were based on randomized controlled trials.
1. Rate of falls
The evidence was downgraded by two levels because of study limitations, including detection bias/incomplete outcome data (-1, risk of bias) and wide confidence intervals crossing the border of clinical relevance (-1, imprecision). The final level is low.
2. Number of fallers
The evidence was downgraded by two levels because of study limitations, including detection bias/incomplete outcome data (-1, risk of bias) and between-study heterogeneity in terms of intervention types (-1, heterogeneity) and wide confidence intervals crossing the border of clinical relevance (-1, imprecision). The final level is very low.
3. Fall-related (serious) adverse events
No data was available for the outcome fall-related (serious) adverse events, and could therefore not be graded.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the effects of interventions for preventing falls after stroke on the number of falls (per person), the number of fallers, fall-related fractures, falls that require medical attention, quality of life and adverse events.
P: Patients with ischemic/intracerebral haemorrhage stroke
I: Exercise related interventions for preventing falls
C: Usual care, no therapy or recreational therapy.
O: Number of falls per person, number of fallers and fall-related (serious) adverse events that require medical attention and/or hospital admission.
Relevant outcome measures
The guideline development group considered number of falls per person and number of fallers as critical outcome measures for decision making; and fall-related (serious) adverse events as important outcome measure for decision making.
The working group defined the outcome measures as follows:
- Rate of falls: falls per person-year, falls per bed-day.
- Number of fallers: number of patients with falls.
- Fall-related (serious) adverse events:
- Fall-related fractures: number of patients with fall-related fractures.
- Falls that require medical attention: number of patients requiring medical attention due to falling.
- Other fall-related adverse events: number of patients with other fall-related adverse events.
For the outcome measure rate of falls, results were presented as rate ratio, defined by the incidence rate in the intervention group divided by the incidence rate in the control group. For the outcome measures, number of fallers and fall-related adverse events, results were presented as risk ratio, comparing the risk for an outcome in the intervention group to this risk in the control group (relative risk).
The working group defined a relative difference of 10% as a minimal clinically (patient) important difference for each outcomes measure between the intervention group and the control group post-intervention (risk ratio/rate ratio ≤ 0.9 or ≥ 1.10).
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until November 25, 2021. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 431 hits. Studies were selected based on the following criteria:
- Patients with ischemic/haemorrhagic stroke.
- RCTs and SRs about interventions for preventing falls.
- A control group receiving usual care.
- At least the number of falls or the number of fallers were reported as an outcome measure.
- More than 10 patients per treatment arm.
- For cross-over studies: a baseline measurement and one at the first cross-over point.
- A description of at least one outcome measure, as described in the PICO.
Nine systematic reviews were initially selected based on title and abstract screening. After reading the full text, six systematic reviews were excluded (see the table with reasons for exclusion under the tab Methods), and three systematic reviews were included (Batchelor, 2010; Denissen, 2019; Yang, 2021). From the systematic reviews, 20 RCTs were extracted.
Additionally, three individual RCTs were selected that were published after the systematic reviews based on title and abstract screening. After reading the full text, two RCT were excluded (see the table with reasons for exclusion under the tab Methods), and one RCT was included (Correi, 2021).
Results
In total, 22 RCTs were included in the analysis of the literature from which 21 RCTs were extracted from three systematic reviews and one RCT was added after the search date of the reviews. Important study characteristics and results are summarized in Table 1. The assessment of the risk of bias was extracted from the selected systematic reviews.
Referenties
- Ashburn A, Hyndman D, Pickering R, Yardley L, Harris S. Predicting people with stroke at risk of falls. Age and Ageing 2008;37(3):270-6. [DOI: 10.1093/ageing/afn066]
- Batchelor, F., Hill, K., Mackintosh, S., & Said, C. (2010). What works in falls prevention after stroke?: a systematic review and meta-analysis. Stroke, 41(8), 1715-1722. https://doi.org/10.1161/STROKEAHA.109.570390
- Correia, A., Pimenta, C., Alves, M., & Virella, D. (2021). Better balance: a randomized controlled trial of oculomotor and gaze stability exercises to reduce risk of falling after stroke. Clinical rehabilitation, 35(2), 213-221. https://doi.org/10.1177/0269215520956338
- Denissen, S., Staring, W., Kunkel, D., Pickering, R. M., Lennon, S., Geurts, A. C., Weerdesteyn, V., & Verheyden, G. S. (2019). Interventions for preventing falls in people after stroke. The Cochrane database of systematic reviews, 10(10), CD008728. https://doi.org/10.1002/14651858.CD008728.pub3
- McDermott R, Gillespie SM, Nelson D, Newman C, Shah MN. Characteristics and acute care use patterns of patients in a senior living community medical practice. J Am Med Dir Assoc. 2012 Mar;13(3):260-3. doi: 10.1016/j.jamda.2010.10.007. Epub 2010 Dec 16. PMID: 21450219; PMCID: PMC3128650
- Roelofs JMB, Zandvliet SB, Schut IM, Huisinga ACM, Schouten AC, Hendricks HT, de Kam D, Aerden LAM, Bussmann JBJ, Geurts ACH, Weerdesteyn V. Mild Stroke, Serious Problems: Limitations in Balance and Gait Capacity and the Impact on Fall Rate, and Physical Activity. Neurorehabil Neural Repair. 2023 Oct 25:15459683231207360. doi: 10.1177/15459683231207360. Epub ahead of print. PMID: 37877724.
- Sackley C, Brittle N, Patel S, Ellins J, Scott M, Wright C, et al. The prevalence of joint contractures, pressure sores, painful shoulder, other pain, falls, and depression in the year after a severely disabling stroke. Stroke 2008;39(12):3329?34. [DOI: 10.1161/STROKEAHA.108.518563]
- Sullivan R, Harding K, Skinner I, Hemsley B. Falls in hospital patients with acquired communication disability secondary to stroke: A systematic review and meta-analysis. Int J Lang Commun Disord. 2020 Nov;55(6):837-851. doi: 10.1111/1460-6984.12570.
- Van Criekinge T, Heremans C, Burridge J, Deutsch JE, Hammerbeck U, Hollands K, Karthikbabu S, Mehrholz J, Moore JL, Salbach NM, Schröder J, Veerbeek JM, Weerdesteyn V, Borschmann K, Churilov L, Verheyden G, Kwakkel G. Standardized measurement of balance and mobility post-stroke: Consensus-based core recommendations from the third Stroke Recovery and Rehabilitation Roundtable. Neurorehabil Neural Repair. 2023 Oct 14:15459683231209154. doi: 10.1177/15459683231209154. Epub ahead of print. PMID: 37837351.
- van Duijnhoven HJ, De Kam D, Hellebrand W, Smulders E, Geurts AC, Weerdesteyn V. Development and Process Evaluation of a 5-Week Exercise Program to Prevent Falls in People after Stroke: The FALLS Program. Stroke Res Treat. 2012;2012:407693. doi: 10.1155/2012/407693. Epub 2011 Nov 17. PMID: 22195292; PMCID: PMC3236349.
- Verheyden GS, Weerdesteyn V, Pickering RM, Kunkel D, Lennon S, Geurts AC, Ashburn A. Interventions for preventing falls in people after stroke. Cochrane Database Syst Rev. 2013 May 31;2013(5):CD008728. doi: 10.1002/14651858.CD008728.pub2. PMID: 23728680; PMCID: PMC6513414.
- Yang, F., Lees, J., Simpkins, C., & Butler, A. (2021). Interventions for preventing falls in people post-stroke: A meta-analysis of randomized controlled trials. Gait & posture, 84, 377-388. https://doi.org/10.1016/j.gaitpost.2020.12.034
Evidence tabellen
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Cattaneo D, Gervasoni E, Pupillo E, Bianchi E, Aprile I, Imbimbo I, Russo R, Cruciani A, Turolla A, Jonsdottir J, Agostini M, Beghi E; NEUROFALL Group. Educational and Exercise Intervention to Prevent Falls and Improve Participation in Subjects With Neurological Conditions: The NEUROFALL Randomized Controlled Trial. Front Neurol. 2019 Sep 13;10:865. doi: 10.3389/fneur.2019.00865. PMID: 31572282; PMCID: PMC6754067. |
Wrong population (people with neurological conditions, including multiple sclerosis, Parkinson Disease and stroke). |
|
English C, Hillier SL. Circuit class therapy for improving mobility after stroke. Cochrane Database Syst Rev. 2010 Jul 7;2010(7):CD007513. doi: 10.1002/14651858.CD007513.pub2. Update in: Cochrane Database Syst Rev. 2017 Jun 02;6:CD007513. PMID: 20614460; PMCID: PMC6464862. |
Review did not report the number of falls/fallers as an outcome. |
|
Lubetzky-Vilnai A, Kartin D. The effect of balance training on balance performance in individuals poststroke: a systematic review. J Neurol Phys Ther. 2010 Sep;34(3):127-37. doi: 10.1097/NPT.0b013e3181ef764d. PMID: 20716987. |
Search strategy was not complete enough. |
|
Madhuranga PVH, Mathangasinghe Y, Anthony DJ. Improving balance with wobble board exercises in stroke patients: single-blind, randomized clinical trial. Top Stroke Rehabil. 2019 Dec;26(8):595-601. doi: 10.1080/10749357.2019.1645439. Epub 2019 Jul 26. PMID: 31348727. |
Trial did not report the number of fals/fallers as an outcome |
|
Verheyden GS, Weerdesteyn V, Pickering RM, Kunkel D, Lennon S, Geurts AC, Ashburn A. Interventions for preventing falls in people after stroke. Cochrane Database Syst Rev. 2013 May 31;2013(5):CD008728. doi: 10.1002/14651858.CD008728.pub2. PMID: 23728680; PMCID: PMC6513414. |
Review did not add RCTs to the RCTs that are included in the analysis. |
|
Walter AA, Van Puymbroeck M, Bosch P, Schmid AA. Complementary and integrative health interventions in post-stroke rehabilitation: a systematic PRISMA review. Disabil Rehabil. 2022 Jun;44(11):2223-2232. doi: 10.1080/09638288.2020.1830440. Epub 2020 Oct 12. PMID: 33044872. |
Review did not report individual study results. |
|
Wu S, Chen J, Wang S, Jiang M, Wang X, Wen Y. Effect of Tai Chi Exercise on Balance Function of Stroke Patients: A Meta-Analysis. Med Sci Monit Basic Res. 2018 Dec 3;24:210-215. doi: 10.12659/MSMBR.911951. PMID: 30504762; PMCID: PMC6289026. |
Review did not report individual study results. |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 21-05-2024
Laatst geautoriseerd : 21-05-2024
Geplande herbeoordeling :
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een doorstart gemaakt met de multidisciplinaire werkgroep, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met een herseninfarct of hersenbloeding.
Werkgroep
- dr. B. (Bob) Roozenbeek (voorzitter), neuroloog, Erasmus MC Rotterdam, namens de Nederlandse Vereniging voor Neurologie (NVN)
- prof. dr. J. (Jeannette) Hofmeijer, neuroloog, Rijnstate ziekenhuis Arnhem, namens de NVN
- dr. M.H. (Heleen) den Hertog, neuroloog, Isala Zwolle, namens de NVN
- dr. S.M. (Yvonne) Zuurbier, neuroloog in het Universitair Ziekenhuis Antwerpen (UZA), namens de NVN
- dr. M. (Maarten) Uyttenboogaart, neuroloog, UMC Groningen, namens de NVN
- J.C. (Jeroen) de Jonge, neuroloog in het OLVG, Amsterdam, namens de NVN
- prof. dr. J.M.A. (Anne) Visser-Meily, revalidatiearts, UMC Utrecht, namens de VRA
- prof. dr. C.G.M. (Carel) Meskers, revalidatiearts, Amsterdam UMC, namens de VRA
- A.F.E. (Arianne) Verburg, huisarts, namens het Nederlands Huisartsen Genootschap (NHG)
- prof. dr. W. (Wim) van Zwam, radioloog, Maastricht UMC, namens de Nederlandse Vereniging voor Radiologie (NVvR)
- prof. dr. G. (Gert) Kwakkel, hoogleraar neurorevalidatie, Amsterdam UMC, namens het Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF)
Met ondersteuning van
- Dr. M.L. Molag, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. F. Ham, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. L.C. van Wijngaarden, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Roozenbeek |
Neuroloog, Erasmus MC, Rotterdam |
Geen |
Lid van CONTRAST, coördineert onderzoeksprojecten op gebied van acute beroertezorg gefinancierd door Stichting BeterKeten, Stichting THEIA, Erasmus Universiteit en Erasmus MC |
Geen |
|
Hofmeijer |
Neuroloog, Rijnstate, Arnhem (0,7 fte) Universitair hoofddocent, Universiteit Twente (0,4 fte) |
Geen |
Geen |
Geen |
|
den Hertog |
Neuroloog met aandachtsgebied neurovasculaire aandoeningen en acute neurologie, Isala Medisch hoofd innovatie en wetenschap, Isala Lid medical board speerpunt acute zorg, Isala |
Voorzitter Nederlandse neurovasculaire werkgroep Lid werkgroep digitale cardiovasculaire zorg DCVA, werkgroep onderzoekspijler DCVA, expertisegroep cluster CVRM, werkgroep elearning acute neurologie Deelname aan de SKMS-projectaanvraag Samen beslissen NVvR |
Projectleider ATTEST, betrokkenheid (geen projectleider) bij onderzoek gefinancieerd door Bayer, grant from Thrombolytic Science International en Portola Pharmaceuticals |
Geen |
|
Zuurbier |
Arts assistent in opleiding tot neuroloog, AMC, afdeling neurologie |
Geen |
Geen |
Geen |
|
Uyttenboogaart |
Neuroloog, Neuro-interventionalist, UMCG |
Geen |
Hartstichting TKI Health-Holland - Financiering 2 PhD studenten CONTRAST WORKPACKAGE 8 - WP leider. P.I. van (aanstaande) CASES trial. |
Geen |
|
de Jonge |
AIOS neurologie, UMC Utrecht PhD-student, afdeling neurologie en neurochirurgie, UMC Utrecht, Universiteit Utrecht |
Geen |
Betrokkenheid PRECIOUS |
Geen |
|
Visser-Meily |
Revalidatiearts, hoogleraar en afdelingshoofd van de afdeling Revalidatie, fysiotherapiewetenschap en sport in UMCU (0.8 fte) Hoofd van het Kenniscentrum Revalidatiegeneeskunde Utrecht (samenwerking tussen De Hoogstraat Revalidatie en UMC Utrecht) (0.2 fte) |
Geen |
Geen |
Geen |
|
Meskers |
Revalidatiearts, hoogleraar revalidatiegeneeskunde ihb neuromechanica |
Directeur research programma Ageing & Vitality Movement Sciences Management team Amsterdam Movement Sciences Editor tijdschrift Experimental Gerontology |
Projectleider AMS – Sarcopenia mobility. Betrokkenheid bij ArmCoach4Stroke, EMPOWER-GR en APROOF |
Geen |
|
Verburg |
Huisarts (0.4 fte) |
Senior wetenschappelijk medewerker NHG |
Geen |
Geen |
|
Van Zwam |
Neuro-interventieradioloog, Maastricht University Medical Center |
Geen |
Consultancy activiteiten voor Stryker en Cerenovus, lid CONTRAST, P.I. MRCLEAN LATE |
Geen |
|
Kwakkel |
Hoogleraaar Neurorevalidatie AUMC, Hoofd onderzoek neurorevalidatie Reade |
Europees Editor NeuroRehabilitation and Neural Repair
|
Handling editor Stroke (AHA) Coordinator Stroke Unit Cursus NPI Cursusleider mCIMT bij NPI Cursusleider Neurorebvalidatie-CVA bij NPI
|
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door gebruik te maken van kwaliteitscriteria vanuit patiëntenperspectief voor CVA, ontwikkeld door Harteraad. Verder informeren wij Harteraad, Hartstichting en Hersenletsel door middel van notulen van de vergaderingen met de kerngroep en worden ze betrokken bij relevante onderwerpen. De conceptmodules zijn tevens voor commentaar aan bovengenoemde verenigingen voorgelegd.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerden de werkgroep de knelpunten in de zorg voor patiënten na een herseninfarct of hersenbloeding. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptmodule werd aan de betrokken (wetenschappelijke) verenigingen, instanties en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve module werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd. De commentaartabel is op te vragen bij het Kennisinstituut via secretariaat@kennisinstituut.nl.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van de Federatie Medisch Specialisten.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.