MRI bij gehoorimplantaat
Uitgangsvraag
Wat zou het algemene beleid moeten zijn bij patiënten met een gehoorimplantaat die een MRI moeten ondergaan?
Aanbeveling
Algemene aanbevelingen voor gehoorimplantaten
- Hanteer de door de fabrikant gestelde MR voorwaarden.
- Bij een roterende magneet: informeer patiënt dat het MRI-onderzoek (vrijwel) pijnloos zal zijn, en de kans op complicaties klein.
- Als een drukverband nodig is (zie tabel 4): volg de lokale procedure waarin de taken, verantwoordelijkheden en training van het betrokken personeel beschreven zijn (zie additionele overwegingen).
- In het zeldzame geval dat de magneet verwijderd moet worden voorafgaand aan het MRI-onderzoek (en alternatieve beeldvorming niet mogelijk is): verwijs de patient naar het centrum van implantatie.
- Neem bij vragen of onduidelijkheden contact op met het centrum van implantatie.
Aanbevelingen voor specifieke implantaten
Cochleair implantaten (CI)
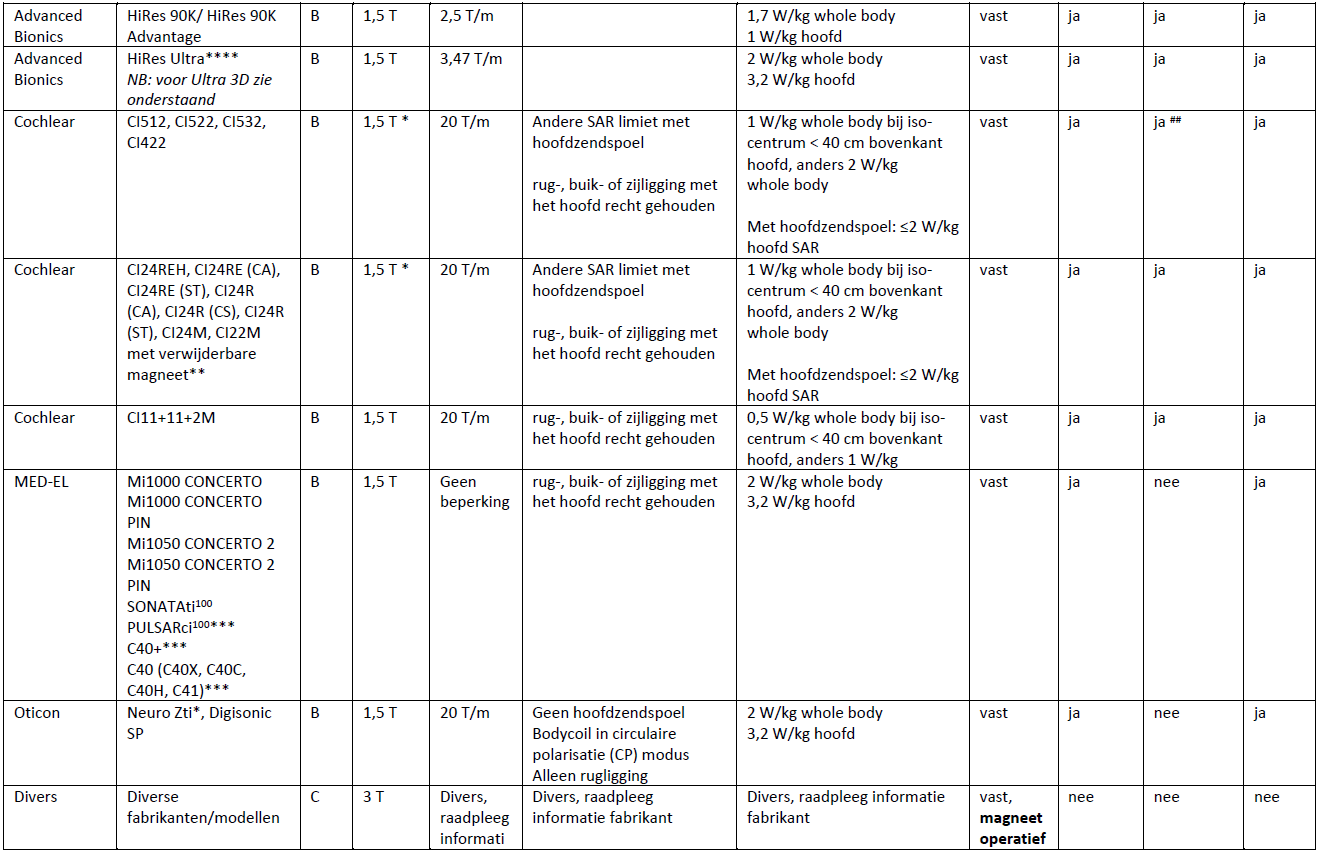
- Bij een CI dat zonder bandage gescand mag worden (subcategorie A in tabel 4): plan de afspraak in op 1,5 T of 3 T MRI, afhankelijk van de vraagstelling en voorwaarden van de CI fabrikant.
- Bij een CI dat na aanbrengen van bandage en spalk de MRI in mag (subcategorie B in tabel 4): volg de lokale procedure.
Instructie voor MRI-laboranten
LET OP: zodra het externe deel van het CI (de spraakprocessor) wordt verwijderd is de patiënt doof! De patiënt heeft het recht zelf een schrijf- of gebarentolk mee te brengen.
Geef de volgende informatie aan patiënten met meedraaiende magneet, zonder bandage, voordat de spraakprocessor is losgekoppeld.
- Magneet kan omklappen tijdens de scan, de patiënt kan dit voelen (tik of klik)
- De patiënt moet zo veel mogelijk met het hoofd in de midden van de tunnel blijven, en mag niet met het hoofd bij de rand van de tunnel van de scanner komen. In de tunnel het hoofd niet meer dan 15 graden richting schouder (om de anterior-posterior-as) draaien. Deze beperking geldt niet voor Advanced Bionics met roterende magneet.
- Instructie om het hoofd stil te houden tijdens de scan.
- De patiënt kan wat ruisen of piepen horen tijdens de scan.
Laat de patiënt de spraakprocessor afnemen; deze mag de scanruimte niet in.
Aandachtspunten vóór en tijdens het MRI-onderzoek:
- Controleer en volg de instructies van de fabrikant (zie tabel 4); let met name op de maximale veldsterkte en een verlaagd SAR niveau.
- Zorg dat de patiënt niet dicht bij de zijkant van de magneetopening van de MRI-scanner ligt. Ondersteun zo mogelijk het hoofd zodat het midden op de patiënttafel ligt en niet meer dan noodzakelijk beweegt. (Dit geldt niet voor de meedraaiende magneet van Advanced Bionics, wel voor de meedraaiende magneet van Cochlear of MED-EL).
- Indien bandage is aangebracht: volg de lokale procedure. De patiënt zal waarschijnlijk pijn ervaren in de MRI door krachten op de geïmplanteerde magneet (en soms ook alleen al van het drukverband). De lokale procedure beschrijft ook de communicatie met de patiënt.
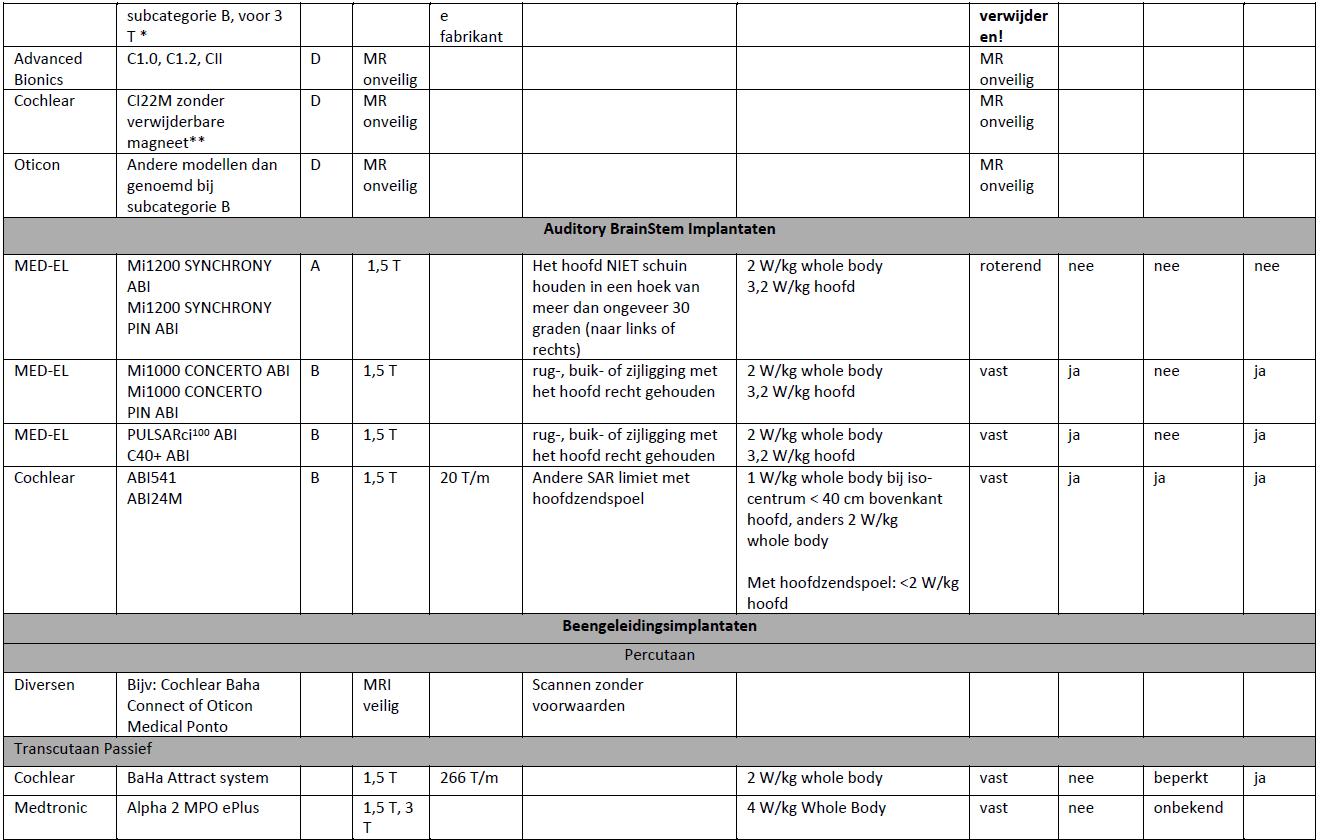
Auditory Brainstem Implants (ABI)
Indien de patiënt een ABI heeft neem dan contact op met het centrum waar het implantaat geplaatst is. In het geval de ABI een roterende magneet heeft kan de patiënt lokaal gescand worden met in acht name van de voorwaarden van de leverancier. Verwijs een patiënt met een ABI met een vaste magneet (zie tabel 4 bij overwegingen) naar het centrum van implantatie.
Beengeleidingsimplantaten
Bepaal het type beengeleidingsimplantaat van de patiënt:
- Indien percutaan, d.w.z. een vaste schroef die de huid doorbreekt waar een externe processor op gezet wordt: patiënt kan gescand worden zonder verdere voorwaarden op 1,5 T en 3 T.
- Indien transcutaan, d.w.z. een onderhuids implantaat waar met een magneet een externe processor opgezet wordt: achterhaal de leverancier en het model van het implantaat. Volg de gestelde voorwaarden door de leverancier voor het scannen met MRI (tabel 4). Indien er een bandageprotocol wordt voorgeschreven (Osia, Cochlear) volg dan de aanbevelingen gegeven bij cochleaire implantaten met bandage. Het bestaan van een schriftelijke lokale procedure is een voorwaarde bij scannen met bandage.
Actieve middenoor implantaten
Bepaal leverancier en het model van het implantaat. In het geval het type MR voorwaardelijk is volg dan de voorwaarden van de leverancier. Voor de meest voorkomende implantaten zie tabel 4.
Passieve Middenoorimplantaten
Een MRI-onderzoek bij een patiënt met een passief middenoorimplantaat kan zonder beperkingen worden uitgevoerd op een 1,5 T of 3 T MRI-scanner.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is één expert consensus artikel gevonden over het uitvoeren van een MRI bij patiënten met cochleaire implantaten (zie tabel 3)
Tabel 3. Overzicht van gevonden guidelines, expert consensus articles, and consensus statements.
|
Type of document |
Author, year |
Conclusion |
Level of evidence |
Technical efficacy stage |
|
Expert consensus |
Jabehdar 2020 |
1) With regards to screening, although currently marketed cochlear implants are MR Conditional, some of the older ones are MR Unsafe. 2) All currently marketed MR Conditional cochlear implants except the SYNCHRONY MED-EL system need removal of the internal magnet if a 3T scan is needed. 3) All currently marketed MR Conditional cochlear implants except the SYNCHRONY MED-EL system need some variation of head wrapping without removal of the internal magnet at 1.5T. 4) The SYNCHRONY MED-EL cochlear implant is MR Conditional for both 1.5T and 3T and does not need head wrapping or internal magnet removal. 5) Removal of the internal magnet of cochlear implants can improve image quality and visualization of immediately adjacent structures (i.e., ipsilateral internal auditory canal). |
5 # |
5 ## |
# Evidence level 5: evidence from systematic reviews of descriptive and qualitative studies
## Technical efficacy stage 5: improvements in patient care, e.g. leading to fewer complications or severe adverse reactions.
Er is in de systematische literatuursearch geen bewijs gevonden over de veiligheid van de MRI bij niet-actieve gehoorimplantaten. In de overwegingen komen we wel terug op enkele wetenschappelijke publicaties.
In de literatuur zijn geen vergelijkende patiëntonderzoeken gevonden. Er is geen GRADE beoordeling uitgevoerd omdat de resultaten niet gepoold konden worden. Over het algemeen zijn negatieve effecten van een MRI-onderzoek lager bij patiënten met implantaten met een roterende magneet of zonder magneet. Observationele studies worden verderop in de overwegingen besproken.
Voor dragers van implantaten geldt in het algemeen dat een gefundeerde afweging gemaakt moet worden tussen het belang van goede diagnostiek en de risico's die gepaard gaan met het betreffende MRI-onderzoek.
Het overzichtsartikel van Fierens (2021) presenteert de resultaten van gestructureerde zoekopdracht in incidentdatabases (MAUDE) en studies gepubliceerd in wetenschappelijke literatuur door middel van zoekopdrachten in Medline en Embase databases. Dit is samengevat in tabel 1 van deze richtlijnmodule. Op basis van deze publicatie ontstaat inzicht welke incidenten voorgevallen zijn, en de frequentie daarvan. Een beperking van deze informatie is dat de incidentie van het risico niet of nauwelijks in te schatten is, omdat onbekend is hoeveel MRI-onderzoeken met een bepaald implantaat uitgevoerd zijn.
In tabel 2 staan enkele observationele studies samengevat. Hierbij is wél bekend wat de aantallen MRI-onderzoeken, patiënten en implantaten zijn, maar de orde-grootte van deze aantallen is te klein om hier goed gefundeerde conclusies aan te kunnen verbinden. Behalve dat uit de meer recentere artikelen blijkt dat de kans op dislocatie van de magneet sterk afhangt van het type implantaat. In grote lijn bevestigen deze studies echter wel het beeld dat geschetst is door Fierens (2021) op basis van incidentdatabases.
De meest voorkomende incidenten zijn:
- Pijn. Dit komt zonder twijfel het vaakst voor en maakt het ondergaan van een MRI-onderzoek belastend voor de patiënt. In sommige gevallen was de pijn dermate ernstig dat het MRI-onderzoek voortijdig gestopt werd. Op basis van de observationele studies van Fussel (2021), Tam (2020) en Rupp (2023) kan de frequentie van voortijdige beëindiging op 1 à 2% ingeschat worden, terwijl andere publicaties een hogere frequentie observeren, zoals Alberlar (2023) 26%, Pross (2018) 12%, Loth (2021) 37%.
- Dislocatie van de magneet van het implantaat. Dit wordt het vaakst genoemd in de incidentdatabases (Fierens: n=442, pijn n=147), en scoort ook het hoogste in de observationele studies (zie tabel 2). Van de gerapporteerde implantaatstoringen betreft ca 90 – 95% een magneetdislocatie.
Samenvatting informatie implantaatfabrikanten
De informatie van fabrikanten is samengevat in tabel 4.
Voor de meest actuele, volledige informatie en gedetailleerde instructies wordt verwezen naar de websites van de fabrikanten. Inschatting van kans op pijn en magneetdislocatie door de werkgroep op basis van literatuur.
| # | inschatting kansen op basis van Hassepass 2014, Kim 2014, Young 2016, Todt 2018, Shew 2019, Tam 2020, Eerkens 2021, Rupp 2023, Alberalar 2023. |
| ## | Loth (2021) en Rupp (2023) rapporteren een incidentie van dislocatie bij de CI500 series van ca 30% op ca 100 procedures; aanzienlijk hoger dan bij andere modellen CI. Tam (2020) rapporteert echter geen dislocaties op ruim 40 procedures met CI400/500. |
| * | 3 T in aantal gevallen mogelijk na explantatie van de magneet, zie informatie fabrikant. |
| ** | CI22M zonder verwijderbare magneet is MR onveilig. CI22M met verwijderbare magneet is MR voorwaardelijk; hiermee is MRI-onderzoek mogelijk op 1,5 T met bandage, zonder de magneet te verwijderen. |
| *** | botdikte onder het implantaat moet minimaal 0,4 mm zijn, te bepalen op CT. Minimaal 6 maanden tussen implantatie en MRI-onderzoek. |
| **** |
toevoeging “3D” geeft aan dat het een roterende magneet betreft. |
Samenvatting informatie uit incidentdatabases van implantaten
Voor deze module zijn de volgende incidentdatabases van implantaten doorzocht:
- Het archief van Inspectie Gezondheidszorg (IGZ);
- De database van de Inspectie Gezondheidszorg en Jeugd (IGJ) met veiligheidsmeldingen vanaf 15 december 2015;
The FDA MAUDE database is niet doorzocht voor deze module omdat in de literatuursamenvatting het artikel van Fierens et al (2021) is meegenomen, welke een recent review uit deze incidentdatabase bevat. De databases werden doorzocht zonder een beperking op de periode van eventuele meldingen tenzij anders vermeld. Voor de precieze zoekverantwoording wordt verwezen naar de tabel ‘Zoekverantwoording Databases van Recalls en Events’. De resultaten zijn:
- Het archief van de IGZ bevatte geen relevante meldingen voor deze module.
- De database van de IGJ bevatte geen relevante meldingen voor deze module.
Hierbij merken we op dat dislocatie in Nederland niet meldingsplichtig is. Er zijn dislocaties in Nederland bekend, maar deze zijn niet gemeld bij IGZ of IGJ.
Risico's bij gehoorimplantaten
Omdat de risico's verschillend zijn voor de diverse soorten gehoorimplantaten worden deze per soort besproken. Hierbij wordt dezelfde indeling in zes hoofdklassen aangehouden voor de diverse soorten implantaten. Vervolgens worden –per soort implantaat– verdere overwegingen besproken.
In het algemeen kan voor gehoorimplantaten gesteld worden dat de risico's die verbonden zijn aan het MRI-onderzoek niet afhankelijk zijn van het te scannen gebied omdat risico's vooral gerelateerd zijn aan interacties met het statisch magneetveld en niet aan opwarming door het RF-veld van de MRI-scanner.
Risico's bij cochleair implantaten
Cochleair implantaten bestaan uit een intern deel en een extern deel, de geluidsprocessor. Het interne deel bestaat uit een elektrode die in het slakkenhuis wordt geplaatst. Deze elektrode is door middel van een ontvangstspoel, die onder de huid op de schedel wordt geïmplanteerd, via de externe zendspoel verbonden met de externe geluidsprocessor. In het midden van de zend- en ontvangstspoel bevindt zich een magneet die het mogelijk maakt de externe zendspoel magnetisch vast te klikken op de schedel ter plaatse van de interne ontvangstspoel, waardoor een betrouwbare signaaloverdracht van de spraakprocessor naar de elektrode ontstaat.
Door deze opbouw is het gemakkelijk om de externe geluidsprocessor met zendspoel af te nemen voorafgaand aan het MRI-onderzoek. De spraakprocessor is altijd MR-onveilig en moet altijd verwijderd worden voordat de patiënt de scanruimte betreedt. Bij bespreking van de risico's wordt ervan uitgegaan dat het externe deel verwijderd is, en worden alleen interacties van de MRI-scanner met het interne deel beschouwd.
1. Risico op verplaatsing en rotatie van het implantaat door de aanwezigheid van het statische magneetveld en de spatiële gradiënt van dit veld.
De interactie van het statisch magneetveld met de magneet van de ontvangstspoel vormt het grootste risico voor een MRI-onderzoek bij een CI-drager. De kracht op de geïmplanteerde magneet is een aantrekkende kracht bij de ingang van de MRI tunnel als gevolg van de spatiële gradiënt. Daarnaast is er een sterke roterende kracht op de geïmplanteerde magneet omdat deze zich wil richten naar het statisch magneetveld van de scanner. De beide magneetvelden staan (bij niet-roterende magneten, zie onderstaand) loodrecht op elkaar; dit heeft een sterke roterende kracht tot gevolg. Afhankelijk van de constructie van de geïmplanteerde magneet brengt dit kleine of juist relatief grote risico's met zich mee:
- Als het implantaat zodanig is ontworpen dat de magneet ongehinderd kan roteren binnen het implantaat, zal deze zich richten naar het magneetveld van de MRI. In dit geval speelt de aantrekkingskracht tussen beide magneten nog wel een rol, maar hier zijn niet of nauwelijks risico's aan verbonden. Dergelijke CI worden in Nederland sinds circa 2019 verkocht, en hierbij is geen bandage noodzakelijk tijdens het MRI-onderzoek om rotatie van de magneet te voorkomen.
- Van oudsher wordt de magneet in een siliconen houder in de ontvangstspoel geplaatst. Het veld van deze magneet staat haaks op het veld van de MRI-scanner waardoor een sterke roterende kracht op de magneet ontstaat. Zonder maatregelen komt de magneet hierdoor uit de siliconen houder, wat bijzonder pijnlijk is voor de patiënt. Er is meestal een operatie nodig om dit te corrigeren. In de literatuur wordt dit aangeduid met “dislocatie van de magneet”. Om het risico op dislocatie van de magneet te verlagen schrijven CI-fabrikanten bij types CI zonder roterende magneet voor om een bandage om het hoofd van de patiënt aan te brengen, waar bij sommige fabrikanten een specifiek kunststof kaartje of kapje onder de bandage op de plek van de magneet geplaatst moet worden. Omdat de kracht op de magneet hierdoor niet vermindert ervaart de patiënt het MRI-onderzoek vaak als pijnlijk, en is de kans op dislocatie van de magneet nog steeds reëel (Fierens 2021, refs tabel 2), afhankelijk van de magneetoriëntatie (tabel 4), en type CI (Eerkens 2021, Hassepass 2014, Kim 2014, Young 2016, Todt 2018, Shew 2019, Rupp 2023, Alberalar 2023). Opvallend is dat Loth (2021) en Rupp (2023) aanzienlijk hogere incidentie van dislocatie rapporteren bij de Cochlear CI500 series (ca 30% op ca 100 procedures) vergeleken met andere types CI (ordegrootte 1%). Daartegenover staat dat Tam (2020) geen dislocaties zag op ruim 40 procedures met CI400/500 series. Verder is er een kans dat de magneet “omgepoold” of gedemagnetiseerd wordt (Fierens 2021, refs tabel 2). NB: in de literatuur wordt bij “ompoling” geen onderscheid gemaakt tussen een fysieke rotatie van de magneet (vergelijkbaar met dislocatie) of een wisseling van de polen van de magneet, waarbij de magneet zelf niet fysiek geroteerd is. In de handleiding van Oticon Neuro Zti geeft de fabrikant aan dat de kans op demagnetisatie toeneemt als het hoofd niet parallel aan het B0-veld van de scanner gehouden wordt, en dat gemiddeld een verlies van 2% magneetkracht na eenmalig scannen op 3 T optreedt, en 3% verlies na tien 3 T scans.
- Bij sommige types CI schrijft de fabrikant voor om de magneet (operatief) te verwijderen voorafgaand aan het MRI-onderzoek, en deze na afloop van het MRI-onderzoek weer te herplaatsen. Hiermee wordt het risico op dislocatie van de magneet geheel vermeden, maar de beide operaties zijn wel belastend voor de patiënt en brengen geheel andere risico's met zich mee. Ook kan het zijn dat een fabrikant een MRI-onderzoek bij 1,5 T wel met bandage toestaat, maar dat de magneet verwijderd moet worden voor een onderzoek bij 3 T. De afweging van preventief explanteren van de magneet bij CI die wel met bandage gescand mogen worden, maar die een relatief hoog risico hebben op dislocatie, zoals de CI500 series, is een individuele afweging die specialisten samen met de patiënt moeten maken.
- Sommige types CI zijn door de fabrikant als MR onveilig gecategoriseerd (mogelijk ook vanwege effecten genoemd onder punt 2). In dergelijke gevallen kan een MRI-onderzoek geen doorgang vinden.
- Risico op opwarming van het implantaat door interactie met het RF-veld. Elektrisch geleidende delen van een implantaat kunnen opwarmen tijdens het MRI-onderzoek. Dit effect kan relevant zijn voor met name de ontvangstspoel en de elektrode. Fabrikanten stellen om deze reden soms beperkingen op voor het maximale RF-vermogen per hoeveelheid lichaamsgewicht dat tijdens het onderzoek gebruikt mag worden. Het RF-vermogen wordt uitgedrukt in de grootheid specific absorption rate (SAR) met als eenheid Watt per kilogram (W/kg). Zeng (2018) rapporteert op basis van simulaties een maximale temperatuursverhoging van ca 3°C bij de elektrode, wat, gezien de onzekerheden in de simulatie, weefselschade (littekenvorming) rond de elektrode niet bij voorbaat uitsluit. Littekenweefsel zou leiden tot verhoging van de weerstand van de elektrode waarvoor het CI automatisch compenseert. De weerstand wordt ook regelmatig gemeten tijdens controles van het CI. Dergelijke verhogingen van elektrodeweerstand als gevolg van MRI-onderzoeken zijn in de literatuur niet beschreven. Op basis van deze informatie schat de werkgroep het risico op weefselschade door opwarming van het CI laag in, met inachtname van eventuele door de fabrikant voorgeschreven SAR beperkingen.
3. Risico op trilling of inductie van stromen door de oscillerende magnetische veldgradiënten die worden toegepast voor de ruimtelijke codering van het MRI-signaal.
Gradiëntvelden kunnen stroom opwekken in de elektrode, wat kan leiden tot de perceptie van geluid (piepen, fluiten) tijdens het onderzoek. Dit is niet schadelijk.
4. Artefact in het MRI-beeld.
De aanwezigheid van een geïmplanteerde magneet verstoort de beeldvorming met MRI. Belangrijkste aspect hiervan is het signaalverlies tot een afstand van 2 tot 7 cm van een niet-roterende magneet, met spinecho op 1,5 Tesla (Sharon 2016, Walker 2018, Todt 2020). Bij een roterende magneet is het gebied met signaalverlies vergelijkbaar of iets groter (Tysome 2019). De exacte grootte van het gebied met signaalverlies is afhankelijk van de MRI-scanner (1,5 of 3 T), de gebruikte pulssequentie (spinecho of gradiëntecho) en diverse parameters zoals echotijd, bandbreedte en spatiele resolutie. In geval van bilaterale implantaten zijn ook de artefacten bilateraal. Gradiëntecho is, vanwege grootte van het gebied met signaalverlies, ongeschikt voor beeldvorming in aanwezigheid van een geïmplanteerde magneet. Een CISS/FIESTA-C/BFFE pulssequentie geeft een artefact vergelijkbaar met spinecho (Sharon 2016). Daarnaast is beeldvorming door middel van echo-planar imaging (EPI), zoals diffusie en perfusie, niet mogelijk. Chemical shift vetsaturatie pulsen geven doorgaans een zwarte balk ergens in de hersenen, deze methode van vetonderdrukking kan beter uitgezet worden, of gewijzigd worden naar STIR. Het gebruik van een magnetische spalk vergroot het gebied met signaalverlies tot circa 12 cm en wordt daarom afgeraden voor hoofd/hals MRI-onderzoeken. Naast signaalverlies treedt ook geometrische vervorming op. Hierdoor zijn afstanden en afmetingen op MRI beelden in de buurt van de geïmplanteerde magneet niet betrouwbaar. Artefacten van de geïmplanteerde magneet zijn zodanig dominant dat artefacten door andere onderdelen van het interne CI-deel niet relevant zijn, tenzij de CI-magneet verwijderd wordt. Als het afbeelden met MRI van de anatomie dicht bij het implantaat essentieel is voor diagnostiek en behandeling van de CI-drager, dan kan overwogen worden om de magneet operatief te verwijderen voorafgaand aan het MRI-onderzoek. Er treedt nog wel signaalverlies op, maar dit beperkt zich tot een afstand van 2 tot 5 cm (Wagner 2015, Walker 2018). De mogelijkheid van magneet explantatie verschilt per type implantaat. Informatie hierover is bij de fabrikant beschikbaar en niet in deze richtlijn opgenomen.
5. Risico van krachten door het Lenz-effect bij snelle beweging van geleidende implantaten in het statisch magnetisch veld van de MRI-scanner.
Dit effect zou zich kunnen uiten in geluidsperceptie tijdens snelle beweging. Snelle bewegingen zijn echter dermate onaangenaam voor de CI-drager door de interactie van de CI-magneet met het statisch magneetveld van de scanner dat dit effect als niet relevant mag worden beschouwd.
6. Risico op verstoring van de werking van het implantaat. Bij punt 1 genoemde risico's ompoling of demagnetisatie komen voor, als mede het bij punt 2 genoemde klachten “altered device performance” en “sound perception”. Een oplossing voor ompoling is dat ook de magneet in de spraakprocessor wordt omgekeerd. Dat de kans op demagnetisatie, “altered device performance” en problemen met “sound perception” beperkt is kan worden afgeleid van het aantal “adverse events” in tabel 1; respectievelijk 2%, 6% en 1% van alle gevonden klachten betreft mogelijk een verstoring in de werking.
Risico's bij auditory brainstem implantaten
Auditory brainstem implantaten (ABI) lijken erg op CI’s in vorm en techniek met het belangrijke verschil dat de electrode niet in het slakkenhuis geplaatst wordt, maar in plaats daarvan direct de hersenstam stimuleert. De risico’s lijken dus erg op die van CI’s maar zijn mogelijk groter door de gevoeligere plek van de electrode. Deze implantaten zijn een stuk zeldzamer dan de CI’s; er worden landelijk enkele implantaten per jaar geplaatst.
1. Risico op verplaatsing en rotatie van het implantaat door de aanwezigheid van het statische magneetveld en de spatiële gradiënt van dit veld.
ABI hebben net als CI’s een interne magneet die aangetrokken wordt door het magneetveld van de MR scanner. Het risico is dus hetzelfde als bij een CI met een vergelijkbare magneet. Er zijn op het moment van het schrijven van deze richtlijn twee leveranciers die ABIs produceren, Med-El en Cochlear. Alle ABIs zijn MRI conditioneel voor 1,5 T. Net als bij CI’s zijn er ABI met een vaste magneet en een roterende magneet. Hierbij gelden voor de verschillende type magneten dezelfde risico’s als beschreven bij de CI’s. In tabel 1 kan bij elke type ABI het type magneet gevonden worden.
2. Risico op opwarming van het implantaat door interactie met het RF-veld.
Dit risico is net als bij CI’s relevant voor de electrode en de ontvangstspoel van het implantaat, maar de electrode zit op een plek waar opwarming een hoger risico vormt. In de literatuur zijn geen duidelijk incidenten te vinden waarbij opwarming van het implantaat een rol speelt, dit risico lijkt dus erg beperkt. Dit wel met inachtname van de SAR beperkingen geven door de leverancier van het implantaat.
3. Risico op trilling of inductie van stromen door de oscillerende magnetische veldgradiënten die worden toegepast voor de ruimtelijke codering van het MRI-signaal.
Deze risico’s zijn hetzelfde als voor CI’s
4. Artefact in het MRI-beeld.
Dit risico is hetzelfde als voor CI’s
5. Risico van krachten door het Lenz-effect bij snelle beweging van geleidende implantaten in het statisch magnetisch veld van de MRI-scanner.
Deze risico's zijn hetzelfde als bij CI’s
6. Risico op verstoring van de werking van het implantaat.
Deze risico's zijn hetzelfde als bij CI’s.
Risico's bij beengeleidingsimplantaten
Er zijn 3 typen beengeleidingsimplantaten:
- Percutaan implantaat
- Transcutaan passief implantaat
- Transcutaan actief implantaat
Bij implantaten van type 1 worden er geen magneten gebruikt, en wordt in plaats daarvan de huid doorbroken. Bij type 2 en 3 worden onderhuidse magneten gebruikt. Bij Type 2 geeft deze magneet direct de geluidssignalen aan het bot door. Type 3 lijkt erg op een CI waarbij een interne ontvangstspoel de signalen door geeft aan een interne geluidprocessor die signalen door geeft aan het bot. De magneet maakt het mogelijk om de externe geluidsprocessor op de interne ontvangstspoel vast te zetten. Alle beengeleidingsimplantaten zijn MR voorwaardelijk.
1. Risico op verplaatsing en rotatie van het implantaat door de aanwezigheid van het statische magneetveld en de spatiële gradiënt van dit veld.
Voor type 1 zijn deze risico’s niet aanwezig zolang de externe componenten verwijderd worden voordat de patiënt de MRI-ruimte betreedt. Bij implantaten van type 2 en 3 kan de interne magneet interacties vertonen met het magneetveld van de MR. Er is een kans dat de magneet verplaatst of loskomt en chirurgisch hersteld moet worden, dit is in meer detail beschreven bij de risico's van CI. Voor de meeste beengeleidingsimplantaten van type 2 en 3 geldt de beperking dat deze alleen op 1,5 T gescand kunnen worden. Hiernaast is er op dit moment één type implantaat op de markt waarbij de fabrikant aangeeft dat er, net als bij sommige CIs, een drukverband met een spalkje gebruikt moet worden om de magneet op zijn plek te houden (zie tabel 1).
2. Risico op opwarming van het implantaat door interactie met het RF-veld.
Voor alle beengeleidingsimplantaten is dit risico kleiner dan bij CI’s, omdat de implantaten geen elektrodes hebben. Voor type 1 en 2 is de fysieke grootte van het implantaat (ordegrootte 1 à 3 cm) zodanig dat opwarming onwaarschijnlijk is.
3. Risico op trilling of inductie van stromen door de oscillerende magnetische veldgradiënten die worden toegepast voor de ruimtelijke codering van het MRI-signaal.
Dit risico is niet van toepassing.
4. Artefact in het MRI-beeld.
Voor type 1 implantaten is dit artefact beperkt tot dicht bij het implantaat door het ontbreken van de magneet, voor type 2 en 3 implantaten zijn de artefacten, door de onderhuidse magneet, vergelijkbaar met die van CI’s.
5. Risico van krachten door het Lenz-effect bij snelle beweging van geleidende implantaten in het statisch magnetisch veld van de MRI-scanner.
Niet relevant voor deze implantaten.
6. Risico op verstoring van de werking van het implantaat.
Voor type 1 implantaten is hier geen risico op. Voor type 2 en 3 kan het loskomen van de magneet van de schedel of demagnetisatie van de magneet ervoor zorgen dat het implantaat niet meer functioneert.
Risico's bij actieve middenoorimplantaten
Actieve middenoorimplantaten geven via een elektromagnetische of piëzo-elektrische transducer geluid door aan de middenoorbeentjes. Er zijn verschillende types actieve middenoorimplantaten, waarvan de meeste voorkomende vergelijkbaar is met cochleair implantaten. Dit type systeem bestaan uit een extern deel dat gelijk is aan een CI (geluidsprocessor en zendspoel) en een intern deel waarbij een transducer in het middenoor de plaats inneemt van de elektrode die bij een CI aanwezig is. De ontvangstspoel is net zoals bij de CI voorzien van een magneet om het externe deel te verbinden. Andere types middenoorimplantaten zoals de Envoy Esteem zijn volledig geïmplanteerd en hebben geen extern deel, en dus ook geen magneet waar het externe deel aan vast zit.
De risico's en overwegingen die eerder zijn besproken voor de CI zijn ook van toepassing voor de actieve middenoorimplantaten. Daarnaast geldt dat voor de middenoorimplantaten ook nog risico's zijn te associëren met de transducer in het middenoor, omdat deze ook is voorzien van een magneet. De additionele risico's worden hieronder besproken.
1. Risico op verplaatsing en rotatie van het implantaat door de aanwezigheid van het statische magneetveld en de spatiële gradiënt van dit veld.
Dit type implantaten bevatten mogelijk twee magneten die interactie kunnen vertonen met het statische magneetveld van de MR, de magneet die gebruikt wordt om het externe deel te bevestigen en de magneet die gebruikt wordt in de elektromagnetische transducer. Echter, de modellen actieve middenoorimplantaten waarbij dit risico speelt zijn MRI onveilig en kunnen dus alleen gescand worden na het chirurgisch verwijderen van het implantaat. Bij de MR-voorwaardelijke modellen is dit risico beperkt door het gebruik van een roterend magneet en slim ontwerp van de elektromagnetische transducer (VORP 503 MED-EL) of door het enkel gebruiken van onderhuidse componenten en piëzoelectrische transducers (bijvoorbeeld de Envoy Esteem van Envoy Medical). Er wordt in literatuur 1 casus beschreven (Heyning 2021) waarbij de elektromagnetische transducer gedislokeerd raakt door een MRI. Hierbij werd en patiënt met de VORP 503 van MED-EL gescand in een 0,2 T MRI, volgens de veiligheidsinformatie zou dit type implantaat alleen op 1,5 T gescand mogen worden.
2. Risico op opwarming van het implantaat door interactie met het RF-veld.
Er is een risico dat de metallische onderdelen van deze implantaten opwarmen door de RF-straling gebruikt bij MRI. Om deze reden geven de leveranciers van de MRI-conditionele implantaten een SAR-limiet waarmee gescand moet worden (zie tabel 4). Er zijn in de literatuur geen casussen beschreven van incidenten met deze implantaten door opwarming. Het risico hierop is laag zolang de SAR-limieten van de leveranciers aangehouden worden.
3. Risico op trilling of inductie van stromen door de oscillerende magnetische veldgradiënten die worden toegepast voor de ruimtelijke codering van het MRI-signaal.
Gradiëntvelden kunnen stromen opwekken in de elektronica van de implantaten, dit kan lijden tot perceptie van geluid.
4. Artefact in het MRI-beeld.
De typen implantaat die gebruik maken van elektromagnetische transducers en de externe geluidsprocessor met een magneet aansluit zullen een vergelijkbaar artefact vertonen als de CI’s. Volgens de site van MED-EL is er ongeveer 14 cm rondom de VORP 503 een artefact zichtbaar. De grootte van dit artefact hangt af van het type scan dat er uitgevoerd wordt. Volgens non-clinical testing van Envoy medical is er tot 5,7 cm van de Envoy Esteem een artefact zichtbaar op een 3 T spin-echo sequentie.
5. Risico van krachten door het Lenz-effect bij snelle beweging van geleidende implantaten in het statisch magnetisch veld van de MRI-scanner.
Dit effect is niet relevant voor dit type implantaten
Risico op verstoring van de werking van het implantaat.
Deze risico's zijn beperkt; de enige casus beschreven in de literatuur is beschreven bij punt 1, namelijk de dislocatie van de magneet in de transducer van een VORP 503. Dit implantaat moest chirurgisch hersteld worden. Deze patiënt was gescand in een 0,2 T systeem terwijl deze implantaten eigenlijk alleen in een 1,5 T gesloten tunnel gescand mogen worden.
Risico's bij gehoorbeenprotheses
Gehoorbeenprotheses zijn passief (geen elektronica) en zijn over het algemeen MR veilig. De enige uitzondering hierop betreft een batch van implantaten genaamd “McGee Piston” gefabriceerd door Richards Company, Memphis, TN, USA in 1987. Deze implantaten zijn per ongeluk met verkeerd geclassificeerd staal gemaakt waardoor deze specifieke implantaten sterk magnetisch zijn. Van deze batch van onveilige implantaten zijn er 1333 verkocht, waarvan 1034 aan Amerikaanse en 299 aan internationale klanten. Tussen de datum van fabricage en de datum van terugroeping (30 juni 1989) is bekend dat er 64 van deze implantaten zijn geplaatst. Deze patiënten zijn op de hoogte gesteld van dit probleem en het feit dat ze geen MRI kunnen verkrijgen met dit implantaat. Hiernaast zijn er na het terugroepen van deze implantaten nog 366 implantaten “vermist” (Fritsch 2007).
1. Risico op verplaatsing en rotatie van het implantaat door de aanwezigheid van het statische magneetveld en de spatiële gradiënt van dit veld.
Niet relevant voor deze implantaten, behalve de McGee piston geplaatst tussen 1987 en 1989. Er is één casus bekend waarbij een patiënt met zo’n McGee piston de MRI ruimte heeft betreden. Toen deze patiënt in de buurt kwam van de 1,5 T scanner verloor de patiënt gehoor aan de rechterkant en werd duizelig. Het gehoor kon operatief hersteld worden door het plaatsten van een nieuw implantaat (Fritsch 2007).
2. Risico op opwarming van het implantaat door interactie met het RF-veld.
Niet relevant voor deze implantaten.
3. Risico op trilling of inductie van stromen door de oscillerende magnetische veldgradiënten die worden toegepast voor de ruimtelijke codering van het MRI-signaal.
Niet relevant voor deze implantaten.
4. Artefact in het MRI-beeld.
Artefact is minimaal en vormt geen risico.
5. Risico van krachten door het Lenz-effect bij snelle beweging van geleidende implantaten in het statisch magnetisch veld van de MRI-scanner.
Niet relevant voor deze implantaten.
6. Risico op verstoring van de werking van het implantaat.
Niet relevant voor deze implantaten.
Ervaringen vanuit het onafhankelijk platform cochleaire implantatie
De ervaringen beschreven in deze sectie zijn gebaseerd op persoonlijke communicatie gedurende de periode 2010 - 2022 met ruim 1.500 CI-dragers (van de in totaal 8846 CI-dragers in Nederland per 31-12-2022, zoals vermeld op de website van de OPCI (OPCI 2022).
In de loop der jaren zijn er veel negatieve ervaringen van CI-dragers geweest. Binnen de patiëntvereniging zijn deze negatieve ervaringen gedeeld en algemeen bekend, waardoor er in algemene zin sprake is van het mijden van een MRI-onderzoek door CI-dragers. De voordelen van een MRI-onderzoek ziet de CI-drager wel degelijk; de waarde ervan staat niet ter discussie, en de uitkomstwaarden (bevestiging van een aandoening, of juist uitsluiting daarvan) is ook voor de CI-drager evident. Desondanks is MRI-mijding een serieus probleem, soms tot frustratie van medisch specialisten. De belangrijkste factoren die bijdragen aan MRI-mijding, genoemd door CI-dragers, zijn pijn en angst voor pijn en onherstelbare gehoorschade. Binnen de patiëntenvereniging is de ervaring dat bijna elke CI-drager pijn ervaart tijdens een MRI-onderzoek. De aantallen MRI-onderzoeken die niet diagnostisch zijn en/of forse schade hebben veroorzaakt zijn weliswaar niet schrikbarend hoog, maar zijn ingrijpend voor de patiënt en voorzaken veel pijn en stress. Daarnaast is er een grote angst voor onherstelbare schade en hierdoor weer doof te worden. Zoals een plots/laat dove formuleerde: “ik weet hoe het is om horend te zijn, helaas ook hoe het is om doof te zijn. Nu CI-horend zal ik elk risico opnieuw doof te worden vermijden”. Hieruit concluderen wij dat CI-dragers hechten aan een MRI-onderzoek, maar nog meer waarde toekennen aan het teruggewonnen horen.
Dit moet gezien worden in het perspectief dat in de literatuur geen cases bekend zijn waar schade onherstelbaar is. In het ergste geval moet schade operatief hersteld worden. Na operatieve correctie functioneerde het CI weer naar behoren bij de gerapporteerde incidenten. Dit is weliswaar een niet te onderschatten en zware belasting voor de CI-drager, maar op lange termijn niet onoverkomelijk.
Naast pijn en angst maakt onduidelijkheid over het verloop van het MRI-onderzoek, en gebrek aan mogelijkheden tot communicatie de CI-drager vaak onzeker tijdens het MRI-onderzoek. De onzekerheid die een CI-drager ervaart in de MRI-kamer wordt versterkt doordat de CI-drager na afnemen van de spraakprocessor doof is. Alles wat gezegd wordt door het personeel (ook onderling) wordt mogelijk negatief geïnterpreteerd en door de CI-drager op zichzelf betrokken. Het is belangrijk dat het personeel dat de patiënt begeleidt tijdens de MRI zich hier bewust van is. Duidelijke communicatie vooraf, tijdens en na het MRI-onderzoek zijn essentieel om MRI-mijding te voorkomen.
Communicatie
De gemiddelde CI-drager bereidt zich goed voor op de vraag “wat te doen als een MRI noodzakelijk is”, en maakt daarbij gebruik van goede en duidelijke informatie die CI-teams en CI-fabrikanten verstrekken.
De patiëntvereniging signaleert wel een kennisgebrek bij aanvragende medisch specialisten, bij radiologen en bij radiodiagnostisch laboranten. Dat draagt significant bij aan de angst voor het ondergaan van een MRI-onderzoek. Het is essentieel dat vooraf aan een MRI-onderzoek de CI-drager goed wordt voorgelicht over de risico's van een MRI-onderzoek met zijn/haar type CI, en welke ervaringen de CI-drager tijdens het MRI-onderzoek kan verwachten. Ook kan het helpen als het personeel dat de patiënt begeleidt tijdens het onderzoek, voordat de externe geluidsprocessor wordt verwijderd, duidelijke afspraken maakt over hoe de patiënt kan aangeven dat hij/zij pijn ervaart en in welke situaties het onderzoek afgebroken zal worden.
Een oplossing voor communicatie nadat de externe geluidsprocessor verwijderd is, kan geboden worden door inzet van schrijf- of gebarentolken. Deze tolken kunnen door de CI-drager zelf geregeld worden, en worden door het UWV aan de CI-drager vergoed. Helaas worden schrijf- of gebarentolken in veel ziekenhuizen geweerd waardoor elke vorm van communicatie wegvalt. Overigens kan het zijn dat de tolk om veiligheidsredenen géén toegang wordt gegeven tot de MRI-kamer, en in geen geval kan apparatuur (bijvoorbeeld een laptop) mee in de MRI-kamer. Potlood en papier kan wél een eenvoudig hulpmiddel zijn in de MRI-kamer. Verder kan het onderzoek vooraf helder doorgesproken worden, en ook kan een signaal afgesproken worden bij pijnklachten, en welke actie hier dan op genomen zal worden. Een tolk kan hierbij van meerwaarde zijn.
Samenvatting en verbeterpunten
Angst voor risico’s en pijn tijdens het MRI-onderzoek mag niet onderschat worden en verdient de aandacht. Op termijn kan dit vermijding van MRI-onderzoeken door CI-dragers verminderen. De belangrijkste factor hierbij is heldere communicatie tussen medische professionals en de CI-drager. Tabel 4 geeft enkele handvaten voor deze communicatie, bijvoorbeeld de kans op pijn en dislocatie voor het betreffend implantaat. Direct voorafgaand aan het MRI-onderzoek kan een schrijf- of gebarentolk bijdragen aan communicatie.
Additionele overwegingen bij cochleair implantaten
Bandage en spalk bij implantaten met vaste magneet
Bij implantaten met een vaste magneet waarbij een MRI-onderzoek is toegestaan zonder de magneet te verwijderen is altijd een bandage vereist om magneetdislocatie te voorkomen. Sommige fabrikanten van implantaten leveren hiervoor hun eigen materialen. Een dergelijke “MRI kit” bestaat uit een kunststof spalk, ook wel “kapje”, “magnet cover” of “splint” genoemd, en soms ook een elastische bandage of “drukverband”. Eerkens (2021) laat echter zien dat de spalk van één fabrikant een duidelijke voorkeur heeft wat betreft de kans op magneetdislocatie, te weten de spalk van Cochlear. De spalken van andere fabrikanten vindt de werkgroep minder geschikt. De spalk van Cochlear is momenteel alleen te bestellen in de versie met magneet (blauw). Voorheen was ook een variant beschikbaar in de vorm van een plastic kaartje (geel), maar deze is bij het schrijven van deze richtlijn niet meer leverbaar. De blauwe spalk kan gemakkelijk op de geïmplanteerde magneet worden geplaatst door de magneet in de spalk. De bandage moet wel zodanig op de spalk worden aangebracht dat deze niet onder de bandage vandaan kan worden getrokken door het magneetveld van de MRI-scanner. De blauwe spalk heeft echter als nadeel dat het gebied met signaalverlies (MRI artefact) groter is dan bij een niet-magnetische spalk. De consensus binnen de werkgroep is dat voor MRI-onderzoek van het hoofd/halsgebied de gele spalk wordt aanbevolen, en voor MRI-onderzoek buiten het hoofd/halsgebied de blauwe spalk. Deze consensus is gebaseerd op ervaring; de wetenschappelijke onderbouwing hiervan is afwezig.
De oude Cochlear spalk is niet meer leverbaar. Een spalk met vergelijkbare geschikte eigenschappen is echter zelf te fabriceren op basis van de volgende beschrijving. De spalk is in essentie een plastic kaart ter grootte van een creditcard, maar dan iets dikker en stijver. De spalk moet de flexibiliteit hebben om onder de bandage met het hoofd mee te buigen, en tevens stijf genoeg zijn om de kracht van de geïmplanteerde magneet over een groot oppervlak te verdelen. De maten zijn 86x54x1 mm. De stijfheid is zodanig dat bij fixatie van de korte einden, de spalk 5 mm doorbuigt bij 10 N puntbelasting in het midden. Ter vergelijking: de Nederlandse rijbewijskaart buigt dezelfde afstand door bij 4 N.)
Het drukverband bestaat uit een elastisch verband met een breedte van circa 6 tot 9 cm breed. De werkgroep heeft goede ervaring met het drukverband en de instructies van Cochlear; dit verband is voldoende breed en zelfklevend. Begin met aanleggen op het achterhoofd en leg het verband zo laag mogelijk over het voorhoofd. Let hierbij op dat de spalk volledig afgedekt wordt. Het verband moet zodanig strak worden aangelegd dat de geïmplanteerde magneet platgedrukt blijft. In de MRI-scanner zal de geïmplanteerde magneet zich met flinke kracht willen richten naar het magneetveld van de MRI-scanner, zodanig dat het magneetje 90 graden draait en rechtop komt te staan. De spalk moet dit voorkomen en de magneet in de houder drukken. Bij de blauwe (magnetische) spalk is verder van belang dat het niet mogelijk is om deze onder het verband uit te trekken. Onjuist en/of niet strak genoeg aangelegd verband verhoogt de kans op dislocatie van de magneet.
Lokale procedure voor MRI-onderzoeken met bandage
Vanwege de complexiteit en de risico's bij niet correct aanbrengen van de spalk en het drukverband vereist de werkgroep dat deze procedure alleen wordt uitgevoerd als de training en verantwoordelijkheden van het personeel schriftelijk zijn vastgelegd in een lokale procedure. Onderbouwing voor deze eis wordt gegeven door de publicatie van Dewey (2022). Uit de systematische analyse van een enquête onder 237 zorgverleners kwam adequate training van personeel als essentieel punt naar voren. Dit is ook logisch aangezien deze categorie implantaten vrij uniek is in verhouding met andere implantaten: er zijn weinig implantaten waarbij de patiënt direct pijn kan ervaren door interactie met het magneetveld en toch gescand kan worden. Hiernaast is communicatie met de patiënt moeilijk door het ontbreken van de externe geluidsprocessor. Het is dus van belang dat het MRI-personeel zich hier bewust van is en getraind is om deze groep patiënten goed te kunnen begeleiden.
In de procedure staan alle taken, verantwoordelijkheden en werkprocessen rondom het MRI-onderzoek benoemd. Omdat de werkprocessen per ziekenhuis verschillen beschrijft de richtlijn globaal welke aspecten in de procedure beschreven worden:
- voorlichtingsconsult. Opmerking: wanneer het MRI onderzoek wordt uitgevoerd in een ziekenhuis waar ook CIs geplaatst worden, kan het voorlichtingsconsult logischerwijs plaatsvinden op de KNO-afdeling, waar de expertise over CI’s zich bevindt.
- aanbrengen van de bandage door getraind personeel. Afhankelijk van de lokale situatie kan dit bijvoorbeeld een verpleegkundige van de afdeling KNO zijn, of een MRI laborant.
- routering en wachttijd patiënt met bandage. De wachttijd moet zo kort mogelijk zijn omdat de bandage zodanig strak moet worden aangebracht dat dit doorgaans ook als pijnlijk wordt ervaren.
- afspraken rondom communicatie met de patiënt na het afnemen van de spraakprocessor.
- de patiënt heeft het recht om een schrijf- of gebarentolk mee te brengen.
- overweeg een loopbriefje aan de patiënt mee te geven waarop kan worden aangegeven wie op welk tijdstip de bandage heeft aangelegd, waar de spalk en bandage retour moeten en met wie de laborant en/of patiënt contact opnemen bij acute of latere klachten.
- controle van instructies van de fabrikant (zie tabel 4); let met name op de maximale veldsterkte en een verlaagd SAR niveau.
- positionering van de patiënt tijdens het onderzoek. Zorg dat de patiënt niet dicht bij de zijkant van de magneetopening van de MRI-scanner komt. Ondersteun zo mogelijk het hoofd zodat het midden op de patiënttafel ligt en niet meer dan noodzakelijk beweegt.
- na afloop van het MRI-onderzoek; verwijder bandage en spalk ter plekke. De spraakprocessor plaatst de patiënt zelf terug. Bij acute klachten gaat de patiënt direct naar de aangewezen contactpersoon.
- hoe te handelen bij een incident zoals magneetdislocatie, met name hoe de patiënt verder geholpen wordt omdat de patiënt na een incident doorgaans doof zal zijn en dus niet zelf met het ziekenhuis van implantatie kan bellen. Het ziekenhuis waar het MRI-onderzoek wordt uitgevoerd blijft verantwoordelijk voor de nazorg bij complicaties die als gevolg van het MRI-onderzoek zijn ontstaan, totdat dit is overgedragen. Voor een verwijzing neemt het ziekenhuis, zo nodig, zelf contact op met het centrum van implantatie. Beschrijf in de lokale procedure wie hier binnen het ziekenhuis verantwoordelijk voor is.
In het voorlichtingsconsult kunnen de volgende aspecten besproken worden:
- De risico’s van de MRI specifiek voor het betreffende merk en type CI. Specifiek voor de CI500 series van Cochlear zijn sterke aanwijzingen voor grotere kans op dislocatie dan bij andere types CI (Rupp 2023, Loth 2021).
- De te nemen voorzorgsmaatregelen.
- Uitleg gang van zaken op dag van het MRI-onderzoek (o.a. noodzaak van het oncomfortabel strakke hoofdverband).
- Uitleg over de mogelijke ervaringen tijdens het MRI-onderzoek.
- Uitleg over de mogelijke complicaties ondanks voorzorgsmaatregelen. Denk hierbij aan de kans op een incident waarbij een chirurgische ingreep noodzakelijk is. Geef deze informatie bij voorkeur ook schriftelijk aan de patiënt.
- Uitleg wat te doen/wie te benaderen indien er klachten tijdens of na de MRI-scan ontstaan.
- Indien het verwijderen van de magneet noodzakelijk is: risico's van verwijderen magneet.
Eventueel oefenen met het drukverband. Hierdoor ervaart de patiënt hoe strak het zit en of dat als pijnlijk wordt ervaren.
Slotoverwegingen
Cochleair Implantaat
De uiteindelijke aanbevelingen in deze richtlijn volgen vrijwel ongewijzigd de voorzorgsmaatregelen, instructies en beperkingen zoals opgesteld door de fabrikant van het CI. Het is niet nodig om voorafgaand aan het MRI-onderzoek contact op te nemen met het centrum van implantatie, tenzij het merk/type implantaat onbekend is, of het een ABI betreft. Daarnaast registreren fabrikanten van CI's welke patiënten hun implantaat dragen. In het uiterste geval is een CI te identificeren aan de hand van een röntgenfoto. Daarmee vormt het volgen van deze voorwaarden geen onoverkomelijke beperkingen voor een MRI-onderzoek. Wel kan de beeldkwaliteit bij bepaalde vraagstellingen minder zijn dan gebruikelijk als gevolg van beperkingen van veldsterkte (1,5 T in plaats van 3 T) of SAR-beperkingen. Bij MRI-opnamen van de hersenen en in het hoofd/hals gebied wordt de beeldkwaliteit sterk beïnvloed door eerdergenoemde verstoring van het statisch magneetveld van de scanner door de magneet van het CI.
Alle CI's op de Nederlandse markt zijn door de fabrikanten geclassificeerd als MR onveilig of MR voorwaardelijk. Gegeven deze formele classificatie definieert de werkgroep binnen deze richtlijn enkele subcategorieën:
- MR voorwaardelijk met meedraaiende magneet
- MR voorwaardelijk zonder meedraaiende magneet
- MR voorwaardelijk zonder meedraaiende magneet waarbij de magneet verwijderd moet worden
- MR onveilig
Voor implantaten waarbij bandage nodig is (zie tabel 4, subcategorie B) stelt de werkgroep de voorwaarde dat er een schriftelijke lokale procedure aanwezig is zoals beschreven in bovenstaande sectie.
ABI
Alle type ABI vallen of in categorie A of B. In het geval van een ABI van classificatie B is er een risico op schade aan het implantaat dat chirurgisch hersteld zou moeten worden. Gezien er maar een enkele plek in Nederland is waar ABI’s geïmplanteerd worden raadt de werkgroep aan om deze implantaten (ABI met vaste magneet) door te verwijzen naar het centrum waar de ABI geïmplanteerd is voor de nodige MRI. Dit omdat dit centrum de enige plek is waar mogelijke schade hersteld kan worden. In het geval van ABI’s die in categorie A vallen zijn de risico's op schade beperkt zolang de voorwaarden van de leverancier gevolgd worden. In dit geval raadt de werkgroep aan contact op te nemen met het centrum waar de ABI geplaatst is voor advies maar hoeft de patiënt niet doorverwezen te worden voor de MRI.
Beengeleidingsimplantaten
Bij beengeleidingsimplantaten moet eerst bepaald worden of het om een percutaan of transcutaan implantaat gaat. Percutane implantaten bestaan uit een schroef die door de huid in het bot wordt vastgezet. Als de spraakprocessor is verwijderd, dan resteert slechts de schroef en dit is een passief implantaat. In het geval van percutaan implantaat kan er, gezien de beperkte risico’s, een MRI-onderzoek uitgevoerd worden zonder uit te zoeken welk merk of type implantaat dit betreft. De spraakprocessor moet wel verwijderd worden; dit onderdeel is MR onveilig.
In het geval van een transcutaan beengeleidingsimplantaat is het belangrijk om het merk en type te achterhalen en de aanbevelingen en beperkingen van de leverancier te volgen. Enkele veel voorkomende types staan vermeld in tabel 4.
Actieve middenoorimplantaten
Actieve middenoorimplantaten zijn of MR voorwaardelijk of MR onveilig. Volg bij MR-voorwaardelijke actieve middenoorimplantaten de voorschriften van de fabrikant om schade aan het implantaat te voorkomen. Deze voorschriften kunnen voor de meest voorkomende implantaten gevonden worden in tabel 4.
Gehoorbeenprotheses
Stapes protheses zijn over het algemeen MR veilig. Van het MR-onveilige type, de McGee piston gefabriceerd tussen 1987 en 1989, zijn maar een beperkt aantal nog mogelijk aanwezig in patiënten wereldwijd. Hiernaast zijn de gevolgen van het blootstellen van dit implantaat aan de MR omgeving van tijdelijke aard en kan de schade hersteld worden door het plaatsten van een nieuw implantaat. Om deze redenen raadt de werkgroep aan om screenen op deze implantaten los te laten.
Kosten (middelenbeslag)
De kosten voor een eventuele schrijftolk worden vergoed door het UWV (https://www.uwv.nl/particulieren/voorzieningen/tolkvoorziening/). De patiënt vraagt deze schrijftolk aan.
Daarnaast beschrijft deze richtlijn in sommige gevallen een extra consult bij de KNO-arts of andere zorgverlener voorafgaand aan het MRI-onderzoek. Dit zijn extra kosten, maar leiden anderzijds tot meer succesvolle MRI-onderzoeken, en minder problemen achteraf. Daardoor is dit naar idee van de werkgroep over het geheel genomen niet kostenverhogend.
Aanvaardbaarheid, haalbaarheid en implementatie
MRI mijding door CI dragers is een fenomeen bekend bij zowel CI-dragers als artsen, en kan leiden tot een late of gemiste diagnose. In het kader van gezondheidsgelijkheid zou MRI mijding zo veel mogelijk voorkomen moeten worden. Hiervoor is juiste informatie vooraf en communicatie vlak voor/tijdens het MRI-onderzoek van belang. Het in deze richtlijn voorgestelde consult, in geval een bandage moet worden aangebracht, zal mogelijk bezwaar opleveren omdat deze consulten tot hogere werkdruk leiden, en mogelijk niet haalbaar worden geacht. Hierbij moet wel in ogenschouw worden genomen dat de slagingskans van het MRI-onderzoek zal toenemen. Verder is het van belang dat de aanvragend artsen meer kennis over gehoorimplantaten hebben, zodat zij de patiënt beter kunnen voorlichten over het MRI-onderzoek en de risico's. Als laatste zouden MRI-laboranten zorg moeten dragen voor goede communicatie. Dit is lastig omdat de patiënt doof is zodra het externe deel van het implantaat wordt afgenomen. Een schrijf- of gebarentaaltolk kan hier een belangrijke bijdrage leveren. De patiënt heeft recht op deze tolk en kan deze tolk zelf regelen. Het ziekenhuis moet deze tolk toegang geven, en kan zich niet beroepen op privacyregelgeving (Algemene Verordening Gegevensbescherming, AVG).
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
In essentie is het uitvoeren van een MRI-onderzoek met passende voorzorgsmaatregelen bij een patiënt met een gehoorimplantaat niet ingewikkeld. Toch blijken er regelmatig incidenten, waaronder magneetdislocatie, plaats te vinden. Deze zijn terug te vinden in internationale databases en in wetenschappelijke publicaties. Dergelijke incidenten dragen bij aan het mijden van MRI-onderzoek door patiënten met een gehoorimplantaat. Uit de resultaten van een enquête onder zorgverleners (Dewey 2022) blijkt dat er vooral behoefte is aan heldere informatie en training omdat de diversiteit aan implantaten, geassocieerde risico's en voorzorgsmaatregelen groot is. Ook Loth (2021) noemt de noodzaak van training, en suggereert dat MRI-onderzoeken alleen in het centrum van implantatie uitgevoerd moeten worden omdat daar voldoende kennis en ervaring aanwezig is. Loth ziet aanwijzingen in de studiedata dat MRI-onderzoeken dan vaker zonder complicaties plaatsvinden. Verder blijkt communicatie tussen zorgverleners onderling, en communicatie met de patiënt van belang voor het welbevinden van de patiënt. Op basis hiervan stelt deze richtlijn het bestaan van een schriftelijke lokale procedure als voorwaarde voor het uitvoeren van een MRI-onderzoek met een gehoorimplantaat waarbij bandage benodigd is.
Onderbouwing
Achtergrond
Voor de groep patiënten met gehoorimplantaten geldt dat vaak bekend is welk implantaat geplaatst is bij de patiënt. In deze richtlijnmodule worden zowel actieve als passieve gehoorimplantaten beschouwd. Bij de actieve implantaten, met name de cochleair implantaten (CI), is het uitgangspunt dat merk en type implantaat bekend zijn, en de fabrikant beleid voor de MR compatibiliteit heeft gepubliceerd. Voor deze implantaten geldt dat, ondanks dat deze vaak MR voorwaardelijk zijn, toch regelmatig problemen optreden tijdens of na afloop van het MRI-onderzoek. In deze richtlijnmodule wordt gekeken naar het risico voor de patiënt van een MRI-onderzoek, en advies gegeven hoe op een zo veilig mogelijke wijze gescand kan worden.
In deze richtlijn worden de volgende actieve implantaten beschouwd: cochleair implantaten, beengeleidingsimplantaten, auditory brainstem implants (ABI), en actieve middenoor implantaten. Vestibulaire implantaten zijn buiten beschouwing gelaten omdat deze in Nederland niet of nauwelijks geïmplanteerd worden.
Onder passieve implantaten worden alleen gehoorbeenprotheses beschouwd. Trommelvliesbuisjes worden niet als implantaat gezien en vallen buiten deze richtlijnmodule.
Conclusies
Due to the observational nature of the studies, pooling of data could not be performed. Therefore, grading of the level of evidence using GRADE could not be applied.
Samenvatting literatuur
Description of studies
Fierens (2021) performed a systematic review on the safety of active auditory implants in MRIs. The review is an update of a review published by Azadarmaki (2014). All reports of adverse events in the Manufacturer and User Facility Device Experience (MAUDE) database of the FDA were collected until January 2020. Medline and Embase were searched from January 2009 until December 2019 for adverse events. Articles were included if they were written in English, had an evidence level of ≥Q3 (journal ranking quartiles within a subdiscipline using the SJR citation index). Articles were excluded if they reported on cadaveric or in silico experiments. The search resulted in 213 deduplicated hits, of which 52 were screened for full text eligibility and 38 studies were included in the final analysis. Outcomes of interest included but were not limited to adverse events. Furthermore, the article gives an overview of labeling of implants, type of implants, and possible physical interaction between the MRI and the implant.
Results
Adverse events
MAUDE database
Fierens (2021) reported a total of 624 adverse events between 2009 and 2019, of which 95% (n=595) were reported by manufacturers, and 5% (n=29) were reported by individuals or user facilities. Adverse events (AE) were reported for cochlear implants (CI) (n=592), bone conduction devices (n=15), middle ear implants (n=13), auditory brainstem implants (ABI) (n=2), and unknown devices (n=5). The most frequently reported adverse event was dislocation of the internal magnet (n=384), often in combination with pain (n=59). Pain surrounding the implant (n=48) without dislocation of the magnet was also reported. Demagnetization of the internal magnet (n=8) was less common. Although it is sometimes advised to remove the internal magnet before MRI, this advice was rarely followed and AE were reported in n=18 cases, and mainly related to the explantation procedure. Examples of such AE are tear in the silicone around the magnet (n=3) and physiological events like inflammation or allergic reaction to the replacement plug (n=11).
Embase and Medline
With a systematic search, Fierens (2021) found 229 articles about adverse events, including 339 patients, 529 MRIs, and 228 adverse events. Eight studies (n=52 patients, >62 MRIs) did not report any adverse events. Reported adverse events occurred with CI (n=179), middle ear implants (n=30), and auditory brainstem implants (n=4), or it was unclear which device was involved (n=15). No reported adverse events involved bone conduction devices. Pain (n=88), including discomfort and pressure, was the adverse event reported most. Of these, in n=50 cases the patient was wearing a headband and n=27 (32%) could not complete the MR exam. Dislocation of the internal magnet (n=58) was the second most reported adverse event. This includes magnet polarity reversal (n=11) and magnet rotation or canting (n=5).
Table 1. Results of systematic review Fierens (2021). Note that data from this review do not allow to relate specific AE with specific (types or models of) devices.
|
|
MAUDE database |
Embase and Medline |
Total |
|
|
N (%) |
N (%) |
N (%) |
|
Type of device |
624 |
228 |
825 (100%) |
|
592 (94.9%) |
179 (78.5%) |
771 (93.5%) |
|
15 (2.4%) |
0 (0%) |
15 (1.8%) |
|
13 (2.1%) |
30 (13.2%) |
43 (5.1%) |
|
2 (0.3%) |
4 (1.8%) |
6 (0.7%) |
|
5 (0.8%) |
15 (6.6%) |
20 (2.4%) |
|
|
|||
|
Adverse events |
624 events |
228 events in 529 MRI scans |
|
|
Dislocation of the internal magnet |
384 |
58 |
442 (86%)* |
|
Of which:
|
|
11 |
|
|
|
5 |
|
|
|
49 (83%) |
|
|
Pain (including discomfort and pressure) |
59 |
88 |
147 (22%)* |
|
Of which:
|
|
50 (56.8%) (of 54 see supp) |
|
|
|
27 (30.7%) (of 29 see supp) |
|
|
Pain surrounding the implant area |
48 |
|
48 |
|
Altered device performance |
24 |
5 |
29 (6%)* |
|
Unintended (acoustic) output |
4 |
6 |
10 (2%)* |
|
Demagnetization |
8 |
4 |
12 (2%)* |
|
Actuator dislocation |
2 |
6 |
8 (2%)* |
|
Sound perception |
|
1 |
1 (0%)* |
|
Subcutaneous movement of implant |
4 |
1 |
5 (1%)* |
|
Tissue heating |
5 |
|
5 (1%)* |
|
Image artifacts |
3 |
52 |
55 |
|
Loss of osseointegration for bone-anchored devices |
1 |
|
1 |
|
Lack of guidance |
1 |
|
1 |
|
Related to magnet explantation procedure |
18 |
|
|
|
3 |
2 |
5 |
|
11 |
|
11 |
* AE's categorized by authors of the “richtlijn” as “device malfunction”. Percentage indicates the fraction of all AE categorized as “device malfunction”.
Four observational, non-comparative studies were described despite not adhering to our comparison of our PICO. Summary of the evidence found in those studies can be found in table 2.
Table 2. Overview of observational, non-comparative studies.
|
Author, year |
Methods |
N |
MRI |
Results |
|
Van de Heyning 2021 |
Survey to retrospectively collect information relating to MRI scans that were performed on recipients of MED-EL HIs (this included CI, ABI, middle ear implants, and bone conduction devices.
17/26 hearing centers responded |
88 patients (78 unilateral, 10 bilateral),
126 scans (114 unilateral, 12 bilateral)
|
Mean time between placement and MRI: 2.4 years
1.5T: 106 scans 3T: 11 scans 0.2T: 2 scans Unknown: 8 scans
Head bandage: Yes: 72 scans No: 23 scans Unspecified: 19 scans |
Discomfort: n=2 (both bilateral, Recipient #1: SONATA on the right side, and non-MED-EL implant on the left. Recipient #2: a PULSAR on the right, and COMBI40 + on the left)
Dislocation of the floating mass transducer (active middle ear implant): n=1 (at 0.2 T; only 1.5T closed bore is approved by manufacturer)
No adverse events for 123 scans.
Artefacts (limited diagnoses): 23/77 head scans |
|
Bestourous 2022 |
Search in the MAUDE database 2010-2014 and 2015-2020 (reflecting the FDA approval of diametric magnet cochlear implants in 2015) For: ‘‘MCM’’, ‘‘Cochlear implants.’’ |
27035 reports, 584 included in this analysis. |
2010-2014 30 pre-MRI explantations
Type of CI with AE: Cochlear limited: n=84 Advanced Bionics implants n=23 MED-EL implants n=2
2015-2020 62 pre-MRI explantations
Type of CI with AE: Cochlear Limited implant n=437 Advanced Bionic implants n=122 MED-EL implants n=7 HiRes Ultra 3D implant n=1 Synchrony CI n=0
Minimum of 6 months after implantation of the device |
2010-2014 Adverse events: 109
Device malfunction (n=79, 72.5%) Displacement: n=69 Polarity switch: n=3 Performance issues: n=7
Patient injury (n=30, 27.5%) Pain: n=16 Infection: n=4 Extrusion: n=1 Lump/swelling: n=5 Skin breakdown: n=3 Vertigo: n=1 Tinnitus: n=0 Hematoma: n=0
2015-2020 Adverse events: 566
Device malfunction (n=386) Displacement: n=365 Polarity switch: n=8 Performance issues: n=13
Patient injury (n=180) Pain: n=114 Infection: n=8 Extrusion: n=7 Lump: n=24 Skin breakdown: n=19 Vertigo: n=3 Tinnitus: n=2 Hematoma: n=3 |
|
Fussell 2021 |
Retrospective review of MRI patients with CI or ABI |
79 patients (61 (77%) unilateral), several patients had multiple MRI exams. Total of 157 “at risk events”
Self-aligning magnet: n=16 Fixed magnet: n=59 Unknown: n=4
ABI: n=14 CI: n=82
|
131 MRIs (all 1.5T)
N=4 ABI magnet in situ N=16 no headwrap required
Intervention: A tight headwrap was placed around every CI or ABI with a fixed magnet. The sound processor was removed and ear plugs were inserted. Specific types of gauze were wrapped around the head (Aquaplast and Coban dressing). Optional injection with 2% lidocaine or mild oral sedative.
Mean time from implantation to MRI: 3.6 years (range, 0.04–17.1 yrs). |
No instances of device stimulation, device malfunction, or excessive heating of the receiver-stimulator package.
Magnet tilt requiring:
Pain (MRI discontinued): n=3 (2%)
No adverse events with compatible devices |
|
Tam 2020 |
Prospective study |
97 patients (21 ABI, 76 CI of whom 23 bilateral)
|
428 MRI sessions consisting of 680 MRI procedures
28/428 (6.5%) magnet removed a priori
1.5T GE Signa Excite and 1.5T GE Discovery MR450, GE Signa HDx, and GE Optima 450w scanners (GE Healthcare), SAR between 0.4 and 0.8 W/kg
Standard protocol: Removal of the external speech processor, a prescan local anaesthetic injection around the receiver stimulator coil with Lignospan 2.2 ml (2% lidocaine hydrochloride with 1:80,000 adrenaline), and application of an external pressure bandage around the patient’s head, with a plastic insert over the implant receiver-stimulator |
Complication rate: 15/428 scans (3.5%) ABI: 8/260 (3.1%) CI: 7/168 (4.2%)
14/97 patients (14.4%)
Magnet in situ: Pain (no start of MRI): n=6 (1.4%) (n=5 CI, n=1 ABI) Pain during scan: n=3 (n=3 ABI) Magnet dislocation: n=5 (n=2 CI, n=3 ABI)
No cases of patient injury, implant device failure, or demagnetization of the device magnet caused by MRI scanning.
Magnet removed: Skin breakdown n=1 (ABI) |
|
Rupp 2022 |
Single-center Retrospective Study |
128 patients with 149 implants (21 implanted bilaterally)
231 CI exposures to MRI
174 exposures (75.3%) with implants from Cochlear® CI24RE = 87 (37.7%) CI500 = 81 (35.1%) CI24M = 4 (1.7%) CI24R = 1 (0.4%) CI600 = 1 (0.4%)
49 exposures (21.2%) with implants from MED-EL® Synchrony = 36 (15.6%) Concerto = 11 (4.8%) Sonata = 2 (0.9%))
8 exposures (3.5%) with implants from Advanced Bionics® HiRes 90 K = 6 (2.6%) HiRes Ultra = 2 (0.9%)
|
196 MRIs (all 1.5T)
Application of compression bandage done with Cochlear™ Nucleus® Implant Bandage and Splint Kit or in case the additional artefact was a problem a A4 folded 5 times was used as splint.
|
Complications after MRI were reported in 50 out of 231 CI exposures (21.6%)
pain and/or swelling at the implant area n = 14 (6.1%) Vertigo n = 3 (1.3%), dysesthesia of the skin covering the implant n = 1 (0.4%), termination of MRI examination ahead of time because of pain n = 4 (1.7%) and magnet dislocation n = 27 (11.7%)
Dislocation rates for implant types with ≥ 20 MRI exposures were: 29.6% for the CI500 1.1% for the CI24RE 0% for the Synchrony
Magnets were repositioned successfully in all 27 cases of dislocation. |
|
Alberalar 2023 |
Single-center Retrospective Study |
49 patients
Of the 66 MRI examinations only for 37 the model of the CI was documented: Cochlear (31/37, about 84%) Med-EL (6/37, about 16%)
Cochlear Nucleus CI512 (19 times, 79% finished MRI examinations) Cochlear Nucleus Freedom (7x, 86%)
|
66 MRIs |
one MRI was aborted due to artifacts (1/66, 1.5%) 17 examinations were aborted with pain (17/66, 25.8%) In four of these the subcutaneous (inner) magnet had become dislocated and required revision surgery (4/66, 6.1%)
The remaining 48 examinations (72.7%) were completed successfully (36 patients), in 47/48 cases without pain and in one case with the patient tolerating the pain. |
Level of evidence of the literature
Due to the observational nature of the studies, pooling of data could not be performed. Therefore, grading of the level of evidence using GRADE could not be applied.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question: What is the chance of negative effects on patients with cochlear implants undergoing an MRI?
P: Patients with auditory implants.
I: MRI investigation.
C: No MRI investigation, adapted MRI investigation.
O: Negative effects: harmful effects on the patient because of interactions between the cochlear implants and the MRI-scanner generated magnetic fields and radiofrequency waves.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from 1-1-2000 until 7-6-2022. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 647 hits. Studies were selected based on the following criteria: reporting on hearing implants, MRI and adverse effects. 127 studies were initially selected based on title and abstract screening. Given the inclusion of a thorough systematic review published in 2021, only the 41 articles published afterwards were considered for full text screening. After reading these full texts, all 41 studies were excluded (see the table with reasons for exclusion under the tab Methods). Furthermore, we included non-comparative studies if they had a sample size of 10 or larger and reported on adverse events in patients with auditory implants undergoing MRI-scanning. Four non-comparative studies were described.
Results
One systematic review was included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables in the supplementary files of Fierens (2021). The assessment of the risk of bias is summarized in the risk of bias tables. Four additional articles were included.
Referenties
- Alberalar et al. Complications of cochlear implants with MRI scans in different body regions: type, frequency and impact. Insights into Imaging 2023; 14:9 https://doi.org/10.1186/s13244-022-01353-x
- Azadarmaki R, Tubbs R, Chen DA, Shellock FG. MRI information for commonly used otologic implants: review and update. Otolaryngol Head Neck Surg. 2014; 150:512-9. doi: 10.1177/0194599813518306.
- Bestourous DE, Davidson L, Reilly BK. A Review of Reported Adverse Events in MRI-Safe and MRI-Conditional Cochlear Implants. Otol Neurotol 2022; 43:42-47. doi: 10.1097/MAO.0000000000003339.
- Dewey RS, Bowtell R, Kitterick P. A global survey of healthcare professionals undertaking MRI of patients with cochlear implants: a heterogeneity of practice and opinions. Br J Radiol. 2022; 95:20220213. doi: 10.1259/bjr.20220213.
- Eerkens HJ, Smits C, Hofman MBM. Cochlear Implant Magnet Dislocation: Simulations and Measurements of Force and Torque at 1.5T Magnetic Resonance Imaging. Ear and Hearing 2021 42:1276-1283. DOI: 10.1097/AUD.0000000000001013.
- Fussell WL, Patel NS, Carlson ML, Neff BA, Watson RE, Lane JI, Driscoll CLW. Cochlear Implants and Magnetic Resonance Imaging: Experience With Over 100 Studies Performed With Magnets in Place. Otol Neurotol 2021; 42:51-58. doi: 10.1097/MAO.0000000000002866..
- Fritsch MH. MRI Scanners and the Stapes Prosthesis Otology & Neurotology 2007; 28:733-738.
- Gallant SC, Danehy AR, Licameli GR. Adverse events in pediatric cochlear implant patients undergoing magnetic resonance imaging. Int J Pediatr Otorhinolaryngol. 2021; 140:110547. doi: 10.1016/j.ijporl.2020.110547.
- Hassepass F, Stabenau V, Arndt S, Beck R, Bulla S, Grauvogel T, Aschendorff A. Magnet Dislocation: An Increasing and Serious Complication Following MRI in Patients with Cochlear Implants. Fortschr Röntgenstr 2014; 186:680685 DOI: 10.1055/s-0033-1356238.
- Jabehdar Maralani P, Schieda N, Hecht EM, Litt H, Hindman N, Heyn C, Davenport MS, Zaharchuk G, Hess CP, Weinreb J. MRI safety and devices: An update and expert consensus. J Magn Reson Imaging 2020; 51:657-674. doi: 10.1002/jmri.26909.
- Kim BG, Kim JW, Park JJ, Kim SH, Kim HN, Choi JY. Adverse events and discomfort during magnetic resonance imaging in cochlear implant recipients. JAMA Otolaryngol Head Neck Surg 2015; 141:45-52. doi: 10.1001/jamaoto.2014.2926.
- Loth AG, Fischer K, Hey AK, Weiß R, Leinung M, Burck I, Linke A, Kramer S, Stöver T, Helbig S. Magnetic Resonance Imaging in Patients With Hearing Implants - Follow-up on Prevalence and Complications. Otol Neurotol. 2021; 42:1334-1341. doi: 10.1097/MAO.0000000000003249.
- OPCI 2022. www.opciweb.nl/ci-centra/aantal-implantaties-in-nederland-t-m-2022
- Pross SE, Ward BK, Sharon JD, Weinreich HM, Aygun N, Francis HW. A Prospective Study of Pain From Magnetic Resonance Imaging With Cochlear Implant Magnets In Situ. Otol Neurotol. 2018; 39:e80-e86. doi: 10.1097/MAO.0000000000001661.
- Rupp R, Balk M, Sievert M, et al., Risk of magnetic resonance imaging?induced magnet dislocation for different types of cochlear implants: a single?center retrospective study. J Otolaryngology - Head & Neck Surgery 2023; 52:28. https://doi.org/10.1186/s40463-023-00633-w.
- Sharon JD, Northcutt BG, Aygun N, Francis HW. Magnetic Resonance Imaging at 1.5 Tesla with a coclear implant magnet in place: image quality and usability. Otology & Neurology 2016; 37:1284-90. Doi: 10.1097/MAO.0000000000001176.
- Shew M, Wichova H, Lin J, Ledbetter LN, Staecker H. Magnetic resonance imaging with cochlear implants and auditory brainstem implants: Are we truly practicing MRI safety? Laryngoscope 2019; 129:482-489. doi: 10.1002/lary.27516.
- Tam YC, Lee JWY, Gair J, Jackson C, Donnelly NP, Tysome JR, Axon PR, Bance ML. Performing MRI Scans on Cochlear Implant and Auditory Brainstem Implant Recipients: Review of 14.5 Years Experience. Otol Neurotol 2020; 41:e556-e562. doi: 10.1097/MAO.0000000000002569.
- Todt I, Rademacher G, Grupe G, Stratmann A, Ernst A, Mutze S, Mittmann P. Cochlear implants and 1.5 T MRI scans: the effect of diametrically bipolar magnets and screw fixation on pain. J Otolaryngol Head Neck Surg 2018; 47:11. doi: 10.1186/s40463-017-0252-9.
- Todt I, Guerkov R, Gehl HB, Sudhoff H. Comparison of Cochlear Implant Magnets and Their MRI Artifact Size. Biomed Res Int. 2020; 2020:5086291. doi: 10.1155/2020/5086291.
- Tysome JR, Tam YC, Patterson I, Graves MJ, Gzaibegovic D. Assessment of a Novel 3T MRI Compatible Cochlear Implant Magnet: Torque, Forces, Demagnetization, and Imaging. Otol Neurotol 2019; 40:e966-e974. doi: 10.1097/MAO.0000000000002407.
- van de Heyning P, Mertens G, Topsakal V, de Brito R, Wimmer W, Caversaccio MD, Dazert S, Volkenstein S, Zernotti M, Parnes LS, Staecker H, Bruce IA, Rajan G, Atlas M, Friedland P, Skarzynski PH, Sugarova S, Kuzovkov V, Hagr A, Mlynski R, Schmutzhard J, Usami SI, Lassaletta L, Gavilán J, Godey B, Raine CH, Hagen R, Sprinzl GM, Brown K, Baumgartner WD, Karltorp E. Two-phase survey on the frequency of use and safety of MRI for hearing implant recipients. Eur Arch Otorhinolaryngol. 2021; 278:4225-4233. doi: 10.1007/s00405-020-06525-3.
- Wagner F, Wimmer W, Leidolt L, Vischer M, Weder S, Wiest R, Mantokoudis G, Caversaccio MD. Significant Artifact Reduction at 1.5T and 3T MRI by the Use of a Cochlear Implant with Removable Magnet: An Experimental Human Cadaver Study. PLoS One. 2015; 10:e0132483. doi: 10.1371/journal.pone.0132483.
- Walker B, Norton S, Phillips G, Christianson E, Horn D, Ou H. Comparison of MRI in pediatric cochlear implant recipients with and without retained magnet. Int J Pediatr Otorhinolaryngol. 2018; 109:44-49. DOI: 10.1016/j.ijporl.2018.03.013
- Young NM, Rojas C, Deng J, Burrowes D, Ryan M. Magnetic Resonance Imaging of Cochlear Implant Recipients. Otol Neurotol. 2016; 37:665-71 DOI: 10.1097/MAO.0000000000001053
- Young NM, Hoff SR, Ryan M. Impact of Cochlear Implant With Diametric Magnet on Imaging Access, Safety, and Clinical Care. Laryngoscope. 2021; 131(3):E952-E956. doi: 10.1002/lary.28854
- Zeng Q, Wang Q, Zheng J, Kainz W, Chen J. Evaluation of MRI RF electromagnetic field induced heating near leads of cochlear implants. Phys Med Biol. 2018; 63:135020. doi: 10.1088/1361-6560/aacbf2.
Evidence tabellen
For the evidence table, please see the Supplementary files of Fierens (2021).
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Alahmadi A, Alenzi S, Alsheikh M, Alghamdi S, Morra ME, Badr KM. Magnet and receiver-stimulator displacement after cochlear implantation: Clinical characters and management approaches. Saudi Med J. 2021 Aug;42(8):813-824. doi: 10.15537/smj.2021.42.8.20210294. PMID: 34344804; PMCID: PMC9195558. |
better systematic reviews available |
|
Aljubeh M, Gürkov R, Sudhoff H, Todt I. Comparison of cochlear-implant magnets and their MRI-artifact size. Laryngorhinootologie 2020; 99(S 02): S252-S253 |
wrong publication (conference poster abstract) |
|
Altindal R, Scholtz LU, Gehl HB, Sudhoff H, Todt I. Choosing MRI sequences in cochlear implantees. Laryngorhinootologie 2020; 99(S 02): S253 |
wrong publication (conference poster abstract) |
|
Ay N, Gehl HB, Sudhoff H, Todt I. Effect of head position on cochlear implant MRI artifact. Eur Arch Otorhinolaryngol. 2021 Aug;278(8):2763-2767. doi: 10.1007/s00405-020-06349-1. |
wrong design (case series to evaluate effect head position on CI magnet-related artefact), wrong population (healthy volunteers with magnet fixed to head with tight head bandage) |
|
Baumgartner WD, Youssefzadeh S, Czerny C, Hamzavi J, Adunka O, Gstoettner W. Klinische Anwendung von Magnetresonanztomographie bei Cochlear-implantierten Patienten [Clinical utilization of magnetic resonance imaging for patients with cochlear implants]. Wien Klin Wochenschr. 2000 Jun 2;112(11):512-4. German. PMID: 10890131. |
wrong publication (article in german) |
|
Bestourous DE, Davidson L, Reilly BK. A Review of Reported Adverse Events in MRI-Safe and MRI-Conditional Cochlear Implants. Otol Neurotol. 2022 Jan 1;43(1):42-47. doi: 10.1097/MAO.0000000000003339. PMID: 34510115. |
wrong design (no comparison, only reporting on adverse events) |
|
Biller A, Bartsch A, Knaus C, Müller J, Solymosi L, Bendszus M. Neuroradiologische Diagnostik bei Patienten mit sensorineuralem Hörverlust vor Cochlea-Implantation [Neuroradiological imaging in patients with sensorineural hearing loss prior to cochlear implantation]. Rofo. 2007 Sep;179(9):901-13. German. doi: 10.1055/s-2007-963124. |
wrong publication (article in german) |
|
Böse M, Schmidt S. Indication and results of re-implantation of a cochlear implant Nucleus from the company Cochlear to the Synchrony from the company Medel in a patiënt. Laryngorhinootologie 2021; 100(S 02): S194-S195 |
wrong design (case study) |
|
Dewey RS, Kitterick PT. Cochlear implant user perceptions of magnetic resonance imaging. Cochlear Implants Int. 2022 Jan;23(1):11-20. doi: 10.1080/14670100.2021.1954748.. |
wrong design/ wrong outcome |
|
Doshi J, Schneiders S, Foster K, Reid A, McDermott AL. Magnetic resonance imaging and bone anchored hearing implants: pediatric considerations. Int J Pediatr Otorhinolaryngol. 2014 Feb;78(2):277-9. doi: 10.1016/j.ijporl.2013.11.023. |
wrong outcome (no information on adverse events) |
|
Dubrulle F, Vincent C, Varoquaux A, Ernst O, Veillon F. Recommandations pour la réalisation d'une IRM chez un patient porteur d'implant cochléaire [Guidelines for the performance of MRI in patients with cochlear implants]. J Radiol. 2011 Oct;92(10):872-7. French. doi: 10.1016/j.jradio.2011.05.013. |
wrong publication (article in French) |
|
Eltawil Y, Aaron KA, Santa Maria PL. When an MRI compatible cochlear implant magnet can hide important findings. Otolaryngology Case Reports, 2022, vol 23 -100404 |
wrong design (case study) |
|
Fierens G, Verhaert N, Benoudiba F, Bellin MF, Ducreux D, Papon JF, Nevoux J. Stability of the standard incus coupling of the Carina middle ear actuator after 1.5T MRI. PLoS One. 2020 Apr 9;15(4):e0231213. doi: 10.1371/journal.pone.0231213. PMID: 32271819; PMCID: PMC7144975. |
wrong population (in vitro study) |
|
Fierens G, Walraevens J, Peeters R, Verhaert N, Glorieux C. A Miniature, Fiber-Optic Vibrometer for Measuring Unintended Acoustic Output of Active Hearing Implants during Magnetic Resonance Imaging. Sensors (Basel). 2021 Oct 2;21(19):6589. doi: 10.3390/s21196589. PMID: 34640909; PMCID: PMC8512570. |
wrong design (novel test method) |
|
Friauf SM, Euteneuer S, Praetorius M. Problems of magnetic Resonance imaging in patients with Cochlea implants: A Heidelberg case study. Laryngorhinootologie 2021; 100(S 02): S198 |
wrong publication (conference poster abstract) |
|
Fussell WL, Patel NS, Carlson ML, Neff BA, Watson RE, Lane JI, Driscoll CLW. Cochlear Implants and Magnetic Resonance Imaging: Experience With Over 100 Studies Performed With Magnets in Place. Otol Neurotol. 2021 Jan;42(1):51-58. doi: 10.1097/MAO.0000000000002866. PMID: 33044338. |
wrong outcome (no specification of adverse events, correlated/associated with MRI) |
|
Gallant SC, Danehy AR, Licameli GR. Adverse events in pediatric cochlear implant patients undergoing magnetic resonance imaging. Int J Pediatr Otorhinolaryngol. 2021 Jan;140:110547. doi: 10.1016/j.ijporl.2020.110547. |
wrong design (no comparison between MRIs) |
|
Holtmann L, Hans S, Kaster F, Müller V, Lang S, Göricke S, Lang-Roth R, Arweiler-Harbeck D. Magnet dislocation following magnetic resonance imaging in cochlear implant users: Diagnostic pathways and managment. Cochlear Implants Int. 2021 Jul;22(4):195-202. doi: 10.1080/14670100.2021.1872906. |
wrong study design (diagnostic pathways) |
|
Jabehdar Maralani P, Schieda N, Hecht EM, Litt H, Hindman N, Heyn C, Davenport MS, Zaharchuk G, Hess CP, Weinreb J. MRI safety and devices: An update and expert consensus. J Magn Reson Imaging. 2020 Mar;51(3):657-674. doi: 10.1002/jmri.26909. |
wrong design (formulate expert advice based on delphi consultation) |
|
Jaimes C, Biaggotti D, Sreedher G, Chaturvedi A, Moore MM, Danehy AR. Magnetic resonance imaging in children with implants. Pediatr Radiol. 2021 May;51(5):748-759. doi: 10.1007/s00247-021-04965-5. |
wrong population (pediatric), wrong publication (narrative review/expert opinion) |
|
Jansson KJ, Håkansson B, Reinfeldt S, Taghavi H, Eeg-Olofsson M. MRI induced torque and demagnetization in retention magnets for a bone conduction implant. IEEE Trans Biomed Eng. 2014 Jun;61(6):1887-93. doi: 10.1109/TBME.2014.2309978. |
bone conduction implant |
|
Jesacher MO, Kiefer J, Zierhofer C, Fauser C. Torque measurements of the ossicular chain: implication on the MRI safety of the hearing implant Vibrant Soundbridge. Otol Neurotol. 2010 Jun;31(4):676-80. doi: 10.1097/MAO.0b013e3181d2d3f3. |
Vibrant soundbridge: ossicular chain |
|
Kaster F, Holtmann L, Lang S, Arweiler-Harbeck D. Magnet dislocation following MRI in patients with cochlaer implants- management of complications and prevention. Laryngorhinootologie 2021; 100(S 02): S202 |
wrong publication (conference poster abstract) |
|
Lauer G, Seidl R, Mittmann P, Ernst A. Postoperative artefact assessment and scalar positioning in Cochleaimplantation in 3 Tesla MRI. Laryngorhinootologie 2020; 99(S 02): S249 |
wrong publication (conference poster abstract) |
|
Leinung M, Loth A, Gröger M, Burck I, Vogl T, Stöver T, Helbig S. Cochlear implant magnet dislocation after MRI: surgical management and outcome. Eur Arch Otorhinolaryngol. 2020 May;277(5):1297-1304. doi: 10.1007/s00405-020-05826-x. |
wrong design (surgical option to magnetically reposition CI) |
|
Leinung M, Loth AG, Kroth M, Burck I, Stöver T, Helbig S. Comparison of bandaging techniques to prevent cochlear implant magnet displacement following MRI. Eur Arch Otorhinolaryngol. 2021 Nov;278(11):4209-4216. doi: 10.1007/s00405-020-06504-8. |
wrong outcome (determine best bandage technique for holding the CI magnet), wrong population (in vitro study) |
|
Loth AG, Fischer K, Hey AK, Weiß R, Leinung M, Burck I, Linke A, Kramer S, Stöver T, Helbig S. Magnetic Resonance Imaging in Patients With Hearing Implants - Follow-up on Prevalence and Complications. Otol Neurotol. 2021 Oct 1;42(9):1334-1341. doi: 10.1097/MAO.0000000000003249. |
wrong design (no comparison between MRIs) |
|
Mandalà M, Baldi TL, Neri F, Mencarelli L, Romanella S, Ulivelli M, Prattichizzo D, Santarnecchi E, Rossi S. Feasibility of TMS in patients with new generation cochlear implants. Clin Neurophysiol. 2021 Mar;132(3):723-729. doi: 10.1016/j.clinph.2020.12.013. |
wrong intervention (TMS), wrong population (mockup in vitro) |
|
Nospes S, Mann W, Keilmann A. Magnetresonanztomographie bei Patienten mit magnetversorgten Hörimplantaten: Überblick und prozedurales Management [Magnetic resonance imaging in patients with magnetic hearing implants: overview and procedural management]. Radiologe. 2013 Nov;53(11):1026-32. German. doi: 10.1007/s00117-013-2570-x. |
wrong publication (article in german) |
|
Patel SH, Halpern CH, Shepherd TM, Timpone VM. Electrical stimulation and monitoring devices of the CNS: An imaging review. J Neuroradiol. 2017 Jun;44(3):175-184. doi: 10.1016/j.neurad.2016.12.005. |
niet over MRI, allerlei implants |
|
Renninger D, Ernst A, Todt I. MRI scanning in patients implanted with a round window or stapes coupled floating mass transducer of the Vibrant Soundbridge. Acta Otolaryngol. 2016;136(3):241-4. doi: 10.3109/00016489.2015.1115552. |
vibrant soundbridge system: round window or stapes coupled floating mass transducer of the Vibrant Soundbridge |
|
Reveles Jensen KH, Navntoft CA, Sindahl CH, Cayé-Thomasen P, Jørgensen MB. Cochlear implant should not be absolute contraindication for electroconvulsive therapy and transcranial magnetic stimulation. Brain Stimul. 2020 Sep-Oct;13(5):1464-1466. doi: 10.1016/j.brs.2020.08.007. |
wrong intervention (TMS) |
|
Rupp R, Hornung J, Balk M, Traxdorf M, Sievert M, Hoppe U, Iro H, Gostian AO. Ultrasound-Controlled Manual Magnet Repositioning in Magnet Dislocation of Cochlear Implants. Otol Neurotol. 2021 Jun 1;42(5):e536-e542. doi: 10.1097/MAO.0000000000003019. PMID: 33534388. |
wrong design (ultrasound to reposition CI) |
|
Rupp R, Hornung J, Balk M, Traxdorf M, Sievert M, Hoppe U, Iro H, Gostian AO. Ultrasound-controlled manual magnet repositioning: a new therapy option of magnet dislocation in patients with cochlear implant. Laryngo-Rhino-Otologie. 2021; 100(S 02). |
wrong publication (conference poster abstract), wrong design (ultrasound to reposition CI) |
|
Rupp, R., Hornung, J., Iro, H., & Gostian, A. O. (2020). Ultrasound in diagnosis and treatment of magnet dislocation in patients with cochlear implant. Laryngo-Rhino-Otologie, 99(S 02). |
wrong publication (conference poster abstract), wrong design (ultrasound to reposition CI) |
|
Schwartz N, Rooth MA, Dillon MT, O'Connell BP, Dedmon MM, Huang BY, Brown KD. MRI surveillance following concurrent cochlear implantation in cases of vestibular schwannoma resection. Am J Otolaryngol. 2020 Jul-Aug;41(4):102518. doi: 10.1016/j.amjoto.2020.102518. |
wrong outcome (feasibility of MRI monitoring and image quality) |
|
Seo HC, Lee Y, Joo S. A simple apparatus for safety assessment of magnetically induced torque on active implantable medical devices (AIMDs) under 1.5 T and 3.0 T MRI. MAGMA. 2021 Oct;34(5):767-774. doi: 10.1007/s10334-021-00921-4. |
wrong design (develop safety assessment apparatus) |
|
Sudhoff H, Gehl HB, Scholtz LU, Todt I. MRI Observation After Intralabyrinthine and Vestibular Schwannoma Resection and Cochlear Implantation. Front Neurol. 2020 Aug 12;11:759. doi: 10.3389/fneur.2020.00759. |
wrong design (no comparison on MRIs) |
|
Sudhoff H, Scholtz LU, Gehl HB, Todt I. Quality Control after Intracochlear Intralabyrinthine Schwannoma Resection and Cochlear Implantation. Brain Sci. 2021 Sep 16;11(9):1221. doi: 10.3390/brainsci11091221. |
wrong outcome (residual tumor) |
|
Takahashi D, Ogura A, Hayashi N, Seino S, Kawai R, Matsuda T, Doi T, Tsuchihashi T. [The Safety of MR Conditional Cochlear Implant at 1.5 Tesla Magnetic Resonance Imaging System]. Nihon Hoshasen Gijutsu Gakkai Zasshi. 2016;72:674-80. Japanese. doi: 10.6009/jjrt.2016_JSRT_72.8.674. |
wrong publication (article in Japanese) |
|
Tam YC, Lee JWY, Gair J, Jackson C, Donnelly NP, Tysome JR, Axon PR, Bance ML. Performing MRI Scans on Cochlear Implant and Auditory Brainstem Implant Recipients: Review of 14.5 Years Experience. Otol Neurotol. 2020 Jun;41(5):e556-e562. doi: 10.1097/MAO.0000000000002569. |
wrong design (no information on specifics of MRI) |
|
Todt I, Guerkov R, Gehl HB, Sudhoff H. Comparison of Cochlear Implant Magnets and Their MRI Artifact Size. Biomed Res Int. 2020 Jan 10;2020:5086291. doi: 10.1155/2020/5086291. |
wrong design (case study) |
|
Todt I, Mittmann P, Ernst A, Mutze S, Rademacher G. In vivo experiences with magnetic resonance imaging scans in Vibrant Soundbridge type 503 implantees. J Laryngol Otol. 2018 May;132(5):401-403. doi: 10.1017/S0022215118000518. |
vibrant soundbridge system: middle ear implant |
|
Todt I, Rademacher G, Wagner F, Schedlbauer E, Wagner J, Basta D, Ernst A. MRI safety of the floating mass transducer. Cochlear Implants Int. 2011 May;12 Suppl 1:S133-5. doi: 10.1179/146701011X13001036693395.. |
vibrant soundbridge: floating mass transducer? |
|
Tsanidis G, Samaras T. Numerical calculation of the radiofrequency transfer function of cochlear implants for assessing deposited power in MRI. Phys Med Biol. 2020;65:175005. doi: 10.1088/1361-6560/ab9fc7. |
wrong design (optimising scan properties for CI) |
|
van de Heyning P, Mertens G, Topsakal V, de Brito R, Wimmer W, Caversaccio MD, Dazert S, Volkenstein S, Zernotti M, Parnes LS, Staecker H, Bruce IA, Rajan G, Atlas M, Friedland P, Skarzynski PH, Sugarova S, Kuzovkov V, Hagr A, Mlynski R, Schmutzhard J, Usami SI, Lassaletta L, Gavilán J, Godey B, Raine CH, Hagen R, Sprinzl GM, Brown K, Baumgartner WD, Karltorp E. Two-phase survey on the frequency of use and safety of MRI for hearing implant recipients. Eur Arch Otorhinolaryngol. 2021 Nov;278(11):4225-4233. doi: 10.1007/s00405-020-06525-3. |
wrong design (no comparison on MRIs) |
|
Wagner JH, Ernst A, Todt I. Magnet resonance imaging safety of the Vibrant Soundbridge system: a review. Otol Neurotol. 2011 Sep;32(7):1040-6. doi: 10.1097/MAO.0b013e31822a9816. |
vibrant soundbridge system |
|
Watson RE Jr, Edmonson HA. MR Safety: Active Implanted Electronic Devices. Magn Reson Imaging Clin N Am. 2020 Nov;28(4):549-558. doi: 10.1016/j.mric.2020.08.001. |
wrong publication (narrative review) |
|
Weiss R, Linke A, Loth A, Fischer K, Kramer S, Leinung M, Stöver T, Helbig S. Systematic examination of complications after MRI in patients with hearing implants. Laryngorhinootologie 2020; 99(S 02): S281 |
wrong publication (conference poster abstract) |
|
Wichova H, Peng K, Ledbetter L, Slattery W, Brackmann D, Lekovic G. Safety of 3 Tesla Magnetic Resonance Imaging in Patients With Auditory Brainstem Implants. Otol Neurotol. 2022 Feb 1;43(2):e263-e267. doi: 10.1097/MAO.0000000000003399. |
wrong design (no comparison on MRIs) |
|
Wild DC, Head K, Hall DA. Safe magnetic resonance scanning of patients with metallic middle ear implants. Clin Otolaryngol. 2006 Dec;31(6):508-10. doi: 10.1111/j.1365-2273.2006.01326.x. |
middle ear implants, geen patiënten |
|
Woodson EA, Aaron K, Nguyen-Huynh A, Vargo J, Mowry SE. Mythbusters! The Truth about Common Misconceptions in Cochlear Implantation. Semin Hear. 2021 Dec 9;42(4):352-364. doi: 10.1055/s-0041-1739368. |
wrong publication (narrative review) |
|
Young NM, Hoff SR, Ryan M. Impact of Cochlear Implant With Diametric Magnet on Imaging Access, Safety, and Clinical Care. Laryngoscope. 2021;131:E952-E956. doi: 10.1002/lary.28854.. |
wrong design (case study n=2) |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 08-04-2024
Laatst geautoriseerd : 08-04-2024
Geplande herbeoordeling : 08-04-2029
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2022 een multidisciplinaire werkgroep samengesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij het opstellen van het beleid of het uitvoeren van een MRI bij patiënten met implantaten.
Werkgroep
- Dr. M.B.M. Hofman, klinisch fysicus, Nederlandse Vereniging voor Klinische Fysica (NVKF), voorzitter
- Prof. Dr. ir. C. van Pul, klinisch fysicus, Nederlandse Vereniging voor Klinische Fysica (NVKF)
- Dr. ir. A.L.H.M.W. van Lier, klinisch fysicus, Nederlandse Vereniging voor Klinische Fysica (NVKF)
- Dr. ir. B.J. van Nierop, klinisch fysicus, Nederlandse Vereniging voor Klinische Fysica (NVKF)
- Dr. J.P.A. Kuijer, klinisch fysicus, Nederlandse Vereniging voor Klinische Fysica (NVKF)
- Dr. N. De Jong, klinisch fysicus, Nederlandse Vereniging voor Klinische Fysica (NVKF)
- Dr. R. Keesman, klinisch fysicus in opleiding, Nederlandse Vereniging voor Klinische Fysica (NVKF)
- Prof.dr.ir. J.C.M. Smits, klinisch fysicus audioloog, Nederlandse Vereniging voor Klinische Fysica (NVKF)
- Dr. ir. E.P.A. Vonken, radioloog, Nederlandse Vereniging voor Radiologie (NVvR) (tot juli 2022)
- S.J.A.M. Soomers-Wanders, MBB-C, Nederlandse Vereniging Medische Beeldvorming en Radiotherapie (NVMBR)
- Prof. Dr. M. Meine, cardioloog, Nederlandse Vereniging voor Cardiologie (NVvC)
- Dr. A.M. Wiersema, vaatchirurg, Nederlandse Vereniging voor Vaatchirurgie (NVvV)
- G.M. Burgemeestre, Hartstimulatiespecialist, Vereniging voor Invasief Technische Hartstimulatie Specialisten (VITHaS)
- H. van Rees, Onafhankelijk Platform Cochleaire Implantatie (OPCI)
Klankbordgroep
- I.G.J. Verstraaten, MSc, Harteraad
- Dr. S. Muller, klinisch fysicus, Nederlandse Vereniging van Klinische Fysica (NVKF)
- Dr. T. Ruytenberg, klinisch fysicus, Nederlandse Vereniging voor Klinische Fysica (NVKF)
Met ondersteuning van
- Dr. I. van Dusseldorp, literatuurspecialist, Kennisinstituut van Federatie Medisch Specialisten
- Dr. N. van der Zwaluw, senior adviseur, Kennisinstituut van Federatie Medisch Specialisten
- Drs. A.E. Sussenbach, junior adviseur, Kennisinstituut van Federatie Medisch Specialisten
- Dr. E. Belfroid, adviseur, Kennisinstituut van Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Dr. M.B.M. Hofman |
Klinisch fysicus, Amsterdam UMC |
Geen |
Geen |
Geen actie vereist |
|
Prof. Dr. ir. C. van Pul |
Klinisch fysicus, Maxima Medisch Centrum |
Universitair HoofdDocent TU Eindhoven |
Geen |
Geen actie vereist |
|
Dr. ir. A.L.H.M.W. van Lier |
Klinisch fysicus, UMC Utrecht |
Lid IEC commissie 'Particular requirements for the basic safety and essential performance of MRI based image guided radiotherapy equipment for use with electron accelerators'; ITEA 3 - Signet - Sensing and Image-Guided Neurological therapies, cardiac Electrophysiology and Tumour treatments |
Geen |
Geen actie vereist |
|
Dr. ir. B.J. van Nierop |
Klinisch fysicus, RNG, UMC Utrecht |
Docent Intop zorgsector |
Geen |
Geen actie vereist |
|
Dr. J.P.A. Kuijer |
Klinisch fysicus, Amsterdam UMC |
Geen |
Geen |
Geen actie vereist |
|
Dr. N. De Jong |
Klinisch fysicus, LUMC |
Geen |
Geen |
Geen actie vereist |
|
Dr. R. Keesman |
Klinisch fysicus in opleiding, Radboudumc |
Contractor bij Cablon Medical B.V. voor Design & Development services |
Geen |
Geen actie vereist |
|
Prof.dr.ir. J.C.M. Smits |
Klinisch fysicus audioloog, Hoogleraar klinische en experimentele audiologie, Amsterdam UMC |
Audiological Advisory Council van Advanced Bionics, Advisory Board or Focus Group Participation |
Geen |
Geen actie vereist |
|
Dr. ir. E.P.A. Vonken |
Radioloog |
Geen |
Geen |
Geen actie vereist |
|
S.J.A.M. Soomers-Wanders |
MBB-C, Noordwest Ziekenhuisgroep |
Geen |
Geen |
Geen actie vereist |
|
Prof. Dr. M. Meine |
Cardioloog, UMC Utrecht |
Advise CRT-3 |
Geen |
Geen actie vereist |
|
Dr. A.M. Wiersema |
Chirurg loondienst Dijklander Ziekenhuis, werkzaam U Clinic spataderzorg |
ACTION-1 trial, ZonMw, Medtronic, DLZ, AUMC |
Geen |
Geen actie vereist |
|
G.M. Burgemeestre |
Hartstimulatiespecialist, Noordwest ziekenhuis groep |
Geen |
Geen |
Geen actie vereist |
|
H. van Rees |
Gepensioneerd, actief bij OPCI |
Geen |
Geen |
Geen actie vereist |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door deelname van OPCI aan de werkgroep en deelname van Harteraad aan de klankbordgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan OPCI en Harteraad en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst kwalitatieve raming |
Toelichting |
|
Module MRI bij gehoorimplantaat |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en daarom naar verwachting geen substantiële financiële gevolgen zullen hebben voor de collectieve uitgaven.
|
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 3.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II, Brouwers 2010).
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann 2013, Hultcrantz 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello 2016a, Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas 2017, Neumann 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die rand voorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open 2017;7(11):e018593. doi: 10.1136/bmjopen-2017-018593.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 28;353:i2016. doi: 10.1136/bmj.i2016.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016, 353:i2089. doi: 10.1136/bmj.i2089.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ 2010;182(18):E839-42. doi: 10.1503/cmaj.090449.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.