Profylactische medicamenteuze behandeling delier
Uitgangsvraag
Wat is de effectiviteit van profylactische medicamenteuze behandeling in het voorkomen van een delier? Meer specifiek werd hierbij tevens gekeken naar het subsyndromaal delier, hypo- of hyperactief delier, delier bij dementie en bij het hypokinetisch rigide syndroom.
Aanbeveling
Geef in de basis geen medicatie ter preventie van een delier.
Overwegingen
Voor- en nadelen van de interventie en kwaliteit van bewijs
In de meta-analyse van Siddiqi (2016) werden in de gepoolde data geen effecten gezien van antipsychotica of cholinesteraseremmers op de incidentie van een delier. Opgemerkt moet worden dat de verschillende studies in deze meta-analyse grote verschillen vertoonden in de delier incidentie van de controlegroepen. Dat is klinisch relevant omdat een meta-analyse uit 2013 (Gilmore & Wolfe, 2013) liet zien dat het effect van antipsychotica op de delier profylaxe afhankelijk kan zijn van de delier incidentie in de controlegroep. Bij hoog-incidentie groepen (zoals in de studie van Larsen, 2010) bleken antipsychotica een aantoonbaar effect te hebben op de incidentie van een delier, terwijl dit bij groepen met een lage delier incidentie (zoals in de studie van Kalisvaart, 2005) niet het geval was (Gilmore & Wolfe, 2013). Individuele medicatie studies kunnen derhalve op basis van een hoog-risicogroep op een delier andere effecten laten zien dan studies bij laag-risicogroepen.
Ondanks het beperkte bewijs voor een profylactische behandeling van het delier wordt in Nederland in de praktijk soms besloten tot een profylactische, preventieve ‘behandeling’, bijvoorbeeld op verzoek van een patient of diens naasten. Op basis van de literatuur is zo’n preventieve aanpak vooral te overwegen bij patiënten met een hoog a priori risico op een delier (bijvoorbeeld een patient met meerdere risicofactoren voor een delier).
Behalve bij patiënten met een hypokinetisch syndroom wordt momenteel als een profylactische behandeling haloperidol het vaakst als eerste keuze overwogen, met een aangepaste, lagere dosis voor oudere patiënten. Er zijn echter ook aanwijzingen dat de medicatie dosering bij ouderen niet te laag zou moeten zijn om effect te laten zien. Daarnaast zijn er aanwijzingen in de literatuur dat in een vroeg stadium van het delier de behandeling gunstiger zou kunnen uitwerken (Fukata, 2017).
In alle geciteerde studies bleken de interventies die bestudeerd werden klinisch relatief veilig en werden er geen belangrijke veiligheidsrisico’s beschreven van de gebruikte medicatie ten opzichte van placebo. Hierbij moet opgemerkt worden dat het in verschillende studies onduidelijk is, hoe er precies naar de veiligheid is gekeken.
Bijwerkingen medicatie
Zie de module ‘Medicamenteuze behandeling delier’.
Aanvaardbaarheid, haalbaarheid en implementatie
Aangezien preventieve medicatie geen standaardbeleid is, zal deze aanbeveling tot weinig weerstand leiden.
Waarden en voorkeuren van patiënten
Patiënten zijn erbij gebaat niet onnodig medicatie voorgeschreven te krijgen. Als bij hoge uitzondering toch gekozen wordt voor medicamenteuze profylactische behandeling ter preventie van een delier dienen de voor- en nadelen duidelijk met patiënt en naasten gecommuniceerd te worden.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Op basis van de literatuur is er geen bewijs dat antipsychotica de incidentie van een delier verminderen. Wanneer er in losse studies effecten van profylactische antipsychotica worden beschreven, is dat met name in patiëntengroepen met een hoge a priorikans op een delier. Verder spelen mogelijk het in een vroeg stadium starten met profylactische medicatie en de juiste dosering van de medicatie een rol (niet te weinig, omdat dat niet voldoende werkzaam is, niet teveel vanwege meer kans op bijwerkingen).
Aanbevolen wordt per patiënt gericht te analyseren hoe groot het risico op een delier is. Hoe hoger het delier risico van de patiënt hoe meer zin een eventuele medicamenteuze interventie heeft. Bij de keuze van de medicamenteuze interventie dient te worden afgewogen in hoeverre de mogelijke voordelen opwegen tegen de mogelijke nadelen.
Evidence-based farmacotherapeutische behandelingen zijn toegespitst op specifieke symptomen die omwille van hun intensiteit, frequentie en impact klinisch relevant zijn. Wanneer er gekozen wordt voor een interventie met medicatie dient het beloop van deze interventie zorgvuldig gemonitord te worden een zogenaamde nulmeting van de doelsymptomen kan daarbij raadzaam zijn.
Het toepassen van andere relevante interventies om een delier te voorkomen (bijvoorbeeld, niet farmacologische interventies, het saneren van gebruikte medicatie, het beperken van medicatie die een delier kan luxeren of onderhouden) zijn vanzelfsprekend aan te raden.
Onderbouwing
Achtergrond
In de delier richtlijn uit 2013 werd aangegeven dat routinematige preventieve medicamenteuze behandeling werd afgeraden, maar kon worden overwogen bij patiënten met een hoog-risico, zoals patienten met meerdere risiscofactoren voor een delier, of patienten die op basis van negatieve ervaringen tijdens een doorgemaakt eerder delier het risico op een nieuw delier willen verminderen. Er is nieuwe literatuur verschenen over preventieve medicamenteuze behandeling, daarom wordt deze tekst herzien.
Conclusies
Incidentie van delier
Antipsychotica
|
Zeer laag GRADE |
Er is geen bewijs dat profylactische antipsychotica een gunstig effect hebben op het voorkómen van een delier bij volwassenen.
Bronnen: (Siddiqi, 2016; Schrijver, 2018) |
Cholinesteraseremmers
|
Zeer laag GRADE |
Er zijn enige aanwijzingen dat rivastigmine pleisters een effect hebben op het voorkómen van een delier bij volwassenen met een ‘mild cognitive impairment’ die een chirurgische ingreep ondergaan vanwege een heupfractuur, voor andere groepen volwassenen is er geen bewijs van effect.
Bronnen: (Youn, 2017; Siddiqi, 2016) |
Melatonine
|
Zeer laag GRADE |
Er is geen bewijs dat profylactische melatonine een effect heeft op het voorkómen van een delier bij volwassenen.
Bronnen: (Siddiqi, 2016) |
Duur van delier
Antipsychotica
|
Zeer laag GRADE |
Het is onduidelijk wat het effect is van profylactische antipsychotica op de duur van een delier.
Bronnen: (Siddiqi, 2016; Schrijver, 2018) |
Cholinesteraseremmers
|
Zeer laag GRADE |
Er zijn aanwijzingen dat profylactische cholinesteraseremmers geen verschil maken in de duur van het delier.
Bronnen: (Siddiqi, 2016) |
Melatonine
|
Laag GRADE |
Er zijn aanwijzingen dat profylactische melatonine geen verschil maakt in de duur van het delier.
Bronnen: (Siddiqi, 2016) |
Ernst van delier
Antipsychotica
|
Zeer laag GRADE |
Het is onduidelijk wat het effect is van profylactische antipsychotica op de ernst van een delier.
Bronnen: (Siddiqi, 2016; Schrijver, 2018) |
Cholinesteraseremmers
|
Zeer laag GRADE |
Er zijn enige aanwijzingen dat profylactische cholinesteraseremmers (rivastigminepleister) een geringe vermindering van de ernst van een delier kunnen geven bij patiënten met ‘mild cognitive impairment’ (MCI) die een chirurgische ingreep ondergaan vanwege een heupfractuur.
Bronnen: (Siddiqi, 2016; Youn, 2017) |
Melatonine
|
Laag GRADE |
Melatonine heeft waarschijnlijk geen effect op de ernst van een delier.
Bronnen: (Siddiqi, 2016) |
Samenvatting literatuur
Beschrijving studies
Er werden geen studies gevonden die gekeken hadden naar het subsyndromaal delier, hypo- of hyperactief delier, delier bij dementie en/of bij het hypokinetisch rigide syndroom. Voor de beantwoording van deze vraag werd allereerst gebruik gemaakt van de systematische review van Siddiqi (2016). Deze sloot het beste aan bij de door de werkgroep gekozen uitkomstmaten en de gekozen setting (niet IC-patiënten). Deze systematische review had als primaire uitkomstmaat de incidentie van delier en als één van de belangrijkste secundaire uitkomstmaten de duur van het delier.
De overige gevonden systematische reviews en meta-analyses includeerden ook patiënten in de ICU-setting of studies waar de medicamenteuze behandeling geen profylactisch karakter had. Deze studies werden derhalve niet meegenomen voor het beantwoorden van de vraag (zie exclusietabel).
De systematische review van Siddiqi (2016) includeerde 39 trials met in totaal 16.802 deelnemers. Veelal ondergingen de deelnemers een operatie in een orthopedische setting. Het bleek lastig om een uitspraak te doen over sommige additionele farmacologische of anesthesiologische interventies omdat er weinig studies beschikbaar waren of omdat de methodologische kwaliteit niet afdoende was.
Het aanvullende systematische literatuuronderzoek van de richtlijnwerkgroep leverde twee RCT’s op (Schrijver, 2018; Youn, 2017), verschenen na 4 december 2015 (uiterste inclusiedatum Siddiqi; zie zoekstrategie voor details).
De RCT van Schrijver (2018, N=245) onderzocht bij patiënten met een VMS score ≥ 1 wat het effect was van preventief haloperidol 1 mg tweemaal daags gedurende zeven dagen, in vergelijking met placebo in een dubbelblinde studie.
De gerandomiseerde enkel-blinde prospectieve studie van Youn (2017, N=62) onderzocht bij patiënten met een lichte cognitieve stoornis wat het effect zou zijn van een rivastigmine pleister (4,6 mg) na een chirurgische ingreep voor een heupfractuur. De interventiegroep kreeg drie dagen voor de operatie tot zeven dagen na de operatie deze pleister.
In de uitwerking van deze uitgangsvraag zal er een splitsing worden gemaakt naar type medicatie, te weten antipsychotica, cholinesteraseremmers en melatonine.
Resultaten
Optreden of uitblijven van een delier
Antipsychotica
Figuur 1 Profylactische antipsychotica versus controle bij delier - incidentie delier (Siddiqi, 2016)
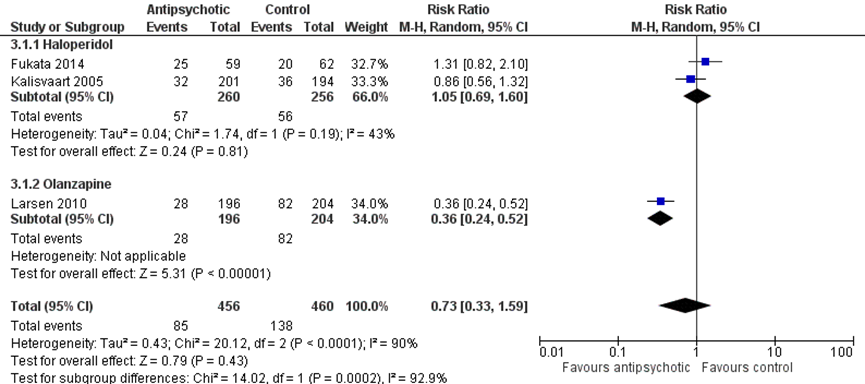
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: berouwbaarheidsinterval
Er werd in de meta-analyse van Siddiqi uit 2016 geen effect gevonden van haloperidol op de incidentie van een delier (RR 1,05, (95% BI (0,69 tot 1,60), I2=43%); 516 patiënten uit twee studies Fukata 2,5 mg haloperidol i.v.; Kalisvaart drie keer daags 0,5 mg haloperidol (figuur 1).
Deze resultaten werden bevestigd in de Nederlandse RCT van Schrijver (2018). Daar werd in de haloperidolgroep (n = 118) een delier incidentie van 19% gevonden in vergelijking met een delier incidentie van 14% in de controlegroep (n = 124). Daarbij werd een OR gezien van 1,43 (95% BI (0,72 tot 2,78), p = 0,302.
Er werd een gunstig effect gevonden van olanzapine (5 mg smelttablet) op de incidentie van een delier in vergelijking tot placebo (RR 0,36, (95% BI (0,24 tot 0,52)); 400 patiënten) (meta-analyse van Siddiqi (2016), op basis van één RCT (Larsen, 2010) (figuur 1).
In de gepoolde data van Siddiqi (2016) werd geen effect van antipsychotische behandeling (haloperidol en olanzapine) op de incidentie van delier gevonden (RR 0,73, (95% BI (0,33 tot 1,59), I2=90%); 916 patiënten, drie studies) (figuur 1).
Cholinesteraseremmers
Figuur 2 Profylactische cholinesteraseremmers versus placebo bij delier - incidentie delier (Siddiqi, 2016)
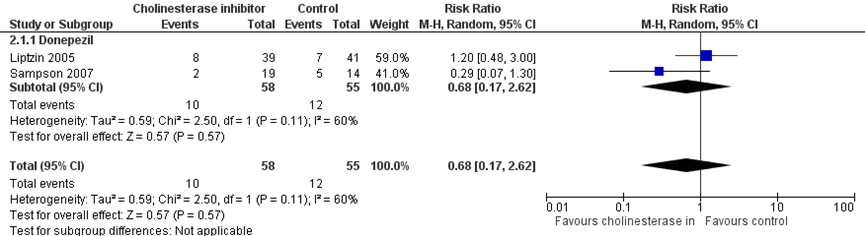
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: berouwbaarheidsinterval
Er was geen effect van donezepil op de incidentie van delier (RR 0,68, (95% BI (0,17 tot 2,62), I2=60%); 113 patiënten, twee studies) in de meta-analyse van Siddiqi (2016) (figuur 2).
De studie van Youn (2017) liet zien dat er een positief effect werd waargenomen op de incidentie van een delier bij het plakken van rivastigmine pleisters (4,6 mg), 16,1% delier in de interventie groep versus 45,2% in de controle groep (gecorrigeerde OR 0,259, (95% BI (0,075 tot 0,905)); N=62 patiënten). Er werden bij de rivastigmine groep geen perioperatieve complicaties beschreven, zoals extrapyramidale stoornissen.
Melatonine:
Figuur 3 Profylactische melatonine versus controle bij delier - incidentie delier (Siddiqi, 2016)
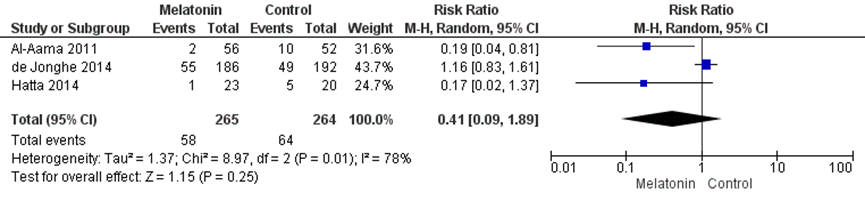
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: berouwbaarheidsinterval
Er werd geen effect gevonden van melatonine (en de melatonine-agonist ramelteon) op de incidentie van een delier (RR 0,41, (95% BI (0,09 tot 1,89), I2=79%); 529 patiënten, drie studies) (figuur 3). Opgemerkt kan worden dat de dosering van melatonine in de studies verschillend was: Al-Aama (2011): 0,5mg/dag gedurende 14 dagen, De Jonghe (2014): 3 mg/dag gedurende 5 dagen. In de studie van Hatta (2014) werd ramelteon (een melatonine-agonist) 8mg/dag gedurende 7 dagen gegeven.
Duur van delier
Antipsychotica
Fukata (2014) rapporteerde alleen een gemiddelde duur zonder standaarddeviatie en kon derhalve niet meegenomen worden in de meta-analyse.
De studie van Kalisvaart (2005) liet zien dat het delier gemiddeld korter duurde bij toediening van haloperidol vergeleken met de controle groep (-6,4 dag, (95% BI (-9.38 tot -3,42)); 68 patiënten).
In de RCT van Schrijver (2018) werd geen verschil gevonden (p=0,33) van haloperidol op de duur van het delier (4 dagen) in vergelijking met een placebo (3 dagen).
De studie van Larsen (2010) liet geen effect zien van toediening van olanzapine (0,60 dag, (95% BI (0,10 tot 1,10)); 110 patiënten) op de duur van een delier.
Cholinesteraseremmers
De duur van delier werd beschreven in één studie (Liptzin, 2005). Dit betrof één RCT die donepezil met placebo vergeleek bij patiënten met een gewricht vervangende operatie van de knie of heup. Deze studie liet geen verschil zien in de duur van een delier (0,20 dag, 95%BI -0,10 tot 0,50; 80 patiënten).
In de studie van Youn (2017) werd de duur van het delier niet beschreven.
Melatonine
De duur van een delier werd beschreven in één studie (De Jonghe, 2014). De studie van De Jonghe (2014) liet zien dat er geen verschil in de duur van een delier waargenomen kon worden (0,00 dag, (95% BI (-0,57 tot 0,57)); 104 patiënten).
Ernst van delier
Antipsychotica
Voor haloperidol (1,5 mg /24 uur) werd een groot effect gezien met een vermindering in de ernst van een delier in de interventiegroep vergeleken met de controlegroep gemiddeld verschil: 4,0, (95% BI (5 2.0 tot 5.8)); P=0,001, 68 deelnemers (Kalisvaart, 2005).
In de RCT van Schrijver (2018) werd geen effect gezien van haloperidol op de ernst van het delier (DRS score 3,5) versus (DRS score 2) placebo, p=0,54.
Olanzapine liet een toegenomen delier ernst zien voor de interventiegroep; gemiddeld verschil 1,90 (95%BI (0,41 tot 3,39)), 110 deelnemers. Gepoolde analyses lieten geen effect zien op delier ernst bij behandeling met antipsychotica; gemiddeld verschil -1,02 (95%BI (-6,80 tot 4,76)), I2=96%; 178 deelnemers.
Cholinesteraseremmers
Het effect van de cholinesteraseremmer donezepil op de ernst van een delier werd onderzocht door Marcantonio (2011) (studie uit meta-analyse van Siddiqi) en deze studie rapporteerde geen effect: gemiddelde verschil was -0,30 (95%BI (-4,17 tot 3,57)), 16 deelnemers.
In de studie van Youn (2017) werden patiënten met “mild cognitive impairment”, die een heupoperatie ondergingen gerandomiseerd tussen de interventie, een rivastigmine pleister (4,6 mg) versus geen pleister. Hier bleek het delier in de rivastigmine groep een significant lagere ernst score conform de Delirium Rating Scale (DRS, Trzepecz, 2001) te vertonen ten opzichte van de controlegroep (gemiddelde verschil -4,0 (95% BI (-7,6; -0,43)) (p=0,033) bij aanvang van het delier. Echter bij de verdere ontwikkeling van het delier verminderde de rivastigmine de ernst van het delier niet.
Melatonine
Ernst van delier werd op verschillende manieren gemeten. De Jonghe rapporteerde delier ernst als een binaire uitkomst, ernstig of niet ernstig (gedefinieerd als ≥ 3mg haloperidol toegediend tijdens de delier episode. Er was geen bewijs voor een verschil tussen melatonine en placebo groepen in het optreden van ernstig delier (RR 0,86 (95% BI (0,58 tot 1,27), 104 deelnemers).
Hatta (2014) rapporteerde de delier ernst met de DRS-R-98. Er was een reductie in delier ernst bij degenen die de melatonine agonist kregen toegediend RR -4,10 (95%BI (-19,47 tot 11,27)), 6 deelnemers.
Bewijskracht van de literatuur
Incidentie van delier
Antipsychotica
De bewijskracht voor de RCT’s start hoog. De bewijskracht voor de uitkomstmaat incidentie van delier is met drie niveaus verlaagd gezien het risico op bias (geen blindering) inconsistentie (tegenstrijdige uitkomsten) en imprecisie (hoge mate van heterogeniteit). Derhalve komt de bewijskracht voor deze uitkomstmaat uit op zeer laag.
Cholinesteraseremmers
Niet alle bestaande cholinesteraseremmers zijn vergelijkbaar onderzocht. De bewijskracht voor de uitgevoerde RCT’sstart hoog. De bewijskracht voor de uitkomstmaat incidentie van delier is met drie niveaus verlaagd gezien het risico of bias (beide studies hadden een hoog risico op attrition bias en hebben een incomplete uitkomstdata), ernstige imprecisie (geschatte effect omvatte de 1 evenals de boven en ondergrens van klinische besluitvorming) en inconsistentie (studies lieten een tegenstrijdig effect zien). Derhalve komt de bewijskracht voor deze uitkomstmaat uit op zeer laag.
Melatonine
De bewijskracht voor de RCT’s start hoog. De bewijskracht voor de uitkomstmaat incidentie van delier is met drie niveaus verlaagd gezien het risico of bias (blindering was niet adequaat, randomisatie was niet adequaat), ernstige imprecisie (zeer breed betrouwbaarheidsinterval, geschatte effect omvatte de 1 evenals de bovengrens en ondergrens van klinische besluitvorming) en inconsistentie (studies lieten een tegenstrijdig effect zien). Derhalve komt de bewijskracht voor deze uitkomstmaat uit op zeer laag.
Duur van delier
Antipsychotica
De bewijskracht voor de RCT’s start hoog. De bewijskracht voor de uitkomstmaat duur van delier is met drie niveaus verlaagd gezien de inconsistente resultaten (studies lieten een tegenovergesteld effect zien) en imprecisie (kleine studiepopulatie). Derhalve komt de bewijskracht voor deze uitkomstmaat uit op zeer laag.
Cholinesteraseremmers
Niet alle bestaande cholinesteraseremmers zijn vergelijkbaar onderzocht. De bewijskracht voor de uitgevoerde RCT’s start hoog. De bewijskracht voor de RCT’s start hoog. De bewijskracht voor de uitkomstmaat duur van delier is met twee niveaus verlaagd gezien de imprecisie (kleine studiepopulatie) en met één niveau wegens risico op bias (één open label studie en één hele kleine studie). Derhalve komt de bewijskracht voor deze uitkomstmaat uit op zeer laag.
Melatonine
De bewijskracht voor de RCTs start hoog. De bewijskracht voor de uitkomstmaat duur van delier is met twee niveaus verlaagd gezien de imprecisie (kleine studiepopulatie). Derhalve komt de bewijskracht voor deze uitkomstmaat uit op laag.
Ernst van delier
Antipsychotica
De bewijskracht voor de RCT’s start hoog. De bewijskracht voor de uitkomstmaat duur van delier is met drie niveaus verlaagd gezien de inconsistente resultaten (studies lieten een tegenovergesteld effect zien) en imprecisie (kleine studiepopulatie). Derhalve komt de bewijskracht voor deze uitkomstmaat uit op zeer laag.
Cholinesteraseremmers
Niet alle bestaande cholinesteraseremmers zijn vergelijkbaar onderzocht. De bewijskracht voor de uitgevoerde RCT’s start hoog. De bewijskracht voor de uitkomstmaat duur van delier is met twee niveaus verlaagd gezien de ernstige imprecisie (kleine studiepopulatie) en heterogeniteit (tegenstrijdige resultaten). Derhalve komt de bewijskracht voor deze uitkomstmaat uit op zeer laag.
Melatonine
De bewijskracht voor de RCT’s start hoog. De bewijskracht voor de uitkomstmaat duur van delier is met twee niveaus verlaagd gezien ernstige imprecisie (kleine studiepopulatie). Derhalve komt de bewijskracht voor deze uitkomstmaat uit op laag.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag (vragen):
P: patiënten met een verhoogd risico op delier;
I: anti-anxiety agents, antipsychotica, cholinesterase inhibitors, serotonine 5HT3 receptor antagonisten, melatonine;
C: placebo; geen, afwachtend beleid;
O: optreden of uitblijven van een delier, duur van een delier, ernst van een delier
Relevante uitkomstmaten
De werkgroep achtte optreden of uitblijven van een delier voor de besluitvorming cruciale uitkomstmaten, daarnaast zijn de duur en ernst van een delier voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a-priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Grenzen voor klinische relevantie
Bij het vaststellen van de grenzen voor klinische relevantie voor de uitkomstmaten ‘optreden of uitblijven van een delier’, duur of ernst van een delier werden de door de internationale GRADE working group voorgestelde default grenzen gehanteerd voor klinische relevantie: een verschil in relatief risico van 25% bij dichotome uitkomstmaten, en een verschil van een halve standaarddeviatie voor continue uitkomstmaten.
Zoeken en selecteren (Methode)
Voor deze uitgangsvraag werd uitgegaan van de search voor medicamenteuze behandeling omdat er in de search geen onderscheid tussen preventie en behandeling kan worden gemaakt. De preventieve interventies met het label ‘preventie’ werden geoormerkt. Daarvoor werd in de databases Medline (via OVID) en Embase (via Embase.com) op 11 maart 2019 met relevante zoektermen gezocht naar studies over de medicamenteuze behandeling van een delier. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 505 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: RCTs gericht op preventieve medicamenteuze interventies waarin de diagnose delier werd gesteld bij voorkeur door een arts of op basis van een gestandaardiseerde vragenlijst, uitgevoerd bij volwassenen (niet kinderen), studies uitgevoerd in ziekenhuis of verpleeghuis, maar niet de Intensive Care, terminaal delier en palliatieve zorg, gepubliceerd in Nederlands of Engels. Op basis van titel en abstract werden in eerste instantie 42 studies voorgeselecteerd. De geëxcludeerde studies worden aan het einde van deze module beschreven in de exclusietabel en één meta-analyse en twee nieuwe RCT’s werden uiteindelijk definitief geselecteerd.
Resultaten
Twee onderzoeken zijn opgenomen in de literatuuranalyse. Het betreft een systematische review (Siddiqi, 2016) en twee aanvullende RCT ‘s (Schrijver, 2018; Youn, 2017). In de betreffende studies is er geen onderscheid gemaakt in de verschillende subtypen van een delier daarom wordt dat onderscheid verder in dit hoofdtuk buiten beschouwing gelaten.
Voor de studiekarakteristieken en risk of bias beoordeling van de systematische review wordt verwezen naar Siddiqi (2016). De studiekarakteristieken en risk of bias van de aanvullende RCT zijn weergegeven in de risk of bias tabel, zie onderaan/ tabblad onderbouwing op de Richtlijnendatabase.
Referenties
- Gilmore ML, Wolfe DJ. Antipsychotic prophylaxis in surgical patients modestly decreases delirium incidence--but not duration--in high-incidence samples: a meta-analysis. Gen Hosp Psychiatry. 2013;35(4):370–375.
- Schrijver EJM, de Vries OJ, van de Ven PM, et al. Haloperidol versus placebo for delirium prevention in acutely hospitalised older at risk patients: a multi-centre double-blind randomised controlled clinical trial. Age Ageing. 2018;47(1):48–55.
- Siddiqi N, Harrison JK, Clegg A, Teale EA, Young J, Taylor J, Simpkins SA. Interventions for preventing delirium in hospitalised non-ICU patients. Cochrane Database Syst Rev. 2016 Mar 11;3:CD005563.
- Youn YC, Shin HW, Choi BS, Kim S, Lee JY, Ha YC. Rivastigmine patch reduces the incidence of postoperative delirium in older patients with cognitive impairment. Int J Geriatr Psychiatry. 2017 Oct;32(10):1079-1084.
Evidence tabellen
Hieronder is een evidencetabel aangegeven voor twee nieuwe RCT’s, voor de overige studies wordt verwezen naar review Siddiqi.
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Youn, 2016 |
Type of study:
Setting: hospital (non-ICU)
Country:
Source of funding: Health Technology R&D Project through the Korea Health Industry Development Institute (KHIDI), funded by the Ministry of Health & Welfare, Republic of Korea (HI14C3331) |
Inclusion criteria: GDS scores from 3 to 5 were included
Exclusion criteria: at admission, history of intolerance or allergy to rivastigmine patch, and refusal to participate. Enrolment and exclusion decisions were made by an investigator who did not otherwise participate in the study (n=50)
Intervention group: N=31
Mean age ± SD:
Sex: 39% M /61 % F
Other important characteristics: 19.4 ± 4.0
Control group: N=31
Mean age ± SD:
Sex: 45% M / 55% F
Other important characteristics:
20.8 ± 3.3
Groups comparable at baseline? Yes |
Describe intervention:
The intervention group received a rivastigmine patch (4.6 mg) from 2 or 3 days before the operation to 7 days after the operation |
Describe control:
The control group did not receive the treatment
|
Endpoint of follow-up:
For how many participants were no complete outcome data available? -
Intervention group: N (%):-
Control group: N (%):-
Reasons for incomplete outcome data described? -
Significant differences between groups? - |
Outcome measures and effect size (include 95%CI and p-value if available):
(adjusted for: ASA score, age and gender) I: 2.2 ± 5.7
p=0.033 |
Authors conclusion:
Perioperative rivastigmine patch application could reduce the occurrence of POD in older patients with low cognitive status |
|
Schrijver, 2018 |
Type of study:
Setting: admitted through the emergency department for general medicine or surgical specialties
Country:
Source of funding: None |
Inclusion criteria:
Exclusion criteria:
Intervention group: haloperidol N = 119
Mean age ± SD:
Sex: 48% M /52 % F
Control group: placebo N = 126
Mean age ± SD:
Sex: 41 % M / 59 % F
Groups comparable at baseline? Yes, only placebo group had more often had previous delirium
|
Describe intervention:
Haloperidol 1 mg twice daily: at 12 am and 20 pm |
Describe control:
Placebo 1 mg twice daily at 12 am and 20pm |
Endpoint of follow-up:
For how many participants were no complete outcome data available? 146 patients had 6 month follow-up data out of 245: 40% loss to follow-up, unclear in which group they were
Reasons for incomplete outcome data described? Yes, DOSS and DRS scores were missing despite repeated comprehensive instructions for all personnel involved. This makes delirium duration and severity mainly based on clinical observations in addition to these scores.
Significant differences between groups? - |
Outcome measures and effect size (include 95%CI and p-value if available):
I: 3.5 (1.8, 5.3) ±
P = 0.54
Duration of delirium (days)
I: 4 (SD 2.5) C: 3 (SD 1.6) |
VMS ≥ 1 only included!!
Authors conclusions: prophylactic low-dose oral haloperidol did not reduce delirium incidence in acutely hospitalised older patients. Therefore, prophylactic use of haloperidol in this population is not recommended
|
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Youn, 2017 |
Randomization into one of the two study groups was random number generation in Microsoft Excel (Microsoft, Redmond, Washington, USA). Group allocations were made by a statistician who did not otherwise participate in the study. |
Unlikely
Allocations were unknown to the investigators. |
Unclear |
Likely |
Unlikely
|
Unlikely |
Unlikely |
Unlikely |
|
Schrijver 2018 |
Treatment assignment was performed in a blind manner using fixed randomisation schemes per site with a block size of 4 (1:1) stratified according to wellknown risk factors for hospital-associated delirium (age 70–79 or ≥80 years; planned surgery on admission or not). An electronic study medication prescription label was created to facilitate and enhance protocol adherence. |
Unlikely
|
unlikely |
Unlikely
Emergency unblinding was possible by 24 h contact with an on-call pharmacist in case delirium developed or when knowledge of treatment assignment could influence patient care. Study staff, clinicians and participants were to remain blinded throughout the study. |
unlikely |
|
|
|
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear.
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Exclusietabel
|
Auteur en jaartal |
Redenen van exclusie |
|
Castro 2018 |
Review preventie |
|
Chakraborti 2015 |
Melatonine review t/m maart 2014, includeert dezelfde RCTs als Siddiqi 2016 |
|
Chen 2016 |
Melatonine review t/m april 2015, includeert dezelfde RCTs als Siddiqi 2016 |
|
Choy 2017 |
Melatonine scoping study t/m november 2017, includeert dezelfde RCTs als Siddiqi 2016 |
|
De Jonghe 2014 |
Melatonine, geïncludeerd in systematische review van Siddiqi 2016 |
|
Fok 2015 |
Antipsychotica preventie review, includeert ook ICU studies |
|
Friedman 2014 |
Syst review t/m 2014 geen kwantitatieve analyse data |
|
Gilmore 2014 |
Antipsychotica meta-analyse t/m 2012 |
|
Gosch 2014 |
Systematic review t/m september 2013 |
|
Hatta 2014 |
Ramelteon RCT |
|
Hirota 2015 |
Syst rev t/m februari 2013 |
|
Jaiswal 2018 |
RCT melatonine |
|
Ji 2013 |
Letter to the editor, dexmedetomidine |
|
Karren 2016 |
Narrative review |
|
Lee 2018 |
Dexmedetomidine RCT |
|
Liu 2016 |
Dexmedetomidine RCT |
|
Li 2017 |
Dexmedetomidine RCT |
|
Maitra 2013 |
Narrative review |
|
Marcantonio 2011 |
Donezepil RCT |
|
Mook-Spermon 2014 |
Meta analyse; geen kwantitatieve analyse |
|
Neufeld 2016 |
Syst review t/m november 2013 |
|
Papadopoulos 2014 |
Ondansetron RCT |
|
Perkisas 2015 |
Commentaar Hatta 2014 |
|
Saager 2012 |
Commentaar Hakim 2012 |
|
Schrijver 2016 |
Systematische review t/m april 2015 haldol |
|
Schrijver 2014 |
Protocol |
|
Shen 2018 |
Syst rev search t/m mei 2017 haldol profylaxe of behandeling; of tweede generatie antipsychotica, includeert ook ICU studies |
|
Steiner 2011 |
Narrative review |
|
Symczak 2014 |
Syst rev tm nov 2013, geen kwantitatieve analyse |
|
Tampi 2015 |
Syst rev t/m juni 2015, geen kwantitatieve analyse |
|
Tao 2018 |
Syst rev t/m oktober 2016, includeert ook ICU studies |
|
Teslyar 2013 |
Syst rev t/m april 2012, includeert ook ICU studies |
|
Termblay 2016 |
Syst rev t/m december 2014, geen kwantitatieve analyse |
|
Vochteloo 2011 |
Prospectieve cohort studie |
|
Walker 2017 |
Syst rev t/m juli 2016, geen kwantitatieve analyse |
|
Wang 2012 |
Haloperidol RCT, ICU setting |
|
Wu 2018 |
Syst rev t/m april 2018, includeert ook ICU setting |
|
Xuan 2018 |
Dexmedetomidine RCT, ICU setting |
|
Yang 2015 |
Dexmedetomidine RCT |
|
Yu 2017 |
Dexmedetomidine RCT |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 15-10-2024
Laatst geautoriseerd : 14-08-2020
Geplande herbeoordeling : 15-10-2029
Uiterlijk in 2025 bepaalt het bestuur van de NVKG of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVKG is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Preventieve medicatie delier |
NVKG |
2020 |
2025 |
Eens in de vijf jaar |
NVKG |
Nieuwe RCTs naar preventie-ve medicatie |
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De Patiëntenvragenlijst, die werd afgenomen bij deze richtlijn, werd medegefinancierd uit de Stichting Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma Kwaliteit, Inzicht en Doelmatigheid in de medisch specialistische Zorg (KIDZ).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met een delier.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Dr. P.L.J. Dautzenberg, klinisch geriater, JBZ, Den Bosch, NVKG (voorzitter)
- Dr. A. De Jonghe, klinisch geriater, Tergooi, NVKG
- Dr. R.J. Osse, psychiater, Erasmus MC, Rotterdam, NVvP
- Drs. M.R. Altena, internist-ouderengeneeskunde, Haaglanden Medisch Centrum, Den Haag, NIV
- Dr. P.L.M. de Kort, Neuroloog, Elisabeth-Twee Stedenziekenhuis, NVN
- Dr. A. Egberts, apotheker, Franciscus Gasthuis & Vlietland, Rotterdam & Schiedam, NVZA
- W.M. Meijer, verpleegkundig specialist geriatrie, OLVG Amsterdam, V&VN Geriatrie & Gerontologie
- J.C. Martinot MsC, verpleegkundig specialist, GC Stichting Zonboog Zuiderkroon en CHPR (Centrale Huisartsenpost Rotterdam), Rotterdam, V&VN VS-netwerk VS 1e lijn
- Drs. S. van de Kamp, specialist ouderengeneeskunde, Zinzia Zorggroep, Wageningen, Verenso
- Drs. E.G.M. Smit, internist-intensivist, Spaarne Gasthuis, NVIC
- Drs. N.A.J. Fennema, anesthesioloog-intensivist, Spaarne Gasthuis, NVIC
- Drs. K. Spijkers, Patientenfederatie Nederland (agendalid)
Samenstelling klankbordgroep
- Patiëntfederatie Nederland
- KBO-PCOB
- Mezzo
- Mind
- Alzheimer Nederland
Met ondersteuning van
- Dr. M. L. Molag, projectleider, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. D. Nieboer, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. J. Prins, adviseur, Kennisinstituut van de Federatie van Medisch Specialisten (tot juli 2019)
- Drs. M. Wessels, informatiespecialist, Kennisinstituut van de Federatie van Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Dautzenberg |
Klinisch geriater (0.8 fte) en directeur ‘brain research center’ (0.2 fte) en voorzitter deze richtlijncommissie |
Lid RvT verpleeghuis Jozefoord, Nuland, betaald |
geen |
Het Brain Research Center is een commerciële instelling die trials voor de industrie doet, Dautzenberg echter richt zich hier op de behandeling van dementie en niet op delier. Dit staat het voorzitterschap en medewerking aan de RL Delier niet in de weg |
|
De Jonghe |
Klinisch geriater |
geen |
Tergooi neemt deel aan multicenterstudie naar deltascan, een delier-monitor. |
Deltascan is een soort diagnostisch EEG voor delier, andere onderzoekers zijn daarvoor primair verantwoor-delijk, dus geen actie |
|
Osse |
psychiater |
Docent en opleider |
Lid van de Euridice trial stuurgroep en betrokken bij Deltascan |
Deltascan is een soort diagnostische EEG, andere werkgroepleden zijn daarvoor primair verantwoor-delijk, dus geen actie |
|
Altena |
Internist-ouderengeneeskunde |
geen |
Geen |
geen |
|
De Kort |
Neuroloog |
Bestuurslid stichting Postacademische Opleiding Klinische Neuropsychologie |
Geen |
geen |
|
Egberts |
Apotheker |
geen |
Geen |
geen |
|
Meijer |
Verpleegkundig specialist geriatrie |
|
Geen |
geen |
|
Martinot |
Verpleegkundig specialist |
geen |
Geen |
geen |
|
Van de Kamp |
Specialist ouderengeneeskunde |
geen |
Geen |
geen |
|
Smit |
Intensivist |
NKIC Kwaliteitsvisitatie |
IC Spaarne gaat mogelijk meedoen aan multicenter studie Deltascan |
Deltascan is een soort diagnostisch EEG voor delier, andere onderzoekers zijn daarvoor primair verantwoordelijk, dus geen actie |
|
Fennema |
Intensivist |
Docent cursus NVIC Luchtwegmanagement |
Als Principal Investigator betrokken bij MIDEX studie |
MIDEX studie heeft betrekking op de IC en dat is uitgesloten in de huidige richtlijn |
|
Spijkers |
Vertegenwoordiger Patiëntenfederatie |
geen |
geen |
geen |
Inbreng patiëntenperspectief
Om meer inzichten te krijgen in de waarden en voorkeuren van patiënten, heeft de Patiëntenfederatie het onderzoek ‘ervaringen rondom een delier’ uitgevoerd via hun patiëntenpanel. Deze vragenlijsten werd ingevuld door 91 mantelzorgers van patiënten die een delier hadden doorgemaakt in het afgelopen jaar. Daarvan had 42% van de patiënten thuis een delier doorgemaakt, bij 16% in het ziekenhuis op een niet-geriatrische afdeling, bij 13% in het verpleeghuis, bij 9% op de intensive care en bij 7% op de geriatrische afdeling van een ziekenhuis of anders (13%). Een verslag hiervan (zie aanverwante producten) is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. Aan het begin werden knelpunten uitgevraagd en aan het einde werd de conceptrichtlijn tevens voor commentaar voorgelegd aan Alzheimer Nederland, KBO-PCOB, Mantelzorg-NL, MIND en de Patiëntenfederatie Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan wordt vastgesteld in overleg met de NVKG na autorisatie van de richtlijn.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn Delier volwassenen (NVKG, 2013)) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door de wetenschappelijke verenigingen, de partijen genoemd onder het kopje inbreng patiëntenperspectief, Actiz en IGJ via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008) en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
C) Voor vragen over de waarde van meet- of classificatie-instrumenten (klinimetrie)
Deze instrumenten werden beoordeeld op validiteit, intra- (test-hertest) en inter-beoordelaarsbetrouwbaarheid, responsiviteit (alleen bij meetinstrumenten) en bruikbaarheid in de praktijk. (naar keuze: optie-1 ‘Bij ontbreken van een gouden standaard, werd een beoordeling van de bewijskracht van literatuurconclusies achterwege gelaten.’ Of optie-2 ‘De kracht van het wetenschappelijk bewijs werd bepaald met de generieke GRADE-methode’).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg
Indicatorontwikkeling
Er werden geen indicatoren ontwikkeld voor deze richtlijn, gekozen werd om aan te sluiten bij de indicatoren van IGJ en VMS. Een andere werkgroep heeft nieuwe indicatoren opgesteld binnen het project van de NVKG ‘Update IGZ indicator Delier’.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G.,.. & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Kennisinstituut van de Federatie Medisch Specialisten. Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Utrecht, 2015
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwaliteit. https://www.demedischspecialist.nl/publicaties/medisch-specialistische-richtlijnen-20-rapport
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E.,... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
