Medicamenteuze behandeling van het delier
Uitgangsvraag
Wat is de meest effectieve medicamenteuze behandeling van het delier?
Deze uitvraag omvat de volgende deelvraag:
- Wat zijn de meest effectieve medicamenteuze interventies voor het behandelen van patiënten met delier? Meer specifiek werd hierbij tevens gekeken naar het subsyndromaal delier, hypo- of hyperactief delier, delier bij dementie en bij het hypokinetisch rigide syndroom
Aanbeveling
Algemeen
Onderzoek of er onderliggende en/of onderhoudende factoren zijn van het delier en behandel deze indien mogelijk.
Zet altijd eerst in op niet-medicamenteuze interventies (zie de module ‘Niet-medicamenteuze behandeling’).
Geef geen medicatie voor het delier, tenzij:
- de patiënt een hoge lijdensdruk ervaart
- de patiënt een gevaar is voor zichzelf of anderen;
- de patiënt zijn behandeling in de weg staat;
- het delier persisterend is.
Bij keuze voor medicamenteuze behandeling
Gebruik haloperidol als eerste keuze voor medicamenteuze behandeling, behalve bij:
- patiënten met een hypokinetisch rigide syndroom;
- patiënten met Lewy body dementie.
Overweeg atypische antipsychotica, of een ander middel, of, bij dementie een cholinesteraseremmer, zoals vermeld in tabel 1, als alternatief voor haloperidol bij onvoldoende effect en/ of bijwerkingen.
Overleg laagdrempelig met een specialist over alternatieven voor haloperidol.
Delier bij hypokinetisch rigide syndroom en Lewy body dementie
Overweeg het verlagen of staken van antiparkinsonmedicatie.
Overweeg bij onvoldoende effect of onmogelijkheid van het staken of verlagen van de antiparkinson medicatie te starten met een cholinesteraseremmer, zoals rivastigmine, of een atypisch antipsychoticum, zoals quetiapine of clozapine.
Delier bij dementie
Behandel, behoudens bij Lewy body dementie, conform de richtlijn Dementie, afhankelijk van de setting van de patiënt.
Overweeg medicamenteuze behandeling met Rivastigmine.
Overwegingen
De kwaliteit van het bewijs en de voor- en nadelen van de interventie
De kwaliteit van het bewijs
Antipsychotica
Bij de vergelijking van ernst van delier na toediening van antipsychotica versus niet-antipsychotica of placebo lieten de resultaten van 494 patiënten zien dat er geen verschil was waargenomen in ernst van het delier (SMD -1,08, 95% CI -2,55 tot 0,39), I2=97%). De sensitiviteitsanalyse waarbij alleen studies werden meegenomen met een laag risico op bias lieten eenzelfde resultaat zien. Bij de vergelijking van ernst van delier tussen atypische en typische antipsychotica waren er zeven RCT’s die deze uitkomst rapporteerden. Het gepoolde resultaat van 542 patiënten liet zien dat er geen verschil was in ernst van het delier (SMD -0,17, 95% CI -0,37 tot 0,02; I2=16%)
De reden voor het oordeel ‘zeer lage bewijskracht’ is het feit dat de methodologische beperkingen van de betrokken studies zorgen voor onduidelijkheid ten aanzien van wat het effect is van typische en atypische antipsychotica behandeling ten opzichte van het toedienen van geen antipsychotica op de ernst van het delier.
Er zijn geen studies die de duur van het delier hebben onderzocht (cruciale uitkomstmaat). Ook studies met data over het effect van behandeling op de belevingen, angst en agitatie van de patiënten met een delier ontbreken. Dit is opmerkelijk omdat het uit studies aannemelijk is dat vooral de aanwezigheid van angstige gedachten en wanen het doormaken van een delier voor patiënten en hun naasten tot een (zeer) negatieve ervaring maakt, en deze verschijnselen ook bij het hypoactieve delier of ‘stille delier’ veel voorkomen.
Cholinesteraseremmers
De search heeft één systematische review opgeleverd (Yu, 2018). Deze review includeerde slechts één studie die voldeed aan de opgestelde PICO. De studie liet zien dat de duur van het delier 6,3 dagen was in de behandelgroep en 9,9 dagen was in de controlegroep. Na beoordeling van de GRADE methodiek werd de bewijskracht van de literatuur als zeer laag gegradeerd. De reden voor de zeer lage bewijskracht is dat er maar één studie (RCT) met weinig deelnemers is gevonden die voldeed aan de zoekopdracht. Daar komt bij dat het een pilot studie betreft met een klein aantal patiënten en te lage power om iets te kunnen concluderen over de uitkomsten. Tevens moet vermeld worden dat de gerapporteerde data scheef verdeeld zijn en het gerapporteerde gemiddelde geen goede representatie van de data weergeeft.
Er zijn geen studies gevonden die de ernst van het delier hebben onderzocht (cruciale uitkomstmaat).
De voor- en nadelen van interventie
Bijwerkingen medicatie
Zowel de voor- als nadelen van verschillende medicijnen die in de beschreven studies zijn gebruikt zijn beperkt beschreven. Wat betreft de mogelijke voordelen van antipsychotica is het opmerkelijk dat er nauwelijks data beschikbaar zijn over de respons van de medicatie op de psychotische kenmerken, effecten op angst, en gevoelens van naderend onheil (Wahnstimmung) van patiënten met een delier. Zaken die bij patiënten met schizofrenie doorgaans gerapporteerd worden als respons op antipsychotica. Vaak blijft de beschrijving van bijwerkingen beperkt tot het optreden van extrapiramidale symptomen en negatieve incidenten in de studie in het algemeen (zogenaamde; adverse events) (Burry, 2018). Door de beperkte beschrijvingen in de studies is het niet altijd duidelijk of de bijwerkingen relatief beperkt opgetreden zijn, of dat deze ondergerapporteerd zijn. In het algemeen kan gesteld worden dat de medicatiestudies over het delier nauwelijks ernstige incidenten melden en dat de genoemde incidenten (adverse events) daarbij zelden kunnen worden toegeschreven aan de onderzochte medicatie.
Het risico op bijwerkingen van de verschillende antipsychotica hangt samen met de affiniteiten op de verschillende receptoren (bijvoorbeeld antidopaminerge-, antiserotonerge-, antinoradrenerge-, antihistaminerge-, en anticholinerge bijwerkingen), maar ook met andere farmacologische effecten (bijvoorbeeld aantal werkzame metabolieten, enzyminductie, beïnvloeding van het cardiale geleidingssysteem).
In de onderstaande tabel staan vereenvoudigd de receptoraffiniteit genoemd van een aantal antipsychotica, met per receptor de veronderstelde werking of bijwerking.
|
|
D2 |
5-HT2a |
Alfa 1 |
H1 |
Ach(M1) |
T1/2 |
|
haloperidol |
2,6 |
61 |
17 |
260 |
>10000 |
12-38 |
|
pipamperon |
124 |
0,04 |
0,5 |
>80 |
20 |
11-35 |
|
risperidon |
3 |
0,6 |
2 |
155 |
>10000 |
3 (24) |
|
olanzapine |
11 |
4 |
19 |
7 |
1,9 |
30 |
|
clozapine |
125 |
12 |
7 |
6 |
1,9 |
6-26 |
|
quetiapine |
329 |
148 |
94 |
30 |
>10000 |
7 (12) |
|
aripiprazol ** |
0,34 |
3,4 |
57 |
61 |
>1000 |
75-146 |
|
Effect / bijwerkingen |
pos. sympt ↓ EPS ↑ prolactine↑ endocrien eff. |
neg. sympt↓ EPS↓ |
hypotensie sedatie ↑ (gewicht ↑) |
sedatie↑ gewicht↑
|
cognitie↓ urine ret. maag-darm↓ visus↓ |
|
Receptor bindingsaffiniteit (Ki in nM, naarmate het getal lager is, wordt de bindingsaffiniteit groter).
Naar van Wielink, 1989; Farah, 2005.
** partiële dopamine agonist
D2: dopamine -2-receptor antagonisme, 5-HT2a: setononine-2a-receptor antagonisme, Alfa 1: alfa-1-receptor antagonisme, H1: Histamine-1-receptor antagonisme, Ach(M1): Acetylcholine (Muscarine-1-receptor) antagonisme, T1/2: halfwaardetijd in uren, (T1/2 van relevante metabolieten).
Effect / bijwerkingen: Pos. sympt.: positieve symptomen, EPS: extrapiramidale symptomen, endocrien eff.: endocriene effecten, neg. sympt.: negatieve symptomen, cognitie: cognitieve functies, urine ret.: urine retentie, maag-darm: maag-darm motiliteit.
N.B. Er zijn effecten en bijwerkingen die niet in deze tabel zijn genoemd maar die in klinische situaties relevant kunnen zijn.
Wanneer de dosering van een medicijn toeneemt zal in het algemeen de bezetting van de meest gevoelige receptor toenemen, maar ook meer van de overige receptoren bezet worden, met meer effecten en/of bijwerkingen als resultaat. Verder treden er bij oudere patiënten eerder bijwerkingen op, vanwege de metabole veranderingen die aan het stijgen van de leeftijd gekoppeld zijn, bijvoorbeeld: verminderde leverdoorbloeding, verminderde lever-, of nierfunctie, veranderde vet-water verhouding in het lichaam, veranderingen in de neurotransmittersystemen van de hersenen, om een paar van die veranderingen te noemen (U.Klotz, Drug metabolism reviews, 2009).
De extrapiramidale bijwerkingen van antipsychotica werden alleen in de ongeblindeerde studies gezien bij behandeling met haloperidol in vergelijking tot de atypische antipsychotica (Skrobik, 2004). Echter, daarnaast is uit twee meta-analyses van RCT’s van Schneider (2005 en 2006) gebleken dat atypische antipsychotica in vergelijking met placebo gebruikt door patiënten met dementie, geassocieerd kunnen zijn met een licht toegenomen sterfte risico en andere bijwerkingen, zoals urineweginfecties en dus ook extrapiramidale symptomen of een verstoord looppatroon. Behoudens de in de tabel genoemde bijwerkingen is het relevant te melden dat alle antipsychotica een centraal pijndempend effect hebben (waardoor pijn soms niet door de patient wordt gesignaleerd), dat ze de epilepsie drempel kunnen verlagen (waarmee de patiënt gevoeliger wordt voor epileptische insulten), en in zeldzame gevallen kunnen ze tot het maligne neurolepticasyndroom leiden. Verder kunnen antipsychotica in sommige gevallen de QTc-tijd verlengen, waardoor hartritmestoornissen kunnen optreden, (waaronder; ventriculaire tachycardie en in zeldzame gevallen torsade de pointes (TdP) (Meyer-Massetti, 2010 en 2011)). Overigens zijn er ook studies die laten zien dat de QT-tijd alleen iets verlengt bij mensen met een normale QT-tijd en korter wordt bij mensen met een reeds verlengde QT-tijd (Blom, 2011; Blom, 2015; Schrijver, 2018). De richtlijn Kortdurend antipsychoticagebruik (NVKG, 2019) geeft aan dat de kans op TdP verwaarloosbaar klein is bij de in de studies gebruikte doseringen antipsychotica. Bijvoorbeeld bij orale haloperidol is dat tot 2mg/dag. Aanbevolen wordt om geen ECG ter controle van de QTc-tijd te verrichten bij het voorschrijven van een antipsychoticum wanneer doseringen worden gebruikt die het risico op TdP niet relevant verhogen. Er wordt geadviseerd om overige risicofactoren voor QTc-verlenging te inventariseren wanneer er hogere doseringen worden gebruikt of combinaties van medicijnen die de QTc-tijd kunnen verlengen. Bij voorkeur dient dit in samenspraak met de apotheker plaats te vinden.
Wat betreft het gebruik van rivastigmine was er in de RCT van Overshott (2010), een pilot studie met 15 patiënten, één patiënt met misselijkheid in de placebogroep en waren er uiteindelijk 4 patiënten in de placebogroep overleden. In een RCT over rivastigmine versus placebo bij IC patiënten werden er aanwijzingen gevonden voor een toegenomen mortaliteit in de rivastgminegroep (Van Eijk, 2011). In andere studies met rivastigmine (Cochrane meta-analyse over dementie Langendam, 2011) zijn gastrointestinale bijwerkingen, zoals misselijkheid, braken, diarree, de meest gerapporteerde bijwerkingen (> 5%), daarnaast werden hoofdpijn, duizeligheid en syncope veel gerapporteerd.
Medicamenteuze behandeling
Medicamenteuze behandeling grijpt idealiter aan op de onderliggende pathofysiologie waardoor behandeling tot herstel leidt. Voor het delier geldt echter dat het een syndromale diagnose is, we kennen de onderliggende pathofysiologie niet. Niet medicamenteuze interventies zijn vooralsnog het belangrijkst en moeten altijd worden toegepast. Hieronder valt ook het zoeken naar en behandelen van de onderliggende oorzaak, dan wel de onderhoudende factoren. Voor de medicamenteuze behandeling van het delier is niet wetenschappelijk bewezen dat een bepaald middel tot een sneller of beter herstel leidt en/of de cognitieve restverschijnselen vermindert. Derhalve richt de medicamenteuze behandeling van het delier zich in de praktijk op het verminderen van onrust, psychotische verschijnselen en angst bij de patiënt. Hierbij is het gevaar dat eventuele sedatie de hyperactieve symptomen van het delier maskeert en er onterecht vanuit wordt gegaan dat er sprake is van klinische verbetering (Neerland, 2019). Medicatie wordt dan ook niet aangeraden tenzij niet-medicamenteuze interventies onvoldoende effect opleveren én de patient een hoge lijdensdruk heeft en/of een gevaar is voor zichzelf of een ander en/of zijn behandeling in de weg staat (door bijvoorbeeld het uittrekken van infusen/lijnen (Marcantonio, 2019). Dit zal over het algemeen een ernstig en hyperactief of gemengd type delier betreffen. Het is goed om te realiseren dat de behandelstudies niet specifiek in een selectieve patiëntengroep met een ernstig delier gedaan zijn en er derhalve geen specifieke kennis is over de effectiviteit in deze groep. Verder kan medicatie gegeven worden om psychotische verschijnselen en angst te verminderen, zoals bijvoorbeeld door hallucinaties en/of wanen. Er zijn aanwijzingen dat met name de psychotische verschijnselen, die lang niet altijd door de patiënt gemeld worden, het doormaken van een delier voor de patiënt en naasten tot een stressvolle en negatieve ervaring maken (Breitbart et al. 2002). Deze psychotische symptomen lijken in gelijke mate bij hyperactieve- en hypoactieve delieren op te treden (Breitbart, 2002). Een bijkomend doel zou kunnen zijn om de kans op het ontstaan van een posttraumatische stress stoornis te verminderen. Het is dus van belang om altijd een goede inschatting te maken of de voordelen van behandelen opwegen tegen de mogelijke risico’s danwel bijwerkingen. Tevens dienen er voor de behandeling behandeldoelen en/of doelsymptomen te worden benoemd, zodat het effect van de behandeling kan worden bepaald aan de hand van het al dan niet bereiken van deze doelen danwel de afname van de doelsymptomen.
De beperkte wetenschappelijke onderbouwing in de literatuur over de behandeling van het delier heeft er toe geleid dat ook in Nederland practice-based protocollen de dagelijkse behandeling van het delier bepalen. Hierin is over het algemeen haloperidol de eerste keuze op grond van het feit dat het al heel lang op de markt is, het nauwelijks sederend of anticholinerg werkzaam is en er inmiddels veel klinische ervaring mee is. Vergeleken met jonge patiënten wordt er een aangepaste dosis voor oudere patiënten aangehouden. De toedieningsweg van haloperidol is oraal (druppels of tabletten) of intramusculair. Het kan ook intraveneus worden gegeven, bijvoorbeeld bij patiënten met een ernstig delier die een i.v. toegang hebben.
In de praktijk worden ook andere antipsychotica en middelen uit andere medicatiegroepen gegeven, voor voorbeelden, zie tabel 1. Hiervoor bestaat geen wetenschappelijk bewijs maar er is wel klinische ervaring zoals bijvoorbeeld met risperidon, olanzapine, een benzodiazepine of met rivastigmine bij patiënten met dementie. Studies noemen ook behandeling met pipamperon (Willekens-Bogaers, 1990) of trazolan (Okamoto, 1999). Benzodiazepinen hebben een plaats in de behandeling van het alcohol- en/of sedativa-onthoudingsdelier, zie daarvoor de desbetreffende richtlijn. Bijwerkingen zijn onder andere sedatie, ademdepressie, vallen en cognitieve stoornissen.
Het hypoactieve delier
Er is een gebrek aan onderzoeksgegevens die betrouwbare informatie geven over de effectiviteit van antipsychotische behandeling van hypoactieve delieren. De werkgroep constateert dat er onder clinici verschil van mening is over de behandelbaarheid. Mogelijk hangt dit samen met verschillen in patiëntenpopulatie. Derhalve is de keuze om wel of niet medicamenteus te behandelen naar inzicht van de behandelaar, maar wordt het zeker ter overweging gegeven wanneer er aanwijzingen zijn voor angst of psychose.
Het zeer ernstige hyperactieve delier
In geval van een zeer ernstig delier, waarbij ophogen van medicatie onvoldoende of geen effect heeft gehad, met dreigend gevaar voor de patiënt dan wel de behandelaar, dient overwogen te worden om de patiënt tevens te sederen. Bij dit complexe delier wordt geadviseerd om contact op te nemen met een collega specialist, deskundig voor de behandeling van een delier. Hierbij is soms overleg nodig met de intensivist, bijvoorbeeld bij achteruitgang door onderliggend somatisch lijden, dreigende uitputting, hyperthermie, etc.
Staken van medicatie voor een delier
Naar het staken van een medicamenteuze behandeling, opgestart ter coupering van de psychiatrische symptomen van het delier, is geen onderzoek gedaan. De commissie adviseert om te starten met de afbouw van de medicamenteuze behandeling voor een delier als de psychiatrische symptomen afnemen in ernst, bijvoorbeeld doordat de patiënt minder onrustig is, beter slaapt of beter georiënteerd is, of wanneer er bijwerkingen van de medicatie bestaan (zoals extrapiramidale symptomen). Als vuistregel kan gesteld worden dat, wanneer er sprake is van verbetering, de totale dagdosering na 2 dagen gehalveerd kan worden, met het handhaven van minimaal een avond inname moment. De halvering gaat iedere 2 dagen door tot een (equivalent) van 1 mg haloperidol, waarna deze laatste dosering na weer 2 dagen in zijn geheel gestaakt kan worden.
Subgroepen
Het onderzoek dat gedaan is, geldt slechts voor een deel van de doelgroep waarvoor de medicatie gebruikt wordt in de dagelijkse praktijk. Zo worden in de genoemde RCT’s vaak geen patiënten met multimorbiditeit, polyfarmacie en/of neurocognitieve stoornissen geïncludeerd terwijl dit in de klinische praktijk de grootste groep patiënten met een delier is en antipsychotica in deze kwetsbare groep meer bijwerkingen hebben (de Jonghe, 2014). De search die is verricht voor deze module heeft zich ook gericht op de drie verschillende motorische subtypes van het delier, het subsyndromaal delier en op specifieke patiëntengroepen, namelijk op patiënten met dementie en met hypokinetisch rigide syndroom. Burry (2018) geeft aan dat de geplande subgroepanalyse bij de oudste leeftijdsgroep en bij patiënten met dementie niet verricht kon worden wegens gebrek aan data. Ook Yu (2018) geeft aan dat er geen subgroepanalyse is verricht wegens deze reden. Op grond van de gevonden literatuur uit onze search is er dus voor deze specifieke situaties geen wetenschappelijk onderbouwd advies te geven.
De behandeling van een delier bij patiënten met een hypokinetisch rigide syndroom
Psychotische symptomen komen frequent voor bij patiënten met hypokinetisch rigide syndroom (Schrag, 2004). Het onderscheid tussen psychotische symptomen en een delier kan gemaakt worden op grond van de aanwezigheid van een helder bewustzijn en behoud van inzicht bij hypokinetisch rigide syndroom (Zahodne, 2008). Volgens deze werkgroep is voor de medicamenteuze behandeling het onderscheid tussen een delier of psychotische symptomen bij patiënten met een hypokinetisch rigide syndroom minder relevant en kan niet uitgesloten worden dat in onderzoeken naar het effect van medicatie beide beelden naast elkaar hebben bestaan. Het zelfde geldt waarschijnlijk eveneens voor het optreden van een delier en Lewy body dementie. Op grond van expert opinion wordt aangeraden de antiparkinson medicatie te verlagen of te staken (anticholinergisch). Het middel met het grootste delirogene effect wordt dan als eerste gestaakt (Vardy, 2015). In de klinische praktijk wordt meestal de navolgende volgorde van het afbouwen van medicatie aangehouden: anticholinergica, MAO-B remmers, dopamine agonisten, COMT-remmers, levodopa, zie richtlijn Parkinson.
Verder is er geen of zeer beperkt onderzoek gedaan met andere medicatie zoals quetiapine, clozapine en rivastigmine. Deze worden op grond van expert opinion wel toegepast. Quetiapine (dosering 12.5mg tot 150mg /dag) of clozapine (dosering 6.25mg tot 100mg) zijn een optie om te geven, waarbij de laagste effectieve dosis moet worden nagestreefd. Bijwerkingen betreffen vooral sedatie, orthostatische hypotensie en speekselvloed (Seppi, 2011; Frieling, 2007). Bij clozapine dient er protocollair gecontroleerd te worden voor agranulocytose. Haloperidol is bij patiënten met een hypokinetisch rigide syndroom gecontraindiceerd.
De behandeling van een delier bij patiënten met dementie.
Er zijn geen RCT’s naar het effect van medicamenteuze behandeling bij patiënten met dementie. In RCT’s wordt veelal aangegeven dat er geen subanalyse kon worden gedaan wegens te kleine patiëntenaantallen of omdat patiënten met dementie waren uitgesloten van deelname. De werkgroep adviseert deze patiëntenpopulatie volgens de algemene adviezen te behandelen, behalve voor patiënten met Lewy body dementie, zie de alinea hierboven. Op grond van expert opinion zou ook een cholinesteraseremmer gegeven kunnen worden.
Waarden en voorkeuren van patiënten (en eventuele hun mantelzorgers)
Er is een klein aantal onderzoeken naar de ervaringen van patiënten met een delier en hun naasten (onder andere Breitbart, 2002; Martins, 2017; O’Malley, 2008; Bélanger, 2011; Partridge, 2012). Al deze studies laten zien dat het doormaken of meemaken van een delier voor patiënten en hun naasten een negatieve ervaring is. Studies naar de Nederlandse situatie zijn niet gepubliceerd. Daarom heeft de Patiëntenfederatie het onderzoek ‘ervaringen rondom een delier’ uitgevoerd via hun patiëntenpanel. Deze vragenlijsten werd ingevuld door 91 mantelzorgers van patiënten die een delier hadden doorgemaakt in het afgelopen jaar. Hier volgt de belangrijkste informatie op het gebied van de behandeling van het delier. De zorg die volgens de deelnemers het meest is gegeven aan patiënten met een delier bestond uit medicatie voor de behandeling van het onderliggend lijden zoals antibiotica, pijnstillers of laxeermiddelen (namelijk bij 40% van de gevallen). Daaropvolgend het krijgen van andere medicijnen (27%), het stoppen met bepaalde medicijnen (22%) en het advies om rust te nemen (19%), om in vertrouwde omgeving te blijven (19%), om dag- en nachtritme aan te houden (18%) en om goed te eten en te drinken (13%). 31% van de deelnemers noemt ander zorg/advies dan in de vragenlijst is genoemd om het delier te behandelen, zoals de patiënt omringen met bekende gezichten. Eventueel door het meebrengen van foto’s wanneer de patiënt niet thuis is. Ook wordt vaak gemeld dat er “geen advies” is gegeven. Voor de behandeling van een delier heeft de Patiëntenfederatie daarom de volgende adviezen opgesteld:
- Betrek de naaste(n) en bespreek vooral met hen de behandeling(opties) en eventuele wijzigingen.
- Aandacht, geduld, het bieden van herkenningspunten en structuur worden als zeer behulpzaam gezien, in een ervaring werd expliciet genoemd dat dit voorrang heeft op het starten met (zware) medicatie.
- Breng een patiënt in een veilige omgeving (in een ervaring werd bijvoorbeeld waakzaamheid bij een infuus genoemd).
- Probeer de behandeling van de patiënt door zoveel mogelijk dezelfde zorgprofessionals uit te laten voeren.
- Bespreek de mogelijkheid van psychosociale zorg met zowel de patiënt als de naaste(n).
Onderbouwing
Achtergrond
In de richtlijn uit 2013 wordt medicatie aanbevolen indien niet-medicamenteuze interventies niet werkzaam zijn. Er is nieuwe literatuur verschenen over de medicamenteuze behandeling, daarom wordt deze tekst herzien.
Een overzicht van de gebruikte middelen naar type medicatie wordt weergegeven in tabel 1.
Tabel 1 Voorbeelden (zonder volledigheid na te streven) van gebruikte middelen voor de behandeling van delier naar type medicatie
|
Groepsnaam |
Generieke naam |
|
Klassieke antipsychotica |
Haloperidol |
|
|
Pipamperon |
|
Atypische antipsychotica |
Risperidon |
|
|
Olanzapine |
|
|
Quetiapine |
|
|
Aripiprazol |
|
|
Clozapine |
|
Benzodiazepines |
Lorazepam |
|
|
Oxazepam |
|
|
Midazolam |
|
Cholinesteraseremmers (bij dementie) |
Rivastigmine |
|
5-HT3-receptorantagonisten |
Ondansetron |
|
5-HT2-receptorantagonisten |
Trazodon |
Conclusies
Duur van delier
Antipsychotica
|
- GRADE |
Over de duur van het delier werd niet gerapporteerd in de geïncludeerde studies.
Bronnen: (Burry, 2018) |
Cholinesteraseremmers
|
Zeer laag GRADE |
Er is onvoldoende bewijs dat rivastigmine als behandeling van delier leidt tot een kortere duur van het delier, vergeleken met geen cholinesteraseremmer.
Bronnen: (Yu, 2018) |
Ernst van delier
Antipsychotica
|
Zeer laag GRADE |
Er is onvoldoende bewijs dat een behandeling met typische of atypische antipsychotica leidt tot een minder ernstig delier vergeleken met geen antipsychotica.
Bronnen: (Burry, 2018) |
Cholinesteraseremmers
|
- GRADE |
Er werd niet gerapporteerd over het effect van cholinesteraseremmers op de ernst van delier.
Bronnen: (Yu, 2018) |
Lengte van verblijf
Antipsychotica en cholinesteraseremmers
|
- GRADE |
Over de lengte van het verblijf werd niet gerapporteerd in de geïncludeerde studies.
Bronnen: (Burry, 2018; Yu, 2018) |
Institutionalisering
Antipsychotica en cholinesteraseremmers
|
- GRADE |
Over institutionalisering werd niet gerapporteerd in de geïncludeerde studies.
Bronnen: (Burry, 2018; Yu, 2018) |
Beleving
Antipsychotica en cholinesteraseremmers
|
- GRADE |
Over de beleving van het delier werd niet gerapporteerd in de geïncludeerde studies.
Bronnen: (Burry, 2018; Yu, 2018) |
Opheffen/voorkomen van agitatie
Antipsychotica en cholinesteraseremmers
|
- GRADE |
Over het opheffen/voorkomen van agitatie werd niet gerapporteerd in de geïncludeerde studies.
Bronnen: (Burry, 2018; Yu, 2018) |
Vrijheidsbeperkende maatregen
Antipsychotica en cholinesteraseremmers
|
- GRADE |
Over het gebruik van vrijheidsbeperkende maatregelen werd niet gerapporteerd in de geïncludeerde studies.
Bronnen: (Burry, 2018; Yu, 2018) |
Samenvatting literatuur
Beschrijving studies
Voor de beantwoording van deze vraag werden drie geschikte reviews gevonden. Dit betrof één Cochrane review over antipsychotica (Burry, 2018), één Cochrane review over acetylcholinesteraseremmers (Yu, 2018) en één netwerk meta-analyse (Wu, 2018). De systematische review van Burry (2018) richtte zich op klassieke en atypische antipsychotica en excludeerde studies uitgevoerd op de IC, conform de richtlijn, dit in tegenstelling tot Wu (2018). Wu werd geëxcludeerd aangezien deze netwerk meta-analyse ook studies uitgevoerd op de IC includeerde. Daarnaast sloten de systematisch reviews van Burry ( 2018) en Yu (2018) het beste aan bij de door de richtlijnwerkgroep gekozen uitkomstmaten. Er werden geen studies gevonden die gekeken hadden naar het subsyndromaal delier, hypo- of hyperactief delier, delier bij dementie en/of bij het hypokinetisch rigide syndroom.
De Cochrane review van Burry (2018) waarin de behandeling met antipsychotica centraal stond werd als uitgangspunt genomen voor het beantwoorden van de uitgangsvraag. De primaire uitkomstmaat was totale duur van delier. Secundaire uitkomstmaten waren ernst van delier, resolutie van delier, mortaliteit, lengte van verblijf in ziekenhuis, verblijf na ziekenhuisontslag, kwaliteit van leven en bijwerkingen. De definitie van de uitkomstmaten is beschreven in Burry (2018).
De Cochrane review van Yu (2018) includeerde slechts één pilot studie met 15 patiënten (Overschott, 2010). In deze review stond de behandeling met cholinesteraseremmers centraal, deze had als primaire uitkomstmaten de duur van het delier, ernst van het delier en bijwerkingen. De secundaire uitkomsten waren het gebruik van levensreddende medicatie, blijvende cognitieve achteruitgang, duur van verblijf in het ziekenhuis, institutionalisering, mortaliteit en de kosten van de interventie.
Het systematische literatuuronderzoek van de richtlijnwerkgroep had geen RCT’s opgeleverd, verschenen na juli 2018 (uiterste inclusiedatum Burry; zie zoekstrategie voor details).
In de uitwerking van deze uitgangsvraag zal er een splitsing worden gemaakt naar type medicatie, te weten antipsychotica en cholinesteraseremmers.
Antipsychotica
Burry (2018) verrichte systematisch onderzoek naar de effectiviteit van antipsychotica bij delier bij volwassen niet IC-patiënten. De antipsychotica kunnen onderverdeeld worden in (klassieke) typische antipsychotica en atypische antipsychotica, zie tabel 1.
Er werd systematisch gezocht in MEDLINE, Embase, Cochrane EBM reviews, CINAHL, Thomson Reuters Web of Science, DARE, Health Technology Assessment Database, Web of Science ISI Proceedings en andere grijze literatuur tot juli 2018. RCTs en quasi-RCTs die 1) de toediening van antipsychotica vergelijkt met niet antipsychotica of met placebo en 2) typische en atypische antipsychotica vergelijkt in de behandeling van delier bij niet-kritieke volwassen ziekenhuispatiënten.
De systematische review van Burry (2018) includeerde 9 trials met in totaal 727 patiënten (Agar, 2016; Breitbart, 1996; Grover, 2011; Grover, 2016; Han, 2004; Hu, 2004; Lin, 2008; Maneeton, 2013; Tahir, 2010). Alleen de ernst van delier kon als uitkomstmaat bepaald worden. De geplande subgroep analyse van Burry (2018) om verschillen in effect in ouderen en in patiënten met neurocognitieve stoornissen te onderzoeken kon niet worden uitgevoerd wegens een tekort aan data. Veel studies excluderen oudere patiënten en/of patiënten met neurocognitieve stoornissen.
Cholinesteraseremmers
De systematische review van Yu (2018) includeerde één pilotstudie (met een klein aantal patiënten, n=15) (Overshott, 2010) waarbij er gekeken werd naar cholinesterase-inhibitoren voor de behandeling van delier bij niet ICU-patiënten. In deze gerandomiseerde placebo gecontroleerde studie werd rivastigmine (n=8, in een dosering van 2 dd 1,5 mg maximaal) met placebo (n=7) vergeleken bij patiënten ouder dan 65 jaar, 7 van de 15 hadden dementie. Alleen de duur van het delier kon als uitkomstmaat worden bepaald.
Resultaten
Duur van delier (tijdsduur tot herstel van een delier)
Antipsychotica:
De duur van het delier werd niet gerapporteerd in de geïncludeerde studies (Burry, 2018).
Cholinesteraseremmers
De duur van het delier was in de behandelgroep 6,3 dagen en in de controlegroep 9,9 dagen, (p: 0,50 (95% BI (-15,6; 8,4)).
Ernst van het delier
Antipyschotica
De ernst van het delier werd gerapporteerd in vier studies waarin gekeken werd naar antipsychotica versus niet antipsychotica of placebo (Agar, 2016; Breitbart, 1996; Hu, 2004; Tahir, 2010). De ernst van het delier werd gescoord met de Delirium Rating Scale (DRS, Trzepacz, 1999; revisie DRS-R-98 Trzepacz, 2001) (Breitbat, 1996; Hu, 2004), DRS-R-98 (Tahir, 2010) en de Memorial Delirium Assessment Scale (MDAS, Breitbart, 1997) (Agar, 2016).
Het gepoolde resultaat van 494 patiënten laat zien dat er geen verschil is in ernst van het delier (standardised mean difference (SMD) -1,08, 95% CI -2,55 tot 0,39), I2=97%) na toediening van antipsychotica versus niet antipsychotica of placebo. Een sensitiviteitsanalyse waarbij alleen studies werden meegenomen met een laag risico op bias (Agar, 2016; Tahir, 2010) lieten eenzelfde resultaat zien (SMD 0,03, 95% CI -0,22 tot 0,27; 289 patiënten; I2= 0%, zie figuur 1).
Figuur 1 Antipsychotica versus geen antipsychotica bij behandeling van delier - ernst van delier (Burry, 2018)
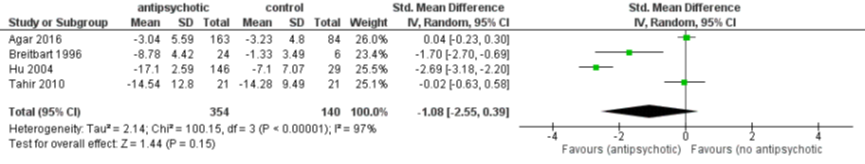
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: berouwbaarheidsinterval
Bij de vergelijking van ernst van delier tussen atypische en typische antipsychotica waren er zeven studies die een uitkomst rapporteerden (Agar, 2016; Grover, 2011; Grover, 2016; Han, 2004; Hu, 2004; Lin, 2008; Maneeton, 2013). De ernst van het delier werd gescoord aan de hand van de DRS (Han, 2004; Hu, 2004; Lin, 2008), DRS-R-98 (Grover, 2011; Grover, 2016; Maneeton 2013) en MDAS (Agar, 2016).
Het gepoolde resultaat van 542 patiënten laat zien dat er geen verschil is in ernst van het delier (SMD -0,17, 95% CI -0,37 tot 0,02; I2=16%, zie figuur 2)
Figuur 2 Atypische versus typische antipsychotica bij behandeling van delier - ernst van delier (Burry, 2018)
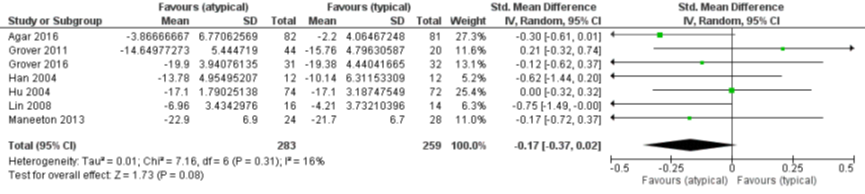
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: berouwbaarheidsinterval
Beleving (delirium experience meeting)
Antipsychotica
Beleving werd niet gerapporteerd in de geïncludeerde studie (Burry, 2018).
Cholinesteraseremmers
Beleving werd niet gerapporteerd in de geïncludeerde studie (Yu, 2018).
Opheffen/voorkomen van agitatie
Antipsychotica
Opheffen/voorkomen van agitatie werd niet gerapporteerd in de geïncludeerde studie (Burry, 2018).
Cholinesteraseremmers
Opheffen/voorkomen van agitatie werd niet gerapporteerd in de geïncludeerde studie (Yu, 2018).
Gebruik van vrijheidsbeperkende maatregelen
Antipsychotica
Gebruik van vrijheidsbeperkende maatregelen werd niet gerapporteerd in de geïncludeerde studie (Burry, 2018).
Cholinesteraseremmers
Gebruik van vrijheidsbeperkende maatregelen werd niet gerapporteerd in de geïncludeerde studie (Yu, 2018).
Lengte van verblijf in het ziekenhuis
Antipsychotica
Lengte van verblijf in het ziekenhuis werd niet gerapporteerd in de geïncludeerde studie (Burry, 2018).
Cholinesteraseremmers
Lengte van verblijf in het ziekenhuis werd niet gerapporteerd in de geïncludeerde studie (Yu, 2018).
Institutionalisering
Antipsychotica
Institutionalisering werd niet gerapporteerd in de geïncludeerde studie (Burry, 2018).
Cholinesteraseremmers
Institutionalisering werd niet gerapporteerd in de geïncludeerde studie (Yu, 2018).
Bewijskracht van de literatuur
Antipsychotica
Ernst van delier
De bewijskracht voor de RCTs start hoog. De bewijskracht voor de uitkomstmaat ernst van delier is met 3 niveaus verlaagd gezien het risico op bias (hoge mate van uitval en onduidelijk risico op selectiebias), inconsistentie (brede betrouwbaarheidsintervallen en hoge mate van heterogeniteit) en imprecisie (lage aantallen). Derhalve komt de bewijskracht voor deze uitkomstmaat uit op zeer laag.
Duur, lengte van verblijf in ziekenhuis, institutionalisering, beleving opheffen/voorkomen van agitatie en gebruik van vrijheidsbeperkende maatregelen
Voor de uitkomsten duur van delier, lengte van verblijf in het ziekenhuis, institutionalisering, beleving, opheffen/voorkomen van agitatie en gebruik van vrijheidsbeperkende maatregelen kon er geen bewijskracht voor de uitkomstmaat bepaald worden, omdat er geen studies met deze uitkomstmaat werden geïncludeerd.
Cholinesteraseremmers:
Duur van delier
De bewijskracht voor de RCT’s start hoog. De bewijskracht voor de uitkomstmaat duur van delier is met 2 niveaus verlaagd gezien de kleine steekproefomvang (imprecisie). Bovendien is de body of evidence erg klein met maar één studie en daarvoor werd de bewijskracht ook verlaagd. Derhalve komt de bewijskracht voor deze uitkomstmaat uit op zeer laag.
Ernst van delier, lengte van verblijf in ziekenhuis, institutionalisering, beleving,opheffen/voorkomen van agitatie en gebruik van vrijheidsbeperkende maatregelen
Voor de uitkomsten ernst van delier, lengte van verblijf in het ziekenhuis, institutionalisering, beleving, opheffen/voorkomen van agitatie en gebruik van vrijheidsbeperkende maatregelen kon er geen bewijskracht voor de uitkomstmaat bepaald worden, omdat er geen studies met deze uitkomstmaat werden geïncludeerd.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag (vragen):
Wat is de effectiviteit van een medicamenteuze interventie in de behandeling van patiënten met een delier?
P: patiënten met een vastgesteld delier; patiënten met een subsyndromaal delier; patiënten met dementie en een delier; patiënten met hypokinetisch rigide syndromen en een delier;
I: antidepressive agents, antipsychotic agents, cholinesteraseremmers, melatonin, 5-HT3-blockers, benzodiazepines;
C: medicatie versus medicatie of medicatie versus placebo;
O: duur van een delier (tijdsduur tot herstel van een delier); Ernst van delier; Lengte van verblijf in het ziekenhuis (LOS); Institutionalisering; Beleving (delirium experience meeting; Opheffen/voorkomen van agitatie; Vrijheidsbeperkende maatregelen.
Relevante uitkomstmaten
De werkgroep achtte duur van een delier en ernst van delier voor de besluitvorming cruciale uitkomstmaten; en beleving, opheffen/voorkomen van agitatie en gebruik van vrijheidsbeperkende maatregelingen voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Hierbij werden de door de internationale GRADE working group voorgestelde default grenzen voor klinische relevantie gehanteerd: een verschil in relatief risico van 25% bij dichotome uitkomstmaten, en een verschil van een halve standaarddeviatie voor continue uitkomstmaten.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is 11 maart 2019 met relevante zoektermen gezocht naar studies over de medicamenteuze behandeling van een delier. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 505 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: RCT’s waarin de diagnose delier werd gesteld met DSM of de CAM, uitgevoerd bij volwassenen, studies uitgevoerd in het ziekenhuis of verpleeghuis en gepubliceerd in het Nederlands of Engels. Geëxcludeerd werden studies die werden uitgevoerd op de Intensive Care, bij patiënten met een terminaal delier of in de palliatieve zorg, en studies die bij kinderen werden gedaan. Op basis van titel en abstract werden in eerste instantie 24 studies voorgeselecteerd, na het lezen van de volledige tekst werden er 21 geëxcludeerd, zie exclusietabel. Voor de beantwoording van deze vraag werd uitgegaan van drie geschikte reviews en meta-analyses.
Resultaten
Drie systematische reviews zijn opgenomen in de literatuuranalyse. Voor de studiekarakteristieken en risk of bias beoordeling wordt verwezen naar de systematische review van Burry (2018) en de systematische review van Yu (2018).
Referenties
- Bélanger L, Ducharme F. Patients' and nurses' experiences of delirium: a review of qualitative studies. Nurs Crit Care. 2011 Nov-Dec;16(6):303-15.
- Blom MT, Bardai A, van Munster BC, Nieuwland MI, de Jong H, van Hoeijen DA, Spanjaart AM, de Boer A, de Rooij SE, Tan HL. Differential changes in QTc duration during in-hospital haloperidol use. PLoS One. 2011;6(9):e23728. doi: 10.1371/journal.pone.0023728. Epub 2011 Sep 22. Erratum in: PLoS One. 2012;7(7): doi/10.1371/annotation/92655d2b-fac1-4641-970c-a8e4fb5739fc. PubMed PMID: 21961030; PubMed Central PMCID: PMC3178516.
- Blom MT, Jansen S, de Jonghe A, van Munster BC, de Boer A, de Rooij SE, Tan HL, van der Velde N. In-Hospital Haloperidol Use and Perioperative Changes in QTc-Duration. J Nutr Health Aging. 2015 May;19(5):583-9. doi: 10.1007/s12603-015-0465-4. PubMed PMID: 25923490.
- Breitbart W, Gibson C, Tremblay A. The delirium experience: delirium recall and delirium-related distress in hospitalized patients with cancer, their spouses/caregivers, and their nurses. Psychosomatics. 2002 May-Jun;43(3):183-94.
- Burry L, Mehta S, Perreault MM, Luxenberg JS, Siddiqi N, Hutton B, Fergusson DA, Bell C, Rose L. Antipsychotics for treatment of delirium in hospitalised non-ICU patients. Cochrane Database Syst Rev. 2018 Jun 18;6:CD005594.
- de Jonghe A, van de Glind EM, van Munster BC, de Rooij SE. Underrepresentation of patients with pre-existing cognitive impairment in pharmaceutical trials on prophylactic or therapeutic treatments for delirium: a systematic review. J Psychosom Res. 2014 Mar;76(3):193-9. doi: 10.1016/j.jpsychores.2013.12.007. Epub 2013 Dec 31. Review. PubMed PMID: 24529037.
- Farah A. Atypicality of atypical antipsychotics. Prim Care Companion J Clin Psychiatry. 2005;7(6):268-274.
- Frieling H, Hillemacher T, Ziegenbein M, Neundorfer B, Bleich S (2007) Treating dopamimetic psychosis in Parkinson’s disease: structured review
- Grover, S.Mattoo, S.K., & Gupta, N. (2011). Usefulness of atypical antipsychotics and choline esterase inhibitors in delirium± a review. Pharmacopsychiatry, 44, 43-54.
- Grover S, Mahajan S, Chakrabarti S, Avasthi A. Comparative effectiveness of quetiapine and haloperidol in delirium: A single blind randomized controlled study. World J Psychiatry. 2016;6(3):365–371.
- Langendam MW, Hooft L, Heus P, et al. Medicamenteuze en nietmedicamenteuze interventies voor patiënten met dementie: scoping review. Dutch Cochrane Centre, 2011.
- Marcantonio ER. Old Habits Die Hard: Antipsychotics for Treatment of Delirium. Ann Intern Med. 2019 Sep 3. doi: 10.7326/M19-2624.
- Martins S, Pinho E, Correia R, et al. What effect does delirium have on family and nurses of older adult patients?. Aging Ment Health. 2018;22(7):903–911.
- Meyer-Massetti C, Cheng CM, Sharpe BA, Meier CR, Guglielmo BJ. The FDA extended warning for intravenous haloperidol and torsades de pointes: how should institutions respond? J Hosp Med. 2010 Apr;5(4):E8-16. doi: 10.1002/jhm.691. Review. PubMed PMID: 20394022.
- Meyer-Massetti C, Vaerini S, Rätz Bravo AE, Meier CR, Guglielmo BJ. Comparative safety of antipsychotics in the WHO pharmacovigilance database: the haloperidol case. Int J Clin Pharm. 2011 Oct;33(5):806-14. doi: 10.1007/s11096-011-9541-y. Epub 2011 Aug 2. PubMed PMID: 21809143.
- National Institute for Health and Clinical Excellence (2010) DELIRIUM: diagnosis, prevention and management. National Clinical Guideline Centre
- Neerland BE, Neufeld KJ, Slooter AJC. Pharmacological Management of Delirium. JAMA Psychiatry. 2019 Jul 3.
- NVKG. Richtlijn Kortdurend antipsychoticagebruik, NVKG 2019.
- O'Malley G, Leonard M, Meagher D, O'Keeffe ST. The delirium experience: a review. J Psychosom Res. 2008 Sep;65(3):223-8. doi: 10.1016/j.jpsychores.2008.05.017.
- Okamoto, Y., Matsuoka, Y., Sasaki, T., Jitsuiki, H., Horiguchi, J., & Yamawaki, S. (1999). Trazodone in the treatment of delirium. J Clin Psychopharmacol., 19 (3), 280-2.
- Overshott, R., Vernon, M., Morris, J., & Burns, A. (2010). Rivastigmine in the treatment of delirium in older people: A pilot study. International Psychogeriatrics, 22 (5), pp. 812-818.
- Partridge JS, Martin FC, Harari D, Dhesi JK. The delirium experience: what is the effect on patients, relatives and staff and what can be done to modify this? Int J Geriatr Psychiatry. 2013 Aug;28(8):804-12. doi: 10.1002/gps.3900. Epub 2012
- Rivière J, van der Mast RC, Vandenberghe J, Van Den Eede F. Efficacy and Tolerability of Atypical Antipsychotics in the Treatment of Delirium: A Systematic Review of the Literature. Psychosomatics. 2019 Jan - Feb;60(1):18-26.
- Schneider, L.S., Dagerman, K.S., Insel, P. (2005). Risk of Death With Atypical Antipsychotic Drug Treatment for Dementia Meta-analysis of Randomized Placebo-Controlled Trials. JAMA, 15, 1934-1943.
- Schneider, L.S., Dagerman, K., Insel, P.S. (2006). Efficacy and adverse effects of atypical antipsychotics for dementia: meta-analysis of randomized, placebo-controlled trials. Am J Geriatr Psychiatry,14(3), 191-210.
- Schrag A. Psychiatric aspects of Parkinson's disease--an update. J Neurol. 2004 Jul;251(7):795-804. Review. PubMed PMID: 15258780.
- Schrijver EJM, de Vries OJ, van de Ven PM, et al. Haloperidol versus placebo for delirium prevention in acutely hospitalised older at risk patients: a multi-centre double-blind randomised controlled clinical trial. Age Ageing. 2018;47(1):48–55.
- Seitz DP, Gill SS. Neuroleptic malignant syndrome complicating antipsychotic treatment of delirium or agitation in medical and surgical patients: case reports and a review of the literature. Psychosomatics. 2009 Jan-Feb;50(1):8-15. doi: 10.1176/appi.psy.50.1.8. Review. PubMed PMID: 19213967.
- Seppi K, Weintraub D, Coelho M, Perez-Lloret S, Fox SH, Katzenschlager R, Hametner EM, Poewe W, Rascol O, Goetz CG, Sampaio C (2011) The movement disorder society evidence-based medicine review update: treatments for the non-motor symptoms of Parkinson’s disease. Mov Disord 26(Suppl 3):42–80
- Skrobik YK, Bergeron N, Dumont M, Gottfried SB. Olanzapine versus haloperidol: treating delirium in a critical care setting. Intensive Care Med. 2004
- Tahir, T.A., Eeles, E., Karapareddy, V., Muthuvelu, P., Chapple, S., Phillips, B.,..., Bisson, J.I. (2010). A randomized controlled trial of quetiapine versus placebo in the treatment of delirium. Journal of Psychosomatic Research, 69 (5), pp. 485-490.
- Vardy ER, Teodorczuk A, Yarnall AJ. Review of delirium in patients with Parkinson's disease. J Neurol. 2015;262(11):2401–2410.
- Wielink PSv, Leysen JE. Relatieve bindingsaffiniteit voor receptoren, in vergelijking tot affiniteit voor D2-receptor. In: Dierick M, Ansseau M, D'Haenen H, Peuskens J, Linkowski P, eds. Handboek Psychofarmacotherapie. Gent, Belgium: Academia Press Wetenschappelijke Uitgeverij; 2003:683.
- Willekens-Bogaers, M.A., & Smits, G.W. (1990). Neuroleptics in psychogeriatrics. Evaluation of a treatment proposal. Tijdschr Gerontol Geriatr., 21 (3), 99-107.
- Wu YC, Tseng PT, Tu YK, Hsu CY, Liang CS, Yeh TC, Chen TY, Chu CS, Matsuoka YJ, Stubbs B, Carvalho AF, Wada S, Lin PY, Chen YW, Su KP. Association of Delirium Response and Safety of Pharmacological Interventions for the Management and Prevention of Delirium: A Network Meta-analysis. JAMA Psychiatry. 2019 Feb 27.
- Yu A, Wu S, Zhang Z, Dening T, Zhao S, Pinner G, Xia J, Yang D. Cholinesterase inhibitors for the treatment of delirium in non-ICU settings. Cochrane Database Syst Rev. 2018 Jun 28;6:CD012494.
- Zahodne, L.B., & Fernandez, H.H. (2008). Pathophysiology and treatment of psychosis in Parkinson's disease: a review. Drugs Aging, 25, 665-82.
Evidence tabellen
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Castro 2018 |
Review over preventie |
|
Chakraboti 2015 |
Melatonine review over preventie |
|
Friedman, 2014 |
Review zonder kwantitatieve analyse data |
|
Grover 2016 |
In Cochrane Burry |
|
Hakim 2012 |
Populatie critically ill |
|
Hawkins 2013 |
Systematic review quetiapine t/m dec 2012 |
|
Hui 2016 |
Current opinion artikel zonder beschrijving uitgevoerde literatuursearch |
|
Jain 2017 |
Open label RCT olanzapine haldol, wegens afwezigheid placebogroep |
|
Kirino 2015 |
Overzichtsartikel zonder beschrijving systematische search apiripazol |
|
Kishi 2016 |
Systematische review tm nov 2014 antipsychotica |
|
Maneeton 2013 |
Opgenomen in Burry |
|
Neufeld 2016 |
Voldoet niet aan de PICO, includeerde ook IC patiënten |
|
Overschott 2010 |
Opgenomen in Yu 2018 |
|
Rivière 2019 |
Voldoet niet aan de PICO, includeerde IC-patiënten |
|
Schrijver 2016 |
Systematische review haloperidol t/m April 2015 |
|
Shen 2018 |
Systematische search t/m mei 2017 haloperidol profylaxe of behandeling |
|
Szymczak 2014 |
Systematische review t/m nov 2013 |
|
Tagarakis 2012 |
RCT na hartchirurgie, deze patiënten werden op IC opgenomen en daarom geëxcludeerd |
|
Tampi 2015 |
Search t/m juni 2015 |
|
Wang 2013 |
Review t/m nov 2012 |
|
Wu 2018 |
Voldoet niet aan de PICO, includeerde IC-patiënten |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 15-10-2024
Laatst geautoriseerd : 14-08-2020
Geplande herbeoordeling : 15-10-2029
Uiterlijk in 2025 bepaalt het bestuur van de NVKG of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVKG is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Medicamenteuze behandeling delier |
NVKG |
2020 |
2025 |
Eens in de vijf jaar |
NVKG |
Nieuwe RCTs of meta-analyses |
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De Patiëntenvragenlijst, die werd afgenomen bij deze richtlijn, werd medegefinancierd uit de Stichting Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma Kwaliteit, Inzicht en Doelmatigheid in de medisch specialistische Zorg (KIDZ).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met een delier.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Dr. P.L.J. Dautzenberg, klinisch geriater, JBZ, Den Bosch, NVKG (voorzitter)
- Dr. A. De Jonghe, klinisch geriater, Tergooi, NVKG
- Dr. R.J. Osse, psychiater, Erasmus MC, Rotterdam, NVvP
- Drs. M.R. Altena, internist-ouderengeneeskunde, Haaglanden Medisch Centrum, Den Haag, NIV
- Dr. P.L.M. de Kort, Neuroloog, Elisabeth-Twee Stedenziekenhuis, NVN
- Dr. A. Egberts, apotheker, Franciscus Gasthuis & Vlietland, Rotterdam & Schiedam, NVZA
- W.M. Meijer, verpleegkundig specialist geriatrie, OLVG Amsterdam, V&VN Geriatrie & Gerontologie
- J.C. Martinot MsC, verpleegkundig specialist, GC Stichting Zonboog Zuiderkroon en CHPR (Centrale Huisartsenpost Rotterdam), Rotterdam, V&VN VS-netwerk VS 1e lijn
- Drs. S. van de Kamp, specialist ouderengeneeskunde, Zinzia Zorggroep, Wageningen, Verenso
- Drs. E.G.M. Smit, internist-intensivist, Spaarne Gasthuis, NVIC
- Drs. N.A.J. Fennema, anesthesioloog-intensivist, Spaarne Gasthuis, NVIC
- Drs. K. Spijkers, Patientenfederatie Nederland (agendalid)
Samenstelling klankbordgroep
- Patiëntfederatie Nederland
- KBO-PCOB
- Mezzo
- Mind
- Alzheimer Nederland
Met ondersteuning van
- Dr. M. L. Molag, projectleider, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. D. Nieboer, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. J. Prins, adviseur, Kennisinstituut van de Federatie van Medisch Specialisten (tot juli 2019)
- Drs. M. Wessels, informatiespecialist, Kennisinstituut van de Federatie van Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Dautzenberg |
Klinisch geriater (0.8 fte) en directeur ‘brain research center’ (0.2 fte) en voorzitter deze richtlijncommissie |
Lid RvT verpleeghuis Jozefoord, Nuland, betaald |
geen |
Het Brain Research Center is een commerciële instelling die trials voor de industrie doet, Dautzenberg echter richt zich hier op de behandeling van dementie en niet op delier. Dit staat het voorzitterschap en medewerking aan de RL Delier niet in de weg |
|
De Jonghe |
Klinisch geriater |
geen |
Tergooi neemt deel aan multicenterstudie naar deltascan, een delier-monitor. |
Deltascan is een soort diagnostisch EEG voor delier, andere onderzoekers zijn daarvoor primair verantwoor-delijk, dus geen actie |
|
Osse |
psychiater |
Docent en opleider |
Lid van de Euridice trial stuurgroep en betrokken bij Deltascan |
Deltascan is een soort diagnostische EEG, andere werkgroepleden zijn daarvoor primair verantwoor-delijk, dus geen actie |
|
Altena |
Internist-ouderengeneeskunde |
geen |
Geen |
geen |
|
De Kort |
Neuroloog |
Bestuurslid stichting Postacademische Opleiding Klinische Neuropsychologie |
Geen |
geen |
|
Egberts |
Apotheker |
geen |
Geen |
geen |
|
Meijer |
Verpleegkundig specialist geriatrie |
|
Geen |
geen |
|
Martinot |
Verpleegkundig specialist |
geen |
Geen |
geen |
|
Van de Kamp |
Specialist ouderengeneeskunde |
geen |
Geen |
geen |
|
Smit |
Intensivist |
NKIC Kwaliteitsvisitatie |
IC Spaarne gaat mogelijk meedoen aan multicenter studie Deltascan |
Deltascan is een soort diagnostisch EEG voor delier, andere onderzoekers zijn daarvoor primair verantwoordelijk, dus geen actie |
|
Fennema |
Intensivist |
Docent cursus NVIC Luchtwegmanagement |
Als Principal Investigator betrokken bij MIDEX studie |
MIDEX studie heeft betrekking op de IC en dat is uitgesloten in de huidige richtlijn |
|
Spijkers |
Vertegenwoordiger Patiëntenfederatie |
geen |
geen |
geen |
Inbreng patiëntenperspectief
Om meer inzichten te krijgen in de waarden en voorkeuren van patiënten, heeft de Patiëntenfederatie het onderzoek ‘ervaringen rondom een delier’ uitgevoerd via hun patiëntenpanel. Deze vragenlijsten werd ingevuld door 91 mantelzorgers van patiënten die een delier hadden doorgemaakt in het afgelopen jaar. Daarvan had 42% van de patiënten thuis een delier doorgemaakt, bij 16% in het ziekenhuis op een niet-geriatrische afdeling, bij 13% in het verpleeghuis, bij 9% op de intensive care en bij 7% op de geriatrische afdeling van een ziekenhuis of anders (13%). Een verslag hiervan (zie aanverwante producten) is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. Aan het begin werden knelpunten uitgevraagd en aan het einde werd de conceptrichtlijn tevens voor commentaar voorgelegd aan Alzheimer Nederland, KBO-PCOB, Mantelzorg-NL, MIND en de Patiëntenfederatie Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan wordt vastgesteld in overleg met de NVKG na autorisatie van de richtlijn.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn Delier volwassenen (NVKG, 2013)) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door de wetenschappelijke verenigingen, de partijen genoemd onder het kopje inbreng patiëntenperspectief, Actiz en IGJ via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008) en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
C) Voor vragen over de waarde van meet- of classificatie-instrumenten (klinimetrie)
Deze instrumenten werden beoordeeld op validiteit, intra- (test-hertest) en inter-beoordelaarsbetrouwbaarheid, responsiviteit (alleen bij meetinstrumenten) en bruikbaarheid in de praktijk. (naar keuze: optie-1 ‘Bij ontbreken van een gouden standaard, werd een beoordeling van de bewijskracht van literatuurconclusies achterwege gelaten.’ Of optie-2 ‘De kracht van het wetenschappelijk bewijs werd bepaald met de generieke GRADE-methode’).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg
Indicatorontwikkeling
Er werden geen indicatoren ontwikkeld voor deze richtlijn, gekozen werd om aan te sluiten bij de indicatoren van IGJ en VMS. Een andere werkgroep heeft nieuwe indicatoren opgesteld binnen het project van de NVKG ‘Update IGZ indicator Delier’.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G.,.. & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Kennisinstituut van de Federatie Medisch Specialisten. Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Utrecht, 2015
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwaliteit. https://www.demedischspecialist.nl/publicaties/medisch-specialistische-richtlijnen-20-rapport
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E.,... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.

