Botulinetoxine injecties bij spasticiteit
Uitgangsvraag
Wat is de effectiviteit van intramusculaire injecties met botulinetoxine bij patiënten met cerebrale en/of spinale spasticiteit?
Aanbeveling
Behandel focale spiertonusverhoging als gevolg van spasticiteit welke leidt tot passieve of actieve hinder bij dagelijkse activiteiten primair met intramusculaire botulinetoxine injecties in een zo laag mogelijke, effectieve dosering en frequentie. Het gebruikelijke interval bedraagt veelal elke drie tot vier maanden.
Laat botulinetoxine behandeling altijd gepaard gaan met actieve en/of passieve (rek) oefeningen om een zo goed en lang mogelijk functioneel resultaat te bereiken.
Selecteer de te injecteren spieren voor botulinetoxine injecties op basis van gedegen, liefst interdisciplinaire, functionele diagnostiek en vaststelling van individuele functionele doelen.
Behandel de onderste extremiteit bijvoorkeur op basis van instrumentele gangbeeldanalyse (inclusief oppervlakte elektromyografie), vooral indien een verbetering van het lopen wordt nagestreefd.
Evalueer de uitkomsten van de behandeling met botulinetoxine aan de hand van vooraf vastgestelde doelen.
Behandel pijn bij een spastische parese niet primair met botulinetoxine injecties, tenzij de causaliteit met de spasticiteit overtuigend is.
Streef bij langdurige, herhaalde behandeling met botulinetoxine injecties naar zo lang mogelijke intervallen voor optimale veiligheid en doelmatigheid. Overweeg in deze gevallen ook alternatieve behandelingen zoals invasieve interventies.
Overwegingen
Botulinetoxine is het middel van eerste keus voor focale spasmolyse van de bovenste en onderste extremiteit bij patiënten met cerebrale spasticiteit en bij patiënten met multipele sclerose. Door een proces van endocytose wordt het middel na intramusculaire injectie opgenomen in de terminale zenuwuiteinden van de geïnjecteerde spier en blokkeert het de uitstoot van acetylcholine in de synaps, en derhalve de prikkeloverdracht van zenuw op spier. Omdat deze prikkeloverdracht bij patiënten met spasticiteit vaak te sterk of op onjuiste wijze plaats vindt, kan het zinvol zijn deze te remmen met botulinetoxine. Het is van belang te benadrukken dat botulinetoxine injecties niet moeten worden beschouwd als een ‘stand-alone’ behandeling, maar bij voorkeur moeten worden gecombineerd met actieve oefentherapie (zoals bewegingsoefeningen) of passieve oefentherapie (zoals rekoefeningen) (Wissel, 2009). Dit bevordert eventuele functionele winst van de injecties. Desgewenst kan gebruik worden gemaakt van rekspalken ter ondersteuning van de passieve oefentherapie, vooral waar het gaat om ernstige spasticiteit van de pols- en vingerflexoren. De reden dat aanvullende rekoefeningen belangrijk zijn bij botulinetoxine behandeling is dat spasticiteit predisponeert tot spierstijfheid en spierverkorting. Waar spasticiteit een neurogeen verschijnsel is, moeten spierstijfheid en spierverkorting worden beschouwd als niet-neurogene symptomen van de spastische parese (Gracies, 2001 en 2005). Door toename en verandering van bindweefsel in de niet-contractiele delen van de spier en door verlies van sarcomeren verliezen spieren uiteindelijk aan passieve compliantie en lengte. Dit leidt vervolgens tot disproportioneel verlies van functie en vaardigheid. De enige manier om dit te voorkómen is door de spastische spieren dagelijks zo veel mogelijk te rekken. Ofschoon voor dit advies geen harde wetenschappelijke onderbouwing kan worden gegeven (in de zin van RCT’s), berust het op klinische ervaring bij veel behandelaars. Onderstaand wordt de wetenschappelijke onderbouwing van het gebruik van botulinetoxine injecties bij cerebrale spasticiteit en multipele sclerose nader besproken. Voor spinale spasticiteit konden geen goed gecontroleerde studies worden geïdentificeerd.
Spiertonus: Zes van de acht geïncludeerde studies betreffende de bovenste extremiteit (BE) behandelden de elleboog- pols-, en vingerflexoren ter reductie van flexiespasticiteit van de arm en hand bij patiënten met een CVA in de chronische fase (minimaal drie (Bakheit, 2001) of zes maanden na CVA). Twee studies betroffen behandeling in de subacute fase twee weken (Rosales, 2012) of vier weken (Shaw, 2010) na CVA. De twee geïncludeerde studies betreffende de onderste extremiteit (OE) behandelden de kuitspier (in de studie van Kaji (2010) aangevuld met de tibialis posterior) ter reductie van spastische pes equinovarus bij patiënten met een CVA in de chronische fase (minimaal drie (Pittock, 2003) of zes maanden na CVA). Alle geïncludeerde studies gebruikten de (Modified) Ashworth Scale / (M)AS als uitkomstmaat voor spiertonus, echter niet altijd als primaire uitkomstmaat. Aangezien de (M)AS een ordinale schaal is met een beperkt aantal niveaus, die statistisch dikwijls (overigens disputabel) als lineaire maat wordt verwerkt, werd een minimum aantal van 25 participanten per behandelgroep gehanteerd voor inclusie. Mede door dit aanvullende methodologische criterium werd slechts een gering aantal studies methodologisch goed genoeg bevonden. Al deze studies lieten een consistent, tonusverlagend effect zien van botulinetoxine in aangedane arm en been. Vijf studies (n=413) konden worden geïncludeerd in een meta-analyse van het tonusverlagende effect van botulinetoxine (gemeten middels de (M)AS) 12 weken na de injecties. Ofschoon na een termijn van 12 weken het effect van botulinetoxine farmacobiologisch al voor een belangrijk deel is uitgewerkt (door regeneratie van terminale zenuwuiteinden) werd een significante reductie van 0,53 op de (M)AS (95%BI: -0,69 tot -0,37) gevonden. Het tonusverlagende effect van botulinetoxine in de periode rond zes weken na injecties kan grofweg worden geschat op ca. 1 punt vermindering van (M)AS. Gezien het beperkt aantal niveaus van deze schaal (5 tot 6) kan dit in de meeste gevallen als een klinisch relevant verschil (20 tot 25% verbetering) worden beschouwd. Van belang is dat, naast de geïncludeerde studies, nog vele niet geïncludeerde studies (vaak van kleinere omvang en met minder interne controle) in dezelfde richting van een significant en klinisch relevant tonusverlagend effect van botulinetoxine wijzen. Ook dierstudies laten een dergelijk effect zien, hetgeen bijdraagt aan de farmacologische onderbouwing ervan. De gevonden duur van het tonusverlagend effect van botulinetoxine bedraagt derhalve (ruim) 12 weken. Beide OE studies laten zien dat significante effecten worden gevonden na vier en acht weken, maar niet meer na 12 weken. De BE-studies laten dus een wat langer durend effect zien tot ruim 12 weken na de injecties. Dit betekent dat, bij effectiviteit van de botulinetoxine injecties, deze na 3-4 maanden zullen moeten worden herhaald, afhankelijk van het individuele effect bij de betreffende patiënt.
Er zijn onvoldoende studies naar het effect van botulinetoxine op de schouderspieren en bovenbeenspieren bij cerebrale spasticiteit. Ook zijn er onvoldoende studies naar toepassing bij spinale spasticiteit, bilaterale spastische parese zoals bij adulte vormen van cerebrale parese (CP) of erfelijke vormen van spasticiteit (HSP). Er werd één studie geïncludeerd naar het effect van botulinetoxine op spasticiteit in de heupadductoren bij patiënten met MS, echter deze was niet conclusief. Toch lijkt toepassing van botulinetoxine bij deze in frequentie minder voorkomende en onderzochte indicaties gerechtvaardigd op dezelfde wijze als bij de hierboven beschreven indicaties, aangezien er belangrijke overeenkomsten zitten in de pathofysiologie van de spasticiteit en de werking van de botulinetoxine bij genoemde patiëntgroepen en indicatiegebieden. In het bijzonder kan worden gedacht aan botulinetoxine behandeling van de pectoralis major bij adductiespasticiteit in de schouder, van de adductoren bij adductiespasticiteit in de heup, van de rectus femoris bij spastische vormen van ‘stiff knee gait’, en van de hamstrings bij een zogenoemde ‘flexiegang’. Ook kan aanvullende behandeling van de tibialis posterior en teenflexoren bij de spastische ‘pes equinovarus’ rationeel zijn. Injecties in de onderste extremiteiten dienen bij voorkeur te worden geïndiceerd op basis van instrumentele gangbeeldanalyse, inclusief gebruik van oppervlakte elektromyografie (EMG), om het patroon en de ernst van de spasticiteit beter te onderbouwen.
Veiligheid: Uit de geïncludeerde studies komt naar voren dat botulinetoxine i.h.a. veilig kan worden toegepast. Er worden bij de met botulinetoxine behandelde patiënten niet méér bijwerkingen gemeld dan bij de patiënten die een placebobehandeling kregen. Hierbij dient te worden opgemerkt dat RCT’s niet de beste garantie bieden op de herkenning van bijwerkingen. Omdat men in een RCT primair gericht is op het beoordelen van (gunstige) effecten, worden bijwerkingen vaak minder precies vastgesteld. Lange termijn bijwerkingen blijven vaak geheel onopgemerkt door een beperkte follow-up. Bovendien worden de meest kwetsbare patiëntgroepen (in het bijzonder patiënten met multi-morbiditeit) vaak niet in studies geïncludeerd. In de praktijk dient men dus alert te blijven op bijwerkingen van botulinetoxine. Naast lokale pijn en hematoomvorming, direct samenhangend met de injecties, gaat het in het bijzonder om ervaren spierzwakte van de geïnjecteerde spieren, maar ook om ervaren spierzwakte van niet geïnjecteerde spieren (‘op afstand’). Deze kan zich onder andere uiten in klachten van dubbelzien, ademhalings- en slikklachten, moeite met ophouden van urine, of meer diffuse zwakte in armen of benen. Dit kan gepaard gaan met verslechtering van functionele mogelijkheden, zoals van de balans- en loopvaardigheid en van de arm- en handvaardigheid. De kans op deze bijwerkingen lijkt vergelijkbaar bij alle producten en toedieningswijzen indien men zich houdt aan de aanbevolen maximale doses per product en aan het voorkómen van intravasale toediening door vóór het injecteren te aspireren. Er zijn echter geen studies die de bijwerkingen hebben vergeleken tussen verschillende producten. Extra voorzichtigheid is geboden bij neurologische aandoeningen die vaak gepaard gaan met ademhalings- en slikproblemen, zoals ALS. Voor een actueel overzicht van bekende en/of gemelde bijwerkingen bij medicatie kan de website van Bijwerkingencentrum Lareb worden geraadpleegd (www.lareb.nl). Via deze website kunnen ook eventuele bijwerkingen worden gemeld, ook van off label gebruik. Dit is van belang om de veiligheid van (off label) gebruik van botulinteoxine bij spasticiteitsbehandeling te kunnen monitoren.
Actief en passief bereik van beweging: Opmerkelijk hebben slechts twee van de acht BE studies (Bakheit, 2001) en geen van de OE studies gekeken naar passief en actief bewegingsbereik (Bakheit, 2001; Rosales, 2012). Door Bakheit (2001) werd slechts een tendens tot verbetering van passief bewegingsbereik gevonden in de elleboogflexoren, meer dan in de pols- en de vingerflexoren, bij toepassing in de chronische fase. Op het actieve bewegingsbereik werden geen effecten gevonden. Dit kan mogelijk verklaard worden doordat in deze studie geen aanvullende oefeningen voor de geïnjecteerde spieren werden gegeven. De huidige Europese consensus (Wissel, 2009) geeft aan dat botulinetoxine behandeling niet als monotherapie moet worden toegepast, maar altijd in combinatie met passieve of actieve oefeningen gericht op verbetering van spierlengte en actieve bewegingssturing. Om effecten op de actieve motoriek te verkrijgen, moet bovendien een nauwkeurige selectie worden gemaakt van patiënten die voldoende (potentie) tot willekeurige, selectieve motoriek hebben. Daarvan was in de studie van Bakheit (2010) geen sprake. Rosales, 2012 hebben naar actief en passief bereik van elleboog en pols gekeken in de subacute fase. Zij vonden wel een tendens tot een groter passief bewegingsbereik in elleboog en pols, maar de gevonden effecten waren relatief klein. Ofschoon deze studie de revalidatiefase betreft, blijft het onduidelijk hoeveel aanvullende therapie gericht op actief en passief bewegen de patiënten kregen.
Pijn: Vier van de acht geïncludeerd BE studies hebben naar pijn gekeken als secundaire uitkomstmaat en vonden een gunstige tendens, maar niet altijd een significant effect. Een belangrijke overweging hierbij is dat deze studies patiënten niet hebben geselecteerd op basis van pijn. In de studie van McCrory (2009) had bijvoorbeeld meer dan de helft van de patiënten bij inclusie geen relevante pijn en de niveaus van pijn in de studie van Bakheit (2001) waren bij inclusie eveneens relatief laag, uitgedrukt in een somscore over meerdere gewrichten van de arm. Diverse niet geïncludeerde studies (Oh, 2015; Pavone, 2010) maken wel melding van een gunstig effect van botulinetoxine op pijn na CVA, bijvoorbeeld door inhibitie van afferenten afkomstig van spierspoeltjes (Pickett, 2010). Pijnreductie wordt zelfs gevondenbij patiënten die geen duidelijke tonusreductie ondervinden. Sommige onderzoekers denken derhalve dat botulinetoxine een onafhankelijk effect op pijn zou kunnen hebben, los van het tonusreducerend effect. Mogelijk hangt dit samen met retrograad axonaal transport van botulinetoxine richting het ruggenmerg (Caleo, 2009a; Caleo, 2009b) of een direct effect van botulinetoxine op de vrije zenuwuiteinden die pijnprikkels signaleren (Picket, 2010). Eén van de geïncludeerde OE studies bij CVA heeft pijn beoordeeld (Pittock, 2003). De auteurs vonden significant meer pijnreductie in de met botulinetoxine behandelde groepen dan in de placebogroep. Dit effect is echter enigszins vertekend, omdat bij inclusie de placebogroep minder pijnklachten had dan de met botulinetoxine behandelde groepen. Eén studie bij MS (Gusev, 2008) vond een reductie van pijn na de behandeling van spasticiteit van de heup adductoren met botulinetoxine injecties, maar opmerkelijk genoeg geen effect van deze injecties op de spiertonus. Mogelijk is het pijneffect dus langs een andere weg tot stand gekomen. Door gebrek aan andere studies bij patiënten met MS blijven deze bevindingen niet conclusief.
Functioneel: Vier van de acht geïncludeerde BE studies hebben de Disability Assessment Scale (DAS) gebruikt om in de chronische fase na CVA vast te stellen of tonusreductie in de flexoren van de aangedane arm leidt tot functionele verbetering. De DAS is een instrument waarbij door behandelaar én patiënt tezamen voorafgaande aan de behandeling één hoofddoel wordt vastgesteld (op het gebied van houding van arm en hand, kleden, hygiëne, of pijn) dat na de behandeling op een vier-puntenschaal wordt gescoord. Alle studies vonden dat twaalf weken na de botulinetoxine injecties significant meer verbetering werd bereikt in de met botulinetoxine behandelde groepen in vergelijking met placebo. In de meeste gevallen werden de doelen gericht op verbetering van houding van arm en hand en verbetering van het kleden, gevolgd door verbetering van hygiëne. Reductie van pijn was slechts een doel bij een minderheid van de patiënten. Eén van de twee overige BE studies (McCrory, 2009) gebruikte hiervoor een kwaliteit van leven (QoL) schaal en Goal Attainment Scaling (GAS) en vond soortgelijke resultaten. Geen enkele van de genoemde studies heeft evenwel een uitkomstmaat gebruikt die armhandvaardigheid op objectieve wijze, bijvoorbeeld instrumenteel of middels gestandaardiseerde observatie, meet. Hierbij moet worden opgemerkt dat verbetering van actieve armhandvaardigheid waarschijnlijk in geen van deze studies een doel was, gezien de inclusie van patiënten met voornamelijk een afunctionele, grotendeels verlamde arm. Alleen Shaw (2010) hebben een uitkomstmaat gebruikt welke de actieve armhandvaardigheid op objectieve wijze vaststelt (ARAT). In deze studie werd na drie maanden een klein doch significant verschil gevonden ten gunste van de botulinetoxine behandeling.
Wat betreft de studies gericht op de OE werden, ondanks tonusreductie van de onderbeenspieren, geen verbeteringen gevonden in spatio-temporele parameters (loopsnelheid, loopafstand, cadans, staplengte) of Rivermead Motor Assessment. Dit wekt geen verbazing daar de indicatie voor tonusreductie bij een spastische ‘pes equinovarus’ primair gericht is op vermindering van de neiging tot slepen, reductie van valrisico, vermindering van compenserende bewegingen, en op verbetering van enkelstabiliteit en reductie van behoefte aan hulpmiddelen zoals enkel-voetorthesen; met andere woorden op de kwaliteit van het looppatroon. Dit werd in geen van beide onderzoeken vastgelegd.
Optimale dosering, oplossing, en spierselectie: Ofschoon er onvoldoende evidentie is voor het feit dat een hogere dosis botulinetoxine leidt tot een groter tonusreducerend effect, leert klinische ervaring dat hogere doses botulinetoxine nodig zijn bij ernstiger vormen van spasticiteit. Er is evenwel zeker geen sprake van een lineaire dosis-repons relatie, daar het tonusverlagende effect gemiddeld 1 punt of de (M)AS betreft, ongeacht de ernst van de spasticiteit en de dosis. Enkele studies laten zien dat er mogelijk een dosis-respons effect is wat betreft de effecten van botulinetoxine op de spiertonus, maar dit effect lijkt minder sterk dan men op grond van de gebruikte aantallen eenheden zou verwachten. Het is dus verstandig én doelmatig om in alle gevallen te streven naar de laagst mogelijke aanbevolen dosis botulinetoxine voor iedere te behandelen spiergroep en hierin in tweede instantie bij te sturen op basis van individuele effectiviteit en (risico op) bijwerkingen.
Het wordt onvoldoende duidelijk uit de literatuur of oplossingsvolume de effectiviteit van botulinetoxine injecties beïnvloedt. Derhalve is het verstandig voor de arm en het been een standaard oplossingsvolume te kiezen om doseringsfouten te vermijden.
De selectie van de te behandelen spieren in bovenste en onderste extremiteit moet worden gemaakt op basis van een zorgvuldige functionele beoordeling van passieve en actieve vaardigheden, waarbij vooral bij complexe patiënten de fysiotherapie en/of ergotherapie bij de functionele diagnostiek, probleemanalyse en het vaststellen van individuele behandeldoelen zouden moeten worden betrokken (interdisciplinaire beoordeling en afstemming). Desgewenst kan het vaststellen van doelen worden ondersteund middels formele Goal Attainment Scaling (GAS) of door gebruik van instrumenten zoals de Canadian Occupational Performance Measure (COPM). Injecties in de onderste extremiteiten dienen initieel bij voorkeur te worden geïndiceerd op basis van instrumentele gangbeeldanalyse, inclusief het gebruik van oppervlakte EMG, om het patroon en de ernst van de spasticiteit beter te onderbouwen. Systematische evaluatie van vooraf gestelde behandeldoelen is een voorwaarde voor continuering van behandeling met botulinetoxine injecties.
Optimale timing en behandelduur:
De meeste geïncludeerde studies onderzochten het gebruik van botulinetoxine injecties in de chronische fase (minimaal drie maanden) na een beroerte. Er zijn aanwijzingen dat botulinetoxine behandeling ook effectief kan zijn in de subacute fase (<3 maanden) na CVA, waarbij zelfs een eenmalige behandeling een langdurig (en mogelijk preventief) effect zou kunnen hebben op de (ontwikkeling van) spasticiteit (Rosales, 2012) in de bovenste extremiteit.
Er is geen optimale duur aan te geven voor de behandeling met botulinetoxine injecties. Langdurig gebruik, in termen van vele jaren, lijkt veilig maar is niet per definitie doelmatig en is zeker niet goed onderzocht. Sommige patiënten hebben een zodanig langdurig effect na herhaalde injecties dat voortzetting niet meer zinvol is. Bij anderen treedt deze geleidelijke verbetering niet op. In deze laatste gevallen moeten op termijn ook andere focale behandelopties (zoals weke-delen chirurgie of selectieve neurectomie) worden overwogen, zeker indien er sprake is van deformiteit en contracturen.
Onderbouwing
Achtergrond
Botulinetoxine injecties maken deel uit van de standaard behandelopties van (focale) spasticiteit. Hoewel de veiligheid en het effect van deze behandeling op de vermindering van de spiertonus zijn vastgesteld, zijn er nog veel vragen over de functionele effecten op bijvoorbeeld loopvaardigheid en handvaardigheid. Daarnaast is het onduidelijk wat de adequate dosering en toedieningsfrequentie is. Tot slot is nog weinig bekend over de lange-termijn effecten van botulinetoxine injecties op veranderingen van spierkenmerken (b.v. atrofie en fibrose).
Conclusies
Vraag 1 Effecten van botulinetoxine
Spiertonus
|
Hoog GRADE |
Injecties met botulinetoxine verminderen de spiertonus vergeleken met placebo bij patiënten met spasticiteit in de bovenste of onderste ledematen als gevolg van een beroerte.
Bronnen (Gracies, 2015; Rosales, 2012; Kaji, 2010a; Shaw, 2010; Kaňovský, 2009; McCrory, 2009; Brashear, 2002; Bakheit, 2001; Kaji, 2010b; Pittock, 2003) |
|
Zeer laag GRADE |
Er is onvoldoende bewijs voor vermindering van spiertonus door botulinetoxine injecties in vergelijking met placebo bij patiënten met spasticiteit in de onderste ledematen als gevolg van MS.
Bronnen (Gusev, 2008) |
Actief of passief bereik van beweging
|
Zeer laag GRADE |
Er is onvoldoende bewijs voor een effect van botulinetoxine injecties op actief of passief bereik van beweging bij patiënten met spasticiteit als gevolg van een beroerte.
Bronnen (Gracies, 2015; Rosales, 2012; Pittock, 2003; Bakheit, 2001) |
Pijn
|
Laag GRADE |
Botulinetoxine injecties lijken pijn als gevolg van spasticiteit te verminderen in vergelijking met placebo bij patiënten met spasticiteit als gevolg van een beroerte.
Bronnen (Rosales, 2012; Shaw, 2010; McCrory, 2009; Bakheit, 2001; Pittock, 2003) |
|
Zeer laag GRADE |
Er is onvoldoende bewijs voor vermindering van pijn als gevolg van spasticiteit door botulinetoxine injecties in vergelijking met placebo bij patiënten met MS en spasticiteit in de onderste ledematen.
Bronnen (Gusev, 2008) |
Functionele metingen
|
Matig GRADE |
Passieve functionaliteit in de bovenste ledematen lijkt te verbeteren door behandeling met botulinetoxine injecties bij patiënten met spasticiteit in de bovenste ledematen als gevolg van een beroerte. Het gaat hier vooral om doelen gericht op verbetering van houding van arm en hand, gemakkelijker kleden en betere hygiëne.
Bronnen (Gracies, 2015; Ward, 2014; Kaňovský, 2009; McCrory, 2009; Brashear, 2002) |
|
Zeer laag GRADE |
Er is nog onvoldoende bewijs voor een gunstig effect van botulinetoxine injecties op de balans- of loopvaardigheid bij patiënten met spasticiteit in de onderste ledematen als gevolg van een beroerte of MS.
Bronnen (Ward, 2014; Kaji, 2010; Pittock, 2003; Gusev, 2008) |
Bijwerkingen
|
Zeer laag GRADE |
Behandeling met botulinetoxine injecties lijkt niet tot meer behandel-gerelateerde bijwerkingen te leiden dan placebobehandeling bij patiënten met spasticiteit als gevolg van een beroerte.
Bronnen (Gracies, 2015; Rosales, 2012; Shaw, 2010; Kaňovský, 2009; McCrory, 2009; Brashear, 2002; Kaji, 2010) |
Vraag 2 Optimale dosering van botulinetoxine
Spiertonus
|
Zeer laag GRADE |
Er is onvoldoende bewijs dat een hogere dosering van botulinetoxine leidt tot een grotere reductie in spiertonus bij patiënten met spasticiteit in de bovenste of onderste ledematen als gevolg van een beroerte.
Bronnen (Gracies, 2015; Pittock, 2003) |
Functionele metingen
|
Zeer laag GRADE |
Er is onvoldoende bewijs dat een hogere dosering van botulinetoxine leidt tot een grotere verbetering in actief bereik van beweging, functionele metingen of pijn bij patiënten met spasticiteit in de bovenste of onderste ledematen als gevolg van een beroerte.
Bronnen (Gracies, 2015; Pittock, 2003) |
Vraag 4 Geschikt oplossingsvolume voor het injecteren
Functionele metingen
|
Zeer laag GRADE |
Er is onvoldoende bewijs dat er een verschil in effect op functionele metingen is tussen hoog en laag volume van botulinetoxine injecties bij patiënten met spasticiteit in de bovenste ledematen als gevolg van een beroerte. |
Bijwerkingen
|
Zeer laag GRADE |
Het is waarschijnlijk dat een hoog volume even veilig is als een laag volume van botulinetoxine injecties bij patiënten met spasticiteit in de bovenste ledematen als gevolg van een beroerte.
Bronnen (Barnes, 2010) |
Samenvatting literatuur
Vraag 1 Effecten van botulinetoxine
Beschrijving studies
Patiënten met een beroerte – Spasticiteit in de bovenste ledematen
Gracies (2015) beoordeelde het effect van abobotulinumtoxinA (Dysport) injecties in spieren in de bovenste ledematen op spiertonus, actieve beweging en functionele metingen. 238 patiënten met spasticiteit in de bovenste ledematen als gevolg van een beroerte of traumatisch hersenletsel waren geïncludeerd. 80 patiënten ontvingen 500 IU in de buigspieren van de elleboog, pols of vingers, 79 patiënten kregen 1000 IU geïnjecteerd en 79 patiënten hebben een placebo gekregen. Spieren werden door middel van elektrostimulatie gelokaliseerd.
Ward (2014) evalueerde de kosteneffectiviteit van een behandeling met botulinetoxine injecties A+ (Botox) in combinatie met standaardzorg ten opzichte van een placebobehandeling met met standaardzorg in zowel de bovenste als onderste ledenmaten. De studie randomiseerde 273 patienten met spasticiteit ten gevolge van een cebrovasculair accident. 139 patiënten kregen op baseline en na twaalf weken injecties met max. 800 U naar inzicht van de behandelaar en 135 kregen een placebo. De studie werd uitgevoerd in Duitsland, Zweden, Groot Brittanië en Canada. De uitkomsten betreffende kosten werden niet gerapporteerd in de publicatie.
Rosales (2012) bepaalde de effectiviteit en veiligheid van vroege toediening van botulinetoxine type A (Dysport) bij patiënten met spasticiteit in de bovenste ledematen. Patiënten met een eerste beroerte twee tot 12 weken geleden met een MAS score van ten minste 1+ in het pols of ellebooggewricht kwamen in aanmerking voor inclusie. In totaal werden 163 patiënten gerekruteerd, waarvan 83 een placebo ontvingen en 80 botulinetoxine injecties kregen. In totaal werd 500 U in de aangedane spieren geïnjecteerd.
Kaji (2010a) evalueerde de effectiviteit en veiligheid van een eenmalige behandeling met botulinetoxine type A (Botox) in patiënten met spasticiteit in de bovenste ledematen als gevolg van een beroerte. 200 units werd in buigspieren van de pols en vingers geïnjecteerd met optioneel ook in buigspieren van de duim tot een maximale dosering van 240 units. In totaal kregen 51 patiënten botulinetoxine toegediend en 26 een placebo.
Shaw (2010) vergeleek de effectiviteit en kosteneffectiviteit van een behandeling met botulinetoxine type A (Dysport) tezamen met een therapie voor de bovenste ledematen met alleen therapie van de bovenste ledematen. Patiënten met spasticiteit in de schouder, elleboog, pols of hand als gevolg van een beroerte meer dan een maand geleden waren geïncludeerd. 170 patiënten ontvingen botulinetoxine type A in een maximale dosering van 1000 units tezamen met een vier weken durende therapieprogramma gericht op de bovenste ledematen. 163 patiënten ontvingen alleen het vier weken durende programma. Tijdens follow-up konden deelnemers additionele injecties of therapie ontvangen als dat nodig mocht zijn.
Kaňovský (2009) bestudeerde de impact van botulinetoxine (Xeomin) op spiertonus, functionele metingen en belasting voor de verzorger bij patiënten met spasticiteit in de pols en vingers als gevolg van een beroerte. Elektrostimulatie of het meten van elektromyografische signalen werden voor het plaatsen van de naald in de spier gebruikt. Een maximale dosis was 400 units (mediaan gegeven dosis: 320 IU). In totaal waren 73 patiënten gerandomiseerd naar de actieve arm en 75 patiënten naar de placebogroep.
McCrory (2009) vergeleek de behandeling met botulinetoxine met placebo bij patiënten met cerebrale spasticiteit in de bovenste ledematen als gevolg van een beroerte. Een dosis van 750-1000 units botulinetoxine (Dysport) werd gegeven. De selectie van de spieren, enkele of meerdere injectiegebieden per spier, en het gebruik van elektromyografie of zenuw/spier stimulatie voor het plaatsen van de injecties waren vrij te bepalen door de behandelend arts. In totaal waren 96 patiënten geïncludeerd met 54 patiënten die botulinetoxine ontvingen en 42 placebo.
Brashear (2002) onderzocht de effecten van één cyclus van botulinetoxine type A (Botox) injecties op de beperkingen met betrekking tot verzorging door de patiënt zelf, ledemaat positie, pijn en spiertonus. De populatie bestond uit patiënten met verhoogde tonus in buigspieren van de pols en vingers als gevolg van een beroerte. De dosis was in totaal 200 tot 240 IU. 50 units werden in elk van de vier pols en vinger spieren geïnjecteerd met optionele injecties van 20 units in één of twee duimspieren. 64 patiënten ontvingen botulinetoxine injecties en 62 patiënten een placebo (N=126).
Bakheit (2001) heeft gekeken naar de effectiviteit en veiligheid van botulinetoxine type A (Dysport) voor de behandeling van spasticiteit in de bovenste ledematen als gevolg van een beroerte. De dosis was 1000 IU verdeeld over spieren in de boven en onderarm. 27 patiënten ontvingen een eenmalige behandeling met botulinetoxine en 32 patiënten een placebo (N=59).
Patiënten met een beroerte – Spasticiteit in de onderste ledematen
Kaji (2010b) onderzocht de effectiviteit en veiligheid van eenmalige injecties met botulinetoxine type A (Botox) bij patiënten met spasticiteit in de onderste ledematen als gevolg van een beroerte. In totaal werd 300 IU geïnjecteerd met behulp van een EMG of zenuw stimulator met een EMG naald. In totaal waren 120 patiënten geïncludeerd met 58 patiënten gerandomiseerd naar de actieve arm en 62 patiënten naar de placebo arm.
Pittock et al., 2003 hadden als doel om het effect van drie verschillende doseringen van botulinetoxine (Dysport) te bepalen bij patiënten met spasticiteit in de kuit als gevolg van een beroerte. In totaal waren 234 patiënten gerandomiseerd naar 500 IU (n=59), 1000 IU (n=60), 1500 IU (n=60) of een placebo (n=55).
MS patiënten – Spasticiteit in de onderste ledematen
Gusev et al., 2008 hebben de effectiviteit van botulinetoxine type A voor de behandeling van volwassenen met heupadductie-spasticiteit als gevolg van (vermoedelijke) multiple sclerosis onderzocht. Patiënten hadden spasticiteit in beide benen. Per been was de maximale dosis 750 units botulinetoxine type A (Dysport). In totaal ontvingen 55 patiënten botulinetoxine en 51 een placebo.
Resultaten
Patiënten met een beroerte – Spasticiteit in de bovenste ledematen
1. Spiertonus
Alle acht studies bij patiënten met spasticiteit in de bovenste ledematen als gevolg van beroerte hebben de spiertonus met behulp van de (Modified) Ashworth Scale bepaald. Gracies (2015) observeerde een significante afname ten opzichte van baseline in spiertonus (MAS) op elk tijdsmoment (week één, week vier en week twaalf) in het voordeel van behandeling met botulinetoxine. Rosales (2012) rapporteerde het gemiddelde verschil tussen interventie en controle ten opzichte van baseline. Op elke tijdsmoment (week twee, vier, acht, 12 en 24) was de score in MAS met ten minste een half punt lager bij patiënten die botulinetoxine kregen vergeleken met het therapieprogramma voor de bovenste ledematen. Resultaten waren voor land en baseline scores gecorrigeerd. Ook Kaji (2010a) maten een significante afname in MAS ten opzichte van baseline op elk tijdsmoment (week vier, week acht en week twaalf). Shaw (2010) observeerde alleen een sterkere afname in MAS score na één maand. Na drie maanden en twaalf maanden werd geen verschil in afname van de MAS score ten opzichte van baseline waargenomen. Brashear (2002) liet vergelijkbare resultaten zien op week zes en week twaalf gemeten met de Ashworth Scale. Kaňovský (2009) onderzocht de spiertonus als de proportie patiënten met een afname van ten minste één punt op de Ashworth Scale per spiergroep en tijdsmoment. Behandeling met botulinetoxine voor een gebogen pols leidde op elke tijdsmoment tot een tweemaal hoger kans op een afname van ten minste één punt vergeleken met placebo (RR week 2 2,05 95%BI: 1,38 tot 3,03; RR week 4 1,85 95%BI: 1,32 tot 2,60; RR week 8 2,23 95%CI: 1,52 tot 3,27; RR week 12 1,72 95%BI: 1,06 tot 2,79). Vergelijkbare resultaten waren waar te nemen voor een gebalde vuist met een kans anderhalf maal hoger in week twaalf (RR 1,56 95%CI: 1,03 tot 2,37). McCrory (2009) observeerde dat de spasticiteit gemeten met de Modified Ashworth Scale over meerdere spiergroepen met anderhalf punten meer afnam in de groep die botulinetoxine ontving dan in de groep die placebo ontving (gemiddelde verschil in verandering ten opzichte van baseline: -1,47 95%BI: -2,10 tot -0,84). Bakheit (2001) observeerde dat de verdeling van patiënten na afname in MAS significant verschillend was tussen de botulinetoxine en placebogroep (p=0,004).
Vijf trials hebben naar de gemiddelde afname in (M)AS na 12 weken ten opzichte van baseline gemeten. Patiënten behandeld met botulinetoxine (n=444) hadden na 12 weken een 0,53 lagere (M)AS score (95%BI: -0,69 tot -0,37) vergeleken met patiënten (n=413) die een placebo of een therapieprogramma kregen (figuur 1).
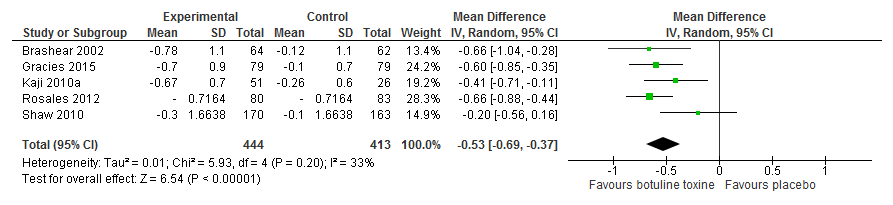
Figuur 1. Meta-analyse van botulinetoxine injecties versus placebo/therapieprogramma na 12 weken, gemiddelde score ten opzichte van baseline
Sensitiviteitsanalyse
Van de trials met minder dan 25 deelnemers per studiearm rapporteerden drie trials resultaten op de uitkomstmaat spiertonus 12 weken (Kong, 2007; . Bhakte, 2000; Hesse, 1998). Kong (2007) randomizeerde 17 patiënten over een botulinetoxine- en een placebogroep. Na twaalf weken werd er een niet significant verschil gevonden in spiertonus van de schouder en elleboog in het voordeel van de botulinetoxinegroep. Bhakta (2000) randomizeerde 40 patiënten. Er werd een niet significante afname van de spiertonus in de vingers en elleboog gevonden na twaalf weken (p=0,006 en 0,062). Hesse (1998) randomizeerde 24 patiënten naar vier groepen: A) botulinetoxine injecties; B) botulinetoxine injecties met elektrostimulatie; C) placebo; D) placebo met elektrostimulatie. Na 12 weken had groep A de grootste afname van de spiertonus zowel in de elleboog, vingers als pols. De resultaten waren niet significant verschillend.
Bovenstaande resultaten konden niet worden meegenomen in de meta-analyse over spiertonus na twaalf weken omdat de gerapporteerde effectmaten geen bruikbare spreidingsmaten kenden. De resultaten wijzen echter in dezelfde richting; botulinetoxineinjecties verlagen de spiertonus vergeleken met placebo. Daarmee versterk de sensitiviteitsanalyse het vertrouwen dat botulinetoxine injecties de spiertonus verminderd.
De trials met minder dan 25 deelnemers per studiearm onderzochten ook andere uitkomsten waaronder pijn. Echter, voor deze uitkomsten werden geen gemiddelden/medianen of spreidingsmaten gerapporteerd, maar enkel de p-waarde. De p-waarde was in alle gevallen niet significant (>0,05). Dit kan een gevolg zijn van de kleine studiegrootte. Door de afwezigheid van gemiddelden/medianen en spreidingsmaten kon dit niet verder onderzocht worden in een meta-analyse.
2. Actief en passief bereik van beweging
Gracies (2015) rapporteerde het actieve bereik van beweging van vingers, pols en elleboogflexoren. Botulinetoxine leidde tot een verbetering in actief bereik vergeleken met placebo. Rosales (2012) heeft actief of passief bereik van beweging in het ellebooggewricht en in het polsgewricht gemeten. Over het geheel genomen nam het actieve bereik van beweging toe bij het geven van botulinetoxine injecties vergeleken met placebo. Echter, de geobserveerde gemiddelde verschillen hadden een breed betrouwbaarheidsinterval. Het passieve bereik van beweging in het ellebooggewricht nam met ten minste vier graden toe twee, vier en 24 weken na het geven van botulinetoxine injecties vergeleken met placebo. In het polsgewricht werd alleen na 24 weken een toename in passief bereik van beweging geobserveerd (gemiddeld verschil: 9,40 95%BI: 2,43 tot 16,38) in het voordeel van botulinetoxine injecties. Bakheit (2001) heeft actieve of passieve bereik van beweging (Range Of Motion/ROM) gemeten in de pols, elleboog en vingers. Er was geen statistisch significant verschil waar te nemen tussen de behandelarmen. De grootte van de steekproef is op basis van een significant verschil in MAS score berekend. Mogelijk kan de power om een verschil in bereik van beweging te observeren lager dan 80% zijn. Er is een mogelijke verbetering in passieve ROM in de elleboog (gemiddelde verschil in score: 6,8 95%BI: -3,4 tot 16,9) waar te nemen. Soortgelijke resultaten zijn te observeren voor actieve en passieve ROM van de pols (actief 4,9 95%BI: -6,5 tot 16,3 en passief 8,3 95%BI: -1,6 tot 18,2) en actieve ROM in de vingers (p=0,06).
3. Pijn
Rosales (2012) maakte gebruik van de Global Pain Scale voor het beoordelen van pijn als gevolg van spasticiteit. Op elk tijdsmoment was een afname in pijnscore waargenomen in het voordeel van botulinetoxine injecties. Het verschil was na vier en 24 weken statistisch significant (week 4 gemiddeld verschil -7,87 95% BI: -13,28 tot -2,46; week 24 gemiddeld verschil -7,15 95% BI: -13,76 tot -0,54). Shaw (2010) beoordeelde pijn in de bovenste ledematen met een score van 0 tot 10. Alleen na 12 weken was de afname in pijn groter bij een behandeling met botulinetoxine injecties en een therapieprogramma vergeleken met alleen een therapieprogramma (gemiddelde verschil: -1,4 (-2,4 tot -0,3)). McCrory (2009) heeft pijn beoordeeld in de hand, pols en vingers in rust en tijdens beweging. Patiënten werd gevraagd hun pijn aan te geven op een 100mm visuele analoge schaal. Geen significant verschil was tussen de behandelarmen geobserveerd (gemiddelde afname van baseline in week acht; botulinetoxine: -9,9 (SE 5,4) en placebo: -4,9 (SE 5,8)). Bakheit (2001) rapporteerde alleen dat er geen significant verschil was waargenomen tussen behandelarmen voor pijn gemeten in de schouder, arm, pols en vingers.
4. Functionele metingen: bovenste ledematen functie, handigheid, activiteiten van dagelijks leven (ADL)
Gracies (2015) heeft de arm-handfunctie beoordeeld aan de hand van de Disability Assessment Scale (DAS). Patiënten tezamen met de behandelend arts hebben uit de domeinen met een score van twee of hoger het primaire therapeutisch doel van behandeling gekozen. Alleen na twaalf weken werd een significante afname in DAS ten opzichte van baseline gemeten bij patiënten die 1000 IU ontvingen vergeleken met placebo. DAS nam met 0,6 (SE 0,1) punten af bij patiënten die 1000 IU kregen vergeleken met 0,4 (SE 0,1) bij patiënten onder behandeling met placebo (p=0,003). Ward (2014) evalueerde het effect op actieve en passieve functionle doelen die door de patiënt en behandelaar gekozen waren met behulp van de Goal Attainment Scale GAS). De odds ratio voor het behalen van het primaire actieve doel was na twaalf weken in het voordeel van de interventiegroep, maar het verschil was niet statistisch significant (OR= 1,20; 95% BI 0,69 tot 2,10). Na 24 weken was de odds ratio 1,36 (95% BI 0,81 tot 2,29). Ook op de secundaire actieve doelen werden geen significante verschillen na twaalf 24 weken gevonden. Daarentegen werd op secundaire passieve doelen wel een significante verbetering gevonden na 24 weken in het voordeel van de botulinumtoxine met gebruikelijke zorg (60,0%) vs. de placebogroep met gebruikelijke zorg (38,6%) (odds ratio, 2,46; 95% BI 1,18-5,14). Kaji et al., 2010a hebben patiënten gevraagd om uit de DAS één domein te kiezen als het primaire therapeutisch doel van behandeling. Op elk tijdsmoment (week vier, week acht en week twaalf) werd een significante afname ten opzichte van baseline gemeten in het voordeel van botulinetoxine. In week twaalf werd een afname in score gemeten van 0,70 (SE 0,10) in de botulinetoxine arm, en in de placeboarm een afname van 0,32 (SE 0,11) (p=0,014). Ook Kaňovský (2009) heeft patiënten gevraagd om één domein uit de DAS te kiezen als het primaire therapeutisch doel van behandeling. Significante verschillen werden in week twee, vier, acht en twaalf waargenomen in het voordeel van botulinetoxine (p≤0.005). Rosales (2012) beoordeelde functionaliteit aan de hand van de Functional Motor Assessment Scale. Er was geen verschil in functionaliteit tussen botulinetoxine injecties en placebo op verschillende tijdsmomenten. Functionaliteit was gemeten als bovenarmfunctie, handbewegingen of geavanceerde handactiviteiten. Shaw (2010) heeft functionaliteit beoordeeld door middel van het meten van de Action Research Arm Test. Na drie maanden was een gemiddeld verschil tussen behandelarmen van 1,8 geobserveerd (95%BI: 0,4 tot 3,2). Er was geen verschil na één maand waargenomen en vanwege foutieve rapportage van het resultaat na 12 maanden is niet bekend wat het effect is na 12 maanden. In de studie van McCrory (2009) had patiënten die botulinetoxine kregen een sterkere toename in de score voor het behalen van individuele doelen dan patiënten in de placeboarm (gemiddelde verschil in verandering ten opzichte van baseline: 3,30 95%BI: -0,36 tot 6,80). Handbewegingen en bovenarmfunctie was gemeten met de Modified Motor Assessment Scale. Een mogelijke toename was te zien in de interventiearm van 0,32 (95%BI: -0,15 tot 0,79). Brashear (2002) mat functionele beperkingen door middel van de DAS. Op basis van deze schaal selecteerden patiënten samen met de onderzoeker welk gebied van functioneren het primaire therapeutisch doel was. Patiënten gerandomiseerd naar de actieve arm hadden in week zes een sterkere afname in score (gemiddelde verschil in verandering ten opzichte van baseline: -0,94 95%BI: -1,16 tot -0,72) dan patiënten in de placeboarm (-0,31 95%BI: -0,48 tot -0,14). Gelijkende resultaten waren waar te nemen in week twaalf. Bakheit (2001) observeerden geen verschil tussen de botulinetoxinegroep en de placebogroep in het bepalen van drie realistische functionele doelen.
Drie trials hebben passieve armhandfunctie met DAS geëvalueerd 12 weken na behandeling met botulinetoxine injecties. Patiënten behandeld met botulinetoxine (n=195) hadden na 12 weken een 0,29 lagere DAS score (95%BI: -0,46 tot -0,12) vergeleken met patiënten (n=167) die een placebo kregen (figuur 2). Omdat Kaňovský (2009) alleen rapporteerde dat verschillen in DAS score statistisch significant, was het niet mogelijk om deze data mee te wegen in de meta-analyse.
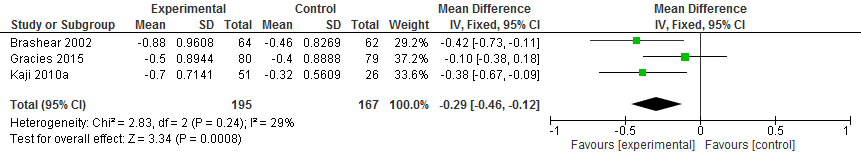
Figuur 2. Meta-analyse van botulinetoxine injecties versus placebo na 12 weken, gemiddelde score ten opzichte van baseline
5. Sociale participatie
Geen van de RCT’s rapporteerden over de uitkomstmaat sociale participatie.
Patiënten met een beroerte – Spasticiteit in de onderste ledematen
1. Spiertonus
Kaji (2010b) observeerde een significante afname in de Modified Ashworth Scale ten opzichte van baseline in week vier (p<0,001) en acht (p<0,001) bij patiënten die botulinetoxine kregen, maar niet in week 12 (p=0,240). Pittock (2003) observeerde een verschil in spiertonus gemeten met de Modified Ashworth Scale. Een verbetering in spiertonus werd bij een groter aantal patiënten waargenomen dat botulinetoxine ontving dan bij een placebogroep in week vier (p=0,003) en week acht (p=0,006), maar niet in week twaalf (p=0,249).
2. Actief en passief bereik van beweging
Pittock (2003) rapporteerde dat er geen statistisch significant verschil was gevonden in actief bereik van beweging tussen de groepen.
3. Pijn
Pittock (2003) heeft pijn door middel van een subjectieve assessment gemeten. Het resultaat was aangegeven op een vier puntenschaal van nul (geen pijn) tot drie (enorme pijn). De score liet geen verschil tussen de groepen zien (p>0,05).
4. Functionele metingen: onderste ledematen functie, handigheid, activiteiten van dagelijks leven (ADL)
Ward (2014) evalueerde het effect op actieve en passieve functionele doelen die door de patiënt en behandelaar gekozen waren met behulp van de Goal Attainment Scale GAS). Een subgroepanalyse werd uitgevoerd voor patiënten met spasticiteit van de enkel plantairflexoren. Hierbij bleek dat het bereiken van het primaire actieve doel in de interventiegroep significant beter was dan in de controlegroep (p=0,03). Het is onduidelijk of er nog andere subgroepen geanalyseerd zijn.
oor het meten van de snelheid over tien meter. Geen verschil in resultaten was waarneembaar. De globale impressie van functionaliteit was bepaald met behulp van een Numeric Rating Scale door de onderzoeker, patiënt en therapeut. Alleen de onderzoeker observeerde een verbetering in de functionaliteit in week vier (p=0,048) en week acht (p=0,016) bij patiënten die botulinetoxine kregen. Pittock (2003) observeerde geen verschil in resultaten tussen de groepen in de uitkomstmaten twee minuten looptest, staplengte, aantal stappen per min, en Rivermead Motor Assessment.
5. Sociale participatie
Geen van de RCT’s rapporteerden over de uitkomstmaat sociale participatie.
MS patiënten – Spasticiteit in de onderste ledematen
1. Spiertonus
Gusev (2008) observeerde geen statistisch significant verschil in verbetering van ten minste één punt in de Modified Ashworth Scale tussen de groepen.
Sensitiviteitsanalyse
Snow (1990) rapporteerde het effect van botulinetoxine injectie op spiertonus met een niet gevalideerde score. Patiënten in de botulinetoxinegroep hadden verbetering in spiertonus ten opzichte van baseline, terwijl patiënten in de placebogroep geen verbetering lieten zien (p=0,009). Het is echter de vraag of deze resultaten van een niet-gevalideerde score naast de resultaten van Gusey (2008) gezet kunnen worden.
2. Actief en passief bereik van beweging
Deze uitkomstmaat was niet gerapporteerd in Gusev (2008).
3. Pijn
Gusev (2008) maten pijn in het bovenbeen aan de hand van een vier-puntsschaal. In zowel week 8 als week 12 rapporteerden patiënten in de botulinetoxinegroep een sterkere verbetering in pijn vergeleken met patiënten in de placebogroep.
4. Functionele metingen: onderste ledematen functie, handigheid, activiteiten van dagelijks leven (ADL)
Functionaliteit was gemeten aan de hand van het stellen van een primair therapeutisch doel. Er was geen verschil in verbetering waargenomen tussen behandelarmen (p>0,05).
5. Sociale participatie
Deze uitkomstmaat was niet gerapporteerd in Gusev (2008).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaten actief of passief bereik van beweging, pijn en bijwerkingen, gemeten in patiënten met een beroerte, zijn met twee of drie niveaus verlaagd gezien inconsistentie en imprecisie. De bewijskracht voor de uitkomstmaat functionele metingen, gemeten in patiënten met spasticiteit in de bovenste ledematen als gevolg van een beroerte, is met één niveau verlaagd gezien imprecisie. De bewijskracht voor de uitkomstmaat functionele metingen, gemeten in patiënten met spasticiteit in de onderste ledematen als gevolg van een beroerte, is met drie niveaus verlaagd gezien inconsistentie en imprecisie. In de studie van Ward was mogelijk sprake van selectieve uitkomstrapportage: slechts één niet a-priori gespecificeerde subroep werd gepresenteerd. Ook werd de aangekondigde uitkomst over kosten(effectiviteit) niet gerapporteerd.
De bewijskracht voor de effecten van botulinebehandeling bij MS patiënten op spiertonus en pijn is met drie niveaus verlaagd gezien inconsistente resultaten en imprecisie (slechts één studie).
Vraag 2 Optimale dosering van botulinetoxine
Beschrijving studies
Spasticiteit in de bovenste ledematen
Gracies (2015) beoordeelde het effect van botulinetoxine injecties in spieren van de bovenste ledematen op spiertonus, actieve beweging en functionele metingen. 238 patiënten met spasticiteit in de bovenste ledematen als gevolg van een beroerte of traumatisch hersenletsel waren geïncludeerd. 80 patiënten ontvingen 500 IU in buigspieren van de elleboog, pols of vingers, 79 patiënten kregen 1000 IU geïnjecteerd en 79 patiënten hebben een placebo gekregen. Spieren werden door middel van elektrostimulatie gelokaliseerd.
Spasticiteit in de onderste ledematen
Pittock (2003) had als doel om het effect van drie verschillende doseringen van abobotulinetoxine (Dysport) bij patiënten met spasticiteit in de kuit als gevolg van een beroerte te onderzoeken. De belangrijkste uitkomstmaat was het effect op lopen, gemeten met behulp van een twee minuten looptest, lengte van de stap, en het aantal stappen per min. In totaal waren 234 patiënten gerandomiseerd naar 500 IU (n=59), 1000 IU (n=60), 1500 IU (n=60) en een placebo (n=55).
Resultaten
Spasticiteit in de bovenste ledematen
Gracies (2015) heeft de spiertonus bepaald met behulp van de (Modified) Ashworth Scale en observeerden een significante afname ten opzichte van baseline in spiertonus (MAS) op elk tijdsmoment (week één, vier en twaalf) in het voordeel van behandeling met botulinetoxine. Er was geen verschil in afname van baseline in MAS tussen de twee doseringen (p>0,05).
Gracies (2015) rapporteerde het actieve bereik van beweging van vingers, pols en elleboogflexoren. Botulinetoxine in een dosering van 1000 U leidde tot een verbetering in actief bereik vergeleken met placebo. Botulinetoxine in een dosering van 500 U had alleen een verbetering in actieve bereik van beweging in vingers tot gevolg.
Gracies (2015) heeft de arm-handfunctie beoordeeld aan de hand van de Disability Assessment Scale (DAS). Patiënten tezamen met de behandelend arts hebben uit de domein met een score van twee of hoger het principiële therapeutisch doel van behandeling gekozen. Alleen na twaalf weken was een significante afname in DAS ten opzichte van baseline gemeten in patiënten die 1000 IU ontvingen vergeleken met placebo. DAS nam met 0,6 (SE 0,1) punten af in patiënten die 1000 IU kregen vergeleken met 0,4 (SE 0,1) in patiënten onder placebo behandeling (p=0,003).
Spasticiteit in de onderste ledematen
Pittock (2003) observeerde geen verschil tussen de verschillende doseringen in resultaten van een twee min looptest, lengte van de stap of het aantal stappen per min. Er was ook geen verschil in uitkomstmaten River Motor Assessment, actief en passief bereik van beweging, pijn of globale bepaling van profijt waargenomen. Het effect op spiertonus, gemeten met de Modified Ashworth Scale, was het grootst in de groep die 1500 IU kregen in week vier, acht en twaalf. Voor de doseringen 500 IU en 1000 IU was alleen een verbetering in spiertonus in week vier waarneembaar.
Bewijskracht van de literatuur
De bewijskracht voor de gemeten uitkomstmaten is met drie niveaus verlaagd gezien imprecisie (beperkt aantal studies).
Vraag 3 Optimaal frequentieschema van botulinetoxine
Geen studies hebben verschillende frequentie schema’s met elkaar vergeleken.
Vraag 4 Geschikt oplossingsvolume voor het injecteren
Beschrijving studies
Spasticiteit in de bovenste ledematen
Barnes 2010 bekeek de effectiviteit en veiligheid van twee oplossingen van botulinetoxine injecties (Xeomin) bij patiënten met spasticiteit in de bovenste ledematen. Het merendeel van patiënten had spasticiteit ten gevolge van een beroerte of traumatische hersenletsel. Drie patiënten met cerebrale parese waren ook geïncludeerd. De aanbevolen maximale dosering was 400 units (mediaan gegeven dosering was 300 units). In totaal waren 192 patiënten geïncludeerd met 97 patiënten gerandomiseerd naar de arm met hoog volume (20 U/ml) en 95 naar laag volume (50 U/ml). De drie patiënten met cerebrale parese zaten in de hoog volume groep.
Resultaten
Spasticiteit in de bovenste ledematen
Barnes (2010) vond geen verschil in het effect van toediening van verschillende volumes van botulinetoxine op functionele metingen. Verbetering in functionaliteit (gemeten met de Disability Assessment Scale) werd geobserveerd door onderzoekers in 51 (63%) patiënten die een hoog volume kregen en in 44 (52%) met een laag volume (percentueel verschil 10,6 %, 95%BI; -4,4 tot 24,9). In totaal had 8,3% in hoog volume arm en 10,4% in laag volume arm een behandeling gerelateerde bijwerkingen (zoals injectie plaats gerelateerd hematoom of pijn, spierzwakte, misselijkheid of een hematoom) gekregen. Verder zijn de uitkomstmaten spiertonus en behandelrespons niet per behandelarm besproken.
Sensiiviteitsanalyse
Francisco (2002) onderzocht het verschil in volume van toediening van botulinetoxine bij patiënten met spasticiteit in de bovenste ledematen als gevolg van een beroerte. Er was geen verschil in spiertonus (MAS in de pols) geobserveerd. De spiertonus in vingerflexoren was mogelijk verbeterd in het voordeel van een hoog volume. Het is daarmee onduidelijk of het volume bij toediening effect heeft op spiertonus.
Bewijskracht van de literatuur
De bewijskracht voor de gemeten uitkomstmaten is met drie niveaus verlaagd gezien de imprecisie (slechts één studie).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende wetenschappelijke vraagstelling(en):
1. Wat zijn de effecten van intramusculaire injecties met botulinetoxine vergeleken met placebo voor de behandeling van spinale of cerebrale spasticiteit bij volwassenen?
P: Volwassen patiënten met spinale of cerebrale spasticiteit (spasticiteit na traumatische hersenletsel of cerebrovasculaire aandoening) of MS patiënten met spasticiteit;
I: Intramusculaire injecties met botulinetoxine, mogelijk als onderdeel van een meer complexe behandeling;
C: Placebo injecties of andere (actieve) interventie;
O: Spiertonus, spiersterkte, actief en passief bereik van beweging, pijn; functionele metingen van balans, lopen, arm-handfunctie, handigheid, activiteiten van dagelijks leven (ADL); sociale participatie.
2. Welke dosering van intramusculaire injecties met botulinetoxine is optimaal voor de behandeling van cerebrale of spinale spasticiteit bij volwassenen?
P: Volwassen patiënten met spinale of cerebrale spasticiteit (spasticiteit na traumatische hersenletsel of cerebrovasculaire aandoening) of MS patiënten met spasticiteit;
I: Dosis A van intramusculaire injecties met botulinetoxine;
C: Dosis B van intramusculaire injecties met botulinetoxine;
of
I1: Dosis A van intramusculaire injecties met botulinetoxine;
I2: Dosis B van intramusculaire injecties met botulinetoxine;
C: Placebo;
O: Spiertonus, spiersterkte, actief en passief bereik van beweging, pijn; functionele metingen van balans, lopen, arm-handfunctie, handigheid, activiteiten van dagelijks leven (ADL); sociale participatie.
3. Welke frequentie van intramusculaire injecties met botulinetoxine is optimaal voor de behandeling van cerebrale of spinale spasticiteit bij volwassenen?
P: Volwassen patiënten met spinale of cerebrale spasticiteit (spasticiteit na traumatische hersenletsel of cerebrovasculaire aandoening) of MS patiënten met spasticiteit;
I: Frequentieschema A van intramusculaire injecties met botulinetoxine;
C: Frequentieschema B van intramusculaire injecties met botulinetoxine;
O: Spiertonus, spiersterkte, actief en passief bereik van beweging, pijn; functionele metingen van balans, lopen, arm-handfunctie, handigheid, activiteiten van dagelijks leven (ADL); sociale participatie.
4. Wat is het meeste geschikte oplossingsvolume van botulinetoxine voor intramusculaire injecties voor de behandeling van cerebrale of spinale spasticiteit bij volwassenen?
P: Volwassen patiënten met spinale of cerebrale spasticiteit (spasticiteit na traumatische hersenletsel of cerebrovasculaire aandoening) of MS patiënten met spasticiteit;
I: Intramusculaire injecties met botulinetoxine in hoog volume oplossing;
C: Intramusculaire injecties met botulinetoxine in laag volume oplossing;
O: Spiertonus, spiersterkte, actief en passief bereik van beweging, pijn; functionele metingen van balans, lopen, arm-handfunctie, handigheid, activiteiten van dagelijks leven (ADL); sociale participatie.
Relevante uitkomstmaten
De werkgroep achtte uitkomstmaten spiertonus, spiersterkte, actief en passief bereik van beweging en pijn voor de besluitvorming kritieke uitkomstmaten; en functionele metingen van balans, lopen, arm-handfunctie, handigheid en activiteiten van dagelijks leven (ADL) voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Zoeken en selecteren (Methode)
In de databases Medline (OVID) en Embase is met relevante zoektermen gezocht naar systematische reviews en gerandomiseerde trials (RCT’s). De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 279 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: systematische review (gezocht in ten minste twee databases met een objectieve en transparante zoekstrategie, data extractie en methodologische beoordeling) of kwalitatief goed uitgevoerde gerandomiseerde trials bij deelnemers met spinale of cerebrale spasticiteit onder behandeling met botulinetoxine injecties vergeleken met elke andere interventie. De kwaliteit van de trials werd beoordeeld aan de hand van een Risk of Bias tool zoals gedefinieerd door de Cochrane Collaboration met als extra toevoeging een minimaal aantal van 25 deelnemers per studiearm. Op basis van titel en abstract werden in eerste instantie 71 studies voorgeselecteerd. Na raadpleging van de volledige tekst en kwaliteit van RCT’s, werden vervolgens 58 studies geëxcludeerd (zie exclusietabel), en dertien studies definitief geselecteerd. Twaalf studies hebben patiënten met een beroerte geïncludeerd en één studie MS patiënten. Vanwege de heterogeniteit in uitkomstmaten, spasticiteit en dosering van botulinetoxine is het niet mogelijk om de resultaten te poolen, behalve voor de uitkomst spiertonus bij patiënten met spasticiteit in de bovenste ledematen. Voor de rest van de uitkomsten worden de geïncludeerde studies afzonderlijk besproken.
Als sensitiviteitsanalyse zijn ook data van kleine trials (minder dan 25 deelnemers per arm) met laag risico op bias geïncludeerd. In totaal werden acht kleine trials meegenomen in deze analyse; zeven trials includeerden patiënten met een beroerte en spasticiteit in de bovenste ledematen en één trial includeerde MS patiënten met spasticiteit in de onderste ledematen (Bakheit, 2000; Bhakta, 2000; Francisco, 2002; Gracies, 2014; Hesse, 1998; Kong, 2007; Marciniak, 2012; Snow, 1990).
(Resultaten)
Geen systematische review voldeed aan de selectiecriteria. Twaalf RCT’s voldeden aan de inclusiecrietria en zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De evidencetabellen en beoordeling van individuele studiekwaliteit zijn opgenomen onder het tabblad Onderbouwing.
Referenties
- Bakheit AM, Pittock S, Moore AP, et al. A randomized, double-blind, placebo-controlled study of the efficacy and safety of botulinum toxin type A in upper limb spasticity in patients with stroke. European Journal of Neurology. 2001;8(6):559-65.
- Bakheit AM, Thilmann AF, Ward AB, Poewe W, Wissel J, Muller J, Benecke R, Collin C, Muller F, Ward CD, Neumann C. A randomized, double-blind, placebo-controlled, dose-ranging study to compare the efficacy and safety of three doses of botulinum toxin type A (Dysport) with placebo in upper limb spasticity after stroke. Stroke. 2000 Oct;31(10):2402-6. PubMed PMID: 11022071.
- Barnes M, Schnitzler A, Medeiros L, et al. Efficacy and safety of NT 201 for upper limb spasticity of various etiologies--a randomized parallel-group study. Acta Neurologica Scandinavica. 2010;122(4):295-302.
- Bhakta BB, Cozens JA, Chamberlain MA, Bamford JM. Impact of botulinum toxin type A on disability and carer burden due to arm spasticity after stroke: a randomised double blind placebo controlled trial. J Neurol Neurosurg Psychiatry. 2000 Aug;69(2):217-21. Erratum in: J Neurol Neurosurg Psychiatry 2001 Jun;70(6):821. PubMed PMID: 10896696; PubMed Central PMCID: PMC1737061.
- Brashear A, Gordon MF, Elovic E, et al. Intramuscular injection of botulinum toxin for the treatment of wrist and finger spasticity after a stroke. New England Journal of Medicine. 2002;347(6):395-400.
- Caleo M, Schiavo G. Central effects of tetanus and botulinum neurotoxins. Toxicon. 2009a;54(5):593-9.
- Caleo M, Antonucci F, Restani L, et al. A reappraisal of the central effects of botulinum neurotoxin type A: by what mechanism? J Neurochem. 2009b;109(1):15-24.
- Francisco GE, Boake C, Vaughn A. Botulinum toxin in upper limb spasticity after acquired brain injury: a randomized trial comparing dilution techniques. Am J Phys Med Rehabil. 2002 May;81(5):355-63. PubMed PMID: 11964576.
- Gracies JM, Brashear A, Jech R, et al. Safety and efficacy of abobotulinumtoxinA for hemiparesis in adults with upper limb spasticity after stroke or traumatic brain injury: a double-blind randomised controlled trial. Lancet Neurology. 2015;14(10):992-1001.
- Gracies JM, Bayle N, Goldberg S, Simpson DM. Botulinum toxin type B in the spastic arm: a randomized, double-blind, placebo-controlled, preliminary study. Arch Phys Med Rehabil. 2014 Jul;95(7):1303-11. doi: 10.1016/j.apmr.2014.03.016. Epub 2014 Apr 4. PubMed PMID: 24709034
- Gusev YI, Banach M, Simonow A, et al. Efficacy and safety of botulinum type a toxin in adductor spasticity due to multiple sclerosis. Journal of Musculoskeletal Pain. 2008;16(3):175-88.
- Hesse S, Reiter F, Konrad M, Jahnke MT. Botulinum toxin type A and short-term electrical stimulation in the treatment of upper limb flexor spasticity after stroke: a randomized, double-blind, placebo-controlled trial. Clin Rehabil. 1998 Oct;12(5):381-8. PubMed PMID: 9796928.
- Kaji R, Osako Y, Suyama K, et al. Botulinum toxin type A in post-stroke upper limb spasticity. Current Medical Research & Opinion. 2010a;26(8):1983-92.
- Kaji R, Osako Y, Suyama K, et al. Botulinum toxin type A in post-stroke lower limb spasticity: A multicenter, double-blind, placebo-controlled trial. Journal of Neurology. 2010b;257(8):1330-7.
- Kanovsky P, Slawek J, Denes Z, et al. Efficacy and safety of botulinum neurotoxin NT 201 in poststroke upper limb spasticity. Clinical Neuropharmacology. 2009;32(5):259-65.
- Kong KH, Neo JJ, Chua KS. A randomized controlled study of botulinum toxin A in the treatment of hemiplegic shoulder pain associated with spasticity. Clin Rehabil. 2007 Jan;21(1):28-35. PubMed PMID: 17213238.
- Marciniak CM, Harvey RL, Gagnon CM, Duraski SA, Denby FA, McCarty S, Bravi LA, Polo KM, Fierstein KM. Does botulinum toxin type A decrease pain and lessen disability in hemiplegic survivors of stroke with shoulder pain and spasticity?: a randomized, double-blind, placebo-controlled trial. Am J Phys Med Rehabil. 2012 Dec;91(12):1007-19. doi: 10.1097/PHM.0b013e31826ecb02. PubMed PMID: 23064478
- McCrory P, Turner-Stokes L, Baguley IJ, et al. Botulinum toxin A for treatment of upper limb spasticity following stroke: a multi-centre randomized placebo-controlled study of the effects on quality of life and other person-centred outcomes. Journal of Rehabilitation Medicine. 2009;41(7):536-44.
- Oh HM, Chung ME. Botulinum Toxin for Neuropathic Pain: A Review of the Literature. Toxins (Basel). 2015;7(8):3127-54.
- Pavone F, Luvisetto S. Botulinum neurotoxin for pain management: insights from animal models. Toxins (Basel). 2010;2(12):2890-913.
- Pittock SJ, Moore AP, Hardiman O, et al. A double-blind randomised placebo-controlled evaluation of three doses of botulinum toxin type A (Dysport) in the treatment of spastic equinovarus deformity after stroke. Cerebrovascular Diseases. 2003;15(4):289-300.
- Rosales RL, Kong KH, Goh KJ, et al. Botulinum toxin injection for hypertonicity of the upper extremity within 12 weeks after stroke: a randomized controlled trial. Neurorehabilitation & Neural Repair. 2012;26(7):812-21.
- Shaw L, Rodgers H, Price C, et al. BoTULS: a multicentre randomised controlled trial to evaluate the clinical effectiveness and cost-effectiveness of treating upper limb spasticity due to stroke with botulinum toxin type A. Health Technology Assessment (Winchester, England). 2010;14(26):1-113, iii-iv.
- Snow BJ, Tsui JK, Bhatt MH, Varelas M, Hashimoto SA, Calne DB. Treatment of spasticity with botulinum toxin: a double-blind study. Ann Neurol. 1990 Oct;28(4):512-5. PubMed PMID: 2252363
- Wissel J, Ward AB, Erztgaard P, et al. European consensus table on the use of botulinum toxin type A in adult spasticity. J Rehabil Med. 2009;41(1):13-25. doi: 10.2340/16501977-0303. PubMed PMID: 19197564.
- Ward AB, Wissel J, Borg J, Ertzgaard P, Herrmann C, Kulkarni J, Lindgren K, Reuter I, Sakel M, Säterö P, Sharma S, Wein T, Wright N, Fulford-Smith A; BEST Study Group. Functional goal achievement in post-stroke spasticity patients: the BOTOX® Economic Spasticity Trial (BEST). J Rehabil Med. 2014 Jun;46(6):504-13. doi: 10.2340/16501977-1817. PubMed PMID: 24715249
Evidence tabellen
Research question: Botulinum toxin versus placebo
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
STROKE PATIENTS |
|||||||
|
UPPER LIMB SPASTICITY |
|||||||
|
Gracies, 2015 |
Type of study: Randomized controlled trial
Setting: 34 neurology or rehabilitation clinics in Europe and the USA
Country: Belgium, Czech Republic, France, Hungary, Italy, Poland, Russia, Slovakia, and the USA
Source of funding: Commercial
|
Inclusion criteria:
Exclusion criteria:
N total at baseline: I1: 80 I2: 79 C: 79
Important prognostic factors2: Mean age (SD): I1: 52 (13) I2: 52 (14) C: 52 (14)
Sex: I1: 65% M I2: 66% M C: 62% M
Groups comparable at baseline? Yes
|
AbobotulinumtoxinA (Dysport)
A single injection session of 500 IU or 1000 IU into the most hypertonic muscle group among the elbow, wrist, or finger flexors, and into at least two additional muscle groups from the elbow, wrist, or finger flexors or shoulder extensors. The only accepted technique for targeting the muscle was electrical stimulation |
Placebo |
Length of follow-up: 12 weeks
Loss-to-follow-up: I1: N = 3 (4%) Reasons: 1 adverse event; 1 moved out of the study area; 1 family reason I2: N = 4 (5%) Reasons: 1 adverse event; 2 consent withdrawn; 1 non-compliance C: N = 7 (9%) Reasons: 3 adverse events; 1 consent violation; 2 protocol violations; 1 lost to follow-up
Incomplete outcome data: I1: N = 1 (1%) Reasons: no baseline or week 4 MAS score I2: N = 2 (2%) Reasons: no baseline or week 4 MAS score C: N = 2 (2%) Reasons: no baseline or week 4 MAS score |
Muscle tone Measured as the change from baseline in MAS, mean (SE)
Baseline I1: 3.9 (SD 0.5) I2: 3.9 (SD 0.4) C: 3.9 (SD 0.4) Week 1 I1: -0.9 (0.1) I2: -0.7 (0.1) C: -0.2 (0.1) p<0.0001 compared with placebo Week 4 I1: -1.2 (0.1) I2: -1.4 (0.1) C: -0.3 (0.1) p<0.0001 compared with placebo Week 12 I1: -0.6 (0.1) I2: -0.7 (0.1) C: -0.1 (0.1) p<0.0001 compared with placebo
Range of Motion
“Active range of motion improved for movements opposing finger, wrist, and elbow flexors in the abobotulinumtoxinA 1000 U group but only for finger flexors in the 500 U group.”
Physician Global Assessment Measured on a 9-point scale from -4 (markedly worse) to 4 (markedly improved), mean (SE)
Week 4 I1: 1.4 (0.1) I2: 1.8 (0.1) C: 0.6 (0.1) p<0.0003 compared with placebo Week 12 I1: 0.5 (0.1) I2: 0.9 (0.1) C: 0.5 (0.1) p=0.001 for I2 compared with placebo
Functional disability Measured with Disability Assessment Scale (DAS), improvement in principal therapeutic target from baseline, mean (SE)
Baseline I1: 2.6 (SD 0.5) I2: 2.5 (SD 0.5) C: 2.6 (SD 0.5) Week 1 I1: -0.4 (0.1) I2: -0.4 (0.1) C: -0.4 (0.1) p>0.05 compared with placebo Week 4 I1: -0.7 (0.1) I2: -0.7 (0.1) C: -0.5 (0.1) p>0.05 compared with placebo Week 12 I1: -0.5 (0.1) I2: -0.6 (0.1) C: -0.4 (0.1) p=0.003 for I2 compared with placebo
Safety Treatment- related adverse event, n (%)
I1: 6 (7%) I2: 7 (9%) C: 2 (2%)
|
Authors’ conclusions: AbobotulinumtoxinA at doses of 500 IU or 1000 IU injected into upper limb muscles provided tone reduction and clinical benefit in hemiparesis. Future research into the treatment of spastic paresis with botulinum toxin should use active movement and function as primary outcome measures.
Adverse event: The most common treatment-emergent adverse event was nasopharyngitis and the most common treatment-related adverse event was muscular weakness (two cases in the 500 IU group and four cases in the 1000 IU group). Other treatment-related adverse events included asthenia (one case in the 500 IU group) and injection site erythema (one case in the 1000 IU group). |
|
Rosales, 2012 |
Type of study: Randomized controlled trial
Setting: 5 neurological and rehabilitation units
Country: Hong Kong, Malaysia, the Philippines, Singapore, Thailand
Source of funding: Commercial
|
Inclusion criteria:
Exclusion criteria:
N total at baseline: I: 80 C: 83
Important prognostic factors2: Mean age (range): I: 55 (23-79) C: 54 (17-79)
Sex: I: 68% M C: 66% M
Groups comparable at baseline? Yes
|
500 U of botulinum neurotoxin type A (Dysport)
The recommended dose distribution was 2 injections of 200 U in a 1 mL volume for the biceps brachii, 1 injection of 100 U in a 0.5 mL volume in the brachioradialis, 1 injection of 100 U in a 0.5 mL volume in the flexor carpi ulnaris, and 1 injection of 100 U in a 0.5 mL volume in the flexor carpi radialis.
Investigators were permitted to adjust the dose per targeted muscle, depending on the level of hypertonicity, as long as the total dosage per patient was 500 U.
|
Placebo (visually identical) |
Length of follow-up: 24 weeks
Loss-to-follow-up: I: N = 4 (5%) Reasons: 2 lost to follow-up; 2 died C: N = 3 (9%) Reasons: 2 lost to follow-up; 1 died
Incomplete outcome data: I: N = 4 (5%) Reasons: 2 lost to follow-up; 2 died C: N = 3 (9%) Reasons: 2 lost to follow-up; 1 died
|
Muscle tone Measured as the change from baseline in MAS in the most affected joint, mean difference (95%CI) adjusted for country and baseline MAS score
Week 2 MD: -0.66 (-0.84 to -0.49) Week 4 MD: -0.67 (-0.88 to -0.47) Week 8 MD: -0.60 (-0.82 to -0.39) Week 12 MD: -0.66 (-0.88 to -0.43) Week 24 MD: -0.54 (-0.79 to -0.30)
Hand movements and upper arm function Measured as the change from baseline in the Functional Motor Assessment Scale, mean difference (95%CI) adjusted for baseline score
Upper-arm function Week 2 MD: 0.07 (-0.25 to 0.39) Week 4 MD: 0.08 (-0.29 to 0.44) Week 8 MD: -0.18 (-0.54 to 0.19) Week 12 MD: -0.23 (-0.64 to 0.18) Week 24 MD: -0.30 (-0.75 to 0.15)
Hand movements Week 2 MD: 0.27 (-0.18 to 0.65) Week 4 MD: 0.26 (-0.16 to 0.69) Week 8 MD: 0.20 (-0.27 to 0.67) Week 12 MD: 0.33 (-0.14 to 0.79) Week 24 MD: 0.23 (-0.27 to 0.74)
Advanced hand activities Week 2 MD: -0.18 (-0.44 to 0.07) Week 4 MD: -0.34 (-0.73 to 0.04) Week 8 MD: -0.42 (-0.87 to 0.04) Week 12 MD: -0.24 (-0.72 to 0.23) Week 24 MD: -0.36 (-0.85 to 0.14)
Pain Measured as the change from baseline in the Global Pain Scale, mean difference (95%CI) adjusted for baseline scores
Week 2 MD: -3.50 (-9.43 to 2.43) Week 4 MD: -7.87 (-13.28 to -2.46) Week 8 MD: -5.84 (-12.61 to 0.94) Week 12 MD: -5.93 (-12.63 to 0.77) Week 24 MD: -7.15 (-13.76 to -0.54)
ROM Measured as voluntary and passive joint range of motion, mean difference (95%CI) adjusted for baseline score Elbow Week 2 Active: 2.80 (-3.98 to 9.58) Passive: 4.07 (1.55 to 6.59) Week 4 Active: 5.16 (-1.94 to 12.25) Passive: 4.67 (1.13 to 8.22) Week 8 Active: 3.78 (-4.29 to 11.85) Passive: 2.86 (-1.24 to 6.97) Week 12 Active: 5.06 (-3.05 to 13.18) Passive: 2.14 (-2.15 to 6.42) Week 24 Active: 5.23 (-2.87 to 13.34) Passive: 4.52 (1.13 to 7.90)
Wrist Week 2 Active: 0.34 (-5.50 to 6.19) Passive: 2.78 (-4.19 to 9.75) Week 4 Active: 0.71 (-5.45 to 6.88) Passive: 7.31 (0.68 to 13.94) Week 8 Active: 3.21 (-3.48 to 9.90) Passive: 6.08 (-0.18 to 12.34) Week 12 Active: 3.80 (-3.77 to 11.36) Passive: 6.43 (-0.74 to 13.59) Week 24 Active: 2.73 (-6.31 to 11.77) Passive: 9.40 (2.43 to 16.38)
Safety A total of 84 adverse events were reported: 31 serious and 53 nonserious. There was o clinically relevant difference in the distribution of adverse events (36 [43%] in the placebo group and 48 [57%] in the BoNT-A group) or of serious adverse events (13 [15%] in the placebo group and 18 [21%] in the BoNT-A group).
|
The sponsor, Ipsen Pharma, provided logistical support, study drugs, support for investigator meetings, central statistical support, and data analysis.
No additional antispasticity medication was permitted after entry. All patients continued with their standard rehabilitation programs throughout the study, as deemed suitable by the attending physician. |
|
Kaji, 2010a |
Type of study: Randomized controlled trial
Setting: Patients with focal spasticity of the wrist and fingers after stroke from 19 national institutions
Country: Japan
Source of funding: Commercial |
Inclusion criteria:
Exclusion criteria:
N total at baseline: I: 51 C: 26
Important prognostic factors2: Mean age (SD): I: 63 (9) C: 63 (11)
Sex: I: 71% M C: 54% M
Groups comparable at baseline? Yes, except sex
|
Single set of intramuscular injections with botulinum toxin type A (Botox) with a total dose of 200 U
The following muscles were injected: flexor carpi radialis, flexor carpi ulnaris, flexor digitorum profundus and flexor digitorum superficialis. Patients with thumb spasticity (MAS >2) were additional injected with a total dose of 40 U in the flexor pollicis longus and adductor pollicis.
An electromyography (EMG) or a nerve stimulator, and an EMG injection needle were used to identify proper muscles and facilitate injection in all patients. |
Placebo (visually identical) |
Length of follow-up: 12 weeks
Loss-to-follow-up: I: N = 4 (8%) Reasons: 1 subject’s request, 3 adverse event C: N = 1 (4%) Reasons: 1 adverse event
Incomplete outcome data: Week 4 I: N = 0 (0%) C: N = 0 (0%) Week 8 I: N = 3 (6%) C: N = 2 (8%) Week 12 I: N = 4 (8%) C: N = 1 (4%) Reasons unclear at each time point |
Muscle tone: Measured with the MAS, mean change from baseline (SE)
Wrist Baseline I: 3.31 (SD 0.47) C: 3.18 (SD 0.40) Week 4 I: -1.05 (0.13) C: -0.48 (0.13) P=0.006 Week 8 I: -1.01 (0.14) C: -0.35 (0.12) P=0.002 Week 12 I: -0.83 (0.12) C: -0.20 (0.08) P<0.001
Fingers Baseline I: 3.08 (SD 0.66) C: 3.09 (SD 0.54) Week 4 I: -0.92 (0.11) C: -0.37 (0.13) P=0.003 Week 8 I: -0.86 (0.11) C: -0.35 (0.16) P=0.004 Week 12 I: -0.67 (0.10) C: -0.26 (0.12) P=0.016
Functional disability Measured with Disability Assessment Scale (DAS), improvement in principal therapeutic target from baseline, mean change from baseline (SE)
Baseline I: 2.24 (SD 0.71) C: 2.27 (SD 0.47) Week 4 I: -0.82 (0.11) C: -0.31 (0.12) P=0.002 Week 8 I: -0.79 (0.11) C: -0.38 (0.13) P=0.018 Week 12 I: -0.70 (0.10) C: -0.32 (0.11) P=0.014
Clinical global impression (CGI): Measured by Numeric Rating Scale, mean change (SE) from baseline
Investigator Baseline I: -1.29 (SD 1.51) C: -3.00 (SD 0.89) Week 4 I: 1.80 (0.20) C: 0.50 (0.23) P<0.001 Week 8 I: 1.33 (0.28) C: 0.42 (0.23) P=0.003 Week 12 I: 0.94 (0.28) C: 0.32 (0.22) P=0.032
Patient Baseline I: -1.43 (SD 1.97) C: -1.55 (SD 2.07) Week 4 I: 1.53 (0.25) C: 0.65 (0.38) P=0.043 Week 8 I: 1.52 (0.23) C: 0.54 (0.27) P=0.006 Week 12 I: 1.32 (0.25) C: 0.92 (0.39) P=0.096
Physical/occupational therapist Baseline I: -1.27 (SD 1.74) C: -2.64 (SD 1.03) Week 4 I: 1.08 (0.21) C: 0.62 (0.24) P=0.122 Week 8 I: 0.98 (0.21) C: 0.63 (0.20) P=0.348 Week 12 I: 0.74 (0.21) C: 0.64 (0.20) P=0.961
Safety Reported as investigator-determined treatment-related adverse events
I: 2 (4%) C: 2 (8%)
|
Authors’ conclusions: BoNTA reduced spasticity in upper limb muscles and improved ADL performance in terms of limb position and dressing. BoNTA is safe and effective in the treatment of post-stroke upper limb spasticity.
Comment: Role of the sponsor is unclear. Majority of authors are employed by the sponsor |
|
Shaw, 2010 |
Type of study: Randomized controlled trial
Setting: Twelve stroke services
Country: United Kingdom
Source of funding: Commercial
|
Inclusion criteria:
Scale19 > 2 at the elbow and/or spasticity at the hand, wrist or shoulder (there is no validated measure of spasticity at these sites)]
Exclusion criteria:
N total at baseline: I: 170 C: 163
Important prognostic factors2: Median age (IQR): I: 67 (58 to 74) C: 66 (59 to 72)
Sex: I: 65% M C: 71% M
Groups comparable at baseline? Yes
|
Botulinum toxin type A (Dysport) and 4-week upper limb therapy program (1 hour twice per week provided by study therapist).
Dysport is available as a white lyophilised powder for reconstitution containing 500 units of C. botulinum type A toxin– haemagglutinin complex together with 125 μg of a 20% albumin solution and 2.5 mg lactose in a clear glass vial. The maximum dose of botulinum toxin that could be administered at any one time point was 1000 units.
Participants could receive further injections or therapy if required. |
4-week upper limb therapy program (1 hour twice per week provided by study therapist).
Participants could receive further therapy if required. |
Length of follow-up: N=208 (62%) followed for 12 months N=125 (38%) followed for three months
Loss-to-follow-up: At 3 months I: N = 7 (4%) Reasons: 4 withdrawn; 1 died; 2 not done C: N = 12 (7%) Reasons: 6 withdrawn; 2 died; 4 not done
Incomplete outcome data: Week 4 I: N = 0 (0%) C: N = 0 (0%) Week 8 I: N = 3 (6%) C: N = 2 (8%) Week 12 I: N = 4 (8%) C: N = 1 (4%) Reasons unclear at each time point |
Muscle tone: Measured with the MAS in the elbow, mean change from baseline (95%CI)
One month I: -0.6 (-0.8 to -0.4) C: -0.1 (-0.2 to 0.1) Difference: -0.5 (-0.8 to -0.3) Three months I: -0.3 (-0.4 to -0.1) C: -0.1 (-0.3 to 0.1) Difference: -0.2 (-0.5 to 0.1) Twelve months (n=188) I: -0.3 (-0.5 to -0.1) C: -0.2 (-0.5 to 0.1) Difference: -0.1 (-0.4 to 0.2)
Functionality Measured with grip strength, kg, mean change from baseline (95%CI)
One month I: 0.5 (0.0-1.0) C: 0.6 (0.2-1.1) Difference: -0.2 (-0.8 to 0.5) Three months I: 1.9 (1.1-2.8) C: 0.9 (0.4-1.5) Difference: 1.0 (0.0 to 2.0) Twelve months (n=189) I: 1.5 (0.7-2.4) C: 1.6 (0.7-2.6) Difference: -0.1 (-1.4 to 1.1)
Measured with ARAT, mean change from baseline (95%CI)
One month I: 2.2 (1.3-3.0) C: 1.5 (0.8-2.2) Difference: 0.7 (-0.4 to 1.8) Three months I: 3.0 (2.0-4.2) C: 1.3 (0.4-2.1) Difference: 1.8 (0.4 to 3.2) Twelve months (n=189)* I: Unclear C: Unclear Difference: Unclear
Pain Measured as upper limb pain and scored from 0 to 10, mean change from baseline (95%CI)
One month I: -1.3 (-1.9 to -0.8) C: -1.1 (-1.6 to -0.6) Difference: -0.3 (-1.0 to 0.5) Three months I: -1.6 (-2.2 to 1.1) C: -1.2 (-1.8 to -0.6) Difference: -0.4 (-1.2 to 0.3) Twelve months (n=189) I: -2.2 (-2.9 to -1.4) C: -0.8 (-1.5 to 0.1) Difference: -1.4 (-2.4 to -0.3)
Safety Indicated as serious adverse events
I: 52 (30%) C: 50 (32%) |
Authors’ conclusions: The addition of botulinum toxin type A to an upper limb therapy program to treat spasticity due to stroke did enhance improvement in muscle tone at 1 month, upper limb strength at 3 months, upper limb functional activities related to undertaking specific basic functional tasks at 1, 3 and 12 months, and upper limb pain at 12 months. Botulinum toxin was well tolerated and side effects were minor.
*Reported mean and confidence interval did not match in both control and intervention group |
|
Kanovsky, 2009 |
Type of study: Randomized controlled trial
Setting: Patients with focal spasticity of the wrist and finger flexors after stroke from 23 centres
Country: Czech Republic, Hungary, Poland
Source of funding: Commercial |
Inclusion criteria:
Exclusion criteria:
N total at baseline: I: 73 C: 75
Important prognostic factors2: Mean age (SD): I: 58 (10) C: 53 (13)
Sex: I: 62% M C: 67% M
Groups comparable at baseline? Yes
|
Single set of intramuscular injections with botulinum neurotoxin type A NT 201 (Xeomin) with a maximum dose of 400 units
Appropriate localization of the needle in the muscle targeted for treatment was assured by means of electrical stimulation or recording of electromyography signal (EMG).
Each muscle for the clinical patterns flexed wrist and clenched fist had to be treated. Other spastic muscles were treated as individually needed. |
Placebo (visually identical) |
Length of follow-up: 12 weeks
Loss-to-follow-up:
I: N = 2 (3%) Reasons: 1 consent withdrawn, 1 adverse event (paraparesis) C: N = 1 (1%) Reasons: 1 death due intracranial hematoma
Incomplete outcome data: I: N = 0 (0%) C: N = 0 (0%)
|
Muscle tone Measured as a reduction of at least 1 point of the Ashworth Scale, n %
Flexed wrist Week 2 I: 45 (62) C: 22 (30) RR 2.05, 95%CI: 1.38-3.03 Week 4 I: 50 (68) C: 27 (37) RR 1.85, 95%CI: 1.32-2.60 Week 8 I: 49 (67) C: 22 (30) RR 2.23, 95%CI: 1.52-3.27 Week 12 I: 31 (42) C: 18 (25) RR 1.72, 95%CI: 1.06-2.79
Clenched fist Week 2 I: 50 (69) C: 22 (29) RR 2.33, 95%CI: 1.59-3.43 Week 4 I: 50 (69) C: 27 (36) RR 1.90, 95%CI: 1.35-2.67 Week 8 I: 44 (60) C: 27 (36) RR 1.67, 95%CI: 1.17-2.39 Week 12 I: 35 (48) C: 23 (31) RR 1.56, 95%CI: 1.03-2.37
Functional disability Measured with Disability Assessment Scale (DAS), improvement in principal therapeutic target from baseline
Significant differences in week 2, 4, 8, and 12 were found in favor of the active arm (p≤0.005)
Impact on physical carer burden Measured with the Carer burden scale
Superiority of NT 201 over placebo was observed for the items putting the affected arm through a sleeve (P = 0.021) and for cleaning the palm of affected hand (P = 0.028) at week 4
Safety Indicated as adverse events
I: 21 (29%) C: 20 (27%) |
Authors’ conclusions: Botulinum neurotoxin led to statistically significant improvements in muscle tone and disability and was well tolerated in patients with post-stroke upper limb spasticity. During the entire treatment period, the proportion of treatment responders with improved muscle tone was consistently higher in the botulinum neurotoxin group compared with placebo for all 5-treated muscle groups (flexors of the wrist, finger, elbow, and thumb as well as forearm pronators).
Comment: Sponsor was involved in authorship of the paper. |
|
McCrory, 2009 |
Type of study: Randomized, controlled trial
Setting: Patients with upper limb spasticity after stroke from six national centres
Country: Australia
Source of funding: Commercial
|
Inclusion criteria:
Exclusion criteria:
N total at baseline: I: 54 C: 42
Important prognostic factors2: Mean age (SD): I: 59 (12) C: 58 (14)
Sex: I: 59% M C: 62% M
Groups comparable at baseline? Yes
|
Single treatment with intramuscular injection with BoNT-A (Dysport) into the principal spastic muscles of the distal upper limb (restricted to muscles acting at elbow, wrist and finger joints) with a total dose range of 750-1000 units
The selection of muscles, use of single or multiple injection sites within a given muscle, and electromyography or nerve/muscle stimulation to assist accurate placement were all at the clinicians’ discretion.
Patients received re-treatment at week 12, which was not considered in this table. |
Placebo (visually equivalent) |
Length of follow-up: 24 weeks (Follow-up till week 12 was considered for this table)
Loss-to-follow-up: Intervention: N=1 (2%) Reasons: 1 withdrew
Control: N=4 (10%) Reasons: 3 withdrew; 1 protocol violation
Incomplete outcome data: Week 8 I: N=0 C: N=3 Week 12 I: N=1 C: N=4 Reasons: 4 withdrew; 1 protocol violation
|
Pain Measured in the hand, wrist and elbow “at rest” and “on movement” using a (100-mm) visual analogue scale, mean change (SE) from baseline
Baseline I: 44.3 (6.3) C: 36.0 (5.7) P=0.34 Week 8 I: -9.9 (5.4) C: -4.9 (5.8) Mean difference: 5.07 (95%CI: -10.9 to 21.0)
Depression Measured using the Hospital Anxiety and Depression Rating Scale (HADs), mean change (SE) from baseline
Baseline I: 5.7 (0.4) C: 5.2 (0.6) P=0.48 Week 8 I: 0.0 (0.3) C: -0.3 (0.4) Mean difference: -0.3 (95%CI: -1.24 to 0.68)
Achievement of individual goals Measured using Goal Attainment Scaling (GAS), mean change (SE) from baseline
Baseline I: 28.7 (0.7) C: 29.5 (0.9) P=0.49 Week 8 I: 3.5 (1.3) C: 0.2 (1.1) Mean difference: 3.30 (95%CI: -0.36 to 6.80)
Spasticity Measured during passive range of movement at the elbow, wrist and finger joints using the MAS, mean change (SE) from baseline
Baseline I: 7.1 (0.2) C: 6.9 (0.2) P=0.35 Week 8 I: -1.8 (0.2) C: -0.3 (0.2) Mean difference: -1.47 (95%CI: -2.10 to -0.84)
Hand movements and upper arm function Measured with the Modified Motor Assessment Scale (MMAS), mean change (SE) from baseline
Baseline I: 1.1 (0.2) C: 1.5 (0.3) P=0.28 Week 8 I: 0.3 (0.2) C: 0
Patient and carer burden Measured using the Patient Disability Scale (PDS) and the Carer Burden Scale (CBS), mean change (SE) from baseline
PDS Baseline I: 1.8 (0.1) C: 1.8 (0.1) P=0.81 Week 8 I: -0.2 (0.1) C: -0.3 (0.1) Mean difference: -0.05 (95%CI: -0.28 to 0.18)
CBS Baseline I: 1.5 (0.1) C: 1.9 (0.2) P=0.19 Week 8 I: -0.2 (0.1) C: -0.1 (0.1) Mean difference: 0.06 (95%CI: -0.48 to 0.60)
Patient functional outcome measure (PFOM) Chosen by patients as the activity in the PDS as their preferred activity to improve, n (%) improved from baseline
Week 8 I: 20 (37%) C: 6 (15%) P=0.02
Global assessment of benefit Measured by asking to rate the overall benefit on a 5-point Likert scale by the patient and the investigator, n (%)
Investigator Week 12 I: 31 (58%) C: 12 (32%) P=0.01
Patient Week 12 I: 32 (60%) C: 13 (34%) P=0.01
Safety Indicated as experiencing at least 1 treatment-related adverse event
I: 6% C: 10%
|
Authors’ conclusions: Botulinum toxin type A was found to be safe and efficacious in reducing upper limb spasticity and improving the ability to achieve personal goals. No consistent difference in reduction of pain or depression was observed. However, these symptoms were not prominent among the study population and the groups were not well matched with respect to pain at baseline.
Comment: Sponsor had no influence on the interpretation of data and the final conclusions drawn. Sponsor is an author of the paper. |
|
Brashear, 2002 |
Type of study: Randomized, placebo-controlled trial
Setting: Patients with focal spasticity of the wrist and fingers after stroke
Country: United States of America
Source of funding: Commercial |
Inclusion criteria:
Exclusion criteria:
N total at baseline: I: 64 C: 62
Important prognostic factors2: Mean age (range): I: 61 (23-88) C: 62 (23-87)
Sex: I: 44% M C: 56% M
Groups comparable at baseline? Yes
|
Single treatment with intramuscular injection of Botulinum toxin A (Botox) with a total dose of 200 to 240 IU
50 units injected in each of four wrist and finger muscles with optional injections in one or two thumb muscles |
Placebo (visually identical) |
Length of follow-up: 12 weeks
Loss-to-follow-up: Intervention: N=0 (0%)
Control: N=4 (6%) Reasons: Unknown
Incomplete outcome data: Unclear
|
Functional disability: Measured with the Disability Assessment Scale with the principal therapeutic target chosen by subject and study investigator, mean (95%CI)
Baseline I: 2.70 C: 2.52 P=0.04 Mean change from baseline Week 6 I: -0.94 (-1.16 to -0.72) C: -0.31 (-0.48 to -0.14) P<0.001 Week 12 I: -0.88 (-1.12 to -0.63) C: -0.46 (-0.67 to -0.24) P=0.02
Muscle tone: Measured with the Ashworth Scale, mean change in score from baseline (95%CI)
1. Wrist flexor: Baseline I: 3.11 C: 3.13 P=0.79 Week 6 I: -1.66 (-1.87 to -1.44) C: -0.48 (-0.66 to -0.30) P<0.001 Week 12 I: -1.07 (-1.30 to -0.84) C: -0.31 (-0.48 to -0.14) P<0.001
2. Finger flexor Baseline I: 3.06 C:3.05 P>0.99 Week 6 I: -1.34 (-1.60 to -1.07) C: -0.32 (-0.50 to -0.14) P<0.001 Week 12 I: -0.78 (-1.05 to -0.51) C: -0.12 (-0.32 to -0.08) P<0.001
3. Thumb flexor Baseline I: 2.46 C: 2.28 P=0.28 Week 6 I; -1.31 (-1.63 to -0.98) C: -0.62 (-0.95 to -0.28) P=0.09 Week 12 I: -0.92 (-1.27 to -0.56) C: -0.31 (-0.62 to -0.01) P=0.02
Global Assessment: Measured with the Global Assessment Scale, mean change from pre-treatment status (95%CI)
1. Physician: Week 6 I: 1.77 (1.55-1.99) C: 0.57 (0.35-0.78) P<0.001 Week 12 I: 1.09 (0.80-1.38) C: 0.50 (0.29-0.72) P<0.001
2. Patient or caregiver’s: Week 6 I: 1.60 (1.30-1.89) C: 0.63 (0.40-0.85) P<0.001 Week 12 I: 1.05 (0.76-1.34) C: 0.48 (0.25-0.72) P=0.002
Safety: There were no significant differences between the study groups in the incidence of specific adverse events.
Neutralizing antibodies: Defined as a positive test for neutralizing antibodies to botulinum toxin A
In total N=93 measured I: positive N=1 C: positive N=0
|
Authors’ conclusions: Intramuscular injections of botulinum toxin A reduce spasticity of the wrist and finger muscles and associated disability in patients who have had a stroke.
Comment: Sponsor was responsible for data management and statistical analysis. The interpretation of the data and preparation of the manuscript were performed by all the authors, who had full access to the data. The content of the manuscript and the decision to submit it for publication were not controlled by the sponsor. |
|
Bakheit, 2001 |
Type of study: Randomized, placebo-controlled trial
Setting: Patients from 7 international centres with upper limb spasticity after a stroke
Country: United Kingdom, Ireland and Germany
Source of funding: Commercial |
Inclusion criteria:
Exclusion criteria:
N total at baseline: I: 27 C: 32
Important prognostic factors2: Mean age ± SD: I: 64 (13) C: 67 (11)
Sex: I: 41% M C: 47% M
Groups comparable at baseline? Yes
|
Single treatment with Botulinum A toxin-haemagglutinin (Dysport) diluted in 2 ml of 0.9% NaCl solution to give 1000 IU
About 300-400 IU of BtxA were injected into the biceps brachii (two sites), 150-250 IU into the flexor digitorum superficialis and 150 IU into each of the flexor digitorum profundus, flexor carpi ulnaris and flexor carpi radialis. Only one site per muscle was injected in the forearm. The injections were placed in the muscle belly using anatomical landmarks.
|
Placebo (visually identical)
|
Length of follow-up: 16 weeks
Loss-to-follow-up: I: N = 1 (2%) before the last scheduled visit of the study at 16 weeks C: N = 0 (0%) Reason: Lost to follow-up
Incomplete outcome data: Outcomes measured at week 16
I: N = 1 (2%) before the last scheduled visit of the study at 16 weeks C: N = 0 (0%) Reason: Lost to follow-up
|
Muscle spasticity: Measured as the change in MAS from baseline, n (%) decrease in score
Week 4 No change I: 5 (19) C: 10 (31) Decrease of 1 I: 8 (30) C: 15 (47) Decrease of 2 I: 7 (26) C: 3 (9) Decrease of 3 I: 5 (19) C: 4 (13) Decrease of 4 I: 2 (7) C: 0 (0) P=0.004
Joint ROM: Measured with a hand-held goniometer for elbow and wrist. A scale was used for hands. Measured change at week 4 from baseline
Elbow Active Not reported; only data from 1 centre available Passive, mean (SE) I: 10.3 (3.8) C: 3.5 (3.9) Mean difference: 6.8 (95%CI: -3.4 to 16.9) Wrist Active, mean (SE) I: 14.6 (4.3) C: 9.7 (4.4) Mean difference: 4.9 (95%CI: -6.5 to 16.3) Passive, mean (SE) I: 25.7 (3.8) C: 17.4 (3.8) Mean difference: 8.3 (95%CI: -1.6 to 18.2) Fingers Active, n (%) increase in score I: 15 (56%) C: 11 (34%) P=0.06 Fingers Passive, n (%) increase in score I: 9 (33%) C: 8 (25%) P=0.60
Severity of pain: Measured at the shoulder, arm, wrist and fingers on a four-point scale (0=no pain, 1=mild pain, 2=moderate pain, 3=severe pain)
No statistically significant differences between the study groups
Patient’s functional abilities: Measured with the Barthel index of activities of daily living
No statistically significant differences between the study groups
Goal attainment scale: Measured by assessment of attainment of three realistic functional goals
No statistically significant differences between the study groups
Difficulties in functional activities: Measured by assessing three abilities at week 4
1. Cleaning palm No or little difficulties I: 17 (63%) C: 16 (50%) Moderate difficulties I: 3 (11%) C: 7 (22%) Great difficulties/cannot do I: 7 (26%) C: 9 (28%) Too small number to perform statistical testing 2. Cutting fingernails No or little difficulties I: 2 (7%) C: 3 (10%) Moderate difficulties I: 0 (0%) C: 1 (3%) Great difficulties/cannot do I: 25 (93%) C: 28 (88%) Too small number to perform statistical testing 3. Putting arm through sleeve No or little difficulties I: 10 (37%) C: 10 (31%) Moderate difficulties I: 8 (30%) C: 9 (28%) Great difficulties/cannot do I: 9 (33%) C: 13 (41%) Too small number to perform statistical testing
Global assessment of benefit: Measured as an overall subjective assessment of treatment by patients and investigators at week 16
Patient N (%) ‘much improved’ and ‘some improvement’ I: 24 (92%) C: 16 (50%) RR 1.85 (95%CI: 1.28-2.66)
Investigator N (%) ‘much improved’ and ‘some improvement’ I: 23 (88%) C: 16 (50%) RR 1.84 (95%CI: 1.28-2.65)
|
Authors’ conclusions: Treatment with BtxA in a dose of 1000 units reduces muscle tone in patients with post-stroke upper limb spasticity. BtxA is safe in the dose used in this study.
Comment: The role of the sponsor in this study is unclear.
|
|
STROKE PATIENTS |
|||||||
|
LOWER LIMB SPASTICITY |
|||||||
|
Kaji, 2010b |
Type of study: Randomized, placebo-controlled trial
Setting: Patients with lower limb spasticity after stroke from 19 national medical institutions
Country: Japan
Source of funding: Commercial |
Inclusion criteria:
Exclusion criteria:
N total at baseline: I: 58 C: 62
Important prognostic factors2: Mean age (SD): I: 62 (9) C: 62 (9)
Sex: I: 86% M C: 74% M
Groups comparable at baseline? Yes, except for sex
|
Single treatment with intramuscular injection Botulinum toxin type A (Botox) with a total dose of 300 IU
75 IU were injected per muscle into each of the following: medial head of the gastrocnemius, lateral head of the gastrocnemius, and soleus muscle and tibialis posterior muscle (divided into three sites per muscle).
An EMG or nerve stimulator, and an EMG injection needle were used to identify the proper muscles and facilitate injection in all patients. |
Placebo (visually identical) |
Length of follow-up: 12 weeks
Loss-to-follow-up: Intervention: N=6 (10%) Reasons: 3 adverse events; 3 subject’ request
Control: N=1 (2%) Reasons: 1 protocol violation
Incomplete outcome data: Week 4 I: N=4 C: N=1 Week 8 I: N=5 C: N=3 Week 12 I: N=5 C: N=2 Reasons per time point unclear |
Muscle tone: Measured with the MAS, mean change from baseline (SE)
Week 4 I: -0.88 (0.09) C: -0.43 (0.09) P<0.001 Week 8 I:-0.82 (0.09) C: -0.43 (0.09) P<0.001 Week 12 I: -0.56 (0.09) C: -0.40 (0.07) P=0.240
Gait pattern scale (physician’s rating scale): Measured by assessment of 10m walk using the Physician’s Rating Scale, mean change (SE) from baseline
Week 4 I: 0.54 (0.17) C: 0.63 (0.19) P=0.688 Week 8 I: 0.61 (0.16) C: 0.78 (0.24) P=0.825 Week 12 I: 0.55 (0.17) C: 0.58 (0.20) P=0.775
Speed of gait: Measured by timing (in seconds) the walk over 10m straight, mean change (SE) from baseline
Week 4 I: -6.10 (3.11) C: -7.37 (2.66) P=0.209 Week 8 I: -3.14 (4.87) C: -8.19 (2.41) P=0.367 Week 12 I: -10.14 (3.70) C: -8.53 (3.16) P=0.585
Clinical global impression (CGI): Measured by Numeric Rating Scale, mean change (SE) from baseline
Investigator Week 4 I: 1.09 (0.17) C: 0.64 (0.14) P=0.048 Week 8 I: 1.13 (0.18) C: 0.59 (0.16) P=0.016 Week 12 I: 0.81 (0.18) C: 0.52 (0.16) P=0.166
Patient Week 4 I: 0.75 (0.21) C: 0.44 (0.23) P=0.120 Week 8 I: 1.00 (0.28) C: 0.70 (0.25) P=0.281 Week 12 I: 0.49 (0.21) C: 0.49 (0.28) P=0.409
Physical/occupational therapist Week 4 I: 0.64 (0.17) C: 1.07 (0.18) P=0.119 Week 8 I: 1.04 (0.24) C: 1.00 (0.21) P=0.589 Week 12 I: 1.02 (0.18) C: 0.97 (0.19) P=0.600
Safety: Indicated as investigator-determined treatment-related adverse events
I: 7 (12%) C: 7 (11%)
|
Authors’ conclusions: This was the first large-scale trial to indicate that BoNTA significantly reduced spasticity in lower limb muscles. Both BoNTA and placebo treatment were associated with slight increases in the Physician’s Rating Scale score (i.e., gait pattern scale), and no significant difference was noted between BoNTA and placebo. In addition, the time required for 10-m walking decreased after treatment with either BoNTA or placebo, and no significant difference was noted between the two treatments. A significantly greater increase in the CGI score by the investigator was noted in the BoNTA group compared to the placebo group, but no significant differnecne was noted by the patient of physical/occupational therapist. Since the result of the Physician’s Rating Scale score and speed of gait was not significant in this study, the treatment outcome seems to have fallen short of the expectation of patients and the physical/occupational therapist.
Comment: Role of the sponsor is unclear. Majority of authors are employed by the sponsor |
|
Pittock, 2003 |
Type of study: Randomized, controlled trial
Setting: Patients with lower limb spasticity after stroke from 29 international centres
Country: Ireland, United Kingdom, Czech Republic, Slovak Republic, Poland, Russia, Germany, Austria, Netherlands, Italy
Source of funding: Commercial |
Inclusion criteria:
Exclusion criteria:
N total at baseline: I1: 59 I2: 60 I3: 60 C: 55
Important prognostic factors2: Mean age (SD): I1: 56 (13) I2: 54 (14) I3: 54 (10) C: 55 (11)
Sex: I1: 61% M I2: 65% M I3: 58% M C: 67% M
Groups comparable at baseline? Yes
|
Single treatment with intramuscular injection Botulinum toxin type A-haemagglutinin complex (Dysport) diluted with 1.0 ml 0.9% NaCl giving a total of 4 ml. Three different doses were given:
1. 500 IU 2. 1000 IU 3. 1500 IU
Four sites were injected. The upper and lower sites were determined by palpation of the femoral and calcaneal insertions of the gastrocnemius muscle, 1/4 and 1/3 of the total length from the femoral insertions, respectively. At each site, medial and lateral injections were made. At the upper lateral, lower lateral and medial sites, deep positioning of the needle, penetrating the bulk of the gastrocnemius, enabled the soleus muscle to be injected with 0.5 ml. The needle was partially withdrawn and 0.5 ml injected into the gastrocnemius muscle. The upper medial site was injected last and received 1.0 ml into the gastrocnemius muscle. |
Placebo (visually identical) |
Length of follow-up: 12 weeks
Loss-to-follow-up: I1: N=4 (7%) Reasons: 3 lost to follow-up; 1 open treatment I2: N=5 (8%) Reasons: 5 lost to follow-up I3: N=3 (5%) Reasons: 1 lost to follow-up; 2 withdrawals (1 severe pain; 1 withdrew consent) C: N=1 (2%) Reasons: 1 withdrawal due to severe pain
Incomplete outcome data: Varied per outcome and time point.
|
2-min walking test: Measured as the distance in m covered during 2 min, mean change (SE) from baseline
Week 4 I1: 2.9 (5.0) I2: 3.7 (5.2) I3: 5.5 (5.1) C: 5.1 (4.8) Week 8 I1: 7.6 (5.3) I2: 4.9 (5.5) I3: 7.7 (5.3) C: 7.1 (4.9) Week 12 I1: 8.1 (5.3) I2: 7.7 (5.6) I3: 8.4 (5.3) C: 9.1 (4.9) No statistical significant differences were observed
Difference in step length: Measured in cm, mean change (SE) from baseline
Week 4 I1: -0.2 (1.7) I2: -1.9 (1.4) I3: -0.2 (1.7) C: -0.6 (1.4) Week 8 I1: -1.1 (1.6) I2: -1.6 (1.4) I3: -0.7 (1.7) C: -0.1 (1.6) Week 12 I1: -0.3 (1.7) I2: -2.5 (1.4) I3: -1.1 (1.6) C: -0.3 (1.5) No statistical significant differences were observed
Stepping rate: Measured as the number of steps per min, mean change (SE) from baseline
Week 4 I1: 2.7 (4.6) I2: 2.5 (4.0) I3: 4.4 (4.0) C: 3.1 (4.3) Week 8 I1: 4.3 (4.7) I2: 3.9 (4.3) I3: 4.1 (4.1) C: 3.9 (4.3) Week 12 I1: 4.4 (4.7) I2: 7.1 (4.3) I3: 7.2 (4.0) C: 5.2 (4.4) No statistical significant differences were found
Rivermead Motor Assessment:
No statistically significant differences between study groups, data not shown
Active and passive range of movement: Measured in the affected ankle
No statistically significant differences between study groups, data not shown
Muscle tone: Measured with the Modified Ashworth Scale, n (%) decrease in score
Week 4 I1: 23 (40) I2: 23 (40) I3: 31 (53) C: 8 (15) P=0.003 Week 8 I1: 29 (53) I2: 23 (43) I3: 35 (57) C: 14 (26) P=0.006 Week 12 I1: 27 (48) I2: 22 (38) I3: 29 (50) C: 16 (30) P=0.249
Pain: Subjectively assessed in the knee, leg, ankle or foot, n(%) decrease in score
Week 4 I1: 14 (25) I2: 23 (39) I3: 20 (34) C: 11 (20) P=0.157 Week 8 I1: 20 (35) I2: 25 (45) I3: 23 (40) C: 10 (19) P=0.063 Week 12 I1: 18 (32) I2: 22 (41) I3: 17 (29) C: 10 (19) P=0.234
Global assessment of benefit: Rating by patient and investigator at week 12, n(%) improved
Patient I1: 43 (75) I2: 35 (65) I3: 35 (60) C: 31 (57) P>0.05 Investigator I1: 38 (66) I2: 36 (65) I3: 38 (66) C: 34 (64) P>0.05 |
Authors’ conclusions: The greatest benefits were in patients receiving 1500 IU. Significant improvements in spasticity as measured by MAS limb pain and a reduction in the use of walking aids. Although there were clear benefits in subsets of patients, there was no statistically significant benefit of dysport over placebo with respect to walking speed, stepping rate or step length.
Comment: Sponsor was responsible for monitoring of data collection. Additional statistical tests were performed and help was given with manuscript by the sponsor. |
|
STROKE PATIENTS |
|||||||
|
UPPER AND LOWER LIMB SPASTICITY |
|||||||
|
Ward, 2014 |
Type of study: RCT and the treatment arms were stratified according to location of spasticity (UL or LL).
Setting: Not reported, but probably rehabilitation centre
Country: Germany, Sweden, the United Kingdom, and Canada
Source of funding: Allergan employees were involved in: (i) the design and conduct of the study; and (ii) the collection, management, analysis, and interpretation of the study data. The authors had sole control over the preparation, review, and approval of this manuscript. Editorial assistance for preparation of this manuscript was provided by Right Angle Communications, funded by Allergan.
All participating authors had a conflict of interest. |
Inclusion criteria: men and women aged 18–85 years who: had experienced a stroke due to a primary cerebral haemorrhage/ infarction or subarachnoid haemorrhage, leading to a hemiplegia/ hemiparesis, ≥ 3 months before the screening visit
Exclusion criteria: Patients with a fixed contracture as a result of spasticity and with causes of spasticity other than stroke
N total at baseline: Intervention: 139 Control:137
Important prognostic factors: Age (95% CI): I: 64.11 (22.6–81.2) C: 61.86 (26.8–82.4)
Sex: I: 61.2% M C: 56.3% M
Groups comparable at baseline? Yes on the reported variables |
onabotulinumtoxinA (BOTOX®, Allergan, Inc., Irvine, CA, USA) + standard of care (SC) with a minimum inter-injection interval of 12 weeks. A maximum of 800 U of study medication was available to the investigator for any single treatment session. While minimum doses for each muscle were recommended in the study protocol, the principal investigators agreed that, in order to reflect clinical practice, individual patients’ dosing was to be at each investigator’s discretion based upon their clinical experience. This may not have reflected the manufacturer ’s label.
Each participating centre individually determined SC in terms of available resources and usual practice in that centre. Therefore SC was anticipated to differ between individual patients and centres across the study but for some, this may well have been a more intensive programme of care than prior to study entry, e.g., physical therapy, occupational therapy and SC focussed on their active functional goal achievement.
|
placebo + standard care
Each participating centre individually determined SC in terms of available resources and usual practice in that centre. Therefore SC was anticipated to differ between individual patients and centres across the study but for some, this may well have been a more intensive programme of care than prior to study entry, e.g., physical therapy, occupational therapy and SC focussed on their active functional goal achievement. |
Length of follow-up: 52 weeks (22 to 34 weeks double blind. Thereafter open label)
Loss-to-follow-up: Intervention: N 16 (12%) Reasons: Discontininued onabotulinumtoxin n= 8 Patients request/withdrew consent n=5 Non-compliance with study visits n=1 Administrative reasons n=1 Loss to follow up n=1
Control: N 28 (20%) Reasons: Discontinued placebo n=13 Serious adverse event n=2 Patients request/withdrew consent n=4 Administrative reasons n=2 Died n=5 Did not receive placebo n=1 Serious adverse event n=1
Incomplete outcome data: Missing data was imputed following the last-case carries forward procedure
|
Outcome measures and effect size (include 95%CI and p-value if available):
Goal attainment scaling: Principal active functional goal achievement at 12 weeks was comparable for patients receiving onabotulinumtoxinA + SC or placebo + SC. OR= 1.20 (0.69 to 2.10); p = 0.512
24 weeks OR= 1.36 (0.81 to 2.29); p = 0.247
Resistance to passive movement (spasticity): 24 weeks, mean change from baseline I: –4.3 (–5.7 to –2.8) C: –1.7 (–2.9 to –0.4)
Adverse events (treatment related) double blind phase: I: n= 14 (10.1%) C: n=5 (3.7%) |
To fill in the evidence table two publications have been consulted. The original publication by Ward et al. 2014 and the published protocol:
Borg J, Ward AB, Wissel J, Kulkarni J, Sakel M, Ertzgaard P, Åkerlund P, Reuter I, Herrmann C, Satkunam L, Wein T, Girod I, Wright N; BEST Study Group. Rationale and design of a multicentre, double-blind, prospective, randomized, European and Canadian study: evaluating patient outcomes and costs of managing adults with post-stroke focal spasticity. J Rehabil Med. 2011 Jan;43(1):15-22. doi: 10.2340/16501977-0663. PubMed PMID: 21174051.
The authors did not do a multi level analysis on centre/country level but added the variable as a possible confounder or effect modifier. Neglectingthe multi level |
|
MS PATIENTS |
|||||||
|
LOWER LIMB SPASTICITY |
|||||||
|
Gusev, 2008 |
Type of study: Randomized, controlled trial
Setting: Patients with leg adductor muscle spasticity of both legs with definite or probable MS from 17 international centres
Country: Germany, Poland, and Russia
Source of funding: Commercial |
Inclusion criteria:
Exclusion criteria:
N total at baseline: I: 55 C: 51
Important prognostic factors2: Mean age : I: 46 C: 45
Sex: I: 36% M C: 33% M
Groups comparable at baseline? Yes
|
Single treatment with intramuscular injection Botulinum toxin type A-haemagglutinin complex (Dysport) with a max of 750 units per leg and in total of 1,500 units
Three adductor muscles were injected; adductor magnus, adductor longus, adductor brevis. Muscles were located by palpation, and sites of injection guided by standard locations used for electromyography.
|
Placebo (visually identical) |
Length of follow-up: 12 weeks
Loss-to-follow-up: I: N=1 (2%) Reason: consent withdrawn C: N=0 (0%)
Incomplete outcome data: I: N=1 (2%) Reason: consent withdrawn C: N=0 (0%)
|
Functional disability Measured as improvement of at least one grade in principal therapeutic target, n (%)
Week 4 I: 16 (29) C: 15 (29) P=0.745 Week 8 I: 16 (29) C: 14 (27) P=0.469 Week 12 I: 14 (25) C: 12 (24) P=0.497
Distance between the knees Measured at the medial aspect of the joint line using a tape measure of calipers following passive of active abduction
No statistically significant differences between study groups
Muscle tone Measured with the Modified Ashworth Scale, improvement at least one point
No statistically significant differences between study groups
Upper leg pain Rating of degree of pain associated with spasticity in upper legs on a four-point scale (0=absent to 3=severe), responders (%)
Week 8 P=0.008 Week 12 P=0.013
Global assessment of benefit Assessed on a five point scale from much worse to great benefit
No statistically significant differences between study groups, data not shown
Safety Reported as adverse events
I: 29 (53%) C: 14 (27%)
|
Authors’ conclusions: A treatment benefit in favor of BoNT-A, which tended towards significance, was seen for many of the endpoints used in this study, but not for the novel, subjective patient-determined primary outcome measure.
Comment: This study was supported and coordinated by sponsor. |
Trials geincludeerd in de sensitiviteitsanalyse
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
STROKE PATIENTS |
|||||||
|
UPPER LIMB SPASTICITY |
|||||||
|
Bakheit, 2000 |
Type of study: RCT [parallel]
Setting: 11 West European centers
Country: Not specifically stated
Source of funding: Industry |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention1: 22 Intervention2: 22 Intervention3: 19 Control: 19
Important prognostic factors2: Age ± SD: I1: 64 (15) I2: 60 (9) I3: 61 (15) C: 63 (14)
Sex: I1: 68% M I2: 55% M I3: 63% M C: 63% M
Groups comparable at baseline? Yes
|
1. Dysport 500 2. Dysport 1000 3. Dysport 1500
|
Placebo – identical to active drug
|
Length of follow-up: 16 weeks
Loss-to-follow-up: Interventions: N = 0 (0%)
Control: N = 1 (5%) Reasons: unclear
Incomplete outcome data: Interventions: N = 0 (0%)
Control: N = 1 (5%) Reasons: unclear
|
Muscle tone Measured with the MAS, change from baseline, mean difference compared to placebo (95%CI)
Elbow 16 weeks I1: -13.0 (-21.3 to -4.7) I2: -11.8 (-20.1 to -3.5) I3: -10.9 (-19.5 to -2.4)
Wrist 16 weeks I1: -10.8 (-20.3 to -1.2) I2: -14.4 (-24.0 to -4.8) I3: -12.2 (-22.1 to -2.2)
Fingers 16 weeks I1: -5.5 (-15.2 to 4.2) I2: -10.0 (-19.8 to -0.3) I3: -7.1 (-17.2 to 3.0)
Joint ROM Measured on voluntary extension of the elbow and wrist and on passive muscle stretch (with a hand-held goniometer), change in degrees (unclear whether mean with SD or SE)
Passive ROM – Elbow Week 4 I1: 11.4 (16.8) I2: 0.9 (26.2) I3: 16.9 (26.4) C: 8.2 (27.8) No statistical significant differences
Passive ROM – Wrist Week 4 I1: 16.5 (13.0) I2: 16.7 (26.4) I3: 14.6 (33.3) C: 5.3 (36.7) No statistical significant differences
Active ROM – Elbow Week 4 I1: 10.1 (41.4) I2: -1.0 (18.1) I3: 7.8 (24.8) C: 9.4 (25.5) No statistical significant differences
Active ROM – Wrist Week 4 I1: -6.3 (35.8) I2: 0.1 (25.3) I3: 2.4 (14.0) C: 1.4 (17.2) No statistical significant differences
Pain Measured as the severity of muscle pain at the shoulders, wrist and fingers (score; 0 to 3)
Week 4 I1: -1.4 (1.7) I2: -0.9 (1.8) I3: -1.2 (1.4) C: -1.3 (2.7) No statistical significant differences
Functionality Measured with the Rivermead Motor Assessment and the Barthel Index of activities of daily living
Rivermead Motor Assessment Week 4 I1: 0.2 (1.0) I2: 0.3 (0.7) I3: 0.1 (0.5) C: 0.2 (0.7) No statistical significant differences
Barthel Index Week 4 I1: 0.1 (1.4) I2: 0.1 (2.5) I3: 0.8 (2.6) C: 0.7 (1.2) No statistical significant differences
Safety Measured by recording the reported adverse events, n (%)
I1: 13 (59) I2: 4 (18) I3: 8 (42) C: 8 (42) No statistical significant differences
|
The study was sponsored by Ipsen Limited, Maidenhead, Berkshire, UK, who also designed the study in consultation with the senior authors and was responsible for the recruitment of the researchers and monitoring of the data collection. The statistical analysis of the study data was performed by Hartington Statistics and Data Management Limited, London, UK. The sponsors were not involved in the data interpretation or the writing of the manuscript. None of the authors were employees or paid consultants of Ipsen Ltd. |
|
Bhakta, 2000 |
Type of study: RCT [parallel]
Setting: Patients referred to rehabilitation medicine unit for potential treatment with botulinum toxin
Country: unclear
Source of funding: Industry |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 20 Control: 20
Important prognostic factors2: Median age (range): I: 60 (22-77) C: 53 (11-72)
Sex: I: 65% M C: 50% M
Groups comparable at baseline? Doubtful
|
Botulinum toxin type A (Dysport) 1000 Mouse Units, divided over elbow, wrist and finger flexors, diluted in 0.9% salin
|
Placebo (diluted in 0.9% saline)
|
Length of follow-up: 12 weeks
Loss-to-follow-up: Intervention: N = 0 (0%)
Control: N = 2 (10%) Reasons; Unable to attend the week 6 assessment
Incomplete outcome data: Intervention: N = 0 (0%)
Control: N = 2 (10%) Reasons; Unable to attend the week 6 assessment
|
Muscle tone Measured with the MAS, change from baseline, median (25, 75 percentile)
Finger flexor Week 2 I: -2.0 (-3.0 to -0.3) C: 0 (-0.3 to 0) P<0.001 Week 6 I: -1.5 (-2.8 to 0) C: 0 (0 to 0) P<0.001 Week 12 I: -1.0 (-2.0 to 0) C: 0 (0 to 0) P=0.006
Elbow flexor Week 2 I: -1.0 (-1.0 to 0) C: 0 (-0.25 to 0) P=0.002 Week 6 I: -0.5 (-1.0 to 0) C: 0 (-1.0 to 0) P=0.42 Week 12 I: 0 (-1.0 to 0) C: 0 (-1.0 to 0) P=0.62
Joint ROM Data reported only in the text.
“At baseline, only 14/40 had voluntary elbow movement and 3/40 voluntary wrist movement. Active ROM was not changed with BT-A in comparison with placebo. Passive elbow extension was recorded as 0 if full extension was possible (+ve values indicating flexion deformity). There was no improvement in overall passive ROM at the elbow or shoulder between groups.”
Pain Self-completed 0-10 rating of pain, median change from baseline (IQR) Week 6 I: -2 (-10 to 0) C: 0 (-5.5 to 0) No statistical significant differences
Patient disability Based on eight items rated on a five point Likert scale
Week 2 I: -0.6 (-1.4 to -0.3) C: -0.5 (-1.0 to -0.2) P=0.004 Week 6 I: -0.5 (-1.0 to -0.2) C: -0.1 (-0.5 to 0.1) P=0.016 Week 12 I: -0.5 (-1.3 to 0) C: -0.2 (-0.4 to 0.1) P=0.055
Carer burden Based on eight items rated on a five point Likert scale
Week 2 I: -0.77 (-1.8 to 0) C: 0 (-0.4 to 0) P=0.011 Week 6 I: -1.0 (-1.9 to 0) C: 0 (-0.3 to 0) P=0.005 Week 12 I: -1.0 (-2.0 to 0) C: 0 (-0.3 to 0) P=0.027
Safety Data reported in the text
“In the BT-A group, two patients developed self-limiting arm pain within 1 week of injection and one patient reported worsening of muscle spasm. No serious BT-A related adverse events were reported. In the placebo group, one patient reported herpes labialis 7 days postinjection, one patient reported two transient ischaemic attacks 12 days postinjection, and one patient had exacerbation of cardiac failure 4 weeks after treatment.”
|
|
|
Gracies, 2014 |
Type of study: RCT [parallel]
Setting: Tertiary care center
Country: United States of America
Source of funding: Industry |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention1: 8 Intervention2: 8 Control: 8
Important prognostic factors2: Age ± SD: I1: 44 (12) I2: 46 (17) C: 61 (13)
Sex: I1: 62% M I2: 62% M C: 50% M
Groups comparable at baseline? Difficult to assess with few participants
|
RimabotulinumtoxinB (BoNT/B)
1 10000 U total dose, of which a blinded fixed dose of 2500 U was injected into the elbow flexors 2 15000 U total dose, of which a blinded fixed dose of 5000 U was injected into the elbow flexors
|
Saline placebo
50% of subjects received 2 mL, of which 0.5 mL was injected into the elbow flexors; the other 50% received 3 mL, of which 1 mL was injected into the elbow flexors
|
Length of follow-up: 3 months
Loss-to-follow-up: None were lost to follow-up
|
Muscle tone Measured with the AS, mean change from baseline (SD)
1 month I1: -0.14 I2: -0.80 C: 0.00 P=0.13
Active Range of Motion Measured in the elbow joint
1 month I1: 9.8 I2: 6.6 C: -9.0 P=0.028
Pain Measured with GSA (score out of 10), mean change from baseline
1 month I1: -0.9 I2: -0.1 C: -0.2 P=0.61
Global Self-Assessment Total score (out of 10), mean change from baseline
1 month I1: -2.4 I2: 3.1 C: -0.4
Safety Reported in the text
“No adverse effects associated with either dose of BoNT/B (n=16 subjects) occurred in this study.” |
|
|
Hesse, 1998 |
Type of study: RCT [parallel]
Setting: neurological rehabilitation clinic
Country: Germany
Source of funding: Industry |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 6 Control: 6
Important prognostic factors2: Age ± SD: I: 54 C: 42
Groups comparable at baseline?
|
BtxA (Dysport), 1000 units
Injected into the Mm. biceps brachii, brachialis (each 250 units), flexor carpi ulnaris, flexor carpi radialis, flexor digitorum profunus et superficialis (each 125 units) at two sites per muscle, close to the motor point.
|
Placebo
|
Length of follow-up: 12 weeks
Loss-to-follow-up: Not stated
Incomplete outcome data: Not stated
|
Muscle tone Measured with the MAS, mean (SD)
Elbow Week 0 (baseline) I: 3.17 (1.17) C: 2.67 (0.82) Week 2 I: 2.67 (1.21) C: 2.67 (0.82) Week 6 I: 2.67 (1.21) C: 2.83 (0.75) Week 12 I: 3.00 (1.27) C: 2.83 (0.75)
Wrist Week 0 (baseline) I: 3.17 (1.17) C: 2.83 (0.75) Week 2 I: 2.83 (0.75) C: 2.67 (0.52) Week 6 I: 2.83 (0.75) C: 2.50 (0.55) Week 12 I: 3.00 (0.89) C: 2.67 (0.82)
Finger Week 0 (baseline) I: 4.17 (0.98) C: 3.83 (0.75) Week 2 I: 3.50 (1.38) C: 3.83 (0.75) Week 6 I: 3.50 (1.38) C: 3.67 (0.82) Week 12 I: 3.67 (1.21) C: 4.00 (0.63)
Difficulties with activities of daily living Measured with three indicators, score (0-4 unable), mean (SD)
Cleaning the palm of the affected hand Week 0 (baseline) I: 1.67 (0.82) C: 2.00 (0.90) Week 2 I: 1.67 (0.82) C: 2.17 (0.75) Week 6 I: 1.67 (0.82) C: 2.17 (0.75) Week 12 I: 1.67 (0.82) C: 2.17 (0.75)
Cutting the fingernails of the affected hand Week 0 (baseline) I: 1.50 (0.84) C: 2.33 (0.52) Week 2 I: 1.50 (0.84) C: 2.17 (0.75) Week 6 I: 1.83 (0.98) C: 2.17 (0.5) Week 12 I: 1.67 (0.82) C: 2.33 (0.52)
Putting the affected arm through a sleeve Week 0 (baseline) I: 2.17 (0.75) C: 2.00 (0.63) Week 2 I: 1.83 (0.75) C: 2.00 (0.63) Week 6 I: 1.83 (0.75) C: 2.00 (0.63) Week 12 I: 2.17 (0.75) C: 2.00 (0.63)
Safety Following stated in the text:
“The treatment was well tolerated by all patients; no study-related side-effects were observed”
|
|
|
Kong, 2007 |
Type of study: RCT
Setting: Outpatient clinic of a tertiary rehabilitation centre
Country: United Kingdom
Source of funding: Funded in part by Ipsen Beaufor |
Inclusion criteria: 1) Age 21-80 years. 2) More than three months after onset of stroke. 3) Hemiplegic shoulder pain of two weeks duration or more, with pain severity score of 4 or higher when assessed on a visual analogue scale, with 0 indicating no pain and 10, severe pain. 4) Shoulder adductor and elbow flexor spasticity of at least 2 or higher on the 5-point Ashworth Scale.
Exclusion criteria: 1) Previous history of shoulder pain/shoulder surgery before stroke. 2) Significant aphasia or cognitive impairment that precluded accurate clinical assessment of visual analogue scale scores. 3) Reflex sympathetic dystrophy. 4) Poststroke central pain. 5) History of neuromuscular disease (e.g. myasthenia gravis or previous BT-A injection).
N total at baseline: Intervention: 8 Control: 9
Important prognostic factors2: Age ± SD: I: 46.3 (9.0) C: 56 (13.6)
Sex: I: 43% M C: 89% M
Groups comparable at baseline? No, groups were too small to guaranty proper randomization (difference is gender, and nature of stroke) |
500 units of BT-A were diluted with 2.5 mL of normal saline, and 250 units of BT-A were injected into the pectoralis major and biceps brachii respectively using anatomical landmarks.
|
2.5 mL of normal saline without BT-A was used. |
Length of follow-up: 12 weeks
Loss-to-follow-up: Intervention: N 1 (12.5%) Reason: fractured his left humerus after a fall, six weeks after enrolment
Control: N 0 (0%)
Incomplete outcome data: Intervention: N 0 (0%) Reasons (describe)
Control: N 0 (0%)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Shoulder pain (VAS): 12 weeks I: -3.0 (-3.5 to -0.5) C: -2.0 (-4.0 to -1.8) p-value: 0.50
Muscle tone (Ashworth) 12 weeks I: -1.0 (-2.0 to -1.0) C: -1.0 (-1.0 to 0) p-value: 0.14
Passive shoulder abduction 12 weeks I: +48 (13 to 53) C: +15 (4 to 31) p-value: 0.48
Adverse events: The only reported adverse event was pain during injection, which occurred in 11 patients - six in the BT-A group and five in the placebo group |
|
|
Marciniak, 2012 |
Type of study: RCT
Setting: multisite academic rehabilitation practice: one urban site and one suburban site
Country: United States of America
Source of funding: Funded by an unrestricted educational grant from Allergan, Inc, for which Christina M. Marciniak has been a consultant. |
Inclusion criteria: 18 yrs or older, weight of more than 88 lbs, diagnosis of stroke with resultant hemiplegia or hemiparesis, stable medical illnesses, willingness to remain on a stable dose of antispasticity medication throughout the study and on a stable dose for 3 wks before the study enrollment, received physical therapy or occupational therapy for shoulder pain for at least 2 wks with no change in pain or function, shoulder pain of at least 4 on the visual analog scale for pain rated at the time of the screening visit, an Ashworth grade of 3 or greater for shoulder tone for adductors and internal rotators at the screening visit, no history of BoT-A injections before 1998, ability to appropriately rank pain on a cognitive function screening tool where the subjects were asked to rank pain associated with three painful scenarios, and a negative serum pregnancy test drawn on the day of the injection(s) for women of childbearing potential.
Exclusion criteria: known allergy or sensitivity to the study medication; pregnancy, planning pregnancy, or breastfeeding; women of childbearing potential not using a reliable means of contraception; concurrent use of aminoglycoside antibiotics, curare-like agents, or other agents that might interfere with neuromuscular function; any medical condition such as myasthenia gravis, Eaton-Lambert syndrome, amyotrophic lateral sclerosis, or other disorders that would put the participant at increased risk with exposure to BoT; infection or dermatologic condition at the injection site; presence of significant fixed contracture of the study limb shoulder; significant inflammation (clinical examination findings such as redness, increased warmth, or swelling) or oedema of the study limb; obesity to the degree that the shoulder landmarks were obscured such that the medication could not safely be injected; planned initiation of new antispasticity medication during the study period; concurrent medical condition that may be the more likely cause of the shoulder pain or that may put the participant at significant increased risk; and significant aphasia to the degree that the assessment tools would not be completely reliable.
N total at baseline: Intervention: 10 Control: 11
Important prognostic factors2: Age ± SD: I: 60.2 ± 7.8 C: 59.8 ± 10.3
Sex: I: 60% M C: 63.6% M
Groups comparable at baseline? No, groups were too small to guaranty proper randomization |
two syringes were used to reconstitute two vials of BoT-A, at a concentration of 100 units/1 ml. The participants had a total of 100Y150 units (1Y1.5 ml of 100 units/1 ml concentration) injected into the pectoralis major muscle (or the volume of saline that would correspond to this number of units, in the case of placebo injections). A total of 40Y60 units (or the corresponding saline volume) was injected into the teres major muscle if the shoulder extensors exhibited spasticity of an Ashworth grade of 3 or 4.
Dosing was adjusted on the basis of the Modified Ashworth Scale score and muscle size, as determined by the experienced injectors. Three sites were injected in the pectoralis muscle at the anterior aspect of the shoulder, and one site was injected in the teres major muscle, at the posterior aspect of the shoulder, lateral and superior to the scapular tip. Electromyographic guidance was used for the injections. |
2 ml of saline The participants had a total of 100Y150 units (1Y1.5 ml of 100 units/1 ml concentration) injected into the pectoralis major muscle (or the volume of saline that would correspond to this number of units, in the case of placebo injections). A total of 40Y60 units (or the corresponding saline volume) was injected into the teres major muscle if the shoulder extensors exhibited spasticity of an Ashworth grade of 3 or 4.
Dosing was adjusted on the basis of the Modified Ashworth Scale score and muscle size, as determined by the experienced injectors. Three sites were injected in the pectoralis muscle at the anterior aspect of the shoulder, and one site was injected in the teres major muscle, at the posterior aspect of the shoulder, lateral and superior to the scapular tip. Electromyographic guidance was used for the injections.
|
Length of follow-up: 16 weeks (randomization was opened after 12 weeks. After 12 weeks a total of six participants who were initially in the saline group elected to receive BoT-A.
Loss-to-follow-up: Intervention: N 0 (0%)
Control: N 2 (18%) Reasons: one because of death from recurrent stroke and one because of hospitalization with bleeding
Incomplete outcome data: Intervention: N 0 (0%)
Control: N 0 (0%)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Pain: 12 weeks No significant difference between groups (data not reported)
Muscle tone (Ashworth) 12 weeks No significant difference between groups (data not reported)
Passive range of motion: 12 weeks No significant difference between groups (data not reported)
Disability assessment scale: 12 weeks No significant difference between groups (data not reported)
Fugl-Meyer Scale: 12 weeks Significant difference: P = 0.013
FIM Hygiene: 12 weeks No significant difference between groups (data not reported)
Adverse events: Ten adverse events were reported; these occurred in seven subjects. I: treatments for bronchitis and rectal bleeding, and one subject was referred for psychologic follow-up because of the severity of depressive symptoms reported on the BDI. C: died at week 8 post injection after a new stroke, three subjects with dehydration accompanied by urinary tract infections, one subject who reported anemia requiring transfusion, and one subject with a seizure.
|
|
|
MS PATIENTS |
|||||||
|
LOWER LIMB SPASTICITY |
|||||||
|
Snow, 1990 |
Type of study: RCT cross over design
Setting: Not reported
Country: Canada
Source of funding: Injections of botuline toxine were supplied by Smith-Kettlewell Eye Research institute. No other information reported. |
Inclusion criteria: Not reported
Exclusion criteria: Not reported
N total at baseline: N= 10 cross over design
Important prognostic factors2: Not specified per group
Age ± SD: 40.2 (no SD reported)
Sex: 10% M
Groups comparable at baseline? Yes, it is a cross over design |
400 MU (160 ng) was the standard dose for all patients. The toxin was given in divided doses of 50 MU into adductor brevis (total 100 MU), adductor longus (total 100 MU) and adductor magnus (total 200 MU. The site of the injection was guided by the standard locations used for electromyography.
|
0.9% saline to a concentration of 100 mouse units (MU/ml.
|
Length of follow-up: 6 weeks (after 3 months cross over)
Loss-to-follow-up: During saline administration: 1 (10%) Reason: developed left-sided numbness and hemiparesis
Incomplete outcome data: Not reported.
|
Spasticity (no validated score): Baseline I: 7.9 ± 4.87 C:6.8 ± 5.26
6 weeks I: 4.7 ± 4.31 C:7.1 ± 4.77 Significant difference between groups before and after injection P = 0.009
Hygiene score (no validated score): 6 weeks Significant improvement in toxin group p-value = 0.02
Side effects: No side effects attributable to the toxin were noted at any stage of the study. |
|
Notes:
1. Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
2. Provide data per treatment group on the most important prognostic factors [(potential) confounders]
3. For case-control studies, provide sufficient detail on the procedure used to match cases and controls
4. For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Research question: High volume injections versus low volume injections
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3 |
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
STROKE PATIENTS |
|||||||
|
UPPER LIMB SPASTICITY |
|||||||
|
Barnes, 2010 |
Type of study: Randomized trial
Setting: Patients with stable upper limb spasticity following a stroke, brain injury, multiple sclerosis or cerebral palsy from 32 sites in eight Western European countries
Country: Spain, Italy, Austria, United Kingdom, Germany, Portugal, France, Switserland
Source of funding; Commercial |
Inclusion criteria:
Exclusion criteria:
N total at baseline: I: 97 C: 95
Important prognostic factors2: Mean age (SD): I: 55 (15) C: 55 (14)
Sex: I: 51% M C: 65% M
Groups comparable at baseline? No, proportionally more males in the control group |
Single treatment with intramuscular injections with botulinum neurotoxin type A NT 201 (Xeomin) with 100 IU dissolved in 5 ml (high volume group)
Injections could be controlled by EMG, electrical stimulation, or sonography.
The individual injection pattern was adapted to the patient’s needs. |
Single treatment with intramuscular injections with botulinum neurotoxin type A NT 201 (Xeomin) with 100 IU dissolved in 2 ml (low volume group)
Injections could be controlled by EMG, electrical stimulation, or sonography.
The individual injection pattern was adapted to the patient’s needs. |
Length of follow-up: 20 weeks
Loss-to-follow-up:
I: N = 6 (6%) Reasons: 2 consent withdrawn, 1 visit scheduling issues, 2 lost to follow-up, 1 other reasons C: N = 6 (6%) Reasons: 1 adverse event, 5 visit scheduling issues
Incomplete outcome data: I: N = 16 (16%) C: N = 11 (12%) Reason: major protocol deviations
|
Functional disability: Rating of the investigator (on the four-point DAS) of the chosen primary therapeutic target, n (%) showing improvement
Week 4 I: 51 (63%) C: 44 (52%) Percentage difference: 10.6% (95%CI: -4.4 to 24.9)
Muscle tone: Measured with the Ashworth Scale
Data not stratified by treatment group
Global assessment of treatment response: Measured at week 4
Data not stratified by treatment group
Safety: Treatment related adverse events
I: 8.3% C: 10.4% |
Authors’ conclusions: NT 201 improved functional disability and muscle tone and was well tolerated in patients with upper limb spasticity of diverse aetiology in both dilutions.
Comment: Conclusions were not specified by treatment group.
Sponsor performed the statistical analysis and were authors of the paper.
3 cerebral palsy patients were included in the high volume group and 1 MS patient as well. |
Trials geincludeerd in de sensitiviteitsanalyse
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
STROKE PATIENTS |
|||||||
|
UPPER LIMB SPASTICITY |
|||||||
|
Francisco, 2002 |
Type of study: RCT [parallel]
Setting: Freestanding rehabilitation hospital
Country: United States of America
Source of funding: Non-commercial |
Inclusion criteria:
N total at baseline: Intervention: 7 (6 completed) Control: 8 (7 completed)
Important prognostic factors2: Age (range): I: 46 (27-70) C: 42 (19-65)
Sex: I: 67% M C: 71% M
Groups comparable at baseline? Difficult to judge with few participants
|
High-volume – 50 units of BTX-A per 1 mL of preservative-free saline and 1.2 mL per muscle
27-gauge Teflon-coated monopolar needle was introduced to the sites, and needle placement was confirmed with an electrical stimulator.
The spastic flexor carpi radialis and ulnaris and the digitorum superficialis and profundus received 60 units each.
On average, patients in the high-volume group received 417 units BTX-A.
|
Low-volume – 100 units of BTX-A per 1 ml of preservative-free saline and 0.6 ml per muscle.
27-gauge Teflon-coated monopolar needle was introduced to the sites, and needle placement was confirmed with an electrical stimulator.
The spastic flexor carpi radialis and ulnaris and the digitorum superficialis and profundus received 60 units each.
Patients in the low-volume group received, on average, 432 units. |
Length of follow-up: 12 weeks
Loss-to-follow-up: Intervention: N = 1 (14%) Reasons: Failed to attend the posttreatment assessments
Control: N = 1 (13%) Reasons: Failed to attend the posttreatment assessments
Incomplete outcome data: Intervention: N = 1 (14%) Reasons: Failed to attend the posttreatment assessments
Control: N = 1 (13%) Reasons: Failed to attend the posttreatment assessments
|
Muscle tone Measured with the MAS, mean change from baseline (SD)
Wrist flexors Week 4 I: -1.9 (0.7) C: -1.7 (0.7) Week 8 I: -1.9 (0.6) C: -1.9 (0.6) Week 12 I: -1.6 (0.8) C: -1.3 (1.1)
Finger flexors Week 4 I: -1.8 (0.7) C: -1.3 (0.4) Week 8 I: -1.9 (0.9) C: -1.4 (0.7) Week 12 I: -1.7 (1.2) C: -0.9 (0.6)
Global Rating Scale Measures the subjective impressions of change in spasticity (high score indicates worsening of symptoms), mean change from baseline
Patient/caregiver Week 4 I: -1.7 (0.8) C: -1.6 (0.5) Week 8 I: -2.0 (0.6) C: -3.3 (1.1) Week 12 I: -3.0 (1.5) C: -4.9 (1.2)
Investigator Week 4 I: -1.8 (0.8) C: -1.7 (0.5) Week 8 I: -1.7 (0.8) C: -3.9 (0.7) Week 12 I: -3.0 (1.3) C: -4.6 (1.0)
Safety Following reported in the text:
“There was no adverse event reported by any of the patients.” |
|
Notes:
1. Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
2. Provide data per treatment group on the most important prognostic factors [(potential) confounders]
3. For case-control studies, provide sufficient detail on the procedure used to match cases and controls
4. For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Research question: Efficacy of botulin toxin
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Gracies, 2015 |
Patients were randomly allocated in a ratio of 1:1:1 […]. Computer-generated randomisation lists were created by a sponsor statistician independent from the study and treatment numbers were assigned when patients entered the study with a 24-h interactive voice response system from an external contract research organisation. |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Ward, 2014 |
Patients were randomized to onabotulinumtoxinA (BOTOX®, Allergan, Inc., Irvine, CA, USA) + standard of care (SC) or placebo + SC (in a 1:1 ratio) (Fig. 1) and the treatment arms were stratified according to location of spasticity (UL or LL). |
Unclear, blinding of the allocation was not decribed |
Unlikely |
Unlikely |
Unlikely |
Likely; not all pre specified outcomes are reported in the publication |
Unclear: 12% and 20% of the participants were lost to follow up. However, data was imputed (imputed a clean data were not reported separately). |
Unlikely |
|
Rosales, 2012 |
Eligible patients were allocated to receive BoNT-A or placebo in a 1:1 ratio according to a predetermined randomization schedule (block size of 4) generated by the sponsor-assigned biostatistician. The sponsor-assigned randomization manager provided treatment allocation codes to the drug supplier and drug safety officer, with the master listing kept confidential and secured by the sponsor representative. |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Barnes, 2010 |
A randomization list was provided by the sponsor using the computerized randomization program RANCODE version 3.6 for block-wise randomization and distribution to the centers, ensuring stratification by center |
Unclear |
Unclear |
Unclear |
Unlikely |
Unlikely |
Unlikely |
Unlikely; Although study had a high number of protocol violations in both treatment arms, the results of the PP and ITT analyses were the same |
|
Kaji, 2010a |
Eligible patients were randomly assigned to BoNTA or placebo by blocked randomisation with a randomisation ratio of 2:1 within each medical institution. The randomisation code was prepared by a clinical research organisation which was independent of all the clinical staff engaged in the study and access to the randomisation code was maintained at a secure location. The randomisation remained blinded until study completion. |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Kaji, 2010b |
The person responsible for randomization prepared a randomization code table, and it was concealed from all investigators and all study personnel |
Unclear |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Shaw, 2010 |
Randomisation was by a central independent webbased randomisation service […]. Participants were stratified according to research site and level of upper limb function (ARAT 0-3, ARAT 4-28, ARAT 29-56), and randomised to intervention or control in a 1:1 ratio using permuted block sequences. |
Unclear |
Likely |
Likely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Kanovsky, 2009 |
[…], patients were randomly assigned to either botuline toxin or placebo by a computer-generated list stratified by the centers. |
Unclear |
Unlikely |
Unlikely |
Unclear |
Unlikely |
unlikely |
Unlikely |
|
McCrory, 2009 |
A computer-generated master list of randomized treatment allocation codes was prepared centrally by an independent organization with a 1:1 proportion of patients assigned to each group. Group assignments was determined independently of the treating team by sequential allocation of treatment packs from the hospital pharmacy with pre-assigned randomization numbers. |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Gusev, 2008 |
[…], eligible patienrs were randomized [1:1] using a computer-generated code. Random computer-generated numbers were attached to individual medication boxes, each containing three vials which were identical in size and appearance. |
Unlikely |
Unlikely |
Unlikely |
Unclear |
Unlikely |
Unlikely |
Unlikely |
|
Pittock, 2003 |
Using computer-generated treatment coding, patients were randomly allocated to one of four treatment groups |
Unclear |
Unlikely |
Unlikely |
Unclear |
Unlikely |
Unlikely |
Unlikely |
|
Brashear, 2002 |
Only statement: randomly assigned, no further information is given |
Unclear |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Bakheit, 2001 |
Randomly assigned to one of the two groups in accordance with a randomization list generated in blocks of four prior to the study and held centrally by a third party. |
Unclear |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Trials geincludeerd in de sensitiviteitsanalyse |
||||||||
|
Bakheit, 2000 |
Patients were randomized to 1 to 4 study groups |
Unclear |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Bhakta, 2000 |
An individual randomisation code produced by the University medical statistics department |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Francisco, 2002 |
The allocation schedule was generated by randomly permuting a sequence containing nine assignments to each of the two treatment groups. |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Gracies, 2014 |
Eligible subjects were allocated to 1 of 3 grups (1:1:1 ratio) using a computer-generated randomization list |
Unclear
|
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Hesse, 1998 |
Patients were randomly assigned to one of four groups. |
Unclear |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unclear |
Unlikely |
|
Kong, 2007 |
Subjects were block-randomized in block sizes of four into either the BT-A or placebo group using a computer-generated sequence. Treatment allocation was revealed only after eligible subjects had consented to participate in the study. In |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Marciniak, 2012 |
Restricted randomization with random allocation was used. Sealed envelopes were prepared, with one half of the envelopes containing assignment to the placebo group, and one half, to the BoT group. The envelopes disclosing the study group assignment were then opened by the research coordinator preparing the medication at the time of randomization. |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unclear: 18% of the control were lost to follow up |
Unlikely |
|
Snow, 1990
|
A randomized cross-over design was used. |
Unclear, blinding of the allocation was not decribed |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unclear |
1. Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
2. Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
3. Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
4. Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
5. If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
6. Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Exclusietabel
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur, jaartal |
In-/Exclusie |
Reden van exclusie |
|
Reviews |
|
|
|
Eftekhar, 2014 |
Exclusie |
Conference abstract |
|
Foley, 2010 |
Exclusie |
Includeerde niet alleen RCT’s, maar ook single-interventie trials |
|
Ghasemi, 2013 |
Exclusie |
Gezocht tot december 2012; niet systematisch gezocht |
|
Iskedjian, 2010 |
Exclusie |
Conference abstract |
|
Lyons, 2007 |
Exclusie |
Cochrane review teruggetrokken |
|
Silva, 2010 |
Exclusie |
Conference abstract |
|
Tenniglo, 2014 |
Exclusie |
Gezocht tot februari 2013; niet alleen RCT’s zijn geïncludeerd |
|
RCT’s |
|
|
|
Baguley, 2011 |
Exclusie |
Uitkomst spier selectie |
|
Bakheit, 2000 |
Exclusie |
Klein steekproef (n<25 in elke arm) |
|
Baricich, 2008 |
Exclusie |
Patiënten waren allen voor randomisatie behandeld met botuline toxine |
|
Bayram, 2006 |
Exclusie |
Scheve vergelijking (verschil in dosering en elektrostimulatie per arm) |
|
Beard, 2003 |
Exclusie |
Systemische review van MS patiënten en behandelopties; RCT’s over botuline toxine gebruik includeerde ook patiënten zonder spasticiteit |
|
Bhakta, 2000 |
Exclusie |
Klein steekproef (n<25 in elke arm) |
|
Bhakta, 2008 |
Exclusie |
Dezelfde studiepopulatie als no 22 met andere uitkomsten |
|
Bollens, 2013 |
Exclusie |
Vergelijking tussen neurotomie en botuline toxine |
|
Borg, 2011 |
Exclusie |
Studie protocol; trial is afgerond, maar nog niet gepubliceerd |
|
Brashear, 2003 |
Exclusie |
Narratieve review |
|
Brashear, 2004 |
Exclusie |
Open-label extensie van behandelarm uit trial no. 28 |
|
Burhaud, 1996 |
Exclusie |
Hoog risico op bias |
|
Cardoso, 2005 |
Exclusie |
Systematische review; geincludeerde RCT’s zijn ook gevonden met deze strategie |
|
Childers, 2004 |
Exclusie |
Hoog risico op bias |
|
Cousins, 2010 |
Exclusie |
Standaard dosis werd per patiënt bepaald en vervolgens gehalveerd of een kwart van genomen |
|
De Boer, 2008 |
Exclusie |
Hoog risico op bias |
|
Dunne, 2012 |
Exclusie |
Dose groups were pooled, no distinction between groups possible |
|
Elia, 2009 |
Exclusie |
Systematische review gezocht tot sept 2006 |
|
Farina, 2008 |
Exclusie |
Botuline toxine en gipsen versus botuline toxine alleen |
|
Fietzek, 2014 |
Exclusie |
Tijd tot behandeling |
|
Foley, 2010 |
Exclusie |
Dubbel (review, no 6) |
|
Foley, 2013 |
Exclusie |
Systematische review; gezocht tot nov 2011 |
|
Francis, 2004 |
Exclusie |
Review niet systematisch gezocht |
|
Francisco, 2002 |
Exclusie |
Klein steekproef (n<25 in elke arm) |
|
Gracies, 2014 |
Exclusie |
Klein steekproef (n<25 in elke arm) |
|
Hesse, 1995 |
Exclusie |
Vergelijking: botuline toxine met of zonder elektrostimulatie |
|
Hesse, 2012 |
Exclusie |
Preventie van spasticiteit |
|
Hesse, 1998 |
Exclusie |
Klein steekproef (n<25 in elke arm) |
|
Hyman, 2000 |
Exclusie |
High risk of bias |
|
Hyman, 2000 |
Exclusie |
Dubbel (94) |
|
Jahangir, 2007 |
Exclusie |
High risk of bias |
|
Johnson, 2004 |
Exclusie |
Controle groep kreeg fysiotherapie en interventiegroep botuline toxine en FES -> scheve vergelijking |
|
Johnson, 2002 |
Exclusie |
Pilot studie van trial no. 97 |
|
Kaji, 2010 |
Exclusie |
Dubbel (101) |
|
Karadag-Saygi, 2010 |
Exclusie |
Elke patiënt kreeg botuline toxine |
|
Kirazli, 1998 |
Exclusie |
Klein steekproef (n<25 in elke arm) |
|
Kong, 2007 |
Exclusie |
Klein steekproef (n<25 in elke arm) |
|
Lamotte, 2003 |
Exclusie |
Review naar indicatie voor botuline toxine |
|
Lampire, 2013 |
Exclusie |
Geen gerandomiseerd onderzoek |
|
Lim, 2008 |
Exclusie |
Patiënten met schouderpijn |
|
Lindsay, 2014 |
Exclusie |
Studieprotocol |
|
Luate, 2004 |
Exclusie |
Geen vergelijkend onderzoek |
|
Mancini, 2005 |
Exclusie |
Dosis vergelijking, maar patiënten ontvingen een dosis op hun situatie afgestemd |
|
Marciniak, 2008 |
Exclusie |
Geen vergelijkend onderzoek |
|
Marciniak, 2012 |
Exclusie |
Klein steekproef (n<25 in elke arm) |
|
Marco, 2007 |
Exclusie |
Patiënten met schouderpijn |
|
Mayer, 2008 |
Exclusie |
Vergelijking tussen verschillende injectietechnieken |
|
McIntyre, 2012 |
Exclusie |
Systematische review; niet alleen studies met botuline toxine zijn geïncludeerd |
|
Miscio, 2004 |
Exclusie |
Geen vergelijkend controle groep meegenomen |
|
Olvey, 2010 |
Exclusie |
Systematische review; geïncludeerd studies zijn gevonden met deze zoekstrategie |
|
Pandyan, 2002 |
Exclusie |
Geen vergelijkend onderzoek |
|
Pavesi, 1998 |
Exclusie |
Case series |
|
Pedreira, 2008 |
Exclusie |
Patiënten met schouderpijn; geen vergelijkend onderzoek |
|
Phadke, 2014 |
Exclusie |
Review; associatie tussen spasticiteit en balans en het effect van botuline toxine op balans |
|
Pimentel, 2014 |
Exclusie |
Klein steekproef (n<25 in elke arm) |
|
Reiter, 1998 |
Exclusie |
Geen duidelijke vergelijking |
|
Richardson, 2000 |
Exclusie |
High risk of bias |
|
Rodgers, 2008 |
Exclusie |
Studie protocol |
|
Rosales, 2008 |
Exclusie |
Systematische review; gezocht tot 2006 |
|
Rousseaux, 2008 |
Exclusie |
Geen gerandomiseerd onderzoek |
|
Rousseaux, 2005 |
Exclusie |
Geen vergelijkend onderzoek |
|
Rousseaux, 2002 |
Exclusie |
Geen vergelijkend onderzoek |
|
Rousseaux, 2003 |
Exclusie |
Narratieve review |
|
Rowland, 2002 |
Exclusie |
Perspectief; geen origineel onderzoek |
|
Sampaio, 1997 |
Exclusie |
Geen vergelijkend onderzoek |
|
Santamato, 2015 |
Exclusie |
Review; inclusie van trials niet relevant voor deze vraag; niet alleen RCT’s geïncludeerd |
|
Shakespeare, 2003 |
Exclusie |
Cochrane review gezocht tot juni 2003, data is niet gepoold vanwege heterogeniteit. Studies zijn gevonden met deze zoekstrategie |
|
Shaw, 2009 |
Exclusie |
Narratieve review |
|
Shaw, 2011 |
Exclusie |
Same trial as 186 |
|
Sheean, 2003 |
Exclusie |
Narratieve review |
|
Simpson, 1997 |
Exclusie |
Narratieve review |
|
Simpson, 2009 |
Exclusie |
Klein steekproef (n<25 in elke arm) |
|
Singh, 2010 |
Exclusie |
Patiënten met schouderpijn |
|
Singh, 2011 |
Exclusie |
Dubbel (195) |
|
Slawek, 2005 |
Exclusie |
Geen vergelijkend onderzoek |
|
Smith, 2000 |
Exclusie |
Participanten opnieuw gerandomiseerd halverwege zijn geïncludeerd in analyses |
|
Snow, 1990 |
Exclusie |
Klein steekproef (n<25 in elke arm) |
|
Stampacchia, 2004 |
Exclusie |
Geen vergelijkend onderzoek |
|
Takekawa, 2013 |
Exclusie |
Geen vergelijkend onderzoek |
|
Teasell, 2012 |
Exclusie |
Narratieve review |
|
Thompson, 1999 |
Exclusie |
Conference abstract |
|
Tok, 2012 |
Exclusie |
Variabele dose per patient |
|
Turhnangoglu, 2002 |
Exclusie |
Geen vergelijkend onderzoek |
|
Van Kuijk, 2002 |
Exclusie |
Systematische review; gezocht tot 2000 |
|
Viriyavejakul, 1998 |
Exclusie |
Geen vergelijkend onderzoek |
|
Voller, 2001 |
Exclusie |
Narratieve review |
|
Wallesch, 1997 |
Exclusie |
Panel discussie |
|
Wang, 2002 |
Exclusie |
Geen vergelijkend onderzoek |
|
Ward, 2008 |
Exclusie |
Narratieve review |
|
Ward, 2014 |
Exclusie |
Standard behandeling naast de studie medicatie was verschillende tussen centra |
|
Wilkenfeld, 2013 |
Exclusie |
Narratieve review |
|
Wissel, 2001 |
Exclusie |
Narratieve review |
|
Wissel, 1999 |
Exclusie |
Geen vergelijkend onderzoek |
|
Wolf, 2012 |
Exclusie |
Klein steekproef (n<25 in elke arm) |
|
Yazdchi, 2013 |
Exclusie |
Vergelijking met orale spasmolytica |
|
Yelnik, 2003 |
Exclusie |
Narratieve review |
|
Yelnik, 2007 |
Exclusie |
Systematische review; search gedaan voor 2003 (meeste studies gevonden) |
|
Ding, 2015 |
Exclusie |
High risk of bias |
|
Pennati, 2015 |
Exclusie |
Klein steekproef (n<25 in elke arm) |
|
Tao, 2015 |
Exclusie |
Klein steekproef (n<25 in elke arm) |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 01-01-2016
Laatst geautoriseerd : 01-01-2016
Geplande herbeoordeling : 01-01-2022
Uiterlijk in 2021 bepaalt het bestuur van de Nederlandse Vereniging van Revalidatieartsen of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging van Revalidatieartsen is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Momenteel ontbreekt er een gestandaardiseerde behandelwijze voor volwassen patiënten met cerebrale en/of spinale spasticiteitsklachten. Er zijn veel verschillende (para)medisch specialismen (revalidatiearts, neuroloog, neurochirurg, handchirurg, anesthesioloog, orthopeed, fysiotherapeut, ergotherapeut, arts verstandelijk gehandicapten en specialist oudergeneeskunde) betrokken bij de behandeling van deze patiëntengroep. Een goede afstemming en consensus over wat optimale zorgverlening is voor deze groep patiënten is dan ook gewenst. Een landelijke evidence-based richtlijn is nodig om zorgprofessionals te ondersteunen in hun klinische besluitvorming en transparantie te bieden aan patiënten en derden.
Doelgroep
De patiëntengroep is divers; zo zijn er patiënten die weinig tot geen behandeling van hun spasticiteit nodig hebben of patiënten die in hun dagelijkse activiteiten (ADL) juist gebruik maken van hun spasticiteit (staan, lopen, aankleden). De spiertonus kan echter in de loop der tijd wijzigen, waardoor behandeling noodzakelijk wordt. Spasticiteit kan in dat geval leiden tot pijnklachten, fysiek ongemak, beperkte mobiliteit en zelfzorg, complicaties als contracturen, een laag zelfbeeld en decubitus, smetplekken vanwege moeilijkheden om een adequate hygiëne te realiseren (in gedeformeerde handen wordt dit probleem vaak gezien).
Beroerte, traumatisch hersenletsel en multiple sclerose kennen een hoge incidentie. Een belangrijk percentage van deze patiënten ontwikkelt spasticiteit. De incidentie/prevalentie van spasticiteit is niet exact bekend. Geschat wordt dat een derde van de CVA patiënten (van Kuijk et al., 2007; Watkins et al., 2002), 80% van patienten met Multiple Sclerose (MS) en 75% van de patiënten met lichamelijk beperkingen na traumatisch hersenletsel (THL) uiteindelijk spasticiteit ontwikkelt en in aanmerking komt voor behandeling. Gelet op de hoge incidentie van CVA, traumatisch hersenletsel en MS in Nederland is het aantal mensen met spasticiteit zeer omvangrijk.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2014 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met cerebrale en/of spinale spasticiteit te maken hebben.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende twee jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Kerngroep
- prof. dr. A.C.H. Geurts, revalidatiearts, werkzaam in het Radboudumc, Nijmegen (voorzitter per 01-07-2015), VRA
- drs. J.D. Martina, revalidatiearts, werkzaam in Medisch Spectrum Twente, Enschede (voorzitter tot 01-07-2015), VRA
- drs. E.M. Delhaas, anesthesioloog, werkzaam in het Erasmus Medisch Centrum, Rotterdam, NVA
- drs. A.M.V. Dommisse, revalidatiearts, werkzaam in het Isala Klinieken, Zwolle
- dr. J. Fermont, neuroloog, werkzaam in het Amphia ziekenhuis, Breda, VRA
- dr. J.F.M. Fleuren, revalidatiearts, werkzaam in het Roessingh, Enschede, VRA
- dr. H.J.L. van der Heide, orthopedisch chirurg, werkzaam in het Leids Universitair Medisch Centrum, Leiden, NOV
- drs. E. Kurt, neurochirurg, Radboudumc, Nijmegen, NVNN
- dr. M. Kreulen, plastisch chirurg, werkzaam in het Rode Kruis ziekenhuis, Beverwijk, NVPC
- prof. Dr. G. Kwakkel, Hoogleraar Neurorevalidatie, werkzaam in het VU Medisch Centrum, Amsterdam, KNGF
- dr. C.G.M. Meskers, revalidatiearts, werkzaam in het VU Medisch Centrum, Amsterdam, VRA
- dr. A.V. Nene, revalidatiearts, werkzaam in het Roessingh, Enschede, VRA
- drs. W.P. Polomski, revalidatiearts, werkzaam in het Spaarne Gasthuis, Hoofddorp, VRA
- drs. M.N. Ruissen-Eversdijk, ergotherapeut, bewegingswetenschapper werkzaam in het Reade, centrum voor revalidatiegeneeskunde en reumatologie, Amsterdam, EN
- dr. I.T.H.J. Verhagen, neurochirurg, werkzaam in het Neurochirurgisch Science Centrum, Tilburg, NVNN
Klankbordgroep
- drs. W.G.M. Bakx, revalidatiearts, werkzaam in de Adelante zorggroep, Hoensbroek, VRA
- prof. Dr. J. Becher, kinderrevalidatiearts, werkzaam in het Vrije Universiteit Medisch Centrum, Amsterdam, NVK
- A. Cremers, patiëntvertegenwoordiger, werkzaam bij Hersenletsel.nl, Velp
- drs. E. de Klerk, revalidatiearts, werkzaam in het Bravis ziekenhuis, Bergen op Zoom, VRA
- drs. W.J. Lubbers, huisarts, werkzaam bij de Zorggroep Almere, Almere, NHG
- drs. C.J. Meijer, specialist ouderengeneeskunde, werkzaam in de Zonnehuisgroep Vlaardingen, Vlaardingen, Verenso
- drs. P.A.A. Struyf, revalidatiearts, werkzaam bij Zuyderland medisch centrum, Sittard, VRA
- drs. B. Tinselboer, arts voor verstandelijk gehandicapten, 's Heeren Loo, Apeldoorn, NVAVG
Met ondersteuning van:
- dr. W.A. van Enst, senior adviseur, Kennisinstituut van Medisch Specialisten
- dr. B.H. Stegeman, adviseur, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen d.m.v. reputatiemanagement, belangen vanwege extern gefinancierd onderzoek, en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten, een overzicht vindt u hieronder:
|
Naam werkgroeplid |
Belangen |
Consequenties |
|
Delhaas |
Consultant Medtronic, directeur van Care4home |
Geen consequenties |
|
Dommisse |
|
|
|
Fermont |
Geen |
|
|
Fleuren |
Geen |
|
|
Geurts |
Doceren bij cursussen en congresbijdragen gefinancierd door Ipsen en Medtronic en onderzoeksgelden ontvangen van Ipsen en Merz. |
Geen consequenties |
|
Kreulen |
Geen |
|
|
Kurt |
Geen |
|
|
Kwakkel |
Geen |
|
|
Martina |
Doceren bij cursussen gefinancierd door Ipsen, Medtronic en Allergan |
Geen consequenties |
|
Meskers |
STW project gehonoreerd waaraan Ipsen bijdraagt |
Geen consequenties |
|
Nene |
Geen |
|
|
Polomski |
Geen |
|
|
Ruissen-Eversdijk |
Geen |
|
|
Van der Heide |
Geen |
|
|
Verhagen |
Geen |
|
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door vroegtijdig af te stemmen met de Patiëntenfederatie Nederland en de patiëntenvereniging Cerebraal. Door een fusie tussen Cerebraal, CVA vereniging Samen Verder, en Afasievereniging tot Hersenletsel.nl kon er pas vanaf de ontwikkelfase worden samengewerkt. In de ontwikkelfase is een interview met een vertegenwoordiger van de patiëntenvereniging Hersenletsel.nl gehouden. De verkregen input is verwerkt bij het opstellen van de richtlijntekst. Deze is nadien nog gecontroleerd door de vertegenwoordiger van Hersenletsel.nl en een patiënt die de problematiek beschreven in de richtlijn zelf ervaart. De uitkomsten zijn verwerkt in de tekst over communicatie met de patiënt (module 'Organisatie van zorg bij spasticiteit'). Tevens is de gehele richtlijn ter commentaar voorgelegd aan Hersenletsel.nl, Dwarslaesie Organisatie Nederland en de MS vereniging. Dit commentaar is verwerkt in de definitieve richtlijn.
Methode ontwikkeling
Evidence based
Implementatie
Dit implementatieplan is opgesteld ter bevordering van de implementatie van de richtlijn ‘Behandeling van cerebrale en/of spinale spasticiteit’. Voor het opstellen van dit plan is een inventarisatie gedaan van de mogelijk bevorderende en belemmerende factoren voor het naleven van de aanbevelingen. Daarbij heeft de werkgroep een advies uitgebracht over het tijdpad voor implementatie, de daarvoor benodigde randvoorwaarden en de acties die door verschillende partijen ondernomen dienen te worden.
Werkwijze
De werkgroep heeft per aanbeveling geïnventariseerd:
- per wanneer de aanbeveling overal geïmplementeerd moet kunnen zijn;
- de verwachte impact van implementatie van de aanbeveling op de zorgkosten;
- randvoorwaarden om de aanbeveling te kunnen implementeren;
- mogelijk barrières om de aanbeveling te kunnen implementeren;
- mogelijke acties om de implementatie van de aanbeveling te bevorderen;
- verantwoordelijke partij voor de te ondernemen acties.
Voor iedere aanbeveling is nagedacht over de hierboven genoemde punten. Echter niet voor iedere aanbeveling kon ieder punt worden beantwoord (“Overweeg om …”) en wordt dus meer ruimte gelaten voor alternatieve opties. Voor “sterk geformuleerde aanbevelingen” zijn bovengenoemde punten in principe verder uitgewerkt dan voor de “zwak geformuleerde aanbevelingen”.
Implementatietermijnen
Voor de volgende aanbevelingen geldt dat zij zo spoedig mogelijk geïmplementeerd dienen te worden. Uiterlijk per november 2017 dient iedereen aan deze aanbevelingen te voldoen. Veel andere aanbevelingen zijn al onderdeel van de huidige praktijk en brengen daarom weinig of geen implementatieproblemen met zich mee.
- Interdisciplinaire diagnostiek met inbreng van relevante disciplines bij de indicering en evaluatie van invasieve en niet-reversibele behandelopties.
- Gebruik van gangbeeldanalyse ten behoeve van het indiceren en evalueren van invasieve, niet-reversibele therapie voor de onderste extremiteiten bij patiënten met residuele sta- en loopvaardigheid.
- Gebruik van echografie en/of elektrostimulatie ter geleiding van intramusculaire injecties met botulinetoxine.
- Gebruik van mini-infusor voor de proefbehandeling van intrathecale baclofen bij mensen met residuele sta- of loopvaardigheid.
Daarnaast wordt aanbevolen om uiterlijk november 2019 te komen tot de erkenning van een beperkt aantal behandelcentra in Nederland voor 1. Weke-delen en enkel-voetchirurgie bij patiënten met cerebrale en/of spinale spasticiteit, 2. Neurochirurgische ingrepen bij patiënten met cerebrale en/of spinale spasticiteit, en 3. Intrathecale baclofenbehandeling (inclusief ‘trouble shooting’). Deze centra dienen te beschikken over goede mogelijkheden voor geavanceerde gangbeeldanalyse indien het gaat om patiënten met residuele sta- en loopvaardigheid.
Impact op zorgkosten
Veel aanbevelingen brengen geen of nauwelijks gevolgen met zich mee voor de zorgkosten, omdat het gaat om reeds geïmplementeerde behandeling. Doordat deze richtlijn een aanzet doet om niet altijd een seriële behandelstrategie op te volgen (zie de module 'Organisatie van zorg bij spasticiteit’) kunnen mogelijk kosten bespaard worden. Indien onnodige behandelingen niet worden toegepast, kan sneller de meeste effectieve therapie voor de individuele patiënt worden gevonden. Een aantal aanbevelingen zal extra kosten met zich meebrengen, omdat hiervoor extra apparatuur of scholing nodig is of omdat de behandeling nu nog weinig wordt toegepast. Deze kostenverhoging wordt echter als relatief gering ingeschat. Scholing kan bovendien leiden tot doelmatiger behandelen, waarmee uiteindelijk kosten gereduceerd kunnen worden. De verwachte impact op kosten is gebaseerd op een inschatting door experts, niet op een kostenanalyse.
Vergoeding
De vergoedingen voor ITB-behandelingen zijn problematisch, wat goede zorg in de weg staat. De problematiek kan als volgt worden samengevat:
- de bestaande DOT’s voor ITB zijn niet specialisme-overstijgend;
- nieuwe DOT’s zijn noodzakelijk;
- aanpassing van nomenclatuur is noodzakelijk;
- vergoeding is veelal onvoldoende of zelfs niet aanwezig (vooral voor de betrokkenheid van de revalidatiearts bij de instelling en nazorg).
Weliswaar is er over deze problematiek reeds overleg geweest met de NZa, maar de oplossing lijkt nog ver weg. Afgeleid van de Zorgboom Anesthesiologie Pijnbestrijding is onderstaand model (figuur 1) in de plenaire vergadering van de Vereniging voor Neuromodulatie Nederland geaccordeerd en bij de NZa ter discussie aangeboden. De NZa zal hiertoe vertegenwoordigers van de verschillende medische specialismen uitnodigen om tot een consensus te komen.
Figuur 1. Voorstel voor aanpassing van de DOT voor ITB-behandelingen
Te ondernemen acties per partij
Hieronder wordt per partij toegelicht welke acties zij kunnen ondernemen om de implementatie van de richtlijn te bevorderen.
Alle direct betrokken wetenschappelijk verenigingen/beroepsorganisaties (VRA, NVA, NOV, NVPC, NVN, NVvN, KNGF, EN, Verenso, NVAVG en het NHG):
- Bekend maken van de richtlijn onder de leden.
- Publiciteit voor de richtlijn maken door over de richtlijn te publiceren in tijdschriften en te vertellen op congressen.
- Bespreken van vergoedingsproblematiek rondom de aanbevolen zorg uit de richtlijn met ZN en het Zorginstituut.
- Ontwikkelen van gerichte bijscholing/trainingen, onder andere gericht op pathofysiologie, diagnostiek, toediening van botulinetoxine injecties, chemische neurolyse met fenol, en op intrathecale baclofenbehandeling.
- Oprichten van interdisciplinaire kennisplatformen (VRA, NVA, NOV, NVPC, NVN, NVvN, KNGF, en EN, Verenso, NVAVG en het NHG)
- Ontwikkelen en aanpassen van patiënteninformatie.
- Controleren van de toepassing van de aanbevelingen middels audits en de kwaliteitsvisitatie.
- Gezamenlijk afspraken maken over en opstarten van continu modulair onderhoud van de richtlijn.
De lokale vakgroepen/individuele medisch professionals:
- Het bespreken van de aanbevelingen in de vakgroepsvergadering en lokale werkgroepen.
- Het volgen van bijscholing die bij gebruik maakt van deze richtlijn.
- Aanpassen van lokale patiënteninformatie op grond van de materialen die door de verenigingen beschikbaar gesteld zullen worden.
- Afstemmen en afspraken maken met andere betrokken disciplines om de toepassing van de aanbevelingen in de praktijk te borgen.
De systeemstakeholders (onder andere zorgverzekeraars, (koepelorganisaties van) ziekenhuisbestuurders, IGZ):
Ten aanzien van de financiering van de zorg voor patiënten met cerebrale en/of spinale spasticiteit wordt van het bestuur van de revalidatiecentra en ziekenhuizen verwacht dat zij bereid zijn om de nodige investeringen te doen (zie hierboven bij impact op zorgkosten) om de aanbevelingen in deze richtlijn te kunnen implementeren. Daarnaast wordt van de bestuurders verwacht dat zij bij de betrokken medisch professionals nagaan op welke wijze zij kennis hebben genomen van de nieuwe richtlijn cerebrale en/of spinale spasticiteit en deze toepassen in de praktijk.
Wanneer de zorg beschreven in de richtlijn niet kan worden aangeboden (b.v. geen mogelijkheid tot het uitvoeren van een gangbeeldanalyse, afwezigheid van echografie of elektrostimulatie, of onvoldoende expertise) dienen er afspraken te worden gemaakt tussen zorginstellingen over het doorverwijzen van patiënten, waarbij de kwaliteit van zorg kan worden gegarandeerd. Het verzorgen van een goed ingericht ziekenhuisinformatiesysteem kan bijdragen aan de implementatie van de aanbevelingen die betrekking hebben op de verslaglegging van lichamelijk en aanvullend onderzoek en de terugkoppeling aan (para)medici in eerste en tweede lijn. Van zorgverzekeraars wordt verwacht dat zij de zorg die in deze richtlijn wordt aanbevolen zullen vergoeden. De geformuleerde aanbevelingen in deze richtlijn kunnen, na verloop van de aangegeven implementatietermijnen, door zorgverzekeraars worden gebruikt voor de inkoop van zorg. Voorwaarde voor zorginkoop op kwaliteitsbeleid is dat de aanbevolen zorg vergoed wordt.
Het Kennisinstituut van Medisch Specialisten:
- Toevoegen van richtlijn aan richtlijnendatabase.
- Opnemen van het implementatieplan in ‘aanverwante producten’, zodat het voor alle partijen goed te vinden is.
- Opnemen van kennislacunes in ‘aanverwante producten’.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen volgens het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwalitieit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (http://www.agreetrust.org/agree-ii/), dat een internationaal breed geaccepteerd instrument is, en op de ‘richtlijnen voor richtlijn’ voor de beoordeling van de kwaliteit.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door Allergan, Inspectie voor de Gezondheidszorg, Ipsen, Medtronic en Zorginstituut Nederland via een invitational conference. Een verslag hiervan kunt u hier vinden.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang als cruciaal, belangrijk of onbelangrijk. Tevens definieerde de werkgroep, voor zover mogelijk, wat zij voor een bepaalde uitkomstmaat een klinisch relevant verschil vond, dat wil zeggen wanneer de verbetering in uitkomst een verbetering voor de patiënt was.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De specifieke zoekstrategieën en de gehanteerde selectiecriteria zijn te vinden in de module van de desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld op basis van op voorhand opgestelde methodologische kwaliteitscriteria om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de risk of bias tabellen.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende overeenkomsten tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/) (Atkins et al, 2004).
B) Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose
Bij dit type vraagstelling kan GRADE (nog) niet gebruikt worden. De bewijskracht van de conclusie is bepaald volgens de gebruikelijke EBRO-methode (van Everdingen et al, 2004).
Formuleren van de conclusies
Voor vragen over de waarde van diagnostische tests, schade of bijwerkingen, etiologie en prognose is het wetenschappelijke bewijs samengevat in een of meerdere conclusie, waarbij het niveau van het meest relevante bewijs is weergegeven.
Bij interventievragen verwijst de conclusie niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence). Hierbij maakten de werkgroepleden de balans op van elke interventie. Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen.
Overwegingen
Voor een aanbeveling zijn naast het wetenschappelijke bewijs ook andere aspecten belangrijk, zoals de expertise van de werkgroepleden, patiëntenvoorkeuren, kosten, beschikbaarheid van voorzieningen of organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beste beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden in de module 'Organisatie van zorg bij spasticiteit' behandeld.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn is overwogen om interne kwaliteitsindicatoren te ontwikkelen. Echter, de werkgroep heeft afgezien van de ontwikkeling omdat er geen harde aanbevelingen worden gedaan waarvan het meten van uitkomsten kan bijdragen aan de kwaliteitscyclus. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten (secretariaat@kennisinstituut.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek staat bij aanverwante producten (Onderzoek/ Kennislacunes).
Commentaar- en autorisatiefase
De conceptrichtlijn wordt aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. De commentaren worden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren wordt de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn zal nadien aan de betrokken (wetenschappelijke) verenigingen worden voorgelegd voor autorisatie en door hen geautoriseerd.
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
