Lokale ablatie
Uitgangsvraag
Wat is de plaats van lokale ablatie voor patiënten met pijn bij botmetastasen?
Aanbeveling
Bespreek patiënten die in aanmerking komen voor lokale ablatie in een multidisciplinair overleg, waarbij in ieder geval de geschiktheid, haalbaarheid en meest geschikte techniek van een lokale ablatie besproken worden.
Bespreek met de patiënt de mogelijkheid van een lokale ablatie bij pijnlijke botmetastasen die refractair zijn voor, of ongeschikt zijn voor, medicamenteuze behandeling, radiotherapie of chirurgie. Lokale ablatietechnieken zijn radiofrequente ablatie (RFA), cryoablatie (CA), Magnetic Resonance-guided Focused Ultrasound (MRgFUS) en microwave ablatie (MWA).
Voer lokale ablatie alleen uit in centra met uitgebreide ervaring en expertise met ablatie van botmetastasen. Overleg met een regionaal academisch centrum als het niet in het lokale centrum kan.
Overwegingen
Lokale percutane ablatietechnieken kunnen overwogen worden bij patienten met pijnlijke botmetastasen, die refractair zijn voor, of ongeschikt zijn voor, medicamenteuze behandeling, radiotherapie of chirurgie. Tot op heden zijn er geen gerandomiseerde vergelijkende studies gepubliceerd, waardoor er in de literatuur onvoldoende bewijs is voor het effect van lokale ablatie op pijnstilling bij patiënten met botmetastasen. De systematische reviews suggereren echter een veelbelovend pijnstillend effect. De geschiktheid, haalbaarheid en meest geschikte techniek van een lokale ablatie dient besproken te worden in een multidisciplinair team.
Op basis van de literatuur is er geen voorkeur aan te geven voor een ablatiemethode, dit zal vooral afhangen van de ervaring van de behandelaar en de beschikbare ablatiemethoden in het betreffende behandelcentrum.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Systematische reviews van niet-vergelijkende, voornamelijk retrospectieve studies laten een afname in pijn zien (op basis van alleen pijnscore zonder meenemen van de hoeveelheid pijnmedicatie) (met een maximale follow-up duur tot 60 maanden) voor verschillende soorten lokale ablatie (radiofrequente ablatie, microwave ablatie, cryoablatie en MR-guided focused ultrasound). Het is onduidelijk wat (de grootte van) het effect van lokale ablatie is in directe vergelijking met andere pijninterventies, omdat kwalitatief goed onderzoek daarnaar ontbreekt. Op dit moment (mei 2023) loopt er in ieder geval één gerandomiseerde studie om het effect van MR-guided focused ultrasound te onderzoeken (FURTHER trial) (Slotman, 2022). Vooralsnog kan niet worden bevestigd noch ontkend dat lokale ablatie een effect heeft op pijnverlichting bij patiënten met botmetastasen.
Waarden en voorkeuren van patiënten (en evt. hun naasten)
Voor patiënten is het belangrijk dat zij goed geïnformeerd worden over de mogelijkheden, de verwachte effecten en de mogelijke nadelen van de verschillende vormen van lokale ablatie. Hoe pijnlijk is de behandeling zelf, is er verschil in effect op de pijn en in risico op fracturen tussen de verschillende behandelmogelijkheden? Zijn de bijwerkingen kortdurend, langdurend of blijvend? Uiteindelijk moeten de patiënt en de behandelaar samen beslissen of lokale ablatie wenselijk is na consultering van een interventieradioloog.
Lokale ablatie technieken
Alle lokale-ablatietechnieken zijn pijnlijk, en het merendeel van de behandelingen kan onder diepe sedatie worden uitgevoerd.
Op warmte gebaseerde ablatietechnieken
Alle op warmte gebaseerde ablatietechnologieën bewerkstelligen celdood via het gemeenschappelijke eindpunt van eiwitdenaturatie en stollingsnecrose. Radiofrequente ablatie (RFA) maakt gebruik van een electrode om hoogfrequente wisselstroom (400 en 500 kHz) aan het doelweefsel toe te dienen, wat ionische agitatie en wrijvingswarmte veroorzaakt (tot temperaturen van 60 - 100 °C). Het bereikte volume van de ablatiezone is afhankelijk van de impedantie van het weefsel en de doorbloeding. Microwave ablatie (MWA) bereikt hogere intratumorale temperaturen en wordt minder beïnvloed door weefselgeleidbaarheid/impedantie variabelen en door doorbloeding gemedieerde weefselkoeling (‘heatsink’). Vanwege de hoge impendantie van sclerotische botmetastasen kunnen deze beter behandeld met MWA in plaats van RFA. Andere voordelen van MWA zijn grotere ablatievolumes welke in een kortere tijd bereikt kunnen worden en optimalere verwarming van cysteuze gedegenereerde massa's. Bovendien zijn pacemakers geen contraindicatie voor MWA, in tegenstelling tot RFA, aangezien er geen aardingspads vereist zijn. Voor warmte geableerde ablatie technieken wordt meestal een maximum aantal van 3-5 laesies gehanteerd met elk een diameter < 3 cm.
MR guided focused ultrasound (MRgFUS) is geïndiceerd voor palliatie van pijnlijke osteolytische, osteoblastische of gemengde botmetastasen. De acoustische energie (geluidsgolven) wordt, in tegenstelling tot RFA en MWA, niet-invasief toegediend aan de patiënt waarna het weefsel opwarmt tot temperaturen > 65°C. Hierdoor ontstaat lokale weefselcoagulatie en necrose. Deze behandeling wordt gecombineerd met MRI-beeldvorming om de botmetastase zo goed mogelijk af te beelden en de behandeling hierop te plannen. MRgFUS wordt niet aanbevolen wanneer de corticale verdikking meer is dan 6 mm en MRgFUS wordt bij voorkeur niet verricht op een peri-articulaire locatie of binnen 10 mm van een belangrijke neurale structuur. De aanwezigheid van chirurgisch osteosynthesemateriaal is ook een contra-indicatie voor MRgFUS. De totale duur van de behandeling zal ongeveer tussen de 2 en 3 uur zijn.
Cryoablatie
Cryoablatie (CA) gebruikt extreme kou om tumoren te vernietigen. Snelle expansie van argongas, geleverd onder hoge druk via een cryoprobe, veroorzaakt een plotselinge sterke temperatuurdaling (onder -180 °C), het Joule-Thompson-fenomeen, waardoor intra- en extracellulair water bevriest en waardoor celmembranen worden verstoord. Tijdens het daaropvolgende passieve ontdooien vindt er een vloeistofverschuiving plaats van het interstitium naar de tumorcellen, waardoor de cel scheurt en er meer water beschikbaar komt om te bevriezen tijdens de volgende bevriezingsfase. Cellulaire necrose wordt bereikt bij temperaturen onder -40 °C. De belangrijkste voordelen van cryoablatie (CA) zijn de nauwkeurige visuele controle van de ijsbal zowel met CT als MRI en sterk verminderde per- en onmiddellijke postprocedurele pijn als gevolg van een relatief anesthetisch effect. Er bestaat de voorkeur om grote botmetastasen (> 4cm) met complexe morfologie en botmetastasen dichtbij risicovolle organen bij voorkeur te behandelen met cryoablatie vanwege de nauwkeurige visuele controle van de ijsbal, het vermogen om een groot weefselvolume te behandelen en verminderde per- en postprocedurele pijn in vergelijking tot de op warmte gebaseerde ablatie modaliteiten. Ook botmetastasen in de buurt van metalen implantaten kunnen veilig worden behandeld zonder de potentiële risico's van elektrische geleidbaarheid en nadelige thermische effecten die gepaard gaan met RFA, MWA en MRgFUS.
Contra-indicaties
Absolute contra-indicaties voor alle ablatie technieken zijn lokale of systemische infectie en niet-corrigeerbare stollingsafwijkingen. Relatieve contra-indicaties zijn onder meer grote laesies en de nabijheid van een belangrijke structuur die niet kan worden bewaakt (weefseltemperatuurbewaking met een temperatuursensor) of beschermd (met hydro- of CO2-dissectie). Bij de behandeling van botmetastasen in gewichtdragende botten moet ablatie worden gebruikt in combinatie met botconsolidatie/-augmentatie voor ondersteuning en stabiliteit vanwege een verhoogd risico op fracturen na ablatie.
Specifieke nadelen van RFA zijn onder meer de gevoeligheid voor het warmteafvoereffect en de slechte werkzaamheid bij sclerotische botmetastasen. Hoewel RFA niet absoluut gecontra-indiceerd is in de aanwezigheid van chirurgisch fixatiemateriaal, is grote zorg vereist om mogelijke nadelige verhittingseffecten te voorkomen. In deze situatie worden bipolaire RF-electrodes aanbevolen, evenals het gebruik van lokale weefseltemperatuurbewaking en -bescherming. MRgFUS wordt bij voorkeur niet verricht op een peri-articulaire locatie of binnen 10 mm van een belangrijke neurale structuur. Voorafgaande chirurgische fixatie is ook een contraindicatie voor MRgFUS.
Complicaties
Complicaties na ablatieprocedures zijn vooral fracturen (2-3%). Andere relatief weinig voorkomende complicaties zijn infectie, brandwonden van de huid, perifere sensorische of motorische neuropathie, arthropathie en hematoomvorming. Tijdelijke neurolyse wordt gemeld in tot 6% van de gevallen na cryoablatie waarin zenuwen worden blootgesteld aan temperaturen van minder dan 10 °C.
Kosten (middelenbeslag)
Ablatie is geen bijzonder dure behandeling, de kosten zouden geen belemmering moeten zijn om de behandeling aan te bieden.
Aanvaardbaarheid, haalbaarheid en implementatie
De werkgroep ziet lokale ablatie bij pijnlijke botmetastasen in een specifieke groep patiënten als alternatief. Hierbij wordt vooral gedacht aan patienten die geen medicamenteuze, chirurgische of radiotherapeutische mogelijkheden meer hebben. De werkgroep verwacht geen problemen met de implementatie. In de huidige klinische praktijk wordt een lokale ablatie al toegepast bij pijnlijke botmetastasen na eerdere radiotherapie. Het is mogelijk dat het betreffende behandelcentrum geen lokale ablatie kan aanbieden. Na overleg kunnen patienten verwezen worden naar een regionaal academisch centrum om de lokale-ablatiebehandeling over te nemen.
Onderbouwing
Achtergrond
Radiotherapie is de gouden standaard voor het behandelen van pijnlijke botmetastasen wanneer pijnmedicatie onvoldoende verlichting biedt. Tot 30% van de patiënten met botmetastasen heeft echter geen adequate pijnverlichting na radiotherapie.
In het afgelopen decennium zijn thermale ablatietechnieken, en vooral radiofrequente (RF) ablatie, veelvuldig gebruikt voor de behandeling van pijnlijke botmetastasen. Daarbij is de belangstelling voor cryoablatie de laatste jaren toegenomen. Cryoablatie lijkt voordelen te hebben ten opzichte van andere thermale ablatietechnieken. Meerdere studies naar de verschillende ablatietechnieken hebben pijnverlichting, afname van opioïdengebruik en verbetering van de kwaliteit van leven met minimale complicaties aangetoond.
Conclusies
|
No GRADE |
Due to the lack of well-designed and comparative studies, we can neither confirm nor deny that local ablation has an effect on pain relief in patients with metastastic bone disease. |
Samenvatting literatuur
Description of studies
Systematic reviews focusing on local ablation without simultaneous interventions
Gennaro (2019) performed a systematic review to determine the efficacy of percutaneous thermal ablation (TA) of bone metastases (radiofrequency ablation (RFA), microwave ablation (MWA), cryoablation (CA), and MR-guided focused ultrasound (MRgFUS)) in reducing pain in patients with advanced stage cancer. MEDLINE/PubMed, MEDLINE In-Process (US National Library of Medicine), BIDS ISI, Embase (Elsevier), CINAHL, and the Cochrane database were searched. Original articles written in English between January 2001 and March 2018 were included. Studies on less than five patients and studies about molecular, focused, in vitro, or animal studies or patients who also underwent other therapies (e.g., RT, cementoplasty) were excluded. In total, eleven studies (including a total of 364 patients) were included. RFA was used in three studies (Callstrom, 2002 (n=12); Goetz, 2004 (n=43); Dupuy, 2010 (n=55)), MRgFUS in five studies (Catane 2007a/b (n=13); Gianfelice, 2008 (n=11); Liberman, 2009 (n=31); Hurwitz, 2014 (n=112)), MWA in one study (Kastler, 2014 (n=17)) and CA in two studies (Tomasian, 2016 (n=14); Wallace, 2016 (n=56)). Pain improvement was assessed at baseline (before treatment), 0-1 week, 1-4 weeks, and 4-12 weeks. Only the latest pain evaluation was included if more than one pain evaluation fell into the same time interval. Pain was assessed with the Brief Pain Inventory (short form, BPI-SF), the Visual Analog Scale (VAS), the Numerical Rating Scale (NRS) and a 100-point pain scale which was converted to a ten-point scale. Follow-up ranged from 3 to 6 months. The risk of bias was assessed with the modified version of the Newcastle-Ottawa scale (NOS). Gennaro 2019 considered all articles included in the systematic review of high quality (assessed with at least five stars).
Systematic reviews focusing on local ablation with combination of interventions
Mehta (2020) performed a systematic review and meta-analysis to assess pain response after RFA over time for bone metastases. They searched MEDLINE/PubMed, Embase, and Google Scholar in January 2020 and included studies that were published in a peer-reviewed journal, included patients treated with RFA for metastatic bone tumors, used standardized, objective method or tool to assess patient-reported pain pertinent to metastatic bone disease both before and after RFA, and reported when pain was objectively assessed after RFA. Exclusion criteria were data presented in more than one article (in this case the article with the most complete data was chosen) and article lacking sufficient information for calculating the correlation coefficient. In total, 14 studies (including a total of 426 patients) were included, of which were nine retrospective studies and five prospective studies. Three studies applied RFA alone (Dupuy, 2010 (n=55); Goetz, 2004 (n=43); Thanos, 2008 (n=30)). Eleven studies used RFA in combination with cementoplasty (Belfiore, 2008 (n=12); Glarencon, 2013 (n=24); Fares, 2018 (n=30); Hoffmann, 2008 (n=22); Masala, 2011 (n=15); Prezzano, 2019 (n=17); Ruiz Santiago, 2011 (n=26); Tian, 2014 (n=38); Wallace, 2015 (n=72); Zhao, 2018 (n=16); Zheng, 2014 (n=26)). A subgroup analysis on the effects of cementoplasty was performed. The main outcome was patient-reported pain after RF ablation measured with the VAS, BPI, NRS and the Memorial Pain Assessment Card. The median follow-up was 24 weeks (range 4 to 52 weeks). The Newcastle-Ottawa Scale was used to assess study quality. Eleven studies were assessed with a low risk of bias and three studies with a mild to moderate bias.
Piras (2021) performed a systematic review to describe the feasibility and effectiveness of the association between RFA and RT in the treatment of metastatic bone pain in oligo-metastatic patients, evaluating its role in alleviating bone pain, reducing the risk of fractures, and consequently ensuring a better quality of life. EMBASE, PubMed and Science Direct databases were searched until April 2020. Original studies were included if they confirmed bone metastases in adult patients, included patients with painful bone metastases and were treated with combined RFA-RT. Studies with treatments different from combined RFA-RT or including plurimetastatic patients were excluded. In total, three retrospective studies (including a total of 92 patients) were included. Two studies compared RFA-RT with RT alone (Di Staso, 2011 (n=45); Prezzano, 2019 (n=26)) and one study investigated only RFA-RT (Greenwood, 2015 (n=21)). Pain was measured with the VAS and follow-up ranged from 6 to 8 months. However, pain reduction induced by pain medication was not included in the response analysis. The study quality was not assessed.
Sun (2019) performed a systematic review to assess the analgesic effect of ablation therapy combined with cementoplasty, as well as to identify the duration of analgesic effect and risk for cement leaks. PubMed and Web of Science databases were searched between January 2013 and March 2019. Inclusion criteria were studies with similar hypotheses and methods, studies that included patients that were diagnosed with cancer bone pain, studies that specified the precise number of sample size and studies that provided complete pain data for analysis. Review articles, repeated studies, non-clinical studies, letters, clinical studies without primary efficacy data, trials that did not involve combination treatment and studies in patients without cancer-induced bone pain were excluded. In total, twelve retrospective studies (including a total of 329 patients) were included (Elizabeth, 2016 (n=26); Fares, 2018 (n=30); Hoffmann, 2008 (n=22); Ma, 2017 (n=45); Madaelil, 2016 (n=6); Pusceddu, 2015 (n=35); Tian, 2014 (n=38); Tyler, 2017 (n=48); Wallace, 2015 (n=11); Wei, 2015 (n=26), Zhao, 2018 (n=16); Zheng, 2014 (n=26)) The VAS or NRS were used to measure pain. Follow-up was up to 24 weeks. The study quality was assessed using the methodological index for non-randomized studies (MINORS) and showed moderate to high quality.
Results:
1. Pain
Gennaro (2019) reported the pain scores at baseline, after 0 to 1 weeks, after 1 to 4 weeks and after 4 to 12 weeks (Table 1). The pain score at baseline ranged from 5.4 to 8. After 0 to 1 weeks of treatment, the pain scores were between 1.6 and 5.8. At 1 to 4 weeks of treatment, the pain scores ranged from 0.5 to 5, and at 4 to 12 weeks from 0.3 to 4.5. Pain reduction ranged from 26% to 91% at 4 weeks, and from 16% to 95% at 12 weeks as compared with baseline. Unfortunately, international consensus for the definition of a pain response was not followed, thus not taking into account the amount of pain medication.
Table 1. Overview of pain scores at baseline, 0-1 weeks, 1-4 weeks and 4-12 weeks for different treatment modalities (adapted from Gennaro 2019).
|
|
Author |
Scale |
Baseline |
0-1 weeks |
1-4 weeks |
4-12 weeks |
|
RFA |
Callstrom, 2002 |
BPI-SF |
8.0 |
4.6 |
3.1 |
1.0 |
|
|
Goetz, 2004 |
BPI-SF |
7.9 |
5.8 |
4.5 |
3.0 |
|
|
Dupuy, 2010 |
100 points |
5.4 |
- |
4.1 |
4.5 |
|
MWA |
Kastler, 2014 |
VAS |
7.4 |
1.6 |
1.9 |
2.2 |
|
MRgFUS |
Catane, 2007a |
VAS |
5.5 |
2.3 |
2.8 |
2.0 |
|
|
Catane, 2007b |
VAS |
5.5 |
5.4 |
0.5 |
0.3 |
|
|
Gianfelic, 2008 |
VAS |
6.5 |
- |
1.3 |
0.5 |
|
|
Liberman, 2009 |
VAS |
5.9 |
- |
2.3 |
2.3 |
|
|
Hurwitz, 2014 |
NRS |
7.0 |
4.8 |
3.3 |
3.4 |
|
CA |
Tomasian, 2016 |
NRS |
8.0 |
3.0 |
3.0 |
3.0 |
|
|
Wallace, 2016 |
NRS |
8.0 |
5.0 |
5.0 |
4.5 |
BPI-SF: Brief Pain Inventory short form; CA: cryoablation; MWA: microwave ablation; MRgFUS: MR-guided focused ultrasound; NRS: Numerical Rating Scale; RFA: radiofrequency ablation; VAS: Visual Analog Scale.
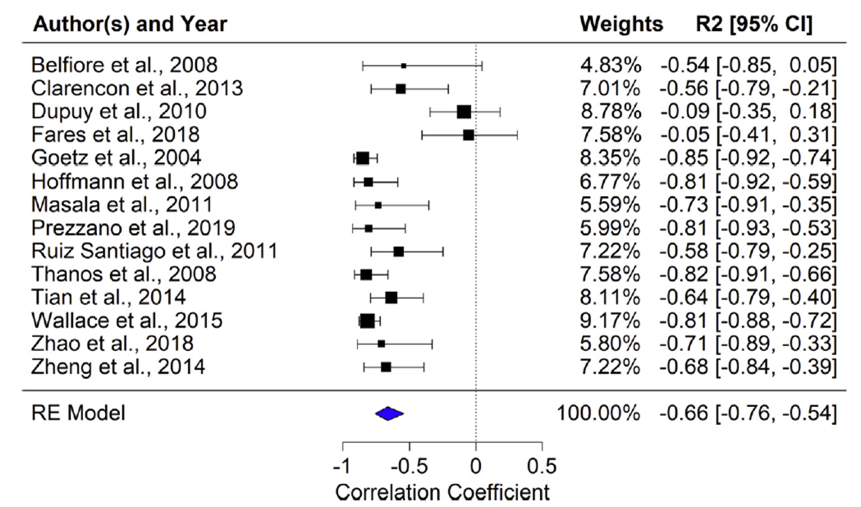
Mehta (2020) reported the median pain reduction after RF ablation (figure 2). The median reduction in pain (considered as decrease in pain score) after RF ablation was 67% over a median follow-up of 24 weeks, with 44% pain reduction within 1 week. For studies combining cementoplasty after RF ablation, a median pain reduction of 64% (range 37% to 90%) from baseline was found as compared to a median pain reduction of 79% (range 17% to 79%) from baseline for studies not using cementoplasty after RF ablation. No significant effect of cementoplasty on pain reduction was demonstrated.
Figure 2. Patient-reported pain after RF ablation over time. Adapted from Mehta (2020). RE model: random-effects model.
Piras (2021) reported that all included studies confirmed a significant decrease in bone pain. A complete pain response was demonstrated in 5 of the 30 patients (16.6%) who received RT alone versus 53.3% (8/15 patients) after the combination of RFA en RT (Di Staso, 2011).
Sun (2019) reported the changes in pain score at day 1 post-treatment and after 1, 4, 12, and 24 weeks. Pain was measured with the VAS (score between 0 and 10) or NRS (score between 1 and 10). Differences were −3.90 (95% CI: −4.80 to −3.00), −4.55 (95% CI:−5.46 to −3.64), −4.78 (95% CI: −5.70 to −3.86), −5.16 (95% CI: −6.39 to −3.92), and −5.91 (95% CI: −6.63 to −5.19) after 1 ,4, 12 and 24 weeks respectively.
2. Complications/toxicity
Gennaro (2019) reported complications. In total, 82 minor complications and 9 major complications were experienced. Major complications were acetabular fracture, foot drop, fractures, grade III skin burn, hip flexor neuropathy, and hemothorax. No complications were reported for MWA treatment, while MRgFUS has the highest complication rate.
Sun (2019) reported safety. Cement leakage was demonstrated in four studies. In total, 15 cement leaks occurred in 94 patients (for 131 treatments).
Level of evidence of the literature
The evidence retrieved for answering the review question consists (mainly) of studies with a retrospective or before-and-after design. This type of study designs is inherently susceptible to bias (ie, systematic errors). One of the major limitations of a before-and-after design study is the lack of a comparison or control group. This seriously limits the value of information obtained on the effect of local ablation on pain. Another limitation encountered by the systematic review authors are the clinical heterogeneity, for example due to the diversity in study designs and assessment scales used in the studies and the (very) small sample sizes in the individual studies. Pain medication induced changes in pain were not always included in the response analysis, which causes bias. Furthermore, inherently to pain research, is the importance of blinding patients (who are also the outcome assessors) to the treatment received.
Although the systematic review authors conclude that the results regarding the effect of local ablation on pain are promising, further, well-designed and comparative studies are needed to define the magnitude of the effect of local ablation on pain.
Due to the descriptive character of the studies found for this review question, the level of evidence (GRADE) of the literature was not assessed. Taken all of the above in consideration, it is reasonable to conclude that we are very uncertain about the effect of local ablation on pain.
Ongoing studies
At the moment (May 2023), one randomized study is carried out to investigate the effect of MR-guided focused ultrasound (FURTHER trial) (Slotman, 2022).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the effect of local ablation on pain in patients with bone metastases?
P: Patients with painful bone metastases
I: Local ablation (radiofrequency ablation (RFA), microwave ablation (MWA), Magnetic Resonance-guided Focused Ultrasound (MRgFUS), cryoablation (CA)
C: Other interventions aimed at reducing pain
O: Pain response, and secondary complications/toxicity.
Relevant outcome measures
Following international criteria, pain response was defined as
- a decrease in the initial pain score by at least 2 points (on a Visual Analogue Scale (VAS) from 0-10), without analgesic increase
or
- an analgesic decrease of ≥25% without an increase in pain score.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 25th of May 2022. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 482 hits. Studies were selected based on the following criteria:
- Systematic review, meta-analysis, randomized controlled trial or other comparative studies (cross-sectional, case control or cohort study);
- Including patients with bone metastases;
- Preferably no simultaneous interventions that can also have an effect on pain (or corrected for this in the analysis);
- Measured pain with a validated instrument.
Thirty-six studies were initially selected based on title and abstract screening. After reading the full text of those articles, the working group decided to limit the literature summary for this guideline module to a description of systematic reviews that describe the effect of local ablation on pain. Thirty-one studies were excluded (see the table with reasons for exclusion under the tab Methods), and four studies were included.
Results
Four systematic reviews were included in the analysis of the literature (Gennaro 2019; Mehta 2020; Piras 2021; Sun 2019).
Referenties
- 1 - Gennaro N, Sconfienza LM, Ambrogi F, Boveri S, Lanza E. Thermal ablation to relieve pain from metastatic bone disease: a systematic review. Skeletal Radiol. 2019 Aug;48(8):1161-1169. doi: 10.1007/s00256-018-3140-0. Epub 2019 Jan 9. PMID: 30627778.
- 2 - Mehta TI, Heiberger C, Kazi S, Brown M, Weissman S, Hong K, Mehta M, Yim D. Effectiveness of Radiofrequency Ablation in the Treatment of Painful Osseous Metastases: A Correlation Meta-Analysis with Machine Learning Cluster Identification. J Vasc Interv Radiol. 2020 Nov;31(11):1753-1762. doi: 10.1016/j.jvir.2020.08.002. Epub 2020 Oct 1. PMID: 33012648.
- 3 - Piras A, La Vecchia M, Boldrini L, D'Aviero A, Galanti D, Guarini A, Sanfratello A, Venuti V, Angileri T, Daidone A. Radiofrequency thermoablation (RFA) and radiotherapy (RT) combined treatment for bone metastases: a systematic review. Eur Rev Med Pharmacol Sci. 2021 May;25(10):3647-3654. doi: 10.26355/eurrev_202105_25930. PMID: 34109573.
- 4 - Sun Y, Zhang H, Xu HR, Liu JZ, Pan J, Zhai HZ, Lu CY, Zhao X, Chen YQ, Zhou LL, Yu J, Han J. Analgesia of percutaneous thermal ablation plus cementoplasty for cancer bone metastases. J Bone Oncol. 2019 Nov 5;19:100266. doi: 10.1016/j.jbo.2019.100266. PMID: 31788416; PMCID: PMC6880023.
Evidence tabellen
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Lin X, Chen W, Wei F. Technique Success, Technique Efficacy and Complications of HIFU Ablation for Palliation of Pain in Patients With Bone Lesions: A Meta-Analysis of 28 Feasibility Studies. Ultrasound Med Biol. 2021 May;47(5):1182-1191. doi: 10.1016/j.ultrasmedbio.2021.01.018. Epub 2021 Feb 11. PMID: 33583637. |
Wrong outcome |
|
Bitton RR, Rosenberg J, LeBlang S, Napoli A, Meyer J, Butts Pauly K, Hurwitz M, Ghanouni P. MRI-Guided Focused Ultrasound of Osseous Metastases: Treatment Parameters Associated With Successful Pain Reduction. Invest Radiol. 2021 Mar 1;56(3):141-146. doi: 10.1097/RLI.0000000000000721. PMID: 32858582. |
Wrong population |
|
Bucknor MD, Chan FP, Matuoka JY, Curl PK, Kahn JG. Cost-effectiveness analysis of magnetic resonance-guided focused ultrasound ablation for palliation of refractory painful bone metastases. Int J Technol Assess Health Care. 2020 Dec 3;37:e30. doi: 10.1017/S0266462320001907. PMID: 33267915. |
Wrong comparison: with medication |
|
Carrafiello G, Laganà D, Pellegrino C, Mangini M, Fontana F, Piacentino F, Recaldini C, Rovera F, Dionigi G, Boni L, Fugazzola C. Ablation of painful metastatic bone tumors: a systematic review. Int J Surg. 2008;6 Suppl 1:S47-52. doi: 10.1016/j.ijsu.2008.12.035. Epub 2008 Dec 14. PMID: 19196558. |
No systematic review |
|
Luigi Cazzato R, Auloge P, De Marini P, Rousseau C, Chiang JB, Koch G, Caudrelier J, Rao P, Garnon J, Gangi A. Percutaneous image-guided ablation of bone metastases: local tumor control in oligometastatic patients. Int J Hyperthermia. 2018;35(1):493-499. doi: 10.1080/02656736.2018.1508760. Epub 2018 Oct 11. PMID: 30307346. |
No comparison; other outcomes |
|
Chang EM, Shaverdian N, Capiro N, Steinberg ML, Raldow AC. Cost Effectiveness of External Beam Radiation Therapy versus Percutaneous Image-Guided Cryoablation for Palliation of Uncomplicated Bone Metastases. J Vasc Interv Radiol. 2020 Aug;31(8):1221-1232. doi: 10.1016/j.jvir.2020.03.027. Epub 2020 Jul 13. PMID: 32674872. |
Other outcomes: cost-effectiveness |
|
De Marini P, Cazzato RL, Auloge P, Koch G, Dalili D, Garnon J, Gangi A. Percutaneous image-guided thermal ablation of bone metastases: a retrospective propensity study comparing the safety profile of radio-frequency ablation and cryo-ablation. Int J Hyperthermia. 2020;37(1):1386-1394. doi: 10.1080/02656736.2020.1859628. PMID: 33322960. |
No systematic review; retrospective comparison |
|
Di Francesco A, Flamini S, Zugaro L, Zoccali C. Preoperative radiofrequency ablation in painful osteolytic long bone metastases. Acta Orthop Belg. 2012 Aug;78(4):523-30. PMID: 23019787. |
No systematic review |
|
Di Staso M, Zugaro L, Gravina GL, Bonfili P, Marampon F, Di Nicola L, Conchiglia A, Ventura L, Franzese P, Gallucci M, Masciocchi C, Tombolini V. A feasibility study of percutaneous Radiofrequency Ablation followed by Radiotherapy in the management of painful osteolytic bone metastases. Eur Radiol. 2011 Sep;21(9):2004-10. doi: 10.1007/s00330-011-2133-3. Epub 2011 May 1. PMID: 21533865. |
Included in systematic review |
|
Di Staso M, Gravina GL, Zugaro L, Bonfili P, Gregori L, Franzese P, Marampon F, Vittorini F, Moro R, Tombolini V, Di Cesare E, Masciocchi C. Treatment of Solitary Painful Osseous Metastases with Radiotherapy, Cryoablation or Combined Therapy: Propensity Matching Analysis in 175 Patients. PLoS One. 2015 Jun 23;10(6):e0129021. doi: 10.1371/journal.pone.0129021. PMID: 26103516; PMCID: PMC4478013. |
No systematic review; retrospective study |
|
Ferrer-Mileo L, Luque Blanco AI, González-Barboteo J. Efficacy of Cryoablation to Control Cancer Pain: A Systematic Review. Pain Pract. 2018 Nov;18(8):1083-1098. doi: 10.1111/papr.12707. Epub 2018 Jun 7. PMID: 29734509. |
No meta-analysis |
|
Gouveia AG, Chan DCW, Hoskin PJ, Marta GN, Trippa F, Maranzano E, Chow E, Silva MF. Advances in radiotherapy in bone metastases in the context of new target therapies and ablative alternatives: A critical review. Radiother Oncol. 2021 Oct;163:55-67. doi: 10.1016/j.radonc.2021.07.022. Epub 2021 Jul 29. PMID: 34333087. |
Background article |
|
Hurwitz MD, Ghanouni P, Kanaev SV, Iozeffi D, Gianfelice D, Fennessy FM, Kuten A, Meyer JE, LeBlang SD, Roberts A, Choi J, Larner JM, Napoli A, Turkevich VG, Inbar Y, Tempany CM, Pfeffer RM. Magnetic resonance-guided focused ultrasound for patients with painful bone metastases: phase III trial results. J Natl Cancer Inst. 2014 Apr 23;106(5):dju082. doi: 10.1093/jnci/dju082. PMID: 24760791; PMCID: PMC4112926. |
Wrong comparison |
|
Jiao D, Wu G, Ren J, Han X. Radiofrequency ablation versus 125I-seed brachytherapy for painful metastases involving the bone. Oncotarget. 2016 Dec 27;7(52):87523-87531. doi: 10.18632/oncotarget.11983. PMID: 27636995; PMCID: PMC5350007. |
No systematic review; retrospective analysis |
|
Ke J, Cheng S, Yang T, Zhang C, Wang M, Zhang Y. Feasibility of Controlling Metastatic Osseous Pain Using Three Kinds of Image-Guided Procedures for Thermal Microwave Ablation: A Retrospective Study. Orthop Surg. 2021 Feb;13(1):116-125. doi: 10.1111/os.12849. Epub 2020 Dec 10. PMID: 33305522; PMCID: PMC7862186. |
Wrong comparison: feasibility study about three different ways of imaging |
|
Kojima H, Tanigawa N, Kariya S, Komemushi A, Shomura Y, Sawada S. Clinical assessment of percutaneous radiofrequency ablation for painful metastatic bone tumors. Cardiovasc Intervent Radiol. 2006 Nov-Dec;29(6):1022-6. doi: 10.1007/s00270-005-0318-3. PMID: 16988875. |
Wrong comparison: RFA vs RFA+RT vs RFA + bone cement |
|
Kurup AN, Schmit GD, Atwell TD, Sviggum EB, Castaneda WR, Rose PS, Callstrom MR. Palliative Percutaneous Cryoablation and Cementoplasty of Acetabular Metastases: Factors Affecting Pain Control and Fracture Risk. Cardiovasc Intervent Radiol. 2018 Nov;41(11):1735-1742. doi: 10.1007/s00270-018-1998-9. Epub 2018 Jun 7. PMID: 29881934. |
Wrong comparison: complete versus incomplete ablation |
|
Lawrenz JM, Ilaslan H, Lietman SA, Joyce MJ, Winalski CS, Mesko NW. Minimally invasive techniques for pain palliation in extraspinal bone metastases: a review of conventional methods and cryoablation. Current Orthopaedic Practice. 2016 Sep 1;27(5):547-52. |
Background article |
|
Lawrenz JM, Ilaslan H, Lietman SA, Joyce MJ, Winalski CS, Mesko NW. Minimally invasive techniques for pain palliation in extraspinal bone metastases: a review of embolization, laser photocoagulation, percutaneous ethanol ablation, and microwave ablation. Current Orthopaedic Practice. 2017 Jan 1;28(1):97-103. |
Background article |
|
Lee HL, Kuo CC, Tsai JT, Chen CY, Wu MH, Chiou JF. Magnetic Resonance-Guided Focused Ultrasound Versus Conventional Radiation Therapy for Painful Bone Metastasis: A Matched-Pair Study. J Bone Joint Surg Am. 2017 Sep 20;99(18):1572-1578. doi: 10.2106/JBJS.16.01248. PMID: 28926387. |
Wrong intervention |
|
Ma Y, Wallace AN, Waqar SN, Morgensztern D, Madaelil TP, Tomasian A, Jennings JW. Percutaneous Image-Guided Ablation in the Treatment of Osseous Metastases from Non-small Cell Lung Cancer. Cardiovasc Intervent Radiol. 2018 May;41(5):726-733. doi: 10.1007/s00270-017-1843-6. Epub 2017 Dec 4. PMID: 29204695. |
No comparison between modalities, and no systematic review |
|
Masala S, Guglielmi G, Petrella MC, Mastrangeli R, Meschini A, Anselmetti GC, Bartolucci DA, Mammucari M, Manenti G, Simonetti G. Percutaneous ablative treatment of metastatic bone tumours: visual analogue scale scores in a short-term series. Singapore Med J. 2011 Mar;52(3):182-9. PMID: 21451927. |
No systematic review; retrospective study |
|
Mesko NW, Lawrenz JM, Lietman SA, Joyce MJ, Winalski CS, Ilaslan H. Minimally invasive techniques for pain palliation in extraspinal bone metastases: a review of cementoplasty and radiofrequency ablation. Current Orthopaedic Practice. 2016 Nov 1;27(6):686-95. |
Background article |
|
Rodrigues DB, Stauffer PR, Vrba D, Hurwitz MD. Focused ultrasound for treatment of bone tumours. Int J Hyperthermia. 2015 May;31(3):260-71. doi: 10.3109/02656736.2015.1006690. Epub 2015 Mar 31. PMID: 25825987. |
Background article |
|
Ryan A, Byrne C, Pusceddu C, Buy X, Tsoumakidou G, Filippiadis D. CIRSE Standards of Practice on Thermal Ablation of Bone Tumours. Cardiovasc Intervent Radiol. 2022 May;45(5):591-605. doi: 10.1007/s00270-022-03126-x. Epub 2022 Mar 29. PMID: 35348870; PMCID: PMC9018647. |
Background article |
|
Simões Corrêa Galendi J, Yeo SY, Simic D, Grüll H, Stock S, Müller D. A time-driven activity-based costing approach of magnetic resonance-guided high-intensity focused ultrasound for cancer-induced bone pain. Int J Hyperthermia. 2022;39(1):173-180. doi: 10.1080/02656736.2021.2023768. PMID: 35021942. |
Wrong outcome: about costs |
|
Thacker PG, Callstrom MR, Curry TB, Mandrekar JN, Atwell TD, Goetz MP, Rubin J. Palliation of painful metastatic disease involving bone with imaging-guided treatment: comparison of patients' immediate response to radiofrequency ablation and cryoablation. AJR Am J Roentgenol. 2011 Aug;197(2):510-5. doi: 10.2214/AJR.10.6029. PMID: 21785102. |
No systematic review; retrospective study |
|
Tomasian A, Jennings JW. Percutaneous Minimally Invasive Thermal Ablation of Osseous Metastases: Evidence-Based Practice Guidelines. AJR Am J Roentgenol. 2020 Aug;215(2):502-510. doi: 10.2214/AJR.19.22521. Epub 2020 May 26. PMID: 32452697. |
Background article |
|
Tsai YC, Lee HL, Kuo CC, Chen CY, Hsieh KL, Wu MH, Wen YC, Yu HW, Hsu FC, Tsai JT, Chiou JF. Prognostic and predictive factors for clinical and radiographic responses in patients with painful bone metastasis treated with magnetic resonance-guided focused ultrasound surgery. Int J Hyperthermia. 2019;36(1):932-937. doi: 10.1080/02656736.2019.1655593. PMID: 31535591. |
Wrong study aim: prognostic factors for response, no comparison between modalities |
|
Verbiest A, De Meerleer G, Albersen M, Beuselinck B. Non-Surgical Ablative Treatment of Distant Extracranial Metastases for Renal Cell Carcinoma: A Systematic Review. Kidney Cancer. 2018 Jan 1;2(1):57-67. |
Wrong population: no bone metastases |
|
Zhang Q, Zhang K, Xie B, Ren Y, Li G, Zhang L, Wang A, Li Y. Analysis of curative effect of I125 implantation combined with radiofrequency ablation in treating bone metastases. J Bone Oncol. 2018 Jan 8;11:23-26. doi: 10.1016/j.jbo.2018.01.001. PMID: 29892521; PMCID: PMC5993946. |
Wrong comparison |
|
Zugaro L, DI Staso M, Gravina GL, Bonfili P, Gregori L, Franzese P, Marampon F, Tombolini V, DI Cesare E, Masciocchi C. Treatment of osteolytic solitary painful osseous metastases with radiofrequency ablation or cryoablation: A retrospective study by propensity analysis. Oncol Lett. 2016 Mar;11(3):1948-1954. doi: 10.3892/ol.2016.4108. Epub 2016 Jan 14. PMID: 26998106; PMCID: PMC4774585. |
No systematic review; retrospective study |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 10-10-2024
Laatst geautoriseerd : 10-10-2024
Geplande herbeoordeling : 10-10-2029
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Het initiatief voor deze richtlijn is afkomstig van Nederlandse Orthopaedische Vereniging (NOV). De richtlijn is opgesteld door een multidisciplinaire commissie met vertegenwoordigers vanuit de orthopedisch chirurgen, radiotherapeuten, radiologen, nucleair geneeskundigen, internist-oncologen, en chirurgen/traumatologen.
Het perspectief van patiënten werd ingebracht door een vertegenwoordiger van de Nederlandse Federatie van Kankerpatiëntenorganisaties (NFK) samen met een aantal patiënten. Zie hiervoor ook de samenstelling van de werkgroep.
Werkgroep
- Dr. J.J.W. Ploegmakers, orthopedisch chirurg, Universitair Medisch Centrum Groningen, NOV (voorzitter)
- Dr. P.G. Westhoff, radiotherapeut-oncoloog, Radboud UMC Nijmegen, NVRO (vice-voorzitter)
- Dr. E.F. Dierselhuis, orthopedisch chirurg, Radboud UMC Nijmegen, NOV
- Drs. B. Meesters, traumachirurg, Zuyderland Medisch Centrum, NVVH NVT
- Dr. C.S.P. van Rijswijk, interventieradioloog, Leids Universitair Medisch Centrum, NVVR
- Dr. F. Intema, nucleair geneeskundige, Rijnstate Ziekenhuis, NVNG
- Prof. Dr. Y.M. van der Linden, radiotherapeut-oncoloog, Leids Universitair Medisch Centrum, NVRO
- Dr. mr. J.J. de Haan, internist-oncoloog, Universitair Medisch Centrum Groningen, NIV
- W. van der Veen, namens Borstkankervereniging Nederland (BVN) (tot juni 2023)
- E. Walrave, namens Longkanker Nederland (tot januari 2022)
- J. Rijlaarsdam, namens Longkanker Nederland (van februari 2022 tot september 2022)
- Dr. K.M. Holtzer, Nederlandse Federatie van Kankerpatiëntenorganisaties (vanaf september 2022)
Met ondersteuning van
- Dr. M.A. Pols, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs M. Oerbekke, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot september 2022)
- Dr. J. Boschman, senior adviseur (vanaf september 2022)
- I. van Dusseldorp, senior informatiespecialist, Kennisinstituut van de Federatie Medisch Specialisten
Wilma van der Veen heeft namens de NFK/BVN een waardevolle bijdrage geleverd aan de totstandkoming van deze richtlijnmodules. Helaas heeft zij de afronding van de richtlijn niet meer mee mogen maken. De werkgroep is Wilma dankbaar voor de prettige en open samenwerking en heeft bewondering voor de manier waarop zij zich heeft ingezet voor huidige en toekomstige patiënten.
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
E. Dierselhuis
|
Orthopedisch chirurg |
Opleidingscommissie Nederlandse Orthopedische Vereniging (onbetaald) |
Betrokken bij onderzoek naar BOS-score (niet commercieel)
|
Geen restricties |
|
J. de Haan
|
Internist-oncoloog |
Geen |
Betrokken bij onderzoek van Astellas, Boehringer, Cogent, Incyte, Inhibrx, Zentalis, Zymeworks (geen relatie met onderwerp richtlijn, geen persoonlijke vergoeding) |
Geen restricties |
|
F. Intema |
Nucleair geneeskundige |
Geen |
Geen |
Geen restricties |
|
Y. van der Linden
|
Radiotherapeut-oncoloog. Hoofd expertisecentrum palliatieve zorg. |
Course director ESTRO cursus Palliative Care and Radiotherapy |
Betrokken bij onderzoek naar BOS-score (niet commercieel) AlpduZes UL 2013-6286 OPTIMAL study |
Geen restricties |
|
B. Meesters
|
Traumachirurg |
Bestuurslid Nederlandse Vereniging voor Trauma Chirurgie |
Geen |
Geen restricties |
|
J. Ploegmakers |
Orthopedisch chirurg |
Geen |
Stryker, 3M: honorarium dienstverlening (2020, 2021, geen relatie met onderwerp richtlijn)
|
Geen restricties |
|
J. Rijlaarsdam
|
Panellid Longkanker Nederland. Onbezoldigd |
Geen |
Geen |
Geen restricties |
|
C. van Rijswijk |
Interventieradioloog |
Geen |
PI van FLOW-project (met Philips): geen relatie met botmetastasen. W.L. Gore & Associates: honorarium dienstverlening (2021, 2022, geen relatie met onderwerp richtlijn Cordis Netherlands: honorarium dienstverlening (2022, geen relatie met onderwerp richtlijn) |
Geen restricties |
|
W. van der Veen |
Patient advocate Borstkankervereniging Nederland, onbetaald |
Vrijwilliger Abrona, dagbesteding, onbetaald |
Geen |
Geen restricties |
|
P. Westhoff |
Radiotherapeut-oncoloog |
Geen |
Betrokken bij onderzoek naar BOS-score (niet commercieel) |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door deelname in de werkgroep van vertegenwoordigers vanuit patiëntenverenigingen en van de Nederlandse Federatie van Kankerpatiëntenorganisaties. De vertegenwoordigers zijn betrokken bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen en aanbevelingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan betrokken patiëntenverenigingen en de eventueel aangeleverde commentaren zijn besproken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Module |
Uitkomst raming |
Toelichting |
|
Module Lokale ablatie |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en daarom naar verwachting geen substantiële financiële gevolgen zal hebben voor de collectieve uitgaven. |
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met botmetastasen door middel van een schriftelijke knelpuntenanalyse. De werkgroep beoordeelde de aanbeveling(en) uit de eerdere richtlijn Botmetastasen (IKNL, 2010) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door de NVRO, IGJ, KNGF, NVKF, NVRO, NVKG. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van de specifieke uitgangsvraag zijn genoemd bij de overwegingen. Een aantal bijkomende aspecten van de organisatie van zorg worden behandeld in de modules Ondersteunende zorg en Multidisciplinaire zorg.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënten)organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.