Phyllodestumoren - Resectiemarges
Uitgangsvraag
Wat is de plaats van de resectiemarge bij de chirurgische behandeling van een phyllodestumor?
De uitgangsvraag omvat de volgende deelvragen:
- Welke resectiemarge dient te worden gehanteerd bij de chirurgische behandeling van een benigne phyllodestumor?
- Welke resectiemarge dient te worden gehanteerd bij de chirurgische behandeling van een borderline phyllodestumor?
- Welke resectiemarge dient te worden gehanteerd bij de chirurgische behandeling van een maligne phyllodestumor?
Aanbeveling
Verricht geen re-excisie bij een benigne phyllodestumor; een positieve resectiemarge is acceptabel.
Verwijder een borderline phyllodestumor bij voorkeur met een tumornegatieve (free on ink) marge. Bij een positieve resectiemarge heeft een re-excisie de voorkeur, de beperkte bewijskracht van de relevante literatuur in acht nemend.
Verwijder een maligne phyllodestumor met een tumornegatieve marge (free on ink). Bij irradicale resectie dient een re-excisie verricht te worden.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
In de systematische review van Lu (2019) worden verschillende studies besproken die lokale recidieven rapporteren bij patiënten met een phyllodestumor die een resectie hebben ondergaan. De meeste studies hanteerden 1 centimeter als een adequate resectiemarge. Een van de vergelijkingen uit de systematische review gaat om de lokale recidieven bij een resectie met een negatieve resectiemarge versus een resectie met een positieve resectiemarge.
Hiervoor werden subgroepanalyses gedaan voor benigne, borderline en maligne phyllodestumoren. Er werden klinisch relevante verschillen gevonden voor het effect van een negatieve resectiemarge op lokale recidieven, maar de bewijskracht was zeer laag. Er werden geen data gerapporteerd over totale overleving en complicaties.
Er werden slechts observationele cohortstudies geïncludeerd in de systematische review van Lu (2019), omdat er geen gerandomiseerde studies zijn gepubliceerd over resectiemarges bij phyllodestumoren. De studies laten klinische en statistische heterogeniteit zien die deels onverklaarbaar is. Daarnaast waren de aantallen geïncludeerde patiënten laag, met name bij de subgroepanalyses. Bovendien was er sprake van risk of bias, met name omdat er niet gecorrigeerd werd voor mogelijke confounders. Deze factoren resulteren in een zeer lage bewijskracht.
Op basis van de cruciale uitkomstmaten die werden gerapporteerd in deze systematische review kan er dus geen eenduidige conclusie worden getrokken over de invloed van een negatieve resectiemarge op de kans op een lokaal recidief na chirurgische behandeling van een benigne, borderline of maligne phyllodestumor.
Na de systematische review van Lu verscheen er nog een aantal studies dat de resectiemarges adresseert.
Neron onderzocht retrospectief in 13 centra in Frankrijk de recidiefkans na excisie van een maligne phyllodestumor (Neron, 2020). In deze serie werden 212 patiënten geïncludeerd, waarvan er 123 sparend werden geopereerd, met verschillende marges. De mediane tumorgrootte was 58 mm en de follow-up duur 4,1 jaar. De enige factor van invloed op lokaal recidiefkans bleek het soort chirurgie (mastectomie versus lokale excisie, HR 4.85). De invloed van marge op lokaal recidief was niet aanwezig (HR 0,68 voor een marge van ≥ 3 mm versus 0-1-2 mm, p = 0,42). Thind (2020) publiceerde na Lu nog een systematische review naar de invloed van resectiemarge op lokaal recidief bij borderline en maligne phyllodestumoren (NB wel geïncludeerd door Bogach, maar voldoet niet aan de PICO). Hierin werden 10 studies geïncludeerd. De kans op lokaal recidief na resectie met marge > 1 cm werd vergeleken met de recidiefkans na resectie met marge < 1 cm. De kans op lokaal recidief was niet groter bij een marge < 1 cm voor zowel borderline als maligne phyllodes. Wen (2020) rapporteert de recidiefkans in een retrospectieve single centre Canadese studie. Van 96 geïncludeerde patiënten hadden 75 een benigne phyllodes, 10 een borderline (BL) en 10 een maligne (M). Gezien de kleine aantallen BL en M zijn alleen de bevindingen betreffende benigne phyllodes noemenswaardig. Na een mediane follow-up duur van 47,3 maanden was er een local recurrence rate van 4% in deze groep. Er waren 38 patiënten met een positieve marge na 1 ingreep, hiervan ondergingen 20 een re-operatie. De kans op lokaal recidief (mediaan na 18,4 maanden) was niet groter in de groep die geen 2e operatie onderging.
De grootste single centre retrospectieve serie is gepubliceerd door Rosenberger et al in 2020 in de Journal of Clinical Oncology. In deze studie werden 550 patiënten uit 11 centra geïncludeerd, met een mediane tumorgrootte van 3 cm. Hiervan was 68,9% benigne, 19,6% borderline en 10,5% (n=58) maligne. Mediane follow-up duur was 36,7 maanden. Na de eerste ingreep (lokale excisie bij 93,8%) was er sprake van een tumorpositieve marge bij 42%, hiervan onderging 68,4% een tweede ingreep. Uiteindelijk had >10% van de patiënten een positieve marge. Recidieven traden op bij 3,3% (n=18). Dit betrof met name lokale recidieven (n=15). Mediane duur tot aan lokaal recidief was 18,8 maanden. Er was sprake van upgrading bij 2 benigne phyllodestumoren (naar borderline) en 1 borderline phyllodes (naar maligne). Afstandsrecidief trad op bij 3 patiënten, na mediaan 7 maanden. De kans op lokaal recidief was bij univariate analyse afhankelijk van subtype (maligne versus borderline/benigne), stromale atypie, stromale ovegroei en grootte. Positieve resectiemarge en een resectiemarge van < 2 mm was niet geassocieerd met een grotere kans op locaal recidief (respectievelijk OR 0,96 en 0,39). Dit gold voor alle subtypen.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Een patiënt met een borderline phyllodestumor welke met een tumorpositief snijvlak is verwijderd zal de positieve en negatieve effecten van re-excisie tegen elkaar af moeten wegen: het verminderen van het lokaal recidief risico versus de negatieve gevolgen van een re-operatie voor cosmetisch eindresultaat. Dit besluit zal door middel van gemeenschappelijke besluitvorming (shared decision making) genomen moeten worden.
Kosten (middelenbeslag)
Bij borderline en maligne phyllodestumoren vermindert een re-excisie bij een positieve resectiemarge het risico op een lokaal recidief. Er is geen bewezen invloed op de overleving. Er zijn geen richtlijnen die bepalen of de kosten van een re-excisie acceptabel zijn voor deze uitkomst.
Aanvaardbaarheid, haalbaarheid en implementatie
Patiënten in Nederland hebben allemaal vergelijkbare toegang tot chirurgische behandeling van phyllodestumoren. Aangezien chirurgische behandeling van mammatumoren in de meeste ziekenhuizen in Nederland wordt aangeboden, zal implementatie van deze aanbevelingen haalbaar zijn.
Rationale van aanbeveling 1: weging van argumenten voor en tegen de interventies
De hierboven beschreven onderzoeken laten zien dat een ruime excisie van een benigne phyllodestumor zeer waarschijnlijk geen invloed heeft op de recidiefkans. Bovendien is een recidief in vrijwel alle gevallen ook weer benigne. Het verrichten van een re-excisie bij positief snijvlak is dan ook niet bijdragend, terwijl er wel een nadeel voor de patiënt is (cosmetisch nadeel, heroperatie).
Rationale van aanbeveling 2: weging van argumenten voor en tegen de interventie
Een borderline phyllodestumor is nadrukkelijk niet maligne en zal ook niet metastaseren. Het belang van het voorkomen van een lokaal recidief is dan ook beperkt.
De beschreven studies laten een beperkte invloed van resectiemarge op recidiefkans zien voor borderline phyllodestumoren. Bij een re-excisie moet dan ook de winst van een mogelijk lagere recidiefkans worden afgewogen tegen de kosten van verminderde cosmetiek en de belasting van een tweede ingreep. Radiotherapie als alternatief voor een noodzakelijk geachte/gewenste re-excisie kan met de patiënt worden besproken (zie module ‘Radiotherapie bij phyllodestumor’).
Rationale van aanbeveling 3: weging van argumenten voor en tegen de interventie
Voor maligne phyllodestumoren rapporteert de meerderheid van de studies een consistent verband tussen het verkrijgen van een vrije resectiemarge en de recidiefkans. De grootte van de tumorvrije marge is in deze studies niet van invloed op de recidiefkans. Hoewel er geen studies zijn die de relatie tussen lokaal recidief en overleving hebben aangetoond, wordt het voorkomen van een lokaal recidief gezien de kans op metastasering van een maligne phyllodestumor zinvol geacht.
Onderbouwing
Achtergrond
Ten tijde van de resectie van een zwelling met verdenking phyllodestumor is niet altijd duidelijk of het om een benigne, borderline of maligne phyllodestumor gaat. Ook kan een vermeend fibroadenoom (op basis van een biopt) na excisie een benigne phyllodestumor blijken te zijn.
In de literatuur zijn verschillende resultaten te vinden met betrekking tot de relatie tussen resectiemarge en kans op lokaal recidief. Over de invloed van de resectiemarge op de lokale recidiefkans voor de verschillende subtypen zijn met name retrospectieve, kleine studies verschenen, met wisselende uitkomsten. Dit leidt tot grote heterogeniteit met betrekking tot chirurgische behandeling van phyllodestumoren. In deze module wordt beoogd de relevante literatuur te analyseren om zo tot een aanbeveling te komen met betrekking tot de chirurgische behandeling voor de verschillende subtypes.
Conclusies
Local recurrence
|
Very low GRADE |
The evidence is very uncertain about the effect of a resection with a negative margin (no tumor on ink) compared to resection with a positive margin on local recurrence in patients with a benign, borderline or malignant phyllodes tumor.
Source: Lu, 2019 |
Overall survival
|
- GRADE |
No studies reported the overall survival of patients with a malignant phyllodes tumor resected with a negative margin compared to patients resected with a positive margin.
Source: - |
Complications
|
- GRADE |
No studies reported the complications of patients with a benign, borderline or malignant phyllodes tumor resected with a negative margin compared to patients resected with a positive margin.
Source: - |
Samenvatting literatuur
Description of studies
Lu (2019) conducted a systematic review and meta-analysis to investigate local recurrence rates among benign, borderline and malignant phyllodes tumors. Moreover, multiple risk factors were assessed, among which surgical margin status. Multiple databases (PubMed, EMBASE, Medline, Web of Science, and Cochrane Library) were searched from 1995 to May 2018. Studies of uni- or bilateral phyllodes tumors with more than 50 patients receiving surgical treatments were included. For the analysis on surgical margin status, studies reporting local recurrence rates stratified by surgical margin status were included. Review papers, conference abstracts, meta-analyses, editorial/comment papers, and case reports were excluded. Twenty-four retrospective cohort studies assessing the association between local recurrence and surgical margin status were included, with a total of 3806 patients (Bellezza, 2016; Chaney, 2000; Chen, 2005; Cheng, 2006; Chng, 2018; Choi, 2018; Huang, 2014; Jang, 2012; Jung, 2010; Kim, 2013; Matos, 2017; Moo, 2017; Moutte, 2016; Rodrigues, 2018; Slodkowska, 2018; Sotheran, 2005; Spitaleri, 2013; Tan, 2005; Tan, 2012; Tremblay-LeMay, 2017; Tsang, 2012; Wei, 2014; Yom, 2015; Zhou, 2018).
The methodological quality of the included studies was assessed by Lu (2019) using the Newcastle-Ottawa Scale (0-9). The authors reported that all observational studies had a quality score of 5 or higher (Newcastle–Ottawa scale) and were therefore considered to have high quality. However, this is a relatively low threshold and no further details per domain or question were provided.
All studies in the systematic review were observational, which might have introduced selection bias. The sample sizes in the analysis of local recurrence risk factors (a.o. surgical margin status) were relatively small. Moreover, the studies were heterogenous in terms of follow-up period and histological type. Potential confounding was not considered in the analysis. These factors influence the methodological quality.
Results
Local recurrence (critical)
All 24 studies in the systematic review reported on local recurrence.
Nineteen studies reported an odds ratio (OR) for local recurrence (figure 1). The pooled OR was 3.32 (95% CI: 2.18 to 5.06) with an I2 of 35% in favor of a negative margin. This difference is clinically relevant (OR>1.25).
Five studies reported a hazard ratio (HR) for local recurrence (figure 2). The pooled HR was 5.01 (95% CI: 3.10 to 8.11) with an I2 of 39% in favor of a negative margin. This difference is clinically relevant (HR>1.25).
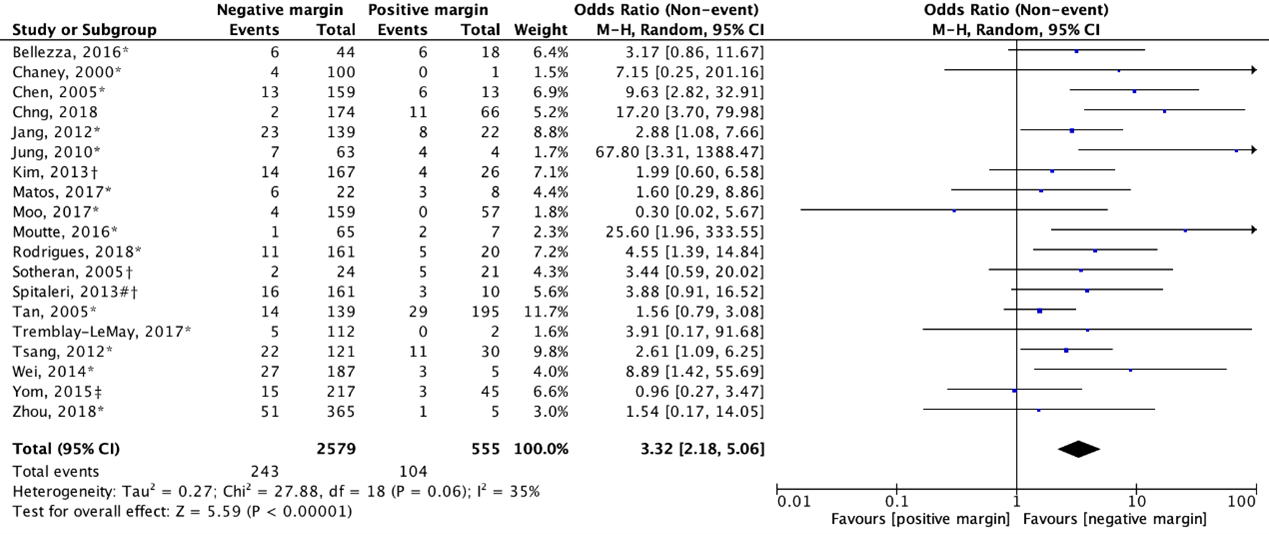
Figure 1. Outcome local recurrence with positive resection margin versus negative resection margin (OR: total)
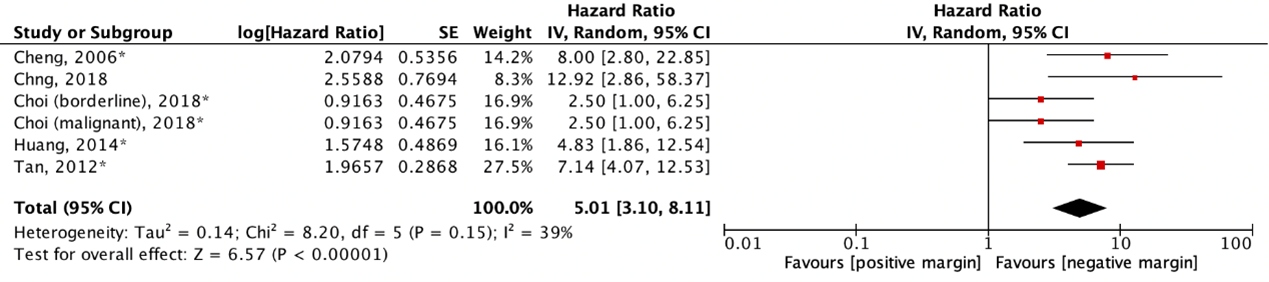
Figure 2. Outcome local recurrence with positive resection margin versus negative resection margin (HR: total)
The results were also separately analyzed for benign, borderline, and malignant grades (figure 3). For benign phyllodes tumors (n=6), the pooled OR was 3.95 (95% CI: 0.58 to 26.76) with an I2 of 58% in favor of a negative margin. For borderline phyllodes tumors (n=5), the pooled OR was 1.60 (95% CI: 0.42 to 6.07) with an I2 of 0% in favor of a negative margin. For malignant phyllodes tumors (n=5), the pooled OR was 6.85 (95% CI: 1.58 to 29.64) with an I2 of 18% in favor of a negative margin. These differences are clinically relevant (OR>1.25). However, it should be noted that the number of events is very low.
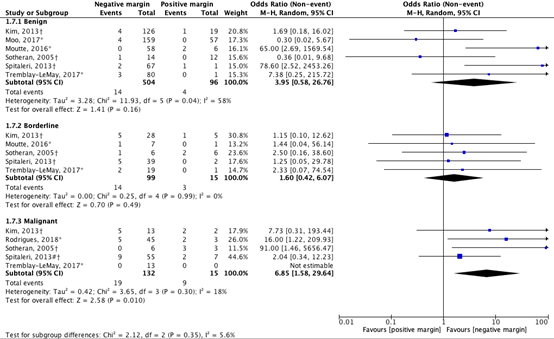
Figure 3. Outcome local recurrence with positive resection margin versus negative resection margin (OR: benign, borderline, malignant)
Lu (2021) also referenced the study of Slodkowska (2018) in the results for surgical margins. However, the results were not shown in the forest plots of the systematic review.
Overall survival (critical)
The systematic review did not report results of studies that assessed overall survival of patients with a malignant phyllodes tumor resected with a negative margin compared to patients resected with a positive margin.
Complications (important)
The systematic review did not report results of studies that assessed complications of patients with a benign, borderline or malignant phyllodes tumor resected with a negative margin compared to patients resected with a positive margin.
Level of evidence of the literature
The evidence was derived from a systematic review of observational studies. Therefore, the level of evidence starts at low GRADE.
Local recurrence
The level of evidence regarding the outcome measure local recurrence was downgraded by three levels because of study limitations (-1; risk of bias, mainly regarding confounding); applicability (-1; bias due to indirectness) and number of included patients (-1; imprecision).
Overall survival
The level of evidence regarding the outcome measure overall survival could not be graded as no studies reported the overall survival of patients with a malignant phyllodes tumor resected with a negative margin compared to patients resected with a positive margin.
Complications
The level of evidence regarding the outcome measure complications could not be graded as no studies reported the complications of patients with a benign, borderline or malignant phyllodes tumor resected with a negative margin compared to patients resected with a positive margin.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following questions:
1. What is the effect of resection with a negative margin (no tumor on ink) compared to resection with a positive margin on local recurrence in patients with a benign phyllodes tumor?
P: patients with benign phyllodes tumor
I: resection with negative/free margin (no tumor on ink)
C: resection with positive margin
O: local recurrence, complications
2. What is the effect of resection with a negative margin (no tumor on ink) compared to resection with a positive margin on local recurrence in patients with a borderline phyllodes tumor?
P: patients with borderline phyllodes tumor
I: resection with negative/free margin (no tumor on ink)
C: resection with positive margin
O: local recurrence, complications
3. What is the effect of resection with a negative margin (no tumor on ink) compared to resection with a positive margin on local recurrence in patients with a malignant phyllodes tumor?
P: patients with malignant phyllodes tumor
I: resection with negative/free margin (no tumor on ink)
C: resection with positive margin
O: local recurrence, overall survival, complications
Relevant outcome measures
The guideline development group considered local recurrence and overall survival as critical outcome measures for decision making; and complications as an important outcome measure for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The guideline development group defined the following differences as a minimal clinically (patient) important difference:
- Local recurrence: HR<0.8 or HR>1.25, OR<0.8 or OR>1.25
- Overall survival: HR<0.8 or HR>1.25, OR<0.8 or OR>1.25
- Complications: Absolute difference >5% for lethal complications, or >25% for serious complications
Search and select (Methods)
Bogach (2022) published a scoping review of the literature on phyllodes tumors. The included papers resulting from the systematic search were reviewed for eligibility.
The databases Medline (via OVID), Embase (via Embase.com) and Cochrane CENTRAL were searched with relevant search terms until 10-08-2020. The detailed search strategy of the scoping review is depicted under the tab Methods.
In total, Bogach (2022) included 183 papers. Forty-five studies reported on resection margins. Studies were selected based on the following criteria:
- Systematic reviews, randomized controlled trials, or observational comparative studies;
- Full-text English language publication;
- Complying with the PICO criteria.
After reading the full text, 44 studies were excluded (see the table with reasons for exclusion under the tab Methods). One systematic review was included.
Results
One systematic review with 24 observational studies was included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- 1 - Bogach J, Shakeel S, Wright FC, Hong NJL. Phyllodes Tumors: A Scoping Review of the Literature. Ann Surg Oncol. 2022 Jan;29(1):446-459. doi: 10.1245/s10434-021-10468-2. Epub 2021 Jul 22. PMID: 34296360.
- 2 - Bellezza G, Prosperi E, Del Sordo R, et al. IMP3 is strongly expressed in malignant phyllodes tumors of the breast: an immunohistochemical study. Int J Surg Pathol. 2016;24:37–42.
- 3 - Chaney AW, Pollack A, McNeese MD, et al. Primary treatment of cystosarcoma phyllodes of the breast. Cancer. 2000;89:1502–11.
- 4 - Chen WH, Cheng SP, Tzen CY, et al. Surgical treatment of phyllodes tumors of the breast: retrospective review of 172 cases. J Surg Oncol. 2005;91:185–94.
- 5 - Cheng SP, Chang YC, Liu TP, et al. Phyllodes tumor of the breast: the challenge persists. World J Surg. 2006;30:1414–21.
- 6 - Chng TW, Gudi M, Lim SH, et al. Validation of the Singapore nomogram for outcome prediction in breast phyllodes tumours in a large patient cohort. J Clin Pathol. 2018;71:125–8.
- 7 - Choi N, Kim K, Shin KH, et al. Malignant and borderline phyllodes tumors of the breast: a multicenter study of 362 patients (KROG 16-08). Breast Cancer Res Treat. 2018;171:335–44.
- 8 - Huang C-C, Liu T-P, Cheng S-P, et al. Surgical treatment of phyllodes tumor of the breast with the trend. J Exp Clin Med. 2014;6:161–5.
- 9 - Jang JH, Choi MY, Lee SK, et al. Clinicopathologic risk factors for the local recurrence of phyllodes tumors of the breast. Ann Surg Oncol. 2012;19:2612–7.
- 10 - Jung C-W, Suh K-S, Lee J-S, et al. Mutation-free expression of c-Kit and PDGFRA in phyllodes tumors of the breast. J Breast Cancer. 2010;13:257.
- 11 - Kim S, Kim JY, Kim DH, et al. Analysis of phyllodes tumor recurrence according to the histologic grade. Breast Cancer Res Treat. 2013;141:353–63.
- 12 - Lu Y, Chen Y, Zhu L, Cartwright P, Song E, Jacobs L, Chen K. Local Recurrence of Benign, Borderline, and Malignant Phyllodes Tumors of the Breast: A Systematic Review and Meta-analysis. Ann Surg Oncol. 2019 May;26(5):1263-1275. doi: 10.1245/s10434-018-07134-5. Epub 2019 Jan 7. PMID: 30617873.
- 13 - Matos AN, Neto J, Antonini, M, Ferraro O, Mancinelli B, Pereira A, Lopes R. Phyllodes tumors of the breast: a retrospective evaluation of cases from the hospital do servidor público estadual de São Paulo. Mastology. 2017;27:339–43.
- 14 - Moo TA, Alabdulkareem H, Tam A, et al. Association between recurrence and re-excision for close and positive margins versus observation in patients with benign phyllodes tumors. Ann Surg Oncol. 2017;24:3088–92.
- 15 - Moutte A, Chopin N, Faure C, et al. Surgical management of benign and borderline phyllodes tumors of the breast. Breast J. 2016;22:547–52.
- 16 - Neron, M., Sajous, C., Thezenas, S., Piperno-Neumann, S., Reyal, F., Laé, M., ... & Firmin, N. (2020). Surgical margins and adjuvant therapies in malignant phyllodes tumors of the breast: a multicenter retrospective study. Annals of Surgical Oncology, 27(6), 1818-1827.
- 17 - Rodrigues MF, Truong PT, McKevitt EC, et al. Phyllodes tumors of the breast: the British Columbia Cancer Agency experience. Cancer Radiother. 2018;22:112–9.
- 18 - Rosenberger LH, Thomas SM, Nimbkar SN, Hieken TJ, Ludwig KK, Jacobs LK, Miller ME, Gallagher KK, Wong J, Neuman HB, Tseng J, Hassinger TE, King TA, Jakub JW. Contemporary Multi-Institutional Cohort of 550 Cases of Phyllodes Tumors (2007-2017) Demonstrates a Need for More Individualized Margin Guidelines. J Clin Oncol. 2021 Jan 20;39(3):178-189. doi: 10.1200/JCO.20.02647. Epub 2020 Dec 10. PMID: 33301374; PMCID: PMC8462612.
- 19 - Slodkowska E, Nofech-Mozes S, Xu B, et al. Fibroepithelial lesions of the breast: a comprehensive morphological and outcome analysis of a large series. Mod Pathol. 2018;31:1073–84.
- 20 - Sotheran W, Domjan J, Jeffrey M, et al. Phyllodes tumours of the breast: a retrospective study from 1982 to 2000 of 50 cases in Portsmouth. Ann R Coll Surg Engl. 2005;87:339–44.
- 21 - Spitaleri G, Toesca A, Botteri E, et al. Breast phyllodes tumor: a review of literature and a single-center retrospective series analysis. Crit Rev Oncol Hematol. 2013;88:427–36.
- 22 - Tan PH, Jayabaskar T, Chuah KL, et al. Phyllodes tumors of the breast: the role of pathologic parameters. Am J Clin Pathol. 2005;123:529–40.
- 23 - Tan PH, Thike AA, Tan WJ, et al. Predicting clinical behaviour of breast phyllodes tumours: a nomogram based on histological criteria and surgical margins. J Clin Pathol. 2012;65:69–76.
- 24 - Thind, A., Patel, B., Thind, K., Isherwood, J., Phillips, B., Dhaliwal, K., & Remoundos, D. D. (2020). Surgical margins for borderline and malignant phyllodes tumours. The Annals of The Royal College of Surgeons of England, 102(3), 165-173.
- 25 - Tremblay-LeMay R, Hogue JC, Provencher L, et al. How wide should margins be for phyllodes tumors of the breast? Breast J. 2017;23:315–22.
- 26 - Tsang JY, Mendoza P, Putti TC, et al. E-cadherin expression in the epithelial components of mammary phyllodes tumors. Hum Pathol. 2012;43:2117–23.
- 27 - Wei J, Tan YT, Cai YC, et al. Predictive factors for the local recurrence and distant metastasis of phyllodes tumors of the breast: a retrospective analysis of 192 cases at a single center. Chin J Cancer. 2014;33:492–500.
- 28 - Wen B, Mousadoust D, Warburton R, Pao JS, Dingee C, Chen L, McKevitt E. Phyllodes tumours of the breast: Outcomes and recurrence after excision. Am J Surg. 2020 May;219(5):790-794. doi: 10.1016/j.amjsurg.2020.02.048. Epub 2020 Feb 28. PMID: 32145921.
- 29 - Yom CK, Han W, Kim SW, et al. Reappraisal of conventional risk stratification for local recurrence based on clinical outcomes in 285 resected phyllodes tumors of the breast. Ann Surg Oncol. 2015;22:2912–8.
- 30 - Zhou ZR, Wang CC, Sun XJ, et al. Prognostic factors in breast phyllodes tumors: a nomogram based on a retrospective cohort study of 404 patients. Cancer Med. 2018;7:1030–42.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: What is the effect of a positive versus a negative surgical margin on local recurrence and complications in the surgical treatment of a phyllodes tumor?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Lu, 2019
[individual study characteristics deduced from Lu, 2019]
|
SR and meta-analysis of 54 cohort studies. The subgroup analysis on surgical margins included 24 studies.
Literature search up to May 2018.
A: Bellezza, 2016 B: Chaney, 2000 C: Chen, 2005 D: Cheng, 2006 E: Chng, 2018 F: Choi, 2018 G: Huang, 2014 H: Jang, 2012 I: Jung, 2010 J: Kim, 2013 K: Matos, 2017 L: Moo, 2017 M: Moutte, 2016 N: Rodrigues, 2018 O: Slodkowska, 2018 P: Sotheran, 2005 Q: Spitaleri, 2013 S: Tan, 2012 U: Tsang, 2012 V: Wei, 2014 W: Yom, 2015 X: Zhou, 2018
Study design: retrospective cohort studies
Country: A: Italy B: USA C: Taiwan D: Taiwan E: Singapore F: Korea G: Taiwan H: Korea I: Korea J: South Korea K: Brazil L: USA M: France N: Canada O: Canada P: UK Q: Italy S: Singapore U: Hong Kong V: China W: Korea X: China
Source of funding and conflicts of interest: Funding was not reported. The authors declare that they have no conflict of interest.
|
Inclusion criteria SR: more than 50 patients - PT patients received surgical treatments - included the LR rate with the clinicpathologic factor surgical margin - published between 1 January 1995 and 31 May 2018
Exclusion criteria SR: - review papers, conference abstracts, meta-analyses, editorial/comment papers, and case reports
24 studies included for the subgroup analysis
Important patient characteristics at baseline:
N, mean/median age A: 62, 42 years B: 101, 41 years C: 172, 37 years D: 182, 37 years E: 240, 37.7 years F: 362, 43 years G: 170, 39 years H: 164, 43 years I: 67, 37.6 years J: 193, 40.5 years K: 52, 45.9 years L: 216, 35 years M: 76, 37.9 years N: 183, 48 years O: 94, not available P: 50, not available Q: 172, 44 years R: 335, 42 years S: 552, 42 years T: 114, 44.4 years U: 152, 44 years V: 192, 40 years W: 285, 36.4 years X: 404, 41 years
Histological type (N) Be/Bo/Ma A: 40/13/9 B: 59/12/30 C: 131/12/29 D: 138/13/31 E: 196/27/17 F: 0/127/235 G: 106/32/32 H: 82/42/40 I: 39/16/12 J: 145/33/15 K: 30/11/11 L: 216/0/0 M: 67/9/0 N: 81/49/49 O: 45/28/21 P: 29/12/9 Q: 68/42/62 R: 250/54/31 S: 399/103/50 T: 81/20/13 U: 90/42/20 V: 80/63/49 W: 191/61/33 X: 168/184/52 |
Resection with a negative (free) margin.
|
Resection with a positive margin, defined as a tumor present:
A: on the surgical margin. B: on the surgical margin. C: on the surgical margin. D: on the surgical margin. E: (not available) F: on the surgical margin. G: on the surgical margin. H: on the surgical margin. I: on the surgical margin. J: on the surgical margin or <1mm from the margin. K: on the surgical margin. L: on the surgical margin. M: on the surgical margin. N: on the surgical margin. O: (not available) P: on the surgical margin or <1mm from the margin. Q: on the surgical margin or <1mm from the margin. R: on the surgical margin. S: on the surgical margin. T: on the surgical margin. U: on the surgical margin. V: on the surgical margin. W: on the surgical margin or <0.1mm from the margin. X: on the surgical margin.
|
Median follow-up (months):
A: not available B: 47 C: 71 D: 33 E: 19.9 F: 60 G: 18.9 H: 33.6 I: not available J: 65 K: 53.9 L: 35.5 M: 58 N: 65 O: 56 P: 35 Q: 85 R: 20.4 S: 56.9 T: 15.48Be/59.88Bo/ 65.04Ma U: 75 V: 72.9 W: 81.1 X: 46
|
Local recurrence rate
Positive vs. negative (total, N=19) * OR 3.32; 95% CI 2.18–5.06;
Positive vs. negative (N=5) HR, 5.00; 95% CI 3.09–8.10;
Positive vs. negative (benign, N=6) OR 3.95; 95% CI 0.58–26.76
Positive vs. negative (borderline, N=5) OR 1.60; 95% CI 0.42–6.07
Positive vs. negative (malignant, N=5) OR 6.85; 95% CI 1.58–29.64
* In Spitaleri (2013), three events (20 altogether) were not LR (recurrence in the breast and axilla (n=1), distant metastases (n=2)).
Overall survival
Not reported. Complications
Not reported.
|
Authors concluded that surgical margin status may be one of the risk factors for local recurrence. Different management strategies could be considered for different PT grades.
Local recurrence outcomes from Slodkowska (2018) are untraceable in the systematic review. |
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Lu, 2019 |
Yes
Reason: PICOS criteria for in- and exclusion were reported. |
Yes
Reason: Multiple databases were searched. The search period and strategy were described. |
No
Reason: The excluded studies were not listed or referenced. |
Yes
Reason: Characteristics of the included studies are presented in a table. |
No
Reason: Potential confounding was not mentioned nor taken into account in the analyses. |
Yes
Reason: The quality of each eligible study was rated independently by two reviewers using the modified Newcastle–Ottawa scale. |
No
Reason: High clinical heterogeneity (a.o. histological type, follow-up period) and statistical heterogeneity (Chi square, I2). |
Yes
Reason: No significant publication bias was observed in the funnel plots. |
No
Reason: Conflicts were not reported for each individual study. |
Table of excluded studie
|
Reference |
Reason for exclusion |
|
Abusalem OT, Al-Masri A. Phyllodes Tumors of the Breast. Mater Sociomed. 2011;23(4):200-5. doi: 10.5455/msm.2011.23.200-205. PMID: 26664294; PMCID: PMC4651313. |
Wrong comparison. |
|
Adam MJ, Bendifallah S, Kalhorpour N, Cohen-Steiner C, Ropars L, Mahmood A, Rousseau C, Leveque J, Nyangoh Timoh K, Der Some A, Ouldamer L, Legendre G, Ballester M, Daraï E, Canlorbe G, Lavoue V. Time to revise classification of phyllodes tumors of breast? Results of a French multicentric study. Eur J Surg Oncol. 2018 Nov;44(11):1743-1749. doi: 10.1016/j.ejso.2018.08.007. Epub 2018 Aug 18. PMID: 30195948. |
Wrong comparison (5 mm margin cut-off). |
|
Al-Alawi Y, Alhefdhi A, Aldrees B, AlSani S, Anwar I, Tulbah A, Al-Tweigeri T, et al. Phyllodes Breast Tumors: A Review of a Single Saudi Institution Experience. Clin Surg. 2018; 3: 1904. |
Wrong comparison. |
|
Asoglu O, Ugurlu MM, Blanchard K, Grant CS, Reynolds C, Cha SS, Donohue JH. Risk factors for recurrence and death after primary surgical treatment of malignant phyllodes tumors. Ann Surg Oncol. 2004 Nov;11(11):1011-7. doi: 10.1245/ASO.2004.02.001. PMID: 15525831. |
Wrong comparison (1 cm margin cut-off). |
|
Barrio AV, Clark BD, Goldberg JI, Hoque LW, Bernik SF, Flynn LW, Susnik B, Giri D, Polo K, Patil S, Van Zee KJ. Clinicopathologic features and long-term outcomes of 293 phyllodes tumors of the breast. Ann Surg Oncol. 2007 Oct;14(10):2961-70. doi: 10.1245/s10434-007-9439-z. Epub 2007 Jun 12. PMID: 17562113. |
Included in selected systematic review (Lu, 2019). |
|
Ben Hassouna J, Damak T, Gamoudi A, Chargui R, Khomsi F, Mahjoub S, Slimene M, Ben Dhiab T, Hechiche M, Boussen H, Rahal K. Phyllodes tumors of the breast: a case series of 106 patients. Am J Surg. 2006 Aug;192(2):141-7. doi: 10.1016/j.amjsurg.2006.04.007. PMID: 16860620. |
Included in selected systematic review (Lu, 2019). |
|
Cervoni GE, Quintana L, Erlinger AL, Neo DT, Recht A, Schnitt SJ, Hacker MR, Sharma R. Local recurrence after breast-conserving therapy for phyllodes tumors: A 15-year retrospective review. Breast J. 2020 May;26(5):988-990. doi: 10.1111/tbj.13707. Epub 2019 Dec 9. PMID: 31814215. |
Wrong comparison (1 mm margin cut-off). |
|
Chen, H. M., Chen, S. C., Hsueh, S., Hwang, T. L., Jeng, L. B., Jan, Y. Y., ... & Chen, M. F. (1993). Surgical treatment of phyllodes tumor of the breast. Review of the clinico-pathologic features. Journal of Surgical Association Republic of China, 26(5), 1974-1981. |
Included in selected systematic review (Lu, 2019). |
|
Choi N, Kim K, Shin KH, Kim Y, Moon HG, Park W, Choi DH, Kim SS, Ahn SD, Kim TH, Chun M, Kim YB, Kim S, Choi BO, Kim JH. The Characteristics of Local Recurrence After Breast-Conserving Surgery Alone for Malignant and Borderline Phyllodes Tumors of the Breast (KROG 16-08). Clin Breast Cancer. 2019 Oct;19(5):345-353.e2. doi: 10.1016/j.clbc.2019.04.003. Epub 2019 Apr 11. PMID: 31103280. |
Included in selected systematic review (Lu, 2019). |
|
Cowan ML, Argani P, Cimino-Mathews A. Benign and low-grade fibroepithelial neoplasms of the breast have low recurrence rate after positive surgical margins. Mod Pathol. 2016 Mar;29(3):259-65. doi: 10.1038/modpathol.2015.157. Epub 2016 Jan 8. PMID: 26743469. |
Wrong population (fibroadenoma with phyllodal features). |
|
Di Liso E, Bottosso M, Lo Mele M, Tsvetkova V, Dieci MV, Miglietta F, Falci C, Faggioni G, Tasca G, Giorgi CA, Giarratano T, Mioranza E, Michieletto S, Saibene T, Dei Tos AP, Conte P, Guarneri V. Prognostic factors in phyllodes tumours of the breast: retrospective study on 166 consecutive cases. ESMO Open. 2020 Oct;5(5):e000843. doi: 10.1136/esmoopen-2020-000843. PMID: 33020219; PMCID: PMC7537333. |
Wrong comparison. |
|
Ditsatham C, Chongruksut W. Phyllodes tumor of the breast: diagnosis, management and outcome during a 10-year experience. Cancer Manag Res. 2019 Aug 19;11:7805-7811. doi: 10.2147/CMAR.S215039. PMID: 31695485; PMCID: PMC6707441. |
Wrong comparison (free vs. wide margin). |
|
Jang JH, Choi MY, Lee SK, Kim S, Kim J, Lee J, Jung SP, Choe JH, Kim JH, Kim JS, Cho EY, Lee JE, Nam SJ, Yang JH. Clinicopathologic risk factors for the local recurrence of phyllodes tumors of the breast. Ann Surg Oncol. 2012 Aug;19(8):2612-7. doi: 10.1245/s10434-012-2307-5. Epub 2012 Apr 4. PMID: 22476816. |
Included in selected systematic review (Lu, 2019). |
|
Kapiris I, Nasiri N, A'Hern R, Healy V, Gui GP. Outcome and predictive factors of local recurrence and distant metastases following primary surgical treatment of high-grade malignant phyllodes tumours of the breast. Eur J Surg Oncol. 2001 Dec;27(8):723-30. doi: 10.1053/ejso.2001.1207. PMID: 11735168. |
Wrong comparison (1 cm margin cut-off). |
|
Kim S, Kim JY, Kim DH, Jung WH, Koo JS. Analysis of phyllodes tumor recurrence according to the histologic grade. Breast Cancer Res Treat. 2013 Oct;141(3):353-63. doi: 10.1007/s10549-013-2684-x. Epub 2013 Sep 24. PMID: 24062207. |
Included in selected systematic review (Lu, 2019). |
|
Lenhard MS, Kahlert S, Himsl I, Ditsch N, Untch M, Bauerfeind I. Phyllodes tumour of the breast: clinical follow-up of 33 cases of this rare disease. Eur J Obstet Gynecol Reprod Biol. 2008 Jun;138(2):217-21. doi: 10.1016/j.ejogrb.2007.08.002. Epub 2007 Sep 14. PMID: 17868973. |
Wrong intervention. |
|
Lim RS, Cordeiro E, Lau J, Lim A, Roberts A, Seely J. Phyllodes Tumors-The Predictors and Detection of Recurrence. Can Assoc Radiol J. 2021 May;72(2):251-257. doi: 10.1177/0846537119899553. Epub 2020 Feb 24. PMID: 32090614. |
Wrong comparison (1 mm margin cut-off). |
|
Lin CC, Chang HW, Lin CY, Chiu CF, Yeh SP. The clinical features and prognosis of phyllodes tumors: a single institution experience in Taiwan. Int J Clin Oncol. 2013 Aug;18(4):614-20. doi: 10.1007/s10147-012-0442-4. Epub 2012 Jul 7. PMID: 22773245. |
Wrong comparison (width of surgical margin). |
|
Mangi, A. A., Smith, B. L., Gadd, M. A., Tanabe, K. K., Ott, M. J., & Souba, W. W. (1999). Surgical management of phyllodes tumors. Archives of Surgery, 134(5), 487-493. |
Wrong comparison (1 cm margin cut-off). |
|
Mituś J, Reinfuss M, Mituś JW, Jakubowicz J, Blecharz P, Wysocki WM, Skotnicki P. Malignant phyllodes tumor of the breast: treatment and prognosis. Breast J. 2014 Nov-Dec;20(6):639-44. doi: 10.1111/tbj.12333. Epub 2014 Sep 17. PMID: 25227987. |
Wrong comparison (1 cm margin cut-off). |
|
Mitus JW, Blecharz P, Jakubowicz J, Reinfuss M, Walasek T, Wysocki W. Phyllodes tumors of the breast. The treatment results for 340 patients from a single cancer centre. Breast. 2019 Feb;43:85-90. doi: 10.1016/j.breast.2018.11.009. Epub 2018 Nov 26. PMID: 30521986. |
Wrong comparison (width of surgical margin). |
|
Mokbel K, Price RK, Mostafa A, Wells CA, Carpenter R. Phyllodes tumour of the breast: a retrospective analysis of 30 cases. Breast. 1999 Oct;8(5):278-81. doi: 10.1054/brst.1999.0058. PMID: 14965745. |
Wrong comparison. |
|
Moo TA, Alabdulkareem H, Tam A, Fontanet C, Lu Y, Landers A, D'Alfonso T, Simmons R. Association Between Recurrence and Re-Excision for Close and Positive Margins Versus Observation in Patients with Benign Phyllodes Tumors. Ann Surg Oncol. 2017 Oct;24(10):3088-3092. doi: 10.1245/s10434-017-5955-7. Epub 2017 Aug 1. PMID: 28766221. |
Included in selected systematic review (Lu, 2019). |
|
Neron, M., Sajous, C., Thezenas, S., Piperno-Neumann, S., Reyal, F., Laé, M., ... & Firmin, N. (2020). Surgical margins and adjuvant therapies in malignant phyllodes tumors of the breast: a multicenter retrospective study. Annals of Surgical Oncology, 27(6), 1818-1827. |
Wrong comparison (width of surgical margin). |
|
Noordman PCW, Klioueva NM, Weimann MN, Borgstein PJ, Vrouenraets BC. Phyllodes tumors of the breast: a retrospective analysis of 57 cases. Breast Cancer Res Treat. 2020 Jun;181(2):361-367. doi: 10.1007/s10549-020-05620-7. Epub 2020 Apr 10. PMID: 32277376. |
Wrong comparison and wrong population. |
|
Onkendi EO, Jimenez RE, Spears GM, Harmsen WS, Ballman KV, Hieken TJ. Surgical treatment of borderline and malignant phyllodes tumors: the effect of the extent of resection and tumor characteristics on patient outcome. Ann Surg Oncol. 2014 Oct;21(10):3304-9. doi: 10.1245/s10434-014-3909-x. Epub 2014 Jul 18. PMID: 25034817. |
Wrong comparison (1 cm margin cut-off). |
|
Padmanabhan, P., Patrick, E., Policastro, T., Low, N., Nerurkar, A., Rusby, J., ... & Krupa, K. (2019). P030. Retrospective review of benign phyllodes cases to analyse treatment, follow-up practice and factors predictive of local recurrence. European Journal of Surgical Oncology, 45(5), 893-894. |
Conference abstract. |
|
Pandey, M., Mathew, A., Kattoor, J., Abraham, E. K., Mathew, B. S., Rajan, B., & Nair, K. M. (2001). Malignant phyllodes tumor. The breast journal, 7(6), 411-416. |
Full-text not available. |
|
Park HJ, Ryu HS, Kim K, Shin KH, Han W, Noh DY. Risk Factors for Recurrence of Malignant Phyllodes Tumors of the Breast. In Vivo. 2019 Jan-Feb;33(1):263-269. doi: 10.21873/invivo.11470. PMID: 30587634; PMCID: PMC6364066. |
Wrong intervention. |
|
Pimiento JM, Gadgil PV, Santillan AA, Lee MC, Esposito NN, Kiluk JV, Khakpour N, Hartley TL, Yeh IT, Laronga C. Phyllodes tumors: race-related differences. J Am Coll Surg. 2011 Oct;213(4):537-42. doi: 10.1016/j.jamcollsurg.2011.07.012. Erratum in: J Am Coll Surg. 2012 Mar;214(3):384. PMID: 21856184. |
Wrong comparison (2 mm margin cut-off). |
|
Pornchai, S., Chirappapha, P., Lertsithichai, P., Kondan, Y., Sukarayothin, T., & Leesombatpaiboon, M. (2017). Predictive factors of recurrence following surgical treatment of phyllodes tumors in Ramathibodi Hospital. J Med Assoc Thai, 100(9), S160-S173. |
Wrong intervention. |
|
Qian Y, Quan ML, Ogilvi T, Bouchard-Fortier A. Surgical management of benign phyllodes tumours of the breast: Is wide local excision really necessary? Can J Surg. 2018 Dec 1;61(6):17617. doi: 10.1503/cjs.017617. PMID: 30265644; PMCID: PMC6281457. |
No comparison. |
|
Rodrigues MF, Truong PT, McKevitt EC, Weir LM, Knowling MA, Wai ES. Phyllodes tumors of the breast: The British Columbia Cancer Agency experience. Cancer Radiother. 2018 Apr;22(2):112-119. doi: 10.1016/j.canrad.2017.08.112. Epub 2018 Mar 7. PMID: 29523388. |
Included in selected systematic review (Lu, 2019). |
|
Sawalhi S, Al-Shatti M. Phyllodes tumor of the breast: a retrospective study of the impact of histopathological factors in local recurrence and distant metastasis. Ann Saudi Med. 2013 Mar-Apr;33(2):162-8. doi: 10.5144/0256-4947.2013.162. PMID: 23563006; PMCID: PMC6078618. |
Wrong comparison (1 mm margin cut-off). |
|
Slodkowska E, Nofech-Mozes S, Xu B, Parra-Herran C, Lu FI, Raphael S, Zubovits J, Hanna W. Fibroepithelial lesions of the breast: a comprehensive morphological and outcome analysis of a large series. Mod Pathol. 2018 Jul;31(7):1073-1084. doi: 10.1038/s41379-018-0032-8. Epub 2018 Feb 14. PMID: 29449684. |
Included in selected systematic review (Lu, 2019). |
|
Spanheimer PM, Murray MP, Zabor EC, Stempel M, Morrow M, Van Zee KJ, Barrio AV. Long-Term Outcomes After Surgical Treatment of Malignant/Borderline Phyllodes Tumors of the Breast. Ann Surg Oncol. 2019 Jul;26(7):2136-2143. doi: 10.1245/s10434-019-07210-4. Epub 2019 Feb 19. PMID: 30783853; PMCID: PMC6545258. |
Wrong comparison (close/positive margin in one group). |
|
Spitaleri, G., Toesca, A., Botteri, E., Bottiglieri, L., Rotmensz, N., Boselli, S., ... & De Pas, T. (2013). Breast phyllodes tumor: a review of literature and a single center retrospective series analysis. Critical Reviews in Oncology/Hematology, 88(2), 427-436. |
Included in selected systematic review (Lu, 2019). |
|
Taira N, Takabatake D, Aogi K, Ohsumi S, Takashima S, Nishimura R, Teramoto N. Phyllodes tumor of the breast: stromal overgrowth and histological classification are useful prognosis-predictive factors for local recurrence in patients with a positive surgical margin. Jpn J Clin Oncol. 2007 Oct;37(10):730-6. doi: 10.1093/jjco/hym099. Epub 2007 Oct 11. PMID: 17932112. |
Wrong comparison. |
|
Thind, A., Patel, B., Thind, K., Isherwood, J., Phillips, B., Dhaliwal, K., & Remoundos, D. D. (2020). Surgical margins for borderline and malignant phyllodes tumours. The Annals of The Royal College of Surgeons of England, 102(3), 165-173. |
Wrong comparison (1 cm and 1 mm margin cut-off). |
|
Toussaint, A., Piaget-Rossel, R., Stormacq, C., Mathevet, P., Lepigeon, K., & Taffe, P. (2021). Width of margins in phyllodes tumors of the breast: the controversy drags on?—a systematic review and meta-analysis. Breast cancer research and treatment, 185(1), 21-37. |
Wrong comparison (10 mm margin cut-off). |
|
Tsang JY, Mendoza P, Putti TC, Karim RZ, Scolyer RA, Lee CS, Pang AL, Tse GM. E-cadherin expression in the epithelial components of mammary phyllodes tumors. Hum Pathol. 2012 Dec;43(12):2117-23. doi: 10.1016/j.humpath.2012.03.028. Epub 2012 Jul 21. PMID: 22820000. |
Included in selected systematic review (Lu, 2019). |
|
Wei J, Tan YT, Cai YC, Yuan ZY, Yang D, Wang SS, Peng RJ, Teng XY, Liu DG, Shi YX. Predictive factors for the local recurrence and distant metastasis of phyllodes tumors of the breast: a retrospective analysis of 192 cases at a single center. Chin J Cancer. 2014 Oct;33(10):492-500. doi: 10.5732/cjc.014.10048. Epub 2014 Aug 8. PMID: 25104281; PMCID: PMC4198752. |
Included in selected systematic review (Lu, 2019). |
|
Wen B, Mousadoust D, Warburton R, Pao JS, Dingee C, Chen L, McKevitt E. Phyllodes tumours of the breast: Outcomes and recurrence after excision. Am J Surg. 2020 May;219(5):790-794. doi: 10.1016/j.amjsurg.2020.02.048. Epub 2020 Feb 28. PMID: 32145921. |
Wrong comparison (2 mm margin cut-off). |
|
Yom CK, Han W, Kim SW, Park SY, Park IA, Noh DY. Reappraisal of conventional risk stratification for local recurrence based on clinical outcomes in 285 resected phyllodes tumors of the breast. Ann Surg Oncol. 2015 Sep;22(9):2912-8. doi: 10.1245/s10434-015-4395-5. Epub 2015 Feb 5. PMID: 25652050. |
Included in selected systematic review (Lu, 2019). |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 01-11-2021
Laatst geautoriseerd : 01-12-2023
Geplande herbeoordeling : 01-01-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Doel en doelgroep
Deze richtlijn is een document met aanbevelingen en handelingsinstructies ter ondersteuning van de dagelijkse praktijkvoering. De richtlijn berust op de resultaten van wetenschappelijk onderzoek en aansluitende meningsvorming gericht op het vaststellen van goed medisch handelen. Er wordt aangegeven wat in het algemeen de beste zorg is voor de patiënt met (verdenking op) borstkanker of voor hen die voor screening in aanmerking komen. De richtlijn beoogt een leidraad te geven voor de dagelijkse praktijk van de screening, diagnostiek, behandeling en nazorg van borstkanker. Tevens wordt deze richtlijn gebruikt voor het maken van informatiemateriaal voor patiënten, in samenwerking met kanker.nl en thuisarts.nl. Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die aan de ontwikkeling van deze richtlijn hebben bijgedragen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met borstkanker.
|
Werkgroeplid |
Namens |
|
dr. M.A.W.M.C. (Marlene) Hoynck van Papendrecht |
BVN |
|
drs. C. (Cristina) Guerrero Paez |
BVN |
|
drs. M.A. (Marjolein) Scholten |
BVN |
|
C.M. (Marco) van Esterik |
Contactgroep Phyllodes |
|
M. (Michelle) Verseveld MSc |
KNGF |
|
prof. dr. G.H. (Truuske) de Bock |
NHG |
|
dr. B.E.P.J. (Birgit) Vriens |
NIV |
|
dr. A. (Agnes) Jager |
NIV |
|
dr. C.H. (Carolien) Smorenburg, voorzitter |
NIV |
|
dr. H. (Hiltje) de Graaf |
NIV |
|
dr. J.R. (Judith) Kroep |
NIV |
|
dr. H.H. (Huub) van Rossum |
NVKC |
|
dr. ir. C. (Christiaan) van Swol |
NVKF |
|
dr. F. (Frederiek) van den Bos |
NVKG |
|
dr. C.D.L. (Carine) Bavelaar-Croon |
NVNG |
|
dr. L.A.E. (Leonie) Woerdeman |
NVPC |
|
prof. dr. M.A.M. (Marc) Mureau |
NVPC |
|
dr. A.N. (Astrid) Scholten |
NVRO |
|
dr. H.J.G.D. (Desiree) van den Bongard |
NVRO |
|
dr. J.H. (John) Maduro |
NVRO |
|
dr. M.J.C. (Maurice) van der Sangen |
NVRO |
|
dr. N. (Nina) Bijker |
NVRO |
|
prof. dr. L.J. (Liesbeth) Boersma |
NVRO |
|
dr. D.J.P. (Dominique) van Uden |
NVvH |
|
dr. E.L. (Emily) Postma |
NVvH |
|
dr. J.H. (José) Volders |
NVvH |
|
dr. L.J.A. (Luc) Strobbe |
NVvH |
|
mr. dr. F.H. (Frederieke) van Duijnhoven |
NVvH |
|
drs. E.M. (Elise) Bekers |
NVVP |
|
dr. A.I.M. (Inge-Marie) Obdeijn |
NVvR |
|
dr. C.E. (Claudette) Loo |
NVvR |
|
dr. M.B.I. (Marc) Lobbes |
NVvR |
|
dr. C. (Carla) Meeuwis |
NVvR |
|
drs. L.M.H. (Lidy) Wijers |
NVvR |
|
drs. M.W. (Mechli) Imhof-Tas |
NVvR |
|
A. (Angelie) van den Bosch |
V&VN |
|
C. (Celine) Zoetbrood |
V&VN |
|
A.M.J. (Antoinette) Holterman |
V&VN oncologie |
|
drs. J.M. (Margriet) Collée |
VKGN |
Met ondersteuning van
Drs. S.N. (Sarah) van Duijn
Dr. L. (Linda) Oostendorp
Drs. M. (Miriam) te Lintel Hekkert
Dr. N. (Nadine) Zielonke
Dr. J. (Joppe) Tra
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Clusterstuurgroep
|
Clusterlid |
Functie |
Nevenwerkzaamheden |
Gemelde belangen |
|
Smorenburg (voorzitter) |
* Internist-oncoloog Antoni van Leeuwenhoek (0,9 fte - betaald) |
Lid Bestuur gasthuis Antoni van Leeuwenhoek (onbetaald) |
In 2018 een vergoeding van €1,307,00 ontvangen van Pfizer.
|
|
Guerrero Paez |
Directeur Borstkanker Vereniging Nederland |
Lid Raad van Toezicht SPL te Leiden (onbetaald) |
Als patiëntenorganisatie leveren wij vanuit patïëntenperspectief advies aan. Persoonlijk ben ik alleen betrokken bij het Covid consortium waar we onderzoek doen naar Covid en Borstkanker. Trekker is IKNL (geen rol als projectleider). Verder werken wij met de PAG samen en allerlei vrijwilligers. Wij ontvangen van de farmacie gelden voor specifieke projecten op het gebied van informatievoorziening en/of lotgenotencontact. Deze zijn multisponsored en worden altijd opgenomen in het transparantieregister. |
|
Vriens |
Internist-oncoloog Catherinaziekenhuis Eindhoven |
In 2018 een vergoeding van €870,00 ontvangen van Novartis. |
|
|
Mureau |
Plastisch chirurg, Erasmus MC, Universitair Medisch Centrum Rotterdam |
* Maatschapslid AZR>SFG, werkzaamheden als plastisch chirurg (betaald) |
Polytech Health & Aesthetics GmbH - Long-term results of breast reconstruction with polyurethane covered implants: a multicenter randomized controlled trial - Projectleider |
|
Lobbes |
* Radioloog - Zuyderland Medisch Centrum, afdeling Medische Beeldvorming (0,9 fte) |
Lid wetenschappelijke adviesraad LRCB - Lid wetenschappelijke raad Zuyderland Medisch Centrum |
* GE Healtcare - Rapid Access to Contrast-Enchanced mammography in Recalls form breast cancer screening (RACER) – Projectleider * Boegbeeldfunctie wereldwijd van contrast-enhance mammography (CEM) * Betrokkenen heeft financiële vergoedingen gekregen voor het verzorgen van workshops, presentatie en deelname van medical advisory boards van onder andere GE Healthcare, Hologic, Tromp Medical, Suazio, Bayer |
|
Bosch, van den |
Verpleegkundig specialist mammacarcinoom in het Catherinaziekenhuis te Eindhoven |
Gast-docent HBO-V studenten aan Fontys Hogeschool te Eindhoven (betaald) |
Geen |
|
Bongard, van den |
Radiotherapeut-oncoloog, Amsterdam UMC |
* Lid NABON bestuur (onbetaald) |
* KWF/ Pink Ribbon - Eenmalige hoge dosis radiotherapie mammacarcinooom (ABLATIVE project, 2013 en 2020) - Projectleider; VARIAN grant voor Adaptive Radiotherapy in Breast Cancer patients (BREAST-ART, 2020) - Projectleider. * Lid landelijke werkgroep hypofractionering mammacarcinoom |
|
Van Swol |
* Klinisch Fysicus, St. Antonius Ziekenhuis (0,9 fte) |
Voorzitter Bestuur Stichting Opleiding Klinische Fysica - onbetaald. Zie www.stichtingokf.nl |
Geen |
|
Van Duijnhoven |
Chirurg-oncoloog, Nederlands Kanker Instituut / Antoni van Leeuwenhoek Ziekenhuis |
* European Organization for Research and Treatment of Cancer, secretary of the Breast Cancer Group |
* Innovatiefonds Zorgverzekeraars - Towards omitting breast surgery in patients with a complete response to neoadjuvant chemotherapy - biopten past NAC ter evaluatie respons onderzoek inmiddels afgerond- Geen projectleider, co-PI * KWF - Management of low risk ductal carcinoma in situ (low-risk DCIS): a non-randomized, multicenter, non-inferiority trial between standard therapy approach versus active surveillance - clinical trial ongoing - Geen projectleider, co-PI * KWF - Clinically node negative breast cancer patients undergoing breast conserving therapy: Sentinel lymph node procedure versus follow-up - randomized clinical trial, accural complete January 2022 - Geen projectleider, local PI * EORTC-quality of life group - Follow-up in Early and Locally Advanced Breast Cancer Patients: An EORTC QLG-BCG-ROG Protocol - clinical study in which quality of life data are registered in patients treated for breast cancer < 3 years ago - Geen projectleider, local PI * Als arts ook betrokken bij de patiëntenvereniging voor Phyllodes tumoren van de borst, wat 1 van de geformuleerde knelpunten vanuit onze beroepsvereniging is. |
|
Volders |
Oncologische chirurg |
* Bestuurslid werkgroep Mammachirurgie NVCO - onbetaald |
Geen |
|
Van der Sangen |
Radiotherapeut-oncoloog, afdeling Radiotherapie, Catharina Ziekenhuis Eindhoven |
Bestuurslid BOOG (Borstkanker Onderzoeksgroep Nederland), onbetaald |
NVRO/IKNL - Retrospectief onderzoek naar het gebruik van radiotherapie in Nederland - Geen projectleider |
Clusterexpertisegroep
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
|
Bavelaar-Croon |
Nucleair Geneeskundige - Ziekenhuis Gelderse Vallei in Ede |
* Voorzitter werkgroep mammacarcinoom NVNG (Nederlandse Vereniging Nucleaire Geneeskunde) |
Geen |
|
Imhof-Tas |
Mammaradioloog en screeningsradioloog Radboud UMC (100%) |
Geen |
Geen |
|
Obdeijn |
Mammaradioloog in het Erasmus MC |
Geen |
* ZonMw - KWF, Sisters Hope, Pink Ribbon Stichting… - MRI versus mammography for breast cancer screening in women with familial risk (FAMRIsc: a multicentre randomised, controlled trial (Lancet Oncology 2019) |
|
Wijers |
Mamma- en neuroradioloog Alrijne Zorggroep (Leiderdorp - Leiden - Alphen) |
* Lid NABON |
In 2020 een vergoeding van €1270,00 ontvangen van Bayer. |
|
Collée |
Klinisch geneticus, Erasmus MC Rotterdam |
Geen |
* KWF - Nationwide infrastructure integrating research and health care to improve management for Dutch women with familial breast cancer risk Infrastructure Initiatives – * KWF Building in the Archipelago of Ovarian Cancer Research - Geen projectleider |
|
Rossum, van |
Laboratorium specialist Klinische Chemie, Afdeling Algemeen Klinisch Laboratorium Antoni van Leeuwenhoek Ziekenhuis Amsterdam |
* Eigenaar en directeur Huvaros B.V. (onbetaald) |
* Health Holland - Subsidie voor vingerprik bloedafname systeem voor Covid-19 serologie - Projectleider
|
|
Bock, de |
Hoogleraar oncologische epidemiologie en interim afdelingshoofd afdeling Epidemiologie van het UMCG (voltijds aanstelling) |
* Lid werkgroep herziening richtlijn familiaire en erfelijke eierstokkanker |
* W.J. Thijnstichting - STIC, het begin of het einde - Projectleider samen met gynaecoloog
|
|
Bos, van den |
Internist-ouderengeneeskunde LUMC |
Voorzitter kerngroep ouderen NIV (onbetaald) |
SKMS - Keuzehulpen nij patiënten met multimorbiditeit - Projectleider
|
|
Verseveld |
* Bestuurslid Nederlandse Vereniging voor fysiotherapie bij Lymfologie en Oncologie, portefeuilehouder Wetenschap Oedeem en Oncologie: 8 uur per week |
* NVFL: vrijwillige functie |
Geen |
|
Loo |
Radioloog, gespecialiseerd mammaradiologie & screening BVO (regio midden west). NKI-AVL (Nederlands Kanker Instituut, Antoni van Leeuwenhoek) en BVO midden west |
* Wetenschappelijke cie NBCA (deels betaals/vacatie) |
In 2019 een vergoeding van €1749,00 ontvangen van Bayer. |
|
Meeuwis |
Mammaradioloog Ziekenhuis Rijnstate |
* NABON - werkgroep standaardisatie verslaglegging (onbetaald) |
* SENO medical - Echografie gecombineerd met laserlicht voor de diagnostiek bij verdachte massa's in de borst - Projectleider
|
|
Louwe |
Gynaecoloog, 0,9 aanstelling Leids Universitair Medisch Centrum |
Geen |
Geen |
|
Graaf, de |
Internist-oncoloog MCL |
Lid commissie kwaliteit NVMO. Medisch manager Oncologisch Netwerk Friesland (ONF) Coach Coassistenten Lid raad van toezicht zorg en welzijn |
Geen |
|
Jager |
Internist-oncoloog Erasmus MC Kanker Instituut Rotterdam |
* Voorzitter Stichting BOOG (Borstkanker onderzoeksgroep) - onbezoldigd |
* KWF - Prediction of Breast Cancer chemotherapy response in patients by determination of chemosensitivity in tumor tissue ex vivo - Projectleider In 2019 een vergoeding van €980,00 ontvangen van Roche Pharma. |
|
Strobbe |
Borstkankerchirurg CWZ Nijmegen fulltime staflid |
Geen |
Geen |
|
Maduro |
Radiotherapeut oncoloog, Universitaire Medische Centrum Groningen en Prinses Maxima Centrum voor kinderoncologie |
Bestuur BOOG, onbetaald |
EU - HARMONIC, gevolgen straling bij kinderen - Geen projectleider
|
|
Boersma |
Radiotherapeut-oncoloog Maastro, Maastricht |
* Klinische werkzaamheden en wetenschappelijke werkzaamheden * Voorzitter van Landelijk Platform Protonentherapie en lid van commissie kwaliteit NVRO |
ZonMw - MOVE project: verbeteren zorgpaden protonentherapie; SKMS project: INNOVATE: verbeteren implementatie van innovaties. KWF: Descartes studie: de-escalatie van bestraling bij patiënten met pCR na Neoadjuvante chemotherapie
|
|
Scholten |
Radiotherapeut-oncoloog, NKI-AVL |
- |
KWF - PPAPBI-2 trial - Projectleider
|
|
Postma |
Oncologisch chirurg Antonius Ziekenhuis Nieuwegein |
Geen |
Geen |
|
Uden |
Fellow chirurgische oncologie: per 17-1-2022 te Gelre Ziekenhuizen (hiervoor fellow chirurgische oncologie in het Rijnstate Ziekenhuis) |
Niet van toepassing |
Onbetaald en ongefinancierd promotie onderzoek naar inflammatoir mammacarcinoom: nu geen aandachtspunt voor de revisie. |
|
Bijker |
Radiotherapeut-oncoloog Amsterdam UMC |
* Kartrekker lateralisatie mammazorg AmsterdamUMC, onbetaald |
* KWF 12900 - Reduction of organ motion during radiotherapy by non-invasive mechanical ventilation supported berating control - Geen projectleider
|
|
Kroep |
Internist-Oncoloog, LUMC |
Betaald adviseurschap: AstraZeneca, GSK, Eisai, Lilly, MSD, Novartis |
* AstraZeneca - FAB, DOMEC en MMRd-GREEN studie; behandeling ovariumca (FAB) en endometrium carcinoom (DOMEC en MMRd-GREEN) drugs (olaparib, durvalumab) en onregstricted grant - Projectleider * Novartis - NEOLBC studie met neoadjuvant chemotherapie vs ribociclib en letrozol in hormoongevoelig mammacarcinoom. ribociclib en unregstricted grant - Projectleider * Philips - NEOLBC studie met neoadjuvant chemotherapie vs ribociclib en letrozol in hormoongevoelig mammacarcinoom. unrestricted grant - Projectleider |
|
Woerdeman |
Plastisch chirurg Antoni van Leeuwenhoek Amsterdam |
* Hoofd afdeling plastische chirurgie Antoni van Leeuwenhoek |
Dutch Cancer Society, Grand/Award Number: - Ontwikkeling borst reconstructie keuzehulp - Projectleider
|
|
Esterik, van |
Tot 2014 zelfstandige als Invalbakker |
* Brood en Banker Bakker |
Geen |
|
Scholten, M |
* Belangenbehartiger bij BVN (Borstkankervereniging), 50% |
* Zitting in Medische Advies Raad Parkinsonvereniging (vrijwillig) |
Geen |
|
Hoynck van Papendrecht |
Vrijwilligster BVN |
* Gepensioneerd arts |
Geen |
|
Bekers |
Patholoog, Antoni van Leeuwenhoek Ziekenhuis |
Geen |
Geen |
|
Zoetbrood |
|
|
|
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door de Borstkankervereniging Nederland (BVN) uit te nodigen voor de invitational conference en de werkgroep. Het verslag hiervan [zie aanverwante producten] is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan BVN en de Nederlandse Federatie van Kankerpatiëntenorganisaties (NFK). De eventueel aangeleverde commentaren zijn bekeken en waar mogelijk verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er [waarschijnlijk geen/ mogelijk] substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Module HER2-gerichte therapie in adjuvante setting |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met HER2-positieve borstkanker) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module HER2-gerichte therapie in gemetastaseerde setting |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met HER2-positieve borstkanker) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module immuuntherapie in gemetastaseerde setting |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met borstkanker en indicatie immuuntherapie in gemetastaseerde setting) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module directe borstreconstructie en radiotherapie |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met borstkanker, directe borstreconstructie en radiotherapie) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module uitgestelde borstreconstructie en radiotherapie |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met borstkanker, uitgestelde borstreconstructie en radiotherapie) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module nacontrole: detectie van nieuwe carcinoom manifestaties |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (>5.000 patiënten jaarlijks in nacontrole voor borstkanker), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Phyllodestumoren – beeldvorming en pathologie |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met Phyllodestumoren) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module phyllodestumoren - radiotherapie |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met Phyllodestumoren) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module phyllodestumoren – resectiemarges |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met Phyllodestumoren) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module phyllodestumoren – systemische therapie |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met Phyllodestumoren) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Phyllodestumoren - nacontrole |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met Phyllodestumoren) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module screening buiten het bevolkingsonderzoek tijdens zwangerschap en borstvoeding |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met indicatie screening buiten het bevolkingsonderzoek tijdens zwangerschap en borstvoeding) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
|
Module immuuntherapie in neoadjuvante setting |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten met borstkanker en indicatie immuuntherapie in neoadjuvante setting) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep schriftelijk de knelpunten in de zorg voor patiënten met borstkanker. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model met behulp van Review Manager 5.4. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
