Geneesmiddeleninteracties met opioïden bij pijn bij kanker
Uitgangsvraag
Op welke wijze dienen geneesmiddeleninteracties te worden gemonitord en gemanaged bij de behandeling met opioïden van patiënten met kanker en pijn?
Aanbeveling
- Wees extra alert op geneesmiddeleninteracties met opioïden bij patiënten met polyfarmacie en/of patiënten ouder dan 70 jaar (1A).
- Voor apotheker: Overleg bij een klinisch relevante interactie met opioïden met de voorschrijvend arts (1D).
- Voor voorschrijvend arts: Overleg bij een klinisch relevante interactie met opioïden met de apotheker (1D).
Overwegingen
Klinisch relevante interacties met diverse sterk werkende opioïden (morfine, oxycodon, hydromorfon, methadon, fentanyl en buprenorfine) kunnen zich manifesteren als een verminderd of versterkt analgetisch effect of een toename van bijwerkingen van het opioïd of het daarmee interacterende middel. Voor alle opioïden zijn interacties met alcohol (leidend tot versterking sedatie), MAO-remmers (leidend tot serotonerg syndroom en verhoging toxiciteit opioïd), naltrexon (leidend tot onttrekkingsverschijnselen) en centraal depressieve stoffen (leidend tot versterking sedatie) belangrijk. Daarnaast geldt voor methadon, fentanyl, buprenorfine en oxycodon, dat interacties door enzyminductie en/of -remming kunnen plaatsvinden.
Gelet op de kwetsbare patiëntengroep met pijn bij kanker en het veelal meervoudig geneesmiddelengebruik (polyfarmacie) moet aandacht worden gegeven aan mogelijke interacties met opioïden. Zorgverleners dienen kennis te nemen van deze interacties om hierop te kunnen anticiperen en om desgewenst de dosering aan te passen of een alternatief geneesmiddel te kunnen kiezen.
Tabel 1 geeft een overzicht van alle potentiële geneesmiddelinteracties van opioïden bij patiënten met kanker, zoals bekend ten tijde van het schrijven van de huidige versie van de richtlijn. In de Nederlandse medisch-farmaceutische praktijk wordt in de meeste gevallen voor de geautomatiseerde interactie signalering gebruik gemaakt van de landelijke G-Standaard van de KNMP. Apotheker en arts vinden hierin wegingen voor de klinische relevantie van de interactie. Per klinisch relevante interactie bevat de G- Standaard adviezen voor de afhandeling daarvan. Deze informatie is opgenomen in voorschrijf- en apotheeksystemen en wordt voortdurende geactualiseerd op basis van nieuwe wetenschappelijke gegevens. Daarom wordt bij verdenking op potentiële geneesmiddelinteracties van opioïden overleg tussen voorschrijvend arts en apotheker en raadplegen van de G-Standaard geadviseerd.
Voor een sluitende medicatiebewaking door apotheker en arts zijn beschikbaarheid en toegankelijkheid van een actueel medicatieoverzicht van een patiënt noodzakelijk. Dit wordt in de praktijk echter bemoeilijkt door het bestaan van verschillende automatiseringssystemen in de 1e en 2e lijn, die de informatieoverdracht beperken.
Onderbouwing
Achtergrond
Geneesmiddelen die gelijktijdig worden gebruikt door patiënten met kanker kunnen interacties geven (Bernnard, 2002; Kong, 2009, Lussier, 2004). Deze interacties kunnen leiden tot een verminderd of versterkt effect of een toename van bijwerkingen van het analgeticum en/of het daarmee interacterende middel.
Geneesmiddelen die vaak worden gebruikt door patiënten met kanker en interacties kunnen vertonen zijn oncologische middelen, immunosuppressiva, analgetica, anti- epileptica, antidepressiva, anxiolytica en antipsychotica (Bernard, 2000). Geneesmiddelen uit andere groepen geven in het algemeen minder kans op interacties,. Omdat pijn bij kanker vroeg of laat meestal wordt behandeld met opioïden zal specifiek worden ingegaan op geneesmiddeleninteracties met opioïden, die kunnen leiden tot een verminderd of versterkt analgetisch effect of tot bijwerkingen.
Interacties kunnen worden geclassificeerd als farmacokinetisch of farmacodynamisch. Farmacokinetische interacties treden op bij beïnvloeding van absorptie, distributie, metabolisme of eliminatie van de betrokken geneesmiddelen, waardoor de hoeveelheid en de duur van de beschikbaarheid van het geneesmiddel bij de receptor verandert. Veel farmacokinetische interacties worden gemedieerd door het cytochroom P450 (CYP450) enzymsysteem in de lever, dat verantwoordelijk is voor het metabolisme van diverse geneesmiddelen, waaronder analgetica, antidepressiva, anti-epileptica, steroïden, anticoagulantia, oncolytica en andere. Binnen het CYP450 systeem kunnen geneesmiddelen worden geclassificeerd als substraten, inductoren, of remmers. Substraten zijn middelen die worden gemetaboliseerd door het enzym, terwijl inductoren en remmers het metabolisme van substraten voor dit enzym stimuleren of remmen. Daarbij kan genetisch polymorfisme van met name CYP2D6 belangrijke interindividuele verschillen geven in de omzettingssnelheid van geneesmiddelen.
Er is sprake van farmacodynamische interacties als het farmacologische effect van de betreffende geneesmiddelen wordt beïnvloed. Een voorbeeld hiervan is een combinatie van middelen die beide depressie van het centraal zenuwstelsel geven, waardoor additieve sedatie kan optreden zonder veranderingen in plasmaconcentraties.
Conclusies
Van alle opioïden zijn voor methadon de meeste geneesmiddeleninteracties beschreven (geen beoordeling).
(Bernard, 2000; Clemens, 2012; Gaertner, 2012; Jansman, 2008; Kotlinska-Lemieszek, 2012; Maurer, 1993; Metzke, 2012; van Oijk, 2012; Weschules, 2008; www.fk.cvz.nl)
Polyfarmacie en hogere leeftijd zijn risicofactoren voor het ontwikkelen van een geneesmiddeleninteractie met opioïden (geen beoordeling).
(Metzke, 2012; Weschules, 2008)
Genetisch polymorfismen van enzymen die opioïden afbreken kunnen belangrijke interindividuele verschillen geven in de omzettingssnelheid en daarmee van de effectiviteit en toxiciteit van opioïden (geen beoordeling).
(Metzke, 2012; Weschules, 2008)
Evaluaties door een apotheker, die onderdeel uitmaakt van een multidisciplinair team, is een mogelijkheid om geneesmiddeleninteracties bij patiënten met kanker (waaronder met opioïden) op te sporen en terug te dringen (geen beoordeling).
(Mancini, 2012)
Samenvatting literatuur
Beschrijving studies
Voor de beschrijving van geneesmiddeleninteracties bij opioïden werd de review gebruikt van Jansman (2008), alsmede het Farmacotherapeutisch Kompas (www.fk.cvz.nl) geraadpleegd.
Tevens werden er drie systematische reviews (Weschules, 2008; Fredheim, 2008; Leppert, 2009) geïncludeerd die geneesmiddeleninteracties met methadon in het bijzonder vergeleken. Deze reviews vatten literatuur vanaf 1966 tot 2008 samen: trials, observationele studies en case-reports en tevens in-vitro studies waarin geneesmiddeleninteracties met methadon werden beschreven.
Daarnaast werd de review van Olkkola (2009) geïncludeerd, welke een beschrijving geeft over de recente wetenschappelijke literatuur betreffende oxycodon.
Er werden twee observationele studies geïncludeerd die geneesmiddeleninteracties beschreven in patiënten. Gaertner (2012) beschreef in een retrospectieve studie het geneesmiddelgebruik van 200 opeenvolgende patiënten opgenomen op de afdeling “Palliative Medicine” tussen 2007 en 2008. Alle potentiele geneesmiddeleninteracties in de medicatielijsten werden geïdentificeerd en beschreven.
Mancini (2012) beschrijft het protocol van een multidisciplinaire ondersteunende oncologische polikliniek van een gespecialiseerd oncologisch ziekenhuis in de Verenigde Staten. Dit team bestaat uit een verpleegkundige, een apotheker, een diëtist en een sociaal-maatschappelijk werker. De resultaten van de werkzaamheden van dit team in het eerste jaar (75 patiënten gezien) worden beschreven in dit artikel.
Resultaten
Deelvraag 1: Wat voor geneesmiddeleninteracties van opioïden en andere geneesmiddelen worden er beschreven in de literatuur en wat is de incidentie hiervan?
Tabel 1 geeft een overzicht van veelvoorkomende interacties van opioïden met andere geneesmiddelen en het mechanisme en effect hiervan. Deze tabel is overgenomen uit het review door Jansman (2008) en aangevuld met gegevens uit het reviews van Olkkola (2009), Leppert (2009) Weschules (2008) en Fredheim (2008) en uit het Farmacotherapeutisch Kompas (www.fk.cvz.nl).
Tabel 1@
|
Opioïd* |
Interacterend |
Effect |
|
Alle opioiden |
Alcohol |
Versterking sedatie |
|
|
Centraal depressieve stoffen |
Versterking sedatie |
|
|
MAO-remmer |
Serotonerg syndroom |
|
|
|
Verhoging opioïdconcentratie toxiciteit opioïd |
|
|
Naltrexon / naloxone |
Antagonisme opioïd onttrekkingsverschijnselen |
|
Methadon |
Abacavir# |
Inductie CYP3A4 Onttrekkingsverschijnselen |
|
|
Amiodaron |
Matige remming CYP3A4 matige toxiciteit methadon |
|
|
Antimycotica |
Verlenging QT-interval |
|
|
Antipsychotica |
Verlenging QT-interval |
|
|
Barbituraten |
Inductie CYP3A4/CYP2D6 Onttrekkingsverschijnselen |
|
|
Cannabinoïden |
Toename concentratie methadon toxiciteit methadon |
|
|
Carbamazepine |
Inductie CYP3A4/CYP2D6 Onttrekkingsverschijnselen |
|
|
Chinolonen |
Verlenging QT-interval |
|
|
Ciclosporine |
Remming CYP3A4 toxiciteit methadon |
|
|
Cimetidine |
Versterking sedatie |
|
|
Ciprofloxacine# |
Toename concentratie methadon toxiciteit methadon |
|
|
Claritromycine |
Matige remming CYP3A4 matige toxiciteit methadon of juist Toename concentratie methadon toxiciteit methadon |
|
|
Dexomethason# |
Inductie CYP3A4 Onttrekkingsverschijnselen |
|
|
Didanosine |
Vertraging resorptie en stimulatie first pass effect didanosine afname effect didanosine |
|
|
Diltiazem# |
Remming CYP3A4 toxiciteit methadon |
|
|
Disopyramide |
Verlenging QT-interval |
|
|
Efavirenz |
Inductie CYP3A4/CYP2D6 Onttrekkingsverschijnselen |
|
|
Erytromycine |
Toename concentratie methadon toxiciteit methadon |
|
|
Fenobarbital# |
Inductie CYP3A4/CYP2D6 Onttrekkingsverschijnselen |
|
|
Fenytoine |
Inductie CYP3A4/CYP2D6 Onttrekkingsverschijnselen |
|
|
Fluconazol |
Toename concentratie methadon toxiciteit methadon |
|
|
Fusidinezuur# |
Inductie CYP3A4 Onttrekkingsverschijnselen |
|
|
Grapefruitsap |
Toename concentratie methadon toxiciteit methadon |
|
|
Isoniazide# |
Toename concentratie methadon toxiciteit methadon |
|
|
Itroconazol |
Toename concentratie methadon toxiciteit methadon |
|
|
Ketoconazol |
Matige remming CYP3A4 matige toxiciteit methadon |
|
|
Kinidine |
Remming CYP3A4 toxiciteit methadon, verlenging QT- interval |
|
|
Macrolide antibiotica |
Verlenging QT-interval |
|
|
Nevirapine# |
Inductie CYP3A4/CYP2D6 Onttrekkingsverschijnselen |
|
|
NSAIDs |
Versterkt effect pijnstilling |
|
|
Omeprazol# |
Toename concentratie methadon toxiciteit methadon |
|
|
Rifabutine# |
Inductie CYP3A4 Onttrekkingsverschijnselen |
|
|
Rifampicine |
Inductie CYP3A4/CYP2D6 Onttrekkingsverschijnselen |
|
|
Ritonavir icm lopinavir of sanquinavir |
Daling methadonspiegel onthoudingsverschijnselen |
|
|
Sint Janskruid |
Inductie CYP3A4/CYP2D6 Onttrekkingsverschijnselen of juist Toename concentratie methadon toxiciteit methadon |
|
|
Sotalol |
Verlenging QT-interval |
|
|
Spironolacton# |
Toename concentratie methadon toxiciteit methadon |
|
|
SSRI’s |
Toename concentratie methadon toxiciteit methadon |
|
|
Stavudine |
Vertraging resorptie en stimulatie first pass effect stavudine afname effect stavudine |
|
|
Tricyclische antidepressiva |
Verlenging QT-interval |
|
|
Verapamil |
Remming CYP3A4 toxiciteit methadon |
|
|
Zidovudine |
Verhoging plasmaspiegels zidovudine |
|
Fentanyl |
Aprepitant |
Matige remming CYP3A4 matige toxiciteit fentanyl |
|
|
Claritromycine |
Remming CYP3A4 Toxiciteit fentanyl |
|
|
Ditiazem |
Matige remming CYP3A4 matige toxiciteit fentanyl |
|
|
Erytromycine |
Remming CYP3A4 Toxiciteit fentanyl |
|
|
Fenelzyne# |
Toename SSRI concentratie toxiciteit SSRI |
|
|
Fluconazol |
Matige remming CYP3A4 matige toxiciteit fentanyl |
|
|
Fosamprenavir |
Matige remming CYP3A4 matige toxiciteit fentanyl |
|
|
Grapefruitsap |
Matige remming CYP3A4 matige toxiciteit fentanyl |
|
|
Indinavir |
Remming CYP3A4 toxiciteit fentanyl |
|
|
Itraconazol |
Remming CYP3A4 Toxiciteit fentanyl |
|
|
Ketoconazol |
Remming CYP3A4 Toxiciteit fentanyl |
|
|
Lopinavir# |
Remming CYP3A4 toxiciteit fentanyl |
|
|
Nasale decongestiva |
Bij fentanyl neusspray: afname plasmaspiegel fentanyl afzwakking effect |
|
|
Ritonavir |
Remming CYP3A4 toxiciteit fentanyl |
|
|
SSRI’s# |
Toename SSRI concentratie toxiciteit SSRI |
|
|
Tranylcypromine# |
Toename SSRI concentratie toxiciteit SSRI |
|
|
Verapamil |
Matige remming CYP3A4 matige toxiciteit fentanyl |
|
Buprenorfine |
Atazanavir# |
Toename concentratie toxiciteit buprenorfine |
|
|
Cimetidine |
Versterking sedatie |
|
|
Efavirenz# |
Afname concentratie afzwakking effect |
|
|
Indinavir# |
Toename concentratie toxiciteit buprenorfine |
|
|
Ketoconazol# |
Remming CYP3A4 Toxiciteit buprenorfine |
|
|
Lopinavir# |
Afname concentratie afzwakking effect |
|
|
Opioiden (anderen dan buprenorfine) |
Versterking werking opioiden |
|
|
Ritonavir# |
Toename concentratie toxiciteit buprenorfine |
|
Oxycodon |
Azolen (oa voriconazole) |
Remming CYP3A4 toxiciteit oxycodon |
|
|
Carbamazepine |
Remming CYP2D6 afzwakking effect |
|
|
Fenytoine |
Remming CYP2D6 afzwakking effect |
|
|
Grapefruitsap |
Remming CYP3A4 toxiciteit oxycodon |
|
|
Kinidine |
Remming CYP2D6 remming oxymorfon productie, effect oxycodon onveranderd |
|
|
Macrolide antibiotica |
Remming CYP3A4 toxiciteit oxycodon |
|
|
Paroxetine |
Remming CYP3A4 toxiciteit oxycodon |
|
|
Proteaseremmers |
Remming CYP3A4 toxiciteit oxycodon |
|
|
Rifampicine |
Toename N-demethylatie toename eliminatie oxycodon afzwakking effect |
|
|
Sint Janskruid |
Remming CYP2D6 afzwakking effect |
|
|
SSRI’s# |
Toename serotonine spiegels |
|
Morfine |
Ritonavir# |
Afname concentratie afzwakking effect morfine |
@Gebaseerd op literatuuronderzoek per 21-7-2014. Zie voor een actueel overzicht de G-Standaard van de KNMP
*morfine, oxycodon, hydromorfon, methadon, fentanyl, buprenorfine
# wordt niet genoemd in het Farmacotherapeutisch Kompas SSRI: selective serotonin reuptake inhibitor
Gaertner (2012) beschrijft in een retrospectieve observationele studie in 200 patiënten opgenomen op een palliatieve afdeling dat er bij 151 (75%) patiënten geneesmiddeleninteracties werden geïdentificeerd. Vier (0,6%) van de interacties betroffen opioïd agonisten met partiële opioïd-agonisten leidend tot een afname van het effect van opioïden. Achttien (2,9%) interacties betroffen opioïden met enzyminductoren (onder andere carbamazepine) leidend tot een afname van de effect van opioïden. Methadon werd geclassificeerd als een geneesmiddel met een hoog potentieel voor interacties. Morfine en fentanyl werden geclassificeerd als geneesmiddelen met een laag potentieel voor geneesmiddeleninteracties.
Deelvraag 2. Wat zijn de risicofactoren van patiënten voor het ontwikkelen van adverse events door deze geneesmiddeleninteracties?
Weschules (2008) beschrijft in een systematische review de potentiele geneesmiddeleninteracties met methadon. De belangrijkste zijn farmacokinetische, i.e. metabolisme geassocieerde, interacties via invloed op P450 enzymen. Hierbij zijn een genetisch polymorfisme in P450 enzym concentratie en een hogere leeftijd met een daaraan gerelateerde verminderde P450 enzymconcentratie, additionele risicofactoren voor het optreden van interacties.
Deelvraag 3: Worden er in de literatuur interventies beschreven voor:
a. het selecteren van risicogroepen patiënten
b. de preventie van adverse events door geneesmiddeleninteracties
c. management van adverse events bij geneesmiddeleninteracties
In de studie van Mancini (2012) werden bij 47% van de patiënten dubbel voorgeschreven geneesmiddelen geïdentificeerd, bij 44% geneesmiddeleninteracties, bij 75% bijwerkingen, bij 95% ineffectieve geneesmiddelen en bij 73% onbehandelde aandoeningen.
Deelvraag 4. Is er evidence over de effectiviteit van interventies voor de preventie van geneesmiddeleninteracties bij opioïden?
Er werden geen studies gevonden die een interventie om geneesmiddeleninteracties te voorkomen vergeleken met geen interventie met als uitkomstmaat incidentie van geneesmiddeleninteracties met opioïden.
Zoeken en selecteren
Om deze vraag adequaat te beantwoorden aan de hand van de beschikbare literatuur is deze in een viertal deelvragen opgesplitst:
- Wat voor geneesmiddeleninteracties van opioïden en andere geneesmiddel en worden er beschreven in de literatuur en wat is de incidentie hiervan?
- Wat zijn de risicofactoren van patiënten voor het ontwikkelen van adverse events door deze geneesmiddeleninteracties?
- Worden er in de literatuur interventies beschreven voor:
- het selecteren van risicogroepen patiënten;
- de preventie van adverse events door geneesmiddeleninteracties;
- management van adverse events bij geneesmiddeleninteracties.
- Is er evidence over de effectiviteit van interventies voor de preventie van geneesmiddeleninteracties bij opioïden?
Zoeken en selecteren (Methode)
In de databases Medline (OVID), Embase and Cochrane is met relevante zoektermen gezocht naar systematische reviews, randomized controlled trials en ander vergelijkend onderzoek. De literatuurzoekactie leverde 323 treffers op.
Studies werden geselecteerd op grond van de volgende selectiecriteria:
- de studie diende een origineel artikel of systematische review te zijn;
- de studie diende relevant te zijn voor het beantwoorden van één van de deeluitgangsvragen;
- de patiënt populatie bestond uit patiënten met kanker; en
- de studie gaf informatie over risicofactoren voor het ontwikkelen geneesmiddeleninteracties en/of incidentie van geneesmiddeleninteracties en/of over interventies die geneesmiddeleninteracties eventueel konden voorkomen.
Op basis van titel en abstract werden in eerste instantie 32 studies voorgeselecteerd. Na raadpleging van de volledige tekst werden vervolgens 25 studies geëxcludeerd en zeven studies definitief geselecteerd.
Relevante uitkomstmaten
De werkgroep achtte de klinische relevantie van een geneesmiddeleninteractie met opioïden een voor de besluitvorming kritieke uitkomstmaat en risicofactoren voor het optreden van een geneesmiddeleninteractie met opioïden een voor de besluitvorming belangrijke uitkomstmaat.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte uitkomstmaten.
Per uitkomstmaat: de werkgroep definieerde het optreden van bijwerkingen of het minder of sterker werkzaam worden door een geneesmiddeleninteractie met opioïden als een klinisch relevant verschil.
Resultaten
Zeven onderzoeken zijn opgenomen in de literatuuranalyse. Zie ook de evidence tabellen.
Referenties
- Bernard SA, Bruera E. Drug interactions in palliative care. J Clin Oncol 2000;18:1780-99.
- Bernard SA. The interaction of medications used in palliative care. Hematol Oncol Clin North Am 2002;16:641 655.
- Clemens KE, Faust M. Drug interactions in palliative care patients with intractable cancer pain and polypharmacy: Focus on hydromorphone. Palliative Med 2012;26(4):564-5.
- Fredheim OM, Moksnes K, Borchgrevink PC, Kaasa S, Dale O. Clinical pharmacology of methadone for pain. Acta Anaesthesiol Scand. 2008; 52: 879–889
- Gaertner J, Ruberg K, Schlesiger G, et al. Drug interactions in palliative careits more than cytochrome P450. Palliative Med 2012;26(6):813-25.
- Jansman FGA. www.oncotherapie.nl/opinie/1281. 19 februari 2008.
- Kong VK, Irwin MG. Adjuvant analgesics in neuropathic pain. Eur J Anaesthesiol 2009;26:96-100.
- Kotlinska-Lemieszek A, Deskur-Smielecka E, Zaporowska-Stachowiak I. Polytherapy in patients with advanced cancer-the importance of pharmacokinetic interactions. Palliative Med 2012;26(4):579-80.
- Leppert W. The role of methadone in cancer pain treatment--a review. Int J Clin Pract. 2009;63(7):1095–1109. doi:10.1111/j.1742-1241.2008.01990.x
- Lussier D, Huskey AG, Portenoy RK. Adjuvant analgesics in cancer pain management. Oncologist 2004;9:571-91.
- Mancini R. Implementing a Standardized Pharmacist Assessment and Evaluating the Role of a Pharmacist in a Multidisciplinary Supportive Oncology Clinic. J Supportive Oncol 2012;10(3):99-106.
- Maurer PM, Bartkowski RR. Drug interactions of clinical significance with opioid analgesics. Drug Safety 1993;8(1):30-48.
- Metzke B, Hug MJ, Fink G, et al. Drug-drug interactions in the hematology and oncology department: A real-life assessment of frequency and severity. Blood 2012;120(21).
- Olkkola KT, Hagelberg NM. Oxycodone: new 'old' drug. Curr Opin Anaesthesiol. 2009; 22: 459–462
- Van Ojik AL, Jansen PA, Brouwers JR, et al. Treatment of chronic pain in older people. Drugs & aging 1;29(8):615- 25.
- Weschules DJ, Bain KT, Richeimer S. Actual and potential drug interactions associated with methadone. Pain Medicine 2008;9(3):315-44.
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 01-11-2023
Laatst geautoriseerd : 06-12-2019
Geplande herbeoordeling : 01-02-2024
Actualisatie
Deze richtlijn is goedgekeurd op 6 december 2019. De Nederlandse Vereniging voor Anesthesiologie (NVA) bewaakt samen met betrokken verenigingen de houdbaarheid van deze (modules van de) richtlijn. Zo nodig zal de richtlijn tussentijds op onderdelen worden bijgesteld. De geldigheidstermijn van de richtlijn is maximaal 5 jaar na vaststelling. Indien de richtlijn dan nog actueel wordt bevonden, wordt de geldigheidsduur van de richtlijn verlengd.
Houderschap richtlijn
De houder van de richtlijn (NVA) moet kunnen aantonen dat de richtlijn zorgvuldig en met de vereiste deskundigheid tot stand is gekomen.
IKNL draagt zorg voor het beheer en de ontsluiting van de richtlijn.
Juridische betekenis van richtlijnen
Een richtlijn is een kwaliteitsstandaard. Een kwaliteitsstandaard beschrijft wat goede zorg is, ongeacht de financieringsbron (Zorgverzekeringswet (Zvw), Wet langdurige zorg (Wlz), Wet maatschappelijke ondersteuning (Wmo), aanvullende verzekering of eigen betaling door de cliënt/patiënt). Opname van een kwaliteitsstandaard in het Register van Zorginstituut Nederland betekent dus niet noodzakelijkerwijs dat de in de kwaliteitsstandaard beschreven zorg verzekerde zorg is.
De richtlijn bevat aanbevelingen van algemene aard. Het is mogelijk dat deze aanbevelingen in een individueel geval niet van toepassing zijn. Er kunnen zich feiten of omstandigheden voordoen waardoor het wenselijk is dat in het belang van de patiënt van de richtlijn wordt afgeweken. Wanneer van de richtlijn wordt afgeweken, dient dit beargumenteerd gedocumenteerd te worden. De toepassing van de richtlijnen in de praktijk is de verantwoordelijkheid van de behandelende arts.
Algemene gegevens
Autoriserende/instemmende en bij de werkgroep betrokken verenigingen:
- Nederlandse Internisten Vereniging
- Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose
- Nederlandse Vereniging voor Anesthesiologie
- Nederlandse Vereniging voor Klinische Geriatrie
- Nederlandse Vereniging voor Neurologie
- Vereniging voor Specialisten Ouderengeneeskunde
- Verpleegkundigen en Verzorgenden Nederland
- Nederlandse Vereniging van Ziekenhuisapothekers
- Nederlandse vereniging voor professionele palliatieve zorg
Financiering
Deze richtlijn c.q. module is gefinancierd door IKNL. De inhoud van de richtlijn c.q. module is niet beïnvloed door de financierende instantie.
Procesbegeleiding
IKNL (Integraal Kankercentrum Nederland) is het kennis- en kwaliteitsinstituut voor professionals en bestuurders in de oncologische en palliatieve zorg dat zich richt op het continu verbeteren van de oncologische en palliatieve zorg.
IKNL benadert preventie, diagnose, behandeling, nazorg en palliatieve zorg als een keten waarin de patiënt centraal staat. Om kwalitatief goede zorg te waarborgen ontwikkelt IKNL producten en diensten ter verbetering van de oncologische zorg, de nazorg en de palliatieve zorg, zowel voor de inhoud als de organisatie van de zorg binnen en tussen instellingen. Daarnaast draagt IKNL nationaal en internationaal bij aan de beleidsvorming op het gebied van oncologische en palliatieve zorg.
IKNL rekent het (begeleiden van) ontwikkelen, implementeren en evalueren van multidisciplinaire, evidence-based richtlijnen voor de oncologische en palliatieve zorg tot een van haar primaire taken. IKNL werkt hierbij conform de daarvoor geldende (inter)nationale kwaliteitscriteria. Bij ontwikkeling gaat het in toenemende mate om onderhoud (modulaire revisies) van reeds bestaande richtlijnen.
Doel en doelgroep
Doel
Een richtlijn geeft aanbevelingen ter ondersteuning van de belangrijkste knelpunten uit de dagelijkse praktijk. Deze richtlijn is zoveel mogelijk gebaseerd op wetenschappelijk onderzoek en consensus. De richtlijn 'Pijn’ geeft aanbevelingen over begeleiding en behandeling van patiënten met pijn bij kanker (zowel in de curatieve als de palliatieve fase) en beoogt hiermee de kwaliteit van de zorgverlening te verbeteren.
Hoewel de evidentie alleen is verzameld voor de diagnostiek en behandeling van pijn bij patiënten met kanker zijn de aanbevelingen ook grotendeels van toepassing voor patiënten met andere levensbedreigende aandoeningen.
Doelgroep
Deze richtlijn is bestemd voor alle professionals die betrokken zijn bij de zorg voor patiënten met pijn zoals huisartsen, specialisten ouderengeneeskunde, medisch specialisten, apothekers, verpleegkundigen, verzorgenden, verpleegkundig specialisten, physician assistants, fysiotherapeuten, medisch maatschappelijk werkers, geestelijk verzorgers, GZ- en klinisch psychologen.
Indien in de richtlijn wordt gesproken over zorgverleners rondom de patiënt met pijn, worden, afhankelijk van de specifieke situatie van de patiënt, alle bovengenoemde professionals bedoeld.
De richtlijn is ook relevant voor zorgverleners van andere disciplines en vrijwilligers die werkzaam zijn in de palliatieve fase. De multidimensionele benadering van de patiënt in de palliatieve fase vergt immers een gezamenlijke, interdisciplinaire verantwoordelijkheid, zoals ook in het Kwaliteitskader palliatieve zorg Nederland is beschreven.
Samenstelling werkgroep
Alle werkgroepleden en klankbordleden zijn afgevaardigd namens wetenschappelijke, beroeps- en patiëntenverenigingen en hebben daarmee het mandaat voor hun inbreng. Bij de samenstelling van de werkgroep is geprobeerd rekening te houden met landelijke spreiding, inbreng van betrokkenen uit zowel academische als algemene ziekenhuizen/instellingen en vertegenwoordiging van de verschillende verenigingen/disciplines.
Het patiëntenperspectief is vertegenwoordigd door Patiëntenfederatie Nederland.
Bij de uitvoering van het evidence-based literatuuronderzoek is de kaderopleiding Palliatieve Zorg en een literatuuronderzoeker van IKNL en de voorzitter van de richtlijnwerkgroep betrokken geweest.
Werkgroepleden
- Mw. prof. dr. M.H.J. van den Beuken-van Everdingen, internist, NIV
- Dhr. dr. M.J.M.M. Giezeman †, anesthesioloog, NVA
- Dhr. dr. A. de Graeff (voorzitter), internist-oncoloog en hospice-arts, Palliactief
- Mw. drs. H. Klaren, klinisch geriater, NVKG
- Mw. B. Kramp, verpleegkundig specialist, V&VN
- Dhr. drs. M. Martens, specialist ouderengeneeskunde en consulent palliatieve zorg, Verenso
- Mw. drs. M.J. Oortman, huisarts, SCEN-arts, palliatief consulent en hospice-arts, NHG
- Dhr. drs. P. Oosterhof, poliklinisch apotheker, NVZA
- Mw. prof.dr. A.K.L. Reyners, internist, NIV
- Mw. M. Schielke, verpleegkundig pijnspecialist, V&VN
- Mw. drs. M.C. Sieders, huisarts (waarnemend), SCEN-arts, palliatief consulent, NHG
- Dhr. dr. M.F.M. Wagemans, anesthesioloog, NVA
Klankbordleden
- Dhr. prof. dr. K.C.P. Vissers, anesthesioloog, NVA
- Mw. drs. L. Bellersen, cardioloog, NVVC
- Mw. drs. B.A. Brouwer, neuroloog/pijnspecialist NVN/pijnspecialist
- Mw. M. Geerts, verpleegkundig specialist, V&VN
- Dhr. drs. S.M. de Hosson, longarts, NVALT
- Mw. drs. S. Visser, apotheker, KNMP
- Mw. drs. R. Lammers, beleidsmedewerker, Patiëntenfederatie Nederland
Ondersteuning
- Mw. T.T.M. Bluemink-Holkenborg, secretaresse, IKNL
- Mw. drs. M.G. Gilsing, adviseur (richtlijnen) palliatieve zorg, IKNL
- Mw. dr. O.L. van der Hel, literatuuronderzoeker, IKNL
- Prof.dr. J Kleijnen, epidemioloog, literatuuronderzoeker MUMC Maastricht/York
- Mw. L.K. Liu, secretaresse, IKNL
- Dhr. dr. R. Vernooij (i.s.m. de kaderopleiding Palliatieve Zorg), literatuuronderzoeker, IKNL
Belangenverklaringen
Om de beïnvloeding van de richtlijnontwikkeling of formulering van de aanbevelingen door conflicterende belangen te minimaliseren zijn de leden van werkgroep gemandateerd door de wetenschappelijke en beroepsverenigingen.
Alle leden van de richtlijnwerkgroep hebben verklaard onafhankelijk gehandeld te hebben bij het opstellen van de richtlijn. Een onafhankelijkheidsverklaring ‘Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling' zoals vastgesteld door onder meer de KNAW, KNMG, Gezondheidsraad, CBO, NHG en Orde van Medisch Specialisten is door de werkgroepleden bij aanvang en bij afronding van het traject ingevuld. De bevindingen zijn schriftelijk vastgelegd in de belangenverklaring en opvraagbaar via info@iknl.nl.
Inbreng patiëntenperspectief
De input van patiëntvertegenwoordigers is nodig voor de ontwikkeling van kwalitatief goede richtlijnen. Goede zorg voldoet immers aan de wensen en eisen van zowel zorgverlener als patiënt. Patiëntenfederatie Nederland is in het gehele richtlijntraject meegenomen en heeft plaats gehad in de klankbordgroep (zie ook de Samenstelling van de werkgroep).
Tijdens de landelijke consultatiefase heeft Patiëntenfederatie Nederland commentaar gegeven op de conceptrichtlijn en patiënten/naasten geraadpleegd via een referentenpanel voor onderzoeksaanvragen op het gebied van palliatieve zorg. Ook heeft de Patiëntenfederatie Nederland - naast NFK, nog andere patiëntenorganisaties benaderd voor het leveren van commentaar.
Patiëntenfederatie Nederland heeft tot slot de richtlijn goedgekeurd.
Patiënteninformatie gebaseerd op de richtlijn is opgesteld en gepubliceerd op de daarvoor relevante sites (o.a. zie link https://www.kanker.nl/gevolgen-van-kanker/pijn/wat-is/pijn-bij-kanker#show-menu).
Methode ontwikkeling
Evidence based
Implementatie
Bevorderen van het toepassen van de richtlijn in de praktijk begint met een brede bekendmaking en verspreiding van de richtlijn.
Bij verdere implementatie gaat het om gerichte interventies om te bevorderen dat professionals de nieuwe kennis en kunde opnemen in hun routines van de zorgpraktijk, inclusief borging daarvan.
Als onderdeel van elke richtlijn stelt IKNL samen met de richtlijnwerkgroep een implementatieplan op en ondersteunt een aantal basis-activiteiten voor de implementatie. De verantwoordelijkheid voor verdere implementatie-activiteiten ligt bij de eigenaar van de richtlijn (en het veld).
Activiteiten en interventies voor verspreiding en implementatie kunnen zowel op landelijk als regionaal niveau plaatsvinden. Deze kunnen eventueel ook op maat gemaakt worden per instelling of specialisme.
Het implementatieplan bij deze richtlijn is een belangrijk hulpmiddel om effectief de aanbevelingen uit deze richtlijn te implementeren voor en door de verschillende disciplines.
Werkwijze
In de huidige richtlijn zijn de NVA-richtlijn van 2015 en de richtlijn 'Pijn' van Pallialine samengevoegd. Daarbij zijn de onderdelen van de NVA-richtlijn, die in 2015 niet zijn herzien (en waarbij de teksten van de NVA-versie van 2008 onveranderd zijn gehandhaafd) grotendeels evidence-based (op basis van aanvullend literatuuronderzoek) aangepast en aangevuld met evidence-based en consensus-based teksten over de diagnostiek en behandeling van pijn bij patiënten met gevorderde stadia van COPD of hartfalen. De onderdelen van de NVA-richtlijn die in 2015 zijn herzien zijn onveranderd overgenomen (zie ook de Algemene inleiding).
De bedoeling is om te komen tot een integrale en actuele richtlijn over de diagnostiek en behandeling van pijn bij zowel patiënten met kanker (in de curatieve én de palliatieve fase) als bij patiënten met COPD of hartfalen.
Voor de evidence-based (herzieningen van) modules zijn de aanbevelingen voorzien van een gradering met cijfers en letters om de verhouding tussen de sterkte van de aanbeveling en de kwaliteit van de evidence weer te geven (zie onderstaande tabel). Deze werkwijze is gebaseerd op de methodiek zoals voorgesteld door de GRADE working group (zie http://www.gradeworkinggroup.org).
|
Gradering van aanbevelingen |
|
|
Sterkte van de aanbeveling |
Cijfer |
|
Sterke aanbeveling |
1 |
|
Zwakke aanbeveling |
2 |
|
Kwaliteit van de evidence |
Letter |
|
Hoog |
A |
|
Matig |
B |
|
Laag |
C |
|
Zeer laag |
D |
De richtlijnteksten die gebaseerd zijn op uitgangsvragen, zijn opgebouwd volgens het volgende vaste stramien: uitgangsvraag en aanbevelingen, literatuur, conclusies, overwegingen en referenties. De evidence tabellen staan bij de desbetreffende modules. De antwoorden op de uitgangsvragen (derhalve de aanbevelingen in deze richtlijn) zijn voor zover mogelijk gebaseerd op gepubliceerd wetenschappelijk onderzoek.
De uitgangsvragen zijn óf evidence-based (via de GRADE methodiek) óf consensus-based (zonder systematisch literatuuronderzoek) uitgewerkt.
De GRADE-methodiek
Selectie
Naast de selectie van studies op relevantie werd tevens geselecteerd op bewijskracht. Hiervoor werd gebruik gemaakt van de volgende hiërarchische indeling van studiedesigns gebaseerd op bewijskracht:
- Gerandomiseerde gecontroleerde studies (RCT's)
- Niet gerandomiseerde gecontroleerde studies (CCT's)
Waar deze niet voorhanden waren werd verder gezocht naar vergelijkend cohortonderzoek.
Critical appraisal
De kwaliteit van bewijs wordt weergegeven in vier categorieën: hoog, matig, laag en zeer laag. RCT's starten hoog en observationele studies starten laag. Vijf factoren verlagen de kwaliteit van de evidentie (beperkingen in onderzoeksopzet, inconsistentie, indirectheid, imprecisie, publicatie bias) en drie factoren kunnen de kwaliteit van de evidentie verhogen (sterke associatie, dosis-respons relatie, plausibele (residuele) confounding) (zie tabel 1).
Tabel 1. GRADE-methodiek voor het graderen van bewijs
|
Quality of evidence |
Study design |
Lower if * |
Higher if * |
|
High (4) |
Randomized trial |
Study limitations -1 Serious -2 Very serious Inconsistency -1 Serious -2 Very serious Indirectness -1 Serious -2 Very serious Imprecision -1 Serious -2 Very serious Publication bias -1 Likely -2 Very likely |
Large effect + 1 Large + 2 Very large Dose response + 1 Evidence of a gradient All plausible confounding + 1 Would reduce a demonstrated effect, or + 1 Would suggest a spurious effect when results show no effect |
|
Moderate (3) |
|
||
|
Low (2)
|
Observational study |
||
|
Very low (1) |
|
Algehele kwaliteit van bewijs
Omdat het beoordelen van de kwaliteit van bewijs in de GRADE-benadering per uitkomstmaat geschiedt, is er behoefte aan het bepalen van de algehele kwaliteit van bewijs. Zowel voor als na het literatuuronderzoek wordt door de richtlijnwerkgroep bepaald welke uitkomstmaten cruciaal, belangrijk en niet belangrijk zijn.
Het niveau van de algehele kwaliteit van bewijs wordt in principe bepaald door de cruciale uitkomstmaat met de laagste kwaliteit van bewijs. Als echter de kwaliteit van het bewijs verschilt tussen de verschillende cruciale uitkomstmaten zijn er twee opties:
- De uitkomstmaten wijzen in verschillende richtingen (zowel gewenst als ongewenste effecten) of de balans tussen gewenste en ongewenste effecten is onduidelijk, dan bepaalt de laagste kwaliteit van bewijs van de cruciale uitkomstmaten de algehele kwaliteit van bewijs;
- De uitkomstmaten in dezelfde richting wijzen (richting gewenst of richting ongewenst effecten), dan bepaalt de hoogste kwaliteit van bewijs van de cruciale uitkomstmaat dat op zichzelf voldoende is om de interventie aan te bevelen de algehele kwaliteit van bewijs.
Tabel 2. Formulering conclusies op basis van kwaliteit van bewijs per uitkomstmaat
|
Kwaliteit van bewijs |
Interpretatie |
Formulering conclusie |
|
Hoog |
Er is veel vertrouwen dat het werkelijk effect dicht in de buurt ligt van de schatting van het effect. |
Er is bewijs van hoge kwaliteit dat...
(Referenties) |
|
Matig |
Er is matig vertrouwen in de schatting van het effect: het werkelijk effect ligt waarschijnlijk dicht bij de schatting van het effect, maar er is een mogelijkheid dat het hier substantieel van afwijkt. |
Er is bewijs van matige kwaliteit dat...
(Referenties) |
|
Laag |
Er is beperkt vertrouwen in de schatting van het effect: het werkelijke effect kan substantieel verschillend zijn van de schatting van het effect. |
Er is bewijs van lage kwaliteit dat....
(Referenties) |
|
Zeer laag |
Er is weinig vertrouwen in de schatting van het effect: het werkelijke effect wijkt waarschijnlijk substantieel af van de schatting van het effect. |
Er is bewijs van zeer lage kwaliteit dat....
(Referenties) |
|
Formulering algehele kwaliteit van bewijs: hoog/matig/laag/zeer laag |
||
Methode voor het formuleren van ‘Overwegingen’
Naast de evidence uit de literatuur (conclusies) zijn er andere overwegingen die meespelen bij het formuleren van de aanbeveling. Deze aspecten worden besproken onder het kopje ‘Overwegingen' in de richtlijntekst. Hierin worden de conclusies (op basis van de literatuur) geplaatst in de context van de dagelijkse praktijk en vindt een afweging plaats van de voor- en nadelen van de verschillende beleidsopties. De uiteindelijk geformuleerde aanbeveling is het resultaat van de conclusie(s) in combinatie met deze overwegingen.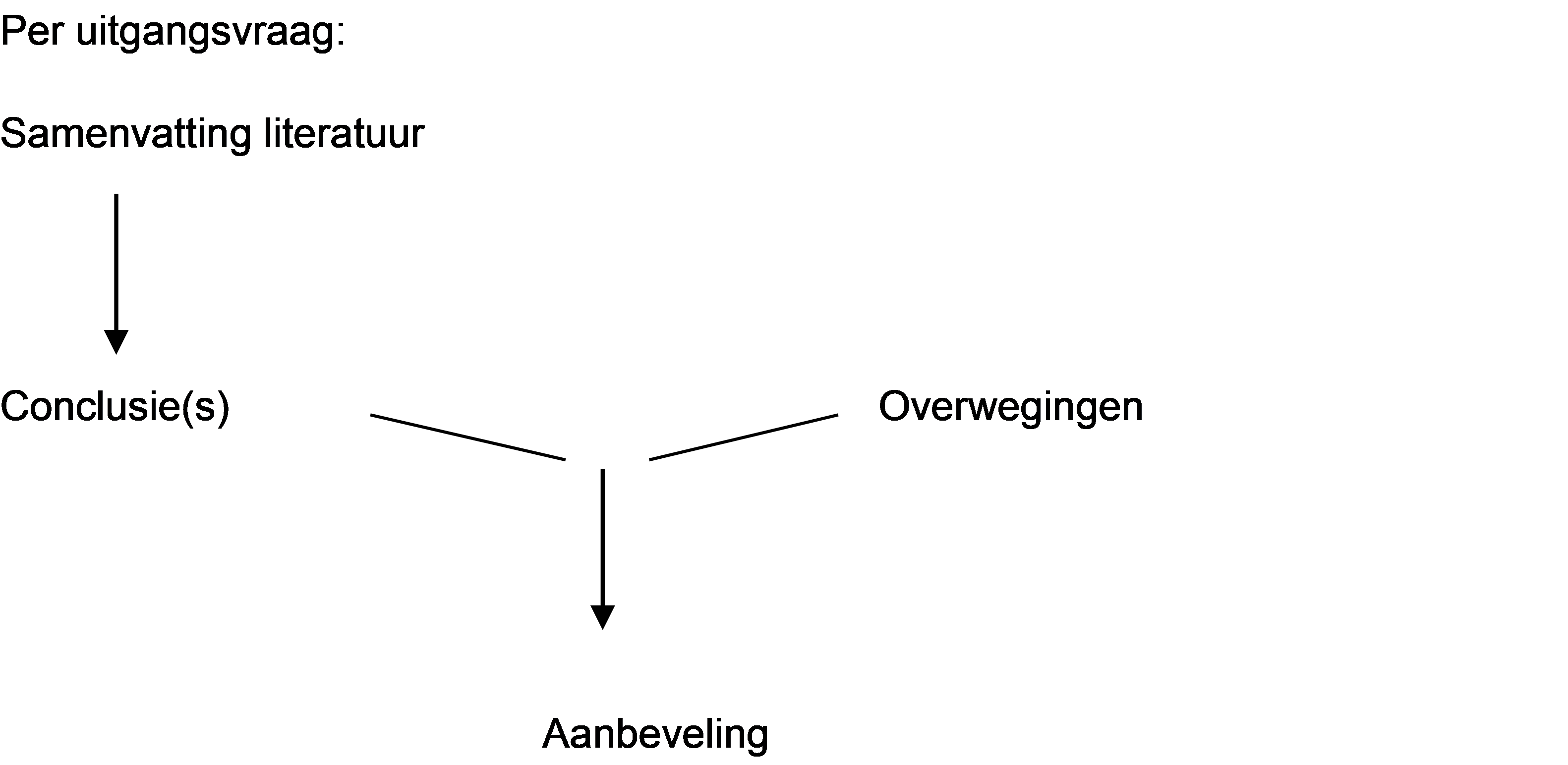
Figuur 1. Van bewijs naar aanbeveling
Bij het schrijven van de overwegingen zijn onderstaande zaken in acht genomen.
- Kwaliteit van het bewijs
Hoe hoger de algehele kwaliteit van het bewijs, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling. - Balans van gewenste en ongewenste effecten
Hoe groter het verschil is tussen de gewenste en ongewenste effecten, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling. Hoe kleiner dit verschil of hoe meer onzekerheid over de grootte van het verschil, des te waarschijnlijker wordt het formuleren van een conditionele aanbeveling.
Toelichting: - Patiëntenperspectief
Hoe groter de uniformiteit in waarden en voorkeuren van patiënten bij het afwegen van de voor- en nadelen van een interventie, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling. - Professioneel perspectief
Hoe groter de uniformiteit in waarden en voorkeuren van professionals ten aanzien van de toepasbaarheid van een interventie, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling.
Toelichting:
- Kennis en ervaring met technieken/therapieën.
- Risico’s die professional loopt bij het toepassen van de interventie.
- Verwachte tijdbesparing.
- Verlies aan tijd door het invoeren van de interventie.
N.B.: de hierna volgende factoren (5, 6 en 7) alleen evalueren als een positief geformuleerde aanbeveling wordt overwogen! Een positief geformuleerde aanbeveling is een aanbeveling waarbij een bepaalde interventie wel ‘dient’ plaats te vinden (sterk) of wel ‘kan worden overwogen’ (zwak/conditioneel). Als dat daarentegen juist niet het geval is, is sprake van een negatief geformuleerde aanbeveling.
- Middelenbeslag
Hoe minder middelen er worden gebruikt (m.a.w. hoe lager de kosten van een interventie zijn vergeleken met de beschouwde alternatieven en andere kosten gerelateerd aan de interventie), des te waarschijnlijker wordt het formuleren van een sterke aanbeveling. Hoe meer onzekerheid over het middelenbeslag, des te waarschijnlijker wordt een conditionele aanbeveling. - Organisatie van zorg
Hoe meer onzekerheid of de geëvalueerde interventie daadwerkelijk op landelijke schaal toepasbaar is, des te waarschijnlijker wordt het formuleren van een conditionele aanbeveling.
Toelichting: - Maatschappelijk perspectief
(Juridische overwegingen/ethische overwegingen/industriële belangen/vergoeding door verzekeraars/politieke en strategische consequenties)
Hoe groter de onzekerheid hierover is, des te waarschijnlijker wordt het formuleren van een conditionele aanbeveling.
Toelichting:
- Indien twee behandelingen even effectief zijn waarvan één behandeling wordt vergoed, zal deze laatste behandeling mogelijk de voorkeur hebben.
Methode voor het formuleren van aanbevelingen
GRADE kent twee soorten aanbevelingen: sterke aanbevelingen of conditionele (zwakke) aanbevelingen. De sterkte van aanbevelingen reflecteert de mate van vertrouwen waarin – voor de groep patiënten waarvoor de aanbevelingen zijn bedoeld - de gewenste effecten opwegen tegen de ongewenste effecten.
Formulering:
- Sterke aanbevelingen: Doe/geef etc. (of er dient…. te worden gegeven/gedaan)
- Zwakke/conditionele aanbevelingen: Overweeg….. te geven/te doen.
Consensus-based methodiek
Naast de evidence-based uitwerking (GRADE) zijn er ook uitgangsvragen via de consensus-based methodiek uitgewerkt. Hierbij zijn de richtlijnteksten ook gebaseerd op evidence, maar is er geen systematisch literatuuronderzoek gedaan en zijn de gevonden studies niet methodologisch beoordeeld.
