Langwerkende β2-sympathicomimetica (LABA)
Uitgangsvraag
Kan een vrouw tijdens zwangerschap veilig langwerkende β2-sympathicomimetica (LABA) blijven gebruiken?
Aanbeveling
Rationale
LABA wordt toegepast bij astma voor de verlichting van benauwdheidsklachten. De werkgroep is van mening dat op basis van de beschikbare literatuur, deze medicatie veilig kan worden toegepast tijdens de zwangerschap. Combineer LABA altijd met een Inhalatiecorticosteroïd (ICS) en kies bij zwangere patiënten uit de verschillende combinaties van ICS-LABA bij voorkeur een strategie uit die gebruikt maakt van het Maintenance and Reliever Therapy (MART) principe, waarbij dezelfde inhaler wordt gebruikt voor zowel onderhoud als voor ‘zo nodig’ therapie (zie ook module ‘ICS-formoterol therapie’).
Continueer LABA-gebruik bij de behandeling van een zwangere met astma, indien hier goede astmacontrole mee is bereikt.
Gebruik bij voorkeur LABA waarmee de meeste ervaring is opgedaan tijdens de zwangerschap (formoterol of salmeterol).
Combineer LABA altijd met een inhalatiecorticosteroïd (ICS).
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Op basis van de literatuur kan er niet met zekerheid een uitspraak gedaan worden over de gevolgen van het gebruik van LABA tijdens de zwangerschap bij vrouwen met astma. Neonatale en maternale complicaties als gevolg van astmamedicatie gebruik tijdens de zwangerschap waren gedefinieerd als cruciale uitkomstmaten. De bewijskracht hiervoor is gewaardeerd als zeer laag, waardoor er geen richting kan worden gegeven aan de besluitvorming.
Hoewel de kracht van de bewijsvoering als ‘zeer laag’ wordt gegradeerd, lijkt het de werkgroep zeer aannemelijk dat het gebruik van LABA bij astma in de zwangerschap als veilig kan worden beschouwd. Hierbij speelt mee dat de power van de meeste studies aanzienlijk is geweest. Alle beschikbare studies lieten geen significant verhoogd risico zien op de door de werkgroep aangewezen cruciale uitkomstmaten. De beschikbare data voor een aantal aangewezen major outcomes (‘small for gestational age’ en ‘preterm delivery’) lieten eveneens geen significant verhoogd risico zien. Het Lareb geeft aan dat van formoterol en salmeterol de meeste gegevens beschikbaar zijn. Deze middelen hebben de voorkeur boven vilanterol in verband met een ruimere ervaring waaruit geen aanwijzingen naar voren zijn gekomen voor een hoger risico op aangeboren afwijkingen of andere nadelige effecten (www.lareb.nl). De werkgroep gaat ervan uit dat als de afzonderlijke medicamenten (ICS en LABA) veilig zijn, de combinaties waarschijnlijk ook als veilig beschouwd kunnen worden omdat er voldoende gegevens beschikbaar zijn voor de losse componenten. Er zijn ook studies die specifiek hebben gekeken naar combinatie preparaten en aantonen dat deze ICS-LABA combinatie preparaten waarschijnlijk veilig zijn in de zwangerschap (Cosette, 2013; Eltonsy, 2015).
Waarden en voorkeuren van patiënten
Goede astmacontrole met medicamenteuze behandeling tijdens de zwangerschap is veiliger en geeft minder complicaties dan het accepteren van astmaklachten en longaanvallen door het staken van medicatie uit zorg over bijwerkingen voor het kind (NHG standaard “Astma bij volwassenen”, 2020). De aanstaande moeder dient hierover voorlichting te ontvangen. In het gesprek met aanstaande moeder dient achterhaald te worden wat het achterliggende gedachte is van wel/niet astmamedicijnen te blijven gebruiken tijdens zwangerschap, en dienen haar zorgen of angst te worden besproken.
Kosten (middelenbeslag)
Een inadequaat behandelde astmapatiënt kan leiden tot meer zorggebruik en hogere zorgkosten (Yaghoubi, 2019; Suijkerbuijk, 2013a; Suijkerbuijk, 2013b; Finkelstein, 2021). Een inadequate behandeling van een zwangere astmapatiënte zal naar verwachting ook dezelfde nadelige gevolgen met zich meebrengen. Salmeterol en formoterol zijn al jaren op de markt en zijn inmiddels (in combinatie met ICS) als generiek beschikbaar, wat de kosten van een behandeling met deze medicatie laag houdt.
Aanvaardbaarheid, haalbaarheid en implementatie
Zorgen met betrekking tot potentieel schadelijke effecten van medicatie op de foetus resulteert vaak in een inadequate behandeling van astma tijdens de zwangerschap. In de meest recente behandelrichtlijnen voor astma (GINA, NHG) hebben LABA een prominentere rol gekregen ten koste van de SABA terwijl in het verleden tijdens zwangerschap behandelen met SABA de voorkeur had. Voorlichting over het belang van het gebruik van astmamedicatie waaronder LABA voor een goede astmacontrole, ook tijdens zwangerschap, kan bijdragen aan een goede therapie.
Een toekomstig ‘zwangerschapsformularium’ waar momenteel (2022) aan wordt gewerkt door de afdeling Farmacologie en Toxicologie van het Radboudumc met Maastricht UMC+ en ‘ Lareb/ Moeders van Morgen’ kan positief bijdragen aan implementatie van de adviezen uit deze module en eenduidige adviezen over veiligheid en de juiste doseringen van medicatie tijdens de zwangerschap stimuleren.
Onderbouwing
Conclusies
Long-acting β2-agonists (LABA)
|
very low GRADE |
Major congenital malformations The evidence is very uncertain about the effect of LABA exposure during pregnancy in women with asthma on the risk of major congenital malformations in the offspring, compared to unexposed (healthy) pregnant women.
Sources: Eltonsy, 2011; Kallen, 2007a,b; Vasilakis-Scaramozza, 2013; Tata, 2008; Garne, 2016 |
|
very low GRADE |
Small for gestational age The evidence is very uncertain about the effect of LABA exposure during pregnancy in women with asthma on the risk of having a baby small for gestational age, compared to unexposed (healthy) pregnant women.
Sources: Bracken 2003 |
|
very low GRADE |
Preterm birth The evidence is very uncertain about the effect of LABA exposure during pregnancy in women with asthma on the risk of preterm birth, compared to unexposed (healthy) pregnant women.
Sources: Bracken, 2003 |
|
- GRADE |
No conclusions could be drawn about the effect of LABA exposure during pregnancy on the risk of pregnancy-induced hypertension, having a baby with a low birth weight, stillbirth and spontaneous abortion in women with asthma, compared with non-exposure to LABA, because of the absence of relevant studies.
Sources: - |
Samenvatting literatuur
Description of studies
Vasilakis-Scaramozza (2013) conducted a matched cohort study that compared congenital anomalies between users of various types of anti-asthma drugs with the offspring of women not exposed to asthma drugs during early pregnancy. No source of funding for the study has been mentioned. Vasilakis-Scaramozza (2013) included women (with singleton pregnancies) aged 15-45 years that were exposed to asthma drugs during early pregnancy and a sample of matched unexposed pregnant women in The United Kingdom’s General Practice Research Database. Cases were defined as congenital anomaly based on International Classification of Diseases, Ninth Revision (ICD-9) codes (740.0–759.9, excluding chromosomal anomalies). There were 7,911 women exposed to asthma drugs during the first trimester of pregnancy and 15,840 unexposed women. The majority of women had a BMI <25 (49.2%), was under 35 years of age (86.6%), and did not smoke (50.5%).
Eltonsy (2011) conducted a cohort study examining the association between exposure to SABA and LABA in the first trimester of pregnancy and the risk of congenital malformations among women with asthma. The study by Eltonsy (2011) was sponsored by non-commercial organisations. Eltonsy (2011) included women between 12-50 years old, who had at least one pregnancy ending in a delivery (live or still birth) between 1990 and 2002, and who were diagnosed with asthma (International Classification of Diseases [ICD]-9 code 493 and used SABA and LABA during the first trimester. Relevant data was retrospectively obtained from three administrative databases from Québec, Canada. The final cohort included 13,117 pregnancies. Most of the women were between 18 and 34 years old, received social assistance, and were living in urban areas.
Kallen (2007) conducted a cohort study examining the association between the use of anti-asthmatic drugs during pregnancy and pregnancy complications. No source of funding for the study has been mentioned. Kallen (2007) included women who reported the use of anti-asthmatic drugs in early pregnancy and women who were prescribed anti-asthmatic drugs later during pregnancy. Maternal characteristics and pregnancy and delivery complications were compared with all women that gave birth to a child recorded in the same time period. In total, the cohort included 24,369 women that used anti-asthmatic medication early in pregnancy, 7,778 that used anti-asthmatic medication late in pregnancy and 860,215 pregnant women without asthma.
Tata (2008) conducted a case-control study examining the association between maternal
asthma and gestational exposure to asthma medications with risk of congenital malformations in the offspring. The study by Tata (2008) was sponsored by non-commercial organizations. Using the health improvement network database, Tata (2008) selected cases defined as children with malformations and control children that were matched to cases on birth year, general practice and singleton or twin delivery. In total, 5124 cases of liveborn children with major congenital malformations and 30,053 controls were included in the study. Maternal age at birth was similar for cases and controls. Compared with mothers of controls, mothers of cases were more likely to be obese before the pregnancy (OR=1.16; 95% CI 1.03 to 1.31) or to be underweight before the pregnancy (OR=1.19; 95% CI 1.00 to
1.42). Cases and controls had a similar proportion of mothers who were current smokers before the pregnancy (OR=1.00; 95% CI 0.92 to 1.08) and had the same distribution across levels of household socioeconomic status.
Bracken (2003) conducted a prospective cohort study examining the association between maternal asthma and/or asthma medication and the risk of preterm delivery, intrauterine grown restriction, or birthweight in offspring. The study by Bracken (2003) was sponsored by non-commercial organizations. Between April 1997 and June 2000, Bracken (2003) included women with a history of a physician-diagnosed asthma (n=813) and a simple random sample of non-asthmatic women (n=1,333) as control from 15 clinics associated with six hospitals in Connecticut and Massachusetts. Most women were White (67.9%), between the ages of 30 and 34 (31.2%), no prior live births (45.2%) , married (63.0%) and did not smoke (82.9%).
Results
Major congenital malformations (critical outcome)
LABA exposure and risk of major congenital malformations, cohort studies
In the cohort study by Eltonsy (2011), the absolute risk of major congenital malformations was 7.9% (13/165) in the LABA-exposed group, compared with 5.8% (749/12,953) in the asthmatic non-user control group. After adjusting for diabetes mellitus, use of teratogenic drugs in first trimester, use of intranasal corticosteroids in first trimester, emergency department visit or hospitalization for asthma in first trimester, and asthma severity in the year before pregnancy, the risk of major malformations was not significantly increased in the LABA exposed group (OR=1.31; 95% CI 0.74 to 2.31).
In the cohort study by Kallen (2007a,b), the risk of major congenital malformations, adjusted for year of birth, maternal age, parity, smoking in early pregnancy, and number of previous miscarriages, was also not statistically significantly increased for pregnant women exposed to salmeterol (OR=1.34; 95% CI 0.96 to 1.88) and formoterol (OR=1.07; 95% CI 0.63 to 1.82).
In summary, two cohort studies reported on the risk of major malformations (Eltonsy, 2011; Kallen, 2007a,b). The pooled adjusted estimates of these two cohort studies (Figure 2.1) did not show an increased risk of major congenital malformations after exposure to LABA during pregnancy (OR=1.27; 95% CI 0.98 to 1.63).
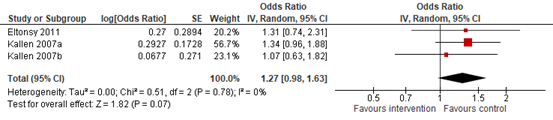
Figure 2.1. Odds ratios for the association between LABA use during pregnancy and major congenital malformations (cohort studies)
LABA exposure and risk of major congenital malformations, case-control studies
In the case-control study by Tata (2008), the absolute risk of major malformations was 0.48% (25/5124) in the LABA-exposed group, compared with 0.44% (131/30,053) in the asthmatic non-user control group. After adjusting for maternal age at birth of case or control child, maternal smoking status, body mass index, socioeconomic status, and sex of the child, the risk of major malformations was not significantly increased in the LABA-exposed group (OR=1.12; 95% CI 0.72 to 1.75).
In the meta-analysis of three congenital anomaly registries by Garne (2016), the absolute risk of major malformations was 3.3% (42/1286) in the LABA-exposed group. After adjusting for period, maternal age, and socio-economic status, the risk of major malformations was not significantly increased in the LABA exposed group (OR=1.20; 95% CI 0.80 to 1.80).
LABA exposure and risk of cleft lip or palate
Compared to unexposed controls, Vasilakis-Scaramozza (2013) reported exposure to LABA during pregnancy did not result in an increased risk of cleft lip or palate (RR=2.4; 95% CI 0.3 to 21.8), but these finding were based on only 1 exposed case.
LABA exposure and risk of musculoskeletal congenital anomalies
Compared to unexposed controls, Vasilakis-Scaramozza (2013) reported exposure to LABA during pregnancy did not result in an increased risk of musculoskeletal anomalies (RR=1.9; 95% CI 0.4 to 9.1), but these finding were based on only 2 exposed cases.
LABA exposure and risk of cardiovascular anomalies
Compared to unexposed controls, Vasilakis-Scaramozza (2013) reported exposure to LABA during pregnancy did not result in an increased risk of cardiovascular anomalies (RR=1.0; 95% CI 0.2 to 4.4), but these finding were based on only 2 exposed cases.
Small for gestational age (important outcome)
LABA exposure and risk of having a baby small for gestational age
In the cohort study by Bracken (2003), the absolute risk of ‘small for gestational age’ was 8.3% (4/48), in the LABA-exposed group, compared with 7.6% (164/2153) in the asthmatic non-user control group. After adjusting for maternal age, gravidity, marital status, race, education, pre-pregnancy weight, height, smoking status, daily caffeine consumption, parity, and prenatal vitamin use, the risk of small for gestational age was not significantly increased in the LABA-exposed group (OR=1.10; 95% CI 0.39 to 3.11).
Low birth weight (important outcome)
LABA exposure and risk of low birth weight
No studies assessed the association of LABA exposure during pregnancy with the risk of low birth weight in women with asthma, compared to women with asthma not exposed to LABA.
Preterm birth (important outcome)
LABA exposure and risk of preterm birth
In the cohort study by Bracken (2003), the absolute risk of preterm birth was 10.9% (7/64), in the LABA-exposed group, compared with 6.8% (146/2141) in the asthmatic non-user control group. After adjusting for maternal age, gravidity, marital status, race, education, pre-pregnancy weight, height, smoking status, daily caffeine consumption, parity, and prenatal vitamin use, the risk of preterm birth was not significantly increased in the LABA-exposed group (OR=0.99; 95% CI 0.97 to 1.02).
Pregnancy-induced hypertension (important outcome)
LABA exposure and risk of pregnancy-induced hypertension
No studies assessed the association of LABA exposure during pregnancy with the risk of pregnancy-induced hypertension in women with asthma, compared to women with asthma not exposed to LABA.
Stillbirth (important outcome)
LABA exposure and risk of stillbirth
No studies assessed the association of LABA exposure during pregnancy with the risk of stillbirth in women with asthma, compared to women with asthma not exposed to LABA.
Spontaneous abortion (important outcome)
LABA exposure and risk of spontaneous abortion
No studies assessed the association of LABA exposure during pregnancy with the risk of spontaneous abortion in women with asthma, compared to women with asthma not exposed to LABA.
Level of evidence of the literature
The level of evidence for (meta-analyses of) observational studies starts ‘low’. The quality of evidence regarding the outcome measures ‘major congenital malformations’, ‘small for gestational age’ and ‘preterm birth’ was downgraded to ‘very low’, because of bias due to indirectness (comparison to a healthy control group) and inconsistency (varying study results).
The level of evidence for outcome measures ‘low birth weight’, ‘pregnancy-induced hypertension’, ‘stillbirth’ and ‘spontaneous abortion’ could not be assessed due to the absence of relevant studies.
Zoeken en selecteren
For the PICO-question, relevant outcome measures and the results of the systematic literature search please see the module ‘Safety of asthma medication’ (‘Veiligheid astmamedicatie’). Important study characteristics and results are summarized in the evidence tables. The assessment of risk of bias is summarized in the risk of bias tables (see the module ‘Safety of asthma medication’ (‘Veiligheid astmamedicatie’)).
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 12-04-2023
Laatst geautoriseerd : 12-04-2023
Geplande herbeoordeling :
Algemene gegevens
De ontwikkeling van deze richtlijn werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). Patiëntenparticipatie bij deze richtlijn werd medegefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ. De financiers hebben geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2019 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor zwangere vrouwen met astma.
Werkgroep
- Drs. S.A. van Nederveen-Bendien, longarts in HagaZiekenhuis, NVALT (voorzitter)
- Dr. M. de Kruif, longarts in Zuyderland ziekenhuis, NVALT
- Dr. A.N. van der Meer, longarts in Medisch Centrum Leeuwarden, NVALT
- Drs. A.H. Feitsma, gynaecoloog in HagaZiekenhuis, NVOG
- C. van Hoolwerff, huisarts in Huisartsenpraktijk Vredenburch, NHG
- Dr. K. Koehorst-ter Huurne, apotheker in Apotheek de Hofbraak, KNMP
- Drs. A. Kuiterman, verloskundige, KNOV
- A. Wittkampf, longverpleegkundige in HagaZiekenhuis, V&VN
- M. Poulissen-Erinkveld, Longfonds
- A. Brons, ervaringsdeskundige, Longfonds
Met ondersteuning van
- Dr. E.V. van Dorp-Baranova, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- F. Jansen, MSc, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. A.J. Versteeg, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Nederveen-Bendien* |
longarts |
werkgroeplid NHG standaard astma, betaald |
Betaald: scholing gegeven voor huisartsen, LVPK en specialisten voor ALK, GSK, Sanofi en AstraZeneca |
Geen betaald adviseurschap gedurende de periode van de richtlijn ontwikkeling |
|
Feitsma |
gynaecoloog |
bestuurslid Integrale Geboortezorgorganisatie HJGC (IGO HJGC), onbetaald |
Geen |
Geen |
|
Koehorst-ter Huurne |
beherend apotheker |
lid special interest group (SIG) Long, KNMP |
Geen |
Geen |
|
Brons |
ervaringsdeskundige Longfonds |
Docent-onderzoeker, lid Cliëntenraad Merem (vrijwilligersvergoeding), |
Geen |
Geen |
|
Wittkampf |
longverpleegkundige |
Voorzitter V&VN longverpleegkundigen, onbetaald |
Geen |
Geen |
|
Kuiterman |
zelfstandig waarnemend verloskundige 1e lijn
|
Geen |
Geen |
Geen |
|
Van der Meer |
longarts
|
Geen |
Adviesraad Chiesi: triple therapie bij astma, betaald Unrestricted research grant MD-PhD traject: GlaxoSmithKline, Teva Stichtijng Longziekten Fryslan Medical Centre Leeuwarden research fund |
Geen |
|
De Kruif |
longarts |
Geen |
Geen |
Geen |
|
Hoolwerff |
kaderarts astma/COPD |
Werkzaam als huisarts, betaald. |
Geen |
Geen |
|
Poulissen |
sr. projectleider zorg |
Geen |
Geen |
Geen |
*voorzitter richtlijncommissie
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het organiseren van een focusgroep en het invullen van een patietenvragenlijst (ontworpen speciaal voor deze richtlijn m.b.v. de dialoogtool van PGO support), afvaardiging van patiëntenvereniging in de werkgroep en betrekken van patiëntenvertegenwoordigers bij het ontwikkelen van Thuisarts-situaties. Het verslag hiervan van de focusgroep (zie aanverwante producten) is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de overwegingen (zie kop ‘waarden en voorkeuren van patiënten’ bij module ‘Monitoring’). De conceptrichtlijn is tevens voor commentaar voorgelegd aan de patiëntenvereniging en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn (zie onderstaande tabel).
Module |
Uitkomst raming |
Toelichting |
|
Module 1a Veiligheid van astmamedicatie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat [het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet OF het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft]. Er worden daarom geen financiële gevolgen verwacht. |
|
Module 1b Step-down in inhalatiemedicatie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat [het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet OF het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft]. Er worden daarom geen financiële gevolgen verwacht. |
|
Module 1c ICS-formoterol ‘zo nodig’ therapie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat [het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet OF het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft]. Er worden daarom geen financiële gevolgen verwacht. |
|
Module 2 Astmamedicatie tijdens borstvoeding |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat [het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet OF het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft]. Er worden daarom geen financiële gevolgen verwacht. |
|
Module 3a Neonatale uitkomsten |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat [het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet OF het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft]. Er worden daarom geen financiële gevolgen verwacht. |
|
Module 3b Voorspellers van negatieve uitkomsten |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat [het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet OF het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft]. Er worden daarom geen financiële gevolgen verwacht. |
|
Module 4 Preceonceptioneel advies |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat [het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet OF het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft]. Er worden daarom geen financiële gevolgen verwacht. |
|
Module 5 Monitoring van astma bij zwnageren |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat [het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet OF het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft]. Er worden daarom geen financiële gevolgen verwacht. |
|
Module 6 Organisatie van zorg |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat [het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet OF het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft]. Er worden daarom geen financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor zwangere vrouwen met astma door middel van een schriftelijke knelpunteninventarisatie (enquête). De volgende partijen zijn gevraagd om knelpunten aan te dragen: Inspectie Gezondheidszorg en Jeugd (IGJ), Lareb, Nederlandse Associatie Physician Assistants (NAPA), Nederlandse Vereniging van Longfunctieanalisten (NVLA), Nederlandse zorgautoriteit (NZA), Nederlandse Federatie van Universitair Medische Centra (NFU), Nederlandse Vereniging van Ziekenhuizen (NVZ), Patiëntenfederatie Nederland, Samenwerkende Topklinische opleidingsZiekenhuizen (STZ), Vereniging Innovatieve Geneesmiddelen (VIG), Zorginstituut Nederland (ZiNL), Zelfstandige Klinieken Nederland (ZKN), Zorgverzekeraars Nederland (ZN), Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie (KNMP), Koninklijke Nederlandse Organisatie van Verloskundigen (KNOV), Longfonds, Nederlands Huisartsen Genootschap (NHG), Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose (NVALT), Nederlandse Vereniging voor Obstetrie & Gynaecologie (NVOG), Verpleegkundigen & Verzorgenden Nederland (V&VN). Het verslag van de schriftelijke knelpunteninventarisatie is opgenomen onder aanverwante producten. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwaliteit.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
