Het optimale provocatieschema
Uitgangsvraag
- Wat is het optimale dosisaantal en de optimale dosisopbouw?
- Wat is de optimale hoogste dosis van een provocatie?
- Wat is het optimale tijdsinterval tussen twee opeenvolgende dosisstappen?
Aanbeveling
Aanbeveling 1
Aanbevolen wordt voor zowel open als dubbelblinde provocaties gebruik te maken van schema’s bestaande uit 6 tot 8 stappen, waarbij de dosis allergeen semi-logaritmisch toeneemt. Als de hoeveelheid allergeen per dosis wordt uitgedrukt als milligram allergeen eiwit, dan kan de hoeveelheid allergeen eiwit per dosisstap voor elk allergeen voedingsmiddel gelijk zijn om tot een optimaal schema te komen voor al deze allergenen. De optimale semi-logaritmische reeks ziet er dan als volgt uit: 3 – 10- 30 – 100 – 300 – 1000 – 3000 mg allergeen eiwit.
Aanbeveling 2
Aanbevolen wordt de laatste dosisstap van een provocatie gelijk te laten zijn aan een leeftijdsadequate portie.
Aanbeveling 3
Aanbevolen wordt een tijdsinterval van ten minste een halfuur aan te houden tussen twee opeenvolgende doses.
Rationale aanbeveling 1
Met schema’s waarbij de dosesreeks opgebouwd wordt volgens deze aanbeveling is ruime ervaring opgedaan. Wanneer van deze schema’s gebruik wordt gemaakt blijkt dat het aantal patiënten wat op de eerste en laatste dosisstap reageert niet te groot is en de percentages patiënten die op de tussenliggende doses reageren vergelijkbaar zijn en zeer ernstige reacties worden erg weinig gezien.
Rationale aanbeveling 2
Door te eindigen met een leeftijdsadequate portie wordt de kans op een fout-negatieve uitkomst verkleind. Echter zelfs als geëindigd wordt met een leeftijdsadequate portie is een vals negatieve uitkomst niet uitgesloten omdat er meer factoren zijn dan de grootte van de laatste dosis die bepalend zijn voor het aantal vals negatieve uitkomsten zoals invloed van de matrix op de allergeniciteit, of aan- of afwezigheid van cofactoren of (eventueel) tolerantie inductie door de provocatieprocedure zelf. Een aantal van deze factoren zijn vaak niet te controleren omdat ze vaak niet bekend zijn zoals aan- of afwezigheid van cofactoren of omdat ze niet te vermijden zijn omdat bij een DBPGVP een allergeen nu eenmaal in een matrix moet worden ingebouwd om het allergeen te kunnen maskeren. Om een ernstige reactie thuis te voorkomen wordt daarom in sommige gevallen aanbevolen een negatieve provocatie te laten volgen door een klinische introductie.
Vlieg-Boerstra (20) publiceerde nieuwe, gevalideerde recepten met als laatste stap 3000 mg allergeen eiwit, wat een aanzienlijke hogere dosis is dan de hoogste dosis die gegeven is in de hier besproken studies van Blom (10) en Eller (9) en in de studies waarin gekeken is naar het optreden van fout-negatieve uitkomsten. Hoewel er nog niet voldoende provocaties zijn gedaan met deze recepten om een uitspraak te doen over de kans op een fout-negatieve uitkomst, kan worden verwacht dat deze lager uitpakt.
Als men altijd zou willen eindigen met 3000 mg (cumulatief ca. 4400 mg eiwit) allergeen eiwit in de laatste stap conform aanbeveling 23 dan is dit niet altijd haalbaar voor DBPGVP’s met alle allergenen of leidt dit voor sommige allergenen tot een portie die aanzienlijke groter is of kleiner is dan een leeftijdsadequate portie.
- Voor OVP’s en DBPGVP’s met pinda’s, soja, noten, zaden, pitten, tarwe, (circa 10-20 g eiwit per 100 g voedingsmiddel) en voor melk en sojamelk (circa 3,5 g eiwit per 100 ml) leidt het volgen van dit advies tot acceptabele hoeveelheden per dosisstap en komt de laatste stap met 3000 mg allergeen eiwit ongeveer overeen met een leeftijdsadequate portie.
- Voor ei (circa 14 g eiwit per 100 g voedingsmiddel) is de ideale totale aanbevolen hoeveelheid 7000 mg (overeenkomend met circa 1 ei), maar dit is vooralsnog alleen haalbaar in een open provocatie.
- Voor relatief eiwitrijke allergenen als vis, schaal- en schelpdieren en vlees (alle rond 20 g eiwit per 100 g voedingsmiddel) leidt dit advies tot een hoeveelheid in de laatste stap die lager is dan een leeftijdsadequate portie. Geadviseerd wordt te eindigen met ca. 100 gram vlees, vis, of schaaldieren.
- Voor relatief eiwitarme allergenen zoals een aantal groenten en fruit leidt dit tot een te grote laatste dosis. Geadviseerd wordt te eindigen met 1 stuk fruit of één eetlepel groente.
- De laatste doses zoals hierboven aangegeven kunnen eventueel naar beneden worden aangepast als de laatste doses groter zijn dan adequaat voor de leeftijd van het kind.
Rationale aanbeveling 3
Als men een schema met tijdsintervallen van een halfuur gebruikt, kan de drempeldosis waarop de patiënt reageert soms een relatieve overschatting zijn van de echte drempeldosis. In de praktijk maakt het voor de te geven adviezen echter niet uit of de feitelijke drempeldosis een stap lager ligt dan de dosis waarop de patiënt reageert. In beide gevallen moet de patiënt het allergeen in dezelfde mate vermijden.
Theoretisch kan een te kort interval de kans op een ernstige reactie verhogen, omdat de patiënt dan op een cumulatieve dosis reageert. Uit de gepubliceerde studies bleek echter geen verschil tussen de ernst van reageren bij schema’s met korte en langere tijdsintervallen.
Omdat schema’s met tijdsintervallen langer dan een halfuur geen consequenties hebben voor het vervolgbeleid en niet veiliger zijn, wordt tussen twee opeenvolgende stappen een interval van een halfuur geadviseerd. De provocaties blijven zo in een dagdeel uitvoerbaar, zodat dure opnames met lange observatieperioden worden voorkomen.
Overwegingen
1 Kwaliteit van bewijs
Er zijn een aantal RCT’s en enkele niet-gecontroleerde studies geselecteerd, waarvan de kwaliteit van bewijs niet is bepaald.
2. Balans van voordelen en nadelen
Een provocatieschema met te weinig stappen en te korte intervallen kan leiden tot een groter risico op anafylaxie tijdens de provocatie en tot een groter percentage fout-negatieve uitkomsten. Een provocatieschema waarbij de kans op anafylactische reacties en fout-negatieve uitkomsten zo gering mogelijk is, en dat nog in een dagdeel uitvoerbaar is, is optimaal.
3. Patiëntperspectief en perspectief van de professional
Middelenbeslag en haalbaarheid
Voor het vaststellen of een patiënt allergisch is voor voeding, is vaak een provocatie nodig. Omdat er veel patiënten zijn met mogelijke allergie en omdat niet elk allergeen in elk ziekenhuis geprovoceerd kan worden, worden er in sommige ziekenhuizen veel provocaties gedaan. Het is in het belang van arts en patiënt dat een dergelijk provocatie in een dagdeel kan plaatsvinden. Provocaties die langer dan een dag duren, vereisen opname van de patiënt en kunnen leiden tot reacties buiten kantoortijd, wat extra kosten en risico’s met zich mee brengt.
Onderbouwing
Achtergrond
Op dit moment worden in verschillende ziekenhuizen op historische gronden verschillende provocatieschema’s gebruikt. Mede hierdoor zijn de provocaties (inter)nationaal niet goed vergelijkbaar en vaak suboptimaal. Het type schema’s dat hier besproken wordt, is ontworpen met als doel onderzoek te doen naar acute allergische reacties. Deze schema’s zijn minder geschikt om de relatie tussen inname van voeding en geïsoleerd eczeem te onderzoeken of om een relatie aan te tonen tussen inname en klachten die meer dan 2 uur na inname optreden. Ze kunnen wel gebruikt worden als de observatietijd verlengd wordt tot liefst 24 uur. Wanneer in zeldzame gevallen de verdenking bestaat dat eczeem door een voedingsmiddel wordt veroorzaakt zonder dat er acute reacties ontstaan, dan wordt geadviseerd een ander provocatieschema te gebruiken, waarbij het allergeen gedurende enkele dagen placebogecontroleerd wordt gegeten. De schema’s zijn ook niet geschikt om vast te stellen wat de laagste dosis is van een allergeen waarop de patiënt nog reageert. Voor het vaststellen van deze zogenaamde lowest observed adverse effect levels (LOAEL) zijn andere schema’s nodig.
Eisen gesteld aan provocatie
Het optimale voedselprovocatieschema voldoet aan een aantal eisen:
- De provocatie is uitvoerbaar in een dagdeel;
- De kans op anafylaxie tijdens een provocatie is zo klein mogelijk en de kans op anafylactische shock of overlijden is afwezig;
- Er is geen risico op acuut ernstig reageren op introductie na een negatieve provocatie.
Ad 1: Een kort schema telt minder stappen en kortere tijdsintervallen. Een kort schema maakt dat de provocatie nog uitvoerbaar is in een dagdeel. Zo blijft er nog voldoende tijd over voor observatie, zodat de patiënt ook na een reactie zonder klachten naar huis kan gaan, en kan opname voor observatie vermeden worden vermeden.
Ad 2: een anafylactische reactie leidt tot langere opname op een afdeling en bij shock tot een opname op de IC, wat een sterk negatieve invloed heeft op de kwaliteit van leven van de patiënt. Een provocatieschema waarbij frequent ernstige allergische reacties optreden, is als diagnostische test dan ook niet acceptabel, zelfs al is deze provocatie de meest betrouwbare test voor het aantonen van voedselallergie.
Ad 3: Na een negatief verlopen provocatie instrueert de arts de patiënt om het voedingsmiddel te (her)introduceren. Het is dan niet acceptabel dat de patiënt thuis alsnog kans loopt op een acute ernstige reactie. Een milde of late reactie thuis is na een negatieve provocatie misschien niet altijd te vermijden; er bestaat altijd een kans op een fout-negatieve test. Oorzaken van een fout-negatieve test zijn:
- Het ontbreken van noodzakelijke cofactoren tijdens de provocatie, zoals infectie, inspanning, alcohol, NSAID-gebruik (1). Bij voedselafhankelijke inspannings-geïnduceerde anafylaxie (food-dependent exercise-induced anaphylaxis, FDEIA) is inspanning een noodzakelijke factor. Bij verdenking op FEDAI moet de voedselinname dan ook altijd worden gevolgd door inspanning (2);
- De progressieve dosering tijdens de provocatie kan mogelijk tijdelijke tolerantie veroorzaken (3);
- Bij een DBPGVP kan door verwerking in een matrix (4) en bewerkingsprocessen als verhitten (5) maken dat het allergeen deels of volledig zijn allergeniciteit verliest, wat een schijnbaar negatieve uitkomst veroorzaakt. Wanneer bij de DBPGVP gevalideerde recepten worden gebruikt, dan is vastgesteld dat de invloed van matrix en verwerking minimaal is (6) en mag men ervan uitgaan dat er bij het geadviseerde beleid geen kans is op een acute ernstige reactie.
Optimaal provocatieschema
De eis dat een provocatie zo kort mogelijk moet duren, zonder dat te korte tijdsintervallen ertoe leiden dat er eigenlijk sprake is van de inname van één cumulatieve dosis, en de eis dat de kans op anafylaxie tijdens provocatie zo klein mogelijk moet zijn, zijn tegenstrijdig. Elk schema is dan ook een compromis, gebaseerd op de optimale balans tussen veiligheid en uitvoerbaarheid.
Het schema waarbij de balans tussen uitvoerbaarheid en veiligheid optimaal is, voldoet aan de volgende theoretische eisen wat betreft laagste dosis, dosisinterval, hoogste dosis en tijdsinterval (zie ook figuur 1):
- Op theoretische gronden valt te verwachten dat als het relatieve dosisverschil tussen twee achtereenvolgende stappen groter wordt, de kans op een heftiger reactie ook groter wordt. Een allergische patiënt die op de ene dosis nog net niet reageert en op de volgende wel is dan immers blootgesteld aan een veel hogere dosis dan nodig is om een allergie aan te tonen. Om dan de kans op anafylaxie tijdens provocatie zo klein mogelijk te maken, mag het relatieve verschil tussen twee opeenvolgende dosistappen niet te groot zijn. Omdat in de praktijk het dosisverschil tussen de laagste en hoogste dosis waarop iemand nog kan reageren, echter erg groot blijkt, is het aantal dosisstappen bij verdubbeling van elke dosis zo groot, dat een provocatie niet meer in een werkdag gedaan kan worden. In de praktijk worden schema's gebruikt waarbij de dosisopbouw sneller plaatsvindt. Om na te kunnen gaan of deze schema's in theorie veilig kunnen zijn, kan gekeken worden naar het extra percentage patiënten wat tussen opeenvolgende dosisstappen reageert. Als het extra percentage wat reageert tussen opeenvolgende dosisstappen vergelijkbaar is en niet al te hoog dan kan daar uit afgeleid worden dat patiënten niet onnodig aan een te hoge doses worden blootgesteld;
- De laagste dosis moet net onder of in ieder geval in de buurt van de laagste dosis liggen waarop een patiënt nog net met objectieve klachten kan reageren. Als het percentage patiënten dat al op de eerste dosis reageert, hoog is, dan is de kans op een anafylactische reactie op deze eerste stap theoretisch ook verhoogd;
- De hoogste dosis is gelijk aan de portie die men in het dagelijkse leven ook in een keer inneemt (leeftijdadequate portie). Het percentage wat op deze hoogste dosis reageert, moet zo laag mogelijk zijn: naarmate dat percentage hoger wordt, wordt het risico ook groter dat er allergische patiënten zijn die niet reageren tijdens de provocatie omdat de laatste dosisstap voor hen te laag is (aantal fout negatieven);
- De dosisintervallen zijn lang genoeg om een type I-allergische reactie te detecteren, maar niet zo kort dat er feitelijk sprake is van een cumulatieve dosis.
Als men al de hierboven genoemde voorwaarden toepast op een schema met 8 stappen, dan zou het optimale schema er zo uit kunnen zien: tussen 2 opeenvolgende stappen reageert steeds ongeveer 14% van de allergische patiënten en na de laatste stap nog 2%. Daarmee zou de respons 100% zijn.
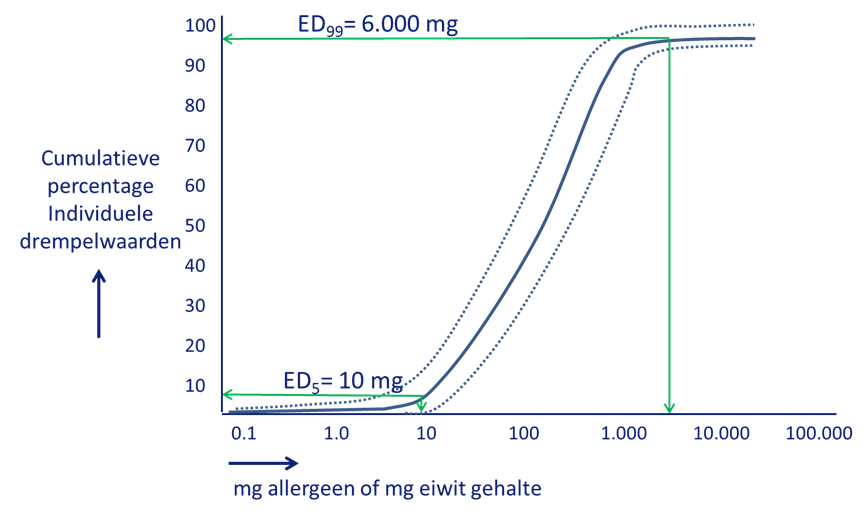
Figuur 1. Cumulatieve verdeling (%) van de drempelwaarden (eliciting doses, ED) van allergenen met 95%-betrouwbaarheidsinterval. Als men de dosis uitdrukt in mg eiwit per 100 g allergeen en die van melk in ml, vallen de curves van de allergenen melk, ei, pinda en hazelnoot samen.
Conclusies
Optimale dosisreeks
Schema’s die bestaan uit 6 tot 8 stappen en waarbij de dosis semi-logaritmisch toeneemt, voldoen aan de eisen gesteld aan het optimale schema. Ten eerste is de provocatie met een dergelijk schema inclusief observatietijd na de laatste stap uitvoerbaar in een dagdeel, ten tweede is het risico op een anafylactische shock verwaarloosbaar en overlijden er geen patiënten door een ernstige reactie.
Hoeveelheid laatste dosisstap
Of de laatste stap voldoende is om een acute reacties in de thuissituatie te voorkomen, is niet onderzocht. De ervaring geeft aan dat de kans op een acute allergische reactie thuis bij provocatie met deze schema’s gering is, maar niet geheel valt uit te sluiten.
Tijdsinterval tussen twee opeenvolgende stappen
Wanneer het gebruikelijke tijdsinterval van een halfuur tussen twee opeenvolgende doses stappen wordt aangehouden, kan de gevonden drempelwaarde voor de patiënt te hoog zijn. Voor het betrouwbaar vaststellen van de drempel is minimaal een tijdsinterval van een uur of langer nodig.
Samenvatting literatuur
1. Wat is het optimale aantal stappen en wat is de optimale dosisverdeling over deze stappen?
Er werden 2 studies gevonden waarin van een aantal veelvoorkomende allergenen, waarmee een groot aantal DBPGVP’s zijn uitgevoerd, de dosisresponscurve werd getoond.
In de studie van Blom, gepubliceerd in 2013 (7), werden 135 DBPGVP’s met pinda, 93 met koemelk, 53 met kippenei, 28 met hazelnoot, 10 met soja en 31 met walnoot geanalyseerd. Alle patiënten waren tussen 2 en 18 jaar oud. Voor deze 7 allergenen werden de doses bepaald waarbij 5% van de patiënten met objectieve en subjectieve klachten reageerde. Het aantal patiënten dat per dosisstap reageert, werd per allergeen weergegeven in een tabel. Met uitzondering van soja en walnoot, waarbij het aantal provocaties te laag was, werden de dosis-responscurves bepaald. In de studie van Eller (8) werden de data geanalyseerd van 405 provocaties met hazelnoot, melk, pinda en ei die eindigden met objectieve klachten. 48% van de patiënten was jonger dan 4 jaar, 90% jonger dan 15 jaar. Per allergeen werden de doses waarbij 5 en 10% van de patiënten reageerden, weergegeven in een tabel. Ook werden dosis-responscurves bepaald.
Zowel de studie van Blom (7) als van Eller (8) was bedoeld om de laagste drempelwaarden voor een aantal allergenen te bepalen. Omdat in beide studies cumulatieve dosis-responscurves zijn weergegeven, zijn ze geschikt om de hier gestelde vraag te beantwoorden.
Ballmer-Weber (9) analyseerde de in het kader van Europrevall verrichte DBPGVP’s en bepaalde de doses waarop 10% van de allergische populatie reageerde (ED10) op pinda, hazelnoot, selderij, vis en garnaal.
2. Hoeveel moet de hoogste dosis minimaal zijn?
Er zijn 3 studies gevonden waarin nagegaan is wat de kans is op een fout-negatieve uitkomst.
In de studie van Caffarelli (10) ondergingen 242 kinderen 370 DBPGVP’s of OVP’s. Nagegaan is hoeveel kinderen na een negatieve uitkomst van de provocatie tijdens (her)introductie reageerden.
In een op het EAACI-congres in 2012 gepresenteerde poster (11) werd het aantal fout-negatieve uitkomsten van DBPGVP’s getoond, waarbij was gezocht naar risicofactoren voor een fout-negatieve uitkomst tijdens introductie. Kinderen met een fout-negatieve uitkomst werden vergeleken met kinderen met een echt negatieve uitkomst (introductie thuis zonder klachten).
In de studie van Niggemann (5) werd bij 490 negatieve provocaties, waarvan 151 DBPGVP’s met melk (n = 109), ei (n = 166), tarwe (n = 35), soja (n = 20) en hazelnoot (n = 57) nagegaan hoe vaak er een reactie optrad als de dag na de provocatie een cumulatieve dosis (doses 1 tot en met 7 bij elkaar opgeteld) werd gegeven. Alle kinderen hadden eczeem en waren gesensibiliseerd voor het betreffende allergeen. De doses die in de laatste provocatiestap waren gegeven, waren voor koemelk 100 ml (4,8 g eiwit), voor kippenei 38 g (4,9 g eiwit), voor pinda 12 g (3,1 g eiwit), voor hazelnoot 25 g (3 g eiwit), voor tarwe 3,5 g (2,9 g eiwit), voor soja 100 ml (4,2 g eiwit).
In een vijftal studies (3, 12-15) werd gekeken naar oorzaken van falen van introductie na een negatieve provocatie. Een van de oorzaken is reacties tijdens de introductie. Omdat de vermelde percentages patiënten die klachten kregen tijdens introductie verkregen zijn met enquêtes of interviews achteraf en er veel andere oorzaken kunnen zijn waarom voedsel na een negatieve test niet werd geïntroduceerd, zijn deze uitkomsten niet representatief voor het werkelijke aantal fout-negatieve uitkomsten.
3. Wat is het optimale tijdsinterval tussen 2 opeenvolgende dosisstappen?
Er werden 2 studies gevonden waarbij gekeken werd of een door de patiënt gerapporteerd langer tijdsinterval tussen inname en optreden van klachten of een langer tijdsinterval tussen twee dosisstappen tijdens de provocatie van invloed kon zijn op de drempel waarbij de patiënt reageerde.
In de studie van Pettersson (16) werden alle 232 patiënten tussen 0,7 en 17,8 jaar (mediaan 5,8 jaar) die tussen 2002 en 2011 in het UMCG positief verlopen provocaties hadden ondergaan met melk (27,2%), ei (11,6%), pinda (34,1%), cashewnoot (17,2%) of hazelnoot (9,9%), verdeeld in twee groepen op basis van de snelheid waarmee de patiënt klachten kreeg. 195 patiënten reageerden binnen 30 minuten, 37 na meer dan 30 minuten. De uitlokkende doses (ED) en cumulatieve doses (CD) van de 2 groepen werden vergeleken met de ernst waarmee ze reageerden tijdens de provocatie. Verwacht werd dat patiënten die na meer dan 30 minuten reageerden, dat deden op de cumulatieve dosis, en ook ernstiger klachten hadden dan patiënten die binnen 30 minuten reageerden.
In de studie van Blumchen (17) tenslotte werden bij 63 patiënten drempelwaarden voor pinda bepaald met provocaties met tijdsintervallen van 2 uur. Dit werd gedaan om meer aan te sluiten bij de praktijk, waarin klachten vaak pas na 30 minuten optreden. De provocatie duurde in totaal 14 uur, verdeeld over 2 dagen.
Resultaten
1. Wat zijn optimale dosisintervallen en wat is het optimale aantal stappen?
In de Europrevallstudie van Ballmer-Weber (9) werden de volgende ED10 gevonden: pinda 2,8 mg eiwit, hazelnoot 8,5 mg eiwit, selderij 1,6 mg eiwit, vis 27,3 mg eiwit, garnaal 2504 mg eiwit. Hieronder zijn de dosis respons curves weer gegeven van de studies van Blom (7) (figuur 2) en Eller (8) (figuur 3). In de studie van Blom is gebruik gemaakt van recepten die voor een deel ook in Nederland gebruikt worden, met relatief lage einddosis. In deze studie is ook nog gekeken naar de invloed van verschillende stopcriteria – stoppen bij subjectieve (figuur 2A) of objectieve klachten (figuur 2B) – op de cumulatieve percentages. In figuur 3 wordt op de x-as de hoeveelheid voeding in mg eiwit van het voedingsmiddel weergegeven.
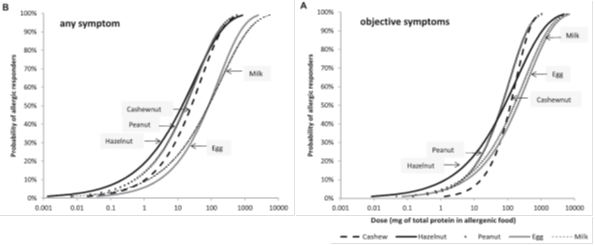
Figuur 2. Waarschijnlijkheidsverdeling van drempelwaarden voor pinda, hazelnoot, cashewnoot, koemelk en kippenei uitgedrukt in mg eiwit van het allergeen. Drempelwaarden zijn weergegeven voor stoppen bij subjectieve klachten (A) en bij objectieve klachten (B).
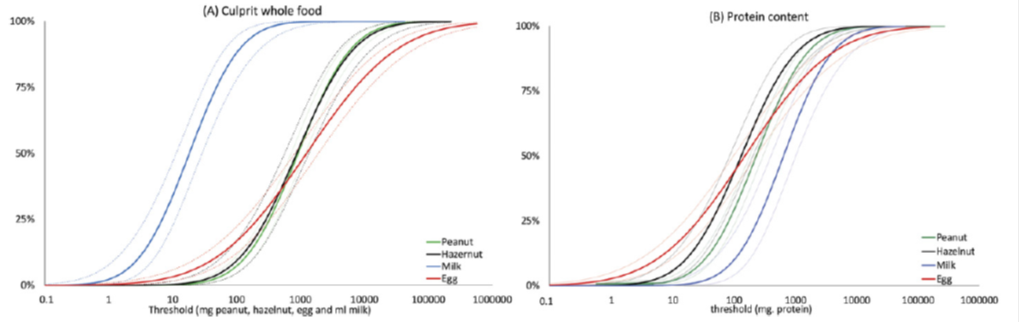
Figuur 3. Cumulatieve verdeling van objectieve drempelwaarden van pinda, hazelnoot, ei en melk, met 95%-betrouwbaarheidsinterval. Drempelwaarden zijn uitgedrukt in mg voeding (A) en in mg eiwitgehalte per allergeen (B).
Uit de studies kan het volgende worden opgemaakt:
- Het percentage patiënten dat na elke volgende dosisstap reageert, is tussen de verschillende dosisstappen redelijk vergelijkbaar;
- De dosis waarop 5% van de patiënten reageert (ED5) ligt redelijk in de buurt van de eerste dosis. In de studie van Eller (8) bleek de ED5 van melk met 19% duidelijk te hoog. Daarop is de 1e dosisstap (aanvankelijk 5 ml koemelk) verlaagd;
- Bij Blom (7) had geen enkele patiënt een anafylactische reactie. Bij Eller (8) hadden enkelen een graad 4-reactie; geen van de patiënten had een graad 5-reactie volgens Sampson (18);
- De ED100 is een berekend getal. De hoogste dosis waarop een patiënt nog kan reageren, is voor geen enkel allergeen bekend;
- Als men de dosisstappen uitdrukt in hoeveelheid allergeen eiwit, blijken de cumulatieve dosis-responscurves voor de verschillende allergenen over elkaar te liggen (zie figuur 2B). Dit maakt het mogelijk om voor alle allergenen voor elke stap een eiwit equivalente dosis te formuleren waarbij het extra percentage patiënten dat reageert steeds vergelijkbaar is. De dosisreeksen in de studies van Eller en Blom zijn semi-logaritmisch met als dosisstappen 3 – 10- 30 – 100 – 300 – 1000 – 3000 mg allergeen eiwit. Deze dosisreeks wordt ook door de PRACTALL-werkgroep aanbevolen (19).
2. Hoeveel moet de laatste dosis minimaal zijn?
In de studie van Caffarelli (10) reageerden vijf van de 193 kinderen (3%) (4 tussen 1 en 2 jaar oud, één 11 jaar) met negatieve uitkomst van DBPGVP of OVP tijdens de introductie een dag na de provocatie. Een kind kreeg urticaria en 1 urticaria met angio-oedeem op koemelk, 1 kind kreeg urticaria en 1 urticaria met angio-oedeem en 1 kind urticaria met rhinitis en conjunctivitis op kippenei. De doses waarop de kinderen thuis reageerden, was niet hoger dan de dosis gegeven in de laatste stap van de provocatie en de voeding die thuis werd gegeven was op dezelfde manier bewerkt als de voeding tijdens de provocatie.
In Bloms studie (7) introduceerden 387 (87,4%) van 443 kinderen de voeding thuis na een negatieve provocatie. Bij 74 kinderen (19,1%) traden klachten op. De 4 belangrijkste risicofactoren voor een fout-negatieve uitkomst bleken astma, eczeem in het eerste levensjaar of urticaria in de anamnese, een hoog sIgE en oudere leeftijd. Ernst en aard van de klachten tijdens introductie zijn niet vermeld.
In de studie van Niggemann (3) reageerden 38 kinderen (13%) die een dag eerder niet tijdens de provocatie reageerden, de volgende dag op een cumulatieve dosis. 26 reageerden met urticaria en/of angio-oedeem, 12 met maagpijn, misselijkheid roodheid of toename van het eczeem, of met urticaria bij contact met de voeding op de huid. De reacties waren gelijkelijk verdeeld over de verschillende allergenen. De conclusie was dat een aanzienlijk deel van de kinderen het risico loopt op een forse reactie thuis tijdens introductie en dat dit kan worden voorkomen als de volgende dag nog eenmaal een cumulatieve dosis wordt gegeven in het ziekenhuis. Als mogelijke verklaring voor deze fout-negatieve uitkomsten werd genoemd dat tijdens de provocatie een tijdelijke periode van tolerantie werd bereikt.
3. Wat is het optimale tijdsinterval tussen 2 opeenvolgende dosisstappen?
Petterson (16) vond bij de patiënten die na meer dan 30 minuten reageerden, een mediane ED van 1,60 en een CD van 2,15; bij de patiënten die binnen 30 minuten reageerden, was dat respectievelijk 0,48 (p = 0,004) en 0,64 (p = 0,005). Dit verschil suggereert dat de eerste groep reageerde op de cumulatieve dosis van de DBPGVP. De patiënten die laat reageerden, hadden geen ernstiger klachten dan de patiënten die vroeg reageerden.
Bij Blumchen (17) bleken 45 van de 63 patiënten (71%) pas na 30 minuten of later objectieve klachten te krijgen. 8 van de 15 patiënten met een graad 4-reactie reageerden tussen 55 en 110 minuten na inname van de laatste pindadosis. Dit geeft aan dat ED’s bepaald met intervallen van 2 uur meer valide zijn dan die bepaald met intervallen van 30 minuten.
Zoeken en selecteren
Wat is het optimale aantal stappen en wat is de optimale dosisverdeling over deze stappen?
Van een aantal allergenen is onderzocht wat de laagste dosis is waarop een patiënt nog kan reageren, het LOAEL. Deze waarde is van belang voor labeling, maar niet zozeer voor provocatie. Het is geen probleem dat op de eerste stap al patiënten reageren, als dit percentage maar niet te groot wordt; als te veel patiënten reageren op de eerste stap, kan de kans op een ernstige reactie daarbij toenemen. De literatuur waarin LOAEL’s zijn bepaald, wordt hier dan ook niet besproken.
Er bestaan geen studies waarin verschillende schema’s prospectief zijn vergeleken wat betreft veiligheid en betrouwbaarheid. Als alternatief is daarom gezocht naar studies waarin de toegepaste provocatieschema’s bij een groot aantal patiënten retrospectief werden geanalyseerd. Meer specifiek is gekeken naar studies waarin een dosisresponscurve is gepubliceerd. Uit de dosisresponscurve kan worden opgemaakt wat het percentage patiënten is dat op de laagste dosisstap en op de vervolgdoses reageert. Daarbij is ook gekeken naar hoe frequent er tijdens provocaties met deze schema’s ernstige reacties zijn opgetreden.
Hoe hoog moet de hoogste dosis minimaal zijn?
Een provocatie is pas acceptabel als een patiënt na een negatieve uitkomst niet acuut ernstig reageert. Een belangrijke oorzaak van fout-negatieve uitkomsten is een te lage dosis in de laatste stap. Omdat niet bekend is wat de hoogste dosis is waarop een patiënt nog kan reageren, is ook niet bekend hoe hoog deze dosis zou moeten zijn. Als de laatste dosisstap gelijk is aan een leeftijdadequate portie, kan men ervan uitgaan dat de laatste dosis afdoende is. Het lukt echter niet altijd een dergelijke grote hoeveelheid allergeen voor een DBPGVP te maskeren in een portie die nog gemakkelijk door een patiënt in één stap kan worden gegeten, en nog veel minder als de patiënt een kind is.
Zelfs als geëindigd wordt met een dagelijkse hoeveelheid, is er vanwege de genoemde redenen echter nog een kans op fout-negatieve uitkomsten. Het is niet te achterhalen wat de oorzaak is van fout-negatieve uitkomstin in gepubliceerde studies; alleen als de laatste doses te laag lijkt, kan men vermoeden dat dat de belangrijkste oorzaak is. Milde allergische klachten thuis tijdens introductie zijn waarschijnlijk dan ook nooit helemaal te vermijden.
Gezocht is naar studies waarin gekeken is naar de kans op reageren na een negatieve uitkomst van de provocatie en naar de laatste dosisstap.
Wat is het optimale tijdsinterval tussen 2 opeenvolgende dosisstappen?
Bijna alle gebruikte voedselprovocatieschema’s gaan uit van een tijdsinterval van 20 tot 30 minuten tussen twee opeenvolgende stappen, hoewel in de praktijk blijkt dat patiënten nog tot wel 2 uur na inname kunnen reageren. Er bestaat dan ook de kans dat bij gebruik van tijdsintervallen van een halfuur de gevonden drempelwaarden te hoog zijn, omdat de volgende dosis al gegeven is voordat de patiënt op de vorige dosis heeft kunnen reageren. De patiënt heeft dan op de cumulatieve dosis gereageerd.
Gezocht is naar studies waarin is gekeken naar de invloed van het tijdsinterval tussen inname en optreden van klachten op de mediane drempeldosis waarbij de provocatie tot klachten leidde.
Er is voor gekozen om, uitgaande van de artikelen die de werkgroep al bezit, in de referenties bij de artikelen (snowballing) te zoeken naar artikelen die gemist werden. Hetzelfde is gedaan met de referenties bij de richtlijnen. Verder is gezocht in relevante databases (Cochrane Library, Medline, Embase) en zijn uit de archieven van de werkgroepleden artikelen geselecteerd die aan de inclusiecriteria voldeden. Selectiecriteria waren de doelgroep en het onderwerp van de uitgangsvraag. Ook is gekeken of er al richtlijnen beschikbaar waren via www.guideline.gov/, www.nice.org.uk/, www.cbo.nl/thema/richtlijnen/, SUM search: http://sumsearch.uthscsa.edu / en www.sign.ac.uk/. Er werden uiteindelijk 7 studies geïncludeerd (waarvan 1 studie voor twee subvragen kon worden gebruikt).
Referenties
- 1 - Wölbing F, Fischer J, Köberle M, Kaesler S, Biedermann T. About the role and underlying mechanisms of cofactors in anaphylaxis. Allergy 2013;68:1085-92.
- 2 - Sheffer AL, Soter NA, McFadden ER Jr, Austen KF. Exercise-induced anaphylaxis: a distinct form of physical allergy. J Allergy Clin Immunol 1983;71:311-6.
- 3 - Niggemann B, Lange L, Finger A, Ziegert M, Müller V, Beyer K. Accurate oral food challenge requires a cumulative dose on a subsequent day. J Allergy Clin Immunol 2012;130:261-3.
- 4 - Grimshaw KE, King RM, Nordlee JA, Hefle SL, Warner JO, Hourihane JO. Presentation of allergen in different food preparations affects the nature of the allergic reaction a case series. Clin Exp Allergy 2003; 33:1581-5.
- 5 - Lepski S, Brockmeyer J. Impact of dietary factors and food processing on food allergy. Mol Nutr Food Res 2013;57:145-52.
- 6 - Libbers L, Flokstra-de Blok BM, Vlieg-Boerstra BJ, Heide S van der, Meulen GN van der, Kukler J, et al. No matrix effect in double-blind, placebo-controlled egg challenges in egg allergic children. Clin Exp Allergy 2013;43:1067-70.
- 7 - Blom WM, Vlieg-Boerstra BJ, Kruizinga AG, Heide S van der, Houben GF, Dubois AE. Threshold dose distributions for 5 major allergenic foods in children. J Allergy Clin Immunol 2013;131:172-9.
- 8 - Eller E, Hansen TK, Bindslev-Jensen C. Clinical thresholds to egg, hazelnut, milk and peanut: results from a single-center study using standardized challenges. Ann Allergy Asthma Immunol 2012;108:332-6.
- 9 - Ballmer-Weber BK, MD, Fernandez-Rivas M, Beyer K, Defernez M, Sperrin M, Mackie AR, et al. How much is too much? Threshold dose distributions for 5 food allergens. J Allergy Clin Immunol 2015;135:964-71.
- 10 - Caffarelli C, Petroccione T. False-negative food challenges in children with suspected food allergy. Lancet 2001;358:1871-2.
- 11 - Daubenbüchel A, Flokstra B, Kukler J, Heide S van der, Kerkhof M, Dubois A. Recurrence of symptoms after a negative double-blind, placebo-controlled food challenge: false positive re-introduction or false negative double-blind, placebo-controlled food challenge? Allergy 2012;67:370.
- 12 - Sicherer SH, Morrow EH, Sampson HA. Dose-response in double-blind, placebo-controlled oral food challenges in children with atopic dermatitis. J Allergy Clin Immunol 2000;105:582-6.Wensing M, Penninks AH, Hefle SL, Akkerdaas JH, van Ree R, Koppelman SJ, et al. The range of minimum provoking doses in hazelnut-allergic patients as determined by double-blind, placebo-controlled food challenges. Clin Exp Allergy. 2002 Dec;32(12):1757-62.
- 13 - Wensing M, Penninks AH, Hefle SL, Koppelman SJ, Bruijnzeel-Koomen CA, Knulst AC. The distribution of individual threshold doses eliciting allergic reactions in a population with peanut allergy. J Allergy Clin Immunol 2002;110:915-20.
- 14 - Flinterman AE, Pasmans SG, Hoekstra MO, Meijer Y, Hoffen E van, Knol EF, et al. Determination of no-observed-adverse-effect levels and eliciting doses in a representative group of peanut-sensitized children. J Allergy Clin Immunol 2006;117:448-54.Pettersson ME, Flokstra-de Blok BM, Heide S van der, Kukler J, Dubois AE. Is 30 minutes between doses long enough in oral food challenges? Pediatr Allergy Immunol 2014;25:615-7.
- 15 - Blumchen K, Beder A, Beschorner J, Ahrens F, Gruebl A, Hamelmann E, et al. Modified oral food challenge used with sensitization biomarkers provides more real-life clinical thresholds for peanut allergy. J Allergy Clin Immunol 2014;134:390-8.
- 16 - Sampson HA. Anaphylaxis and emergency treatment. Pediatrics 2003;111:1601-8.
- 17 - Sampson HA, Gerth van Wijk R, Bindslev-Jensen C, Sicherer S, Teuber SS, Burks AW, et al. Standardizing double-blind, placebo-controlled oral food challenges: American Academy of Allergy, Asthma & Immunology-European Academy of Allergy and Clinical Immunology PRACTALL consensus report. J Allergy Clin Immunol 2012;130:1260-74.
- 18 - Vlieg-Boerstra BJ, Herpertz I, Pasker L, Heide S van der, Kukler J, et al. Validation of novel recipes for double-blind, placebo-controlled food challenges in children and adults. Allergy 2011;66:948-54.
Evidence tabellen
Er zijn voor deze richtlijn geen evidence tabellen opgesteld.
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 01-01-2016
Laatst geautoriseerd : 01-01-2016
Geplande herbeoordeling :
Uiterlijk in 2019 wordt door de NVvA, na raadpleging van of op advies van aan de richtlijn participerende verenigingen, bepaald of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om (delen van) de richtlijn te herzien. De geldigheid van de huidige richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn om een herzieningstraject te starten.
Algemene gegevens
De richtlijn is gefinancierd met het gealloceerde budget van de stichting Kwaliteitsgelden Medisch specialisten (SKMS) dat bestemd is voor de individuele projecten van de NVvA.
Doel en doelgroep
- Aanbevelingen te doen over de indicatiestelling voor provocatie, de provocatieprocedure, de keuze van het provocatiemateriaal, de beoordeling van de uitkomst van de provocatie en het optimale beleid na provocatie, op basis van het beschikbare bewijs en consensus binnen de werkgroep, teneinde de kwaliteit van diagnostiek van voedselallergie te verbeteren;
- Aanbevelingen te doen over de eisen van de provocatiesetting en het personeel betrokken bij provocaties, teneinde de provocatie zo veilig mogelijk te laten verlopen;
- De indicatiestelling, de provocatieprocedure en de beoordeling van uitkomsten van provocaties te harmoniseren, teneinde de vergelijkbaarheid te vergroten tussen de ziekenhuizen en andere tweedelijnszorginstellingen waar provocaties worden gedaan;
- Het aanwezige bewijs en de hiaten in het bewijs voor verschillende aspecten van de voedselprovocatie inzichtelijk te maken;
- Inzichtelijk te maken waar deze Nederlandse richtlijn afwijkt van ander nationale en internationale richtlijnen;
- Indicatoren te formuleren die beogen de effectiviteit en veiligheid van de voedselprovocatie te kunnen meten;
- Een medical audit te ontwikkelen waarmee specialisten kunnen evalueren in hoeverre zij de richtlijn opvolgen.
Doelgroep
De beoogde gebruikers van deze richtlijn zijn medische specialisten, verpleegkundigen, diëtisten en doktersassistenten werkzaam in de 2e of 3e lijn die op wat voor manier dan ook betrokken zijn bij de indicatiestelling of begeleiding van patiënten voor, tijdens of na een voedselprovocatie.
Samenstelling werkgroep
Belangenverklaringen
Er zijn voor deze richtlijn geen belangenverklaringen opgesteld.
Inbreng patiëntenperspectief
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is geprobeerd rekening te houden met de implementatie van de richtlijn en de daadwerkelijke uitvoerbaarheid van de aanbevelingen. Daarbij is expliciet gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Daarnaast is er een patiëntenversie van de richtlijn ontwikkeld. De richtlijn wordt verspreid onder alle relevante beroepsgroepen, patiëntenorganisaties en onderwijsinstellingen. Er wordt aandacht voor de richtlijn gevraagd via publicaties in tijdschriften en websites van de verschillende verenigingen. Ook is de richtlijn te downloaden vanaf de website van het CBO: www.cbo.nl.
Werkwijze
Deze richtlijn is ontwikkeld in lijn met het adviesrapport Medisch Specialistische Richtlijnen 2.0 en volgens andere adviezen over de wijze waarop richtlijnen tot stand komen. In hoofdlijnen hebben de volgende activiteiten plaatsgevonden:
Inventarisatie
In opdracht van de Nederlandse Vereniging voor Allergie (NVvA) is er een werkgroep voedselprovocatie in het leven geroepen. Het doel van deze werkgroep was een richtlijn te ontwikkelen die aangeeft hoe voedselprovocaties het beste uitgevoerd kunnen worden. De werkgroep wordt gevormd door kinderartsen, dermatologen, allergologen, diëtisten, een mdl-arts, een longarts, een klinisch chemicus en vertegenwoordigers van patiënten. Aan twee verpleegkundigen die betrokken zijn bij voedselprovocaties is gevraagd aanwezig te zijn bij de bijeenkomsten en commentaar te geven op de teksten. Zij schreven niet zelf mee. De leden van de werkgroep komen uit verschillende delen van het land en zijn werkzaam in de academie of de periferie. Tijdens de eerste bijeenkomst zijn zoveel mogelijk knelpunten met betrekking tot voedselprovocaties in kaart gebracht. De vragen die deze knelpunten opleverden, komen aan de orde in de richtlijn.
Om na te gaan of er nog knelpunten ontbraken, zijn er 2 landelijke enquêtes uitgevoerd:
- Er is een digitale enquête verspreid onder 246 artsen, diëtisten en overige leden van de NVvA en NVK-SKA. Van 83 personen is respons gekregen, van wie 78 arts, diëtist of overig lid waren (5 respondenten hadden niets ingevuld en zijn niet meegenomen in de analyse). In totaal waren er 71 artsen die provocaties aanvragen binnen hun eigen ziekenhuis of zorginstelling;
- Een tweede enquête is gestuurd aan 1.600 leden van de Stichting Voedselallergie (SVA) en 1.216 leden van het Nederlandse Anafylaxie Netwerk (NAN). Tevens is de link van de digitale enquête getwitterd naar 950 volgers van de SVA. In totaal hebben 418 personen de enquête ingevuld. De respons was daarmee 11% (en 19% als de 950 twittervolgers niet meegerekend worden).
Knelpunten en uitgangsvragen
In 2008 is door individuele leden van de Vakgroep Allergologie (die gelieerd is aan de NVvA) gestart met het inventariseren van de bestaande protocollen aangaande voedselprovocatietests. Daarnaast zijn enkele uitgangsvragen opgesteld voor het ontwikkelen van een richtlijn. Voor de ontwikkeling van deze richtlijn heeft de werkgroep de relevante uitgangsvragen geselecteerd die in 2008 zijn opgesteld. Gelijktijdig zijn de verschillende werkwijzen in de Nederlandse praktijken in kaart gebracht aangaande de diagnostiek van voedselallergie en de voedselprovocatietest (zie inventarisatie/twee landelijke enquêtes). Op basis van de enquête is een knelpuntenanalyse opgesteld.
Knelpunten
- Er zijn nog geen goede en gevalideerde recepten voor veel voedselprovocaties. De hoogste dosering is daarom soms niet afdoende. Ook weigeren kinderen soms grote hoeveelheden voedsel.
- Bereiding van de recepten is kostbaar en lastig vanwege de eisen die er aangesteld worden.
- Er is geen enkele standaardisatie en validatie voor open provocaties.
- Er ontbreekt een centraal punt waar recepten besteld kunnen worden.
- Er zijn geen uniforme provocatieprotocollen waarin provocatieprocedures, stopcriteria, observatietijden en veiligheidsmaterialen zijn opgenomen.
- Provocaties zijn arbeidsintensief en de vergoeding ervoor schiet te kort.
- De diëtist wordt niet meer vergoed, waardoor veel ouders afzien van een bezoek aan de diëtist.
- Er is een tekort aan gekwalificeerd personeel.
- Een betere uniforme begeleiding na provocaties ontbreekt. Bijvoorbeeld wat betreft de handelwijze bij klachten thuis na provocatie of na een ‘shock’-reactie tijdens provocatie en een ‘verloren’ gevoel thuis.
- De informatieverstrekking aan patiënten en ouders kan beter, bijvoorbeeld over de risico’s tijdens de provocatie (bijvoorbeeld welke medicatie gestaakt moet worden en welke doorgebruikt mag worden). Dit geldt ook voor de informatie voor de huisarts.
- Te lange wachttijd, zeker bij meerdere allergenen.
Deze knelpunten vormen samen met de relevante uitgangsvragen uit 2008 het startpunt voor de vastgestelde uitgangsvragen.
Uitgangsvragen
- Wat is de voorspellende waarde van sensibilisatieonderzoek op de uitkomst van de provocatie?
- Wat zijn relatieve en absolute contra-indicaties van voedselprovocaties?
- Wanneer kan er voor een open en wanneer voor een dubbelblinde placebogecontroleerde voedselprovocatie gekozen worden?
- Kunnen we onderscheid maken tussen hoogrisico- en laagrisicoprovocaties, en is dit zinvol?
- Aan welke eisen moet de receptuur voor provocatie voldoen?
- Hoe ziet het ideale provocatieschema er uit?
- Welke stopcriteria kan men het best hanteren?
- Welk beleid kan gevolgd worden na de voedselprovocatie?
- Welke instructies en adviezen moeten gegeven worden aan patiënten en personeel betrokken bij provocaties?
Werkwijze werkgroep
De werkgroep heeft gedurende een periode van ongeveer tweeënhalf jaar gewerkt aan de beantwoording van de uitgangsvragen en opstellen van de tekst voor de conceptrichtlijn. De conclusies uit de literatuur vormden de basis voor het opstellen van de aanbevelingen. De verantwoordelijke werkgroepleden deden daarvoor een voorzet, die tijdens de werkgroepvergadering werd besproken en desgewenst aangevuld met praktijkinformatie. De uiteindelijke aanbevelingen zijn tot stand gekomen op basis van (informele) consensus binnen de werkgroep.
Tijdens plenaire vergaderingen werden de teksten besproken en geaccordeerd na verwerking van het commentaar. De door de werkgroep geaccordeerde conceptrichtlijn is vervolgens voor commentaar aangeboden aan de betrokken beroeps- en patiëntenverenigingen. Na de verwerking van dit commentaar is een definitief concept van de richtlijn op 27 mei 2015 door de werkgroep vastgesteld. De definitieve versie van de richtlijn is op 29 september 2015 vastgesteld.
Wetenschappelijke onderbouwing
Er is gewerkt volgens de methodiek van het adviesrapport Medisch Specialistische Richtlijnen 2.0. Aangezien alle uitgangsvragen en publicaties betrekking hebben op validiteit, betrouwbaarheid en normering van diagnostische instrumenten, is afgezien van een gradering van de kwaliteit van bewijs. Hoewel voor het type uitgangsvragen en publicaties de toepassing van GRADE als beoordelingssystematiek niet goed toepasbaar is, is er wel voor gekozen om de opbouw van hoofdstukken volgens het GRADE-format te doen. Dit betekent dus dat na de beschrijving van de toegepaste zoek- en selectiemethode en de beschrijving van de studies een passage ‘van bewijs naar aanbeveling’ is opgenomen. Dit leidt tot de formulering van aanbevelingen, die volgens de GRADE-systematiek worden afgesloten met een rationale.
Consensus
Binnen de werkgroep Voedselprovocatie zijn voldoende disciplines en gezaghebbende experts vertegenwoordigd om de bereikte consensus over de aanbevelingen autoriteit te geven. Daarnaast zullen de standpunten van experts in recent gepubliceerde nationale/internationale richtlijnen en ´position papers´ geïncorporeerd worden. Hierbij wordt rekening gehouden met de implementeerbaarheid. De aanbevelingen moeten immers een leidraad bieden voor de praktijkvoering van de medisch specialist, opdat de best beschikbare zorg aan de patiënt geboden wordt.
Totstandkoming van de aanbevelingen
Voor het komen tot een aanbeveling zijn er naast het wetenschappelijk bewijs ook andere aspecten van belang, bijvoorbeeld balans van gewenste en ongewenste effecten, belasting van een provocatie, patiëntvoorkeuren, professioneel perspectief, beschikbaarheid van speciale technieken of expertise, organisatorische aspecten, maatschappelijke consequenties en kosten.
Ter inventarisatie van het professioneel perspectief werden ook buitenlandse richtlijnen aangaande de diagnostiek, behandeling, begeleiding en beoordeling van voedselallergie/voedselprovocatie geraadpleegd. Hiervoor is gezocht in de databases van de US National Guideline Clearinghouse (www.guideline.gov) en het Guidelines International Network (www.g-i-n.net).
Deze aspecten worden besproken na de ‘Conclusie’ onder het kopje ‘Van bewijs naar aanbeveling’. De uiteindelijk geformuleerde aanbeveling is het resultaat van het beschikbare bewijs in combinatie met de overige overwegingen. Het volgen van deze procedure en het opstellen van de richtlijn in dit format heeft als doel de transparantie van de richtlijn te vergroten. Door aan de aanbeveling een rationale toe te voegen werd getracht deze transparantie te effectueren. Het bood ruimte voor een efficiënte discussie tijdens de werkgroepvergaderingen en vergroot bovendien de helderheid voor de gebruiker van de richtlijn.
De sterkte van aanbevelingen is een combinatie van het beschikbare bewijs en de overige aspecten die door de werkgroep van belang werden geacht. De werkgroep heeft ervoor gekozen om dit in de aanbevelingen terug te laten komen door consequent twee formuleringen te gebruiken:
- Aanbevolen wordt …… (sterke aanbeveling)
- Overwogen kan worden om …… (zwakke aanbeveling).
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
