Block/replace versus monotherapie bij Graves’
Uitgangsvraag
Welk medicamenteuze behandeling heeft de voorkeur bij patiënten met Graves’ hyperthyreoïdie: block/replace therapie of monotherapie?
Aanbeveling
Het block/replace en monotherapie regime zijn beide goed bruikbaar. Bespreek de voor- en nadelen met de patiënt om tot een passende behandelkeuze te komen.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er zijn op grond van de beschikbare literatuur geen duidelijke verschillen in recidiefkans tussen een block/ replace en monotherapie regime bij de behandeling van Graves’ hyperthyreoïdie. Bijwerkingen, waaronder huiduitslag, komen minder voor bij monotherapie. De beschikbare literatuur toont mogelijk een hoger risico op agranulocytose bij block/replace therapie dan bij monotherapie. Zeer recent liet een Deense studie, gebaseerd op een landelijk register, zien dat acute pancreatitis mogelijk geassocieerd is met thiamazol (Brix, 2020).
De bewijskracht van de verschillende studies tezamen is beperkt door variatie in dosis, behandelduur, en duur van follow-up. Hierdoor zijn studies moeilijk te vergelijken. Tevens vermeldt het merendeel van de studies niet of patiënten eerst in volledige remissie zijn gekomen alvorens een recidief te ontwikkelen. Er is geen vergelijkende literatuur beschikbaar over het effect op kwaliteit van leven.
Als argument in de keuze voor block/replace kan worden genoemd dat de keuzemogelijkheden in dosering van levothyroxine groot zijn (diverse tabletten met doseringsstapjes van 12,5 µg zijn beschikbaar). Bij de monotherapiemethode zijn van thiamazol alleen tabletten van 5, 10 en 30 mg beschikbaar, waarmee het niet altijd mogelijk is een stabiele eenmaal daagse dosis te bereiken. De tabletten thiamazol 5 mg zijn niet beschikbaar als geregistreerd geneesmiddel, maar als doorgeleverde bereiding. Als aanvullend argument in de keuze voor block/replace therapie kan worden genoemd dat het aannemelijk is dat patiënten gezien de gemiddeld hogere startdosering van thyreostaticum eerder euthyreoot zullen zijn. Dit leidt mogelijk tot sneller herstel van de klinische symptomen en minder controles. Daarentegen is het aannemelijk dat monotherapie minder kans op bijwerkingen geeft dan block/replace omdat de dosering thyreostaticum hierbij lager is. Er is geen bewijs dat agranulocytose voorkomen kan worden door het meten van leukocyten. Er is daarom geen reden om routinematig leukocyten te controleren.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Patiënten spreken soms een voorkeur uit voor monotherapie omdat daarmee zowel het aantal medicamenten als de totale dosis thyreostaticum lager zijn. Deze voorkeur is rationeel en moet afgewogen worden tegen het nadeel van het mogelijk minder snel bereiken van biochemische euthyreoïdie en een biochemisch minder stabiele instelling waardoor er mogelijk meer frequente controles vereist zijn.
Kosten (middelenbeslag)
Niet relevant; de kosten zijn vergelijkbaar voor beide regimes omdat de kosten voor levothyroxine laag zijn.
Aanvaardbaarheid, haalbaarheid en implementatie
De aanbeveling is onveranderd ten opzichte van de oude richtlijn. Derhalve worden geen problemen met implementatie verwacht.
Rationale/ balans tussen de argumenten voor en tegen de interventie
Er zijn geen duidelijke verschillen in recidiefkans tussen block/replace en monotherapie. Voordelen van monotherapie zijn het gebruik van minder medicijnen en een lager risico op bijwerkingen, waaronder huiduitslag en mogelijk een verlaagd risico op agranulocytose. Mogelijke voordelen van block/replace therapie zijn een snellere biochemische instelling met sneller resolutie van symptomen en minder controles. Deze afwegingen kunnen met de patiënt besproken worden om samen tot een behandelkeuze te komen.
Onderbouwing
Achtergrond
De behandeling van Graves’ hyperthyreoïdie kan afhankelijk van de diagnose bestaan uit thyreostatica, radioactief jodium of thyreoïdectomie. Bij een recidief Graves’ is deze behandeling gelijkwaardig. Deze module richt zich op de behandeling van een eerste episode van Graves, waarbij medicamenteuze behandeling de voorkeur heeft. De medicamenteuze therapie van Graves’ hyperthyreoïdie kan bestaan uit monotherapie met een thyreostaticum of uit block/replace therapie (thyreostaticum met levothyroxine). Methimazol en carbimazol zijn thyreostatica met thiamazol als werkzame stof, en deze laatste term wordt gehanteerd in deze module. Het is momenteel onduidelijk welke van deze twee behandelmodaliteiten de beste uitkomsten geeft (recidiefkans, bijwerkingen, kwaliteit van leven). In de meeste gevallen wordt de behandeling na minstens één jaar gestopt om vervolgens te controleren of de patiënt in blijvende remissie is (proefstop).
Conclusies
Recidiefkans
|
Laag GRADE |
De recidiefkans lijkt niet te verschillen tussen block/replace en monotherapie op lange termijn (> 24 maanden).
Bronnen: (Abraham, 2010; Liu, 2014) |
Bijwerkingen
|
Laag GRADE |
De kans op huiduitslag en het aantal patiënten dat zich in klinische studies terugtrok door bijwerkingen is mogelijk hoger bij block/replace therapie dan bij monotherapie.
Bronnen: (Abraham, 2010) |
Bijwerkingen - agranulocytose
|
Laag GRADE |
Er is mogelijk een hogere kans op agranulocytose bij block/replace therapie dan bij monotherapie.
Bronnen: (Abraham, 2010) |
Kwaliteit van leven
|
- GRADE |
Er zijn geen studies beschikbaar die kwaliteit van leven hebben onderzocht. |
Samenvatting literatuur
Beschrijving studies
Een Cochrane review van Abraham (2010) bevatte een meta-analyse van 12 RCT’s waarin de effectiviteit van block/replace therapie en monotherapie met elkaar is vergeleken. Twee RCT’s uit deze meta-analyse zijn geexcludeerd voor deze richtlijn: de studie van Tuncel (2010) is alleen gepubliceerd als een abstract en bevat zeer geringe methodologische informatie (zoals behandeling en follow-up duur) en de studie van Benker (1998) vergelijkt twee doseringen thiamazol met eventueel levothyroxine en voldoet dus niet aan de interventie-criteria. In de hier onderstaande literatuuranalyse zijn alle patiënten meegenomen die de studies hebben afgerond (n=1176). Het aantal drop-outs is per studie weergegeven in de evidencetabellen.
In 8 studies werd carbimazol als thyreostaticum gebruikt met doseringen tussen 30 en 100 mg daags in de block/replace-arm en 25 tot 60 mg in de monotherapie-arm. Thiamazol werd gebruikt in 2 studies met doseringen van 30 mg per dag in de block/replace-arm en 30 mg of een flexibele dosering in de monotherapie-arm. De behandelingsduur was 6 maanden in 2 studies, 12 maanden in 5 studies en 18 maanden in 3 studies.
Liu (2014) keek in een RCT naar lange termijneffecten van thiamazol met en zonder levothyroxine in patiënten met Graves’ hyperthyreoïdie. Alle studiedeelnemers startten met een dosering van 30 mg thiamazol, waarbij het afbouwen als volgt verliep: Groep 1 (n=46) (30 mg→20 mg→15 mg→10 mg→5 mg); groep 2 (n=47) (30 mg→20 mg→15 mg→10 mg+L-thyroxine→ 5mg+L-thyroxine); groep 3 (n=52) (30 mg→20 mg→15 mg→10 mg+L-thyroxine→5 mg+L-thyroxine→2.5mg+L-thyroxine). Er was geen vaste behandelduur, dit wisselde per patiënt. De uitkomst recidiefkans werd gemeten tot 6 jaar na de laatste medicatie wijziging.
Resultaten
Recidiefkans
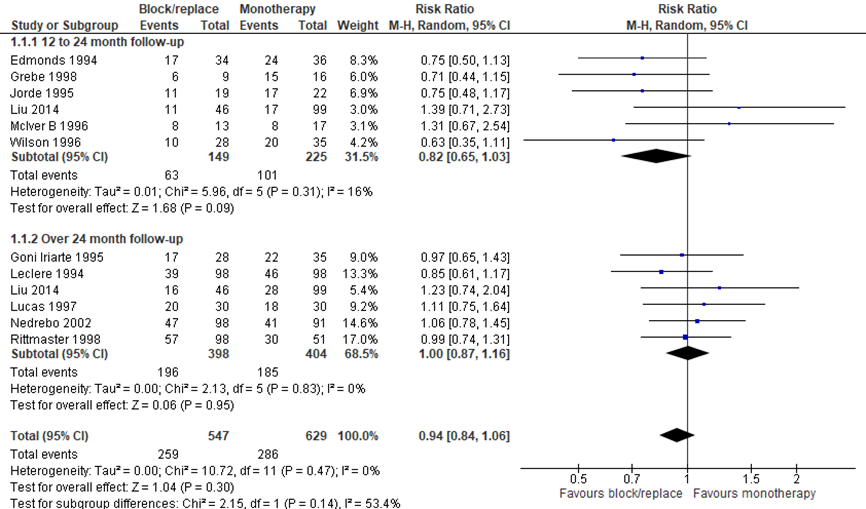
De meta-analyse van Abraham (2010) werd aangevuld met de gegevens van de RCT van Liu (2014). De recidiefkans is onderverdeeld naar 12 tot 24 maanden follow-up en meer dan 24 maanden follow-up. Het Relatief Risico (RR) voor een recidief binnen 12 tot 24 maanden was 0,82 (95%-BI: 0,65 tot 1,03), met een niet statistisch significant voordeel voor block/replace in vergelijking met monotherapie (Figuur 1). Na een follow-up duur van meer dan 24 maanden werd er geen verschil gevonden tussen block/replace en monotherapie (RR 1,00 (95%-BI: 0,87 tot 1,16)). Abraham (2010) en de meeste individuele studies beschrijven echter niet of de deelnemers eerst in remissie waren. Daarom kunnen wij niet uitsluiten dat er in sommige deelnemers sprake was van aanhoudende hyperthyreoïdie en niet van een recidief.
Figuur 1 Recidiefkans bij block/replace in vergelijking met monotherapie
Bijwerkingen
Het Cochrane review van Abraham (2010) bevat een meta-analyse van 6 RCT’s waarin informatie over bijwerkingen werd gerapporteerd.
Agranulocytose
Agranulocytose kwam voor bij 9 van de 434 patiënten. In de block/replace groep waren er 7 (3,2%) patiënten met agranulocytose versus 2 (0,9%) patiënten in de monotherapie groep. Gezien het beperkte aantal cases dient geen waarde gehecht te worden aan de p-waarde van deze associatie (p=0,13).
Patiënten met agranulocytose in de block/replace groep kregen medicatie in de dosering variërend van 60 mg carbimazol/thiamazol (n=5) tot 100 mg carbimazol (n=2). De 2 patiënten in de monotherapie groep kregen 25 of 60 mg carbimazol.
Overige bijwerkingen
Huiduitslag kwam twee keer zo vaak voor tijdens block/replace therapie in vergelijking met monotherapie (12% versus 7%), p=0,01). Het aantal patiënten dat vanwege bijwerkingen stopte met de behandeling was 16% in de block/replace groep versus 9% in de monotherapiegroep (p=0,02). Geen van de genoemde studies heeft leverfunctiestoornissen als bijwerking gedocumenteerd. Liu (2014) rapporteerde geen bijwerkingen.
Kwaliteit van leven
Er zijn geen studies beschikbaar die de kwaliteit van leven tijdens de 2 behandelregimes hebben bestudeerd.
Bewijskracht van de literatuur
De bewijskracht voor RCT’s begint hoog. De bewijskracht voor de uitkomstmaten recidiefkans en bijwerkingen is met twee niveaus verlaagd tot laag gezien beperkingen in de onderzoeksopzet (risk of bias) en inconsistentie.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag (vragen):
Wat zijn de (on)gunstige effecten van block/replace therapie versus monotherapie bij patiënten met Graves’ hyperthyreoïdie.
P: patiënten patiënten met hyperthyreoïdie door de ziekte van Graves’;
I: interventie block/replace therapie (thyreostaticum met levothyroxine);
C: controle monotherapie (thyreostaticum);
O: outcome recidiefkans, bijwerkingen, kwaliteit van leven.
Relevante uitkomstmaten
De werkgroep achtte recidiefkans, bijwerkingen en kwaliteit van leven voor de besluitvorming cruciale uitkomstmaten.
De werkgroep definieerde recidiefkans als: het percentage patiënten dat na stoppen met thyreostatica euthyreoot is gebleven en later opnieuw hyperthyreoïdie ontwikkelt.
De werkgroep definieerde bijwerkingen als: huiduitslag, leverfunctiestoornissen, pancreatitis, agranulocytose.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 27 maart 2019 met relevante zoektermen gezocht naar literatuur over de effecten en bijwerkingen van ‘block and replace’ therapie in vergelijking met monotherapie in patiënten met de ziekte van Graves’. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 283 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: systematische reviews en RCT’s gepubliceerd na 2011 (in 2011 is de vorige richtlijn opgesteld en een bijbehorende literatuurstudie uitgevoerd. Op basis van titel en abstract werden in eerste instantie 10 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 8 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en één systematische review en één RCT definitief geselecteerd. De systematische review (Abraham, 2010) was tevens opgenomen in de oude richtlijn (2012).
Resultaten
Eén systematische review en één RCT zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- 1 - Abraham, P., Avenell, A., McGeoch, S. C., Clark, L. F., & Bevan, J. S. (2010). Antithyroid drug regimen for treating Graves' hyperthyroidism. Cochrane Database of Systematic Reviews, (1).
- 2 - Benker, G., Reinwein, D., Kahaly, G., Tegler, L., Alexander, W. D., Faßbinder, J., ... & European Multicentre Trial Group of the Treatment of Hyperthyroidism with Antithyroid Drugs. (1998). Is there a methimazole dose effect on remission rate in Graves' disease? Results from a long‐term prospective study. Clinical endocrinology, 49(4), 451-457.
- 3 - Brix, T. H., Lund, L. C., Henriksen, D. P., Folkestad, L., Bonnema, S. J., Hallas, J., & Hegedüs, L. (2020). Methimazole and risk of acute pancreatitis. The Lancet Diabetes & Endocrinology.
- 4 - Edmonds, C. J., & Tellez, M. (1994). Treatment of Graves' disease by carbimazole: high dose with thyroxine compared to titration dose. European journal of endocrinology, 131(2), 120-124.
- 5 - Goñi, M. I., Forga, L. L., Iriarte, A. B., Apiñániz, E. A., Rodríguez, R. E., & Menéndez, E. T. (1995). Recurrence of Graves-Basedow disease: the influence of treatment schedule. Medicina clinica, 104(1), 11-14.
- 6 - Grebe, S. K., Feek, C. M., Ford, H. C., Fagerström, J. N., Cordwell, D. P., Delahunt, J. W., & Toomath, R. J. (1998). A randomized trial of short‐term treatment of Graves' disease with high‐dose carbimazole plus thyroxine versus low‐dose carbimazole. Clinical endocrinology, 48(5), 585-592.
- 7 - Jorde, R., Ytre‐Arne, K., Størmer, J., & Sundsfjord, J. (1995). Short‐term treatment of Graves' disease with methimazole in high versus low doses. Journal of internal medicine, 238(2), 161-165.
- 8 - Leclere, J. (1994). Treatment of Basedow disease with synthetic antithyroid drugs. Evaluation of the dose on the efficacy of the long term treatment. In Annales d'endocrinologie (Vol. 55, No. 1, pp. 11-14).
- 9 - Liu, X., Qiang, W., Liu, L., Liu, S., Gao, A., Gao, S., & Shi, B. (2014). A 6-year follow-up of a randomized prospective trial comparing methimazole treatment with or without exogenous L-thyroxine in chinese patients with Graves’ disease. Experimental and Clinical Endocrinology & Diabetes, 122(10), 564-567.
- 10 - Lucas, A., Salinas, I., Rius, F., Pizarro, E., Granada, M. L., Foz, M., & Sanmarti, A. (1997). Medical therapy of Graves’ disease: does thyroxine prevent recurrence of hyperthyroidism?. The Journal of Clinical Endocrinology & Metabolism, 82(8), 2410-2413.
- 11 - McIver, B., Rae, P., Beckett, G., Wilkinson, E., Gold, A., & Toft, A. (1996). Lack of effect of thyroxine in patients with Graves' hyperthyroidism who are treated with an antithyroid drug. New England Journal of Medicine, 334(4), 220-224.
- 12 - Nedrebo, B. G., Holm, P. I., Uhlving, S., Sorheim, J. I., Skeie, S., Eide, G. E., ... & Aanderud, S. (2002). Predictors of outcome and comparison of different drug regimens for the prevention of relapse in patients with Graves' disease. European journal of endocrinology, 147(5), 583-589.
- 13 - Rittmaster, R. S., Abbott, E. C., Douglas, R., Givner, M. L., Lehmann, L., Reddy, S., ... & York, S. E. (1998). Effect of methimazole, with or without L-thyroxine, on remission rates in Graves’ disease. The Journal of Clinical Endocrinology & Metabolism, 83(3), 814-818.
- 14 - Tuncel, E., Erturk, E., & Imamoglu, S. (2000). Effects of antithyroid drugs alone and plus L-thyroxine on the relapse of Graves' disease. Journal of Endocrinological Investigation, 23(7; SUPP 1), 40-40.
- 15 - Wilson, R., Buchanan, L., Fraser, W. D., McKillop, J. H., & Thomson, J. A. (1996). Do higher doses of carbimazole improve remission in Graves' disease?. QJM: An International Journal of Medicine, 89(5), 381-386.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
|
Liu, 2014 |
Type of study: RCT
Setting and country: China
Funding and conflicts of interest: Special Project of Health Industry Research of China (201002002). |
Inclusion criteria: First diagnosis of GD, based on medical history, symptoms of hyperthyroidism, elevated levels of free T3, free T4 and depressed TSH level.
Exclusion criteria: 1) prior treatment for GD; 2) pregnant and lactating women; 3) patients combined with thyroid tumor or thyroiditis; 4) serious hepatic impairment.
N total at baseline: Group 1 (control), n=46 Group 2 (2,5mg MMI+T4), n=47 Group 3 (5mg MMI+T4), n=52
Important prognostic factors2: Sex 1: 15% M 2: 13% M 3: 17% M
Age 1: 33.1 ± 10.9 2: 33.1 ± 12.3 3: 34.3 ± 13.9
Groups comparable at baseline? Yes |
Describe intervention (treatment/procedure/test):
group 2: (30mg→20 mg→15 mg→10 mg+T4→5mg+T4);
group 3: (30mg→20 mg→15 mg→10 mg+T4→5mg+T4 →2.5mg+T4)
With the initial large drug dose, the follow-up time was approximately one month.
|
Describe control (treatment/procedure/test):
group 1: 30mg→20 mg→15 mg→10 mg→5mg (no placebo in place of T4)
|
Length of follow-up: The follow-up was carried out continuously 1, 3, 6, 9, 12, 18, 24, 36, 48, 60 and 72 months after drug withdrawal and all thyroid functions were recorded.
Loss-to-follow-up: Not mentioned in the study
|
Outcome measures and effect size (include 95%CI and p-value if available):
Cumulative relapse after 72 months (%):
Group 1: 34.8% Group 2: 25.5% Group 3: 30.8% |
|
Abraham, 2010 |
SR and meta-analysis of RCTs
Literature search up to April 2009
A: Edmonds, 1994 B: Grebe, 1998 C: Jorde, 1995 D: McIver B 1996 E: Wilson, 1996 F: Goni Iriarte, 1995 G: Leclere, 1994 H: Lucas, 1997 I: Nedrebo, 2002 J: Rittmaster, 1998
Study design: RCT
Setting and Country: A: UK B: New Zealand C: Norway D: UK E: UK F: Spain G: France H: Spain I: Norway J: Canada
Source of funding and conflicts of interest: Non commercial
|
Inclusion criteria SR:
Exclusion criteria SR:
11 studies included
Important patient characteristics at baseline: mean age A: I: 48 (11.9) C: 41(12.1) B: I: 33.7 (11.9) C: 33(8.7); C: I: 43.8 (2.8) C: 40.6(2.1); D: I: 36 (10) C: 33 (9) E: no details given F: 39 (1.8) G: no details given H: I: 34.5 (8.3) C: 37.5 (13.9) I: I-A: 43.9 (10.2) I-B: 40.2 (11.5) 2-A: 42.4 (12.2) 2-B: 43.4 (13.3) J: I-A: 38 (13) I-B: 39 (15) C: 39 (14)
Sex, Male/Female: A: I: 6/28 C: 11/25 B: I: 3/17 C: 5/12 C: I: 5/24 C: 6/21 D: I: 11/48 C: 11/41 E: no details F: I: 4/26 C: 7/39 G: no details given H: I: 4/26 C: 7/23 I: I-A: 43.9 (10.2) I-B: 40.2 (11.5) C-A: 42.4(12.2) C-B: 43.4 (13.3) J: I-A: 5/45 I-B: 11/37 C: 7/44
Groups comparable at baseline? yes |
Describe intervention:
A: Carbimazole 60mg for 1month, then thyroxine to maintain normal free T3 B: Carbimazole 100mg/d, thyroxine added after 2-4weeks to maintain euthyroidism C: Methimazole 30 mg b.d., thyroxine added after 2-4 weeks D: Carbimazole (initial dose 40 mg for 1 month) till restoration to normal of free T4 and thyroxine 100 μg added and adjusted to achieve TSH < 0.04mU/ml E: Carbimazole 60 mg daily for 1 month, then liothyronine added to maintain normal free T3 F: Carbimazole (initial dose 30-40 mg/d, maintenance 10-15 mg/d) by clinical evaluation and restoration of free T4 and total T3 G: Carbimazole 60 mg and T4 or T3 H: Block and replace; restoration to normal of free T4 and total T3 I: Block and replace regimen. For the subsequent 12 months Groups A had thyroxine alone and Group B had no treatment J: A: Methimazole 15 mg b.d. for 18 months + T4 to maintain TSH in range 2 -5.4 mIU/L B: Methimazole 15mg b.d. for 18 months + T4 to maintain TSH in range 2 -5.4 mIU/L
|
Describe control:
A: Titration of carbimazole (initial dose 60 mg for 1 month) titrated down by clinical evaluation and restoration of free T4 and total T3 B: Titration of carbimazole (Initial dose 25 mg daily) adjusted to maintain euthyroidism (mean dose carbimazole 17 mg/d) C: Titration of methimazole (Initial dose 15 mg b.d.) titrated down with checks every 2-4 weeks to a mean dose of 7.5 mg daily D: Titration of carbimazole (initial dose 40 mg for 1 month) by clinical evaluation and restoration of free T4 and total T3 E: Titration of carbimazole (initial dose 45 mg daily for 1month, then 30 mg daily for 1 month, then 20 mg daily for 10 months), liothyronine commenced to keep euthyroid, mean time 4.5 months F: Titration of carbimazole (initial dose 30-40 mg/d, maintenance 10-15 mg/d) by clinical evaluation and restoration of free T4 and total T3 G: Carbimazole 60 mg/day titrated down after 4-6 weeks. H:Titration of carbimazole by clinical evaluation and restoration of free T4 and total T3 I: titration regimen. For the subsequent 12 months Groups 2A had thyroxine alone and Group 2B had no treatment J: Methimazole for 18/12 adjusted to keep TSH in normal range (0.3 -5.4 mIU/L) |
End-point of follow-up:
A: two years B: two years C: two years D: 1 year E: 1 year F: 3 years G: 3 years H: mean 4.9 years (SD: 1.6) I: 13.4-41.7 months J: 27 months (range 6-47)
For how many participants were no complete outcome data available? (intervention/control) A: allocated: I: 49 c: 46 completed I: 34 c: 36 B: allocated: I: 17 c: 20 completed I: 9 c:16 C: allocated: I: 29 c: 27 completed I: 19 c: 22 D: allocated: I: 59 c: 52 completed I: 13 c: 17 E: allocated: I: 33 c: 44 completed I: 28 c: 35 F: allocated: I: 30 c: 46 completed I: 28 c: 35 G: allocated: I: 123 c: 123 completed I: 98 c: 98 H: allocated: I: 30 c: 30 completed I: 30 c: 30 I: allocated: IA: 54, IB:56 cA: 54, cB: 54 completed IA: 47, IB:51 cA: 46, cB: 45 J: allocated: 199 completed I: 98 c: 51 |
Outcome measure-1 Defined as.....
Effect measure: OR [95% CI]: Study completers only A: 0.51 (0.20-1.31) B: 0.14 (0.02-1.28) C: 0.42 (0.11-1.54) D: 1.75 (0.42-7.28) E: 0.43 (0.16-1.15) F: 0.91 (0.33-2.52) G: 0.75 (0.43-1.32) H: 1.33 (0.47-3.76) I: 1.12 (0.63-1.99) J: 0.97 (0.49-1.93)
Pooled effect (fixed effects model): 0.86 [95%-CI: 0.68-1.08] favouring B&R. Heterogeneity (I20.0):
Assuming relapse in all drop-outs A: 0.67 (0.28-1.60) B: 0.28 (0.04-2.18) C: 0.61 (0.18-2.08) D: 2.21 (0.72-6.77) E: 0.44 (0.18-1.09) F: 0.68 (0.25-1.82) G: 0.47 (0.29-0.78) H: 1.33 (0.47-3.76) I: 1.00 (0.59-1.70) J: 0.97 (0.49-1.93)
Pooled effect (fixed effects model): 0.79 [95%-CI: 0.64-0.98] favouring B&R. Heterogeneity (I2=24%) |
Risk of bias tabellen: gerandomiseerd onderzoek
|
Study reference
|
Describe method of randomisation |
Bias due to inadequate concealment of allocation? |
Bias due to inadequate blinding of participants to treatment allocation? |
Bias due to inadequate blinding of care providers to treatment allocation? |
Bias due to inadequate blinding of outcome assessors to treatment allocation? |
Bias due to selective outcome reporting on basis of the results?
|
Bias due to loss to follow-up?
|
Bias due to violation of intention to treat analysis?
|
|
Liu, 2014 |
random number table |
Unlikely |
Unclear
Not mentioned |
Unclear
Not mentioned |
Unclear
Not mentioned |
Unclear
Not mentioned |
Unclear
Not mentioned |
Unclear
Not mentioned |
|
Edmonds, 1994 |
Sealed envelope |
Unlikely |
Likely
Patients were not blinded |
Unclear
Not mentioned
|
Unclear
Assessor blinding: not mentioned |
Likely |
Unlikely B&R: 34/49, 69% Titration: 36/46, 78% |
Likely
No ITT |
|
Grebe 1998 |
No description given |
Unclear |
Likely
Patients were not blinded |
Unclear
Not mentioned |
Unclear
Assessor blinding: not mentioned |
Unlikely |
Likely B&R: 9/17, 53% Titration: 16/20, 80% |
Unlikely
ITT performed |
|
Jorde, 2015 |
No description given |
Unclear |
Likely
Patients were not blinded |
Unclear
Not mentioned |
Unclear
Assessor blinding: not mentioned |
Unlikely |
Likely B&R: 19/29, 66% Titration: 22/27, 82% |
Unlikely
ITT performed |
|
McIver B 1996 |
No description given |
Unclear |
Likely
Patients were not blinded |
Unclear
Not mentioned |
Unclear
Assessor blinding: not mentioned |
Likely |
Likely B&R: 13/59, 22% Titration: 17/52, 33% |
Likely
No ITT |
|
Wilson, 1996 |
No description given |
Unclear |
Likely
Patients were not blinded |
Unclear
Not mentioned |
Unclear
Assessor blinding: not mentioned |
Likely |
Unlikely B&R: 28/33, 85% Titration: 35/44, 80% |
Likely
No ITT |
|
Goni Iriarte, 1995 |
No description given |
Unclear |
Likely
Patients were not blinded |
Unclear
Not mentioned |
Unclear
Assessor blinding: not mentioned |
Likely |
Likely B&R: 28/30, 93.3% Titration: 35/46, 76.0% |
Likely
No ITT |
|
Leclere, 1994 |
Statistical tables |
Unlikely |
Likely
Patients were not blinded |
Unclear
Not mentioned |
Likely
Outcome assessor not blinded |
Unlikely |
Unlikely B&R: 98/123, 80% Titration: 98/123, 80% |
Unlikely
ITT not specifically mentioned, but was possible |
|
Lucas, 1997 |
Sequentially numbered envelopes |
Unlikely |
Likely
Patients were not blinded |
Unclear
Not mentioned |
Unclear
Assessor blinding: not mentioned |
Unlikely |
Unlikely B&R: 30/30, 100% Titration: 30/30, 100% |
Likely
No ITT |
|
Nedrebo, 2002 |
No description given |
Unclear |
Likely
Patients were not blinded |
Unclear
Not mentioned |
Likely
Outcome assessor not blinded |
Unlikely |
Unlikely B&R: 98/110, 89% Titration: 91/108, 84% |
Unlikely
ITT not specifically mentioned, but was possible |
|
Rittmaster, 1998 |
No description given |
Unclear |
Likely
Patients were not blinded |
Unclear
Not mentioned |
Unclear
Assessor blinding: not mentioned |
Likely |
Unclear
Completed not presented per group |
Likely
No ITT |
Exclusietabel
|
Auteur en jaartal |
Redenen van exclusie |
|
Aggerwal, 2016 |
Uitkomst voldoet niet |
|
Azizi, 2017 |
Geen studie naar block and replace vs monotherapie |
|
Burch, 2015 |
Geen studie naar block and replace vs monotherapie |
|
Cramon, 2016 |
Geen studie naar block and replace vs monotherapie |
|
Liu, 2015 |
Geen studie naar block and replace vs monotherapie |
|
Ren, 2015 |
Geen studie naar block and replace vs monotherapie |
|
Sundaresh, 2013 |
Geen studie naar block and replace vs monotherapie |
|
Torring, 2019 |
Geen studie naar block and replace vs monotherapie |
|
Zeng, 2018 |
Geen studie naar block and replace vs monotherapie |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 01-07-2020
Laatst geautoriseerd : 01-07-2020
Geplande herbeoordeling : 01-01-2018
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2025 bepaalt het bestuur van de NIV of de modules van deze richtlijn nog actueel zijn. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NIV is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
Goedgekeurd door:
- Nederlands Huisartsen Genootschap
- Schildklierorganisatie Nederland
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Deze richtlijn geeft aanbevelingen ten aanzien van behandeling van volwassen patiënten (leeftijd ≥18 jaar) met schildklierfunctiestoornissen. Doel van deze gedeeltelijke herziening is om een richtlijn te verkrijgen waarin de meeste recente medische kennis omtrent de zorg voor patiënten met schildklierfunctiestoornissen wordt meegenomen.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met schildklierfunctiestoornissen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met schildklierfunctiestoornissen.
Werkgroep
- Prof. dr. E. Fliers (voorzitter vanaf 1 mei 2019), internist-endocrinoloog, NIV
- Prof. dr. R. Peeters (voorzitter tot 1 mei 2019), internist-endocrinoloog, NIV
- Dr. W.E. Visser, internist-endocrinoloog, NIV
- Dr. A. Roos, internist-endocrinoloog, NIV
- Dr. M. Medici, internist-endocrinoloog, NIV
- Dr. A.F. Muller, internist-endocrinoloog, NIV
- Prof. dr. O.M. Dekkers, internist-endocrinoloog en klinisch epidemioloog, NIV
- Dr. A.A. Bouman, SON
- R. Nix, SON (tot 1 september 2019)
Meelezers
- Dr. M.M.E. van Rumste, gynaecoloog, NVOG (vanaf 1 april 2019)
- Drs. M. Sijbom, huisarts, NHG (vanaf 1 juli 2019)
- Dr. S. van der Berg, klinisch chemicus, NVKC (vanaf 1 augustus 2019)
Met ondersteuning van
- Drs. L. Boerboom, literatuurspecialist, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. S.R. Zwakenberg, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. N.L. van der Zwaluw, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met evt. belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Prof. dr. E. Fliers, internist-endocrinoloog, NIV (voorzitter vanaf 1-5-2019) |
Hoofd- afdeling Endocrinologie en Metabolisme, Amsterdam UMC, Hoogleraar Endocrinologie UvA |
Board memberships, committees: - ETA guideline committee diagnosis and management of central hypothyroidism (2017-2018) - Executive Committee European Thyroid Association (tot 2019) - Program organizing committee ETA Annual Meeting 2017, 2018, 2019 - Member Thyroid Network of Dutch Endocrine Society (NVE) (2017 - present)
Voorzitter Medische Adviesraad Schildklier Organisatie Nederland (SON) |
geen |
Geen |
|
Prof. dr. R. Peeters, internist-endocrinoloog, NIV (voorzitter tot 1-05-2019) |
Erasmus MC, Internist-endocrinoloog, hoogleraar schildklierziekten |
Member of International guideline committees: American Thyroid Association Task Force: Guidelines for thyroid disease and pregnancy (not remunerated)
Board memberships and committees of professional societies: - Programme Organizing Committee of the 2019 European Congress of Endocrinology. 2018 Annual Meeting of the American Thyroid Association - Iodine Global Network (https://www.ign.org/), National representative for the Netherlands (not remunerated) - Chair of the Scientific Advisory Board of the World Iodine Association (not remunerated) - Treasurer of the Dutch Thyroid Club / Foundation for Thyroid Research (not remunerated) |
Zie transparantieregister voor financiële banden (red: diverse diensten met onkosten) vergoeding van Shire International licenising, Genzyme Europe BV, Ipsen Farmaceutica BV, Merck BV, IBSA, Bayer, - Adviesraad Eisai BV (vergoeding) |
Geen; vergoedingen waren niet gerelateerd aan de richtlijn
|
|
Dr. W.E. Visser, internist-endocrinoloog, NIV |
Erasmus MC, Internist-endocrinoloog |
Member of international committees - European Thyroid Association Task Force: Guideline on Diagnosis and Management of Resistance to Thyroid Hormone & other disorders of thyroid hormone action (2016 - present) - Educational Committee of the European Thyroid Association (2017 - present) - Chair Thyroid Network of Dutch Endocrine Society (NVE) (2017 - present)
Editorial Board membership - Editorial Board of Frontiers in Neurogenomics (2013 - present) - Editorial Board of the Journal of Endocrinology (2016 - present) - Editorial Board of the Journal of Molecular Endocrinology (2016 - present) - Editorial Board of the Endocrinology, Diabetes and Metabolism (2016 - present) - Editorial Board of the European Thyroid Journal (2017 - present)
Management role in International Consortia - Founder and chair MCT8 patient registry (2016 - present). - Chair rare thyroid hormone signalling disorders in Endo-ERN (European Reference Networks) (2016 - present) - Chair Thyroid Group of Endo-ERN EuRRECa (2018 - present)" |
geen |
Vergoedingen niet gerelateerd aan richtlijn (diabetes, schildklierkanker) |
|
Drs. A. Roos, internist-endocrinoloog, NIV |
Internist-endocrinoloog Martini Ziekenhuis, Groningen |
Geen |
Geen |
Geen |
|
Dr. M. Medici, internist-endocrinoloog, NIV |
Internist-Endocrinoloog radboudUMC (0,6 fte) en Erasmus MC (0,4 fte) |
Geen;
|
Erasmus Universiteit Fellowship: geen belang bij het advies van de richtlijn. |
geen |
|
Dr. A.F. Muller, internist-endocrinoloog, NIV |
Internist, Diakonessenhuis |
Zie transparantieregister (red: diverse diensten met (onkosten)vergoeding voor Novo Nordisk, Eli Lilly and Company (adviesraad), Amgen, Sanofi) |
|
Vergoedingen waren niet gerelateerd aan de richtlijn (diabetes, schildklierkanker)
|
|
Prof. dr. O.M. Dekker, internist, NIV |
Hoogleraar Interne Geneeskunde LUMC Leiden |
Collegelid CBG (betaald) Lid Gezondheidsraad (onbetaald) Voorzitter Vereniging Epidemiologie (onbetaald)" |
Geen |
Geen |
|
Dr. A.A. Bouman, SON |
Gepensioneerd (tot 1-9-2012 werkzaam als Klinisch chemicus bij het Vumc) |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afgevaardigden van de patiëntenvereniging Schildklier Organisatie Nederland (SON). De conceptrichtlijn is tevens voor commentaar voorgelegd aan de patiëntenvereniging.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt, wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn (Richtlijn schildklierfunctiestoornissen, 2012) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door middel van een schriftelijke invitational conference. De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg en patiëntveiligheid.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep en de adviseur concept-uitgangsvragen opgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De gespecificeerde zoekstrategieën zijn op te vragen bij het Kennisinstituut.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: Cochrane - voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS - voor observationeel onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008) en een generieke GRADE-methode voor vragen over bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (eindconclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een eindconclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg. De module over organisatie van zorg wordt opgenomen in deel 2 van de richtlijn.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialist.
