Obesitas tijdens de overgang
Uitgangsvraag
Welke specifieke leefstijladviezen moeten aangereikt worden bij peri- en postmenopauzale vrouwen met overgewicht (in combinatie met een vergrote buikomvang en/of comorbiditeit) of obesitas voor het verminderen van overgangsklachten en/of gewicht?
Aanbeveling
- Wijs vrouwen in de overgang met overgewicht of obesitas er op dat de combinatie van een gezond voedingspatroon en meer bewegen kan leiden tot een gezonder gewicht en daarmee gezondheidswinst geeft.
- Informeer vrouwen in de overgang met overgewicht of obesitas dat meer bewegen mogelijk een gunstig effect heeft op de kwaliteit van leven.
- Informeer vrouwen in de overgang met overgewicht of obesitas dat er momenteel geen studies bekend zijn, die het effect van een leefstijlinterventie op overgangsklachten hebben onderzocht.
- Wijs vrouwen in de overgang met overgewicht of obesitas met overgangsklachten er op dat er geen specifiekere adviezen voor leefstijl zijn dan voor vrouwen met overgewicht en obesitas die geen overgangsklachten hebben.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is literatuuronderzoek verricht naar het effect van een GLI, voeding- of beweeginterventie op gewichtsverlies, kwaliteit van leven en overgangssymptomen in peri-menopauzale vrouwen met overgewicht of obesitas.
Studies met gewichtsverlies als cruciale uitkomstmaat.
Op basis van de literatuur kan geconcludeerd worden dat een GLI, voedings- of beweeginterventie waarschijnlijk tot gewichtsreductie leidt in peri-menopauzale vrouwen met overgewicht of obesitas. De bewijskracht hiervoor is beoordeeld als matig.
Studies met kwaliteit van leven als uitkomstmaat
Voor de belangrijke uitkomstmaat kwaliteit van leven is de bewijskracht beoordeeld als zeer laag, waardoor deze geen richting kan geven aan de besluitvorming. Het blijft onduidelijk of een beweeginterventie bij peri-menopauzale vrouwen met overgewicht en obesitas resulteert in een betere kwaliteit van leven.
In de NVOG Richtlijn Management rondom menopauze uit 2018 werd daarentegen de aanbeveling gedaan dat zowel een gezond voedingspatroon als meer bewegen een gunstige invloed zouden kunnen hebben op de kwaliteit van leven. Een gezond voedingspatroon zou mogelijk ook minder klachten van nachtzweten geven.
Studies met overgangsklachten als uitkomstmaat
Er zijn geen studies gevonden die hebben gekeken naar het effect van een GLI, voeding of beweeginterventie op specifiek overgangsklachten.
In eerdere studies is een relatie beschreven tussen het hebben van overgewicht of obesitas en hinderlijke overgangsklachten. Met name is er een verband gezien tussen opvliegers overdag en overgewicht (Saccomani, 2017). Er lijkt minder een verband tussen overgewicht en nachtzweten. Het lijkt dus aannemelijk dat gewichtsreductie ook minder klachten zou geven van met name opvliegers overdag.
Er is weinig bekend in de literatuur over voeding en effect op opvliegers en nachtzweten bij perimenopauzale vrouwen. De WHEL (Women's Healthy Eating an Living) study toonde aan dat bij premenopauzale vrouwen met borstkanker en Tamoxifen gebruik, er een verbetering was op deze klachten bij vrouwen met een vezelrijke voeding en een sterk sociaal netwerk (Gold, 2006). Meer studies over voeding en opvliegers en nachtzweten zijn er helaas niet.
Hormoontherapie
Hormoontherapie (HST) is de meest effectieve behandeling van opvliegers en nachtzweten, maar dient goed afgewogen te worden ten opzichte van de ziektelast. Het gevolg van opvliegers en nachtzweten is dat er spraken is van verstoorde slaap. Het is bekend dat verstoorde slaap een in standhoudende factor is voor obesitas en bij vrouwen kan leiden een verhoogd risico op comorbiditeit zoals onder andere diabetes mellitus type 2, hypertensie, dyslipidemie. Zij hebben ook een verhoogd risico op borstkanker, hart- en vaatzieken en trombose door gewichtsreductie kunnen deze risicofactoren worden verminderd (Lambrinoudaki, 2010). Het is echter onbekend in hoeverre behandeling van overgangsklachten, zoals hormoontherapie of andere therapieën, een gunstig effect heeft op gewicht of andere relevante uitkomstmaten (zie module ‘Uitkomstmaten’).
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Vanuit het algemene gezondheidsperspectief is een gezond gewicht voor vrouwen in de postmenopauze van belang. Met name vanwege het risico op hart- en vaatziekten en diabetes. Dus er lijkt gezondheidswinst op langere termijn te verwachten door gewichtsreductie.
Kosten (middelenbeslag)
Het is aannemelijk dat gewichtsreductie, net zo als in andere situaties waarbij sprake is van overgewicht, en daarmee gepaard gaande gezondheidsverbetering en verbetering op uitkomstmaten (zie module ‘Uitkomstmaten’) op langere termijn een vermindering van zorgkosten oplevert.
Aanvaardbaarheid, haalbaarheid en implementatie
Na afvallen blijkt het behoud van het gewicht de grootste uitdaging voor veel vrouwen. In de andere modules is aangetoond dat sterke calorierestrictie leidt tot vertraging van de stofwisseling. De werkgroep acht de haalbaarheid van sommige voeding interventies met sterke calorierestrictie dan ook niet haalbaar op lange termijn en beveelt daarom alleen een gezond eetpatroon aan zonder sterke calorierestrictie.
Verder ziet de werkgroep geen belemmeringen om een gezond eetpatroon of beweegpatroon aan te bevelen bij deze groep vrouwen. De werkgroep verwijst naar de modules ‘Gecombineerde Leefstijlinterventie’, ‘Voeding en dieetbehandeing’ en ‘Beweging’ voor de specifieke behandeling.
Wel of geen leefstijlinterventie adviseren?
De genoemde leefstijlinterventies zijn veilig en hebben geen nadelige effecten. In de praktijk blijkt dat mensen een interventie op langere termijn niet op eigen kracht volhouden. Begeleiding zou dus zinvol kunnen zijn, temeer daar overgangsklachten vaak langer duren, daarbij is er behoefte aan langere follow up.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Er zijn geen studies gevonden die hebben gekeken naar het effect van een GLI, voeding of beweeginterventie op overgangsklachten. Wel is aangetoond dat gewichtsreductie te bereiken is met een gezonder voedingspatroon en met meer bewegen. Daarnaast zijn gezonde voeding en beweging een belangrijk onderdeel van een gezonde leefstijl naast slaap en ontspanning, maar zijn er geen andere adviezen voor voeding en leefstijl dan voor vrouwen met overgewicht en obesitas die geen overgangsklachten hebben.
Na afvallen blijkt het behoud van het gewicht de grootste uitdaging voor veel vrouwen. In de andere modules is aangetoond dat sterke calorierestrictie leidt tot vertraging van de stofwisseling. De werkgroep acht de haalbaarheid van sommige voeding interventies met sterke calorierestrictie dan ook niet haalbaar op lange termijn en beveelt daarom alleen een gezond eetpatroon aan zonder sterke calorierestrictie.
Onderbouwing
Achtergrond
Een derde van de vrouwen in de overgang ervaart hinderlijke overgangsklachten die gedurende 5 jaar na menopauze kunnen aanhouden. Deze klachten kunnen de kwaliteit van leven verminderen door de slaap te verstoren en angst en depressie te verergeren (Huang, 2010). Verschillende studies suggereren dat vrouwen met een hoger BMI vaker menopauzale klachten ervaren dan vrouwen met een lager BMI (Whiteman, 2003; Gold, 2004; Wilbur 1998). De vraag is welke expliciete (leefstijl) adviezen van nut zijn bij de behandeling van deze klachten bij deze groep vrouwen die zich melden bij een zorgverlener. Ons doel is om aan te tonen welke voeding en leefstijl interventies effectief zijn in de behandeling van overgewicht bij vrouwen in de overgang. Inzicht hierin maakt het makkelijker om deze specifieke groep te overtuigen en te motiveren deze adviezen daadwerkelijk toe te passen.
Introduction
A third of menopausal women experience cumbersome menopausal symptoms that can persist for 5 years post-menopause. These symptoms can reduce quality of life by disrupting sleep and exacerbating anxiety and depression (Huang, 2010). Several studies suggest that women with a higher BMI experience more menopausal symptoms compared to women with a lower BMI (Whiteman, 2003; Gold, 2004; Wilbur 1998).The question is which explicit (lifestyle) advice is useful in the treatment of menopausal symptoms in this group of women who report to a healthcare provider. Our aim is to demonstrate which diet and lifestyle interventions are effective in the treatment of overweight in menopausal women. Insight into these treatment options makes it easier to convince and motivate this specific group to follow given advice.
Conclusies
|
Moderate GRADE |
Weight
A lifestyle intervention, diet intervention, or exercise intervention may reduce weight in peri- and postmenopausal women with overweight and obesity compared to another diet or exercise intervention, usual care, or no treatment.
Sources: Cheng, 2018; Borkoles; 2016; de Roon, 2017; Seimon 2019; Seimon, 2020. |
|
Very low GRADE |
Quality of life
It is unclear if an aerobic exercise intervention may improve quality of life compared to another exercise intervention in peri- and postmenopausal women with overweight and obesity
Sources: Courneya, 2017 |
|
No GRADE |
Menopausal symptoms
There are no studies available that assessed the effectiveness of a combined lifestyle intervention, diet intervention, or exercise intervention in peri- and postmenopausal women with overweight and obesity compared to another diet or exercise intervention, usual care, or no treatment.
|
Samenvatting literatuur
Description of studies
Cheng (2018) conducted a systematic review and meta-analysis examining the effects of dietary and exercise interventions on weight loss in overweight/obese peri- and postmenopausal women. Cheng (2018) covers the literature until December (2016) and searches were conducted in Medline, Central, Embase, and Google Scholar. Cheng (2018) included RCTs or prospective studies with participants who were overweight or obese peri- and postmenopausal women (overweight, BMI ≥25.0 kg/m2; obese, BMI ≥30.0 kg/m2), and compared the effects of diet and exercise, or the effects of diet or exercise alone, on body composition profile. In total, 11 studies were included, of which 8 were RCTs and 3 were prospective longitudinal studies. A total of 1317 overweight or obese peri- and postmenopausal women were included. Article quality was assessed according to the criteria specified in the Cochrane Handbook for Systematic Reviews, by categorizing generation of allocation sequence (selection bias), allocation concealment (selection bias), blinding of participants and personal (performance bias), blinding and completeness of outcome data as adequate (detection bias), incomplete outcome data (attrition bias), and selective reporting (reporting bias). Outcome measures were different in mean of change in body weight from baseline to after intervention between dietary versus control group, exercise versus control group and dietary plus exercise versus dietary group. Only RCTs were included
Courneya (2017) conducted an RCT examining the dose-response effects of aerobic exercise on quality of life in postmenopausal women. Included were postmenopausal women aged 50-74 years, BMI between 22 and 40 kg/m2, non-smoker, and inactive (defined as <90 min/week of exercise). Participants were randomized to a year-long exercise intervention consisting of either a moderate volume of aerobic exercise based on 100% of the minimum public health guideline of 150 min/week (moderate group) or a high volume of aerobic exercise based on double (200%) the minimum public health guideline of 300 min/week (high group). In total, 400 women were included, of whom 200 women (58% <60 years of age; 61% BMI <30 kg/m2) were allocated to the moderate group min/week) and 200 women (62% <60 years of age; 62% BMI <30 kg/m2) were allocated to the high group. Outcomes were QoL assessed at baseline and 1 year using the short form-36 health survey.
De Roon (2017) conducted an RCT examining the long-term effects of a weight loss intervention with or without an exercise component on body weight and physical activity. Included were women aged 50–69 years, postmenopausal, overweight or obese (BMI 25–35 kg/m2), and insufficiently physically active (≥2 h/week of ≥4 metabolic equivalents activity). Participants were randomized to diet or exercise for 16 weeks. In total, 195 participants were included of whom 97 participants (mean age 59±4.9 years; BMI 29.0±2.9 kg/m2; weight 80±9.0 kg) were allocated to the diet group and 98 participants (mean age 61±4.6 years; BMI 29.5±2.6 kg/m2; weight 80±8.6 kg) were allocated to the exercise group. During the intervention, both groups had achieved the set goal of 5–6 kg weight loss. All women were re-contacted twelve months after study cessation for follow-up where changes in body weight were measured. Outcomes were bodyweight levels at follow up compared to baseline and at end of study
Seimon (2019) conducted an RCT comparing the long-term effects of weight loss via severe versus moderate energy restriction on lean mass and other aspects of body composition. Included were postmenopausal women aged 45 to 65 years with BMI from 30 to 40 kg/m2, at least 5 years after menopause, and with less than 3 hours of structured physical activity per week (ie, sedentary). Participants were randomized to either 12 months of moderate (25%-35%) energy restriction with a food-based diet (moderate intervention) or 4 months of severe (65%-75%) energy restriction with a total meal replacement diet followed by moderate energy restriction for an additional 8 months (severe intervention). Both interventions had a prescribed protein intake of 1.0g/kg of actual body weight per day, and physical activity was encouraged but not supervised. In total, 101 participants were randomized of whom 51 participants (mean age 58.0±4.2; mean BMI 34.6±2.5 kg/m2; mean weight 92.4±8.3 kg) were allocated to the moderate intervention and 50 participants (mean age 58.0±4.4; mean BMI 34.3±2.5 kg/m2; mean weight 90.1±9.4 kg) were allocated to the severe intervention. The primary outcome was whole-body lean mass at 12 months after commencement of intervention. Secondary outcomes were body weight, thigh muscle area and muscle function (strength), bone mineral density, and fat mass and distribution, measured at 6, and 12 months.
Seimon (2020) reported 3 year follow-up outcomes in 72 of the 101 randomized participants. Outcomes were body composition outcomes for the TEMPO Diet Trial 24- and 36-month.
Results
Weight
Cheng (2018) reported on the outcome measure weight change in studies. In their meta-analysis they included five studies (Bouchard, 2009; Foster-Schubert, 2012; Garcia-Unciti, 2012; Svendsen, 1993; van Gemert 2015) that reported on the difference in mean of change in body weight from baseline to after intervention between dietary versus control group. Cheng (2018) found that the mean difference was -6.55 kg (95% CI -9.60 to -3.50; figure 1) in favour of the dietary group. This is a clinically relevant difference.
They conducted a second meta-analysis in which they included three studies (Bouchard, 2009; Foster-Schubert, 2012; van Gemert 2015) that reported on the difference in mean of change in body weight from baseline to after intervention between exercise versus control group. They found that the mean difference was -3.49 kg (95% CI -6.96 to -0.02; figure 1) in favour of the exercise group. This is a clinically relevant difference.
Finally, they conducted a third meta-analysis in which they included 7 studies (Bouchard, 2009; Bochu, 2009; Figueroa, 2013a; Figueroa, 2013b; Foster-Schubert, 2012; Garcia-Unciti, 2012; Svendsen, 1993) that reported on the difference in mean of change in body weight from baseline to after intervention between dietary plus exercise versus dietary group. They found that the mean difference was -2.48 kg (95% CI -5.13 to 0.16; figure 11.1) but this is not a clinically relevant difference.
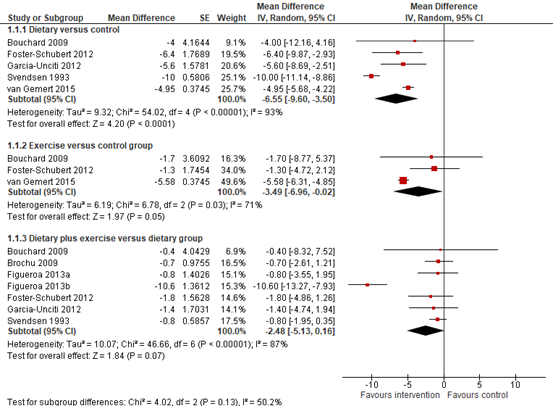
Figure 11.1. Forest plot showing the effects of dietary and exercise interventions on weight loss. Pooled mean difference, random effects model.
de Roon (2017) found that after the 16-week intervention the exercise group showed a mean weight change of −4.3 kg (95% CI −4.9 to−3.7) compared to baseline, and diet group showed a mean weight change of −3.4 kg (95% CI −4.1 to−2.6). The mean difference was −0.90 kg (−1.81 to 0.01). At follow-up the exercise group regained 1.3 kg of lost weight and the diet group regained 1.5 kg of lost weight. The mean difference was -0.20 kg (95% CI -1.18 to 0.78).
Seimon (2019) measured weight change at 6 and 12 months in the severe and moderate group. They found that mean weight at 6 months was -17.8 kg (95% -19.7 to -15.9) in the severe group and -8.5 kg (-10.5 to -6.6) in the moderate group. The mean difference was -9.30 kg (95% CI -11.98 to -6.62) in favour of the severe group. At 12 months, the mean weight was -15.3 kg (95% CI -18.1 to -12.5) in the severe group and -8.4 kg (-11.4 to -5.4 kg) in the moderate group. The mean difference was -6.90 kg (95% CI -10.88 to -2.92) in favour of the severe group. This is a clinically relevant difference.
Seimon (2020) reported outcomes on weight change at 24 and 36 months in the severe and moderate group. They found that mean weight at 12 months was -10.0 kg (95% -13.3 to -6.6) in the severe group and -6.0 kg (-9.7 to -2.4) in the moderate group. The mean difference was -4.00 kg (95% CI -8.79 to 0.79) in favour of the severe group. At 24 months, the mean weight was -8.0 kg (95% -11.7 to -4.4) in the severe group and -4.9 kg (-8.9 to -0.9) in the moderate group. The mean difference was -3.10 kg (95% CI -8.35 to 2.15) in favour of the severe group. This is a clinically relevant difference.
Quality of life
Courneya (2017) used the SF-36 questionnaire to assess quality of life. Scores for each health domain ranged from 0 to 100 with higher scores indicating higher function or well-being. They found that for mean change in physical health components score compared to baseline was -1.5 (-2.7 to -0.3) in the high group compared to -1.5 ( 95% CI -2.7 to -0.3) in the moderate group. The mean difference was 0.0 (95% CI -1.6 to 1.6). The mean change in mental health components score compared to baseline was 0.8 (-0.6 to 2.2) in the high group compared to -0.4 ( 95% CI -1.8 to 0.9) in the moderate group. The mean difference was 1.2 (95% CI -0.6 to 3.1) in favour of the high group. This is not a clinically relevant difference
Menopausal symptoms
There are no studies available that assessed the effectiveness on menopausal symptoms of a combined lifestyle intervention (CLI), diet intervention, or exercise intervention in pre- and postmenopausal women with overweight and obesity compared to another diet or exercise intervention, usual care, or no specific lifestyle or diet intervention.
Level of evidence of the literature
The level of evidence regarding the outcome measure weight comes from randomized controlled trials and therefore starts high. The level of evidence was downgraded by one level because 95% confidence intervals crossing the border for clinical relevance (imprecision).
The level of evidence regarding the outcome measure quality of live comes from randomized controlled trials and therefore starts high. The level of evidence was downgraded by three levels because only one study reported the outcome and because 95% confidence intervals crossing the border for clinical relevance (imprecision; -2), and due to inadequate blinding of participants (risk of bias; -1).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question: What is the effectiveness of a GLI, diet or exercise in peri- and postmenopausal women with overweight and obesity?
P: Peri- and postmenopausal women with overweight or obesity and without hormone therapy.
I: CLI, dietary intervention, exercise intervention.
C: Comparison of diet/exercise, usual care or no treatment.
O: Weight, quality of life, menopausal symptoms.
Relevant outcome measures
The guideline development group considered weight as the main outcome measure for decision making; and quality of life and menopausal symptoms as an important additional outcome measure for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The guideline development group defined a 5% weight loss (or an absolute weight loss of three kilograms) and [a 10-point improvement on the Short Form 36 in] quality of life as a clinically (for the patient) important difference (Brigden, 2018).
Search and select (Methods)
Since we expected an overwhelming amount of studies to be available on this topic, we decided to perform two different literature searches. At first we searched for systematic reviews and after this we performed an additional search to supplement the selected review(s) with RCT’s that were published after the search date of the selected review(s).
- Search 1: systematic reviews
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from 1 January 2010 until 16 March 2021. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 99 hits. Studies were selected based on the following criteria: systematic reviews focusing on the effectiveness of a combined lifestyle intervention (CLI), diet intervention, or exercise intervention in peri- and postmenopausal women with overweight and obesity compared to another diet or exercise intervention, usual care, or no treatment. 5 studies were initially selected based on title and abstract screening. After reading the full text, 4 studies were excluded (see the table with reasons for exclusion under the tab Methods), and 1 study was included (Chen, 2018).
- Search 2: RCTs
Chen (2018) searched several from databases until 31 December 2016. Therefore, we performed an additional search on RCTs in the databases Medline (via OVID) and Embase (via Embase.com) with relevant search terms between 1 January 2016 and 16 March 2021. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 315 hits. Studies were selected based on the following criteria: RCT’s focusing on the effectiveness of a combined lifestyle intervention (CLI), diet or excercise in peri- and postmenopausal women with overweight and obesity compared to another diet or exercise, usual care or no treatment. 24 studies were initially selected based on title and abstract screening. After reading the full text, 20 studies were excluded (see the table with reasons for exclusion under the tab Methods), and four studies were included (Courneya, 2017; de Roon, 2017; Seimon, 2019; Seimon, 2020).
Results
A total of Seven studies were found. (Cheng, 2018; Borkoles, 2016; Courneya, 2017; de Roon, 2017; Mason, 2019; Seimon, 2019; Seimon, 2020). These were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Cheng, C. C., Hsu, C. Y., & Liu, J. F. (2018). Effects of dietary and exercise intervention on weight loss and body composition in obese postmenopausal women: a systematic review and meta-analysis. Menopause, 25(7), 772-782.
- Courneya, K. S., McNeil, J., O'Reilly, R., Morielli, A. R., & Friedenreich, C. M. (2017). Dose-response effects of aerobic exercise on quality of life in postmenopausal women: Results from the Breast Cancer and Exercise Trial in Alberta (BETA). Annals of Behavioral Medicine, 51(3), 356-364.
- de Roon, M., van Gemert, W. A., Peeters, P. H., Schuit, A. J., & Monninkhof, E. M. (2017). Long-term effects of a weight loss intervention with or without exercise component in postmenopausal women: A randomized trial. Preventive medicine reports, 5, 118-123.
- Gold, E. B., Flatt, S. W., Pierce, J. P., Bardwell, W. A., Hajek, R. A., Newman, V. A., Rock, C. L., & Stefanick, M. L. (2006). Dietary factors and vasomotor symptoms in breast cancer survivors: the WHEL Study. Menopause (New York, N.Y.), 13(3), 423433.
- Huang, A. J., Subak, L. L., Wing, R., West, D. S., Hernandez, A. L., Macer, J., & Grady, D. (2010). An intensive behavioral weight loss intervention and hot flushes in women. Archives of internal medicine, 170(13), 1161-1167.
- Lambrinoudaki, I., Brincat, M., Erel, C. T., Gambacciani, M., Moen, M. H., Schenck-Gustafsson, K., ... & Rozenberg, S. (2010). EMAS position statement: managing obese postmenopausal women. Maturitas, 66(3), 323-326.
- Saccomani, S., Lui-Filho, J. F., Juliato, C. R., Gabiatti, J. R., Pedro, A. O., & Costa-Paiva, L. (2017). Does obesity increase the risk of hot flashes among midlife women?: a population-based study. Menopause, 24(9), 1065-1070.
- Seimon, R. V., Wild-Taylor, A. L., Keating, S. E., McClintock, S., Harper, C., Gibson, A. A., ... & Sainsbury, A. (2019). Effect of weight loss via severe vs moderate energy restriction on lean mass and body composition among postmenopausal women with obesity: the TEMPO diet randomized clinical trial. JAMA network open, 2(10), e1913733-e1913733.
- Seimon, R. V., Wild-Taylor, A. L., McClintock, S., Harper, C., Gibson, A. A., Johnson, N. A., ... & Sainsbury, A. (2020). 3-Year effect of weight loss via severe versus moderate energy restriction on body composition among postmenopausal women with obesity-the TEMPO Diet Trial. Heliyon, 6(6), e04007.
- Whiteman, M. K., Staropoli, C. A., Langenberg, P. W., McCarter, R. J., Kjerulff, K. H., & Flaws, J. A. (2003). Smoking, body mass, and hot flashes in midlife women. Obstetrics & Gynecology, 101(2), 264-272.
- Wilbur, J., Miller, A. M., Montgomery, A., & Chandler, P. (1998). Sociodemographic characteristics, biological factors, and symptom reporting in midlife women. Menopause (New York, NY), 5(1), 43-51.
Evidence tabellen
Evidence tables
Evidence table for systematic review of RCTs and observational studies (intervention studies)
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Cheng, 2018
|
SR and meta-analysis of RCTs longitudinal observational studies. Only RCTs are included in this module
Literature search until 31 December 2016
A: van Gemert, 2015 B: Figueroa, 2013a C: Figueroa, 2013b D: Foster-Schubert,2012 E: Garcia-Unciti, 2012 F: Bouchard, 2009 G: Brochu, 2009 H: Svendsen, 1993
Study design: RCT (A-H)
Setting and Country: A: Netherlands B: USA C: USA D: USA E: Spain F: Canada G: Canada H: Denmark
Source of funding and conflicts of interest: No funding received and no conflicts of interest reported
|
Inclusion criteria SR: Inclusion criteria for the systematic review were (1) randomized controlled trials (RCTs) or prospective studies with participants who were overweight or obese peri- and postmenopausal women (overweight, BMI >25.0 kg/m2; obese, BMI >30.0 kg/m2); (2) compared the effects of diet and exercise, or the effects of diet or exercise alone, on body composition profile.
Exclusion criteria SR: Exclusion criteria were (1) non-RCTs (eg, retrospective or cohort studies, case reports, letters, comments, editorials, seminar proceedings, or personal communication); (2) participants had chronic diseases (other than chronic obesity); (3) intervention was through online social networks, Internet-based or Webbased weight reduction educational programs; (4) no quantitative primary or secondary outcome data.
8 RCTs included in meta-analysis
Important patient characteristics at baseline:
n Control/n Intervention A: 48/97 B: 13/14 C: 13/14 D: 87/118 E: 9/12 F: 12/12 G: 71/36 H: 21/51
Groups comparable at baseline? Yes |
Describe intervention A: Dietary program or aerobic exercise program B: dietary program only and low-intensity resistance exercise training C: dietary program only and low-intensity resistance exercise training D: Dietary program or aerobic exercise program or Dietary program and aerobic exercise program E: Dietary program or resistance training program; F: Dietary program and resistance training program; G: Dietary program and resistance training program H: Dietary program or Dietary program and aerobic exercise and resistance training program
|
Describe control A: Usual care B: dietary program only or low-intensity resistance exercise training C: Usual care D: Usual care E: Usual care F: Usual care G: dietary program with calory restriction only H: Usual care
|
End-point of follow-up A: 16 weeks B: 12 weeks C: 12 weeks D: 1 year E: 16 weeks F: 3 months G: 6 months H: 12 weeks
For how many participants were no complete outcome data available? (intervention/control) A-H: not described in SR
|
Outcome
Dietary versus control group
Change in body weight; MD (95% CI) -6.55 kg (-9.60 to -3.50)
Exercise versus control group
Change in body weight; MD (95% CI) -3.49 kg (-6.96 to -0.02)
dietary plus exercise versus dietary group
Change in body weight; MD (95% CI) -2.48 kg (-5.13 to 0.16) |
Facultative: The authors conclude that dietary interventions reduced body weight and body composition profile parameters in peri- and postmenopausal women more than exercise alone. The addition of exercise reinforced the effect of dietary interventions on changing body weight and composition
|
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])1
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Courneya, 2017 |
Type of study: Parallel group, randomised controlled trial
Setting and country: Canada
Funding and conflicts of interest: The study received non-commercial funding
Authors have no financial or other conflicts of interest. |
Inclusion criteria: between the ages of 50 and 74 years, a body mass index (BMI) between 22 and 40 kg/m2, a non-smoker, able to do unrestricted physical activity as assessed by physician screening, and inactive (defined as <90 min/week of exercise or if between 90 and 120 min/week, having a VO2max <34 ml/kg/min as assessed by a submaximal fitness test).
Exclusion criteria: Not fulfilling inclusion criteria
N total at baseline: Total: 400 Intervention:200 Control: 200
Important prognostic factors2: Intervention/Control
Age >60 years; n (%) 84 (42)/76 (38)
BMI >30 kg/m2; n (%) 78 (39)/77 (39)
Presence of comorbidities; n (%) 138 (69)/133 (67)
Groups comparable at baseline? Yes
|
Describe intervention: Moderate volume of aerobic exercise based on 100% of the minimum public health guideline of 150 min/week. |
Describe control: High volume of aerobic exercise based on double (200%) the minimum public health guideline of 300 min/week. |
Length of follow-up: 12 months
Incomplete outcome data: Intervention Lost to follow-up (n=15; 7%)
Control Lost to follow-up (n=12; 6%)
|
Outcome measures and effect size
Mean change in physical health score; MD (95% CI) 0.0 (-1.6 to 1.6)
Mean change in mental health component score; MD (95% CI) 1.2 (95% CI -0.6 to 3.1)
|
The authors conclude that a higher volume of aerobic exercise, approximately double the minimum public health guideline, did not provide any additional QoL or psychosocial benefits in inactive postmenopausal women compared to the minimum public health guideline
RoB: Participants were stratified by center and BMI before being randomized in a 1:1 ratio using a random number program with blocks randomly sized between four and six within strata
|
|
De Roon, 2017 |
Type of study: Parallel group, randomised controlled trial
Setting and country: Netherlands
Funding and conflicts of interest: The study received non-commercial funding
Authors have no financial or other conflicts of interest. |
Inclusion criteria: aged 50–69 years, postmenopausal, overweight or obese (BMI 25–35 kg/m2), and insufficiently physically active (b2 h/week of ≥4 metabolic equivalents activity).
Exclusion criteria: smoking, use of exogenous (sex) hormones, diabetes, or ever diagnosed with breast cancer
N total at baseline: Total: 195 Intervention1:98 Intervention 2: 97
Important prognostic factors2: Intervention/Control
Age (mean ± SD), years 61± 4.6/59± 4.9
Weight (mean ± SD), kg: 80± 8.6/80± 9.0
Height (mean ± SD), cm 165± 6.0/166± 5.2
BMI (mean ± SD), kg/m2 29.5± 2.6/29.0± 2.9
Waist circumference (mean ± SD), cm 97.8± 7.5/97.5± 8.3
Groups comparable at baseline? Yes
|
Describe intervention: 16-week diet-induced weight loss group (‘diet Group. Women were prescribed a diet with a deficit of 3500 kcal/week
|
Describe control: weight loss mainly induced by exercise. Women followed an intensive four hour/week exercise program; two one-hour group sessions of combined strength and endurance training at the physiotherapy centre and two one-hour sessions of moderate-to-vigorous Nordic walking per week. The average energy expenditure by exercise was approximately 2530 kcal/week. These women were also prescribed a relatively small caloric intake restriction of 1750 kcal/week. The total targeted weekly energy deficit was, therefore, approximately 4280 kcal/week
|
Length of follow-up: 12 months
Incomplete outcome data: Intervention: Lost to follow-up (n=12; 12%)
Control: Lost to follow-up (n=9; 9%)
|
Outcome measures and effect size
Mean change in physical health score; MD (95% CI) 0.0 (-1.6 to 1.6)
Mean change in mental health component score; MD (95% CI) 1.2 (95% CI -0.6 to 3.1)
|
The authors conclude that this study shows largely sustained weight loss one year after completing a 16-week weight loss program by a hypocaloric diet only or mainly exercise in overweight and obese postmenopausal women with an inactive lifestyle. Maintenance of weight loss at follow-up did not differ between taking part in the exercise or diet group.
RoB: Women were stratified for municipality randomized by computer. Unclear if this trial was blinded |
|
Seimon, 2019 |
Type of study: Parallel group, randomised controlled trial
Setting and country: Netherlands
Funding and conflicts of interest: The study received non-commercial funding
Authors have no financial or other conflicts of interest. |
Inclusion criteria: postmenopausal women aged 45 to 65 years with body mass index (calculated as weight in kilograms divided by height in meters squared) from 30 to 40, at least 5 years after menopause, with less than 3 hours of structured physical activity per week (ie, sedentary)
Exclusion criteria: Not fulfilling inclusion criteria
N total at baseline: Total: 101 Intervention:51 Control: 50
Important prognostic factors2: Intervention/Control
Age (mean ± SD), years 58.0±4.4/58.0±4.2
Weight (mean ± SD), kg: 90.1±9.4/92.4±8.3
Height (mean ± SD), cm 1.62±0.06/1.63±0.05
BMI (mean ± SD), kg/m2 34.3±2.5/34.6±2.5
Waist circumference (mean ± SD), cm 108.3±7.3/108.8±7.0
Groups comparable at baseline? Yes
|
Describe intervention: severe intervention involved a severe energy restriction of 65%to 75%relative to estimated energy expenditure for 4 months (16 weeks) or until a body mass index of no lower than 20 was reached, whichever came first. This was achieved using a total meal replacement diet (KicStart meal replacement shakes and soups from Prima Health Solutions) supplemented with a whey protein isolate (Beneprotein; Nestlé HealthCare Nutrition) to achieve the prescribed protein target. This was followed by moderate energy restriction (ie, the moderate intervention) for the remaining period to 12 months (52 weeks).
|
Describe control: moderate intervention involved a moderate energy restriction of 25%to 35%relative to estimated energy expenditure for a total of 12 months (52 weeks). This was achieved using a food based diet, with recommendations based on the Australian Guide to Healthy Eating
|
Length of follow-up: 12 months
Incomplete outcome data: Intervention: Lost to follow-up (n=12; 24%)
Control: Lost to follow-up (n=4; 8%)
|
Outcome measures and effect size
Mean change in weight loss at 6 months; MD (95% CI) -9.30 kg (-11.98 to -6.62)
Mean change in weight loss at 12 months; MD (95% CI) -6.90 kg (-10.88 to -2.92)
|
The authors conclude that severe energy restriction with a total meal replacement diet in postmenopausal women with obesity induced greater weight loss and approximately 1.5-fold as much loss of whole-body lean mass and thigh muscle area compared with moderate energy restriction over 12 months
RoB: Participants were randomized using stratified permuted block randomization. Individuals in each of the 4 stratified groups were then randomized in blocks of 2 and with a 1:1 ratio into 1 of 2 interventions. Randomization was undertaken by 1 investigator who had no contact with participants before randomization and was not involved in implementing the interventions. None of the investigators who undertook screening or clinical testing were aware of the method used for randomization, and were not able to predict which intervention a particular participant would be randomized to. |
|
Seimon, 2020 |
Type of study: Parallel group, randomised controlled trial
Setting and country: Netherlands
Funding and conflicts of interest: The study received non-commercial funding
Authors have no financial or other conflicts of interest. |
Inclusion criteria: postmenopausal women aged 45 to 65 years with body mass index (calculated as weight in kilograms divided by height in meters squared) from 30 to 40, at least 5 years after menopause, with less than 3 hours of structured physical activity per week (ie, sedentary)
Exclusion criteria: Not fulfilling inclusion criteria
N total at baseline: Total: 101 Intervention:51 Control: 50
Important prognostic factors2: Intervention/Control
Age (mean ± SD), years 58.0±4.4/58.0±4.2
Weight (mean ± SD), kg: 90.1±9.4/92.4±8.3
Height (mean ± SD), cm 1.62±0.06/1.63±0.05
BMI (mean ± SD), kg/m2 34.3±2.5/34.6±2.5
Waist circumference (mean ± SD), cm 108.3±7.3/108.8±7.0
Groups comparable at baseline? Yes
|
Describe intervention: severe intervention involved a severe energy restriction of 65%to 75%relative to estimated energy expenditure for 4 months (16 weeks) or until a body mass index of no lower than 20 was reached, whichever came first. This was achieved using a total meal replacement diet (KicStart meal replacement shakes and soups from Prima Health Solutions) supplemented with a whey protein isolate (Beneprotein; Nestlé HealthCare Nutrition) to achieve the prescribed protein target. This was followed by moderate energy restriction (ie, the moderate intervention) for the remaining period to 12 months (52 weeks).
|
Describe control: moderate intervention involved a moderate energy restriction of 25%to 35%relative to estimated energy expenditure for a total of 12 months (52 weeks). This was achieved using a food based diet, with recommendations based on the Australian Guide to Healthy Eating
|
Length of follow-up: 36 months
Incomplete outcome data: Intervention: Lost to follow-up (n=12; 24%)
Control: Lost to follow-up (n=4; 8%)
|
Outcome measures and effect size
Mean change in weight loss at 24 months; MD (95% CI) -4.00 kg (-8.79 to 0.79)
Mean change in weight loss at 36 months; MD (95% CI) -3.10 kg (-8.35 to 2.15) |
The authors conclude that severe energy restriction is more effective than moderate energy restriction for reducing weight and adiposity in postmenopausal women in the long term (3 years)
RoB: Participants were randomized using stratified permuted block randomization. Individuals in each of the 4 stratified groups were then randomized in blocks of 2 and with a 1:1 ratio into 1 of 2 interventions. Randomization was undertaken by 1 investigator who had no contact with participants before randomization and was not involved in implementing the interventions. None of the investigators who undertook screening or clinical testing were aware of the method used for randomization, and were not able to predict which intervention a particular participant would be randomized to. |
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Risk of bias table for systematic reviews of RCTs and observational studies.
|
|
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Cheng, 2018 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Yes |
Unclear1 |
1 Potential conflicts of interest are not reported for the individual studies.
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Courneya, 2017 |
Participants were stratified by center and BMI before being randomized in a 1:1 ratio using a random number program with blocks randomly sized between four and six within strata.
|
The study coordinator in Calgary, who was blinded to the randomization sequence, revealed the randomization from sealed opaque envelopes after all baseline assessments were completed. |
Likely Patients were aware of their treatment allocation |
Likely Care providers were aware of their treatment allocation |
Unclear Not mentioned if outcome assessor was and remained blinded to treatment allocation. |
Unlikely All relevant outcomes were reported |
Unlikely There is limited loss to follow-up. Loss to follow-up is equal between groups |
Unlikely intention-to-treat analyses was used that included all participants with 12-month follow-up data (complete case analysis) regardless of their protocol adherence |
|
De Roon, 2017 |
women were stratified for municipality randomized by computer |
Unclear
It is unclear if participants or the lead researcher was blinded. |
Unclear
It is unclear if participants or the lead researcher was blinded. |
Likely It was a delayed start control group. All participants received the same intervention. |
Unclear Not mentioned if outcome assessor was and remained blinded to treatment allocation. |
Unlikely All relevant outcomes were reported |
Unlikely There is limited loss to follow-up. Loss to follow-up is equal between groups |
Unlikely, Data analysis was performed according to intention-to-treat principle. |
|
Seimon, 2019 |
Participants were randomized using stratified permuted block randomization. Individuals in each of the 4 stratified groups were then randomized in blocks of 2 and with a 1:1 ratio into 1 of 2 interventions.
|
Unlikely
Randomization was undertaken by 1 investigator who had no contact with participants before randomization and was not involved in implementing the interventions.
|
Unclear
It is unclear if participants or the lead researcher was blinded |
Unlikely/unclear
None of the investigators who undertook screening or clinical testing were aware of the method used for randomization, and were not able to predict which intervention a particular participant would be randomized to. It is ,however, unclear if care providers remained blinded after randomization. |
Unlikely/unclear
None of the investigators who undertook screening or clinical testing were aware of the method used for randomization, and were not able to predict which intervention a particular participant would be randomized to. It is ,however, unclear if outcome assessors remained blinded after randomization. |
Unlikely All relevant outcomes were reported and the trial was registered in theAustralian New Zealand Clinical Trials Registry Reference Number: 12612000651886,
|
Likely,There is ore 3x more loss to follow-up in the intervention group. |
Unlikely To compare longitudinal changes between groups, intention-to-treat analysis was performed using data from all participants originally randomized, using random-effects linear mixed models. |
|
Seimon, 2020 |
Participants were randomized using stratified permuted block randomization. Individuals in each of the 4 stratified groups were then randomized in blocks of 2 and with a 1:1 ratio into 1 of 2 interventions.
|
Unlikely
Randomization was undertaken by 1 investigator who had no contact with participants before randomization and was not involved in implementing the interventions.
|
Unclear
It is unclear if participants or the lead researcher was blinded |
Unlikely/unclear
None of the investigators who undertook screening or clinical testing were aware of the method used for randomization, and were not able to predict which intervention a particular participant would be randomized to. It is ,however, unclear if care providers remained blinded after randomization. |
Unlikely/unclear
None of the investigators who undertook screening or clinical testing were aware of the method used for randomization, and were not able to predict which intervention a particular participant would be randomized to. It is ,however, unclear if outcome assessors remained blinded after randomization. |
Unlikely All relevant outcomes were reported and the trial was registered in theAustralian New Zealand Clinical Trials Registry Reference Number: 12612000651886,
|
Likely,There is ore 3x more loss to follow-up in the intervention group. |
Unlikely To compare longitudinal changes between groups, intention-to-treat analysis was performed using data from all participants originally randomized, using random-effects linear mixed models. |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignment influences the process of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Jull, 2014 |
Wrong publication type (no meta-analysis) |
|
Colpani, 2018 |
P does not meet PICO |
|
Baker, 2016 |
Wrong publication type (no meta-analysis) |
|
Gao, 2016 |
Wrong publication type |
|
Witkowski, 2018 |
O does not meet PICO |
|
Huang, 2018 |
I does not meet PICO |
|
Blomquist, 2017 |
O does not meet PICO |
|
Wong, 2016 |
O does not meet PICO |
|
Blomquist, 2018 |
O does not meet PICO |
|
Lin, 2021 |
P does not meet PICO |
|
Van Gemert, 2016 |
O does not meet PICO |
|
Azadpour, 2017 |
P does not meet PICO |
|
Szczepanik, 2020 |
O does not meet PICO |
|
Evans, 2021 |
O does not meet PICO |
|
Grossman, 2018 |
Wrong study design |
|
Luo, 2019 |
I does not meet PICO |
|
Martinez, 2017 |
Wrong study design |
|
Khalfa, 2017 |
I does not meet PICO |
|
Farris, 2018 |
O does not meet PICO |
|
Seimon, 2018 |
Wrong study design (trial protocol) |
|
Bajerska, 2018 |
Wrong duration <6 months follow-up |
|
Kotopoulea-nikolaid, 2018 |
P does not meet PICO |
|
Dupuit, 2020 |
Wrong duration <6 months follow-up |
|
Hintze, 2018 |
P does not meet PICO |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 07-07-2023
Laatst geautoriseerd : 07-07-2023
Geplande herbeoordeling : 01-07-2027
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2027 bepalen Partnerschap Overgewicht Nederland (PON) en Care for Obesity/de Vrije Universiteit Amsterdam, of de modules van deze richtlijn nog actueel zijn. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden. De geldigheid van de richtlijnmodules komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn om een herzieningstraject te starten.
Het Partnerschap Overgewicht Nederland (PON) en Care for Obesity/de Vrije Universiteit Amsterdam (C4O/VU) zijn respectievelijk regiehouder van het volwassenendeel en het kinderdeel en van de richtlijn. Daarnaast zijn ze eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van hun deel van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd door de Vrije Universiteit Amsterdam en het Ministerie van Volksgezondheid, Welzijn en Sport. De financiers hebben geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Het doel van deze richtlijn is bij te dragen aan de verbetering van de ondersteuning en zorg voor volwassenen en kinderen met obesitas of overgewicht in combinatie met risicofactoren en/of comorbiditeit. Deze richtlijn is volgens Medische Specialistische Richtlijnen 2.0 tot stand gekomen, waarin de huidige stand van wetenschappelijke kennis en praktijkervaring aangaande het onderwerp is meegenomen.
De obesitasrichtlijn is ontwikkeld in samenwerking met veel partijen (zie samenstelling werkgroepen en klankbordgroepen) en is bedoeld voor de verschillende bij de ondersteuning en zorg voor obesitas of overgewicht in combinatie met risicofactoren en/of comorbiditeit betrokken beroepsgroepen.
Deze richtlijn gaat over de diagnostiek en behandeling van volwassenen en kinderen met obesitas of overgewicht in combinatie met risicofactoren en/of comorbiditeit. Het betreft hier zorggerelateerde preventie (VWS, 2021).
Deze richtlijn richt zich op de beste diagnostiek, ondersteuning en zorg voor volwassene en kinderen met obesitas, gebaseerd op de meest recente literatuur en expert-/practice-based adviezen. Daarnaast is deze richtlijn relevant voor de geïndiceerde preventie (VWS, 2021) van obesitas bij volwassenen en kinderen. Dit betreft volwassenen en kinderen met overgewicht zonder risicofactoren en/of comorbiditeit.
Hierbij moet worden opgemerkt dat het gezondheidsrisico van overgewicht en obesitas wordt bepaald aan de hand van de BMI in combinatie met wel of geen aanwezigheid van risicofactoren en/of comorbiditeit. De BMI is ingedeeld in categorieën. Echter, de afkappunten van die categorieën zijn niet voor alle groepen precies hetzelfde. De mate van vervetting van het lichaam bij een bepaalde BMI is afhankelijk van het geslacht (vrouwen hebben een hoger vetpercentage dan mannen), de leeftijd (oudere mensen hebben een hoger vetpercentage dan jongere) en de etniciteit (mensen uit Azië hebben een hoger vetpercentage dan Europeanen). Daarnaast kunnen mensen met een grote spiermassa zoals sporters en mensen die zwaar lichamelijk werk doen een lager gezondheidsrisico hebben dan van hun BMI afgeleid kan worden met de bestaande afkappunten. Dit is de reden dat naast de BMI ook de buikomvang van groot belang is bij de bepaling van het gezondheidsrisico bij volwassenen met overgewicht of obesitas (Wharton, 2020).
Doelgroep
Deze richtlijn is primair bedoeld voor de beroepsgroepen die betrokken zijn bij de diagnostiek, ondersteuning en zorg voor volwassenen en kinderen met obesitas of overgewicht in combinatie met risicofactoren en/of comorbiditeit.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2019 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van relevante specialismen die betrokken zijn bij de ondersteuning en zorg voor kinderen en volwassenen met obesitas of overgewicht in combinatie met risicofactoren en/of comorbiditeit.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Prof. dr. E.F.C. (Liesbeth) Van Rossum, PON, voorzitter
- W. (Wytse) Brongers, KNGF
- S.A. (Sione) Brugman, BLCN – tot februari 2023
- I. (Inge) Out, BLCN – vanaf februari 2023
- B. (Bernadette) Deenen, NVD
- K. (Karen) De Leest, KNMP
- Dr. K. (Karen) Freijer, PON
- E. (Ellen) Govers, NVD
- M. (Marc) Huls, NHG
- F. (Francoise) Langens, huisarts – tot februari 2021
- R.S.L. (Ronald) Liem, NVvH
- Dr. M. (Mattijs) Out, NIV
- E.M.J.N. (Evelyn) Sloots-Jongen, NIP
- N. (Nicolette) Slot, VvOCM
- I. (Inez) van den Anker, Stichting Over Gewicht (patiëntenorganisatie)
- J. (Jacqui) van Kemenade – van Vught, NHG
Klankbordgroep
- I.R.M. (Jurriaan) Blekemolen, NVAB
- Dr. G.J. (Gert-Jan) Braunstahl, NVALT
- D.O.A. (Darie) Daemers, KNOV
- D. (Dorenda) Dijken, NVOG
- S. (Sander) Galjaard, NVOG
- Prof. dr. A. (Annemieke) Hoek, NVOG
- M.M. (Maarten) Hoogbergen, NVPC
- Y.F.C. (Yvo) Kortmann, NVMDL
- P. (Patricia) Lottman, BLCN
- N. (Nienke) van der Putten, Hartstichting
- Dr. G.A.H. (Edgar) van Mil, NVK
- Dr. T.M. (Tessa) van Elten, Voedingscentrum
- Dr. M.E. (Janneke) Wittekoek, NVvC
Met ondersteuning van
- Dr. A.N. (Anh Nhi) Nguyen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. B. (Bart) Versteeg, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Overzicht van de belangen van werkgroepleden
|
Achternaam werkgroeplid |
Hoofdfunctie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Van Rossum (voorzitter) |
Internist-endocrinoloog/ hoogleraar Gezond Gewicht en biologisch stressonderzoek in het Erasmus MC |
-Voorzitter Partnerschap Overgewicht Nederland – onbetaald (met in dat kader extra werkzaamheden zoals: *vertegenwoordiger PON bij de tafel Overgewicht voor het Nationaal Preventie Akkoord (onbetaald ) *adviseur keten/netwerkaanpak overgewicht bij volwassenen (tijdelijk betaald) en *lid commissie onderwijs leefstijl en overgewicht in de basiscurricula van zorgprofessionals (onbetaald) -Voorzitter Nationaal Obesitas Symposium – betaald -Bestuurslid stichting STRESS-NL (platform Nederlandse stress onderzoekers)– onbetaald -Lid Koninklijke Hollandsche Maatschappij der Wetenschappen – onbetaald -Lid OPEN Policy working group European Association of the Study of Obesity (sinds Dec 2022) – onbetaald -Lid Voedingsbeleidadviesteam Erasmus MC – onbetaald -Lid Hogeschoolraad – onbetaald -Deelnemer netwerk NL2025 – onbetaald - Jurylid Heineken Award commissie - betaald - Lid voedingsbeleidcommissie Erasmus MC – onbetaald -Spreker /dagvoorzitter bij multipele (inter)nationale en regionale (wetenschappelijke) congressen, webinars, podcasts, media, en nascholingen voor zorgprofessionals. beleidsmakers of algemeen publiek : oa voor Langerhans symposia, Dutch Obesity Academy, Dutch Diabetes Academy, NVE Academy, E-wise, KOEL, SCEM, ASCEND, European Association of the Study of Obesity, International Medical Press, Food First Network, Obesitas Platform, overgewicht.tv, Breedenburg, Het Grote Obesitas Debat, POLITICO Health Care summit EU, European Commission, Diabetes Genootschap Zuid Nederland, Vereniging Arts en Leefstijl, Internistendagen – deels onbetaald en deels betaald (zonder belangenverstrengeling of bemoeienis over wetenschappelijke inhoud door commerciele partijen in geval van betaling).
Afgeronde nevenfuncties: Lid van diverse commissies en wetenschappelijke besturen (onbetaald) |
- In 2019 boek gepubliceerd met co-auteur Mariëtte Boon ""VET belangrijk: feiten en fabels over voeding, vetverbranding en verborgen dikmakers"". Inkomsten naar uitgever Ambo Anthos en boekwinkels en een klein deel naar de auteurs (Mariette Boon en Obesity Science). In 2020 is het boek internationaal gepubliceerd. - Elisabeth Fonds (ondergebracht bij Erasmus MC Trustfonds) financiert de ontwikkeling van de online diagnostische ObesEcare tool om oorzaken overgewicht op te sporen. Het Elisabeth Fonds is een maatschappelijk / charitatief fonds en heeft geen winstoogmerk. - Firma Rhythm financiert een internationale multicenter trial voor een nieuw geneesmiddel (setmelanotide) voor patiënten met een zeldzame vorm van genetische obesitas. - Bezoek aan internationale Masterclass: ''leading the change in the management of Obesity & T2D'', gesponsord door Johnson & Johnson, 2017 (geen honorarium ontvangen) - Actieve bijdrage aan de ontwikkeling van een gespecialiseerde leefstijlinterventie in het Erasmus MC en bij de ontwikkeling van een diagnostische (online) ondersteuningstool voor mensen met overgewicht of obesitas (ook in het Erasmus MC).
|
Geen |
|
Brongers |
Manager fysiotherapie, fysiotherapeut en leefstijlcoach (GLI aantekening). Werkgever: Leidsche Rijn Julius Gezondheidscentra |
Geen |
Geen |
Geen |
|
Brugman |
Zelfstandig Leefstijlcoach |
Bestuurslid BLCN, deel betaald |
Geen |
Geen |
|
De Leest |
Apotheker GHC de Roerdomp Nieuwegein 24 uur Apotheker Geneesmiddel Informatie Centrum KNMP 10 uur |
onbetaald redactie Vascazine/vrijwilliger Vasculitis Vereniging |
Geen |
Geen |
|
Freijer |
Algemeen manager Partnerschap Overgewicht Nederland (PON) ondergebracht bij Erasmus MC te Rotterdam |
- Voorzitter van ISPOR Special Interest Group (SIG) Nutrition Economics. Werkzaamheden: het nieuw opgezette gebied binnen het bestaande gebied van gezondheidseconomie en daarbuiten vergroten.
- Eigenaar van eenmanszaak met naam Freijer4Food & Health Care Activiteitenomschrijving: Geven van lezingen op gebied van voeding; ontwikkelen van kennis/kunde omtrent voedingseconomie (Nutrition Economics); Schrijver/publicist van (wetenschappelijke) artikelen; geven van workshops op bovengenoemd gebied; projectmatig begeleiden van (commerciële) onderzoeken; consultancy op gebied van voeding. |
Geen |
Geen |
|
Govers |
Voorzitter van het NVD netwerk Obesitas (Kenniscentrum Diëtisten Overgewicht en Obesitas; www.KDOO.nl) Dit is een niet betaalde functie |
Vice-voorzitter van de ESDN Obesity van the European Federation of Associations of Dietitians. Een niet betaalde functie |
Geen |
Geen |
|
Langens |
Huisarts |
Ontwikkelen e-learnings/ webinar ( CME-online/accredidact/medonline): betaald Preventieconsult: medische begeleiding bij overgewicht/leefstijl : betaald Huisartsen Eemland: bevorderen wijkgericht werken: betaald Fieldlab obesitas Amersfoort: onbetaald |
Geen |
Geen |
|
Liem |
Gastro-intestinaal en traumachirurg
Groene Hart Ziekenhuis (GHZ) in Gouda (60%) Alrijne Ziekenhuis in Leiderdorp/Alphen ad Rijn (10%) Nederlandse Obesitas Kliniek West in Den Haag (20%) Keizer Kliniek in Voorschoten (10%) |
- Hoofd afdeling chirurgie in GHZ - Voormalig voorzitter Dutch Society for Metabolic and Bariatric Surgery - Lid Auditcommissie (Ned Ver v Heelkunde) - Lid Landelijke Commissie Chirurgische Complicatie Registratie (Ned Ver v Heelkunde) - Clinical Audit Board Audit voor de Behandeling van Obesitas van DICA - Lid Registry Committee of the Internationale Federation for the Surgery of Obesity and Metabolic Disorders - Lid Multi-National Advisory Group of IFSO-European Chapter
Al deze nevenfuncties zijn onbetaald |
Nederlandse Obesitas Kliniek. De chirurgische behandeling van obesitas en obesitas gerelateerde metabole ziekten maakt onderdeel uit van het behandel spectrum. Als ervaren bariatrisch en metabool chirurg maak ik derhalve ondereel uit van deze commissie. De uiteindelijke richtlijn heeft invloed op de positionering van deze behandeling in het behandel spectrum. Voor de chirurgische behandeling zelf, is in 2020 een herziene richtlijn gepubliceerd door de NVVH en het Kennisinstituut. Hiernaar zal worden verwezen in deze Zorgstandaard. Ik heb een beperkt belang in NOK West in Den Haag.
Ik ben daarnaast regelmatig een gevraagde spreker op (internationale) bijeenkomsten en congressen, soms gefaciliteerd door Johnson & Johnson Institute, Medtronic, Gore en Olympus. Daar staat soms een tijdvergoeding tegenover, conform Europese regelgeving. |
Geen |
|
Out |
Internist-vasculair geneeskunde (MST Enschede, fulltime) |
Klinisch Netwerk Obesitas (commissie NVE, lid) |
Van januari t/m juni 2020 heb ik één dag per week onbetaald verlof om de mogelijkheden te exploreren van het opzetten van een leefstijicentrum (bijvoorbeeld als anderhalvelijns centrum, al dan niet in naam van/in samenwerking met het MST). - Deelname aan deze richtlijncommissie kan mijn naam/reputatie als leefstijlarts versterken |
Geen |
|
Out-Hoiting |
Eigenaar Mijn leefstijl op recept
Vice-voorzitter BLCN (deel betaald, deel vrijwillig) |
Geen |
In mijn bedrijf maak ik oa producten voor GLI coaches. Deze coaches hebben belang bij een goed obesitasbeleid waarbij de GLI blijft bestaan. ik ben zelf geen GLI coach meer. |
Geen |
|
Sloots-Jongen |
Klinisch psycholoog bij Maasstad Ziekenhuis |
Geen |
Geen |
Geen |
|
Slot |
VvOCM Nicolette Slot eigen praktijk voor oefentherapie, wandeltrainer en leefstijlcoach |
Oefentherapeut Mensendieck - betaald leefstijlcoach - betaald wandeltrainer - betaald voorzitter Drunens Wandelfestival - niet betaald voorzitter Avond4daagse Drunen - niet betaald |
Geen |
Geen |
|
Van den Anker |
Freelance opdracht HR bij WijzijnMeo (bedrijfsnaam Blue Wolf) Bestuurslid NSOG (Nederlandse stichtijng over gewicht) - Patiëntenorganisatie (onbezoldigd) |
Bestuurslid Pon (onbezoldigd) |
Als bestuurslid van de patiëntenorganisatie voor mensen die leven met obesitas kan de richtlijn ter uitleg en informatie gebruikt worden voor de patiënten |
Geen |
|
Van Kemenade |
Waarnemend huisarts (huisartspraktijk Biesbosch Made) |
Auteur Consult HZG (huisartszorggroep Breda) betaald per uur bij werkzaamheden Creeeren scholingen/presentaties op het gebied Diabetes/leefstijl. Betaald per scholing/presentatie |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afgevaardigden van de patiëntenverenigingen in de werkgroepen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Nederlandse Stichting Over Gewicht.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijnmodule is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Module |
Uitkomst raming |
Toelichting |
|
Obesitas tijdens de overgang |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat [het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitters van de werkgroep en de adviseurs knelpunten in de zorg voor kinderen en volwassenen met obesitas of overgewicht in combinatie met risicofactoren en/of comorbiditeit. Tevens zijn er knelpunten aangedragen door AJN Jeugdartsen Nederland, Beroepsvereniging Gewichtsconsulenten Nederland, Beroepsvereniging Leefstijl Coaches Nederland, Care for Obesity (VU Amsterdam), Inspectie voor de Gezondheidszorg en Jeugd, Jongeren op Gezond Gewicht, GGD Har voor Brabant, Amsterdamse Aanpak Gezond Gewicht (GGD Amsterdam), Koninklijk Nederlands Genootschap voor Fysiotherapie, Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie, Koninklijke Nederlandse Maatschappij ter bevordering van de Tandheelkunde, Landelijke Verenging Medische Psychologie, Landelijke Huisartsen Vereniging, Nederlandse Associatie Physician Assistants, Nederlands Centrum Jeugdgezondheid, Nederlandse Diabetes Federatie, Nederlands Huisartsen Genootschap, Nederlandse Internisten Vereniging, Nederlands Jeugdinstituut, Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose, Nederlandse Vereniging van Diëtisten, Nederlandse Vereniging voor Kindergeneeskunde, Nederlandse Vereniging van Maag-Darm-Leverartsen, Nederlandse Vereniging voor Obstetrie & Gynaecologie, Nederlandse Vereniging voor Cardiologie, Nederlandse Vereniging voor Heelkunde, Nederlandse Vereniging voor Plastische Chirurgie, Partnerschap Overgewicht Nederland, Pharos, Stichting over gewicht, Vereniging Gehandicaptenzorg Nederland, Voedingscentrum, Vereniging Vertrouwensartsen Kindermishandeling, Vereniging van Oefentherapeuten Cesar en Mensendieck, Zorginstituut Nederland en Zelfstandige Klinieken Nederland via een Invitational conference. Een verslag van de Invitational conference is opgenomen in de bijlagen.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitters en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroepen besproken waarna de werkgroepen de definitieve uitgangsvragen hebben vastgesteld. Vervolgens inventariseerden de werkgroepen per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroepen waardeerden deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerden de werkgroepen ten minste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag.
Gezien de hoge mate van uitval en terugval en daarmee het teruglopen van het percentage succesvolle resultaten na verloop van tijd zijn korte-termijn leefstijlinterventies weinig informatief voor de klinische praktijk. Vanwege het belang van een duurzaam effect zijn bij de selectie van de literatuur daarom alleen studies met een minimale duur van 2 jaar geïncludeerd bij de kinderrichtlijn (Reinehr, 2009).
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk die meegewogen dienen te worden, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module ‘Organisatie van zorg’.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk onderzoek van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., et al. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit.https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.htMl Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H., Brożek J., Guyatt G., et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., et al. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Reinehr, T., Widhalm, K., l'Allemand, D., Wiegand, S., Wabitsch, M., Holl, R. W., & APV‐Wiss Study Group and German Competence Net Obesity. (2009). Two‐year follow‐up in 21,784 overweight children and adolescents with lifestyle intervention. Obesity, 17(6), 1196-1199.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Wharton, S., Lau, D. C., Vallis, M., Sharma, A. M., Biertho, L., Campbell-Scherer, D., ... & Boyling, E. (2020). Obesity in adults: a clinical practice guideline. CMAJ, 192(31), E875-E891.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
