(Operatieve) behandeling van littekenbreuken
Uitgangsvraag
Hoe kan een littekenbreuk (operatief) behandeld worden?
De uitgangsvraag omvat de volgende deelvragen
- Moet een littekenbreuk geopereerd worden?
- Wat zijn de behandelopties voor een littekenbreuk?
- Wat zijn de verschillen tussen een open operatie en een laparoscopische benadering bij patiënten met een littekenbreuk (CAC-score)?
- Wat zijn de verschillen tussen het sluiten van een littekenbreuk met een kunststof mesh ten opzichte van het primair sluiten van een littekenbreuk met alleen hechtingen?
- Bij welke patiënt- of breukkarakteristieken, moet je bepaalde behandelingen/ operatietechnieken juist niet toepassen?
Aanbeveling
Bespreek bij patiënten met een asymptomatische reponibele littekenbreuk met een relatief ruime breukpoort ten opzichte van de breukinhoud en een rudimentaire behandelwens of een expectatief beleid de optie van keuze kan zijn.
Gebruik bij herstel van een littekenbreuk in beginsel altijd een mesh.
Betrek bij de keuze tussen open of laparoscopische operatie de relevante patiënten- (onder andere DM, obesitas) en herniakarakteristieken (breukafmeting, kwaliteit buikwand, adhesies, loss of domain en contaminatie) om tot een goede interventiemethode te komen.
Indien bij geselecteerde patiënten met kleine littekenbreuken voor een laparoscopische procedure wordt gekozen en een bridgingtechniek onvermijdelijk blijkt, kies dan voor een overlap van minimaal 5 cm, rekening houdend met de verhouding tussen de grootte van de mesh en de breukpoortdiameter.
Overwegingen
Uitgangsvraag 1: Moet een littekenbreuk geopereerd worden?
Voor deze vraag is geen sluitende wetenschappelijke onderbouwing te vinden. Met name de veiligheid van een expectatief beleid is een volstrekt onbeantwoorde vraag.
Geadviseerd wordt om bij patiënten met een asymptomatische reponibele littekenbreuk met een relatief ruime breukpoort ten opzichte van de breukinhoud en een rudimentaire behandelwens te bespreken of een expectatief beleid de optie van keuze voor arts en patiënt kan zijn, met name bij co-morbiditeit. Het is verstandig om hierbij te bespreken wat de patiënt kan doen bij eventuele beklemmingsverschijnselen, zoals reponeren of direct SEH-bezoek.
Betrek bij de keuze tussen een expectatief beleid of een operatie de relevante patiëntkarakteristieken (onder andere DM, obesitas) en herniakarakteristieken (onder andere breukafmeting, kwaliteit buikwand, adhesies, loss of domain en contaminatie) om tot een goede indicatie voor een beleidskeuze te komen.
Uitgangsvraag 2a: Wat zijn de verschillen tussen een open operatie en een laparoscopische benadering bij patiënten met een littekenbreuk?
Voor deze vraag is geen sluitende wetenschappelijke onderbouwing te vinden. De opbouw van studies is te heterogeen om deze vraag te beantwoorden.
Er is geen positief voorspellende evidence waarop een richtinggevende keuze voor open of laparoscopische chirurgie gemaakt kan worden in individuele gevallen.
Diverse breukkarakteristieken en gewenste uitkomsten zijn hierin namelijk mede van invloed. Voor optimale cosmetiek is het bijvoorbeeld bij grote breuken goed om herstel van de buikwandcontour na te streven. Dit kan bij geselecteerde patiënten door laparoscopisch de breukpoort te sluiten, maar ook door een open opbouwplastiek. In voorkomende gevallen is een partiële release van de buikwand noodzakelijk. (bijvoorbeeld anterieure of posterieure componenten separatie techniek).
Aangezien er bij laparoscopische ingrepen minder infecties zijn, is het te overwegen bij hoogrisicopatiënten deze techniek te prefereren, mits de breukkenmerken dit toestaan. Denk hierbij aan verhoogdrisicopatiënten met bijvoorbeeld DM, roken en/of overgewicht (Froylich, 2017).
Bij laparoscopische ingrepen is de adhesiolyse een extra punt van aandacht. Hoewel er geen significant verschil met betrekking tot het aantal enterotomieën tussen open en laparoscopisch herstel is aangetoond (Sauerland, 2011) kan de adhesiolyse technisch uitdagend zijn. Derhalve is een uitgebreide abdominale voorgeschiedenis met een reële kans op veel adhesies een reden om een open procedure te overwegen.
Op basis van de diverse variabelen wordt geadviseerd om via ‘shared decision making’ in overleg met de patiënt het beste behandelplan te creëren.
Uitgangsvraag 2b: Wat zijn de verschillen tussen het sluiten van een littekenbreuk met een kunststof mesh en het primair sluiten van een littekenbreuk met hechtingen?
Hoewel het kwaliteitsniveau van de evidence voor deze vraag beperkt is, zijn alle studieresultaten wel gelijkluidend ten aanzien van de preventie van recidieven door het gebruik van de mesh. Ook in de meest recente liesbreukrichtlijn is het gebruik van een mesh onomstotelijk verbonden met minder recidieven en wordt het gebruik ten zeerste aanbevolen (HerniaSurg Group, 2018). Derhalve adviseren we (ten zeerste) om in geschikte situaties een mesh te gebruiken voor het herstel van een littekenbreuk.
Uitgangsvraag 3: Bij welke patiënt- of breukkarakteristieken moet je bepaalde behandelingen/ operatietechnieken juist niet toepassen?
Voor deze vraag is geen sluitende wetenschappelijke onderbouwing te vinden. De opbouw van studies is te heterogeen om deze vraag te beantwoorden. Wel is er een aantal factoren aan te geven waarbij een techniek kwetsbaar is.
Een meta-analyse van Le Blanc (2016) van 95 studies (prospectief en retrospectief) met 8864 patiënten keek naar de overlap van een mat bij open en laparoscopische chirurgie. Voor de open chirurgie was de mate van overlap niet van invloed op de recidiefkans. Voor laparoscopische chirurgie was er een afname van de recidief kans waarbij een overlap van
>5 cm beter scoorde (1,4% recidief) van een overlap van 3 tot 5 cm welke op zijn beurt weer beter scoorde dan een overlap van >3cm (8,6% recidief). De fixatiemethode van de mesh (tackers, hechtingen of beide, resorbeerbaar of niet) had hierop bij analyse geen invloed. Het effect van de breukpoort kon wegens te weinig data onvoldoende worden geanalyseerd. Wel bleek bij kleine breukpoorten (<4 cm diameter) er een halvering van de recidiefkans op te treden als de mesh 3 tot 5 cm overlap had, in plaats van <3. Bij medium (4 tot 10 cm diameter) en grote (>10 cm) breuken kon de recidief kans van 7 naar 3% verlaagd worden als de mesh overlap van <3 naar >5 cm werd verhoogd.
Aangezien voldoende overlap dus een direct verband houdt met de recidiefkans, betekent dit automatisch een grens voor de afmeting van de breuk die laparoscopisch behandeld wordt. De grotere littekenbreuken lenen zich dan ook veelal minder voor een laparoscopisch herstel. De invloed van het verkleinen of sluiten van de breukpoort hierop is niet goed te duiden.
Het centreren van de mesh tijdens de procedure, zodat de overlap naar alle kanten minimaal 5 cm bedraagt, is uiteraard met name laparoscopisch essentieel.
Wellicht kun je de grens van bridging bij de laparoscopische littekenbreukchirurgie het beste bepalen door de verhouding tussen de oppervlakte van de mat en de oppervlakte van de breuk te bepalen.
De studie van Hauters (2017) toont in een consecutief cohort van 213 patiënten (parietex mesh, >3 cm overlap, tackers) aan dat de mesh/defect (M/D)-ratio een mutivariate onafhandelijke variabele is. Hierbij bleek een M/D-ratio <13 zelfs bij een overlap van 5 cm een recidief kans van 22% te hebben. Bij een M/D-ratio tussen 13 en 16 was de kans 9% en bij een ratio >16 was de kans 0%, met een mean follow-up van 69 +/- 44 maanden (mediaan 65 (6 tot 152 maanden)).
Op basis van deze gegevens zou voor een 7 cm grote breuk een mat met een diameter van 28 cm nodig zijn. Hiermee zou de grens voor laparoscopisch bridgen voor wat betreft een zo klein mogelijke recidiefkans rond de 7 cm komen.
Tabel 1 Benodigde overlap en diameter van de mesh voor defectgrootte om een M/D-ratio van 13 of 16 te krijgen (Hauters, 2017)
|
Diameter van het defect |
Benodigde grootte voor een M/D-ratio van 13 |
Benodigde grootte voor een M/D-ratio van 16 |
||
|
Overlap mesh (cm) |
Diameter mesh (cm) |
Overlap mesh (cm) |
Diameter mesh (cm) |
|
|
2 |
2,5 |
7 |
3 |
8 |
|
3 |
4 |
11 |
4,5 |
12 |
|
4 |
5 |
14 |
6 |
16 |
|
5 |
6,5 |
18 |
7,5 |
20 |
|
6 |
7,5 |
21 |
9 |
24 |
|
7 |
9 |
25 |
10,5 |
28 |
|
8 |
10,5 |
29 |
12 |
32 |
Onderbouwing
Achtergrond
Bij de behandelkeuzes van littekenbreuken zijn diverse vragen relevant. Om te beginnen: is er wel een operatieve behandeling noodzakelijk of is er net als bij liesbreuken tot op zekere hoogte ruimte voor afwachtend beleid (‘watchful waiting’)?
De operatieve behandelingen zijn het best te verdelen in twee categorieën, te weten open chirurgie en laparoscopische chirurgie. Uiteraard zijn hierbij diverse variaties te bedenken ten aanzien van de fixatie/positie van de mat en de reconstructie van de buikwand. Voor de optimale keuze van de behandeling dienen meerdere patiënt-/breukkarakteristieken alsmede het gewenste doel van de behandeling te worden meegenomen. Hierdoor is er veelal noodzaak voor het individualiseren van een therapie.
In deze module worden de grote lijnen ten aanzien van de behandelingsopties beschreven. Deze grote lijnen dienen vervolgens als handleiding voor de besliskunde met betrekking tot de individuele patiënt. In deze module wordt ingegaan op de volgende deelvragen:
- Moet een littekenbreuk geopereerd worden?
- Wat zijn de behandelopties voor een littekenbreuk?
- Wat zijn de verschillen tussen een open operatie en een laparoscopische benadering bij patiënten met een littekenbreuk?
- Wat zijn de verschillen tussen het sluiten van een littekenbreuk met een kunststof mesh ten opzichte van het primair sluiten van een littekenbreuk met alleen hechtingen?
- Bij welke patiënt- of breuk karakteristieken moet je bepaalde behandelingen/ operatietechnieken juist niet toepassen?
Voor vragen over de positie van de mesh (module 5) en het sluiten van de breukpoort versus bridging (module 7) wordt naar andere modules verwezen.
Conclusies
Uitgangsvraag 1 Moet een littekenbreuk geopereerd worden?
|
- GRADE |
Er is geen evidence waaruit kan worden bepaald of een operatief of expectatief beleid moet prevaleren bij een responsible littekenbreuk zonder klachten. Het beklemmingsrisico is onbekend. |
Uitgangsvraag 2a Bij welke breuk moet welke operatieve techniek worden toegepast, open of laparoscopisch? (PICO 2)
|
Redelijk GRADE |
Er is met redelijk sterke bewijskracht aangetoond dat het toepassen van een laparoscopische operatietechniek bij littekenbreuken niet significant verschillend is in het aantal recidieven in vergelijking met een open operatietechniek bij patiënten met een littekenbreuk. (RR=1,29 (95% BI 0,82 tot 2,05)).
Bronnen (Sauerland, 2011; Eker, 2013) |
|
Redelijk GRADE |
Er is met redelijk sterke bewijskracht aangetoond dat de mate van acute pijn (1, 2 en 3 dagen postoperatief) niet significant verschilt tussen een laparoscopische operatietechniek en een open operatietechniek bij patiënten met littekenbreuken (RR= 0,09 (95% CI -0,45 tot 0,62)).
Bronnen (Sauerland, 2011) |
|
Laag GRADE |
Er is met lage bewijskracht aangetoond dat de mate van chronische pijn (>6 maanden postoperatief) niet significant verschilt tussen een laparoscopische operatietechniek en een open operatietechniek bij patiënten met een littekenbreuk (RR= 0,44 (95% CI -0,24 tot 1,11)).
Bronnen (Sauerland, 2011) |
|
Redelijk GRADE |
Er is met redelijk sterke bewijskracht aangetoond dat er significant minder infecties zijn na een laparoscopische procedure in vergelijking met een open operatietechniek bij littekenbreuken (RR= 0,29 (95% CI 0,18 tot 0,47) p<0,001).
Bronnen (Sauerland, 2011; Eker, 2013; Rogmark, 2013) |
|
Redelijk GRADE |
Er is met redelijk sterke bewijskracht aangetoond dat het aantal seroom gevallen bij littekenbreuken significant hoger is bij het toepassen van een laparoscopische operatietechniek in vergelijking met een open operatietechniek met een sublay matpositie (RR= 1,77 (95 CI% 1,08 tot 2,90) p=0,02).
Bronnen (Sauerland, 2011; Eker, 2013; Rogmark, 2013) |
Uitgangsvraag 2b Wat zijn de verschillen tussen het sluiten van een littekenbreuk met een kunststof mesh en het primair sluiten van een littekenbreuk met hechtingen?
|
Redelijk GRADE |
Er is met lage bewijskracht aangetoond dat het gebruik van een mesh tot significant minder recidieven leidt dan het gebruik van hechtingen na een hersteloperatie van een littekenbreuk.
Bronnen (Mathes, 2015; Venclauskas, 2010; Korenkov, 2002; Luijendijk, 2000; Weber, 2010) |
Uitgangsvraag 3 Bij welke patiënt of breukkarakteristieken moet je bepaalde behandelingen/operatietechnieken juist niet toepassen?
Niet van toepassing; er werden geen studies geselecteerd.
Zie de paragraaf Overwegingen voor expert opinion adviezen van de commissie.
Samenvatting literatuur
Uitgangsvraag 1 Moet een littekenbreuk geopereerd worden? Beschrijving studies
Niet van toepassing; er werden geen studies geselecteerd.
Resultaten
Niet van toepassing; er werden geen studies geselecteerd.
Uitgangsvraag 2a Bij welke breuk moet welke operatieve techniek worden toegepast, open of laparoscopisch? (PICO 2)
Beschrijving studies
Drie studies zijn opgenomen in de literatuuranalyse, waarvan één Cochrane systematische review (Sauerland, 2011). De Cochrane review beschreef tien RCT’s. Deze review kon worden geüpdatet met de twee recentere RCT’s uit de zoekactie (Eker, 2013; Rogmark, 2013). Daarmee is deze literatuuranalyse een beschrijving van twaalf RCT’s. In diverse studies zijn naast de littekenbreuken ook primaire buikwandbreuken, umbilicale en parastomale hernia’s en in één studie hernia van spigheli’s meegenomen. De data was niet geschikt om alleen de data van de littekenbreuken te extraheren.
De meeste studies includeerden alleen breuken >3cm en enkele studies excludeerden breuken >15cm. De studies vergeleken laparoscopische techniek met een open operatie bij patiënten met vooral littekenbreuken. Bij de laparoscopische techniek werden 3 tot 4 poorten gebruikt met een (expanded) polytetrafluoroethyleen (ePTFE) of polypropyleen mesh met meestal meer dan 3 cm overlap. De fixatie varieerde tussen alleen hechtingen, alleen tackers of hechtingen en tackers. Voor de open operatietechniek werden met name een polypropyleen mesh gebruikt, veelal retromusculair, maar de positie van de mesh kon ook onlay of intraperitoneaal zijn. In 1 studie werd een polytetrafluoroethyleen mesh gebruikt.
De studiepopulaties waren heterogeen. Er was met name veel variatie in de grootte van de littekenbreuken, het type breuk, primaire breuken, littekenbreuken, mate van contaminatie en co-morbiditeit. De follow-up was in slechts zes van de twaalf studies langer dan twee jaar. Alle RCT’s betroffen nietgeblindeerde studies uitgevoerd in één of meer centra. Hoewel er geen statistische heterogeniteit is, is de klinische en methodologische heterogeniteit aanzienlijk. Derhalve wordt er in alle meta-analyses gebruik gemaakt van de random effectsmethode. De volgende uitkomsten werden beschreven: recidieven van de littekenbreuk, acute pijn postoperatief, chronische pijn, infecties en seroom.
Resultaten
Recidieven van de ventrale buikwandbreuk
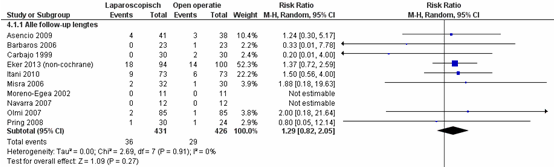
Er is één studie toegevoegd (Eker, 2013) aan de Cochrane review (Sauerland, 2011) voor de uitkomstmaat recidieven van de littekenbreuk. Rogmark (2013) onderzocht ook recidieven van littekenbreuken, maar had slechts een follow-uptijd van 8 weken en is daarom weggelaten uit de resultaten. De follow-uptijd voor de recidieven van de geïncludeerde studies varieerde van 6 maanden tot 35 maanden.
Er is geen significant verschil in het voorkomen van recidieven van de littekenbreuk tussen de patiënten geopereerd middels een laparoscopische techniek versus patiënten geopereerd middels een open operatietechniek, RR van 1,29 (95% BI 0,82 tot 2,05),
p=0,27, I2=0% (figuur 1) (Sauerland, 2011; Eker, 2013).
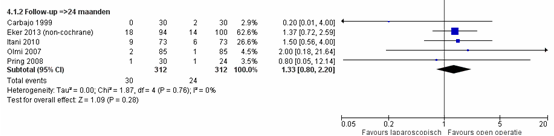
De resultaten zijn hetzelfde wanneer enkel studies werden meegenomen die een follow- up hebben van ≥24 maanden: RR van 1,33 (95% BI 0,80 tot2,20), p=0,28, I2=0% (figuur 2) (Sauerland, 2011; Eker, 2013).
Figuur 1 Forest plot voor recidieven ventrale buikwandbreuk – alle follow-up lengtes, vergelijking tussen laparoscopie en open chirurgie
Figuur 2 Forest plot voor recidieven ventrale buikwandbreuk – follow-up ≥24 maanden, vergelijking tussen
laparoscopie en open chirurgie
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat recidieven van de littekenbreuk is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (niet geblindeerde heterogene studie en verschillen in de follow-up). Het niveau van de bewijskracht komt uit op GRADE
‘redelijk’.
Acute pijn (postoperatief)
Er zijn geen nieuwe studies toegevoegd aan de Cochrane literatuurreview (Sauerland, 2011) voor de uitkomstmaat acute pijn bij littekenbreuk. De definitie in de Cochrane review voor acute pijn was pijn op dag 1, 2 en 3 postoperatief gemeten met een visuele analoge of numerieke schaal.
Rogmark (2013) en Eker (2013) onderzochten beide ook acute pijn bij littekenbreuken, maar er waren niet genoeg details beschikbaar om de uitkomst te vergelijken met de Cochrane-data en deze uitkomsten zijn daarom weggelaten uit de resultaten.
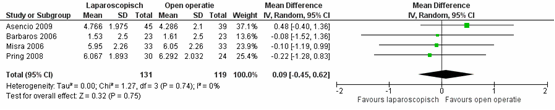
Er bleek geen verschil in de mate van acute pijn tussen de patiënten geopereerd middels een laparoscopische techniek versus patiënten geopereerd middels een open operatietechniek, met een gepooled gemiddeld verschil van 0,09 (95% CI -0,45 tot 0,62),
p=0,75, I2=0% (figuur 3) (Sauerland, 2011).
Figuur 3 Forest plot voor acute pijn, vergelijking tussen laparoscopie en open chirurgie
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat acute pijn (postoperatief) is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (niet- geblindeerde studie opzet). Het niveau van de bewijskracht komt uit op GRADE ‘matig’.
Chronische pijn
Er zijn geen nieuwe studies toegevoegd aan de Cochrane literatuurreview (Sauerland, 2011) voor de uitkomstmaat chronische pijn bij littekenbreuk. Voor deze uitkomstmaat is slechts 1 studie opgenomen in de review (Asencio, 2009) door Sauerland (2011). De definitie in de Cochrane review voor chronische pijn was pijn >6 maanden postoperatief.
Er bleek geen verschil in de mate van chronische pijn tussen de patiënten geopereerd met een laparoscopische techniek versus patiënten geopereerd met een open operatietechniek, met een gemiddeld verschil van 0,44 (95% CI -0,24 tot 1,11), p=0,20
(Sauerland, 2011).
Figuur 4 Forest plot voor chronische pijn, vergelijking tussen laparoscopie en open chirurgie

Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat chronische pijn is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (niet-geblindeerde studieopzet) en het geringe aantal patiënten uit slechts één studie (imprecisie). Het niveau van de bewijskracht komt
uit op GRADE ‘laag’.
Lokale infecties
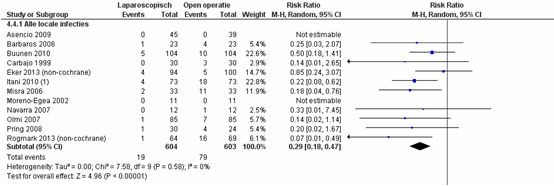
Er zijn twee nieuwe studies toegevoegd (Eker, 2013; Rogmark, 2013) aan de Cochrane literatuurreview (Sauerland, 2011) voor de uitkomstmaat infecties bij littekenbreuk.
Lokale infecties bij littekenbreuk komen significant minder voor bij patiënten geopereerd middels een laparoscopische techniek vergeleken met patiënten geopereerd middels een open operatie techniek, met een gepooled RR van 0,29 (95% CI 0,18 tot 0,47), p<0,001, I2=0% (figuur 5) (Sauerland, 2011; Eker, 2013; Rogmark 2013).
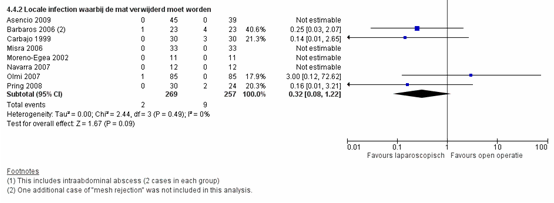
Dit geldt ook voor ernstigere lokale infecties waarbij het matje verwijderd moest worden, maar daar was het effect niet meer significant, met een gepooled RR van 0,32 (95% CI 0,08 tot 1,22), p=0,09, I2=0% (figuur 6) (Sauerland, 2011).
Figuur 5 Forest plot voor alle locale infecties, vergelijking tussen laparoscopie en open chirurgie
Figuur 6 Forest plot voor locale infecties waarbij de mat verwijderd moet worden, vergelijking tussen laparoscopie en open chirurgie
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat infecties is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (niet geblindeerde studie opzet). Het niveau van de bewijskracht komt uit op GRADE ‘redelijk’.
Seroom
Er zijn twee nieuwe studies toegevoegd (Eker, 2013; Rogmark, 2013) aan de Cochrane literatuurreview (Sauerland, 2011) voor de uitkomstmaat seroom bij littekenbreuk.
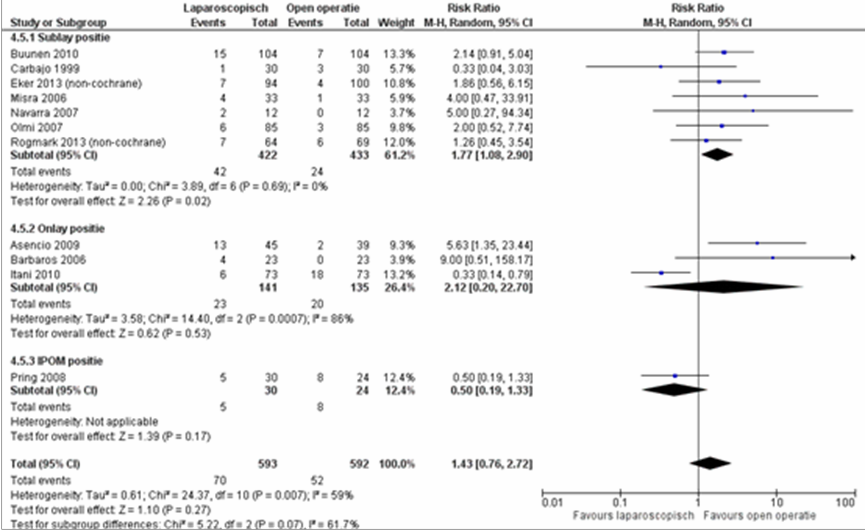
Er bleek geen verschil in het voorkomen van seroom tussen de patiënten geopereerd middels een laparoscopische techniek versus patiënten geopereerd door een open operatie techniek RR van 1,43 (95% BI 0,76 tot 2,72), p=0,32, I2=59% (figuur 7) (Sauerland, 2011; Eker, 2013; Rogmark, 2013). De statistische heterogeniteit lijkt verklaard te kunnen worden door de positie van de mesh bij de open operatietechniek. De subgroepanalyse laat zien dat voor de sublay positie bij de open operatietechniek er wel een significant effect is in het voordeel van de open operatietechniek met een gepooled RR 1,77 (95 CI% 1,08 tot 2,90), p=0,02, I2=0% (figuur 7) (Sauerland, 2011; Eker,
2013; Rogmark, 2013).
Figuur 7 Forest plot voor seroom en 1. Open sublay positie mat, 2. Open onlay positie mat en 3. Open IPOM positie mat, vergelijking tussen laparoscopie en open chirurgie
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat seroom is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (niet geblindeerde studie-opzet). Het niveau van de bewijskracht komt uit op GRADE ‘redelijk’.
Verder kunnen nog analyses gemaakt worden ten aanzien van enterotomie, hematoom, reoperatie, kwaliteit van leven, opnameduur, tijdstip van werkhervatting, patiënttevredenheid en cosmetiek. Alle zijn echter zonder significant verschil en zijn omwille van de leesbaarheid van deze module niet verder uitgewerkt.
Uitgangsvraag 2b Wat zijn de verschillen tussen het sluiten van een littekenbreuk met een kunststof mesh en het primair sluiten van een littekenbreuk met hechtingen?
Beschrijving studies
Een systematische review (Mathes, 2016) hebben we opgenomen in de uitwerking van de literatuuranalyse. Deze studie onderzocht het effect van het gebruik van een mesh ten opzichte van hechtingen bij littekenbreukoperaties op het opnieuw krijgen van de littekenbreuken. Omdat Mathes (2016) naast littekenbreuken ook navelbreuken includeerde hebben we zelf een subgroepanalyse uitgevoerd waarbij we de navelbreuken hebben geëxcludeerd. In totaal hebben we 772 patiënten met een littekenbreuk geïncludeerd, waarvan 405 patiënten in de groep waarbij de breukpoort is gesloten met behulp van een mesh en 368 patiënten in de groep waarbij de breukpoort is gesloten met behulp van hechtingen. We hebben de data gebruikt uit de review van Mathes (2016). Hierbij kan een aantal kanttekeningen worden geplaatst. Niet alle gegevens waren compleet in de review van Mathes (2016). Bijvoorbeeld het percentage geslacht en gemiddelde leeftijd werden niet gepresenteerd. Waar we konden hebben we deze uit de bronartikelen gehaald.
De vier studies waarbij wij een subanalyse hebben uitgevoerd, hebben een gespreide follow-up tijd van negen maanden tot vijf jaar.
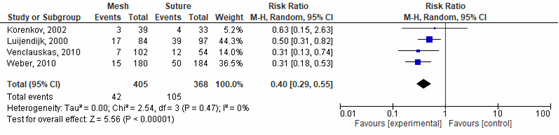
De subgroepanalyse laat zien dat het gebruik van een mesh bij een littekenbreukoperatie significant verschilt van het gebruik van hechtingen bij het sluiten van de breuk. Dit is het voordeel van het gebruik van de mesh: RR 0,40 (95 CI% 0,29 tot 0,55), p=<0,00001 I2=0% (figuur 8) (Mathes, 2015; Korenkov, 2002; Luijendijk, 2000; Weber, 2010).
Figuur 8 Forest plot voor recidief mesh in vergelijking tot hechtingen
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat recidief is met 1 niveau verlaagd gezien beperkingen in de onderzoeksopzet (niet geblindeerde studie-opzet en voor het hoge aantal lost to follow-up). Daarnaast is de conclusie gebaseerd op 147 incidenten (imprecisie). Echter, het effect is dermate sterk dat de richting van het effect niet enkel op toeval berust. Het niveau van de bewijskracht komt uit op GRADE ‘redelijk’.
Uitgangsvraag 3 Bij welke patiënt of breukkarakteristieken moet je bepaalde behandelingen/operatietechnieken juist niet toepassen?
Niet van toepassing; er werden geen studies geselecteerd.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvragen:
1. Wat zijn de (on)gunstige effecten van operatie ten opzichte van een conservatieve benadering, of geen behandeling bij patiënten een littekenbreuk?
P: patiënten met een littekenbreuk; I: operatie;
C: conservatief (breukband, afwachten);
O: recidieven van de littekenbreuk, pijn en complicaties (infecties en seroom).
2. Wat zijn de (on)gunstige effecten van een open operatie ten opzichte van een laparoscopische benadering bij patiënten met een littekenbreuk?
P: patiënten met een littekenbreuk; I: open operatie;
C: laparoscopische benadering;
O: recidieven van de littekenbreuk, pijn en complicaties (infecties en seroom).
3. Wat zijn de (on)gunstige effecten van het sluiten van een littekenbreuk met een kunststof mesh ten opzichte van een van het primair sluiten van een littekenbreuk met alleen hechtingen?
P: patiënten met een littekenbreuk; I: correctie met een kunststof mesh;
C: primair sluiten van een littekenbreuk met hechtingen; O: recidieven van de littekenbreuk.
Relevante uitkomstmaten
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Zoeken en selecteren (Methode)
In de database Medline (via OVID), Embase (via Embase.com) is met relevante zoektermen gezocht naar systematische reviews, RCT’s, CCT’s en observationeel onderzoek gericht op de behandeling van littekenbreuken. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 3740 treffers op. Een adviseur van het Kennisinstituut van de Federatie Medisch Specialisten maakte een voorselectie van studies die 2 of meer behandelingen gericht op littekenbreuken met elkaar vergeleken. Na de voorselectie zijn er 278 studies overgebleven waarvan 207 vergelijkende studies en 71 systematische reviews. Voor het beantwoorden van de uitgangsvraag werden studies geselecteerd op grond van de volgende selectiecriteria: studiedesign (systematische literatuur review, RCT), full-tekst beschikbaar in Nederlands of Engels, beschrijving van operatieve behandeling bij littekenbreuk en minimaal één van de uitkomstmaten; recidieven van de littekenbreuk, pijn, infecties en seroom.
Op basis van titel en abstract werden in eerste instantie 49 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 46 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en drie studies definitief geselecteerd.
Drie onderzoeken zijn opgenomen in de literatuuranalyse (Sauerland, 2011; Eker, 2013; Rogmark, 2013). De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias-tabellen.
Referenties
- Eker HH, Hansson BM, Buunen M, et al. Laparoscopic versus open incisional hernia repair: a randomized clinical trial. JAMA Surg. 2013;148(3):259-63. PubMed PMID: 23552714.
- Froylich D, Haskins IN, Aminian A, et al. Laparoscopic versus open inguinal hernia repair in patients with obesity: an American College of Surgeons NSQIP clinical outcomes analysis. Surg Endosc. 2017;31(3):1305-1310. PubMed PMID: 27444828.
- Hauters P, Desmet J, Gherardi D, et al. Assessment of predictive factors for recurrence in laparoscopic ventral hernia repair using a bridging technique. Surg Endosc. 2017;11. PubMed PMID: 28078462.
- Hernia Surge Group. International guidelines for groin hernia management. Hernia. 2018;22(1):1-165. doi: 10.1007/s10029-017-1668-x. Epub 2018 Jan 12. PubMed PMID: 29330835.
- LeBlanc K. Proper mesh overlap is a key determinant in hernia recurrence following laparoscopic ventral and incisional hernia repair. Hernia. 2016;20(1):85-99. doi: 10.1007/s10029-015-1399-9. Epub 2015 Jul 5. Review. PubMed PMID: 26143072.
- Rogmark P, Petersson U, Bringman S, et al. Short-term outcomes for open and laparoscopic midline incisional hernia repair: a randomized multicenter controlled trial: the ProLOVE (prospective randomized trial on open versus laparoscopic operation of ventral eventrations) trial. Annals of Surgery. 2013;258(1):37-45.
- Sauerland S, Walgenbach M, Habermalz B, et al. Laparoscopic versus open surgical techniques for ventral or incisional hernia repair. Cochrane Database Syst Rev. 201116;(3):CD007781. doi: 10.1002/14651858.CD007781.pub2. Review. PubMed PMID: 21412910.
Evidence tabellen
Research question: Hoe dient een littekenbreuk (operatief) behandeld te worden?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Sauerlan d, 2011 |
Cochrane SR and meta-analysis of RCT’s
Literature search up to july 2010
A: Ascensio, 2009 B: Barbaros, 2006 C: Buunen, 2010 D: Carbajo, 1999 E: Itani, 2010 F: Misra, 2006 G: Moreno- Egea, 2002 H: Navarra, 2007 I: Olmi, 2007 J: Pring, 2008
Study design: A: open RCT B: RCT C: RCT D: RCT E: RCT F: RCT |
Inclusion criteria SR: RCT’s, which compare laparoscopic with open repair (suture or mesh) in patients with ventral or incisional hernia or both. Studies were included irrespective of language, publication status, or sample size.
Exclusion criteria SR: Quasi- randomized trials
10 studies included |
Describe intervention: laparoscopic technique
A: 3 ports, ePTFE mesh, 3 cm overlap, transfascial sutures and helical tacks B: 3 ports, ePTFE, HA- CMC coated polypropylene meshes or polyurethane and polyester meshes, ≥3 cm overlap, non- absorbable transfascial sutures and titanium tackers. C: Not reported (abstract only) D: 3 ports, PTFE mesh, transfascial sutures and helical tacks. E: 3 ports, PTFE mesh, ≥3 cm overlap, transfixation sutures (every 6 cm) and tacks (in between). F: 3 ports, polypropylene mesh, 3 - 5cm overlap, tacks |
Describe control: conventional method= open repair (suture or mesh)
A: Standard polypropylene mesh in Rives/Stoppa sublay technique or onlay technique B: Polypropylene mesh, onlay, 5 cm overlap, onlay, non-absorbable sutures. C: Not reported (abstract only) D: Polypropylene mesh, sublay E: Polypropylene mesh, onlay with component separation, 3 cm overlap F: Polypropylene mesh, sublay, 3 - 5cm overlap, non-absorbable sutures G: Polypropylene mesh, sublay, overlap > 3cm H: Polypropylene mesh, sublay, overlap 4 - 5 cm |
End-point of follow-up: Recurrence (mean) A: 12 months B: 18 months in laparoscopic group and 20 months in open repair group D: 27 months E: 24 months F: 13 months G: 39 months H: 6 months I: 24 months J: 27.5 months
For how many participants were no complete outcome data available?
A: No risk of bias according to authors. 3 patients were excluded from the analysis, because they withdrew consent (n= 2) or intra- operative hernia size was |
Outcome measure-1 Defined as Hernia recurrence
Effect measure: RR (95% CI): A: 1.24 (0.30 to 5.17) B: 0.33 (0.01 to 7.78) D: 0.20 (0.01 to 4.00) E: 1.24 (0.30 to 5.17) F: 1.88 (0.18 to 19.63) G: Not estimable H: Not estimable I: 2.00 (0.18 to 21.64) J: 0.80 (0.05 to 12.14)
Pooled effect (random effects model): 1.22 (95% CI 0.62 to 2.38) favoring conventional Heterogeneity (I2): 0%
Outcome measure-2 Defined as acute pain
Effect measure: Mean difference (95% CI): A: 0.48 (-0.40 to 1.36) B: -0.08 (-1.52 to 1.36) |
Author’s conclusions: The short-term results of laparoscopic repair in ventral hernia are promising. In spite of the risks of adhesiolysis, the technique is safe. Nevertheless, long-term follow-up is needed in order to elucidate whether laparoscopic repair of ventral/ incisional hernia is efficacious.
Level of evidence: GRADE
Sensitivity analyses: Learning curve bias for hernia recurrence Pooled effect with learning curve bias (studies B and D) (random effects model): 0.25 (95% |
|
|
G: RCT H: RCT I: RCT J: RCT
Setting and Country: A: monocentric B: multicentric C: multicentric D: monocentric E: multicentric F: monocentric G: monocentric H: monocentric I: monocentric J: monocentric
Source of funding: German Ministry of Education and Research, Germany |
Important patient characteristics at baseline:
A: incisional size > 5 cm < 15 cm B: primary and incisional (incl. parastomal), size > 3 cm C: Primary and incisional, size > 3 cm < 15cm D: Primary and incisional, size > 80 cm2 E: Incisional (“Ventral incisional hernias (VIHs) after laparotomy”) F: Primary and incisional, size > 80 cm2 G: Spigelian, all sizes H: Incisional, size 3-12 cm I: Incisional, all sizes J: Primary or incisional, size > 3 cm |
G: either by totally extraperitoneal or by laparoscopic approach, 3 ports, polypropylene mesh in TEP and composite mesh, to overlap the defect widely, stapling (TEP) or transfascial sutures with helical tacks H: 3 ports, ePTFE mesh or polypropylene- polydioxanone, 5 cm overlap, non- absorbable sutures I: 3 ports, composite mesh, 4 to 5 cm overlap, tacks J: 3 or 4 ports, PTFE mesh, overlap 3 - 4 cm, transfascial sutures and helical tacks |
I: Polypropylene mesh, sublay, nonabsorbable separate stiches J: PTFE mesh, placed intraperitoneally, sutures |
<5 cm. It is unclear to which group these patients were initially randomised Those instances, where outcome data were missing, are clearly described. B: No losses to follow-up mentioned. C: 14 patients were excluded for various reasons. 7 patients were converted to open surgery but analysed according to ITT principle D: No losses to follow-up mentioned. E: The primary analysis was based on a modified intention-to- treatpopulation. In this analysis, patients who underwent surgery and had at least 1 follow-up visit were included. Two sensitivity analyses based on all the randomized patients were performed”. Of the initially randomized sample (n= 162), a total of 16 (10%) had to be excluded from analysis. All 16 patients were excluded, |
F: -0.10 (-1.19 to 0.99) J: 0-0.22 (-1.28 to 0.83)
Pooled effect (random effects model): 0.09 (95% CI -0.45 to 0.62), p=0.75 favoring conventional Heterogeneity (I2): 0%
Outcome measure-2 Defined as chronic pain
Effect measure: Mean difference (95% CI): A: 0.44 (-0.24 -1.11), p=0.11, favouring laparoscopic
No pooled effect (1 study)
Outcome measure-4a Defined as local infection (irregardless of severity)
Effect measure: RR (95% CI): A: Not estimable B: 0.25 (0.03 to 2.07) C: 0.50 (0.18 to 1.41) D: 0.14 (0.01 to 2.65) E: 0.22 (0.08 to 0.62) F: 0.18 (0.04 to 0.76) G: Not estimable H: 0.33 (0.01 to 7.45) I: 0.14 (0.02 to 1.14) J: 0.20 (0.02 to 1.67) |
CI 0.03 to 2.23), p=0.22 favoring laparoscopic Heterogeneity (I2): 0%
Pooled effect no information on learning curve bias (studies A, G, H, I) (random effects model): 1.44 (95% CI 0.62 to 2.38), p=0.49 favoring conventional Heterogeneity (I2): 0%
Pooled effect (random effects model): 1.47 (95% CI 0.62 to 3.46), p=0.38 favoring conventional Heterogeneity (I2): 0%
Mesh replacement for local seroma
Pooled effect for sublay mesh position (studies C, D, F, H, I) (random effects model): 1.99 (95% CI 1.05 to 3.76), p=0.03 favoring conventional Heterogeneity (I2): 0%
Pooled effect for onlay mesh position (studies A, B, E) (random effects model): 2.12 (95% CI 0.20 to 22.70), p=0.53 favoring conventional Heterogeneity (I2): 86% |
|
|
|
Unclear whether groups were comparable at baseline (no data on other characteristics from individual studies included) |
|
|
because they were not operated on. The 16 patients were evenly distributed across the two groups. Follow-up completeness was similar between the groups. F: 5 patients in group L and 4 patients in group O were lost to follow-up evaluation after 1 month. Review authors do not believe this will introduce bias G: Follow-up was completed in all patients. H: No losses to follow-up mentioned. I: Apparently no losses until the last follow-up 1 month after surgery J: Only 54 of the 58 randomized patients were included in the analyses. 4 patients received a mesh other than PTFE (3 from the open group and 1 from the laparoscopic group). This violates the intention-to-treat principle |
Pooled effect (random effects model): 0.26 (95% CI 0.15 to 0.46), p< 0.00001 favoring laparoscopic Heterogeneity (I2): 0%
Outcome measure-4b Defined as local infection (requiting mesh removal)
Effect measure: RR (95% CI): A: Not estimable B: 0.25 (0.03 to 2.07) D: 0.14 (0.01 to 2.65) F: Not estimable G: Not estimable H: Not estimable I: 3.00 (0.12 to 76.62) J: 0.16 (0.01 to 3.21)
Pooled effect (random effects model): 0.32 (95% CI 0.08 to 1.22), p=0.094, favoring laparoscopic Heterogeneity (I2): 0%
Outcome measure-5 Defined as seroma
Effect measure: RR (95% CI): A: 5.63 (1.35 to 23.44) B: 9.00 (0.51 to 158.17) C: 2.14 (0.91 to 5.04) D: 0.09 (0.01 to 1.57) |
Pooled effect for IPOM position (study J) (random effects model): 0.50 (95% CI 0.19 to 1.33), p=0.17 favoring laparoscopic Heterogeneity (I2): NA
Heterogeneity for seroma may explained by the mesh position. |
|
|
|
|
|
|
|
E: 0.33 (0.14 to 0.79) |
|
|
F: 4.00 (0.47 to 33.91) |
|||||||
|
H: 5.00 (0.27 to 94.34) |
|||||||
|
I: 2.00 (0.52 to 7.74) |
|||||||
|
J: 0.50 (0.19 to 1.33) |
|||||||
|
Pooled effect (random |
|||||||
|
effects model): 1.42 (95% |
|||||||
|
CI 0.60 to 3.40), p=0.43 |
|||||||
|
favoring conventional |
|||||||
|
Heterogeneity (I2): 69% |
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))1
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3 |
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Eker, 2013 |
Type of study: Non-blinded randomised controlled trial
Setting: Clinical multicentre setting (2 university hospitals and 8 teaching hospitals)
Country: The Netherlands
Source of funding: Not reported |
Inclusion criteria: -hernia diameter 3 -15 cm -location at the ventral abdominal wall at least 5 cm from the costae and inguinal area indication for elective repair -age ≥18 years -written informed consent
Exclusion criteria: -contraindication for pneumo-peritoneum -absolute contraindication |
Laparoscopic incisional hernia repair was performed through 3 to 5 abdominal trocars (one 10mmand 2 to four 5 mm). The mesh was introduced into the abdominal cavity through the 10- Mm trocar. The mesh was then placed over the defect with at least 5-cm overlap at all sides. Fixation of the mesh was achieved by 5- mm non absorbable tackers. |
Open ventral incisional hernia repair: After closing of the peritoneum or posterior rectus sheath, a mesh was positioned preperitoneally or in the sublay position, respectively, with at least 5-cm overlap at all sides. The mesh was fixated to the rectus muscle at each corner and side with non- absorbable (polypropylene) sutures |
Length of follow-up: Preoperatively, patients were asked to complete VAS scales for pain and nausea at 3 days, 1 week, and 4 weeks postoperatively. After discharge from the hospital, patients were invited for follow-up visits at outpatient clinics at 1 week, 6 weeks, 1 year, and 5 years. |
Postoperative pain on day 1, mean on VAS scale: L: 5.1 O: 4.3
Hernia recurrence rate: N (%): L: 17 (18) O: 14 (14) P=0.30 (log rank test)
Seroma: N(%): L: 7 (7) O: 4 (4) |
Mean on VAS scale voor acute pain afgelezen uit grafiek (onnauwkeurig, dus niet meegenomen in literatuur analyse) |
|
|
|
for general anesthesia |
|
|
Loss-to-follow-up: |
|
|
|
-history of an open |
Twelve patients |
Infections |
|||||
|
abdomen treatment |
withdrew consent or |
(wound |
|||||
|
-Patients participating |
underwent no |
infection) N(%) |
|||||
|
in other trials |
incisional hernia |
L: 4 (4) |
|||||
|
|
repair after |
O: 5 (5) |
|||||
|
N total at baseline: |
randomization. |
|
|||||
|
Randomized: |
At a mean (SD) |
|
|||||
|
Laporoscopic:n=99 |
follow-up of 35 (33.3) |
|
|||||
|
Open: n=107 |
months after index |
|
|||||
|
|
surgery, 146 of 194 |
|
|||||
|
Analyzed: |
patients (75%) |
|
|||||
|
Laporoscopic:n=94 |
completed follow- |
|
|||||
|
Open: n=100 |
up |
|
|||||
|
Important prognostic |
Incomplete outcome |
|
|||||
|
factors2: |
data: |
|
|||||
|
Age: mean (SD) |
94 patients were |
|
|||||
|
L: 59.1 (12.8) |
analysed |
|
|||||
|
O: 56.7 (12.8) |
|
|
|||||
|
Sex: % M |
|
|
|||||
|
L: 60% |
|
|
|||||
|
O: 59% |
|
|
|||||
|
Preoperative BMI, |
|
|
|||||
|
mean (SD): |
|
|
|||||
|
L: 28.3 (4.7) |
|
|
|||||
|
O: 29.3 (4.6) |
|
|
|||||
|
Groups were |
|
|
|||||
|
comparable at baseline |
|
|
|||||
|
Rogmark, 2013 |
Type of study: Non-blinded randomised controlled trial |
Inclusion criteria: Age ≥ 18 years age Incisional hernia within the compartment of the |
Pneumoperitoneum was achieved by an open-access technique laterally and the intra-abdominal |
The retromuscular rectus aponeurosis was sutured and the hernia sac invaginated. A heavyweight |
Length of follow-up: 8 weeks
Loss-to-follow-up: |
Hernia Recurrence (after 8 weeks): L: 0 (0%) O: 0 (0%) |
Mean on VAS scale voor acute pain afgelezen uit grafiek (onnauwkeurig, dus niet meegenomen |
|
|
Setting: 2 university hospitals and 5 general public hospitals 11 surgeons
Country: Sweden
Source of funding: funding from Lund University, Region Skane Research & Development Funds, Ethicon, Johnson & Johnson Medical Ltd., The Einar and Inga Nilsson Foundation, The Anna Lisa and Sven- Eric Lundgren Foundation, and The Crafoord Foundation. |
rectus muscles and with a hernia defect not exceeding 10 cm in width at preoperative physical examination. Hernias medially located in otherwise sufficient oblique or transverse incisions were accepted.
Exclusion criteria: Emergency operation, previous hernia mesh repairs, parastomal hernias, other planned simultaneous operation, immunesuppressive therapy, liver cirrhosis, ascites, generalized malignancy, enterocutaneous fistula, skin infection, physical conditions precluding laparoscopic surgery, the ASA grade > III, risk of pulmonary insufficiency after reduction of hernia content, previous open abdomen treatment, former abdominal |
insufflation pressure was set at a maximum of 10 to 12 mm Hg. A minimum of 3 trocars were used. The total length of the old scar was covered with a composite mesh of appropriate size, overlapping the hernia defect by at least 5 cm. It |
polypropylene mesh was positioned behind the rectus muscles, reaching the lateral borders covering the total length of the dissected area. An exception from covering the total length of the old scar was in the case of a hernia located in the midline of an oblique or transverse incision. The mesh was fixed to the closed posterior aponeurosis with only a running non-absorbable suture in the midline. The anterior aponeurosis was closed in front of the mesh, and when this was not possible, sutured to the mesh. |
Of 157 randomized patients, 133 received intervention and were analysed During follow-up: 2 lost to follow-up in LR (peritoneal carcinosis and missing protocol data) and 2 (declined further participation and undiagnosed abuse) in OR.
Incomplete outcome data: Intention to treat analysis was reported |
Postoperative Pain 0-5 days (VAS) L: 5.2 O: 4.3
Surgical Site Infections L: n=1 O: n=16 P<0.001 (Fischer exact test) |
in literatuur analyse) |
|
|
|
radiation therapy, body |
|
|
|
|
|
|
mass index (BMI) |
|||||||
|
exceeding 40 kg/m2, |
|||||||
|
bleeding |
|||||||
|
disorders, females |
|||||||
|
planning future |
|||||||
|
pregnancy, and |
|||||||
|
psychological |
|||||||
|
or social conditions |
|||||||
|
prohibiting the patient |
|||||||
|
to adhere to the |
|||||||
|
protocol |
|||||||
|
N total at baseline: |
|||||||
|
157 randomized |
|||||||
|
patients, 133 received |
|||||||
|
intervention: 64 LR and |
|||||||
|
69 OR. |
|||||||
|
Important prognostic |
|||||||
|
factors2: |
|||||||
|
Age: mean (SD) |
|||||||
|
L: 58 (13.6) |
|||||||
|
O: 58 (11.1) |
|||||||
|
Sex: % M |
|||||||
|
L: 42% |
|||||||
|
O: 41% |
|||||||
|
BMI, mean (SD): |
|||||||
|
L: 29.3 (4.0) |
|||||||
|
O: 29.3 (4.7) |
|||||||
|
Groups were |
|||||||
|
comparable at baseline |
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence-table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors ((potential) confounders).
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
Evidence table for systematic review of RCT’s and observational studies (intervention studies)
Research question:
Wat zijn de verschillen tussen het sluiten van een littekenbreuk met een kunststof mesh ten opzichte van een van get primair sluiten van een littekenbreuk met een hechtingen?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Mathes, 2016 |
SR and meta- analysis of RCT’s
Literature search up to (06/2014)
A: Luijendijk, 2000 B: Korenkov, 2002 C: Venclauskas, 2010 D: Weber, 2010
Study design: RCT
Setting and Country: |
Inclusion criteria SR: 1. Patients Adult patients (C18) with primary or incisional ventral hernia 2. Intervention/co mparison of suture versus mesh repair
RCT |
Describe intervention: A: Mesh (sublay, polypropylene)
B: Suture
C: Mesh (onlay, Polypropylene + polyglecaprone CG1)
D: Mesh (sublay) |
Describe control:
A: Suture (polypropylene)
B: Mesh (onlay polypropylene) Onlay autodermal skin graft
C: Suture (nonabsorbable, keel technique, IG)
D: Suture |
End-point of follow-up:
A: 3 years B: 9 months C: 12 months D: 5 years
For how many participants were no complete outcome data available? (intervention/control) A: Randomised: 84/97 Analysed: 84/97
B: Randomised: 33/39 + 28 Analysed: 33/39+ 28 C: Randomised: 54/57+50 |
Outcome measure-1 Number of recurrences
Effect measure: RR, RD, mean difference (95% CI): A: 17 versus 39; 0.005 B: 4 versus 3 versus 4; NS C: 12 versus 6 versus 1; NS (IG versus CG1); P= 0.002 D: 15 (8 %) versus 50 (27 %); p= 0.001
Pooled effect (random effects model / fixed effects model): 0.39((0.28, 0.54) favouring mesh. Heterogeneity (I2): 0% P=<0.00001 |
Facultative:
Brief description of author’s conclusion
Personal remarks on study quality, conclusions, and other issues (potentially) relevant to the research question
Level of evidence: GRADE (per comparison and outcome measure) including reasons for down/upgrading
Sensitivity analyses (excluding small studies; excluding studies with short follow-up; |
|
|
Faculty of Health-School of Medicine, Institute for Research in Operative Medicine, Witten/Herdeck e University, Cologne, Germany
Source of funding: Non-commercial / there was no funding for this systematic review. |
5. Language Article in English or German Exclusion criteria SR: Not mentioned
4 studies included
Hernia type: A: Primary or first time recurrent vertical midline incisional hernia (≥ 6 cm) B: Simple incisional hernia (< 10 cm diameter) C: Middle incisional hernia D: Ventral hernias ≤ 25 cm2
Important patient characteristics at baseline: Number of patients; characteristics important to the research |
|
|
Analysed: 50/53+49 D: Randomised: 247/247 Analysed: 180/184 |
|
excluding low quality studies; relevant subgroup-analyses); mention only analyses which are of potential importance to the research question
Heterogeneity: clinical and statistical heterogeneity; explained versus unexplained (subgroupanalysis) |
|
|
|
question and/or |
|
|
|
|
|
|
for statistical |
|||||||
|
adjustment |
|||||||
|
(confounding in |
|||||||
|
cohort studies); |
|||||||
|
for example, |
|||||||
|
age, sex, bmi,... |
|||||||
|
N |
|||||||
|
A: I:84/ C:97 |
|||||||
|
B: I: 33/ C 39 + |
|||||||
|
28 |
|||||||
|
C: I: 54/C:57+50 |
|||||||
|
D: I: 247/C: 247 |
|||||||
|
Age: |
|||||||
|
A: Median |
|||||||
|
(Range) |
|||||||
|
I:63 (25–82) |
|||||||
|
C: 57 (23–85) |
|||||||
|
B: Mean ± SD |
|||||||
|
I:60 ± 13/ 50 ± |
|||||||
|
17 |
|||||||
|
C: 61 ± 11 |
|||||||
|
C: Mean ± SD |
|||||||
|
I: 56.9 ± 11.5 |
|||||||
|
/53 ± 11.6 |
|||||||
|
C: 54.2 ± 12.4 |
|||||||
|
D:?? |
|||||||
|
Sex: |
|||||||
|
A: Ratio |
|||||||
|
Male 1.0:1 |
|||||||
|
Female 1.5:1 |
|||||||
|
B: |
|||||||
|
I: 32%/33% |
|||||||
|
C: 25% |
|
|
|
C: D:
Groups comparable at baseline? |
|
|
|
|
|
Table of quality assessment for systematic reviews of RCT’s and observational studies
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Sauerland, 2011 |
Yes |
Yes |
Yes |
Yes |
Not applicable, all RCT’s |
Yes |
Yes |
Yes |
Yes |
|
Mathes, 2015 |
Yes |
Yes |
No |
No |
Not applicable, all RCT’s |
Yes |
Yes |
No |
Yes |
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table et cetera).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (for example Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (for example funnel plot, other available tests) and/or statistical tests (for example Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Risk of bias table for intervention studies (randomized controlled trials)
Research question: Hoe dient een littekenbreuk (operatief) behandeld te worden?
|
Study reference
(first author, publicatio n year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/uncle ar) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/uncle ar) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/uncle ar) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/uncle ar) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/uncle ar) |
Bias due to loss to follow-up?5
(unlikely/likely/uncle ar) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/uncle ar) |
|
Eker, 2013 |
Patients were randomized by computer-generated lists stratified by center and primary or recurrent incisional hernia. |
Unclear |
Likely |
Likely |
Likely |
Unlikely |
Unclear |
Unclear |
|
Rogmark, 2013 |
For allocation of the participants, a computer-generated list of random numbers was used. The randomization sequence was created using Microsoft Excel 2003 and was stratified by the center with a 1:1 allocation using |
Unlikely |
Likely |
Likely |
Likely |
Unlikely |
Unlikely |
|
|
|
random block sizes of 4, 6, or 8. The randomization took place when the patient was scheduled for operation. |
|
|
|
|
|
|
|
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear.
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 23-11-2018
Laatst geautoriseerd : 23-11-2018
Geplande herbeoordeling : 01-01-2023
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep wel/niet in stand gehouden. Uiterlijk in 2023 bepaalt het bestuur van de Nederlandse Vereniging voor Heelkunde of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse vereniging Voor Heelkunde is regiehouder van deze richtlijn Littekenbreuken en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn Littekenbreuken. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Autorisatie en commentaarfase
De conceptrichtlijn wordt aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (http://www.kennisinstituut.nl) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Het doel van het project is het ontwikkelen van een multidisciplinaire evidencebased richtlijn voor de diagnostiek en behandeling van patiënten met complexe littekenbreuken. Met behulp van deze richtlijn kan de praktijkvariatie worden teruggedrongen en kan de zorg aan deze patiëntengroep worden verbeterd. Een evidencebased richtlijn zal bijdragen aan meer uniformiteit in de behandeling en zal waardevol zijn om toegewijde chirurgen en andere gerelateerde zorgverleners te ondersteunen bij een effectieve en veilige behandeling.
Doelgroep
Deze richtlijn geldt voor alle volwassen patiënten met één of meerdere littekenbreuken in de buikwand tussen de laterale zijde van de musculus abdominis recti.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2016 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met Littekenbreuken te maken hebben.
Werkgroep
- Dr. S.W. (Simon) Nienhuijs, chirurg, werkzaam in het Catharina ziekenhuis, Eindhoven, NVvH (voorzitter)
- Dr. T.J. (Theo) Aufenacker, chirurg, werkzaam in het Rijnstate, Arnhem, NVvH
- E. (Elske) Berkvens, MSc, fysiotherapeut, werkzaam in het Elkerliek ziekenhuis, Helmond, KNGF
- Prof. dr. M.A. (Marja) Boermeester, chirurg, werkzaam in het AMC, Amsterdam, NVvH
- S. (Sandra) Janssen MSc, verpleegkundig specialist, werkzaam in het Elkerliek ziekenhuis, Helmond, V&VN
- Dr. R.K.J. (Rogier) Simmermacher, chirurg, werkzaam in het UMC, Utrecht, NVvH
- Dr. T.S. (Tammo) de Vries Reilingh, chirurg, werkzaam in het Elkerliek ziekenhuis, Helmond, NVvH
- P. (Pieter) Zwanenburg MSc., arts onderzoeker, werkzaam in het AMC, Amsterdam
Met ondersteuning van:
- Dr. W.A. van Enst, senior-adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- H. Kooijmans, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- D.P. Gutierrez, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Aufenacker |
Chirurg |
Penningmeester DHS/ werkgroep buikwand chirurgie van NVGIC. Lid Steering committee Herniasurge: International guidelines for groin hernia management |
- |
Geen |
|
Berkvens |
Fysiotherapeut |
Extern beoordelaar scripties bij Fontys Hogeschool opleiding Fysiotherapie |
- |
Geen |
|
Boermeester |
GE Chirurg |
Advisory board member and/of speaker for Acelity/KCI, Bard, Johnson&Johnson Vice-president van |
Grants en pending grants voor investigator-initiated onderzoek (geen contract onderzoek) van Baxter, Ipsen, Bard, Acelity/KCI, Mylan, Johnson&Johnson, LifeCell/Allergan |
Geen |
|
|
|
Surgical Infection Society Europe |
|
|
|
Enst, van |
Senior-adviseur |
Lid van GRADE working group / Dutch GRADE Network |
- |
Geen |
|
Janssen |
Verpleegkundig Specialist wondzorg |
Docent opleiding wondverpleegkundige Zorgacademie Radboud UMC en Zorgacademie Erasmus MC Docent opleiding wondconsulent Zorgacademie Radboud UMC Bestuurslid V&VN Lid Wondplatform Nederland |
- |
Geen |
|
Nienhuijs |
Chirurg |
DHS/ voorzitter werkgroep buikwand chirurgie van NVGIC |
Deelname hernia umbilcalis/epigastrica studie zowel Medtronic als bij Johnson & Johnson. |
Geen |
|
Simmermacher |
Chirurg en Hoofd afdeling Heelkunde |
- |
- |
Geen |
|
Vries, de Reilingh |
Gastro- Intestinaal chirurg en Chirurg Oncoloog |
- |
Multicenter studies geinitieerd elders: Phasix trial, Sanics II trial, Close-up trial |
Geen |
|
Zwanenburg |
Promovendus / onderzoeker |
- |
Promotie traject gefinancierd vanuit een grant voor het AMC als "center of expertise" van Acelity/KCI |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een focusgroep. Een verslag hiervan (zie aanverwante producten) is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. Tijdens de oriënterende zoekactie werd gezocht op literatuur naar patiëntenperspectief (zie Strategie voor zoeken en selecteren van literatuur).
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten. De werkgroep heeft geen interne kwaliteitsindicatoren ontwikkeld maar doet suggesties wat geregisteerd kan worden.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidencebased richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door Nederlandse vereniging voor Heelkunde, Koninklijk Nederlands Genootschap Fysiotherapie, Verpleegkundigen & Verzorgende Nederland, Kenniscentrum Wondzorg, Kenniscentrum Wondzorg, Zorgverzekeraars Nederland via een Invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen Nice en Sign richtlijnen, systematische reviews via Medline (OVID). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE- methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008) en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE- methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Randvoorwaarden.
Indicatorontwikkeling
Er werden geen interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
van Everdingen JJE, Burgers JS, Assendelft WJJ, et al. Evidence-based richtlijnontwikkeling. Bohn Stafleu Van Loghum. 2004.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit.https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
