Kweekafname en transport voor het vaststellen van dragerschap van MRSA
Uitgangsvraag
Wat is het beleid rond kweekafname en transport voor het vaststellen van dragerschap van MRSA?
Aanbeveling
Neem bij patiënten kweken af van de neus, keel en perineum/rectum voor de detectie van dragerschap van MRSA.
Neem bij personeelsleden kweken af van de neus, keel en eventueel perineum.
Neem op indicatie ook materiaal af van andere anatomische locaties, zoals bij niet intacte huid, uitgezonderd waar steriele wondbedekking aanwezig is.
Gebruik voor een uitstrijk voor MRSA detectie een swab met een adequaat transportmedium (Amies). Overweeg om een flocked swab te gebruiken.
Overwegingen
Kwaliteit van bewijs
Ten aanzien van anatomische locatie screening
Niet van toepassing, omdat geen systematic review verricht is.
Ten aanzien van afnamemateriaal
Verschil in detectiepercentages SA/MRSA
a) Screening in een populatie van patiënten met gekende kolonisatiestatus voor SA/MRSA
De algehele kwaliteit van het bewijs is zeer laag vanwege indirectheid, beperkingen in onderzoeksopzet en imprecisie.
b) Screening in een populatie waarin de kolonisatiestatus voor SA/MRSA niet bekend was
De algehele kwaliteit van het bewijs is matig vanwege beperkingen in onderzoeksopzet en uitvoering.
Verschil in percentage niet interpreteerbare tests
De algehele kwaliteit van het bewijs is laag vanwege imprecisie.
Waarden en voorkeuren
Ten aanzien van anatomische locatie screening
Op het gebied van het opsporen van patiënten met MRSA heeft een patiënt geen specifieke keuzemogelijkheid doordat er geen diversiteit aan keuzes bestaat. Zodoende is gezamenlijke besluitvorming in dit onderdeel van de medische hulpverlening niet aan de orde.
Ten aanzien van afnamemateriaal
Niet van toepassing, omdat de keuze van het afnamemateriaal geen bijkomende belasting voor de individuele persoon oplevert.
Kosten en middelen
Ten aanzien van anatomische locatie screening
Het valt niet te verwachten dat toepassing van onderstaande aanbevelingen extra kosten met zich mee zal brengen aangezien deze grotendeels al worden toegepast in de huidige praktijk.
Ten aanzien van afnamemateriaal
Flocked swabs zijn duurder dan niet-flocked swabs. De verhouding tussen de kosten en de netto-baten zal echter sterk afhangen van de toegevoegde waarde van flocked swabs om extra gevallen van kolonisatie met MRSA te ontdekken: indien verspreiding van MRSA in een uitbraaksituatie en bijkomende screeningsrondes kunnen worden voorkomen, zou de kosten/baten verhouding in het voordeel van flocked swabs kunnen uitvallen. Op basis van het beschikbare bewijs kan de werkgroep geen uitspraak doen over de kosten/baten verhouding van screening met flocked swabs screening tegenover screening met niet-flocked swabs.
Professioneel perspectief
Ten aanzien van anatomische locatie screening
Het advies is om per anatomische locatie een swab te gebruiken. Bij gebruik van dezelfde swab voor meerdere anatomische locaties in dezelfde persoon moet gerealiseerd worden dat daarmee ook verplaatsing van micro-organismen gebeurt. Bij patiënten is dit af te raden. Ook neemt de gevoeligheid voor detectie per swab af als meerdere locaties worden afgestreken. Bij personeel kan overwogen worden om dezelfde swab te gebruiken voor keel en neus, daar deze locaties anatomisch al in verbinding staan. Voor afname van rectum/perineum kan het zelfde principe gelden en overwogen worden om deze twee locaties met 1 swab af te nemen.
Bij grootschalige screeningsakties is het te overwegen om materialen te “poolen”: dat wil zeggen dat er een ophopingsmedium wordt gebruikt voor meerdere afnamestokken.
De keuze is om dit random bij ontvangst op het laboratorium te doen, of per persoon; personeelslid of patiënt. Het is in ieder geval altijd zo dat de sensitiviteit en kans op detectie daalt zodra er meer swabs in 1 ophopingsmedium worden samengevoegd om daarna 1 test uit te voeren op dit medium. Poolen van verschillende personen in 1 medium heeft nadelen ten opzichte van poolen van 1 persoon. Indien niet is te achterhalen vanuit het restmateriaal welke swab het positieve testresultaat heeft gegenereerd, is voor alle uitslagen van de materialen in de pool, de uitslag niet interpreteerbaar. Poolen van dezelfde personen verdient daarom de voorkeur boven poolen van verschillende personen.
Dragerschap kan zich met name manifesteren in de neus, keel en perineum/rectum. De lies, vagina, darm en oksel zijn andere locaties genoemd in de literatuur (zie richtlijn NVMM Guideline Laboratory detection of highly resistant microorganisms (2012)/ 2.1.2.1. Culture sites).
De kans om op deze locaties MRSA aan te treffen is voor geen enkele locatie 100%. Dit is de reden om altijd meerdere locaties te testen.
Mertz et al. (2009) hebben voor methicillin sensitive Staphylococcus aureus (MSSA) aangetoond dat 12% alleen keeldragerschap had, en 36% alleen neusdragerschap. Voor gezonde vrijwilligers waren deze percentages 16 en 15% respectievelijk. Zij geven aan dat er uit de literatuur geen aanwijzingen zijn dat MSSA zich anders zou verspreiden over het lichaam dan MRSA. Zij hebben niet op rectum/perineumdragerschap getest. In een studie uit Denemarken is een keel dragerschap aangetoond bij 86/133 (65%), een neusdragerschap bij 81/142 (57%) en een perineum dragerschap bij 43/125 (34%) van de MRSA dragers die in aanmerking kwamen voor eradicatietherapie (Bagge et al., 2019).
Kolonisatie van MSSA in een gezonde controle groep (n=30) uit Zweden liet zien dat 21/30 (70%) neusdrager was, 20/30 (66%) keeldrager en 10/30 (33%) perineumdrager was. Dragerschap op 1 anatomische locatie was gezien bij 13/30 (43%), en 13/30 (43%) en 3/30 (10%) waren op 2 en resp. 3 plaatsen drager (Dahlman et al., 2017).
Of de distributie van anatomische locaties voor dragerschap bij zorgverleners anders is, is niet bekend. In een studie van Bitterman et al. (2010) was de neus de meest voorkomende plaats van kolonisatie van MRSA vergeleken met 45% en 38% voor perineum en keel respectievelijk. De gevoeligheid om MRSA aan te tonen was voor de neus en keel tezamen 82%, voor neus en
perineum was dit 90%. 30% was alleen in de neus gekoloniseerd, 16% alleen in de keel, 9% alleen in het perineum. De toegevoegde waarde van een kweek van de lies was in de studie van Senn et al. (2012) afhankelijk van de clone: neus en keel had een sensitiviteit van 74% (68-78%) en neus, keel en lies was 99% (97-100%). In deze studie was het perineum niet meegenomen. Voor pasgeborenen was de anatomische locatie met de hoogste opbrengst de navelstomp (MSSA: 64%; MRSA: 68%) maar de combinatie van neus en navelstreng gaf nog betere resultaten: MSSA: 86%; MRSA: 91% (Cursino et al., 2012). Deze studies onderbouwen dat er van meerdere anatomische locaties materiaal afgenomen moet worden waarbij in ieder geval neus, keel en perineum geïncludeerd wordt. Op indicatie wordt ook materiaal afgenomen van andere anatomische locaties, zoals bij niet intacte huid, uitgezonderd waar steriele wondbedekking aanwezig is. Om praktische redenen kan overwogen worden om rectum/perineum bij het testen van zorgpersoneel eerstens achterwege te laten, tenzij een uitbraak onbegrepen voortgaat.
Ten aanzien van afnamemateriaal
Materiaal voor kweekafname kan onderscheiden worden in niet-flocked en flocked swabs oftewel wattenstok. Niet–flocked swabs kunnen droog zijn of met een transport medium.
Transportmedia zijn oplossingen van buffers met koolhydraten, peptonen en andere voedingsstoffen (met uitzondering van groeifactoren) die zijn ontworpen om de levensvatbaarheid van bacteriën tijdens transport te behouden zonder hun vermenigvuldiging toe te staan. Stuart Transport Medium is een niet-voedingsmedium met een klein gehalte aan agar zodat er een halfvaste consistentie ontstaat die oxidatie en uitdroging tijdens transport voorkomt.
Amies is een modificatie van Stuart's medium waarin glycerofosfaat wordt vervangen door een anorganische fosfaatbuffer (Phosphate buffered solution (PBS). Deze wijziging verlengt de levensvatbaarheid en verhoogt dus de opbrengst (Amies, 1967). Robinson et al. (2012) toonde aan dat MRSA (en VRE) kunnen overleven in Amies transportmedia gekoeld of op kamertemperatuur. Er werd over de periode van 14 dagen geen significante afname van de opbrengst van MRSA (of VRE) aangetoond. Amies medium is geschikt voor transport van afnamemateriaal bestemd voor MRSA.
Amies wordt toegepast in gel of agar (non-flocked) of als vloeistof (flocked eSwabs). Synthetische swabs (polyester, rayon en dacron) hebben de voorkeur boven katoenen swabs die remmende stoffen kunnen bevatten.
Flocked swabs zijn swabs bedekt met korte nylonvezels die loodrecht op de kern van de stok zijn gerangschikt. Dit verhoogt de absorptie van materiaal. Er wordt een webachtige structuur gerealiseerd, zodat het meer materiaal verzamelt en vasthoudt dan traditionele swabs. De flocked swabs hebben geen interne kern om het materiaal in te verzamelen zoals bij niet niet-flocked swabs. ESwab zijn een flocked swab en 1 ml gemodificeerde Amies transport medium, waarin het materiaal elueert. Voordeel is dat het monster hierdoor vloeibaar is, zodat meerdere tests uitgevoerd kunnen worden. Elutie (eSwab=Elution swab) in het vloeibare (transport)media is essentieel en is een mechanisch proces, dus aandacht voor het vortex proces is belangrijk. Het vloeibare transport medium wordt gebruikt voor verdere bewerking in bouillon agar of moleculaire testen.
Screening met flocked swabs in een populatie van patiënten met gekende kolonisatiestatus voor SA/MRSA
Saegeman et al. (2011) vonden in een kwantitatieve vergelijking van groeidichtheid tussen de eSwab en een droge katoenen swab dat er op platen beënt met eluaat van de eSwab gemiddeld 9 keer meer kolonies groeiden. Op platen beënt met de roll-plate methode groeiden gemiddeld 1,3 keer meer kolonies met de eSwab dan met een katoenen swab. Ondanks deze verschillen was er geen significant verschil tussen het aantal gedetecteerde patiënten met MRSA kolonisatie. Smismans et al. (2009) vonden in in-vitro vergelijkingen ook een 3,6 tot 6 keer hogere recovery met de elutie en roll-plate methode voor de eSwab in vergelijking met een Venturi Transystem swab (rayon swabs), maar konden geen verschil aantonen in een beperkte klinische studie.
De gunstige prestatiekenmerken voor eSwabs t.o.v non-flocked swabs in in-vitro studies hebben zich in deze studies niet vertaald naar een significant hoger detectiepercentage.
Screening met flocked swabs in een populatie waarin de kolonisatiestatus voor SA/MRSA niet bekend was
Jones et al. (2011) detecteerden significant meer SA kolonisatie met de eSwab dan met een M40 Transystem (Rayon swabs met Amies of Stuart medium), zowel met en zonder aankweekmedium. Een nadeel van deze studie was dat de verwerking van eSwabs en de M40 transystem swabs anders verliep (automatisch vs. manueel), wat tot een vertekening zou kunnen leiden. Verhoeven et al. (2010) vonden zowel in in-vitro studies als monsters van vrijwilligers een verschil tussen flocked swabs en rayon swabs voor detectie van SA kolonisatie, ten voordele van flocked swabs.
In tegenstelling tot bovenstaande studies vonden De Silva et al. (2010) en Beck et al. (2016) geen significant verschil tussen flocked swabs en rayon swabs.
Hoewel alle geïncludeerde klinische studies en in-vitro onderzoeken ten voordele van de flocked swab zijn, is het bewijs te onzeker om de flocked swab sterk aan te bevelen boven andere niet-flocked swabs.
Verschil in percentage niet interpreteerbare testen
Beck et al. (2016) hadden significant minder niet-interpreteerbare testen (Xpert SA Nasal Complete Assay) met de eSwab dan met een kunststof (rayon) swab. De interne controle (die vervat zit in de testcapsule) had lagere Ct waarden met de eSwab dan met de kunststof swab – deze bevinding is niet helemaal uitgeklaard door de auteurs. Mogelijk kan de hoeveelheid vloeistof die per swab werd gebruikt of het aantal inhibitoren in deze vloeistof een rol spelen.
Indirect
Warnke et al. gebruikten een kunstneus met een gestandaardiseerde hoeveelheid MRSA om verschillende soorten swabs te vergelijken. Copan eSwabs hadden de hoogste recovery van MRSA en de hoogste sensitiviteit (100% (15/15) zowel met en zonder Amies medium). De sensitiviteit van kunststof (rayon) swabs varieerde: de Dryswab (MWE) had een sensitiviteit van 73% (11/15) zonder Amies medium en 93% (14/15) met Amies medium; de Mastaswab (Mast Group) had een sensitiviteit van 13% (2/15) zonder Amies medium en 6/15 (40%) met Amies medium en een ‘ Neutral Swab’ (Sarstedt) had een sensitiviteit van 0% (0/15) zonder Amies medium en 47% (7/15) met Amies medium. Een swab van polyurethaan schuim, Σ-Swab (Mast group) had een sensitiviteit van 93% (14/15) zonder Amies medium en 100% (15/15) met Amies medium.
Deze studie toont het belang van een elutie/transportmedium aan en benadrukt de betere resultaten in-vitro van flocked swabs en PU schuim swabs tegenover kunststof swabs. In deze studie werden swabs direct (of vanuit een elutiemedium) uitgeplaat. Mogelijk zijn de sensitiviteitsverschillen tussen verschillende soorten swabs kleiner als er een ophopingsmedium wordt gebruikt.
Europese en internationale richtlijnen
Aanbevelingen betreffende het type swab voor MRSA of SA screening zijn zeldzaam. De Belgische richtlijnen (HGR, 2019) raden een transportmedium (Stuart of Amies) aan en ontraden het gebruik van droge swabs. Tevens wordt vermeld dat eSwabs meer MRSA dragers zouden opsporen dan katoenen uitstrijkjes. De bron voor deze uitspraak wordt niet vermeld.
Aanvaardbaarheid en haalbaarheid van de aanbevelingen
De aanbevelingen sluiten aan op de huidige klinische praktijk en de vorige NVMM richtlijnen. De werkgroep verwacht bijgevolg dat de aanbevelingen aanvaardbaar en haalbaar zijn voor alle betrokken partijen.
Rationale van de aanbeveling(en)
Ten aanzien van anatomische locatie screening
De aanbevelingen zijn gebaseerd op de algemene kennis en literatuur over anatomische locaties van S. aureus dragerschap.
Ten aanzien van afnamemateriaal
Leidend bij het opstellen van de aanbevelingen was het feit dat de bewijskracht onvoldoende is om een sterke voorkeur voor flocked swabs uit te spreken.
Onderbouwing
Achtergrond
Voor kweekafname ter detectie van MRSA is het van belang dat de anatomische locaties waar MRSA zich kan bevinden worden getest. Anatomische locaties van dragerschap worden zodanig geselecteerd dat er een minimale kans is om dragers te missen.
Veel controles op de aanwezigheid van MRSA gebeuren in de thuissituatie. Daarbij spelen transportvoorwaarden en -condities een rol, waarbij de kwaliteit van het resultaat negatief beïnvloed kan worden. (Zelf)afname op thuislocaties en transport per reguliere post van de kweekmaterialen geeft een langere periode zonder gereguleerde temperatuur condities. De transportvoorwaarden en -condities zijn voor MRSA niet anders dan voor gevoelige S. aureus.
Een voordeel is dat de test op MRSA na incubatie in een ophoping gebeurt, eventuele teruggang in aantallen MRSA tijdens transport kunnen hierdoor teniet gedaan worden.
Conclusies
|
Zeer laag GRADE |
Populatie van patiënten met positieve kolonisatiestatus voor SA/MRSA
Verschil in detectiepercentages SA/MRSA In een populatie met een positieve kolonisatiestatus voor SA/MRSA lijkt screening voor SA/MRSA met een niet-flocked swab te resulteren in een lager detectiepercentage vergeleken met screening met een flocked swab. Het bewijs hiervoor is echter zeer onzeker.
Bron: Smismans et al., 2009; Saegeman et al., 2011 |
|
Matig GRADE |
Populatie waarin de kolonisatiestatus voor SA/MRSA niet bekend was
Verschil in detectiepercentages SA/MRSA In een populatie waarvan de kolonisatiestatus voor SA/MRSA niet gekend was reduceert screening voor SA/MRSA met een niet-flocked swab waarschijnlijk het detectiepercentage in vergelijking tot het screening met een flocked swabs.
Bron: De Silva et al., 2010; Verhoeven et al., 2010; Jones et al., 2011; Beck et al., 2016 |
|
Laag GRADE |
Totale populatie
Verschil in detectiepercentages SA/MRSA In de totale populatie lijkt screening met een niet-flocked swab te resulteren in een lager detectiepercentage vergeleken met een flocked swabs.
Bron: Smismans et al., 2009; Saegeman et al., 2011; De Silva et al., 2010; Verhoeven et al., 2010; Jones et al., 2011; Beck et al., 2016 |
|
Laag GRADE |
Verschil in percentage niet interpreteerbare tests In een populatie waarvan de kolonisatiestatus voor SA/MRSA niet gekend was lijkt screening voor SA/MRSA met een niet-flocked swab het percentage niet interpreteerbare moleculaire tests te verhogen in vergelijking tot het screening met een flocked swabs. Het bewijs hiervoor is echter zeer onzeker.
Bron: Beck et al., 2016 |
Samenvatting literatuur
Ad PICO-vraagstelling 1: afnamemateriaal voor MRSA screening
Ter informatie:
- Zie de evidence tabellen voor gedetailleerde informatie over het risico op bias per studie. Voor gedetailleerde informatie betreffende studiepopulatie, interventie, uitkomstmaten en resultaten zie de evidence tabellen. Voor deze samenvatting zijn in elke studie alleen de data geëxtraheerd die betrekking hebben op de huidige PICO vraagstelling.
- De PICO-vraag is een vraag op het domein van diagnostiek maar valt niet geheel onder het paradigma diagnostisch accuraatheidsonderzoek. In dit type onderzoek is namelijk altijd zowel sensitiviteit als specificiteit van belang voor het aantonen of uitsluiten van ziekte. Hier betreft het alleen het verschil in gevoeligheid (sensitiviteit) tussen twee tests c.q. twee methoden voor afnamemateriaal om SA/MRSA te detecteren. Ter info: vals positieven bestaan niet in deze setting.
Onderzoeksdesign
Alle geïncludeerde studies zijn cross-sectionele studies. Zie de evidence tabellen voor de oorspronkelijke opzet van de studies.
Land waar studie is verricht
Tabel 2. Land waar studie is verricht
|
Studie verricht in |
Aantal studies |
|
België |
2 studies (Smismans et al., 2009; Saegeman et al., 2011) |
|
Australië |
1 studie (De Silva et al., 2010) |
|
Frankrijk |
1 studies (Verhoeven et al., 2010) |
|
Verenigd Koninkrijk |
1 studie (Jones et al., 2011) |
|
Verenigde Staten |
1 studie (Beck et al., 2016) |
Studiepopulaties
Tabel 3. Studiepopulaties waarover data geëxtraheerd is
|
Studie referentie |
Studiepopulatie |
|
Smismans et al., 2009 |
Patiënten gekend met MRSA kolonisatie (n=18). Beide tests werden uitgevoerd in dezelfde populatie |
|
De Silva et al., 2010 |
Gezonde vrijwilligers (n=100). Beide tests werden uitgevoerd in dezelfde populatie |
|
Verhoeven et al., 2010 |
Gezonde vrijwilligers (n=90). Beide tests werden uitgevoerd in dezelfde populatie |
|
Jones et al., 2011 |
Patiënten die werden opgenomen in het ziekenhuis (n=867). Beide tests werden uitgevoerd in dezelfde populatie |
|
Saegeman et al., 2011 |
Een verzameling van patiënten met gekende MRSA kolonisatie en patiënten waarvan de kolonisatiestatus niet bekend was (n=137).Beide tests werden uitgevoerd in dezelfde populatie |
|
Beck et al., 2016 |
Patiënten in het ziekenhuis (n=223). Beide tests werden uitgevoerd in dezelfde populatie |
De studiepopulaties zijn heterogeen ten aanzien van het achtergrondrisico op dragerschap van SA/MRSA. Twee studies onderzochten patiënten waarvan de kolonisatiestatus met SA/MRSA gekend was: Smismans (2009) includeerde enkel patiënten die gekend waren met MRSA kolonisatie en Saegeman (2011) maakte een selectie van patiënten met gekende MRSA kolonisatie en patiënten waarvan de kolonisatiestatus niet bekend was. Vier studies onderzochten patiënten of vrijwilligers zonder dat de kolonisatiestatus bekend was (De Silva et al., 2010; Verhoeven et al., 2010; Jones et al., 2011; Beck et al., 2016).
Afnamemateriaal
De controle test werd in elke studie uitgevoerd met een flocked swab. Vijf studies gebruikten een eSwab (Copan) (Smismans et al., 2009; De Silva et al., 2010; Jones et al., 2011; Saegeman et al., 2011; Beck et al., 2016). Verhoeven (2010) gebruikte een “regular flocked swab” (Copan). De afnamematerialen die gebruikt werden voor de interventietest zijn hieronder weergegeven in tabel 4.
Tabel 4. Gebruikte interventietests
|
Studie referentie |
Afnamemateriaal interventietest |
|
|
Smismans et al., 2009 |
Venturi Transystem (Copan, Brescia, Italy) met Amies gel transport medium |
|
|
De Silva et al., 2010 |
Rayon swab (Copan) |
|
|
Verhoeven et al., 2010 |
Rayon swabs (standard swabs met Amies agar gel, reference 108C; Copan) |
|
|
Jones et al., 2011 |
M40 charcoal-based Transystem swab (Copan Italia 408CST) |
|
|
Saegeman et al., 2011 |
Dry cotton Copan swabs (dry swab, wooden applicator, cotton tip, 150C, Sterilin; Copan, Brescia, Italy) |
|
|
Beck et al., 2016 |
Liquid Stuart BBL Dual CultureSwab (traditional swab) (BD Diagnostics, Sparks, MD) |
Detectiemethodes
Vijf studies detecteerden SA of MRSA op basis van kweek op chromogene media (zie de evidence tabellen) (Smismans et al., 2009; De Silva et al., 2010; Verhoeven et al., 2010; Jones et al., 2011; Saegeman et al., 2011). Drie studies maakten gebruik van een ophopingsmedium (Smismans et al., 2009; De Silva et al., 2010; Jones et al., 2011). Een studie detecteerde SA en MRSA met moleculaire methoden: Beck (2016) gebruikte de Xpert SA Nasal Complete assay (Cepheid).
Interventietests
Alle 6 studies vergeleken afname met flocked swabs met afname met andere typen swabs om SA/MRSA dragerschap aan te tonen (zie tabel 4).
Resultaten voor de uitkomstmaat ‘verschil in detectiepercentages SA/MRSA’
a) Screening in een populatie van patiënten met gekende kolonisatiestatus voor SA/MRSA
Twee studies onderzochten het effect van afnamemateriaal in een populatie waarvan de kolonisatiestatus van SA/MRSA bekend was (Saegeman et al., 2011; Smismans et al., 2009).
Pooling laat zien dat wanneer men met een flocked swab patienten screent op SA/MRSA-dragerschap, men 30 per 1000 gekoloniseerde patienten meer identificeert dan wanneer men met een niet-flocked swab screent. Het 95% BI geeft aan dat men met een flocked swab in het beste geval 90 per 1000 gekoloniseerde patienten meer identificeert en in het slechtste geval 30 per 1000 patienten minder identificeert.
Figuur 1. Niet-flocked swabs vs. flocked swabs, uitkomst: verschil in detectiepercentage patiënten positief voor kolonisatie met SA/MRSA (kolonisatiestatus in onderzoekspopulatie bekend)
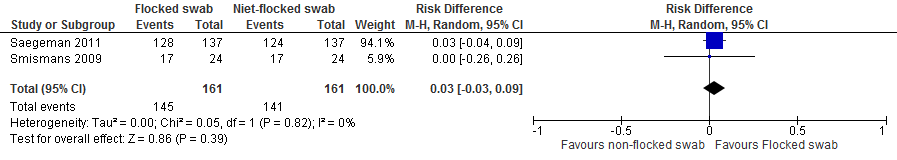
b) Screening in een populatie waarin de kolonisatiestatus voor SA/MRSA niet bekend was
Vier studies onderzochten een populatie waarin de kolonisatiestatus met SA/MRSA niet bekend was (De Silva et al., 2010; Verhoeven et al., 2010; Jones et al., 2011; Beck et al., 2016).
Pooling laat zien dat wanneer men met een flocked swab patienten screent op SA/MRSA-dragerschap, men 30 per 1000 gekoloniseerde patienten meer identificeert dan wanneer men met een niet-flocked-swab screent. Het 95% BI geeft aan dat men met een flocked swab in het beste geval 70 per 1000 gekoloniseerde patienten meer identificeert en in het slechtste geval 10 per 1000 patienten minder identificeert.
Figuur 2. Niet-flocked swabs vs. flocked swabs, uitkomst: verschil in detectiepercentage patiënten positief voor kolonisatie met SA/MRSA (kolonisatiestatus onbekend).
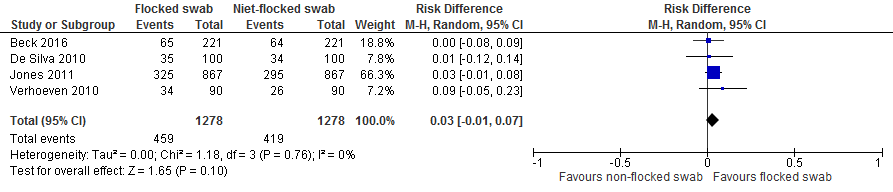
c) Screening in totale populatie
Pooling van de totale populatie (populatie van patiënten met gekende kolonisatiestatus voor SA/MRSA en een populatie waarin de kolonisatiestatus voor SA/MRSA niet bekend was) laat zien dat wanneer men met een flocked swab patienten screent op SA/MRSA-dragerschap, men 30 per 1000 gekoloniseerde patienten meer identificeert dan wanneer men met een niet-flocked-swab screent (95% CI: -0.00, 0.06).
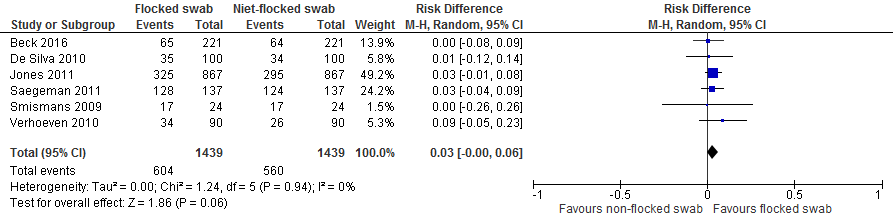
Resultaten voor de uitkomstmaat “verschil in percentage niet interpreteerbare tests”
Één studie onderzocht het aantal niet interpreteerbare tests (Beck et al., 2016).
Deze studie liet zien dat wanneer men met een flocked swab patiënten door middel van een moleculaire test screent op SA, men 50 per 1000 minder niet interpreteerbare testen heeft dan met een niet-flocked swab. Het 95% BI geeft aan dat men met een flocked swab in het beste geval 100/1000 niet interpreteerbare tests minder heeft en in het slechtste geval 10 per 1000 niet interpreteerbare tests minder heeft.
Figuur 3. Niet-flocked swabs vs. flocked swabs, uitkomst: verschil in percentage niet interpreteerbare tests (kolonisatiestatus onbekend).

Bewijskracht van de literatuur
Cross-sectionele studies over diagnostiek starten in de GRADE-methodiek als hoge kwaliteit van bewijs.
Verschil in detectiepercentages SA/MRSA
a. ten aanzien van screening in een populatie van patiënten met gekende kolonisatiestatus voor SA/MRSA
De bewijskracht werd afgewaardeerd van hoog naar zeer laag:
- met één niveau omdat het 95% BI geen effect (RR=1) insluit (ernstige onnauwkeurigheid);
- met één niveau omdat de grootste studie geen ophopingsmedium gebruikte en als interventietest een droge swab werd gebruikt hetgeen in Nederland geen gangbaar alternatief is (indirectheid);
- met één niveau vanwege ernstig risico op vertekening (in de grootste van de twee studies is 30% van de geïncludeerde patiënten niet meegenomen in de analyse).
Ter info: geen van de studies vermeldde de transporttijd en afname tot aan het inzetten (beperkingen in onderzoeksopzet). De werkgroep heeft echter het niveau van bewijs om die reden niet verder verlaagd.
b. ten aanzien van screening waarin de kolonisatiestatus niet bekend was
De bewijskracht werd afgewaardeerd van hoog naar matig:
- met één niveau omdat de controle en interventie test in de grootste studie (Jones et al., 2011) op verschillende manieren werden verwerkt: flocked swabs werden automatisch geënt en niet-flocked swabs werden handmatig geënt (beperking in onderzoeksopzet en uitvoering).
- Een van de drie studies die SA/MRSA op basis van kweek detecteerden gebruikte geen ophopingsmedium. Omdat de grootste twee studies wel een ophopingsmedium gebruikten (967/1050 patiënten) heeft de werkgroep het niveau van bewijs niet verlaagd omwille van indirectheid.
Ter info: geen van de studies vermeldde de transporttijd en afname tot aan het inzetten (beperkingen in onderzoeksopzet). De werkgroep heeft echter het niveau van bewijs om die reden niet verder verlaagd.
c. ten aanzien van screening totale populatie
De bewijskracht werd afgewaardeerd van hoog naar laag:
- met één niveau vanwege ernstig risico op vertekening in de twee grootste studies: in de studie van Jones et al. (2011) werden de controle en interventie test op verschillende manieren verwerkt: flocked swabs werden automatisch geënt en niet-flocked swabs werden handmatig geënt. In de studie van Saegeman et al. (2011) werden 30% van de geïncludeerde patiënten niet meegenomen in de analyse.
- met één niveau omdat twee van de zes studies die SA/MRSA op basis van kweek detecteerden geen ophopingsmedium gebruikten (indirectheid).
Verschil in percentage niet interpreteerbare tests
De bewijskracht werd afgewaardeerd van hoog naar laag:
- Met twee niveaus omdat enkel één studie deze uitkomstmaat bestudeert en er minder dan 300 events gerapporteerd zijn (ernstige imprecisie).
Zoeken en selecteren
Ten aanzien van anatomische locatie screening
Er is geen systematische literatuuranalyse verricht. De werkgroepleden maakten gebruik van door hen zelf verzamelde artikelen (zie overwegingen).
Ten aanzien van afnamemateriaal
Om de uitgangsvraag te kunnen beantwoorden heeft de werkgroep een systematische literatuuranalyses verricht met de volgende PICO-vraagstellingen:
Wat is geschikt afnamemateriaal om dragerschap van methicilline-resistente Staphylococcus aureus (MRSA) aan te tonen?
Tabel 1 Selectiecriteria PICO 1
|
Type studies |
|
|
Type patiënten |
|
|
Interventietest |
|
|
Controletest |
|
|
Type uitkomstmaten |
|
|
Type setting |
|
|
Exclusiecriteria |
|
*De werkgroep is geïnteresseerd in MRSA screening. Veel studies onderzoeken echter dragerschap van Staphylococcus aureus (SA). De werkgroep verwacht dat de resultaten van studies over SA ook extrapoleerbaar zijn naar MRSA, omdat niet wordt verwacht dat de recovery uit verschillende swabs gebonden is aan resistentiemechanismen. Om die reden heeft de werkgroep ook studies meegenomen die SA screening hebben onderzocht.
In de databases Medline (OVID), Embase and Cochrane is een systematische search verricht. Zie de zoekverantwoording. Na ontdubbeling van de zoekresultaten leverde de literatuurzoekactie 770 treffers op. Studies die voldeden aan de selectiecriteria in tabel 1 zijn opgenomen in de samenvatting van de literatuur. Acht studies werden geselecteerd op basis van titel en abstract. Bijkomend werden 2 studies gevonden door middel van handmatig zoeken (referentielijsten van gevonden studies en richtlijnen). Na het lezen van de volledige artikelen werden uit een totaal van 10 studies uiteindelijk 6 studies opgenomen in de literatuuranalyse (Smismans et al., 2009; De Silva et al., 2010; Verhoeven et al., 2010; Jones et al., 2011; Saegeman et al., 2011; Beck et al., 2016). In de evidence tabellen staan de redenen van exclusie van de andere 4 studies vermeld.
Referenties
- Amies C R. A modified formula for the preparation of Stuart's Transport Medium. Can J Public Health. 1967 Jul;58(7):296-300.
- Bagge K, Benfield T, Westh H, Bartels MD. Eradicating MRSA carriage: the impact of throat carriage and Panton-Valentine leukocidin genes on success rates. Eur J Clin Microbiol Infect Dis. 2019 Apr;38(4):683-688.
- Beck, E., Buchan, B., Reymann, G., & Ledeboer, N. (2016). Comparison of ESwab and Wound Fiber Swab Specimen Collection Devices for Use with Xpert SA Nasal Complete Assay. Journal Of Clinical Microbiology, 54(7), 1904-1906. doi: 10.1128/jcm.00449-16
- Bitterman Y, Laor A, Itzhaki S, Weber G. Characterization of the best anatomical sites in screening for methicillin-resistant Staphylococcus aureus colonization. Eur J Clin Microbiol Infect Dis. 2010 Apr;29(4):391-7.
- Cursino MA, Garcia CP, Lobo RD, Salomão MC, Gobara S, Raymundo GF, Kespers T, Soares RE, Mollaco CH, Keil KG, Malieno PB, Krebs VL, Gibelli MA, Kondo MM, Zugaib M, Costa SF, Levin AS. Performance of surveillance cultures at different body sites to identify asymptomatic Staphylococcus aureus carriers. Diagn Microbiol Infect Dis. 2012 Dec;74(4):343-8.
- Dahlman D, Jalalvand F, Blomé MA, Håkansson A, Janson H, Quick S, Nilsson AC. High Perineal and Overall Frequency of Staphylococcus aureus in People Who Inject Drugs, Compared to Non-Injectors. Curr Microbiol. 2017 Feb;74(2):159-167.
- De Silva, S., Wood, G., Quek, T., Parrott, C., & Bennett, C. (2010). Comparison of Flocked and Rayon Swabs for Detection of Nasal Carriage of Staphylococcus aureus among Pathology Staff Members. Journal Of Clinical Microbiology, 48(8), 2963-2964. doi: 10.1128/jcm.01617-09
- Hoge Gezondheidsraad (HGR). 2019. Aanbevelingen inzake preventie, beheersing en aanpak van patiënten die drager zijn van tegen antibiotica multiresistente organismen (mdro) in zorginstellingen. België.
- Jones, G., Matthews, R., Cunningham, R., & Jenks, P. (2011). Comparison of Automated Processing of Flocked Swabs with Manual Processing of Fiber Swabs for Detection of Nasal Carriage ofStaphylococcus aureus. Journal Of Clinical Microbiology, 49(7), 2717-2718. doi: 10.1128/jcm.00504-11
- Mertz D, Frei R, Periat N, Zimmerli M, Battegay M, Flückiger U, Widmer AF. Exclusive Staphylococcus aureus throat carriage: at-risk populations. Arch Intern Med. 2009 Jan 26;169(2):172-8.
- Nederlandse Vereniging voor Medische Microbiologie (2012). Guideline Laboratory detection of highly resistant microorganisms
- Nicholas P. Vitko and Anthony R. Richardson. Laboratory Maintenance of Methicillin-Resistant Staphylococcus aureus (MRSA). Curr Protoc Microbiol. 2013 February, 0 9: Unit–9C.2. doi:10.1002/9780471729259.mc09c02s28.
- Robinson Gwen L, Anthony D Harris, Daniel J Morgan, Lisa Pineles, Beverly M Belton, J Kristie Johnson, Benefits of Universal Gloving and Gowning (BUGG) Study Group. Survival of methicillin-resistant Staphylococcus aureus and vancomycin-resistant Enterococcus spp. for an extended period of transport. J Clin Microbiol. 2012 Jul;50(7):2466-8. doi: 10.1128/JCM.00911-12. Epub 2012 Apr 25.
- Saegeman, V., Flamaing, J., Muller, J., Peetermans, W., Stuyck, J., & Verhaegen, J. (2011). Clinical evaluation of the Copan ESwab for methicillin-resistant Staphylococcus aureus detection and culture of wounds. European Journal Of Clinical Microbiology & Infectious Diseases, 30(8), 943-949. doi: 10.1007/s10096-011-1178-1
- Smismans, A., Verhaegen, J., Schuermans, A., & Frans, J. (2009). Evaluation of the Copan ESwab transport system for the detection of methicillin-resistant Staphylococcus aureus: a laboratory and clinical study. Diagnostic Microbiology And Infectious Disease, 65(2), 108-111. doi: 10.1016/j.diagmicrobio.2009.06.015
- Verhoeven, P., Grattard, F., Carricajo, A., Pozzetto, B., & Berthelot, P. (2010). Better Detection of Staphylococcus aureus Nasal Carriage by Use of Nylon Flocked Swabs. Journal Of Clinical Microbiology, 48(11), 4242-4244. doi: 10.1128/jcm.01425-10
- Warnke, P., Frickmann, H., Ottl, P., & Podbielski, A. (2014). Nasal Screening for MRSA: Different Swabs – Different Results!. Plos ONE, 9(10), e111627. doi: 10.1371/journal.pone.0111627
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention test (I) |
Control test (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Smismans 2009 |
Type of study: Cross-sectional
Setting: Not specified
Country: Belgium
Source of funding: NR |
Inclusion criteria: Patients known with previous MRSA colonisation
Exclusion criteria: NR
N total at baseline: Intervention/Control: 18 (Intervention and comparison test were carried out in the same group)
Important prognostic factors2: NA
Groups comparable at baseline? NA |
Venturi Transystem (Copan, Brescia, Italy) with Amies gel transport medium screening of nares
MRSA Isolation with MRSA-ID plate and use of BHI with 6,5 NaCl enrichment broth.
Enrichment broth was used. |
Copan eSwab (with Amies medium) screening of nares.
MRSA Isolation with MRSA-ID plate and use of BHI with 6,5 NaCl enrichment broth.
Enrichment broth was used. |
N/A |
MRSA+ patients detected: I: 17/24 C: 17/24 |
In vitro testing showed more recovery of viable MRSA bacteria from eSwab, but in vivo testing did not show any difference in MRSA detection rates in previously MRSA+ patients. |
|
De Silva 2010 |
Type of study: Cross-sectional
Setting: Pathology laboratory staff
Country: Australia
Source of funding: National Health and Medical Research Council as part of the Community Onset S. aureus Household Cohort (COSAHC) study |
Inclusion criteria: Healthy volunteers receiving screening for S. aureus carriage
Exclusion criteria: NR
N total at baseline: Intervention/Control: 100 (Intervention and comparison test were carried out in the same group)
Important prognostic factors2:
|
Rayon swab (Copan) screening of nares MRSA isolation with CHROMID S. aureus (bioMerieux). Enrichment broth was used. |
Copan eSwab screening of nares
MRSA isolation with CHROMID S. aureus (bioMerieux).
Enrichment broth was used. |
N/A |
S. aureus+ volunteers detected: I: 34/100 C: 35/100 |
|
|
Verhoeven 2010 |
Type of study: Cross-sectional (data extracted)
Setting: Health care workers in University Hospital of Saint-Etienne
Country: France
Source of funding: University Hospital of Saint-Etienne |
Inclusion criteria: Healthy volunteers receiving screening for S. aureus carriage
Exclusion criteria: NR
N total at baseline: Intervention/Control: 90 (Intervention and comparison test were carried out in the same group)
Important prognostic factors2:
|
Rayon swabs (standard swabs with Amies agar gel, reference 108C; Copan)
No enrichment broth. |
Regular flocked swabs, (reference 552C; Copan, Brescia, Italy).
No enrichment broth. |
N/A |
S. aureus+ volunteers detected: I: 26/90 C: 34/90 |
Testing occurred in a five-week period; a total of 628 paired swabs were taken. A S. aureus+ volunteer is defined as having at least one positive swab for MRSA. |
|
Jones 2011 |
Type of study: Cross-sectional
Setting: Medical Assessment Unit of Derriford Hospital, Plymouth, between January and September 2009 Country: United Kingdom
Source of funding: Copan Italia, Brescia, Italy |
Inclusion criteria: Patients undergoing S. aureus screening
Exclusion criteria: NR
N total at baseline: Intervention/Control: 867 (Intervention and comparison test were carried out in the same group)
Important prognostic factors: |
M40 charcoal-based Transystem swab (Copan Italia 408CST).
Inoculated and quad-streaked manually on Staphylococcus selective medium plate (Columbia blood agar with aztreonam and polymxyin [CAP]; Oxoid PB0122A) and an MRSA selective agar plate (ChromID MRSA agar; bioMérieux 43451).
Enrichment broth was used and evaluated separately |
ESwab (Copan Italia 480CE)
Inoculated and streaked with WASP on Staphylococcus selective medium plate (Columbia blood agar with aztreonam and polymxyin [CAP]; Oxoid PB0122A) and an MRSA selective agar plate (ChromID MRSA agar; bioMérieux 43451).
Enrichment broth was used and evaluated separately |
N/A |
S. aureus+ patients detected:
Direct method (no EB): I: 237/867 C: 268/867
With use of EB: I: 295/867 C: 325/867
Only the results with use of EB were extracted for the review. |
Funded by Copan. Difference between intervention and control: intervention was streaked manually, and control was processed automatically with WASP. MRSA plates were also streaked, these results were included in S. aureus carriage and were not reported separately. |
|
Saegeman 2011 |
Type of study: Cross-sectional
Setting: Geriatric and internal medicine wards, University Hospitals Leuven Country: Belgium
Source of funding: ESwab MRSA Collection Kits and the conventional ESwabs were provided by Copan |
Inclusion criteria: Patients known with previous MRSA colonisation And patients undergoing MRSA screening
Exclusion criteria: NR
N total at baseline: 200 (Intervention and comparison test were carried out in the same group)
Important prognostic factors: |
dry cotton Copan swabs (dry swab, wooden applicator, cotton tip, 150C, Sterilin; Copan, Brescia, Italy)34 |
ESwab MRSA Collection Kit (MRSA ESwab) |
Analysis was performed for 137 paired swabs (n at baseline: 200 paired swabs). This discrepancy is not explained in the text. |
MRA+ patients detected: I: 124/137 C: 128/137 |
ESwab MRSA Collection Kits and the conventional ESwabs were provided by Copan.
The patient population predominantly exists of patients with known MRSA colonisation, but the exact make-up is not known. |
|
Beck 2016 |
Type of study: Cross-sectional
Setting: NR Country: United States
Source of funding: Cepheid and Copan Diagnostics provided material support for this study
|
Inclusion criteria: Patients undergoing screening for MRSA
Exclusion criteria: NR
N total at baseline: 223 (Intervention and comparison test were carried out in the same group)
Important prognostic factors: |
Liquid Stuart BBL Dual CultureSwab (traditional swab) (BD Diagnostics, Sparks, MD)
Xpert SA Nasal Complete assay (SA Complete) (Cepheid, Sunnyvale, CA) |
ESwab collection device (ESwab) (Copan Diagnostics, Murrieta, CA)
Xpert SA Nasal Complete assay (SA Complete) (Cepheid, Sunnyvale, CA) |
N/A |
S. aureus+ patients detected: I: 64/221 C: 65/221
MRSA+ patients detected: I: 13/221 C: 13/221
Inconclusive tests: I: 18/221 C: 6/221
Only results pertaining to S. aureus were extracted for the review. |
One MRSA+ traditional swab was ruled to be a false positive by the authors (changed from 14 to 13) |
|
Study references |
Collection materials |
Anatomical site screened |
MRSA/Staphylococcus aureus isolation method |
Method of identification |
Method of susceptibility testing |
Use of enrichment broth? |
|
Smismans 2009 |
Intervention: Venturi Transystem (Copan, Brescia, Italy) with Amies gel transport medium screening of nares
Control: Copan Eswab (with Amies medium) screening of nares.
|
Nares |
MRSA-ID plate (MRSA CHROMagar; bioMérieux, Marcy l'Etoile, France) |
S. aureus ID plate (SA select; Bio-Rad) |
N/A |
Yes: BHI with 6.5% NaCl (Becton-Dickinson) |
|
De Silva 2010 |
Intervention: Rayon swab (Copan)
Control: Copan eSwab |
Nares |
CHROMID S. aureus (bioMerieux) |
Gram stain; coagulase test (Staphytec Oxoid) and confirmation using DNase (with ACM 5190 for S. aureus and ATCC 12225 for Staphylococcus epidermidis used as controls) |
N/A |
Yes: tryptic soy broth (TSB) with 6.5% NaCl |
|
Verhoeven 2010 |
Intervention: Rayon swabs (standard swabs with Amies agar gel, reference 108C; Copan)
Control: Regular flocked swabs, (reference 552C; Copan, Brescia, Italy).
|
Nares |
BBL CHROMagar Staph aureus (Becton Dickinson) |
Maldi-TOF (Bruker Daltonics, Bremen, Germany) |
N/A |
No |
|
Jones 2011 |
Intervention: M40 charcoal-based Transystem swab (Copan Italia 408CST) (streaked manually)
Control: ESwab (Copan Italia 480CE) (Streaked automatically) |
Nares |
ChromID MRSA agar (bioMérieux 43451) |
NR |
|
Yes: 7% salt broth (Oxoid EB1040E) (Evaluated separately from direct streaking). |
|
Saegeman 2011 |
Intervention: dry cotton Copan swabs (dry swab, wooden applicator, cotton tip, 150C, Sterilin; Copan, Brescia, Italy)
Control: ESwab MRSA Collection Kit (MRSA ESwab) |
Nares and perineum (one eSwab was used, and two separate dry swabs) |
MRSA CHROMagar |
Tube test, DNase and/or Maldi BioTyper® Flex series (Bruker, Germany) |
|
No |
|
Beck 2016 |
Intervention: Liquid Stuart BBL Dual CultureSwab (traditional swab) (BD Diagnostics, Sparks, MD)
Control: ESwab collection device (ESwab) (Copan Diagnostics, Murrieta, CA)
|
Nares |
N/A |
Xpert SA Nasal Complete assay (SA Complete) (Cepheid, Sunnyvale, CA) |
N/A |
|
NR: not reported
Risk of bias table
|
Study |
Alternate or random first use of swab (type)? |
Were the results interpreted without knowing what sampling method was used? |
Were inconclusive test results reported? |
All patients in the analysis? |
Applicability (indirectness in GRADE) |
|
Smismans et al., 2009 |
Yes: Alternate (except for 6 patients) (Low Risk) |
Unclear (Unclear risk) |
N/A |
Yes (Low Risk) |
Low Risk. |
|
Saegeman et al., 2011 |
Yes: alternate (Low Risk) |
Unclear (Unclear risk) |
N/A |
No (High Risk) (Only 137 from the 200 patients analyzed) |
No enrichment broth: High risk. |
|
De Silva et al., 2010 |
Yes: random (Low Risk) |
Yes (Low Risk) (Laboratory staff involved in isolating S. aureus were blinded to the swabbing sequence) |
N/A |
Yes (Low Risk) |
Low Risk. |
|
Verhoeven et al., 2010 |
Yes: random (one swab per nostril, randomly allocated) (Low Risk) |
Unclear (Unclear risk) |
N/A |
Yes (Low Risk) |
No enrichment broth: High risk. |
|
Jones et al., 2011 |
Unclear (Unclear risk) |
No (High risk) (Flocked swabs and non-flocked swabs were processed differently) |
N/A |
Yes (Low Risk)
|
Low Risk |
|
Beck et al., 2016 |
Yes: random (Low risk) |
Unclear (Unclear risk) |
Yes (Low Risk) |
Yes (Low Risk) |
Low Risk |
Tabel exclusie na het lezen van het volledige artikel
|
Auteur |
Redenen van exclusie |
|
Bowen et al. 2013 |
Geen test voor dragerschap SA/MRSA, maar swabs gebruikt bij klinische infectie (impetigo) |
|
Dalpke et al. 2014 |
Geen patiëntmonsters gebruikt, maar gespikede monsters. |
|
Hohenwarter et al. 2017 |
Poster, geen publicatie |
|
Silbert et al. 2014 |
Geen patiëntmonsters gebruikt, maar gespikede monsters. |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 27-07-2021
Laatst geautoriseerd : 27-07-2021
Geplande herbeoordeling : 01-01-2027
Uiterlijk in 2025 bepaalt het bestuur van de Nederlandse Vereniging voor Medische Microbiologie of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Medische Microbiologie is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door B.S. Niël-Weise, zelfstandig richtlijnmethodoloog, en werd gefinancieerd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De richtlijn is ontwikkeld in samenwerking met de Vereniging voor Hygiëne en Infectiepreventie in de Gezondheidszorg.
Doel en doelgroep
Doel
Het doel van het project is het herzien van de huidige richtlijn Laboratoriumdiagnostiek van BRMO die dateert uit 2012. Afgezien van het verstrijken van de reguliere termijn voor herziening zijn er nieuwe inzichten en methoden beschikbaar gekomen die de diagnostiek kunnen optimaliseren.
Doelgroep
De richtlijn is met name bedoeld voor artsen-microbioloog, deskundigen infectiepreventie, internisten-infectioloog en medisch moleculair microbiologen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2018 een werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de pre-analytische (afname, transport en bewaaromstandigheden) en de analytische fase van de laboratorium detectie van BRMO inclusief de rapportage naar de aanvrager danwel naar het patiëntendossier.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende 2 jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep:
- Prof. dr. J.A.J.W. Kluytmans, arts-microbioloog, Amphia Ziekenhuis Breda/Oosterhout; Elisabeth-TweeSteden Ziekenhuis, Tilburg; Universitair Medisch Centrum Utrecht
- Drs. W. van den Bijllaardt, arts-microbioloog, Amphia Ziekenhuis Breda
- Dr. E. Bathoorn, arts-microbioloog, Universitair Medisch Centrum Groningen
- Dr. J. Cohen Stuart, arts-microbioloog, Noordwest Ziekenhuis Alkmaar
- Dr. J. J. Verweij, medisch moleculair microbioloog/parasitoloog, Elisabeth-Tweesteden Ziekenhuis, Tilburg
- Dr. W. H.F. Goessens, microbioloog, Erasmus MC Universitair Medisch Centrum Rotterdam
- Dr. N. al Naiemi, arts-microbioloog, Labmicta, Hengelo
- Prof. Dr. M.C. Vos, arts-microbioloog, Erasmus MC Universitair Medisch Centrum, Rotterdam
- Dr. L. van Dommelen, arts-microbioloog, PAMM, Veldhoven
- Dr. P. Croughs, arts-microbioloog, Erasmus MC Universitair Medisch Centrum, Rotterdam
- Drs. A. Klak, arts-microbioloog in opleiding, Universitair Medisch Centrum Groningen
Meelezers:
- Dr. M.K. Bomers, internist-infectioloog, Amsterdam UMC, locatie VUmc
- Mv. M. Molenaar, deskundige infectiepreventie, OLVG Amsterdam
- Mv. S. Cremers-Pijpers, deskundige infectiepreventie, Radboudumc, Nijmegen
Met ondersteuning van:
- Mw. B.S. Niël-Weise, zelfstandig richtlijnmethodoloog, Deventer
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen d.m.v. reputatiemanagement, belangen vanwege extern gefinancieerd onderzoek, en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij de Nederlandse Vereniging voor Medische Microbiologie, een overzicht vindt u hieronder:
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
|
Jan Kluytmans |
|
|
Geen |
Geen |
Subsidiegevers zijn Euopese commissie, Nederlandse overheid en provincies. Geen belangen bij deze richtlijn |
Geen |
Geen |
|
Erik Bathoorn |
Arts-microbioloog, UMCG Groningen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Wouter van den Bijllaardt |
Arts-microbioloog Amphia ziekenhuis Breda |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
James Cohen Stuart |
Arts-microbioloog Noordwest Ziekenhuisgroep |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Jaco Verweij |
Medisch moleculair microbioloog, ETZ Ziekenhuis, Tilburg |
|
Geen |
Geen |
Geen |
Geen |
Geen |
|
Wil Goessens |
Medisch microbioloog Erasmus Medisch Centrum Rotterdam |
Geen |
Patent: detectie van carbapenemase middels maldi-TOF |
Geen |
Geen |
Geen |
Geen |
|
Nashwan al Naiemi |
Arts-microbioloog LabMicTA Bestuurder LabMicTA |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Greet Vos |
Arts-microbioloog MC Rotterdam |
|
Geen |
Geen |
Unrestricted grant 3m, Pentax |
Geen |
Geen |
|
Adrian Klak |
AIOS Medische Microbiologie UMCG |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Peter Croughs |
Arts-microbioloog, Erasmus Medisch Centrum |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Laura van Dommelen |
Arts-microbioloog, Stichting PAMM te Veldhoven |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Marije Bomers |
Internist- infectioloog, Amsterdam UMC, locatie VUmc |
Geen |
Financieel belang farmaceutisch bedrijf Shionogi |
Geen |
Subsidiegevers zijn ZonMW en Amsterdam UMC corona research fonds. Geen belangen bij deze richtlijn |
Geen |
Geen |
|
Myrte Molenaar |
Deskundige Infectiepreventie OLVG Amsterdam |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Suzan Cremers |
Deskundige |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door in de voorbereidende fase de Patiëntenfederatie Nederland te vragen om schriftelijke input omtrent knelpunten en aandachtspunten. De Patiëntenfederatie gaf aan geen knelpunten aan te leveren vanwege het technisch karakter van de richtlijn. De werkgroep heeft de conceptrichtlijn ook tijdens de commentaarfase voorgelegd aan de Patiëntenfederatie Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren (zie het Implementatieplan in de bijlagen).
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwalitieit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (https://www.agreetrust.org/), dat een internationaal breed geaccepteerd instrument is en op ‘richtlijnen voor richtlijn’ voor de beoordeling van de kwaliteit van richtlijnen.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur welke onderwerpen moesten worden herzien. Deze werden met de werkgroep besproken. Tevens werd aan de volgende organisaties gevraagd om knelpunten aan te dragen: het Zorginstituut Nederland, Inspectie Gezondheidszorg en Jeugd, Vereniging voor Hygiëne & Infectiepreventie in de Gezondheidszorg, Patiëntenfederatie Nederland en Zorgverzekeraars Nederland.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep uitgangsvragen opgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant waren, waarbij zowel naar gewenste als ongewenste effecten werd gekeken.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar relevante buitenlandse richtlijnen en naar systematische reviews. Voor (internationale) richtlijnen is gezocht in de databases van National Guideline Clearinghouse (NGC), Guidelines International Network (GIN), World Health Organisation (WHO) en Centers for Disease Control and Prevention (CDC). Voor bestaande systematic reviews is gezocht in de databases Ovid Medline en Embase (zie de zoekverantwoording).
Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in de module van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de methodologische checklijsten.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende overeenkomsten tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kwaliteit van bewijs (‘quality of evidence’) werd beoordeeld met behulp van GRADE (Guyatt et al., 2008). GRADE is een methode die per uitkomstmaat van een interventie, of voor een risico- of prognostische factor, een gradering aan de kwaliteit van bewijs toekent op basis van de mate van vertrouwen in de schatting van de effectgrootte (tabel 1 en 2).
Tabel 1 Indeling van de kwaliteit van bewijs volgens GRADE
|
Hoog |
Er is veel vertrouwen dat het werkelijke effect dicht in de buurt ligt van het geschatte effect. |
|
|
|
|
Matig |
Er is matig vertrouwen in het geschatte effect: het werkelijk effect ligt waarschijnlijk dicht bij het geschatte effect, maar er is een mogelijkheid dat het hiervan substantieel afwijkt. |
|
|
|
|
Laag |
Er is beperkt vertrouwen in het geschatte effect: het werkelijke effect kan substantieel verschillen van het geschatte effect. |
|
|
|
|
Zeer laag |
Er is weinig vertrouwen in het geschatte effect: het werkelijke effect wijkt waarschijnlijk substantieel af van het geschatte effect. |
Tabel 2 De kwaliteit van bewijs wordt bepaald op basis van de volgende criteria
|
Type bewijs |
Voor studies over interventies: RCT start in de categorie ‘hoog’. Observationele studie start in de categorie ‘laag’. Alle overige studietypen starten in de categorie ‘zeer laag’.
Voor studies over een risico- of prognostische factor: Prospectieve of retrospectieve cohortstudie start in de categorie ‘hoog’. Voor andere studieontwerpen wordt afgewaardeerd via ‘risk of bias’. |
|
|
Afwaarderen |
‘Risk of bias’ |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Inconsistentie |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Indirect bewijs |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Onnauwkeurigheid |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Publicatiebias |
- 1 Waarschijnlijk - 2 Zeer waarschijnlijk |
|
Opwaarderen |
Groot effect |
+ 1 Groot + 2 Zeer groot |
|
|
Dosis-respons relatie |
+ 1 Bewijs voor gradiënt |
|
|
Alle plausibele ‘confounding’ |
+ 1 zou een effect kunnen reduceren + 1 zou een tegengesteld effect kunnen suggereren terwijl de resultaten geen effect laten zien. |
Formuleren van de conclusies
Een conclusie verwijst niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence).
Overwegingen
Voor het komen tot een aanbeveling zijn naast de kwaliteit van het wetenschappelijk bewijs over de gewenste en ongewenste effecten van een interventie, of over de effectgrootte van een risico- of prognostische factor, vaak ook nog andere factoren van belang (Alonso-Coello et al., 2016).
Genoemd kunnen worden:
- kosten,
- waarden, voorkeuren en ervaringen van patiënten en behandelaars met betrekking tot interventies en uitkomsten van zorg,
- balans van gewenste en ongewenste effecten van interventies ten opzichte van geen of andere interventies,
- aanvaardbaarheid van interventies,
- haalbaarheid van een aanbeveling.
Bij voorkeur wordt ook voor deze aspecten naar wetenschappelijk bewijs gezocht. De werkgroep die deze richtlijn heeft opgesteld, heeft hiervan afgezien omdat de hiervoor benodigde tijd in geen enkele verhouding zou staan tot de verwachte opbrengst. De werkgroep heeft, daar waar dit noodzakelijk werd geacht, op basis van eigen ervaring en expertise de hiervoor genoemde aspecten geïnventariseerd.
Deze aspecten worden besproken na de ‘conclusie’ onder het kopje ‘overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beste beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. Dit is afhankelijk van het gewicht dat wordt toegekend aan kosten, gewenste of ongewenste effecten en andere onder de overwegingen genoemde factoren.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek staat in de bijlage Kennislacunes.
Commentaar- en autorisatiefase
De conceptrichtlijn is aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. Tevens is de richtlijn voorgelegd aan de organisaties die ook tijdens de knelpuntanalyse betrokken waren. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Literatuurlijst
- Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089.
- Guyatt et al., 2008Guyatt GH, Oxman AD, Vist GE, Kunz R, Falck-Ytter Y, Alonso-Coello P, Schünemann HJ; GRADE Working Group (2008). GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ. 336: 924-6.
- Programm für Nationale VersorgungsLeitlinien von BÄK, KBV und AWMF Qualitätsindikatoren. Manual für Autoren: 6. Qualitätsindikatoren für Nationale VersorgungsLeitlinien (2009).
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
