Behandeling chronische rhinosinusitis bij CF
Uitgangsvraag
Hoe kan een chronische ontsteking van de neusbijholten het best worden behandeld bij patiënten met CF?
Aanbeveling
Behandel de chronische rhinosinusitis van patiënten met CF (kinderen en volwassenen) conform de vigerende Europese richtlijn. Volg hierin dezelfde strategieën als bij patiënten zonder CF.
Bespreek de optie van volledige neusbijholtenchirurgie met de patiënt of diens vertegenwoordiger aan de hand van de volgende aandachtspunten:
- Door de patiënt ervaren neusklachten die significante impact hebben op zijn/haar kwaliteit van leven ondanks adequate medicamenteuze therapie.
- Intermitterende kolonisatie van de longen met pathogene Gram-negatieve bacteriën (zoals P. aeruginosa) ondanks adequate eradicatiekuren (lokaal en/of systemisch), met concordante positieve neuskweken.
- Intermitterende kolonisatie van de neusbijholten met pathogene Gram-negatieve bacteriën (zoals P. aeruginosa) ondanks adequate eradicatiekuren (lokaal en/of systemisch).
- Aanhoudende achteruitgang van de longfunctie (> 10% per jaar) ondanks antibiotische therapie.
- Een recente longtransplantatie zonder eerdere neusbijholtenchirurgie.
Overweeg bij chronische rhinosinusitus regelmatig de kolonisatiestatus van de neusbijholten middels neuskweken te monitoren.
Overwegingen
Kwaliteit van het bewijs en balans tussen voor- en nadelen
Zoals uit de literatuurstudie duidelijk naar voren komt, is rol en timing van neusbijholtenchirurgie in patiënten met CF nog zeer onontgonnen terrein. Als zodanig is er vanuit de literatuur maar weinig onderbouwing voor welk advies dan ook. De werkgroep meent daarom voorzichtig te moeten zijn in de aanbevelingen. Wel speelt een aantal andere overwegingen nog mee in het uiteindelijke advies; deze worden hieronder uiteengezet.
Alhoewel neusbijholtenchirurgie zeer veilige chirurgie is, zijn de zeer zeldzame complicaties wel zwaarwegend (bijvoorbeeld schade aan het oog of aan de schedelbasis). Deze risico’s kunnen opwegen tegen de nadelen van niet-chirurgisch handelen zoals bij patiënten met chronische rhinosinusitis zonder CF (bijvoorbeeld aanhouden van hevige mate van klachten, slechte toegang voor lokale therapie in geval van ernstige polyposis). Bij patiënten met CF komt er daarnaast nog een andere dimensie van risico-afweging om de hoek kijken ten aanzien van neusbijholtenchirurgie, namelijk het effect op de pulmonale status (bijvoorbeeld achteruitgang in longfunctie en (re-) kolonisatie van de longen vanuit het reservoir van de neusbijholten). De klachten van de patiënt kunnen een behoorlijke impact hebben op hun kwaliteit van leven.
Wat vinden patiënten: patiëntenvoorkeur
Klachten van de patiënt (aanhoudend vol gevoel, chronische neusverstopping etcetera) kunnen een grote invloed hebben op de keuze voor wel of niet opereren. Patiënten willen graag goede informatie ontvangen over de behandelopties met voor en nadelen, zodat zij goed in staat zijn om mede te beslissen over de behandeling.
Wat vinden artsen: professioneel perspectief
In de behandeling van chronische rhinosinusitis bij patiënten met CF dient er aandacht te zijn voor zowel het nasale domein (zoals bij patiënten zonder CF) en het pulmonale domein. Op beide domeinen kan een indicatie liggen voor neusbijholtenchirurgie. Het nasale domein wordt goed gedekt door de European Position Paper on Rhinosinusitus and Nasal Polyps (EPOS) richtlijn (Fokkens, 2012).
Voor het pulmonale domein is er, zoals hierboven beschreven, maar weinig goede evidence. Het doel van behandeling moet zijn om de longen zo lang mogelijk ‘goed’ te houden. Hierbij is de reservoirfunctie van de neusbijholten voor pathogenen een groot aandachtspunt (Aanæs, 2013). De werkgroep is dan ook van mening dat de neusbijholten, net zoals de longen, regelmatig gecontroleerd moeten worden op pathogenen. Er moet naar het oordeel van de werkgroep tot (aanvullende) behandeling van de neusbijholten worden overgegaan indien er, ondanks adequate eradicatiekuren, aanhoudende of intermitterende kolonisatie van de longen met verwekkers zoals pseudomonas aeruginosa blijft bestaan. Ook een steeds verslechterende longfunctie ondanks (antibiotische) therapie noopt tot behandeling van de neusbijholten, mits er natuurlijk aanwijzingen zijn dat de neusbijholten betrokken zijn (door nasendoscopie, CT-onderzoek en/of kweken vastgesteld). Bij een patiënt met CF die een longtransplantatie heeft ondergaan dient ook het reservoir van de neusbijholten aangepakt te worden om kolonisatie van de transplantatie longen te vermijden.
Omdat de kolonisatiestatus van de neusbijholten een indicatie kan vormen voor verdere behandeling, waaronder chirurgie, is de werkgroep van mening dat er met enige regelmaat neuskweken verricht moeten worden. Bovendien is in de literatuur beschreven dat ook de bovenste luchtweg al vanaf jonge leeftijd (geboorte) significante afwijkingen laat zien bij CF-patiënten (Berkhout, 2016). De frequentie (eens per jaar of vaker?), de startleeftijd (vanaf geboorte of pas vanaf 5 jaar?), de techniek (nasopharynxwat, kweek vanuit de middelste neusgang, kweek van neusspoelsel) alsmede de (directe) therapeutische consequenties zijn uitvoerig bediscussieerd binnen de werkgroep. Bij het ontbreken van bewijs in de literatuur, anders dan het bewijs dat de neusbijholten een reservoirfunctie voor pathogenen vormen, is men aangewezen op een expert opinion. De werkgroep stelt daarom voor dat ieder centrum de invulling kan variëren, maar geeft tegelijkertijd als richting aan: vanaf de leeftijd van 5 jaar, minimaal eens per jaar, met een kweek in de middelste neusgang zodra het kind dit toelaat, en met intensivering van lokale behandeling en orale antibiotica bij het aantreffen van pathogenen zoals Pseudomonas aeruginosa, gevolgd door eerdere herhaalkweken om het effect van de behandeling te monitoren.
Als in deze gevallen tot behandeling van de neusbijholten wordt overgegaan, kan dit ook chirurgie inhouden. Het is uit de literatuur onzeker wat de toegevoegde waarde van neusbijholtenchirurgie is. Daarom is de werkgroep van mening dat dit als zodanig met de individuele patiënt (en/of de wettelijke vertegenwoordiger) besproken dient te worden. Het alternatief voor neusbijholtenchirurgie is behandeling met lokale en orale antibiotica; dit zou in geval van chirurgie natuurlijk gecombineerd kunnen worden. Er is (beperkte) ervaring met het spoelen van de neus en neusbijholten met oplossingen van tobramycine of colistine (Berkhout, 2014).
ECFS richtlijn
De ECFS richtlijn (Castellani, 2018) rapporteert nagenoeg niet over dit onderwerp. Derhalve vult deze richtlijnmodule een hiaat in de ECFS richtlijn.
Neuskweken
Er is geen consensus in de werkgroep over de noodzaak van het uitvoeren van neuskweken om de kolonisatiestatus van de neusbijholten te monitoren, daarom is hier nu een zwakke aanbeveling over geformuleerd. Het is van belang om lokale consensus te bereiken over de startleeftijd, frequentie en techniek, en over de precieze therapeutische consequenties en follow-up bij positieve neuskweken.
Kosten
Neusbijholtenchirurgie gaat gepaard met directe kosten (opname al of niet in dagbehandeling, operatiekosten en intensievere nazorg voor een bepaalde periode). Daartegenover staat dat de indirecte kosten van chronische rhinosinusitis ook erg hoog zijn (denk aan ziekteverzuim, productieverlies, beroep op medische voorzieningen et cetera). De werkgroep is van mening dat de directe kosten van neusbijholtenchirurgie verantwoord kunnen worden door een te verwachte reductie van de indirecte kosten en de (tijdelijke) verbetering in kwaliteit van leven door de operatie.
Haalbaarheid
De haalbaarheid van neusbijholtenchirurgie is in nagenoeg alle ziekenhuizen goed. Omdat bij patiënten met CF naast klachtenverlichting ook optimale toegang voor lokale (antibiotische) therapie op de voorgrond staat, kan overwogen worden om laagdrempelig te zijn met uitgebreide neusbijholtenchirurgie (infundibulotomie, volledige ethmoidectomie, sphenotomie (indien aangelegd) en draf IIa (indien aangelegd)) en niet te blijven bij minimale chirurgische procedures (infundibulotomie en beperkte anterieure ethmoidectomie). Deze stelling wordt ondersteund door een recente review van Zheng (2019). De beschikbaarheid van de uitgebreidere neusbijholtenchirurgie is goed, maar kan verwijzing naar een gespecialiseerd/ academisch centrum inhouden.
De werkgroep is van mening dat er een plaats is voor neusbijholtenchirurgie in de behandeling van chronische rhinosinusitis bij patiënten met CF. Het is hierbij van belang om zowel het nasale als het pulmonale domein voor ogen te houden en de behandeling af te stemmen op de individuele omstandigheden en wensen (belasting) van de patiënt en/of diens vertegenwoordigers.
Onderbouwing
Achtergrond
Chronische rhinosinusitis (CRS) is een aanhoudende ontsteking van de neusbijholten. Nagenoeg alle patiënten met CF hebben CRS, ongeveer een kwart heeft daarbij ook neuspoliepen (Gentile, 1996; Orlandi, 2016; Yung, 2002, Berkhout 2014).
Alhoewel het ontstaansmechanisme van CRS bij patiënten met en zonder CF verschillend is, kortweg neutrofiele versus eosinofiele inflammatie, zijn de nasale klachten en de uitkomsten van gangbare therapie vergelijkbaar. Voor beide groepen geldt dat chirurgie alleen geen blijvende klachtencontrole geeft (Kovell, 2011). De gangbare behandeling van CRS (medicamenteus en operatief) valt buiten het bestek van deze kwaliteitsstandaard; zie hiervoor de EPOS richtlijn (Fokkens, 2012).
Bij CF-patiënten is de rol die CRS kan spelen op de lagere luchtwegen echter wezenlijk anders dan bij patiënten zonder CF aangezien er toch al een pulmonaal bedreigde situatie bestaat. Bovendien is gebleken dat de neusbijholten als reservoir kunnen dienen voor pulmonaal bedreigende pathogenen, zoals pseudomonas aeruginosa (Sakano, 2007). Dit heeft ertoe geleid dat er meer aandacht is gekomen voor de kolonisatiestatus van de neusbijholten en voor lokale nasale antibiotische therapie.
Momenteel wordt ook in patiënten met CF neusbijholtenchirurgie verricht. De indicatie wordt meestal gesteld door een combinatie van factoren, waaronder door de patiënt gerapporteerde symptomen, de mate van ziekte, eventuele eerdere behandelingen en het effect van lokale medicamenteuze therapie, frequentie van pulmonale exacerbaties en (onverklaarde) achteruitgang van de longfunctie (Kovell, 2011).
Vanuit anatomisch perspectief zou het aannemelijk zijn dat het chirurgisch verruimen van de toegang tot de neusbijholten bijdraagt aan betere toegang voor en effect van lokale antibiotische therapie en daarmee tot een vermindering van pulmonale ziektelast en kolonisatie. In dit kader zou vroege chirurgie van de neusbijholten aangewezen zijn in patiënten met CF. Toch is de exacte indicatie voor en timing van een chirurgische behandeling van CRS bij patiënten met CF momenteel nog onduidelijk.
Conclusies
|
Zeer laag GRADE |
Er lijkt geen blijvende klinische relevante verbetering van de SNOT-22 score na endoscopische sinuschirurgie, vergeleken met een ander type behandeling, bij patiënten met CF en chronische rhinosinusitis.
Bronnen: (Ayoub, 2017) |
|
Zeer laag GRADE |
Er lijkt geen klinisch relevante verbetering in de FEV1% waarde na endoscopische sinuschirurgie, vergeleken met een ander type behandeling, bij patiënten met CF en chronische rhinosinusitis.
Bronnen: (Ayoub, 2017; Kovell, 2011) |
|
Zeer laag GRADE |
Er lijkt geen klinisch relevante verbetering in de FVC% waarde na endoscopische sinuschirurgie, vergeleken met een ander type behandeling, bij patiënten met CF en chronische rhinosinusitis.
Bronnen: (Kovell, 2011) |
Samenvatting literatuur
1: Wat zijn de effecten van een operatieve behandeling of lokale antibiotica therapie bij CF-patiënten met een chronische ontsteking van de neusbijholten?
Beschrijving studies
De systematische zoekactie in de wetenschappelijke literatuur leverde twee studies op (Ayoub, 2017; Kovell, 2011). De geïncludeerde studies waren retrospectieve cohort studies welke de uitkomsten van patiënten die een chirurgische behandeling ondergingen vergeleken met patiënten die een ander type behandeling ondergingen. De allocatie van de behandeling was in beide studies gebaseerd op onduidelijk gedefinieerde criteria. Bovendien waren de criteria voor een type behandeling verschillend in beide studies. In het artikel van Ayoub (2017) werden patiënten met lage FEV1% waarden geselecteerd voor endoscopische sinuschirurgie, terwijl in het artikel van Kovell (2011) patiënten met hoge FEV1% werden geselecteerd voor endoscopische sinuschirurgie. In allebei de studies waren er significante verschillen in patiënt karakteristieken op baseline, waarvoor niet of slechts gedeeltelijk was gecorrigeerd (Ayoub, 2017; Kovell, 2011).
Ayoub (2017) vergeleek de effecten van een chirurgische behandeling met een medicamenteuze behandeling. Patiënten ≥ 18 jaar met CF en chronische rhinosinusitis werden geïncludeerd. Patiënten die tijdens het eerste bezoek werden doorverwezen voor een endoscopische sinuschirurgie maakten onderdeel uit van het chirurgische cohort (n=46). De patiënten in het medische cohort (n=90) ontvingen een medicamenteuze behandeling bestaande uit ten minste een irrigatie met budesonide-saline en een antibioticakuur van twee weken. In sommige gevallen werd de behandeling aangevuld met orale steroïden en eventuele andere medicamenten. Patiënten die na een initiële medicamenteuze behandeling alsnog werden doorverwezen voor een chirurgische ingreep maakten deel uit van het cross-over cohort (n=32). Er waren significante verschillen tussen alle patiëntengroepen op baseline in het aantal nasale poliepen, voormalige sinuschirurgie, Lund-Mackay CT-score, totale SNOT-22 score en FEV1%. De Lund-Mackay CT-score wordt gebruikt om de ernst van chronische rhinosinusitis te kwantificeren en geeft een score van 0 (geen afwijkingen) tot en met 24 (volledige sluiering van alle neusbijholten).
Een gerapporteerde uitkomstmaat in deze studie is de door middel van de SNOT-22 vragenlijst verkregen SNOT-22 score. De SNOT-22 vragenlijst is een gevalideerde vragenlijst (schaal 0 tot 110) voor patiënten met chronische rhinosinusitis waarmee de impact van een medische of chirurgische behandeling op de gezondheid gerelateerde kwaliteit van leven bepaald kan worden. Overige gerapporteerde uitkomstmaten in deze studie zijn geforceerde expiratoire volume (FEV1%) en geforceerde vitale capaciteit (FVC%) gemeten met spirometrie (Ayoub, 2017).
Kovell (2011) onderzocht retrospectief wat de effecten zijn van een chirurgische behandeling vergeleken met een ander type niet-chirurgische behandeling op longfunctiewaarden. CF patiënten met chronische rhinosinusitis tussen 0 en 21 jaar werden geïncludeerd. Patiënten werden ingedeeld in het chirurgische cohort wanneer ze behandeld werden met endoscopische sinuschirurgie (n=21). Kovell (2011) rapporteerde niet waaruit de behandeling bestond van de vergelijkende (niet-chirurgische) groep (n=41). De gemiddelde leeftijd in beide groepen was 10 tot 11 jaar. Er waren significante verschillen tussen beide patiëntengroepen op baseline in het aantal patiënten met neuspoliepen (86% in de chirurgische groep versus 32% in de vergelijkende groep). Er was niet gecorrigeerd voor dit verschil. Gerapporteerde uitkomstmaten in de studie van Kovell (2011) zijn de FEV1% en FVC%.
Resultaten
SNOT-22 score
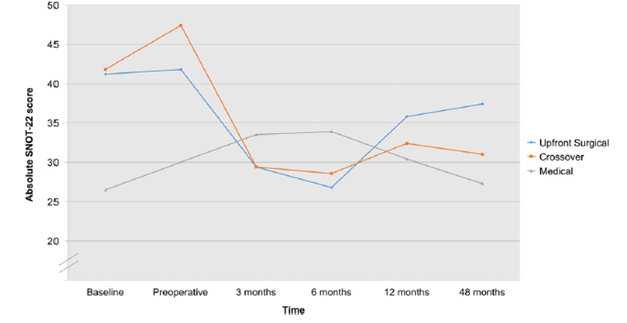
De uitkomstmaat SNOT-22 score is enkel beschreven in de studie van Ayoub (2017). Op baseline was de SNOT-22 score significant lager in patiënten in het medische cohort (26.5 ± 15.4; p < 0.001), vergeleken met het chirurgische cohort (41.2 ± 18.7) en het cross-over cohort (41.8 ± 16.9). Tijdens het preoperatieve meetmoment verhoogde de SNOT-22 score met 5.6 punten tot 47.4 ± 20.7 in het cross-over cohort, maar de SNOT-22 score bleef ongeveer gelijk in het chirurgische cohort (41.8 ± 19.7). 3 maanden na de operatie verbeterde de SNOT-22 score in het chirurgische cohort en het cross-over cohort en verslechterde de score in het medische cohort (niet significant; zie figuur 1) (Ayoub, 2017). In de studie van Ayoub (2017) werden geen significante verschillen in SNOT-22 scores gevonden tussen de groepen tot en met 48 maanden na de operatie.
Bewijskracht van de literatuur
Observationele studies beginnen ‘laag’ in bewijskracht volgens de GRADE-methodiek. De bewijskracht voor de uitkomstmaat SNOT-22 score is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias; niet gecorrigeerd voor mogelijke confounders) en het geringe aantal patiënten (imprecisie). Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
Figuur 1 Trend in absolute SNOT-22 score (Ayoub, 2017)
FEV1%
Beide studies rapporteerden gemiddelde FEV1% waarden (Ayoub, 2017; Kovell, 2011). In de studie van Ayoub (2017) was de gemiddelde baseline FEV1% waarde lager in deelnemers die chirurgisch werden behandeld (59,1) vergeleken met deelnemers in het medische (74,1 ± 26,0) en cross-over cohort (71,6 ± 24,2). Terwijl in de studie van Kovell (2011) de gemiddelde baseline FEV1% waarde hoger was in patiënten die endoscopische sinuschirurgie ondergingen (89,3%) vergeleken met patiënten die niet chirurgisch werden behandeld (76,8%).
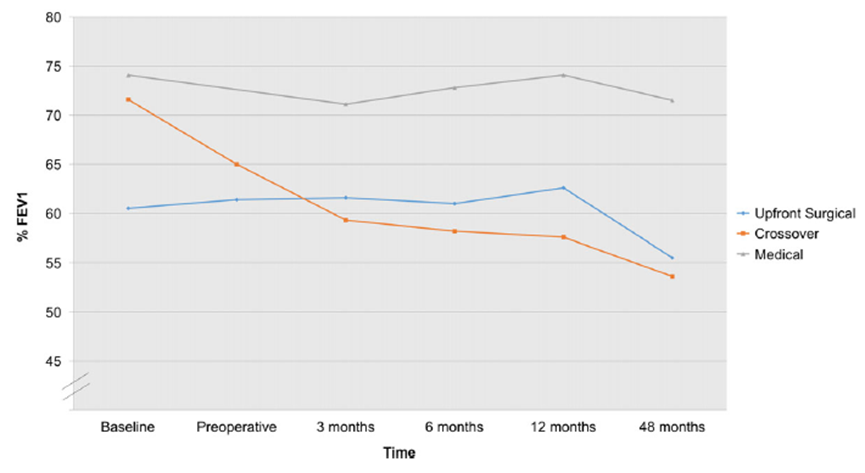
In de studie van Ayoub (2017) nam de FEV1 waarde in het chirurgische cohort toe tot 62,6% en af tot 55,5%, respectievelijk 12 en 48 maanden na de operatie. Patiënten in het cross-over cohort hadden FEV1% waarden vergelijkbaar met de deelnemers in het chirurgische cohort. Patiënten in het medische cohort hadden significant hogere FEV1% waarden, vergeleken met het chirurgische en cross-over cohort, gedurende 6 (p = 0.031), 12 (p = 0.013) en 48 maanden postoperatief (p=0.008) (zie figuur 2).
In de studie van Kovell (2011) was de gemiddelde FEV1% waarde in het chirurgische cohort toegenomen tot 90,7 (95%CI: 82,4 tot 99,0), afgenomen tot 88,4 (95%CI: 80,6 tot 96,2) en weer toegenomen tot 92,0 (95%CI: 84,4 tot 99,6) respectievelijk 6, 12 en 48 maanden postoperatief. In patiënten die niet chirurgisch werden behandeld veranderde de gemiddelde FEV1% tot 76,3 (95%CI: 68,9 tot 83,6), 72,2 (95%CI: 65,5 tot 79,0) en 76.6 (95%CI: 70,0 tot 83,1) respectievelijk 6, 12 en 48 maanden postoperatief.
Bewijskracht van de literatuur
Observationele studies beginnen ‘laag’ in bewijskracht volgens de GRADE-methodiek. De bewijskracht voor de uitkomstmaat FEV1% is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias; niet gecorrigeerd voor mogelijke confounders), het geringe aantal patiënten (imprecisie) en inconsistentie in resultaten. Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
Figuur 2 Trend in absolute FEV1% (Ayoub, 2017)
FVC%
De uitkomstmaat FVC% is alleen beschreven in het artikel van Kovell (2011). In de studie van Kovell (2011) was de gecorrigeerde gemiddelde baseline FVC% waarde hoger in patiënten die chirurgisch werden behandeld (89,3; 95%CI: 81,8 tot 96,8) vergeleken met patiënten die niet chirurgisch werden behandeld (76,8; 95%CI: 70,7 tot 83). Bovendien nam de gemiddelde FVC% waarde in patiënten die endoscopische sinuschirurgie ondergingen significant toe na 2 jaar ten opzichte van het vorige meetmoment; 1 jaar postoperatief (∆2,7; 95%CI: -2,8 tot 8,2). Dit verschil was ook significant ten opzichte van patiënten die geen endoscopische sinuschirurgie ondergingen (∆5,5; 95%CI: 0 tot 11).
Bewijskracht van de literatuur
Observationele studies beginnen ‘laag’ in bewijskracht volgens de GRADE-methodiek. De bewijskracht voor de uitkomstmaat FVC% is met 1 niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias; niet gecorrigeerd voor mogelijke confounders) en het geringe aantal patiënten (imprecisie). Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
2: Wat zijn de effecten van een vroege operatieve behandeling of een normale timing van een operatieve behandeling (dit is: pas bij falen van medicamenteuze therapie volgens de EPOS richtlijn) bij CF-patiënten met een chronische ontsteking van de neus(bijholten)?
Niet van toepassing. Er werden geen studies geïncludeerd.
Zoeken en selecteren
Om de uitgangsvraag en bijbehorende deelvragen te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvragen:
Zoekvraag 1: Wat zijn de (on)gunstige effecten van een operatieve behandeling, vergeleken met een ander type behandeling, bij CF-patiënten met een chronische ontsteking van de neusbijholten?
P: Patiënten met CF met chronische rhinosinusitis;
I: neusbijholte chirurgie;
C: geen operatie of lokale antibiotica;
O: kwaliteit van leven (QoL), door de patiënt gerapporteerde uitkomstmaten (PROM, zoals de SNOT-22 vragenlijst), pulmonale parameters (FEV1%/FVC%/exacerbaties), gradering score van nasale poliepen, Lund-Mackay CT-score en bacteriële long infecties.
Zoekvraag 2: Wat zijn de (on)gunstige effecten van een vroege laagdrempelige operatieve behandeling, vergeleken met een normale timing van een operatieve behandeling, bij CF-patiënten met een chronische ontsteking van de neusbijholten?
P: Patiënten met CF met chronische rhinosinusitis;
I: vroege laagdrempelige neusbijholte chirurgie;
C: normale timing van neusbijholte chirurgie;
O: kwaliteit van leven (QoL), door de patiënt gerapporteerde uitkomstmaten (PROM, zoals de SNOT-22 vragenlijst), pulmonale parameters (FEV1%/FVC%/exacerbaties), gradering score van nasale poliepen, Lund-Mackay CT-score en bacteriële long infecties.
Relevante uitkomstmaten
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
1: Wat zijn de effecten van een operatieve behandeling of lokale antibiotica therapie bij CF-patiënten met een chronische ontsteking van de neusbijholten?
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 5 juli 2017 met relevante zoektermen gezocht naar artikelen over de behandeling van chronische rhinosinusitis bij CF-patiënten. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 178 treffers op. Vergelijkende studies en systematische reviews gericht op de effecten van een operatieve behandeling vergeleken met een ander type behandeling werden geïncludeerd. Op basis van titel en abstract werden in eerste instantie 24 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 22 studies geëxcludeerd en 2 studies definitief geselecteerd (zie exclusietabel onder het tabblad Verantwoording).
Twee studies zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen (zie evidencetabellen onder het tabblad Verantwoording). De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen (zie risk of bias tabellen onder het tabblad Verantwoording).
2: Wat zijn de effecten van een vroege operatieve behandeling of een normale timing van een operatieve behandeling bij CF-patiënten met een chronische ontsteking van de neusbijholten?
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 5 juli 2017 met relevante zoektermen gezocht naar artikelen over de behandeling van chronische rhinosinusitis bij CF-patiënten. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 178 treffers op. Vergelijkende studies en systematische reviews gericht op de effecten van een vroege laagdrempelige operatieve behandeling vergeleken met een normale timing van een operatieve behandeling werden geïncludeerd. Op basis van titel en abstract werden in eerste instantie 24 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 24 studies geëxcludeerd en 0 studies definitief geselecteerd (zie exclusietabel onder het tabblad Verantwoording).
Referenties
- Aanæs K. Bacterial sinusitis can be a focus for initial lung colonisation and chronic lung infection in patients with cystic fibrosis. J Cyst Fibros. 2013 Sep;12 Suppl 2:S1-20. doi: 10.1016/S1569-1993(13)00150-1.
- Ayoub N, Thamboo A, Habib AR, Nayak JV, Hwang PH. Determinants and outcomes of upfront surgery versus medical therapy for chronic rhinosinusitis in cystic fibrosis. Int Forum Allergy Rhinol. 2017 May;7(5):450-458. doi: 10.1002/alr.21912.
- Berkhout MC, van Rooden CJ et al. Sinonasal manifestations of Cystic Fibrosis: a correlation between genotype and phenotype? J Cyst Fibros 2014 Jul; 13(4):442-8
- Berkhout MC, et al. CT-abnormalities, bacteriology and symptoms of sinonasal disease in children with Cystic Fibrosis. J Cyst Fibros. 2016 Nov;15(6):816-824.
- Berkhout MC, et al. Systemic absorption of nasally administered tobramycin and colistin in patients with cystic fibrosis. J Antimicrob Chemother. 2014 Nov;69(11):3112-5.
- Castellani C, Duff AJA, Bell SC, Heijerman HGM, Munck A, Ratjen F, Sermet-Gaudelus I, Southern KW, Barben J, Flume PA, Hodková P, Kashirskaya N, Kirszenbaum MN, Madge S, Oxley H, Plant B, Schwarzenberg SJ, Smyth AR, Taccetti G, Wagner TOF, Wolfe SP, Drevinek P. ECFS best practice guidelines: the 2018 revision. J Cyst Fibros. 2018 Mar;17(2):153-178. doi: 10.1016/j.jcf.2018.02.006.
- Fokkens WJ, Lund VJ, Mullol J, Bachert C, Alobid I, Baroody F, Cohen N, Cervin A, Douglas R, Gevaert P, Georgalas C, Goossens H, Harvey R, Hellings P, Hopkins C, Jones N, Joos G, Kalogjera L, Kern B, Kowalski M, Price D, Riechelmann H, Schlosser R, Senior B, Thomas M, Toskala E, Voegels R, Wang de Y, Wormald PJ. European Position Paper on Rhinosinusitis and Nasal Polyps 2012. Rhinol Suppl.2012 Mar;23:3 p preceding table of contents, 1-298.
- Gentile VG, Isaacson G. Patterns of sinusitis in cystic fibrosis. Laryngoscope. 1996 Aug;106(8):1005-9.
- Kovell LC, Wang J, Ishman SL, Zeitlin PL, Boss EF. Cystic fibrosis and sinusitis in children: outcomes and socioeconomic status. Otolaryngol Head Neck Surg. 2011 Jul;145(1):146-53. doi: 10.1177/0194599811400816.
- Orlandi RR, Kingdom TT, Hwang PH, Smith TL, Alt JA, et al. International Consensus Statement on Allergy and Rhinology: Rhinosinusitis. Int Forum Allergy Rhinol. 2016 Feb;6 Suppl 1:S22-209. doi: 10.1002/alr.21695.
- Sakano E, Ribeiro AF, Barth L, Condino Neto A, Ribeiro JD. Nasal and paranasal sinus endoscopy, computed tomography and microbiology of upper airways and the correlations with genotype and severity of cystic fibrosis. Int J Pediatr Otorhinolaryngol. 2007 Jan;71(1):41-50.
- Yung MW, Gould J, Upton GJ. Nasal polyposis in children with cystic fibrosis:a long-term follow-up study. Ann Otol Rhinol Laryngol. 2002 Dec;111(12 Pt 1):1081-6.
- Zheng Z, et al. Surgical Management of Chronic Rhinosinusitis. Cystic Fibrosis Med. Sci. 2019, 7, 57
Evidence tabellen
Research question: wat zijn de (on)gunstige effecten van een operatieve behandeling, vergeleken met een ander type behandeling, bij CF patiënten met een chronische ontsteking van de neus(bijholten)?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Ayoub 2017 |
Type of study: Retrospective cohort study
Setting: Single-centre
Country: Stanford, United States
Source of funding: Not described |
Inclusion criteria: Exclusion criteria: Not given
N (%) total at baseline: 136 (100%)
Important prognostic factors: |
Surgical cohort: patients who opted for surgery at the initial clinical encounter were assigned to the surgical cohort. The surgical cohorts were identified by Current Procedural Termionolgy (CPT) codes recorded at the time of patient’s first endoscopic sinus surgery (ESS) at Stanford (2006-2012), including maxillary antrostomy (31256 and 31267), anterior ethmoidectomy (31254), total etmoidectomy (31255), frontal sinusotomy (31276), and sphenoid sinusotomy (31287 and 31288).
|
Crossover cohort:
|
Length of follow-up: Mean total postoperative follow-up was 48 months for all three cohorts.
Loss-to-follow-up: No loss-to-follow-up
|
Mean SNOT-22 scores (mean ± SD): |
In this study the decision regarding medical versus surgical treatment follows an assessment of sinonasal symptoms, extent of disease, overall health status, and pulmonary status with regard to tolerance for surgery. However, the exact criteria were not stated in the article. |
|
Kovell 2011 |
Type of study: Retrospective cohort study
Setting: Single-centre Country: Baltimore, United States
Source of funding: None |
Inclusion criteria:
|
Endoscopic Sinus Surgery (ESS) |
Non-Endoscopic Sinus Surgery (non-ESS) |
Length of follow-up:
|
FEV1% (ESS vs non-ESS):
FVC% (ESS vs non-ESS): |
|
Risk of bias table for intervention studies (observational: non-randomized clinical trials, cohort and case-control studies)
Research question: wat zijn de (on)gunstige effecten van een operatieve behandeling, vergeleken met een ander type behandeling, bij CF patiënten met een chronische ontsteking van de neus(bijholten)?
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Ayoub 2017 |
Likely (cases and controls came from the same population, but decision regarding treatment was based on physician assessment) |
Unclear |
Likely (soft outcome measures, but no blinding of outcome assessment) |
Likely (differences between intervention groups at baseline, but not adjusted for important prognostic factors) |
|
Kovell 2011 |
Likely (cases and controls came from the same population, but decision regarding treatment was based on physician assessment) |
Unclear |
Likely (soft outcome measures, but no blinding of outcome assessment) |
Unclear (adjusted for Medicaid insurance coverage, age at first otolaryngology service, gender, and annual income $60,000, possibly other important prognostic factors are left out) |
- Failure to develop and apply appropriate eligibility criteria: a) case-control study: under- or over-matching in case-control studies; b) cohort study: selection of exposed and unexposed from different populations.
- 2 Bias is likely if: the percentage of patients lost to follow-up is large; or differs between treatment groups; or the reasons for loss to follow-up differ between treatment groups; or length of follow-up differs between treatment groups or is too short. The risk of bias is unclear if: the number of patients lost to follow-up; or the reasons why, are not reported.
- Flawed measurement, or differences in measurement of outcome in treatment and control group; bias may also result from a lack of blinding of those assessing outcomes (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Failure to adequately measure all known prognostic factors and/or failure to adequately adjust for these factors in multivariate statistical analysis.
Exclusietabel bij zoekvraag 1: Wat zijn de effecten van een operatieve behandeling of lokale antibiotica therapie bij CF patiënten met een chronische ontsteking van de neus(bijholten)?
|
Auteur en jaartal |
Redenen van exclusie |
|
Alanin (2016) |
Vergelijkend onderzoek in CF-patiënten met chronische rhinosinusitis waarin de longinfectie status voor en na endoscopic sinus surgery (ESS) met elkaar wordt vergeleken. |
|
Brook (2017) |
Vergelijkend onderzoek in CF-patiënten met chronische rhinosinusitis waarin de determinanten voor een bepaalde behandeling met elkaar worden vergeleken. |
|
Chaaban (2013) |
Beschrijvende review |
|
Davidson (1995) |
Protocol |
|
Fokkens (2012a) |
Beschrijvende review |
|
Fokkens (2012b) |
Beschrijvende review |
|
Holzmann (2004) |
Vergelijkend onderzoek waarin de effecten van een chirurgische interventie in longtransplantatie patiënten met CF wordt vergeleken met longtransplantatie patiënten zonder CF. |
|
Hui (1995) |
Beschrijvende review |
|
Illing (2014) |
Beschrijvende review |
|
Kang (2015) |
Systematische review van niet vergelijkend onderzoek. |
|
Keck (2007) |
Onderdeel van de systematische review van Macdonald (2012). Vergelijkend onderzoek naar de verschillen in effecten van paranasal sinus surgery (PSS) pre- en postoperatief. |
|
Liang (2013) |
Systematische review van (hoofdzakelijk) niet vergelijkend onderzoek (21/24). |
|
Lieser (2005) |
Beschrijvende review |
|
Macdonald (2012) |
Systematische review bevat o.a. de studies van Keck, 2007; Moss, 1995; Osborn, 2011 en Rickert, 2010. Vergelijkend onderzoek naar de verschillen in effecten van paranasal sinus surgery (PSS) pre- en postoperatief. |
|
Mainz (2009) |
Beschrijvende review |
|
Mainz (2016) |
Vergelijkend onderzoek waarin de effecten van twee typen medicamenten met elkaar worden vergeleken. |
|
Moss (1995) |
Vergelijkend onderzoek waarin twee typen chirurgische interventies met elkaar worden vergeleken. |
|
Osborn (2011) |
Onderdeel van Macdonald (2012). Vergelijkend onderzoek naar de verschillen in effecten van paranasal sinus surgery (PSS) pre- en postoperatief. |
|
Rickert (2010) |
Onderdeel van Macdonald (2012). Vergelijkend onderzoek naar de verschillen in effecten van paranasal sinus surgery (PSS) pre- en postoperatief. |
|
Rosenfeld (2007) |
Richtlijnen |
|
Rosenfeld (2015) |
Richtlijnen |
|
Virgin (2015) |
Vergelijkend onderzoek naar de inter-hospital variatie in de frequentie van sinus chirurgie in patiënten met CF. |
Exclusietabel bij zoekvraag 2: Wat zijn de effecten van een vroege operatieve behandeling of een normale timing van een operatieve behandeling bij CF patiënten met een chronische ontsteking van de neus(bijholten)?
|
Auteur en jaartal |
Redenen van exclusie |
|
Alanin (2016) |
Vergelijkend onderzoek in CF-patiënten met chronische rhinosinusitis waarin de longinfectie status voor en na endoscopic sinus surgery (ESS) met elkaar wordt vergeleken. |
|
Ayoub (2017) |
Vergelijkend onderzoek in CF-patiënten met chronische rhinosinusitis naar de verschillen in effecten van endoscopische sinuschirurgie vergeleken met een ander type behandeling. |
|
Brook (2017) |
Vergelijkend onderzoek in CF-patiënten met chronische rhinosinusitis waarin de determinanten voor een bepaalde behandeling met elkaar worden vergeleken. |
|
Chaaban (2013) |
Beschrijvende review |
|
Davidson (1995) |
Protocol |
|
Fokkens (2012a) |
Beschrijvende review |
|
Fokkens (2012b) |
Beschrijvende review |
|
Holzmann (2004) |
Vergelijkend onderzoek waarin de effecten van een chirurgische interventie in longtransplantatie patiënten met CF wordt vergeleken met longtransplantatie patiënten zonder CF. |
|
Hui (1995) |
Beschrijvende review |
|
Illing (2014) |
Beschrijvende review |
|
Kang (2015) |
Systematische review van niet vergelijkend onderzoek. |
|
Keck (2007) |
Onderdeel van de systematische review van Macdonald (2012). Vergelijkend onderzoek naar de verschillen in effecten van paranasal sinus surgery (PSS) pre- en postoperatief. |
|
Kovell (2011) |
Vergelijkend onderzoek in CF-patiënten met chronische rhinosinusitis naar de verschillen in effecten van endoscopische sinuschirurgie vergeleken met een ander type behandeling. |
|
Liang (2013) |
Systematische review van (hoofdzakelijk) niet vergelijkend onderzoek (21/24). |
|
Lieser (2005) |
Beschrijvende review |
|
Macdonald (2012) |
Systematische review bevat o.a. de studies van Keck, 2007; Moss, 1995; Osborn, 2011 en Rickert, 2010. Vergelijkend onderzoek naar de verschillen in effecten van paranasal sinus surgery (PSS) pre- en postoperatief. |
|
Mainz (2009) |
Beschrijvende review |
|
Mainz (2016) |
Vergelijkend onderzoek waarin de effecten van twee typen medicamenten met elkaar worden vergeleken. |
|
Moss (1995) |
Vergelijkend onderzoek waarin twee typen chirurgische interventies met elkaar worden vergeleken. |
|
Osborn (2011) |
Onderdeel van Macdonald (2012). Vergelijkend onderzoek naar de verschillen in effecten van paranasal sinus surgery (PSS) pre- en postoperatief. |
|
Rickert (2010) |
Onderdeel van Macdonald (2012). Vergelijkend onderzoek naar de verschillen in effecten van paranasal sinus surgery (PSS) pre- en postoperatief. |
|
Rosenfeld (2007) |
Richtlijnen |
|
Rosenfeld (2015) |
Richtlijnen |
|
Virgin (2015) |
Vergelijkend onderzoek naar de inter-hospital variatie in de frequentie van sinus chirurgie in patiënten met CF. |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 28-10-2019
Laatst geautoriseerd : 07-10-2020
Geplande herbeoordeling :
Voor het beoordelen van de actualiteit van deze kwaliteitsstandaard is de werkgroep niet in stand gehouden. Uiterlijk in 2025 bepalen de besturen van de NVALT, NVK en NCFS of de modules van deze kwaliteitsstandaard nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de kwaliteitsstandaard heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de kwaliteitsstandaard komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVALT, NVK en NCFS zijn regiehouders van deze Kwaliteitsstandaard en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de modules. De andere aan deze kwaliteitsstandaard deelnemende wetenschappelijke verenigingen of gebruikers van de kwaliteitsstandaard delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
Deze richtlijn is ontwikkeld in samenwerking met:
- Landelijke Vereniging Medische Psychologie
- Nederlands Instituut van Psychologen
- Nederlandse Vereniging van Diëtisten
De ontwikkeling van de medisch inhoudelijke modules binnen deze Kwaliteitsstandaard werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
De module over psychosociale zorg en de organisatie van zorg modules werden ondersteund vanuit de Samenwerkende Ouder- en Patiëntenorganisaties (VSOP) en gefinancierd vanuit ZonMW. De financierders hebben geen enkele invloed gehad op de inhoud van de kwaliteitsstandaard.
Doel en doelgroep
Doel
Het tot stand brengen van een evidence-based kwaliteitsstandaard Cystic Fibrosis, een combinatie van een zorgstandaard en een medisch specialistische richtlijn om patiënten met Cystic Fibrosis optimale afgestemde zorg te bieden.
Doelgroep
De doelgroep zijn alle patiënten met Cystic Fibrosis. De kwaliteitsstandaard behelst de gebieden van diagnostiek, behandeling en follow-up conform de diverse stadia van de aandoening en de verschillende leeftijdscategorieën.
Samenstelling werkgroep
Voor het ontwikkelen van de kwaliteitsstandaard is in 2016 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met CF en vertegenwoordigers van de NCFS.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze kwaliteitsstandaard.
Werkgroep
- Drs. G.D. (George) Nossent, longarts, UMCG te Groningen, NVALT (voorzitter)
- Dr. O.W. (Onno) Akkerman, longarts, UMCG te Groningen, NVALT
- S. (Sigrid) Amstelveen-Bökkerink, diëtist, Radboud UMC te Nijmegen, NVD
- Dr. H.G.M. (Bert) Arets, kinderlongarts, Wilhelmina Kinderziekenhuis en UMC Utrecht te Utrecht, NVK
- Dr. M. (Marleen) Bakker, longarts, Erasmus MC te Rotterdam, NVALT
- Drs. J.M.W. (Annemarie) van den Berg, longarts, Hagaziekenhuis te Den Haag, NVALT
- Dr. M.C. (Maaike) Berkhout, KNO arts, OLVG te Amsterdam, NVKNO
- Dr. F.A.J.A. (Frank) Bodewes, kinderarts-MDL, UMCG te Groningen, NVK
- A. (Annet) Bongen, maatschappelijk werker, UMC Utrecht te Utrecht, BPSW
- J. (Jacqueline) Boekhoff, maatschappelijk werker, Amsterdam UMC, locatie VUMC te Amsterdam, BPSW
- Drs. L.H. (Hassan) el Bouzzaoui, longarts, Hagaziekenhuis te Den Haag, NVALT
- D. (Dagmar) Brocke, maatschappelijker werker, UMC Utrecht te Utrecht, BPSW
- Drs. E.J. Brokaar, poliklinisch apotheker, Hagaziekenhuis te Den Haag, NVZA
- Dr. I. (Inez) Bronsveld, longarts, UMC Utrecht te Utrecht, NVALT
- Drs. A. (Agnes) Clement-de Boer, kinderarts (endocrinologie), Hagaziekenhuis te Den Haag, NVK
- W. (Wytze) Doeleman, fysiotherapeut, UMC Utrecht te Utrecht, KNFG
- Dr. M.M. (Menno) van der Eerden, longarts, Erasmus MC te Rotterdam, NVALT
- Prof. Dr. C.K. (Kors) van der Ent, Kinderlongarts, Wilhelmina Kinderziekenhuis en UMC Utrecht te Utrecht, NVK
- Dr. B.C.T. (Boudien) Flapper, kinderarts-sociale pediatrie, UMCG te Groningen, NVK
- Dr. L. (Lianne) van der Giessen, kinderfysiotherapeut, Erasmus MC Sophia Kinderziekenhuis te Rotterdam, KNGF
- Drs. N. (Nanko) de Graaf, kinderradioloog, Erasmus MC te Rotterdam, NVvR
- Dr. V. (Vincent) Gulmans, Hoofd Onderzoek en Kwaliteit van zorg NCFS te Baarn, NCFS
- Prof. dr. H.G.M. (Harry) Heijerman, longarts, UMC Utrecht te Utrecht, NVALT
- Drs. D.M. (Danielle) Hendriks, kinderarts (MDL), Juliana Kinderziekenhuis te Den Haag, NVK
- Dr. J.J.E. Hendriks, kinderlongarts, Zuyderland Medisch Centrum te Heerlen, NVK
- Prof. dr. B. (Bart) van Hoek, MDL-arts, UMC te Leiden, NVMDL
- Drs. R.A.S. (Rogier) Hoek, longarts, Erasmus MC te Rotterdam, NVALT
- Dr. A. (Ageeth) Hofsteenge, kinderdiëtist, Amsterdam UMC, locatie VUMC en AMC, te Amsterdam, NVD
- Drs. C. (Chantal) Hoge, MDL arts, Maastricht UMC+ te Maastricht, NVMDL
- F.M. (Francis) Hollander, diëtist, UMC Utrecht, Utrecht, NVD
- Prof. dr. R.H.J. (Roderick) Houwen, kinderarts MDL, Wilhelmina Kinderziekenhuis en UMC Utrecht te Utrecht, NVK
- Dr. J. (Jakko) van Ingen, arts microbioloog, Radboud UMC te Nijmegen, NVMM
- Dr. H.M. (Hettie) Janssens, (kinder)longarts, Erasmus MC Sophia Kinderziekenhuis te Rotterdam, NVK
- Drs. A.J. (Arjan) Jansz, arts microbioloog, Stichting PAMM te Eindhoven, NVMM
- H.J. (Hetty) van der Kamp, kinderarts-endocrinoloog, HMC Bronovo te Den Haag en Wilhelmina Kinderziekenhuis UMC Utrecht te Utrecht, NVK
- C. (Cora) de Kiviet, verpleegkundig specialist, Wilhelmina Kinderziekenhuis en UMC Utrecht te Utrecht, V&VN
- A. (Annelies) Kok, verpleegkundig consulent, Erasmus MC te Rotterdam, CF Netwerk verpleegkundigen Nederland
- Dr. B.G.P. (Bart) Koot, kinderarts (MDL), Amsterdam UMC, locatie AMC te Amsterdam, NVK
- M.A. (Marian) Kruijswijk, verpleegkundig specialist, UMC Utrecht te Utrecht, V&VN
- Dr. C.J. (Christof) Majoor, longarts, Amsterdam UMC, locatie AMC te Amsterdam, NVALT
- R. (Renske) van der Meer, longarts, Hagaziekenhuis te Den Haag, NVALT
- Dr. P.J.F.M. (Peter) Merkus, kinderlongarts, Radboud MC te Nijmegen, NVK
- Dr. D. (Dick) Mul, kinderarts (endocrinologie), Diabeter te Rotterdam, NVK
- Drs. A.F. (Ad) Nagelkerke, kinderlongarts, Amsterdam UMC, locatie VUmc te Amsterdam, NVK
- drs. J. (Jacquelien) Noordhoek, directeur patiëntenorganisatie NCFS te Baarn, NCFS
- Marit van Oirschot-van de Ven, verpleegkundig specialist, UMC Utrecht te Utrecht, V&VN
- Dr. M (Marianne) Nuijssink, kinderlongarts, Haga ziekenhuis te Den Haag, NVK
- Dr. M.H.E. (Monique) Reijers, longarts, Radboudumc te Nijmegen, NVALT
- Dr. S. (Sietze) Reitsma, KNO-arts, Amsterdam UMC, locatie AMC te Amsterdam, NVKNO
- Prof. dr. Y.B. (Yolanda) de Rijke, afdelingshoofd Klinische Chemie, Erasmus MC te Rotterdam, NVKC
- Dr. B.L. (Bart) Rottier, kinderlongarts, UMCG te Groningen, NVK
- R.A. (Revka) Schrijver, verpleegkundig consulent, Hagaziekenhuis te Den Haag, CF Netwerk verpleegkundigen Nederland
- Drs. L. (Luciënne) Speleman, KNO arts, Wilhelmina Kinderziekenhuis en UMC Utrecht, te Utrecht, NVKNO
- Dr. S.W.J. (Suzanne) Terheggen-Lagro, kinderlongarts, Amsterdam UMC, locatie AMC te Amsterdam, NVK
- Prof. dr. H.A.W.M (Harm) Tiddens, (kinder)longarts, Erasmus MC Sophia Kinderziekenhuis te Rotterdam, NVK
- H. (Hilda) Vale-Eeman, kinderverpleegkundige, Amsterdam UMC, locatie AMC te, Amsterdam, V&VN
- Dr. H. (Hester) van der Vaart, longarts UMCG te Groningen, NVALT
- Dr. H.W. (Harold) de Valk, internist-endocrinoloog UMCU te Utrecht, NIV
- Dr. M. (Marieke) Verkleij, GZ-psycholoog/cognitief gedragstherapeut, Amsterdam UMC, locatie VUMC te Amsterdam, VGCT
- Dr. E.J.M. (Els) Weersink, longarts, Amsterdam UMC, locatie AMC te Amsterdam, NVALT
- M. (Marion) Wessels, Verpleegkundige, UMC Utrecht te Utrecht, V&VN
- Dr. B.J. (Barbara) Wijnberg-Williams, klinisch psycholoog, UMCG te Groningen en Isala Ziekenhuis te Zwolle, NIP
- Dr. K.M. (Karin) de Winter- de Groot, kinderlongarts, Wilhelmina Kinderziekenhuis en UMC Utrecht te Utrecht, NVK
- Dr. P.J.G. (Petra) Zwijnenburg, klinisch geneticus, Amsterdam UMC, locatie VUMC te Amsterdam, VKGN
Met ondersteuning van
- Dr. F. (Floor) Willeboordse, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Ir. T. (Teus) van Barneveld, directeur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. A. (Anne) Speijer, coördinator kwaliteit van zorg, VSOP
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Drs. G.D. (George) Nossent (voorzitter) |
Longarts UMCG |
Bestuurslid NVALT |
Geen |
Geen actie |
|
O. Akkerman |
Longarts, fulltime, UMCG |
Lid nascholingscommissie VvAwT; onbetaald Lid visitatieteam TBC screening LRCB; onbetaald |
Geen |
Geen actie |
|
S. Amstelveen-Bokkerink |
Diëtist Radboudumc Dekkerswald |
Geen |
Geen |
Geen actie |
|
B. Arets |
Kinderlongarts, UMC Utrecht |
Academisch kinder(long)arts, deels Associate Professor Medisch Onderwijs Universiteit.
|
|
Geen actie
Toelichting: Niet direct betrokken bij module waarop de potentiële belangenverstrengeling van toepassing is. |
|
M. Bakker |
Longarts, Erasmus MC Rotterdam |
Geen |
Deelname aan diverse studies Vertex (chloortransportmodulatoren) |
Geen trekker van module CFTR modulatoren (wel meelezer).
Toelichting op onderzoek gesponsord door Vertex: Betrokken bij inclusie van patiënten en dataverzameling. Niet betrokken bij data-analyse, wel principal investigator, geen auteur. |
|
T. van Barneveld |
Directeur Kennisinstituut Federatie Medisch Specialisten |
|
Geen |
Geen actie |
|
A. van den Berg |
Longarts Hagaziekenhuis Den Haag |
Geen |
Geen |
Geen actie |
|
M. Berkhout |
KNO-arts in opleiding in het Academisch Medisch Centrum Amsterdam. Opleider: Prof. dr. F.G. Dikkers |
Geen |
Geen |
Geen actie |
|
F. Bodewes |
Kinderarts-MDL UMC Groningen |
Geen |
Geen |
Geen actie |
|
J. Boekhoff |
medisch maatschappelijk werker Amsterdam UMC, locatie VUmc |
Geen |
Geen |
Geen actie |
|
A. Bongen |
Medisch maatschappelijk werker UMC Utrecht |
Geen |
Geen |
Geen actie |
|
H. Bouazzaoui |
Longarts Hagaziekenhuis Den Haag |
Geen |
Geen |
Geen actie |
|
D. Brocke |
Medisch maatschappelijk werk UMC Utrecht Divisie Hart en Longen |
Geen |
Geen |
Geen actie |
|
E. Brokaar |
Poliklinisch apotheker in de Haga Apotheek, HagaZiekenhuis |
Geen |
Gedeeltelijke vergoeding voor internationaal CF congres door Novartis (2012 en 2014) |
Geen actie |
|
I. Bronsveld |
Pulmonoloog UMC Utrecht |
Geen |
Geen |
Geen actie |
|
A. Clement - Boers, de |
Kinderarts, diabetes HAGA/Julianaziekenhuis Den Haag |
Voorzitter Stichting D-Support (ondersteuning voor gezinnen met diabetes) onbetaald |
Geen |
Geen actie |
|
W. Doeleman |
Fysiotherapeut UMC-Utrecht |
Geen |
Geen |
Geen actie |
|
H. Eeman |
Kinderverpleegkundig consulent CF Werkgever: Academisch Medisch Centrum Amsterdam |
Geen |
Geen |
Geen actie |
|
M. Eerden |
Longarts Erasmus MC |
Geen |
Geen |
Geen actie |
|
K. van der Ent |
Kinderarts, hoogleraar kinderlongziekten UMC Utrecht |
|
Onderzoeksubsidies afgelopen vijf jaar:
Instituut heeft betalingen ontvangen voor klinische studies en adviesraad bijeenkomsten van Gilead, Vertex, GSK, Nutrica, TEVA, ProQR, Galapagos en Proteastasis.
|
Gemelde belangen en nevenfuncties zijn besproken met initiatief nemende verenigingen NVALT en NVK.
Deelname in werkgroep als meelezer bij alle modules op basis van expertise over CF.
Geen trekker van modules over CFTR modulatoren waarvoor er financiële belangen zijn. |
|
B. Flapper |
Kinderarts, sociale pediatrie |
Geen |
Geen |
Geen actie |
|
L. van der Giessen |
0,8 Kinderfysiotherapeut Erasmus MC Sophia 0,1 Coordinator onderwijs Erasmus MC 0,1 docentbegeleiding Erasmus MC |
B. Gastdocent Hogeschool Rotterdam Post HBO kinderfysio B. Cursusleider NPI B. Gastdocent Maas en Meer (B=betaald) |
Geen |
Geen actie |
|
V. Gulmans |
Hoofd onderzoek en kwaliteit van zorg bij Nederlandse Cystic Fibrosis Stichting |
Geen |
Geen persoonlijke vergoedingen. De NCFS heeft corporate sponsorovereenkomsten met meerdere bedrijven (farmaceuten en hulpmiddelen). De overeenkomsten zijn aangemeld bij het transparantieregister. De totale sponsorinkomsten bedragen niet meer dan 10 % van de totale NCFS-begroting. De sponsors hebben geen invloed op de inhoud van NCFS-uitingen. |
Geen actie |
|
H. Heijerman |
Longarts, hoofd afdeling longziekten UMC Utrecht. |
|
|
Gemelde belangen en nevenfuncties zijn besproken met initiatief nemende verenigingen NVALT en NVK.
Deelname in werkgroep als meelezer bij alle modules op basis van expertise over CF.
Geen trekker van modules over CFTR modulatoren waarvoor advies is gegeven. |
|
D. Hendriks |
kinderarts-maagdarmleverziekten Juliana Kinderziekenhuis/Hagaziekenhuis Den Haag |
Geen |
Geen |
Geen actie |
|
H. Hendriks |
kinderarts-longarts in Zuyderland MC en 0,1 fte gedetachteerd naar MUMC + voor CF zorg. |
Geen |
Geen |
Geen actie |
|
B. Hoek |
gastroenteroloog en hepatoloog, LUMC Hoogleraar |
Geen |
Geen gesponsord onderzoek op het gebied van CF. Bij genoemde studies mogelijk auteur en: Novartis: PI, inclusie patiënten Zambon: PI, design studies, data analyse Chiesi: design studie, patiënt inclusie, data analyse Abbvie, Norgine, Astellas: patiënt inclusie CLIF: patiënt inclusie Perspectum: patiënt inclusie, design deel van studie Organ Assist: PI, patiënt inclusie Novartis - deelname aan internationale medicijnstudie bij auto-immuun hepatitis Zambon-unrestricted grant voor onderzoek naar auto-immuun hepatitis en overlap syndromen Chiesi - investigator-initiated studie naar farmacoklnetiek van Envarsus (tacrolimus) na levertransplantatie Abbvie - studie naar langetermijn effect op leverfibrose na DAA behandeling van hepatitis C Norgine - deelname aan rifaximin bij hepatische encefalopathie studie CLIF consortium - deelname aan internationale studies naar accuut - op chronisch leverfalen Perspectum - studies naar nieuew NRI technieken bij leverziekte en na levertransplantatie Astellas - deelname aan immuunsuppressie studie na levertransplantatie OrganAssist - deelname aan studie met machineperfusie voor levertransplantatie |
Geen actie |
|
R. Hoek |
Longarts Erasmus MC Centrum voor Longtransplantatie Centrum voor Cystic Fibrosis en Recidiverende Luchtweginfecties |
Nederlands Transplantatievereniging
allen onbezoldigd |
Geen |
Geen actie |
|
A. Hofsteenge |
Dietist: CF-team (kindergeneeskunde) (Vumc en AMC) Kindergeneeskunde (polikliniek) (VUmc) |
Geen |
Geen |
Geen actie |
|
C. van Hoge |
Maag- darm- leverarts MUMC+ |
Geen |
Geen |
Geen actie |
|
F. Hollander-Kraaijeveld |
Diëtist UMC Utrecht |
Geen |
Geen |
Geen actie |
|
R. Houwen |
Hoofd afdeling kinder-MDL UMCU/WKZ |
De (poli)klinische zorg voor patienten met MDL problematiek, het geven van onderwijs alsmede het vooruitbrengen van de zorg en kennis op dit gebied, onder meer door (meewerken aan) publicaties. Tevens aansturen van de subafdeling kinder-MDL. Deze taken worden verricht in een 100% dienstverband. |
|
Geen actie |
|
J. van Ingen |
Arts-microbioloog, Radboudumc, Nijmegen |
Geen |
Mede-auteur van de internationale richtlijn voor diagnostiek en behandeling van niet-tuberculeuze mycobacterieën bij pantiënten met CF (Floto, 2016). |
Geen actie |
|
H. Janssens |
Kinderlongarts, Erasmus MC/Sophia Kinderziekenhuis |
Voorzitter CF-team Sophia |
Co-promotor bij meerdere studies gefinancierd door unrestricted grant van Chiesi en Gilead. |
Geen actie, meelezer bij module over behandeling P.Aeruginosa (Gilead, Chiesi), geen trekker.
Toelichting gesponsorde onderzoeken. -Studies van Chiesi en Gilead waren met een unrestricted grant, financieen gerund door Sophia BV. De aard van de studies kon door het onderzoeksteam vrij ingevuld worden en gepubliceerd. -Deelname centrum aan sponsor initiated studies van Vertex, en Gilead. Geen mede-auteur. Als voorzitter van CF-team verantwoordelijk voor uitvoer van de studie, en beoordeling adverse events en lab uitslagen van deelnemende patiënten. |
|
A. Jansz |
arts-microbioloog, St PAMM, streeklaboratorium voor de volksgezondheid Veldhoven |
Coördinerend arts-microbioloog, RIVM/IDS, Bilthoven, een detachering van 20% auditor voor de RvA |
Geen |
Geen actie |
|
H. van der Kamp |
kinderarts-endocrinoloog (0,7 fte) werkzaam in het WKZ Utrecht en in het Bronovo ziekenhuis in Den Haag (0,15 fte). |
Lid bestuur NVE (onbetaald) Lid adviesgroep groeihormoon (onbetaald) Lid adviesgroep neonatale screening AGS & CHT (onbetaald) |
Geen |
Geen actie |
|
C. de Kiviet |
Verpleegkundig Specialist Bij CF-centrum UMC Utrecht, locatie WKZ |
Lid van Accreditatiecommissie Van de RSV (Register Verpleegkundig Specialismen) >Vacatievergoeding per bijeenkomst -Beoordelaar scholing voor herregistratie Verpleegkundig Specialisten > Vergoeding per beoordeelde scholing |
Geen |
Geen actie |
|
A. Kok |
verpleegkundig consulent CF Erasmus MC-Sophia Rotterdam |
Geen |
Geen |
Geen actie |
|
B. Koot |
kinderarts AMC Amsterdam |
Bestuur sectie kinder MDL, NVK, onbetaald |
Geen |
Geen actie |
|
M. Kruiswijk |
verpleegkundig specialist afdeling Cystic Fibrosis |
Geen |
Geen |
Geen actie |
|
C. Majoor |
Longarts, Amsterdam UMC, locatie AMC |
|
Inclusie patiënten aan fase IIa, IIb, III en IV studies van Vertex en Galapagos |
Geen actie
Toelichting: Niet direct betrokken bij module waarop de potentiële belangenverstrengeling van toepassing is. |
|
R. van der Meer |
Longarts, aandachtsgebied Cystic Fibrose. Werkzaam in Hagaziekenhuis. Den Haag. |
Geen |
Geen |
Geen actie |
|
P. Merkus |
Kinderarts-pulmonoloog, Radboudumc Amalia Kinderziekenhuis |
|
Deelname Studies bij CF door farmaceutische bedrijven: Vertex, PTC (PI, betrokken bij inclusie, betrokken bij data-analyse) |
Geen actie
Toelichting: Niet direct betrokken bij module waarop de potentiële belangenverstrengeling van toepassing is. |
|
D. Mul |
Kinderarts-endocrinoloog bij Diabeter |
|
Geen |
Geen actie, trekker module diabetes (screening en behandeling)
Toelichting op deelname adviesraad medisch Novo Nordisk: conflicteert niet met trekkersrol van diabetes modules. |
|
A. Nagelkerke |
Kinderlongarts VU medisch centrum |
Geen |
|
Geen actie
Toelichting: Niet direct betrokken bij module waarop de potentiële belangenverstrengeling van toepassing is.
|
|
J. Noordhoek |
Directeur Nederlandse Cystic Fibrosis Stichting |
|
|
Geen actie |
|
M. Nuijsink |
Kinderarts Juliana Kinderziekenhuis/ HAGA ziekenhuis |
Geen |
|
Geen actie
Toelichting: Niet direct betrokken bij module waarop de potentiële belangenverstrengeling van toepassing is. |
|
M. van Oirschot-van de Ven |
Kinderverpleegkundig consulent CF, Academisch Medisch Centrum Amsterdam |
Geen |
Geen |
Geen actie |
|
M. Reijers |
Longarts, Radboud UMC, Nijmegen |
|
|
Geen actie
Toelichting: Niet direct betrokken bij module waarop de potentiële belangenverstrengeling van toepassing is.
|
|
S. Reitsma |
KNO-arts AMC Amsterdam |
Geen |
Geen |
Geen actie |
|
Y de Rijke |
Afdelingshoofd Klinische Chemie Erasmus MC te Rotterdam |
Geen |
Geen |
Geen actie |
|
B. Rottier |
UMC Groningen, kinderlongarts |
Geen |
Geen |
Geen actie |
|
R. Schrijver |
Verpleegkundig consulent CF Hagaziekenhuis |
Geen |
Geen |
Geen actie |
|
A. Speijer |
Coördinator kwaliteit van zorg |
Lid advies - en expertcommissie AQUA van Zorginstituut Nederland.
|
Geen |
Geen actie |
|
L. Speleman |
paediatrische KNO, UMC Utrecht Wilhelminakinderziekenhuis |
|
Geen |
Geen actie |
|
S. Terheggen-Lagro |
Kinderlongarts AMC |
|
Geen |
Geen actie |
|
H. Tiddens |
Kinderlongarts, Erasmus MC, Sofia kinderziekenhuis
|
|
|
Geen actie, meelezer bij module over behandeling P.Aeruginosa geen trekker.
Toelichting gesponsorde onderzoeken. iABC: Co-investigator, CT aquisitie, analyse van CTs, geen betrokkenheid bij inclusie van patiënten ALPINE II: betrokken bij inclusie van patiënten |
|
H. van der Vaart |
Longarts UMCG |
Geen |
Geen |
Geen actie |
|
H. de Valk |
Internist-endocrinoloog, UMC Utrecht |
|
Geen |
Geen actie |
|
H. Verkade |
Kinderarts MDL, UMCG Groningen |
|
Geen |
Geen actie |
|
M. Verkleij |
GZ-psycholoog/cognitief gedragstherapeut, Amsterdam UMC locatie VUmc |
Geen |
Geen |
Geen actie |
|
E. Weersink |
longarts, AMC Amsterdam |
Geen |
|
Geen actie
Toelichting: Niet direct betrokken bij module waarop de potentiële belangenverstrengeling van toepassing is. |
|
M. Wessels-Bakker |
Verpleegkundig Specialist Longtransplantatie, onderzoeker |
Geen |
Geen |
Geen actie |
|
B. Wijnberg-Williams |
Klinisch psycholoog/medisch psycholoog, richting kinderen en jeugdigen, UMCG (0,4 fte) en Isala ziekenhuis (0,7fte) |
Lid van Accreditatiecommissie Federatie van Gezondheidszorgpsychologen en Psychotherapeuten (FGzPt) (vacatiegelden) |
Geen |
Geen actie |
|
F. Willeboordse |
Adviseur Kennisinstituut Federatie Medisch Specialisten |
Geen |
Via werk partner aandelen bij moederbedrijf Johnson & Johnson. Partner is werkzaam bij Janssen Vaccines BV. |
Geen actie |
|
K. Winter-de Groot |
kinderarts-pulmonoloog WKZ/UMC Utrecht |
|
Geen |
Geen actie |
|
P. Zwijnenburg |
kinderarts-klinisch geneticus VUMC afd. klinische genetica |
Geen |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door deelname aan de werkgroep van de patiëntenorganisatie NCFS en de VSOP voor zeldzame en genetische aandoeningen. De uitgangsvragen zijn getoetst via een online peiling onder patiënten en ouders. Voor sommige onderwerpen is het patiënten-panel van de NCFS geraadpleegd om input te verkrijgen over patiëntenvoorkeuren over een behandeling of screeningsmethode.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de kwaliteitsstandaarden de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de kwaliteitsstandaard in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
Deze medisch inhoudelijke modules in deze kwaliteitsstandaard is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Voor de modules over psychosociale zorg en de modules over organisatie van zorg is er volgens de AQUA methode gewerkt: GRADE. De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie https://www.gradeworkinggroup.org/docs/Criteria_for_using_GRADE_2016-04-05.pdf).
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de stuurgroep en de adviseur de knelpunten. De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten. Tevens zijn er knelpunten aangedragen door VSOP, NCFS, NVK, NVALT, Patiëntenfederatie, Lareb, NVMDL, ZiN, ZN, NIP, NVKNO, VKGN, Vereniging innovatieve geneesmiddelen, NVKC, V&VN, NVMM, KNGF, NIV, NVvR, NVD, NVAB, NVZA via een invitational conference.
De concept uitgangsvragen zijn door de NCFS online voorgelegd aan mensen met CF en ouders van kinderen met CF. Vrijwel alle uitgangsvragen werden door tenminste 85% van de 68 respondenten als zinvol tot zeer zinvol ervaren. Bij twee vragen was dit percentage lager (56% respectievelijk 72%), veroorzaakt door het feit dat 25% van de respondenten bij deze vragen geen mening had.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de stuurgroep en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er is voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Voor deze kwaliteitsstandaard was de Europese Best Practice richtlijn van de ECFS (Castellani, 2018) een belangrijk uitgangspunt voor bijna alle modules.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de kwaliteitsstandaard is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van Zorg.
Indicatorontwikkeling
De werkgroep heeft besloten geen indicatoren te ontwikkelen bij de huidige richtlijn omdat er geen substantiële barrières konden worden geïdentificeerd die implementatie van de aanbeveling zouden kunnen bemoeilijken.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Castellani C, Duff AJA, Bell SC, Heijerman HGM, Munck A, Ratjen F, Sermet-Gaudelus I, Southern KW, Barben J, Flume PA, Hodková P, Kashirskaya N, Kirszenbaum MN, Madge S, Oxley H, Plant B, Schwarzenberg SJ, Smyth AR, Taccetti G, Wagner TOF, Wolfe SP, Drevinek P. ECFS best practice guidelines: the 2018.
revision. J Cyst Fibros. 2018 Mar;17(2):153-178. doi: 10.1016/j.jcf.2018.02.006. Epub 2018 Mar 3. Review.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
