Fecaal calprotectine bij diagnose IBD
Uitgangsvraag
Wat is de waarde van het fecaal calprotectine bij het selecteren van kinderen en adolescenten met een verdenking op IBD voor endoscopie?
Aanbeveling
Gebruik FCP in tweede en derdelijns ziekenhuizen als triagetest bij patiënten met een klinische verdenking op IBD om hoog risico van laag risico te onderscheiden en het aantal onterecht uitgevoerde endoscopische procedures te verminderen.
Verricht geen endoscopisch onderzoek ter evaluatie van IBD wanneer het FCP lager is dan 100 μg/g.
Verricht endoscopisch onderzoek wanneer het FCP hoger is dan 250 μg/g en colonpathogenen zijn uitgesloten.
Overweeg endoscopisch onderzoek bij FCP-waarden tussen de 100 en de 250 μg/g.
Verricht endoscopisch onderzoek, ongeacht de hoogte van het FCP, wanneer er sprake is van persisterend rectaal bloedverlies.
Verricht MR-enterografie of video-capsuleonderzoek, wanneer er sprake is van een verhoogd FCP, maar er bij endoscopisch onderzoek van de bovenste en onderste tractus digestivus geen afwijkingen gevonden worden, en de verdenking op ZvC blijvend hoog is.
Overwegingen
Diagnostische waarde
Als de kinderarts op grond van anamnese en lichamelijk onderzoek tot een verdenking op IBD is gekomen, moet de diagnose vervolgens worden bevestigd. Het bevestigen van de diagnose gebeurt bij voorkeur met een test die maximale zekerheid geeft, de ‘gouden standaard’, of een test die deze zo dicht mogelijk benadert. Bij verdenking op IBD is endoscopisch en histopathologisch onderzoek de gouden standaard, maar dit onderzoek is invasief en tijdrovend. Het onderzoek wordt onder narcose of diepe sedatie uitgevoerd en de noodzakelijke darmvoorbereiding is onaangenaam. Dit maakt dat je laagrisicopatiënten hier liever niet aan blootstelt. Een goede triagetest maakt het mogelijk op grond van de testuitslag een uitspraak te doen over de waarschijnlijkheid van de ziekte. De werkgroep heeft de reeds verschenen studies bestudeerd, waarin het gebruik van FCP werd onderzocht om onderscheid te kunnen maken tussen kinderen met een hoog en laag risico op IBD. De meerwaarde van FCP als triagetest is het grootst in omstandigheden met een vooraf kans tussen de 25 en 75%. De werkgroep concludeert dat FCP een betrouwbare marker is in tweede en derdelijns ziekenhuizen om patiënten met hoog risico van laagrisicopatiënten te onderscheiden, en het aantal onterecht uitgevoerde procedures te verminderen.
FCP afkapwaarden
Als de triagetest een continue schaal kent, zoals bij FCP, is een afkappunt nodig. Het ideale afkappunt is niet altijd het punt met de laagste percentages fout-positieve en fout-negatieve uitslagen: het wordt medebepaald door de consequenties van een gemiste of te laat gestelde diagnose en de consequenties van een ten onrechte afgegeven diagnose. Voor FCP geldt dat deze IBD met voldoende zekerheid moet kunnen uitsluiten: het missen van IBD is een groter probleem dan het een keer te vaak verrichten van een endoscopie. De screeningstest moet dus een hoge sensitiviteit hebben; de specificiteit is minder belangrijk. Het aantal fout-negatieve uitslagen wordt zo geminimaliseerd. Als er sprake is van een positieve testuitslag (FCP op het afkappunt of hoger) dan is de kans op IBD verhoogd en is het verrichten van endoscopisch onderzoek gerechtvaardigd. In het merendeel van de gevonden literatuur werd gebruik gemaakt van een afkapwaarde <100 ug/g. Een groot prospectief multicentrum onderzoek naar de waarde van FCP bij kinderen en adolescenten met een verdenking op IBD werd niet geincludeerd in de meta-analyse omdat de publicatie verscheen na 1 juli 2017 (Heida, 2018). In deze studie wordt het gebruik van de zogenaamde “two-threshold” strategie onderbouwd. De lage van de twee afkapwaardes kan worden gebruikt om de diagnose IBD met zekerheid uit te sluiten. Bij patiënten met een klinische verdenking op IBD en FCP concentraties tussen de 100 en de 250 μg/g kan in overleg met patiënt en ouders besloten worden tot een expectatief beleid met het maandelijks vervolgen van FCP of tot direct endoscopisch onderzoek (shared decision making). Wanneer het FCP hoger is dan 250 μg/g valt de patiënt in een hoog risico categorie voor IBD en raadt de werkgroep aan endoscopisch onderzoek te verrichten.
Gebruik van FCP in verschillende settingen
De gepoolde IBD prevalentie in de geïncludeerde studies was 35%. De meerwaarde van het gebruik van de FCP-test bij verdenking op IBD in de huisartsenpraktijk, waar de prevalentie lager is dan 1%, is beperkt. Er is een grote kans op een fout-positieve uitslag. Het inzetten van de FCP-test zonder klinische verdenking op IBD zal er mogelijk toe leiden dat een grote groep kinderen ten onrechte wordt verwezen naar een hoger echelon (Holtman, 2017).
In een IBD-expertise centrum (“vierdelijns” ziekenhuis) waar de prevalentie van IBD zeer hoog is, heeft de FCP-test waarschijnlijk weinig toegevoegde waarde in het besluit wel of niet te scopieren.
Rekening houden met andere redenen voor verhoogd FCP
Aangezien FCP een marker is voor neutrofielen influx in de darm, kunnen ook bacteriële en parasitaire gastro-intestinale infecties een stijging van het FCP veroorzaken (Heida, 2018). Indien er twijfel is over de klinische IBD verdenking bij een positieve FCP-testuitslag is het van belang om een darminfectie uit te sluiten.
Gezonde jonge kinderen (<5 jaar) hebben hogere FCP-concentraties in hun ontlasting dan oudere kinderen en volwassenen. Vanaf de geboorte nemen FCP-concentraties geleidelijk af. “Volwassen” waarden worden rond het 5e levensjaar bereikt (Olafsdottir, 2002; Rugtveit, 2002).
Positieve FCP-testuitslagen worden tevens gezien bij patiënten met een colorectaal carcinoom, juveniele poliepen, diverticulitis, en bij het gebruik van NSAID’s, acetylsalicylzuur en protonpompremmers. De werkgroep raadt aan een besluit tot endoscopisch onderzoek nooit alleen op basis van een verhoogd FCP te nemen, maar actief te zoeken naar andere mogelijke verklaringen voor een verhoogd FCP (Heida, 2018).
Verschillende FCP tests in omloop
FCP-testkits worden geleverd door diverse fabrikanten, waarbij gebruik wordt gemaakt van verschillende meetmethoden. De meest gebruikte methode in het (ziekenhuis) laboratorium is de quantitative enzyme-linked immunosorbent assay (ELISA). Daarnaast zijn er snel-testen die gebaseerd zijn op de lateral flow-based methode. Tot op heden zijn deze methoden onvoldoende head-to-head met elkaar vergeleken. De werkgroep acht het van belang dat men zich er bewust van is dat er verschillen in testuitslagen tussen de verschillende fabrikanten kunnen bestaan.
Pre-analytische variatie
De werkgroep acht het van belang dat men zich er bewust van is dat er een grote variatie in testuitslagen kan bestaan door pre-analytische factoren, zoals de bewaartemperatuur van het ontlastingsmonster en het enkelvoudig of meervoudig bemonsteren van de stoelgang.
Adviezen bij uitzonderingssituaties
De werkgroep is van mening dat er bij persisterend rectaal bloedverlies of perianale ziekte (fistel, abces, grote fissuur of ontstoken skintags), ongeacht de hoogte van het FCP, voldoende reden is om endoscopisch onderzoek te verrichten.
Wanneer er sprake is van een verhoogde FCP-concentratie, maar er bij endoscopisch onderzoek van de bovenste en onderste tractus digestivus geen afwijkingen worden gezien, dan raadt de werkgroep aan om MR-enterografie of video-capsuleonderzoek te laten verrichten (Maaser, 2018)
Onderbouwing
Achtergrond
Doel: kinderen met een hoge verdenking op IBD onderscheiden van hen met een lage verdenking, zodat het aantal onnodig uitgevoerde endoscopieën gereduceerd kan worden zonder IBD te missen.
Chronische buikpijn en diarree zijn veelvoorkomende redenen voor verwijzing naar een kinderarts. Onderscheid tussen functionele klachten (waarin diagnostisch onderzoek zoveel mogelijk beperkt dient te worden) en verdenking op een inflammatoire darmziekte (IBD, waarbij endoscopie noodzakelijk is) is een diagnostische uitdaging.
De gouden standaard voor het stellen van de diagnose IBD is endoscopisch en histopathologisch onderzoek, hetgeen invasief, tijdrovend en belastend is. Om niet alle kinderen met chronische buikpijn en diarree bloot te stellen aan endoscopisch onderzoek, wordt er sinds enkele jaren gebruik gemaakt van een test waarbij de concentratie calprotectine in de ontlasting wordt gemeten. Calprotectine is een eiwit dat in grote hoeveelheden in het cytosol van neutrofiele granulocyten voorkomt, en is een marker voor gastro-intestinale ontsteking. Sinds het jaar 2000 is de diagnostische waarde van fecaal calprotectine (FCP) in tal van studies geëvalueerd. In deze module geven wij een overzicht van de diagnostische waarde van FCP als triagetest om te bepalen welke kinderen en adolescenten met chronische buikpijn en diarree een endoscopie zouden moeten ondergaan wegens een sterke verdenking op IBD.
Conclusies
|
Laag GRADE |
Gebruik van de fecaal calprotectine test bij kinderen vanaf 5 jaar en tieners in een tweedelijns ziekenhuis met een klinische verdenking op IBD leidt tot een afname van onterecht gescopieerde patiënten van 65% naar 12%.
Bronnen (Fagerberg, 2005; Canani, 2006; Sidler, 2008; Ashorn 2009; van de Vijver, 2012; Holtman, 2016) |
|
Laag GRADE |
Een normale FCP-testuitslag (<100 µg/g) bij een patiënt met klachten verdacht voor IBD sluit IBD met 98% zekerheid uit.
Bronnen (Fagerberg, 2005; Canani, 2006; Sidler, 2008; Ashorn 2009; van de Vijver, 2012; Holtman, 2016) |
|
Laag GRADE |
Een afwijkende FCP-testuitslag (>100 µg/g) in combinatie met een klinische verdenking geeft een achterafkans van 75% op IBD en rechtvaardigt daarmee het uitvoeren van endoscopisch onderzoek.
Bronnen (Fagerberg, 2005; Canani, 2006; Sidler, 2008; Ashorn 2009; van de Vijver, 2012; Holtman, 2016) |
Samenvatting literatuur
Resultaten
Populatie en studie karakteristieken
Er werden 6 prospectieve cohortonderzoeken geïncludeerd, waarvan de karakteristieken worden beschreven in Tabel 1 (Fagerberg, 2005; Canani, 2006; Sidler, 2008; Ashorn, 2009; van de Vijver, 2012; Holtman, 2016). Bij alle 6 prospectieve cohortonderzoeken was er tenminste endoscopisch onderzoek van de onderste tractus digestivus in combinatie met biopten gedaan. Bij vier onderzoeken werd er ook endoscopisch onderzoek van de bovenste tractus digestivus verricht (Sidler, 2008; Ashorn, 2009; van de Vijver, 2012; Holtman, 2016). Bij twee onderzoeken werden alleen de patiënten met een hoge verdenking op IBD aan endoscopisch onderzoek blootgesteld (van de Vijver, 2012; Holtman, 2016), terwijl de patiënten met een lage verdenking gedurende 6 maanden werden gevolgd op het ontstaan van extra symptomen. Dit zogenaamde “delayed type” dwarsdoorsnede onderzoek kan een verificatie bias veroorzaken. De patiëntaantallen per onderzoek varieerden van 36 tot 294 personen.
Methodologische kwaliteit van de geïncludeerde onderzoeken
De methodologische kwaliteit van de geïncludeerde studies is getoetst met behulp van de QUADAS-II checklist (QUality Assessment of studies of Diagnostic Accuracy included in Systematic reviews). De resultaten hiervan staan weergegeven in de Risk of Bias tabel. In alle studies werd gebruik gemaakt van een prospectief studie design, waarin patiënten geïncludeerd werden met een verdenking op IBD.
Diagnostische waarde
De diagnostische waarde geeft aan hoe groot de kans is dat een kind of adolescent met een positieve testuitslag IBD heeft en hoe groot de kans op IBD is bij een normale uitslag. In de 6 prospectieve cohortstudies werd een calprotectine concentratie tussen 50 en 100 μg/g beschouwd als de bovengrens van normaal. De keuze voor deze relatief lage afkapwaarde leidt tot een hoge test sensitiviteit (97%) en een specificiteit van 83%. De keuze voor een lage afkapwaarde heeft als consequentie dat de specificiteit van de calprotectine test voor IBD laag is (83%). Bij dit scenario zal circa 12% van de patiënten ten onrechte aan een endoscopisch onderzoek blootgesteld worden (zie Tabel 1)
De gepoolde vooraf kans (pre-test probability) op IBD in de geïncludeerde studies was 35% (95% BI: 31 tot 39%), en is vergelijkbaar met die in een tweedelijns Nederlands ziekenhuis. De gepoolde achteraf kans op IBD (post-test probability) bij een afwijkende FCP-testuitslag is 75% (95% betrouwbaarheidsinterval (BI): 71 tot 79%). Een normale FCP testuitslag verkleint de kans op IBD tot 2% (95% BI: 1 tot 4%), zoals kan worden afgelezen in het Fagan nomogram (Figuur 1)
Figuur 1 Fagan nomogram
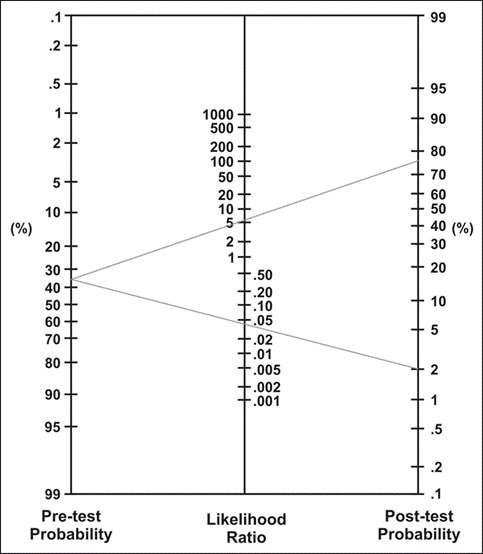
Dit nomogram laat de achteraf kans op IBD zien na een afwijkende (bovenste lijn) en normale FCP-testuitslag (onderste lijn) bij kinderen en adolescenten met een klinische verdenking op IBD.
Figuur 2 Forest plots
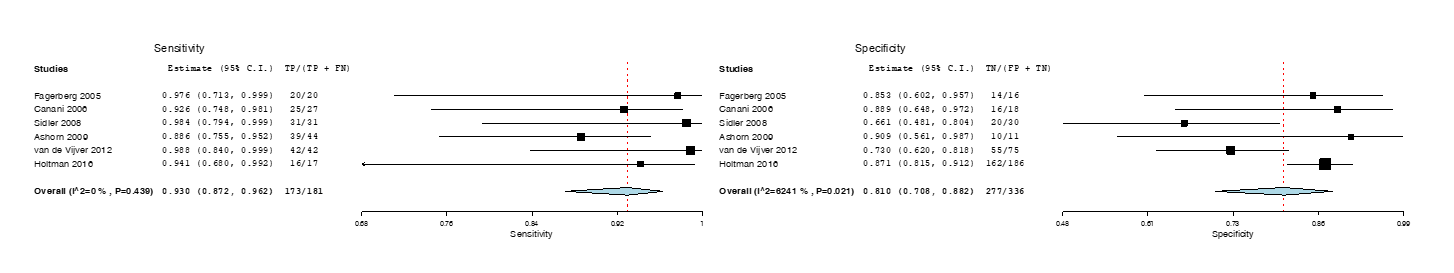
Forest plots van de sensitiviteit en specificiteit van de fecaal calprotectine test voor het onderscheid tussen inflammatoire darmziekten (IBD) en non-IBD bij kinderen en adolescenten. De plots tonen de diagnostische waarde, de 95% betrouwbaarheidsintervallen, en rechthoekjes met een oppervlak dat proportioneel is aan het gewicht in de meta-analyse.
Implicaties
Tabel 2 Prestaties van FCP bij een voorafkans van 35% (95% BI:31 tot 39%) en een afkapwaarde van 100 μg/g (berekend per 100 kinderen en tieners met een klinische verdenking op IBD)
|
Testuitslag |
Bij (n) |
Gevolg voor de patiënt |
|
Terecht positief |
33 |
Snelle endoscopie, tijdige behandeling |
|
Terecht negatief |
53 |
Geruststelling, geen onnodige endoscopie |
|
Fout positief |
12 |
Endoscopie ten onrechte uitgevoerd |
|
Fout negatief |
2 |
Ernstig vertraagde diagnose |
Om te bepalen of het gebruik van de FCP-test als triagemiddel geschikt is hebben we in Tabel 2 het percentage fout negatieven (gemiste gevallen) en fout positieven (onterecht aan endoscopie blootgestelde patiënten) afgeleid uit de gepoolde sensitiviteit en specificiteit, zoals gerapporteerd in Figuur 2. Bij een diagnostische work-up waarin alleen kinderen en tieners met een afwijkende FCP-testuitslag endoscopisch onderzoek zullen ondergaan wordt 2% van de patiënten met IBD gemist, en zal 12% ten onrechte zijn blootgesteld aan endoscopisch onderzoek (Zie Tabel 1). Screening met de FCP-test leidt dus tot een afname van het percentage onterecht gescopieerde patiënten van 65 naar 12, oftewel een absolute reductie van 53%.
Bewijskracht van de literatuur
De geïncludeerde onderzoeken betroffen allemaal prospectieve cohortstudies en mogen vanwege de diagnostische uitgangsvraag worden ingedeeld in de categorie ‘hoge kwaliteit’. De bewijskracht voor de uitkomstmaat diagnostische waarde is met 2 niveaus verlaagd naar Laag gezien het geringe aantal patiënten per studie (imprecisie) en vanwege de vooraf geselecteerde groep van patiënten (indirect effect).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat is de waarde van het fecaal calprotectine bij het selecteren van kinderen en adolescenten met een verdenking op IBD voor endoscopie?
P: kinderen van 5 tot en met 18 jaar met een klinische verdenking op IBD (onder andere chronische buikpijn, rectaal bloedverlies, chronische diarree);
Zoektermen: Child; Pediatric; chronic diarrhea, abdominal (or gastrointestinal) complaints, rectal bleeding.
I: fecaal Calprotectine;
Zoektermen: Leukocyte L1 Antigen Complex, Calprotectin.
C: Endoscopie, al dan niet met histologie (= referentie test); CRP, BSE (alternatieve tests);
Zoektermen: Endoscopy, coloscopy, ileocolonoscopy, sygmoidoscopy, gastroscopy, histopathology.
O: Sensitiviteit, specificiteit, positieve en negatieve voorspellende waarde, missed cases (fout-negatieven), fout-positieven.
Zoektermen: Sensitivity, Specificity, PPV, NPV, diagnostic accuracy.
Relevante uitkomstmaten
De werkgroep achtte diagnostische waarde een voor de besluitvorming kritieke uitkomstmaat; en praktische toepasbaarheid voor de besluitvorming belangrijke uitkomstmaat.
Indien van toepassing:
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Zoeken en selecteren (Methode)
In de databases Medline en Embase is met bovengenoemde zoektermen gezocht naar randomized controlled trials (RCT’s), cohortstudies en case-control studies die voor 1 juli 2017 zijn gepubliceerd. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 955 treffers op. Studies werden geselecteerd wanneer ze gepubliceerd waren in het Engels; handelden over eenmalige FCP-metingen bij kinderen en adolescenten met symptomen die suggestief zijn voor IBD; en wanneer ontlastingsmonsters waren verzameld voorafgaand aan endoscopisch onderzoek. Wanneer het construeren van een 2x2 tabel niet mogelijk was werd de studie niet meegenomen in de analyse.
Op basis van titel en abstract werden 104 studies geselecteerd. Na raadpleging van de volledige tekst, werden 98 uitgesloten (zie exclusietabel onder het tabblad Verantwoording), en werden 6 studies opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabel (zie Tabel 1). De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabel.
Gegevens analyse (Methode)
Wij berekenden de sensitiviteit en specificiteit van elke geincludeerde studie en voerden op basis van deze originele gegevens een diagnostische meta-analyse uit. De gepoolde gegevens zijn vervolgens gepresenteerd in een Fagan Nomogram (Figuur 1) en Forest plot (Figuur 2). De Forest plot toont de diagnostische waarde, de 95% betrouwbaarheidsintervallen, en rechthoekjes met een oppervlak dat proportioneel is aan het gewicht in de meta-analyse.
Tabel 1: Eigenschappen van de geïncludeerde studies (in het Engels).
|
Study reference |
Study characteristics |
Type of study |
No of patients included in meta-analysis |
Proportion female gender |
Target condition
|
Age group (range in years) |
Prevalence IBD (%) (CD/UC/IBD-U)) |
FCP assay type
|
FCP Cut-off value (mg/g) |
Reference standard |
|
Fagerberg, 2005 |
Setting: Department of Gastroenterology, Astrid Lindgren Children’s Hospital, Stockholm, and the Department of Paediatrics, Central Hospital, Vasteras.
Country: Sweden
|
prospective cohort study |
36 |
53% |
IBD
|
Children and adolescents (6.5-17.8) |
56% (not specified) |
PhiCal (Calprest, Eurospital Trieste, Italy)
|
50 |
Ileocolonoscopie and histology.
|
|
Canani, 2006 |
Setting: Paediatric Gastroenterology Unit, University Federico II of Naples
Country: Italy |
Prospective cohort study |
45 |
47%
|
IBD
|
Children and adolescents (unknown) |
60% (17/10/-) |
PhiCal (Calprest, Eurospital Trieste, Italy)
|
95.3 |
Colonoscopy and histology
|
|
Sidler, 2008 |
Setting: Gastroenterology outpatient clinic at Syndey Children’s Hospital, Randwick
Country: Australia |
Prospective cohort study |
61 |
IBD: 39% non-IBD: 43%
|
Organic intestinal disease
|
Children and adolescents (2.2 -16.0) |
IBD: 51% (CD:UC 97:3) |
PhiCal (Nycomed, Oslo, Norway)
|
50 |
Upper GI endoscopy, colonoscopy and histology
|
|
Ashorn, 2009 |
Setting: Hospital for Children and Adolescents Helsinki
Country: Finland |
Prospective cohort study |
55 |
43% |
IBD |
Children and adolescents (5.8-19.9) |
80% (15/25/4) |
PhiCal (Company unknown) |
100 |
Upper GI endoscopy, colonoscopy and histology |
|
Vd Vijver, 2012 |
Setting: six outpatient clinics for general paediatrics and one tertiary care hospital (UMCG)
Country: the Netherlands |
Prospective cohort study |
117 |
57 M / 60 F |
IBD
|
Children and teenagers (6-18) |
36% (24/17/2)
|
PhiCal (Calpro AS, Lysaker, Norway)
|
50 |
Ileocolonoscopy, upper GI endoscopy and histology (n=68). Patients with a low pre-test probability of IBD had 6 months follow-up to confirm resolution of symptoms.
|
|
Holtman 2016 |
Setting: primary care practices and 4 general hospitals and 3 academic centers
Country: the Netherlands |
Prospective cohort study |
204 (114 primary care cohort en 90 referred cohort) |
37% (75/204) |
IBD |
Children and adolescents
Primary care chort: 9 (6-12) yrs Referred cohort: 11 (7-15) yrs. |
8% (17/204) |
PhiCal (Calpro AS, Lysaker, Norway)
|
50 |
Endoscopic assessment (esophagogastroduodenoscopy, ileocolonoscopy, and histopathologic examination) or 1-year follow-up |
Referenties
- Ashorn S, Honkanen T, Kolho KL, et al. Fecal calprotectin levels and serological responss to microbial antigens among children and adolescents with inflammatory bowel disease. Inflamm Bowel Dis. 2009;15:199-205.
- Bar-Gil Shitrit A, Koslowsky B, Livovksy DM, et al. A prospective study of fecal calprotectin and lactoferrin as predictors of small bowel Crohn's disease in patients undergoing capsule endoscopy. Scandinavian Journal of Gastroenterology. 52;3:328-333.
- Canani RB, de Horatio LT, Terrin G, et al. Combined use of noninvasive tests is useful in the initial diagnostic approach to a child with suspected inflammatory bowel disease. J Pediatr Gastroenterol Nutr. 2006;42:9-15.
- Fagerberg UL, Loof L, Myrdal U, et al. Colorectal inflammation is well predicted by fecal calprotectin in children with gastrointestinal symptoms. J Pediatr Gastroenterol Nutr 2005;40:450-5.
- Heida A, Holtman GA, Lisman-van Leeuwen Y, et al. Avoid Endoscopy in Children With Suspected Inflammatory Bowel Disease Who Have Normal Calprotectin Levels. J Pediatr Gastroenterol Nutr. 2016;62: 4749.
- Heida A, Van de Vijver E, van Ravenzwaaij D, et al. Predicting inflammatory bowel disease in children with abdominal pain and diarrhoea: calgranulin-C versus calprotectin stool tests. Arch Dis Child. 2018;0:17.
- Holtman GA, Lisman-van Leeuwen Y, Kollen BJ, et al. Diagnostic Accuracy of Fecal Calprotectin for Pediatric Inflammatory Bowel Disease in Primary Care: A Prospective Cohort Study. Ann Fam Med. 2016;14:437-445.
- Holtman GA, Lisman-van Leeuwen Y, Kollen BJ, et al. Diagnostic test strategies in children at increased risk of inflammatory bowel disease in primary care. PLoSOne. 2017;12(12):e0189111.
- Maaser C, Sturm A, Vavricka SR, et al.; European Crohns and Colitis Organisation [ECCO]; European Society of Gastrointestinal and Abdominal Radiology [ESGAR]. ECCO-ESGAR Guideline for Diagnostic Assessment in Inflammatory Bowel Disease. J Crohns Colitis. 2018 Aug 23. doi: 10.1093/ecco-jcc/jjy113. [Epub ahead of print]
- Olafsdottir E, Aksnes L, Fluge G, et al. FCP levels in infants with infantile colic, healthy infants, children with inflammatory bowel disease, children with recurrent abdominal pain and healthy children. Acta Paediatr. 2002;91:45-50.
- Rugtveit J, Fagerhol MK. Age-dependent variations in fecal calprotectin concentrations in children. J Pediatr Gastroenterol Nutr. 2002;34(3):323-4.
- Sidler MA, Leach ST, Day AS. Fecal S100A12 and fecal calprotectin as noninvasive markers for inflammatory bowel disease in children. Inflamm Bowel Dis. 2008;14:359-66.
- van de Vijver E, Schreuder AB, Cnossen WR, et al. Safely ruling out inflammatory bowel disease in children and teenagers without referral for endoscopy. Arch Dis Child. 2012;97:10141018.
Evidence tabellen
Wat is de waarde van het fecaal calprotectine bij het selecteren van kinderen en adolescenten met een verdenking op IBD voor endoscopie?
|
Study reference |
Study characteristics |
Patient characteristics
|
Index test (test of interest) |
Reference test
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Ashorn, 2009 |
Type of study: Prospective cohort
Setting: Hospital for Children and Adolescents Helsinki
Country: Finland
Conflicts of interest: not reported
|
Inclusion criteria: children and adolescents examined for suspicion of IBD
Exclusion criteria: not reported
N= 73
Prevalence IBD (CD/UC/IBD-U)): 80% (18/36/6)
Mean age ± SD: IBD: 13.8 yrs (2.7-19.9), Non-IBD: 8.1 yrs (5.8 – 14.9)
Sex: 45% F
Other important characteristics:
|
Describe index test: FCP measured by enzyme immunoassay (PhiCal) in fecal samples.
Cut-off point(s): FCP level higher than 100 mg/g was considered elevated.
Comparator test[1]: Serological tests; anti-I2 and anti-OmpW, IgA, ASCA for both IgG and IgA isotypes
Cut-off point(s): Equivocal/borderline results were interpreted as negative. Results exceeding 25 U for IgG and/or IgA ASCA were regarded as positive. |
Describe reference test[2]: Upper GI endoscopy, colonoscopy and histology
Cut-off point(s): The presence and degree of inflammation were determined in the upper gastrointestinal biopsies using the modified Sydney system.
|
Time between the index test en reference test: FCP levels were assessed at the time of diagnosis
For how many participants were no complete outcome data available? N=18 (25%), there were only 55 patients samples available for FCP analysis.
Reasons for incomplete outcome data described? Nine patients diagnosed 5.3yrs (2.0-12.8yrs) before first available serum or feces sample. |
Outcome measures and effect size (include 95%CI and p-value if available)4: FCP levels were elevated more frequently in IBD patients (89%, 39/44) compared to non-IBD cases (9%, 1/11, P < 0.001)
|
|
|
Canani, 2006 |
Type of study: Prospective cohort study
Setting: Pediatric Gastroenterology Unit, University Federico II of Naples
Country: Italy
Conflicts of interest: Not reported
|
Inclusion criteria: All children referred to the paediatric gastroenterology unit for initial assessment of suspected IBD.
Exclusion criteria: Patients with symptoms or signs (right-lower quadrant mass or perianal disease or hematochezia) mandating a complete work-up for IBD were excluded.
N= 49
Prevalence: 60% (27/45) IBD (CD:UC = 63:37)
Mean age ± SD: Non-IBD 11,0 yrs (2.2), CD 14.5yrs (5.1), UC 11.0yrs (5.0)
Sex: 53% M / 47% F
Other important characteristics:
|
Describe index test: FCP values were analysed by a commercial enzyme linked immunosorbent assay (ELISA) (Calprest, Eurospital Trieste, Italy)
Cut-off point(s): 95.3 μg/g
Comparator test: Cellobiose and mannitol were measured; The IgA and IgG ASCA were determined by a commercially available ELISA assay according to the instruction manuals (Medizym ASCA, ALIFAX, MEDIPAN Diagnostic, Selchow, Germany); To detect pANCA, an indirect immunofluorescence method was performed on commercially available slides (Bios GmbH, Munchen, Germany). |
Describe reference test: Endoscopy with biopsies.
Cut-off point(s): final diagnosis of IBD or non-IBD according to the presence or absence of previously reported clinical, radiographic, endoscopic and histopathologic criteria.
|
Time between the index test en reference test: FCP test was performed in all patients at the time of initial assessment.
For how many participants were no complete outcome data available? N=4
Reasons for incomplete outcome data described? Withdrawn consent. |
Outcome measures and effect size (include 95%CI and p-value if available): Median FCP concentration in the IBD group was significantly higher compared with that of the non-IBD group (p < 0.001) without differences between CD and UC patients or between patients with and without small intestine involvement.
|
|
|
Fagerberg, 2005 |
Type of study: prospective cohort study
Setting: Department of Gastroenterology, Astrid Lindgren Children’s Hospital, Stockholm, and the Department of Pediatrics, Central Hospital, Vasteras.
Country: Sweden
Conflicts of interest: not reported
|
Inclusion criteria: children (age between 6 and 17 years old) with gastrointestinal symptoms who were scheduled for colonoscopy to rule out IBD.
Exclusion criteria: bacterial gastroenteritis detectable by fecal culture or serology and having any other chronic inflammatory disease.
N=36
Prevalence IBD: 56%
Age range: 6.5-17.8yrs
Sex: 17 M / 19 F (53% F)
Other important characteristics:
|
Describe index test: FCP measured by Calprest, Europsital, Trieste, Italy
Cut-off point(s): 50 μg/g
Comparator test:
Cut-off point(s):
|
Describe reference test: Complete ileocolonoscopy with histopathologic evaluations of mutlitple tissue samples.
Cut-off point(s): Accepted conventional criteria for diagnosis of IBD
|
Time between the index test en reference test: median 3 days (range 0-37)
For how many participants were no complete outcome data available? N=4
Reasons for incomplete outcome data described? Two delivered fecal sample after colonoscopy and in two children, assessment of colonic inflammation was not possible because of incomplete colonoscopy with normal findings. |
Outcome measures and effect size (include 95%CI and p-value if available):Median FCP concentration was 349 μg/g (95% CI 213-440 μg/g) in the group with colonic inflammation compared with 16.5 μg/g (95%CI 6.9-28.2 μg/g) in the group without inflammation. The difference in median FCP concentrations was highly significant (p<0.00001). All children with IBD and the child with juvenile colon polyposis had FCP concentrations > 50 μg/g.
|
Pre-selected group |
|
Sidler, 2008 |
Type of study: prospective cohort study
Setting: gastroenterology outpatient clinic at Syndey Children’s Hospital, Randwick
Country: Australia
Conflicts of interest: not reported
|
Inclusion criteria: Children and adolescents presenting with GI symptoms suggestive of an organic gut disease and required further investigation based on clinical assessment.
Exclusion criteria: previously established diagnosis of an organic gastrointestinal disease, infectious gastroenteritis, having used NSAID agents, antibiotics or corticosteroids in the preceding 2 weeks.
N=61
Prevalence IBD: 51% (CD:UC 97:3)
Age range: 2.2 -16.0
Sex IBD: 61% M / 39% F Sex non-IBD: 57% M / 43 F
Other important characteristics: |
Describe index test: FCP level using PhiCal test (Nycomed, Oslo, Norway)
Cut-off point(s): 50 ug/g
Comparator test: Fecal S100A12 measured by an in-house ELISA using a previously published protocol.
Cut-off point(s):
|
Describe reference test: All children underwent upper gastrointestinal endoscopy and complete ileocolonoscopy including multiple biopsies for histopathological verification. In addition to ileocolonoscopy, the small bowel was assessed by a small bowel follow-through.
Cut-off point(s):
|
Time between the index test en reference test: stool sample collection prior to admission for GI endoscopy and colonoscopy, before the bowel preparation.
For how many participants were no complete outcome data available? N 0 (%)
Reasons for incomplete outcome data described? Not applicable. |
Outcome measures and effect size (include 95%CI and p-value if available): Children diagnosed with IBD (n=31) had elevated fecal s100A12 (median 55.2mg/kg) and calprotectin (median 1265 mg/kg) levels compared with the children without IBD (n=30; s100A12: median 1.1mg/kg, P<0.0001; calprotectin:median 30.5mg/kg;P<0.0001) |
|
|
Vd Vijver, 2012 |
Type of study: prospective cohort study
Setting: outpatient clinics for general paediatrics and one tertiary care hospital (UMCG)
Country: the Netherlands
Conflicts of interest: not reported |
Inclusion criteria: children and teenagers between 6 and 18 years of age with abdominal complaints were eligible for participation.
Exclusion criteria: children < 6 years of age
N=117
Prevalence confirmed IBD: 42 (36%) (24 CD, 17 UC, 2 IBDU) 32 functional abdominal pain.
Mean age: 14yrs (range 6-18)
Sex: 57 M / 60 F
Other important characteristics: |
Describe index test: FCP measurement by CALPRO ELISA test (ALP); Calpro AS, Lysaker, Norway.
Cut-off point(s): positive FCP test when >50ug/g.
Comparator test:
Cut-off point(s):
|
Describe reference test: Confirmation of IBD was obtained after endoscopic and histologic evaluation (n=68) according to the Porto criteria. Diagnosis of non-IBD was made when other test results gave a convincing explanation of symptoms, or when symptoms had completely resolved at 6-month follow-up.
Cut-off point(s):
|
Time between the index test en reference test: median time between FCP sampling and endoscopy was 22 days (range 0-79) in the confirmed IBD group and 42 days (0-164) in the non-IBD group (p=0.105)
For how many participants were no complete outcome data available? N 49
Reasons for incomplete outcome data described? Choice of physician to not do an endoscopy. |
Outcome measures and effect size (include 95%CI and p-value if available): Pretest probability of IBD in the study population was 36%. Calpro (cutoff 50ug/g) was elevated in all children and teenagers with IBD (sens 100%, 95% CI 92-100%), and in 20 out of 75 patients without IBD (spec 73%, 95% CI 62-83%)
Basing referral on a positive FCP test result in the absence of GI infection would have resulted in 22% negative ileocolonoscopies and no missed IBD cases. The reduction of negative endoscopies is significant (p=0.001) |
|
|
Holtman, 2016 |
Type of study: prospective cohort study
Setting: primary care practices and 4 general hospitals and 3 academic centers
Country: the Netherlands
Conflicts of interest: not reported
|
Inclusion criteria: Children aged 4 to 18 years who sought care for chronic diarrhea, recurrent abdominal pain, or both were eligible.
Exclusion criteria: Previous diagnosis of chronic organic gastroin- testinal disease; evaluation with endoscopy or FCP for gastrointestinal symptoms in 6 months before this study; difficulty in understanding questionnaires; children with long-term use (>3 months) of antibiotics, nonsteroidal anti- inflammatory drugs, or oral corticosteroids in the past 6 months, as well as those aged younger than 4 years.
N=204 (114 primary care cohort en 90 referred cohort)
Prevalence confirmed IBD: 8% (17/204)
Mean age (range): Primary care chort: 9 (6-12) yrs. Referred cohort: 11 (7-15) yrs.
Sex: 37% F (75/204)
Other important characteristics: |
Describe index test: FCP measurement by PhiCal (Calpro AS, Lysaker, Norway) Cut-off point(s): 50ug/g.
Comparator test:
Cut-off point(s):
|
Describe reference test: Endoscopic assessment (esophagogastroduodenoscopy, ileocolonoscopy, and histopathologic examination) or 1-year follow-up
Cut-off point(s): according to the Porto criteria. A negative endoscopy was defined as the absence of endoscopic and histo- pathologic findings of IBD. Children were considered not to have IBD if, after 12 months, the attending phy- sician found no red flags or the pediatric gastroenter- ologist decided that red flags were not related to IBD.
|
Time between the index test en reference test: 4 days and 8 days for children with IBD and without IBD, respectively
For how many participants were no complete outcome data available? In total, values were missing for 11 children (9.6%) in the primary care cohort and 5 (5.5%) in the referred cohort.
Reasons for incomplete outcome data described? Choice of physician to not do an endoscopy. |
Outcome measures and effect size (include 95%CI and p-value if available): The speci city of FCP in the primary care cohort was 0.87 (95% CI, 0.80-0.92). Among the 90 children in the referred cohort, 17 (19%) ultimately received a diagnosis of IBD. The sensitivity of FCP in the referred cohort was 0.99 (95% CI, 0.81-1.00).
|
|
Data voor 2x2 tabel
|
Study reference |
FCP Cut-off value (mg/g) |
TP |
FP
|
TN |
FN
|
Sensitiviteit (95% BI) |
Specificiteit (95% BI) |
PPV |
NPV |
|
Fagerberg, 2005 |
50 |
20 |
2 |
14 |
0 |
97,6% (71,3 – 99,9) |
85,3% (60,2 – 95,7)
|
90,1% |
100% |
|
Canani, 2006 |
95.3 |
25 |
2 |
16 |
2 |
92.6% (74,8 – 98,1) |
88.9% (64,8 – 97,2)
|
92,6% |
88,9% |
|
Sidler, 2008 |
50 |
31 |
10 |
20 |
0 |
98,4% (79,4 – 99,9) |
66,1% (48,1 – 80,4) |
75,6% |
100% |
|
Ashorn, 2009 |
100 |
39 |
1 |
10 |
5
|
88,6% (75,5 – 95,2) |
90,9% (56,1 – 98,7) |
97,5% |
66,7% |
|
van de Vijver, 2012 |
50 |
42 |
20 |
55 |
0 |
98,8% (84 – 99,9) |
73% (62 – 81,8)
|
67,7% |
100% |
|
Holtman, 2016
|
50 |
16 |
24 |
162 |
1 |
94,1% (68 – 99,2) |
87,1% (81,5 – 91,2) |
40% |
99,4% |
Risk of bias tabel
|
Study reference |
Patient selection |
Index test |
Reference standard |
Flow and timing |
Comments with respect to applicability |
|
Ashorn, 2009 |
Was a consecutive or random sample of patients enrolled? Unclear
Was a case-control design avoided? Unclear
Did the study avoid inappropriate exclusions? Yes
|
Were the index test results interpreted without knowledge of the results of the reference standard? /Unclear
If a threshold was used, was it pre-specified? Yes
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Unclear
|
Was there an appropriate interval between index test(s) and reference standard? Unclear
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? No |
Are there concerns that the included patients do not match the review question? Yes/No/Unclear
Are there concerns that the index test, its conduct, or interpretation differ from the review question? Yes/No/Unclear
Are there concerns that the target condition as defined by the reference standard does not match the review question? Yes/No/Unclear
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: UNCLEAR |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: UNCLEAR |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: UNCLEAR |
CONCLUSION Could the patient flow have introduced bias?
RISK: HIGH |
|
|
|
Canani, 2006 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes
|
Were the index test results interpreted without knowledge of the results of the reference standard? Yes
If a threshold was used, was it pre-specified? Yes
|
Is the reference standard likely to correctly classify the target condition? Unclear
Were the reference standard results interpreted without knowledge of the results of the index test? Yes
|
Was there an appropriate interval between index test(s) and reference standard? Unclear
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Unclear
Were all patients included in the analysis? Yes |
Are there concerns that the included patients do not match the review question? Yes/No/Unclear
Are there concerns that the index test, its conduct, or interpretation differ from the review question? Yes/No/Unclear
Are there concerns that the target condition as defined by the reference standard does not match the review question? Yes/No/Unclear
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: LOW |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: LOW |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: UNCLEAR |
CONCLUSION Could the patient flow have introduced bias?
RISK: UNCLEAR |
||
|
Fagerberg, 2005 |
Was a consecutive or random sample of patients enrolled? No
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Unclear
|
Were the index test results interpreted without knowledge of the results of the reference standard? Yes
If a threshold was used, was it pre-specified? Yes
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Yes
|
Was there an appropriate interval between index test(s) and reference standard? Yes
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? No
Were all patients included in the analysis? Yes |
Are there concerns that the included patients do not match the review question? Yes/No/Unclear
Are there concerns that the index test, its conduct, or interpretation differ from the review question? Yes/No/Unclear
Are there concerns that the target condition as defined by the reference standard does not match the review question? Yes/No/Unclear
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: /HIGH |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: LOW |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: LOW |
CONCLUSION Could the patient flow have introduced bias?
RISK: HIGH |
||
|
Sidler, 2008 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Unclear
|
Were the index test results interpreted without knowledge of the results of the reference standard? Unclear
If a threshold was used, was it pre-specified? No
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Unclear
|
Was there an appropriate interval between index test(s) and reference standard? Unclear
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? Unclear |
Are there concerns that the included patients do not match the review question? Yes/No/Unclear
Are there concerns that the index test, its conduct, or interpretation differ from the review question? Yes/No/Unclear
Are there concerns that the target condition as defined by the reference standard does not match the review question? Yes/No/Unclear
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: UNCLEAR |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: HIGH |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: UNCLEAR |
CONCLUSION Could the patient flow have introduced bias?
RISK: UNCLEAR |
||
|
Vd vijver, 2012 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes
|
Were the index test results interpreted without knowledge of the results of the reference standard? Yes
If a threshold was used, was it pre-specified? Yes
|
Is the reference standard likely to correctly classify the target condition? Unclear
Were the reference standard results interpreted without knowledge of the results of the index test? Yes
|
Was there an appropriate interval between index test(s) and reference standard? Yes
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? No
Were all patients included in the analysis? Yes |
Are there concerns that the included patients do not match the review question? Yes/No/Unclear
Are there concerns that the index test, its conduct, or interpretation differ from the review question? Yes/No/Unclear
Are there concerns that the target condition as defined by the reference standard does not match the review question? Yes/No/Unclear |
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: LOW |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: LOW |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: UNCLEAR |
CONCLUSION Could the patient flow have introduced bias?
RISK: HIGH |
|
|
Holtman, 2016 |
Was a consecutive or random sample of patients enrolled? No
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes
|
Were the index test results interpreted without knowledge of the results of the reference standard? Yes
If a threshold was used, was it pre-specified? Yes
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Yes
|
Was there an appropriate interval between index test(s) and reference standard? Yes
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? No
Were all patients included in the analysis? Yes |
Are there concerns that the included patients do not match the review question? Yes/No/Unclear
Are there concerns that the index test, its conduct, or interpretation differ from the review question? Yes/No/Unclear
Are there concerns that the target condition as defined by the reference standard does not match the review question? Yes/No/Unclear |
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: HIGH |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: LOW |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: LOW |
CONCLUSION Could the patient flow have introduced bias?
RISK: HIGH |
|
[1] Comparator test is vergelijkbaar met de C uit de PICO van een interventievraag. Er kunnen ook meerdere tests worden vergeleken. Voeg die toe als comparator test 2 etc. Let op: de comparator test kan nooit de referentiestandaard zijn.
[2] De referentiestandaard is de test waarmee definitief wordt aangetoond of iemand al dan niet ziek is. Idealiter is de referentiestandaard de Gouden standaard (100% sensitief en 100% specifiek). Let op! dit is niet de “comparison test/index 2”.
4 Beschrijf de statistische parameters voor de vergelijking van de indextest(en) met de referentietest, en voor de vergelijking tussen de indextesten onderling (als er twee of meer indextesten worden vergeleken).
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 17-12-2018
Laatst geautoriseerd : 17-12-2018
Geplande herbeoordeling : 01-01-2024
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2023 bepaalt het bestuur van de Nederlandse Vereniging voor Kindergeneeskunde of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Kindergeneeskunde is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (https://www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Het doel van de richtlijn is om een effectieve en efficiënte diagnostiek en behandeling te realiseren bij kinderen met een inflammatoire darmziekte (de ziekte van Crohn of colitis ulcerosa (IBD, Inflammatory Bowel Disease).
Doelgroep
Deze richtlijn is bedoeld voor kinderartsen, kinderartsen-MDL, MDL-artsen, IBD-verpleegkundig specialisten, IBD-physician assistants en IBD-verpleegkundigen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2016 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor kinderen en adolescenten met inflammatoire darmziekten.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Prof. Dr. J.C. Escher, kinderarts maag-darm-leverziekten, werkzaam in het Erasmus Medisch Centrum-Sophia Kinderziekenhuis te Rotterdam, NVK, voorzitter
- Drs. M.A. Aardoom MSc, arts-onderzoeker, werkzaam in het Erasmus Medisch Centrum-Sophia Kinderziekenhuis te Rotterdam, NVK
- Drs. G. van den Brink MSc, arts-onderzoeker, werkzaam in het Erasmus Medisch Centrum-Sophia Kinderziekenhuis te Rotterdam, NVK
- Dr. K. Diederen, MSc, onderzoeker binnen de kindergeneeskunde, werkzaam in het Academisch Medisch Centrum-Emma Kinderziekenhuis te Amsterdam, NVK
- M.A.C. van Gaalen, verpleegkundig specialist kinder-MDL, werkzaam in het Erasmus Medisch Centrum-Sophia Kinderziekenhuis te Rotterdam, V&VN
- Drs. S. Haisma MSc, arts-onderzoeker, werkzaam in het Universitair Medisch Centrum-Beatrix Kinderkliniek te Groningen, NVK
- Dr. A. Kindermann, kinderarts maag-darm-leverziekten, werkzaam in het Emma Kinderziekenhuis-Emma Kinderziekenhuis te Amsterdam en in het Academisch Medisch Centrum te Amsterdam, NVK
- Drs. M. Oldenziel, klinisch psycholoog, werkzaam in het Gelre ziekenhuis te Apeldoorn, NIP
- Dr. P.F. van Rheenen, kinderarts maag-darm-leverziekten, werkzaam in het Universitair Medisch Centrum-Beatrix Kinderkliniek te Groningen, NVK
- Dr. L. de Ridder, kinderarts maag-darm-leverziekten, werkzaam in het Erasmus Medisch Centrum-Sophia Kinderziekenhuis te Rotterdam, NVK
- Prof. Dr. C.J. van der Woude, maag-darm-leverarts, werkzaam in het Erasmus Medisch Centrum te Rotterdam, NVMDL
Klankbordgroep
De klankbordgroepleden hebben gedurende de ontwikkeling van de richtlijn meegelezen met de conceptteksten en deze becommentarieerd.
- Dr. J. Curvers, klinisch chemicus, werkzaam in het Catharina ziekenhuis te Eindhoven, NVKC
- Dr. W. van Gemert, chirurg, werkzaam in het Universitair Medisch Centrum te Maastricht, NVvH
- Dr. L. Hanff, ziekenhuisapotheker, werkzaam in het Prinses Máxima Centrum te Utrecht, , NVZA
- T. Markus, directeur, werkzaam bij de Crohn en Colitis Ulcerosa Vereniging Nederland te Woerden
- H. Rippen, directeur, werkzaam bij Stichting Kind en Ziekenhuis te Utrecht
- H. van der Wielen, verpleegkundig specialist kinder-MDL, werkzaam in het Jeroen Bosch Ziekenhuis te Den Bosch, V&VN
Met ondersteuning van:
- Dr. I.M. Mostavaya, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. A.M.M. Vaes, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Escher |
kinderarts maagdarmleverziekten |
-adviserend arts voor cyberpoli IBD, (onbetaald) -editor voor diverse vaktijdschriften, (onbetaald) -Bestuurslid NVGE (onbetaald) -Voorzitter kinder-IBD-werkgroep (KICC; sectie kinder-MDL, NVK) (onbetaald)
|
-Deelname aan en advisory board member register studie DEVELOP (sponsor is Janssen) -Deelname aan en advisory board member register studie CAPE (sponsor is Abbvie) -Deelname aan TISKIDS studie (ZONMW, co-sponsor is Pfizer) -Biomarkers studie (co-sponsor is MSD) |
Geen actie |
|
Aardoom |
Arts-onderzoeker in Erasmus MC Sophia op gebied van IBD bij kinderen |
Bestuurslid (secretaris) van Young-ICC (onbetaald)
|
- |
Geen actie |
|
Van den Brink |
Arts-onderzoeker in Erasmus MC-Sophia op het onderzoek HAPPY-IBD (angst/depressieklachten bij jongeren met IBD) |
|
- |
Geen actie |
|
Diederen |
Onderzoeker |
Onderzoeker in het Academisch Medisch Centrum-Emma op gebied van IBD bij kinderen |
- |
Geen actie |
|
Van Gaalen |
Verpleegkundig specialist kinder-MDL |
- |
- |
Geen actie |
|
Haisma |
Arts-onderzoeker |
Arts-onderzoeker in UMC Groningen op gebied van IBD bij kinderen |
- |
Geen actie |
|
Kindermann |
kinderarts maagdarmleverziekten |
-Lid commissie voeding NVK (onbetaald) -Lid commissie ondervoeding NVK (onbetaald) -Penningmeester kinder-IBD werkgroep (KICC; sectie kinder-MDL, NVK)(onbetaald)
|
-Deelname DEVELOP register studie (sponsor is Janssen) -Deelname CAPE register studie (sponsor is Abbvie) |
Geen actie |
|
Oldenziel |
Klinisch Psycholoog Hoofd vakgroep psychologie kind & jeugd Opleider |
-Docent aan de opleiding tot Gezondheidszorgpsycholoog, betaald -Docent/trainer, agressietraining, betaald -Deelnemer werkgroep NOLK, onbetaald |
- |
Geen actie |
|
Van Rheenen |
kinderarts maagdarmleverziekten |
-Associate Professor International Child Health (onbetaald) -Coordinator Tropical Medicine Master Education (onbetaald) -Secretaris kinder-IBD werkgroep (KICC; sectie kinder-MDL, NVK) (onbetaald) -Voorzitter P-ECCO (Paediatricians of European Crohn's and Colitis Organisation) (onbetaald) |
-SELFIE-studie, gefinancierd door Buhlmann Laboratories AG -GRINCH-studie, gefinancierd door CisBo BioAssays -CACATU-studie, gefinancierd door CisBo BioAssays |
Geen actie |
|
De Ridder |
kinderarts maagdarmleverziekten |
Lid kinder-IBD werkgroep (KICC; sectie kinder-MDL, NVK) (onbetaald) Secretaris ESPGHAN IBD Porto werkgroep (onbetaald) Penningmeester PIBDnet (onbetaald) Bestuurslid P-ECCO (Paediatricians of European Crohn's and Colitis Organisation) (onbetaald)
|
-Deelname DEVELOP register studie (sponsor is Janssen) -Deelname CAPE register studie (sponsor is Abbvie) -PI van TISKIDS studie (ZONMW, co-sponsor is Pfizer) -PI van REDUCE RISK (Horizon 2020) studie voor Nederland |
Geen actie |
|
Van Der Woude |
Maag-darm-leverarts |
-Lid educatie commissie UEG (onbetaald) -Lid scientific commissie ECCO (onbetaald) -Secretaris NVGE (onbetaald) |
- ZonMw - Pfizer - Danone - Tramedico |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een enquête onder leden van de CCUVN, welke door de CCUVN is geïnitieerd, en waaraan een aantal werkgroepleden inhoudelijk heeft meegewerkt. Het verslag hiervan is besproken in de werkgroep en de belangrijkste overwegingen zijn verwerkt in de richtlijn. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de CCUVN, Stichting Kind en Ziekenhuis en de Patiëntenfederatie Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn(module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn (Nederlandse Vereniging voor Kindergeneeskunde, 2008) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door belanghebbende partijen tijdens de Invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten. De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: 1) klinische relevantie; 2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit; 3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van Zorg.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de bijlage Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html. 2012.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
