CVRM na Polycysteus Ovarium Syndroom (PCOS)
Uitgangsvraag
Uitgangsvraag 1
Wat is het risico op een cardiovasculaire gebeurtenis bij een vrouw met polycysteus ovarium syndroom (PCOS)?
Uitgangsvraag 2
Wat is het cardiovasculaire risicoprofiel van vrouwen met polycysteus ovarium syndroom (PCOS)?
Aanbeveling
Gelet op het beperkte toegenomen relatieve risico op hart- en vaatziekten bij vrouwen met polycysteus ovarium syndroom is er geen reden om verdere diagnostiek en behandeling te adviseren met betrekking tot cardiovasculair risicomanagement.
Overwegingen
Bewijslast om de uitgangsvraag te beantwoorden
In de onderzochte cohorten werd gevonden dat het risico op cardiovasculaire gebeurtenissen in patiënten met PCOS licht verhoogd is in vergeleking met vrouwen zonder PCOS. Het hogere risico op cardiovasculaire gebeurtenissen bij vrouwen met PCOS wordt met name bepaald door een hoger gecombineerd risico op CV gebeurtenissen maar niet specifiek door ischemische hartziekten of beroerte. Bij vrouwen met PCOS is er een hoger risico op DM II en hypertensie.
De werkgroep heeft systematisch de literatuur doorzocht (zie bijlage 5 voor verantwoording zoekstrategie). Studies met meer dan 10 PCOS vrouwen werden meegenomen, patiënt controle studies werden uitgesloten om potentiele overschatting (bias) van de gevonden risico’s te vermijden. Op basis van funnelplots vonden wij geen aanwijzingen voor publicatiebias.
Zwakte van de huidige analyse
Op basis van de analyse kan alleen een uitspraak worden gedaan over de relatieve risico’s van CV gebeurtenissen, ischemische hartziekte en beroertes bij PCOS patiënten. Absolute kansen kon de werkgroep niet berekenen. Tevens is in de verschillende studies wisselend omgegaan met correctie voor verschillende potentiële confounders en is de duur van de follow-up verschillend. Obesitas is een veel voorkomende confounder bij vrouwen met PCOS. Uit de huidige analyses blijkt dat niet alle studies hebben gecorrigeerd voor deze confounder en dat het dus onduidelijk is of obesitas een van de belangrijkste onderliggende factoren is die het verhoogde risico voor enkele eindpunten beïnvloedt. Potentieel zouden vrouwen met PCOS zonder overgewicht of obesitas een ander risico kunnen hebben dan PCOS vrouwen met overgewicht of obesitas.
De etnische diversiteit kan hier ook nog een rol bij spelen. Er zijn echter geen goede vergelijkende studies gedaan die het HVZ risico tussen verschillende etnische groepen hebben vergeleken.
Huidige analyse in perspectief van de overige internationale multidisciplinaire richtlijnen rondom PCOS en cardiovasculair/metabool risico (Fauser 2012; Teede 2011)
De ontwikkelaars van de bovengenoemde richtlijnen hebben geen overtuigend bewijs kunnen vinden voor een absoluut verhoogd cardiovasculair risico voor vrouwen met PCOS. Desalniettemin adviseren zij op basis van klinische consensus dat bij vrouwen met PCOS toch het risico op HVZ geïnventariseerd moet worden aan de hand van risicofactoren.
In dezelfde richtlijnen wordt, net als in de analyse voor deze richtlijn, een verhoogd risico gevonden voor het ontwikkelen van DM II. Er is niet naar bewijs gezocht aangaande de beste screeningsmethode voor detectie van DM II bij vrouwen met PCOS.
De aanbevelingen uit de Australische richtlijn wijken af van de aanbevelingen in deze richtlijn op grond van vrijwel hetzelfde bewijs. Dit kan te maken hebben met een andere visie op risicoscreening in Australië, de mate waarin onderliggende risicofactoren aanwezig zijn in de populatie (prevalentie van obesitas, roken, metabool syndroom, romp adipositas, weinig lichamelijke activiteit etc.). De ontwikkelaars van de Australische richtlijn hebben er voor gekozen om te adviseren bij vrouwen met PCOS het risico op HVZ wel te inventariseren. De belangrijkste overweging was dat door middel van screening meer informatie verkregen kan worden over de relaties tussen HVZ, DM II en PCOS. De werkgroep die de huidige richtlijn heeft ontwikkelt heeft echter besloten dat deze overweging zou moeten leiden tot meer wetenschappelijk onderzoek en niet tot een aanbeveling in een evidence based richtlijn.
De werkgroep heeft overwogen om voor vrouwen met PCOS wel screening op DM II te adviseren. Besloten werd om deze aanbeveling vooralsnog niet te geven, op grond van de volgende overwegingen. Ondanks het verhoogde risico op diabetes mellitus type 2 is er onvoldoende wetenschappelijk bewijs dat vrouwen met PCOS een substantieel verhoogd risico op cardiovasculaire gebeurtenis hebben. Bovendien wordt PCOS vastgesteld bij de evaluatie van onvervulde kinderwens. Verreweg de meesten van deze vrouwen zullen, omdat PCOS goed behandelbaar is, zwanger worden. In de zwangerschap behoren vrouwen met PCOS gescreened te worden op zwangerschapsdiabetes (NVOG richtlijn diabetes mellitus en zwangerschap). Van de vrouwen met PCOS die zwanger worden ontwikkelt ongeveer 1 op 5 zwangerschapsdiabetes (De Wilde 2014). Zwangerschapsdiabetes is een belangrijke voorspeller van DM II. Daarom wordt in de NVOG richtlijn diabetes mellitus en zwangerschap geadviseerd om bij vrouwen die zwangerschapsdiabetes hebben gehad jaarlijks de glucosetolerantie te testen. De werkgroep verwacht daarom dat het overgrote merendeel van de vrouwen met PCOS die uiteindelijk DM II zullen ontwikkelen tijdig kan worden geidentificeerd door het volgen van de adviezen in de NVOG richtlijn diabetes mellitus en zwangerschap.
Onderbouwing
Achtergrond
De diagnose polycysteus ovarium syndroom (PCOS) kan worden gesteld bij vrouwen die aan ten minste twee van de drie volgende criteria voldoen: oligo- tot amenorrhoe, klinisch (hirshutisme, acne, alopecia androgenentica) of biochemisch hyperandrogenisme, en/of polycysteuze ovaria (PCO) (meer dan 12 antrale follikels per ovarium zichtbaar bij echoscopie of een ovarieel volume > 10ml) (Rotterdam ESHRE/ASRM-Sponsored PCOS consensus workshop group, 2004). PCOS gaat veelal gepaard met subfertiliteit; vijf tot zeven procent van de vrouwen in de fertiele levensfase heeft PCOS (Fauser, 2012). Vrouwen met PCOS hebben over het algemeen een ongunstig cardiovasculair risicoprofiel (Cussons, 2008). Een substantieel deel van de vrouwen met PCOS heeft overgewicht of obesitas en de incidentie hiervan is sterk verhoogd in een populatie vrouwen met PCOS (Fauser, 2012). Daarnaast hebben deze vrouwen vaker insuline resistentie, diabetes mellitus type 2 en ongunstige lipiden profielen ten opzichte van vrouwen zonder PCOS (Chan 2011). Deze factoren maken deel uit van het metabool syndroom, een cluster van risicofactoren voor hart- en vaatziekten (HVZ). Hoewel het hebben van deze klassieke risicofactoren gepaard gaat met een toegenomen risico op het krijgen van HVZ zijn er weinig harde gegevens over dit verband bij vrouwen met PCOS niet voorhanden. De bestaande literatuur en internationale richtlijnen zijn zeer summier en spreken elkaar ook soms tegen (Fauser 2012; Teede 2011). Vanwege het veelvuldig voorkomen van ongunstige niveau’s van klassieke cardiovasculaire risicofactoren bij vrouwen met PCOS is moglijk vroege detectie van behandelbare risicofactoren van belang om toekomstige HVZ te voorkómen. In dit hoofdstuk worden de bestaande literatuur samengevat en de bewijsvoering beschreven voor het al dan niet bestaan van een verhoogd cardiovasculair risico bij vrouwen met PCOS.
Conclusies
|
Kwaliteit van bewijs: B |
Vrouwen met PCOS hebben een licht verhoogd risico op fatale of niet fatale cardiovasculaire gebeurtenissen (RR 1.38, 95% BI 1.04-1.83) in vergelijking met vrouwen zonder PCOS (figuur 4.2.1.). Iftikhar 2012; Morgan 2012; Schmidt 2011; Shaw 2007 |
|
Kwaliteit van bewijs: B |
Vrouwen met PCOS hebben geen verhoogd risico op fataal of niet fataal ischemische hartziekte (RR 1.11, 95% BI 0.69-1.81) in vergelijking met vrouwen zonder PCOS (figuur 4.2.2.). Iftikhar 2012; Lunde 2007; Schmidt 2011; Wild 2000 |
|
Kwaliteit van bewijs: B |
Vrouwen met PCOS hebben geen verhoogd risico op een fatale of niet fatale beroerte (RR 1.79, 95% BI 0.92-3.48) in vergelijking met vrouwen zonder PCOS (figuur 4.2.3.). Iftikhar 2012; Lunde 2007; Schmidt 2011; Wild 2000 |
|
Kwaliteit van bewijs: A1 |
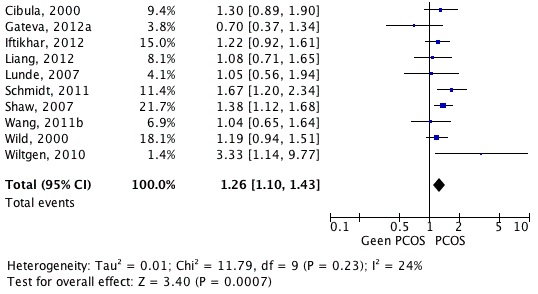
Vrouwen met PCOS hebben een licht verhoogd risico op het ontwikkelen van hypertensie (RR 1.26, 95% BI 1.10-1.43) in vergelijking met vrouwen zonder PCOS (figuur 4.2.4.). Hudecova 2011; Liang 2012; Moran 2010; Wiltgen 2010 |
|
Kwaliteit van bewijs: A1 |
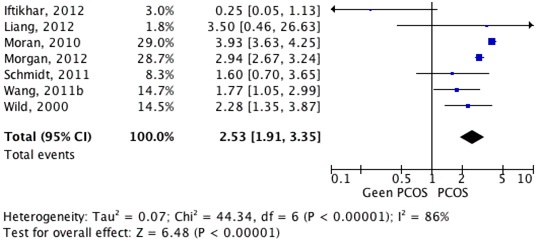
Vrouwen met PCOS hebben een verhoogd risico op het ontwikkelen van type II diabetes mellitus (RR 2.53, 95% BI 1.91-3.35) in vergelijking met vrouwen zonder PCOS (figuur 4.2.5.). Hudecova 2011; Iftikhar 2012; Liang 2012; Moran 2010; Morgan 2012; Schmidt 2011; Wang 2011b; Wild 2000; Wiltgen 2010 |
|
Kwaliteit van bewijs: A1 |
Vrouwen met PCOS hebben een licht verhoogd risico op het ontwikkelen van dyslipidemie (RR 1.75, 95% BI 1.12-2.72) in vergelijking met vrouwen zonder PCOS (figuur 4.2.6.). Hudecova 2011; Shaw 2008; Schmidt 2011; Wang 2011; Liang 2012; Wild 2000; Wiltgen 2010 |
Samenvatting literatuur
Uitgangsvraag 1
Wat is het risico op een cardiovasculaire gebeurtenis bij een vrouw met polycysteus ovarium syndroom (PCOS)?
Er zijn zes onderzoeken naar voren gekomen uit de zoekstrategie en de beoordeling door de reviewers die geschikt werden geacht voor het beantwoorden van deze uitgangsvraag (Iftikhar 2012; Lunde 2007; Morgan 2012; Schmidt 2011; Shaw 2007; Wild 2000). Voor de zoekverantwoording wordt verwezen naar bijlage 5 en voor de evidencetabel naar bijlage 6.
In tabel 4.2.1. (bijlage 4) staan risico’s op het krijgen van een fataal en/of niet-fataal cardiovasculaire (CV) gebeurtenis van bovengenoemde studies. Figuur 4.2.1., 4.2.2. en 4.2.3. zijn de forest plots voor respectievelijk CV gebeurtenis, ischemische hartziekten (IHZ) en beroerte bij vrouwen met PCOS vergeleken met vrouwen zonder PCOS. De forest plot in figuur 4.2.1. laat het licht verhoogde risico op een CV gebeurtenis bij vrouwen met PCOS zien ten opzichte van vrouwen zonder PCOS. De afzonderlijke relatieve risico’s voor IHZ en beroerte zijn blijkens figuur 4.2.2. en 4.2.3. niet significant verhoogd.
Figuur 4.2.1: De kans op het krijgen van een CV gebeurtenis bij vrouwen met PCOS (in de voorgeschiedenis) ten opzichte van vrouwenzonder PCOS
|
Studie |
Gewicht |
Relatief risico (95% BI) |
CV gebeurtenis |

Figuur 4.2.2: De kans op het krijgen van een ischemische hartziekte (IHZ) bij vrouwen met PCOS (in de voorgeschiedenis) ten opzichte van vrouwen zonder PCOS
|
Studie |
Gewicht |
Relatief risico (95% BI) |
IHZ |

Figuur 4.2.3: De kans op het krijgen van een beroerte bij vrouwen met PCOS (in de voorgeschiedenis) ten opzichte van vrouwen zonder PCOS
|
Studie |
Gewicht |
Relatief risico (95% BI) |
Beroerte |

Uitgangsvraag 2
Wat is het cardiovasculaire risicoprofiel van vrouwen met polycysteus ovarium syndroom (PCOS)?
Er zijn 19 onderzoeken naar voren gekomen uit de zoekstrategie en de beoordeling van de reviewers die geschikt lijken voor het beantwoorden van deze uitgangsvraag (Chang 2011; Cibula 2000; Coksuer 2011; Gateva 2012a; Huang 2010; Hudecova 2011; Iftikhar 2012; Karabulut 2012; Liang 2012; Lunde 2007; Meyer 2012; Moran 2010; Morgan 2012; Rahmanpour 2012; Schmidt 2011; Shaw 2007; Wang 2011b; Wild 2000; Wiltgen 2010). Voor de zoekverantwoording wordt verwezen naar bijlage 5 en voor de evidencetabel naar bijlage 6.
Hypertensie
Met de gehanteerde zoekstrategie zijn 10 studies gevonden (Cibula 2000; Gateva 2012a; Iftikhar 2012; Liang 2012; Lunde 2007; Schmidt 2011; Shaw 2008; Wang 2011b; Wild 2000; Wiltgen 2010) die het antwoord kunnen geven op de vraag of vrouwen met PCOS een verhoogd risico hebben op hypertensie. In tabel 4.2.2. (bijlage 4) en figuur 4.2.4. zijn de risico’s weergegeven.
Over het algemeen hebben vrouwen met PCOS een iets hogere kans (RR 1.26, 95% BI 1.10-1.43) op hypertensie. Mogelijk dat obesitas een belangrijke factor is bij de verhoogde kans op hypertensie. Uit de studies die een correctie voor BMI uitvoerden (Wang 2011b, Wild 2000) of een gematchte obese controle populatie hadden (Gaveta 2012a) blijkt geen verschil in RR voor hypertensie (tabel 4.2.5., bijlage 4). Vrouwen met PCOS blijken niet vaker antihypertensiva te gebruiken (Iftikhar 2012). Er is slechts één prospectieve cohortstudie die laat zien dat het risico op hypertensie bij vrouwen met PCOS 30% hoger ligt dan bij vrouwen zonder PCOS, maar in deze studie werd niet corrigeerd voor gewicht (Schmidt 2011).
Figuur 4.2.4: De kans op het ontwikkelen van hypertensie bij vrouwen met PCOS (in de voorgeschiedenis) ten opzichte van vrouwen zonder PCOS op basis van patiënten series en cohort
|
Studie |
Gewicht |
Relatief risico (95% BI) |
Hypertensie |
Diabetes mellitus type 2
Er zijn 11 onderzoeken, waarvan 1 meta analyse, en 10 cross-sectionele studies (Moran 2010; Hudecova 2011; Iftikhar 2012; Liang 2012; Lunde 2007; Morgan 2012; Schmidt 2011; Wang 2011b; Wild 2000; Wiltgen 2010; Gambineri 2012) naar voren gekomen uit de zoekstrategie en de beoordeling van de reviewers die geschikt lijken voor het beantwoorden van de vraag of vrouwen met PCOS een verhoogd risico hebben op het ontwikkelen van diabetes mellitus type 2 (DM II). In tabel 4.2.3. (bijlage 4) en figuur 4.2.5. zijn de risico’s weergegeven. Vrouwen met PCOS blijken 2.53 keer zo vaak (95% BI 1.91-3.35) DM II te ontwikkelen vergeleken met vrouwen zonder PCOS. Dit risico bleef gelijk indien er gecorrigeerd werd voor BMI.
Figuur 4.2.5: De kans op het ontwikkelen van diabetes mellitus type 2 (DM II) bij vrouwen met PCOS (in de voorgeschiedenis) ten opzichte van vrouwen zonder PCOS op basis van patiënten series en cohortonderzoeken
|
Studie |
Gewicht |
Relatief risico (95% BI) |
DM II |
Lipidenprofiel
Bij onze zoekstrategie zijn zeven studies (Hudecova 2011; Shaw 2008; Schmidt 2011; Wang 2011b; Liang 2012; Wild 2000; Wiltgen 2010) gevonden die het antwoord kunnen geven op de vraag of vrouwen met PCOS een verhoogd risico hebben op dyslipidemie. In tabel 4.2.5. (bijlage 4) en figuur 4.2.7. zijn de risico’s weergegeven.
Uit de analyse blijkt dat er een licht verhoogd risico is (RR 1.75, 95% BI 1.12-2.72) op dyslipidemie bij vrouwen met PCOS. Met name het HDL cholesterol is lager bij vrouwen met PCOS terwijl de triglyceriden en het LDL cholesterol verhoogd zijn (Wild, 2011).
Figuur 4.2.6: De kans op het ontwikkelen van dyslipidemie bij vrouwen met PCOS (in de voorgeschiedenis) ten opzichte van vrouwen zonder PCOS op basis van patiënten series en cohortonderzoeken
|
Studie |
Gewicht |
Relatief risico (95% BI) |
Dyslipidemie |

Zoeken en selecteren
Voor inclusie in de meta-analyse moesten de onderzoeken voldoen aan de volgende criteria:
- Origineel artikel of meta-analyse;
- Cohortonderzoeken;
- Diagnose PCOS conform de Rotterdam 2003 consensus;
- Inclusie >10 individuen met PCOS;
- Cardiovasculaire ziekten, ischemische hartziekten en beroertes prospectief als uitkomst vastgelegd;
- Follow-up tenminste 3 jaar;
- Volwassen populatie;
- Indicatie van het aantal vrouwen met PCOS of aantal persoonsjaren en het aantal of percentage cardiovasculaire gebeurtenissen.
Patiënt controle en cross-sectionele onderzoeken werden uitgesloten bij de analyse op de eindpunten cardiovasculaire gebeurtenissen. Bij de analyse van het risicoprofiel zijn cross-sectionele studies wel meegenomen. Indien meerdere publicaties van hetzelfde onderzoek beschikbaar waren werd onderzoek geïncludeerd dat over de meest gedetailleerde informatie over blootstelling en uitkomst beschikte.
Referenties
- Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome (PCOS). (2004). Hum.Reprod., 19(1), 41-47.
- Chan, D. C., & Watts, G. F. (2011). Dyslipidaemia in the metabolic syndrome and type 2 diabetes: pathogenesis, priorities, pharmacotherapies. Expert.Opin.Pharmacother., 12(1), 13-30.
- Chang, A. Y., Ayers, C., Minhajuddin, A., Jain, T., Nurenberg, P., de Lemos, J. A. et al. (2011). Polycystic ovarian syndrome and subclinical atherosclerosis among women of reproductive age in the Dallas heart study. Clinical Endocrinology, 74(1), 89-96.
- Cibula, D., Cifkova, R., Fanta, M., Poledne, R., Zivny, J., & Skibova, J. (2000). Increased risk of non-insulin dependent diabetes mellitus, arterial hypertension and coronary artery disease in perimenopausal women with a history of the polycystic ovary syndrome. Hum.Reprod., 15(4), 785-789.
- Coksuer, H., Koplay, M., Oghan, F., Haliloglu, B., & Keskin, N. (2011). Evaluation of carotid wall thickness and vertebro-basilar system insufficiency in patients with obese polycystic ovary syndrome. Journal of Obstetrics & Gynaecology Research, 37(8), 997-1003.
- Cussons, A. J., Watts, G. F., Burke, V., Shaw, J. E., Zimmet, P. Z., & Stuckey, B. G. (2008). Cardiometabolic risk in polycystic ovary syndrome: a comparison of different approaches to defining the metabolic syndrome. Hum.Reprod., 23(10), 2352-2358.
- Fauser, B. C., Tarlatzis, B. C., Rebar, R. W., Legro, R. S., Balen, A. H., Lobo, R. et al. (2012). Consensus on women's health aspects of polycystic ovary syndrome (PCOS): the Amsterdam ESHRE/ASRM-Sponsored 3rd PCOS Consensus Workshop Group. Fertil.Steril., 97(1), 28-38.
- Gateva, A., & Kamenov, Z. (2012). Cardiovascular Risk Factors in Bulgarian Patients with Polycystic Ovary Syndrome and/or Obesity. Obstetrics & Gynecology International, 2012, 306347.
- Huang, J., Ni, R., Chen, X., Huang, L., Mo, Y., & Yang, D. (2010). Metabolic abnormalities in adolescents with polycystic ovary syndrome in south China. Reproductive Biology & Endocrinology, 8, 142.
- Hudecova, M., Holte, J., Olovsson, M., Larsson, A., Berne, C., & Sundstrom-Poromaa, I. (2011). Prevalence of the metabolic syndrome in women with a previous diagnosis of polycystic ovary syndrome: long-term follow-up. Fertility & Sterility, 96(5), 1271-1274.
- Iftikhar, S., Collazo-Clavell, M. L., Roger, V. L., St, S. J., Brown, R. D., Jr., Cha, S. et al. (2012). Risk of cardiovascular events in patients with polycystic ovary syndrome. Netherlands Journal of Medicine, 70(2), 74-80.
- Karabulut, A., Yaylali, G. F., Demirlenk, S., Sevket, O., & Acun, A. (2012). Evaluation of body fat distribution in PCOS and its association with carotid atherosclerosis and insulin resistance. Gynecological Endocrinology, 28(2), 111-114.
- Liang, S. J., Liou, T. H., Lin, H. W., Hsu, C. S., Tzeng, C. R., & Hsu, M. I. (2012). Obesity is the predominant predictor of impaired glucose tolerance and metabolic disturbance in polycystic ovary syndrome. Acta Obstetricia et Gynecologica Scandinavica, 91(10), 1167-1172.
- Lunde, O., & Tanbo, T. (2007). Polycystic ovary syndrome: a follow-up study on diabetes mellitus, cardiovascular disease and malignancy 15-25 years after ovarian wedge resection. Gynecological Endocrinology, 23(12), 704-709.
- Meyer, M. L., Malek, A. M., Wild, R. A., Korytkowski, M. T., & Talbott, E. O. (2012). Carotid artery intima-media thickness in polycystic ovary syndrome: A systematic review and meta-analysis. Human Reproduction Update, 18(2), 112-126.
- Moran, L. J., Misso, M. L., Wild, R. A., & Norman, R. J. (2010). Impaired glucose tolerance, type 2 diabetes and metabolic syndrome in polycystic ovary syndrome: a systematic review and meta-analysis. [Review] [123 refs]. Human Reproduction Update, 16(4), 347-363.
- Morgan, C. L., Jenkins-Jones, S., Currie, C. J., & Rees, D. A. (2012). Evaluation of adverse outcome in young women with polycystic ovary syndrome versus matched, reference controls: a retrospective, observational study. Journal of Clinical Endocrinology & Metabolism, 97(9), 3251-3260.
- Rahmanpour, H., Jamal, L., Mousavinasab, S. N., Esmailzadeh, A., & Azarkhish, K. (2012). Association between polycystic ovarian syndrome, overweight, and metabolic syndrome in adolescents. Journal of Pediatric & Adolescent Gynecology, 25(3), 208-212.
- Schmidt, J., Landin-Wilhelmsen, K., Brannstrom, M., & Dahlgren, E. (2011). Cardiovascular disease and risk factors in PCOS women of postmenopausal age: a 21-year controlled follow-up study. Journal of Clinical Endocrinology & Metabolism, 96(12), 3794-3803.
- Shaw, L. J., Bairey Merz, C. N., Azziz, R., Stanczyk, F. Z., Sopko, G., Braunstein, G. D. et al. (2008). Postmenopausal women with a history of irregular menses and elevated androgen measurements at high risk for worsening cardiovascular event-free survival: results from the National Institutes of Health--National Heart, Lung, and Blood Institute sponsored Women's Ischemia Syndrome Evaluation. J.Clin.Endocrinol.Metab, 93(4), 1276-1284.
- Teede, H. J., Misso, M. L., Deeks, A. A., Moran, L. J., Stuckey, B. G., Wong, J. L. et al. (2011). Assessment and management of polycystic ovary syndrome: summary of an evidence-based guideline. Med.J.Aust., 195(6), S65-112.
- Wang, E. T., Calderon-Margalit, R., Cedars, M. I., Daviglus, M. L., Merkin, S. S., Schreiner, P. J. et al. (2011). Polycystic ovary syndrome and risk for long-term diabetes and dyslipidemia. Obstetrical and Gynecological Survey, 66(5), 285-287.
- Wild, S., Pierpoint, T., McKeigue, P., & Jacobs, H. (2000). Cardiovascular disease in women with polycystic ovary syndrome at long-term follow-up: a retrospective cohort study. Clin.Endocrinol.(Oxf), 52(5), 595-600.
- de Wilde, M.A,, Veltman-Verhulst, S.M., Goverde, A.J., Lambalk, C.B., Laven, J.S., Franx, A., Koster, M.P., Eijkemans, M.J., Fauser, B.C. (2014). Preconception predictors of gestational diabetes: a multicentre prospective cohort study on the predominant complication of pregnancy in polycystic ovary syndrome. Hum Reprod.,29(6),1327-1336
- Wiltgen, D., & Spritzer, P. M. (2010). Variation in metabolic and cardiovascular risk in women with different polycystic ovary syndrome phenotypes. Fertility & Sterility, 94(6), 2493-2496.
Evidence tabellen
|
Reference |
Study type |
Characteristics |
Determinant (I) |
Controls (C)
|
Outcome measures and follow-up time |
Results |
Quality assessment study |
|
Chang, 2011 |
Design Cross-sectional cohort study
N = 697
Dallas heart study |
Aim of the study: to determine in a multiethnic population- based sample whether women with PCOS have greater measures of subclinical atherosclerosis than women without PCOS
Inclusion criteria -Women between the ages of 35 and 49 - PCOS according R’dam criteria - Period 2000 - 2002
Exclusion criteria - postmenopausal women
|
Determinants PCOS according R’dam criteria (exept for cycle interval > 45 days)
N = 144 |
Controls Women with regular menses, total testosterone <2.78 nmol/l, no signs of hirsutism and no polycystic ovarian morphology by magnetic resonance imaging (MRI).
N = |
Primary outcomes: Subclinical atherosclerosis defined as coronary artery calcium (CAC) by computed tomography and abdominal aortic plaque by MRI.
Secundary outcomes: Hirsutism (?), BMI, Total Testosterone, FAI, PCOM. Fasting Glucose and Insulin, HOMA-IR, Total cholesterol, LDL, HDL, VLDL, hs-CRP, Leptin, MCP-1. LV mass
Follow up: |
Primary outcomes:
There was a greater prevalence of hypertension in women with PCOS (29.2% vs 18.8%, P = 0.03) but no significant difference in the prevalence of impaired fasting glucose (IFG), diabetes or the metabolic syndrome than controls
In a multivariate logistic regression analysis adjusting for age, BMI, insulin and hypertension, the odds ratio of aortic plaque for women with PCOS compared with controls was not significant (0.63, 95% confidence interval 0.36–1.11; unadjusted odds ratio, 0.66, 95% confidence interval 0.39–1.13). Among women with PCOS, those with aortic plaque had significantly lower HDL [1.22 vs 1.33 mmol/l (47.0 vs 51.5 mg/dl), P = 0.01] and higher fasting glucose [5.38 vs 5.00 mmol/l (97.0 vs 90.0 mg/dl), P = 0.01]. In the control groups, these risk factors were not different in those with or without aortic plaque. In logistic regression analyses, significant predictors of aortic plaque in women with PCOS were glucose [OR 1.01 (1.00–102)], low HDL [OR 2.3 (1.0–5.4)] or the metabolic syndrome.[OR 2.4 (1.1–5.7)]. |
Clearly defined groups: Yes
Selection bias: Not expected
Method of assessing the outcome appropriately: To assess the prevalence of subclinical atherosclerosis, electron beam computed tomography (EBCT) (n = 641) and aortic MRI (n = 569) were performed at visit 3 to provide measurements of CAC and aortic plaque, respectively.
Selective loss to follow up: No, they only included women who completed all three study visits
Identification confounders and correction in analysis: Yes, adjustment for age, BMI, insulin and Hypertension in the aortic plaque model.
Funding: This work was supported by the Donald W. Reynolds Cardiovascular Clinical Research Center at Dallas, the American Heart Association (Fellow-to-Faculty Transition Award #0775033N to AYC) and the Burroughs-Wellcome Fund (Clinical Scientist Award in Translational Research grant #1005954 to RJA).
|
|
Coksuer, 2011 |
Design Case- control
N = 64 |
Aim of the study: To investigate the risk of cardiovascular disease by measuring carotid intima-media thickness (CIMT) and to evaluate the diameters and blood flow volume of vertebral arteries using Doppler ultrasound and the possible contribution of hyperandrogenemia that exists in these patients.
Inclusion criteria - Caucasian women - age 18 – 35 years - nonsmokers
Exclusion criteria pregnancy, hypothyroidism, hyperprolactinemia, Cushings syndrome, nonclassical congenital adrenal hyperplasia, and use of OAC glucocorticoids, antiandrogens, ovulation induction agents, antidiabetic or antiobesity drugs or other hormonal drugs within the previous 6 months. neoplastic, metabolic, hepatic, and cardiovascular disorder or other concurrent medical illness were also excluded from the study |
Determinants PCOS according R’dam criteria
N = 31 |
Controls Healthy women
N = 33 |
Primary outcomes: BMI, W/H ratio, Ferriman-Galwey score, SBP, DBP, heart rate, Blood flow in Vertebral arteries, CIMT, HOMA-IR, free and total T, Prl, E2, FSH, LH, Lipid profile, CRP
Secundary outcomes:
Follow up: |
Primary outcomes: A significant difference between the two groups in IMT on the carotid artery and diameters of vertebral arteries were found (Table 2). Right-left and total flow volumes of the vertebral arteries (VA) were significantly lower in the PCOS group than in the control group. Compared to the control group, diameters of right and left VA decreased (P < 0.05). Conclusion: The results of this study suggest that hyperandrogenemia in obese PCOS patients affects carotid and vertebro-basilar system arteries wall thickness.
In the regression analyses, significant correlation was detected between the IMT and testosterone levels (t = 3.35, P = 0.001). |
Clearly defined groups: Yes
Selection bias: Possible, case-control
Method of assessing the outcome appropriately: All blood samples were obtained in the morning between 08.00–09.00 h after an overnight fast during the early follicular phase (second to fourth day) of a spontaneous or progesterone induced menstrual cycle. Carotid and vertebral arteries ultrasound imaging were performed using Logic-5 Expert US system (General Electric Medical System, CA, USA) by the same experienced radiologist.
Selective loss to follow up: Not applicable
Identification confounders and correction in analysis: Yes, regression analyses
Funding: Not reported
|
|
De Groot, 2011
|
Design systematic review and meta-analysis
N =
Cibula et al. 2000 Lundeand Tanbo et al. 2007 Shaw et al. 2008 Solomon et al. 2002 Wild et al. 2000b
|
Aim of the study: To examine the risk of (non)fatal coronary heart disease (CHD) or stroke in patients with PCOS and ovulatory women without PCOS
Inclusion criteria Controlled studies comparing women with PCOS to women without PCOS were considered for eligibility. outcomes: incident CHD and/or stroke (non-fatal or fatal). PCOS should have been defined according to the WHO (WHO, 1973), NIH (Zawadski, 1992), Rotterdam (Rotterdam, 2004) or AE (Azziz et al., 2009) criteria and the control group should be PCOS-free.
Exclusion criteria Studies without a control group or that did not distinguish women with or without PCOS |
Determinants PCOS according NIH, R’dam and AES-PCOS definitions
N = |
Controls
N = |
After identifying 1340 articles published before January 2010, 5 follow-up studies published between 2000 and 2008 were included.
Primary outcomes: the pooled risk ratio for CHD or stroke or mortality related to CHD or stroke and BMI-adjusted pooled risk ratio
Secundary outcomes:
Follow up: |
Primary outcomes: The relative risk for cardiovascular events ranged from 0.92 to 4.24. Four of five studies showed individually a significant increased risk for women with PCOS. The pooled relative risk from a random effects model was 2.02 (95% confidence interval 1.47, 2.76), showing a 2-fold increased risk for CHD/stroke in women with PCOS. The I2 showed moderate heterogeneity (42%). Two studies provided BMI-adjusted risk estimates (Wild et al., 2000b; Solomon et al., 2002; Fig. 3). The pooled relative risk adjusted for BMI was 1.55 (95% confidence interval 1.27, 1.89). In both analyses most weight came from the Solomon study (Solomon et al., 2002) that scored six out of nine points with the Newcastle–Ottawa Scale.
|
Clearly defined groups: Yes
Selection bias: Not expected
Method of assessing the outcome appropriately: The definition of CHD and stroke was based on the criteria used by the various authors. The studies showed heterogeneity in design, definitions and quality. The quality of the included studieswas assessed according to theNewcastle– Ottawa Scale.
Selective loss to follow up: Not reported in this meta-analysis
Identification confounders and correction in analysis: Not in all studies.
Funding: This study was supported by Leiden University Medical Center.
Newcastle-Ottawa Sclae: One study scored seven out of nine points (Shaw et al., 2008) and one study scored six points (Solomon et al., 2002), indicating high-quality. Three studies scored four points or less (Cibula et al., 2000; Wild et al., 2000b; Lunde and Tanbo, 2007), indicating low quality. |
|
Gateva, 2012a
|
Design Retrospective case-control
N = 301 |
Aim of the study: to investigate some classical cardiovascular risk factors in a crossectional study of Bulgarian women with PCOS and/or obesity.
Inclusion criteria patients referred to the Clinic of Endocrinology in Alexandrovska University Hospital-Sofia for the last 21 years (starting year 1990): - patients with PCOS or obesity that had sufficient data in their medical charts to be included in the analysis. - premenopausal
Exclusion criteria - age less than 18 or higher than 45 years - severe hepatic, cardiovascular or endocrine disorders (incl. diabetes), or other concurrent medical illnesses.
|
Determinants PCOS according to the R’dam criteria
Group 2: Lean PCOS N = 94
Group 3: Obese PCOS (BMI ≥ 30 kg/m2) N = 82
|
Controls Group 1: Obese (BMI ≥ 30 kg/m2)., no PCOS
N = 125 |
Primary outcomes: BMI, W/G ratio, TG, Total Cholesterol, HDL, LDL, HOMA_IR en Gluc/Ins ratio after OGTT, Sex steroid levels, FSH.LH, SHBG
Secundary outcomes:
Follow up: |
Primary outcomes: Both waist-to-stature ratio (WSR) (area under the curve 0.75, p = 0.002) and waist circumference (WC) (area under the curve 0.77, p = 0.001) but not waist-to-hip ratio (WHR) (area under the curve 0.62, p = 0.143) were shown to be good markers of increased cardiovascular risk, insulin resistance and dislipidemia in PCOS patients. The cut-off point for WSR of 0.50 is useful and the cut-off of 80 cm for WC is more appropriate than 88 cm in detecting cardiovascular risk in PCOS patients. Androgen levels and immunoreactive insulin during an oral glucose tolerance test had lower power for predicting increased CVD risk than WC and WSR. Dislipidemia (%) (18.2%) in Normal weight PCOS and (44.4%) in Obese PCOS. Arterial hypertension (%) 0% in normal weight PCOS and 15.8% in Obese PCOS. A statically significant difference was found regarding the results from the OGTT (blood glucose on 0 and 60min and IRI on 0, 60, and 120 min), HOMA-index, glucose/insulin ratio, the rate of hypertension and dislipidemia, systolic and diastolic blood pressure, HDL, VLDL, and TG (Table 2), the rate of liver steatosis and the levels of ALAT, GGT, and AP, and hematological results (WBC and ESR) (Table 3) between the lean and obese PCOS women.
|
Clearly defined groups: Yes
Selection bias: Possible, after agematching of the three groups, 74 women with obesity were excluded.
Method of assessing the outcome appropriately: Yes, Dislipidemia was accepted if there was such a diagnosis in the file and/or there was any treatment for dislipidemia and/or measured during the hospital stay TC > 5.2 mmol/L, and/or HDL <1.3 mmol/L and/or TG > 1.8 mmol/L. Arterial Hypertensionwas accepted if therewas such a diagnosis in the file and/or there was antihypertensive treatment and/or measured during the hospital stay arterial blood pressure ≥140/90mmHg.
Selective loss to follow up: Not applicable
Identification confounders and correction in analysis: No
Funding: Not reported
|
|
Huang 2010 |
Design Case-control
N = 36 |
Aim of the study: The aim of this study was to evaluate the characteristics of ECGs in patients with PCOS.
Inclusion criteria - Taiwanese women who visited the Reproductive Endocrinology Clinic, Wan-Fang Hospital for irregular menstruation from April 2004 to June 2009. - patients with PCOS met two of the three criteria (oligo-ovulation and/or anovulation, a polycystic ovary, and an androgen excess)
Exclusion criteria hyperprolactinaemia, hypogonadotropic hypogonadism, premature ovarian failure, congenital adrenal hyperplasia, androgensecreting tumor, Cushing’s syndrome, disorders of the uterus and chromo-somal anomalies. No sufficient clinical or biochemical records, menarche less than 3 years or at >40 years of age. Subjects without a sinus rhythm and those who did not have at least 10 evaluable leads |
Determinants PCOS
N = 24 |
Controls No PCOS
N = 12 |
Primary outcomes: heart rate, PR interval, QRS duration, Sokolow-Lyon voltage (SV1 þ RV5/6), Cornell voltage (RaVL þ SV3), QT interval and QTc interval were measured in 12-lead ECGs.
Secundary outcomes:
Follow up: |
Primary outcomes: The QRS duration was wider in patients with PCOS than those without PCOS (91+8 vs. 81+10 ms, p50.05). The heart rate, PR interval, Sokolow-Lyon voltage, product of the QRS duration times Cornell voltage combination, QT interval, QTc interval, QT dispersion and QTc dispersion were similar between the two groups.
|
Clearly defined groups: Definition PCOS not very clear.
Selection bias: Possible, selection of controls not clear.
Method of assessing the outcome appropriately: Yes
Selective loss to follow up: Not applicable
Identification confounders and correction in analysis: No
Funding: This study was supported by the Center of Excellence for Clinical Trials and Research of Wan Fang Hospital (DOH99-TD-B-111-003) and grants (98TMU-WFH- 05-4) from Taipei Medical University-Wan Fang Hospital, (NSC96-2628-B-038-012-MY3, NSC96- 2314-B-010-006, NSC97-2314-B-038-030-MY3) from the National Science Council, Taiwan.
Study limitations The data should be interpreted with cautions due to the potential limitations. We did not routinely perform echocardiography or chest X-ray with the measurement of cardiothoracic ratio in the study patients. It would be better if we can show the anatomical or structural differences between the patients with and without PCOS. In addition, the wider QRS duration in the patients with PCOS may be caused by a high sympathetic tone. Future study is warranted to evaluate the autonomic function such as heart rate variability in the patients with PCOS. |
|
Hudecova 2011 |
Design Case-control
N = 167 |
Aim of the study: To examine the prevalence of the metabolic syndrome (MetS) according to the scientific statement of the American Heart Association and the US National Cholesterol Education Program/Adult Treatment Panel III in middle-aged Swedish women previously diagnosed with polycystic ovary syndrome (PCOS) in comparison with age-matched healthy controls.
Inclusion criteria At the time of the follow-up investigation all women, independent of their current PCOS status (resolved or persisting), were included. Healthy controls, born during the same month as the index patients, were randomly selected from population registers.
Exclusion criteria
|
Determinants PCOS according to the R’dam criteria (modified
N = 84 |
Controls General population
N = 83 |
Primary outcomes: W/H ratio, BMI, WC. D- SBP, Heart rate, LDL,HDL, TG, Total cholesterol, HOMA-IR fasting blood glucose levels.
Secundary outcomes:
Follow up: |
Primary outcomes: At the follow-up, 31 women (36.9%) still fulfilled the diagnostic criteria for PCOS (persisting PCOS), whereas 30 women (35.7%) no longer did (resolved PCOS). In 23 women (27.4%) PCOS criteria could not be assessed because of postmenopausal status (n = 9, 10.7%), prior surgery (n=2, 2.4%), or ongoing use of hormonal contraception (n=12, 14.3%)
The prevalence of MetS in women with PCOS (mean _ SD age, 43.0 _ 5.8 years) was 23.8% and in controls was 8.0%, and it did not differ according to PCOS phenotype at the index assessment (polycystic ovaries [PCO], oligomenorrhea, and hirsutism: 10 [22.7%]; PCO and oligomenorrhea: 8 [22.2%]) or according to the persistence of PCOS features at follow-up (persisting PCOS: 25.8%; resolved PCOS: 16.7%).
|
Clearly defined groups: Yes
Selection bias: Not expected
Method of assessing the outcome appropriately: Yes
Selective loss to follow up: Yes, described earlier
Identification confounders and correction in analysis: Yes
Funding: This study was supported by grants from the Family Planning Foundation, Uppsala, Sweden and the Selander Foundation, Uppsala, Sweden.
Limitations: - no patients without the ultrasound criteria were included in the study, and very few had PCO and hyperandrogenism only. - the variable endocrine status in participants |
|
Iftikhar 2012 |
Design Cohort study
N = 625 |
Aim of the study: We conducted a community-based retrospective cohort study in women with PCOS in Olmsted County, Minnesota, and compared CV risk factors and incidence of CV events with those in women without PCOS.
Inclusion criteria patients aged 18 to 40 years, residing in Olmsted County, who were diagnosed with PCOS between 1966 and 1988
Exclusion criteria active thyroid disease, prolactin elevation, adrenal or ovarian tumours, or late-onset 21-hydroxylase deficiency (as shown by either a basal serum 17-hydroxyprogesterone >2.0 ng/ml or an elevated one-hour adrenocorticotropic hormone stimulation test). |
Determinants PCOS according to the R’dam criteria
N = 309 |
Controls No PCOS, age matched
N = 343 |
Primary outcomes: Incidence of CVD (MI, Stroke and coronary bypass surgery), Hypertension, Type II DM, BMI, Framingham risk score.
Secundary outcomes:
Follow up: 23.7 years |
Primary outcomes:
|
Clearly defined groups: Yes
Selection bias: Not expected
Method of assessing the outcome appropriately: By using the Rochester Epidemiology Project resources, a system that links and indexes the recordsof virtually all medical providers in Olmsted County, investigators can electronically identify and review records for all patients who received a particular diagnosis during a defined time period. International Classification of Diseases 9 code 256.4, and Berkson code 027904. The keywords used were polycystic ovaries, Stein-Leventhal syndrome, and sclerocystic ovaries. Ten control subjects for each case were first identified using an established computerised matching algorithm,15 where age and calendar year during their clinic visit plus three years were matching factors. Medical records were abstracted for events through 2005. A follow-up survey was done to update their CV health status through 2007. We incorporated gender and most recent complete data on age, total cholesterol, HDL cholesterol, smoking status, systolic blood pressure, and use of antihypertensive medications into a risk score calculator.18 In the absence of records on systolic blood pressure readings on all patients, we used physician diagnosis of hypertension or use of antihypertensive medications as evidence of hypertension.
Selective loss to follow up: One patient was lost to follow-up.
Identification confounders and correction in analysis: Assessed confounders included age; BMI; smoking status; presence of T2DM, hypertension or hyperlipidaemia; and family history of CVD, hypertension or T2DM.
Funding: This study was funded by Solvay Pharmaceuticals through Women’s Health Fellowship (S.I.) funds and was made possible by the Rochester Epidemiology Project (grant AR30582 from the National Institute of Arthritis and Musculoskeletal and Skin Diseases).
|
|
Karabulut 2012 |
Design Case-control
N = 89 |
Aim of the study: to compare body fat distribution in PCOS with healthy controls and to investigate the factors associated with carotid artery intima media thickness (IMT) and insulin resistance.
Inclusion criteria - September 2009 and September 2010. - Study population was most probably drawn from the patients who attended the outpatient clinic of gynecology of Denizli State Hospital - Control group: non-smoker patients with regular menses, without signs of hirsutismus, normal hormonal status and sonographic examination, who were matched for age and BMI.
Exclusion criteria - type-2 diabetes, hyperprolactinemia, hypogonadotrophic hypogonadism, thyroid disease, congenital adrenal hyperplasia, androgen secreting tumors and Cushing’s syndrome, - smoking |
Determinants PCOS according R’dam criteria
N = 46 |
Controls age matched
N = 43 |
Primary outcomes: Anthropometrical measurements, hormonal levels, lipid and glucose profile were evaluated. Body fat thickness in four regions and carotid IMT were measured
Secundary outcomes:
Follow up: |
Primary outcomes: Visceral and subcutaneous fat thickness and the mean carotid artery IMT were significantly higher in PCOS subjects (p < 0.01). In correlation analysis, age, body mass index (BMI) and waist hip ratio (WHR) showed correlation with carotid artery IMT (r = 0,55, p < 0,001; r = 0.41, p < 0.008 and r = 0.34 p = 0.03, respectively), whereas visceral fat thickness presented a correlation with HOMA-IR index as a sign of insulin resistance.
|
Clearly defined groups: Yes
Selection bias: Possible, case-control study
Method of assessing the outcome appropriately: Yes
Selective loss to follow up: Not applicable
Identification confounders and correction in analysis: Not applicable
Funding: Not reported.
|
|
Liang, 2012 |
Design Case-control
N = 290 |
Aim of the study: To evaluate the contribution to glucose intolerance and metabolic syndromeof obesity combinedwith the diagnostic criteria of polycystic ovary syndrome (PCOS).
Inclusion criteria - Period 31 August 2010 – 31 august 2011 - Taipei University -
Exclusion criteria (i) women who had been diagnosed with hyperprolactinemia, hypogonadotropic hypogonadism, premature ovarian failure, congenital adrenal hyperplasia, androgen-secreting tumor,Cushing’s syndrome, disorders of the uterus and chromosomal anomalies; (ii) women who were less than three years past menarche or who were older than 45 years; (iii) women who received hormones ormedication for majormedical diseases (diabetes or cardiovascular disease); and (iv) women who had had ovarian cysts or ovarian tumors identified by ultra-sonographic examination. |
Determinants PCOS according R’dam criteria
N = 220 |
Controls Women who did not present with any of three PCOS criteria
N = 70 |
Primary outcomes: obesity, hyperandrogenism, oligo-anovulation and polycystic ovary morphology on impaired glucose tolerance and metabolic disturbances
Secundary outcomes:
Follow up: |
Primary outcomes:
Logistic regression analyses demonstrated that obesity was the only parameter which had a significant association with impaired glucose tolerance (OR=8.0, 95% CI 3.9–16.6) andmetabolic syndrome (OR = 54.0, 95% CI 18.3–159.8). |
Clearly defined groups: Yes, however it’s not clear where control women were recruited.
Selection bias: Possible, see clearly defined groups.
Method of assessing the outcome appropriately: Yes, The insulin sensitivity index was evaluated by the HOMAIR using the following formula: HOMA-IR = [fasting insulin (in μIU/mL) × fasting glucose (in mg/dL)]/405.World Health Organization 2006 diagnostic criteria for diabetes were employed (fasting plasma glucose ≥7.0 mmol/L or two hour plasma glucose ≥11.1 mmol/L). Impaired glucose tolerance was defined as two hour glucose levels of 7.8–11.1 mmol/L in the 75 g oral glucose tolerance test. Inwomen with impaired glucose tolerance, the fasting plasma glucose level should be <7 mmol/L.Metabolic syndrome was defined (2005 National Cholesterol Education Program, Adult Treatment Panel III) as the presence of at least three of the following criteria: abdominal obesity (waist circumference >80 cm in women);serumtriglycerides≥1.7 mmol/L; serumHDL<1.3 mmol/L; systolic blood pressure ≥130 mmHg and/or diastolicblood pressure ≥85 mmHg; and fasting plasma glucose ≥7.0 mmol/L.
Selective loss to follow up: Not applicable
Identification confounders and correction in analysis: Logistic regression analysis
Funding: This work was supported by the National Science Council Grant NSC 98-2629-B-038-001-MY3 and Taipei Medical University,Wan FangHospital Grant 98TMU-WFH-05-03.
|
|
Meyer 2012 |
Design systematic review and meta-analysis
N =
From the 36 eligible full-text studies, 8 studies were included in the systematic review and 19 studies were included in the metaanalysis |
Aim of the study: This systematic review and meta-analysis was conducted to determine whether carotid intima-media thickness (CIMT), a marker of subclinical atherosclerosis, is higher in women with PCOS compared with women without PCOS.
Inclusion criteria Primary articles investigating CIMT among women with PCOS and without PCOS (controls) were included if they: (i) were a peer-reviewed primaryarticle, (ii) had a study population of women with PCOS [diagnostic criteria for PCOS specified by the National Institutes of Health (NIH)](Zawadzki and Dunaif, 1992), the European Society of Human Reproduction and Embryology/American Society of Reproductive Medicine(ESHRE/ASRM, 2004) and/or the Androgen Excess Society (AES) criteria(Azziz et al., 2006), and were compared with controls without PCOS, (iii) reported a measure of CIMT (unadjusted or adjusted) and (iv) were published in the English language. . The primary search was conducted in Ovid MEDLINE through 19 November 2010
Exclusion criteria Studies without a control group were excluded |
Determinants PCOS
N = 1123 |
Controls Controls
N = 923 |
Primary outcomes: the mean difference in CIMT between women with PCOS and women without PCOS
Secundary outcomes:
Follow up: |
Primary outcomes:
|
Clearly defined groups: Yes
Selection bias: Assesment of risk of bias by authors
Method of assessing the outcome appropriately: Yes
Selective loss to follow up: Not applicable
Identification confounders and correction in analysis: Depends on the study
Funding: This study was supported through the National Heart, Lung and Blood Institute predoctoral fellowship (NHLBI 5T32HL083825-01A2, -02, -03) and the postdoctoral fellowship (NHLBI T32 5T32HL007055-35).
|
|
Moran, 2010 |
Design systematic review and meta-analysis
N = 35 studies |
Aim of the study: to assess and weight the evidence to provide a realistic estimate of differences in prevalence and incidence of IGT, DM2 and metabolic syndrome in women with and without PCOS and to assess the effect of the confounding factor adiposity on IGT, DM2 and metabolic syndrome prevalence in women with and without PCOS.
Inclusion criteria PCOS defined by the National Institute of Health or Rotterdam - Eachstudy had to have at least three of the five factors as defined by each criterion.
Exclusion criteria - studies where abnormal glucose tolerance, DM2 or IGT were exclusion criteria |
Determinants PCOS
N = |
Controls No PCOS
N = |
Primary outcomes: incidence of IGT, DM2 or metabolic syndrome in women with and without PCOS.
Secundary outcomes: the effects of obesity
Follow up: |
Primary outcomes: A total of 2192 studies were reviewed and 35 were selected for final analysis. Women with PCOS had increased prevalence of IGT (OR 2.48, 95% CI 1.63, 3.77; BMI-matched studies OR 2.54, 95% CI 1.44, 4.47), DM2 (OR 4.43, 95% CI 4.06, 4.82; BMI-matched studies OR 4.00, 95% CI 1.97, 8.10) and metabolic syndrome (OR 2.88, 95% CI 2.40, 3.45; BMI-matched studies OR 2.20, 95% CI 1.36, 3.56). One study assessed IGT/DM2 incidence and reported no significant differences in DM2 incidence (OR 2.07, 95% CI 0.68, 6.30). One study assessed conversion from normal glucose tolerance to IGT/DM2 (OR 2.4, 95% CI 0.7, 8.0). No studies reported metabolic syndrome incidence.
|
Clearly defined groups: Yes
Selection bias: Only 5 of the 35 included studies were found to have a high risk of detection bias; however, all were found to be at high risk of selection bias, performance bias, attrition bias (incomplete outcome data) and reporting bias (selective outcome reporting).
Method of assessing the outcome appropriately: A literature search was conducted (MEDLINE, CINAHL, EMBASE, clinical trial registries and hand-searching) identifying studies reporting prevalence or incidence of IGT, DM2 or metabolic syndrome in women with and without PCOS. Data were presented as odds ratio (OR) [95% confidence interval (CI)] with fixed- and random-effects meta-analysis by Mantel–Haenszel methods. Quality testing was based on Newcastle–Ottawa Scaling and The Cochrane Collaboration’s risk of bias assessment tool. Literature searching, data abstraction and quality appraisal were performed by two investigators.
Selective loss to follow up: It was difficult to assess withdrawals and losses to follow-up.
Identification confounders and correction in analysis: Not applicable
Funding: Not reported
|
|
Morgan 2012 |
Design Retrospective cohort study
N = |
Aim of the study: to determine the relative risk of type 2 diabetes, cancer, large-vessel disease (LVD), and all-cause mortality for women diagnosed with PCOS.
Inclusion criteria - diagnosis of PCOS between 1990 and 2010
Exclusion criteria - any diagnosis of diabetes, LVD, or cancer before the index date. |
Determinants PCOS
N = 21740 |
Controls No PCOS
N = 86936 |
Primary outcomes: Type 2 diabetes, LVD (first record of MI, stroke, angina, or central or peripheral revascularization), cancer, all-cause mortality
Secundary outcomes:
Follow up: Median follow-up was 4.7 yr (interquartile range 2.0–8.6 yr) in those with PCOS and 5.8 yr (2.7–9.6 yr) in the reference group. |
Primary outcomes:
In the PCOS group, there were 713 cases of first incident diabetes during the follow-up period compared with 969 in the control group. The respective rates per 1000 patient-years (kpy) were 5.7 and 1.7, a relative-risk ratio of 3.12 (95% CI 3.10–3.6). In the CPHM, the HR was 3.015 (95% CI 2.733–3.327)
|
Clearly defined groups: Yes, patients were matched to four controls from within their own primary-care practice. The matching criterion was age (±2 yr), with the same requirement of a 12-month wash-in period before the case index date and the exclusion of patients with any diagnosis of diabetes, LVD, or cancer before the case index date.
Selection bias: Not expected
Method of assessing the outcome appropriately: using data from the General Practice Research Database (GPRD), a longitudinal, anonymized research database derived from nearly 600 primarycare practices in the United Kingdom.
Selective loss to follow up: Not applicable
Identification confounders and correction in analysis: Yes, BMI and age
Funding: This work was supported by Centre for Endocrine and Diabetes Sciences, Cardiff University.
|
|
Schmidt 2011 |
Design Cohort study
N = 93 |
Aim of the study: To examine whether postmenopausal PCOS women differ from controls regarding cardiovascular risk factors, myocardial infarction (MI), stroke and mortality.
Inclusion criteria - PCOS according R’dam criteria, aged 40–59 yr, all Caucasian
Exclusion criteria - Congenital adrenal hyperplasia and androgen secreting tumors |
Determinants PCOS according to R’dam criteria
N = 25 |
Controls No PCOS
N = 68 |
Primary outcomes: Blood pressure, glucose, insulin, triglycerides, total cholesterol, highand low-density lipoprotein, apolipoprotein A1 and B, fibrinogen, and plasminogen activator inhibitor antigen were studied. Incidences of MI, stroke, hypertension, diabetes, cancer, cause of death, and age at death
Secundary outcomes:
Follow up: 21 year |
Primary outcomes:
In 2008, seven of 32 PCOS women (22%) and 13 of 95 controls (14%) had diabetes (not significant).
In 2008, 22 of 32 (69%) of the PCOS women and 39 of 95 (41%) of the controls (P=0.008) had hypertension. In 1987, the corresponding rates were 39% (13 of 33) of the PCOS women and 11% (14 of 132) of the controls (P =0.001) |
Clearly defined groups: Yes
Selection bias: Not expected
Method of assessing the outcome appropriately: The population participated in a study in 1987 (9) and was reinvestigated in 2008. Hypertension was defined as use of antihypertensive agent and/or an ICD diagnosis of hypertension. Diabetes was defined as medical or dietary treatment for diabetes and/or diagnosis of type 2 or type 1 diabetes. MI and stroke (including one case of subarachnoidal bleeding among the referents) were defined as being hospitalized due to the diagnosis according to the ICD. Only the first MI or stroke was counted. Fasting venous blood samples were taken between 0700 and 1000 h
Selective loss to follow up: Yes, reported.
Identification confounders and correction in analysis: No
Funding: This work was supported by grants from the Health andMedical Care Committee of the Regional Executive Board, Region Västra Götaland, the Hjalmar Svensson Research Foundation, the Go¨ teborg Medical Society, the Sahlgrenska University Hospital ALF agreement, the Swedish Heart Lung Foundation, and the Swedish Research Council.
|
|
Wang 2011b |
Design Cohort study
N = 1127 |
Aim of the study: To estimate whether women aged 19–32 who fulfilled National Institutes of Health (NIH) criteria for polycystic ovary syndrome (PCOS) would be at a higher risk for subsequent development of incident diabetes, dyslipidemia, and hypertension, and to estimate whether normal-weight women with PCOS would have the same degree of cardiovascular risk as overweight women with PCOS.
Inclusion criteria - Cardia study - Age 18-30 years at baseling in 1985-1986 - Attended at the Year 15 examination - ≥ 1 ovary - Not pregnant - PCOS at ages 20–32: if they reported oligomenorrhea between 20–30 years of age and either reported hirsutism between 20–30 years of age or fulfilled criteria for biochemical hyperandrogenism at Year 2.
Exclusion criteria - FSH >40mIU/ml - self-report of no menses within the last 12 months (Year 16) - OAC - Women who fulfilled criteria for PCOS at Year 16 only - Prevalent cases of diabetes, hypertension or dyslipidemia |
Determinants PCOS according to NIH criteria
N = 53 |
Controls No PCOS
N = 1074 |
Primary outcomes: Hypertension, diabetes and dyslipidemia
Secundary outcomes:
Follow up: 18 years |
Primary outcomes:
|
Clearly defined groups: Yes
Selection bias: Not expected
Method of assessing the outcome appropriately: Participants underwent a baseline exam and follow-up exams at Years 2, 5, 7, 10, 15, and 20 with retention rates of 91, 88, 81, 79, 74, and 72%, respectively. The CARDIA Women’s Study (CWS) is an ancillary study of women who attended an additional examination at Year 16; CWS was designed to examine the role of androgens and polycystic ovaries in the development of cardiovascular disease. The study sample included 1127 women present at both the Year 2 (ages 20–32) and Year 16 (ages 34–46) examinations. Diabetes was defined as a fasting plasma glucose ≥ 126 mg/dL or use of diabetic medications. Dyslipidemia was defined as LDL > 160 mg/dL, HDL < 40 mg/ dL, triglycerides > 200 mg/dL, or use of cholesterol-lowering medications. Hypertension was defined as blood pressure ≥ 140/90 mmHg or the use of antihypertensive medications.
Selective loss to follow up: Women were only included when present at both the Year 2 (ages 20-32) and Year 16 (ages 34-36) examinations.
Identification confounders and correction in analysis: adjusted for age, race, BMI, education, and parity obtained at Year 2, and family history of diabetes obtained at Year 0.
Funding: Supported by the National Heart, Lung and Blood Institute (N01-HC-95095, N01-HC-48047, N01-HC-48048, N-01-HC-48049, N01-HC-48050, N01-HC-05187, N01-HC-45205, N01-HC-45204, N01-HC-45134), as was the CARDIA Women’s Study (R01-HL-065611).
|
|
Wiltgen 2010 |
Design Case-control
N = |
Aim of the study: to compare clinical, hormonal, and metabolic variables in women with classic polycystic ovary syndrome (PCOS), in ovulatory women presenting hirsutism, normal androgen levels, and polycystic ovaries (HþPCO), and in a group with isolated hirsutism (IH) presenting with normal ovaries and androgen levels.
Inclusion criteria - outpatients aged 14–35 years and consulting for hirsutism at the Gynecological Endocrinology Unit at Hospital de Clınicas de Porto Alegre, Brazil - PCOS according NIH and R’dam criteria - Controls: women in the same age range, with regular and proven ovulatory cycles (luteal-phase P >3.8 ng/mL) - None of the subjects or controls had received oral contraceptives, progestins, antiandrogens, antihypertensive, insulin-sensitizing, or weight-control drugs for at least 3 months before the study
Exclusion criteria other hyperandrogenic disorders (nonclassic congenital adrenal hyperplasia, Cushing’s syndrome, androgen-secreting neoplasms), thyroid disorders, or hyperprolactinemia |
Determinants PCOS according NIH and R’dam criteria
N = 195 |
Controls No PCOS
N = 25 |
Primary outcomes:
Secundary outcomes:
Follow up: |
Primary outcomes:
|
Clearly defined groups: Yes, but not clear where PCOS- and control women were recruited
Selection bias: Possible, see ‘clearly defined groups’
Method of assessing the outcome appropriately: The biochemical and ultrasound evaluation were made between days 2 and 10 of the menstrual cycle (and on days 21–24 for P levels) or on any day if the patient was amenorrheic. After an overnight fast, blood samples were drawn from an antecubital vein for biochemical determinations and oral glucose tolerance test. All samples were obtained between 8 AM and 10 AM.
Selective loss to follow up: Not applicable
Identification confounders and correction in analysis: Yes, BMI
Funding: Not reported
|
Risicotabellen
|
Tabel 4.2.1: risico’s op het krijgen van een fataal en/of niet-fataal CV gebeurtenis bij vrouwen met PCOS (in de voorgeschiedenis) ten opzichte van vrouwen zonder PCOS |
|||||||||
|
Studie |
Definitie PCOS |
N
|
Gem. FU (jr) |
Uitkomst |
Aantal gebeurtenissen (N) |
Gecorrigeerde risico’s (95% BI) |
Gecorrigeerd voor
|
||
|
A |
NA |
A |
NA |
||||||
|
Lunde, 2007 |
WHOII, NIH, R’dam, AE |
131 |
723 |
15-25 |
NF IHZ |
2 |
4 |
RR 2.76 (0.51-14.91) |
Geen |
|
NF B |
0 |
8 |
RR 0.32 (0.02-5.56) |
||||||
|
Shaw, 2008 |
WHOII, NIH, R’dam, AE |
104 |
286 |
6 |
F HVZ & NF IHZ |
22 |
32 |
HR 1.59 (1.19-.2.12) |
Leeftijd, DM, BMI, mate van slagaderverkalking |
|
Wild, 2000 |
WHO II, AE, R’dam |
319 |
1060 |
31 |
NF IHZ |
15 |
42 |
OR 1.2 (0.5-2.6) |
BMI |
|
NF B |
10 |
13 |
OR 3.4 (1.2-9.6) |
||||||
|
Iftikhar 2012 |
R’dam |
309 |
343 |
23.7 |
NF MI |
15 |
16 |
HR 0.74 (0.32-1.72) |
Lft, BMI, fertiliteits behandeling, postmenopauzale hormoon behandeling, familie-voorgeschiedenis voor hypertensie |
|
NF IAP |
10 |
6 |
HR 1.32 (0.42-4.13) |
||||||
|
NF B |
6 |
7 |
HR 1.05 (0.28-3.92) |
||||||
|
F HVZ |
4 |
2 |
HR 5.67 (0.51-63.7) |
||||||
|
Schmidt 2011 |
R’dam |
32 |
95 |
19 |
F & NF IHZ |
4 |
9 |
RR 1.32 (0.44-3.99) |
Geen |
|
F & NF B |
6 |
10 |
RR 1.78 (0.70-4.51) |
||||||
|
F & NF HVZ |
10 |
20 |
RR 1.48 (0.78-2.83) |
||||||
|
Morgan |
Read code (UK; huisartsen |
21 740 |
86 936 |
4.7/ 5.8 |
F & NF HVZ |
43 |
162 |
HR 1.08 (0.77-1.51) |
Lft, aantal contacten met huisarts, BMI |
|
Afkortingen: A = aangedaan door ziektebeeld; AE = Androgen-excess; B = beroerte; BI = betrouwbaarheidsinterval; BMI = body mass index; DM = diabetes mellitus; F = fataal; FU = follow-up; HR = hazard ratio; HVZ = hart- en vaatziekten; IAP = instabiele angina pectoris; IHZ = ischemische hartziekten; lft = leeftijd; MI = myocard infarct; NA = niet aangedaan door ziektebeeld; NF = niet fataal; NIH = National Institutes of Health; OR = odds ratio; R’dam = Rotterdam; RR = relatief risico; UK = United Kingdom; WHO II = World Health Organization |
|||||||||
|
Tabel 4.2.2: risico’s op het ontwikkelen van hypertensie in vrouwen met PCOS vergeleken met vrouwen zonder PCOS. |
|||||||||||||||
|
Studie |
Definitie PCOS |
N |
Gem FU (jr) |
Gem lft FU |
Definitie HT
|
Aantal vrouwen met HT (N)
|
Gecorrigeerde risico (95% BI) |
Gecorrigeerd voor |
|||||||
|
A |
NA |
A |
NA |
A |
NA |
||||||||||
|
Onderzoeken met patiënten series waarin vrouwen met PCOS zijn vergeleken met vrouwen zonder PCOS |
|||||||||||||||
|
Cibula |
WHOII, NIH, R’dam, AE |
28 |
752 |
NA |
51.9 |
51.0 |
II/III/IV |
14 |
290 |
RR 1.30 (0.89-1.90) |
Geen |
||||
|
Gateva 2012a |
R’dam |
125 |
82 |
nvt |
26.5 |
26.3 |
II/III/IV/VII |
16 |
15 |
RR 0.70 (0.37-1.34) |
NB: controle groep bestaat uit obese vrouwen. |
||||
|
Iftikhar, 2012 |
R’dam |
309 |
343 |
23.7 |
44.4 |
48.8 |
I/II |
80 |
73 |
RR 1.22 (0.92-1.61) |
Geen |
||||
|
Liang, 2012 |
R’dam |
220 |
70 |
NA |
26.9 |
28.3 |
VI |
68 |
20 |
RR 1.08 (0.71-1.65) |
Geen |
||||
|
Lunde, 2007 |
WHOII, NIH, R’dam, AE |
131 |
723 |
15-25 |
Nb |
Nb |
II |
11 |
58 |
RR 1.05 (0.56-1.94) |
Geen |
||||
|
Schmidt 2011 |
R’dam |
32 |
95 |
19 |
70.4 |
70.7 |
II of V |
22 |
39 |
RR 1.67 (1.20-2.34) |
Geen |
||||
|
Shaw, 2008 |
WHOII, NIH, R’dam, AE |
104 |
286 |
6 |
62.5 |
65.8 |
Nb |
63 |
126 |
RR 1.38 (1.12-1.68) |
Geen |
||||
|
Wang, 2011b |
NIH |
53 |
1074 |
18 |
38-50 |
II, III, IV |
14 |
274 |
OR 1.8 (0.9-3.6) |
Lft, ras, BMI baseline, educatie, pariteit, familieVG DM, BMI |
|||||
|
RR 1.04 (0.65-1.64) |
Geen |
||||||||||||||
|
Wild, 2000 |
WHO II, AE, R’dam |
319 |
1060 |
31 |
Nb |
Nb |
VII |
72 |
201 |
OR 1.4 (0.9-2.0) |
BMI |
||||
|
RR 1.19 (0.94-1.51) |
Geen |
||||||||||||||
|
Wiltgen, 2010 |
NIH/ R’dam |
195 |
25 |
NA |
22.3 |
29.7 |
VI |
`78 |
3 |
RR 3.33 (1.14-9.77) |
Geen |
||||
|
Afkortingen: A = aangedaan door ziektebeeld; BI = betrouwbaarheidsinterval; BMI = body mass index; DM = diabetes mellitus; FU = follow-up; lft = leeftijd; N = aantal; NA = niet aangedaan door ziektebeeld; nb = niet bekend; OR = odds ratio; RR = relatief risico; VG = voorgeschiedenis; |
|||||||||||||||
|
Tabel 4.2.3: risico’s op het ontwikkelen van diabetes mellitus in vrouwen met PCOS vergeleken met vrouwen met zonder PCOS |
||||||||||||
|
Studie |
Definitie PCOS
|
N |
Gem FU (jr) |
Gem lft FU |
Definitie DM
|
Aantal vrouwen met DM (N) |
Gecorrigeerde risico (95% BI) |
Gecorrigeerd voor |
||||
|
A |
NA |
A |
NA |
A |
NA |
|||||||
|
Meta-analyse |
||||||||||||
|
Moran, 2010 |
NIH, R’dam |
441 |
63 |
Nb |
Nb |
Nb |
III/ IV/VIII/ IX |
19 |
63 |
OR 4.00 (1.97-8.10) |
BMI |
|
|
12 105 |
56 959 |
1063 |
1274 |
RR 3.93 (3.63-4.25) |
Geen |
|||||||
|
Cross-sectionele onderzoeken |
||||||||||||
|
Gambineri, 2012 |
NIH |
249 |
Nb |
16.9 |
45.9 |
Nb |
Nb |
39.3% |
5.8% |
Nb |
Nb |
|
|
Hudecova, 2011 |
R’dam |
84 |
87 |
13.9 |
43 |
43.7 |
II |
7 |
0 |
- |
Geen |
|
|
Iftikhar 2012 |
R’dam |
309 |
343 |
23.7 |
44.4 |
48.8 |
I, II, VIII |
2 |
9 |
RR 0.25 (0.05-1.13) |
|
|
|
Liang, 2012 |
R’dam |
220 |
70 |
NA |
26.9 |
28.3 |
III/IV |
11 |
1 |
RR 3.50 (0.46-26.63) |
Geen |
|
|
Lunde, 2007 |
WHOII, NIH, R’dam, AE |
131 |
723 |
15-25 |
Nb |
Nb |
II |
1 |
nb |
SIR 6.1 (2.2-13.0) |
|
|
|
Morgan, 2012 |
Read code classification (UK- huisarts) |
21 740 |
86 936 |
4.7/ 5.8 |
27.1 |
27.1 |
V |
713 |
969 |
OR 3.02 (2.73-3.33) |
Lft, aantal contacten met huisarts, BMI |
|
|
RR 2.94 (2.67-3.24) |
Geen |
|||||||||||
|
Schmidt 2011 |
R’dam |
32 |
95 |
19 |
70.4 |
70.7 |
II of VIII |
7 |
13 |
RR 1.60 (0.70-3.65) |
Geen |
|
|
Wang, 2011b |
NIH |
53 |
1074 |
18 |
38-50 |
II of IX |
12 |
137 |
OR 2.6 (1.3-5.3) |
Lft, ras, BMI baseline, educatie, pariteit, familieVG, DM, BMI |
||
|
RR 1.77 (1.05-2.99) |
Geen |
|||||||||||
|
Wild, 2000 |
WHO II, AE, R’dam |
319 |
1060 |
31 |
Nb |
Nb |
V/VIII |
22 |
32 |
OR 2.2 (0.9-5.2) |
BMI |
|
|
RR 2.28 (1.35-3.87) |
||||||||||||
|
Wiltgen, 2010 |
NIH/ R’dam |
195 |
25 |
NA |
22.3 |
29.7 |
VII |
7 |
0 |
- |
Geen |
|
|
Afkortingen: A = aangedaan door ziektebeeld; BI = betrouwbaarheidsinterval; BMI = body mass index; DM = diabetes mellitus; FU = follow-up; lft = leeftijd; N = aantal; NA = niet aangedaan door ziektebeeld; nb = niet bekend; OR = odds ratio; RR = relatief risico; SIR = standardized incidence ratio; VG = voorgeschiedenis;
Definitie DM: I zelfrapportage; II medicatie gebruik; III nuchtere glucose ≥ 7.0 mmol/l; IV random glucose ≥ 11.1 mmol/l; V ICD-9 codes; VI WHO; criteria; VII = onbekend; VIII medisch dossier; IX nuchtere glucose ≥ 9.0 mmol |
||||||||||||
|
Tabel 4.2.4.: risico’s op het ontwikkelen van het metabool syndroom in vrouwen met PCOS in vergelijking met vrouwen zonder PCOS |
|||||||||||||||
|
Studie |
Definitie PCOS
|
N |
Gem FU (jr) |
Gem lft FU |
Definitie MetS |
Aantal vrouwen met MetS(N) |
Gecorrigeerde risico (95% BI) |
Gecorrigeerd voor |
|||||||
|
A |
NA |
A |
NA |
A |
NA |
||||||||||
|
Meta-analyses |
|||||||||||||||
|
Moran, 2010 |
NIH/ R’dam |
273 |
276 |
Nb
|
NB |
I - IV |
61 |
37 |
OR 2.20 (1.36-3.56) |
BMI |
|||||
|
2256 |
4130 |
508 |
731 |
RR 1.27 (1.15-1.41) |
Geen |
||||||||||
|
Onderzoeken met patiënten series waarin vrouwen met PCOS zijn vergeleken met vrouwen zonder PCOS |
|||||||||||||||
|
Liang, 2012 |
R’dam |
220 |
70 |
Nb |
26.9 |
28.3 |
I |
66 |
10 |
RR 2.10 (1.14-3.86) |
Geen |
||||
|
Wiltgen, 2010 |
NIH/ R’dam |
195 |
25 |
Nb |
22.3 |
29.7 |
I |
61 |
0 |
- |
Geen |
||||
|
Hudecova, 2011 |
R’dam |
84 |
87 |
13.9 |
43 |
43.7 |
I |
22 |
7 |
RR 2.96 (1.30-6.76) |
Geen |
||||
|
Rahmanpout, 2012 |
NIH |
30 |
71 |
Nb |
17.7 |
17.7 |
IV |
10 |
8 |
RR 2.96 (1.30-6.76) |
Geen |
||||
|
Afkortingen: A = aangedaan door ziektebeeld; BI = betrouwbaarheidsinterval; BMI = body mass index; FU = follow-up; lft = leeftijd; MetS = metabool syndroom; N = aantal; NA = niet aangedaan door ziektebeeld; nb = niet bekend; OR = odds ratio; RR = relatief risico Definitie metabool syndroom: I Adult Treatment Panel III (ATPIII); II American Heart Association/National Heart Lung Blood Institute (AHA); III World Health Organization (WHO); IV International Diabetes Federation (IDF) |
|||||||||||||||
|
Tabel 4.2.5.: risico’s op het ontwikkelen van dyslipidemie in PCOS in de voorgeschiedenis vergeleken met vrouwen zonder PCOS in de voorgeschiedenis |
|||||||||||
|
Studie |
Definitie PCOS
|
N |
Gem FU (jr) |
Gem lft FU |
Definitie dyslip |
Aantal vrouwen met dyslipidemie (N) |
Gecorrigeerde risico (95% BI) |
Gecorrigeerd voor |
|||
|
A |
NA |
A |
NA |
A |
NA |
||||||
|
Onderzoeken met patiënten series waarin vrouwen met PCOS zijn vergeleken met vrouwen zonder PCOS |
|||||||||||
|
Hudecova, 2011 |
R’dam |
84 |
87 |
13.9 |
43 |
43.7 |
IV |
18 |
7 |
RR 2.66 (1.17-6.05) |
Geen |
|
Liang, 2012 |
R’dam |
220 |
70 |
NA |
26.9 |
28.3 |
IV |
29 |
3 |
RR 3.08 (0.97-9.79) |
Geen |
|
Schmidt 2011 |
R’dam |
25 |
68 |
19 |
70.4 |
70.7 |
II |
6 |
18 |
RR 0.91 (0.41-2.02) |
Geen |
|
Shaw, 2008 |
WHOII, NIH, R’dam, AE |
104 |
286 |
6 |
62.5 |
65.8 |
Nb |
64 |
166 |
RR 1.06 (0.88-1.27) |
Geen |
|
Wang, 2011b |
NIH |
53 |
1074 |
18 |
38-50 |
II/V/VII/VIII |
18 |
238 |
OR 2.0 (1.0-3.9) |
Lft, ras, BMI baseline, educatie, pariteit, familievoorgeschiedenis DM, BMI |
|
|
Wild, 2000 |
WHO II, AE, R’dam |
319 |
1060 |
31 |
Nb |
Nb |
IX |
Nb |
Nb |
OR 3.2 (1.7-6.0) |
BMI |
|
Wiltgen, 2010 |
NIH/ R’dam |
195 |
25 |
NA |
22.3 |
29.7 |
IV |
45 |
4 |
RR 1.44 (0.57-3.67) |
Geen |
|
Afkortingen: A = aangedaan door ziektebeeld; BMI = body mass index; NA = niet aangedaan door ziektebeeld; nb = niet bekend; Definitie dyslipidemie: I zelfrapportage; II medicatie gebruik; III cholesterol ≥5.0 mmol/l ; IV triglyceriden ≥1.7 mmol/l; V HDL ≤1.0 mmol/l; VI Totaal cholesterol ≥6.2 mmol/l; VII LDL >4.1 mmol/l; VIII triglyceriden ≥2.3 mmol/l; IX cholesterol ≥7.8 mmol/l |
|||||||||||
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 01-01-2014
Laatst geautoriseerd : 01-01-2014
Geplande herbeoordeling : 01-01-2017
Omdat deze richtlijn modulair is opgebouwd, kan herziening op onderdelen eenvoudig plaatsvinden.
De richtlijn zal waarschijnlijk in 2016 al voor de eerste keer worden herzien, als nieuwe gegevens van ten tijde van de richtlijnontwikkeling lopende studies beschikbaar komen. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn om een herzieningstraject te starten.
De Nederlandse Vereniging voor Obstetrie en Gynaecologie is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
Deze richtlijn is tot stand gekomen met ondersteuning van de Afdeling Ondersteuning Professionele Kwaliteit van de Orde van Medisch Specialisten en met financiële steun van SKMS.
INITIATIEF
Nederlandse Vereniging voor Obstetrie en Gynaecologie
IN SAMENWERKING MET
Nederlands Huisartsen Genootschap
Nederlandse Vereniging voor Cardiologie
Nederlandse Internisten Vereniging
Nederlandse Vereniging voor Neurologie
Nederlandse Vereniging voor Radiologie
MET ONDERSTEUNING VAN
Orde van Medisch Specialisten
FINANCIERING
De richtlijnontwikkeling werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS)
Doel en doelgroep
Doelstelling
Het doel van deze richtlijn is (a) inventariseren van de beschikbare kennis over cardiovasculaire risicofactoren en het risico op cardiovasculaire morbiditeit en mortaliteit bij vrouwen met in het verleden opgetreden of vastgestelde reproductieve aandoeningen (zwangerschapshypertensie, pre-eclampsie, herhaald miskraam, vroeggeboorte, groeibeperkt kind, PCOS en/of POI); (b) opstellen van aanbevelingen voor multidisciplinair cardiovasculair risicomanagement (diagnostiek en therapie) op maat bij deze vrouwen, zoveel mogelijk aansluitend bij de bestaande NHG standaard CVRM; (c) ontwikkelen van consensus over de taakverdeling tussen de verschillende disciplines die betrokken zijn bij dit cardiovasculair risicomanagement, alsmede over indicaties voor doorverwijzing, aangezien dit buiten het traditionele kennisgebied van de gynaecoloog valt; en (d) identificeren van belangrijke hiaten in de huidige kennis op dit gebied.
Patiëntencategorie
De richtlijn geldt voor: (a) alle vrouwen die een zwangerschap hebben doorgemaakt die werd gecompliceerd door zwangerschapshypertensie, pre-eclampsie, vroeggeboorte of groeibeperkt kind; (b) vrouwen met een herhaalde miskraam, prematuur ovariële insufficiëntie of polycysteus ovarium syndroom.
Doelgroep en gebruikers
De richtlijn beoogt zorgverleners die betrokken zijn bij de zorg voor vrouwen met een doorgemaakte of aanwezige reproductieve aandoening (zwangerschapshypertensie, pre-eclampsie, vroeggeboorte, intra-uteriene groeivertraging, herhaald miskraam, prematuur ovariële insufficiëntie en polycysteus ovarium syndroom) zoals gynaecologen, huisartsen, (vasculair) internisten, cardiologen, radiologen en neurologen te voorzien van een landelijke, door alle betrokken beroepsverenigingen gedragen richtlijn. Deze richtlijn voldoet aan de eisen van een AGREE-instrument volgens de EBRO-methode en geeft inzicht in de huidige kennis over het cardiovasculaire risico van vrouwen met zwangerschapshypertensie, pre-eclampsie, vroeggeboorte, intra-uteriene groeivertraging, herhaald miskraam, prematuur ovariële insufficiëntie en polycysteus ovarium syndroom. Ook geeft de richtlijn aanbevelingen voor adequate diagnostiek van verhoogd risico en voor behandeling van deze vrouwen. De richtlijn voorziet in de meest recente 'evidencebased' informatie en beoogt de onduidelijkheid en onzekerheid te verminderen over cardiovasculair risicomanagement bij vrouwen met een reproductieve aandoening.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2012 een multidisciplinaire werkgroep ingesteld bestaande uit vertegenwoordigers van de relevante beroepsgroepen die betrokken zijn bij het zorgproces in de eerste, tweede en derde lijn van vrouwen met zwangerschapshypertensie, pre-eclampsie, vroeggeboorte, groeibeperkt kind, herhaald miskraam, primair ovariële insufficiëntie en polycysteus ovarium syndroom. Deze beroepsgroepen zijn de Nederlandse Vereniging voor Obstetrie & Gynaecologie (NVOG), het Nederlands Huisartsen Genootschap (NHG), de Nederlandse Vereniging voor Radiologie (NVvR), de Nederlandse Internisten Vereniging (NIV) en de Nederlandse Vereniging voor Cardiologie (NVvC). De werkgroepleden (zie samenstelling van de werkgroep op pagina 3) waren door de bovengenoemde wetenschappelijke verenigingen gemandateerd voor deelname aan deze werkgroep. De werkgroepleden zijn gezamenlijk verantwoordelijk voor de integrale tekst van deze conceptrichtlijn. De Nederlandse Vereniging voor Neurologie (NVN) en patiëntenvereniging Stichting HELLP-syndroom hadden geen zitting in de werkgroep maar zijn wel geraadpleegd bij de ontwikkeling.
- Dhr. A. Franx, gynaecoloog, Universitair Medisch Centrum Utrecht, Utrecht (voorzitter)
- Dhr. M.L. Bots, arts-epidemioloog, Julius Centrum voor Gezondheidswetenschappen en Eerstelijns Geneeskunde, Utrecht
- Mw. M. Cohen, huisarts, Amsterdam
- Mw. F.M. van Dunné, gynaecoloog, Medisch Centrum Haaglanden, Den Haag
- Mw. C.J.M. de Groot, gynaecoloog, Vrije Universiteit Medisch Centrum, Amsterdam
- Mw. N.M. Hammoud, AIOS gynaecologie, Universitair Medisch Centrum Utrecht, Utrecht
- Mw. A. Hoek, gynaecoloog, Universitair Medisch Centrum Groningen, Groningen
- Dhr. J.S.E. Laven, gynaecoloog, Erasmus Medisch Centrum, Rotterdam
- Mw. A.H.E.M. Maas, cardioloog, Radboud Universitair Medisch Centrum, Nijmegen
- Mw. J. Roeters van Lennep, internist, Erasmus Medisch Centrum, Rotterdam
- Mw. B.K. Velthuis, radioloog, Universitair Medisch Centrum Utrecht, Utrecht
- Dhr. T.A. van Barneveld, klinisch epidemioloog, Orde van Medisch Specialisten, Utrecht
- Dhr. K.Y. Heida, richtlijnondersteuner Nederlandse Vereniging van Obstetrie en Gynaecologie, Utrecht
Extern advies:
- Dhr. Y. B.W.E.M. Roos, neuroloog, Academisch Medisch Centrum, Amsterdam
- Mw. M. Wessels, informatiespecialist, Orde van Medisch Specialisten, Utrecht
- Mw. C. De Groot, voorzitter Stichting HELLP-syndroom
Belangenverklaringen
De belangen van de werkgroepleden werden geïnventariseerd met het door KNAW, KNMG en OMS opgestelde belangenverklaringsformulier. De gemelde belangen zijn besproken in de werkgroep en met vertegenwoordigers van het bestuur van de NVOG. Geconcludeerd werd dat de werkgroep evenwichtig was samengesteld en dat er geen bezwaren waren tegen deelname aan de werkgroep en besluitvorming (proportionaliteitsbeginsel, zie Code KNMG, KNAW).
Inbreng patiëntenperspectief
Voor de ontwikkeling van een goede richtlijn is de input van patiënten nodig. Een behandeling moet immers voldoen aan de wensen en eisen van patiënten en zorgverleners. Patiënten kunnen zorgverleners die een richtlijn ontwikkelen helpen om te begrijpen hoe het is om met een ziekte of aandoening te leven of om er mee geconfronteerd te worden. Op deze manier kan bij het ontwikkelen van een richtlijn beter rekening gehouden worden met de betekenis van verschillende vormen van diagnostiek, behandeling en zorg voor patiënten. Het in kaart brengen van de behoeften, wensen en ervaringen van patiënten met de behandeling biedt tevens de gelegenheid om de knelpunten in kaart te brengen. Wat zou er volgens patiënten beter kunnen? Een patiënt doorloopt het hele zorgtraject, een behandelaar ziet vaak slechts het stukje behandeling waarin hij zich heeft gespecialiseerd. Het is dus heel zinvol om voor verbetering van de kwaliteit van de behandeling ook knelpunten vanuit patiëntenperspectief in kaart te brengen. Bij deze richtlijn is er in de beginfase van de ontwikkeling een knelpuntenanalyse uitgevoerd door middel van een drietal groepsinterviews met patiënten (focusgroepen). Uit de praktijken van leden van de werkgroep en via de Stichting HELLP-syndroom werden patiënten met een pre-eclampsie in de voorgeschiedenis, PCOS of POI uitgenodigd om deel te nemen aan een van deze focusgroep bijeenkomsten. De verslagen van de focusgroepen zijn besproken binnen de werkgroep en de belangrijkste knelpunten die uit de verslagen naar voren kwamen zijn geadresseerd in de richtlijn. Het concept van de richtlijn is voor commentaar voorgelegd aan deelnemers van de focusgroep. Zie hieronder voor de focusgroep verslagen.
Verslag patiëntenfocusgroep ‘pre-eclampsie’
In dit document worden de aandachtspunten die volgden uit het focusgroepsgesprek van 13 december 2012 uitgelicht.
Doel van het focusgroepsgesprek
Vanuit het patiëntenperspectief inzichtelijk maken hoe de nazorg aan vrouwen, die een hypertensieve aandoening tijdens de zwangerschap hebben gehad, patiënt gerichter kan.
Deelneemsters aan het focusgroepgesprek
In samenwerking met de Stichting HELLP-syndroom, een patiëntenvereniging specifiek voor deze doelgroep, en werkgroepleden, werden deelnemers benaderd en geselecteerd. Er namen in totaal 7 vrouwen deel, waarbij de periode na de doorgemaakte pre-eclampsie varieerde van anderhalf tot 35 jaar.
De gespreksstructuur
Het gesprek werd gestructureerd door chronologisch het zorgproces door te spreken volgens een vast stramien: periode in het ziekenhuis, nazorg in het eerste jaar en nazorg op lange termijn. De belangrijkste aandachtspunten worden in dit verslag uitgelicht, gegroepeerd naar bovenstaande zorgmomenten.
Algemene punten voor verbetering van het multidisciplinaire zorgproces
Periode in het ziekenhuis
- Informatievoorziening in de periode dat de deelneemsters opgenomen lagen in het ziekenhuis met een hypertensieve aandoening, inclusief kraambed.
a) De ervaringen in de verschillende ziekenhuizen wisselden sterk, sommige deelneemsters werden continu goed geïnformeerd over de stand van zaken, terwijl één deelneemster er pas bij de zes weekse controle achterkwam dat ze een ernstige pre-eclampsie had. Iedereen geeft aan dat eerlijkheid gewaardeerd wordt.
b) Een deelneemster geeft aan dat nazorg al begint tijdens de opname. Als men daar minder steken laat vallen, dan heb je een betere nazorg.
c) Er wordt echter ook aangegeven dat de informatie die gegeven wordt, vaak niet opgeslagen wordt, aangezien ze op dat moment voornamelijk zijn gefocust op hun kind en niet op hun eigen gezondheid. Dit komt pas in een later stadium, maar hier dient wel rekening mee gehouden te worden door de hulpverleners. - Een terugkomende klacht is dat zo snel de baby geboren is, er geen aandacht meer is voor de moeder, ongeacht haar ziektebeeld. Tevens wordt de man vaak vergeten, terwijl het voor hem ook heel heftig is. Het is erg belangrijk om hem er ook bij te betrekken.
- De opvang door de afdeling neonatologie werd door allen als prettig ervaren, aangezien er goed geluisterd werd en er naar oplossingen werd gezocht.
- Er wordt geopperd om de ontslag brief niet alleen naar de huisarts te sturen, maar ook naar het consultatiebureau en bedrijfsarts, zodat er meer awareness en begrip is voor klachten die samenhangen met een doorgemaakte hypertensieve aandoening in de zwangerschap. Over het consultatiebureau is overigens niet iedereen het eens.
- In de ontslagbrief moet meer aandacht komen voor de overdracht aan de huisarts, zodat de nazorg voor de vrouwen een stuk beter is.
Nazorg in het eerste jaar - De deelneemsters geven aan erg onzeker te zijn na een doorgemaakte pre-eclampsie. Niet alleen laat je eigen lichaam je in de steek en duurt het lang voordat je weer op de been bent. Ook staan op internet beangstigende ervaringsverhalen van andere vrouwen.
- Alles huisartsen hebben een brief ontvangen over het verloop van de zwangerschap en bevalling. Bij een enkeling kwam de huisarts langs in het kraambed. Het contact bestond verder uit nog eenmalig de bloeddruk meten, maar verder was er geen follow-up.
- Controle 6 weken postpartum bij gynaecoloog
a) Bij de meeste deelneemster is er onvoldoende informatie gegeven over de langdurige gevolgen van een ernstige pre-eclampsie. Wat kunnen de vrouwen zowel lichamelijk als geestelijk verwachten? Veel gehoorde klachten zijn concentratiestoornissen, geheugenverlies en vermoeidheid. Het merendeel geeft aan niet meer op het oude niveau terug te kunnen komen.
b) Naonderzoek (bijvoorbeeld Prius in Nijmegen en Maastricht) is niet aangeboden aan iedereen.
c) Naast de standaard controle, 6 weken postpartum, is er ook behoefte aan een gesprek op een later tijdstip. Dit initiatief moet ook van de zorgverlener komen, aangezien veel vrouwen het allemaal zelf willen oplossen en zichzelf niet op de eerste plaats zetten.
d) Men is unaniem over de toegevoegde waarden van de Stichting HELPP- syndroom, aangezien ze daar veel informatie vandaan halen, bijvoorbeeld over hart- en vaatziekten op latere leeftijd. Ze zouden hier graag bij ontslag of bij de controle 6 weken postpartum over geïnformeerd worden. Dit zou ook in een patiëntenfolder aan bod kunnen komen. - Er is een duidelijke behoefte aan een patiëntenfolder/naslagboekje over het traject na een doorgemaakte pre-eclampsie. Niet alleen over de klachten die kunnen voorkomen, maar ook tot wie je je kan wenden bij welk probleem. Deze patiëntenfolder kan eventueel ook gebruikt worden bij overleg met de bedrijfsarts. Zo’n patiëntenfolder kan zowel in boekvorm als op een website.
- De vraag is wie in de nazorg een centrale rol moeten spelen, hierover zijn de meningen verdeeld. Een enkeling vind de gynaecoloog de aangewezen persoon, aangezien diegene vaker te maken heeft met dit soort patiënten. Terwijl een ander juist de huisarts noemt, maar niet iedereen heeft een even goede band met haar huisarts. Ook wordt medisch maatschappelijk werk als mogelijkheid genoemd. Het was niet voor iedereen bekend dat het mogelijk is om na ontslag uit het ziekenhuis alsnog contact op te nemen met maatschappelijk werk. Zij kunnen mogelijk ook nazorg groepen organiseren, zodat lotgenoten met elkaar in contact komen. Hier is ook duidelijk behoefte aan. Tot slot wordt het consultatiebureau geopperd als belangrijke schakel tussen de verschillende disciplines, maar er komt ook naar voren dat daar minder expertise is betreft de gezondheid van moeders.
- Er wordt meer begrip verwacht van de huisarts en gynaecoloog voor de klachten waarmee de deelneemsters te kampen hebben. Ook zouden ze, indien noodzakelijk, een juiste doorverwijzing krijgen naar bijvoorbeeld een diëtiste, fysiotherapeut, oogarts, neuroloog etc. Op dit moment is er weinig begrip voor hun klachten, dit in tegenstelling tot oncologie patiënten. Voor hen is er een uitgebreid nazorgtraject.
- Eén deelneemster wordt regelmatig gezien op een gecombineerd spreekuur met een gynaecoloog en internist. Er is dan niet alleen aandacht voor lichamelijke klachten, maar ook op het emotionele vlak. Zij is hier erg over te spreken.
- Door meerdere deelneemster wordt aangegeven dat ze het erg fijn zouden vinden om nog eens een rondleiding te krijgen door het ziekenhuis en verloskunde centrum om hetgeen er gebeurd is beter te kunnen verwerken.
- Ervaren wordt dat er weinig begrip is in de omgeving t.a.v. aanhoudende klachten zoals vermoeidheid en concentratieproblemen. Ze lopen hier tegen aan in hun vrienden- en familiekring, maar ook op het werk. De ziekte heeft een erg lange nasleep. Meerder deelneemsters hebben een burn-out gekregen.
- Er komt met name naar voren dat de deelneemsters gehoord willen worden. En dat er een gestructureerde manier van nazorg georganiseerd moet worden, waarin duidelijke informatie gegeven wordt en er indien nodig doorverwezen wordt.
Nazorg lange termijn - De deelneemsters willen graag een duidelijk nazorg traject Wanneer dienen ze voor te komen, op welke klachten moeten ze letten, welke testen moeten uitgevoerd worden. Deze verantwoordelijkheid moet bij de huisarts komen te liggen en niet bij henzelf.
- Ze zouden graag een advies op maat krijgen. Bijvoorbeeld leefstijl- en sportadviezen/begeleiding of gespreksgroepen. Hier dient zo vroeg mogelijk mee begonnen te worden, zodat vrouwen sneller in het arbeidstraject komen.
- De meesten van de deelneemsters voelen zich best gezond. Hier moet in de richtlijn wel rekening mee gehouden worden, want het is iets heel anders als je gaat werken vanuit de motivatie dat je ziek bent dan wanneer je gezond ben. Het uitgangspunt moet gezondheidsbevordering zijn.
Verslag patiëntenfocusgroep PCOS
In dit document worden de aandachtspunten die volgden uit het focusgroepsgesprek van 1 juli 2013 uitgelicht.
Doel van het focusgroepsgesprek
Vanuit het patiëntenperspectief inzichtelijk maken hoe de zorg aan vrouwen met het polycysteus ovarium syndroom (PCOS) patiënt gerichter kan.
Deelneemsters aan het focusgroepgesprek
Er bestaat tot dusver geen patiëntenvereniging specifiek voor deze doelgroep. Voor het organiseren van de focusgroep werden deelnemers daarom benaderd en geselecteerd door werkgroepleden. Er namen in totaal 7 vrouwen deel.
De gespreksstructuur
Het gesprek werd gestructureerd door chronologisch het zorgproces door te spreken volgens een vast stramien: stellen van diagnose, behandeling, voorlichting, nazorg en toekomst. De belangrijkste aandachtspunten worden in dit verslag uitgelicht, gegroepeerd naar bovenstaande zorgmomenten.
Algemene punten voor verbetering van het multidisciplinaire zorgproces
Diagnose
- De diagnose PCOS werd niet altijd tijdig gesteld ondanks dat er sprake was van klachten.
- Klachten die met name genoemd werden, zijn: overberharing, acné, onregelmatig en/of weinig tot niet menstrueren en een onvervulde kinderwens.
- De diagnose werd meestal gesteld door een gynaecoloog, maar een enkele keer door bijvoorbeeld een dermatoloog die geconsulteerd werd in verband met overbeharing, waarna een verwijzing naar de gynaecoloog volgde.
- De ervaring van de meeste deelneemster was dat door de huisarts weinig gesproken wordt over de menstruatie, waardoor de diagnose PCOS pas laat gesteld werd. Sommige gynaecologen gaven ook niet veel uitleg over PCOS nadat ze de diagnose gesteld hadden.
- Ook al is de frequentie en regelmaat van de menstruatie te beschouwen als afwijkend, toch wordt dit vaak als normaal beschouwd. Dit kan komen doordat vrouwelijke familieleden hetzelfde menstruatiepatroon hebben (gehad) of dat men ervan uitgaat dat met het ouder worden de menstruatie vanzelf regelmatig wordt.
- Vrouwen met PCOS hebben vaker een eetstoornis en last van stemmingswisselingen.
- Voor de meeste deelneemsters was het een opluchting dat de klachten die zij hadden, verklaarbaar waren.
Behandeling - Alle deelneemsters kregen ‘de pil’ (orale anticonceptiva) voorgeschreven. Ook kregen zij leefstijladviezen: gezond eten en sporten om af te vallen.
- Een enkele deelneemster kreeg het advies van de huisarts of internist om te stoppen met ‘de pil’ aangezien ze last hadden van depressieve gevoelens. Bij deze hulpverleners was echter niet bekend dat ‘de pil’ niet als anticonceptiemiddel voorgeschreven werd, maar in verband met PCOS.
- Eén deelneemster is verwezen naar een diëtiste, maar aangezien zij een normale voedselintake had, kon de diëtiste weinig voor haar betekenen.
- De meeste deelneemsters zijn goed op gewicht, maar kennen vrouwen met PCOS die ondanks veel sporten en een dieet, toch aankomen in gewicht.
- Bij kinderwens werd meestal ovulatie inductie toegepast en werd vaak uitgelegd dat overgewicht de uitkomsten nadelig kon beinvloeden.
Voorlichting - Er zou meer bekendheid bij huisartsen en andere specialisten moeten komen over PCOS. De ervaring van enkele deelneemsters is dat hun huisarts onjuiste informatie geeft, zoals dat het helemaal niet erg is als je niet ongesteld wordt, dat scheelt alleen maar ‘gezeik’.
- De deelneemsters van deze focusgroep ervaren PCOS als verzamelbak van veel symptomen, waarin ze zichzelf niet altijd even goed herkennen, aangezien ze vaak maar één of twee symptomen hebben.
- De meningen wisselen over het zelf halen of aangeboden krijgen van informatie. Het liefst willen de deelneemsters zelf bepalen wanneer ze over een bepaald onderwerp meer willen weten afhankelijk van de fase in hun leven, zoals bij een kinderwens.
- Er is weinig Nederlandstalige informatie over dit onderwerp, ondanks dat er een NVOG patiëntenfolder is. Deze vinden de deelneemsters echter te beknopt.
- Informatie zouden ze het liefst aangeboden krijgen via internet. Ook zou een mail waarin staat dat er nieuwe informatie beschikbaar is, gewaardeerd worden.
- De meeste deelneemsters hebben geen behoefte aan lotgenotencontact, maar zouden het wel fijn vinden als er een patiëntenvereniging zou bestaan die zou dienen als informatiepunt. Je kan dan als patiënt zelf bepalen of je behoefte hebt aan lotgenoten contact of als je naar een informatieavond wilt gaan of lotgenotencontact waarin je kan delen als gewoon inhoudelijke informatieve avonden. Voorkeur om dit van het ziekenhuis uit te laten gaan.
- Een andere vorm van informatievoorziening, zou een soort van chatbox zijn, waarin de patiënt vragen kan stellen aan de hulpverlener. Dan is het niet noodzakelijk om een afspraak te hebben op de poli en kunnen ze sneller antwoord krijgen als ze een vraag hebben.
- Aan de meesten is wel verteld dat er een hogere kans bestaat op het ontwikkelen van hart- en vaatziekten, maar er is niet diep op in gegaan en het werd vaak tegelijk met de diagnose PCOS medegedeeld. Het zou beter zijn als hier op een later moment op terug gekomen wordt.
- Informatie moet veel meer uitgewisseld worden onder specialisten en huisartsen. Als een patiënt bijvoorbeeld al onder controle is bij een internist, dan hoeft diegene geen extra cardiovasculaire check meer te krijgen.
- Een terugkerend item is het onderwerp ‘zorg op maat’. De deelneemsters willen niet alleen informatie die op dat moment belangrijk voor hen is, ook moet de hulpverlener zich aanpassen aan het intelligentieniveau van de patiënt.
- De ervaring van de deelneemsters is dat het bij PCOS vooral over een eventuele kinderwens gaat, daar richt de gezondheidszorg zich nu met name op. Ze hebben het idee dat PCOS pas van belang is als je zwanger wilt worden. Voor hun is het ook belangrijk om informatie te krijgen over PCOS als er geen kinderwens is. Wat betekent de diagnose PCOS dan voor je.
- Ook informatie voor familie is belangrijk, zij maken zich vaak nog meer zorgen dan de patiënt zelf.
Nazorg - In principe hebben de deelneemsters eens in de 2 jaar een controle bij de gynaecoloog. In de tussenperiode hebben ze regelmatig vragen, maar hiermee gaan ze niet naar de huisarts, want de deelneemsters vinden dat die niet voldoende weten over PCOS. Een digitaal spreekuur zou een uitkomst zijn.
Toekomst - Alle deelneemsters zijn zich bewust van het belang van een gezonde leefstijl.
- Indien er bepaalde risicofactoren aanwezig zijn op het krijgen van hart- en vaatziekten, zoals een te hoog cholesterol, dan is er onder de deelneemsters een wisselende bereidheid om te starten met medicatie. Dit is ook afhankelijk van hoe hoog het risico is op hart- en vaatziekten.
- Risicocommunicatie is erg belangrijk, risico’s zijn namelijk moeilijk in te schatten en te begrijpen. Daarom is het belangrijk dat de patiënt de risico’s kan visualiseren door bijvoorbeeld kleuren toe te kennen aan de hoogte van een risico. Verder is het is belangrijk om gezamenlijk tot een beslissing te komen.
- De zorg rond hart- en vaatziekten risico moet bij voorkeur bij de internist komen te liggen. De gynaecoloog ziet deze vrouwen echter vroeg in hun leven en kan de regie over het verdere zorgpad voeren.
Verslag patiëntenfocusgroep POI
In dit document worden de aandachtspunten die volgden uit het focusgroepsgesprek van 2 juli 2013 uitgelicht.
Doel van het focusgroepsgesprek
Vanuit het patiëntenperspectief inzichtelijk maken hoe de zorg aan vrouwen met premature ovariële insufficiëntie (POI) patiënt gerichter kan.
Deelneemsters aan het focusgroepgesprek
Er bestaat tot dusver geen patiëntenvereniging specifiek voor deze doelgroep. Voor het organiseren van de focusgroep werden deelnemers daarom benaderd en geselecteerd door werkgroepleden. Er namen in totaal 7 vrouwen deel.
De gespreksstructuur
Het gesprek werd gestructureerd door chronologisch het zorgproces door te spreken volgens een vast stramien: stellen van diagnose, behandeling, voorlichting, nazorg en toekomst. De belangrijkste aandachtspunten worden in dit verslag uitgelicht, gegroepeerd naar bovenstaande zorgmomenten.
Algemene punten voor verbetering van het multidisciplinaire zorgproces
Diagnose
- De diagnose POI werd meestal gesteld nadat de deelneemsters zich meldden met de volgende klachten: ongewenste kinderloosheid of bij het opeens optreden van een onregelmatige menstruatie of nadat de menstruatie opeens gestopt was terwijl die voorheen normaal blek te zijn geweest (dit laatste ook na het gebruik van orale anticonceptiva).
- Ook waren er deelneemsters die POI hebben ontwikkeld na chemotherapie. Zij kregen de mogelijkheid om eitjes in te laten vriezen, maar op jonge leeftijd is het erg moeilijk om deze beslissing te nemen aangezien er dan nog geen kinderwens is.
- De diagnose werd meestal gesteld door een gynaecoloog in een 2e lijns centrum, maar ook een enkele keer door de huisarts. De diagnose werd vaak niet of slechts ten dele medegedeeld. Meestal werd patiënten verteld dat de gynaecoloog het zelf niet zo goed begreep. Soms werd gezegd dat de tot dan toe gedane bevindingen niet konden kloppen en om die reden werd patiënte verwezen naar de 3e lijn. De deelneemsters kregen het gevoel dat de arts zelf ook schrok van de uitslagen van het bloedonderzoek en ze kregen nauwelijks uitleg over oorzaken en de gevolgen van POI.
- Eén deelneemster kreeg de diagnose te horen tijdens een telefonisch consult, dit heeft zij als zeer lomp ervaren.
- Ze kregen allen een doorverwijzing naar een gynaecoloog in een 3e lijns centrum. Een enkele deelneemster vraagt zich af of het ook mogelijk is om meteen doorgestuurd te worden naar een 3e lijn centrum in plaats van eerst naar een 2e lijns ziekenhuis. De ervaring is dat er meer expertise is in een 3e lijns centrum.
- De deelneemster waarderen een directe en eerlijke manier van communiceren.
Behandeling - De deelneemsters gebruiken eventueel orale anticonceptiva gezien de kleine kans om toch zwanger te worden. Meestal echter gebruikte men een hormoonsubstitutie preparaat. Sommigen zijn nog wel behandeld voor hun kinderwens terwijl dat bij anderen niet zinvol werd geacht, zij hebben daarom die behandeling niet gehad. Er was een deelneemster die ondanks de slechte prognose toch behandeld werd en ook een kind kreeg, dat is echter wel de uitzondering op de regel. Hormoonsubstitutie werd ook gegeven om overgangsklachten te verminderen. Sommigen gebruikten ook homeopathische middelen. Een enkeling was gestopt of had geen medicatie. Daarnaast werd ook vaak leefstijladviezen gegeven.
Voorlichting - Met allen is er is over hart- en vaatziekten gesproken en over botontkalking. Vooral dat laatste is benadrukt.
- Over het algemeen staat het onderwerp hart- en vaatziekten ver van de deelneemsters af, er is hun vertelt dat pas na het 40e levensjaar verdere controle volgen.
- Wat betreft informatie over hart- en vaatziekten is het advies gegeven om te sporten. Door de bijkomende overgangsklachten kan het echter wel extra zwaar zijn. Er is behoefte aan meer begeleiding en informatie over hoe je dit het beste kan combineren.
- Een deelneemster heeft de bloeduitslagen mee naar huis gekregen. Dit heeft haar goed geholpen bij de acceptatie van de diagnose POI. Bij twijfel pakt ze de uitslagen erbij en realiseert ze zich dat de waarden afwijkend zijn.
- Er is geen patiëntenvereniging voor vrouwen met POI, deelneemsters zouden wel behoefte hebben aan meer informatie, zowel patiëntspecifieke uitslagen als algemene informatie. En ze zouden graag op de hoogte willen zijn van de laatste ontwikkelingen op het gebied van onderzoek. De meeste deelneemsters zouden het fijn vinden als er een patiëntenvereniging zou bestaan die zou dienen als informatiepunt. Als patiënt kan je dan zelf bepalen of je behoefte hebt aan lotgenoten contact of naar een informatieavond wilt gaan.
- Informatie zouden ze het liefst aangeboden krijgen via internet, maar dit zou ook in de vorm van een standaard informatiepakket kunnen. Deze informatie kan ook nuttig zijn voor mensen in de directe omgeving.
- De meningen wisselen over het zelf halen of aangeboden krijgen van informatie. Het liefst willen de deelneemsters zelf bepalen wanneer ze over een bepaald onderwerp meer willen weten afhankelijk van de fase in hun leven.
Nazorg - Eén deelneemsters heeft positieve ervaring met de Mammacare verpleegkundige in het omgaan met stress in relatie tot overgangsklachten.
- Niet aan iedereen is nazorg aangeboden bij een psycholoog of medisch maatschappelijk werk, maar deelneemsters geven aan dat ze er gebruik van willen maken wanneer zij daar zelf behoefte aan hebben. Ze staan er wel positief tegenover, want het kan prettig zijn om met een onafhankelijk persoon te praten, waarbij je geen rekening hoeft te houden met de gevoelens van diegene.
- Het wordt gewaardeerd als de polikliniek voor patiënten met POI gescheiden is van de zwangere poli.
Toekomst - De meeste deelneemsters blijven tegen beter weten in toch hopen dat er misschien nog ‘een verdwaald eitje’ zit.
- Als er iemand in de omgeving zwanger is of al kinderen heeft, kunnen de meeste deelneemsters hier mee omgaan, maar ze blijven het er wel moeilijk mee hebben. Ieder heeft zijn eigen manier om hier mee om te gaan.
- De mening over klachten die samenhangen met POI zijn wisselend. Sommigen hebben helemaal geen klachten, anderen noemen minder energie, concentratiestoornissen en verandering van het karakter als klachten die samenhangen met POI.
Deelneemsters kunnen er goed met de omgeving over praten, ze merken dat er begrip is voor hun situatie, maar echt begrijpen doen ze het niet.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is geprobeerd rekening te houden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. De richtlijn wordt verspreid onder alle relevante beroepsgroepen en ziekenhuizen. Daarnaast wordt patiëntenvoorlichtingsmateriaal ontwikkeld. Ook is de richtlijn te downloaden via de websites van de Nederlandse Vereniging voor Obstetrie en Gynaecologie (www.nvog.nl), de Nederlandse Vereniging voor Cardiologie (www.nvvc.nl), de Nederlandse Internisten Vereniging (www.internisten.nl) en de algemen richtlijnendatabase (www.richtlijnendatabase.nl).
Werkwijze
Werkwijze werkgroep
De werkgroep werkte gedurende twee jaar aan de totstandkoming van de conceptrichtlijn. De werkgroepleden zochten systematisch naar de literatuur en beoordeelden de kwaliteit en inhoud ervan. De richtlijnondersteuner maakte, in samenspraak met de subwerkgroep die voor elk hoofdstuk was aangesteld, bewijs (evidence)tabellen. Een samenvatting van het bewijs met de conclusies werd teruggekoppeld aan de gehele werkgroep waarna gezamenlijk de overige overwegingen en aanbevelingen werden geformuleerd. Tijdens vergaderingen werden teksten toegelicht en werd door de werkgroepleden meegedacht en gediscussieerd. De uiteindelijke teksten vormen samen de hier voorliggende conceptrichtlijn.
Methode richtlijnontwikkeling
Deze richtlijn is opgesteld aan de hand van het “Appraisal of Guidelines for Research & Evaluation” (AGREE) instrument (www.agreecollaboration.org). Dit instrument is een breed (internationaal) geaccepteerd instrument voor de beoordeling van de kwaliteit van richtlijnen.
Knelpuntenanalyse /invitational conference
De werkgroep heeft een analyse gemaakt van knelpunten die aanknopingspunten bieden voor de verbetering van de zorg voor vrouwen die een zwangerschap hebben doorgemaakt die werd gecompliceerd door zwangerschapshypertensie, pre-eclampsie, vroeggeboorte of een groeibeperkt kind of vrouwen met een herhaalde miskraam, prematuur ovariële insufficiëntie of polycysteus ovarium syndroom. Op basis hiervan is een concept raamwerk van de in de richtlijn te bespreken onderwerpen opgesteld. Om de richtlijn zoveel mogelijk te laten aansluiten bij de dagelijkse praktijk is vervolgens een invitational conference georganiseerd. Hiervoor zijn diverse stakeholders, betrokken bij de zorg voor patiënten met een van deze reproductieve aandoeningen, uitgenodigd zoals: zorgverzekeraars, de Inspectie voor de Gezondheidszorg (IGZ) , patiëntenorganisaties, organisaties van zorginstellingen en het College voor Zorgverzekeringen (CVZ). Met deze partijen is het door de werkgroep opgestelde raamwerk besproken en nader geëxpliciteerd. Ook zijn stakeholders gevraagd aanvullingen te geven en zijn hun verwachtingen over de richtlijn en het richtlijnontwikkelingsproces geïnventariseerd. De werkgroep heeft vervolgens een prioritering aangebracht van in de richtlijn te behandelen onderwerpen en het raamwerk van de richtlijn definitief vastgesteld.
Strategie voor zoeken naar literatuur
Er werd eerst oriënterend gezocht naar bestaande richtlijnen (http://www.guideline.gov/, http://www.nice.org.uk/, http://www.cbo.nl/thema/Richtlijnen/, SUMsearch: http://sumsearch.uthscsa.edu/ en http://www.sign.ac.uk/) en naar systematische reviews in de Cochrane Library en via SUMsearch. Vervolgens werd er voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in de elektronische databases Medline en Embase. Tevens werd aanvullend handmatig gezocht naar studies aan de hand van de literatuurlijsten van de opgevraagde artikelen. De gebruikte zoektermen staan in bijlage 5, zoekverantwoording.
Definiëren klinisch relevante uitkomstmaten en acceptabele meetinstrumenten hiervoor
Alvorens te starten met de literatuurselectie werden door de werkgroep klinisch relevante uitkomstmaten en acceptabele meetinstrumenten gedefinieerd. Ook definities voor andere relevante variabelen werden afgestemd. Zie voor de uitwerking hiervan verderop in dit hoofdstuk onder het kopje ‘Uitkomstmaten’ (blz 13) en hoofdstuk 3 ‘Definities’ (blz 21).
Literatuurselectie
Per uitgangsvraag werden ten minste twee werkgroepleden aangesteld om onafhankelijk van elkaar de literatuur te beoordelen op relevantie.
Bij deze selectie van titel en abstract werden de volgende exclusiecriteria gehanteerd:
- niet van toepassing op de vraagstelling;
- niet vergelijkbaar met de Nederlandse populatie;
- niet-gedefinieerde uitkomstmaat;
- minder dan 10 vrouwen in de onderzoekspopulatie (imprecisie);
- niet-primair onderzoek;
- case reports, case series, letters, abstracts.
Beoordeling van de kwaliteit van studies
Na selectie door de werkgroepleden bleven de artikelen over die als onderbouwing bij de verschillende conclusies staan vermeld. De geselecteerde artikelen zijn vervolgens door minimaal twee werkgroepleden op volledige tekstinhoud beoordeeld en daarna beoordeeld op kwaliteit van het onderzoek en gegradeerd naar mate van bewijs. Hierbij is de indeling gebruikt, zoals weergegeven in tabel 1.1.
De beoordeling van de verschillende artikelen vindt u in de verschillende teksten terug onder het kopje ‘Samenvatting van de literatuur’. De richtlijnondersteuner maakte in samenspraak met de subgroepen per uitgangsvraag evidencetabellen (zie bijlage 6) van de geselecteerde individuele studies als hulpmiddel bij het beoordelen en samenvatten van deze studies. Vervolgens werd de kwaliteit van de evidence op het niveau van de systematische review beoordeeld. Met de kwaliteit van de evidence wordt bedoeld in hoeverre er vertrouwen is dat de aanbevelingen gebaseerd kunnen worden op de (effectschatting van de) evidence. Het wetenschappelijk bewijs is vervolgens kort samengevat in de ‘conclusies uit de literatuur’. De belangrijkste literatuur waarop deze conclusies zijn gebaseerd staat bij de conclusies vermeld, inclusief de EBRO-gradering van bewijs. Voor deze richtlijn hebben we geen gebruik gemaakt van de GRADE-methode, omdat GRADE momenteel alleen geschikt is voor het beoordelen van vergelijkend interventieonderzoek. Voor het beoordelen van diagnostisch accuratesse onderzoek of onderzoeken met een etiologische of prognostische vraagstelling blijft de ‘reguliere’ EBRO-beoordelingsmethode van toepassing.
Bij de EBRO-methode worden studies individueel beoordeeld op methodologische kwaliteit (onderzoeksopzet/studiedesign). Naar aanleiding van deze beoordeling wordt elke studie ingedeeld naar mate van bewijs volgens de classificatie in tabel 1.1. Studies van niveau A1 hebben de hoogste mate van bewijs en niveau D staat voor de laagste bewijskracht.
Tabel 1.1: EBRO-indeling van methodologische kwaliteit van individuele studies
|
Bewijskrachtniveau |
Interventieonderzoek |
Onderzoek naar diagnostische accuratesse |
Schade of bijwerkingen, etiologie, prognose |
|
|
A1 |
systematische review/meta-analyse van ten minste 2 onafhankelijk van elkaar uitgevoerde onderzoeken van A2-niveau |
|||
|
A2
|
gerandomiseerd dubbelblind vergelijkend klinisch onderzoek van goede kwaliteit van voldoende omvang
|
onderzoek t.o.v. een referentietest (‘gouden standaard’) met tevoren gedefinieerde afkapwaarden en onafhankelijke beoordeling van resultaten, met voldoende grote serie van opeenvolgende patiënten die allen de index- en referentietest hebben gehad |
prospectief cohortonderzoek van voldoende omvang en follow-up, waarbij adequaat gecontroleerd is voor ‘confounding’ en selectieve follow-up voldoende is uitgesloten
|
|
|
B |
vergelijkend onderzoek, maar niet met alle kenmerken als genoemd onder A2 (ook patiënt-controleonderzoek, cohortonderzoek) |
onderzoek t.o.v. een referentietest, maar niet met alle kenmerken die onder A2 zijn genoemd |
prospectief cohortonderzoek, maar niet met alle kenmerken als genoemd onder A2 of retrospectief cohortonderzoek of patiënt-controleonderzoek |
|
|
C |
niet-vergelijkend onderzoek |
|||
|
D |
mening van deskundigen |
|||
Formuleren van aanbevelingen
Nadat de gegevens uit de evidencetabellen werden samengevat als tekst werden hieruit conclusies getrokken. Om vervolgens tot een gewogen aanbeveling te komen werden de overige overwegingen besproken en geformuleerd. Dit is van belang omdat voor een aanbeveling naast het wetenschappelijke bewijs ook nog andere aspecten in mee gewogen horen te worden zoals patiëntenvoorkeuren, frequentie en ernst van aandoening, kosten, beschikbaarheid van voorzieningen of organisatorische aspecten. Bij de overwegingen spelen de ervaring en opvattingen van de werkgroepleden een rol bij het ontbreken van wetenschappelijk bewijs. De ‘aanbevelingen’ geven een antwoord op de uitgangsvraag en zijn gebaseerd op zowel het beschikbare wetenschappelijke bewijs als op de belangrijkste overwegingen. De gebruikte methodiek voor richtlijnontwikkeling verhoogt de transparantie van de totstandkoming van de aanbevelingen in deze richtlijn.
Uitkomstmaten
Bij de beoordeling van de literatuur heeft de werkgroep vooral gekeken naar studies waarbij naar inzicht van de werkgroepleden klinisch relevante uitkomstmaten gebruikt werden.
Om pragmatische redenen zijn hierbij de definities uit de gevonden literatuur overgenomen.
Tabel 1.2 Uitkomstmaten en gebruikte definities
|
Uitkomstmaten |
Gekozen meetinstrumenten
|
|
Cardiovasculaire gebeurtenissen |
Sterfte aan een cardiovasculaire oorzaak, en niet fatale, myocardinfarct, coronaire hartziekte, beroerte (CVA), decompensatio cordis, nierfalen, perifeer vaatlijden, angina pectoris, aneurysma aortae. |
|
Risicofactoren |
Hypertensie, diabetes mellitus type 2, dyslipidemie |
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
