Hyperkaliëmie bij chronische nierschade
Uitgangsvraag
Is het afkappunt om het serum kalium niet tot >5,5 mmol/l te laten stijgen om (cardiovasculaire) mortaliteit voorkomen terecht?
Aanbeveling
Bij patiënten met chronische nierschade dient het serum kalium niet tot boven de 5,5 mmol/l te stijgen aangezien dit aanleiding kan geven tot hartritmestoornissen en derhalve geassocieerd is met sterfte en cardiovasculaire events.
Tot de te nemen maatregelen bij een hyperkaliëmie horen het aanpassen van het dieet, het aanpassen of staken van kaliumverhogende medicamenten en de behandeling van een metabole acidose. Tevens kan het gebruik van kationenwisselaars worden overwogen. Indien een kationwisselaar wordt voorgeschreven heeft een calciumhoudende variant de voorkeur.
Belangrijkste veranderingen t.o.v. NfN richtlijn chronische nierschade 2009:
- Dit onderwerp maakte geen deel uit van de vorige richtlijn.
Overwegingen
Hyperkaliëmie is een beruchte complicatie bij chronische nierschade en kan leiden tot fatale ritmestoornissen. Het sterfterisico is niet gerelateerd aan klachten van de patiënt maar wordt weerspiegeld door veranderingen in de cardiale geleiding hetgeen tot uiting komt in het ECG. ECG veranderingen correleren vaak met de mate van hyperkaliëmie, maar de progressie van milde naar ernstige afwijkingen kan onvoorspelbaar verlopen en een normaal ECG sluit het later alsnog optreden van ritmestoornissen niet uit. De snelheid van verandering in het serum kalium speelt hierin vaak een grote rol.
Het serum kaliumgehalte blijft doorgaans binnen normale grenzen tot de eGFR <15 ml/min/1,73 m2 daalt of oligurie optreedt. Hyperkaliëmie kan echter eerder optreden bij metabole acidose, bij patiënten met diabetes mellitus en tubulo-interstitiële aandoeningen, en bij gebruik van kaliumhoudende voedingsmiddelen en/of bepaalde medicamenten (o.a. kaliumsparende diuretica inclusief aldosteronreceptor antagonisten, ACE-remmers, angiotensinereceptor blokkers, directe renineremmers, NSAID’s, ß-blokkers, trimethoprim, calcineurineremmers).
Patiënten met chronische nierschade lijken een (milde) hyperkaliëmie beter te tolereren m.b.t. cardiale (ritme-) problemen dan individuen met een normale nierfunctie, met name als deze chronisch aanwezig is. Verder vormt een relatief laag(-normaal) serum kalium ook een risico. Uit een observationele studie bij patiënten met CNS blijkt dat het risico op sterfte en cardiovasculaire events bij een serum kalium <4 mmol/l significant verhoogd was t.o.v. waardes tussen de 4,1 en 5,5 mmol/l, terwijl bij waardes tussen de 5,5 en 5,9 mmol/l het risico slechts minimaal verhoogd was (Kargaonkar 2010).
Alhoewel het bewijs voor het strikt handhaven van een bovengrens voor het serum kalium bij patiënten met chronische nierschade zwak is, er in de literatuur geen eenduidige groep te definiëren is bij wie het risico (absoluut en relatief) met name verhoogd is, en de risico’s vooral lijken te bestaan bij een serum kalium ≥6,0 mmol/l kiest de werkgroep er voor als advies om bij patiënten met CNS ongeacht het stadium het serum kalium niet routinematig te laten stijgen tot >5,5 mmol/l. Reden voor dit advies is dat de literatuur in veel gevallen een verhoogd risico boven deze waarde aangeeft, de gevolgen zeer ernstig kunnen zijn en omdat het serum kalium onder invloed van dieet nog wel eens kan fluctueren, hetgeen maar matig te controleren is, met name bij matig tot ernstig verstoorde nierfunctie.
Het risico op het ontstaan van een hyperkaliëmie na start van een ACE-remmer of een angiotensine-II-receptorblokker lijkt mee te vallen. De werkgroep adviseert om 1-2 weken na start van deze medicatie naast controle van het serum creatinine ook controle van het serum kalium te laten verrichten. Gezien het feit dat ACE-remmers en angiotensine-II-receptorblokkers frequent worden voorgeschreven, de aanwezige kans op ontstaan van een hyperkaliëmie en de beperkte extra belasting, adviseert de werkgroep om op dit moment ook het serum kalium te laten bepalen.
T.a.v. de behandeling van hyperkaliëmie bestaan de opties uit het verlagen van de kaliuminname met het dieet tot 2000 - 3000 mg of 50-75 mmol per dag door dieetadvies [Fouque, 2007], het behandelen van een metabole acidose en het aanpassen van kaliumverhogende medicatie (zie hierboven voor een opsomming). Eventueel kan het gebruik van kationenwisselaars worden overwogen. Met betrekking tot dit laatste zijn natrium-polystyreensulfonaat en calciumpolystyreensulfonaat beschikbaar, waarbij de eerste iets meer dan 60 mmol natrium per 15 gram bevat, hetgeen een flinke natriumbelasting vormt. De werkgroep adviseert dan ook bij voorkeur de calciumhoudende variant te gebruiken. Beiden werken na 1 uur en de werking houdt ongeveer 6 uur aan. Bijwerkingen van deze middelen komen frequent voor, met name van gastro-intestinale aard (misselijkheid, braken, diarree of obstipatie) en de meeste patiënten ervaren een vieze, zanderige smaak. Verder dient te worden opgemerkt dat het bewijs voor de effectiviteit van kationenwisselaars zeer mager is, [Harel 2013] en dat toediening rectaal en met name bij bijmenging van sorbitol (wat in Nederland niet het geval is) schadelijk kan zijn (risico op darmperforatie). Twee recente placebogecontroleerde fase 2 studies naar nieuwe kationenwisselaars, patiromer en natrium zirconium cyclosilicate, tonen goede resultaten bij patiënten met chronische nierschade [Packham, 2015; Weir 2015]. Bij het schrijven van deze module zijn deze middelen nog niet geregistreerd en/of verkrijgbaar, en is de evidence rondom deze middelen nog niet meegewogen bij de formulering van de aanbevelingen.
Onderbouwing
Conclusies
|
LAAG |
Een verhoogd serum kalium is geassocieerd met het optreden van cardiovasculaire events en sterfte bij personen met chronische nierschade, waarbij de bewijskracht voor een duidelijk afkappunt laag is. Einhorn, 2009; Heersprink, 2014; Jain, 2012; Korgaonkar, 2010; Lee, 2014; Luo, 2016 |
Samenvatting literatuur
Ash et al. voerden een fase II studie uit bij 90 patiënten met eGFR tussen 30 en 60 ml/min/1,73m2 en serumkalium tussen 5,0 en 6,0 mmol/L [Ash, 2015]. Zij onderzochten de effectiviteit van ZS-9 (sodium zirconium cyclosilicate) in verschillende doseringen vergeleken met placebo gedurende twee tot vier dagen. In dit onderzoek werd gekeken naar invloed op het serum kalium en overige serumparameters en naar bijwerkingen. In dit onderzoek is niet gekeken naar de invloed van het middel op hartritmestoornissen, en dit artikel geeft derhalve geen antwoord op de uitgangsvraag. De artikelen van Dunn et al. en Lazich et al. bleken bij bestudering van de fulltekst narratieve reviews en derhalve geen systematisch onderzoek [Dunn, 2015; Lazich, 2014]. Deze artikelen kunnen niet gebruikt worden voor de beantwoording van deze uitgangsvraag. Chernin et al. onderzochten het effect van sodium polystyreen sulfonaat bij patiënten met chronische nierschade en hart- en vaatziekten, die ten minste één episode van hyperkaliëmie (K>6 mmol/L) hadden gehad en met RAAS-I therapie werden behandeld [Chernin, 2012]. Dit betrof een retrospectief onderzoek onder veertien patiënten. Na een mediane follow-up van 14,5 maanden was er weliswaar een daling van het serumkalium (van 6,4 ± 0,3 naar 4,6 ± 0,6), maar er is niet bestudeerd welke invloed dit had op het optreden van hartritmestoornissen. Hwang et al. bestudeerden het risico op mortaliteit bij patiënten met chronische nierschade en hemodialyse en hypokaliëmie [Hwang, 2011]. In dit onderzoek zijn weliswaar patiënten met hyperkaliëmie geïncludeerd, maar hierbij zijn geen conclusies te trekken over preventie van hartritmestoornissen in deze groep. Het artikel van Preston et al. handelt over mechanismen van kaliumstofwisseling bij patiënten met chronische nierschade en de effecten van RAAS blokkade daarop [Preston, 2009]. In dit onderzoek werden geen voor deze uitgangsvraag relevante uitkomstmaten betrokken. Datzelfde geldt voor het onderzoek van Wang et al., dat zich bovendien met name richt op hypokaliëmie [Wang, 2013]. Weir et al. onderzochten het effect van patiromer bij patiënten met chronische nierschade en hyperkaliëmie, die met RAAS blokkers werden behandeld [Weir, 2015]. Ook in dit onderzoek werd niet gekeken naar voor deze uitgangsvraag relevante uitkomstmaten.
In het onderzoek van Einhorn et al. is de incidentie van hyperkaliëmie onderzocht bij patiënten met en zonder chronische nierschade die wel en niet met een RAAS-remmer behandeld werden, waarbij werd gekeken naar de mortaliteit [Einhorn, 2009]. Dit onderzoek is een retrospectief onderzoek onder 245.808 patiënten. Hyperkaliëmie werd gedefinieerd als serum kalium ≥ 5,5 mmol/L en ernstige hyperkaliëmie als serum kalium ≥ 6,0 mmol/L. Uit dit onderzoek bleek dat chronische nierschade een belangrijke risicofactor voor hyperkaliëmie is. De odds ratio voor hyperkaliëmie wanneer werd vergeleken met patiënten zonder chronische nierschade was 2,14 (95% BI: 2,17-2,30) voor patiënten met chronische nierschade in stadium 3, 5,91 (95%BI: 5,63-6,20) in stadium 4 en 11,00 (95% BI: 10,34-11,69) voor stadium 5. Van alle patiënten overleed 2,4% binnen een dag nadat het serum kalium was bepaald. Bij patiënten met chronische nierschade was er een inverse relatie tussen het stadium van chronische nierschade en de kans op overlijden binnen een dag na bepalen van het serum kalium, ook bij ernstige hyperkaliëmie. Opgemerkt moet worden dat er in deze retrospectieve studie alleen sprake was van kaliumbepaling wanneer dat door een arts nodig werd geacht, wanneer de kliniek daartoe aanleiding gaf (dus niet routinematig, in het kader van dit onderzoek). Daarmee kan er sprake zijn van vertekening van de resultaten. Tevens gaat het hier waarschijnlijk om relatieve i.p.v. absolute risico’s op overlijden (dit staat niet duidelijk in het artikel). Absolute risico’s blijven meest waarschijnlijk het hoogst bij patiënten met een ernstiger stadium van chronische nierschade.
Jain et al. onderzochten voorspellers van hyperkaliëmie en mortaliteit bij patiënten met hartfalen en hypertensie [Jain, 2012]. In dit retrospectieve onderzoek werden 15.803 patiënten geïncludeerd, van wie er 1.385 chronische nierschade stadium 3 tot 5 hadden. Hyperkaliëmie werd in dit onderzoek gedefinieerd als serum kalium > 5 mmol/L. Bij 3.868 patiënten trad er hyperkaliëmie op. Hyperkaliëmie bleek bij patiënten met chronische nierschade geassocieerd te zijn met mortaliteit (OR: 1,63; 95% BI: 1,04-2,55).
Korgaonkar et al. onderzochten associaties tussen serum kalium en uitkomsten bij patiënten met chronische nierschade [Korgaonkar, 2010]. In dit prospectieve observationele onderzoek werden 820 patiënten met chronische nierschade stadium 3 tot 5 geïncludeerd (gemiddelde eGFR 25,4 ± 6,9 ml/min/1,73m2 (range 3,7 tot 91,7 ml/min/1,73m2] ). Hiervan waren er bij de start van de studie 122 hypokalemisch (≤ 4,0 mmol/L), 633 normokalemisch (4,0-5,5 mmol/L) en 65 hyperkalemisch (≥5,5 mmol/L). De gemiddelde follow-up bedroeg 2,6 jaar (range 0-7). Er kon geen relatie worden aangetoond tussen hyperkaliëmie (serum kalium 6,0 versus 5,0 mmol/L in regressiemodel als continue variabele) en mortaliteit, eindstadium nierfalen en de gecombineerde uitkomst eindstadium nierfalen of mortaliteit. Wel werd er een relatie gevonden met de gecombineerde uitkomst cardiovasculair event of mortaliteit; de hazard ratio was 1,84 (95% BI: 1,24-2,74). Wanneer werd gekeken naar vergelijking van hyperkaliëmie (≥5,5 mmol/L) met normokaliëmie, dan was de hazard ratio op een cardiovasculair event of overlijden 1,75 (95% BI: 1,18-2,62). Overigens vonden de auteurs ook associaties tussen hypokaliëmie en de verschillende patiëntrelevante uitkomsten; deze verbanden waren sterker dan bij hyperkaliëmie.
Het artikel van Lee et al. beschreef de resultaten van een retrospectief onderzoek naar renale uitkomsten en mortaliteit bij patiënten met chronische nierschade en hyperkaliëmie [Lee, 2014]. In dit onderzoek werden 258 patiënten geïncludeerd met chronische nierschade stadium 3 of 4 en hyperkaliëmie (serum kalium ≥5,5 mmol/L) die met ACE-remmers of angiotensine-II-receptorblokkers werden behandeld (RAAS blokkade). De gemiddelde follow-up was 45,7 maanden (sd 18,3). Gedurende de follow-up werd bij een aantal patiënten de RAAS blokkade gecontinueerd (n=150) en bij anderen gestopt (n=108); deze groepen werden met elkaar vergeleken. ‘Renale survival’, gedefinieerd als het niet bereiken van de primaire uitkomsten eindstadium nierfalen of verdubbeling van serum creatinine, was hoger in de groep die de behandeling continueerde (HR: 1,35; 95% BI: 1,08-1,92). Wanneer echter met regressiemodellen werd gecorrigeerd voor proteïnurie en eGFR bij baseline, kon geen relatie worden aangetoond tussen RAAS blokkade en renale progressie. Continueren van de RAAS blokkade liet geen significant verschil zien in het optreden van hyperkaliëmie en ook niet in daarmee geassocieerde ziekenhuisopname of mortaliteit. Aan het eind van de studieperiode was het serumkalium gedaald in zowel de groep die RAAS blokkade continueerde (van 5,79 ± 0,38 naar 5,39 ± 0,52) als in de groep bij wie die behandeling werd gestopt (5,77 ±0,48 naar 5,23 ± 0,61).
Luo et al. onderzochten in een retrospectieve studie de associatie tussen serum kalium en mortaliteit, ziekenhuisopname en cardiovasculaire events bij patiënten met verminderde nierfunctie [Luo, 2016]. In dit onderzoek werden 55.266 patiënten met chronische nierschade geïncludeerd, die werden gestratificeerd naar serumkalium concentratie en eGFR concentratie. De voor deze uitgangsvraag belangrijkste resultaten zijn opgenomen in tabel 1. De mediane follow-up bedroeg 2,76 jaar.
Tabel 1. Relatief risico (95% BI) op overlijden en cardiovasculaire events afhankelijk van eGFR en serum kalium (vergeleken met serum kalium 4,5-4,9 als referentie)
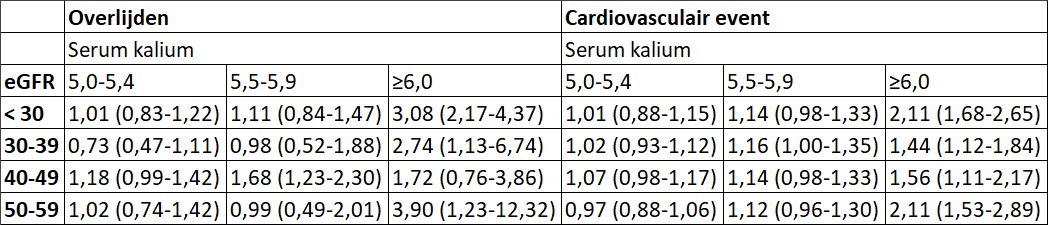
*RR gecorrigeerd voor eerdere ziekenhuisopname, leeftijd, geslacht, ras/etniciteit, diabetes, hartfalen, coronaire hartziekten, beroerte en medicatie
Het artikel van Heerspink et al. bestudeerde het effect van duale RAAS-blokkade versus mono RAAS blokkade bij 24.973 patiënten met atherosclerose of diabetes mellitus met eindorgaanschade [Heerspink, 2014]. Na zes weken behandeling bleek een lagere eGFR een verhoogd risico te geven voor de ontwikkeling van hyperkaliëmie (K ≥ 5,5 mmol/l); elke 10 ml/min/1,73 m2 lagere eGFR was geassocieerd met een 16% verhoogd risico op hyperkaliëmie. Dit gold echter niet alleen voor patiënten met chronische nierschade (maar was gebaseerd op de gehele studiepopulatie). Bij de start van de studie hadden 5.695 patiënten een eGFR < 60 ml/min/1,73 m2 en normokaliëmie. Van deze patiënten had na zes weken 4,4% van degenen met duale therapie hyperkaliëmie, tegenover 2,9% in de groep met monotherapie. Bij een nog verder geselecteerde groep van 2.622 patiënten met eGFR < 60 ml/min/1,73 m2 in combinatie met diabetes mellitus type 2, had 6,7% hyperkaliëmie na zes weken behandeling met de duale behandeling, tegenover 4,6% van de patiënten die met monotherapie behandeld werd. De follow-up voor cardiovasculaire en renale eindpunten bedroeg twee jaar. In de gehele studiepopulatie (dus ook inclusief patiënten zonder chronische nierschade) bleek hyperkaliëmie (na zes weken) geassocieerd met een verhoogd risico op cardiovasculaire eindpunten (cardiovasculaire mortaliteit, hartfalen, beroerte en hartfalen) gedurende de follow-up: HR 1,43 (95% BI: 1,19-1,73). Ook het risico op renale eindpunten (verdubbeling serum creatinine, dialyse) en het risico op overlijden was verhoogd bij hyperkaliëmie: HR 2,08 (95% BI: 1,33-3,26) respectievelijk 1,53 (95% BI: 1,24-1,89).
Zoeken en selecteren
Voor een antwoord op deze uitgangsvraag is op 22 februari 2016 naar literatuur gezocht in Medline (zie de zoekverantwoording). Dit leverde 215 abstracts op. Deze abstracts zijn op onderwerp (sluit het artikel aan bij de uitgangsvraag?) en research design (systematische reviews, randomized controlled trials en cohortonderzoek) geselecteerd, wat resulteerde in 13 artikelen, die fulltekst zijn beoordeeld. Een aanvullende search op 31 augustus 2016 leverde 25 abstracts op, waarvan er één relevant bleek, die eveneens fulltekst is beoordeeld.
Referenties
- Ash SR, Ash SR. A phase 2 study on the treatment of hyperkalemia in patients with chronic kidney disease suggests that the selective potassium trap, ZS-9, is safe and efficient. Kidney Int 2015; 88: 404-11.
- Chernin G, Chernin G, Gal-Oz A, Ben-Assa E, Schwartz I. Secondary prevention of hyperkalemia with sodium polystyrene sulfonate in cardiac and kidney patients on renin-angiotensin-aldosterone system inhibition therapy. Clin Cardiol 2012; 35: 32-6.
- Dunn JD, Benton WW, Orozco-Torrentera E, Adamson RT., Dunn JD. The burden of hyperkalemia in patients with cardiovascular and renal disease. Am J Man Care 2015; 21: s307-15.
- Einhorn LM, Einhorn LM. The frequency of hyperkalemia and its significance in chronic kidney disease. Arch Intern Med 2009; 169: 1156-62.
- Fouque D, Vennegoor M, Ter Wee P, Wanner C, Basci A, Canaud D, et al. EBPG Guideline on Nutrition. Nephrol Dial Transplant 2007; 22(suppl 2): ii45-87.
- Hwang JC, Wang CT, Chen CA, Chen HC., Hwang J-C, Wang C-T, et al. Hypokalemia is associated with increased mortality rate in chronic hemodialysis patients. Blood Purification 2011; 32: 254-61.
- Harel Z, Harel S, Shah PS, Wald R, Perl J, Bell CM. Gastrointestinal adverse events with sodium polystyrene sulfonate (Kayexalate) use: a systematic review. Am J Med 2013; 126: 264.e9-24.
- Heerspink HJL, Gao P, De Zeeuw D, Clase C, Dagenais GR, Sleight P, et al. The effect of Ramipril and telmisartan on serum potassium and its association with cardiovascular and renal events: Results from the ONTARGET trial. Eur J Prev Cardiol 2014; 21: 299-309.
- Jain N, Jain N, Kotla S, Little B. Predictors of hyperkalemia and death in patients with cardiac and renal disease. Am J Cardiol 2012; 109: 1510-3.
- Korgaonkar S, Tilea, Korgaonkar S, Tilea A, Gillespie B. Serum potassium and outcomes in CKD: insights from the RRI-CKD cohort study. Clin J Am Soc Nephrol 2010; 5: 762-9.
- Lazich I, Lazich I. Prediction and management of hyperkalemia across the spectrum of chronic kidney disease. Sem Nephrol 2014; 34: 333-9.
- Lee JH, Kwon YE, Park JT, Lee MJ, Oh HJ, Han SH, et al. The effect of renin-angiotensin system blockade on renal protection in chronic kidney disease patients with hyperkalemia. J Ren-Angiotens-Aldost-Syst 2014; 15: 491-7.
- Luo J, Luo J. Association between Serum Potassium and Outcomes in Patients with Reduced Kidney Function. Clin J Am Soc Nephrol 2016; 11: 90-100.
- Packham DK, Rasmussen HS, Lavin PT, El-Shahawy MA, Roger SD, Block G, et al. Sodium zirconium cyclosilicate in hyperkalemia. New Engl J Med 2015; 372: 222-31.
- Preston RA, Preston RA. Mechanisms of impaired potassium handling with dual renin-angiotensin-aldosterone blockade in chronic kidney disease. Hypertension 2009; 53: 754-60.
- Wang HH, Hung CC, Hwang DY, Kuo MC, Chiu YW, Chang JM, et al. Hypokalemia, its contributing factors and renal outcomes in patients with chronic kidney disease. PLoS ONE 2013; 8: e67140.
- Weir MR, Bakris GL, Bushinsky DA, Mayo MR, Garza, Weir MR. Patiromer in patients with kidney disease and hyper-kalemia receiving RAAS inhibitors. N Engl J Med 2015; 372: 211-21.
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 18-01-2018
Laatst geautoriseerd : 18-01-2018
Geplande herbeoordeling :
De Nederlandse Federatie voor Nefrologie monitort de geldigheid van de aanbevelingen in deze modules. Indien nieuwe knelpunten of nieuwe evidence aanleiding zijn tot herziening van (delen van) deze modules, dan zal de NFN in overleg met de NIV hiertoe het initiatief nemen.
Algemene gegevens
De NIV-Modules zijn aanvullend op de multidisciplinaire richtlijn Chronische Nierschade. Voor verdere afbakening en verantwoording van de gevolgde procedures wordt verwezen naar de multidisciplinaire richtlijn Chronische Nierschade.
Deze richtlijn is ontwikkeld in samenwerking met:
- Nederlandse Federatie voor Nefrologie (NfN)
- PROVA
De ontwikkeling van deze richtlijn is gefinancierd vanuit een projectbudget door de Stichting Kwaliteitsgelden Medisch Specialisten.
Doel en doelgroep
De doelgroep van deze NIV-Modules zijn internisten-(nefrologen) en internisten in opleiding.
Samenstelling werkgroep
Aanvullend op de MDR Chronische Nierschade zijn 2e lijns knelpunten uitgewerkt door de drie internist-nefrologen uit de MDR werkgroep, te weten:
- Dhr. dr. Marc Hemmelder, internist-nefroloog, Nefrovisie, Utrecht, namens de Nederlandse Internisten Vereniging en de Nederlandse Federatie voor Nefrologie – voorzitter
- Dhr. prof. dr. Ron Gansevoort, internist-nefroloog, UMC Groningen, namens de Nederlandse Internisten Vereniging en de Nederlandse Federatie voor Nefrologie
- Mw. dr. Neelke van der Weerd, internist-nefroloog, AMC, Amsterdam, namens de Nederlandse Internisten Vereniging en de Nederlandse Federatie voor Nefrologie
Zij zijn daarbij ondersteund door. Mw. drs. Mariska Tuut, epidemioloog, PROVA, Varsseveld, in de rol van secretaris en methodoloog. Deze uitwerking heeft geresulteerd in 10 extra modules.
Bij het uitwerken van deze 2e lijns knelpunten is gebruik gemaakt van richtlijncommissie van de Nederlandse Federatie voor Nefrologie (NfN) en van de voorbereidende werkzaamheden van een reeds bestaande NfN werkgroep Chronische Nierschade, te weten prof.dr P.M. ter Wee (voorzitter), internist-nefroloog, VUmc, Amsterdam; prof.dr R.T. Gansevoort (secretaris), internist-nefroloog, UMC Groningen; dr E.C. Hagen, internist-nefroloog, Meander MC, Amersfoort; prof dr H.A.H. Kaasjager, internist-nefroloog, vasculair-geneeskundige, UMC Utrecht; dr C.J.A.M. Konings, internist-nefroloog, Catharina ziekenhuis, Eindhoven. (lid kwaliteitscommissie NfN); dr M.B. Rookmaaker, internist-nefroloog, UMC, Utrecht. (lid kwaliteitscommissie NfN); dr P.L. Rensma, internist-nefroloog, St Elisabeth ziekenhuis, Tilburg; dr N.C. van de Weerd, internist-nefroloog, AMC, Amsterdam; prof.dr J.F.M. Wetzels internist-nefroloog, Radboudumc, Nijmegen.
Methode ontwikkeling
Evidence based
Implementatie
Gedurende het hele proces van richtlijnontwikkeling is rekening gehouden met implementatie van de richtlijn in de praktijk, bijvoorbeeld bij de samenstelling van de werkgroep, de brede knelpunteninventarisatie en de uitgebreide commentaarronde. De werkgroep heeft adviezen voor implementatie (implementatieplan) en indicatoren geformuleerd. Deze zijn opgenomen onder de aanverwante producten.
Na autorisatie van de richtlijn wordt deze ten minste op de website van de Nederlandse Internisten Vereniging en het Nederlands Huisartsen Genootschap gepubliceerd. Ook andere deelnemende partijen zijn vrij de richtlijn op hun website te publiceren. De richtlijn wordt ter publicatie aangeboden aan www.richtlijnendatabase.nl. Daarnaast wordt getracht samenvattingen van de richtlijn in Nederlandse tijdschriften te publiceren, aandacht aan de richtlijn te besteden op congressen, en nascholingsmateriaal en voorlichtingsmateriaal te ontwikkelen, om zo de implementatie van de richtlijn te bevorderen.
Een voor patiënten begrijpelijke samenvatting van de aanbevelingen uit deze richtlijn komt beschikbaar via www.thuisarts.nl. Een verdieping daarvan komt beschikbaar via de website van de Nierstichting/Nederlandse Vereniging van Nierpatiënten.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
