Preventieve maatregelen TACO
Uitgangsvraag
Aanbeveling
Bij patiënten met een risicoprofiel voor TACO (hartfalen, nierfalenfunctievermindering en/of uiting van een positief vochtbalans (gewichtstoename)):
- Pas de transfusiesnelheid aan naar een infusiesnelheid van 150 ml/uur of lager. Houdt hierbij rekening met de toegestane maximale toedieningstijd.
- Overweeg bij niet-bloedende patiënten tevens intraveneus een lisdiureticum te geven (bij verminderde nierfunctie dosering verhogen) voor de start van een transfusie.
Overwegingen
Op dit moment is TACO de belangrijkste oorzaak van transfusie gerelateerde sterfte in Europa (Bolton-Maggs, 2017). De pathofysiologie van TACO wordt gedeeltelijk door overvulling verklaard. Het is daarom ook niet onverwachts dat patiënten met hartfalen, nierfunctievermindering en/of een positieve vochtbalans (gewichtstoename) een verhoogd risico hebben op het ontwikkelen van TACO. In dezelfde lijn is het te verwachten dat een lagere infusiesnelheid (het lichaam kan zich makkelijker aanpassen aan de volumebelasting) en het preventief toedienen van lisdiuretica (zie het farmacotherapeutisch kompas: https://www.farmacotherapeutischkompas.nl/bladeren/groepsteksten/lisdiuretica) in deze patiëntencategorie de kans op TACO doet verminderen. De werkgroep heeft op basis van de literatuur gekozen om een infusiesnelheid van 150 ml/uur of lager aan te bevelen bij patiënten met een risico op het ontwikkelen van TACO. Lisdiuretica dienen intraveneus toegediend te worden in verband met de snelle werking ten opzichte van oraal. In geval van nierfunctiestoornissen dient de lisdiuretica dosis verhoogd te worden (tot een maximum bolus van 500 mg furosemide bij zeer ernstige nierfunctiestoornissen). Er is momenteel geen goed uitgevoerde gerandomiseerde studie beschikbaar voor de lagere infusiesnelheid danwel het toedienen van lisdiuretica en is er alleen indirect bewijs uit observationele studies en kleine gerandomiseerde studies. Toekomstige onderzoeken moeten uitwijzen of een checklist kan leiden tot preventie van TACO. Zie de TRIP-website voor een voorbeeld van een checklist: https://www.tripnet.nl/wp-content/uploads/2018/04/zakkaartje-arts-maart-2018.pdf en
https://www.tripnet.nl/wp-content/uploads/2018/04/zakkaartje-vpk-april2018.pdf.
Onderbouwing
Achtergrond
Transfusion associated circulatory overload (TACO) is op dit moment de belangrijkste oorzaak van transfusie gerelateerde morbiditeit en mortaliteit in Europa (Bolton-Maggs, 2017; TRIP Rapport Hemovigilantie 2017). Om een betere afweging te kunnen maken om een patiënt een bloedtransfusie te geven, danwel voorzorgsmaatregelen te nemen rondom transfusie, is het belangrijk om te weten of een patiënt een risico heeft op TACO. Op basis van grote cohort studies (Bosboom, 2018; Clifford, 2017; Menis, 2014; Murphy, 2013; Rana, 2006; Refaai, 2015; Roubinian, 2017) is de afgelopen jaren inzicht gekomen welke patiënten een risico hebben op het ontwikkelen van TACO. De belangrijkste risico factoren voor het optreden van TACO zijn nierfunctievermindering (klaring minder dan 60 ml/min) (Bosboom, 2018), hartfalen (Bosboom, 2018) en een positieve vochtbalans (gewichtstoename) (Bosboom, 2018).
Conclusies
|
zeer laag GRADE |
Het is onduidelijk of de implementatie van een pre-transfusie checklist, met aandacht voor risicofactoren, vermindering laat zien in het risico op TACO bij een erytrocytentransfusie in de algemene ziekenhuispopulatie.
Bronnen: (Tseng, 2016) |
|
zeer laag GRADE |
Het is onduidelijk of het verlagen van de infusiesnelheid de kans op het optreden van TACO vermindert bij patiënten zonder een risicoprofiel voor TACO.
Bronnen: (Li, 2011) |
|
zeer laag GRADE |
Het is onduidelijk of het gebruik van een intraveneus lisdiureticum, voorafgaand aan een bloedtransfusie, de wiggedruk verlaagt bij patiënten zonder een risicoprofiel voor het optreden van TACO.
Bronnen: (Gupta, 1983; Nand, 1986) |
|
- GRADE |
Er werden geen studies gevonden die het effect van volume-gereduceerde producten op het optreden van TACO onderzochten. |
Samenvatting literatuur
We hebben géén studies gevonden die het effect van preventief toedienen van diuretica, snelheid van infusie of volume-gereduceerde producten op het optreden van TACO onderzochten bij patiënten met een risicoprofiel. Voor de samenvatting van de literatuur hebben we daarom ook studies meegenomen die patiënten includeerden zonder risicoprofiel voor het optreden van TACO.
Vier onderzoeken (Sarai, 2015; Li, 2011; Tseng, 2016; Gupta, 1983) zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Beschrijving studies
We hebben één systematische review (Sarai, 2015) geïncludeerd. Dit systematische review onderzocht het effect van preventief gebruik van diuretica op het optreden van TACO bij kinderen en volwassenen. Geen van de studies die in het systematische review worden samengevat presenteert uitkomsten voor TACO, wel onderzochten twee van deze studies (N = 40) (Nand, 1985; Nand, 1986) het effect van het preventief gebruik van furosemide bij volbloedtransfusies op de wiggedruk (verhoging van de linkerventrikel eind diastolische druk gemeten via een arterie pulmonalis katheter, is de oorzaak van optreden van hydrostatisch longoedeem) bij volwassenen met ernstige bloedarmoede. We includeerden één gerandomiseerde studie (N = 20) (Gupta, 1983). Deze studie onderzocht het effect van het toedienen van furosemide, kort voor transfusie van volbloed, op de wiggedruk bij volwassenen met een ernstige bloedarmoede.
Eén cohortstudie (met een controlled before-after design, N=130) (Tseng, 2016) onderzocht het effect van de implementatie van een ‘pre-transfusie checklist’. De checklist werd geïntroduceerd op een afdeling voor interne geneeskunde en moest gebruikt worden bij het aanvragen van producten voor een erytrocytentransfusie. De checklist bevatte items over risicofactoren voor circulatoire overvulling (leeftijd ≥ 70 jaar, nierfalen (creatine > 100 mmol/L), linker ventrikel ejectie fractie (LVEF ≤ 60%), en congestief hartfalen). Bij aanwezigheid van tenminste één van deze risicofactoren, werd het intraveneus toedienen van furosemide aanbevolen. In deze studie werd gekeken naar het optreden van TACO.
Eén nested case-control studie (Li, 2011) onderzocht de associatie tussen infusiesnelheid (mL/u) en het optreden van TACO bij ernstig zieke patiënten opgenomen op een intensive care unit. In de studie werden erytrocyten en vers-bevroren plasma producten getransfundeerd. De associatie werd gecorrigeerd voor leeftijd, geslacht en diagnose bij opname op de intensive care unit.
Resultaten
Er zijn géén studies gevonden die het effect van preventief toedienen van diuretica, snelheid van infusie of volume-gereduceerde producten op het optreden van TACO onderzochten bij patiënten met een risicoprofiel. Onderstaande resultaten betreffen uitkomstmaten over patiënten zonder risicoprofiel voor het optreden van TACO.
TACO
Eén studie (Li, 2011) onderzocht de associatie tussen infusiesnelheid en het optreden van TACO binnen 24 uur na de transfusie bij ernstig zieke patiënten, opgenomen op een intensive care unit. Een hogere infusiesnelheid (mediane snelheid 225 ml/u) vergeleken met een mediane infusiesnelheid van 168 ml/u vergrootte de kans op het optreden van TACO (odds-ratio (OR) = 1,88; 95% betrouwbaarheidsinterval (BI) (1,06 tot 3,33).
Eén studie (Tseng, 2016) vond geen verschil in het optreden van TACO vóór (0 events in 68 patiënten) en ná de implementatie van een pre-transfusie checklist (0 events in 62 patiënten).
Wiggedruk
Drie studies (Gupta, 1983; Nand, 1985; Nand, 1986) onderzochten het effect van preventief gebruik van furosemide op de wiggedruk bij patiënten met ernstige anemie. De resultaten van deze studies konden worden samengevat in een meta-analyse (Figuur 1). De resultaten uit de studie van Nand (1985) zijn niet meegenomen in het gewogen gemiddelde, omdat dit hoogstwaarschijnlijk dezelfde data betreft als de data gepresenteerd in de studie van Gupta (1983). Het preventief gebruik van furosemide verlaagt de wiggedruk (gewogen gemiddelde = -3,92; 95% BI (-5,52 tot -2,33).
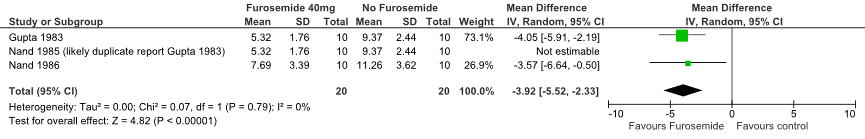
Figuur 1 Forest plot, effect van preventief furosemide bij volbloed transfusie, op wiggedruk bij patiënten met bloedarmoede
Bewijskracht van de literatuur
Het gebruik van een ‘checklist met risicofactoren’ op TACO
De bewijskracht voor de effectiviteit van een ‘pre-transfusie checklist’ op het optreden van TACO is zeer laag. De bewijskracht is gebaseerd op een observationele studie en we hebben de bewijskracht verlaagd met drie niveaus gezien de beperkingen in studieopzet (risk of bias), extrapoleerbaarheid (de gevonden resultaten zijn mogelijk een onderschatting voor het effect; het is aannemelijk dat de effectiviteit van de ‘pre-transfusie checklist’ in een populatie van patiënten met een risicoprofiel voor het ontwikkelen van TACO groter is), en het geringe aantal patiënten (imprecisie).
Het verlagen van infusiesnelheid op TACO
De bewijskracht voor de effectiviteit van het verlagen van infusiesnelheid op het optreden van TACO is zeer laag. De bewijskracht is gebaseerd op een observationele studie en we hebben de bewijskracht verlaagd met drie niveaus gezien de beperkingen in studieopzet (risk of bias), extrapoleerbaarheid (de gevonden resultaten zijn mogelijk een onderschatting voor het effect; het is aannemelijk dat de effectiviteit van het verlagen van de infusiesnelheid in een populatie van patiënten met een risicoprofiel voor het ontwikkelen van TACO groter is), en het geringe aantal patiënten (imprecisie).
Het effect van lisdiuretica op de wiggedruk
De bewijskracht voor de effectiviteit van het preventief gebruik van lisdiuretica op het verlagen van de wiggedruk is zeer laag. De bewijskracht is gebaseerd op gerandomiseerde studies en we hebben de bewijskracht verlaagd met drie niveaus gezien de beperkingen in studieopzet (risk of bias), extrapoleerbaarheid (de gevonden resultaten zijn mogelijk een onderschatting voor het effect; het is aannemelijk dat de effectiviteit van preventief toedienen van lisdiuretica in een populatie van patiënten met een risicoprofiel voor het ontwikkelen van TACO groter is), en het geringe aantal patiënten (imprecisie).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvragen:
- Wat is het effect van preventief toedienen van diuretica (o.a. furosemide), in vergelijking met gebruikelijke zorg, op het optreden van TACO bij patiënten met een risicoprofiel?
- Wat is het effect van snelheid van infusie, in vergelijking met gebruikelijke zorg, op het optreden van TACO bij patiënten met een risicoprofiel?
- Wat is het effect van volume-gereduceerde producten, in vergelijking met gebruikelijke zorg, op het optreden van TACO bij patiënten met een risicoprofiel?
P: patiënten met een risicoprofiel voor het ontwikkelen van TACO (nierfunctievermindering, hartfalen en een positieve vochtbalans (gewichtstoename) voor de transfusie);
I: preventief toedienen van diuretica (o.a. furosemide), snelheid van infusie, volume-gereduceerde producten;
C: gebruikelijke zorg;
O: optreden van TACO, kosteneffectiviteit, patient reported outcome measures (PROMs)
Relevante uitkomstmaten
De werkgroep achtte het optreden van TACO een voor de besluitvorming belangrijke uitkomstmaat. De werkgroep hanteerde in afwezigheid van TACO, verhoogde wiggedruk als uitkomstmaat voor overvulling.
Zoeken en selecteren
In de databases Medline (via OVID) en Embase (via embase.com) is op 16 maart 2018 met relevante zoektermen gezocht naar systematische literatuurstudies, gerandomiseerde studies en observationele studies die het effect van diuretica, snelheid van infusie en volume-gereduceerde producten op het optreden van TACO onderzochten. De zoekverantwoording staat beschreven onder het tabblad Verantwoording.
Studies werden geselecteerd op grond van de volgende selectiecriteria: 1) patiënten die een bloedtransfusie ondergaan; 2) alle mogelijke interventies voor het voorkomen van TACO; 3) uitkomstmaat gepresenteerd voor TACO.
De literatuurzoekactie leverde 136 treffers op. Op basis van titel en abstract werden in eerste instantie 13 studies geselecteerd. Na lezen van de volledige tekst, werden vervolgens 9 studies geëxcludeerd (Fry, 2010; Blumberg, 2010; Lieberman, 2013; Narick, 2012; Rana, 2006; Frazier, 2017; Andrzejewski, 2013; Alam, 2013; Mahasandana, 1979) (zie exclusietabel onder het tabblad Verantwoording).
Referenties
- Alam A, Lin Y, Lima A, Hansen M, Callum JL. The prevention of transfusion-associated circulatory overload. Transfus Med Rev, 2013 Apr;27(2):105-12.
- Andrzejewski C, Casey MA, Popovsky MA. How we view and approach transfusion-associated circulatory overload: pathogenesis, diagnosis, management, mitigation, and prevention. Transfusion, 2013 Dec;53(12):3037-47.
- Blumberg N, Heal JM, Gettings KF, Philipps RP, Masel D, Refaai MA, Kirkley SA, Fialkow LB. An association between decreased cardiopulmonary complications (transfusion-related acute lung injury and transfusion-associated circulatory overload) and implementation of universal leukoreduction of blood transfusions. Transfusion, 2010 Dec;50(12):2738-44.
- Bolton-Maggs PHB (Ed), Poles D, et al. on behalf of the Serious Hazards of Transfusion (SHOT) Steering Group. The 2016 Annual SHOT Report (2017).
- Bosboom JJ, Klanderman RB, Zijp M, et al. Incidence, risk factors, and outcome of transfusion-associated circulatory overload in a mixed intensive care unit population: a nested case-control study. Transfusion. 2018;58(2):498-506. PubMed PMID: 29238981.
- Clifford L, Jia Q, Subramanian A, et al. Risk Factors and Clinical Outcomes Associated with Perioperative Transfusion-associated Circulatory Overload. Anesthesiology. 2017;126(3):409-418. PubMed PMID: 28072601.
- Frazier SK, Higgins J, Bugajski A, Jones AR, Brown MR. Adverse reaction to transfusion of blood products and best practices for prevention. Crit Care Nurs Clin North Am, 2017 Sep;29(3):271-290.
- Fry JL, Arnold DM, Clase CM, Crowther MA, Holbrook AM, Traore AN, Warkentin TE, Heddle NM. Transfusion premedication to prevent acute transfusion reactions: a retrospective observational study to assess current practices. Transfusion, 2010 Aug;(50(8):1722-30.
- Gupta SP, Nand N, Gupta MS, Mohan JC. Haemodynamic changes following blood transfusion in cases of chronic sever eanemia: increased safety with simultaneous furosemide administration. Angiology, 1983 Nov;34(11):699-704.
- Li G, Rachmale S, Kojicic M, Shahjehan K, Malinchoc M, Kor DJ, Gajic O. Incidence and transfusion risk factors for transfusion-associated circulatory overload among medical intensive care unit patients. Transfusion, 2011 Feb;51(2):338-43.
- Lieberman L, Maskens C, Cserti-Gazdewich C, Hansen M, Lin Y, Pendergrast J, Yi Ql, Callum J. A Retrospective Review of Patient Factors, Transfusion Practices, and Outcomes in Patients With Transfusion-Associated Circulatory Overload. Transfus Med Rev, 2013 Oct;27(4):206-12.
- Mahasandana S. The management of immediate transfusion reactions. Southeast Asian J Trop Med Public Health, 1979 Jun;10(2):199-203.
- Menis M, Anderson SA, Forshee RA, et al. Transfusion-associated circulatory overload (TACO) and potential risk factors among the inpatient US elderly as recorded in Medicare administrative databases during 2011. Vox Sang. 2014;106(2):144-52. PubMed PMID: 23848234.
- Murphy EL, Kwaan N, Looney MR, et al. Risk factors and outcomes in transfusion-associated circulatory overload. Am J Med. 2013;126(4):357.e29-38. PubMed PMID: 23357450.
- Nand N, Gupta SP, Gupta MS. Hemodynamic evaluation of blood transfusion in chronic severe anemia with special reference to speed of transfusion. Japanese Heart Journal 1985;26(5):759–65.
- Nand N, Gupta MS, Sharma M. Furosemide supplemented blood transfusion in cases of chronic severe anemia. Japanese Heart Journal 1986;27(2):177–82.
- Narick C, Triulzi DJ, Yazer MH. Transfusion-associated circulatory overload after plasma transfusion. Transfusion, 2012 Jan;52(1):160-5.
- Rana R, Fernández-Pérez ER, Khan SA, et al. Transfusion-related acute lung injury and pulmonary edema in critically ill patients: a retrospective study. Transfusion, 2006;46(9):1478-83.
- Refaai MA, Goldstein JN, Lee ML, et al. Increased risk of volume overload with plasma compared with four-factor prothrombin complex concentrate for urgent vitamin K antagonist reversal. Transfusion. 2015;55(11):2722-9. PubMed PMID: 26135740.
- Roubinian NH, Hendrickson JE, Triulzi DJ, et al; NHLBI Recipient Epidemiology and Donor Evaluation Study-III (REDS-III). Incidence and clinical characteristics of transfusion-associated circulatory overload using an active surveillance algorithm. Vox Sang. 2017;112(1):56-63. PubMed PMID: 28001313.
- Sarai M, Tejani AM. Loop diuretics for patients receiving blood transfusions. Cochrane Database Syst Rev 2015 Feb 16;(2)CD010138. doi: 10.1002/14651858.CD010138.pub2.
- TRIP Rapport Hemovigilantie 2017 [Internet]. Available from: https://www.tripnet.nl/wp-content/uploads/2018/11/Trip.HEMO_uitgebreid_def-2017-met-links.pdf
- Tseng E, Spradbrow J, Cao X, Callum J, Lin Y. An order set and checklist improve physician transfusion ordering practices to mitigate the risk of transfusion-associated circulatory overload. Transfus Med, 2016 Apr;26(2):104-10.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question:
Wat is de effectiviteit van preventieve maatregelen om TACO te voorkomen bij patiënten met een risicoprofiel?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Sarai 2015
Individual study characteristics deduced from:
A: Nand 1985
B: Nand 1986
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to January 2015
A: Nand, 1985 B: Nand, 1986
Study design: RCT
Setting and Country:
A: India (likely inpatient institution)
B: India (likely inpatient institution)
Source of funding:
A: Not reported.
B: Not reported. |
Inclusion criteria SR: All adults and children who received, or were to receive, a transfusion of any blood product.
Exclusion criteria SR: None specified.
4 studies included, of which 2 are relevant for answering the guideline’s research question
Important patient characteristics at baseline:
N, mean age A: Intervention, N=10, mean age (SD) = 28.7 (9.1); control group, N=10, mean age (SD) = 26.1 (7.9)
B: Intervention, N=10, mean age (SD) = 30.1 (10.4); control group, N=10, mean age (SD) = 30.8 (13.7)
Sex: A: Not reported. B: Not reported. |
A: Furosemide: 40 mg IV, dosed just before the start of 1 unit (300 to 350 mL) whole blood transfusion.
B: Furosemide: 40 mg IV administered before the start of transfusion (2 units (650 to 700 mL) transfused at a rate of 5 mL/min).
|
A: Whole blood transfusion: 1 unit (300 to 350 mL) (i.e. no matching placebo).
B: Whole blood transfusion: 2 units (650 to 700 mL) transfused at a rate of 5 mL/min (i.e. no matching placebo).
|
End-point of follow-up:
A: Not specified.
B: Not specified.
For how many participants were no complete outcome data available? (intervention/control)
A: Not reported . B: Not reported.
|
Pulmonary capillary wedge pressure (PWCP)
Effect measure: mean difference [95% CI]:
A: Pulmonary capillary wedge pressure. PWCP increased from baseline in the control group (from mean (SD) 7.75 (2.34) to 9.37 (2.44)). PWCP in the furosemide group decreased (from mean (SD) 6.80 (2.32) to 5.32 (1.76)). Between-group statistical comparisons were not reported. Based on raw data: MD = -4.05, 95% CI (-5.91 to -2.19).
B: Pulmonary capillary wedge pressure. PWCP increased from baseline in the control group (from mean (SD) 8.05 (3.58) to 11.27 (3.62)). PWCP in the furosemide group decreased (from mean (SD) 7.99 (2.89) to 7.69 (3.39)). Between group statistical comparisons were not reported. Based on raw data: MD = -3.57, 95% CI (-6.64 to -0.50).
|
Review author’s conclusion: While the included studies report statistically significant improvements in FiO2 and PCWP, current evidence does not support the routine use of loop diuretics for the prevention of clinically important (i.e. organ failure, mortality, total serious adverse events) transfusion-related morbidity. Moreover, there is insufficient evidence to assess harm caused by loop diuretics in patients receiving transfusion.
Review authors state that the included studies did not report between-group comparisons, and therefore, a meta-analysis was not possible. However, using the raw data presented in the text, a weighted mean difference can be estimated. See results section in the guideline’s text. |
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies([cohort studies, case-control studies, case series))1
Research question:
Wat is de effectiviteit van preventieve maatregelen om TACO te voorkomen bij patiënten met een risicoprofiel?
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3 |
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Gupta, 1983 |
Type of study: Randomised controlled trial
Setting: Not reported.
Country: India.
Source of funding: Not reported. |
Inclusion criteria: Adults suffering from chronic severe anemia (haemoglobin less than 6.0 g%).
Exclusion criteria: Any systemic disease.
N total at baseline: I: N=10 C: N=10
Important prognostic factors2:
Age years mean (SD): I: 27.1 (8.45) C: 26.06 (7.86)
Sex: Not specified per treatment group.
Haemoglobin g% mean (SD) I:3.50 (1.20) C:3.48 (1.26)
Wedge pressure (mean (SD) I: 6.80 (2.32) C: 7.75 (2.34) |
Transfused one unit of blood (300-350ml) at a speed of 5 ml/min. Just prior to blood transfusion 40mg furosemide IV.
|
Transfused one unit of blood (300-350ml) at a speed of 5 ml/min. |
Length of follow-up: Soon after completion of blood transfusion.
Loss-to-follow-up: I: Not reported.
C: Not reported.
|
Outcome measures and effect size
Wedge pressure mean (SD) after blood transfusion I: 5.32 (1.76) C: 9.37 (2.44)
Mean difference (95% CI) = -4.05, 95% CI (-5.91 to -2.19). |
Original publication, Nand 1985 (which is included in systematic review Sarai 2015) . |
|
Li, 2011 |
Nested case-control study |
Inclusion criteria base cohort: Consecutive patients who were transfused in the medical intensive care unit at a tertiary care medical centre.
Cases: Patients who developed TACO (N=51)
Controls Patients without TACO (N=51)
Important prognostic factors2:
Age years median (IQ-range): Cases: 73 (57-81) Controls: 75 (64-82)
Sex, female N (%): Cases: 24 (47) Controls: 24 (47)
Predicted blood volume median (IQR) Cases: 5 (4.3-5.6) Controls: 4.8 (3.9-5.4)
Smoker number (%) Cases: 28 (54.9) Controls: 25 (49)
Alcohol abuse number (%) Cases: 9 (17.6) Controls: 5 (9.8)
Diabetes number (%) Cases: 16 (31.4) Controls: 17 (33.3)
Hypertension number (%) Cases: 19 (37.3) Controls: 24 (47.1)
Chronic kidney disease number (%) Cases: 10 (19.6) Controls: 13 (25.5) |
Transfusion rate of median (IQR) = 225 mL/hr (135-350) |
Transfusion rate of median (IQR) = 168 mL/hr (100-205) |
All patients were closely observed for the occurrence of a respiratory complication in the 24-hour period after transfusion. |
Transfusion rate of 225 mL/hr (IQR 135-350) compared to a median of 168 (100-205) increased the odds of developing TACO (OR = 1.88 95% CI (1.06 to 3.33)
Adjusted for age, sex, and the diagnostic category at the time of ICU admission.
|
|
|
Tseng, 2016 |
Cohort study, controlled-before-after study |
Inclusion criteria: All consecutive transfusions ordered for patients admitted to general internal medicine between June and August 2013. A post-intervention audit was conducted for 3 months between November 2013 and January 2014.
N total at baseline: I: N=62 C: N=68
Important prognostic factors2:
Age years mean (SD): I: 75.3 (14.7) C: 73.0 (16.8)
Sex, male N (%): I: 25 (40) C: 33 (48)
Comorbidity, cerebrovascular N (%): I: 12 (19) C: 19 (28)
Comorbidity, coronary artery disease N (%): I: 49 (79) C: 54 (79)
Comorbidity, renal N (%): I: 22 (36) C: 15 (22) |
Implementation of ‘pre-transfusion checklist’, including items on risk factors for circulatory overload. |
Usual care. |
Not specified. |
Amongst patients admitted to general internal medicine, no cases of TACO were observed during the study period.
TACO: I: 0 events / N=62 C: 0 events / N=68 RD = 0
No adjustment for possible confounding factors. |
|
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors ((potential) confounders).
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Sarai, 2015 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Yes |
No |
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table et cetera).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (for example Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (for example funnel plot, other available tests) and/or statistical tests (for example Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Risk of bias table for intervention studies (randomized controlled trials)
Research question:
Wat is de effectiviteit van preventieve maatregelen om TACO te voorkomen bij patiënten met een risicoprofiel?
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Gupta 1983 |
Randomised, no details provided |
Unclear |
Likely |
Likely |
Likely |
Likely |
Unclear |
Unlikely |
|
Nand 1985 |
Randomised, no details provided |
Unclear |
Likely |
Likely |
Likely |
Likely |
Unclear |
Unlikely |
|
Nand 1986 |
Randomised, no details provided |
Unclear |
Likely |
Likely |
Likely |
Likely |
Unclear |
Unlikely |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear.
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Risk of bias table for intervention studies (observational: non-randomized clinical trials, cohort and case-control studies)
Research question:
Wat is de effectiviteit van preventieve maatregelen om TACO te voorkomen bij patiënten met een risicoprofiel?
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Li, 2011 |
Unlikely |
Unlikely |
Unlikely |
Likely |
|
Tseng, 2016 |
Unlikely |
Unlikely |
Unlikely |
Likely |
- Failure to develop and apply appropriate eligibility criteria: a) case-control study: under- or over-matching in case-control studies; b) cohort study: selection of exposed and unexposed from different populations.
- 2 Bias is likely if: the percentage of patients lost to follow-up is large; or differs between treatment groups; or the reasons for loss to follow-up differ between treatment groups; or length of follow-up differs between treatment groups or is too short. The risk of bias is unclear if: the number of patients lost to follow-up; or the reasons why, are not reported.
- Flawed measurement, or differences in measurement of outcome in treatment and control group; bias may also result from a lack of blinding of those assessing outcomes (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Failure to adequately measure all known prognostic factors and/or failure to adequately adjust for these factors in multivariate statistical analysis.
Exclusietabel
|
Auteur en jaartal |
Redenen van exclusie |
|
Alam 2013 |
Niet-systematische literatuurstudie. |
|
Andrzejewski 2013 |
Niet-systematische literatuurstudie. |
|
Blumberg 2010 |
Geen preventieve interventie voor TACO. De studie vergelijkt het gebruik van leuko-gereduceerde producten met niet-leuko gereduceerde producten op het optreden van TACO. Momenteel worden in Nederland standaard leuko-gereduceerde producten gebruikt. |
|
Frazier 2017 |
Niet-systematische literatuurstudie. |
|
Fry 2010 |
Geen interventiestudie. Beschrijving frequentie van interventies voor de preventie van het optreden van TACO. Beschrijving klinische kenmerken van patiënten die een preventieve interventie hebben ondergaan. |
|
Lieberman 2013 |
Geen interventiestudie. Beschrijving klinische kenmerken van patiënten die TACO hebben ontwikkeld. |
|
Mahasandana 1979 |
Niet-systematische literatuurstudie. |
|
Narick 2012 |
Geen interventiestudie. Beschrijving incidentie van het optreden van TACO. |
|
Rana 2006 |
Geen uitkomsten voor TACO. |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 15-10-2020
Laatst geautoriseerd : 26-06-2020
Geplande herbeoordeling :
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
De transfusierichtlijn geeft ten eerste antwoorden op grote uitgangsvragen over wie, wanneer, hoe, hoeveel en met welke producten getransfundeerd wordt en wat daarvan volgens wetenschappelijk onderzoek aan voordelig/nadelig resultaat verwacht mag worden. Na het bepalen van de wetenschappelijke waarde van dit onderzoek, worden uiteindelijk aanbevelingen opgesteld, gebaseerd op de conclusies van het wetenschappelijke onderzoek en na het beschouwen van een additionele context van bijvoorbeeld kosten- ethische, maatschappelijke of wettelijke overwegingen. Deze aanbevelingen zijn bedoeld om verantwoord en wenselijk handelen voor leden van de beroepsgroep te definieren in de voorkomende dagelijkse klinische praktijk. Echter, er kan beargumenteerd altijd afgeweken worden van de algemene aanbevelingen en gekozen worden voor een meer op de individuele patient afgestemde ondersteuning.
Doelgroep
Naast de genoemde beoogde gebruikers van de richtlijn is de richtlijn ook bedoeld en van waarde voor de collega’s van de nationale bloedvoorzieningsorganisatie Sanquin.
Samenstelling werkgroep
Voor de herziening van de richtlijn zijn er in 2016 zes multidisciplinaire werkgroepen ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij patiënten die een bloedtransfusie nodig hebben. Een stuurgroep, bestaande uit de voorzitters van de deelprojecten, coördineerde de werkgroepen.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep Plasmatransfusies
- Dr. J.W.P.H (Hans) Soons, laboratoriumspecialist klinische chemie, voorzitter, NVKC
- Dr. E.A.M. (Erik) Beckers, internist-hematoloog/ transfusiespecialist, NIV
- Drs. K.A. (Klasien) Bergman, kinderarts-neonatologie, NVK
- Dr. M. (René) van Hulst, ziekenhuisapotheker, NVZA
- Prof. dr. K. (Karina) Meijer, internist-hematoloog, NIV
- Dr. M.C.A. (Marcella) Müller, internist-intensivist, NVIC
- Dr. E.C.M. (Lizzy) van Pampus, internist-hematoloog/transfusiespecialist, NIV
- Dr. M. (Marjolein) Peters, kinderarts-hematoloog, NVK
- Drs. K.M.E.M. (Koen) Reyntjens, anesthesioloog, NVA
Werkgroep Transfusiereacties en gerelateerde aandoeningen
- Dr. M.R. (Martin) Schipperus, internist-hematoloog, voorzitter, NIV
- Dr. J.L.P. (Hans) van Duijnhoven, laboratoriumspecialist klinische chemie, NVKC
- Drs. C.T. (Christian) Favoccia, anesthesioloog, NVA
- Prof dr. C.J. (Karin) Fijn van Draat, hoogleraar kinderhematologie/ senior onderzoeker Sanquin research, NVK
- G.H. (Judith) Lie, hemovigilantiefunctionaris, weefselvigilantiecoördinator, NVML
- Dr. T. (Tanja) Netelenbos, internist-hematoloog, NIV
- M.R. (Michaela) van Bohemen, verpleegkundige n.p., hemovigilantieconsulent V&VN (vanaf juli 2018)
- Dr. J. (Jennita) Slomp, laboratoriumspecialist klinische chemie en hematologie, NVKC
- Dr. D. (Dik) Versteeg, arts-microbioloog, NVMM (tot juli 2018)
- Dr. J. H. (Jan) Marcelis arts-microbioloog, NVMM (vanaf juli 2018)
- Dr. A.P.J. (Alexander) Vlaar, internist-Intensivist, NVIC
- Dr. J.C. (Jo) Wiersum-Osselton, TRIP hemo- en biovigilantie, landelijk coördinator, , arts M&G, NVDG
Met ondersteuning van:
- Drs. E.E. (Eva) Volmeijer, adviseur Kennisinstituut van de Federatie Medisch Specialisten, projectleider
- Drs. T. (Tessa) Geltink, junior adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Dr. R. (Roy) Elbers, adviseur Kennisinstituut van de Federatie Medisch Specialisten
- S. (Sonja) Wouters, projectsecretaresse Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Voorzitters (kerngroep) |
||||
|
M. Schipperus |
Internist-hematoloog (100%) |
Voorzitter Bestuur Stichting TRIP (Transfusie in patiënten), onbetaald |
ITP-onderzoek gefinancierd door AMGeN Advisory board Novartis |
Lid participeert niet in besluitvorming omtrent producten van AMGEN of Novartis. |
|
A. Koopman- van Gemert |
Anesthesioloog |
Diverse functies bij nationale en internationale commissies bv Concilium, Stuurgroep antistolling, examencommissie et cetera Internationaal lid van de Europese examencommissie |
-Participatie in de PETS-studie van het EMC, geen financiële relatie. -Participatie in verschillende onderzoeken (geen financiële relatie en geen direct verband bloedtransfusie) -Organisatie symposia met sponsoring (geen directe financiële relatie en direct verband bloedtransfusie) |
Geen restricties |
|
J.J. Zwaginga |
Hematoloog LUMC (Leiden), Transfusiespecialist, Hoogleraar transfusiegeneeskunde |
-Penningmeester VHL=Vereniging Hematologische laboratoria -Voorzitter van de benigne hematologische werkgroep van NVvH |
-Sprekershonoraria Viforpharma (ijzer: medicatie kan transfusies uitsparen) -Wetenschappelijke adviesraad: Novantis (ijzerchelatie kan transfusie gemedieerde ijzerstapeling opheffen) - Gilead: CLL medicatie webcast geen relatie met transfusiebeleid PI van meerdere Sanquin onderzoeken ogv - allumminisatie door RBC transfusies - ijzertoxiciteit door bloedtransfusies - bloedings IRM (voldoende) plaatjestransfusies et cetera |
Lid participeert niet in besluitvorming omtrent Novartis en wanneer SANQUIN-studies worden geïncludeerd waarbij lid een van de auteurs is |
|
E. Beckers |
Internist-hematoloog/transfusiespecialist MUMC + Maastricht |
Bestuurslid Ned. Ver. Bloedtransfusie, onbetaald - Bestuurslid Ned. Ver. Hematologie, onbetaald - Lid adviesraad TRIP (Transfusie Reacties in Patiënten), onbetaald - Lid Landelijke Gebruikers Raad Sanquin, onbetaald - Lid Stuurgroep TiN studie (Trombocytopathie in Nederland) |
Project 'Predictors of Bleeding' externe financiering door Bayer
Transparantieregister.nl: sprekers vergoeding van Roche; gastvrijheidsbijdrage van: Roche, Pfizer, Sanquin en Bayer |
Lid participeert niet in besluitvorming omtrent producten van Bayer en Roche en wanneer specifiek de studie "predictors of bleeding" (gefinancierd door Bayer) worden geïncludeerd |
|
J. Slomp |
Laboratorium specialist Klinische Chemie en hematologie MST/Medlon |
-Bestuurslid VHL - onbetaald -Bestuurslid NVvH - onbetaald -Werkgroep Bloedtransfusie VHL (vz.) onbetaald -Lid LGR onbetaald - - Lid Expert committee TRIP (onbetaald) |
-Medical Advisory Board Janssen: advies omtrent bloedtransfusie bij patiënten die daratumumab gebruiken, betaald - In samenwerking met UMCU en VU bezig om een landelijk protocol op te stellen voor bloedtransfusie en daratumumab |
Lid participeert niet in besluitvorming omtrent productn van Janssen (daratumumab) |
|
H. Soons |
Laboratoriumspecialist Klinische Chemie, St. Anna Ziekenhuis (1 fte) en Kempenhaeghe (detachering vanuit St. Anna Ziekenhuis)
|
-Bestuur Nederlandse Vereniging voor Bloedtransfusie (NVB), voorzitter, onbetaald -Bestuur Transfusie Reacties in Patiënten (TRIP), secretaris, vacatiegeld - Medisch Advies Raad Sanquin (MAR), lid, vacatiegeld -Lid Landelijke Gebruikersraad Sanquin (LGR), onbetaald |
|
Geen restricties |
|
Werkgroep laboratoriumaspecten |
||||
|
H. de Wit |
Laboratoriumspecialist Klinische Chemie en Hematologie, Certe |
-Bestuurslid/ penningmeester Nederlandse Vereniging voor Bloedtransfusue (onbetaald) - Bestuurslid/ penningmeester Stichting Vrienden van de NVB (onbet aald) |
|
Geen restricties |
|
K. de Vooght |
Laboratoriumspecialist Klinische Chemie, Hoofd Patiëntenzorg LKCH ad interim |
Bestuurslid/ penningmeester Stichting TRIP (onbetaald) - Bestuurslid/voorzitter Stichting vrienden van de Utrechtse bloedbank (onbetaald) - Lid Werkgroep Consortium Transfusiegeneeskundig Onderzoek (onbetaald) - Lid PROTON II Adviesraad (onbetaald) - Lidmaatschap NVB - Lidmaatschap NVvH - Docent OKU (Onderwijs Kring Utrecht) (betaald) -Docent PAO Farmacie (betaald) -Lid Wetenschappelijke commissie NVB/TRIP symposium (onbetaald) |
|
Geen restricties |
|
C. Folman |
Manager Laboratorium Erytrocytenserologie (Sanquin) |
- Docent Hogeschool Arnhem en Nijmegen, betaald - Lid TRIX-werkgroep, onbetaald - Secretaris werkgroep Bloedtransfusie van de VHL (Vereniging Hematologische Laboratoriumdiagnostiek), onbetaald - Lid Expert Committee TRIP (Transfusie Reacties In Patiënten), onbetaald -Lid wetenschappelijke commissie NVB (Nederlandse Vereniging voor Bloedtransfusie), onbetaald" |
- Dienstverband Sanquin - werkzaam in expertiselaboratorium waar onderzoek wordt gericht voor derden op het gebied van bloedtransfusie |
Werkgroeplid is geen trekker/primaire auteur bij uitspraken over diagnostiek.
|
|
M. de Haas |
-Bijzonder hoogleraar Translationele Immunohematologie (bezoldiging Sanquin, onbezoldigd aangesteld bij LUMC -Clustermanager Immunohematologie Diagnostiek |
- Secretaris NVB (tot mei 2017) |
-Dienstverband Sanquin -Hoofd van een expertiselaboratorium dat ingezet zou kunnen worden door derden voor het uitvoeren van (uit de richtlijn voortkomende) laboratoriumdiagnostiek |
Werkgroeplid is geen trekker/primaire auteur bij uitspraken over diagnostiek.
|
|
H. Russcher |
Laboratoriumspecialist Klinisch Chemie en Hematologie, in het Erasmus MC en Havenziekenhuis |
- Auditor RvA i.h.k.v. ISO 15189:2012 voor medische laboratoria - Betaald |
|
restricties t.a.v. producten van Roche diagnostiek.Gebruikersraad geen belangen tav Sanquin, geen restriicties |
|
N. Som |
Senior hoofdanaliste bloedtransfusiedienst VUmc |
- Hemovigilantiecoördinator Vumc |
|
Geen restricties |
|
J. Lie |
-Stafadviseur hemovigilantie 24,8 uur -Weefselvigil antiecoördinator 7,2 uur" |
-Contactpersoon voor landelijk Bureau TRIP: meldingen transfusiereacties en bijwerkingen - Voorzitter landelijk Hemovigilantoe Platform Nederland (vanaf 2016, eerder lid, mede oprichter HPN), onbetaald - Voorzitter en oprichter Regionaal Hemovigilantie Platform Zuidoost - BestuursLid NVB |
|
Geen restricties |
|
Werkgroep Anemie |
||||
|
A. Van Gammeren |
Laboratoriumspecialist Klinische Chemie
|
|
|
Geen restricties
|
|
N. Juffermans |
Intensivist |
Chief editor Netherlands Journal of Critical Care, vergoeding |
|
Geen restricties
|
|
K. Bergman |
Kinderarts-neonatologie, Beatrix kinderziekenhuis, UMCG ten Groningen (0,9fte). Als kinderarts-neonatologie voorzitter van het Regioteam Perinatale Audit Noord Nederland (Perined). Deze functie (0,1fte) wordt uitgeoefend binnen de UMCG aanstelling. |
-Lid programmacommissie Prenatale screening infectieziekten en erytrocyten-immunisatie RIVM namens NVK (vacatiegeld) -Lid werkgroep neonatale infectieziekten sectie neonatologie NVK (onbetaald) -Projectcommissielid ZonMw project: Introduction of Audit generated Changes in perinatal care using ""Tailored"" implementation strategies. (ACTion-project) (onbetaald) =Projectcommissielid 5 genes per minute, afdeling Medische genetica, UMCG, Groningen (onbetaald) |
|
Geen restricties
|
|
P. te Boekhorst |
Internist-Hematoloog / Transfusiespecialist
|
Medisch Adviesraad Sanquin, Lid, Vacatiegeld
|
In verleden: - Gastvrijheid Firma Alexion - Adviesraad Firma AmgeN (ITP) |
Lid participeert niet bij besluitvorming omtrent ITP |
|
B. Biemond |
Internist-hematoloog |
|
|
Geen restricties |
|
L. Oosten |
Hematoloog, Afdeling Immunohematologie & Bloedtransfusie bij het Leids Universitair Medisch Centum |
|
|
Geen restricties |
|
K. Fijn van Draat |
-Hoogleraar kinderhematologie AMC - Senior onderzoeker Sanquin Research |
VIDI selectiecommissie ZONMW, onbetaald (wel vacatievergoeding) |
Lid van de stuurgroep van de PLANET-2 studie die onderzoek doet naar triggers van trombocytentransfusie bij neonatenop de Neonatale Intensive Care Unit. PLANET-2 ontvangt geen sponsoring van de farmaceutische industrie |
Geen restricties |
|
Werkgroep trombocytentransfusies |
||||
|
A. Vlaar |
- Internist-Intensivist, Academisch Medisch Centrum, Amsterdam - Principal investigator Infusion related morbidity and mortality in the critically ill |
- Klinisch brug figuur Sanquin, onbetaald
|
Onderzoek gefinancierd door NWO, ZonMW, Sanquin: PI van de PACER studie (onder andere): hierbij worden trombotriggers voor invasieve ingrepen aangehouden. |
Geen restricties (ten aanzien van PACER studie: geen tegengesteld belang. Studie wordt niet gepubliceerd binnen termijn afronding richtlijn). |
|
l. van Pampus |
Internist-hematoloog-transfusiespecialist Radboudumc |
- Vice voorzitter hemovigilantiekamer TRIP (onbezoldigd)
|
Tegemoetkoming verblijfkosten Dublin (Ierland) het 17th Annual NATA Symposium on Patient Blood Management, Haemostasis and Thrombosis (NATA 2016) cf de CGR-rgels. |
Geen restricties |
|
G. Jansen |
Internist-hematoloog, afdeling Hematologie, Erasmus MC |
Post doctoraal onderzoeker bij afdeling Plasmaeiwitten, Sanquin Bloedvoorziening. Gastvrijheidovereenkomst, onbetaald |
"1) Naam project: ""Surface sialic acid is critical for platelet survival"" Financier: Sanquin Product and Process development (PPOC nr. 13-019). Bedrag: 499.000 euro. Rol: AIO project 2013-2018. Principal investigator en co-promotor
Toelichting: van dit geld is een OIO aangesteld (Mw M. Rijkers) die in dienst van Sanquin (1,0 fte) dit onderzoek verricht" |
Bij onderwerp sialic acid en trombocytenoverleving geen trekker /betrokkenheid opstellen aanbevelingen |
|
J.L. Kerkhoffs |
Internist - Hematoloog (0,8 FTE)
|
Transfusie-specialist / transfusie research (0,2 FTE) via Sanquin
|
Op Sanquin verricht ik klinisch transfusie onderzoek wat deels gefinancieerd wordt door de industrie TerumoBCT: PI van de PREPAReS studie, een RCT naar de klinische effectiviteit van trombocyten concentraten behandeld met een pathogeen-reductie proces (Mirasol, TERUMO BCT).
|
Restricties t.a.v. producten behandeld met pathogeen reductie proces en biomarkers. Deze onderwerpen zijn vooralsnog niet geprioriteerd voor de richtlijn, dus geen restricties nodig.
|
|
R. Schutgens |
Internist-hematoloog
|
Lid van Medische Adviesraad patiëntenvereniging ITP |
-Speakersfee (voor instituut) en/of unrestricted research grant en/of lid advisory board van: Bayer, Baxalta, CSL Behring, NovoNordisk, Sanquin, Pfizer, Bristol-Meyers Squibb -Principal Investigator van de Trombocytopathie in Nederland (TiN) studie, mede gefinancierd door een unrestricted grant van Sanquin - deelname (in UMCU) ontwikkeling PACT en U-PACT (geen financieel belang) |
Geen betrokkenheid vragen bij bloedplaatjesfunctietest (PACT). Deze onderwerpen zijn vooralsnog niet geprioriteerd voor de richtlijn, dus geen restricties nodig. |
|
M. Coppens |
Internist-vasculaire geneeskunde
|
- Diverse naschollingen en adviesraden (allen incidenteel) aangaande directe orale anticoagulantie georganiseerd door de fabrikanten van deze middelen, te weten Boehringer Ingelheim, Bayer, Pfizer, Bristol-Meyers Squibb, Daiichi Sankyo. Deze diensten zijn betaald, waarbij het geld naar mijn instituut gaat - Adviesraad aangaande 'The future of hemophilia treatment' georganiseerd door CSL Behring. Twee maal een advisory board; in 2015 en 2016. Deze diensten zijn betaald waarbij geld naar instituut gaat. CSL Behring produceert o.a. Haemocomplettan P (fibrinogeenconcentraat) en Beriplex (vierfactorenconcentraat). De huidige richtlijn zal mogelijk off-label gebruik van deze 2 middelen gaan bespreken. De genoemde adviesraad richtte zich op hemofilie A en B en de producten Haemocomplettan P en Beriplex zijn hier niet aan de orde geweest." |
Lid van de Stuurgroep van de Trombopathie in Nederland studie (geen financiele belangen). -Sanquin Blood Supply: Prothrombin Complex Concentrate (PCC) for the immediate reversal of the anticoagulant effects if new oral anticoagulants in emergency situations. Sanquin Blood Supply is producent van Cofact, een PCC, - CSL Behring: Biomarkers to detect subclinical arthropathy and predict long-term clinical arthropathy in patients with hemophilia. This project was awarded a 2016 Heimburger Award. CSL Behring produceert zowel Haemocomplettan P (fibrinogeenconcentraat) als Beriplex (een PCC), Dit project is gecofinancierd door CSL Behring, maar hebben geen betrekking op Haemocomplettan P noch Beriplex. |
Geen betrokkenheid opstellen aanbevelingen t.a.v. fibrinogeenconcrentraat en vierfactoren concentraat |
|
E. Lopriore |
Sectiehoofd Neonatologie WAKZ/LUMC |
Lid bloedtransfusiecommissie LUMC |
Onderzoek gefinancieerd door Sanquin: 1. PROC 12-012-027: Matisse studie: RCT in neonaten naar twee verschillende triggers voor trombocyten transfusies 50 vs 25; Promovenda: Suzanne Gunnink 2. PROC 16-33: Promotie onderzoek naar Rhesus hemolytische ziekt: Promovenda: Isabelle Ree |
Geen restricties |
|
H. van Ommen (meelezer) |
Kinderhematoloog |
|
'- PI Einstein junior (Bayer) Behandeling trombose bij kinderen - PI Hokusai kinderen (Daiichi Sankyo) Behandeling trombose bij kinderen - Nationaal coördinator BMS studie Apixaban ter preventie van trombose bij kinderen met een hartafwijking |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afstemming met de Patiëntenfederatie, Stichting Zeldzame Bloedziekten en Oscar Nederland. Deze verenigingen zijn uitgenodigd voor de invitational conference (knelpuntenanalyse) voorafgaand aan deze herziening en hebben input geleverd voor de te prioriteren vragen. De verenigingen hebben aangegeven graag in de commentaarfase de conceptrichtlijn te ontvangen voor commentaar. Tevens zal in de eindfase van deze richtlijn nog worden overlegd over de communicatie aan patiënten en of er nog aanvullende teksten voor patiënten kunnen worden opgesteld.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan zal bij afronding van de richtlijn te vinden zijn bij de aanverwante producten. De werkgroep zal tevens de interne kwaliteitsindicatoren die bij de Richtlijn bloedtransfusie 2011 zijn opgesteld beoordelen en indien nodig door ontwikkelen.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitters van de werkgroepen en de adviseurs de knelpunten. De werkgroepen beoordeelden de aanbevelingen uit de eerdere richtlijn Bloedtransfusiebeleid (2011) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door patiëntenverenigingen en andere aanwezigen tijdens de Invitational conference. De werkgroepen stelden vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitters en de adviseurs concept-uitgangsvragen opgesteld. Deze zijn in de werkgroepen besproken waarna de werkgroepleden de definitieve uitgangsvragen hebben vastgesteld. Vervolgens inventariseerden de werkgroepen per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroepen waardeerden deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroepen tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen en systematische reviews (Medline). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje “Overwegingen”.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk om mee te wegen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs, de belangrijkste overwegingen en de weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn word aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren worden verzameld en besproken met de werkgroepen. Naar aanleiding van de commentaren word de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroepen. De definitieve richtlijn word aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html. 2012.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
