Transfusiebeleid niet-cardiochirurgische chirurgie
Uitgangsvraag
Is een liberaal of restrictief transfusiebeleid geïndiceerd bij perioperatieve patiënten?
Aanbeveling
- Transfundeer perioperatief bij electieve (m.n. onderzochte orthopedische, maar niet onlogisch ook oncologische) chirurgie en de gecontroleerd bloedende patiënt zonder comorbiditeit in de stabiele fase restrictief bij een Hb < 4,5 mmol/l.
- Overweeg op patiënt specifieke basis een eventueel hogere transfusietrigger van 5 mmol/l bijvoorbeeld bij:
- Patiënten met een beperkte cardiopulmonale compensatiemogelijkheden of tekenen van cardiale ischemie
- Ouderen (>65 jaar) met pre-operatieve anemie
- Transfundeer 1 unit rode bloedcellen per keer en monitor het Hb.
- Stem bij overplaatsing van de verkoever naar de verpleegafdeling af of bij de patiënt hetzelfde restrictief beleid gehandhaafd kan worden. Bespreek dit met de operateur
Voor pre-operatieve optimalisatie van het Hb en bloedbesparende technieken wordt verwezen naar de module Anesthesiologische maatregelen om het perioperatief bloedverlies te verminderen.
Voor perioperatieve situaties waarin ongecontroleerd bloedverlies ontstaat wordt verwezen naar de module Combinatie van bloedbesparende technieken.
Overwegingen
Onderzochte triggers in de studies
De transfusie triggers in de onderzochte studies bij perioperatieve patiënten verschillen tussen de studies. De restrictieve arm betreft over het algemeen een Hb trigger van 7 tot 8 g/dL (4,3- 5,0 mmol/L). Met een liberale trigger wordt meestal een Hb trigger van 9 tot 10 g/dl (5,6- 6,2 mmol/L) bedoeld. Het betreffen triggers voor post- en intra-operatieve bloedtransfusies. In de vorige richtlijn werd op basis van de Hebert-studie de 4-5-6-regel geïntroduceerd. Daarin werd de 7 g/dl (= 4.3 mmol/l) afgerond naar 4 mmol/l. Echter de in de studies gehanteerde restrictieve triggers waren in dit opzicht altijd hoger dan de 4 mmol/l van de regel en meestal werd ook 8 g/l = 5 mmol/L als zodanig bestudeerd. In deze richtlijn besloten we dus m.n. iets zuiverder de bestudeerde restrictieve trigger afteronden en werden de volgende definities gebruikt:
- Liberale trigger: Hb < 5,6 mmol/l
- Restrictieve trigger: Hb < 4,5 mmol/l.
Algehele overwegingen.
Onze overwegingen berusten op RCTs zoals beschreven onder de samenvatting van de literatuur (Carson 1998 en 2011, Foss 2009, Gregerson 2014, Grover 2006, Lotke 1999, Markatou 2012, Nielsen 2014, Parker 2013; de Almeida, 2015). Deze studies laten met een matige bewijskracht zien dat de mortaliteit en ligduur in het ziekenhuis waarschijnlijk niet verschillend zijn met een liberaal of restrictief beleid. Ook in een 3 jaar follow-up van de FOCUS-studie bij heupfracturen werd er geen verschil gezien tussen de restrictieve en liberale groep (Carson 2014). Echter (anders dan bij cardiochirurgie of patiënten op de intensive care) lijkt ter voorkoming van een nieuw myocardinfarct of voorkomen van hartfalen een voordeel voor een liberale trigger te bestaan. Voor patiënten die cardiochirurgie ondergingen, voor patiënten op de intensive care en patiënten met een acuut myocardinfarct wordt verwezen naar de desbetreffende modules. Tevens zijn m.n. patiënten rond orthopedische operaties bestudeerd. T.a.v. de oncologisch chirurgische patiënt ontbreken gegevens maar lijkt eenzelfde restrictief beleid logisch.
Het over het algemeen goed verdragen van een restrictieve trigger geldt voor patiënten in een stabiele fase. Bij patiënten die nog bloeden kan het zijn dat de reeds bij een hogere trigger getransfundeerd moet worden, dit in verband met het “achterlopen” van de uitslagen van de Hb- en stollingsmetingen. Streef echter perioperatief bij electieve chirurgie en de gecontroleerd bloedende patiënt zonder comorbiditeit in de niet stabiele fase naar een Hb van 4,5 - 5 mmol/l. Daarnaast zal perioperatief gemeten fysiologische parameters, zoals bloeddruk, hartfrequentie en gemeten bloedverlies gebruikt worden als trigger. De in 2016 verrichtte ETPOS studie liet zien dat een geisoleerde Hb-trigger slechts in 8.5% gehanteerd werd, maar dat combinaties met fysiologische triggers (met name hypotensie 55,4% en tachycardie 30,7%), comorbiditeit (cardiovasculair 35,7%), en bloedverlies het meest het geven van een bloedtransfusie bepaalde (Meier 2016). Het geven van een bloedtransfusie als vulling in plaats van een plasmavervangmiddel werd niet als motief opgegeven.
De snelheid en mate van daling van het Hb wordt soms slechter ervaren, dan het bereiken van een laag Hb perse. Patiënten die een een Hb-daling van tenminste 50% ondergingen hadden 27 resp 53% meer complicaties ook al bleef de Hb-trigger boven de in de cardiochirurgie gebruikte Hb-trigger van 4,2 mmol/l (Hogervorst 2014; Karkouti 2004).
Leeftijd en comorbiditeit.
Een zorg is dat oudere patiënten een restrictieve trigger, niet goed verdragen. Op hogere leeftijd kan een laag hemoglobinegehalte namelijk minder goed of snel gecompenseerd worden door toename van de hartfrequentie, hartvolume en ademhalingsfrequentie. Tevens moet bij de oudere patiënt eerder gedacht worden aan additionele fysiologische beperkingen door bv. medicatie, als beta-blokkers of antihypertensiva. Ook kunnen narcose gerelateerde cognitieve dysfunctie of moeite van de patiënt om de klachten goed te benoemen, mee gewogen te worden. Patiënten met een pre-operatieve anemie zijn door de oorzaak van deze anemie mogelijk ook extra kwetsbaar. Een exacte leeftijdsgrens is echter moeilijk vast te stellen, omdat er heel veel individuele verschillen zijn. Per patiënt zal individueel het risico moeten worden afgewogen.
Onderbouwing
Achtergrond
Perioperatieve anemie heeft twee oorzaken te weten multicausaal veroorzaakte preoperatieve anemie, niet zijnde een acute bloeding en perioperatief “gecontroleerd” bloedverlies met als gevolg per- en postoperatieve anemie. Bloedmanagementprogramma’s richten zich op het voorkomen/ beperken van bloedtransfusies tijdens en na de operatie door preoperatieve maatregelen. Dit bloedmanagementbeleid is echter geen deel van deze uitgangsvraag. Wel is het mogelijk dat patiënten met een door preoperatieve beleid hoger Hb, een plotse en grotere daling van het Hb slechter ervaren dan patiënten die dezelfde trigger bereiken vanuit een lager uitgangs-Hb. In cardiochirurgie vond men dat een daling van tenminste 50% gepaard ging met een 27 resp. 53% meer complicaties (Hogervorst 2014; Karkouti 2008). In deze module wordt behandeld de perioperatieve anemie ontstaan door “gecontroleerd” bloedverlies. De werkgroep heeft voor gecontroleerd bloedverlies de volgende definitie gekozen: “bloedverlies dat perioperatief plaatsvindt en waarbij over het algemeen door infuus- en transfusietherapie een normovolaemische conditie gehandhaafd wordt”
Van belang verder is te realiseren dat perioperatief hypothermie, rillen of pijn eerder kunnen leiden tot verhoogde zuurstofbehoefte van de patiënt en behandelt dient te worden. Het perioperatieve transfusiebeleid bij niet-cardiale chirurgie is de laatste jaren uitgebreid - maar met name retrospectief- onderzocht. Hieruit bleek dat preoperatieve anemie associeerde met een slechte uitkomst, maar bloedtransfusie ook. Belangrijk in deze beschreven relaties blijft het risico op “confounding by indication”. Het effect van correctie van deze anemie door transfusies maar ook door ijzer of EPO therapie, op morbiditeit en mortaliteit kan dus alleen middels RCTs worden onderzocht. Los van de op zich nog niet opgeloste causaliteit van bloedtransfusies met slechte outcome - is het zoveel mogelijk voorkomen van bloedtransfusies door preoperatief bloedmanagement altijd een goede zaak. De laatste tijd is preoperatief bloedmanagement met name gericht op het verhogen van het Hb middels het bestrijden van bij veel patiënten aanwezige ijzerdeficiëntie met iv of oraal ijzer. Als met dergelijke maatregelen het Hb verhoogd wordt is het evident dat de transfusiebehoefte in meer of mindere mate afneemt. Pre-operatieve optimalisatie en bloedbesparende technieken zullen in een andere module (jaar 2) verder worden behandeld.
Reeds jaren is gezocht naar optimale patiënt specifieke transfusietriggers ook in de perioperatieve setting. In 2016 bleek uit de in 126 landen dat bij 18% van perioperatief een bloedtransfusie toegediend wordt maar dat in 59 % een transfusie tenminste ten dele was gegeven op basis van fysiologische tekenen van ondervulling en slechts in 8,5% op basis van alléén een Hb trigger (ETPOS-studie). De werkgroep realiseert zich dat in de literatuur geen gerandomiseerde studies gedaan zijn naar fysiologische transfusietriggers of naar een combinatie van Hb-triggers met fysiologische triggers. De werkgroep heeft zich gericht op Hb-triggers (oftewel op liberaal vs restrictief beleid). Natuurlijk geldt ook bij deze patiëntengroep dat alleen de genoemde restricties onderzocht zijn. Derhalve of meer restrictie – dus met nog lagere Hb triggers- mogelijk zijn is onduidelijk en zou ook in deze patiëntengroep onderwerp van nieuwe RCTs kunnen zijn (Shander, 2014; Carson, 2014). Voor een samenvatting van de fysiologie van zuurstoftransport en de compensatie bij zeer lage Hbs wordt verwezen naar de algemene inleiding van deze module.
Verder vallen buiten deze module:
- Patiënten die een cardiochirurgische ingreep ondergaan (zie module Transfusiebeleid bij patiënten die cardiopulmonale chirurgie ondergaan)
- Patiënten met massaal bloedverlies als calamiteit bij een ingreep, zie de module bloedingen en bloedbesparende technieken (zal later worden toegevoegd)
- Patiënten die postoperatief op de IC belanden zie de module Transfusiebeleid voor IC-patiënten
Conclusies
Mortaliteit na 30 dagen
|
Matig GRADE |
Het is waarschijnlijk dat er geen verschil is in mortaliteit bij een restrictief versus een liberaal transfusiebeleid.
Carson 1998 en 2011, Foss 2009, Gregerson 2014, Grover 2006, Lotke 1999, Markatou 2012, Nielsen 2014, Parker 2013; de Almeida, 2015 |
Kwaliteit van leven
|
Laag GRADE |
Er zijn onvoldoende betrouwbare gegevens om een conclusie te trekken over kwaliteit van leven of de incidentie van delier bij een restrictief versus een liberaal transfusiebeleid.
Parker 2013 |
Myocardinfarct
|
Matig GRADE |
Het risico op een nieuw myocardinfarct is waarschijnlijk lager met een liberaal transfusiebeleid dan met een restrictief transfusiebeleid.
Carson 2011, Fan 2014, Foss 2009, Grover 2006, Lotke 1999, de Almeida 2015 |
Congestief hartfalen
|
Matig GRADE |
Het risico op congestief hartfalen is enigszins lager met een liberaal transfusiebeleid dan met een restrictief transfusiebeleid.
Carson 2011, Foss 2009, Parker 2013, de Almeida 2015 |
Ligduur in het ziekenhuis
|
Hoog GRADE |
Er is geen verschil in ligduur in het ziekenhuis bij een restrictief versus een liberaal transfusiebeleid.
Carson 1998 en 2011, Fan 2014, Foss 2009, Gruber-Baldini 2013, So-Osman 2010, de Almeida 2015 |
Infecties
|
Matig GRADE |
Infecties als pneumonie en wondinfectie lijken minder vaak voor te komen bij een restrictief versus een liberaal transfusiebeleid.
Carson 1998 en 2011, Fan 2014, Foss 2009, Marketou 2012, Nielsen 2014, Parker, 2013, de Almeida 2015 |
Aantal units getransfundeerd
|
Matig GRADE |
Een restrictief beleid leidt tot minder units bloed ten opzichte van een liberaal beleid. Echter de resultaten in de verschillende studies zijn op verschillende manieren weergegeven wat het trekken van een kwantitatieve conclusie bemoeilijkt.
Carson 1998; DeAlmeida 2015; Gregerson 2014; Gruber-Baldini 2013; Nielsen 2014, de Almeida 2015 |
Samenvatting literatuur
NICE
Er werden acht studies geselecteerd voor deze patiëntengroep. Perioperatieve patiënten betroffen in dit geval patiënten die een operatie ondergingen in verband met een heupfractuur (Carson, 1998, Carson, 2011, Foss 2009), patiënten boven de 65 jaar die een totale heupprothese kregen (Fan, 2014), , patiënten die electieve onderste extremiteiten vervangingschirurgie ondergingen (Grover, 2006), patiënten die een totale knieprothese kregen (Lotke, 1999), patiënten die een grote abdominale operatie ondergingen (Markatou, 2012) en patiënten die een electieve heup- of knievervanging ondergingen (So-Osman, 2010).
Toegevoegde studies
De studie van Almeida (2015) beschrijft volwassen patiënten (n=198) die grote abdominale chirurgie ondergingen voor een oncologisch proces, waarbij vergeleken werd een restrictief (bij hemoglobinewaarde lager dan 9 g/dl; (5,6mmol/L), 1 eenheid erytrocytenconcentraat) (n=101) versus een liberaal (bij hemoglobinewaarde lager dan 7 g/dl (4,3 mmol/L), 1 eenheid erytrocytenconcentraat) (n=97) transfusiebeleid. De primaire uitkomstmaten van deze studie waren mortaliteit en morbiditeit gedurende 30 dagen follow-up. De uitkomsten worden in dit artikel voor veel uitkomstmaten gepresenteerd in percentages. Percentages kunnen niet meegenomen worden in de meta-analyse. Waar voldoende data beschikbaar waren zijn de percentages op basis van het aantal geïncludeerde patiënten in de studie (liberale groep 97 en restrictieve groep 101 patiënten) omgerekend naar absolute getallen. Waar deze omrekening is gedaan wordt dit expliciet gemeld.
De studie van Gregersen (2014) beschrijft patiënten van 65 jaar en ouder (n=184) die geopereerd werden in verband met een heupfractuur. In het artikel staat niet beschreven of ze een kophalsprothese kregen dan wel dat de fractuur gestabiliseerd werd met schroeven. Onderzocht werd restrictief transfusiebeleid (igv Hb< 6 mmol/l ten minst 1 eenheid erytrocytenconcentraat) (n=144) versus een liberaal beleid (streef Hb> 11,3 gr/dl = 7 mmol/l) (n=140) tot 30 dagen postoperatief. Onderzocht werd het verschil in mortaliteit, morbiditeit en herstel met een follow-up van 90 dagen.
De studie van Gruber-Baldini (2013) beschrijft 130 patiënten van 50 jaar of ouder (gemiddelde leeftijd 81,5 jaar) die geopereerd werden in verband met een heupfractuur met cardiovasculaire comorbiditeit dan wel daarvoor evidente risicofactoren (waarbij een liberaal beleid (Hb> 10 g/dl = 6,2 mmol/l) versus een restrictief transfusiebeleid (Hb> 8 g/dl = 5 mmol/l) werd vergeleken. Het betrof een aanvullende studie naar delier en ernst van de symptomen binnen de FOCUS-trial (zie ook Carson 1998 in NICE).
De studie van Nielsen (2014) beschrijft 67 patiënten die een revisie-operatie ondergingen van hun geïmplanteerde heupprothese. Onderzocht werd of er verschil was in de mobiliteit middels de “Timed Up and Go-test” (tijd nodig voor opstaan uit de stoel en over een lijn lopen) bij een restrictief beleid (1 eenheid RBC igv Hb< 7,3 g/dl = 4,5 mmol/l) versus een liberaal transfusiebeleid (1 eenheid RBC igv Hb< 8,9 g/dl = 5,5 mmol/l.
De studie van Parker (2013) beschrijft 200 patiënten die geopereerd werden in verband met een heupfractuur. Patiënten werden op de 1e of 2e dag geïncludeerd indien hun Hb daalde tot 8,0 – 9,5 g/dl (= 5,0-5,9 mmol/l). Patiënten binnen deze Hb-grenzen werden getransfundeerd tot een streef Hb van 10 g/dl (=6,2 mmol/l) in de liberale groep versus geen transfusie tenzij de patiënt klachten die te verklaren waren door de anemie. Onderzocht werd de mortaliteit, morbiditeit en postoperatieve complicaties tot een follow-up van 1 jaar.
Resultaten
Mortaliteit na 30 dagen
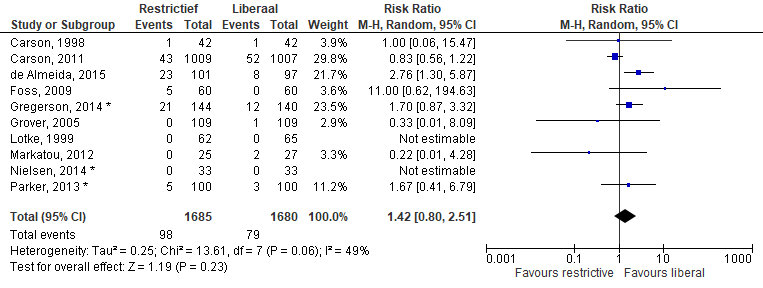
Mortaliteit na 30 dagen (zie Figuur 1) werd beschreven in tien studies (restrictief beleid 1584 patiënten, liberaal beleid 1583 patiënten). In de restrictieve groep overleden 98 van 1.685 (5,8%) patiënten in vergelijking met 79 van de 1.680 (4,7%) in de liberale groep. Meta-analyse van deze studies gaf een relatief risico van 1,45=2 [95%CI: 0,80 tot 2,51]. De studie van de Almeida meldt dat de meest gevonden doodsoorzaak septische schok en multi-orgaanfalen (n=24) was, daarna volgde noninfectieuze circulatoire shock (n=3), kanker-gerelateerde complicaties (n=3) en respiratoir falen (n=1).
Figuur 1 Meta-analyse uitkomstmaat: mortaliteit na 30 dagen
Kwaliteit van leven
Kwaliteit van leven (Figuur 2) is niet als koepelbegrip beschreven in de studies. Delier is door de werkgroep beschreven als een negatieve factor op kwaliteit van leven. Eén studie (Parker 2013) beschrijft de incidentie van delier: in de restrictieve groep had geen van 100 patiënten (0%) een delier in vergelijking met 3 van de 100 (3%) in de liberale groep (RR 0,14, 95%CI [0,01; 2,73]).
Figuur 2 Meta-analyse uitkomstmaat: kwaliteit van leven

Myocardinfarct
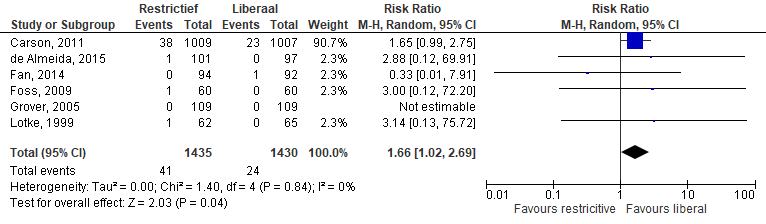
De uitkomstmaat myocardinfarct (Figuur 3) werd beschreven in zes studies (n=2.865). In totaal kregen in de restrictieve groep 41 van 1435 patiënten (2,9%) een nieuw cardiaal event in vergelijking met 24 van 1430 (1,7%) in de liberale groep. De percentages uit de studie van de Almeida werden hier omgerekend naar absolute getallen. Meta-analyse van deze studies gaf een verschil in de incidentie van nieuwe cardiale events wat betreft myocardinfarct (RR 1,66 (95%CI [1,02 tot 2,69]).
Figuur 3 Meta-analyse uitkomstmaat: myocardinfarct
Congestief hartfalen
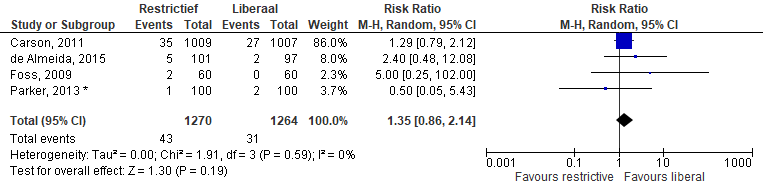
De incidentie van congestief hartfalen (Figuur 4) werd beschreven door vier studies. In de restrictieve groep hadden 43 van 1.270 (3.4%) van de patiënten congestief hartfalen in vergelijking met 31 van 1.264 (2,5%) in de liberale groep. De percentages uit de studie van de Almeida werden hier omgerekend naar absolute getallen. Meta-analyse gaf een relatief risico van 1,35 (95%CI [0,86 tot 2,14]).
Figuur 4 Meta-analyse uitkomstmaat: congestief hartfalen
Ligduur in het ziekenhuis
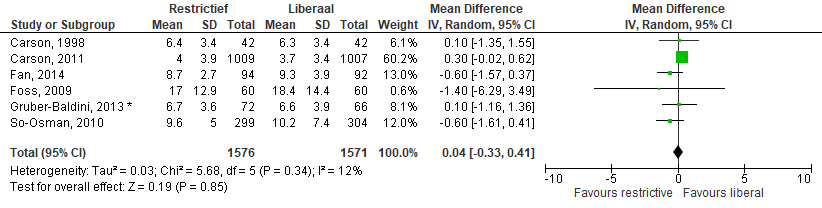
De gemiddelde ligduur in het ziekenhuis (Figuur 5) werd gerapporteerd in zes studies (restrictieve groep 1576 patiënten en liberale groep 1571 patiënten). Meta-analyse van deze studies gaf een gemiddeld verschil van 0,04 [-0,33; 0,41] opnamedagen in het ziekenhuis.
Figuur 5 Meta-analyse uitkomstmaat: ligduur in het ziekenhuis
Ook de studies Nielsen (2014), Parker (2013) en De Almeida (2015) zeggen iets over ligduur; echter, de data is niet op vergelijkbare manier weergegeven en kan derhalve niet gepoold worden meegenomen. Alle drie de studies rapporteren geen significant verschil tussen de restrictieve en liberale strategie. Nielsen (2014) presenteert in beide groepen een mediaan van 8 dagen verblijf in het ziekenhuis (P=0,71). Parker (2013) geeft zonder standaarddeviatie 21,8 dagen verblijf in het ziekenhuis in de transfusie groep versus 23,3 dagen in de groep zonder transfusie (P=0,64). De Almeida (2015) rapporteerde een mediane ziekenhuisopname duur van 13 dagen (IQR 10-20) in de liberale groep in vergelijking met 14 dagen (20-22) in de restrictieve groep (p=0,69).
Infecties
Pneumonie
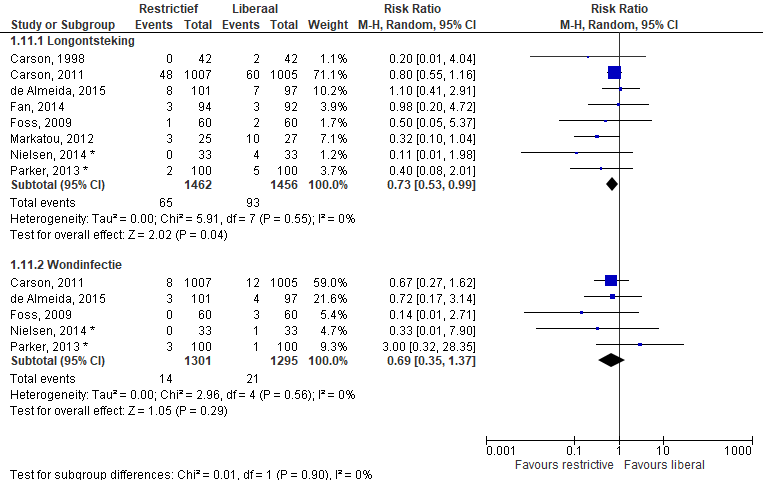
De uitkomstmaat pneumonie (Figuur 6) werd gerapporteerd in acht studies (n=2.918). Er is gekozen om de data uit de primaire studie van Carson te gebruiken en niet de composiet data uit NICE. In de restrictieve groep kregen 65 van 1.462 (4,4%) patiënten een pneumonie in vergelijking met 93 van 1.456 (6,4%) patiënten in de liberale groep. De gerapporteerde percentages in de studie van de Almeida zijn hier omgerekend naar absolute getallen. Meta-analyse van deze studies laat een relatief risico zien van 0,73 [0,53; 0,99] ten faveure van restrictief transfunderen.
Wondinfecties
Het aantal wondinfecties (Figuur 6) wordt gerapporteerd in vijf studies (n=2.596). In de restrictieve groep kregen 14 van 1.301 (1,1%) patiënten een wondinfectie in vergelijking met 21 van 1.295 (1,6%) in de liberale groep. Meta-analyse van deze studies laat een relatief risico zien van 0,69 [0,35; 1,37].
Figuur 6 Meta-analyse uitkomstmaten: pneumonie en wondinfectie
Samengestelde uitkomstmaat infecties
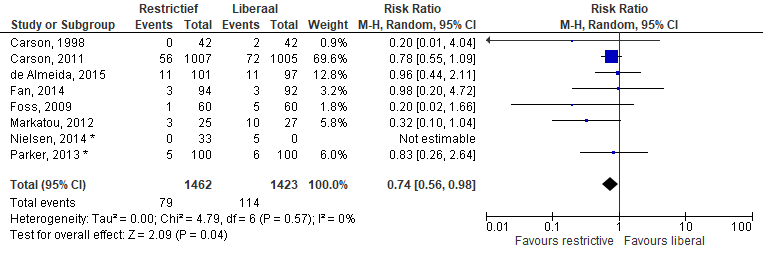
In een aantal studies worden “infecties” (niet nader gespecificeerd) gerapporteerd, of een samengestelde uitkomstmaat voor infecties (incl. pneumonie en wondinfectie). De werkgroep is van mening dat de term infectie (niet nader gespecificeerd) te onduidelijk is en daarmee te weinig informatie geeft (in potentie wordt een hiv-infectie vergeleken met een wondinfectie). Deze getallen zijn daarom niet meegenomen in de meta-analyse.
Meta-analyse van de samengestelde score (pneumonie en wondinfectie) (figuur 7) laat een relatief risico van 0,74 (0,56 - 0,98) zien ten faveure van restrictief transfunderen.
Figuur 7 Meta-analyse samengestelde uitkomstmaat pneumonie en wondinfectie
Voor de volledigheid worden deze getallen voor infecties (niet nader gespecificeerd) van de geïncludeerde studies hier wel beschreven:
- Gruber-Baldini: composiet score voor infectie liberaal 3/66 (4,6%), restrictief 3/72 (4,2%)
- Nielsen: cijfers wondinfectie en pneumonie zijn geïncludeerd in meta-analyse. In de tekst wordt daarnaast, aangegeven dat meer complicaties werden gezien bij liberaal beleid, (echter niet significant) en dat de studie niet is ingericht om complicaties te onderzoeken (kijken naar testmoment binnen 3 dagen na operatie).
- Parker: cijfers wondinfectie en pneumonie zijn geïncludeerd in de meta-analyse. In de tekst wordt verder alleen in algemene zin iets beschreven over ‘complicaties’ (geen significant verschil).
Aantal units getransfundeerd
De meta-analyse in de NICE-richtlijn bevat een studie over de hier beschreven zoekvraag (perioperatief, zonder hartchirurgie). Het gaat om de studie van Carson uit 1998 waarin geen verschil gezien in het gemiddeld aantal eenheden getransfundeerd per patiënt wordt tussen beide groepen. De aanvullende studies beschrijven de uitkomsten op een andere manier en zijn daarmee niet te poolen in een meta-analyse.
De Almeida 2015 beschrijft met een restrictieve strategie een significante besparing van eenheden per patiënt. Het mediane aantal was 2 units (IQR 1-3) in de liberale groep in vergelijking met 1 (IQR 1-3) in de restrictieve groep (p=0,17). Dit geldt zowel op de IC als na overplaatsing naar de afdeling. Tijdens ziekenhuisverblijf ontvingen meer patiënten in de liberale groep (48,5%) een transfusie dan in de restrictieve groep (32,7%) (p=0,024). Gregerson 2014 en Gruber- Baldini 2013 beschrijven in overeenstemming een besparing van 2 en 3 eenheden door een restrictief beleid. In de laatste studie is door restrictief beleid bij 54,2% geen transfusie nodig in vergelijking van maar 4,5% in de liberale groep. Nielsen 2014 rapporteert eenzelfde maar niet significante trend van respectievelijk 63% t.o.v. 52% patiënten die geen transfusie nodig hebben (p-waarde=0,32).
Bewijskracht van de literatuur
De bewijskracht voor mortaliteit na 30 dagen is met 1 niveau verlaagd naar matig door onnauwkeurigheid (imprecisie). Kwaliteit van leven is niet gerapporteerd in de geïncludeerde studies. De werkgroep beschrijft delier als relevante uitkomstmaat omdat dit een negatieve invloed op kwaliteit van leven heeft. Delier is gerapporteerd in 1 studie (Parker 2013) maar de bewijskracht hiervan is met 2 niveaus verlaagd naar laag voor beperkingen in de studieopzet en onvoldoende bewijslast. De bewijskracht voor zowel myocardinfarct als congestief hartfalen is om dezelfde reden verlaagd met 1 niveau. De bewijskracht voor ligduur blijft hoog. De bewijskracht voor infecties is met een niveau verlaagd naar matig in verband met onnauwkeurigheid. De bewijskracht voor het aantal units getransfundeerd is met 1 niveau verlaagd naar matig. Er zijn geen studies die rapporteren over TACO en TRALI.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag (vragen): Wat is de klinische effectiviteit van rode bloedcel transfusies bij verschillende hemoglobine concentraties dan wel post-transfusie hemoglobine levels?
- P: volwassenen, kinderen, jongeren met anemie die een operatie moeten ondergaan exclusie: wisseltransfusies en hartoperaties
- I: Lage (restrictieve) hemoglobine drempelwaarde (threshold, trigger) en streefwaarde (target) voor transfusie
- C: Hoge (liberale) hemoglobine drempelwaarde (threshold, trigger) en streefwaarde (target) voor transfusie
- O: Mortaliteit na 30 dagen, kwaliteit van leven (o.a. delier), nieuw cardiaal event, ligduur in het ziekenhuis, infecties zoals pneumonie, aantal patiënten dat een transfusie nodig heeft, aantal units getransfundeerd, acute en vertraagde ernstige bijwerkingen (zoals TRALI (transfusion related acute lung injury) en TACO (transfusion associated circulatory overload)).
Relevante uitkomstmaten
De werkgroep achtte mortaliteit, nieuw cerebrovasculair event (myocardinfarct, hartfalen of een herseninfarct), infectie, (verlengde) ligduur en vertraagd herstel (een) voor de besluitvorming kritieke uitkomstmaten. Wat betreft infecties werden de vaak vele verschillende infecties gegroepeerd en onderverdeeld in wondinfecties en pneumonie.
Kwaliteit van leven is door de werkgroep gedefinieerd als QOL, en delier. De werkgroep definieerde de overige uitkomstmaten niet a priori, maar hanteerde de in de studies gebruikte definities.
Zoeken en selecteren (Methode)
Voor deze vraag werd de NICE-richtlijn ‘blood transfusion’ hoofdstuk 10 als uitgangspunt gebruikt. Voor de NICE-richtlijn werd gezocht tot januari 2015. In de NICE-richtlijn zijn de studies over cardiochirurgische ingepen niet apart beschreven. Deze studies zijn voor de huidige zoekvraag geëxcludeerd (dus alleen andere chirurgische ingrepen zijn hier beschreven).
In aanvulling op de NICE-richtlijn werd in de databases Medline (OVID), Embase en de Cochrane Library is met relevante zoektermen gezocht naar de meest recente systematic reviews en RCT’s. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 303 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: vergelijkende studie (restrictief vs. liberaal erytrocyten transfusiebeleid) bij volwassen (>18 jaar), gepubliceerd in Engels, met rapportage van minimaal één van de benoemde uitkomstmaten. Op basis van titel en abstract werden in eerste instantie 88 studies voorgeselecteerd; 23 systematic reviews, 34 RCTs, 31 overige designs. Na raadpleging van de volledige tekst, werden vervolgens 83 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en 5 studies definitief geselecteerd.
NICE
In de NICE-richtlijn werden voor deze patiëntengroep 8 artikelen opgenomen in de literatuuranalyse. Deze artikelen worden kort beschreven in tabel 1. De studies over cardiochirurgische ingepen zijn, zoals eerder vermeld, geëxcludeerd.
Vijf recente studies zijn toegevoegd aan de NICE-analyses (de Almeida, 2015; Gregersen, 2014, Gruber-Baldini, 2013, Nielsen, 2014; Parker, 2013). De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence tabel. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen. Voor de evidence tabellen van de studies in geïncludeerd zijn in de NICE-review wordt verwezen naar de supplements van de NICE.
Er zijn geen studies gevonden die het beleid bij kinderen onderzocht hebben.
Referenties
- de Almeida JP, Vincent JL, Galas FR, de Almeida EP, Fukushima JT, Osawa EA, et al. Transfusion requirements in surgical oncology patiënts: a prospective, randomized controlled trial. Anesthesiology. 2015;122(1):29
- Carson JL, Chen AY. In search of the transfusion trigger. Clinical Orthopaedics and Related Research. 1998;(357):30-35
- Carson JL, Terrin ML, Noveck H, Sanders DW, Chaitman BR, Rhoads GG, et al. Liberal or restrictive transfusion in high-risk patiënts after hip surgery. New England Journal of Medicine. 2011;365(26):2453-62
- Carson JL, Patel MS. Red blood cell transfusion thresholds:can we go even lower? Transfusion. 2014;54:2593-2594.
- Fan YX, Liu FF, Jia M, Yang JJ, Shen JC, Zhu GM, et al. Comparison of restrictive and liberal transfusion strategy on postoperative delirium in aged patiënts following total hip replacement: a preliminary study. Archives of Gerontology & Geriatrics. 2014;59(1):181-5
- Foss NB, Kristensen MT, Jensen PS, Palm H, Krasheninnikoff M, Kehlet H. The effects of liberal versus restrictive transfusion thresholds on ambulation after hip fracture surgery. Transfusion. 2009;49(2):227-34
- Gregersen M, Borris LC, Damsgaard EM. Postoperative blood transfusion strategy in frail, anemic elderly patiënts with hip fracture: the TRIFE randomized controlled trial. Acta Orthopaedica. 2015;86(3):363-72
- Grover M, Talwalkar S, Casbard A, Boralessa H, Contreras M, Boralessa H, et al. Silent myocardial ischaemia and haemoglobin concentration: a randomized controlled trial of transfusion strategy in lower limb arthroplasty. Vox Sanguinis. 2006;90(2):105-12
- Gruber-Baldini AL, Marcantonio E, Orwig D, Magaziner J, Terrin M, Barr E, et al. Delirium outcomes in a randomized trial of blood transfusion thresholds in hospitalized older adults with hip fracture. Journal of the American Geriatrics Society. 2013;61(8):1286-95
- Lotke PA, Barth P, Garino JP, Cook EF. Predonated autologous blood transfusions after total knee arthroplasty: immediate versus delayed administration. Journal of Arthroplasty. 1999;14(6):647-650
- Markatou M, Theodoraki K, Rizos D, Fassoulaki A. Targeting perioperative haemoglobin in major abdominal surgery. Journal of Anaesthesia and Clinical Research. 2012; 3(2)
- Nielsen K, Johansson PI, Dahl B, Wagner M, Frausing B, Borglum J, et al. Perioperative transfusion threshold and ambulation after hip revision surgery--a randomized trial. BMC Anesthesiology. 2014;14:89
- Parker MJ. Randomised trial of blood transfusion versus a restrictive transfusion policy after hip fracture surgery. Injury. 2013;44(12):1916-8
- Shander A. An update on mortality and morbidity in patiënts with very low postoperative hemoglobin levels who decline blood transfusion. Transfusion 2014;54:2688-95.
- Karkouti K, Wijeysundera DN, Yau TM, McCluskey SA, van Rensburg A, Beattie WS. The influence of baseline hemoglobin concentration on tolerance of anemia in cardiac surgery. Transfusion. 2008 Apr;48(4):666-72
- Hogervorst E, Rosseel P, van der Bom J, Bentala M, Brand A, van der Meer N, van de Watering L. Tolerance of intraoperative hemoglobin decrease during cardiac surgery. Transfusion. 2014 Oct;54(10 Pt 2):2696-704.2004
Evidence tabellen
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
de Almeida, 2015 |
randomized, controlled, parallel-group, double-blind (patiënts and outcome assessors) superiority trial
After consent, the medical staff contacted the study randomization centre to register the patiënt and to be told which group the patiënt was allocated to. To avoid loss of concealment, the group to which the patiënt was allocated could only be accessed after registration in the study randomization centre. Allocation numbers were derived from a random number table prepared by the chief statistician and were placed in opaque envelopes and opened sequentially to determine the treatment group of the patiënt. The patiënts and the study investigators who classified outcomes and those who conducted the follow-up telephone assessments were blinded to the study-group assignments and had no access to transfusion data. |
Unlikely |
Unlikely |
Unclear
|
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Gregerson 2014
|
Randomization was provided by an allocation concealment process in the web-based clinical trial support system “TrialPartner” (Public Health and Quality Improvement, Central Denmark Region). This central computer program using permuted block sizes stratified the randomization according to sex and type of residence, and allocated each participant to one of the transfusion strategies. The project manager entered the patiënt’s civil registration number into the computer program, and passed on the randomization result to the electronic patiënt record (which was available to the hospital staff in the orthopaedic and geriatric wards since they were to administer the transfusions during the intervention period. The participants, their relatives, and the endpoint assessors were blind as to the result of randomization and to information on the patiënts’ Hb levels. |
Unlikely |
Unlikely |
Unclear
|
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Gruber-Baldini, 2013 |
Subjects were randomized using an automated central telephone randomization system to the liberal transfusion arm or restrictive arm.
(Carson 2011: We randomly assigned patiënts to the liberal strategy group or the restrictive-strategy group using an automated telephone randomization system. Staff members at the data coordinating centre prepared randomization schedules for each site using randomly ordered block sizes of two, four, six, or eight. After randomization, clinical-site staff members, clinicians, and patiënts were aware of study-group assignments) Possible inconsistency: 30 from 206 eligible subjects refused Cognitive Ancillary Study, 37 from 176 subjects were not randomized due to HgB >10g/dl (35), 2 withdrew from main study (2)? |
Unclear from this publication.
When looking at the original study to which this study is ancillary (the FOCUS-trial, see Carson 2011 in NICE), RoB is likely. |
Unclear from this publication.
When looking at the original study to which this study is ancillary (the FOCUS-trial, see Carson 2011 in NICE), RoB is likely. |
Unclear from this publication.
When looking at the original study to which this study is ancillary (the FOCUS-trial, see Carson 2011 in NICE), RoB is likely. |
Unclear from this publication.
When looking at the original study to which this study is ancillary (the FOCUS-trial, see Carson 2011 in NICE), RoB is likely. |
Unlikely |
Unlikely
|
Unlikely |
|
Nielsen, 2014 |
The randomization was done preoperatively after informed consent was obtained. A dedicated computer program (Idefix) was used for randomization, only one investigator had access to the program, investigators at the other hospital had to call this investigator to randomize. The allocation was written on a form which was kept in the investigators office and the allocation could only be accessed by the investigator in charge of administering red blood cells. |
Unlikely |
Unlikely |
Unclear |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Parker, 2013 |
Randomization was undertaken using numbered, sealed opaque envelopes that were prepared before start of the study. Assessment was undertaken by a nurse who was blinded to the group to which the patiënts had been allocated. |
Unclear |
Unclear |
Unclear |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Reden van exclusie |
|
Alvarez, 2001 |
Geen systematische review, methodologische verantwoording voor de geïncludeerde studies mist. |
|
Bagwe, 2017 |
Search tot feb 2017 Includeren zowel prospectieve als retrospectieve studies. Veel overlap met NICE, includeren wel nieuwere studies dan NICE (ook RCT). |
|
Bennet, 2017 |
Geen RCT’s nieuwer dan NICE. |
|
Brunskill, 2015 |
Search tot okt 2015
|
|
Carless, 2010 |
Review en ouder dan NICE, bovendien is er een nieuwere versie. |
|
Carson, 2012 |
Review/richtlijn en ouder dan NICE Populatie niet perioperatief (“transfusions in hemodynamically stable adults and children”) |
|
Carson, 2016 |
Richtlijn Populatie niet perioperatief (“transfusions in hemodynamically stable adults and children”) |
|
Carson, 2002 |
Review en ouder dan NICE
|
|
Carson, 2016 |
Veel overlap met NICE, en includeert maar 1 additionele studie. Search tot mei 2016. Verder analyses ook niet volledig separaat voor chirurgische patiënten.
|
|
Carson, 2013 |
Meta-analysis en ouder dan NICE. Patiënten populatie omvat wel perioperatieve patiënten. |
|
Curley, 2014 |
SR & meta-analysis en ouder dan NICE + ‘cardiac’ |
|
Goodnough, 2015 |
Gaat over decision support tool. Onduidelijk of patiënten populatie perioperatief omvat. |
|
Hardy, 2004 |
Geen systematische review. Onduidelijk of patiënten populatie perioperatief omvat. |
|
Hill, 2002 |
Niet juiste patiënten populatie. |
|
Holst, 2015 |
Search tot oktober 2014, ouder dan NICE Perioperatief ook onderdeel van de patiëntenpopulatie. |
|
Hovaguimian, 2016 |
Overlap met NICE en minder informatie. Specifiek gericht op infectie. Maken wel onderscheid cardiac surgery en orthopedisch (ook groep Acute). Perioperatief ook onderdeel van de patiëntenpopulatie. |
|
Mirski, 2015 |
Geen systematische review. |
|
Patel, 2015 |
Review, geen additionele data ten opzichte van NICE. Cardiac surgery, bevat ook studies en informatie over non-cardiac operations. Alle chirurgische artikelen zijn al geincludeerd. |
|
Rohde, 2014 |
Slechts klein deel geïncludeerde studies gericht op per en post operatieve transfusie. Geen additionele studies t.o.v. NICE. |
|
Spah, 2015 |
Niet perioperatief, populatie high risk patiënts progressive anemia |
|
Stanworth, 2015 |
Narrative review, geen systematic review. |
|
Teng, 2015 |
Includeren zelfde studies al NICE richtlijn. Alleen de studie: Gruber-Baldini, A. L. et al. Delirium outcomes in a randomized trial of blood transfusion thresholds in hospitalized older adults with hip fracture. J. Am. Geriatr. Soc. 61, 1286–1295 (20130), die hebben we zelf ook gevonden en geselecteerd.
|
|
Wilkinson, 2014 |
‘Cardiac’ maar ouder dan NICE en Cochrane analyse (Carson, 2016b) |
|
Blumberg, 2014 |
Abstract, geen volledig artikel gepubliceerd. (Special Issue: Abstract Presentations from the AABB Annual Meeting). Meta-analyses of randomized trials. |
|
Brierley, 2014 |
Study protocol |
|
Carson, 2013 |
Cardiac catheterization is geen operatieve ingreep. |
|
Carson, 2015 |
Aanvullende studie Carson, 2011. Geïncludeerd in NICE richtlijn. |
|
Carson, 2011 |
Geïncludeerd in NICE richtlijn. Transfusie is onderdeel van de ziekte episode, dus valt onder per en post operatief. |
|
Chen, 2009 |
Populatie niet perioperatief |
|
Cholette, 2011 |
Populatie niet perioperatief |
|
Cholette, 2017 |
Cardiac surgery, niet perioperatief. |
|
de Gast-Bakker, 2013 |
Cardiac surgery, niet perioperatief. |
|
Fominskiy, 2015 |
Meta-analyses of randomized trials, data tot maart 2015 |
|
Foss, 2009 |
Geïncludeerd in NICE richtlijn. |
|
Garcia-Erce, 2006 |
Andere uitgangsvraag: perioperative administration of intravenous iron, with or without erythropoietin. |
|
Gregersen, 2016 |
Gregersen, 2015 Postoperative blood transfusion strategy in frail, anemic elderly patiënts with hip fracture: the TRIFE randomized controlled trial. Acta Orthopaedica. 2015;86(3):363-72 geïncludeerd. |
|
Gregerson, 2015 |
Gregersen, 2015 Postoperative blood transfusion strategy in frail, anemic elderly patiënts with hip fracture: the TRIFE randomized controlled trial. Acta Orthopaedica. 2015;86(3):363-72 geïncludeerd. |
|
Gregersen, 2015 |
Gregersen, 2015 Postoperative blood transfusion strategy in frail, anemic elderly patiënts with hip fracture: the TRIFE randomized controlled trial. Acta Orthopaedica. 2015;86(3):363-72 geïncludeerd. |
|
Gregersen, 2015 |
Gregersen, 2015 Postoperative blood transfusion strategy in frail, anemic elderly patiënts with hip fracture: the TRIFE randomized controlled trial. Acta Orthopaedica. 2015;86(3):363-72 geïncludeerd. |
|
Grover, 2006 |
Geïncludeerd in NICE richtlijn. |
|
Haijar, 2010 |
Geïncludeerd in NICE richtlijn (cardiac surgery). |
|
Murphy, 2015 |
Geïncludeerd in NICE richtlijn (cardiac surgery). |
|
Nakamura, 2015 |
Cardiac surgery |
|
Nielsen, 2012 |
Outcome: subcutaneous oxygen tension |
|
Reeves, 2016 |
Cardiac surgery |
|
Rouette, 2010 |
Al ouder dan NICE, uit eerdere update. |
|
Shehata, 2012 |
Geïncludeerd in NICE richtlijn (cardiac surgery). |
|
Slight, 2008 |
Cardiac surgery |
|
So-Osman, 2013 |
Geïncludeerd in NICE: post hoc analyse bij So-Osman 2010. |
|
So-Osman, 2010 |
Geïncludeerd in NICE richtlijn. |
|
Theodoraki, 2014 |
Main outcome inflammatory mediators. |
|
Willems, 2010 |
Cardiac surgery
|
|
Almeida, 2011 |
Case-control propensity score (cardiac surgery). |
|
Bagate, 2013 |
Type design: cohort study (cardiac surgery). |
|
Balzer, 2017 |
Type design: retrospective study (cardiac surgery). |
|
Bolton, 2015 |
Type design: retrospective cohort. |
|
Chan, 2016 |
Type design: prospective study, niet perioperatief. |
|
Clausen, 2014 |
Type design: retrospective study. |
|
Costello, 2010 |
Type design: matched case- control. |
|
DeLeon, 2016 |
Type design: retrospective study. |
|
Ejaz, 2014 |
Type design: prospective study. Focus niet patiënt uitkomsten maar verschillen tussen artsen |
|
Fan, 2014 |
Geïncludeerd in NICE richtlijn |
|
Fischer, 2014 |
Geïncludeerd in NICE richtlijn |
|
Foss, 2008 |
Geïncludeerd in NICE richtlijn |
|
Fusaro, 2017 |
Type design: retrospective study (decision tree/model analysis). Main outcome: cost |
|
Gombotz, 2016 |
Type design: post hoc multicentre cohort study. |
|
Goodnough, 2014 |
Type design: retrospective study. Gaat overdecision support and education. |
|
Hogervorst, 2014 |
Cardiac surgery |
|
Hogervorst, 2016 |
Cardiac surgery |
|
Mikroulis, 2011 |
Cardiac surgery, onduidelijk design. Abstract ontbreekt |
|
Mullis, 2015 |
Type design: retrospective case study. Transfusie versus anemie niet restrictive versus liberal Outcome: complications of severe anemia |
|
Nielsen, 2012 |
Type design: observational study. |
|
Pull ter Gunne, 2010 |
Type design: retrospective study. |
|
Roubinian, 2015 |
Onduidelijk design, abstract ontbreekt. |
|
Roubinian, 2014 |
Type design: retrospective cohort study. |
|
Smilowitz, 2016 |
Type design: retrospective study. |
|
Szpila, 2015 |
Type design: retrospective, historical control analysis. Vergelijking voor na introductie restrictief beleid, gebruik bloedproducten en kosten. |
|
Goodnough, 2016 |
Gaat over clinical decision support tool. |
|
Van Der HIlst, 2010 |
Type design: prospective study. Niet als artikel beschikbaar, het is een boek. |
|
Wang, 2016 |
Cardiac surgery |
|
Wehry, 2015 |
Type design: cohort study. |
|
Yerrabothala, 2014 |
Gaat om clinical decision support tool (computerized order auditing). |
|
Galas, 2013 |
Cardiac surgery |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 15-10-2020
Laatst geautoriseerd : 27-11-2019
Geplande herbeoordeling :
Voor het beoordelen van de actualiteit van deze richtlijn wordt een deel van de werkgroep in stand gehouden. Op modulair niveau is een onderhoudsplan beschreven. Bij het afronden van de richtlijn zal de werkgroep per module een inschatting maken over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Internisten Vereniging (NIV), Nederlandse Vereniging van Anesthesiologie (NVA) en Nederlandse Vereniging van Klinische Chemie (NVKC) zijn regiehouders van deze richtlijn(module) en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn(module). De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
De transfusierichtlijn geeft ten eerste antwoorden op grote uitgangsvragen over wie, wanneer, hoe, hoeveel en met welke producten getransfundeerd wordt en wat daarvan volgens wetenschappelijk onderzoek aan voordelig/nadelig resultaat verwacht mag worden. Na het bepalen van de wetenschappelijke waarde van dit onderzoek, worden uiteindelijk aanbevelingen opgesteld, gebaseerd op de conclusies van het wetenschappelijke onderzoek en na het beschouwen van een additionele context van bijvoorbeeld kosten- ethische, maatschappelijke of wettelijke overwegingen. Deze aanbevelingen zijn bedoeld om verantwoord en wenselijk handelen voor leden van de beroepsgroep te definieren in de voorkomende dagelijkse klinische praktijk. Echter, er kan beargumenteerd altijd afgeweken worden van de algemene aanbevelingen en gekozen worden voor een meer op de individuele patient afgestemde ondersteuning.
Doelgroep
Naast de genoemde beoogde gebruikers van de richtlijn is de richtlijn ook bedoeld en van waarde voor de collega’s van de nationale bloedvoorzieningsorganisatie Sanquin.
Samenstelling werkgroep
Voor de herziening van de richtlijn zijn er in 2016 zes multidisciplinaire werkgroepen ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij patiënten die een bloedtransfusie nodig hebben. Een stuurgroep, bestaande uit de voorzitters van de deelprojecten, coördineerde de werkgroepen.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep Laboratoriumaspecten
- Dr. J (Jennita) Slomp, laboratoriumspecialist klinische chemie en hematologie, voorzitter, NVKC
- Dr. C. (Claudia) Folman, manager laboratorium erytrocytenserologie, NVKC
- Prof. dr. M (Masja) de Haas, clustermanager immunohematologie diagnostiek, NVKC
- G.H. (Judith) Lie, hemovigilantiefunctionaris, weefselvigilantiecoördinator, NVML
- Dr. H. (Henk) Russcher, Laboratoriumspecialist Klinische Chemie en Hematologie, NVKC
- Dr. M.R. (Martin) Schipperus, internist-hematoloog, NIV
- N. (Nel) Som, senior hoofdanaliste bloedtransfusiedienst, NVML
- Dr. K.M.K. (Karen) de Vooght, laboratoriumsepcialist klinische chemie en transfusie, NVKC
- Dr. H. (Harry) de Wit, Laboratoriumspecialist Klinische Chemie en Hematologie, NVKC
Werkgroep Anemie
- Prof. dr. J.J. (Jaap Jan) Zwaginga, internist-hematoloog/ transfusiespecialist/ hoogleraar transfusiegeneeskunde, voorzitter, NIV
- Drs. K.A. (Klasien) Bergman, kinderarts-neonatologie, NVK
- dr. J.M. (Jurriën) ten Berg, Cardioloog, NVVC
- Dr. B.J. (Bart) Biemond, internist-hematoloog, NIV
- Dr. P.A.W. (Peter) te Boekhorst, internist-hematoloog/ transfusiespecialist, NIV
- Prof. dr. C.J. (Karin) Fijn van Draat, hoogleraar kinderhematologie/ senior onderzoeker Sanquin research, NVK
- Dr. A.J. (Adriaan) van Gammeren, laboratoriumspecialist klinische chemie en hematologie, NVKC
- Dr. N.P. (Nicole) Juffermans, Intensivist, NVIC
- Dr. A.W.M.M. (Ankie) Koopman-van Gemert, anesthesioloog, NVA
- Dr. L.E.M. (Liesbeth) Oosten, internist-hematoloog, NIV
Werkgroep Trombocytentransfusies
- Dr. E.A.M. (Erik) Beckers, internist-hematoloog/ transfusiespecialist, hematoloog, voorzitter, NIV
- Dr. M. (Michiel) Coppens, internist-vasculaire geneeskunde, NIV
- Dr. A.J.G. (Gerard) Jansen, internist-hematoloog, NIV
- Dr. J.L.H. (Jean-Louis) Kerkhoffs, internist-hematoloog, NIV
- Dr. E. (Enrico) Lopriore, sectiehoofd neonatologie, NVK
- Dr. C. (Heleen) van Ommen, kinderarts hematoloog, NVK
- Dr. E.C.M. (Lizzy) van Pampus, internist-hematoloog-transfusiespecialist, NIV
- Dr. R.E.G. (Roger) Schutgens, internist-hematoloog, NIV
- Dr. J.W.P.H (Hans) Soons, laboratoriumspecialist klinische chemie, NVKC
- Dr. A.P.J. (Alexander) Vlaar, internist-intensivist, NVIC
Werkgroep Bloedingen en bloedbesparende technieken
- Dr. A. (Ankie) Koopman – van Gemert, anesthesioloog, voorzitter, NVA
- Dr. J.J. (Hans) Duvekot, gynaecoloog-perinatoloog, NVOG
- Dr. L.M.G. (Leo) Geeraedts, traumachirurg, NVvH
- Dr. ir. Y.M.C. (Yvonne) Henskens, laboratoriumspecialist klinische chemie en hematologie, NVKC
- Drs. E.J. (Elise) Huijssen-Huisman, kinderarts, kinderhematoloog, transfusiespecialist, NVK
- Dr. N.P. (Nicole) Juffermans, intensivist, NVIC
- Prof. dr. F.W.G. (Frank) Leebeek, internist hematoloog en internist vasculair geneeskundige, NIV
- P.M.J. (Peter) Rosseel, anesthesioloog–intensivist, NVA
- Dr. E.C.T.H. (Edward) Tan, traumachirurg, NVvH
- Drs. V.A. (Victor) Viersen, anesthesioloog, NVA
- Dr. A.B.A. (Alexander) Vonk, cardiothoracaal chirurg, NVT
- Prof. dr. J.J. (Jaap Jan) Zwaginga, hematoloog/ transfusiespecialist/ hoogleraar transfusiegeneeskunde, NIV
Werkgroep Plasmatransfusies
- Dr. J.W.P.H (Hans) Soons, laboratoriumspecialist klinische chemie, voorzitter, NVKC
- Dr. E.A.M. (Erik) Beckers, internist-hematoloog/ transfusiespecialist, NIV
- Drs. K.A. (Klasien) Bergman, kinderarts-neonatologie, NVK
- Dr. M. (René) van Hulst, ziekenhuisapotheker, NVZA
- Prof. dr. K. (Karina) Meijer, internist-hematoloog, NIV
- Dr. M.C.A. (Marcella) Müller, internist-intensivist, NVIC
- Dr. E.C.M. (Lizzy) van Pampus, internist-hematoloog/transfusiespecialist, NIV
- Dr. Marjolein Peters, kinderarts-hematoloog, NVK
- Drs. K.N.M.E.M. (Koen) Reyntjens, anesthesioloog, NVA
Werkgroep Transfusiereacties en gerelateerde aandoeningen
- Dr. M.R. (Martin) Schipperus, internist-hematoloog, voorzitter, NIV
- Dr. J.L.P. (Hans) van Duynhoven, laboratoriumspecialist klinische chemie, NVKC
- Drs. C.T. (Christian) Favoccia, anesthesioloog, NVA
- Prof dr. C.J. (Karin) Fijn van Draat, hoogleraar kinderhematologie/ senior onderzoeker Sanquin research, NVK
- G.H. (Judith) Lie, hemovigilantiefunctionaris, weefselvigilantiecoördinator, NVML
- Dr. T. (Tanja) Netelenbos, internist-hematoloog, NIV
- Dr. J. (Jennita) Slomp, laboratoriumspecialist klinische chemie en hematologie, NVKC
- Dr. Dik Versteeg, arts-microbioloog, NVMM
- Dr. A.P.J. (Alexander) Vlaar, internist-Intensivist, NVIC
- Dr. J.C. (Jo) Wiersum-Osselton, TRIP hemo- en biovigilantie, landelijk coördinator, sociale geneeskunde
- C. (Clary) Wijenberg, verpleegkundig specialist palliatieve zorg, V&VN
Met ondersteuning van:
- Dr. M.M. (Marja) Molag, adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Drs. S.M. (Sabrina) Muller-Ploeger, adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Drs. M. (Marleen) Ploegmakers, senior-adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Drs. E. (Ester) Rake, junior adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Drs. E.E. (Eva) Volmeijer, adviseur Kennisinstituut van de Federatie Medisch Specialisten, projectleider
- Drs. T. (Tessa) Geltink, junior adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Drs. S. (Sanne) Snoeijs, adviseur Kennisinstituut van de Federatie Medisch Specialisten
- D.P. (Diana) Gutierrez, projectsecretaresse Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Voorzitters (kerngroep) |
||||
|
M. Schipperus |
Internist-hematoloog (100%) |
Voorzitter Bestuur Stichting TRIP (Transfusie in patiënten), onbetaald |
ITP-onderzoek gefinancierd door AMGeN Advisory board Novartis |
Lid participeert niet in besluitvorming omtrent producten van AMGEN of Novartis. |
|
A. Koopman- van Gemert |
Anesthesioloog |
Diverse functies bij nationale en internationale commissies bv Concilium, Stuurgroep antistolling, examencommissie et cetera Internationaal lid van de Europese examencommissie |
-Participatie in de PETS-studie van het EMC, geen financiële relatie. -Participatie in verschillende onderzoeken (geen financiële relatie en geen direct verband bloedtransfusie) -Organisatie symposia met sponsoring (geen directe financiële relatie en direct verband bloedtransfusie) |
Geen restricties |
|
J.J. Zwaginga |
Hematoloog LUMC (Leiden), Transfusiespecialist, Hoogleraar transfusiegeneeskunde |
-Penningmeester VHL=Vereniging Hematologische laboratoria -Voorzitter van de benigne hematologische werkgroep van NVvH |
-Sprekershonoraria Viforpharma (ijzer: medicatie kan transfusies uitsparen) -Wetenschappelijke adviesraad: Novantis (ijzerchelatie kan transfusie gemedieerde ijzerstapeling opheffen) - Gilead: CLL medicatie webcast geen relatie met transfusiebeleid PI van meerdere Sanquin onderzoeken ogv - allumminisatie door RBC transfusies - ijzertoxiciteit door bloedtransfusies - bloedings IRM (voldoende) plaatjestransfusies et cetera |
Lid participeert niet in besluitvorming omtrent Novartis en wanneer SANQUIN-studies worden geïncludeerd waarbij lid een van de auteurs is |
|
E. Beckers |
Internist-hematoloog/transfusiespecialist MUMC + Maastricht |
Bestuurslid Ned. Ver. Bloedtransfusie, onbetaald - Bestuurslid Ned. Ver. Hematologie, onbetaald - Lid adviesraad TRIP (Transfusie Reacties in Patiënten), onbetaald - Lid Landelijke Gebruikers Raad Sanquin, onbetaald - Lid Stuurgroep TiN studie (Trombocytopathie in Nederland) |
Project 'Predictors of Bleeding' externe financiering door Bayer
Transparantieregister.nl: sprekers vergoeding van Roche; gastvrijheidsbijdrage van: Roche, Pfizer, Sanquin en Bayer |
Lid participeert niet in besluitvorming omtrent producten van Bayer en Roche en wanneer specifiek de studie "predictors of bleeding" (gefinancierd door Bayer) worden geïncludeerd |
|
J. Slomp |
Laboratorium specialist Klinische Chemie en hematologie MST/Medlon |
-Bestuurslid VHL - onbetaald -Bestuurslid NVvH - onbetaald -Werkgroep Bloedtransfusie VHL (vz.) onbetaald -Lid LGR onbetaald - - Lid Expert committee TRIP (onbetaald) |
-Medical Advisory Board Janssen: advies omtrent bloedtransfusie bij patiënten die daratumumab gebruiken, betaald - In samenwerking met UMCU en VU bezig om een landelijk protocol op te stellen voor bloedtransfusie en daratumumab |
Lid participeert niet in besluitvorming omtrent productn van Janssen (daratumumab) |
|
H. Soons |
Laboratoriumspecialist Klinische Chemie, St. Anna Ziekenhuis (1 fte) en Kempenhaeghe (detachering vanuit St. Anna Ziekenhuis)
|
-Bestuur Nederlandse Vereniging voor Bloedtransfusie (NVB), voorzitter, onbetaald -Bestuur Transfusie Reacties in Patiënten (TRIP), secretaris, vacatiegeld - Medisch Advies Raad Sanquin (MAR), lid, vacatiegeld -Lid Landelijke Gebruikersraad Sanquin (LGR), onbetaald |
|
Geen restricties |
|
Werkgroep laboratoriumaspecten |
||||
|
H. de Wit |
Laboratoriumspecialist Klinische Chemie en Hematologie, Certe |
-Bestuurslid/ penningmeester Nederlandse Vereniging voor Bloedtransfusue (onbetaald) - Bestuurslid/ penningmeester Stichting Vrienden van de NVB (onbet aald) |
|
Geen restricties |
|
K. de Vooght |
Laboratoriumspecialist Klinische Chemie, Hoofd Patiëntenzorg LKCH ad interim |
Bestuurslid/ penningmeester Stichting TRIP (onbetaald) - Bestuurslid/voorzitter Stichting vrienden van de Utrechtse bloedbank (onbetaald) - Lid Werkgroep Consortium Transfusiegeneeskundig Onderzoek (onbetaald) - Lid PROTON II Adviesraad (onbetaald) - Lidmaatschap NVB - Lidmaatschap NVvH - Docent OKU (Onderwijs Kring Utrecht) (betaald) -Docent PAO Farmacie (betaald) -Lid Wetenschappelijke commissie NVB/TRIP symposium (onbetaald) |
|
Geen restricties |
|
C. Folman |
Manager Laboratorium Erytrocytenserologie (Sanquin) |
- Docent Hogeschool Arnhem en Nijmegen, betaald - Lid TRIX-werkgroep, onbetaald - Secretaris werkgroep Bloedtransfusie van de VHL (Vereniging Hematologische Laboratoriumdiagnostiek), onbetaald - Lid Expert Committee TRIP (Transfusie Reacties In Patiënten), onbetaald -Lid wetenschappelijke commissie NVB (Nederlandse Vereniging voor Bloedtransfusie), onbetaald" |
- Dienstverband Sanquin - werkzaam in expertiselaboratorium waar onderzoek wordt gericht voor derden op het gebied van bloedtransfusie |
Werkgroeplid is geen trekker/primaire auteur bij uitspraken over diagnostiek.
|
|
M. de Haas |
-Bijzonder hoogleraar Translationele Immunohematologie (bezoldiging Sanquin, onbezoldigd aangesteld bij LUMC -Clustermanager Immunohematologie Diagnostiek |
- Secretaris NVB (tot mei 2017) |
-Dienstverband Sanquin -Hoofd van een expertiselaboratorium dat ingezet zou kunnen worden door derden voor het uitvoeren van (uit de richtlijn voortkomende) laboratoriumdiagnostiek |
Werkgroeplid is geen trekker/primaire auteur bij uitspraken over diagnostiek.
|
|
H. Russcher |
Laboratoriumspecialist Klinisch Chemie en Hematologie, in het Erasmus MC en Havenziekenhuis |
- Auditor RvA i.h.k.v. ISO 15189:2012 voor medische laboratoria - Betaald |
|
restricties t.a.v. producten van Roche diagnostiek.Gebruikersraad geen belangen tav Sanquin, geen restriicties |
|
N. Som |
Senior hoofdanaliste bloedtransfusiedienst VUmc |
- Hemovigilantiecoördinator Vumc |
|
Geen restricties |
|
J. Lie |
-Stafadviseur hemovigilantie 24,8 uur -Weefselvigil antiecoördinator 7,2 uur" |
-Contactpersoon voor landelijk Bureau TRIP: meldingen transfusiereacties en bijwerkingen - Voorzitter landelijk Hemovigilantoe Platform Nederland (vanaf 2016, eerder lid, mede oprichter HPN), onbetaald - Voorzitter en oprichter Regionaal Hemovigilantie Platform Zuidoost - BestuursLid NVB |
|
Geen restricties |
|
Werkgroep Anemie |
||||
|
A. Van Gammeren |
Laboratoriumspecialist Klinische Chemie
|
|
|
Geen restricties
|
|
N. Juffermans |
Intensivist |
Chief editor Netherlands Journal of Critical Care, vergoeding |
|
Geen restricties
|
|
K. Bergman |
Kinderarts-neonatologie, Beatrix kinderziekenhuis, UMCG ten Groningen (0,9fte). Als kinderarts-neonatologie voorzitter van het Regioteam Perinatale Audit Noord Nederland (Perined). Deze functie (0,1fte) wordt uitgeoefend binnen de UMCG aanstelling. |
-Lid programmacommissie Prenatale screening infectieziekten en erytrocyten-immunisatie RIVM namens NVK (vacatiegeld) -Lid werkgroep neonatale infectieziekten sectie neonatologie NVK (onbetaald) -Projectcommissielid ZonMw project: Introduction of Audit generated Changes in perinatal care using ""Tailored"" implementation strategies. (ACTion-project) (onbetaald) =Projectcommissielid 5 genes per minute, afdeling Medische genetica, UMCG, Groningen (onbetaald) |
|
Geen restricties
|
|
P. te Boekhorst |
Internist-Hematoloog / Transfusiespecialist
|
Medisch Adviesraad Sanquin, Lid, Vacatiegeld
|
In verleden: - Gastvrijheid Firma Alexion - Adviesraad Firma AmgeN (ITP) |
Lid participeert niet bij besluitvorming omtrent ITP |
|
B. Biemond |
Internist-hematoloog |
|
|
Geen restricties |
|
L. Oosten |
Hematoloog, Afdeling Immunohematologie & Bloedtransfusie bij het Leids Universitair Medisch Centum |
|
|
Geen restricties |
|
K. Fijn van Draat |
-Hoogleraar kinderhematologie AMC - Senior onderzoeker Sanquin Research |
VIDI selectiecommissie ZONMW, onbetaald (wel vacatievergoeding) |
Lid van de stuurgroep van de PLANET-2 studie die onderzoek doet naar triggers van trombocytentransfusie bij neonatenop de Neonatale Intensive Care Unit. PLANET-2 ontvangt geen sponsoring van de farmaceutische industrie |
Geen restricties |
|
Werkgroep trombocytentransfusies |
||||
|
A. Vlaar |
- Internist-Intensivist, Academisch Medisch Centrum, Amsterdam - Principal investigator Infusion related morbidity and mortality in the critically ill |
- Klinisch brug figuur Sanquin, onbetaald
|
Onderzoek gefinancierd door NWO, ZonMW, Sanquin: PI van de PACER studie (onder andere): hierbij worden trombotriggers voor invasieve ingrepen aangehouden. |
Geen restricties (ten aanzien van PACER studie: geen tegengesteld belang. Studie wordt niet gepubliceerd binnen termijn afronding richtlijn). |
|
l. van Pampus |
Internist-hematoloog-transfusiespecialist Radboudumc |
- Vice voorzitter hemovigilantiekamer TRIP (onbezoldigd)
|
Tegemoetkoming verblijfkosten Dublin (Ierland) het 17th Annual NATA Symposium on Patient Blood Management, Haemostasis and Thrombosis (NATA 2016) cf de CGR-rgels. |
Geen restricties |
|
G. Jansen |
Internist-hematoloog, afdeling Hematologie, Erasmus MC |
Post doctoraal onderzoeker bij afdeling Plasmaeiwitten, Sanquin Bloedvoorziening. Gastvrijheidovereenkomst, onbetaald |
"1) Naam project: ""Surface sialic acid is critical for platelet survival"" Financier: Sanquin Product and Process development (PPOC nr. 13-019). Bedrag: 499.000 euro. Rol: AIO project 2013-2018. Principal investigator en co-promotor
Toelichting: van dit geld is een OIO aangesteld (Mw M. Rijkers) die in dienst van Sanquin (1,0 fte) dit onderzoek verricht" |
Bij onderwerp sialic acid en trombocytenoverleving geen trekker /betrokkenheid opstellen aanbevelingen |
|
J.L. Kerkhoffs |
Internist - Hematoloog (0,8 FTE)
|
Transfusie-specialist / transfusie research (0,2 FTE) via Sanquin
|
Op Sanquin verricht ik klinisch transfusie onderzoek wat deels gefinancieerd wordt door de industrie TerumoBCT: PI van de PREPAReS studie, een RCT naar de klinische effectiviteit van trombocyten concentraten behandeld met een pathogeen-reductie proces (Mirasol, TERUMO BCT).
|
Restricties t.a.v. producten behandeld met pathogeen reductie proces en biomarkers. Deze onderwerpen zijn vooralsnog niet geprioriteerd voor de richtlijn, dus geen restricties nodig.
|
|
R. Schutgens |
Internist-hematoloog
|
Lid van Medische Adviesraad patiëntenvereniging ITP |
-Speakersfee (voor instituut) en/of unrestricted research grant en/of lid advisory board van: Bayer, Baxalta, CSL Behring, NovoNordisk, Sanquin, Pfizer, Bristol-Meyers Squibb -Principal Investigator van de Trombocytopathie in Nederland (TiN) studie, mede gefinancierd door een unrestricted grant van Sanquin - deelname (in UMCU) ontwikkeling PACT en U-PACT (geen financieel belang) |
Geen betrokkenheid vragen bij bloedplaatjesfunctietest (PACT). Deze onderwerpen zijn vooralsnog niet geprioriteerd voor de richtlijn, dus geen restricties nodig. |
|
M. Coppens |
Internist-vasculaire geneeskunde
|
- Diverse naschollingen en adviesraden (allen incidenteel) aangaande directe orale anticoagulantie georganiseerd door de fabrikanten van deze middelen, te weten Boehringer Ingelheim, Bayer, Pfizer, Bristol-Meyers Squibb, Daiichi Sankyo. Deze diensten zijn betaald, waarbij het geld naar mijn instituut gaat - Adviesraad aangaande 'The future of hemophilia treatment' georganiseerd door CSL Behring. Twee maal een advisory board; in 2015 en 2016. Deze diensten zijn betaald waarbij geld naar instituut gaat. CSL Behring produceert o.a. Haemocomplettan P (fibrinogeenconcentraat) en Beriplex (vierfactorenconcentraat). De huidige richtlijn zal mogelijk off-label gebruik van deze 2 middelen gaan bespreken. De genoemde adviesraad richtte zich op hemofilie A en B en de producten Haemocomplettan P en Beriplex zijn hier niet aan de orde geweest." |
Lid van de Stuurgroep van de Trombopathie in Nederland studie (geen financiele belangen). -Sanquin Blood Supply: Prothrombin Complex Concentrate (PCC) for the immediate reversal of the anticoagulant effects if new oral anticoagulants in emergency situations. Sanquin Blood Supply is producent van Cofact, een PCC, - CSL Behring: Biomarkers to detect subclinical arthropathy and predict long-term clinical arthropathy in patients with hemophilia. This project was awarded a 2016 Heimburger Award. CSL Behring produceert zowel Haemocomplettan P (fibrinogeenconcentraat) als Beriplex (een PCC), Dit project is gecofinancierd door CSL Behring, maar hebben geen betrekking op Haemocomplettan P noch Beriplex. |
Geen betrokkenheid opstellen aanbevelingen t.a.v. fibrinogeenconcrentraat en vierfactoren concentraat |
|
E. Lopriore |
Sectiehoofd Neonatologie WAKZ/LUMC |
Lid bloedtransfusiecommissie LUMC |
Onderzoek gefinancieerd door Sanquin: 1. PROC 12-012-027: Matisse studie: RCT in neonaten naar twee verschillende triggers voor trombocyten transfusies 50 vs 25; Promovenda: Suzanne Gunnink 2. PROC 16-33: Promotie onderzoek naar Rhesus hemolytische ziekt: Promovenda: Isabelle Ree |
Geen restricties |
|
H. van Ommen (meelezer) |
Kinderhematoloog |
|
'- PI Einstein junior (Bayer) Behandeling trombose bij kinderen - PI Hokusai kinderen (Daiichi Sankyo) Behandeling trombose bij kinderen - Nationaal coördinator BMS studie Apixaban ter preventie van trombose bij kinderen met een hartafwijking |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afstemming met de Patiëntenfederatie, Stichting Zeldzame Bloedziekten en Oscar Nederland. Deze verenigingen zijn uitgenodigd voor de invitational conference (knelpuntenanalyse) voorafgaand aan deze herziening en hebben input geleverd voor de te prioriteren vragen. De verenigingen hebben aangegeven graag in de commentaarfase de conceptrichtlijn te ontvangen voor commentaar. Tevens zal in de eindfase van deze richtlijn nog worden overlegd over de communicatie aan patiënten en of er nog aanvullende teksten voor patiënten kunnen worden opgesteld.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan zal bij afronding van de richtlijn te vinden zijn bij de aanverwante producten. De werkgroep zal tevens de interne kwaliteitsindicatoren die bij de Richtlijn bloedtransfusie 2011 zijn opgesteld beoordelen en indien nodig door ontwikkelen.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitters van de werkgroepen en de adviseurs de knelpunten. De werkgroepen beoordeelden de aanbevelingen uit de eerdere richtlijn Bloedtransfusiebeleid (2011) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door patiëntenverenigingen en andere aanwezigen tijdens de Invitational conference. De werkgroepen stelden vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitters en de adviseurs concept-uitgangsvragen opgesteld. Deze zijn in de werkgroepen besproken waarna de werkgroepleden de definitieve uitgangsvragen hebben vastgesteld. Vervolgens inventariseerden de werkgroepen per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroepen waardeerden deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroepen tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen en systematische reviews (Medline). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje “Overwegingen”.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk om mee te wegen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs, de belangrijkste overwegingen en de weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn word aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren worden verzameld en besproken met de werkgroepen. Naar aanleiding van de commentaren word de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroepen. De definitieve richtlijn word aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html. 2012.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
