Transfusiebeleid bij cardiopulmonale chirurgie
Uitgangsvraag
Is een liberaal of restrictief transfusie beleid geïndiceerd voor correctie van anemie bij patiënten die een cardiochirurgische ingreep (hebben) ondergaan?
Aanbeveling
Deze aanbevelingen gelden voor volwassenen (voor kinderen werden onvoldoende gegevens gevonden om een uitspraak te kunnen doen):
- Transfundeer rode bloedcellen bij niet-bloedende patiënten die een cardiochirurgische ingreep hebben ondergaan bij een Hb van 4,7 mmol/L of lager.
- Transfundeer 1 unit rode bloedcellen per keer.
- Monitor de Hb-waarde voor een volgende transfusieorder.
- Bepaal en bespreek bij overplaatsing of bij overplaatsing van afdelingen met een hoge monitor frequentie naar een minder intensieve afdeling bij de patiënt hetzelfde restrictief beleid gehandhaafd kan worden.
Overwegingen
Verschillen in studies
De transfusie trigger in de onderzochte studies bij cardiochirurgische patiënten verschilt tussen de studies. De restrictieve arm betreft in het algemeen een Hb trigger van 7-8 g/dL (4,3 tot 5,0 mmol/L). Met een liberale trigger wordt meestal een Hb trigger van 9 tot 10 g/dl (5,6 tot 6,2 mmol/L) bedoeld. Ook verschillen studies in het moment van inclusie: post- of al intra-operatief.
Ook verschillen de studies in welke verschillende typen ingrepen erin worden bestudeerd:
|
|
restrictief |
liberaal |
|
Shehata |
|
|
|
CABG |
13 (52%) |
15 (60%) |
|
Kleppen |
5 (20%) |
1 (4%) |
|
gecombineerd |
7 (28%) |
9 (36%( |
|
|
|
|
|
CABG |
408 (40,8%) |
408 (40,7%) |
|
Kleppen |
307 (30,7%) |
304 (30,3%) |
|
Gecombineerd |
196 (19,5%) |
203(20,3%) |
|
Major aortic |
54 (5,4%) |
62 (6,2%) |
|
Mazer |
|
|
|
CABG |
622/2429 (25.6) |
645/2430 (26.5) |
|
valve |
703/2429 (28.9) |
716/2430 (29.5) |
|
CABG+ valve |
464/2429 (19.1) |
472/2430 (19.4) |
|
CABG + another (non-valve) |
205/2429 (8.4) |
203/2430 (8.4) |
|
anders |
433/2429 (17.8) |
394/2430 (16.2) |
|
Hajjar |
|
|
|
GABG |
152 (61%) |
155 (61%) |
|
Valve |
80 (32%) |
79 (31%) |
|
CABG+Valve |
17(7%) |
19 (8%) |
|
* Bracey: alleen inclusie GABG; Willems en Cholette: diversiteit aan ingrepen. |
||
Algehele overwegingen
De indicatie tot transfusie stellen alsook het monitoren van de effectiviteit van transfusie op grond van symptomen acht de werkgroep in zijn algemeenheid in de periode van (post)cardiochirurgie onwerkbaar, omdat 1) patiënten symptomen niet goed kunnen aangeven vanwege sedatie dan wel herstellende van sedatie, en 2) het moeizaam is om symptomen van anemie (tachycardie, dyspnoe/hypoxie) toe te schrijven aan de anemie of aan tal van andere oorzaken zoals deze vaak voorkomen post cardiochirurgie, zoals atelectase post longdesufflatie en hemodynamische veranderingen.
De Murphy (2015) trial liet een hogere mortaliteit zien in de restrictieve arm. Echter, dit was een secundaire uitkomstmaat. De Mazer (2017) trial toont geen verschillen aan tussen groepen, gerandomiseerd volgens dezelfde transfusietriggers. Wel valt op dat het relatieve risico op overlijden na 30 dagen verschuift ten faveure van een liberaal beleid wanneer deze vergeleken wordt met het relatieve risico op mortaliteit verder weg in de tijd. Dit zou overeenkomen met een vroeg voordeel van een liberale trigger. Na 90 dagen verdwijnen deze overigens niet significante trends.
Studieresultaten komen veelal overeen met de landmark trial van Hebert in 1999, waarin een restrictieve trigger van Hb 4,3 mmol/L bij patiënten op IC niet gepaard gaat met slechtere uitkomsten. Het blijkt dat anemie goed wordt verdragen tijdens cardiochirurgie, met als voordeel dat er minder bloedtransfusie gegeven hoeft te worden. Er wordt op geen enkel gemeten eindpunt voordeel aangetoond voor een liberale trigger. Alles bij elkaar genomen lijken er geen nadelen of extra risico’s verbonden te zijn bij hanteren van een restrictieve trigger maar er daarnaast wel een kosteneffectief en zinnig bloedverbruik is. Derhalve lijkt het hanteren van een restrictieve trigger van 7,5 g/dl (4,7 mmol/L) voor de cardiochirurgische populatie zinvol.
Leeftijd
Een zorg is dat oudere patiënten een restrictieve trigger niet goed verdragen, door een beperkte fysiologische capaciteit. In de Mazer trial (met een gemiddelde patiënt leeftijd van 72 jaar) werd een omgekeerd effect gezien: oudere patiënten (>75 jaar) hadden een betere uitkomst met een restrictieve trigger. Dit komt overeen met de Focus trial uitgevoerd is in heupchirurgie (Carson, 2011). In deze studie was de gemiddelde leeftijd van patiënten 82 jaar en had het merendeel een cardiovasculaire aandoening. Ook in deze studie werd een restrictieve trigger goed verdragen door patiënten.
Mogelijke uitzondering
Opgemerkt dient te worden dat een restrictieve trigger mogelijk niet verdragen wordt als er geen volledige revascularisatie van het coronarialijden kan worden bewerkstelligd. Een aparte analyse van degelijke patiënten bleek echter niet mogelijk.
Onderbouwing
Achtergrond
Bijna alle patiënten die een cardiochirurgische ingreep ondergaan worden anemisch. In Nederland krijgt 10-50% van de cardiochirurgische patiënten perioperatief erytrocyten transfusies. Preoperatieve anemie is verder geassocieerd met slechte uitkomst in deze populatie. Patiënten die een cardiochirurgische ingreep ondergaan kunnen een beperkte cardiovasculaire capaciteit hebben om een anemie te compenseren. Echter, allogene bloedtransfusie is ook geassocieerd met slechte uitkomst (Murphy, 2007; Mariscalco, 2015). Derhalve is het hanteren van een optimale transfusie trigger klinisch relevant.
Conclusies
Mortaliteit
|
Hoog GRADE |
Er werd geen verschil gevonden in het risico op overlijden bij een restrictief in vergelijking met een liberaal transfusiebeleid bij patiënten die een cardio-chirurgische ingreep ondergaan.
Bronnen (Bracey, 1999; Hajjar, 2010; Murphy, 2015, Shehata, 2010; Cholette, 2017; Mazer, 2017) |
|
Hoog GRADE |
Er werd geen verschil gevonden in het risico op een cerebrovasculair accident bij een restrictief in vergelijking met een liberaal transfusiebeleid bij patiënten die een cardiochirurgische ingreep ondergaan.
Bronnen (Mazer, 2017; Murphy, 2015, Shehata, 2010; Cholette, 2017) |
|
Laag GRADE |
Het risico op tromboembolische complicaties bij een restrictief of liberaal transfusiebeleid bij patiënten die een cardiochirurgische ingreep ondergaan lijkt niet te verschillen.
Bronnen (Shehata, 2010; Cholette, 2017) |
|
Hoog GRADE |
Er werd geen verschil gevonden in het risico op delier bij een restrictief in vergelijking met een liberaal transfusiebeleid bij patiënten die een cardiochirurgische ingreep ondergaan.
Bronnen (Mazer, 2017) |
|
Hoog GRADE |
Er werd geen verschil gevonden in het risico op acute nierschade een restrictief in vergelijking met een liberaal transfusiebeleid bij patiënten die een cardiochirurgische ingreep ondergaan.
Bronnen (Mazer, 2017; Murphy, 2015) |
Nieuw cardiaal event
|
Hoog GRADE |
Er werd geen verschil gevonden in het risico op een nieuw myocardinfarct bij een restrictief in vergelijking met een liberaal bloedtransfusiebeleid bij patiënten die een cardiale ingreep ondergaan.
Bronnen (Bracey, 1999; Murphy, 2015; Shehata, 2010; Mazer, 2017) |
Ligduur in het ziekenhuis
|
Hoog GRADE |
Er werd geen verschil gevonden in de gemiddelde ligduur in het ziekenhuis bij een restrictief in vergelijking met een liberaal bloedtransfusiebeleid bij patiënten die een cardiale ingreep ondergaan.
Bronnen (Bracey, 1999; Shehata, 2010; Johnson, 1992; Murphy, 2015; Mazer, 2017) |
Infectie
|
Hoog GRADE |
Er werd geen verschil gevonden in het risico op een infectie (pneumonie of infecties in het algemeen) bij een restrictief in vergelijking met een liberaal bloedtransfusiebeleid bij patiënten die een cardiale ingreep ondergaan.
Bronnen (Shehata, 2010; Bracey, 1999; Hajjar, 2010; Murphy, 2015) |
Aantal units getransfundeerd in patiënten die een transfusie ondergingen
|
Hoog GRADE |
In de restrictieve groep wordt per patiënt die een cardiale ingreep ondergaat tussen de 0.5 en 1 minder eenheden getransfundeerd dan bij dergelijke patiënten in de liberale groep.
Bronnen (Bracey, 1999; Johnson, 1992; Cholette, 2017; Murphy, 2015) |
Samenvatting literatuur
Er werden uit de NICE-richtlijn vijf studies geselecteerd voor de patiëntengroep cardiopulmonale chirurgie (Bracey, 1999; Johnson, 1992; Shehata, 2012; Hajjar, 2010; Murphy, 2015). De studie van Johnson, 1992 werd hier niet meegenomen in de analyses aangezien dit autologe bloeddonoren betrof.
In de studie van Cholette (2017) werden kinderen die 10 kg of minder wogen en een biventriculaire ingreep of palliatieve (nonseptated) operatie moesten ondergaan gerandomiseerd voor een postoperatief conservatieve (n=82) of liberale (n=80) transfusiestrategie. In de groep met restrictief transfusiebeleid kregen de kinderen een transfusie bij hemoglobine lager dan 7,0 g/dL (4,3 mmol/L) voor biventriculaire ingrepen of lager bij een hemoglobine lager dan 9,0 g/dl (5,9 mmol/L) voor palliatieve procedures indien er klinische indicatie (als ingeschat door de arts, bijvoorbeeld hypotensie, tachycardie) bestond. In de liberale groep werd een bloedtransfusie gegeven bij een hemoglobine minder dan 9,5 g/dl (5,9 mmol/L) voor biventriculaire ingrepen of lager dan 12 g/dl (7,5 mmol/L) voor palliatieve ingrepen (onafhankelijk van klinische indicatie).
De studie van Mazer (2017) is een multicenter, open-label, non-inferiority trial waarin 5243 volwassen patiënten die een cardiologische ingreep ondergaan met een EuroScore I van 6 of hoger (d.w.z. een gemiddeld tot hoog risico) werden gerandomiseerd voor restrictief transfusiebeleid (<7,5g/dl = 4,7 mmol/L) of liberaal transfusiebeleid (<9,5g/dl = <5,9 mmol/L) in de operatiekamer of <8,5g/dl (< 5,3 mmol/L) postoperatief). De gemiddelde leeftijd van de patiënten was 72±10 jaar, 35.4% was vrouw en de gemiddelde EUROSCORE I was 7,8±1,9. Van de patiënten onderging 26,1% alleen een CABG; 27,7% een CABG en andere procedure en 46,2% een niet-CABG-procedure.
De studie van Willems (2010) is een subgroepanalyse bij post cardiale chirurgie patiënten van een RCT (TRIP-ICU-studie) die pediatrische IC-patiënten onderzoekt. Kinderen met een hemoglobine <95 g/l (=5,9 mmol/l) binnen 7 dagen na opname op de IC werden gerandomiseerd om prestorage leukocyt gedepleteerde erytrocytentransfusie te ontvangen bij een hemoglobine <70g/l (=4,3 mmol/l) (restrictief, n=63) of 95 g/l (=5,9mmol/l) (liberaal, n=62). Neonaten (<28 dagen) en patiënten die cyanotisch bleven werden geëxcludeerd.
In de studies werden verschillende grenswaarden aangehouden in de restrictieve en liberale transfusiebeleid groep. In tabel 1 is voor elke studie aangegeven welke waarden werden aangehouden.
|
Tabel 1 overzicht grenswaarden van de geïncludeerde studies |
|||
|
|
Restrictief beleid |
Liberaal beleid |
Interventie periode |
|
Johnson, 1992 |
8,3 g/dl (=5,15 mmol/l) |
10,7 g/dl (6,6 mmol/l) |
Postoperatief |
|
Bracey 1999 |
8,0 g/dl (5,0 mmol/l) |
9,0 g/dl (5,6 mmol/l) |
Postoperatief |
|
Hajjar, 2010 |
8,0 g/dl (5,0 mmol/l) |
10,0 g/dl (6,2 mmol/l) |
Intra-operatief en postoperatief |
|
Shehata 2012 |
7,0 g/dl (=4,3 mmol/l) intraoperatief tijdens CPB; 7,5 g/dl postoperatief (4,7 mmol/l) |
9,5 g/dl (=5,9 mmol/l) intraoperatief tijdens CPB; 10,0 g/dl (=6,2mmol/l) postoperatief |
Intra-operatief en postoperatief |
|
Murphy 2015 |
7,5 g/dl (=4,7 mmol/l) |
9,0 g/dl (5,6 mmol/l) |
Postoperatief |
|
Cholette, 2017 |
7,0 g/dL (=4,3 mmol/l) for biventricular repairs 9,0 g/dL (5,6 mmol/l) for palliative procedures
|
9.5 g/dL (=5,9 mmol/l) for biventricular repairs 12 g/dL (=7,5 mmol/l) for palliative procedures |
Intra-operatief en postoperatief |
|
Mazer, 2017 |
7,5 g/dl (=4,7 mmol/l), start bij inductie van anesthesiagedurende operatie |
<9,5 g/dl (=5,9 mmol/l) in operatiekamer of <8.5 g/dl (=5,3mmol/l) postoperatief |
Intra-operatief en postoperatief |
|
Willems, 2010 |
<70g/l (=4,3 mmol/l) |
95 g/l (=5,9 mmol/l) |
Postoperatief (op IC) |
Mortaliteit
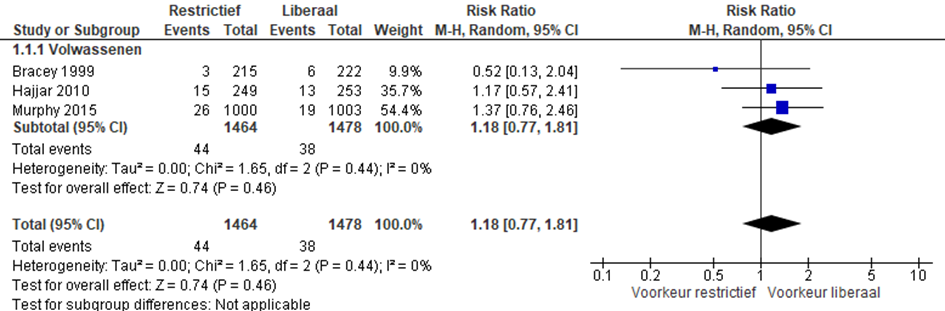
Mortaliteit (30 dagen).
De mortaliteit na 30 dagen werd gerapporteerd in de studies van Bracey, Hajjar en Murphy (figuur 1). In totaal overleden in de restrictieve groep 44 van 1464 patiënten binnen 30 dagen na de ingreep in vergelijking met 38 van de 1478 patiënten in de groep met liberaal transfusiebeleid (RR 1,18 (95%-CI: 0,77-1,81, p=0,44).
Figuur 1 meta-analyse uitkomstmaat mortaliteit (30 dagen)
Mortaliteit (verschillende follow-up)
In de studies van Shehata en Cholette werd de mortaliteit in het ziekenhuis beschreven. In de studie van Murphy wordt ook de mortaliteit (binnen 90 dagen) gerapporteerd (Murphy, 2015). In de studie van Mazer wordt de mortaliteit tot einde van de follow-up (ziekenhuisontslag of 28 dagen) gerapporteerd. In de studie van Willems werd de mortaliteit 28 dagen na randomisatie beschreven.
Figuur 2 meta-analyse uitkomstmaat mortaliteit (verschillende follow-up)
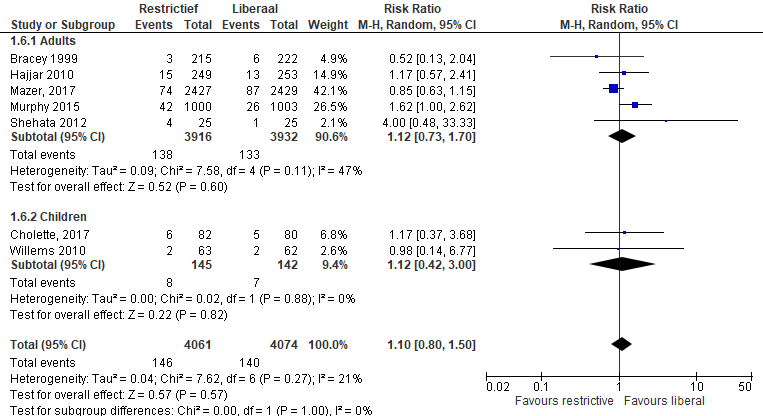
Meta-analyse van deze studieresultaten (figuur 2) laat zien dat er in totaal 146 van 4061 patiënten overleden (verschillende tijdsperioden) in de restrictieve groep in vergelijking met 140 van 4074 patiënten in de liberale groep (RR 1,10 (0,80 tot 1,50), p=0,57).
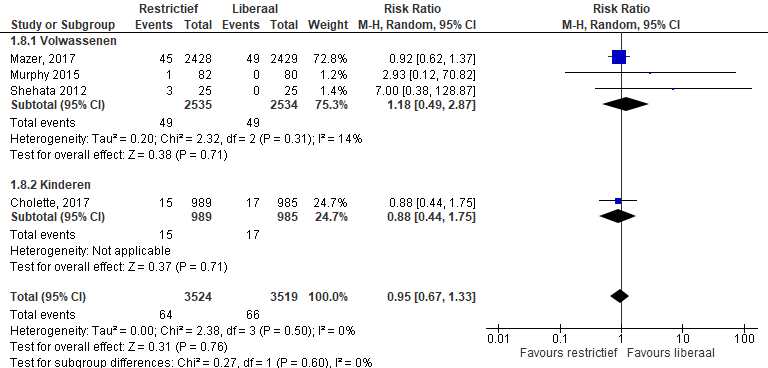
Cerebrovasculair accident
De uitkomstmaat cerebrovasculaire events (CVA, stroke) werd gerapporteerd in vier studies (Mazer, 2017; Cholette, 2017; Shehata, 2012; Murphy, 2015). In totaal kregen 64 van 3524 patiënten in de restrictieve groep in vergelijking met 66 van 3519 patiënten in de liberale groep een cerebrovasculair accident (RR 0,95 (0,67-1,33), p=0,76) (figuur 3).
Figuur 3 meta-analyse uitkomstmaat cerebrovasculair accident
Tromboembolische complicaties
Het optreden van een tromboembolische complicatie (diepe veneuze trombose of longembolie) werd in twee studies gerapporteerd (Cholette, 2017; Shehata, 2012). In de studie van Cholette kregen 7 van 82 in de restrictieve groep in vergelijking met 4 van de 80 patiënten in de liberale groep een trombose (p=0,37). In de studie van Shehata werd bij 1 van 25 patiënten in de restrictieve groep en bij geen van 25 patiënten in de liberale groep een DVT gerapporteerd (geen p-waarde).
Kwaliteit van leven
Er waren geen studies die “kwaliteit van leven” rapporteerden als uitkomstmaat. Wel werd in de studie van Mazer het optreden van een delier gerapporteerd. In totaal kregen in de restrictieve groep 306 van 2428 (12,6%) patiënten een delier in vergelijking met 264 van 2429 (10,9%) in de liberale groep (OR 1,18 (0,99 tot 1,41)).
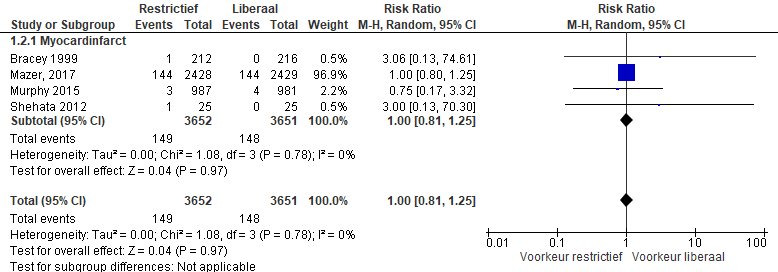
Nieuw cardiaal event
Het optreden van een myocardinfarct werd gerapporteerd in vier studies (Bracey, 1999; Murphy, 2015; Shehata, 2010; Mazer, 2017). In totaal kreeg in de restrictieve transfusiebeleid groep 149 van de 3652 een myocardinfarct in vergelijking met 148 van de 3651 patiënten in de liberale groep (RR 1,00 (0,81 tot 1,25), p=0.97) (figuur 4).
Figuur 4 meta-analyse uitkomstmaat nieuw cardiaal event
Ligduur in het ziekenhuis
De ligduur in het ziekenhuis werd op een manier die meta-analyse mogelijk maakt gerapporteerd in twee studies (Bracey, 1999; Shehata, 2010). Meta-analyse (figuur 5) laat een gemiddeld verschil in ligduur zien van -0,34 dagen (95%-CI -1,10 tot 0,41), p=0,35).
Figuur 5 meta-analyse uitkomstmaat ligduur in het ziekenhuis
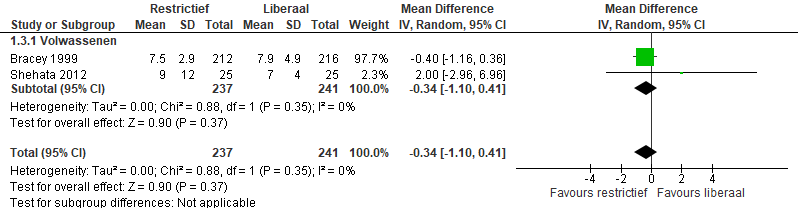
In de studie van Murphy wordt deze uitkomstmaat wel gerapporteerd, maar wordt alleen de mediaan (7,0 versus 7,0 dagen) gegeven waardoor deze resultaten niet kunnen worden meegenomen in de meta-analyse. Ook in de studie van Mazer wordt de ligduur gerapporteerd in mediaan (IQR): in de restrictieve groep 8,0 (7,0 tot 13,0) in vergelijking met 8,0 (7,0 tot 12,0) in de liberale transfusiegroep (HR: 0,93 (0,88 tot 0,99)).
Kinderen
In de studie van Cholette werd de duur van de ziekenhuisopname wel gerapporteerd; echter, er werd alleen een mediaan en range gegeven. Hierdoor kunnen de resultaten niet worden toegevoegd aan de meta-analyse. De mediane ziekenhuisopname duur was bij patiënten die een conservatief transfusiebeleid hadden 13 dagen (4-143) in vergelijking met 13 dagen (6 tot 133) in de groep met liberaal transfusiebeleid (p=0,42).
In de studie van Willems wordt de totale duur op de PICU gerapporteerd. Dit was 4,6 ±3,1 dagen in de groep met een restrictief beleid in vergelijking met 4,7±4,6 dagen in de groep met een liberaal transfusiebeleid.
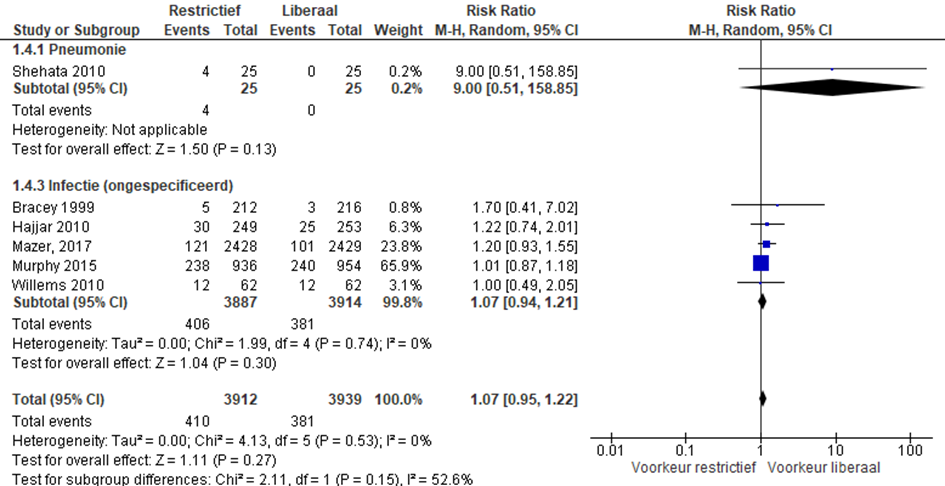
Infecties
De uitkomstmaat infecties (zoals pneumonie) werd gerapporteerd in vijf studies (Shehata, 2010; Bracey, 1999; Hajjar, 2010; Murphy, 2015; Mazer). In drie studies werden infecties, niet nader gespecificeerd, gerapporteerd en in de studie van Shehata worden specifiek het aantal pneumonieen gerapporteerd. In de studie van Willems worden het aantal ziekenhuis gerelateerde infecties gerapporteerd.
In totaal kregen 406 van 3912 patiënten met restrictief beleid een infectie in vergelijking met 381 van 3939 patiënten met liberaal beleid (RR 1,07 (0,95 tot 1,22), p=0,27)) (figuur 6).
Figuur 6 meta-analyse uitkomstmaat infecties
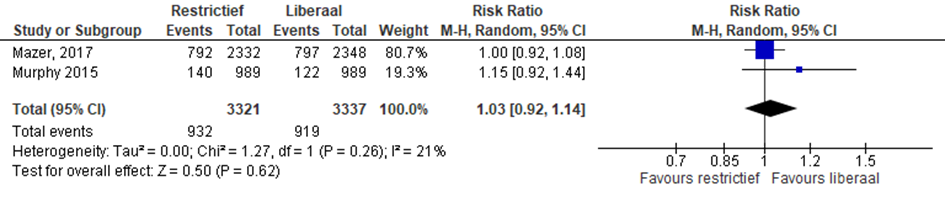
Acute nierschade
Twee studies rapporteerde acute nierschade (Murphy, 2015; Mazer, 2017). In totaal kregen 932 van 3321 patiënten met restrictief beleid acuut nierfalen in vergelijking met 919 van 3337 patiënten met liberaal beleid (RR 1,03 (0,92 tot 1,14), p=0,26)) (figuur 7).
Figuur 7 meta-analyse uitkomstmaat acute nierschade
Aantal units getransfundeerd
Een studie rapporteerde het gemiddelde aantal units getransfundeerd per patiënt (Bracey, 1999): gemiddeld 0,9 units (±1,5) in de restrictieve groep in vergelijking met 1,4 units (±1,8) in de liberale groep (gemiddeld verschil -0,50 (-0,81 tot -0,19, p=0,002).
In de studie van Murphy worden het mediane aantal units getransfundeerd gerapporteerd (in de restrictieve groep 1 (IQR 0 tot 2) versus 2 (IQR 1 tot 3) in de liberale groep).
Ook in de studie van Mazer worden het mediane (IQR) aantal units gerapporteerd (in de restrictieve groep 2 (IQR 1 tot 4) in vergelijking met 3 (2 tot 5) in de liberale transfusiegroep (RR 0.85 (0.82-0.88)).
Kinderen
In de studie van Cholette werd het aantal units getransfundeerd wel gerapporteerd;echter, er werd alleen een mediaan en range gegeven. Hierdoor kunnen de resultaten niet worden toegevoegd aan de meta-analyse. Het mediane aantal erytrocytentransfusies was in de conservatieve groep 0 (range 0 tot 10) in vergelijking met 1 (range 0 tot 10) in de liberale groep (p<0,01).
Bewijskracht van de literatuur
De bewijskracht van de literatuur is hoog omdat er RCT’s voorhanden zijn welke geïncludeerd zijn. Hoewel er in geen van de studies geblindeerd werd (dit is praktisch niet mogelijk) wordt de bewijskracht hierdoor niet verlaagd omdat de uitkomstmaten klinisch objectiveerbaar zijn. Het risico op bias door het gebrek aan blindering is daarom toch laag. Voor de uitkomstmaat thromboembolische complicaties werd de bewijskracht met twee niveaus verlaagd gezien de ernstige imprecisie (klein aantal patiënten in de studie en laag aantal events).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag (vragen):
Wat is de klinische effectiviteit van rode bloedcel transfusies bij verschillende peri-operatieve hemoglobine concentraties?
P: Patiënten die een cardiochirurgische ingreep ondergaan (volwassenen, kinderen, jongeren)
I: lage (restrictieve) hemoglobine trigger voor erytrocytentransfusie
C: hoge (liberale) hemoglobine trigger voor erytrocytentransfusie;
O: mortaliteit na 30 dagen, kwaliteit van leven (waaronder het optreden van delier), nieuw cardiaal of cerebrovasculair event, ligduur in het ziekenhuis, infecties zoals pneumonie en andere postoperatieve complicaties, aantal patiënten dat een transfusie nodig heeft, aantal units getransfundeerd, acute nierschade, cerebrovasculair accident (stroke, CVA) en tromboembolische complicaties (trombo-embolie).
Relevante uitkomstmaten
De werkgroep achtte mortaliteit en nieuwe cardiale en cerebrovasculaire en ischemische events voor de besluitvorming kritieke uitkomstmaten; kwaliteit van leven, ligduur in het ziekenhuis, infecties zoals pneumonie, aantal patiënten dat een transfusie nodig heeft, aantal units getransfundeerd, acute en vertraagde ernstige bijwerkingen zoals TRALI (transfusion related acute lung injury) en TACO (transfusion associated circulatory overload) zijn voor de besluitvorming belangrijke uitkomstmaten.
In cardiochirurgische patiënten is niet gekeken naar toename van ongetransfundeerde patiënten door restrictief transfunderen zoals dat bij minder bloedige interventies wel van belang is.
Zoeken en selecteren (Methode)
Voor deze vraag werd de NICE-richtlijn bloodtransfusion hoofdstuk 10 als uitgangspunt genomen (NICE, 2015). In de NICE-richtlijn werden geen separate analyses voor cardiale chirurgie uitgevoerd (ten opzichte van andere chirurgie). De data uit de NICE-richtlijn (met 5 studies) zijn overgenomen, maar de analyses zijn voor deze richtlijn opnieuw gedaan en aangevuld met de meest recente literatuur. Hiervoor werd in de databases Medline (OVID), Embase en de Cochrane Library met relevante zoektermen gezocht naar studies die een liberaal bloedtransfusiebeleid vergeleken met een restrictief dan wel conservatief beleid bij patiënten met anemie die na de searchdatum van de NICE-richtlijn (januari 2015) werden gepubliceerd. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. Deze brede (voor meerdere uitgangsvragen gezamenlijk) literatuurzoekactie leverde 1354 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: RCT’s betreffende volwassenen en kinderen (maar niet neonaten) die cardiochirurgie ondergingen, met een vergelijking van verschillende Hb-triggers. Op basis van titel en abstract werden in eerste instantie 26 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 24 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 3 studies studie (in additie op studies in de NICE-richtlijn) geselecteerd (Cholette, 2017; Willems, 2010; Mazer, 2017).
In totaal worden voor deze analyse dus zeven studies geïncludeerd. Reeds in NICE:
- Bracey, 1999
- Johnson, 1992
- Shehata, 2012
- Hajjar, 2010
- Murphy, 2015
Niet in de NICE-richtlijn
- Cholette, 2017
- Mazer, 2017
- Willems, 2010
De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Referenties
- Bracey AW, Radovancevic R, Riggs SA, et al. Lowering the hemoglobin threshold for transfusion in coronary artery bypass procedures: effect on patiënt outcome. Transfusion. 1999;39(10):1070-1077.
- Carson JL, Brooks MM, Abbott JD, et al. Liberal versus restrictive transfusion thresholds for patiënts with symptomatic coronary artery disease. Am Heart J. 2013;165(6):964-971.e1. PubMed PMID: 23708168
- Hajjar LA, Vincent JL, Galas FR, et al. Transfusion requirements after cardiac surgery: the TRACS randomized controlled trial. JAMA. 2010; 304(14):1559-1567.
- Johnson RG, Thurer RL, Kruskall MS, et al. Comparison of two transfusion strategies after elective operations for myocardial revascularization. J Thorac Cardiovasc Surg. 1992;104(2):307-14. PubMed PMID: 1495291.
- Murphy GJ, Pike K, Rogers CA, et al. Liberal or restrictive transfusion after cardiac surgery. New England Journal of Medicine. 2015; 372(11):997-1008.
- NICE. Transfusion. Blood transfusion. NICE guideline NG 24. Methods, evidence and recommendations, 2011.
- Carson JL, Terrin ML, Noveck H, et al. Liberal or restrictive transfusion in high-risk patiënts after hip surgery. N Engl J Med. 2011;365(26):2453-62.
- Shehata N, Burns LA, Nathan H, Hebert P, Hare GMT, Fergusson D et al. A randomized controlled pilot study of adherence to transfusion strategies in cardiac surgery. Transfusion. 2012; 52(1):91-99.
- Willems A, Harrington K, Lacroix J, et al. Pediatric Acute Lung Injury and Sepsis Investigators (PALISI) Network. Comparison of two red-cell transfusion strategies after pediatric cardiac surgery: a subgroup analysis. Crit Care Med. 2010;38(2):649-56. PubMed PMID: 19789443.
- Cholette JM, Swartz MF, Rubenstein J, et al. Outcomes Using a Conservative Versus Liberal Red Blood Cell Transfusion Strategy in Infants Requiring Cardiac Operation. Ann Thorac Surg. 2017;103(1):206-214.
- Mazer CD, Whitlock RP, Fergusson DA, et al. Restrictive or Liberal Red-Cell Transfusion for Cardiac Surgery. N Engl J Med. 2017;377(22):2133-2144.
- Murphy GJ, Reeves BC, Rogers CA, et al. Increased mortality, postoperative morbidity, and cost after red blood cell transfusion in patiënts having cardiac surgery. Circulation. 2007;116(22):2544-52. Epub 2007 Nov 12. PubMed PMID: 17998460.
- Mariscalco G, Biancari F, Juvonen T, Zanobini M, Cottini M, Banach M, Murphy GJ, Beghi C, Angelini GD. Red blood cell transfusion is a determinant of neurological complications after cardiac surgery. Interact Cardiovasc Thorac Surg. 2015 Feb;20(2):166-71.
Evidence tabellen
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy – otherwise the evidence table for studies of diagnostic test accuracy should be used.
|
Study reference |
Study characteristics |
Patiënt characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Bracey, 1999
|
Type of study: RCT
Setting: heart institute, postoperatively admitted to ICU
Country: USA
Source of funding: unknown |
Inclusion criteria: Patiënts who underwent first time, elective coronary artery bypass graft surgery at the Texas Heart Institute (THI) between February 4, 1997, and November 15, 1997.
Exclusion criteria: preoperative Hb level <12 g per dL, history of bleeding diathesis, use of an intraaortic balloon pump, blood loss >2500 mL within 24 hours of operation, and the patiënt’s refusal of blood transfusion for religious reason
N total at baseline: Intervention: 212 Control: 216
Important prognostic factors2: age ± SD: I: 61 ± 11 C: 62 ± 11
Sex: I: 82% M C: 83% M
Groups comparable at baseline? yes |
Describe intervention (treatment/procedure/test):
Restrictive group received RBC transfusion at a Hb level <8.0 g/dl
RBC transfusion in the postoperative period at a Hb level less than 8 g per dL, unless the patiënt experienced blood loss >750 mL since the last transfusion, hypovolemia with hemodynamic instability and excessive acute blood loss, acute respiratory failure or inadequate cardiac output and oxygenation, or hemodynamic instability requiring the use of vasopressors. |
Describe control (treatment/procedure/test):
Liberal group received transfusions at Hb level <9.0 g/dl
Patiënts who received transfusions on the instructions of their individual physicians, who considered the clinical assessment of the patiënt and the institutional guidelines, which propose a Hb level <9 g per dL as the postoperative threshold for RBC transfusion.
|
Length of follow-up: till discharge
Loss-to-follow-up: -
Incomplete outcome data: -
|
Outcome measures and effect size (include 95%CI and p-value if available):
Mortality: I: 3 (1.4%) C: 6 (2.7%)
Length of hospital stay: I: 7.5 ± 2.9 C:7.9 ± 4.9
Blood usage (units) (postoperatively): mean restrictive: 0.9 ±1.5 control: 1.4 ± 1.8 (p= 0.005).
Complications Neurologic deficit I: 11 (5%) C: 9 (4%)
Pulmonary complications: I: 57 (27%) C: 64 (30%)
Renal failure: I: 8 (4%) C: 5 (2%)
Infection rates I: 5 (2%) C: 3 (1%)
Cardiac events Atrial arrhythmia I: 30 (14%) C:40 (19%)
Ventricular arrhythmia: I: 13 (6%) C: 9 (4%)
Myocardial infarction: I: 1 (0,5%) C: 0 (0%) |
|
|
Hajjar, 2010 NICE 123 |
Type of study: RCT
Setting: heart institute of university hospital
Country: Brazil
Source of funding: none reported |
Inclusion criteria: Patiënts who were undergoing CABG surgery or cardiac valve replacement or repair, alone or in combination
Exclusion criteria: younger than 18 years; surgery without cardio-pulmonary bypass; emergency procedure ; ascending and descending thoracic aortic procedures; left ventricular aneurysm resection; inability to receive blood products; enrolment in another study; chronic anemia (preoperative haemoglobin concentration less than 10 g/dL); low platelet count (preoperative platelet count less than 150 103/μL); coagulopathy (previous history or prothrombin time longer than 14.8 seconds); pregnancy ; neoplasm; endocarditis; congenital heart defect; hepatic dysfunction (total bilirubin value higher than 1.5 mg/dL (to convert to μmol/L, multiply by 17.104)); end-stage renal disease (receiving chronic dialysis therapy); and refusal to consent.
N total at baseline: Intervention: 255 Control: 257
Important prognostic factors2: Mean age ± SD: Restrictive: 58.6 ± 12.5 C: 60.7 ± 12.5
Sex: Restrictive:60 % M Liberal: 64% M
Type of surgery (restrictive vs. liberal) GABG: 152 (61%) vs. 155 (61%) Valve: 80 (32%) vs. 79 (31%) CABG+Valve: 17(7%) vs.19 (8%)
Groups comparable at baseline? yes |
Describe intervention (treatment/procedure/test):
Restrictive group were transfused if haematocrit values were less than 24%
|
Describe control (treatment/procedure/test):
Liberal group were transfused RBC if the haematocrit was less than 30% at any time from the start of surgery until discharge from the ICU
|
Length of follow-up:
Excluded patiënts: 10 patiënts (1.9%) (4 in the liberal-strategy group and 6 in the restrictive-strategy group) were excluded after consent because surgery was performed without cardiopulmonary bypass,
Incomplete outcome data: -
|
Outcome measures and effect size (include 95%CI and p-value if available):
composite end point— (all-cause 30-day mortality, cardiogenic shock, ARDS, or acute renal injury requiring dialysis or hemofiltration during the hospital stay): Restrictive: 11% Liberal: 10%
Mortality (30 days): Restrictive: 6% Liberal: 5%
Cardiogenic shock: Restrictive: 9% Liberal: 5%
Cardiac complications: Restrictive: 24% Liberal: 21% OR:
Infectious complications: Restrictive: 12% Liberal: 10%
Acute respiratory distress syndrome: Restrictive: 2% Liberal: 1%
Respiratory complications: Restrictive: 11% Liberal: 11%
No. of days in hospital (median): Restrictive: 9 Liberal: 9
|
TRACS |
|
Johnson, 1992 NICE |
Type of study: RCT
Setting: operation theatre and IC afterwards
Country: USA
Source of funding: dr. Kruskall is in part supported by Transfusion Medicine Academic Award K07HL02033 from the National Institutes of Health |
Inclusion criteria: autologous blood donors undergoing elective myocardial revascularisation, who were able to donate at least three units of packed cells before their operation
Exclusion criteria: not enough donated blood, operation too soon after catheterization, excerise test on day five or six in weekend
N total at baseline: Intervention: 20 Control: 18
Important prognostic factors2: Mean age ± SD: Restrictive: 58.2 ± 7.5 C: 60.5 ± 6.9
Sex: Restrictive: 100% M Liberal: 89% M
Groups comparable at baseline? yes
|
Restrictive group
Received blood for haematocrit values less than 25% |
Liberal group:
Received blood to achieve a haematocrit value of 32% as long as autologous blood was available |
Length of follow-up: Till sixth postoperative day
Loss-to-follow-up: Intervention: N (%) Reasons (describe)
Control: 1 N (%) Reasons (describe): intraoperative great vessel injury necessitating all his autologous blood, eliminated because of continued hemodynamic instability
Incomplete outcome data: -
|
Outcome measures and effect size (include 95%CI and p-value if available):
Mortality (30 days): Restrictive: Liberal:
Perioperative myocardinfarct: Restrictive: 0 Liberal: 1
Arrhythmias: Restrictive:4 Liberal: 6
Infectious complications: Not reported
Respiratory complications: Pulmonary oedema Restrictive: 0 Liberal: 1
Pneumothorax: Restrictive: 2 Liberal: 0
Units transfused (mean): Restrictive: 1.0 ± 0.86 Liberal: 2.0 ± 0.93
No. of days in hospital (median): Restrictive: 7.9 ± 4.3 Liberal: 7.6 ± 1.9 |
Autologous donation |
|
Murphy, 2015 NICE 203 |
Type of study: a multicenter, parallel-group, randomized, controlled trial
Setting: nonemergency cardiac surgery
Country: Uk
Source of funding: Supported by the NIHR Health Technology Assessment program (ref: 06/402/94). Dr. Reeves and the research nurse team in Bristol were supported in part by the NIHR Bristol Biomedical Research Unit in Cardiovascular Disease, and Drs. Murphy, Angelini, and Rogers were supported by the British Heart Foundation (ref: CH/12/1/29419 and CH/92027). |
Inclusion criteria: >16 years of age, undergoing nonemergency cardiac surgery
Exclusion criteria: emergency cardiac surgery, prevented from having blood and blood products according to a system of beliefs (e.g. Jehovah’s Witnesses), congenital or acquired platelet, red cell or clotting disorders (patiënts with iron deficient anaemia are not excluded), ongoing or recurrent sepsis, unable to give full informed consent, critical limb ischaemia (defined as rest pain in affected limb associated with peripheral vascular disease), already participating in another study
N total at baseline: Intervention: 1000 Control: 1003
Important prognostic factors2: Age (median) ± SD: Restrictive: 69.9 Liberal: 70.8 Sex: Restrictive: 69% M Liberal: 68%M Groups comparable at baseline? Yes
Type of surgery CABG 408 (40,8%) vs 408 (40,7%) valves: 307 (30,7%) vs 304 (30,3%) combined: 196 (19,5%) vs. 203(20,3%) Major aortic: 54 (5,4%) vs. 62 (6,2%) |
Describe intervention (treatment/procedure/test):
Restrictive (Experimental) Group:
Continue monitoring Hb / Hct level. Eligible for transfusion if Hb < 7.5g/dL / Hct < 22 |
Describe control (treatment/procedure/test):
Liberal (Control) Group:
Eligible for transfusion when Hb < 9.0g/dL / Hct < |
Length of follow-up: 3 months
Loss-to-follow-up: Not described
Incomplete outcome data: Not described
|
Outcome measures and effect size (include 95%CI and p-value if available):
Mortality (30 days): Restrictive: 26/1000 (2.6%) Liberal: 19/2003 (1.9%)
Mortality (90 days): Restrictive: 42/1000 (4.2%) Liberal: 26/1003 (2.6%) Odds ratio: 1.64 (1.00-2.67), p=0.045
Myocardinfarct: Restrictive: 3/987 (0.3%) Liberal: 4/981 (0.4%)
Ischemic event: Restrictive: 156/991 (15.7%) Liberal: 139/991 (14.0%) OR: 1.16 (0.90-1.49)
Infectious event: Restrictive: 238/936 (25.4%) Liberal: 240/954 (25.2%)
Clinically significant pulmonary complications: Restrictive: 127/979 (13%) Liberal: 116/982 (11.8%)
Patiënts transfused: Restrictive: 637 (63.7%) Liberal: 952 (94.9%)
Units transfused: Restrictive: 1494 Liberal: 2494
No. of days in hospital (median): Liberal: 7.0
|
Study protocol details described in Brierley et al., 2014
Most patiënts had undergone coronary-artery bypass grafting (40.7%) or valve surgery (30.5%). A total of 25.7% of the participants received a red-cell transfusion before randomization |
|
Shehata, 2012 NICE 278 |
Type of study: pilot RCT
Setting: university-affiliated tertiary care centre
Country: Canada
Source of funding: This study was supported by Canadian Blood Services SPF XT00070. |
Inclusion criteria: adult patiënts undergoing cardiac surgery with a CARE score (a score for cardiac surgery patiënts used to predict morbidity and mortality) of 3 or 4,17 or patiënts of advanced age defined as greater than or equal to 80 years.
Exclusion criteria: refusal of participation, unable to receive or refused blood products, or involved in autologous predonation program
N total at baseline: Intervention: 25 Control: 25
Important prognostic factors2: Mean age ± SD: I: 67.2 ± 11.2 C: 68.8 ± 9.2
Sex: I: 68% M C: 80% M
Surgical procedure (restrictive vs. liberal): CABG: 13 (52%) vs. 15 (60%) Valve: 5 (20%) vs. 1 (4%) Combined: 7 (28%) vs. 9 (36%)
Groups comparable at baseline? yes |
Describe intervention (treatment/procedure/test):
Patiënts allocated to a “restrictive” transfusion strategy received RBC transfusions if their Hb was 70 g/L or less during cardiopulmonary bypass (CPB) and 75 g/L or less postoperatively after bypass.
|
Describe control (treatment/procedure/test):
Patiënts allocated to a “liberal” transfusion strategy received RBC transfusions if their Hb concentration was 95 g/L or less during and less than 100 g/L after bypass. A lower Hb concentration for transfusion was used during CPB because metabolic demands are reduced during anesthesia and CPB. When a threshold was reached, each group was to receive 1 unit of RBCs administered at a time followed by determination of the Hb concentration. |
Length of follow-up: unclear
Adherence For patiënts allocated to the restrictive strategy, adherence was 69% in the operating room, 82% in the intensive care unit, and 100% on the ward. For the liberal group, adherence was 40% in the operating room, 69% in the intensive care unit, and 14% on the ward. There were 10 RBC units in the restrictive group and 3 units in the liberal group that were transfused in the absence of a Hb transfusion threshold being attained. Thus adherence overall was 84% in the restrictive group and 41% in the liberal group. Reasons for nonadherence included patiënt refusal, the use of hemoconcentration, hemorrhage, the Hct and not the Hb concentration being used to transfuse the patiënt, confusion about the transfusion strategy and whether it was to be applied on the ward, hyperkalemia, the physician planning to repeat the complete blood count before transfusing the patiënt, and the perfusionist being occupied.
Loss-to-follow-up: - Incomplete outcome data: - |
Outcome measures and effect size (include 95%CI and p-value if available):
Mortality (in hospital): Restrictive: 4/25 (16%) Liberal: 1/25 (4%)
Myocardinfarct: Restrictive: 1/25 (4%) Liberal: 0/25 0%)
Pneumonia: Restrictive: 4/25 Liberal: 0/25 (0%)
Patiënts transfused (intraoperative): Restrictive: 6/25 (24%) Liberal: 15/25 (60%)
Patiënts transfused (postoperative, IC): Restrictive: 11/25 (44%) Liberal: 17/25 (68%)
No. of days in hospital (mean ±sd): Restrictive: 9.0 ± 12 Liberal: 7.0 ± 4
|
A CARE score of 3 is defined as patiënts with uncontrolled medical problems such as unstable angina treated with intravenous heparin or nitroglycerin, use of a preoperative intraaortic balloon pump, heart failure with pulmonary or peripheral edema, uncontrolled hypertension, renal insufficiency (creatinine level greater than 140 mmol/L), debilitating systemic diseases, or patiënts in whom a complex surgery is undertaken (i.e., reoperation, combined valve and coronary artery surgery, multiple valve surgery, left ventricular aneurysmectomy, repair of ventricular septal defect after myocardial infarction, or CABG of diffuse or heavily calcified vessels). A CARE score of 4 is defined as patiënts with any uncontrolled medical problem and in whom a complex surgery is undertaken. |
|
Willems, 2010 |
Type of study: RCT
Setting: tertiary pediatric intensive care units
Country: Canada
Source of funding: supported, in part, by Grants 84300 and 130770 from the Canadian Institutes of Health Research (CIHR) and Grant 13904 from the Fonds de la Recherche en Sante´ du Que´bec (FRSQ). |
Inclusion criteria: TRIPICU study enrolled stabilized critically ill children from 19 tertiary care pediatric intensive care units (ICUs). Children aged between 3 days and 14 yrs, with at least one hemoglobin concentration of <=95 g/L within the first 7 days after pediatric ICU admission
Exclusion criteria: Expected to stay < 24 hours in PICU, lack of approval from the physician, hemodynamically unstable, acute blood loss, weight < 3 Kg , cardiovascular problems, never discharged from neonatal ICU, hemolytic anemia, , enrollment in another study, other causes see figure 1
N total at baseline: Restrictive (I): 63 Liberal (C): 62
Important prognostic factors2: age ± SD: I: 31.4 ± 38.1 C: 26.4 ± 39.1
Sex: I: 57% M C: 57% M
Groups comparable at baseline? yes
|
Describe intervention (treatment/procedure/test):
restrictive (haemoglobin <70 g/L)
|
Describe control (treatment/procedure/test):
liberal (haemoglobin <95 g/L) |
Length of follow-up:
No patiënts lost to follow-up and adherence to research protocol was excellent
Seven patiënts in the restrictive group and one in the liberal group were suspended temporarily from the transfusion protocol. Length of suspension was comparable (1.1 ± 0.4 days in the restrictive and 1.0 day in the liberal group). During the suspension period, seven red-cell transfusions were given in the restrictive group and one in the liberal group.
Incomplete outcome data: -
|
Outcome measures and effect size (include 95%CI and p-value if available):
Mortality (30 days): Restrictive: 2/63 (3%) Liberal: 2/62 (3%)
Ischemic event: Not reported
Nosocomial infections: Restrictive: 12 (19%) Liberal: 12 (19%)
Number of transfusions: Restrictive: 13 Liberal: 82
No. of days IC (median): NOTE: different numbers in abstract and table 3. Abstract: Restrictive: 7.0 ± 5.0 Liberal: 7.4 ± 6.4 Table (total PICU stay after randomisation): I:4,6 ±3,1 C: 4,7±4,6 |
subgroup analysis focused on patiënts included in the TRIPICU study who had undergone cardiac surgery or catheterization:
Leukocyte reduced allogeneic red-cell units |
|
Type of study: RCT
Setting: hospital
Country: USA
Source of funding:not stated |
Inclusion criteria: congenital heart disease requiring operation, and weight of 10 kg or less for the consistent use of our infant cardiopulmonary bypass (CPB) circuit
Exclusion criteria: transition to extracorporeal membrane oxygenation (ECMO) from CPB, Hb greater than 17.5 g/dL, isolated patent ductus arteriosus, or non–English–speaking parent/guardian
N total at baseline: 162 Intervention: 82 (53 biventricular, 29 palliative) Control: 80 (52 biventricular, 28 palliative)
Important prognostic factors2: Age in days (median (range): I: 84 (2–914) C: 43 (1–730)
Male Sex: I: 40 (49%) C: 45 (56%)% M
Weight in KG (median, (range)): I: 4.5 (2.0–10.0) C: 4.0 (2.3–9.4)
PCICU admission Hb, g/dL I: 11.9 ± 1.4 C: 11.9 ± 1.7
Groups comparable at baseline? yes |
Conservative RBC transfusion for a hemoglobin less than 7.0 g/dL for biventricular repairs or less than 9.0 g/dL for palliative procedures plus a clinical indication
Red cell transfusion was ordered immediately on breaching the Hb threshold in the liberal arm. In contrast, the combination of both breaching the Hb threshold in conjunction with a clinical indication as determined by the attending physician was required for transfusion in the conservative group. “Clinically indicated” transfusions were based on the judgment of the PCICU attending physician (ie, hypotension, tachycardia).
|
Liberal RBC transfusion for a hemoglobin less than 9.5 g/dL for biventricular repairs or less than 12 g/dL for palliative procedures regardless of clinical indication |
Length of follow-up: The transfusion strategy was initiated at admission to the pediatric cardiac intensive care unit (PCICU) and was maintained until 1) transfer from PCICU service, 2) postoperative day (POD) 28, 3) decision to cannulate for ECMO, or 4) death.
Loss-to-follow-up: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
Incomplete outcome data: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Mortality (30 days): not reported. In hospital death: Restrictive: 6 (7%) Liberal: 5 (6%) P=0.97
Thrombosis Restrictive: 7 (9) Liberal: 4 (5) P: 0.37
Myocardinfarct: NR
Ischemic event: Restrictive: Liberal: Cerebral vascular accident Restrictive: 1 (1) Liberal: 0 P=0.32
Infectious event: NR
Clinically significant pulmonary complications: NR
Patiënts transfused: NR
Units transfused: Number of RBC transfusions Restrictive: 116 Liberal: 166
Nu. Of RBC transfusions (median (range)): I: 1 (0–10) C: 0 (0–10), p<0.01
No. of days in hospital (median): Restrictive: 13 (4–143) Liberal: 13 (6–133) P=0.42 |
Rapporteren ook veel niet benoemde uitkomstmaten (lactaat concentraties, hemoglobine concentraties, avO2diff)
Block randomization (block size = 8) divided patiënts to either a conservative or liberal transfusion strategy (stratified randomization). Patiënts were further divided into two strata based on the type of operation as follows: biventricular repair or palliative (nonseptated) procedure. Palliative procedure is defined as including all cases in which the heart is not septated or in which there continues to be intracardiac mixing.
All blood was prestored, leukoreduced, irradiated (CISUS IBL 437 at 2,500 cg), ABO identical, and Rh matched. A volume-depleted protocol was used except in rare emergent cases when time does not allow for volume depletion methods and citrate-phosphate-dextroseadenine (CPDA)-1 red cells of the patiënt’s blood type are not available. Volume depletion was accomplished by centrifugation to remove additive solution, washing with normal saline, or using CPDA-1 red cells that do not have an additive solution. All RBCs were stored for less than 14 days and platelets for 3 to 5 days, and transfusion was initiated within 60 minutes of breaching the Hb threshold. |
|
|
Mazer, 2017 |
Type of study: open label randomized non-inferiority trial
Setting: hospital
Country: International (17 countries)
Source of funding: Canadian Institutes of Health Research, the Canadian Blood Services–Health Canada, the National Health and Medical Research Council of Australia, and the Health Research Council of New Zealand |
Inclusion criteria: 18 years of age or older who were scheduled to undergo cardiac surgery with cardiopulmonary bypass and who had a preoperative additive EuroSCORE I of 6 or higher.
Exclusion criteria: unable to receive blood products, declined blood products, were involved in a preoperative autologous donation program, were undergoing heart transplantation, were having surgery solely for the insertion of a ventricular assist device, or were pregnant or lactating.
N total at baseline: 4860 I: 2430 C: 2430 Important prognostic factors2: Age mean ±SD I:72±10 C:72±10
Male Sex, n(%) I: 1553 (63.9) C: 1586 (65.3)
EuroSCORE I‡ I: 7.9±1.8 C: 7.8±1.9
BMI I: 28.1±6.0 C: 28.0±5.2
Type of surgery: CABG: 622/2429 (25.6) vs. 645/2430 (26.5) Valve: 703/2429 (28.9) vs. 716/2430 (29.5) CABG+ valve: 464/2429 (19.1) vs. 472/2430 (19.4) CABG + another (non-valve): 205/2429 (8.4) vs. 203/2430 (8.4) Other: 433/2429 (17.8) vs. 394/2430 (16.2)
Groups comparable at baseline? yes
|
Restrictive transfusion strategy received a red-cell transfusion if their hemoglobin concentration was less than 7.5 g per deciliter intraoperatively or postoperatively.
If the hemoglobin concentration fell below the appropriate threshold at any time, 1 unit of red cells was administered at a time and was followed with a reassessment of the hemoglobin concentration. Red-cell transfusion was to be administered as soon as possible after the threshold-related hemoglobin concentration was measured and had to be initiated within the following maximum time frames: 2 hours for patiënts during an operation; 18 hours in the ICU, including step-down units; or 40 hours on the non-ICU hospital ward. |
Liberal transfusion strategy received a red-cell transfusion if their hemoglobin concentration was less than 9.5 g per deciliter intraoperatively or postoperatively in the intensive care unit (ICU) or if the hemoglobin concentration was less than 8.5 g per deciliter when the patiënt was in the non-ICU ward |
Length of follow-up: 28 days or until discharche
Loss-to-follow-up: -
Incomplete outcome data: -
|
Death — no./total no. (%) 74/2427 (3.0) vs. 87/2429 (3.6), OR: 0.85 (0.62–1.16)
Stroke: Stroke — no./total no. R: (%) 45/2428 (1.9) L: 49/2429 (2.0) HR: 0.92 (0.61–1.38)
Myocardial infarction — no./total no. (%) 144/2428 (5.9) vs. 144/2429 (5.9) OR: 1.00 (0.79–1.27)
Lenght of stay in ICU, days median: 2.1 vs, 1.9 HR: 0.89 (0.84–0.94)
Lenght of stay in hospital days median: 8.0 vs. 8.0, HR: 0.93 (0.88–0.99)
Infection — no./total no. (%) 121/2428 (5.0) vs. 101/2429 (4.2), OR: 1.21 (0.92–1.58)
New-onset renal failure with dialysis — no./total no. (%) 61/2428 (2.5) vs. 72/2429 (3.0) HR: 0.84 (0.60–1.19)
≥1 Unit of red cells — no. (%) 1271 (52.3) vs. 1765 (72.6), OR 0.41 (0.37–0.47)
No. of units of red cells transfused, median 2 vs. 3, RR 0.85 (0.82–0.88)*
Pts receiving no RBC transfusion n(%): 1159 (47.7) vs. 665 (27.4)
|
|
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patiënts between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors ((potential) confounders).
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Bracey, 1999 |
randomly assigned to study and control groups on the basis of the last digit of their medical record number. |
likely |
unlikely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Carson, 2013 |
Using an automated telephone system, we implemented a permuted block randomization process stratified by clinical site and clinical diagnosis (acute coronary syndrome or stable coronary artery disease). |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
unlikely |
|
Johnson, 1992 |
Randomized with the aid of a random numbers and an odd-even (conservative strategy-liberal strategy) designation |
unlikely |
unlikely |
unlikely |
unclear |
unlikely |
unlikely |
unlikely |
|
Hajjar, 2010 |
Opaque envelopes arranged using a random-number table were prepared by the chief statistician and opened sequentially to determine the patiënt’s treatment group. The research coordinator enrolled the participants and obtained informed consent. |
unlikely |
unlikely |
not possible |
unlikely |
unlikely |
unlikely |
unlikely |
|
Murphy, 2015 |
by means of a secure Internet-based system that concealed assignments and used cohort minimization to balance assignments according to center and type of surgery. |
unlikely |
unlikely |
not possible |
not possible |
unlikely |
unlikely |
unlikely |
|
Shehata, 2012 |
Randomization sequence was created using permuted blocks of four stratified by age and the Cardiac Anesthesia Risk Score (CARE) score.Opaque sequential sealed envelopes were used and opened at the start of surgery. The allocation sequence was generated by an independent statistician at the Ottawa Methods Centre of the Ottawa Hospital Research Institute. The research coordinator enrolled participants and assigned participants to the transfusion strategies. |
unlikely |
unclear |
unclear |
unclear |
unlikely |
unclear |
unlikely |
|
Cholette, 2017 |
Block randomization (block size = 8) |
unlikely |
Unlikely |
Likely (no blinding and treatment was clinically indicated by the treating physician. |
Unclear (not blinded) |
Unlikely |
Unlikely |
Unlikely |
|
Mazer, 2018 |
concealed centralized, Web-based system, stratified according to center, with computer-generated random permuted blocks of varying sizes from two to six. |
Unlikely |
Unlikely |
Incluclear (no blinding, this was not possible, however might cause bias( |
unlikely |
Unlikely |
unlikely |
Per protocol analysis, however modified ITT and adjusted analyses of the primary and secondary outcomes was performed to examine the consistency of the treatment effect. The modified intention-to-treat population included all the patiënts who underwent randomization except for those who did not undergo the planned surgical procedure and those who withdrew consent preoperatively. |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patiënts and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patiënt nor the care provider (attending physician) knows which patiënt is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patiënt assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patiënts lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patiënts lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear.
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Brierley, 2014 |
Protocol, geen resultaten |
|
Murphy, 2007 |
Pilot study van Murphy 2015 (wel geïncludeerd) met zelfde data |
|
Curley, 2014 |
Review, andere PICO |
|
Hogervorst, 2016 |
Cohort study |
|
Galas, 2013 |
Subgroep analyse van Hajjar, 2010 naar length of hospital stay, niet PICO |
|
Nakamura, 2015 |
De studie van Nakamura et al., (2015) is een substudie/secundaire analyse van de Transfusion Requirements After Cardiac Surgery (TRACS) RCT waarin patiënten werden gerandomiseerd voor restrictief of liberaal bloedtransfusiebeleid (Hajjar, 2010). In deze subgroepanalyse werden patiënten onderverdeeld in patiënten jonger en ouder dan 60 jaar. De resultaten van de primaire RCT (Hajjar, 2010) zijn reeds geïncludeerd in deze literatuuranalyse (en die van NICE). |
|
Reeves, 2016 |
Is een uitgebreide beschrijving van de TITRe2 trial (Murphy, 2015) waarbij een kosteneffectiviteitsanalyse is toegevoegd. Beschrijft dezelfde primaire data als Murphy 2015, dus exclusie. |
|
Wang, 2016 |
Niet gerandomiseerd retrospectief onderzoek |
|
Wilkinson, 2014 |
Gaat over congenital heart disease, sluit niet aan bij PICO. Tevens ouder dan NICE richtlijn en Cochrane analyse (2016b) |
|
Slight. 2008;95(3):205-10 |
Exclusie: voldoet niet aan PICO (had ook in NICE en Cochrane moeten zitten) |
|
Carson 2013 |
Cardiac catheterization is geen operatieve ingreep. Studie wordt tevens meegenomen in de analyses voor patiënten met ACS. |
|
de Gast-Bakker. 2013;39(11):2011-9 |
Ouder dan NICE en Cochrane en daar zit hij niet in bij de cardiac surgery groep.
|
|
Almeida. 2011;15:30 |
Study design: Case control |
|
Bagate, Intensive Care Medicine. 2013;39:S413. |
Study design:: cohort studie |
|
Balzer, Anesthesia and Analgesia. 2016;122(5):S60 |
Vanwege type design: retrospective study. Cardiac surgery
|
|
Costello. Annals of Thoracic Surgery. 2010;89(6):1833-41 |
Vanwege type design: matched case- control. Focus niet bloedtransfusie maar infectie. |
|
Hogervorst E. Applied Cardiopulmonary Pathophysiology. 2014;18:49-50 |
Vanwege type design: single centre cohort study. Cardiac surgery |
|
Hogervorst. Journal of Cardiothoracic & Vascular Anesthesia. 2016;30(2):363-72 |
Vanwege type design: cohort study (data 1997-2013). Cardiac surgery
|
|
Mikroulis. Evidence-Based Medicine. 2011;16(4):107-8 |
Onduidelijk design. |
|
Wang. Journal of Cardiothoracic & Vascular Anesthesia. 2016;30(5):1163-6 |
Vanwege design: retrospective, controlled study |
|
Galas . Cardiothorac Surg. 2013;8:54 |
Vanwege design: retrospective study |
|
Bhaskar,. Annals of Thoracic Surgery, 2012. 94(2): p. 460-7 |
Exclusie: type studie |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 15-10-2020
Laatst geautoriseerd : 27-11-2019
Geplande herbeoordeling :
Voor het beoordelen van de actualiteit van deze richtlijn wordt een deel van de werkgroep in stand gehouden. Op modulair niveau is een onderhoudsplan beschreven. Bij het afronden van de richtlijn zal de werkgroep per module een inschatting maken over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Internisten Vereniging (NIV), Nederlandse Vereniging van Anesthesiologie (NVA) en Nederlandse Vereniging van Klinische Chemie (NVKC) zijn regiehouders van deze richtlijn(module) en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn(module). De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
De transfusierichtlijn geeft ten eerste antwoorden op grote uitgangsvragen over wie, wanneer, hoe, hoeveel en met welke producten getransfundeerd wordt en wat daarvan volgens wetenschappelijk onderzoek aan voordelig/nadelig resultaat verwacht mag worden. Na het bepalen van de wetenschappelijke waarde van dit onderzoek, worden uiteindelijk aanbevelingen opgesteld, gebaseerd op de conclusies van het wetenschappelijke onderzoek en na het beschouwen van een additionele context van bijvoorbeeld kosten- ethische, maatschappelijke of wettelijke overwegingen. Deze aanbevelingen zijn bedoeld om verantwoord en wenselijk handelen voor leden van de beroepsgroep te definieren in de voorkomende dagelijkse klinische praktijk. Echter, er kan beargumenteerd altijd afgeweken worden van de algemene aanbevelingen en gekozen worden voor een meer op de individuele patient afgestemde ondersteuning.
Doelgroep
Naast de genoemde beoogde gebruikers van de richtlijn is de richtlijn ook bedoeld en van waarde voor de collega’s van de nationale bloedvoorzieningsorganisatie Sanquin.
Samenstelling werkgroep
Voor de herziening van de richtlijn zijn er in 2016 zes multidisciplinaire werkgroepen ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij patiënten die een bloedtransfusie nodig hebben. Een stuurgroep, bestaande uit de voorzitters van de deelprojecten, coördineerde de werkgroepen.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep Laboratoriumaspecten
- Dr. J (Jennita) Slomp, laboratoriumspecialist klinische chemie en hematologie, voorzitter, NVKC
- Dr. C. (Claudia) Folman, manager laboratorium erytrocytenserologie, NVKC
- Prof. dr. M (Masja) de Haas, clustermanager immunohematologie diagnostiek, NVKC
- G.H. (Judith) Lie, hemovigilantiefunctionaris, weefselvigilantiecoördinator, NVML
- Dr. H. (Henk) Russcher, Laboratoriumspecialist Klinische Chemie en Hematologie, NVKC
- Dr. M.R. (Martin) Schipperus, internist-hematoloog, NIV
- N. (Nel) Som, senior hoofdanaliste bloedtransfusiedienst, NVML
- Dr. K.M.K. (Karen) de Vooght, laboratoriumsepcialist klinische chemie en transfusie, NVKC
- Dr. H. (Harry) de Wit, Laboratoriumspecialist Klinische Chemie en Hematologie, NVKC
Werkgroep Anemie
- Prof. dr. J.J. (Jaap Jan) Zwaginga, internist-hematoloog/ transfusiespecialist/ hoogleraar transfusiegeneeskunde, voorzitter, NIV
- Drs. K.A. (Klasien) Bergman, kinderarts-neonatologie, NVK
- dr. J.M. (Jurriën) ten Berg, Cardioloog, NVVC
- Dr. B.J. (Bart) Biemond, internist-hematoloog, NIV
- Dr. P.A.W. (Peter) te Boekhorst, internist-hematoloog/ transfusiespecialist, NIV
- Prof. dr. C.J. (Karin) Fijn van Draat, hoogleraar kinderhematologie/ senior onderzoeker Sanquin research, NVK
- Dr. A.J. (Adriaan) van Gammeren, laboratoriumspecialist klinische chemie en hematologie, NVKC
- Dr. N.P. (Nicole) Juffermans, Intensivist, NVIC
- Dr. A.W.M.M. (Ankie) Koopman-van Gemert, anesthesioloog, NVA
- Dr. L.E.M. (Liesbeth) Oosten, internist-hematoloog, NIV
Werkgroep Trombocytentransfusies
- Dr. E.A.M. (Erik) Beckers, internist-hematoloog/ transfusiespecialist, hematoloog, voorzitter, NIV
- Dr. M. (Michiel) Coppens, internist-vasculaire geneeskunde, NIV
- Dr. A.J.G. (Gerard) Jansen, internist-hematoloog, NIV
- Dr. J.L.H. (Jean-Louis) Kerkhoffs, internist-hematoloog, NIV
- Dr. E. (Enrico) Lopriore, sectiehoofd neonatologie, NVK
- Dr. C. (Heleen) van Ommen, kinderarts hematoloog, NVK
- Dr. E.C.M. (Lizzy) van Pampus, internist-hematoloog-transfusiespecialist, NIV
- Dr. R.E.G. (Roger) Schutgens, internist-hematoloog, NIV
- Dr. J.W.P.H (Hans) Soons, laboratoriumspecialist klinische chemie, NVKC
- Dr. A.P.J. (Alexander) Vlaar, internist-intensivist, NVIC
Werkgroep Bloedingen en bloedbesparende technieken
- Dr. A. (Ankie) Koopman – van Gemert, anesthesioloog, voorzitter, NVA
- Dr. J.J. (Hans) Duvekot, gynaecoloog-perinatoloog, NVOG
- Dr. L.M.G. (Leo) Geeraedts, traumachirurg, NVvH
- Dr. ir. Y.M.C. (Yvonne) Henskens, laboratoriumspecialist klinische chemie en hematologie, NVKC
- Drs. E.J. (Elise) Huijssen-Huisman, kinderarts, kinderhematoloog, transfusiespecialist, NVK
- Dr. N.P. (Nicole) Juffermans, intensivist, NVIC
- Prof. dr. F.W.G. (Frank) Leebeek, internist hematoloog en internist vasculair geneeskundige, NIV
- P.M.J. (Peter) Rosseel, anesthesioloog–intensivist, NVA
- Dr. E.C.T.H. (Edward) Tan, traumachirurg, NVvH
- Drs. V.A. (Victor) Viersen, anesthesioloog, NVA
- Dr. A.B.A. (Alexander) Vonk, cardiothoracaal chirurg, NVT
- Prof. dr. J.J. (Jaap Jan) Zwaginga, hematoloog/ transfusiespecialist/ hoogleraar transfusiegeneeskunde, NIV
Werkgroep Plasmatransfusies
- Dr. J.W.P.H (Hans) Soons, laboratoriumspecialist klinische chemie, voorzitter, NVKC
- Dr. E.A.M. (Erik) Beckers, internist-hematoloog/ transfusiespecialist, NIV
- Drs. K.A. (Klasien) Bergman, kinderarts-neonatologie, NVK
- Dr. M. (René) van Hulst, ziekenhuisapotheker, NVZA
- Prof. dr. K. (Karina) Meijer, internist-hematoloog, NIV
- Dr. M.C.A. (Marcella) Müller, internist-intensivist, NVIC
- Dr. E.C.M. (Lizzy) van Pampus, internist-hematoloog/transfusiespecialist, NIV
- Dr. Marjolein Peters, kinderarts-hematoloog, NVK
- Drs. K.N.M.E.M. (Koen) Reyntjens, anesthesioloog, NVA
Werkgroep Transfusiereacties en gerelateerde aandoeningen
- Dr. M.R. (Martin) Schipperus, internist-hematoloog, voorzitter, NIV
- Dr. J.L.P. (Hans) van Duynhoven, laboratoriumspecialist klinische chemie, NVKC
- Drs. C.T. (Christian) Favoccia, anesthesioloog, NVA
- Prof dr. C.J. (Karin) Fijn van Draat, hoogleraar kinderhematologie/ senior onderzoeker Sanquin research, NVK
- G.H. (Judith) Lie, hemovigilantiefunctionaris, weefselvigilantiecoördinator, NVML
- Dr. T. (Tanja) Netelenbos, internist-hematoloog, NIV
- Dr. J. (Jennita) Slomp, laboratoriumspecialist klinische chemie en hematologie, NVKC
- Dr. Dik Versteeg, arts-microbioloog, NVMM
- Dr. A.P.J. (Alexander) Vlaar, internist-Intensivist, NVIC
- Dr. J.C. (Jo) Wiersum-Osselton, TRIP hemo- en biovigilantie, landelijk coördinator, sociale geneeskunde
- C. (Clary) Wijenberg, verpleegkundig specialist palliatieve zorg, V&VN
Met ondersteuning van:
- Dr. M.M. (Marja) Molag, adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Drs. S.M. (Sabrina) Muller-Ploeger, adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Drs. M. (Marleen) Ploegmakers, senior-adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Drs. E. (Ester) Rake, junior adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Drs. E.E. (Eva) Volmeijer, adviseur Kennisinstituut van de Federatie Medisch Specialisten, projectleider
- Drs. T. (Tessa) Geltink, junior adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Drs. S. (Sanne) Snoeijs, adviseur Kennisinstituut van de Federatie Medisch Specialisten
- D.P. (Diana) Gutierrez, projectsecretaresse Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Voorzitters (kerngroep) |
||||
|
M. Schipperus |
Internist-hematoloog (100%) |
Voorzitter Bestuur Stichting TRIP (Transfusie in patiënten), onbetaald |
ITP-onderzoek gefinancierd door AMGeN Advisory board Novartis |
Lid participeert niet in besluitvorming omtrent producten van AMGEN of Novartis. |
|
A. Koopman- van Gemert |
Anesthesioloog |
Diverse functies bij nationale en internationale commissies bv Concilium, Stuurgroep antistolling, examencommissie et cetera Internationaal lid van de Europese examencommissie |
-Participatie in de PETS-studie van het EMC, geen financiële relatie. -Participatie in verschillende onderzoeken (geen financiële relatie en geen direct verband bloedtransfusie) -Organisatie symposia met sponsoring (geen directe financiële relatie en direct verband bloedtransfusie) |
Geen restricties |
|
J.J. Zwaginga |
Hematoloog LUMC (Leiden), Transfusiespecialist, Hoogleraar transfusiegeneeskunde |
-Penningmeester VHL=Vereniging Hematologische laboratoria -Voorzitter van de benigne hematologische werkgroep van NVvH |
-Sprekershonoraria Viforpharma (ijzer: medicatie kan transfusies uitsparen) -Wetenschappelijke adviesraad: Novantis (ijzerchelatie kan transfusie gemedieerde ijzerstapeling opheffen) - Gilead: CLL medicatie webcast geen relatie met transfusiebeleid PI van meerdere Sanquin onderzoeken ogv - allumminisatie door RBC transfusies - ijzertoxiciteit door bloedtransfusies - bloedings IRM (voldoende) plaatjestransfusies et cetera |
Lid participeert niet in besluitvorming omtrent Novartis en wanneer SANQUIN-studies worden geïncludeerd waarbij lid een van de auteurs is |
|
E. Beckers |
Internist-hematoloog/transfusiespecialist MUMC + Maastricht |
Bestuurslid Ned. Ver. Bloedtransfusie, onbetaald - Bestuurslid Ned. Ver. Hematologie, onbetaald - Lid adviesraad TRIP (Transfusie Reacties in Patiënten), onbetaald - Lid Landelijke Gebruikers Raad Sanquin, onbetaald - Lid Stuurgroep TiN studie (Trombocytopathie in Nederland) |
Project 'Predictors of Bleeding' externe financiering door Bayer
Transparantieregister.nl: sprekers vergoeding van Roche; gastvrijheidsbijdrage van: Roche, Pfizer, Sanquin en Bayer |
Lid participeert niet in besluitvorming omtrent producten van Bayer en Roche en wanneer specifiek de studie "predictors of bleeding" (gefinancierd door Bayer) worden geïncludeerd |
|
J. Slomp |
Laboratorium specialist Klinische Chemie en hematologie MST/Medlon |
-Bestuurslid VHL - onbetaald -Bestuurslid NVvH - onbetaald -Werkgroep Bloedtransfusie VHL (vz.) onbetaald -Lid LGR onbetaald - - Lid Expert committee TRIP (onbetaald) |
-Medical Advisory Board Janssen: advies omtrent bloedtransfusie bij patiënten die daratumumab gebruiken, betaald - In samenwerking met UMCU en VU bezig om een landelijk protocol op te stellen voor bloedtransfusie en daratumumab |
Lid participeert niet in besluitvorming omtrent productn van Janssen (daratumumab) |
|
H. Soons |
Laboratoriumspecialist Klinische Chemie, St. Anna Ziekenhuis (1 fte) en Kempenhaeghe (detachering vanuit St. Anna Ziekenhuis)
|
-Bestuur Nederlandse Vereniging voor Bloedtransfusie (NVB), voorzitter, onbetaald -Bestuur Transfusie Reacties in Patiënten (TRIP), secretaris, vacatiegeld - Medisch Advies Raad Sanquin (MAR), lid, vacatiegeld -Lid Landelijke Gebruikersraad Sanquin (LGR), onbetaald |
|
Geen restricties |
|
Werkgroep laboratoriumaspecten |
||||
|
H. de Wit |
Laboratoriumspecialist Klinische Chemie en Hematologie, Certe |
-Bestuurslid/ penningmeester Nederlandse Vereniging voor Bloedtransfusue (onbetaald) - Bestuurslid/ penningmeester Stichting Vrienden van de NVB (onbet aald) |
|
Geen restricties |
|
K. de Vooght |
Laboratoriumspecialist Klinische Chemie, Hoofd Patiëntenzorg LKCH ad interim |
Bestuurslid/ penningmeester Stichting TRIP (onbetaald) - Bestuurslid/voorzitter Stichting vrienden van de Utrechtse bloedbank (onbetaald) - Lid Werkgroep Consortium Transfusiegeneeskundig Onderzoek (onbetaald) - Lid PROTON II Adviesraad (onbetaald) - Lidmaatschap NVB - Lidmaatschap NVvH - Docent OKU (Onderwijs Kring Utrecht) (betaald) -Docent PAO Farmacie (betaald) -Lid Wetenschappelijke commissie NVB/TRIP symposium (onbetaald) |
|
Geen restricties |
|
C. Folman |
Manager Laboratorium Erytrocytenserologie (Sanquin) |
- Docent Hogeschool Arnhem en Nijmegen, betaald - Lid TRIX-werkgroep, onbetaald - Secretaris werkgroep Bloedtransfusie van de VHL (Vereniging Hematologische Laboratoriumdiagnostiek), onbetaald - Lid Expert Committee TRIP (Transfusie Reacties In Patiënten), onbetaald -Lid wetenschappelijke commissie NVB (Nederlandse Vereniging voor Bloedtransfusie), onbetaald" |
- Dienstverband Sanquin - werkzaam in expertiselaboratorium waar onderzoek wordt gericht voor derden op het gebied van bloedtransfusie |
Werkgroeplid is geen trekker/primaire auteur bij uitspraken over diagnostiek.
|
|
M. de Haas |
-Bijzonder hoogleraar Translationele Immunohematologie (bezoldiging Sanquin, onbezoldigd aangesteld bij LUMC -Clustermanager Immunohematologie Diagnostiek |
- Secretaris NVB (tot mei 2017) |
-Dienstverband Sanquin -Hoofd van een expertiselaboratorium dat ingezet zou kunnen worden door derden voor het uitvoeren van (uit de richtlijn voortkomende) laboratoriumdiagnostiek |
Werkgroeplid is geen trekker/primaire auteur bij uitspraken over diagnostiek.
|
|
H. Russcher |
Laboratoriumspecialist Klinisch Chemie en Hematologie, in het Erasmus MC en Havenziekenhuis |
- Auditor RvA i.h.k.v. ISO 15189:2012 voor medische laboratoria - Betaald |
|
restricties t.a.v. producten van Roche diagnostiek.Gebruikersraad geen belangen tav Sanquin, geen restriicties |
|
N. Som |
Senior hoofdanaliste bloedtransfusiedienst VUmc |
- Hemovigilantiecoördinator Vumc |
|
Geen restricties |
|
J. Lie |
-Stafadviseur hemovigilantie 24,8 uur -Weefselvigil antiecoördinator 7,2 uur" |
-Contactpersoon voor landelijk Bureau TRIP: meldingen transfusiereacties en bijwerkingen - Voorzitter landelijk Hemovigilantoe Platform Nederland (vanaf 2016, eerder lid, mede oprichter HPN), onbetaald - Voorzitter en oprichter Regionaal Hemovigilantie Platform Zuidoost - BestuursLid NVB |
|
Geen restricties |
|
Werkgroep Anemie |
||||
|
A. Van Gammeren |
Laboratoriumspecialist Klinische Chemie
|
|
|
Geen restricties
|
|
N. Juffermans |
Intensivist |
Chief editor Netherlands Journal of Critical Care, vergoeding |
|
Geen restricties
|
|
K. Bergman |
Kinderarts-neonatologie, Beatrix kinderziekenhuis, UMCG ten Groningen (0,9fte). Als kinderarts-neonatologie voorzitter van het Regioteam Perinatale Audit Noord Nederland (Perined). Deze functie (0,1fte) wordt uitgeoefend binnen de UMCG aanstelling. |
-Lid programmacommissie Prenatale screening infectieziekten en erytrocyten-immunisatie RIVM namens NVK (vacatiegeld) -Lid werkgroep neonatale infectieziekten sectie neonatologie NVK (onbetaald) -Projectcommissielid ZonMw project: Introduction of Audit generated Changes in perinatal care using ""Tailored"" implementation strategies. (ACTion-project) (onbetaald) =Projectcommissielid 5 genes per minute, afdeling Medische genetica, UMCG, Groningen (onbetaald) |
|
Geen restricties
|
|
P. te Boekhorst |
Internist-Hematoloog / Transfusiespecialist
|
Medisch Adviesraad Sanquin, Lid, Vacatiegeld
|
In verleden: - Gastvrijheid Firma Alexion - Adviesraad Firma AmgeN (ITP) |
Lid participeert niet bij besluitvorming omtrent ITP |
|
B. Biemond |
Internist-hematoloog |
|
|
Geen restricties |
|
L. Oosten |
Hematoloog, Afdeling Immunohematologie & Bloedtransfusie bij het Leids Universitair Medisch Centum |
|
|
Geen restricties |
|
K. Fijn van Draat |
-Hoogleraar kinderhematologie AMC - Senior onderzoeker Sanquin Research |
VIDI selectiecommissie ZONMW, onbetaald (wel vacatievergoeding) |
Lid van de stuurgroep van de PLANET-2 studie die onderzoek doet naar triggers van trombocytentransfusie bij neonatenop de Neonatale Intensive Care Unit. PLANET-2 ontvangt geen sponsoring van de farmaceutische industrie |
Geen restricties |
|
Werkgroep trombocytentransfusies |
||||
|
A. Vlaar |
- Internist-Intensivist, Academisch Medisch Centrum, Amsterdam - Principal investigator Infusion related morbidity and mortality in the critically ill |
- Klinisch brug figuur Sanquin, onbetaald
|
Onderzoek gefinancierd door NWO, ZonMW, Sanquin: PI van de PACER studie (onder andere): hierbij worden trombotriggers voor invasieve ingrepen aangehouden. |
Geen restricties (ten aanzien van PACER studie: geen tegengesteld belang. Studie wordt niet gepubliceerd binnen termijn afronding richtlijn). |
|
l. van Pampus |
Internist-hematoloog-transfusiespecialist Radboudumc |
- Vice voorzitter hemovigilantiekamer TRIP (onbezoldigd)
|
Tegemoetkoming verblijfkosten Dublin (Ierland) het 17th Annual NATA Symposium on Patient Blood Management, Haemostasis and Thrombosis (NATA 2016) cf de CGR-rgels. |
Geen restricties |
|
G. Jansen |
Internist-hematoloog, afdeling Hematologie, Erasmus MC |
Post doctoraal onderzoeker bij afdeling Plasmaeiwitten, Sanquin Bloedvoorziening. Gastvrijheidovereenkomst, onbetaald |
"1) Naam project: ""Surface sialic acid is critical for platelet survival"" Financier: Sanquin Product and Process development (PPOC nr. 13-019). Bedrag: 499.000 euro. Rol: AIO project 2013-2018. Principal investigator en co-promotor
Toelichting: van dit geld is een OIO aangesteld (Mw M. Rijkers) die in dienst van Sanquin (1,0 fte) dit onderzoek verricht" |
Bij onderwerp sialic acid en trombocytenoverleving geen trekker /betrokkenheid opstellen aanbevelingen |
|
J.L. Kerkhoffs |
Internist - Hematoloog (0,8 FTE)
|
Transfusie-specialist / transfusie research (0,2 FTE) via Sanquin
|
Op Sanquin verricht ik klinisch transfusie onderzoek wat deels gefinancieerd wordt door de industrie TerumoBCT: PI van de PREPAReS studie, een RCT naar de klinische effectiviteit van trombocyten concentraten behandeld met een pathogeen-reductie proces (Mirasol, TERUMO BCT).
|
Restricties t.a.v. producten behandeld met pathogeen reductie proces en biomarkers. Deze onderwerpen zijn vooralsnog niet geprioriteerd voor de richtlijn, dus geen restricties nodig.
|
|
R. Schutgens |
Internist-hematoloog
|
Lid van Medische Adviesraad patiëntenvereniging ITP |
-Speakersfee (voor instituut) en/of unrestricted research grant en/of lid advisory board van: Bayer, Baxalta, CSL Behring, NovoNordisk, Sanquin, Pfizer, Bristol-Meyers Squibb -Principal Investigator van de Trombocytopathie in Nederland (TiN) studie, mede gefinancierd door een unrestricted grant van Sanquin - deelname (in UMCU) ontwikkeling PACT en U-PACT (geen financieel belang) |
Geen betrokkenheid vragen bij bloedplaatjesfunctietest (PACT). Deze onderwerpen zijn vooralsnog niet geprioriteerd voor de richtlijn, dus geen restricties nodig. |
|
M. Coppens |
Internist-vasculaire geneeskunde
|
- Diverse naschollingen en adviesraden (allen incidenteel) aangaande directe orale anticoagulantie georganiseerd door de fabrikanten van deze middelen, te weten Boehringer Ingelheim, Bayer, Pfizer, Bristol-Meyers Squibb, Daiichi Sankyo. Deze diensten zijn betaald, waarbij het geld naar mijn instituut gaat - Adviesraad aangaande 'The future of hemophilia treatment' georganiseerd door CSL Behring. Twee maal een advisory board; in 2015 en 2016. Deze diensten zijn betaald waarbij geld naar instituut gaat. CSL Behring produceert o.a. Haemocomplettan P (fibrinogeenconcentraat) en Beriplex (vierfactorenconcentraat). De huidige richtlijn zal mogelijk off-label gebruik van deze 2 middelen gaan bespreken. De genoemde adviesraad richtte zich op hemofilie A en B en de producten Haemocomplettan P en Beriplex zijn hier niet aan de orde geweest." |
Lid van de Stuurgroep van de Trombopathie in Nederland studie (geen financiele belangen). -Sanquin Blood Supply: Prothrombin Complex Concentrate (PCC) for the immediate reversal of the anticoagulant effects if new oral anticoagulants in emergency situations. Sanquin Blood Supply is producent van Cofact, een PCC, - CSL Behring: Biomarkers to detect subclinical arthropathy and predict long-term clinical arthropathy in patients with hemophilia. This project was awarded a 2016 Heimburger Award. CSL Behring produceert zowel Haemocomplettan P (fibrinogeenconcentraat) als Beriplex (een PCC), Dit project is gecofinancierd door CSL Behring, maar hebben geen betrekking op Haemocomplettan P noch Beriplex. |
Geen betrokkenheid opstellen aanbevelingen t.a.v. fibrinogeenconcrentraat en vierfactoren concentraat |
|
E. Lopriore |
Sectiehoofd Neonatologie WAKZ/LUMC |
Lid bloedtransfusiecommissie LUMC |
Onderzoek gefinancieerd door Sanquin: 1. PROC 12-012-027: Matisse studie: RCT in neonaten naar twee verschillende triggers voor trombocyten transfusies 50 vs 25; Promovenda: Suzanne Gunnink 2. PROC 16-33: Promotie onderzoek naar Rhesus hemolytische ziekt: Promovenda: Isabelle Ree |
Geen restricties |
|
H. van Ommen (meelezer) |
Kinderhematoloog |
|
'- PI Einstein junior (Bayer) Behandeling trombose bij kinderen - PI Hokusai kinderen (Daiichi Sankyo) Behandeling trombose bij kinderen - Nationaal coördinator BMS studie Apixaban ter preventie van trombose bij kinderen met een hartafwijking |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afstemming met de Patiëntenfederatie, Stichting Zeldzame Bloedziekten en Oscar Nederland. Deze verenigingen zijn uitgenodigd voor de invitational conference (knelpuntenanalyse) voorafgaand aan deze herziening en hebben input geleverd voor de te prioriteren vragen. De verenigingen hebben aangegeven graag in de commentaarfase de conceptrichtlijn te ontvangen voor commentaar. Tevens zal in de eindfase van deze richtlijn nog worden overlegd over de communicatie aan patiënten en of er nog aanvullende teksten voor patiënten kunnen worden opgesteld.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan zal bij afronding van de richtlijn te vinden zijn bij de aanverwante producten. De werkgroep zal tevens de interne kwaliteitsindicatoren die bij de Richtlijn bloedtransfusie 2011 zijn opgesteld beoordelen en indien nodig door ontwikkelen.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitters van de werkgroepen en de adviseurs de knelpunten. De werkgroepen beoordeelden de aanbevelingen uit de eerdere richtlijn Bloedtransfusiebeleid (2011) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door patiëntenverenigingen en andere aanwezigen tijdens de Invitational conference. De werkgroepen stelden vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitters en de adviseurs concept-uitgangsvragen opgesteld. Deze zijn in de werkgroepen besproken waarna de werkgroepleden de definitieve uitgangsvragen hebben vastgesteld. Vervolgens inventariseerden de werkgroepen per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroepen waardeerden deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroepen tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen en systematische reviews (Medline). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje “Overwegingen”.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk om mee te wegen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs, de belangrijkste overwegingen en de weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn word aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren worden verzameld en besproken met de werkgroepen. Naar aanleiding van de commentaren word de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroepen. De definitieve richtlijn word aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html. 2012.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
