ABO-bloedgroep compatibiliteit bij plasmatransfusie
Uitgangsvraag
Is ABO-identiek transfunderen bij patiënten die een plasmatransfusie ontvangen beter dan ABO compatibel transfunderen?
Aanbeveling
ABO-identiek transfunderen bij patiënten die een plasmatransfusie ontvangen is niet (voldoende) bewezen beter dan ABO-compatibel transfunderen. Selecteer ABO-compatibele plasma eenheden.
Voor informatie over PNH-patiënten wordt verwezen naar de richtlijn Paroxysmale Nachtelijke Hemoglobinurie, ontwikkeld en geautoriseerd door de Nederlandse Vereniging voor Hematologie.
Overwegingen
De hier uitgevoerde literatuursearch levert twee relevante studies op (Inaba, 2010; Shanwell, 2009). De in de vorige richtlijn genoemde studie van Benjamin voldeed niet aan de selectiecriteria voor de systematische literatuuranalyse (letter to the editor, geen volledige (peer reviewed) studie) (Benjamin, 1999). Hoewel de uitkomsten van de geselecteerde studies suggereren dat transfusie van niet ABO-identiek plasma meer multi-orgaanschade en een hogere mortaliteit geeft, mogelijk door de vorming van complexen van antistoffen en vrij A en/of B, heeft dit niet geleid tot enig (gepubliceerd) vervolgonderzoek. De bewijskracht van beide studies is zeer laag, en heeft niet geleid tot aanbevelingen in andere internationale richtlijnen (zoals die van de AABB (USA) en United Kingdom Blood Services).
Gezien de zeer lage bewijslast van de beschikbare literatuur, is de werkgroep van mening dat het niet zinvol is te streven naar het transfunderen van ABO-identieke plasma eenheden.
Onderbouwing
Achtergrond
Plasma wordt bloedgroep ABO-compatibel gegeven, aangezien plasma antistoffen tegen bloedgroepantigenen A en B kan bevatten. In de richtlijn van 2011 paragraaf 3.9 wordt aanbevolen om meer onderzoek te verrichten. Dit naar aanleiding van twee studies (Benjamin, 1999 en Shanwell, 2009) die suggereren dat transfusie van ABO-compatibel –niet ABO-identiek- plasma meer multi-orgaanschade en een hogere mortaliteit geeft, mogelijk door de vorming van complexen van antistoffen bij de ontvanger tegen vrij A en/of B in het plasmaproduct. De literatuursearch die uitgevoerd werd heeft als doel te onderzoeken of er nu meer bewijs is voor de bevindingen uit genoemde eerdere studies en of op basis daarvan de aanbeveling voor plasmatransfusie veranderd moet worden van ABO-compatibel naar ABO-identiek transfunderen.
Conclusies
Mortaliteit
|
Zeer laag GRADE |
Er zijn te weinig gegevens van voldoende kwaliteit om een conclusie te trekken over de mortaliteit na een plasmatransfusie met ABO-identiek plasma in vergelijking met een transfusie met ABO-compatibel plasma.
Bronnen (Shanwell,2009; Inaba, 2010) |
Morbiditeit
|
Zeer laag GRADE |
Er zijn te weinig gegevens van voldoende kwaliteit om een conclusie te trekken over de morbiditeit (totaal, ARDS en sepsis) na een plasmatransfusie met ABO-identiek plasma in vergelijking met een transfusie met ABO-compatibel plasma.
Bronnen (Inaba, 2010) |
Samenvatting literatuur
Shanwell (2009) bestudeerde alle patiënten uit de SCANDAT-database die een eerste geregistreerde plasmatransfusie ondergingen (18 jaar of ouder). Deze database bevat nationale gegevens. Zij vergeleken mortaliteit na transfusie met ABO-compatibel plasma mortaliteit na transfusies met ABO-identiek plasma, met een follow up van 14 dagen. Uiteindelijk omvatte het cohort 86.082 patiënten uit 29 Zweedse ziekenhuizen met een gemiddelde leeftijd van 70 jaar (55% man).
Inaba (2010) heeft over een periode van negen jaar alle trauma patiënten geïncludeerd die een plasmatransfusie hebben ontvangen. In deze groep zijn de patiënten die ABO-compatibel plasma ontvingen vergeleken met de groep die ABO-identiek plasma ontvingen, met betrekking tot mortaliteit en morbiditeit. In verband met grote verschillen zijn de twee groepen gematched naar profiel volgens propensity score matching. De groep bestond uiteindelijk uit 2x284 patiënten (gemiddelde leeftijd 34.0 (17.5) en 80.8% man).
In de CBO-richtlijn van 2011 werden de resultaten gerapporteerd van Benjamin (1999). Deze studie is in de huidige literatuursearch niet gevonden. Dit komt doordat de referentie van Benjamin (1999) een letter tot the editor is en geen peer reviewed publicatie van een studie. Deze letter to the editor verwijst naar een eerdere studie van Benjamin over beenmergtransplantatiepatiënten (andere patiëntpopulatie). Beide publicaties voldoen niet aan de inclusiecriteria en zijn daarom niet meegenomen in de systematische literatuuranalyse.
Resultaten
Mortaliteit
In de studie van Shanwell (2009) werd geen significant verschil gevonden in mortaliteit binnen 14 dagen tussen patiënten die een ABO-compatibele plasmatransfusie ondergingen (8,99%) ten opzichte van patiënten die een ABO-identieke transfusie ondergingen (8,14%): RR 1,06; 95% BI 0,997-1,13. In deze analyse was gecorrigeerd voor een aantal potentiële confounders, maar niet voor comorbiditeit.
Een aanvullende analyse werd uitgevoerd waarin patiënten die de eerste dag na transfusie overleden werden vergeleken met zij die overleefden. Uit de resultaten is echter onduidelijk welk effect precies wordt bekeken (dosis plasma of compatibiliteit).
De studie van Inaba (2010) vond geen significant verschil in mortaliteit tussen patiënten die een ABO-compatibele plasmatransfusie ondergingen in vergelijking met patiënten die een ABO-identieke transfusie ondergingen (35,2% versus 33,5; p=0,66).
Een meta-analyse die voor deze uitkomstmaat werd uitgevoerd resulteerde in een klein, maar significant verschil in mortaliteit ten voordele van plasma transfusie met ABO-identiek plasma. In totaal overleden in de ABO-compatible groep 1927 van 20604 patiënten (9,4%) van de patiënten in vergelijking met 5448 van 66046 patiënten (8,2%) in de identieke groep (R 1,10 (1,05-1,16 zie figuur 1).
In deze analyse wordt echter niet gecorrigeerd voor mogelijke confounders.
Figuur 1 Meta-analyse: risico op mortaliteit bij transfusie met ABO-compatibel plasma ten opzichte van ABO-identiek plasma
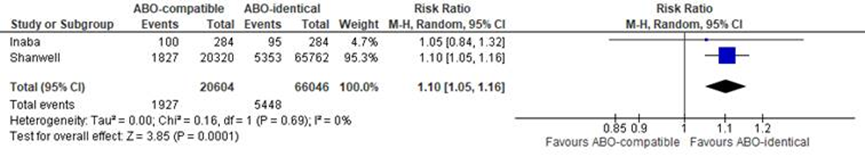
Morbiditeit
Inaba (2010) heeft het effect van een ABO-compatibele en ABO-identieke plasmatransfusie vergeleken op het totaalaantal complicaties, en specifiek voor ARDS en sepsis. Voor alle drie de uitkomsten was er een significant verschil ten nadele van de groep die ABO-compatibel plasma had ontvangen: totaal aan complicaties: 53,5% versus 40,5%; p=0.002; ARDS: 19,4% versus 9,2%; p=0,001; sepsis 38,0% versus 28,9%; p=0,02.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat mortaliteit is met 2 niveaus verlaagd naar zeer laag gezien beperkingen in de onderzoeksopzet (risk of bias) en extrapoleerbaarheid (bias ten gevolge van indirectheid).
De bewijskracht voor de uitkomstmaat morbiditeit is met 3 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias); extrapoleerbaarheid (bias ten gevolge van indirectheid) en het geringe aantal patiënten (imprecisie).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Is ABO-identiek transfunderen bij patiënten die een plasmatransfusie ontvangen beter dan ABO-compatibel transfunderen?
P: patiënten die een plasmatransfusie ontvangen;
I: ABO-identiek transfunderen bij plasmatransfusies;
C: ABO-compatibel transfunderen;
O: morbiditeit en mortaliteit.
Relevante uitkomstmaten
De werkgroep achtte morbiditeit en mortaliteit voor de besluitvorming kritieke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Zoeken en selecteren (Methode)
In de databases Medline (OVID), Embase en de Cochrane Library is tot 31 maart 2017 met relevante zoektermen gezocht naar vergelijkend onderzoek waarbij transfunderen met ABO-identiek plasma en ABO-compatibel plasma werd vergeleken bij patiënten die een plasmatransfusie nodig hebben, gelet op de uitkomsten mortaliteit en morbiditeit. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 167 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: systematische reviews of meta-analyses, gerandomiseerde klinische studies of observationeel vergelijkend onderzoek. Op basis van titel en abstract werden in eerste instantie 19 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 17 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en 2 studies definitief geselecteerd.
Twee onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Er was een review met literatuur tot 2015 beschikbaar, die twee relevante studies bevatte die ook in de selectie waren geïncludeerd (Balvers, 2016). Door incorrecte gegevens in het review en beperkte weergave van details werd besloten tot het includeren van de losse studies in plaats van de review. De meta-analyse werd separaat opnieuw uitgevoerd.
Referenties
- Inaba K, Branco BC, Rhee P, et al. Impact of ABO-identical versus ABO-compatible nonidentical plasma transfusion in trauma patients. Arch.Surg. 2010;145(9):899-906.
- Shanwell A, Andersson TM, Rostgaard K, et al. Post-transfusion mortality among recipients of ABO-compatible but non-identical plasma. Vox Sang. 2009;96(4):316-323.
- Balvers K, Saleh S, Zeerleder SS, et al. Are there any alternatives for transfusion of AB plasma as universal donor in an emergency release setting?. Transfusion. 2016;56(6):1469-1474.
- Benjamin RJ, Antin JH. ABO-incompatible bone marrow transplantation: the transfusion of incompatible plasma may exacerbate regimen-related toxicity. Transfusion. 1999;39(11-12):1273-4. PubMed PMID: 10604259.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Shanwell, 2009 |
Type of study: retrospective cohort study
Setting: Swedish patients who received plasma transfusion from database SCANDAT
Country: Sweden
Source of funding: regional agreement Stockholm County council and Karolinska Institutet |
Inclusion criteria: Adult patients (≥18yrs) with first recorded allogeneic plasma transfusion
Exclusion criteria: history of transplantation or transfusion, blood group AB, blood from donor with unknown blood group
N total at baseline: Intervention: 20,320 Control: 65,762
Important prognostic factors2: Median Age (min-max): I: 69 (18-100) C: 70 (18-105)
Sex: I: 57.3% M C: 54.9% M
Groups comparable at baseline? |
Describe intervention (treatment/procedure/test):
Plasma transfusion with ABO compatible plasma
|
Describe control (treatment/procedure/test):
Plasma transfusion with ABO identical plasma
|
Length of follow-up: 14 days
Loss-to-follow-up: n.a.
Incomplete outcome data: None described
|
Outcome measures and effect size (include 95%CI and p-value if available):
Mortality ABO compatible: 8.99 vs ABO identical 8.14% After adjustment for confounders: RR 1.06 (0.997-1.13); p=0.06;
|
A supplementary analysis was performed to compare pts who died the first day with pts who survived. From the results they present it is unclear whether they studied dose or compatibility (related to the outcome) |
|
Inaba, 2010 |
Type of study: retrospective cohort study
Setting: level 1 trauma center
Country: Los Angeles, California, US
Source of funding: none reported |
Inclusion criteria: All trauma patients who received plasma (200-2008)
Exclusion criteria: Blood group AB, patients who received ABO incompatible plasma
N total at baseline: Intervention: 338 Control: 2352 After propensity score matching: 284 matched pairs
Important prognostic factors2: age (SD): I: 33.9 (17.6) C: 34.2 (17.4)
Sex: I: 80.6% M C: 80.6% M
Groups comparable at baseline? No (propensity score matching) |
Describe intervention (treatment/procedure/test):
Plasma transfusion with ABO compatible plasma
|
Describe control (treatment/procedure/test):
Plasma transfusion with ABO identical plasma
|
Length of follow-up: Not defined; duration of hospital stay
Loss-to-follow-up: Not defined
Incomplete outcome data: Not defined
|
Outcome measures and effect size (include 95%CI and p-value if available):
Mortality I: 35.2% C: 33.5% P=0.66
Overall complications I: 53.5% C: 40.5% P=0.002
ARDS I: 19.4% C: 9.2% P=0.001
Sepsis I: 38.0% C: 28.9% P=0.02 |
Patients with blood group O had a significantly higher complication rate for overall complications (50.9% vs 40%; p=0.03) and ARDS (17.4% vs 7.8% , p<0.001) with transfusion of ABO compatible plasma
Complication rates between recipient blood groups were not significantly different with transfusion of ABO compatible plasma.
|
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors ((potential) confounders).
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
Risk of Bias tabel
|
|
Pre-intervention |
|
At intervention |
Post-intervention |
|
|
|
|
Study reference
|
Risk of Bias due to confounding1
|
Risk of Bias in selection of participants into the study2 |
Risk of Bias in measurement of exposure3 |
Risk of Bias due to departures from intended exposure(s)4 |
Risk of Bias due to missing data5 |
Risk of Bias in measurement of outcomes6 |
Risk of Bias in selection of the reported result7 |
|
Shanwell, 2009 |
Moderate; morbidity not taken into account |
Low |
Low |
Low |
Low |
Low |
Moderate; supplementary analysis only describes results for compatible transfusions |
|
Inaba, 2010 |
Moderate; potential confounding by indication |
Low |
Low |
Low; propensity score matching |
Low |
Low |
Low |
Exclusietabel
|
Auteur en jaartal |
Redenen van exclusie |
|
Balvers K, Saleh S, Zeerleder SS, Klinkspoor JH, Goslings JC, Juffermans NP. Are there any alternatives for transfusion of AB plasma as universal donor in an emergency release setting?. Transfusion 2016 Jun;56(6):1469-1474 |
Door incorrecte gegevens in het review en beperkte weergave van details werd besloten tot het includeren van de losse studies in plaats van de review.
|
|
Dunbar NM, Katus MC, Freeman CM, Szczepiorkowski ZM. Easier said than done: ABO compatibility and D matching in apheresis platelet transfusions. Transfusion 2015 Aug;55(8):1882-1888 |
vragenlijst, geen score op hemolyse oid
|
|
Godin MM, Souza LdO, Schmidt LC, Vieira LM, Diniz RS, Dusse LMS. Dangerous universal donors: the reality of the Hemocentro in Belo Horizonte, Minas Gerais. Rev.bras.hematol.hemoter 2016 Jul-Sep;38(3):193-198 |
(alleen titerbepalingen |
|
Novak DJ, Bai Y, Cooke RK, Marques MB, Fontaine MJ, Gottschall JL, et al. Making thawed universal donor plasma available rapidly for massively bleeding trauma patients: experience from the Pragmatic, Randomized Optimal Platelets and Plasma Ratios (PROPPR) trial. Transfusion 2015 Jun;55(6):1331-1339 |
|
|
Zielinski MD, Schrager JJ, Johnson P, Stubbs JR, Polites S, Zietlow SP, et al. Multicenter comparison of emergency release group A versus AB plasma in blunt-injured trauma patients. Clin.Transl.Sci. 2015 Feb;8(1):43-47 |
Bestudeerde groep is een mix van allerlei bloedgroepen, niet duidelijk is welke groep incompatibel, dan wel compatibel, dan wel identiek heeft gekregen. Wat mij betreft onmogelijk om conclusies te trekken over compatibel versus identiek. Zelfs onduidelijk om incompatibel versus compatibel te duiden. Daarom wat mij betreft niet geschikt. |
|
Refaai MA, Fialkow LB, Heal JM, Henrichs KF, Spinelli SL, Phipps RP, et al. An association of ABO non-identical platelet and cryoprecipitate transfusions with altered red cell transfusion needs in surgical patients. Vox Sang. 2011 Jul;101(1):55-60 |
Trombocytentransfusies, niet plasmatransfusie |
|
Henrichs KF, Howk N, Masel DS, Thayer M, Refaai MA, Kirkley SA, et al. Providing ABO-identical platelets and cryoprecipitate to (almost) all patients: approach, logistics, and associated decreases in transfusion reaction and red blood cell alloimmunization incidence. Transfusion 2012 Mar;52(3):635-640 |
Plasma is bij compatibele (niet identieke) plaatjestransfusies weggewassen. Daarom niet te gebruiken als input voor onze onderzoeksvraag. |
|
Chhibber V, Greene M, Vauthrin M, Bailey J, Weinstein R. Is group A thawed plasma suitable as the first option for emergency release transfusion? (CME). Transfusion 2014 quiz 1750; Jul;54(7):1751-1755 |
Er is alleen gekeken naar patiënten die incompatibel plasma hebben gekregen (niet compatibel) en de mate van hemolyse |
|
28 de Franca NDG, Poli MCC, Ramos PGdA, Borsoi CSdR, Colella R. Titers of ABO antibodies in group O blood donors. Rev.bras.hematol.hemoter 2011;33(4):259-262 |
Alleen titerbepalingen |
|
Jilma-Stohlawetz P, Kursten FW, Walasek C, Horvath M, Leitner G, List J, et al. Safety of a universal, virus-inactivated and prion-depleted, pharmaceutical-quality plasma: a randomized, double-blind, clinical trial in healthy volunteers. Transfusion 2011 Jun;51(6):1228-1240 |
gaat alleen over virusveiligheid ed. Niet geschikt. |
|
Josephson CD, Castillejo M, Grima K, Hillyer CD. ABO-mismatched platelet transfusions: strategies to mitigate patient exposure to naturally occurring hemolytic antibodies. Transfus.Apheresis Sci. 2010 Feb;42(1):83-88 |
Alleen titerbepalingen |
|
Solheim BG, Chetty R, Oystein F. Indications for use and cost-effectiveness of pathogen-reduced ABO-universal plasma. Curr.Opin.Hematol. 2008 /;15(6):612-617 |
Geen klinische uitkomstmaten beschreven |
|
Easmin F, Rahman A, Sultana N, Hoque MM, Islam K, Shorminm S, et al. Study of hemolysintitre in ���O��� group donors. J.Med. 2015 2015/;16(2):93-96 |
Alleen titerbepalingen |
|
Issitt RW, Crook RM, Cross NT, Shaw M, Robertson A, Burch M, et al. Incompatible ABO-plasma exchange and its impact on patient selection in paediatric cardiac transplantation. Perfusion 2012 Nov;27(6):480-485 |
gaat over plasmaferese bij ABO incompatibele hart transplantaties |
|
Karafin MS, Blagg L, Tobian AAR, King KE, Ness PM, Savage WJ. ABO antibody titers are not predictive of hemolytic reactions due to plasma-incompatible platelet transfusions. Transfusion 2012 Oct;52(10):2087-2093 |
artikel gaat om ABO titers in relatie tot hemolyse. Kan niet gebruikt worden voor onze onderzoeksvraag. |
|
Lapierre V, Mahe C, Auperin A, Stambouli F, Oubouzar N, Tramalloni D, et al. Platelet transfusion containing ABO-incompatible plasma and hepatic veno-occlusive disease after hematopoietic transplantation in young children. Transplantation 2005 Aug 15;80(3):314-319 |
gaat om kinderen en hepatic veno-occlusive disease, en daarnaast alleen om incompatibel plasma. |
|
Josephson CD, Mullis NC, Van Demark C, Hillyer CD. Significant numbers of apheresis-derived group O platelet units have "high-titer" anti-A/A,B: implications for transfusion policy. Transfusion 2004 Jun;44(6):805-808 |
er zijn alleen titerbepalingen uitgevoerd, geen klinische uitkomst. |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 15-10-2020
Laatst geautoriseerd : 27-11-2019
Geplande herbeoordeling :
Voor het beoordelen van de actualiteit van deze richtlijn wordt een deel van de werkgroep in stand gehouden. Op modulair niveau is een onderhoudsplan beschreven. Bij het afronden van de richtlijn zal de werkgroep per module een inschatting maken over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Internisten Vereniging (NIV), Nederlandse Vereniging van Anesthesiologie (NVA) en Nederlandse Vereniging van Klinische Chemie (NVKC) zijn regiehouders van deze richtlijn(module) en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn(module). De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
De transfusierichtlijn geeft ten eerste antwoorden op grote uitgangsvragen over wie, wanneer, hoe, hoeveel en met welke producten getransfundeerd wordt en wat daarvan volgens wetenschappelijk onderzoek aan voordelig/nadelig resultaat verwacht mag worden. Na het bepalen van de wetenschappelijke waarde van dit onderzoek, worden uiteindelijk aanbevelingen opgesteld, gebaseerd op de conclusies van het wetenschappelijke onderzoek en na het beschouwen van een additionele context van bijvoorbeeld kosten- ethische, maatschappelijke of wettelijke overwegingen. Deze aanbevelingen zijn bedoeld om verantwoord en wenselijk handelen voor leden van de beroepsgroep te definieren in de voorkomende dagelijkse klinische praktijk. Echter, er kan beargumenteerd altijd afgeweken worden van de algemene aanbevelingen en gekozen worden voor een meer op de individuele patient afgestemde ondersteuning.
Doelgroep
Naast de genoemde beoogde gebruikers van de richtlijn is de richtlijn ook bedoeld en van waarde voor de collega’s van de nationale bloedvoorzieningsorganisatie Sanquin.
Samenstelling werkgroep
Voor de herziening van de richtlijn zijn er in 2016 zes multidisciplinaire werkgroepen ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij patiënten die een bloedtransfusie nodig hebben. Een stuurgroep, bestaande uit de voorzitters van de deelprojecten, coördineerde de werkgroepen.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep Laboratoriumaspecten
- Dr. J (Jennita) Slomp, laboratoriumspecialist klinische chemie en hematologie, voorzitter, NVKC
- Dr. C. (Claudia) Folman, manager laboratorium erytrocytenserologie, NVKC
- Prof. dr. M (Masja) de Haas, clustermanager immunohematologie diagnostiek, NVKC
- G.H. (Judith) Lie, hemovigilantiefunctionaris, weefselvigilantiecoördinator, NVML
- Dr. H. (Henk) Russcher, Laboratoriumspecialist Klinische Chemie en Hematologie, NVKC
- Dr. M.R. (Martin) Schipperus, internist-hematoloog, NIV
- N. (Nel) Som, senior hoofdanaliste bloedtransfusiedienst, NVML
- Dr. K.M.K. (Karen) de Vooght, laboratoriumsepcialist klinische chemie en transfusie, NVKC
- Dr. H. (Harry) de Wit, Laboratoriumspecialist Klinische Chemie en Hematologie, NVKC
Werkgroep Anemie
- Prof. dr. J.J. (Jaap Jan) Zwaginga, internist-hematoloog/ transfusiespecialist/ hoogleraar transfusiegeneeskunde, voorzitter, NIV
- Drs. K.A. (Klasien) Bergman, kinderarts-neonatologie, NVK
- dr. J.M. (Jurriën) ten Berg, Cardioloog, NVVC
- Dr. B.J. (Bart) Biemond, internist-hematoloog, NIV
- Dr. P.A.W. (Peter) te Boekhorst, internist-hematoloog/ transfusiespecialist, NIV
- Prof. dr. C.J. (Karin) Fijn van Draat, hoogleraar kinderhematologie/ senior onderzoeker Sanquin research, NVK
- Dr. A.J. (Adriaan) van Gammeren, laboratoriumspecialist klinische chemie en hematologie, NVKC
- Dr. N.P. (Nicole) Juffermans, Intensivist, NVIC
- Dr. A.W.M.M. (Ankie) Koopman-van Gemert, anesthesioloog, NVA
- Dr. L.E.M. (Liesbeth) Oosten, internist-hematoloog, NIV
Werkgroep Trombocytentransfusies
- Dr. E.A.M. (Erik) Beckers, internist-hematoloog/ transfusiespecialist, hematoloog, voorzitter, NIV
- Dr. M. (Michiel) Coppens, internist-vasculaire geneeskunde, NIV
- Dr. A.J.G. (Gerard) Jansen, internist-hematoloog, NIV
- Dr. J.L.H. (Jean-Louis) Kerkhoffs, internist-hematoloog, NIV
- Dr. E. (Enrico) Lopriore, sectiehoofd neonatologie, NVK
- Dr. C. (Heleen) van Ommen, kinderarts hematoloog, NVK
- Dr. E.C.M. (Lizzy) van Pampus, internist-hematoloog-transfusiespecialist, NIV
- Dr. R.E.G. (Roger) Schutgens, internist-hematoloog, NIV
- Dr. J.W.P.H (Hans) Soons, laboratoriumspecialist klinische chemie, NVKC
- Dr. A.P.J. (Alexander) Vlaar, internist-intensivist, NVIC
Werkgroep Bloedingen en bloedbesparende technieken
- Dr. A. (Ankie) Koopman – van Gemert, anesthesioloog, voorzitter, NVA
- Dr. J.J. (Hans) Duvekot, gynaecoloog-perinatoloog, NVOG
- Dr. L.M.G. (Leo) Geeraedts, traumachirurg, NVvH
- Dr. ir. Y.M.C. (Yvonne) Henskens, laboratoriumspecialist klinische chemie en hematologie, NVKC
- Drs. E.J. (Elise) Huijssen-Huisman, kinderarts, kinderhematoloog, transfusiespecialist, NVK
- Dr. N.P. (Nicole) Juffermans, intensivist, NVIC
- Prof. dr. F.W.G. (Frank) Leebeek, internist hematoloog en internist vasculair geneeskundige, NIV
- P.M.J. (Peter) Rosseel, anesthesioloog–intensivist, NVA
- Dr. E.C.T.H. (Edward) Tan, traumachirurg, NVvH
- Drs. V.A. (Victor) Viersen, anesthesioloog, NVA
- Dr. A.B.A. (Alexander) Vonk, cardiothoracaal chirurg, NVT
- Prof. dr. J.J. (Jaap Jan) Zwaginga, hematoloog/ transfusiespecialist/ hoogleraar transfusiegeneeskunde, NIV
Werkgroep Plasmatransfusies
- Dr. J.W.P.H (Hans) Soons, laboratoriumspecialist klinische chemie, voorzitter, NVKC
- Dr. E.A.M. (Erik) Beckers, internist-hematoloog/ transfusiespecialist, NIV
- Drs. K.A. (Klasien) Bergman, kinderarts-neonatologie, NVK
- Dr. M. (René) van Hulst, ziekenhuisapotheker, NVZA
- Prof. dr. K. (Karina) Meijer, internist-hematoloog, NIV
- Dr. M.C.A. (Marcella) Müller, internist-intensivist, NVIC
- Dr. E.C.M. (Lizzy) van Pampus, internist-hematoloog/transfusiespecialist, NIV
- Dr. Marjolein Peters, kinderarts-hematoloog, NVK
- Drs. K.N.M.E.M. (Koen) Reyntjens, anesthesioloog, NVA
Werkgroep Transfusiereacties en gerelateerde aandoeningen
- Dr. M.R. (Martin) Schipperus, internist-hematoloog, voorzitter, NIV
- Dr. J.L.P. (Hans) van Duynhoven, laboratoriumspecialist klinische chemie, NVKC
- Drs. C.T. (Christian) Favoccia, anesthesioloog, NVA
- Prof dr. C.J. (Karin) Fijn van Draat, hoogleraar kinderhematologie/ senior onderzoeker Sanquin research, NVK
- G.H. (Judith) Lie, hemovigilantiefunctionaris, weefselvigilantiecoördinator, NVML
- Dr. T. (Tanja) Netelenbos, internist-hematoloog, NIV
- Dr. J. (Jennita) Slomp, laboratoriumspecialist klinische chemie en hematologie, NVKC
- Dr. Dik Versteeg, arts-microbioloog, NVMM
- Dr. A.P.J. (Alexander) Vlaar, internist-Intensivist, NVIC
- Dr. J.C. (Jo) Wiersum-Osselton, TRIP hemo- en biovigilantie, landelijk coördinator, sociale geneeskunde
- C. (Clary) Wijenberg, verpleegkundig specialist palliatieve zorg, V&VN
Met ondersteuning van:
- Dr. M.M. (Marja) Molag, adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Drs. S.M. (Sabrina) Muller-Ploeger, adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Drs. M. (Marleen) Ploegmakers, senior-adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Drs. E. (Ester) Rake, junior adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Drs. E.E. (Eva) Volmeijer, adviseur Kennisinstituut van de Federatie Medisch Specialisten, projectleider
- Drs. T. (Tessa) Geltink, junior adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Drs. S. (Sanne) Snoeijs, adviseur Kennisinstituut van de Federatie Medisch Specialisten
- D.P. (Diana) Gutierrez, projectsecretaresse Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Voorzitters (kerngroep) |
||||
|
M. Schipperus |
Internist-hematoloog (100%) |
Voorzitter Bestuur Stichting TRIP (Transfusie in patiënten), onbetaald |
ITP-onderzoek gefinancierd door AMGeN Advisory board Novartis |
Lid participeert niet in besluitvorming omtrent producten van AMGEN of Novartis. |
|
A. Koopman- van Gemert |
Anesthesioloog |
Diverse functies bij nationale en internationale commissies bv Concilium, Stuurgroep antistolling, examencommissie et cetera Internationaal lid van de Europese examencommissie |
-Participatie in de PETS-studie van het EMC, geen financiële relatie. -Participatie in verschillende onderzoeken (geen financiële relatie en geen direct verband bloedtransfusie) -Organisatie symposia met sponsoring (geen directe financiële relatie en direct verband bloedtransfusie) |
Geen restricties |
|
J.J. Zwaginga |
Hematoloog LUMC (Leiden), Transfusiespecialist, Hoogleraar transfusiegeneeskunde |
-Penningmeester VHL=Vereniging Hematologische laboratoria -Voorzitter van de benigne hematologische werkgroep van NVvH |
-Sprekershonoraria Viforpharma (ijzer: medicatie kan transfusies uitsparen) -Wetenschappelijke adviesraad: Novantis (ijzerchelatie kan transfusie gemedieerde ijzerstapeling opheffen) - Gilead: CLL medicatie webcast geen relatie met transfusiebeleid PI van meerdere Sanquin onderzoeken ogv - allumminisatie door RBC transfusies - ijzertoxiciteit door bloedtransfusies - bloedings IRM (voldoende) plaatjestransfusies et cetera |
Lid participeert niet in besluitvorming omtrent Novartis en wanneer SANQUIN-studies worden geïncludeerd waarbij lid een van de auteurs is |
|
E. Beckers |
Internist-hematoloog/transfusiespecialist MUMC + Maastricht |
Bestuurslid Ned. Ver. Bloedtransfusie, onbetaald - Bestuurslid Ned. Ver. Hematologie, onbetaald - Lid adviesraad TRIP (Transfusie Reacties in Patiënten), onbetaald - Lid Landelijke Gebruikers Raad Sanquin, onbetaald - Lid Stuurgroep TiN studie (Trombocytopathie in Nederland) |
Project 'Predictors of Bleeding' externe financiering door Bayer
Transparantieregister.nl: sprekers vergoeding van Roche; gastvrijheidsbijdrage van: Roche, Pfizer, Sanquin en Bayer |
Lid participeert niet in besluitvorming omtrent producten van Bayer en Roche en wanneer specifiek de studie "predictors of bleeding" (gefinancierd door Bayer) worden geïncludeerd |
|
J. Slomp |
Laboratorium specialist Klinische Chemie en hematologie MST/Medlon |
-Bestuurslid VHL - onbetaald -Bestuurslid NVvH - onbetaald -Werkgroep Bloedtransfusie VHL (vz.) onbetaald -Lid LGR onbetaald - - Lid Expert committee TRIP (onbetaald) |
-Medical Advisory Board Janssen: advies omtrent bloedtransfusie bij patiënten die daratumumab gebruiken, betaald - In samenwerking met UMCU en VU bezig om een landelijk protocol op te stellen voor bloedtransfusie en daratumumab |
Lid participeert niet in besluitvorming omtrent productn van Janssen (daratumumab) |
|
H. Soons |
Laboratoriumspecialist Klinische Chemie, St. Anna Ziekenhuis (1 fte) en Kempenhaeghe (detachering vanuit St. Anna Ziekenhuis)
|
-Bestuur Nederlandse Vereniging voor Bloedtransfusie (NVB), voorzitter, onbetaald -Bestuur Transfusie Reacties in Patiënten (TRIP), secretaris, vacatiegeld - Medisch Advies Raad Sanquin (MAR), lid, vacatiegeld -Lid Landelijke Gebruikersraad Sanquin (LGR), onbetaald |
|
Geen restricties |
|
Werkgroep laboratoriumaspecten |
||||
|
H. de Wit |
Laboratoriumspecialist Klinische Chemie en Hematologie, Certe |
-Bestuurslid/ penningmeester Nederlandse Vereniging voor Bloedtransfusue (onbetaald) - Bestuurslid/ penningmeester Stichting Vrienden van de NVB (onbet aald) |
|
Geen restricties |
|
K. de Vooght |
Laboratoriumspecialist Klinische Chemie, Hoofd Patiëntenzorg LKCH ad interim |
Bestuurslid/ penningmeester Stichting TRIP (onbetaald) - Bestuurslid/voorzitter Stichting vrienden van de Utrechtse bloedbank (onbetaald) - Lid Werkgroep Consortium Transfusiegeneeskundig Onderzoek (onbetaald) - Lid PROTON II Adviesraad (onbetaald) - Lidmaatschap NVB - Lidmaatschap NVvH - Docent OKU (Onderwijs Kring Utrecht) (betaald) -Docent PAO Farmacie (betaald) -Lid Wetenschappelijke commissie NVB/TRIP symposium (onbetaald) |
|
Geen restricties |
|
C. Folman |
Manager Laboratorium Erytrocytenserologie (Sanquin) |
- Docent Hogeschool Arnhem en Nijmegen, betaald - Lid TRIX-werkgroep, onbetaald - Secretaris werkgroep Bloedtransfusie van de VHL (Vereniging Hematologische Laboratoriumdiagnostiek), onbetaald - Lid Expert Committee TRIP (Transfusie Reacties In Patiënten), onbetaald -Lid wetenschappelijke commissie NVB (Nederlandse Vereniging voor Bloedtransfusie), onbetaald" |
- Dienstverband Sanquin - werkzaam in expertiselaboratorium waar onderzoek wordt gericht voor derden op het gebied van bloedtransfusie |
Werkgroeplid is geen trekker/primaire auteur bij uitspraken over diagnostiek.
|
|
M. de Haas |
-Bijzonder hoogleraar Translationele Immunohematologie (bezoldiging Sanquin, onbezoldigd aangesteld bij LUMC -Clustermanager Immunohematologie Diagnostiek |
- Secretaris NVB (tot mei 2017) |
-Dienstverband Sanquin -Hoofd van een expertiselaboratorium dat ingezet zou kunnen worden door derden voor het uitvoeren van (uit de richtlijn voortkomende) laboratoriumdiagnostiek |
Werkgroeplid is geen trekker/primaire auteur bij uitspraken over diagnostiek.
|
|
H. Russcher |
Laboratoriumspecialist Klinisch Chemie en Hematologie, in het Erasmus MC en Havenziekenhuis |
- Auditor RvA i.h.k.v. ISO 15189:2012 voor medische laboratoria - Betaald |
|
restricties t.a.v. producten van Roche diagnostiek.Gebruikersraad geen belangen tav Sanquin, geen restriicties |
|
N. Som |
Senior hoofdanaliste bloedtransfusiedienst VUmc |
- Hemovigilantiecoördinator Vumc |
|
Geen restricties |
|
J. Lie |
-Stafadviseur hemovigilantie 24,8 uur -Weefselvigil antiecoördinator 7,2 uur" |
-Contactpersoon voor landelijk Bureau TRIP: meldingen transfusiereacties en bijwerkingen - Voorzitter landelijk Hemovigilantoe Platform Nederland (vanaf 2016, eerder lid, mede oprichter HPN), onbetaald - Voorzitter en oprichter Regionaal Hemovigilantie Platform Zuidoost - BestuursLid NVB |
|
Geen restricties |
|
Werkgroep Anemie |
||||
|
A. Van Gammeren |
Laboratoriumspecialist Klinische Chemie
|
|
|
Geen restricties
|
|
N. Juffermans |
Intensivist |
Chief editor Netherlands Journal of Critical Care, vergoeding |
|
Geen restricties
|
|
K. Bergman |
Kinderarts-neonatologie, Beatrix kinderziekenhuis, UMCG ten Groningen (0,9fte). Als kinderarts-neonatologie voorzitter van het Regioteam Perinatale Audit Noord Nederland (Perined). Deze functie (0,1fte) wordt uitgeoefend binnen de UMCG aanstelling. |
-Lid programmacommissie Prenatale screening infectieziekten en erytrocyten-immunisatie RIVM namens NVK (vacatiegeld) -Lid werkgroep neonatale infectieziekten sectie neonatologie NVK (onbetaald) -Projectcommissielid ZonMw project: Introduction of Audit generated Changes in perinatal care using ""Tailored"" implementation strategies. (ACTion-project) (onbetaald) =Projectcommissielid 5 genes per minute, afdeling Medische genetica, UMCG, Groningen (onbetaald) |
|
Geen restricties
|
|
P. te Boekhorst |
Internist-Hematoloog / Transfusiespecialist
|
Medisch Adviesraad Sanquin, Lid, Vacatiegeld
|
In verleden: - Gastvrijheid Firma Alexion - Adviesraad Firma AmgeN (ITP) |
Lid participeert niet bij besluitvorming omtrent ITP |
|
B. Biemond |
Internist-hematoloog |
|
|
Geen restricties |
|
L. Oosten |
Hematoloog, Afdeling Immunohematologie & Bloedtransfusie bij het Leids Universitair Medisch Centum |
|
|
Geen restricties |
|
K. Fijn van Draat |
-Hoogleraar kinderhematologie AMC - Senior onderzoeker Sanquin Research |
VIDI selectiecommissie ZONMW, onbetaald (wel vacatievergoeding) |
Lid van de stuurgroep van de PLANET-2 studie die onderzoek doet naar triggers van trombocytentransfusie bij neonatenop de Neonatale Intensive Care Unit. PLANET-2 ontvangt geen sponsoring van de farmaceutische industrie |
Geen restricties |
|
Werkgroep trombocytentransfusies |
||||
|
A. Vlaar |
- Internist-Intensivist, Academisch Medisch Centrum, Amsterdam - Principal investigator Infusion related morbidity and mortality in the critically ill |
- Klinisch brug figuur Sanquin, onbetaald
|
Onderzoek gefinancierd door NWO, ZonMW, Sanquin: PI van de PACER studie (onder andere): hierbij worden trombotriggers voor invasieve ingrepen aangehouden. |
Geen restricties (ten aanzien van PACER studie: geen tegengesteld belang. Studie wordt niet gepubliceerd binnen termijn afronding richtlijn). |
|
l. van Pampus |
Internist-hematoloog-transfusiespecialist Radboudumc |
- Vice voorzitter hemovigilantiekamer TRIP (onbezoldigd)
|
Tegemoetkoming verblijfkosten Dublin (Ierland) het 17th Annual NATA Symposium on Patient Blood Management, Haemostasis and Thrombosis (NATA 2016) cf de CGR-rgels. |
Geen restricties |
|
G. Jansen |
Internist-hematoloog, afdeling Hematologie, Erasmus MC |
Post doctoraal onderzoeker bij afdeling Plasmaeiwitten, Sanquin Bloedvoorziening. Gastvrijheidovereenkomst, onbetaald |
"1) Naam project: ""Surface sialic acid is critical for platelet survival"" Financier: Sanquin Product and Process development (PPOC nr. 13-019). Bedrag: 499.000 euro. Rol: AIO project 2013-2018. Principal investigator en co-promotor
Toelichting: van dit geld is een OIO aangesteld (Mw M. Rijkers) die in dienst van Sanquin (1,0 fte) dit onderzoek verricht" |
Bij onderwerp sialic acid en trombocytenoverleving geen trekker /betrokkenheid opstellen aanbevelingen |
|
J.L. Kerkhoffs |
Internist - Hematoloog (0,8 FTE)
|
Transfusie-specialist / transfusie research (0,2 FTE) via Sanquin
|
Op Sanquin verricht ik klinisch transfusie onderzoek wat deels gefinancieerd wordt door de industrie TerumoBCT: PI van de PREPAReS studie, een RCT naar de klinische effectiviteit van trombocyten concentraten behandeld met een pathogeen-reductie proces (Mirasol, TERUMO BCT).
|
Restricties t.a.v. producten behandeld met pathogeen reductie proces en biomarkers. Deze onderwerpen zijn vooralsnog niet geprioriteerd voor de richtlijn, dus geen restricties nodig.
|
|
R. Schutgens |
Internist-hematoloog
|
Lid van Medische Adviesraad patiëntenvereniging ITP |
-Speakersfee (voor instituut) en/of unrestricted research grant en/of lid advisory board van: Bayer, Baxalta, CSL Behring, NovoNordisk, Sanquin, Pfizer, Bristol-Meyers Squibb -Principal Investigator van de Trombocytopathie in Nederland (TiN) studie, mede gefinancierd door een unrestricted grant van Sanquin - deelname (in UMCU) ontwikkeling PACT en U-PACT (geen financieel belang) |
Geen betrokkenheid vragen bij bloedplaatjesfunctietest (PACT). Deze onderwerpen zijn vooralsnog niet geprioriteerd voor de richtlijn, dus geen restricties nodig. |
|
M. Coppens |
Internist-vasculaire geneeskunde
|
- Diverse naschollingen en adviesraden (allen incidenteel) aangaande directe orale anticoagulantie georganiseerd door de fabrikanten van deze middelen, te weten Boehringer Ingelheim, Bayer, Pfizer, Bristol-Meyers Squibb, Daiichi Sankyo. Deze diensten zijn betaald, waarbij het geld naar mijn instituut gaat - Adviesraad aangaande 'The future of hemophilia treatment' georganiseerd door CSL Behring. Twee maal een advisory board; in 2015 en 2016. Deze diensten zijn betaald waarbij geld naar instituut gaat. CSL Behring produceert o.a. Haemocomplettan P (fibrinogeenconcentraat) en Beriplex (vierfactorenconcentraat). De huidige richtlijn zal mogelijk off-label gebruik van deze 2 middelen gaan bespreken. De genoemde adviesraad richtte zich op hemofilie A en B en de producten Haemocomplettan P en Beriplex zijn hier niet aan de orde geweest." |
Lid van de Stuurgroep van de Trombopathie in Nederland studie (geen financiele belangen). -Sanquin Blood Supply: Prothrombin Complex Concentrate (PCC) for the immediate reversal of the anticoagulant effects if new oral anticoagulants in emergency situations. Sanquin Blood Supply is producent van Cofact, een PCC, - CSL Behring: Biomarkers to detect subclinical arthropathy and predict long-term clinical arthropathy in patients with hemophilia. This project was awarded a 2016 Heimburger Award. CSL Behring produceert zowel Haemocomplettan P (fibrinogeenconcentraat) als Beriplex (een PCC), Dit project is gecofinancierd door CSL Behring, maar hebben geen betrekking op Haemocomplettan P noch Beriplex. |
Geen betrokkenheid opstellen aanbevelingen t.a.v. fibrinogeenconcrentraat en vierfactoren concentraat |
|
E. Lopriore |
Sectiehoofd Neonatologie WAKZ/LUMC |
Lid bloedtransfusiecommissie LUMC |
Onderzoek gefinancieerd door Sanquin: 1. PROC 12-012-027: Matisse studie: RCT in neonaten naar twee verschillende triggers voor trombocyten transfusies 50 vs 25; Promovenda: Suzanne Gunnink 2. PROC 16-33: Promotie onderzoek naar Rhesus hemolytische ziekt: Promovenda: Isabelle Ree |
Geen restricties |
|
H. van Ommen (meelezer) |
Kinderhematoloog |
|
'- PI Einstein junior (Bayer) Behandeling trombose bij kinderen - PI Hokusai kinderen (Daiichi Sankyo) Behandeling trombose bij kinderen - Nationaal coördinator BMS studie Apixaban ter preventie van trombose bij kinderen met een hartafwijking |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afstemming met de Patiëntenfederatie, Stichting Zeldzame Bloedziekten en Oscar Nederland. Deze verenigingen zijn uitgenodigd voor de invitational conference (knelpuntenanalyse) voorafgaand aan deze herziening en hebben input geleverd voor de te prioriteren vragen. De verenigingen hebben aangegeven graag in de commentaarfase de conceptrichtlijn te ontvangen voor commentaar. Tevens zal in de eindfase van deze richtlijn nog worden overlegd over de communicatie aan patiënten en of er nog aanvullende teksten voor patiënten kunnen worden opgesteld.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan zal bij afronding van de richtlijn te vinden zijn bij de aanverwante producten. De werkgroep zal tevens de interne kwaliteitsindicatoren die bij de Richtlijn bloedtransfusie 2011 zijn opgesteld beoordelen en indien nodig door ontwikkelen.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitters van de werkgroepen en de adviseurs de knelpunten. De werkgroepen beoordeelden de aanbevelingen uit de eerdere richtlijn Bloedtransfusiebeleid (2011) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door patiëntenverenigingen en andere aanwezigen tijdens de Invitational conference. De werkgroepen stelden vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitters en de adviseurs concept-uitgangsvragen opgesteld. Deze zijn in de werkgroepen besproken waarna de werkgroepleden de definitieve uitgangsvragen hebben vastgesteld. Vervolgens inventariseerden de werkgroepen per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroepen waardeerden deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroepen tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen en systematische reviews (Medline). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje “Overwegingen”.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk om mee te wegen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs, de belangrijkste overwegingen en de weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn word aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren worden verzameld en besproken met de werkgroepen. Naar aanleiding van de commentaren word de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroepen. De definitieve richtlijn word aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html. 2012.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
